Способ получения изепамицина и промежуточные соединения - RU2120444C1
Код документа: RU2120444C1
Описание
Изобретение относится к технологии производства известного аминогликозидного антибиотика, в частности к новому способу получения изепамицина.
Известен способ получения изепамицина (=1-N-(S)-3-амино-2-оксипропионил] -гентамицин B), который заключается в том, что гентамицин B в виде комплекса с двухвалентной солью подвергают взаимодействию с N-бензилоксикарбонилоксифталимидом и получаемое при этом соединение подвергают ацилированию N-(S-3-бензилоксикарбониламино-2-оксипропионилокси)сукцинимидом с последующим снятием защитных бензилоксикарбонильных групп путем каталитического гидрирования на палладии на угле и выделением целевого продукта (см. патент США N 4 230847, МКИ C 07 H 15/22, 1980, примеры 11 и 24).
Недостатком известного способа является то, что выход изепамицина не превышает 60%.
Задачей изобретения является повышение выхода изепамицина.
Поставленная задача решается в предлагаемом способе получения изепамицина путем взаимодействия гентамицина B в виде комплекса с двухвалентной солью с гетероциклическим соединением, ацилирования получаемого при этом соединения и последующего снятия защитных групп и выделения целевого продукта за счет того, что в качестве гетероциклического соединения используют 2-формилмеркаптобензотиазол, ацилирование осуществляют соединением N-защищенного (S)-изосерина, а снятие защитных групп осуществляют основным гидролизом.
Изепамицин имеет следующую формулу

2-формилмеркаптобензотиазол формулы II
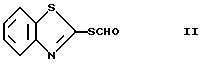
представляет собой новое соединение.
Способ его получения описывается в нижеследующем примере 1.
Пригодными в качестве комплексообразователя двухвалентными солями являются соли на основе таких металлов, как, например, медь (II), никель (II), кобальт (II), кадмий (II), цинк (II), а также их смеси. Двухвалентные соли этих металлов представляют собой соли неорганических и органических кислот, предпочтительно органических кислот, таких как, например, муравьиная кислота, уксусная кислота, пропионовая кислота, триметилуксусная кислота и бензойная кислота. Предпочтительными солями двухвалентных металлов являются триметилуксуснокислые соли цинка (II). В частности, используют триметилуксуснокислую соль цинка (II).
Образование комплекса гентамицина B и двухвалентной соли осуществляют в среде инертного органического растворителя. Предпочтительными органическими растворителями являются, например, диметилсульфоксид, диметилформамид, диметиацетамид, метиленхлорид, толуол, этилацетат и их смеси.
При образовании гентамицина B в виде комплекса с двухвалентной солью целесообразно применять примерно 1,5 - 4,5 моль двухвалентной соли, например, цинка (II) на моль гентамицина B. Предпочтительно применяют примерно 2,7-3,5 моль двухвалентной соли на моль гентамицина B.
Гентамицин B в виде комплекса с двухвалентной солью подвергают взаимодействию с 2-формилмеркаптобензотиазолом, в результате чего защитной формильной группой снабжаются аминогруппы в положениях 3 и 6'. 2-Формилмеркаптобензотиазол и комплекс гентамицина B и двухвалентной соли обычно применяют в мольном соотношении 2-3:1, предпочтительно 2,5:1.
Реакцию формилирования гентамицина B в виде комплекса с двухвалентной солью осуществляют при температурах 0 - 40oC, предпочтительно 20-30oC. Реакцию обычно проводят в среде органического растворителя или смеси органических растворителей. Пригодным органическими растворителями являются, например, диполярные апротонные органические растворители, такие как диметилсульфоксид, диметилформамид, диметилацетамид и т.п. Возможно также применять смеси диполярных апротонных органических растворителей с инертными органическими растворителями, такими, как, например, толуол, этилацетат, 1, 2-диметоксиэтан, тетрагидрофуран, ацетонитрил, метиленхлорид и т.п. Предпочтительной смесью растворителей является смесь диметилсульфоксида с метиленхлоридом или этилацетатом.
Ацилирование проводят путем введения боковой цепи (S)-изосерина у 1-аминогруппы 3,6'-ди-N-формилгентамицина B, что можно осуществлять путем образования на месте активного сложного эфира N-защищенного
(S)-изосерина в результате взаимодействия (S)-изосерина с активирующим реагентом в присутствии дициклогексилкарбодиимида согласно следующей реакционной схеме

Соединениями N-защищенного (S)-изосерина, пригодными для осуществления предлагаемого способа, являются те, у которых аминогруппа защищается ацильной группой, которая может легко удаляться в условиях, позволяющих снятие защитных формильных групп и отрицательно не воздействующих на остальные части молекулы. В предлагаемом способе используют такие защитные группы для ацила, которые можно удалять в мягких основных условиях или путем обработки гидразином. Примерами защитных групп для ацила, которые можно легко удалять в мягких условиях, являются, например, формил, трихлорацетил, трифторацетил. Примерами защитных групп для ацила, которые можно удалять воздействием гидразина, являются, например, фталоил, сукциноил. Предпочтительной защитной группой для N-ацила изосеринового соединения является формил.
Пригодными соединениями N-защищенного изосерина являются, например, N-формил-(S)-изосерин, N-фталоил-(S)-изосерин, N-трифторацетил-(S)-изосерин, N-трифторацетил-(S)-изосерин, N-трихлорацетил-(S)-изосерин. Предпочтительным соединением N-защищенного изосерина является N-формил-(S)-изосерин.
Активные сложные группы N-защищенного (S)-изосерина получают взаимодействием изосерина с таким соединением, как, например, N-оксибензотриазол, N-оксисукцинимид, имидазол, N-оксифталимид, N-окси-5-норборнен-2,3-дикарбоксимид и т. п., в присутствии связующего вещества, такого как, например, дициклогексилкарбодиимид.
Реакцию N-защищенного (S)-изосерина с 3,6'-ди-N-формилгентамицином B осуществляют при температуре 0-40oC, предпочтительно при комнатной температуре, в среде растворителя. Примерами пригодных растворителей являются протонные органические растворители, как, например, спирты, такие как метанол, этанол, пропанол и т.п., смеси воды со спиртом, такие как водный метанол, водный этанол и т.п., апротонные растворители, такие как диметилформамид, диоксан, метиленхлорид. Предпочтительным растворителем является водный метанол.
В результате взаимодействия N-формилизосерина с 3,
6'-ди-N-формилгентамицином B получается соединение формулы IV, т.е. триформилизепамицин. Защитные группы снимаются с соединения формулы IV путем гидролиза согласно следующей схеме

Перед снятием защитных групп с соединения формулы IV растворитель удаляют из реакционной смеси. Хотя снятие защитных групп путем гидролиза является общепринятым мероприятием, снятие формильных групп без удаления боковой цепи изосерина до сих пор еще не проводилось в химии аминогликозидов. Было найдено, что высокий выход целевого продукта (88-90%) достигается в том случае, если проводить гидролиз путем перемешивания при комнатной температуре в течение 14-16 часов или же в течение ночи. Получаемый продукт гидролиза подкисляют до величины pH 6, после чего изепамицин выделяют из реакционной смеси. Изобретение иллюстрируется следующими примерами, в которых используются следующие условные сокращения:
w = широкая линия
FAB = бомбардировка быстрыми атомами.
Пример 1. Получение 2-формилмеркаптобензотиазола
В трехгорлую круглодонную колбу
емкостью 500 мл подают 80 мл ацетонитрила, 5 мл (0,133 моль) муравьиной кислоты и 18,1 г (0,266 моль) формиата натрия. Получаемую суспензию охлаждают до 0-5oC, после чего медленно добавляют
14,6 мл (0,2 моль) ацетилхлорида, поддерживая температуру реакционной смеси ниже 8oC. После завершения добавления ацетилхлорида реакционную смесь нагревают до 18-20oC. Завершение
реакции определяют путем анализа с помощью1H-ЯМР. К гетерогенной смеси, содержащей ацетомуравьиный ангидрид, последовательно добавляют 60 мл ацетонитрила и 20 г (0,103 моль)
2-меркаптобензотиазола. Реакционной смеси дают нагреваться до 32oC и ее поддерживают на этой температуре. За ходом реакции следят при помощи жидкостной хроматографии, осуществляемой каждые
10 минут. Реакцию считают законченной, когда примерно 4% 2-меркаптобензотиазола остаются непрореагировавшимися или же когда указанный процент начинает увеличиваться в результате разложения
продукта.
Затем к реакционной смеси добавляют 200 мл ледяной воды и перемешивают в течение 2 минут. Осадившийся продукт фильтруют, тщательно промывают водой (4 раза по 150 мл) и сушат в вакууме до водосодержания твердого вещества, равного < 0,08%. Получают 21,4 г (89%) 2-формилмеркаптобензотиазола с чистотой 98% (определенной жидкостной хроматографией). Т. пл. 125-130oC (разл.).
1H-ЯМР (CDCl3)w 7,36-7,44 (м, 3H), 8,45-8,52 (м, 1H), 9,92 (с, 1H).
Пример 2. Получение цинковой соли триметилуксусной кислоты.
К 250 мл воды с температурой 60-70oC добавляют 56,1 г (0,55 моль) триметилуксусной кислоты, после чего порциями добавляют 31,25 г (0,25 моль) карбоната цинка в течение 10-15 минут и температуру повышают до 96-98oC. После перемешивания реакционной смеси в течение часа охлаждают до 4oC в течение 30 минут при помощи ледяной бани и суспензию фильтруют. Фильтровальный осадок последовательно промывают 75 мл холодной воды и три раза холодным ацетоном, взятым в количествах по 50 мл. Получаемый продукт сушат при 60oC в течение 16 часов в печи, получают 58 г (87%) цинковой соли триметилуксусной кислоты.
Пример 3. Получение 3,6'-ди-N-формилгентамицина B
Вариант A
К 285 мл
диметилсульфоксида и 285 мл метиленхлорида добавляют 34 г (127 моль) цинковой соли триметилуксусной кислоты и 19 г (36,7 ммоль) гентамицина B с чистотой 93,1%. Получаемую суспензию перемешивают при
комнатной температуре в течение 10-15 минут и к получаемому при этом раствору добавляют 16 г (81,9 ммоль) 2-формилмеркаптобензотиазола. Через 5 минут берут аликвот, который подвергают жидкостной
хроматографии для определения соотношения пиков моноформила и диформила. 2-Формилмеркаптобензотиазол добавляют еще два раза в малом количестве, так что общее количество составляет 16,95 г (86,8
ммоль). При этом конечное соотношение пиков составляет 0,02, что рассматривается как желаемый результат реакции. Реакционную смесь подают в разделительную воронку емкостью 2 л, куда добавляют 800 мл
воды. Фазы разделяют и водный слой экстрагируют 30 мл метиленхлорида. Затем водный слой фильтруют на целите. Фильтрат разбавляют водой до объема 2 л. Получаемый водный раствор с pH примерно 6 подают в
колонку, содержащую 800 мл Амберлите IRC-50. Продукт элюируют 0,75 N гидроокисью аммония. Фракции, содержащие продукт, собирают и концентрируют с получением раствора, который согласно данным
жидкостной хроматографии содержит 17,5 г (90,5%) 3,6'-ди-N-формилгентамицина B.
Масс-спектр (m/e)% (FAB/GLY-THIO) 539 (100, M+ + 1), 511(9), 380 (9), 350 (4), 191 (10), 190 (5), 160 (28).
1H-ЯМР (400 МГц, D2O; pH 9) w 1,25 (с, 3H, C-4''-CH3), 2,57 (с, 3H, N-CH3), 5,11 (д, J = 4,02 Гц, 1H, аномерно), 5,38 (д, J = 4,02 Гц, 1 H, аномерно), 8,15 (с, 1H, N-CHO), 8,16 (с, 1H, N-CHO).
13C-ЯМР (100 МГц, D2O; pH 9) w 51,36 (C-1), 47,8 (C-3), 38,96 (C-6'), 64,5 (C-3''), 37,01 (N-CH3), 22,22 (C-4''-CH3), 165,47 (N-CHO), 164,76 (N-CHO).
Вариант Б
Повторяют вариант А с той разницей, что к 75 мл диметилсульфоксида и 75 мл
этилацетата добавляют 7,76 г (31,5 ммоль) ацетата кобальта в виде тетрагидрата и 5 г (9,16 ммоль) гентамицина В с чистотой 88,4%. Полученную суспензию перемешивают при комнатной температуре в течение
15 минут с получением раствора, к которому добавляют 4,5 г (22,12 ммоль) 2-формилмеркаптобензотиазола, после чего продолжают перемешивание при комнатной температуре в течение 30 минут.
Реакционную смесь подают в разделительную воронку емкостью 500 мл, куда добавляют 300 мл воды. Продукт, содержащий водный слой, фильтруют на целите и фильтрат подвергают жидкостной хроматографии. Получают 4,19 г (84,9%) 3,6'-ди-N-формилгентамицина В, имеющего вышеуказанную характеристику.
Пример 4. Получение N,O-диформил-(S)-изосерина
В круглодонную колбу емкостью 1 л
подают 50 г (0,476 ммоль) (S)-изосерина и 62,5 мл муравьиной кислоты, после чего добавляют 5 эквивалентов свежеприготовленного раствора ацето-муравьиного ангидрида при 0-5oC в течение 30
минут (этот раствор получают путем добавления ацетилхлорида к 1,2 эквивалентам порошкового безводного формиата натрия в среде безводного ацетонитрила (концентрация формиата натрия в ацетонитриле может
составлять до 50%) при температуре 0-5oC. Реакция завершена через 2 часа, после чего осадок фильтруют. В зависимости от температуры из реакционной смеси может выделяться небольшое
количество окиси углерода. Продукт реакции является стабильным при 0oC в течение месяца). После завершения реакции примерно через два часа, что подтверждается данными1H-ЯМР,
смесь концентрируют в вакууме примерно до половины первоначального объема при 40oC. Медленно добавляют 250 мл изопропанола при одновременном охлаждении для достижения кристаллизации.
Суспензию перемешивают при 0oC в течение одного часа. Получаемый N,O-диформил-(S)-изосерин фильтруют и промывают изопропанолом. Выход: 64 г (84%). Т. пл. 139,5-141,5oC; [α
] ; -38o (с = 1%; метанол).
1H-ЯМР (D2O): w 3,8 (дд, 1H, J = 14,6, 4,4 Гц), 3,91 (дд, 1H, J = 14,6, 5,5 Гц), 5,38 (дд, 1H, J = 5,5, 4,4 Гц) 8,15 (с, 1H), 8,27 (с, 1H).
Пример 5. Получение N-фталоил-(S)-изосерина
К
перемешиваемой суспензии 15,75 г (150 ммоль) (S)-изосерина и 22,2 г (150 ммоль) фталевого ангидрида в 600 мл смеси толуола и диметилформамида ( 3 : 1) добавляют 2,1 мл (15 ммоль) триэтиламина.
Суспензию нагревают с обратным холодильником и выделяющуюся воду удаляют при помощи конденсатора типа Дин-Строка. Через два часа при температуре кипения вода больше не выделяется. Растворитель
упаривают до конечного объема примерно 100 мл. Реакционную смесь охлаждают, разбавляют ледяной водой и подкисляют 2 N хлористоводородной кислотой. Получаемый продукт фильтруют, промывают ледяной водой
и сушат в вакууме.
Получают 30,4 г (86%) N-фталоил-(S)-изосерина с т. пл. 227-228oC.
[α]
1H-ЯМР (DMCO-d6) w 3,76 (дд, 1H, J = 13,46, 7,69 Гц), 3,84 (дд, 1H, J = 13, 46, 5,77 Гц), 4,3 (дд, 1H, J = 7,69, 5,77 Гц), 7,77-7,89 (м, 4H).
Пример 6. Получение N-трифторацетил-S-изомерина
К 11 мл (1 экв.) перемешиваемого 24,8%-ного по весу раствора
метилата натрия в метаноле добавляют 5 г (S)-изосерина. Смесь перемешивают при комнатной температуре в течение 15 минут. К получаемому гомогенному раствору добавляют 7 мл (1,25 экв.)
этилтрифторацетата, после чего смесь перемешивают в течение 30 минут. Завершение реакции определяют при помощи спектра1H-ЯМР. Смесь концентрируют при пониженном давлении до максимально
возможного объема. К остатку добавляют 50 мл этилацетата. Смесь охлаждают до 0-5oC, добавляют сначала 25 мл (1 экв.) 2 N хлористоводородной кислоты и затем 5 г твердого хлористого натрия.
Органический слой отделяют. Водный слой повторно экстрагируют 50 мл этилацетата. Объединенные органические экстракты сушат над 5 г безводного сульфата магния, фильтруют и концентрируют до 20 мл при
пониженном давлении. Остаток подают в ледяную ванну, к которой добавляют 50 мл гептана при перемешивании в течение 30 минут. Продукт фильтруют и сушат. Получают 8,86 г (93%)
N-трифторацетил-(S)-изосерина с т. пл. 142-143oC.
[α]
1H-ЯМР (D2O); w 3,78 (д, 2H, J = 5,48 Гц), 4,53 (т, 1H, J = 5,48 Гц),
Пример 7. Получение изепамицина
Вариант А
Сначала приготовляют раствор N-формил-(S)-изосерина путем перемешивания 20 г (124,2 моль) N,O-диформил-(S)-изосерина в смеси 85 мл метанола и 15 мл пиридина при комнатной температуре в течение
14-16 часов. Завершение реакции определяют при помощи спектра1H-ЯМР.
N-формил-(S)-изосерин имеет следующую характеристику:
1H-ЯМР (D2O; 250
МГц):
δ 3,35 (дд, J = 13,88, 6,21 H2, 1H), 3,45 (дд, J = 13,88, 4,02 H2, 1H), 4,05 (дд, J = 6,21, 4,02 H2, 1H) 7,95 (с, 1H)
В другой колбе 4,
424 г (8,2 ммоль) 3,6'-ди-N-формил-гентамицина B в виде концентрата в 15,576 г воды и 1,26 г (8,26 ммоль) моногидрата 1-N-оксибензотриазола растворяют в 40 мл метанола. К перемешиваемой смеси
одновременно добавляют в течение 40 минут 22,2 мл (24,4 ммоль, 3 экв.) N-формил-(S)-изосерина в виде метанольного раствора и раствор 5 г (24,3 ммоль; 3 экв.) дициклогексилкарбодиимида в 20 мл
метанола. Затем смесь размешивают в течение 15 минут. За ходом реакции следят при помощи жидкостной хроматографии под давлением (возможен и анализ при помощи тонкослойной хроматографии). Растворитель
удаляют под пониженным давлением и получаемый продукт, триформилизепамицин, подвергают гидролизу с помощью 90 мл 2 N гидроокиси натрия при комнатной температуре в течение 16 часов. Во время процесса
гидролиза перемешивают, реакционную смесь нейтрализуют кислотой до pH 6, фильтруют и фильтрат разбавляют до 1000 мл. Анализ полученного раствора посредством стандартной жидкостной хроматографии под
давлением показывает 89%-ный выход изепамицина (4,17 г; 7,3 ммоль).
Вышеупомянутый трифтормилизепамицин имеет следующую характеристику:
13C-ЯМР (D2O), 62,
896 МГц):
δ 23,7; 35,1; 38,7; 40,5; 43,6; 49,1; 51,7; 66,2; 69,9; 70,4; 72,5; 72,9; 73,9; 74,1; 74,9; 77,8; 81,5; 84,6; 101; 102,4; 166,4; 167,1; 176,3.
Вариант Б
1,56 г (2,07 ммоль) 96,6%-ного 3,6'-ди-N-формилгентамицина B, 800 мг (1,7 экв.) N-фталоил-(S)-изосерина и 365 мг (1,26 экв.) моногидрата N-оксибензотриазола растворяют в 40 мл метанола. К
получаемому раствору добавляют 700 мг (1,7 экв.) дициклогексилкарбодиимида. Реакционную смесь перемешивают при комнатной температуре около часа, после чего добавляют 160 мг N-фталоил-(S)-изосерина и
140 мг дициклогексилкарбодиимида и реакционную смесь перемешивают при комнатной температуре в течение 3 часов. За ходом реакции следят при помощи тонкослойной хроматографии.
Растворитель упаривают и остаток поглощают в 50 мл метанола и 5 мл воды. Защитные группы удаляют путем обработки получаемой смеси 85%-ным гидратом гидразина, взятым в количестве 6 мл. Реакционную смесь нагревают при 85-90oC в атмосфере азота в течение 14 часов. Согласно данным жидкостной хроматографии под давлением получают 1,05 г (89%; 1,85 ммоль) изепамицина.
Вариант B
К 8,45 г (15,7 ммоль) 3,6'-ди-N-формилгентамицина B в виде концентрата в 40,45 г воды последовательно добавляют 2,4 г (15,7 ммоль) моногидрата 1-N-окси-бензотриазола и 80 мл
метанола. К перемешиваемой смеси одновременно добавляют 9,5 г (47,3 ммоль; 3 экв.) N-трифторацетил-(S)-изосерина в 40 мл метанола и 9,7 г (47,1 ммоль; 3 экв.) дициклогексилкарбодиимида в течение 40
минут. Затем смесь перемешивают в течение 15 минут. За ходом реакции следят при помощи жидеостной хроматографии под давлением (возможен и анализ при помощи тонкослойной хроматографии). Растворитель
удаляют под пониженным давлением и продукт подвергают гидролизу путем обработки 170 мл 2 N гидроокиси натрия при комнатной температуре в течение 16 часов. Реакционную смесь нейтрализуют кислотой до pH
6, фильтруют и фильтрат разбавляют до 1000 мл. Согласно данным жидкостной хроматографии под давлением получают 7,84 (88%; 13,8 ммоль) изепамицина.
Реферат
Изобретение может быть использовано в медицине и относится к технологии производства известного аминогликозидного антибиотика. Описывается способ получения изепамицина путем
взаимодействия гентамицина В в виде комплекса с двухвалентной солью с 2-формилмеркаптобензотиазолом, ацилирования получаемого при этом соединения соединением N-защищенного (S)-изосерина с последующим
снятием защитных групп путем основного гидролиза и выделением целевого продукта. Описываемый способ позволяет повысить выход целевого продукта на 25 - 30%. Кроме того, описываются еще исходные
соединения, т.е. N, O-диформил-(S)-изосерин, N-формил-(S)-изосерин и 2-формилмеркаптобензотиазол, а также промежуточный триформилизепамицин формулы

и 3,6-ди-N-формилгентамицин В формулы
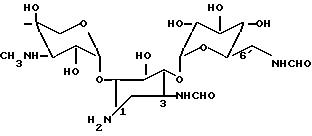
Формула
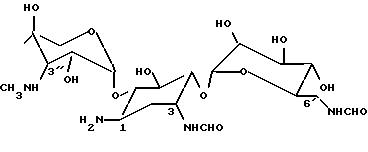
7. Триформилирепамицин формулы

8. N,O-диформил-(S)-изосерин.

Комментарии