Пролекарство для терапии опухолей и воспалительных заболеваний - RU2191021C2
Код документа: RU2191021C2
Чертежи



Описание
Действие лекарств очень часто проявляется в том, что ими подавляется деятельность ферментов, цитокинов или других генов, стимулирующих заболевание и патологически избыточно выделяющихся при определенных заболеваниях. Разумеется, подавляющий эффект лекарств распространяется не только на фармакологически целевые структуры (ферменты, цитокины, гены) пораженной ткани, ими также тормозятся процессы, протекающие в здоровых тканях. Поэтому при использовании многих лекарств наблюдаются нежелательные побочные действия. Для снижения побочных эффектов лекарств были разработаны экспериментальные системы, позволяющие выборочное выделение лекарств в пораженной ткани. Ниже приводится краткое описание таких систем.
Система направленной на антитело терапии ферментным пролекарством (далее - АТФП) (Antibody directed enzyme prodrug therapy, Bagshawe, 1987 г., в журнале Вr. J. Cancer., 56, стр. 531-532) представляет собой двухстадийную систему, при которой на первой стадии внутривенно впрыскивают конъюгат антитела и фермента (КАФ). Благодаря своей опухолевой избирательности КАФ остается в опухоли, а из здоровых тканей выводится через 2-7 суток. На второй стадии внутривенно введенное пролекарство (нетоксичная лекарственная предстадия) превращается внутри опухоли в результате ферментной активности КАФ в токсичное лекарство. Как следствие активации такого специфичного противоопухолевого пролекарства наблюдается повышение концентрации лекарства внутри опухоли (в 5-50 раз) и снижение его концентрации в здоровой ткани по сравнению со стандартной терапией. В результате на моделях ксенотрансплантата опухоли человека (Sharma, S.K. и др., 1991 г., в журнале Disease Markers, 9, стр. 225-231) отмечены более легкая переносимость и превосходящие терапевтические эффекты.
Аналогично системе АТФП работает и программа активации пролекарства через слияние белка (далее - АПСБ) (Fusion protein mediated prodrug activation), при которой вместо чужеродного и, следовательно, иммуногенного КАФ используется неиммуногенный слившийся белок человека для активизации избирательного действия на опухоль пролекарства (Bosselet и др., в журнале Cancer Res. 54, стр. 2151-2159).
И в системе терапии зависимым от переносчика ферментным пролекарством (далее - ТЗПФП) (Vector dependent enzyme prodrug therapy, Trinh и др., в журнале Cancer Res., 55, стр. 4808-4812), являющейся двухстадийным генно-терапевтическим приемом, пролекарства активируются избирательно в отношении опухоли после инъекции переносчика и экспрессии структурного гена, кодирующего фермент.
Эндогенная активация пролекарств (глюкуронил-спейсер-антрациклин) (Glucuronyl-Spacer-Anthrazyclin, Jacquessy и др., 1991 г., Международная заявка WO 92/19639) в некротических опухолях и при воспалительных процессах и монотерапия в сочетании с выраженными противоопухолевыми и противовоспалительными фармакологическими эффектами были впервые описаны Bosslet и др., 1994 г., в журнале Cancer Res., 54, стр. 2151-2159 и 1995 г., в журнале Tumor Targeting, 1, стр. 45-50, как монотерапия пролекарствами (МТП) (Prodrug Monotherapie). Во время фармакологического употребления системы МТП было установлено, что решающее значение для эффективности in vivo имеют как химия самоэлиминирующегося спейсера, так и гидрофильность и молярная цитотоксичность лекарственного компонента пролекарства. Дополнительное повышение эффективности МТП наблюдалось в комбинации с веществами, индуцирующими некрозы (Европейский патент ЕР 0696456 А2). Прежде всего применение конъюгатов антител, обладающих специфичностью в отношении рецепторного комплекса VEGF/VEGF и ковалентно связанных с коагулирующими белками, как, например, укороченный фактор ткани, оказалось особенно эффективным в фармакологических моделях in vivo в сочетании с приемлемыми пролекарствами.
Неожиданным образом удалось синтезировать пролекарства, которые после соответствующей эндогенной ферментной активизации оказались in vivo еще более эффективными, чем пролекарства, описанные в Европейских патентах ЕР 0511917 А1 и ЕР 0595133 А2. Такое превосходное действие обусловлено, с одной стороны, специфичной и благоприятной химией спейсера и, с другой стороны, большой молярной цитотоксичностью использованного лекарственного компонента. Новая благоприятная химия спейсера характеризуется тем, что особенно при наличии активных начал, связанных через гидроксильную группу со спейсером, активное начало выделяется после ферментного расщепления глюкозильного остатка путем циклизации и отщепления спейсера. В результате повышается устойчивость пролекарств при одновременной хорошей ферментной расщепляемости. Пролекарства согласно изобретению, кроме того, более устойчивы в физиологических условиях, чем известные пролекарства, поскольку они не так быстро выделяют активное начало.
Изобретение касается пролекарства формулы I:
Гликозил-Y[-С(=Y)-Х-]р-W(R)n-Z-С(=Y)-активное начало
(I)
и/или физиологически переносимых солей соединения формулы I, где
гликозил - это ферментно отщепляемый поли-, олиго- или моносахарид;
W - 1) 5-14-членный ароматический
остаток,
2) нафтил,
3) инденил,
4) антрил,
5) фенантрил,
6) 5-14-членный гетероциклический остаток с 1, 2, 3 или 4 гетероатомами из группы: кислород, азот
и сера,
7) алкил с 1-6 атомами углерода,
8) алкенил с 2-6 атомами углерода,
9) циклоалкил с 3-6 атомами углерода или
10) фенил;
R - 1) атом водорода,
2) алкил с 1-4 атомами углерода,
3) фенил,
4) метоксил,
5) карбоксил,
6) метилоксикарбонил,
7) циано-группа,
8) гидроксил,
9)
нитрогруппа,
10) галоген, например фтор, хлор или бром,
11) сульфонил,
12) сульфонамид или
13) сульфон-алкиламид с 1-4 атомами углерода в алкильной части;
р - ноль или 1;
n - ноль, 1, 2 или 3;
X - 1) атом кислорода,
2) группа -NH-,
3) метиленоксил,
4) метиленамино-группа,
5)
метилен-алкиламино-группа
с 1-4 атомами углерода в алкильной части,
6) алкиламино-группа с 1-4 атомами углерода в алкильной части, или
7) циклоалкиламино-группа с 1-4 атомами
углерода в алкильной части;
Y - атом кислорода или имино-группа;
Z - 1) алкиламино-группа с 1-4 атомами углерода в алкильной части,
2) группа -N(СН3)-,
3) группа -С(СН3)2-NН-,
4) группа -СН(СН3)-NН-,
5) группа -С(СН3)2-N(R2)-, где R2 означает алкил с 1-4
атомами углерода, или
6)
имино-группа, если W означает алкил с 1-4 атомами углерода, и активное начало - биологически активное соединение, связанное через атом кислорода, первичную или
вторичную аминогруппу или
иминогруппу.
Если n означает целое число 2 или 3, то в этом случае остатки R имеют независимо друг от друга значения, приведенные в пунктах R1)-R13). Под понятием "алкил" или "алкенил" понимаются радикалы, углеродная цепь которых может быть линейной, разветвленной или цикличной; двойные связи могут быть многократными. Цикличными алкильными радикалами могут быть, например, 3-6-членные моноциклы, как, например, циклопропил, циклобутил, циклопентил или циклогексил. К понятию "5-14-членный гетероцикличный радикал с 1, 2, 3 или 4 гетероатомами из группы: кислород, азот и сера" относятся, например, радикалы, производные от пиррола, азепина, пиридина, имидазола, пиримидина, триазина, фурана, 1,2-диазепина, оксазола, пиразина, изоксазола, изоксазолина, тиазола, изотиазола, изотиазолидина, индола, хинолина, изохинолина, бензимидазола, индазола, пурина, птеридина, тиопирана или тиофена.
Приемлемыми, физиологически переносимыми солями соединения формулы I являются, например, соли щелочных, щелочноземельных металлов и аммония, в том числе соли органических аммониевых оснований.
Под "моносахаридом" понимаются остатки, такие как, например, D-глюкуронил, L-идуронил, D-глюкопиранозил-, D-галактопиранозил, N-ацетил-D-глюкозаминил-, N-ацетил-D-галактозаминил-, D-маннопиранозил- или L-фукопиранозил. Олиго- или полисахариды состоят из 2-20 указанных выше моносахаридов, связанных между собой альфа- или бета-O-гликозидами. Связь между моносахаридом и остатком Y является альфа- или бета-O-гликозидной. Приемлемыми ферментами, вызывающими отщепление гликозильного остатка от остатка Y, являются индуронидаза, глюкозидаза, галактозидаза, N-ацетил-D-глюкозаминидаза, N-ацетил-D-галактозаминидаза, маннозидаза, фукозидаза или глюкуронидаза, предпочтительно β-глюкуронидаза.
В качестве активного начала приемлемы такие соединения, как, например, антрациклин, преимущественно доксорубицин, 4'-эпидоксорубицин, 4- или 4'-дезоксидоксорубицин или соединение, предпочтительно выбранное из группы: этопосид, N-бис(2-хлорэтил)-4-гидроксианилин, 4-гидроксициклофосфамид, виндезин, винбластин, винкристин, терфенадин, тербуталин, фенотерол, сальбутамол, мускарин, оксифенбутазон, салициловая кислота, пара-аминосалициловая кислота, 5-фтороурацил, 5-фтороцитидин, 5-фтороуридин, метотрексат, диклофенак, флуфоаминовая кислота, 4-метиламинофеназон, теофиллин, нифедипин, митомицин С, митоксантрон, камптотецин, мета-АМСА, таксол, нокодазол, колчицин, циклофосфамид, рашелмицин, цисплатин, мелфалан, беломицин, азот-горчичный газ, фосфорамид-горчичный газ, кверцетин, геништейн, эрбстатин, тирфостин, роитукин-производное((-)-цис-5, 7-дигидрокси-2-(2-хлорфенил)-8-[4-(3-гидрокси-1-метил)-пиперидинил] -4Н-1-бензопиран-4-он; см. Европейский патент ЕР 0 366 061), ретинолевая кислота, масляная кислота, форбольный эфир, аклациномицин, прогестерон, бузерелин, тамоксифен, мифепристон, онапристон, N-(4-аминобутил)-5-хлоро-2-нафтален-сульфонамид, пиридинилоксазол-2-он, квинолилоксазолон-2-он, изоквинолилоксазолон-2-он, стауроспорин, верапамил, форсколин, 1,9-дидеоксифорсколин, хинин, хинидин, резерпин, 18-О-(3,5-диметокси-4-гидроксибензоил)-резерпат, лонидамин, бутионинсульфоксимин, диэтилдитиокарбамат, циклоспорин А, азатиоприн, хлорамбуцил, амид N-(4-трифторметил)-фенил-2-циано-3-гидроксикротоновой кислоты (см. Международную заявку WO 91 17748), 15-деоксиспергуалин, FK 506, ибупрофен, индометацин, аспирин, сульфазалазин, пенициллинамин, хлорохин, дексаметазон, преднизолон, лидокаин, пропафенон, прокаин, мефенаминовая кислота, парацетамол, 4-аминофеназон, мускозин, орципреналин, изопреналин, амилорид, пара-нитрофенилгуанидинбензоат или их производные, дополнительно замещенные одной или несколькими гидрокси-, амино- или имино-группами.
Предпочтительно используются пролекарства, в которых активным началом является цитостатический препарат, антиметаболит, 5-фтороуразил, 5-фтороцитидин, 5-фтороуридин, цитозинарабинозид или метотрексат, активным началом является вещество, встриваемое в ДНК, активным началом является доксорубицин, дауномицин, идарубицин, эпирубицин или митоксантрон, в которых активное начало подавляет топоизомеразу I и II, в которых активным началом является камптотезин, этопозид или мета-АМСА, активным началом является ингибитор тубулин, активным началом являются винкристин, винбластин, виндестин, таксол, нокодазол или колчицин, активным началом является алкиланц, активным началом является циклофосфамид, митомицин С, рашелмицин, цисплатин, фосфорамид-горчичный газ, мефалан, блеомицин, азот-горчичный газ или N-бис-(2-хлорэтил)-4-гидроксианилин, активным началом является неокарзиностатин, калихеамицин, динемицин или эсперармицин А, соединение, инактивирующее рибосомы, активным началом является веррукарин А, активным началом является ингибитор тирозин-фосфокиназа, активным началом является кверцетин, геништейн, эрбстатин, тирфостин или производное руитукина, активным началом является диференцирующий индуктор, активным началом является рутиноловая кислота, масляная кислота, форболэфир или аклациномицин, активным началом является гормон, гормон-агонист или гормон-антагонист, активным началом является прогестерон, бузерелин, тамоксифен, мифепристон или онапристон, активным началом является вещество, изменяющее плейотропную сопротивляемость по отношению к цитостатическим препаратам, активным началом является ингибитор калмодулина, активным началом является ингибитор протеинкиназы С, активным началом является ингибитор Р-гликопротеина, активным началом является модулятор митохондриально связанной гексокиназы, активным началом является ингибитор y-глютамил-цистейнсинтетазы или глютатион-S-трансферазы, активным началом является ингибитор супероксид-дисмутазы, активным началом является ингибитор пролифератно-ассоциированного, задаваемого посредством MAk Ki67 белка в ядре делящейся клетки, активным началом является вещество, вызывающее иммунно-подавляющие эффекты, активным началом является стандартное подавляющее средство, активным началом является макролид, активным началом является циклоспорин А, рапамицин, FK 506, активным началом является азатиоприн, метотрексат, циклофосфамид или хлорамбуцил, активным началом является вещество, обладающее противовоспалительным действием, активным началом является нестереоидальное противовоспалительное вещество, активным началом является противоревматическое лекарство медленного действия ("slow acting antirheumatic drug"), активным началом является стероид, активным началом является субстанция, обладающая противовоспалительным, обезболивающим или жаропонижающим действием, активным началом является производное органической кислоты, активным началом является некислое обезболивающее/противовоспалительное средство, активным началом является оксифенбутазон, активным началом является средство местного обезболивания, активным началом является средство против аритмии, активным началом является антагонист Са++, активным началом является противогистаминное средство, активным началом является симпатомиметическое средство или активным средством является вещество с ингибиторным действием на урокиназу человека, и производные перечисленных выше активных начал, причем активное начало через атом кислорода, группу -NH- или иминогруппу связано с остатком Y соединения формулы I.
Активным началом являются предпочтительно указанные в примерах соединение азотистого иприта, хинин или дипиридамол.
Предпочтительны пролекарства, в которых гликозил означает
ферментно-отщепляемую
глюкуроновую кислоту,
W означает фенил,
R означает атом водорода, циан-группу, нитро-группу, фтор, хлор, бром,
р равно 0,
n означает целое
число 0, 1 или 2,
Y означает атом кислорода,
Z означает группу -N(СН3)-, -С(СН3)2-NН-, -СН(СН3)-NН-, -С(СН3)2
-N(С1-С4
)алкил)-, -СН(СН3)-N(С1-С4)алкил и
активным началом является соединение, обладающее биологическим действием, связанное через
гидроскил, амино- или
иминогруппу.
Особо предпочтительны соединения:
2-[N-метил-N-[(4-(N, N'-бис-(2-хлороэтил)амино)фенилоксикарбонил] амино] -4-нитрофенил-β
-D-глюкуроновая кислота,
2-[N-метил-N-[N, N'-бис-(2-йодоэтил)амино)фенилоксикарбонил]амино]-4-нитрофенил-β-D-глюкуроновая кислота,

или

Изобретение касается также способа получения пролекарства формулы I, отличающегося тем, что осуществляют взаимодействие соединения формулы II
гликозил-Y[-C(=Y)-X-]p-W(R)n-Z (II)
в которой радикалы гликозил, Y, X, р, W, R, n и Z имеют значения, указанные в формуле I,
с активным началом, содержащим активированную карбоксильную, амино- или имино-группу, причем это взаимодействие протекает в присутствии растворителя, выбранного из группы: ацетонитрил, диоксан, тетрагидрофуран, дихлорметан, диметилформамид, ацетон, и затем гидролитически отщепляют защитные группы.
Активация активного начала проводится, например, по методу, описанному H.J. Marley в журнале Chem. Soc. Chem. Communication (1987 г.), стр. 112-113 или описанному Н. Hagemann в журнале Angew. Chem., 93, (1981 г.), стр. 813-814. Отщепление защитных групп производится, например, посредством раствора едкой щелочи, карбоната щелочного металла, цианида щелочного металла, окиси бария, пиперидина или морфолина в присутствии метанола, этанола или воды.
Изобретение относится также к лекарственному средству, отличающемуся тем, что оно содержит эффективное количество по меньшей мере одного соединения формулы I и/или физиологически переносимой соли соединения I, причем радикалы гликозил, Y, X, p, W, R, n, Z и активное начало имеют значения, указанные выше, вместе с физиологически приемлемым и физиологически переносимым веществом-носителем, добавкой и/или другими активными и вспомогательными веществами.
Благодаря фармакологическим свойствам соединения согласно изобретению превосходно пригодны для профилактики и терапии всех видов заболеваний или нарушений, при протекании которых внутриклеточные ферменты, которые способны расщеплять гликозильный остаток, интенсивно множатся и/или выделяются, или к которым в результате разрушения клетки открывается доступ. Такими болезнями являются в первую очередь рак, аутоиммунные заболевания или воспалительные, иммунологические или вызванные нарушением обмена веществ острые или хронические артритиды и артропатии, преимущественно опухолевые заболевания и ревматический артрит.
Изобретение касается также применения соединения формулы I для получения лекарственных средств, предназначенных для профилактики и терапии раковых заболеваний, аутоиммунных заболеваний и хронических воспалительных заболеваний типа ревматического артрита.
Изобретение касается, кроме того, способа получения лекарственного средства, отличающегося тем, что, по меньшей мере, одно соединение формулы I вместе с фармацевтически приемлемым и физиологически переносимым носителем и при необходимости вместе с другими приемлемыми активными, целевыми или вспомогательными веществами переводят в пригодную для употребления форму.
Приемлемыми лекарственными формами являются, например, инъецируемые растворы, для приготовления которых используются традиционные вспомогательные средства, как, например, вещества-носители, связывающие средства, средства, вызывающие набухание, или смазочные средства и агенты растворения. Часто используемыми вспомогательными веществами являются карбонат магния, двуокись титана, лактоза, маннит и другие сахара, тальк, молочный белок, желатина, крахмал, целлюлоза и их производные, животные и растительные масла, как, например, рыбий жир, подсолнечное, арахисовое или кунжутное масло, и растворители, как, например, стерильная вода и одно- или многовалентные спирты, как, например, глицерин. Могут также применяться в качестве носителей и липосомы или белки человека.
Фармацевтические препараты предпочтительно приготавливают и дают для приема в дозировочных единицах, причем в каждой единице в качестве активного компонента содержится определенная доза соединения формулы I согласно изобретению. Для инъекцируемых растворов такая доза для взрослого пациента весом около 70 кг может составлять до приблизительно 10 г, однако предпочтительно от 3 до 5 г. При определенных условиях могут употребляться и более высокие или низкие суточные дозы. Прием суточной дозы может происходить либо за один раз в виде отдельной дозировочной единицы, либо в виде нескольких небольших дозировочных единиц, либо несколько раз через определенные интервалы времени с разбивкой доз.
Пролекарства согласно изобретению могут применяться и при любых заболеваниях неонкологического характера, при которых макрофаги, гранулоциты и тромбоциты находятся, в частности, в активированном состоянии. В активированном состоянии упомянутые клетки выделяют главным образом внутриклеточные ферменты, обеспечивающие местную специфичную активацию пролекарств согласно изобретению.
При лечении онкологических заболеваний активация пролекарств согласно изобретению вызывается внутриклеточными ферментами, выделившимися из отмирающих опухолевых клеток. Такое явление наблюдается, прежде всего, при значительных опухолях (диаметром свыше 0,3 см), но и после повреждения опухоли в результате лечения с применением иммунных токсинов, цитостатических средств, облучения, слившихся белков или конъюгатов антител и ферментов. Ввиду того, что гликозильная часть в пролекарствах согласно изобретению выбрана такой, что она отщепляется только в патофизиологических условиях локально выделившимися ферментами, то липофильное лекарство может выделяться также только в целевой ткани и проявлять в ней свое цитотоксичное действие.
Превосходное действие пролекарства согласно изобретению, содержащего цитотоксичный лекарственный компонент, может быть улучшено за счет того, что его комбинируют с другим цитотоксичным лекарственным компонентом. При этом преимуществом обладают те из комбинаций пролекарств, в которых используются цитотоксичные компоненты с разными механизмами действия в соответствии с полихимиотерапией. Особенно показано применение активных начал, которые очень эффективно вызывают разрыв одной или двух нитей в ДНК, например калихеамицин. Особенно предпочтительны, разумеется, комбинации пролекарств, в которых одно пролекарство обладает цитотоксичным потенциалом, а другое блокирует мультилекарственную сопротивляемость.
Кроме того, изобретение касается фармацевтических композиций с содержанием соединения формулы I и конъюгатов антител с ферментами.
Под конъюгатами антител с ферментами понимаются соединения, которые через антитела специфически связываются с опухлевой или воспаленной тканью и содержат часть ферментов, способных расщеплять гликозильный остаток соединения формулы I. Примеры таких соединений описаны в Европейских патентах ЕР 0 501 215, ЕР 0 390 530 и ЕР 0 623 352.
Пример
1
Производное азотистого иприта в качестве пролекарства (F373; соединение 11)

синтезировали следующим образом (см. схему).
В качестве исходного вещества брали 2-амино-4-нитрофенол (соединение 1). Сначала соединение 1 монометилировали с помощью йодистого метила (соединение 2), а амино-группу защитили как БОК-производное (БОК - трет.бутилоксикарбонил) (соединение 3). Защищенную глюкуроновую кислоту вводили посредством соединения 3 и бромида (соединение 4), связанных окисью серебра, с получением соединения 5. После отщепления БОК-защитной группы действием соляной кислоты получали амин (соединение 6). Соединение 7 превращали в хлороформат (соединение 8) и конденсировали с соединением 6 с получением соединения 9. После расщепления сложных эфиров глюкуроновокислой части соединения 3 в две стадии (метилат натрия/метиловый спирт, затем водная гидроокись натрия) через соединение 10 получили пролекарство (соединение 11).
Соединение 2:
2-(N-метиламино)-4-нитрофенол (2).
В раствор 2-амино-4-нитрофенола (1) (1,54 г, 10 ммолей) и йодистого метила (1 мл, 16 ммолей) в метаноле (10 мл) добавляли триэтиламин (2 мл, 14,4 ммоля). Через час при 40oС дополнительно добавляли йодистый метил (1 мл) и триэтиламин (1 мл) и перемешивали при 40oС в течение 2 часов. В вакууме реакционную смесь сгущали до сухого остатка, добавляли в водный 2Н раствор ацетата натрия и экстрагировали уксусным эфиром. Органическую фазу сушили над сульфатом натрия и хроматографировали (носитель: дихлорметан/ метанол, 95:5). Выход целевого продукта: 880 мг (52%).
C7H8N2
O3
Расчет: C:50,0; H:4,76; N:16,73.
Найдено: C:50,00; H:4,80; N:16,66.
Температура плавления: 148oС (толуол)
1H ЯМР
(250 МГц, диметилсульфоксид):
δ 7.44(дд, Jopтo=9 Гц, Jмета
=3.0 Гц, 1 Н),
7.13 (д,J=3 Гц, 1Н),
6.77 (д, J=9 Гц, 1Н),
2.76 (с, 3Н).
ИКС (бромид калия): v(cm-1) 3363(ОН), 1538, 1338(NO2).
МС(десорбц.-хим. ионизация, аммиак): m/z [M+H]+:169
Соединение 3:
2-(N-БОК,N-метиламино)-4-нитрофенол(3);
(БОК-трет.бутилоксикарбонил)
В
раствор 2-N-метиламино-4-нитрофенола (2) (4,18 г, 24,9 ммоля) в тетрагидрофуране (50 мл) добавляли
ди-трет.бутилдикарбонат (14 г, 64,15 ммолей), карбонат калия (17 г, 123 ммоля) и воду (50 мл) и в
течение ночи перемешивали при комнатной температуре. Реакционную смесь подкисляли насыщенным водным
раствором хлорида аммония, экстрагировали уксусным эфиром, сушили сульфатом натрия и сгущали в
вакууме. Сырой продукт в течение 2 часов перемешивали в метаноле (100 мл) с карбонатом калия (17 г, 123
ммоля), подкисляли насыщенным водным раствором хлорида аммония, экстрагировали уксусным эфиром,
сушили над сульфатом натрия и сгущали в вакууме. Продукт хроматографировали на силикагеле (носитель:
дихлорметан/метанол, 97.5:2.5). Выход целевого продукта составил 6,2 г (93 %).
C12H16N2O5
Расчет: C:53,72; H:6,01; N:10,44.
Найдено: C:53,64; H:6,20; N:10,36.
Температура плавления: 197oС (толуол/петролейный эфир)
1H ЯМР (250 МГц, диметилсульфоксид):
δ
8,10-8,00 (2Н),
7,03 (д, J+8.5 Гц, 1Н),
3,04 (с, 3Н),
1,40-1,30
(9Н).
ИКС (бромид калия): ν(см-1) 3129 (ОН), 1672 (СО), 1529, 1339 (NO2)
MC (десорбц.-хим. ионизация, аммиак);
м/е [M+H]+:269,
[М+Н-С4Н8]+:213,
[М+Н-C4Н8ОСО]+:169
Соединение 5:
Метиловый сложный эфир 2-(N-БОК,
N-метиламино)-4-нитрофенил-2,3,4-три-О-ацетил-β-D-глюкуроновой кислоты (5).
В раствор бромида сложного метилового эфира 2,3,4-три-O-ацетил--α-D-глюкуроновой кислоты (4) (126 мг, 0,317 ммоля) в ацетонитриле (5 мл) добавили окись серебра (0,23 г, 0,992 ммоля) и 2-(N-БОК, N-метиламино)-4-нитрофенол (3). Реакционную смесь перемешивали в течение часа при комнатной температуре, фильтровали через целит и сгущали в вакууме. Продукт хроматографировали на силикагеле (растворитель: дихлорметан/метанол, 97,5:2,5). Выход целевого продукта составил 165 мг (89%).
C25H32N2O14
Расчет: C:51,37; H:5,52;
N:4,79.
Найдено: C:51,79; H:5,72; N:4,66.
Температура плавления:
80oС (толуол/петролейный эфир)
[α]D20 =
-39o (с=1,02 в хлороформе).
1H ЯМР (250 МГц, дейтерир.
хлороформ):
δ 8,14 (дд, Jopтo=9 Гц, Jмета=2,5 Гц, 1Н),
8,15-8,
05 (1Н),
7,30-7,20 (1Н),
5,45-5,30 (4Н),
4,25 (д, J=9 Гц, 1Н),
3,73 (с, 3Н),
3,13 (с, 3Н),
2,15-2,05 (9Н),
1,65-1,40 (9Н).
ИКС (дейтерир. хлороформ): ν(cм-1) 1760 (СО, эфир), 1699 (СО, карбамат), 1529, 1349 (NO2).
МС (десорбц.-хим.ионизация, аммиак): м/е [М+NН4 ]+:602.
Соединение 6:
Сложный метиловый эфир
2-(N-метиламино)-4-нитрофенил-2,3,4-три-O-ацетил-β-D-глюкуроновой кислоты (6).
Раствор сложного метилового эфира 2-(N-БОК,N-метиламино)-4-нитрофенил-2,3,4-три-O-ацетил-β -D-глюкуроновой кислоты (5) (3 г, 5,13 ммоли) в 2,12 М соляной кислоте и уксусном эфире (60 ммолей) перемешивали в течение одного часа при комнатной температуре. Раствор добавляли в избыточный водный насыщенный раствор бикарбоната натрия и экстрагировали уксусным эфиром. Органическая фаза просушивалась сульфатом натрия и сгущалась. Продукт хроматографировали на силикагеле (носитель: дихлорметан/метанол = 97.5:2.5). Выход целевого продукта: 2,14 г (86%), твердое вещество желтого цвета.
C20
H24N2O12
Расчет: C:49,
59; H:4,99; N:5,78.
Найдено: C:49,81; H:5,12; N:4,80.
Температура плавления: 120oС
(толуол)
[α]D20 = -58o (с=1,04 в СНСl3).
1H ЯМР (300 МГц, дейтерир. хлороформ):
δ 7,53 (дд,
Jopтo=8.5 Гц, Jмeтa=2,5 Гц, 1Н),
7,
37(д, J=2,5 Гц, 1Н),
6,91 (д, J=8,5 Гц, 1Н),
5,45-5,30 (4Н),
5,16 (д, J=7 Гц, ушир.,1Н),
4,50 (д,
J=5 Гц, 1Н),
4,24 (д, J=9 Гц, 1Н),
3,75 (с, 3Н),
2,90 (д, J=5 Гц, 1Н),
2,10-2,05 (9Н)
ИКС (дейтерир. хлороформ): ν(см-1) 3443 (NH), 1758
(СО), 1553, 1346 (NO2).
МС(десорбц.-хим.ионизация, аммиак):м/е [M+H]+:485.
Соединение 8:
4-[N,
N-бис-(2-хлороэтил)-амино]-фенил-хлороформат (8)
Фосген в толуоле (1,93 М) (8 мл,
15,4 ммоля) добавляли в суспензию гидрохлорида 4-[N,N-бис-(2-хлороэтил)амино]фенола (7) (1,85 ммоля) в
тетрагидрофуране (30 мл) и перемешивали в течение 30 мин при 0oС. После добавки
триэтиламина (1 мл, 7,17 ммоля) продолжали перемешивать в течение одного часа при 0oС. Затем
суспензию фильтровали и сгущали в условиях вакуума при комнатной температуре. Путем
флэш-хроматографии на силикагеле с использованием дихлорметана в качестве носителя был получен продукт в виде
бесцветной жидкости, которую тут же использовали в последующей реакции. Выход продукта
составил 70%.
1H ЯМР (250 МГц, дейтерир. хлороформ):
δ 7,10 (д, J=9 Гц,
2Н),
6,66 (д, J=9 Гц, 2Н),
3,73 (т, J=6.5 Гц, 4Н),
3,63 (т,
J=6.5 Гц, 4Н).
ИКС (дейтерир. хлороформ): ν(см-1) 1779 (СО), 1514 (ароматика).
МС(десорбц.-хим.ионизация, аммиак): м/е
[М+Н]+
:296,
[M+2+H]+:298.
Соединение 9:
Сложный метиловый эфир
2-[N-метил-N-[4-(N,N'-бис-(2-хлороэтил)-амино]-фенилоксикарбонил] -амино] -4-нитрофенил-2,3,
4-три-O-ацетил-β-D-глюкуроновой кислоты (9).
В раствор хлороформата 4-[N, N-бис-(2-хлороэтил)амино)фенила (8) (0,31 г, 1,04 ммоля) в тетрагидрофуране (15 мл) и диизопропилэтиламине (0,25 мл, 1,44 ммоля) добавляли метиловый эфир 2-(N-метиламино)-4-нитрофенил-2,3, 4-три-О-ацетил-β-D-глюкуроновой кислоты (6) (0,50 г, 1,03 ммоля) и выдерживали при кипении в течение двух часов с обратным холодильником. После охлаждения до комнатной температуры реакционную массу сгущали. Продукт хроматографировали на силикагеле (носитель: дихлорметан/метанол, 97.5/2.5). Выход продукта составил 487 мг (64%).
C31H35O14
Cl2:
Расчет: C:50,00; H:4,74; N:5,64; Cl:9,52.
Найдено: C:49,90; H:4,82; N:5,62; Cl:9,78.
Температура плавления: 101oС (метанол)
[α]D20 = -47o (с=1.10 в хлороформе).
1H ЯМР (300 МГц, дейтерир. хлороформ):
δ 8,25-8,15 (2Н),
7,45-7,
35 (1Н),
7,25-7,05 (1Н),
6,95-6,85 (1Н),
6,70-6,55 (2Н),
5,45-5,
25 (4Н),
4,28 (д, J=9 Гц, 1Н),
3,80-3,55 (11Н),
338 (с) 2 диастереомерных
карбамата (40/60) 3Н,
3,27 (с),
2,20-2,00 (9Н).
ИКС (дейтерир. хлороформ): ν(см-1) 1760 (СО, эфир), 1722 (СО, карбамат), 1530, 1350 (NO2 ).
МС(десорбц.-хим.ионизация, аммиак): м/е
[M+H]+: 744;
[M+2+H]+:746,
[M+Na]+:766,
[M+2+Na]+:768.
Соединение 10:
Сложный метиловый эфир 2-[N-метил-N-[(4-(N,
N'-бис-(2-хлороэтил)-амино)-фенилоксикарбонил]-амино]-4-нитрофенил-β-D-глюкуроновой кислоты (10)
В
суспензию сложного метилового эфира 2-[N-метил-N-[(4-(N,
N'-бис-(2-хлорэтил)-амино)-фенилоксикарбонил] -амино] -4-нитрофенил-2,3,4-три-O-ацетил-β-D-глюкуроновой кислоты (9) (68 мг, 0,0915 ммоля)
в метаноле (5 мл), добавляли метилат натрия (2 мг, 0,
037 ммоля) при -15oС и перемешивали в течение 6 часов при -15oС. После нейтрализации ионитом (Амберлит IRC-50 S) и фильтрации
раствор сгущали и хроматографировали на силикагеле
с уксусным эфиром в качестве носителя. Выход продукта составил 50 мг (89%).
C25H29N3O11
Cl2
1H ЯМР (300 МГц,
дейтерир. хлороформ):
δ 8,22 (с, 1Н),
8,16 (д, J=8,5 Гц, 1Н),
7,25 (д, 1Н),
7,15-6,90 (2Н),
6,
80-6,45 (2Н),
5,06 (1Н),
4,09 (1Н),
4,20-3,15 (17Н).
ИКС (дейтерир. хлороформ): ν(cм-1) 3601, 3448 (ОН), 1714 (СО), 1528, 1349 (NO2).
МС (ионизация электронным
распылением):
м/е [M+Na]+: 640, [М+2+Nа]+:642.
Соединение 11:
2-[N-метил-N-[(4-(N,
N'-бис-(2-хлороэтил)амино)фенилоксикарбонил] амино]
-4-нитрофенил-β-D-глюкуроновая кислота (11).
В раствор соединения 10 (50 мг, 0,0809 ммоля) в ацетоне (4 мл), добавляли при -15oС 0,3 мл водного 1 Н раствора гидроокиси натрия. Смесь перемешивали в течение 2 часов при -15oС, нейтрализовали водной 1Н соляной кислотой и сгущали в вакууме (температура ниже 40oС). Продукт хроматографировали на силикагеле с применением смеси ацетонитрила/воды (9/1). Выход продукта составил 45 мг (89%).
С24Н27N3О11Сl2
1H ЯМР (250 МГц, дейтерир. хлороформ):
δ 8,30 (с, 1Н),
8,24 (дд, Jopтo=9 Гц, Jмeтa=2,5 Гц, 1Н),
7,52 (д, J=9 Гц, 1Н),
6,99 (д, J=9 Гц, 2Н),
6,69 (д, J=9 Гц, 2Н),
5,23 (1Н),
3,89 (д, J=9 Гц, 1Н),
3,80-3,33 (1Н).
ИКС (бромид калия): ν(см-1) 3418 (ОН), 1705(СО), 1516, 1349 (NO2).
МС (ионизация электронным распылением):
м/е [М-Н]+: 603
[М+2-Н]+:605.
Пример
2
2-[N-метил-N-[(4-(N, N'-бис-(2-йодоэтил)амино)фенилоксикарбонил] амино] -4-нитрофенил-β-D-глюкуроновая кислота (12).
(Соединение
12):
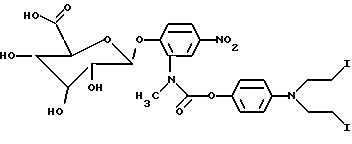
Синтез проводился аналогично описанному в примере 1.
Пример 3
(Соединение 13):
пролекарство хинина (F 391).
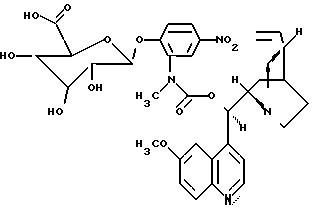
Синтез проводился аналогично описанному в примере 1.
Пример 4
(Соединение 14): пролекарство дипиридамола (F 392)

Синтез выполнялся аналогично описанному в примере 1.
Пример 5
Ферментное расщепление пролекарства F 373.
Пролекарство F 373 (соединение 11) при инкубации ферментно расщепляли с помощью β-глюкуронидазы с получением ароматического производного азотистого иприта (4-[N, N-бис-(2-[хлороэтил)амино]фенол) (соединение 7), глюкуроновой кислоты и спейсера.
F 373
- глюкуроновая кислота +

Пролекарство F 373 при хранении в растворе безводного диметилсульфоксида сохраняет стабильность. Для исследования расщепляемости раствор F 373 10 мкл (5 мг/мл в диметилсульфоксиде) разводили 180 мкл 0.02 М фосфатного буферного раствора с величиной рН 7.2 и 10 мкл E.coli β-глюкуронидаза (Sigma) (330 мкг/мл) и инкубировали при 37oС. 25 мкл исходной смеси разбавляли 225 мкл 0.1 М фосфатного буферного раствора с величиной рН 3.0 (85%) и ацетонитрилом (15%) и сразу же проводили анализ с применением системы высокоэффективной жидкостной хроматографии.
Система высокоэффективной жидкостной
хроматографии
Применявшаяся система высокоэффективной жидкостной хроматографии включала в себя градиентный насос (Gynkotek, модель 480), автоматический пробоотборник (Abimed, модель 231/401),
ультрафиолетовый
детектор (Beckman, модель 166, длина волны детектирования: 212 нм) и анализаторный блок (Beckman, система Gold). Разделения производились на колонке RP (Zorbax SB-C 18, 5 микрон, 125*
4.6 мм).
Подвижную фазу образовывали из двух компонентов по следующей схеме:
А - ацетонитрил
В - 0.02 М фосфатный буферный раствор, рН 3.0
0 мин - 15% А, 85% В
15
мин - 75%
А, 25% В
25 мин - 75 % А, 25% В
27 мин - 15% А, 85% В
35 мин - 15% А, 85% В
Были найдены следующие величины площадей пиков (см. таблицу 1).
Пример 6: Цитотоксичность соединений F 373, 391, 392 по отношению к опухолевым клеткам в присутствии и при отсутствии β-глюкуронидазы.
На пластину для микротитрования с 96 ячейками в среду из 100 мкл минимальной поддерживающей среды +10% сыворотки плода коровы высеивали LoVo-клетки в расчете 2•103 на 1 ячейку. Через сутки тестируемые вещества помещали в 100 мкл среды с необходимой концентрацией и при необходимости добавляли дополнительно β-глюкуронидазу (50 мкг/мл конечной концентрации; Sigma G 7896). Каждая группа состояла из 4 ячеек, контроль осуществлялся только инкубацией в среде. Через 65 часов добавляли 50 мкл 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолий-бромида мг/мл в физиологическом растворе с фосфатным буфером), а через 3 часа удаляли надосадочную жидкость. Краситель, образованный живыми клетками, растворяли добавкой 100 мкл диметилсульфоксида на ячейку. Для каждой ячейки экстинкцию измеряли на универсальном сканирующем фотометре 340 СС (фирмы Flow) при 492 нм. Показатели 4 ячеек каждой группы усредняли и использовали при расчете кривой эффективности дозы и ИК50 с использованием программного обеспечения GraFit 3.0 (см. таблицу 2).
Токсичным соединением в пролекарстве F 373 было соединение 7 (пример 1) и при отдельном тестировании показатель ИК50 составил 5 мкмолей. Токсичным соединением в пролекарстве F 391 был хинин и при отдельном тестировании показатель ИK50 составил 103 мкмоли. Токсичным соединением в пролекарстве F 393 был дипиридамол и при отдельном тестировании показатель ИК50 был равен 43 мкмолям.
Реферат
Изобретение относится к медицине, в частности к фармакологии, и касается пролекарства для терапии опухолей и воспалительных заболеваний формулы I: гликозил-Y-W(R)n-Z-C(=y)-активное начало, и/или физиологически переносимые соли соединения формулы I, где Y, W, n, R и Z имеют значения, указанные в тексте описания. 1 з.п.ф-лы., 2 табл.
Формула
гликозил-Y-W(R)n-Z-C(=Y)-активное начало,
и/или физиологически переносимые соли соединения формулы I, где гликозил - ферментно отщепляемый моносахарид, предпочтительно ферментно отщепляемая глюкуроновая кислота;
W означает фенил;
R означает атом водорода, цианогруппу, нитрогруппу, фтор, хлор или бром;
n означает целое число 0, 1 или 2;
Y означает атом кислорода;
Z означает группы -N(CH3)-, -C(CH3)2-NH-, -CH(CH3)-NH-, -C(CH3)2-N(C1-C4)-алкил или -CH(CH3)-N(C1-C4)-алкил;
активное начало - биологически активное соединение, связанное через радикал кислорода, первичный или вторичный аминорадикал или иминорадикал.
2-[N-метил-N-[(4(N,N -бис-(2-хлороэтил)-амино)-фенилоксикарбонил]-амино] -4-нитрофенил-β-D-глюкуроновая кислота,
2-[N-метил-N-[(4(N, N -бис-(2-йодоэтил)-амино)-фенилоксикарбонил]-амино] -4-нитрофенил-β-D-глюкуроновая кислота

или


Комментарии