Новые ароматические фторгликозидные производные, содержащие эти соединения лекарственные средства, и их применение - RU2340622C2
Код документа: RU2340622C2
Описание
Настоящее изобретение относится к замещенным ароматическим фторгликозидным производным, их физиологически приемлемым солям, а также к физиологически функциональным производным.
Из литературы уже известны некоторые классы веществ с воздействием на SGLT. Все эти структуры служат в качестве образа природного вещества флоризина. От него производятся следующие классы веществ, которые описываются в следующих патентах:
- пропиофенонгликозиды Tanabe (заявка WO-0280936, заявка WO-0280935, патент Японии 2000080041 и Европейский патент 850948);
- 2-(глюкопиранозилокси)бензилбензолы Kissei (заявки WO-0244192, WO-0228872 и WO-0168660);
- глюкопиранозилоксипиразолы Kissei и Ajinomoto (заявки WO-0268440, WO-0268439, WO-0236602 и WO-0116147);
- О-гликозидбензамиды Bristol-Myers Squibb (заявки WO-0174835 и WO-0174834);
- и С-арилгликозиды Bristol-Myers Squibb (заявка WO-0127128 и патент США 2002137903).
Все известные структуры в качестве очень важного структурного элемента содержат глюкозу.
Далее, из патента США 2002/132807 известны диарилсульфидные соединения для лечения воспалительных и иммунных заболеваний. В заявке на ЕР 0953357-А1 описываются вообще гликозидные соединения в качестве почечных носителей лекарственных средств, а в заявке WO-95/23780 описываются
4-гидроксифеноксигетероциклоалкильные соединения в качестве осветлителей кожи.
Задачей изобретения является получение новых соединений, с помощью которых возможна профилактика и лечение диабета типа 1 и диабета типа 2. Согласно изобретению неожиданно обнаружено, что ароматические фторгликозидные производные повышают воздействие на SGLT. Эти соединения поэтому особенно пригодны для профилактики и лечения диабета типа 1 и диабета типа 2.
Изобретение поэтому относится к соединениям формулы (I):

где
R1 и R2 означают ОН, F или H или R1 и R2 означают F, причем исключаются три комбинации: R1 = F, R2 = OH и R1 = OH, R2 = F и R1, R2 = OH;
R3 означает ОН или F, причем по меньшей мере один из остатков R1, R2, R3 должен означать F;
А означает О, NH, CH2, S или связь;
R4, R5, R6 означают атом водорода, F, Cl, Br, J, OH, NO2, CN, COOH, CO-(C1-C6)-алкил, СОО-(С1-С6)-алкил, CONH2, CONH-(C1-C6)-алкил, CON-[(C1-C6)-алкил]2, (С1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, (С1-С6)-алкоксил, НО-(С1-С6)-алкил, (С1-С6)-алкил-О-(С1-С6)-алкил, фенил, бензил, причем в алкильных, алкоксильных, алкенильных и алкинильных остатках один, несколько или все атомы водорода могут быть заменены фтором;
SO2-NH2, SO2NH-(C1-C6)-алкил, SO2N-[(C1-C6)-алкил]2, S-(C1-C6)-алкил, S-(CH2)o-фенил, SO-(C1-C6)-алкил, SO-(CH2)o-фенил, SO2-(C1-C6)-алкил, SO2-(CH2)o-фенил, причем о может означать 0-6 и фенильный остаток может быть замещен вплоть до двукратно с помощью F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-алкила, (С1-С6)-алкила, NH2;
NH2, NH-(C1-C6)-алкил, N-((C1-C6)-алкил)2, NH-(C1-C7)-ацил, фенил, О-(СН2)о-фенил, причем о может означать 0-6 и фенильный цикл может быть замещен от однократно до трехкратно с помощью F, Cl, Br, J, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-алкила, (С1-С6)-алкила, NH2, NH-(C1-C6)-алкила, N-((C1-C6)-алкил)2, SO2-CH3, COOH, COO-(C1-C6)-алкила, CONH2;
В означает (С0-С15)-алкандиил, причем один или несколько атомов углерода алкандиильного остатка, независимо друг от друга, могут быть заменены на -О-, -(С=О)-, -СН=СН-, -С≡С-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N-((C1-C6)-алкил)-, -N-((C1-C6)-алкилфенил)- или -NH-;
n означает число от 0 до 4;
Сyc1 означает 3-7-членный насыщенный, частично насыщенный или ненасыщенный цикл, причем один атом углерода может быть заменен на О, N или S;
R7, R8, R9 означают атом водорода, F, Cl, Br, J, OH, CF3, NO2, CN, COOH, СОО-(С1-С6)-алкил, СО-(С1-С4)-алкил, CONH2, CONH-(C1-C6)-алкил, CON-[(C1-C6)-алкил]2, (С1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, (С1-С8)-алкоксил, (С1-С6)-алкил-ОН, (С1-С6)-алкил-О-(С1-С6)-алкил, причем в алкильных остатках один, несколько или все атомы водорода могут быть заменены фтором;
SO2-NH2, SO2NH-(C1-C6)-алкил, SO2N-[(C1-C6)-алкил]2, S-(C1-C6)-алкил, S-(CH2)o-фенил, SO-(C1-C6)-алкил, SO-(CH2)o-фенил, SO2-(C1-C6)-алкил, SO2-(CH2)o-фенил, причем о может означать 0-6 и фенильный остаток может быть замещен вплоть до двукратно с помощью F, Cl, Br, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-алкила, (С1-С6)-алкила, NH2;
NH2, NH-(C1-C6)-алкил, N-((C1-C6)-алкил)2, NH-(C1-C7)-ацил, фенил, О-(СН2)о-фенил, причем о может означать 0-6 и фенильный цикл может быть замещен от однократно до трехкратно с помощью F, Cl, Br, J, OH, CF3, NO2, CN, OCF3, (С1-С8)-алкоксила, (С1-С6)-алкила, NH2, NH-(C1-C6)-алкила, N-((C1-C6)-алкил)2, SO2-CH3, COOH, COO-(C1-C6)-алкила, CONH2;
или
R8 и R9 вместе с соединенными с ними атомами углерода образуют 5-7-членный насыщенный, частично или полностью ненасыщенный цикл Cyc2, причем 1 или 2 атома углерода цикла также могут быть заменены на N, O или S, и Сус2, в случае необходимости, может быть замещен с помощью (С1-С6)-алкила, (С2-С5)-алкенила, (С2-С5)-алкинила, причем, смотря по обстоятельствам, одна группа СН2 может быть заменена на О, или замещена с помощью Н, F, Cl, OH, CF3, NO2, CN, COO-(C1-C4)-алкила, CONH2, CONH-(C1-C4)-алкила, OCF3;
а также к их фармацевтически приемлемым солям.
Места связывания R4, R5, R6 и В в фенильном цикле выбираются независимо. Все получаемые соединения формулы (I) относятся к настоящему изобретению. Предпочтительны соединения формулы (I), в которых заместитель В у фенильного цикла находится в орто-положении (соседнее положение) к заместителю А.
Предпочтительны соединения формулы (I), где
R1, R2 означают ОН, F или Н или R1 и R2 означают F, причем один из остатков R1 или R2 должен означать F и при этом исключаются три комбинации: R1 = F, R2 = OH и R1 = OH, R2 = F и R1, R2 = OH;
R3 означает ОН;
А означает О или NH;
R4, R5, R6 означают атом водорода, F, Cl, Br, J, OH, CF3, NO2, CN, COOH, CO-(C1-C6)-алкил, СОО-(С1-С6)-алкил, CONH2, CONH-(C1-C6)-алкил, CON-[(C1-C6)-алкил]2, (С1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, (С1-С6)-алкоксил, НО-(С1-С6)-алкил, (С1-С6)-алкил-О-(С1-С6)-алкил, фенил, бензил, SO-(C1-C6)-алкил, причем в алкильных, алкоксильных, алкенильных и алкинильных остатках один, несколько или все атомы водорода могут быть заменены фтором;
В означает (С0-С15)-алкандиил, причем один или несколько атомов углерода алкандиильного остатка, независимо друг от друга, могут быть заменены на -О-, -(С=О)-, -СН=СН-, -С≡С-, -S-, -CH(OH)-, -CHF-, -CF2-, -(S=O)-, -(SO2)-, -N-((C1-C6)-алкил)-, -N-((C1-C6)-алкилфенил)- или -NH-;
n означает число от 0 до 4;
Сyc1 означает 3-7-членный насыщенный, частично насыщенный или ненасыщенный цикл, причем один атом углерода может быть заменен на О, N или S;
R7, R8, R9 означают атом водорода, F, Cl, Br, J, OH, CF3, NO2, CN, COOH, СОО-(С1-С6)-алкил, СО-(С1-С4)-алкил, CONH2, CONH-(C1-C6)-алкил, CON-[(C1-C6)-алкил]2, (С1-С6)-алкил, (С2-С6)-алкенил, (С2-С6)-алкинил, (С1-С8)-алкоксил, (С1-С6)-алкил-OH, (С1-С6)-алкил-О-(С1-С6)-алкил, SO-(С1-С6)-алкил, причем в алкильных остатках один, несколько или все атомы водорода могут быть заменены фтором;
или
R8 и R9 вместе с соединенными с ними атомами углерода образуют 5-7-членный насыщенный, частично или полностью ненасыщенный цикл Cyc2, причем 1 или 2 атома углерода цикла также могут быть заменены на N, O или S, и Сус2, в случае необходимости, может быть замещен с помощью (С1-С6)-алкила, (С2-С5)-алкенила, (С2-С5)-алкинила, причем, смотря по обстоятельствам, одна группа СН2 может быть заменена на О, или замещена с помощью Н, F, Cl, OH, CF3, NO2, CN, COO-(C1-C4)-алкила, CONH2, CONH-(C1-C4)-алкила, OCF3.
Далее, предпочтительны соединения формулы (I), в которых сахаридные остатки являются бета(β)-связанными и стереохимия в положении 2, 3 и 5 сахаридного остатка соответствует конфигурации D-глюкозы.
Особенно предпочтительны соединения формулы (I), где
R1, R2 означают ОН, F или H или R1 или R2 означают F, причем один из остатков R1 или R2 должен означать F и при этом исключаются три комбинации: R1 = F, R2 = OH и R1 = OH, R2 = F и R1, R2 = OH;
R3 означает ОН;
А означает О;
R4, R5, R6 означают атом водорода, ОН, (C1-C6)-алкил, (С1-С4)-алкоксил, НО-(С1-С4)-алкил, (С1-С4)-алкил-О-(С1-С4)-алкил, F, Cl, Br, J, CF3, OCF3, OCH2CF3, (C1-C4)-алкил-CF2-, фенил, бензил, (С2-С4)-алкенил, (С2-С4)-алкинил, СОО-(С1-С4)-алкил;
В означает (С1-С4)-алкандиил, причем одна группа СН2 также может быть заменена на -(С=О)-, -CH(OH)-, -CO-NH-, -СО-N-(C1-C6)-алкил-, -CHF-, -CF2-, -O-, -NH-;
n означает число 2 или 3;
Сyc1 означает ненасыщенный 5- или 6-членный цикл, причем один атом углерода может быть заменен на О, N или S;
R7, R8, R9 означают атом водорода, (С1-С6)-алкил, (С1-С8)-алкоксил, OCF3, OCH2CF3, OH, HO-(C1-C4)-алкил, (С1-С4)-алкил-О-(С1-С4)-алкил, F, Cl, Br; или
R8 и R9 вместе означают -СН=СН-О-, -СН2-СН2-О-, -СН=СН-S-, -СН=СН-СН=СН-, -О-, (СН2)р-О-, где р означает 1 или 2; и
R7 означает метил, этил, метоксигруппу, F, Cl, Br или атом водорода.
В высшей степени предпочтительны соединения формулы (I), где
R1 означает F и R2 означает Н; или
R1 означает Н и R2 означает F; или
R1 означает F и R2 означает F;
R3 означает ОН;
А означает О;
R4, R5, R6 означают атом водорода, ОН, (С1-С4)-алкоксил, CF3, (C1-C4)-алкил, F, Cl, Br, J;
В означает -СН2-, -С2Н4-, -С3Н6-, -СН(ОН)-, -(С=О)-, -СО-NH-СН2- или -СО-СН2-СН2-, -О-, -NH-;
n означает число 2 или 3;
Сyc1 означает ненасыщенный 6-членный цикл, причем один атом углерода может быть заменен на N, или ненасыщенный 5-членный цикл, причем один атом углерода может быть заменен на S;
R7, R8, R9 означают атом водорода, (С1-С4)-алкил, (С1-С7)-алкоксил, OCF3, галоген; или
R8 и R9 вместе означают -СН=СН-О-, -СН2-СН2-О-, -СН=СН-СН=СН-, -О-(СН2)р-О-, где р означает 1 или 2; и
R7 означает метил, этил, метоксигруппу, F, Cl, Br, атом водорода.
Далее, в высшей степени предпочтительны соединения формулы (Ia):

где
R1 означает F и R2 означает Н; или
R1 означает Н и R2 означает F; или
R1 означает F и R2 означает F;
R3 означает ОН;
А означает О;
R4 означает атом водорода, (С1-С4)-алкил, (С1-С4)-алкоксил или ОН;
R5 означает атом водорода, F, метоксигруппу или этоксигруппу;
R6 означает атом водорода или ОН;
В означает -СН2-, -СО-NH-CH2-, -О- или -СО-СН2-СН2-;
Сyc1 означает фенил или тиофен;
R7, R8, R9 означают атом водорода, ОН, Cl, OCF3, (С1-С4)-алкил или (С1-С4)-алкоксил; или
R8 и R9 вместе означают -СН=СН-О-, -СН=СН-СН=СН- или -СН2-СН2-О-; и
R7 означает атом водорода.
Особенно предпочтительны соединения формулы (Ib):

где
R1 означает F и R2 означает Н; или
R1 означает Н и R2 означает F; или
R1 означает F и R2 означает F;
R3 означает ОН;
А означает О;
R4 означает атом водорода, метил, метоксигруппу или ОН;
R5 означает атом водорода, F или метоксигруппу;
R6 означает атом водорода или ОН;
В означает -СН2-, -СО-NH-CH2-, -О- или -СО-СН2-СН2-;
Сyc1 означает фенил;
R7 означает атом водорода;
R8 означает атом водорода, ОН, этил, Cl, OCF3 или метоксигруппу; или
R9 означает атом водорода; или
R8 и R9 вместе означают -СН=СН-О- или -СН2-СН2-О-.
Кроме того, в высшей степени предпочтительны такие соединения формулы (I), в которых R1 = H и R2 = F.
Изобретение относится к соединениям формулы (I) в форме их рацематов, рацемических смесей и чистых энантиомеров, а также к их диастереомерам и их смесям.
Алкильные остатки в заместителях R4, R5, R6, R7, R8 и R9 могут быть как линейными, так и также разветвленными. Под галогеном понимают F, Cl, Br, J, предпочтительно F и Cl.
Фармацевтически приемлемые соли из-за своей более высокой растворимости в воде, по сравнению с исходными, соответственно, основными соединениями, особенно пригодны для применений в медицине. Эти соли должны иметь фармацевтически приемлемый анион или катион. Пригодными фармацевтически приемлемыми аддитивными солями кислот предлагаемых согласно изобретению соединений являются соли неорганических кислот, как соляная кислота, бромоводородная кислота, фосфорная кислота, метафосфорная кислота, азотная кислота и серная кислота, а также органических кислот, как, например, уксусная кислота, бензолсульфокислота, бензойная кислота, лимонная кислота, этансульфокислота, фумаровая кислота, глюконовая кислота, гликолевая кислота, изетионовая кислота, молочная кислота, лактобионовая кислота, малеиновая кислота, яблочная кислота, метансульфокислота, янтарная кислота, п-толуолсульфокислота и винная кислота. Пригодными фармацевтически приемлемыми основными солями являются соли аммония, соли щелочных металлов (как натриевые и калиевые соли), соли щелочно-земельных металлов (как магниевые и кальциевые соли), соли трометамола (2-амино-2-гидроксиметил-1,3-пропандиол), диэтаноламина, лизина или этилендиамина.
Соли с фармацевтически неприемлемым анионом, как, например, трифторацетатный анион, также входят в рамки изобретения в качестве полезных промежуточных продуктов для получения или очистки фармацевтически приемлемых солей и/или для использования в случае нетерапевтических, например, in vitro, применений.
Используемое в данном контексте понятие "физилогически функциональное производное" означает любое физиологически приемлемое производное предлагаемого согласно изобретению соединения формулы (I), например, сложный эфир, которое при введении млекопитающему, как, например, человеку, способно (прямо или непрямо) образовывать соединение формулы (I) или его активный метаболит.
К физиологически функциональным производным относятся также пролекарственные формы предлагаемых согласно изобретению соединений, как, например, описывается H. Okada и др., Chem. Pharm. Bull., 42, 57-61 (1994). Такие пролекарства могут метаболизироваться in vivo до предлагаемого согласно изобретению соединения. Эти пролекарства сами могут быть активными или нет. Предпочтительны карбонаты в положении 6 сахаридного остатка (см. заявки WO-0280936 и WO-0244192), особенно предпочтительны метилкарбонат и этилкарбонат.
Предлагаемые согласно изобретению соединения могут находиться также в различных полиморфных формах, например, в виде аморфных и кристаллических полиморфных форм. Все полиморфные формы предлагаемых согласно изобретению соединений входят в рамки изобретения и составляют дальнейший аспект изобретения.
В нижеследующем контексте все указания на "соединение (соединения) формулы (I)" относятся к соединению (соединениям) формулы (I), как описываемое (описываемые) выше, а также к их солям, сольватам и физиологически функциональным производным, как описываемые в данном контексте.
Соединение (соединения) формулы (I) можно вводить также в комбинации с другими биологически активными веществами.
Количество соединения формулы (I), которое является необходимым для достижения желательного биологического эффекта, зависит от ряда факторов, например, от выбранного конкретного соединения, предусматриваемого применения, типа введения и клинического состояния пациента. В общем, суточная доза находится в пределах от 0,3 мг до 100 мг (более типично от 3 мг до 50 мг) в сутки на килограмм массы тела, например, 3-10 мг/кг/сутки. Внутривенная доза может составлять величину, например, в пределах от 0,3 мг до 1,0 мг/кг, которую более пригодным образом можно вводить в виде инфузии от 10 нг до 100 нг на килограмм в минуту. Пригодные инфузионные растворы для этой цели могут содержать, например, от 0,1 нг до 10 мг, более типично от 1 нг до 10 мг на миллилитр. Разовые дозы могут содержать, например, от 1 мг до 10 г биологически активного вщества. Таким образом, ампулы для инъекций могут содержать, например, от 1 мг до 100 мг, и перорально вводимые лекарственные формы в виде разовой дозы, как, например, таблетки или капсулы, могут содержать, например, от 1,0 мг до 1000 мг, более типично от 10 мг до 600 мг, биологически активного вещества. Для терапии вышеуказанных состояний соединения формулы (I) можно использовать даже в виде соединения, однако предпочтительно они находятся вместе с приемлемым носителем в виде фармацевтической композиции. Носитель, естественно, должен быть приемлемым в том смысле, что он является совместимым с другими компонентами композиции и не наносящим вред здоровью пациента. Носителем может быть твердое вещество или жидкость или то и другое и, предпочтительно, его можно использовать вместе с соединением для получения композиции в виде разовой дозы, например, в виде таблетки, которая может содержать от 0,05 мас.% до 95 мас.% биологически активного вещества. Также могут присутствовать другие фармацевтически активные вещества, включая другие соединения формулы (I). Предлагаемые согласно изобретению фармацевтические композиции можно получать согласно одному из известных фармацевтических способов, которые по существу состоят в том, что компоненты смешивают с фармакологически приемлемыми носителями и/или вспомогательными веществами.
Предлагаемые согласно изобретению фармацевтические композиции представляют собой такие, которые пригодны для орального, ректального, локального, перорального (например, подъязычного) и парентерального (например, подкожного, внутримышечного, интрадермального или внутривенного) введения, хотя самый пригодный способ введения в каждом отдельном случае зависит от рода и тяжести подвергаемого лечению состояния и от рода используемого в каждом случае соединения формулы (I). В рамки изобретения также входят дражированные лекарственные формы и дражированные лекарственные формы пролонгированного действия. Предпочтительны резистентные к кислоте и желудочному соку лекарственные формы. Пригодные, резистентные к желудочному соку покрытия включают ацетатфталат целлюлозы, поливинилацетатфталат, гидроксипропилметилцеллюлозофталат и анионные полимеры метакриловой кислоты и метилового эфира метакриловой кислоты.
Пригодные фармацевтические соединения для орального введения могут находиться в виде отдельных единиц, как, например, капсулы, оболочки облаток, таблетки для сосания или таблетки, которые содержат, соответственно, определенное количество соединения формулы (I); в виде порошков и гранулятов; в виде раствора или суспензии в водной или неводной жидкости; или в виде эмульсии масло-в-воде или вода-в-масле. Эти композиции, как уже упоминалось, можно получать любым пригодным фармацевтическим способом, который включает стадию, на которой биологически активное вещество и носитель (который может состоять из одного или нескольких дополнительных компонентов) вводят в контакт. В общем, композиции приготовляют путем равномерного и гомогенного смешения биологически активного вещества с жидким и/или тонкоизмельченным твердым носителем, после чего продукт, если необходимо, подвергают формованию. Так, например, таблетку можно получать тем, что порошок или гранулят соединения прессуют или формуют, в случае необходимости, вместе с одним или несколькими дополнительными компонентами. Прессованные таблетки можно получать путем таблетирования в пригодном устройстве соединения в свободно текучей форме, как, например, в форме порошка или гранулята, в случае необходимости смешанного со связующим, придающим скользкость таблеткам веществом, инертным разбавителем и/или одним (несколькими) поверхностно-активным веществом/диспергатором. Формованные таблетки можно получать путем формования в пригодном устройстве порошкообразного соединения, увлажненного с помощью инертного жидкого разбавителя.
Фармацевтические композиции, которые пригодны для перорального (подъязычного) введения, включают таблетки для сосания, содержащие соединение формулы (I) вместе с вкусовым веществом, обычно сахарозой и гуммиарабиком или трагантом, и пастилки, которые включают соединение в инертной основе, как желатин и глицерин или сахароза и гуммиарабик.
Пригодные фармацевтические композиции для парентерального введения предпочтительно включают стерильные водные композиции на основе соединения формулы (I), которые предпочтительно изотоничны с кровью предусматриваемого реципиента. Эти композиции предпочтительно вводят внутривенно, хотя также можно осуществлять введение подкожно, внутримышечно или интрадермально, в виде инъекции. Эти композиции предпочтительно получают тем, что соединение смешивают с водой и полученный раствор стерилизуют и придают изотоничность с кровью. Вводимые путем инъекции композиции согласно изобретению содержат, в общем, от 0,1 мас.% до 5 мас.% активного соединения.
Пригодные фармацевтические композиции для ректального введения находятся предпочтительно в виде содержащих одноразовую дозу лекарственного средства суппозиториев. Их получают тем, что соединение формулы (I) смешивают с одним или несколькими обычными твердыми носителями, как, например, масло какао, и образовавшуюся смесь подвергают формованию.
Пригодные фармацевтические композиции для локального применения на коже находятся предпочтительно в виде мази, крема, лосьона, пасты, спрея, аэрозоля или масла. В качестве носителей можно использовать вазелины, ланолин, полиэтиленгликоли, спирты и комбинации двух или нескольких из этих веществ. Биологически активное вещество находится, в общем, в концентрации от 0,1 мас.% до 15 мас.%, например, от 0,5 мас.% до 2 мас.%, по отношению к композиции.
Также возможно чрескожное введение. Пригодные фармацевтические композиции для чрескожных применений могут находиться в виде отдельных пластырей, которые пригодны для долговременного тесного контакта с эпидермисом пациента. Такие пластыри содержат биологически активное вещество, в случае необходимости, в забуференном водном растворе, растворенным и/или диспергированным в адгезиве или диспергированным в полимере. Пригодная концентрация биологически активного вещества составляет от примерно 1% до 35%, предпочтительно, от примерно 3% до 15%. В качестве особой возможности биологически активное вещество, как описывается, например, в Pharmaceutical Research, 2 (6), 318 (1986), может высвобождаться путем электротранспорта или ионофореза.
Объектом изобретения, далее, являются способы получения соединений общей формулы (I), которые можно получать соответственно следующим реакционным схемам способов А-F:
Способ А:

Способ В:

Способ С:

Способ D:

Способ Е:

Способ F:

где: Ас - ацетил; Bn - бензил; Bz - бензоил; Ме - метил; BAST - [бис(2-метоксиэтил)амино]трифторид серы; TMSCl - триметилсилилхлорид; DEAD - диэтилазодикарбоксилат; PPh3 - трифенилфосфин; DMS - диметилсульфид.
Представленные схемы способов А-F являются наглядными и, таким образом, выполнимы специалистом. Подробности в деталях, однако, указываются в экспериментальной части. Согласно способам А-F получают соединения примеров 1-24. Другие соединения формулы (I) можно получать соответствующим образом или известными способами.
Соединение (соединения) формулы (I) также можно вводить в комбинации с другими биологически активными веществами.
В качестве других биологически активных веществ для комбинированных препаратов пригодны следующие:
Все антидиабетические средства, которые указаны в Красном Списке 2001, глава 12. Их можно комбинировать с предлагаемыми согласно изобретению соединениями формулы (I), в особенности для синергического повышения действия. Введение комбинации биологически активных веществ можно осуществлять либо путем раздельного введения биологически активных веществ пациенту, либо в форме комбинированных препаратов, где несколько биологически активных веществ находятся в одной фармацевтической композиции. Большинство из нижеуказанных биологически активных веществ указано в фармакопее США, справочнике USAN и международном реестре названий лекарственных средств, US Pharmacopeia, Rockville, 2001.
Антидиабетические средства включают инсулин и производные инсулина, как, например, Lantus® (см. www.lantus.com) или HMR 1964, быстродействующие инсулины (см. патент США 6221633), производные GLP-1, как, например, такие, которые указаны в заявке WO-98/08871 фирмы Novo Nordisk A/S, а также орально эффективные гипогликемические биологически активные вещества.
Орально эффективные гипогликемические биологически активные вещества предпочтительно включают сульфонилмочевины, бигуанидины, меглитиниды, оксадиазолидиндионы, тиазолидиндионы, ингибиторы глюкозидазы, антагонисты глюкагона, агонисты GLP-1, открыватели калиевых каналов, как, например, таковые, указанные в заявках WO-97/26265 и WO-99/03861 фирмы Novo Nordisk A/S, инсулиновые сенсибилизаторы, ингибиторы ферментов печени, которые принимают участие в стимуляции глюконеогенеза и/или гликогенолиза, модуляторы поглощения глюкозы, изменяющие жировой обмен соединения, как антигиперлипидемические биологически активные вещества и антилипидемические биологически активные вещества, соединения, которые уменьшают потребление продуктов питания, агонисты PPAR и PXR и биологически активные вещества, которые оказывают воздействие на АТФ-зависимый калиевый канал бета-клеток.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором HMGCoA-редуктазы, как симвастатин, флувастатин, правастатин, ловастатин, аторвастатин, церивастатин, розувастатин.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором резорбции холестерина, как, например, эзетимиб, тиквесид, памаквесид.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с агонистом PPAR-гамма, как, например, росиглитазон, пиоглитазон, JTT-501, GI 262570.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с агонистом PPAR-альфа, как, например, GW 9578, GW 7647.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации со смешанным агонистом PPAR-альфа/гамма, как, например, GW 1536, AVE 8042, AVE 8134, AVE 0847, AVE 0897 или как описанные в заявках WO-00/64888, WO-00/64876, WO-03/20269.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с фибратом, как, например, фенофибрат, клофибрат, безафибрат.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором МТР, как, например, имплитапид, BMS-201038, R-103757.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором резорбции желчной кислоты (см., например, патенты США 6245744 или 6221897), как, например, HMR 1741.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором СЕТР, как, например, JTT-705.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с полимерным адсорбентом желчной кислоты, как, например, холестирамин, колесевелам.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с индуцирующим рецептор LDL средством (см. патент США 6342512), как, например, HMR 1171, HMR 1586.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором АСАТ, как, например, авасимиб.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с антиоксидантом, как, например, ОРС-14117.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором липопротеин-липазы, как, например, NO-1886.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором АТФ-цитрат-лиазы, как, например, SB-204990.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором сквален-синтетазы, как, например, BMS-188494.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с антагонистом липопротеина(ов), как, например, CI-1027 или никотиновая кислота.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором липазы, как, например, орлистат.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с инсулином.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с сульфонилмочевиной, как, например, толбутамид, глибенкламид, глипизид или глимепирид.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с бигуанидом, как, например, метформин.
Согласно снова варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с меглитинидом, как, например, репаглинид.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с тиазолидиндионом, как, например, троглитазон, циглитазон, пиоглитазон, росиглитазон или указанные в заявке WO-97/41097, Dr. Reddy's Research Foundation, соединения, в особенности 5-[[4-[(3,4-дигидро-3-метил-4-оксо-2-хиназолинил)метокси]фенил]метил]-2,4-тиазолидиндион.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с ингибитором α-глюкозидазы, как, например, миглитол или акарбоза.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с биологически активным веществом, которое воздействует на АТФ-зависимый калиевый канал бета-клеток, как, например, толбутамид, глибенкламид, глипизид, глимепирид или репаглинид.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с более чем одним из вышеуказанных соединений, например, в комбинации с сульфонилмочевиной и метформином, сульфонилмочевиной и акарбозой, репаглинидом и метформином, инсулином и сульфонилмочевиной, инсулином и метформином, инсулином и троглитазоном, инсулином и ловастатином, и т.д.
Согласно дальнейшему варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с модуляторами CART (см. "Cocaine-amphetamine-regulated transcript influences energy metabolism, anxiety and gastric emptying in mice", Asakawa A. и др., М.: Hormone and Metabolic Research, 33 (9), 554-558 (2001)); антагонистами NPY (например, {4-[(4-аминохиназолин-2-иламино)метил]циклогексилметил}амид нафталин-1-сульфокислоты; гидрохлорид (CGP 71683A)); агонистами МС4 (например, [2-(3a-бензил-2-метил-3-оксо-2,3,3а,4,6,7-гексагидропиразол[4,3-c]пиридин-5-ил)-1-(4-хлорфенил)-2-оксоэтил]-амид амино-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (WO-01/91752)); антагонистами орексина (например, 1-(2-метилбензоксазол-6-ил)-3-[1,5]нафтиридин-4-илмочевина; гидрохлорид (SB-334867-A)); агонистами Н3 (соль щавелевой кислоты 3-циклогексил-1-(4,4-диметил-1,4,6,7-тетрагидроимидазо[4,5-c]-пиридин-5-ил)пропан-1-она (WO-00/63208)); агонистами TNF; антагонистами CRF (например, [2-метил-9-(2,4,6-триметилфенил)-9Н-1,3,9-триазафлуорен-4-ил]дипропиламин (WO-00/66585)); антагонистами CRF BP (например, урокортин); агонистами урокортина; β3-агонистами (например, 1-(4-хлор-3-метансульфонилметилфенил)-2-[2-(2,3-диметил-1Н-индол-6-илокси)этиламино]этанол; гидрохлорид (WO-01/83451)); агонистами MSH (меланоцитстимулирующий гормон); агонистами ССК-А (например, соль трифторуксусной кислоты {2-[4-(4-хлор-2,5-диметоксифенил)-5-(2-циклогексилэтил)тиазол-2-илкарбамоил]-5,7-диметилиндол-1-ил}уксусной кислоты (WO-99/15525)); ингибиторами повторного поглощения серотонина (например, дексфенфлурамины); смешанными серотонин- и норадренергенными соединениями (например, WO-00/71549); агонистами 5НТ, как, например, соль щавелевой кислоты 1-(3-этилбензофуран-7-ил)пиперазина (WO-01/09111); агонистами бомбезина; антагонистами галанина; гормонами роста (например, человеческий гормон роста); высвобождающими гормон роста соединениями (трет-бутиловый эфир 6-бензилокси-1-(2-диизопропиламиноэтилкарбамоил)-3,4-дигидро-1Н-изохинолин-2-карбоновой кислоты (WO-01/85695)); агонистами TRH (см., например, Европейский патент 0462884); 2- и 3-модуляторами разрыва протеиновой связи; агонистами лептина (см., например, Lee, Daniel W; Leinung, Matthew C.; Rozhavskaya-Arena, Marina; Grasso, Patricia; "Leptin agonists as a potential approach to the treanment of obesity", Drugs of the Future, 26 (9), 873-881 (2001)); агонистами DA (бромкриптин, допрексин); ингибиторами липазы/амилазы (например, WO-00/40569); модуляторами PPAR (например, WO-00/78312); модуляторами RXR или агонистами TR-β.
Согласно варианту осуществления изобретения, другим биологически активным веществом является лептин; см., например, "Perspectives in the therapeutic use of leptin", Salvador Javier; Gomez-Ambrosi Javier; Fruhbeck Gema; Expert Opinion on Pharmacotherapy, 2 (10), 1615-1622 (2001).
Согласно варианту осуществления изобретения, другим биологически активным веществом является дексамфатамин или амфетамин.
Согласно варианту осуществления изобретения, другим биологически активным веществом является фенфлурамин или дексфенфлурамин.
Согласно варианту осуществления изобретения, другим биологически активным веществом является сибутрамин.
Согласно варианту осуществления изобретения, другим биологически активным веществом является орлистат.
Согласно варианту осуществления изобретения, другим биологически активным веществом является мазиндол или фентермин.
Согласно варианту осуществления изобретения, соединения формулы (I) вводят в комбинации с балластными веществами, предпочтительно, с нерастворимыми балластными веществами (см., например, Carob/Caromax® (Zunft H.J. и др. "Carob pulp preparation for treatment of hypercholesterolemia", ADVANCES IN THERAPY, 18 (5), 230-236 (2001, сентябрь-октябрь)). Каромакс представляет собой содержащий кароб продукт фирмы Nutrinova, Nutrition Specialties and Food Ingredients GmbH, Industriepark Höchst, 65926, Франкфурт-на-Майне)). Комбинацию с Caromax® можно осуществлять в виде композиции или путем раздельного введения соединений формулы (I) и Caromax®. Caromax® при этом можно вводить также в форме пищевых продуктов, как, например, в хлебобулочных изделиях или батончиках мюсли.
Разумеется, что каждая пригодная комбинация предлагаемых согласно изобретению соединений с одним или несколькими из вышеуказанных соединений и, на выбор, с одним или несколькими другими фармакологически активными веществами рассматривается как подпадающая под объем охраны настоящего изобретения.

Нижеприводимые примеры служат для пояснения изобретения, однако, не ограничивая его объема охраны.


*: Под указанием "МС означает ok" понимают, что снят масс-спектр или осуществлена высокоэффективная жидкостная хроматография (ВЭЖХ) с масс-спектрометрией и при этом обнаружен молекулярный пик М+1 (МН+) и/или М+18 (MNH4+) и/или М+23 (MNa+).
Соединения формулы (I) отличаются благоприятными воздействиями на обмен глюкозы, они в особенности снижают уровень сахара в крови и пригодны для лечения диабета типа 1 и диабета типа 2. Соединения поэтому можно использовать индивидуально или в комбинации с другими снижающими уровень сахара в крови биологически активными веществами (антидиабетические средства).
Соединения формулы (I) пригодны, далее, для предупреждения и лечения диабетических поздних повреждений, как, например, нефропатия, ретинопатия, невропатия, а также синдрома Х, ожирения, сердечного инфаркта, инфаркта миокарда, периферических артериальных облитерирующих заболеваний, тромбозов, артериосклероза, воспалений, иммунных заболеваний, аутоиммунных заболеваний, как, например, СПИД, астма, остеопороз, рак, псориаз, болезнь Альцгеймера, шизофрения, и инфекционных заболеваний, предпочтительно, для лечения диабета типа 1 и диабета типа 2, а также для предотвращения и лечения диабетических поздних повреждений, синдрома Х и ожирения.
Эффективность соединений тестировали следующим образом:
Получение везикул мембран щеточной каймы из тонкой кишки кролика, крысы и свиньи
Получение везикул мембран щеточной каймы из кишечных клеток тонкой кишки осуществляли путем так называемого метода преципитации с помощью Mg2+. Слизистую оболочку тонкой кишки соскабливали и суспендировали в 60 мл охлажденного льдом Трис/HCl-буфера (рН=7,1)/300 мМ маннита, 5 мМ EGTA. После разведения до 300 мл с помощью охлажденной льдом дистиллированной воды гомогенизировали, при охлаждении льдом, с помощью турборастворителя (18-Stab, IKA Werk Staufen, ФРГ) 2×1 минута при максимальной мощности 75%. После добавки 3 мл 1 М раствора MgCl2 (конечная концентрация 10 мМ) выдерживали в течение точно 15 минут при температуре 0°С. Путем добавки Mg2+ клеточные мембраны агрегируются и осаждаются, за исключением мембран щеточной каймы. После центрифугирования в течение 15 минут с ускорением 3000×g (5000 оборотов в минуту, ротор SS-34) осадок отбрасывают и супернатант, который содержит мембраны щеточной каймы, центрифугируют в течение 30 минут с ускорением 26700×g (15000 оборотов в минуту, ротор SS-34). Супернатант отбрасывают, осадок снова гомогенизируют в 60 мл 12 мМ Трис/HCl-буфера (рН 7,1)/60 мМ маннита, 5 мМ EGTA, с помощью гомогенизатора Potter Elvejhem (Braun, Melsungen, 900 оборотов в минуту, 10 ходов). После добавки 0,1 мл 1 М раствора MgCl2 и инкубации в течение 15 минут при температуре 0°С снова центрифугируют в течение 15 минут с ускорением 3000×g. Супернатант затем еще раз центрифугируют в течение 30 минут с ускорением 46000×g (20000 оборотов в минуту, ротор SS-34). Осадок обрабатывают с помощью 30 мл 20 мМ Трис/Hepes-буфера (рН 7,4)/280 мМ маннита и ресуспендируют путем 20 ходов в гомогенизаторе Potter Elveihem со скоростью 1000 оборотов в минуту. После центрифугирования в течение 30 минут с ускорением 48000×g (20000 оборотов в минуту, ротор SS-34) осадок обрабатывали с помощью 0,5-2 мл Трис/Hepes-буфера (рН 7,4)/280 мМ маннита (конечная концентрация 20 мг/мл) и ресуспендировали с помощью туберкулинового шприца с иглой калибра 27.
Везикулы использовали либо непосредственно после приготовления для исследований маркировки или транспортировки, либо хранили при температуре -196°С порциями по 4 мг в жидком азоте.
Для получения везикул мембран щеточной каймы из тонкой кишки крыс, от 6 до 10 самцов крыс линии Wistar (разведение животных на основе использования ящиков (Tierzucht Kastengrund); Aventis Pharma) умерщвляли путем цервикальной дислокации, извлекали тонкие кишки и промывали холодным изотоническим раствором хлорида натрия. Кишки разрезали и соскабливали слизистую оболочку. Обработку для выделения мембран щеточной каймы осуществляли, как описано выше. Для отделения от частей цитоскелета везикулы мембран щеточной каймы из тонкой кишки крыс обрабатывали с помощью KSCN в качестве хаотропного иона.
Для получения мембран щеточной каймы из тонкой кишки кролика кроликов умерщляли путем внутривенной инъекции 0,5 мл водного раствора 2,5 мг тетракаин-HCl, 100 мг м-бутрамида и 25 мг мебезонийиодида. Тонкие кишки извлекали, промывали охлажденным льдом физиологическим раствором хлорида натрия, замораживали в пластиковом пакете в атмосфере азота при температуре -80°С и хранили в течение 4-12 недель. Для получения мембранных везикул замороженные кишки оттаивали при температуре 30°С на водяной бане и затем соскабливали слизистую оболочку. Обработку мембранных везикул осуществляли, как описано выше.
Для получения везикул мембран щеточной каймы из свиной кишки сегменты тощей кишки свежезарезанной свиньи промывали охлажденным льдом физиологическим раствором хлорида натрия и замораживали в пластиковых пакетах в атмосфере азота при температуре -80°С. Получение мембранных везикул осуществляли, как описано выше.
Получение везикул мембран щеточной каймы из кортекса почки крыс
Получение везикул мембран щеточной каймы из кортекса почки крыс осуществляли по методу Biber и др. Почки 6-8 крыс (200-250 г) извлекали и с каждой почки снимали кортекс в виде слоя толщиной примерно 1 мм. Почки обрабатывали с помощью 30 мл охлажденного льдом 12 мМ Трис/HCl-буфера (рН 7,4)/300 мМ маннита, и при охлаждении льдом гомогенизировали 4×30 секунд с помощью турборастворителя (позиция: 180 Вольт). После добавки 42 мл охлажденной льдом дистиллированной воды добавляли 850 мкл 1 М раствора MgCl2. После инкубации в течение 15 минут при температуре 0°С центрифугировали в течение 15 минут со скоростью 4500 оборотов в минуту (ротор Sorvall SS-34). Осадок отбрасывали, супернатант центрифугировали в течение 30 минут со скоростью 16000 оборотов в минуту. После ресуспендирования осадка в 60 мл 6 мМ Трис/HCl-буфера (рН 7,4)/150 мМ маннита/2,5 мМ EGTA, путем 10 ходов в гомогенизаторе Potter-Elvejhem (900 оборотов в минуту) и после добавки 720 мкл 1 мМ раствора MgCl2 инкубировали в течение 15 минут при температуре 0°С. После центрифугирования в течение 15 минут при 4×500 оборотов в минуту (ротор SS-34) полученный супернатант центрифугировали в течение 30 минут со скоростью 16000 оборотов в минуту. Супернатант гомогенизировали путем 10 ходов в 60 мл 20 мМ Трис/Hepes-буфера (рН 7,4)/280 мМ маннита и образовавшуюся суспензию затем центрифугировали в течение 30 минут со скоростью 20000 оборотов в минуту. Осадок с помощью туберкулинового шприца с иглой калибра 27 ресуспендировали в 20 мМ Трис/HCl-буфере (рН 7,4)/280 мМ маннита и устанавливали концентрацию протеина 20 мг/мл.
Определение поглощения глюкозы везикулами мембран щеточной каймы
Поглощение [14C]-меченой глюкозы везикулами мембран щеточной каймы определяли по методу мембранной фильтрации. 10 мкл суспензии мембранных везикул щеточной каймы в 10 мМ Трис/Hepes-буфера (рН 7,4)/300 мМ маннита при температуре 30°С добавляли к 90 мкл раствора 10 мкМ [14C]-D-глюкозы и соответствующих концентраций соответствующих ингибиторов (5-200 мкМ) в 10 мМ Трис/Hepes-буфере (рН 7,4)/100 мМ NaCl/100 мМ маннита. После инкубации в течение 15 секунд процесс транспортировки прекращали за счет добавки 1 мл охлажденного льдом "стоп"-раствора (10 мМ Трис/Hepes-буфер (рН 7,4)/150 мМ KCl) и суспензию везикул тотчас отфильтровывали в вакууме 25-35 мбар через мембранный фильтр из нитрата целлюлозы (0,45 мкм; диаметр 25 мм; Schleicher and Schüll). Фильтр дополнительно промывали с помощью 5 мл охлажденного льдом "стоп"-раствора. Каждую точку измерения определяли двукратно или трехкратно. Для определения поглощения радиоактивно меченных субстратов мембранный фильтр растворяли в 4 мл соответствующего сцинтиллятора (Quickszint 361, Zinsser Analytik GmbH, Франкфурт-на-Майне) и радиоактивность определяли путем измерения сцинтилляции жидкости. Определенные значения, после калибровки прибора с помощью стандартных образцов и после поправки на возможно имеющуюся хемилюминесценцию, получали в виде dpm (дезинтеграций в минуту).
Сравнение активностей биологически активных веществ осуществляли с помощью данных IC50 (полумаксимальная ингибирующая концентрация), которые получали путем количественного анализа в отношении транспортировки с везикул мембран щеточной каймы тонкой кишки кролика для выбранных веществ (абсолютные значения могут быть зависимы от вида и теста).
Ниже подробно описывается получение соединений согласно различным примерам, остальные соединения формулы (I) получают аналогичным образом.
Экспериментальная часть
Реакционная схема: Синтез α-бромгликозидов



где: Pyr - пиридин; Ас - ацетил
1-Бром-4-дезокси-4-фтор-2,3,6-три-О-ацетил-альфа-D-глюкоза (2)

5 г (27,5 ммоль) 4-дезокси-4-фтор-D-глюкопиранозы 1 (Apollo) суспендируют в 50 мл пиридина и 50 мл ангидрида уксусной кислоты. Реакционный раствор перемешивают в течение 4 часов при температуре 45°С. При этом образуется прозрачный реакционный раствор, который затем концентрируют. Получают 12 г сырого продукта. Этот сырой продукт растворяют в 160 мл 33%-го раствора HBr в ледяной уксусной кислоте и выдерживают в течение 2 часов при комнатной температуре. Реакционный раствор затем выливают в смесь 300 г льда и 300 мл этилацетата. Органическую фазу промывают два раза с помощью водного раствора NaCl, фильтруют через небольшое количество силикагеля и концентрируют. Остаток разделяют хроматографией на силикагеле (этилацетат:гептан=1:1). Получают 8,19 г (80% за две стадии) соединения 2 в виде твердого вещества светло-желтого цвета.
1-Бром-4-дезокси-4-фтор-2,3,6-три-О-ацетил-альфа-D-галактоза (4)
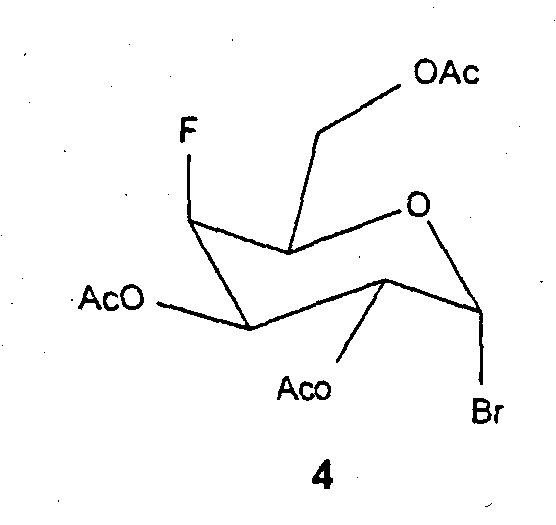
100 мг (0,55 ммоль) соединения 3 вводят во взаимодействие с 3,5 мл пиридина и 3,5 мл ангидрида уксусной кислоты, аналогично получению соединения 2. Получают 89 мг (44%) соединения 4 в виде аморфного твердого вещества.
1-Бром-3-дезокси-3-фтор-2,4,6-три-О-ацетил-альфа-D-глюкоза (6)

335 мг (1,84 ммоль) соединения 5 вводят во взаимодействие с 10 мл пиридина и 10 мл ангидрида уксусной кислоты, аналогично получению соединения 2. Получают 628 мг (92%) соединения 6 в виде аморфного твердого вещества.

Аналогичным образом получают:

Пример 1 (соединение 9)

100 мг (0,47 ммоль) 2-(4-метоксибензил)фенола 7 и 370 мг (1,17 ммоль) бромида 2 растворяют в 6 мл дихлорметана. К этому раствору последовательно добавляют 160 мг Bu3BnNCl (бензилтрибутиламмонийхлорид) (РТК = межфазный катализатор), 320 мг К2СО3 и 0,4 мл воды и затем перемешивают в течение 20 часов при комнатной температуре. Реакционный раствор разбавляют с помощью 20 мл этилацетата и фильтруют через силикагель. Фильтрат концентрируют и остаток разделяют хроматографией на силикагеле (этилацетат:гептан=1:1). Получают 72 мг соединения 8 в виде бесцветного твердого вещества. Полученные 72 мг соединения 8 обрабатывают с помощью 4 мл метанола и смешивают с 1 мл 1н. метилата натрия/метанолом. Спустя один час нейтрализуют с помощью раствора HCl в метаноле, концентрируют и остаток разделяют хроматографией на силикагеле (дихлорметан:метанол:концентрированный раствор аммиака=30:5:1). Получают 29 мг соединения 9 в виде бесцветного твердого вещества. С20Н23FO6 (378,40); MC (ESI-) (масс-спектрометрия с ионизацией электронным распылением при образовании отрицательных ионов): 423,22 (M+CHO2-).
Пример 2 (соединение 10)

100 мг (0,47 ммоль) 2-бензилфенола и 370 мг (1,17 ммоль) бромида 2 вводят во взаимодействие аналогично синтезу соединения 9 и получают 31 мг соединения 10 в виде бесцветного твердого вещества. С19Н21FO5 (348,37); MC (ESI-): 393,15 (M+CHO2-).
Пример 3 (соединение 11)

200 мг (0,94 ммоль) 2-(4-Метоксибензил)фенола 7 и 200 мг (0,63 ммоль) бромида 4 вводят во взаимодействие аналогично синтезу соединения 9 и получают 110 мг соединения 11 в виде бесцветного твердого вещества. С20Н23FO6 (378,40); MC (ESI-): 423,22 (M+CHO2-).

Аналогичным образом получают:
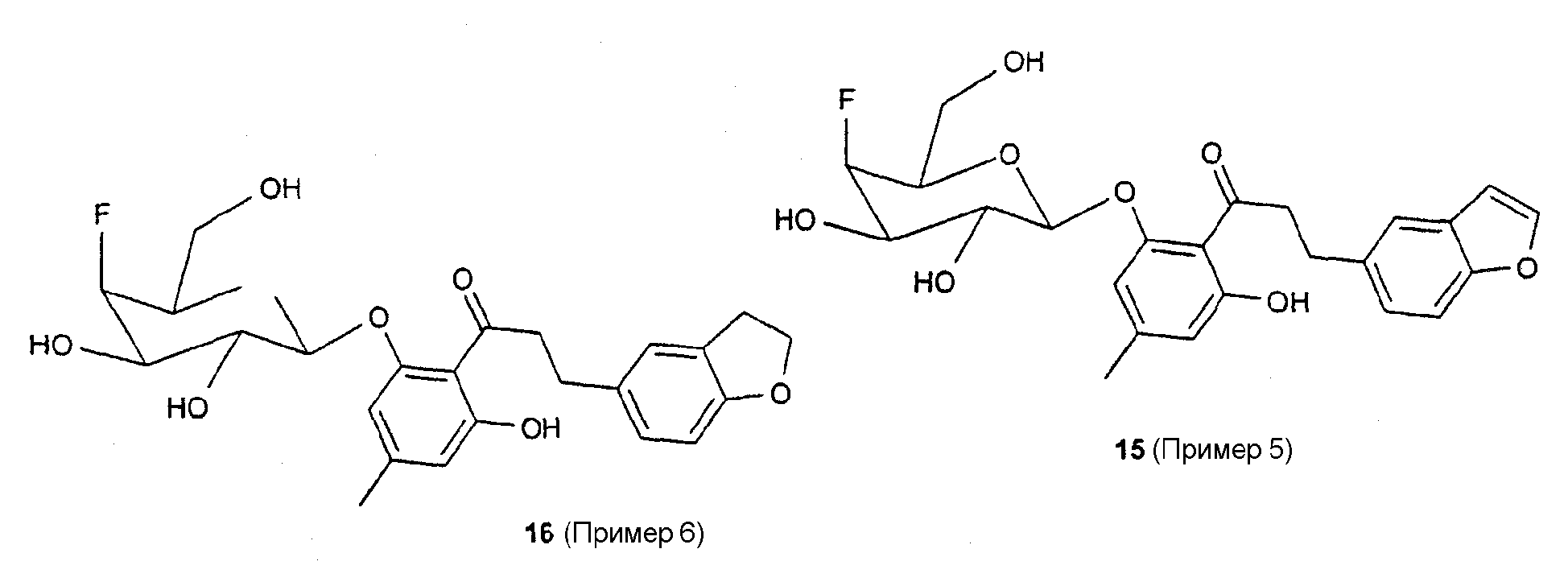
Пример 4 (соединение 14)

90 мг (0,30 ммоль) 3-бензофуран-5-ил-1-(2,6-дигидрокси-4-метилфенил)пропан-1-она 12 и 280 мг (0,76 ммоль) бромида 2 вводят во взаимодействие аналогично синтезу соединения 8 и получают 400 мг соединения 13 в виде сырого продукта, из которого аналогично синтезу глюкозида 9 непосредственно с помощью метилата натрия/метанола удаляют защитные группы. Получают 75 мг соединения 14 (54% за две стадии) в виде бесцветного твердого вещества. С24Н25FO8 (460,46); MC (ESI-): 459,03 (M-H+).
Пример 5 (соединение 15)

100 мг (0,33 ммоль) 3-бензофуран-5-ил-1-(2,6-дигидрокси-4-метилфенил)пропан-1-она 12 и 150 мг (0,40 ммоль) бромида 4 вводят во взаимодействие аналогично синтезу соединения 14 и получают 75 мг соединения 15 в виде бесцветного твердого вещества. С24Н25FO8 (460,46); MC (ESI-): 459,03 (M-H+).
Пример 6 (соединение 16)
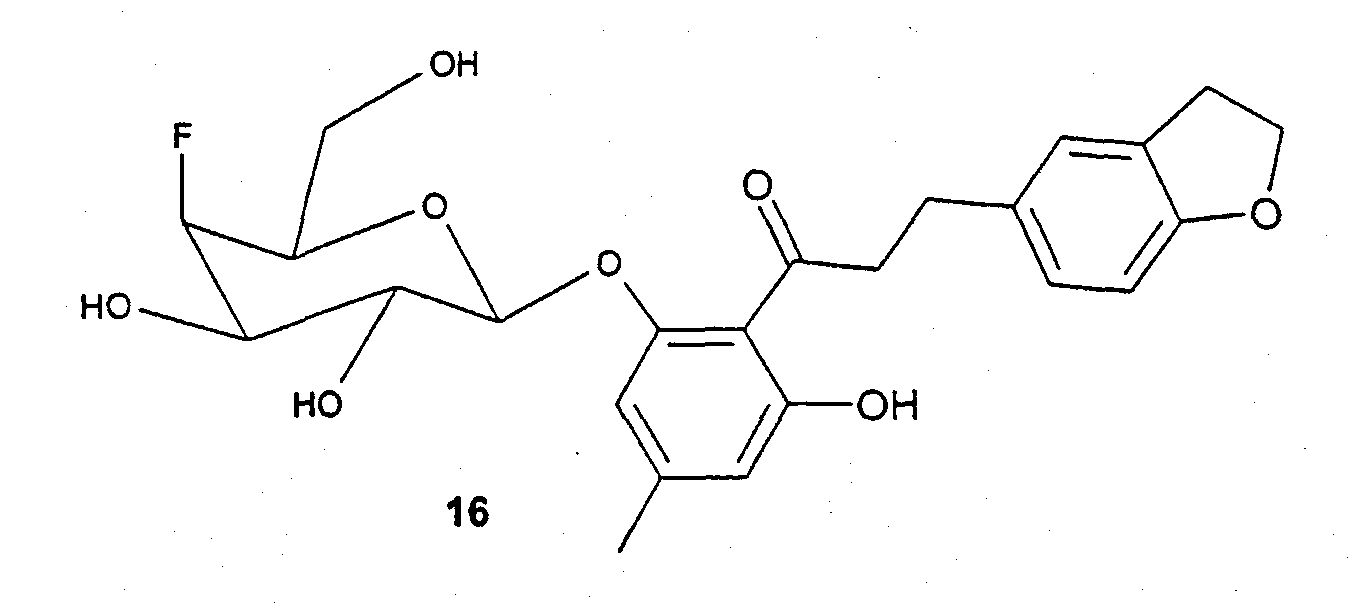
150 мг (0,5 ммоль) 3-(2,3-дигидроксибензофуран-5-ил)-1-(2,6-дигидрокси-4-метилфенил)пропан-1-она и 150 мг (0,40 ммоль) бромида 4 вводят во взаимодействие аналогично синтезу соединения 14 и получают 75 мг соединения 16 в виде бесцветного твердого вещества. С24Н27FO8 (462,46); MC (ESI-): 461,03 (M-H+).

Аналогичным образом получают:

Пример 7 (соединение 20)

1,0 г (6,0 ммоль) 1-(2,6-дигидрокси-4-метилфенил)этанона 17 и 1,0 г (2,7 ммоль) бромида 2 растворяют в 30 мл дихлорметана. К этому раствору при интенсивном перемешивании последовательно добавляют 800 мг бензилтрибутиламмонийхлорида (РТК), 1,6 г карбоната калия и 1,5 мл воды. Эту суспензию перемешивают при защите от света (алюминиевая фольга) в течение 18 часов и затем разбавляют с помощью 150 мл этилацетата и 150 мл н-гептана. Твердые компоненты отфильтровывают через небольшое количество силикагеля и фильтрат концентрируют. Остаток разделяют хроматографией на силикагеле (этилацетат:гептан=1:2). Получают 430 мг соединения 18 (плохо отделяется от параллельно получаемого побочного продукта, поэтому чистота составляет только приблизительно 50%. Побочный продукт можно легко удалять на ближайшей стадии) в виде твердого вещества светло-желтого цвета. С21Н25О10F (456,43); MC (ESI-): 455,25 (M-H+).
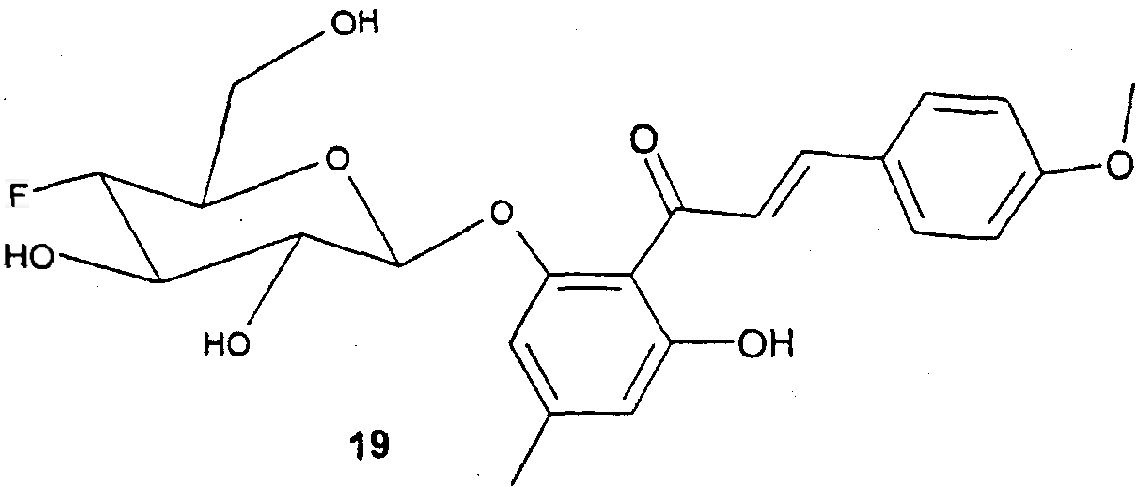
200 мг соединения 18 (примерно 50%-ной чистоты) и 225 мг анисового альдегида (Fluka) растворяют в 10 мл метанола. После добавки 5 мл 1н. раствора метилата натрия в метаноле реакционный раствор кипятят с обратным холодильником в течение 12 часов. Реакционный раствор нейтрализуют с помощью раствора HCl в метаноле, концентрируют и остаток разделяют хроматографией на силикагеле (дихлорметан:метанол:концентрированный раствор аммиака=30:5:1). Получают 60 мг соединения 19 в виде твердого вещества желтого цвета.
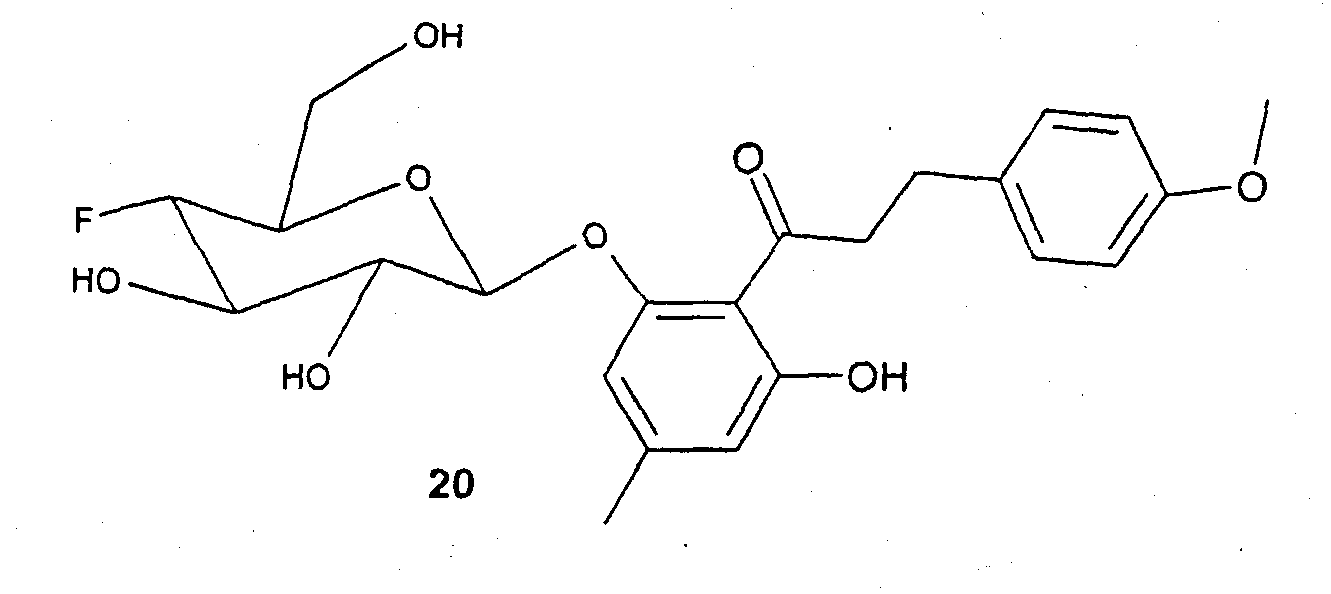
60 мг (0,13 ммоль) Халкона 19 и 50 мг Pd/C (10% Pd) суспендируют в 15 мл метанола и гидрируют в атмосфере водорода при давлении 5 бар в течение 5 часов при комнатной температуре. Реакционный раствор концентрируют и остаток очищают флэш-хроматографией (дихлорметан:метанол:концентрированный раствор аммиака=30:5:1). Выход составляет 25 мг (42%) соединения 20 в виде аморфного твердого вещества белого цвета. С23Н27FO8 (424,47); MC (ESI-): 449,17 (M-H+).
Пример 8 (соединение 21)

200 мг соединения 18 (примерно 50%-ной чистоты) и 350 мг п-бензилоксибензальдегида (Fluka) вводят во взаимодействие аналогично синтезу соединения 20. Получают 36 мг соединения 21 в виде бесцветного твердого вещества. С22Н25FO8 (436,44); MC (ESI-): 481,08 (M+CHO2-).

Пример 9 (соединение 27)

350 мг бромида 2, 100 мг фенола 22 и 350 мг п-бензил-оксибензальдегида (Fluka) вводят во взаимодействие аналогично синтезу соединения 21. Получают 40 мг соединения 27 в виде бесцветного твердого вещества. С21Н23FO9 (438,41); MC(ESI-): 483,15 (M+CHO2-).
Пример 10 (соединение 28)

110 мг бромида 4, 80 мг фенола 22 и 350 мг п-бензил-оксибензальдегида (Fluka) вводят во взаимодействие аналогично синтезу соединения 21. Получают 50 мг соединения 28 в виде бесцветного твердого вещества. С21Н23FO9 (438,41); MC(ESI-): 483,15 (M+CHO2-).

Пример 11 (соединение 30)

200 мг бромида 2 и 300 мг фенола 29 вводят во взаимодействие аналогично синтезу соединения 14. Получают 40 мг соединения 30 в виде бесцветного твердого вещества. С21Н24FNO8 (437,43); MC(ESI-): 482,15 (M+CHO2-).
Пример 12 (соединение 31)
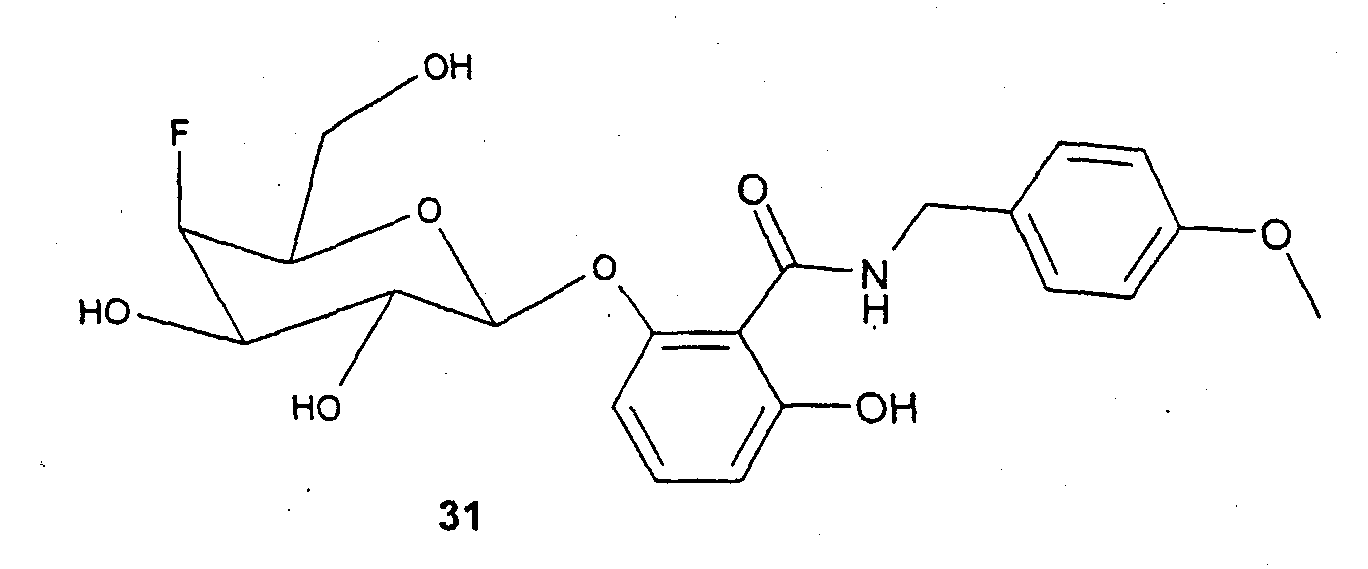
200 мг бромида 4 и 300 мг фенола 29 вводят во взаимодействие аналогично синтезу соединения 14. Получают 115 мг соединения 31 в виде бесцветного твердого вещества. С21Н24FNO8 (437,43);
MC(ESI-): 482,15 (M+CHO2-).

Пример 13 (соединение 33)

200 мг бромида 2 и 300 мг фенола 32 вводят во взаимодействие аналогично синтезу соединения 14. Получают 80 мг соединения 33 в виде бесцветного твердого вещества. С22Н26FNO8 (451,45); MC(ESI-): 496,17 (M+CHO2-).
Пример 14 (соединение 34)

200 мг бромида 4 и 300 мг фенола 32 вводят во взаимодействие аналогично синтезу соединения 14. Получают 130 мг соединения 34 в виде бесцветного твердого вещества. С21Н24FNO8 (451,45);
MC(ESI-): 496,15 (M+CHO2-).

1-(2,6-Бис-бензилокси-4-метилфенил)этанон (36)

1,62 г (9,75 ммоль) 1-(2,6-дигидрокси-4-метилфенил)этанона (35) растворяют в 30 мл диметилформамида и смешивают с 4,0 мл (33,7 ммоль) бензилбромида и 13,8 г (100 ммоль) карбоната калия. Реакционную смесь перемешивают в течение 3 часов при комнатной температуре. Затем добавляют воду и экстрагируют два раза этилацетатом. Объединенные органические фазы промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в ротационном испарителе. Получают 1,35 г (40%) соединения 36 в виде бесцветного кристаллического продукта. С23Н22О3 (346,2); МС(ESI+) (масс-спектрометрия с ионизацией электронным распылением при образовании положительных ионов): 347,15 (М+Н+).
1-(2,6-Бис-бензилокси-4-метилфенил)-3-(4-метоксифенил)пропенон(37)

37
3,46 г (10 ммоль) 1-(2,6-бис-бензилокси-4-метилфенил)-этанона (36) растворяют в 150 мл этанола и добавляют 1,34 мл п-анисового альдегида. Затем прикапывают 7 мл водного раствора гидроксида калия. Реакционную смесь перемешивают в течение 12 часов при комнатной температуре.
В ротационном испарителе отгоняют половину растворителя. При охлаждении льдом нейтрализуют с помощью 2 М соляной кислоты и затем смесь встряхивают три раза с водой и этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и выпаривают в ротационном испарителе. Выделившееся масло кристаллизуется. Кристаллы перемешивают в диэтиловом эфире, отфильтровывают под вакуумом и высушивают. Получают 4,3 г (92%) соединения 37 в виде бесцветного твердого вещества, г/моль С31Н28О4 (464,2); МС(ESI+): 465,10 (М+Н+).
1-(2,6-Дигидрокси-4-метилфенил)-3-(4-метоксифенил)пропан-1-он (38)

1,50 г (3,23 ммоль) 1-(2,6-бис-бензилокси-4-метилфенил)-этанона (37) растворяют в 40 мл этилацетата и в атмосфере аргона добавляют 400 мг 10%-ного палладия-на-активном угле. Гидрируют в автоклаве для гидрирования при давлении 3 бара и комнатной температуре в течение 2 часов. Катализатор затем отфильтровывают, промывают этилацетатом и полученный раствор концетрируют в ротационном испарителе. Сырой продукт очищают колоночной хроматографией (SiO2; этилцетат:н-гептан=1:3). Выделяют 600 мг продукта 38 (65%) в виде бесцветного твердого вещества. С17Н18О4 (286,3); МС(ESI+): 287,10 (М+Н+).
Ссылочный пример 7 (соединение 20)

174,4 мг (0,61 ммоль) соединения 38 растворяют в 50 мл толуола и смешивают с 340 мг (0,61 ммоль) бромида 60 и 421 мг (2,44 ммоль) карбоната кадмия. Реакционную смесь кипятят с обратным холодильником в течение 1 часа при использовании водоотделителя. Карбонат кадмия отфильтровывают и полученный прозрачный раствор концентрируют в ротационном испарителе. Сырой продукт суспендируют в 25 мл метанола и смешивают с 5,0 мл 0,5 М раствора метилата натрия в метаноле и перемешивают в течение 12 часов при комнатной температуре. Реакционный раствор нейтрализуют путем добавки раствора HCl в метаноле и очищают флэш-хроматографией (SiO2; этилацетат:гептан=от 1:4 до 1:1). Получают 78,8 мг (29%) соединения 20 в виде бесцветного твердого вещества. С23Н27FO8 (450,5); МС(ESI+): 473,15 (М+Na+).
Аналогичным образом получают соединения 40 (пример 15), 41 (пример 16), 42 (пример 17) и 43 (пример 18).


1-Метокси-4-дезокси-4,4-дифтор-2,3,6-три-О-бензил-альфа-D-глюкоза (45)

3,69 г (7,9 ммоль) 1-метокси-2,3,6-три-О-бензил-α-D-глюкозы 44 (Tetrahedron Asymmetry, 11, 385-387 (2000)) растворяют в 110 мл дихлорметана и в атмосфере аргона прикапывают 3,6 г (8,5 ммоль) реагента Dess-Martin (Aldrich). После выдерживания в течение 3 часов при комнатной температуре разбавляют с помощью 300 мл смеси этилацетата и н-гептана (1:1) и промывают один раз с помощью раствора NaHCO3 и один раз с помощью раствора Na2S2O3. Органическую фазу фильтруют через силикагель и концентрируют. Остаток разделяют хроматографией на силикагеле (этилацетат:н-гептан=1:1). Получают 2,9 г (79%) кетона. Его растворяют в 30 мл дихлорметана и в атмосфере аргона прикапывают 4,0 мл BAST ([бис(2-метоксиэтил)амино]трифторид серы; Aldrich). После выдерживания в течение 20 часов при комнатной температуре разбавляют с помощью 200 мл этилацетата и осторожно (сильное вспенивание) промывают холодным раствором NaHCO3. Органическую фазу фильтруют через силикагель и концентрируют. Остаток разделяют хроматографией на силикагеле (этилацетат:н-гептан=1:1). Получают 2,6 г (85%) соединения 45 в виде бесцветного масла.
4-Дезокси-4,4-дифтор-1,2,3,6-тетра-О-ацетил-альфа-D-глюкоза (46)

2,3 г (4,7 ммоль) соединения 45 и 2 г Pd/C (10% Pd) растворяют в 150 мл метанола и 10 мл уксусной кислоты и в атмосфере водорода при давлении 5 бар гидрируют в течение 16 часов при комнатной температуре. Реакционный раствор концентрируют и остаток очищают флэш-хроматографией (дихлорметан:метанол: концентрированный раствор аммиака=30:5:1). Выход: 850 мг (83%) 1-метокси-4-дезокси-4,4-дифтор-альфа-D-глюкозы в виде аморфного твердого вещества белого цвета. С7Н12F2O5 (214,17); MC (DCI) (масс-спектрометрия с десорбционно-химической ионизацией): 215,4 (М+Н+).
700 мг (3,3 ммоль) этого соединения растворяют в 3,5 мл уксусной кислоты и 6,3 мл ангидрида уксусной кислоты. После добавки 0,2 мл концентрированной H2SO4 перемешивают в течение 5 часов при температуре 60°С. Реакционный раствор затем выливают в смесь 30 г льда и 30 мл этилацетата. Органическую фазу промывают два раза водным раствором NaCl, фильтруют через небольшое количество силикагеля и концентрируют. Остаток разделяют хроматографией на силикагеле (этилацетат:н-гептан=1:1). Получают 300 мг (25%) соединения 46 в виде смеси аномеров. С14Н18F2O9 (368,29); МС (DCI): 369,3 (М+Н+).
1-Бром-4-дезокси-4,4-дифтор-2,3,6-три-О-ацетил-альфа-D-глюкоза (47)

300 мг (0,8 ммоль) тетраацетата 46 растворяют в 13 мл 33%-ного раствора HBr в ледяной уксусной кислоте и выдерживают в течение 6 часов при комнатной температуре. Реакционный раствор затем выливают в смесь 10 г льда и 10 мл этилацетата. Органическую фазу промывают два раза водным раствором NaCl, фильтруют через небольшое количество силикагеля и концентрируют. Остаток разделяют хроматографией на силикагеле (этилацетат:гептан=1:1). Получают 112 мг (35%) соединения 47 в виде бесцветного твердого вещества. С12Н15BrF2O7 (389,15); МС (DCI): 389,2 (М+Н+).

где: Bu3BnNCl - бензилтрибутиламмонийхлорид.
Пример 19 (соединение 50)

100 мг (0,47 ммоль) 2-бензилфенола (Aldrich) и 40 мг (0,10 ммоль) дифторбромида 47 вводят во взаимодействие аналогично синтезу соединения 9 и получают 21 мг соединения 50 в виде бесцветного твердого вещества. С19Н20F2O5 (366,37); MC(ESI-): 411,15 (M+CHO2-).

(4-Метоксифенил)-(2-метоксифенил)метанол (51)

1,5 г о-анисового альдегида растворяют в тетрагидрофуране и охлаждают до температуры 0°С. К смеси добавляют 24,2 мл 4-метоксифенилмагнийбромида (0,5 М в тетрагидрофуране). Реакционный раствор перемешивают в течение ночи при комнатной температуре, затем выливают в 20%-ный раствор NH4Cl и экстрагируют этилацетатом. Получают 2,63 г продукта, который можно использовать без дальнейшей очистки. С15Н16O3 (244,29); MC(ESI+): 227,05 (M-OH)+.
(4-Метоксифенил)-(2-метоксифенил)метанон (52)

2,63 г (4-метоксифенил)-(2-метоксифенил)метанола 51 растворяют в дихлорметане и добавляют 5,03 г реагента Dess Martin. Смесь перемешивают при комнатной температуре в течение 2 часов. Затем добавляют 20%-ный раствор Na2SO3 и 20%-ный раствор NaHCO3 и смесь экстрагируют диэтиловым эфиром. Органическую фазу экстрагируют насыщенным раствором NaCl и сушат над сульфатом натрия. Раствор концентрируют в вакууме и очищают колоночной хроматографией. Получают 2,61 г соединения 52. С15Н14O3 (242,28); MC(ESI+): 243,04 (M+H+).
Альтернативно этому можно осуществлять окисление с помощью реагента Jones:
155 мг (4-Метоксифенил)-(2-метоксифенил)метанола 51 растворяют в 10 мл ацетона и добавляют по каплям 2 мл реагента Jones. После выдерживания в течение 2 часов при комнатной температуре к смеси добавляют 50 мл метил-трет-бутилового эфира и 30 мл воды, органическую фазу экстрагируют насыщенным раствором NaCl, сушат над сульфатом натрия и концентрируют досуха. Таким образом, полученный продукт (126 мг) имеет достаточную для дальнейшего превращения чистоту.
(2-Гидроксифенил)-(4-метоксифенил)метанон (53)

2,61 г (4-метоксифенил)-(2-метоксифенил)метанона 52 растворяют в дихлорметане. Смесь охлаждают на бане со льдом и добавляют 3,71 г комплекса трибромида бора с диметилсульфидом. Смесь нагревают до комнатной температуры и выдерживают при перемешивании в течение 3 часов. Затем реакцию прерывают путем выливания в воду со льдом, дихлорметановую фазу отделяют и водную фазу многократно экстрагируют этилацетатом. Объединенную органическую фазу промывают водой и раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Сырой продукт хроматографируют на силикагеле с помощью смеси этилацетата и гептана. Получают 1,26 г продукта. С14Н12О3 (228,25); МС (DCI): 229,2 (М+Н+).
2-(4-Метоксибензил)фенол (7)

0,78 г (2-гидроксифенил)-(4-метоксифенил)метанона растворяют в ацетонитриле и охлаждают до температуры 0°С. К смеси прикапывают 2 мл триметилсилилхлорида и затем добавляют 1 г цианоборгидрида натрия. Смесь перемешивают в течение 3 часов при комнатной температуре. Реакционный раствор разбавляют дихлорметаном и фильтруют через целит. Органическую фазу экстрагируют водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. Сырой продукт хроматографируют на силикагеле с помощью смеси этилацетат:гептан=1:2. Получают 0,72 г целевого продукта. С14Н14O2 (214,27); MC(ESI+): 232,20 (M+NH4+)+.

(4-Этилфенил)-(2-метоксифенил)метанол (54)

1,01 г о-анисового альдегида растворяют в тетрагидрофуране и охлаждают до температуры 0°С. К смеси добавляют 16,29 мл 4-этилфенилмагнийбромида (0,5 М в тетрагидрофуране). Реакционный раствор перемешивают в течение ночи при комнатной температуре, затем выливают в 20%-ный раствор NH4Cl и экстрагируют этилацетатом. Получают 1,92 г продукта, который можно использовать без дальнейшей очистки. С16Н18O2 (242,32); MC(ESI+): 225,15 (M-OH)+.
(4-Этилфенил)-(2-метоксифенил)метан (55)
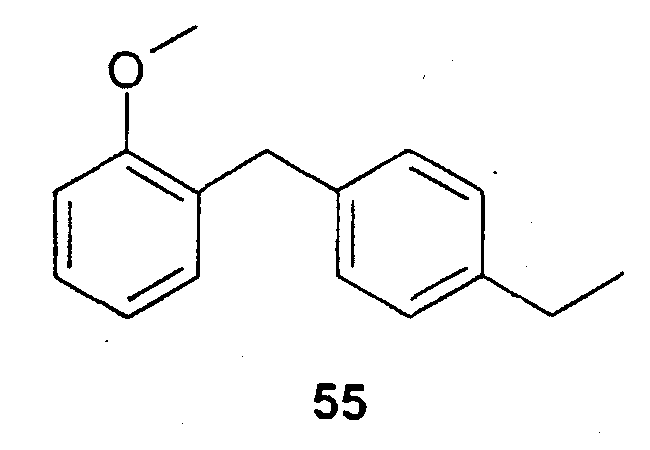
1,34 г (4-этилфенил)-(2-метоксифенил)метанола растворяют в ацетонитриле и охлаждают до температуры 0°С. К смеси добавляют 1,50 г цианоборгидрида натрия, затем добавляют 3,00 мл триметилсилилхлорида. Смесь перемешивают в течение ночи при комнатной температуре. Реакционный раствор фильтруют через целит и экстрагируют насыщенным раствором NaCl. Органическую фазу сушат над сульфатом натрия и концентрируют. Сырой продукт хроматографируют на силикагеле с помощью смеси этилацетата и гептана (в соотношении 1:12). Получают 0,83 г продукта. С16Н18О (226,32); МС (DCI): 227,4 (М+Н+).
2-(4-Этилбензил)фенол (56)

0,83 г (4-этилфенил)-(2-метоксифенил)метана 55 растворяют в дихлорметане. К смеси прикапывают 11,0 мл трибромида бора (1 М в дихлорметане). Смесь перемешивают в течение 5 часов при комнатной температуре, смешивают с водой и дихлорметановую фазу отделяют. Водную фазу экстрагируют этилацетатом. Объединенные органические фазы промывают водой и раствором NaCl, сушат над сульфатом натрия и концентрируют. Получают 0,77 г соединения в виде сырого продукта, который можно очищать хроматографией. С15Н16О (212,29); МС (ESI): 235,20 (М+Na+).

Метил-2,3,6,-три-О-бензоил-4-фтор-4-дезокси-α-D-глюкопиранозид (58)

3 г метил-2,3,6-три-О-бензоил-α-D-галактопиранозида 57 (Reist и др., J. Org. Chem., 30, 2312 (1965)) вносят в дихлорметан и охлаждают до температуры -30°С. Затем прикапывают 3,06 мл [бис(2-метоксиэтил)амино]трифторида серы (BAST). Реакционный раствор нагревают до комнатной температуры и перемешивают в течение ночи. Смесь разбавляют дихлорметаном и органическую фазу экстрагируют с помощью Н2О, раствора NaHCO3 и насыщенного раствора NaCl. Органическую фазу сушат над сульфатом натрия и концентрируют. Сырой продукт кристализуют из этилацетата и гептана. Получают 1,95 г соединения 58 в виде бесцветного твердого вещества. С28Н25FO8 (508,51); МС (ESI+): 526,18 (М+NH4+).
Альтернативно, реакцию можно осуществлять также при использовании 2,8 экв. диэтиламинотрифторида серы (DAST); при этом реакционный раствор после осуществленной добавки кипятят с обратным холодильником в течение 18 часов. Обработку осуществляют аналогично вышеописанному.
1-О-Ацетил-2,3,6-три-О-бензоил-4-фтор-4-дезоксиглюкоза (59)

12 г метил-2,3,6-три-О-бензоил-4-фтор-4-дезокси-α-D-глюкопиранозида 58 суспендируют в 150 мл ангидрида уксусной кислоты. 8,4 мл концентрированной серной кислоты смешивают с 150 мл ледяной уксусной кислоты и при охлаждении льдом добавляют к смеси. Смесь перемешивают при комнатной темературе в течение 60 часов. Реакционную смесь выливают в раствор NaHCO3 и этот раствор экстрагируют дихлорметаном. Органическую фазу экстрагируют раствором NaCl, сушат над сульфатом натрия и концентрируют. Остаток перекристализуют из этилацетата и гептана. Получают 5,97 г продукта в виде бесцветного твердого вещества. С29Н25FO9 (536,52); МС (ESI+): 554,15 (M+NH4+).
2,3,6-Три-О-бензоил-4-фтор-4-дезоксиглюкозилбромид (60)

1,44 г 1-О-ацетил-2,3,6-три-О-бензоил-4-фтор-4-дезоксиглюкозы растворяют в 20 мл 33%-ного раствора бромоводорода в ледяной уксусной кислоте и перемешивают при комнатной температуре. Спустя 5 часов смесь выливают в воду со льдом, водную фазу экстрагируют три раза дихлорметаном. Объединенную органическую фазу промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют досуха. Сырой продукт фильтруют через силикагель при использовании смеси этилацетата и гептана в соотношении 70:30. Получают 1,40 г продукта в виде твердого вещества. С27Н22BrFO7 (557,37); МС (ESI+): 574,05/576,05 (M+NH4+).
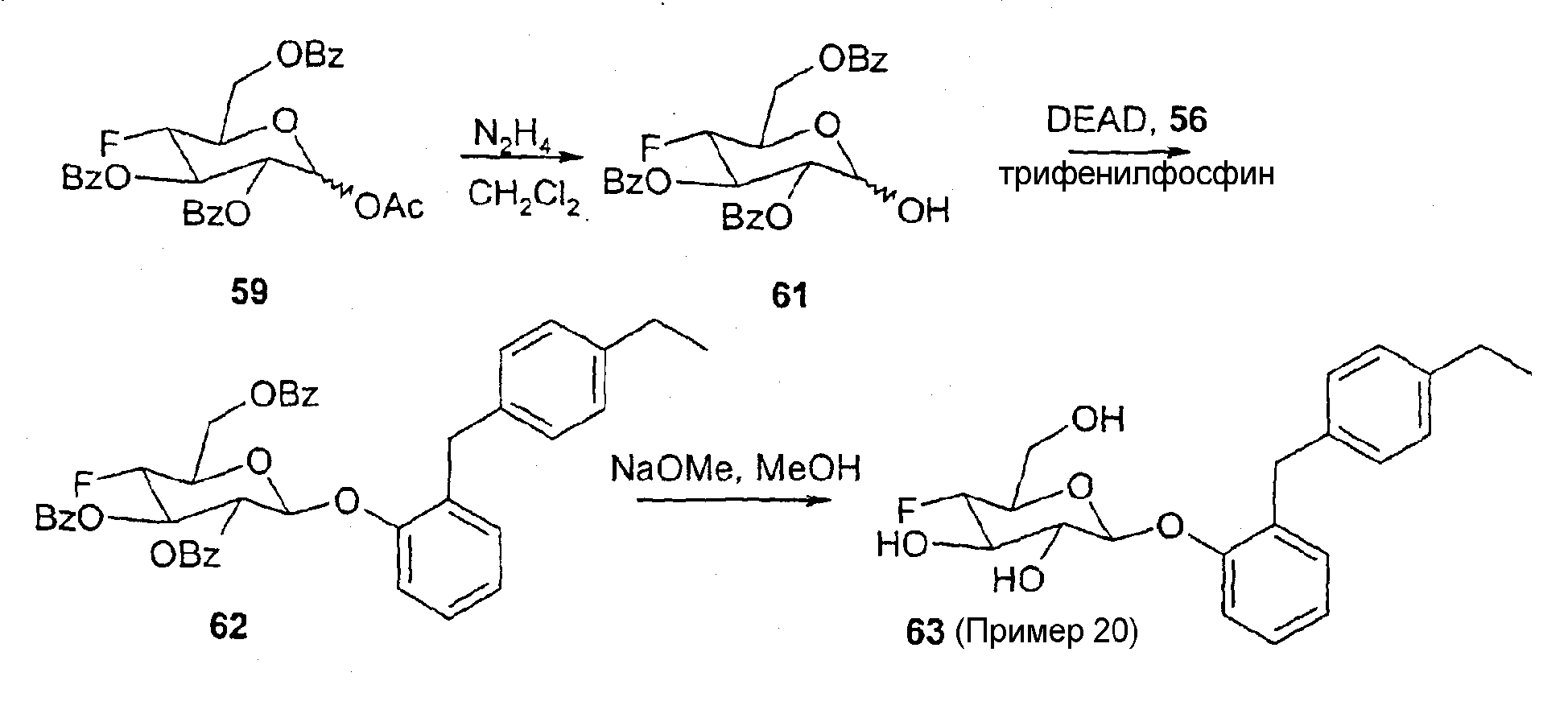
2,3,6-Три-О-бензоил-4-фтор-4-дезоксиглюкоза (61)

1,60 г 1-О-ацетил-2,3,6-три-О-бензоил-4-фтор-4-дезокси-глюкозы растворяют в дихлорметане. К этому раствору добавляют 173 мкл гидразингидрата. Спустя 16 часов реакционный раствор распределяют между дихлорметаном и H2O. Органическую фазу экстрагируют раствором NaCl, сушат над сульфатом натрия и концентрируют досуха. Сырой продукт очищают колоночной хроматографией. Получают 1,22 г целевого продукта. С27Н23FO8 (494,48); МС (ESI+): 512,15 (M+NH4+).
Соединение 62

248 мг 2-(4-этилбензил)фенола (56), 550 мг 2,3,6-три-О-бензоил-4-фтор-4-дезоксиглюкозы (61) и 335 мг трифенилфосфина в 2 мл безводного дихлорметана в атмосфере аргона охлаждают до температуры 0°С. Медленно прикапывают 0,193 мл диэтилазодикарбоксилата. Раствор доводят до комнатной температуры и перемешивают в течение ночи. Раствор затем разбавляют дихлорметаном и экстрагируют водой, 0,5 М раствором NaOH и насыщенным раствором NaCl. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают хроматографией (гептан:этилацетат=3:1). Получают 200 мг целевого продукта. С42Н37FO8 (688,76); МС (ESI): 706,30 (M+NH4+).
Пример 20 (соединение 63)

63 (Пример 20)
200 мг соединения 62 обрабатывают с помощью 10 мл абсолютного метанола и смешивают с 1 мл раствора метилата натрия (10 мг метилата натрия на мл метанола). Раствор перемешивают в течение 8 часов. Натрий удаляют путем добавки ионообменной смолы Amberlyst-15 (Н+-форма), ионообменник отфильтровывают и остаток тщательно промывают. Полученный продукт очищают путем фильтрации через силикагель (дихлорметан:метанол=96:4). Получают 56 мг целевого продукта. С21Н25FO5 (376,43); МС (ESI): 394,25 (M+NH4+).
Соединения согласно следующим примерам получают аналогичным образом, как в примере 20, при использовании соответствующих агликонов:


Соответствующие агликоны можно получать, например, описанными для получения соединения 7 или 56 способами.

1-[4-(2-Метоксифенокси)фенил]этанон (69)

0,15 мл гваякола 67, 167 мг 4-фторацетофенона 68, 335 мг карбоната калия в 5 мл диметилсульфоксида в микроволновой печи нагревают в течение 10 минут при температуре 170°С. Реакционный раствор выливают в воду и эмульсию экстрагируют три раза метил-трет-бутиловым эфиром. Объединенную органическую фазу экстрагируют два раза с помощью 1н. раствора NaOH и один раз насыщенным раствором NaCl, сушат и концентрируют в вакууме. Получают 240 мг целевого продукта. С15Н14O3 (242,28); МС (ESI): 215,10 (M+H+).
2-(4-Этилфенокси)метоксибензол (70)

960 мг 1-[4-(2-метоксифенокси)фенил]этанона 69 растворяют в 20 мл ацетонитрила, охлаждают на бане со льдом и смешивают с 1,05 г цианоборгидрида натрия и 2,01 мл триметилсилилхлорида. Спустя 1 час разбавляют дихлорметаном, отфильтровывают через целит и органическую фазу экстрагируют раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток очищают хроматографией (гептан:этилацетат=7:1). Получают 710 мг целевого продукта. С15Н16O2 (228,29); МС (ESI): 246,20 (M+NH4+).
2-(4-Этилфенокси)фенол (71)

710 мг 2-(4-этилфенокси)метоксибензола 70 растворяют в 5 мл абсолютного дихлорметана. Прикапывают 0,6 мл трибромида бора (1 М в дихлорметане) и раствор перемешивают в течение 6 часов. Добавляют дальнейшее количество BBr3 и перемешивают до тех пор, пока, согласно жидкостной хроматографии с масс-спектрометрией (LCMS), превращение не произойдет почти полностью. Раствор выливают в воду со льдом, органическую фазу отделяют, а водную фазу экстрагируют три раза дихлорметаном. Объединенную органическую фазу сушат, концентрируют досуха и очищают хроматографией. Получают 450 мг целевого продукта. С14Н14O2 (214,27); МС (ESI): 215,10 (M+H+).
Соединение 72

Соединение 61 (466 мг) и фенол 71 (242 мг) вводят во взаимодействие, аналогично синтезу соединения 62. Полученный продукт можно очищать путем колоночной хроматографии (гептан: этилацетат = 4:1). Получают 240 мг целевого продукта. C41H35FO9 (690, 73); МС (ESI): 708,25 (M+NH4+).
Пример 24 (соединение 39)

230 мг соединения 72, аналогично высвобождению соединения примера 20, вводят во взаимодействие с метилатом натрия. Соединение можно очищать хроматографией на силикагеле (дихлорметан: метанол = 96:4). Получают 119 мг целевого продукта. С20Н23FO6 (378, 40); МС (ESI): 396,15 (M+NH4+).
Пример 25
Соединение 73 (С16Н17С1, Mw: 24477)

Данные масспектрометрии следующих соединений:
Реферат
Изобретение относится к замещенным ароматическим фторгликозидным производным формулы (Ib), где R1 и R2 независимо означают Н или F, причем по крайней мере один из остатков R1 и R2 должен означать F; R3 - ОН; А означает О; R4 - водород, (С1-С6)-алкил, (C1-C6)-алкокси или ОН; R5 - водород, (С1-С6)-алкокси или галоген; R6 - водород, галоген или ОН; В - (С1-С6)-алкандиил, -CO-NH-CH2-, -О- или -CO-CH2-CH2-; R7 - водород; R8 - водород, ОН, (С1-С6)-алкил, галоген или (С1-С6)-алкокси, который необязательно одно- или многократно замещен фтором; R9 - водород; или R8 и R9 совместно означают -СН=СН-O- или -CH2-CH2-O-, образуя вместе с атомами углерода, к которым они присоединены, Сус2 - фуранил или дигидрофуранил, соответственно; а также к их фармацевтически приемлемым солям. Данные соединения пригодны для приготовления лекарственных средств для снижения уровня сахара в крови, в частности для приготовления лекарственных средств для лечения диабета типа 1 и типа 2. 3 н. и 2 з. п. ф-лы, 1 табл.

Формула
Документы, цитированные в отчёте о поиске
О-арилглюкозидные ингибиторы sglt2 и способ их применения

Комментарии