Композиции и способы для усиления имунного ответа на антигены - RU2537188C2
Код документа: RU2537188C2
Чертежи















Описание
Уровень техники
Основным назначением вакцины является обеспечение длительного иммунитета против патологического состояния. В идеале вакцины обеспечивают функционально активные антитела, вызывают клеточный иммунитет и активируют Т- и В-лимфоциты с высокоспецифичной реактивностью и "памятью" для обеспечения защиты при дальнейшем столкновении с антигеном.
Адъюванты - это вакцинные добавки, которые неспецифически усиливают иммунный ответ. Механизмы, которыми адъюванты усиливают иммунную систему, сильно различаются. Адъюванты можно классифицировать как "иммуномодуляторные" или системы "доставки антигена". Иммуномодуляторные адъюванты примируют иммунную систему, регулируя действие иммунных клеток через изменение продукции лимфокинов. Системы доставки антигена, с другой стороны, работают для доставки антигена к соответствующим иммунным клеткам. Кроме того, адъюванты могут увеличивать скорость или продолжительность иммунного ответа, модулировать авидность антител, специфичность, распределение изотипов или подклассов, стимулировать клеточный иммунитет, активировать мукозальный иммунитет или усиливать иммунные ответы у незрелых в иммунологическом отношении или пожилых лиц. Адъюванты могут влиять на врожденные, гуморальные или клеточные иммунные ответы либо их комбинации.
Сущность изобретения
Авторы изобретения обнаружили, что синтетический гликолипид определенного класса, при использовании его в сочетании с препаратом вакцины, способен активировать как гуморальные, так и клеточные иммунные ответы при введении субъекту. Соответственно, изобретением предусмотрены композиции, включающие соединения формулы I, представленной ниже:

где: R1 и R2 выбираются независимо из -Н и -ОН, х означает целое число от 18 до 26, а n - целое число от 10 до 15.
Также предусмотрены композиции, включающие соединение формулы I и антиген.
В другом аспекте изобретения предусмотрены способы усиления иммунного ответа на антиген у субъекта путем введения композиции, включающей соединение формулы I и антиген. Усиление иммунного ответа может представлять собой усиление гуморального иммунного ответа, ответа Т-клеток CD4+, ответа цитотоксических Т-клеток CD8+ или активацию антигенпрезентирующих клеток (APCs). Иммунный ответ у субъекта усиливается относительно соответствующего контроля.
В следующем аспекте композиции изобретения вводятся внутримышечно.
Краткое описание фигур
На фиг.1 приведен график, отображающий уровень специфического лизиса Ova-специфичных клеток-мишеней в крови мышей, которым внутривенно (iv) вводили PBS-96, PBS-14 или PBS-11 вместе с или без Ova.
На фиг.2 приведен график, отображающий уровень специфического лизиса Ova-специфичных клеток-мишеней в крови мышей, которым iv вводили αGalCer, PBS-57, PBS-96 или PBS-14 вместе с или без Ova.
На фиг.3 приведен график, отображающий уровень специфического лизиса Ova-специфичных клеток-мишеней в крови мышей, которым внутримышечно (im) вводили αGalCer, PBS-57, PBS-96 или PBS-14 вместе с или без Ova.
На фиг.4А приведен график, отображающий накопление IFNγ в сыворотке мышей через 24 часа после иммунизации различными концентрациями PBS-57.
На фиг.4 В приведен график, отображающий накопление IFNγ в сыворотке мышей через 24 часа после иммунизации различными концентрациями PBS-14.
На фиг.4С приведен график, отображающий накопление IFNγ в сыворотке мышей через 24 часа после иммунизации различными концентрациями PBS-96.
На фиг.4D приведен график, отображающий накопление IFNγ в сыворотке мышей через 24 часа после иммунизации различными концентрациями αGalCer.
На фиг.5 приведен сравнительный график накопления IFNγ в сыворотке мышей через 24 часа после иммунизации с помощью 100 нг PBS-57, PBS-96, PBS-14 или PBS-11.
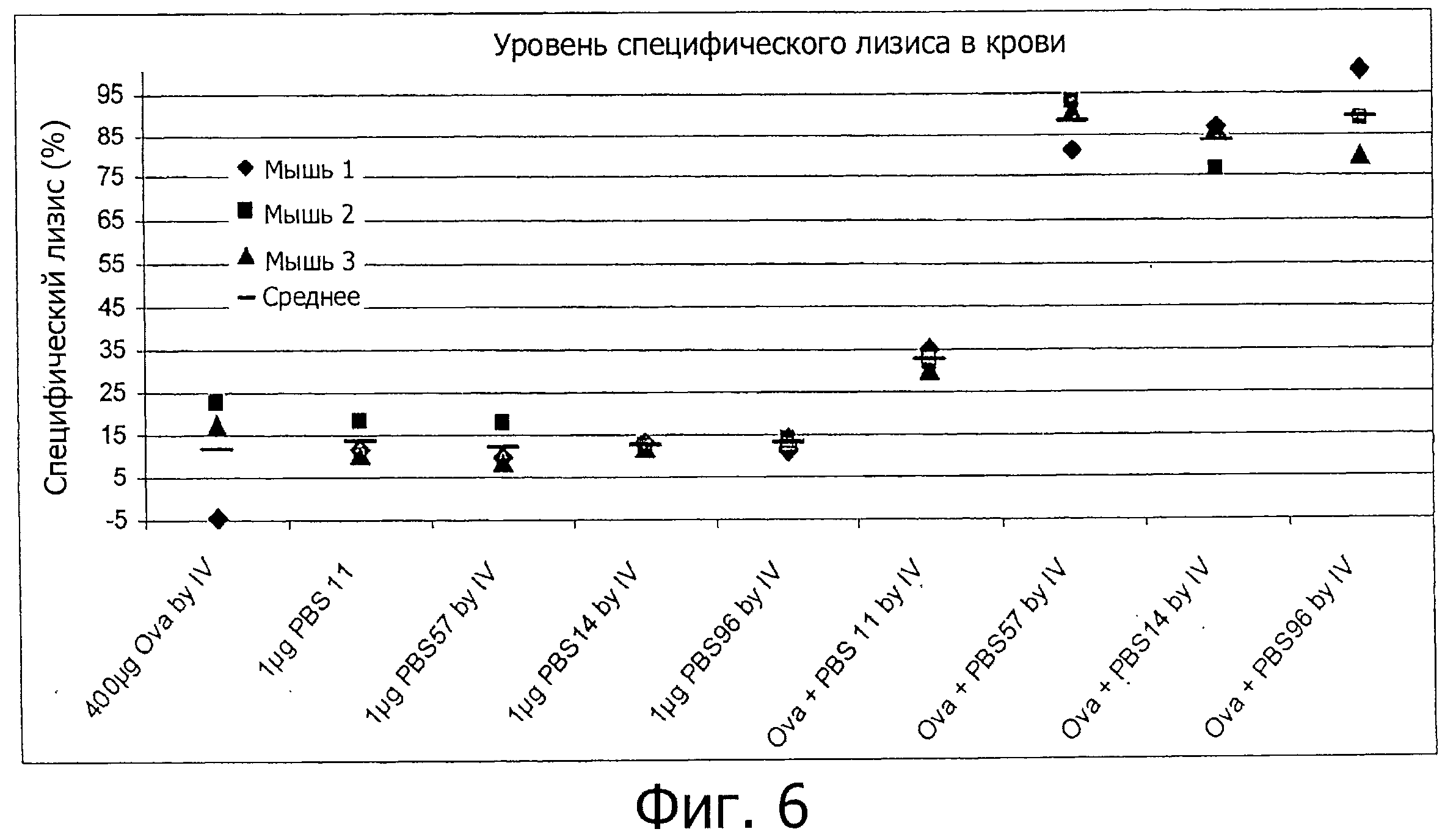
На фиг.6 приведен график, отображающий специфический лизис Ova-специфичных клеток-мишеней в крови мышей, которым iv вводили PBS-11, PBS-57, PBS-96 или PBS-14 вместе с или без Ova.
На фиг.7 приведен график, отображающий специфический лизис Ova-специфичных клеток-мишеней в крови мышей, которым im вводили 100 нг указанного адъюванта вместе с или без Ova.
На фиг.8 приведен график, отображающий специфический лизис Ova-специфичных клеток-мишеней в крови мышей, которым im вводили 10 нг указанного адъюванта вместе с или без Ova.
На фиг.9 приведен график, отображающий в процентах содержание Т-клеток CD8+, реагирующих на пентамер SIINFEKL, в крови мышей, которым im вводили 1 мкг указанного адъюванта вместе с или без Ova.
На фиг.10 приведен график, отображающий в процентах содержание Т-клеток CD8+, реагирующих на пентамер SIINFEKL, в крови мышей, которым im вводили 100 нг указанного адъюванта вместе с или без Ova.
На фиг.11 приведен график, отображающий титр IgG1 в крови мышей, которым im вводили 100 нг указанного адъюванта вместе с или без Ova.
На фиг.12 приведен график, отображающий титр IgG2a в крови мышей, которым im вводили 100 нг указанного адъюванта вместе с или без Ova.
На фиг.13 приведены структурные формулы PBS-14, PBS-96, PBS-11, PBS-57 и αGalCer.
Раскрытие сущности изобретения
Адъюванты повышают иммуногенность антигенов в препаратах вакцин различным образом. Эффективный адъювант также должен быть полезным при комбинировании с широким кругом антигенов для усиления иммунного ответа, вызванного введением антигена. Например, в случае токсинов требуется хороший гуморальный иммунитет. В случае внутриклеточных бактерий важен клеточный иммунитет, обусловленный главным образом цитотоксическими Т-клетками и клетками Th1. В случае вирусных инфекций и гуморальный, и клеточный иммунитет существенны для контролирования инфекции. Способность адъюванта усиливать не только гуморальные, но и клеточные иммунные ответы повышает вероятность приобретения долговременного иммунитета.
Различные липиды были исследованы на предмет адъювантных свойств. Многие природные и синтетические липидные молекулы подвергаются обработке антигенпре-зентирующими клетками и презентируются молекулами CD1 клеткам NKT. Прототипом соединений, используемых для изучения активации клеток NKT in vitro и in vivo, является KRN7000 - α-галактозилцерамид ("αGalCer"), полученный из морской губки Agelas mauritianus. Другие недавно идентифицированные соединения включают изо-глоботригексозилцерамид ("iGB3"), который является эндогенным гликолипидом, и модифицированные 6'-амино-6'-дезоксигалактозилцерамиды, как описано в заявке РСТ PCT/US07/66250, содержание которой включено сюда путем ссылки. Эти соединения активируют клетки NKT и усиливают ответы на цитокины in vitro. Однако в контексте вакцинации in vivo мало что известно об эффективности этих соединений как липидных адъювантов.
Авторы изобретения обнаружили, что гликосфинголипиды формулы I, содержащие аминогруппу и цепь ненасыщенной жирной кислоты, вне ожидания обладают способностью стимулировать и клеточные, и гуморальные иммунные ответы in vivo. Кроме того, соединения формулы I способны стимулировать иммунный ответ на слабый номинальный антиген для выработки антител и одновременно обеспечить клеточно-опосредованный лизис клеток, экспрессирующих специфические поверхностные антигены. Два соединения формулы I, обозначенные PBS-96 и PBS-14, как оказалось, стимулируют и клеточные, и гуморальные иммунные ответы in vivo. Эти соединения также стимулировали иммунный ответ на слабый номинальный антиген для выработки антител и обеспечения клеточно-опосредованной реакции. Кроме того, как оказалось, эти соединения вызывали более сильный ответ при внутримышечном введении или при меньших дозах по сравнению с другими гликосфинголипидами, такими как PBS-57 и αGalCer.
В одном воплощении изобретения предусмотрены композиции, включающие соединения формулы I:
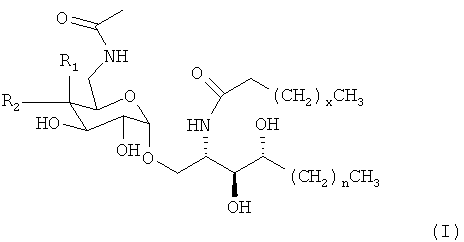
где: R1 и R2 выбираются независимо из -Н и -ОН, х означает целое число от 8 до 26, а n - целое число от 10 до 15. Соединения формулы I обычно содержат амидогруппу в положении С6 молекулы галактозы или глюкозы и цепь насыщенного ацила на церамидной части соединения.
Композиция может дополнительно включать физиологически приемлемый носитель. "Физиологически приемлемым" является такой носитель, который пригоден для введения in vivo (напр., перорального, трансдермального или парентерального введения) или для применения in vitro, напр., на культуре клеток. Подходящими физиологически приемлемыми носителями для введения in vivo являются вода, буферные растворы и растворы глюкозы, среди прочего. Дополнительными компонентами композиций могут быть наполнители, как-то стабилизаторы, консерванты, разбавители, эмульгаторы или скользящие вещества в дополнение к физиологически приемлемому носителю. Подходящими наполнителями являются Tween 20, DMSO, сахароза, L-гистидин, полисорбат 20 и сыворотка. Предпочтительно соединения формулы I заключаются в липосомы. Предпочтительно липосомы относятся к типу SUV, состоящему из фосфатидилхолина (PC)/ фосфатидилглицерина (PG)/ холестерина в соотношении 8 мкмоль/ 2 мкмоль/ 5 мкмоль/ 1 мг. Специалистам в этой области должно быть ясно, что соединения формулы I могут входить в состав различных лекарственных форм для введения субъектам.
В другом воплощении изобретения предусмотрены способы усиления иммунного ответа на антиген у субъекта путем введения композиции, содержащей соединение формулы I и антиген. При этом "субъектом" является млекопитающее, напр., мышь, более предпочтительно человек. "Усиление иммунного ответа" означает способность соединения усиливать гуморальный и/или клеточный иммунный ответ на антиген у субъекта относительно соответствующего контроля. Повышение активации антиген-презентирующих клеток также входит в усиление иммунного ответа у субъекта. Для определения того, что иммунный ответ возрастает относительно контроля, проводится количественное сравнение сигнала в образце от субъекта, вакцинированного антигеном и соединением, с сигналом в образце от субъекта, вакцинированного только антигеном. Иммунный ответ на антиген можно измерить различными способами, которые должны быть известны специалистам. В примерах иммунный ответ измеряется методом цитотоксического лизиса специфических клеток, методом связывания пентамера или методом ELISA, выполнение которых является обычным делом для специалистов.
В определенных воплощениях иммунный ответ возрастает по меньшей мере на 25%, на 30%, на 50%, на 60%, на 65%, на 70%, на 75%, на 80%, на 85%, на 90%, на 95%, на 100%, на 150%, на 200%, на 400%, на 500%, на 750% или на 1000% относительно соответствующего контроля. Подходящим контролем является субъект, которому был введен антиген, но не композиция по изобретению. Возрастание в процентах можно рассчитать по следующей формуле:
[(значение, представляющее иммунный ответ у субъекта после обработки композицией, содержащей соединение формулы I) - (значение, представляющее иммунный ответ в контроле)/(значение, представляющее иммунный ответ у субъекта после обработки композицией, содержащей соединение формулы 1)]×100.
В настоящем изобретении термины "введение" и "совместное введение" обозначают введение адъюванта и антигена одновременно, т.е. в одно и то же время, либо поочередно, т.е. введение адъюванта с последующим введением антигена или введение антигена с последующим введением адъюванта. После введения адъюванта или антигена другой компонент может вводиться практически сразу же либо по прошествии эффективного периода времени, причем эффективный период времени означает промежуток времени, отведенный на реализацию максимальной пользы от введения компонентов. С другой стороны, адъювант и антиген могут входить в состав одной лекарственной формы.
Антигеном может быть полипептид, полинуклеотид или молекула углевода либо их комбинация, к примеру, гликопротеид. Антиген предпочтительно происходит из возбудителя инфекции (напр., патогенного микроорганизма), опухоли, эндогенной молекулы (напр., "собственной" молекулы) или, в целях исследования, номинального антигена типа овальбумина (который обозначается как "OVA"). Предпочтительно антиген заключен в самой вакцине. Композиции вакцин предпочтительно составляются так, чтобы они включали соединение формулы I. "Вакцина" означает такую композицию, которая при введении субъекту вызывает клеточный или гуморальный иммунный ответ. Фармацевтические композиции, используемые в связи с изобретением, предпочтительно включают соединение формулы I и вакцину. В некоторых воплощениях фармацевтические композиции, используемые в связи с изобретением, предпочтительно включают PBS-96 и антиген либо PBS-14 и антиген. Структуры PBS-96 и PBS-14 представлены на фиг.13. PBS-96 и PBS-14 активируют клетки NKT in vitro и in vivo. Они содержат амидогруппу в положении С6 галактозы и цепь насыщенного ацила на церамидной части соединения. PBS-96 и PBS-14 повышают ответ Т-клеток CD8+ на антиген и вызывают высвобождение IFN-γ in vivo. Кроме того, PBS-96 и PBS-14 неожиданно оказались лучше других гликосфинголипидов при использовании их в низких концентрациях, а также при внутримышечном введении.
Композиции, включающие соединения формулы I, могут быть составлены с использованием различных препаративных методов и неактивных ингредиентов, известных специалистам (Remington's Pharmaceutical Sciences, Mack Publishing Co., 2000, включено путем ссылки). Композиции изобретения также могут содержать подходящую систему доставки антигенов для доставки антигена к иммунным клеткам. Системы доставки антигенов известны в этой области, к ним относятся, среди прочего, MVA (модифицированный вирус анкара), аденовирусы, лентивирусы, переносные субъединицы коклюшного токсина или шига-токсина либо инкапсулированные антигеном липосомы. Эффективная дозировка соединения формулы I в вакцинной композиции может быть установлена специалистами, но, как правило, она составляет от 1 нг до 10000 мкг на кг массы тела, хотя обычно составляет 1000 мкг или меньше на кг массы тела. В некоторых воплощениях эффективная дозировка составляет от 10 нг до 1000 мкг на кг массы тела. В другом воплощении эффективная дозировка составляет от 100 нг до 500 мкг на кг массы тела. В другом воплощении эффективная дозировка составляет от 1 мкг до 250 мкг на кг массы тела. В целях исследования подходящая дозировка для мыши составляет от 1 нг до 1 мкг соединения формулы I на дозу 100 мкл в зависимости способа введения. Например, для внутривенного введения подходит дозировка в 100 нг на мышь, а для внутримышечного введения эффективной оказалась дозировка всего лишь в 10 нг. Композиции, содержащие соединения формулы I, можно вводить в виде однократной дозы или дробными дозами на протяжении нескольких недель или месяцев.
В композиции может входить один или несколько антигенов или же они могут вводиться независимо. В настоящем изобретении "антиген" означает такую молекулу, которая вызывает иммунный ответ у субъекта, которому она введена. Следует иметь в виду, что дозировка антигена зависит от конкретного антигена и от возраста и иммунного статуса субъекта, а также от других существенных факторов, которые могут быть установлены специалистами в этой области.
В качестве антигенов можно использовать целые микроорганизмы или их части (напр., мембранные "тени", неочищенные мембранные препараты, лизаты и другие препараты микроорганизмов). Предпочтительно антигены получают из ослабленных или убитых возбудителей инфекций. К подходящим возбудителям инфекций, из которых можно получить антигены, относятся патогены и такие микроорганизмы, как бактерии, паразиты и вирусы. В некоторых случаях подходящие антигены получают из вирусных патогенов, связанных с заболеваниями человека, в том числе HIV/AIDS (Retroviridae, напр., молекулы gpl20 из изолятов HIV-1 и HIV-2, HTLV-1, HTLV-11), вирусов гриппа (Orthomyxoviridae, напр., типа А, В и С), герпесвирусов (напр., вируса простого герпеса, гликопротеидов gB, gD и gH из HSV-1 и HSV-2), ротавирусов (Reoviridae), возбудителей респираторных инфекций (вируса парагриппа и респираторно-синцитиального вируса), полиомиелита (Picomaviridae, напр., полиовирусов, риновирусов), кори и эпидемического паротита (Paramyxoviridae), краснухи (Togaviridae, напр., вируса краснухи), гепатита (напр., вирусов гепатита типа А, В, С, D, Е и/или G), цитомегаловируса (напр., gB и gH), гастроэнтерита (Caliciviridae), желтой лихорадки и лихорадки Западного Нила (Flavi-viridae), бешенства (Rhabdoviridae), корейской геморрагической лихорадки (Bunyaviridae), венесуэльской лихорадки (Arenaviridae), вируса бородавки (Papillomavirus), вируса иммунодефицита обезьян, вируса энцефалита, вируса ветряной оспы, вируса Эпштейна-Барр и других семейств вирусов, включая Coronaviridae, Bimaviridae и Filoviridae.
Подходящие антигены бактерий и паразитов можно получить из известных возбудителей болезней и использовать их в композициях для вакцинации против таких болезней, как дифтерия, коклюш, столбняк, туберкулез, бактериальная или грибковая пневмония, средний отит, гонорея, холера, брюшной тиф, менингит, мононуклеоз, чума, шигеллез или сальмонеллез, болезнь легионеров, болезнь Лайма, проказа, малярия, анкилостомоз, онхоцеркоз, шистосомоз, трипанозомоз, лейшманиоз, жиардиаз, амебиаз, филариоз, боррелиоз и трихинеллез. Можно получить и другие антигены из таких нестандартных патогенов, как возбудители куру, болезни Крейтцфельда-Якоба (CJD), скрэпи, заразной энцефалопатии норки и синдрома хронического исхудания, либо из таких заразных белковых частиц, как прионы, связанные с коровьим бешенством.
Другие специфические патогены, из которых можно получить антигены, включают М. tuberculosis, Chlamydia, N. gonorrhoeae, Shigella, Salmonella, Vibrio cholerae, Treponema pallidum, Pseudomonas, Bordetella pertussis, Brucella, Francisella tularensis, Helicobacter pilori, Leptospira interrogans, Legionella pneumophila, Yersinia pestis. Streptococcus (тип А и В), пневмококков, менингококков, Haemophilus influenza (тип b), Toxoplasma gondii, Moraxella catarrhalis, возбудителей венерической гранулемы и актиномикоза; грибковые патогены включают возбудителей кандидоза и аспергиллеза; паразитические патогены включают Taenia, трематод, аскарид, возбудителей амебиаза, жиардиаза, Cryptosporidium, Schistosoma, Pneumocystis carinii, возбудителей трихомоноза и трихинеллеза. Настоящее изобретение также может применяться для обеспечения хорошего иммунитета против многочисленных ветеринарных заболеваний типа ящура, коронавирусов, Pasteurella multocida, Helicobacter, Strongylus vulgaris, Actinobacillus pleuropneumonia, вируса бычьей вирусной диареи (BVDV), Klebsiella pneumoniae, Е. coli, Bordetella pertussis, parapertussis и bronchiseptica.
В других воплощениях антигены, включаемые в композиции, которые могут применяться в связи с настоящим изобретением, представляют собой опухолевые антигены либо аутологичные или аллогенные целые опухолевые клетки. Предпочтительно опухолевый антиген представляет собой опухолеспецифичный антиген (TSA) или опухолесвязанный антиген (ТАА). Известно несколько опухолевых антигенов вместе с их профилями экспрессии, поэтому их можно выбирать в зависимости от подлежащего лечению типа опухоли. Неограничивающими примерами опухолевых антигенов являются cdk4 (меланома), β-катенин (меланома), каспаза-8 (плоскоклеточная карцинома), MAGE-1 и MAGE-3 (меланома, рак молочной железы, глиома), тирозиназа (меланома), поверхностный идиотип Ig (напр., BCR) (лимфома), Her-2/neu (рак молочной железы, яичников), MUC-1 (рак молочной железы, поджелудочной железы) и HPV E6 и HPV E7 (рак шейки матки). Дополнительными подходящими опухолевыми антигенами являются простато-специфичный антиген (PSA), сиалил-Tn (STn), белки теплового шока и связанные с ними опухолевые пептиды (напр., gp96), молекулы ганглиозидов (напр., GM2, GD2 и GD3), онкофетальный антиген (СЕА) и MART-1.
Как это известно специалистам, фармацевтические композиции предпочтительно составляются так, чтобы они были совместимы с намеченным способом введения. Примеры подходящих способов введения включают парентеральное введение, напр., внутривенное, интрадермальное, подкожное, внутримышечное, пероральное (напр., ингаляция), энтеральное, трансдермальное (топическое), трансмукозальное и ректальное введение. Как видно из примеров, соединения формулы I, как оказалось, обеспечивают неожиданно сильное усиление иммунного ответа после внутримышечного введения.
Следующее воплощение изобретения составляет способ стимулирования гуморального иммунного ответа на антиген. Способ включает совместное введение субъекту соединения формулы I и антигена, как описано выше. В настоящем изобретении "гуморальный иммунный ответ" означает вырабатывание антител В-клетками и сопровождающие его вспомогательные процессы, в том числе активацию Th2 и продукцию цитокинов, образование центра размножения и переключение изотипа, созревание аффинности и образование клеток "памяти". Для определения того, что гуморальный иммунный ответ активирован, проводится количественное сравнение сигнала в образце от субъекта, которому вводили антиген и соединение формулы I, с сигналом в образце от субъекта, которому вводили только антиген. Гуморальный иммунный ответ можно оценить путем измерения эффекторных функций антител, включая нейтрализацию патогена или токсина, классическую активацию комплемента, запуск фагоцитоза опсонином и элиминацию патогена. Антитела, вырабатываемые в ответ на совместное введение соединения формулы I и антигена, могут быть любого типа, напр., IgM, IgA или IgG (как-то IgG1 или IgG2). Гуморальный иммунный ответ можно определять любым известным количественным методом, напр., ELISA, методом простой радиальной иммунодиффузии (SRID), ферментного иммуноанализа (EIA) или методом ингибирования гемагглютинации (HAI).
Следующее воплощение изобретения составляет способ активации Т-лимфоцитов CD4+ у субъекта. Как понимается в этой области, Т-клетки CD4+, или "хелперные Т-клетки", - это клетки, которые распознают антигены, презентированные маркером главного комплекса гистосовместимости (МНС) класса II на поверхности антиген-презентирующих клеток, и секретируют лимфокины для стимуляции как клеточной, так и антительной ветвей иммунной системы. Активация Т-клеток CD4+ вызывает секрецию лимфокинов, переключение изотипа иммуноглобулинов, созревание аффинности иммунного ответа, активацию макрофагов и повышение активности нормальных клеток-киллеров (NK) и цитотоксических Т-клеток (CTL). Лимфокины - это белки, секретируемые лимфоцитами, которые влияют на их собственную активность и/или активность других клеток. К лимфокинам относятся интерлейкины и цитокины, напр., IL-2, IL-4, IL-5, IL-6, IL-10, IL-12 или IFNγ. Для определения того, что Т-лимфоциты CD4+ активированы, проводится количественное сравнение сигнала в образце от субъекта, вакцинированного антигеном и соединением формулы I, с сигналом в образце от субъекта, вакцинированного только антигеном. Методы определения активации Т-клеток CD4+ известны в этой области.
Следующее воплощение изобретения составляет способ активации Т-лимфоцитов CD8+ у субъекта. Т-лимфоциты CD8+ распознают антигены, презентированные молекулами МНС класса I (которые есть на всех имеющих ядро клетках). Вовлечение пептидного комплекса МНС класса I приводит к доставке литических гранул на клетки-мишени, что вызывает лизис клеток-мишеней. Методы определения активации Т-клеток CD8+ известны в этой области, к ним относятся методы ELISPOT, ELISA, метод FACS для связывания тетрамера/пентамера и методы по цитотоксичности. С другой стороны, можно использовать модель на мышах для определения активации Т-клеток CD8+ флуоресцентным методом по измерению обусловленной клетками цитотоксичности, как описано в Hermans et al., 2004, Journal of Immunologic Methods 285: 25-40, включенной путем ссылки во всей полноте. В этом методе мышей иммунизируют в день 0 вакциной с исследуемым соединением или без него. Создаются сингенные клетки-мишени путем выделения спленоцитов из второй партии мышей и мечения клеток двумя разными клеточными флуоресцентными красителями либо при высокой и низкой концентрации одного флуоресцентного красителя, напр., CFSE или CMTMR. Один комплект клеток-мишеней нагружают специфичными к антигену пептидами, а второй комплект клеток-мишеней нагружают посторонним пептидом. Две популяции клеток-мишеней смешивают в равных количествах и вводят иммунизированным мышам. Через 24 часа мышей забивают и получают спленоциты и пробы крови. Уровень каждого комплекта клеток-мишеней анализируют методом проточной цитометрии. Активация лимфоцитов CD8+ определяется путем сравнения числа клеток-мишеней в образце, вакцинированном антигеном и исследуемым соединением, с числом клеток-мишеней в образце от субъекта, вакцинированного только антигеном.
Другие аспекты изобретения станут понятными при рассмотрении нижеследующих неограничивающих примеров и сопровождающих фигур.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1. Тестирование на усиление ответа Т-клеток CD8+ под действием PBS-96, PBS-14 и PBS-11 при внутривенном введении на мышах
Использовали модель на мышах для тестирования in vivo ответа специфических цитотоксических Т-клеток (CD8+), вызванного исследуемыми адъювантными соединениями в сочетании с антигеном при внутривенном введении. В день 0 иммунизировали 8 групп по 3 мыши антигеном (овальбумин = Ova, grade VII, Sigma, St. Louis, МО) вместе с адъювантом или без него, только адъювантом или только носителем (контроль) в объеме 100 мкл PBS внутривенно (боковая хвостовая вена). Исследуемыми адъювантными соединениями были 1 мкг PBS-96, 1 мкг PBS-14, 1 мкг PBS-11 вместе с 50 мкг антигена - овальбумина (OVA) или без него.
Сингенные клетки-мишени получали путем выделения спленоцитов из второй партии самок мышей C57/B1/6J CD45.2 и мечения клеток при низкой концентрации (0,6 мкМ в течение 8 мин при 37°С) либо при высокой концентрации (6 мкМ в течение 8 мин при 37°С) флуоресцентного красителя CFSE. Популяцию, меченную при высокой концентрации CFSE, нагружали пептидом SIINFEKL при 5 мкМ (Ova-специфичный пептид, NeoMPS Inc., San Diego, CA) в течение 60 мин при 37°С. Популяцию, меченную при низкой концентрации CFSE, нагружали пептидом gp33-41 LCMV при 5 мкл (пептид не-Ova, NeoMPS Inc., San Diego, CA) в течение 60 мин при 37°С. Клетки-мишени смешивали при конечном соотношении 47:53 меченных при высокой концентрации CFSE клеток к меченным при высокой концентрации CFSE клеткам (всего 2×107 клеток на 100 мкл) и вводили внутривенно каждой из иммунизированных мышей на 10-й день. На 11-й день мышей забивали и выделяли спленоциты и брали пробы крови из глазничной пазухи. Вычисляли среднюю выживаемость в процентах нагруженных пептидом клеток-мишеней (меченных при высокой концентрации CFSE) относительно контрольной популяции по данным проточной цитометрии. Цитотоксическую активность выражали в процентах специфического лизиса (100 - средняя выживаемость нагруженных пептидом мишеней в процентах). На фиг.1 представлен уровень специфического лизиса клеток-мишеней в крови иммунизированных мышей. Только введение комбинации Ova с PBS-96 или PBS-14 приводило к цитотоксическому лизису Ova-специфичных клеток-мишеней. Напротив, введение PBS-11 не приводило к специфическому лизису клеток.
Пример 2. Сравнение усиления ответа Т-клеток CD8+ под действием PBS-96, PBS-14, PBS-11, PBS-57 и αGalCer при внутривенном и внутримышечном введении на мышах
Для определения способности исследуемых адъювантных соединений in vivo индуцировать специфический ответ цитотоксических Т-клеток (CD8+) при введении их в сочетании с антигеном исследуемые адъювантные соединения подвергали дополнительному анализу методом, описанным в Примере 1. В день 0 иммунизировали 18 групп мышей внутривенно (iv) (группы 1-9 по 3 мыши на группу) либо внутримышечно (im) (группы 10-18 по 6 мышей на группу) следующим образом:
Клетки-мишени смешивали при конечном соотношении 50:50 меченных при высокой концентрации CFSE клеток к меченным при высокой концентрации CFSE клеткам (1×107 клеток при каждой концентрации, всего 2×107 клеток на 100 мкл) и вводили внутривенно каждой из иммунизированных мышей на 10-й день. На 11-й день мышей забивали и брали пробы крови из глазничной пазухи. Лизис Ova-специфичных клеток-мишеней измеряли методом проточной цитометрии клеток периферической крови. Специфический лизис клеток определяли, как описано выше.
На фиг.2 представлены результаты у мышей при внутривенном введении. Средний Ova-специфичный цитотоксический ответ у мышей, получавших только Ova, составил 11,8±14,4%, у получавших Ova + αGalCer - 79,8±0,8%, у получавших Ova + PBS-57 - 88,1±6,2%, у получавших Ova + PBS-14 - 83,3±6,1%, у получавших Ova + PBS-96 - 89,2±10,3%. Результаты показывают, что PBS-14 и PBS-96 индуцировали Ova-специфичные цитотоксические ответы in vivo столь же эффективно, как и PBS-57.
На фиг.3 представлены результаты у мышей при внутримышечном введении. Средний Ova-специфичный цитотоксический ответ у мышей, получавших только Ova, составил 1,60±14,33%, у получавших Ova + αGalCer - 5,85±11,01%, у получавших Ova + PBS-57 - 56,11±13,34%, у получавших Ova + PBS-14 - 52,07±29,56%, у получавших Ova + PBS-96 - 50,29±42,6%. Эти результаты свидетельствуют, что PBS-96 и PBS-14 вызывают иммунный ответ столь же эффективно, как и PBS-57 и при внутривенном, и при внутримышечном введении, причем PBS-14, PBS-96 и PBS-57 более эффективны, чем αGalCer при внутримышечном введении.
Пример 3. Стимулирование IFNγ in vivo исследуемыми адъювантными соединениями
Для определения способности исследуемых адъювантных соединений стимулировать высвобождение цитокинов in vivo эти соединения вводили внутривенно мышам C57BL/6 в различных концентрациях и через 24 часа измеряли продукцию IFNγ в сыворотке методом ELISA. В день 0 группы по 3 мыши иммунизировали внутривенно (хвостовая вена) следующим образом:
Через 24 часа после иммунизации у мышей брали пробы крови и определяли уровни IFNγ с помощью набора для ELISA. Использовали два набора для ELISA: набор Quantikine для IFNγ мыши (RD Systems) использовали для тестирования всех образцов, а набор ELISA mIFNγ (Diaclone) использовали для тестирования групп 1, 2, 3, 6, 7, 8, 11, 12, 13, 16, 17, 18 и 21. Все сыворотки перед работой разбавляли смесью для ELISA следующим образом:
Результаты выражали в виде концентрации IFNγ (пг/мл) в сыворотке с учетом разбавления. На фиг.4 представлены результаты с использованием набора Quantikine для IFNγ мыши фирмы RD Systems. На фиг.4А представлены результаты по уровню IFNγ у мышей, иммунизированных PBS-57, на фиг.4 В представлены результаты по уровню IFNγ у мышей, иммунизированных PBS-14, на фиг.4С представлены результаты по уровню IFNγ у мышей, иммунизированных PBS-96, а на фиг.4D представлены результаты по уровню IFNγ у мышей, иммунизированных αGalCer. При 0,1 нг все адъюванты-кандидаты вызывали высвобождение цитокина, но у мышей, иммунизированных αGalCer, вырабатывалось в 3-4 раза меньше IFNγ, чем у мышей, иммунизированных PBS-57, PBS-14 или PBS-96 (1540,57±397,53 пг/мл, 4398,05±880,86 пг/мл, 6669,31±1232,82 пг/мл, 5823,33±720,69 пг/мл, соответственно). При 1 нг исследуемого адъювантного соединения PBS-57, PBS-14 и PBS-96 проявляли больший ответ (в среднем 11425,98±833,04 пг/мл, 7481,15±3454,03 пг/мл и 6271,95±3737,53 пг/мл, соответственно), чем αGalCer (в среднем 3802,99±586,02 пг/мл). При 100 нг исследуемого адъювантного соединения PBS-57, PBS-96 и PBS-14 все давали больший уровень IFNγ, чем αGalCer (в среднем 21432,76±4312,76 пг/мл для PBS-57, 19679,89±1443,48 пг/мл для PBS-96, 19582,18±3421.20 пг/мл для PBS-14 и 7714,37±3529,07 пг/мл для αGalCer). При 1 мкг исследуемого адъювантного соединения PBS-57 проявлял меньший ответ (3353,45±867,57 пг/мл) по сравнению с дозой в 100 нг (21432,76±4312,76 пг/мл), тогда как PBS-14 или PBS-96 проявляли хотя и меньший, но все-таки сильный ответ (16392,53±5957,70 пг/мл и 17720,11±2869,97 пг/мл, соответственно), чем при дозе в 100 нг (19582,18±3421,20 пг/мл и 19679,89±1443,48 пг/мл, соответственно).
Другую партию мышей использовали для сравнения способности адъювантных соединений стимулировать высвобождение цитокина in vivo описанным выше методом. Пяти группам мышей C57BL/6 внутривенно вводили 100 нг PBS-57, PBS-14, PBS-96 или PBS-11 в 100 мкл PBS либо только 100 мкл одного PBS. Продукцию IFNγ в сыворотке измеряли через 24 часа методом ELISA. На фиг.5 представлены результаты для мышей, иммунизированных 100 нг PBS-11, PBS-96, PBS-14 и PBS-57. В целом при введении PBS-14 и PBS-96 уровень IFNγ оказался близким к PBS-57 и неожиданно большим, чем при введении PBS-11.
Пример 4. Сравнение усиления ответа Т-клеток CD8+ под действием PBS-96, PBS-14, PBS-11 и PBS-57
Для определения способности исследуемых адъювантных соединений in vivo индуцировать специфический ответ цитотоксических Т-клеток (CD8+) в сочетании с антигеном исследуемые соединения тестировали методом, описанным в Примере 1. В день 0 иммунизировали 9 групп мышей внутривенно (iv) следующим образом:
Клетки-мишени смешивали при конечном соотношении 50:50 меченных при высокой концентрации CFSE клеток к меченным при высокой концентрации CFSE клеткам (1×107 клеток при каждой концентрации, всего 2×107 клеток на 100 мкл) и вводили внутривенно каждой из иммунизированных мышей на 10-й день. На 11-й день мышей забивали и брали пробы крови из глазничной пазухи. Специфический лизис Ova-специфичных клеток-мишеней измеряли методом проточной цитометрии клеток периферической крови. Специфический лизис клеток определяли, как описано выше. Результаты представлены на фиг.6. В среднем лизис Ova-специфичных клеток составил 11,8±14,4% у мышей, получавших только Ova, 32,3±2,5% у мышей, получавших Ova+PBS-11, 88,1±6,2% у мышей, получавших Ova+PBS-57, 83,3±6,1% у мышей, получавших Ova+PBS-14 и 89,2±10,3% у мышей, получавших Ova+PBS-96. Эти результаты свидетельствуют, что PBS-14 и PBS-96 индуцируют цитотоксические ответы in vivo столь же эффективно, как и PBS-57 при внутривенном введении в сочетании с антигеном.
Пример 5. Сравнение усиления ответа Т-клеток CD8+ под действием убывающих количеств адъюванта при внутривенном введении
Для определения относительной способности исследуемых адъювантных соединений усиливать иммунный ответ проводили эксперимент, аналогичный описанному в Примере 2. В этом эксперименте в день 0 мышам вводили внутривенно убывающие количества адъюванта (100 нг и 10 нг, соответственно) в сочетании с 50 мкг антигена Ova следующим образом:
эксперимент А:
эксперимент B:
На 10-й день эксперимента вводили клетки-мишени, а на 11-й день брали пробы крови. Результаты эксперимента А с использованием 100 нг каждого адъюванта представлены на фиг.7, а результаты эксперимента В представлены на фиг.8. Из фиг.7 и 8 видно, что PBS-14 и PBS-96 неожиданно лучше других адъювантов усиливали ответ Т-клеток CD8+ на антиген в низких дозах при внутримышечном введении. Так, при внутримышечном введении Ova всего лишь с 10 нг PBS-14 или PBS-96 уровень специфического лизиса клеток-мишеней Т-клетками CD8+ все-таки составил более 60%, тогда как при введении Ova с таким же количеством PBS-57, PBS-11 или αGalCer уровень специфического лизиса клеток-мишеней не отличался от контроля.
Пример 6. Сравнение усиления ответа Т-клеток CD8+ под действием убывающих количеств адъюванта при внутримышечном введении
Для проверки результатов, полученных методом анализа цитотоксичности in vivo, описанным в предыдущих примерах, проводили аналогичные эксперименты и определяли активацию Т-клеток CD8+, измеряя содержание Ova-специфичных Т-клеток CD8+ методом анализа пентамера. Вкратце, в день 0 мышам вводили внутримышечно указанные количества Ova и исследуемого адъювантного соединения в дозе 1 мкг либо 100 нг на мышь следующим образом:
эксперимент А:
эксперимент B:
На 14-й день делали вторую инъекцию, а на 21-й день брали пробы крови у мышей. Выделяли лимфоциты и проводили анализ методом FACS, используя для выявления Т-клеток CD8+, реагирующих на Ova, пентамер Н-2Kb SIINFEKL и антитело к CD8. Результаты эксперимента А представлены на фиг.9, а результаты эксперимента В представлены на фиг.10. Из фиг.9 видно, что при введении в дозе 1 мкг PBS-14, PBS-96 и PBS-57 повышали содержание Ova-специфичных Т-клеток CD8+ после вакцинации, тогда как PBS-11 и αGalCer были не столь эффективны. Из фиг.10 видно, что при меньшей дозе в 100 нг PBS-14 и PBS-96 неожиданно намного лучше усиливали ответ Т-клеток CD8+ на антиген, чем PBS-57, PBS-11 и αGalCer.
Пример 7. Сравнение усиления гуморального ответа после внутримышечной иммунизации с помощью адъюванта и антигена
Для оценки того, будут ли гуморальные и клеточные (хелперных Т-клеток CD4+) иммунные ответы возрастать при введении исследуемых адъювантов вместе с антигеном, измеряли ответы антител IgG1 и IgG2a у мышей, вакцинированных Ova вместе с исследуемыми адъювантами или без них. Мышам (по 6 на группу) внутримышечно вводили 50 мкг одного лишь Ova либо в сочетании со 100 нг указанного адъюванта (в качестве положительного контроля использовали адъювант Фрейнда (FA)) следующим образом:
Через 14 дней после введения брали пробы крови и проводили анализ на IgG1 и IgG2a методом ELISA, используя моноклональные антитела мыши, специфичные к изотипу IgG1 или IgG2a против Ova. Результаты представлены в виде титра антител в периферической крови в нг/мл. Результаты для IgG1 представлены на фиг.11, а для IgG2a - на фиг.12. Как видно из фиг.11, PBS-14, PBS-96 и PBS-57 все вызывали большой титр IgG1 и повышали титр Ova-специфичного IgG1 по сравнению с вакцинацией одним Ova либо Ova в сочетании с PBS-11 или αGalCer. Неожиданно оказалось, что PBS-14 и PBS-96 повышают титр Ova-специфичного IgG2a почти так же хорошо, как адъювант Фрейнда, и намного лучше, чем PBS-57.
Хотя композиции и способы настоящего изобретения были описаны в виде типичных воплощений, специалистам в этой области должно быть ясно, что в композиции и способы и в стадии или в последовательность стадий описанных в нем способов могут вноситься изменения, не отходящие от концепции, сути изобретения и не выходящие за его рамки. В частности, должно быть ясно, что описанные в нем вещества могут быть заменены определенными веществами, родственными им как в химическом, так и в физиологическом отношении, причем будут достигнуты такие же или близкие результаты. Все такие замены и модификации, понятные специалистам в этой области, считаются относящимися к сути, рамкам и концепции изобретения. Кроме того, все патенты и публикации, перечисленные или описанные в настоящем изобретении, включены в него во всей полноте посредством ссылки.
В настоящем описании и прилагаемой формуле изобретения формы единственного числа включает значения множественного, если только содержанием не предписано четко иное. Так, например, ссылка на "полинуклеотид" включает смесь из двух или больше полину клеотидов. Также следует отметить, что термин "или" обычно применяется в смысле, включающем "и/или", если только содержанием не предписано четко иное.
Все публикации, патенты и патентные заявки, процитированные в настоящем описании, показывают уровень рядовых специалистов в той области, к которой относится настоящее изобретение. Все публикации, патенты и патентные заявки прямо включены в него посредством ссылки в той степени, как если бы каждая индивидуальная публикация или патентная заявка была конкретно и индивидуально включена посредством ссылки. В случае противоречий между настоящим описанием и включенными в него патентами, публикациями и ссылками должно превалировать настоящее описание.
Также определенно понимается, что любое численное значение, приведенное в настоящей заявке, включает все значения от меньшего до большего, т.е. все возможные комбинации численных значений между наименьшим и наибольшим из приведенных значений следует считать прямо указанными в настоящей заявке.
Реферат
Группа изобретений относится к медицине и касается иммуностимулирующей композиции, включающей соединение формулы I; способа усиления иммунного ответа на антиген у субъекта, включающего введение субъекту антигена и композиции. Усиление иммунного ответа может представлять собой усиление гуморального иммунного ответа, ответа Т-клеток CD4+, ответа Т-клеток CD8+ или активацию антигенпрезентирующих клеток. Также представлен способ усиления иммунного ответа посредством внутримышечного введения антигена и композиции, включающей соединение формулы I. Группа изобретений позволяет достичь усиление иммунного ответа на антиген. 7 н. и 17 з.п. ф-лы, 7 пр., 13 ил.
Формула

где: R1 означает -H или -OH, R2 означает -H или -OH, x - целое число от 18 до 26, a n - целое число от 10 до 15.

Комментарии