Способ получения сукралозы - SU1635905A3
Код документа: SU1635905A3
Описание
Изобретение относится к биотехнологии , представляет собой получение сахаристого продукта с высоким .подслащивающим действием - сукралозы (,4,1 -6 -трихлор-4-1 ,б -тридеоксига- лактогахароза, известная под обозначением ТГС (TDS)), которая примерно в 600 раз слаще сахарозы.
Цель изобретения - упрощение процесса путем минимизации образования побочных продуктов.
Способ заключается в инкубировании хлорированного производного сахарозы ТХР (раствор 0-о(-В-6-хлор-6-дез- оксигалактопиранозил-(1-6)-с(-В-4- хлор-4-дезоксилактопиранозил-(1-2)- .ji-D-1,6-дихлор-1,6-дидезоксифрукто- фуранозида) в присутствии фермента,
служащего для удаления 6-хлор-дезок- сигалактозильного остатка из положения 6.
Особый интерес представляют галак- тозидазы. Мелибиозы представляют гораздо меньший интерес вследствие того , что хотя мелибиоза (О-об-О-галак- топиранозил-(1 )-о -В-глюкопирано- за) представляет собой компонент ра- финозы, но хлорированная ТХР имеет обращенную конфигурацию. Найдено, что многие из указанных энзимов не обладают , какой-либо полезной активностью в отношении ТХР даже в тех случаях, когда они способны высвобождать сахарозу из рафинозы. Исследовано около 20 энзимов ряда 0 -галактозидаз, полученных из бактериальных, грибковых,
о со
СП
СО
Р
01
см
и растительных источников, однако только 8 из них обладали активностью в отношении гидролиза ТХР, причем все они происходили из грибковых источников , Активными энзимами были полученные из штаммов llortierella vinacea, Circinella muscae. Наиболее активным является Hortierella vinacea.разновидности rafiinoseutilizer (ATCC N 20034), поставляемой фирмой Хоккайдо Шугар Компани. Скорость реакции с участием ТХР в этом случае составляет лишь несколько процентов от скорости реакции с участием самой рафинозы. Однако, принимая во внимание значительные конформационные и конфигурационные различия между рафи- нозой и ТХР, даже эта скорость (или активность) является неожиданной и приводит к практически полному гидролизу ТХР в сукралозу.
Гранулированные клетки M.viracea разновидности raffinoseutilizer используются при производстве свекловичного сахара с 1968 г.
Энзиматическую обработку удобно осуществлять в водном растворе. Однако , хотя для осуществления реакции требуется присутствие воды, обнаружено , что к/ -галактозидаза может интенсивно гидролизовать ТХР в сукралозу и в ряде органических растворителей. Установлено, что энзим является наиболее стабильным и активным в несмешивающихся с водой органических растворителях , тогда как ТХР хорошо растворяется только в гидрофильных растворителях . Таким образом, наиболее подходящими растворителями для гидролиза ТХР являются гидрофильные несмешивающиеся с водой органические растворители , например этилацетат, н-бу- танол и метилизобутилкетон. Так, например , скорость гидролиза ТХР, определенная по числу обращения катализатора (Кко-) в этилацетате, предварительно насыщенном водным буфером (который дает достаточное количество воды для гидролиза), аналогична скорости гидролиза в водном буфере. Предполагается что энзим сохраняет полную каталитическую активность и в том случае, когда он суспендирован в органическом растворителе. Каждый из указанных органических растворителей, будучи предварительно насыщенным водным буфером, остается в виде единой органической фазы. Энзим функциониру0
5
0
5
0
5
0
5
0
ет в органической фазе. Гидрофильные несмешивающиеся с водой растворители (например этилацетат, н-бутанол и метилизобутилкетон ) оказались способными поддерживать высокую каталитическую активность и высокую растворимость ТХР.
В табл. 1, приведены данные раст- воримости при 55°С ТХР и сукралоэы в различных растворителях (все они предварительно насыщались водным буфером ) по сравнению с водным буфером. Совершенно ясно, что растворимость ТХР становится максимальной в случае использования гидрофильных несмешивающихся с водой растворителей.
К числу прочих преимуществ проведения процесса гидролиза в органической среде относится также увеличение термической стабильности (стабильность bi-галактозидазы при 55 с в этилацетате примерно на 50% выше, чем в водном растворе) и растворимости субстрата (растворимость ТХР в указанных выше растворителях составляет свыше 50% (мае/объем), тогда как в водном буфере растворимость ТХР составляет только 15% (мае/объем)).
В случае использования как водных, так и органических систем обработку следует проводить при оптимальных значениях температуры и рН для данного энзима, которые в случае использования 0(,-галактозидазы М.vinacea составляют примерно 55СС и рН 4,5-5,5. В органических растворителях, насыщенных водным буфером, эти значения рН относятся к рН водного буфера. При указанной температуре и рН 5,0 обнаружено, что получаемая сукралоза не подвергается распаду .
Энзим можно растворить или диспергировать в водной системе в виде экстракта , не содержащего клеток, получаемого , например, в результате обработки гранул ультразвуком, или же можно использовать его в иммобилизованном виде, например в виде гранул, помещенных в колонны или расположенных слоями. В органических системах энзим остается в нерастворимой форме и может быть повторно использован в слоях или колоннах.
Отделение получаемой в качестве продукта сукралозы осуществляют любым известным способом, например путем испарения и экстракции в органи
.ческом растворителе, применения хро- матографических методов, селективной кристаллизации из водных или неводных систем.
Пример 1. Получение сукрало- зы в водном растворе (в микроколичествах ) .
Тетрахлоргалакторафинозу в количестве 20 мг помещают в завинчивающийся сверху сосуд, содержащий 2 мл 0,1 М цитрат-фосфатного буфера (рН 5,0). Получают раствор концентрацией 1% (мае/объем). Указанное количество воды поддерживается постоянным в процессе последующего инкубирования путем добавления необходимого ее количества тогда, когда это потребуется .
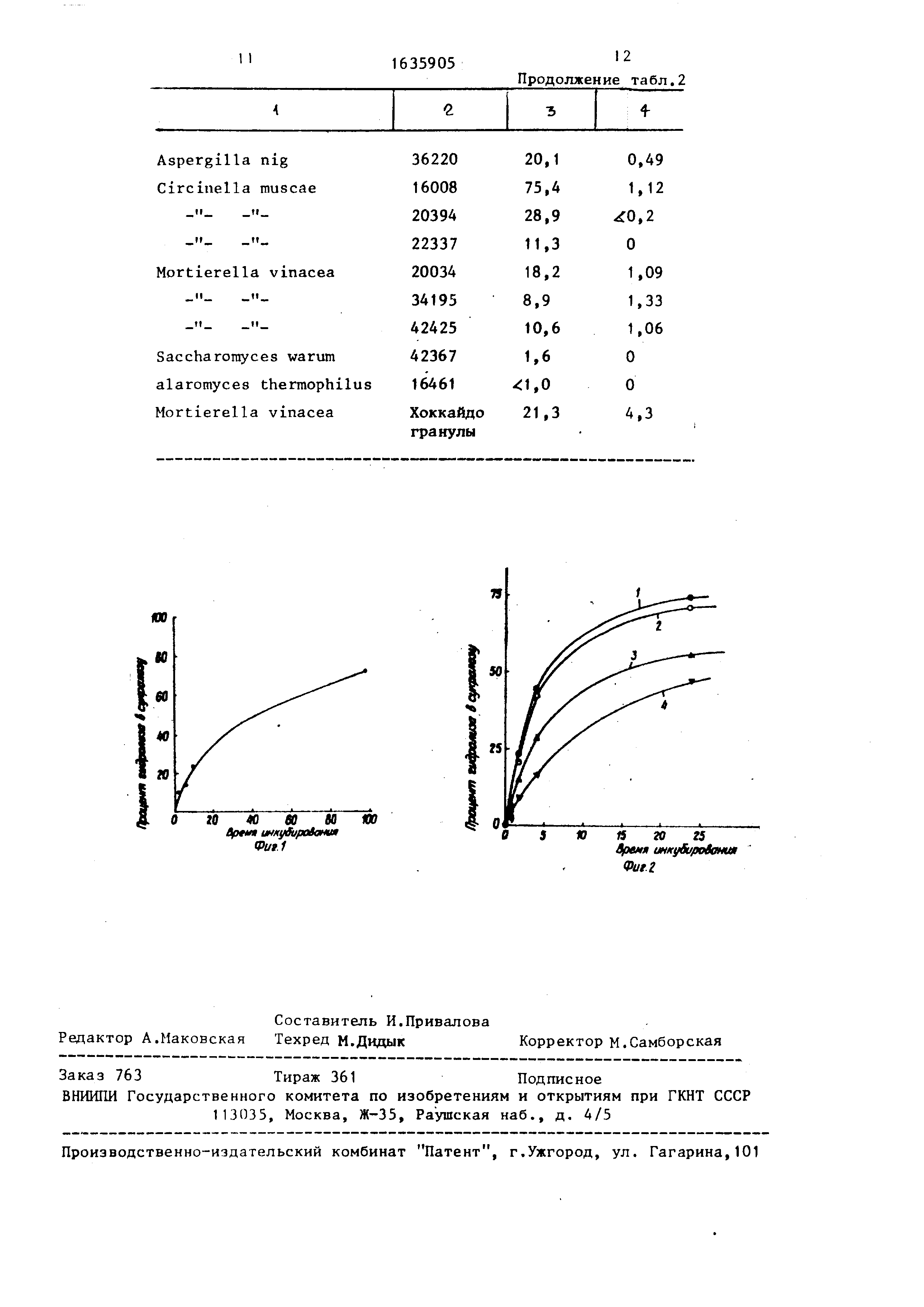
К смеси добавляют 10 мг 0(.-галак- тоэидазы в форме гранулированных клеток Mortierella vinacea разновидности raffinoseutilizer ATCC № 20034 (поставляется фирмой Хоккайдо Шугар Компани, Япония), и инкубируют полу- ченную смесь в течение 100 ч при . Периодическое наблюдение за степенью гидролиза осуществляют, используя метод тонкослойной хроматографии, для чего из реакционной смеси отбирают аликвоты по 250 мкл, которые элюируют смесью этилацетат:этанол:вода (45:5: :1), или метод жидкостной хроматографии под высоким давлением на колонке Уотерс Декстропак С 18 с обратной фазой, применяя для элюирования 20%- ный ацетонитрил (объем/объем). Содержание продуктов измеряют с помощью детектора, основанного на определении показателя преломления. Полученные результаты приведены на фиг.1. Так, было найдено, что примерно 53% продукта прогидролизовано спустя 48 ч и примерно 70% - спустя 90 ч. Продукты разделяют хроматографическим способом, причем помимо сукралозы обнаружены 6-хлоргалактоза и ТХР. В этой системе ТХР можно использовать в количестве до 15% (мае/объем). В водном растворе данный энзим имеет константу Михаэли- са (Кц), равную 5,8 мм, и константу Кцдт равную 52,5 мг на г энзима в час.
Пример 2. Гранулы Mortierella vinacea разновидности raffinoseu- tilizer (ATCC № 20034) в количестве 3 г гидратируют в 0,1 М растворе цитрат-фосфатного буфера (рН 5,0), содержащего 5% (мае/объем) рафинозы,
0
5
0
5
0
5
0
5
0
и заполняют смесью колонку размерами ,9 см с объемом слоя 7 см3 , обо- рудованную водяной рубашкой. В указанной колонке поддерживают температуру , равную 55РС, с помощью циркуляционного водяного насоса. При использовании указанной колонки для гидро-, лиза ТХР в сукралозу было найдено, что время полупревращения (до 50% конверсии) составляет 13 суток.
Пример 3. Микроорганизмы, пригодные для осуществления гидролиза ТХР в сукралозу.
..Микроорганизмы, обладающие активностью в качестве о -галактозидаз, получены из коллекции культур АТСС. Их выращивали в колбах емкостью 100 мл, содержащих среду на основе минеральных солей 1 г/л экстракта дрожжей и 5 г/л расЪинозы, встряхивая при температуре .
Клетки отбирают посредством центрифугирования (5000 об/мин при центрифугировании в течение 10 мин) в поздней экспоненциальной стадии роста , повторно суспендируют в пятикратном количестве от объема цитрат-фосфатного буфера при рН 5,0 и выдерживают при 0°С на бане со льдом, после чего разрушают посредством 3 прогонов по 20 с в ультразвуковом устройстве (Дэйв Сонипросб, тип1130А) при максимальной мощности. Полученную при этом суспензию центрифугируют при 17000 об/мин в течение 30 мин и исследуют на наличие активности в качестве t -галактозидазы (как осадок , так и верхний слой), определяя указанную активность в единицах на 1 г сухой массы клеточного остатка и применяя для этой цели п-нитрофенил- - D-галактопиранозид (фирмы Сигма). В поверхностном слое не обнаружено практически никакой энзиматической активности. Для культур, которые дают положительные результаты при испытании на гидролиз ТХР согласно способу, описанному в примере 1, получаемые результаты (см. табл. 2) приводятся в мг сукралозы, полученной на 1 г сухой массы клеточного остатка в час (для 70%-ной конверсии).
Пример 4. Получение сукралозы в органической среде.
ТХР в количестве 23 мг помещают в пробирку 5 мл с завинчивающейся пробкой и добавляют 2 мл органического
растворителя, предварительно насыщенного водным буфером (ацетат натрия 50 мМ, рН 5,0), получая в результате . 20 мМ (1,15% мае/объем) раствор. В каждую из пробирок добавляют по 100 мг с -галактоэидазы в форме гранулированных клеток M.vinacea разновидности raffinoseutilizer ATCC № 20034, после чего инициируют проте- кание реакции путем введения 1% (объем/объем) водного буфера, интенсивного перемешивания в течение 30 с и помещения пробирки в водяную баню со встряхиванием при 55 С и 100 об/мин Периодически из реакционной смеси отбирают пробы по 25 мкл, которые вво- дят в систему хроматографического анализа при высоком давлении (система с использованием обратной фазы, ко- лонка Уотерс Декстропак С 18), используя для элюирования 20%-ный водный раствор ацетонитрила и измеряя количество полученной сукралозы и остаточной ТХР. Эффект наличия органи- ческого растворителя ри получении сукралозы в течение 24-часового инкубирования приведен на фиг.2. Зависимость степени гидролиза ТХР в сук- ралозу от времени приведена в виде кривой 1 для водного буфера и для трех растворителей: метилизобутилке5 - JQ н.Ц5 . а 20 25 jg
6359058
тона (кривая 2), этилацетата (кривая 3) и н-бутанола (кривая 4). Протекание реакции гидролиза в метилизо- бутилкетоне и водном буфере одинаково , в случае использования этилацетата и н-бутанола зафиксированы более низкие скорости протекания реакции и конверсии. Во всех случаях наблюдается свыше чем 50%-ная конверсия за промежуток времени,равный 24 ч,при конверсии за тот же промежуток времени,равной 70%, для водного буфера и метил- изобутилкетона.
В отдельном опыте определяли в кинетические параметры энзима по Ми- хаэлису-Ментену как для водного буфе- pi, так и для этилацетата, Kjn и К в этилацетате равны соответственно 16,4 мМ ТХР и 56,3 мг сукралозы/г тгранул/ч. Причиной того, что временной график для процесса гидролиза ТХР в этилацетате находится ниже, чем соответствующий график в водном буфере (при 20 мМ ТХР), является более высокое значение Кщ ТХР в этилацетате, а не меньшая каталитическая активность. При использовании 50 мМ ТХР скорость и степень конверсии при гидролизе ТХР в этилацетате аналогичны соответствующим величинам в водном буфере.





Реферат
Изобретение относится к биотехнологии . Цель изобретения - упрощение процесса за счет минимизации образования побочных продуктов. Хлорзаме- щенный сахар 0-й(Ч)-6-хлор-6-дезокси- галактопиранозил- (1 -. 6} -oЈ-D-i -хлор- 4-дезоксигалактопираиозил-(1 2) D-1,6-дихлор-1,6-дидезоксифруктофура- нозид (ТХР) используют для получения сукралозы в результате инкубирования ТХР в растворе в присутствии oL-ra- лактозидазы, служащей для удаления 6-хлор-6-дезоксигалактозильного остатка из положения 6, в частности энзима , получаемого из Mortierella vi- nacea, Circtnella muscae. ТХР получают в результате обработки рафиноэы хлористым тионилом в присутствии окиси трифенилфосфина. Раствор представляет собой водную систему или несмешиваемый с водой гидрофобный растворитель . 1 з.п. ф-лы, 2 табл. Ј (Л

Формула


Комментарии