Способ - RU2671972C1
Код документа: RU2671972C1
Описание
Настоящее изобретение предлагает улучшенные способы получения комплексов рутения или осмия, содержащих P- и N-донорные лиганды, в частности, комплексов рутения.
В статье Jung и др. (Inorganic Chemistry (Неорганическая химия), 1984 г., т. 23, с. 726-729) описываются реакции Ph2P(CH2)nPPh2 (n=1-4) с RuCl2(PPh3)3. Однако описанный в статье Jung и др. Способ получения RuCl2(PPh3)(Ph2P(CH2)4PPh2) не является подходящим для крупномасштабного производства, потому что требуются большие объемы растворителей, чтобы осуществлять реакцию и выделять комплекс RuCl2(PPh3)(Ph2P(CH2)4PPh2). Например, авторы настоящего изобретения обнаружили, что требуются 0,5 л дихлорметана и 2,5 л этанола для превращения 10 г RuCl2(PPh3)3как исходного соединения Ru.
В статье Baratta и др. (Organometallics (Металлоорганические соединения), 2005 г., т. 24, с. 1660-1669) описывается синтез комплексы 2-(аминометил)пиридинфосфинрутения(II). Эти комплексы представляют класс катализаторов, проявляющих активность в реакциях гидрирования и гидрирования с переносом водорода. Описанная в статье Baratta и др. процедура синтеза транс-RuCl2(dppb)(AMPY) кратко представлена ниже:
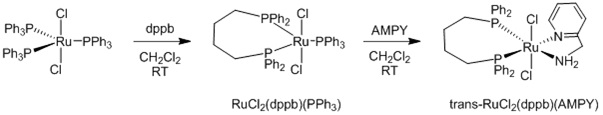
Синтез транс-RuCl2(dppb)(AMPY)
dppb=1,4-бис(дифенилфосфино)бутан; CH2Cl2=дихлорметан; RT=комнатная температура; AMPY=2-(аминометил)пиридин
Хотя описанный в статье Baratta и др. способ может использоваться для получения комплексов 2-(аминометил)пиридинфосфинрутения(II) в граммовых количествах, данный способ не является подходящим для крупномасштабного производства. Согласно данному способу, как описано в статье Jung и др., на первой стадии получается RuCl2(dppb)(PPh3), и при этом требуются большие объемы растворителя. Было показано, что вторая стадия, на которой синтезируется транс-RuCl2(dppb)(AMPY), является проблематичной в случае большого масштаба, поскольку оказывается затруднительным отделение транс-RuCl2(dppb)(AMPY) от PPh3. Это объясняется тем, что при добавлении гептана в раствор дихлорметана осаждается комплекс, происходит соосаждение свободного фосфина, и можно получить лишь небольшую часть транс-RuCl2(dppb)(AMPY), в которой отсутствуют примеси PPh3.
В статье Baratta и др. (Organometallics ((Металлоорганические соединения), 2012 г., т. 31, с. 1133-1142) описывается реакции, в которых участвуют карбонильные соединения и спирты, с комплексами [MCl2(dppf)(AMPY)] [M=Ru (цис-RuCl2(dppf)(AMPY)); M=Os (транс-OsCl2(dppf)(AMPY)); dppf=1,1ʹ-бис(дифенилфосфино)ферроцен; AMPY=2-аминометилпиридин].
Авторы настоящего изобретения разработали способы получения комплексов рутения, содержащих P- и N-донорные лиганды, которые преодолевают проблемы предшествующего уровня техники. Эти способы являются более пригодными для крупномасштабного производства комплексов рутения.
Сущность изобретения
Согласно одному аспекту настоящего изобретения, предлагается способ получения комплекса [M(X)2(L1)m(L2)], причем данный способ включает следующую стадию:
реакция комплекса [M(X)2(L)3] с фосфорным лигандом L1 и бидентатным N,N-лигандом L2 в кетонном растворителе для получения комплекса [M(X)2(L1)m(L2)];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L представляет собой монодентатный фосфорный лиганд;
L1 представляет собой монодентатный фосфорный лиганд, который отличается от L, или бидентатный фосфорный лиганд;
m составляет 1 или 2, причем:
когда m составляет 1, L1 представляет собой бидентатный фосфорный лиганд;
когда m составляет 2, каждый L1 представляет собой монодентатный фосфорный лиганд; и
L2 представляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа.
Согласно еще одному аспекту настоящего изобретения, предлагается способ получения комплекса [M(X)2(L)2(L2)], причем данный способ включает следующую стадию:
реакция комплекса [M(X)2(L)3] с бидентатным N,N-лигандом L2 в кетонном растворителе для получения комплекса [M(X)2(L)2(L2)];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L представляет собой монодентатный фосфорный лиганд; и
L2 представляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа.
Согласно следующему аспекту настоящего изобретения, предлагается способ получения комплекса [M(X)2L(L1)m], причем данный способ включает следующую стадию:
реакция комплекса [M(X)2(L)3] с фосфорным лигандом L1 в кетонном растворителе для получения комплекса [M(X)2L(L1)m];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L представляет собой монодентатный фосфорный лиганд;
L1представляет собой монодентатный фосфорный лиганд, который отличается от L, или бидентатный фосфорный лиганд;
m составляет 1 или 2, причем:
когда m составляет 1, L1 представляет собой бидентатный фосфорный лиганд; и
когда m составляет 2, каждый L1 представляет собой монодентатный фосфорный лиганд.
Согласно еще одному аспекту настоящего изобретения, предлагается способ получения комплекс цис-[M(X)2(L1)m(L2)], причем данный способ включает следующие стадии:
a) обработка комплекс транс-[M(X)2(L1)m(L2)] в спиртовом растворителе, ароматическом растворителе или их смеси; и
b) нагревание реакционной смеси для получения комплекса цис-[M(X)2(L1)m(L2)];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L1 представляет собой монодентатный фосфорный лиганд или бидентатный фосфорный лиганд;
m составляет 1 или 2,
в котором,
когда m составляет 1, L1 представляет собой бидентатный фосфорный лиганд;
когда m составляет 2, каждый L1 представляет собой монодентатный фосфорный лиганд; и
L2 представляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа.
Согласно следующему аспекту настоящего изобретения, предлагается способ получения комплекса цис-[M(X)2(L1)m(L2)], причем данный способ включает следующую стадию:
реакция комплекса [M(X)2(L1)m(L2)] с фосфорным лигандом L1 в спиртовом растворителе, ароматическом растворителе или их смеси для получения комплекса цис-[M(X)2(L1)m(L2)];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L представляет собой монодентатный фосфорный лиганд;
L1 представляет собой монодентатный фосфорный лиганд, который отличается от L, или бидентатный фосфорный лиганд;
m составляет 1 или 2, причем:
когда m составляет 1, L1 представляет собой бидентатный фосфорный лиганд;
когда m составляет 2, каждый L1 представляет собой монодентатный фосфорный лиганд; и
L2 представляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа.
Согласно еще одному аспекту настоящего изобретения, предлагается комплекс [M(X)2(L1)(L2)], в котором: M представляет собой рутений или осмий; X представляет собой анионный лиганд;
L1 представляет собой бидентатный фосфорный лиганд, выбранный из группы, которую составляют:
(i) лиганд формулы (Ia) или (Ib):
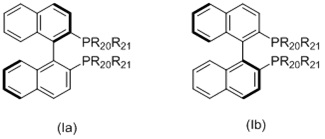
в котором:
R20 и R21 в каждом случае независимо выбираются из группы, которую составляют незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C5-20-арил и замещенный C5-20-арил;
(ii) лиганд формулы (IIa) или (IIb):
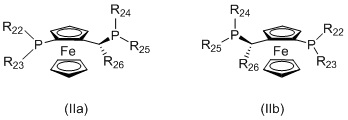
в котором:
R22 и R23 независимо выбираются из группы, которую составляют незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил;
R24 и R25 независимо выбираются из группы, которую составляют незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил; и
R26 выбирается из группы, которую составляют незамещенный C1-20-алкил и замещенный C1-20-алкил;
(iii) лиганд, выбранный из группы, которую составляют 1,1'-бис(диизопропилфосфино)ферроцен, 1,1'-бис(дициклогексилфосфино)ферроцен и 1,1'-бис(ди-трет-бутилфосфино)ферроцен; и
L2 представляет собой бидентатный N,N-лиганд, выбранный из группы, которую составляют лиганды (1), (2) и (3):
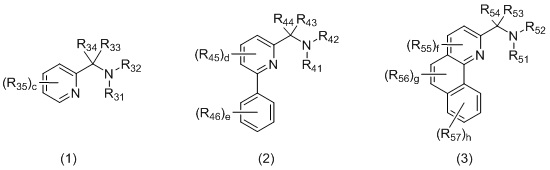
в которых:
R31 и R32, R41 и R42, и R51 и R52 независимо выбираются из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил;
R33 и R34, R43 и R44, и R53 и R54 независимо выбираются из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил;
R35, R45, R46, R55, R56 и R57 независимо выбираются из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил;
c составляет 0, 1, 2, 3 или 4;
d составляет 0, 1, 2 или 3;
e составляет 0, 1, 2, 3, 4 или 5;
f составляет 0, 1 или 2;
g составляет 0, 1 или 2;
h составляет 0, 1, 2, 3 или 4.
Предпочтительные и/или необязательные отличительные признаки настоящего изобретения представлены ниже. Любой аспект настоящего изобретения может сочетаться с любым другим аспектом настоящего изобретения, если другое условие не требуется по контексту. Любой из предпочтительных или необязательных отличительных признаков любого аспекта может сочетаться, индивидуально или в сочетании, с любым аспектом настоящего изобретения, если другое условие не требуется по контексту.
Определение
Место присоединения группы или заместителя представляет знак «-». Например, группа -OH присоединяется через атом кислорода.
«Алкил» означает имеющую неразветвленную или разветвленную цепь насыщенную углеводородную группу. Алкильная группа может содержать, согласно определенным вариантам осуществления, от 1 до 20 атомов углерода, согласно определенным вариантам осуществления, от 1 до 15 атомов углерода, согласно определенным вариантам осуществления, от 1 до 8 атомов углерода. Алкильная группа может быть незамещенной. В качестве альтернативы, алкильная группа может быть замещенной. Если не определяется другое условие, алкильная группа может присоединяться через любой подходящий атом углерода, и, если она является замещенной, замещение может осуществляться при любом подходящем атоме. Типичные алкильные группы включают, но не ограничиваются этим, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гексил и т.п.
Термин «циклоалкил» используется для обозначения насыщенного карбоциклического углеводородного радикала. Циклоалкильная группа может содержать, согласно определенным вариантам осуществления, от 3 до 15 атомов углерода, согласно определенным вариантам осуществления, от 3 до 10 атомов углерода, согласно определенным вариантам осуществления, от 3 до 8 атомов углерода. Циклоалкильная группа может быть незамещенной. В качестве альтернативы, циклоалкильная группа может быть замещенной. Если не определяется другое условие, циклоалкильная группа может присоединяться через любой подходящий атом углерода, и, если она является замещенной, замещение может осуществляться при любом подходящем атоме. Типичные циклоалкильные группы включают, но не ограничиваются этим, циклопропил, циклобутил, циклопентил, циклогексил и т.п.
«Алкокси» означает необязательно замещенную группу формулы алкил-O- или циклоалкил-O-, в которой алкил и циклоалкил являются такими, как определяется выше.
«Арил» означает ароматическую карбоциклическую группу. Арильная группа может содержать единственное кольцо или множество конденсированных колец. Арильная группа может содержать, согласно определенным вариантам осуществления, от 6 до 20 атомов углерода, согласно определенным вариантам осуществления, от 6 до 15 атомов углерода, согласно определенным вариантам осуществления, от 6 до 12 атомов углерода. Арильная группа может быть незамещенной. В качестве альтернативы, арильная группа может быть замещенной. Если не определяется другое условие, арильная группа может присоединяться через любой подходящий атом углерода, и, если она является замещенной, замещение может осуществляться при любом подходящем атоме. Примеры арильных групп включают, но не ограничиваются этим, фенил, нафтил, антраценил и т.п.
«Арилалкил» означает необязательно замещенную группу формулы арил-алкил-, где арил и алкил являются такими, как определяется выше.
«Гало», «гал» или «галогенид» означает -F, -Cl, -Br и -I.
«Гетероалкил» означает имеющую неразветвленную или разветвленную цепь насыщенную углеводородную группу, в которой один или несколько атомов углерода независимо замещаются одним или несколькими гетероатомов (например, атомами азота, кислорода, фосфора и/или серы). Гетероалкильная группа может содержать, согласно определенным вариантам осуществления, от 1 до 20 атомов углерода, согласно определенным вариантам осуществления, от 1 до 15 атомов углерода, согласно определенным вариантам осуществления, от 1 до 8 атомов углерода. Гетероалкильная группа может быть незамещенной. В качестве альтернативы, гетероалкильная группа может быть замещенной. Если не определяется другое условие, гетероалкильная группа может присоединяться через любой подходящий атом, и, если она является замещенной, замещение может осуществляться при любом подходящем атоме. Примеры гетероалкильных групп включают, но не ограничиваются этим, простые эфиры, простые тиоэфиры, первичные амины, вторичные амины, третичные амины и т.п.
«Гетероциклоалкил» означает насыщенную циклическую углеводородную группу, в которой один или несколько атомов углерода независимо замещаются одним или несколькими гетероатомов (например, атомами азота, кислорода, фосфора и/или серы). Гетероциклоалкильная группа может содержать, согласно определенным вариантам осуществления, от 2 до 20 атомов углерода, согласно определенным вариантам осуществления от 2 до 10 атомов углерода, согласно определенным вариантам осуществления, от 2 до 8 атомов углерода. Гетероциклоалкильная группа может быть незамещенной. В качестве альтернативы, гетероциклоалкильная группа может быть замещенной. Если не определяется другое условие, гетероциклоалкильная группа может присоединяться через любой подходящий атом, и, если она является замещенной, замещение может осуществляться при любом подходящем атоме. Примеры гетероциклоалкильных группы включают, но не ограничиваются этим, эпоксид, морфолинил, пиперадинил, пиперазинил, тирранил, пирролидинил, пирпзолидинил, имидазолидинил, тиазолидинил, тиомоморфолинил и т.п.
«Гетероарил» означает ароматическую карбоциклическую группу, в котором один или несколько атомов углерода независимо замещаются одним или несколькими гетероатомов (например, атомами азота, кислорода, фосфора и/или серы). Гетероарильная группа может содержать, согласно определенным вариантам осуществления, от 3 до 20 атомов углерода, согласно определенным вариантам осуществления, от 3 до 15 атомов углерода, согласно определенным вариантам осуществления, от 3 до 8 атомов углерода. Гетероарильная группа может быть незамещенной. В качестве альтернативы, гетероарильная группа может быть замещенной. Если не определяется другое условие, гетероарильная группа может присоединяться через любой подходящий атом, и, если она является замещенной, замещение может осуществляться при любом подходящем атоме. Примеры гетероарильных групп включают, но не ограничиваются этим, тиенил, фуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, тиофенил, оксадиазолил, пиридинил, пиримидил, бензоксазолил, бензтиазолил, бензимидазолил, индолил, хинолинил и т.п.
«Замещенная группа» означает группу, в который один или несколько (например, 1, 2, 3, 4, 5 или более) атомов водорода в каждом случае независимо замещаются заместителями, которые могут быть одинаковыми или различными. Примеры заместителей включают, но не ограничиваются этим, -гало, -C(гало)3, -Ra, -O-Ra, -S-Ra, -NRaRb, -CN, -C(O)-Ra, -COORa, -C(S)-Ra, -C(S)ORa, -S(O)2OH, -S(O)2-Ra, -S(O)2NRaRb и -CONRaRb, предпочтительно -гало, -C(гало)3, -Ra, -O-Ra, -NRaRb, -COORa и -CONRaRb. Ra и Rb независимо выбираются из групп, которые представляют собой H, алкил, арил, арилалкил, гетероалкил, гетероарил, или Ra и Rb вместе с атомом, к которому они присоединяются, образуют гетероциклоалкильную группу, причем Ra и Rb могут быть незамещенными или содержать дополнительные заместители, как определяется в настоящем документе.
«Металлоценил» означает группу комплекса переходного металла, в котором атом или ион переходного металла образует «сэндвич», располагаясь между двумя кольцами из атомов. Металлоценильная группа может быть замещенной. В качестве альтернативы, металлоценильная группа может быть незамещенной. Если не определяется другое условие, металлоценильная группа может присоединяться через любой подходящий атом, и, если она является замещенной, замещение может осуществляться при любом подходящем атоме.
Примеры атомов или ионов переходных металлов включают, но не ограничиваются этим, хром, марганец, кобальт, никель и железо. Пример подходящего кольца из атомов представляет собой циклопентадиенильное кольцо. Пример металлоценильной группы включает, но не ограничивается этим, ферроценил, который содержит ион Fe(II)Ю, расположенный между двумя циклопентадиенильными кольцами, причем каждое циклопентадиенильное кольцо может быть независимо незамещенным или замещенным.
Подробное описание
Согласно одному аспекту настоящего изобретения, предлагается способ получения комплекса [M(X)2(L1)m(L2)], причем данный способ включает следующую стадию:
реакция комплекса [M(X)2(L)3] с фосфорным лигандом L1 и бидентатным N,N-лигандом L2 в кетонном растворителе для получения комплекса [M(X)2(L1)m(L2)];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L представляет собой монодентатный фосфорный лиганд;
L1 представляет собой монодентатный фосфорный лиганд, который отличается от L, или бидентатный фосфорный лиганд;
m составляет 1 или 2, причем:
когда m составляет 1, L1 представляет собой бидентатный фосфорный лиганд;
когда m составляет 2, каждый L1 представляет собой монодентатный фосфорный лиганд; и
L2 представляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа.
Металл M представляет собой металл платиновой группы, в качестве которого выбирается рутений или осмий.
Согласно одному варианту осуществления, M представляет собой рутений. Когда в качестве M присутствует рутений, M может представлять собой Ru(II). Согласно еще одному варианту осуществления, M представляет собой осмий. Когда в качестве M присутствует осмий, M может представлять собой Os(II).
X представляет собой анионный лиганд, предпочтительно галогенид, такой как -Cl, -Br и -I. Предпочтительно X представляет собой -Cl.
L представляет собой монодентатный фосфорный лиганд, причем лиганды L могут быть одинаковыми или различными. Предпочтительно L представляет собой третичный фосфиновый лиганд PR1R2R3. Радикалы R1, R2 и R3 могут независимо выбираться из группы, которую составляют незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил. Радикалы R1, R2 и R3 могут независимо представлять собой замещенными или незамещенные имеющие разветвленную или неразветвленную цепь алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил, циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантанил, или арильные группы, такие как фенил, нафтил или антрацил. Согласно одному варианту осуществления, алкильные группы могут быть необязательно замещенными и содержать один или несколько заместителей, таких как галогенид (F, Cl, Br или I) или алкоксигруппы, например, метокси-, этокси- или пропоксигруппы.
Арильная группа может быть необязательно замещенной и содержать один или несколько (например, 1,2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы (например, метил), C1-C10-алкоксильные группы, имеющие неразветвленную или разветвленную цепь C1-C10-(диалкил)аминогруппы, C3-10-гетероциклоалкильные группы (такие как морфолинил и пиперадинил) или три(гало)метильные группы (например, F3C-). Замещенные или незамещенные гетероарильные группы, такие как пиридил, могут также использоваться. Согласно альтернативному варианту осуществления, любые два из радикалов R1, R2 и R3 могут соединяться друг с другом, образуя циклическую структуру, включающую атом фосфора, предпочтительно кольцо, содержащее от 4 до 7 атомов. Предпочтительно R1, R2 и R3 являются одинаковыми и представляют собой фенильные группы, т.е. PR1R2R3 представляет собой трифенилфосфин. В качестве альтернативы, R1, R2 и R3 могут быть одинаковыми и представляют собой толильные группы, т.е. PR1R2R3 представляет собой тритолилфосфин (например, орто-, мета- или пара-тритолилфосфин).
Согласно одному варианту осуществления, комплекс [M(X)2(L)3] может представлять собой комплекс [Ru(Hal)2(PR1R2R3)3], в котором в качестве R1, R2 и R3 независимо выбираются незамещенный C5-20-арил и замещенный C5-20-арил. Согласно одному предпочтительному варианту осуществления, комплекс [M(X)2(L)3] может представлять собой [RuCl2(PPh3)3]. Согласно еще одному предпочтительному варианту осуществления, комплекс [M(X)2(L)3] может представлять собой [RuCl2(tol)3)].
Согласно еще одному варианту осуществления, комплекс [M(X)2(L)3] может представлять собой комплекс [Os(Hal)2(PR1R2R3)3], в котором в качестве R1, R2 и R3 независимо выбираются незамещенный C5-20-арил и замещенный C5-20-арил. Согласно одному предпочтительному варианту осуществления, комплекс [M(X)2(L)3] может представлять собой [OsCl2(PPh3)3]. Согласно еще одному предпочтительному варианту осуществления, комплекс [M(X)2(L)3] может представлять собой [OsCl2(P(tol)3)3].
L1 представляет собой монодентатный фосфорный лиганд, который отличается от L. В данном случае m составляет 2. В качестве альтернативы, L1 представляет собой бидентатный фосфорный лиганд, и в данном случае m составляет 1.
Может использоваться любое подходящее соединение фосфора, которое способно осуществлять взаимодействие лиганда и атома металла M. В лиганде с каждым атомом фосфора ковалентно связаны 3 атома углерода (третичные фосфины) или n гетероатомов и 3-n атомов углерода, где n=1, 2 или 3. Предпочтительно, гетероатом выбирается из группы, которую составляют N и O.
Фосфорный лиганд может быть монодентатным, например, PPh3, или бидентатным. Лиганд может быть хиральным или ахиральным, хотя во многих случаях оказывается предпочтительным, что фосфорный лиганд является хиральным. Были описаны разнообразные хиральные фосфорные лиганды, а также имеются соответствующие обзоры; см., например, статьи W. Tang и X. Zhang, Chem. Rev., 2003 г., т. 103, с. 3029- 3070, и J. C. Carretero, Angew. Chem. Int. Ed., 2006 г., т. 45, с. 7674-7715. Фосфорные лиганды, которые могут использоваться согласно настоящему изобретению, включают следующие структурные типы, но не ограничиваются ими:
BINAP, R=арил и алкил
P-PHOS, R=арил, алкил
TMBITIOP, R=арил, алкил, X=O, S, N
H8-BINAP, R=арил и алкил
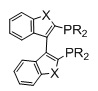
BITIANAP, R=алкил, арил, X=O, S, N
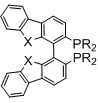
R=арил, алкил,
X=O BIBFUP
X=NH или S
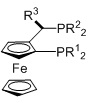
JOSIPHOS, R1=алкил, арил, R2=алкил, арил, R3=алкил, арил
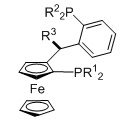
TANIAPHOS, R1=алкил, арил, R2=алкил, арил, R3=алкил
WALPHOS, R1=алкил, арил, R2=алкил, арил
BOPHOZ, R1=алкил, арил, R2=алкил, арил, O-алкил, O-арил, R3=алкил, арил, R4=алкил, арил
включая:
DIPFC, R1=R2=secPr
DCyPFC, R1=R2=Cy
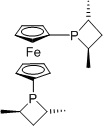
Me-FERROTANE
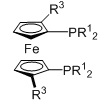
FERROPHOS, R1=алкил, арил, R3=3-пентил
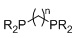
R=алкил, арил; n=3, R=Ph, dppp; n=4, R=Ph, dppb
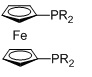
R=алкил, арил; R=Ph, dppf
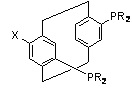
PARAPHOS, X=функциональная группа, R=арил, алкил
включая X=H:
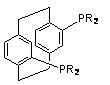
PHANEPHOS
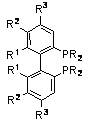
Замещенный бифенил: R=арил и алкил, R1=алкил, алкокси, R2=H, алкил, алкокси, галогенид, R3=H, алкил
включая:
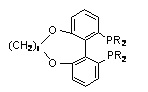
TUNAPHOS
R1=OMe: BIPHEP
R1=OMe, R2=Cl, Cl, MeO: BIPHEP
R1 и R3=Me, R2=OMe: BIMOP
R1=Me: BIPHEMP
R1 и R3=Me: TETRAPHEMP
R1, R2 и R3=Me: HEXAPHEMP
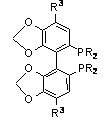
SEGPHOS
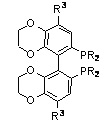
SYNPHOS
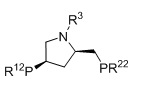
BPPM, R1=алкил, арил, R2=алкил, арил, R3=замещенный алкил
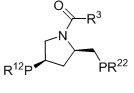
BPPM амид, R1=алкил, арил, R2=алкил, арил, R3=алкил, арил, OR4, NR42, R4=алкил, арил
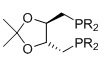
DIOP, R=алкил, арил
В перечисленных выше структурах -PR2 может представлять собой -P(алкил)2, в котором алкил предпочтительно представлять собой C1-C10-алкил; -P(арил)2, где арил включает фенил и нафтил, которые могут быть замещенными или незамещенными, или -P(O-алкил)2 и -P(O-арил)2, где алкил и арил являются такими, как определяется выше. В качестве -PR2 может также присутствовать замещенный или незамещенный -P(гетероарил)2, где гетероарил включает фуранил (например, 2-фуранил или 3-фуранил). В качестве -PR2 предпочтительно присутствует -P(арил)2, где арил включает фенил, толил, ксилил или анизил, или -P(O-арил)2. Если -PR2 представляет собой -P(O-арил)2, наиболее предпочтительные O-арильные группы представляют собой группы, основу которых составляют хиральные или ахиральные замещенные 1,1'-бифенол и 1,1'-бинафтол. В качестве альтернативы, группы R на атоме P могут быть связаны друг с другом, образуя часть циклической структуры.
Замещающие группы могут присутствовать на алкильных или арильных заместителях в фосфорных лигандах. Как правило, такие замещающие группы представляют собой разветвленные или неразветвленные C16-алкильные группы, такие как метил, этил, пропил, изопропил, трет-бутил и циклогексил.
Фосфорные лиганды предпочтительно используются в чистой энантиомерной форме. Эти фосфорные лиганды широко представлены в продаже, и известны способы их получения. Например, получение лигандов PARAPHOS представляет международная патентная заявка WO 04/111065, получение лигандов Bophoz представляют международная патентная заявка WO 02/26750 и патент США № 6906212, а получение лигандов Josiphos представляют европейские патенты № 564406B и № 612758B.
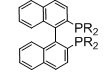
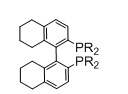
Фосфорный лиганд L1 предпочтительно включает лиганды Binap, лиганды Pphos, лиганды PhanePhos, лиганды Qphos, лиганды Josiphos и лиганды Bophoz.
Когда L1 представляет собой лиганд Binap, этот лиганд моет иметь формулу (Ia) или (Ib):
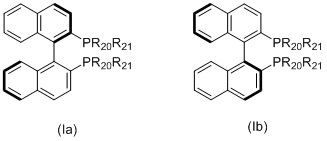
в которых:
R20 и R21 в каждом случае независимо выбираются из группы, которую составляют незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C5-20-арил и замещенный C5-20-арил. Согласно одному варианту осуществления, R20 и R21 в каждом случае независимо выбираются из группы, которую составляют циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантанил, или арильные группы, такие как фенил, нафтил или антрацил. Согласно одному варианту осуществления, циклоалкильные группы могут быть необязательно замещенными и содержать один или несколько заместителей, таких как галогенид (F, Cl, Br или I) или алкоксигруппы, например, метокси-, этокси- или пропоксигруппы. Арильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы (например, метил), C1-C10 -алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10-диалкиламиногруппы, C3-10-гетероциклоалкильные группы (такие как морфолинил и пиперадинил) или три(гало)метильные группы (например, F3C-). Предпочтительно, R20 и R21 являются одинаковыми и выбираются из группы, которую составляют фенил, толил (о-, м- или п-, предпочтительно п-толил) и ксилил (например, 3,5-ксилил).
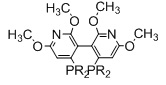
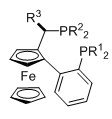
Когда L1 представляет собой лиганд JOSIPHOS, этот лиганд может иметь формулу (IIa) или (IIb):
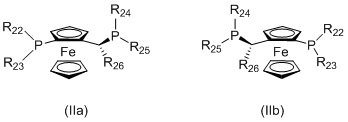
в которых:
R22 и R23 независимо выбираются из группы, которую составляют незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил;
R24 и R25 независимо выбираются из группы, которую составляют незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил; и
R26 выбирается из группы, которую составляют незамещенный C1-20-алкил и замещенный C1-20-алкил;
Согласно одному варианту осуществления, R22 и R23 независимо выбираются из группы, которую составляют замещенные или незамещенные имеющие разветвленную или неразветвленную цепь алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил, циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантанил, арильные группы, такие как фенил, нафтил или антрацил, и гетероарильные группы, такие как фурил. Согласно одному варианту осуществления, алкильные группы могут быть необязательно замещенными и содержать один или несколько заместителей, таких как галогенид (F, Cl, Br или i) или алкоксигруппы, например, метокси-, этокси- или пропоксигруппы. Арильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы (например, метил), C1-C10 -алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10-диалкиламиногруппы, C3-10-гетероциклоалкильные группы (такие как морфолинил и пиперадинил) или три(гало)метильные группы (например, F3C-). Гетероарильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы (например, метил), C1-C10-алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10-(диалкил)аминогруппы или три(гало)метильные группы (например, F3C-). Предпочтительно R22 и R23 являются одинаковыми и выбираются из группы, которую составляют трет-бутил, циклогексил, фенил, 3,5-бис(трифторметил)фенил, 4-метокси-3,5-диметилфенил, 4-трифторметилфенил, 1-нафтил, 3,5-ксилил, 2-метилфенил и 2-фурил, наиболее предпочтительно трет-бутил, циклогексил, фенил, 3,5-бис(трифторметил)фенил, 4-метокси-3,5-диметилфенил, 4-трифторметилфенил, 1-нафтил и 2-фурил.
Согласно одному варианту осуществления, R24 и R25 независимо выбираются из группы, которую составляют замещенные или незамещенные имеющие разветвленную или неразветвленную цепь алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил, циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантанил, арильные группы, такие как фенил, нафтил или антрацил, и гетероарильные группы, такие как фурил. Согласно одному варианту осуществления, алкильные группы могут быть необязательно замещенными и содержать один или несколько заместителей, таких как галогенид (F, Cl, Br или I) или алкоксигруппы, например, метокси-, этокси- или пропоксигруппы. Арильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы (например, метил), C1-C10 -алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10-диалкиламиногруппы, C3-10-гетероциклоалкильные группы (такие как морфолинил и пиперадинил) или три(гало)метильные группы (например, F3C-). Гетероарильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы (например, метил), C1-C10-алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10-(диалкил)аминогруппы или три(гало)метильные группы (например, F3C-). Предпочтительно R24 и R25 являются одинаковыми и выбираются из группы, которую составляют трет-бутил, циклогексил, фенил, 3,5-бис(трифторметил)фенил, 4-метокси-3,5-диметилфенил, 4-трифторметилфенил, 1-нафтил, 3,5-ксилил, 2-метилфенил и 2-фурил, наиболее предпочтительно трет-бутил, циклогексил, фенил, 3,5-ксилил и 2-метилфенил.
Согласно одному варианту осуществления, R26 представляет собой незамещенную имеющую разветвленную или неразветвленную цепь алкильную группу, такую как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил. Предпочтительно R26 представляет собой метильную группу.
Согласно одному варианту осуществления, лиганд формулы (IIa) выбирается из группы, которую составляют:
(R)-1-[(S)-2-ди(фенилфосфино)ферроценил]этилдициклогексилфосфин,
(R)-1-[(S)-2-ди(фенилфосфино)ферроценил]этилди-трет-бутилфосфин,
(R)-1-[(S)-2-ди(циклогексилфосфино)ферроценил]этилдициклогексилфосфин,
(R)-1-[(S)-2-ди(циклогексилфосфино)ферроценил]этилдифенилфосфин,
(R)-1-[(S)-2-ди(фенилфосфино)ферроценил]этилди-3,5-ксилилфосфин,
(R)-1-[(S)-2-ди-(3,5-бис(трифторметил)фенилфосфино)ферроценил]этилдициклогексилфосфин,
(R)-1-[(S)-2-ди-(4-метокси-3,5-диметил)фенилфосфино)ферроценил]этилдициклогексилфосфин,
(R)-1-[(S)-2-ди-(3,5-бис(трифторметил)фенилфосфино)ферроценил]этилди-3,5-ксилилфосфин,
(R)-1-[(S)-2-ди(циклогексилфосфино)ферроценил]этилди-трет-бутилфосфин,
(R)-1-[(S)-2-ди-((4-трифторметил)фенилфосфино)ферроценил]этилди-трет-бутилфосфин,
(R)-1-[(S)-2-ди-(4-метокси-3,5-диметил)фенилфосфино)ферроценил]этилди-трет-бутилфосфин,
(R)-1-[(S)-2-ди-(2-фурил)фосфино)ферроценил]этилди-3,5-ксилилфосфин,
(R)-1-[(S)-2-ди-(2-фурил)фосфино)ферроценил]этилди-трет-бутилфосфин,
(R)-1-[(S)-2-ди(1 -нафтил)фосфино)ферроценил]этилди-трет-бутилфосфин,
(R)-1-[(S)-2-ди(1 -нафтил)фосфино)ферроценил]этилди-3,5-ксилилфосфин,
(R)-1-[(S)-2-ди-(4-метокси-3,5-диметил)фенилфосфино)ферроценил]этилди-3,5-ксилилфосфин,
(R)-1-[(S)-2-ди-(4-метокси-3,5-диметил)фенилфосфино)ферроценил]этилди-(2-метилфенил)фосфин,
(R)-1-[(S)-2-ди-(2-фурил)фосфиноферроценил]этилди-(2-метилфенил)фосфин,
(R)-1-[(S)-2-ди(трет-бутилфосфино)ферроценил]этилдифенилфосфин,
(R)-1-[(S)-2-ди(трет-бутилфосфино)ферроценил]этилди-(2-метилфенил)фосфин, и
(R)-1-[(S)-2-дифенилфосфиноферроценил]этилдифенилфосфин.
Согласно одному варианту осуществления, лиганд формулы (IIb) выбирается из группы, которую составляют:
(S)-1-[(R)-2-ди(фенилфосфино)ферроценил]этилдициклогексилфосфин,
(S)-1-[(R)-2-ди(фенилфосфино)ферроценил]этилди-трет-бутилфосфин,
(S)-1-[(R)-2-ди(циклогексилфосфино)ферроценил]этилдициклогексилфосфин,
(S)-1-[(R)-2-ди(циклогексилфосфино)ферроценил]этилдифенилфосфин,
(S)-1-[(R)-2-ди(фенилфосфино)ферроценил]этилди-3,5-ксилилфосфин,
(S)-1-[(R)-2-ди-(3,5-бис(трифторметил)фенилфосфино)ферроценил]этилдициклогексилфосфин,
(S)-1-[(R)-2-ди-(4-метокси-3,5-диметил)фенилфосфино)ферроценил]этилдициклогексилфосфин,
(S)-1-[(R)-2-ди-(3,5-бис(трифторметил)фенилфосфино)ферроценил]этилди-3,5-ксилилфосфин,
(S)-1-[(R)-2-ди(циклогексилфосфино)ферроценил]этилди-трет-бутилфосфин,
(S)-1-[(R)-2-ди-((4-трифторметил)фенилфосфино)ферроценил]этилди-трет-бутилфосфин,
(S)-1-[(R)-2-ди-(4-метокси-3,5-диметил)фенилфосфино)ферроценил]этилди-трет-бутилфосфин,
(S)-1-[(R)-2-ди-(2-фурил)фосфино)ферроценил]этилди-3,5-ксилилфосфин,
(S)-1-[(R)-2-ди-(2-фурил)фосфино)ферроценил]этилди-трет-бутилфосфин,
(S)-1-[(R)-2-ди(1-нафтил)фосфино)ферроценил]этилди-трет-бутилфосфин,
(S)-1-[(R)-2-ди(1-нафтил)фосфино)ферроценил]этилди-3,5-ксилилфосфин,
(S)-1-[(R)-2-ди-(4-метокси-3,5-диметил)фенилфосфино)ферроценил]этилди-3,5-ксилилфосфин,
(S)-1-[(R)-2-ди-(4-метокси-3,5-диметил)фенилфосфино)ферроценил]этилди-(2-метилфенил)фосфин,
(S)-1-[(R)-2-ди-(2-фурил)фосфиноферроценил]этилди-(2-метилфенил)фосфин,
(S)-1-[(R)-2-ди(трет-бутилфосфино)ферроценил]этилдифенилфосфин,
(S)-1-[(R)-2-ди(трет-бутилфосфино)ферроценил]этилди-(2-метилфенил)фосфин, и
(S)-1-[(R)-2-дифенилфосфиноферроценил]этилдифенилфосфин.
Согласно одному предпочтительному варианту осуществления, лиганд формулы (IIa) представляет собой (R)-1-[(S)-2-дифенилфосфиноферроценил]этилдифенилфосфин. Согласно еще одному предпочтительному варианту осуществления, лиганд формулы (IIb) представляет собой (S)-1-[(R)-2-дифенилфосфиноферроценил]этилдифенилфосфин.
Фосфорный лиганд L1 также предпочтительно включает PPh3, PCy3 (трициклогексилфосфин), dppf (1,1'-бис(дифенилфосфино)ферроцен), dppp (1,3-бис(дифенилфосфино)пропан), dppb (1,4-бис(дифенилфосфино)бутан), Dipfc (1,1'-бис(диизопропилфосфино)ферроцен), dCyPfc (1,1'-бис(дициклогексилфосфино)ферроцен и DB'PF (1,i'-бис(ди-трет-бутилфосфино)ферроцен). Согласно одному варианту осуществления, фосфорный лиганд L1 является незамещенным. Согласно еще одному варианту осуществления, лиганд L1 является замещенным.
Особенно предпочтительные фосфорные лиганды L1 могут выбираться из группы, которую составляют dppf, dppp, dppb и dCyPfc.
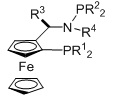
L2 представляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа. В качестве азотсодержащей гетероарильной группы могут присутствовать пиридинильные, порролильные, имидазолильные, пиразолильные, пиримидильные, индолильные или хинолинильные группы, предпочтительно пиридинильные группы. В качестве аминогруппы могут присутствовать первичные, вторичные или третичные аминогруппы, предпочтительно -NH2.
Бидентатный N,N-лиганд может выбираться из группы, которую составляют лиганды (1), (2) и (3):
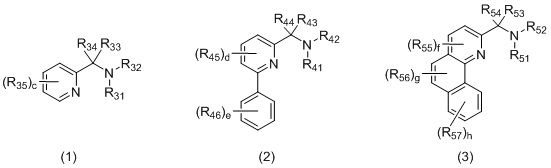
Согласно одному варианту осуществления, бидентатный N,N-лиганд представляет собой лиганд (1). Согласно еще одному варианту осуществления, бидентатный N,N-лиганд представляет собой лиганд (2). Согласно следующему варианту осуществления, бидентатный N,N-лиганд представляет собой лиганд (3).
Бидентатные N,N-лиганды, имеющие формулы (1), (2) или (3), могут добавляться в реакционную смесь в форме свободного основания или соли (например, гидрохлоридной соли). Однако когда используется соль, реакционная смесь может также содержать основание (такое как триэтиламин), чтобы образовалось свободное основание.
Лиганды (1), (2) и (3) представляют собой бидентатные лиганды, поскольку каждый лиганд координируется атомом M через функциональные аминогруппы и пиридиновые группы.
R31 и R32 могут независимо выбираться из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил. Предпочтительно R31 и R32 независимо выбираются из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C5-20-арил и замещенный C5-20-арил, в том числе -H, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил, циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантанил, или арильные группы, такие как фенил, нафтил или антрацил. Согласно одному варианту осуществления, алкильные группы могут быть необязательно замещенными и содержать один или несколько заместителей, таких как галогенид (-F, -Cl, -Br или -I) или алкоксигруппы, например, метокси-, этокси- или пропоксигруппы. Арильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы, C1-C10-алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10-диалкиламиногруппы, C3-10-гетероциклоалкильные группы (такие как морфолинил и пиперадинил) или три(гало)метильные группы (например, F3C-).
Согласно одному варианту осуществления, один из радикалов R31 и R32 представляет собой -H, а другой выбирается из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил. Согласно одному предпочтительному варианту осуществления, один из радикалов R31 и R32 представляет собой -H, а другой выбирается из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C5-20-арил и замещенный C5-20-арил, в том числе -H, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил, циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантанил, или арильные группы, такие как фенил, нафтил или антрацил. Согласно одному варианту осуществления, алкильные группы могут быть необязательно замещенными и содержать один или несколько заместителей, таких как галогенид (-F, -Cl, -Br или -I) или алкоксигруппы, например, метокси-, этокси- или пропоксигруппы. Арильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы, C1-C10-алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10 -диалкиламиногруппы, C3-10-гетероциклоалкильные группы (такие как морфолинил и пиперадинил) или три(гало)метильные группы (например, F3C-).
Согласно одному предпочтительному варианту осуществления, оба радикала R31 и R32 представляют собой -H.
R33 и R34 могут быть одинаковыми или различными. Когда R33 и R34 являются различными, лиганд (1) будет содержать хиральный центр. Лиганд (1) может использоваться как рацемическая смесь, как индивидуальный энантиомер или как смесь энантиомеров, предпочтительно как индивидуальный энантиомер. Энантиомеры лиганда (1) можно получать в форме индивидуальных энантиомеров, например, посредством разделения рацемической смеси лиганда (1).
R33 и R34 могут независимо выбираться из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил. Предпочтительно R33 и R34 независимо выбираются из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C5-20-арил и замещенный C5-20-арил, в том числе -H, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил, циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантанил, или арильные группы, такие как фенил, нафтил или антрацил. Согласно одному варианту осуществления, алкильные группы могут быть необязательно замещенными и содержать один или несколько заместителей, таких как галогенид (-F, -Cl, -Br или -I) или алкоксигруппы, например, метокси-, этокси- или пропоксигруппы. Арильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы, C1-C10-алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10 -диалкиламиногруппы, C3-10-гетероциклоалкильные группы (такие как морфолинил и пиперадинил) или три(гало)метильные группы (например, F3C-). Предпочтительнее в качестве R33 и R34 независимо выбираются -H, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и фенил.
Согласно одному варианту осуществления, один из радикалов R33 и R34 представляет собой -H, а другой выбирается из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил. Согласно одному предпочтительному варианту осуществления, один из радикалов R33 и R34 представляет собой -H, а другой выбирается из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C5-20-арил и замещенный C5-20-арил, в том числе -H, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил, циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантанил, или арильные группы, такие как фенил, нафтил или антрацил. Согласно одному варианту осуществления, алкильные группы могут быть необязательно замещенными и содержать один или несколько заместителей, таких как галогенид (-F, -Cl, -Br или -I) или алкоксигруппы, например, метокси-, этокси- или пропоксигруппы. Арильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы, C1-C10-алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10 -диалкиламиногруппы, C3-10-гетероциклоалкильные группы (такие как морфолинил и пиперадинил) или три(гало)метильные группы (например, F3C-). Предпочтительнее в качестве R33 и R34 независимо выбираются -H, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и фенил. Наиболее предпочтительно один из радикалов R33 и R34 представляет собой -H, а другой из радикалов R33 и R34 выбирается из группы, которую составляют -H, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и фенил.
R35 можно присутствовать или отсутствовать. Когда он отсутствует, c равняется 0, т.е. пиридиновое кольцо является незамещенным. Когда R35 присутствует, c может составлять 1, 2, 3 или 4. Когда c составляет 2, 3 или 4, радикалы R35 могут быть одинаковыми или различными по отношению друг к другу. Единственный или каждый радикал R35 может независимо выбираться из группы, которую составляют незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил. Предпочтительно R35независимо выбирается из группы, которую составляют незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C5-20-арил и замещенный C5-20-арил, в том числе метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил, циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантанил, или арильные группы, такие как фенил, нафтил или антрацил. Согласно одному варианту осуществления, алкильные группы могут быть необязательно замещенными и содержать один или несколько заместителей, таких как галогенид (-F, -Cl, -Br или -I) или алкоксигруппы, например, метокси-, этокси- или пропоксигруппы. Арильная группа может быть необязательно замещенной и содержать один или несколько (например, 1, 2, 3, 4 или 5) заместителей, таких как галогенид (-F, -Cl, -Br или -I), имеющие неразветвленную или разветвленную цепь C1-C10-алкильные группы, C1-C10-алкоксигруппы, имеющие неразветвленную или разветвленную цепь C1-C10 -диалкиламиногруппы, C3-10-гетероциклоалкильные группы (такие как морфолинил и пиперадинил) или три(гало)метильные группы (например, F3C-). Предпочтительно, c равняется 0, т.е. R35 отсутствует, и пиридиновое кольцо является незамещенным.
R41 и R42 могут независимо выбираться из групп, описанных выше для R31 и R32.
R43 и R44 могут быть одинаковыми или различными. Когда R43 и R44 являются различными, лиганд (2) будет содержать хиральный центр. Лиганд (2) может использоваться как рацемическая смесь, как индивидуальный энантиомер или как смесь энантиомеров, предпочтительно как индивидуальный энантиомер. Энантиомеры лиганда (2) можно получать в форме индивидуальных энантиомеров, например, посредством разделения рацемической смеси лиганда (2). R43 и R44 могут независимо выбираться из групп, которые описаны выше для R33 и R34.
R45 можно присутствовать или отсутствовать. Когда он отсутствует, d равняется 0. Когда R45 присутствует, d может составлять 1, 2 или 3. Когда d составляет 2 или 3, все из радикалов R45 могут быть одинаковыми или различными по отношению друг к другу. Единственный или каждый радикал R45 может выбираться из групп, описанных выше для R35. Предпочтительно, d равняется 0, т.е. R45 отсутствует.
R46 можно присутствовать или отсутствовать. Когда он отсутствует, e равняется 0. Когда R46 присутствует, e может составлять 1, 2, 3, 4 или 5. Когда d составляет 2, 3, 4 или 5, все из радикалов R46 могут быть одинаковыми или различными по отношению друг к другу. Единственный или каждый радикал R46 может выбираться из групп, описанных выше для R35. Согласно одному предпочтительному варианту осуществления, e равняется 0, т.е. R46 отсутствует. Согласно еще одному предпочтительному варианту осуществления, e равняется 1, и R46 выбирается из группы, которую составляют метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил, предпочтительно, 4-Me.
R51 и R52 могут независимо выбираться из групп, описанных выше для R31 и R32.
R53 и R54 могут быть одинаковыми или различными. Когда R53 и R54 являются различными, лиганд (3) будет содержать хиральный центр. Лиганд (3) может использоваться как рацемическая смесь, как индивидуальный энантиомер или как смесь энантиомеров, предпочтительно как индивидуальный энантиомер. Энантиомеры лиганда (3) можно получать в форме индивидуальных энантиомеров, например, посредством разделения рацемической смеси лиганда (3). R53 и R54 могут независимо выбираться из групп, которые описаны выше для R33 и R34.
R55 можно присутствовать или отсутствовать. Когда он отсутствует, f равняется 0. Когда R55 присутствует, f может составлять 1 или 2. Когда f составляет 2, все из радикалов R55 могут быть одинаковыми или различными по отношению друг к другу. Единственный или каждый радикал R55 может выбираться из групп, описанных выше для R35. Предпочтительно, f равняется 0, т.е. R55 отсутствует.
R56 можно присутствовать или отсутствовать. Когда он отсутствует, g равняется 0. Когда R56 присутствует, g может составлять 1 или 2. Когда g составляет 2, все из радикалов R56 могут быть одинаковыми или различными по отношению друг к другу. Единственный или каждый радикал R56 может выбираться из групп, описанных выше для R35. Согласно одному предпочтительному варианту осуществления, g равняется 0, т.е. R56 отсутствует.
R57 можно присутствовать или отсутствовать. Когда он отсутствует, h равняется 0. Когда R57 присутствует, h может составлять 1, 2, 3 или 4. Когда d составляет 2, 3 или 4, все из радикалов R57 могут быть одинаковыми или различными по отношению друг к другу. Единственный или каждый радикал R57 может выбираться из групп, описанных выше для R35. Согласно одному предпочтительному варианту осуществления, h равняется 0, т.е. R57 отсутствует.
Согласно одному предпочтительному варианту осуществления, бидентатный N,N-лиганд выбирается из группы, которую составляют:
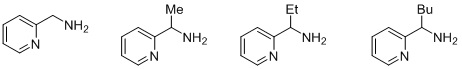
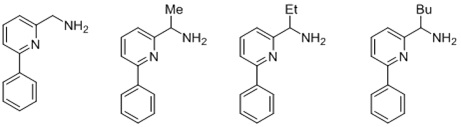
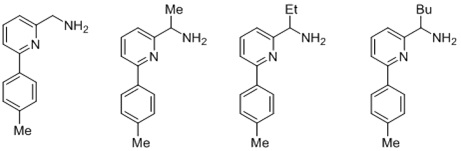
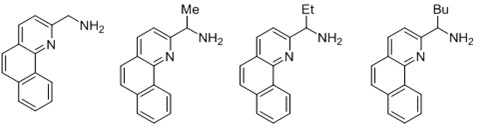
Согласно одному особенно предпочтительному варианту осуществления, бидентатный N,N-лиганд представляет собой 2-аминометилпиридин (AMPY).
Согласно одному предпочтительному варианту осуществления, комплекс [M(X)2(L1)m(L2)] может выбираться из группы, которую составляют:
[RuCl2(dppp)AMPY];
[RuCl2(dppb)AMPY];
[RuCl2(dppf)AMPY];
[RuCl2(DCyPFc)AMPY];
[RuCl2(DiPFc) AMPY];
[RuCl2(DB'PFc)AMPY];
[RuCl2 (Josiphos*) AMPY]; и
[RuCl22(TolBINAP) AMPY];
Комплекс [M(X)2(L1)m(L2)] реагирует с фосфорным лигандом L1 и бидентатным N,N-лигандом L2 в кетонном растворителе, и получается комплекс [M(X)2(L1)m(L2)]. Термин “кетонный растворитель” означает жидкий кетон, который имеет температуру кипения при атмосферном давлении (т.е. 1,0135⋅105 Па), составляющую менее чем 160°C и предпочтительнее ниже 120°C. Предпочтительные примеры представляют собой ацетон, метилэтилкетон (MEK), также известный как 2-бутанон, метилизобутилкетон (MIBK), также известный как 4-метил-2-пентанон, и диэтилкетон, также известный как 3-пентанон. Особенно предпочтительный кетонный растворитель представляет собой MEK. Еще один особенно предпочтительный кетонный растворитель представляет собой ацетон.
Существуют несколько преимуществ, связанных с использованием кетонного растворителя. Одно преимущество заключается в том, что кетонные растворители, такие как ацетон, являются нехлорированными и имеют низкий токсикологический потенциал.
Еще одно преимущество заключается в том, что объемы используемого в реакции растворителя уменьшаются по сравнению с растворителями предшествующего уровня техники, согласно которой использовался дихлорметан.
Кроме того, в отличие от растворителей предшествующего уровня техники, в качестве которых использовался толуол, кетонные растворители, как правило, легче удаляются посредством испарения; кроме того, когда бидентатный N,N-лиганд L2 представляет собой 2-аминометилпиридин, из кетонных растворителей не образуется пастообразный продукт, для фильтрования которого требуется продолжительный период времени, и при высыхании которого не образуется подобный керамике продукт, для которого требуется дальнейшая обработка (например, посредством измельчения) в целях получения порошок. Все из этих преимуществ отсутствуют в случае использования толуола.
В способе согласно одному варианту осуществления настоящего изобретения комплексы суспендируются в кетонном растворителе. “Суспензия” означает гетерогенную смесь, по меньшей мере, частично растворенного комплекса (или комплексов) в кетонном растворителе. Таким образом, “суспензия” представляет собой смесь комплекса или комплексов, которые частично присутствуют в твердой фазе, а также частично растворяются в кетонном растворителе. Комплексы, которые могут суспендироваться, включают исходный материал [M(X)2(L)3], промежуточные комплексы металлов и/или продукт [M(X)2(L1)m(L2)].
Следующее преимущество заключается в том, что кетонный растворитель способен удалять в больших количествах монодентатный фосфорный лиганд L, который высвобождается из исходного материала [M(X)2(L)3] в процессе реакции. Например, когда используется [RuCl2(PPh3)3] в качестве исходного материала и ацетон в качестве кетонного растворителя, может быть получено практически полное удаление PPh3; в данном отношении, комплексы металлов, как правило, присутствуют в твердой форме в реакционной смеси (потому что они образуют суспензию в кетонном растворителе), в то время как лиганд L практически полностью растворяется в кетонном растворителе вместе с непрореагировавшим лигандом L1.
С другой стороны, когда дихлорметан используется в качестве растворителя, реакционная смесь находится в растворе, поскольку компоненты реакционной смеси являются растворимыми. Таким образом, для получения образующегося комплекса, как правило, требуется его осаждение из реакционной смеси. В данном отношении, использование смесей растворителей, содержащих дихлорметан и спирт, дихлорметан и алкан или толуол и алкан, как правило, приводит к значительному снижению выхода и/или образованию загрязненных продуктов.
Согласно еще одному варианту осуществления, исходный материал [M(X)2(L)3] образует суспензию с кетонным растворителем, но в реакции с фосфорным лигандом L1 или бидентатным N,N-лигандом L2 могут образовываться промежуточные комплексы металлов и/или продукт [M(X)2(L1)m(L2)], которые являются растворимыми в кетонном растворителе. В данном случае кетонный растворитель сохраняет способность удаления больших количеств монодентатного фосфорного лиганда L, который высвобождается из исходного материала [M(X)2(L)3] в процессе реакции. Если какой-либо твердый исходный материал [M(X)2(L)3] остается после окончания реакции, исходный материал [M(X)2(L)3] может отделяться от растворимого продукта [M(X)2(L1)m(L2)] посредством фильтрации, декантации или обработки на центрифуге.
Кетонный растворитель может использоваться в любом подходящем объеме. Например, соотношение кетонного растворителя и комплекса [M(X)2(L)3] может составлять от приблизительно 3 до приблизительно 35 мл/г. Согласно определенным вариантам осуществления, данное соотношение может составлять от приблизительно 3 до приблизительно 20 мл/г. Согласно определенным вариантам осуществления, соотношение может составлять от приблизительно 20 до приблизительно 35 мл/г.
Реагирующие вещества могут добавляться в любой подходящей последовательности, но в одном предпочтительном способе согласно настоящему изобретению фосфорный лиганд L1 может добавляться (например, порциями) в смесь, содержащую комплекс [M(X)2(L)3] в кетонном растворителе, и, после перемешивания в течение подходящего периода времени и при подходящей температуре, может добавляться бидентатный N,N-лиганд L2 (например, порциями). Если это желательно, бидентатный N,N-лиганд L2 может добавляться в реакционную смесь в форме раствора в кетонном растворителе. Реакционная смесь может затем перемешиваться в течение дополнительного подходящего периода времени и при подходящей температуре. Если это желательно, кетонный растворитель может насыщаться инертным газом (например, азот) перед тем, как он добавляется в реакционную смесь.
В еще одном предпочтительном способе согласно настоящему изобретению бидентатный N,N-лиганд L2 может добавляться (например, порциями) в смесь, содержащую комплекс [M(X)2(L)3] в кетонном растворителе и, после перемешивания в течение подходящего периода времени и при подходящей температуре, может добавляться фосфорный лиганд L1 (например, порциями). Если это желательно, бидентатный N,N-лиганд L2 может добавляться в реакционную смесь в форме раствора в кетонном растворителе. Реакционная смесь может затем перемешиваться в течение дополнительного подходящего периода времени и при подходящей температуре. Если это желательно, кетонный растворитель может насыщаться инертным газом (например, азот) перед тем, как он добавляется в реакционную смесь.
Фосфорный лиганд L1 может присутствовать в стехиометрическом количестве или в небольшом избытке по отношению к комплексу [M(X)2(L)3]. Когда используются стехиометрические количества, в данной методике не требуется использование избытка лиганда, и в результате этого весь способ приобретает высокую экономичность и атомную эффективность для промышленного производства. Когда используется небольшой избыток, соотношение фосфорного лиганда L1 и комплекса [M(X)2(L)3] может составлять приблизительно 1,05 - приблизительно 1,2 : приблизительно 1, в том числе приблизительно 1,05 : приблизительно 1, приблизительно 1,1 : приблизительно 1, приблизительно 1,15 : приблизительно 1 или приблизительно 1,2 : приблизительно 1.
Бидентатный N,N-лиганд L2 может присутствовать в стехиометрическом количестве или в небольшом избытке по отношению к комплексу [M(X)2(L)3]. В данной методике не требуется использование избытка лиганда, и в результате этого весь способ приобретает высокую экономичность и атомную эффективность для промышленного производства. Когда используется небольшой избыток, соотношение бидентатного N,N-лиганда L2и комплекса [M(X)2(L)3] может составлять приблизительно 1,05 - 1,2 : приблизительно 1, в том числе приблизительно 1,05 : приблизительно 1, приблизительно 1,1 : приблизительно 1, приблизительно 1,15: приблизительно 1 или приблизительно 1,2 : приблизительно 1.
Реакция может осуществляться в инертной атмосфере, например, в атмосфере, содержащей азот или аргон, предпочтительно азот.
Способ согласно настоящему изобретению может предпочтительно осуществляться при одной или нескольких температурах в интервале от приблизительно -10°C до температуры кипения кетонного растворителя, составляющей, например, приблизительно 120°C. Предпочтительнее способ согласно настоящему изобретению может осуществляться в интервале от приблизительно -5°C до приблизительно 80°C, в том числе от приблизительно 0°C до приблизительно 50°C, например, от приблизительно 15°C до приблизительно 30°C, например, при комнатной температуре. Оказывается предпочтительным, что температура поддерживается на уровне ниже температуры разложения, и, поскольку известно, что исходный материал [M(X)2(L)3] и/или продукт [M(X)2(L1)m(L2)] разлагаются в более высоких температурных интервалах, температура должна поддерживаться на уровне ниже температуры разложения.
Реакция может осуществляться в течение периода, составляющего от приблизительно нескольких минут до приблизительно 72 часов, но обычно она завершается в течение приблизительно 24 часов. После завершения реакции продукт [M(X)2(L1)m(L2)] выделяется из реакционной смеси любым соответствующим способом, который зависит от агрегатного состояния продукта. Как правило, когда комплекс [M(X)2(L1)m(L2)] является твердым, он может выделяться из реакционной смеси посредством фильтрации, декантации или обработки на центрифуге. Если это желательно, реакционная смесь может охлаждаться до температуры, которая является выше комнатной температуры и ниже температуры реакции в кетонном растворителе (например, составляет приблизительно от 45 до 50°C, когда кетонный растворитель представляет собой метилэтилкетон), перед выделением комплекса [M(X)2(L1)m(L2)]. Выделение комплекса [M(X)2(L1)m(L2)] из реакционной смеси, которая остается теплой, имеет преимущество, заключающееся в том, что свободный фосфорный лиганд L1 и/или соответствующий оксид (если он присутствует) имеет более высокую растворимость в теплом кетонном растворителе, и, таким образом, упрощается выделение комплекса [M(X)2(L1)m(L2)] из реакционной смеси. Если присутствует свободный фосфорный лиганд L1 и/или соответствующий оксид, присутствие этих соединений может приводить к окрашиванию продукта [M(X)2(L1)m(L2)]. В этом случае комплекс [M(X)2(L1)m(L2)] может перемешиваться однократно или несколько раз (например, 1, 2 или 3 раза) в кетонном растворителе (например, ацетон) до тех пор, пока свободный фосфорный лиганд L1 и/или соответствующий оксид не будет удален практически полностью. В качестве альтернативы или в качестве дополнения, комплекс [M(X)2(L1)m(L2)] можно промывать однократно или несколько раз (например, 1, 2 или 3 раза) кетонным растворителем. Аликвоты кетонного растворителя можно нагревать (например, при температуре от 45 до 50°C) перед промыванием комплекса [M(X)2(L1)m(L2)]. Комплекс [M(X)2(L1)m(L2)] можно высушивать, используя известные методы, например, при температуре в интервале от 10 до 60°C и предпочтительно от 20 до 40°C в условиях вакуума от 1 до 30 мбар (от 100 до 3000 Па) в течение от одного часа до 5 суток. Если это желательно, может осуществляться перекристаллизация комплекса, хотя она, как правило, не является обязательной.
В качестве альтернативы, кетонный растворитель может удаляться (например, методами дистилляции или отгона) из раствора продукта [M(X)2(L1)m(L2)] до тех пор, пока не будет получен более концентрированный раствор продукта [M(X)2(L1)m(L2)] в оставшейся части кетонного растворителя. После этого антирастворитель, в качестве которого выбираются спирты или алканы имеющие низкую температуру кипения, может добавляться, чтобы вызывать осаждение комплекса. Подходящие спирты имеют температуры кипения ниже 160°C и предпочтительнее ниже 120°C. Примеры спиртовых растворителей представляют собой, но не ограничиваются этим, метанол, этанол, изомеры пропанола (например, н-пропанол или изопропанол), изомеры бутанола (например, н-бутанол, изобутанол или трет-бутанол), изомеры пентанола (например, 1-пентанол, 2-пентанол, 3-пентанол, неопентиловый спирт, трет-пентиловый спирт, изопентиловый спирт или циклопропанол) и изомеры гексанола (например, 1-гексанол, 2-гексанол, 3-гексанол или циклогексанол). Предпочтительные примеры представляют собой метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол или трет-бутанол. Особенно предпочтительный спиртовой растворитель представляет собой изопропанол. Подходящие алканы имеют температуры кипения при атмосферном давлении в интервале от 0 до 150°C. Алканы, которые могут использоваться, представляют собой имеющие низкие температуры кипения алканы, такой как изомеры пентана, изомеры гексана, изомеры гептана или изомеры октана. Предпочтительно алкан представляет собой н-пентан, н-гексан, циклогексан или н-гептан и предпочтительнее циклогексан. Комплекс [M(X)2(L1)m(L2)] может затем высушиваться с использованием известных способов, например, при температурах в интервале от 10 до 60°C и предпочтительно от 20 до 40°C в условиях вакуума от 1 до 30 мбар (от 100 до 3000 Па) в течение от одного часа до 5 суток. Если это желательно, может осуществляться перекристаллизация комплекса, хотя она может оказаться необязательной.
Комплекс [M(X)2(L1)m(L2)] можно получать в больших количествах, и связи с этим авторы настоящего изобретения осуществляли способ согласно настоящему изобретению, получая вплоть до 2 кг продукта.
Полученный комплекс [M(X)2(L1)m(L2)] может содержать остаточный кетонный растворитель. Следовательно, комплексы, полученные таким способом, могут оказаться подходящими в качестве катализаторов в приложениях, в которых используются кетонные растворители.
Комплекс [M(X)2(L1)m(L2)], полученный способом согласно настоящему изобретению, представляет собой практически чистый транс-[M(X)2(L1)m(L2)], т.е. комплекс [M(X)2(L1)m(L2)] имеет структуру:
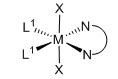
транс-изомер
L1=монодентатный P-лиганд, m=2
транс-изомер

L1=монодентатный P-лиганд, m=1
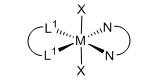
Термин «транс-изомер» определяется в зависимости от ориентации анионных лигандов. В данном отношении октаэдрический комплекс определяется как транс-изомер, когда анионные лиганды образуют угол 180°C по отношению друг к другу. С другой стороны, октаэдрический комплекс определяется как цис-изомер, когда анионные лиганды занимают соседние положения по отношению друг к другу.

цис-изомер

L1=монодентатный P лиганд, m=2

цис-изомер

L1=монодентатный P, m=1
Согласно одному варианту осуществления, комплекс [M(X)2(L1)m(L2)] может выбираться из группы, которую составляют:
транс-[RuCl2(dppp)AMPY];
транс-lRuCl2(dppb)AMPY];
транс-lRuCl2(dppf)AMPY];
транс-[RuCl2(DCyPFc)AMPY]; и
транс-lRuCl2(Josiphos*)AMPY].
Согласно еще одному аспекту настоящего изобретения, предлагается способ получения комплекса [M(X)2(L1)(L2)], причем данный способ включает следующую стадию:
реакция комплекса [M(X)2(L)3] с бидентатным N,N-лигандом L2 в кетонном растворителе для получения комплекс [M(X)2(L1)(L2)];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L представляет собой монодентатный фосфорный лиганд; и
L2 представляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа.
M, X, L, L2, комплекс [M(X)2(L)3], комплекс [M(X)2(L1)(L2)], кетонный растворитель, условия реакции и выделение комплекса [M(X)2(L1)(L2)] являются такими, как, в основном, описано выше.
Согласно следующему аспекту настоящего изобретения, предлагается способ получения комплекса [M(X)2L(L1)m], причем данный способ включает следующую стадию:
реакция комплекса [M(X)2(L)3] с фосфорным лигандом L1 в кетонном растворителе для получения комплекса [M(X)2L(L1)m];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L представляет собой монодентатный фосфорный лиганд;
L1 представляет собой монодентатный фосфорный лиганд, который отличается от L, или бидентатный фосфорный лиганд;
m составляет 1 или 2, причем:
когда m составляет 1, L1 представляет собой бидентатный фосфорный лиганд; и
когда m составляет 2, каждый L1 представляет собой монодентатный фосфорный лиганд.
M, X, L, L1, m, комплекс [M(X)2(L)3], комплекс [M(X)2L(L1)m], кетонный растворитель, условия реакции и выделение комплекса [M(X)2L(L1)m] являются, в основном, такими, как описано выше.
Кроме того, фосфорный лиганд L1 предпочтительно представляет собой PPh3, dppf (1,1'-бис(дифенилфосфино)ферроцен), dppp (1,3-бис(дифенилфосфино)пропан), dppb (1,4-бис(дифенилфосфино)бутан), Dipfc (1,1'-бис(диизопропилфосфино)ферроцен), dCyPfc (1,1'-бис(дициклогексилфосфино)ферроцен), Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантен) и DPEPhos (бис[(2-дифенилфосфино)фенил]эфир). Согласно одному варианту осуществления, фосфорный лиганд L1 является незамещенным. Согласно еще одному варианту осуществления, лиганд L1 является замещенным.
Согласно еще одному аспекту настоящего изобретения, предлагается способ получения комплекса цис-[M(X)2(L1)m(L2)], причем данный способ включает следующие стадии:
a) обработка комплекса транс-[M(X)2(L1)m(L2)] в спиртовом растворителе; и
b) нагревание реакционной смеси для получения комплекса цис-[M(X)2(L1)m(L2)];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L1 представляет собой монодентатный фосфорный лиганд или бидентатный фосфорный лиганд;
m составляет 1 или 2, причем:
когда m составляет 1, L1 представляет собой бидентатный фосфорный лиганд;
когда m составляет 2, каждый L1 представляет собой монодентатный фосфорный лиганд; и
L2 представляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа.
Преимущество получения комплекса цис-[M(X)2(L1)m(L2)] заключается в том, что, согласно некоторым вариантам осуществления, он может проявлять более высокую каталитическую активность в каталитических приложениях.
M, X, L1, m, L2 и комплекс [M(X)2(L1)m(L2)] являются такими, как, в основном, описано выше.
Комплекс транс-[M(X)2(L1)m(L2)] обрабатывается в спиртовом растворителе. Комплекс транс-[M(X)2(L1)m(L2)] может образовывать раствор в спиртовом растворителе, или он может образовывать суспензию. «Суспензия» означает гетерогенную смесь, по меньшей мере, частично растворившегося комплекса (или комплексов) в спиртовом растворителе. Таким образом, «суспензия» представляет собой смесь комплекса или комплексов, которые присутствуют частично в твердой фазе, а также частично растворяются в спиртовом растворителе. Комплексы, которые могут суспендироваться, включают исходный материал транс-[M(X)2(L1)m(L2)], и/или продукт цис-[M(X)2(L1)m(L2)].
Термин «спиртовой растворитель» означает жидкий спирт, который имеет температуру кипения при атмосферном давлении (т.е. 1,0135⋅105 Па), составляющую менее чем 160°C и предпочтительнее ниже 120°C. Примеры спиртовых растворителей представляют собой, но не ограничиваются этим, метанол, этанол, изомеры пропанола (например, н-пропанол или изопропанол), изомеры бутанола (например, н-бутанол, изобутанол или трет-бутанол), изомеры пентанола (например, 1-пропанол, 2-пентанол, 3-пентанол, неопентиловый спирт, трет-пентиловый спирт, изопентиловый спирт или циклопропанол) и изомеры гексанола (например, 1-гексанол, 2-гексанол, 3-гексанол или циклогексанол). Предпочтительные примеры представляют собой метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол или трет-бутанол. Особенно предпочтительный спиртовой растворитель представляет собой изопропанол. Хотя может использоваться смесь спиртовых растворителей, как правило, подходящим оказывается индивидуальный спирт. Предпочтительно, спиртовой растворитель является безводным.
Спиртовой растворитель может использоваться в любом подходящем объеме. Например, соотношение спиртового растворителя и комплекса транс-[M(X)2(L1)m(L2)] может составлять от приблизительно 3 до приблизительно 25 мл/г, в том числе от приблизительно 4 до приблизительно 20 мл/г.
Комплекс транс-[M(X)2(L1)m(L2)] может содержать остаточный кетонный растворитель. В этом случае может оказаться желательным предварительное частичное удаление спиртового растворителя (например, посредством дистилляции) в целях удаления оставшегося кетона. Если это желательно, дополнительная порция спиртового растворителя может добавляться в реакционную смесь для восстановления объема, уменьшающегося при таком удалении.
Реакционная смесь нагревается для получения комплекса цис-[M(X)2(L1)m(L2)]. Согласно одному варианту осуществления, реакционная смесь можно нагреваться с обратным холодильником. Превращение транс-комплекса в цис-комплекс можно наблюдать методом ЯМР.
На стадии (a) может дополнительно присутствовать фосфорный лиганд L1. В данном отношении, таким образом, стадия (a) включает обработку комплекса транс-[M(X)2(L1)m(L2)] и фосфорного лиганда L1 в спиртовом растворителе. Комплекс транс-[M(X)2(L1)m(L2)] может содержать комплекс [M(X)2(L)2(L2)] в качестве побочного продукта. Например, авторы настоящего изобретения обнаружили, что в процессе синтеза транс-[RuCl2(dppb)(AMPY)] комплекс транс-[RuCl2(PPh3)2(AMPY)] может образовываться в различных количествах, составляющих, например, от 5 до 10%, в результате введения лиганда AMPY в непрореагировавший исходный материал [RuCl2(PPh3)3]. Таким образом, нагревание комплекса транс-[M(X)2(L1)m(L2)] с фосфорным лигандом L1 в спиртовом растворителе имеет двойное преимущество. В данном отношении, не желая ограничиваться теорией, авторы настоящего изобретения полагают, что фосфорный лиганд L1 превращает побочный продукт [M(X)2(L)2(L2)] (если он присутствует) в комплекс [M(X)2(L1)m(L2)], и, во-вторых, фосфорный лиганд L1 изомеризует комплекс транс-[M(X)2(L1)m(L2)] в комплекс цис-[M(X)2(L1)m(L2)]. Авторы настоящего изобретения отмечают, что никакая изомеризация не происходит, когда комплекс транс-[M(X)2(L1)m(L2)] нагревается в кетонном растворителе, таком как ацетон.
Количество фосфорного лиганда L1 может находиться в интервале от приблизительно 0,001 до приблизительно 0,7 мол. экв. по отношению к молярному количеству комплекса транс-[M(X)2(L1)m(L2)], например, в интервале от приблизительно 0,002 до приблизительно 0,5 мол. экв.
Реакция может осуществляться в течение периода времени, составляющего от приблизительно нескольких минут до приблизительно 90 часов, но обычно она завершается в течение приблизительно 24 часов. После завершения реакции, полученный цис-[M(X)2(L1)m(L2)] выделяется из реакционной смеси любым соответствующим способом, который зависит от агрегатного состояния продукта. Как правило, когда комплекс цис-[M(X)2(L1)m(L2)] является твердым, он может выделяться из реакционной смеси посредством фильтрации, декантации или обработки на центрифуге. Если это желательно, реакционная смесь может охлаждаться до температуры, которая является выше комнатной температуры и ниже температуры кипения спиртового растворителя (например, приблизительно 50°C, когда спиртовой растворитель представляет собой изопропанол), перед выделением комплекса цис-[M(X)2(L1)m(L2)]. Выделение комплекса цис-[M(X)2(L1)m(L2)], когда реакционная смесь остается теплой, имеет преимущество, заключающееся в том, что свободный фосфорный лиганд L1 и/или соответствующий оксид (если он присутствует) имеет более высокую растворимость в теплом спиртовом растворителе, и, таким образом, упрощается выделение комплекса цис-[M(X)2(L1)m(L2)] из реакционной смеси. Если присутствует свободный фосфорный лиганд L1 и/или соответствующий оксид, присутствие этих соединений может вызывать окрашивание получаемого цис-[M(X)2(L1)m(L2)]. В этом случае комплекс цис-[M(X)2(L1)m(L2)] может перемешиваться однократно или несколько раз (например, 1, 2 или 3 раза) с одним из описанных выше кетонных растворителей (таких как ацетон) до тех пор, пока свободный фосфорный лиганд L1 и/или соответствующий оксид не будет удален практически полностью. В качестве альтернативы или в качестве дополнения, комплекс цис-[M(X)2(L1)m(L2)] можно промывать однократно или несколько раз (например, 1, 2 или 3 раза) спиртовым растворителем (таким как изопропанол). Аликвоты спиртового растворителя можно нагревать (например, до 50°C) перед тем, как осуществляется промывание комплекса цис-[M(X)2(L1)m(L2)]. Комплекс цис-[M(X)2(L1)m(L2)] может затем высушиваться с использованием известных способов, например, при температуре в интервале от 10 до 60°C и предпочтительно от 20 до 40°C в условиях вакуума от 1 до 30 мбар (от 100 до 3000 Па) в течение от одного часа до 5 суток. Если это желательно, может осуществляться перекристаллизация комплекса, хотя она, как правило, не является обязательной.
В качестве альтернативы, спиртовой растворитель может удаляться (например, методами дистилляции или отгона) из раствора получаемого цис-[M(X)2(L1)m(L2)] до тех пор, пока не будет получен более концентрированный раствор продукта цис- [M(X)2(L1)m(L2)] в оставшейся части спиртового растворителя. После этого может добавляться антирастворитель, выбранный из имеющих низкую температуру кипения алканов, вызывая осаждение комплекса. Подходящие алканы имеют температуры кипения при атмосферном давлении в интервале от 0 до 150°C. Алканы, которые могут использоваться, представляют собой имеющие низкую температуру кипения алканы, такие как изомеры пентана, изомеры гексана, изомеры гептана или изомеры октана. Алкан представляет собой предпочтительно н-пентан, н-гексан, циклогексан или н-гептан и предпочтительнее циклогексан. Комплекс цис-[M(X)2(L1)m(L2)] может затем высушиваться с использованием известных способов, например, при температуре в интервале от 10 до 60°C и предпочтительно от 20 до 40°C в условиях вакуума от 1 до 30 мбар (от 100 до 3000 Па) в течение от одного часа до 5 суток. Если это желательно, может осуществляться перекристаллизация комплекса, хотя она может оказаться необязательной.
Комплекс цис-[M(X)2(L1)m(L2)] может быть получен в большом количестве, и в данном отношении авторы настоящего изобретения осуществляли данный способ, получая вплоть до 1,9 кг продукта.
Согласно еще одному аспекту настоящего изобретения, предлагается способ получения комплекса цис-[M(X)2(L1)m(L2)], причем данный способ включает следующую стадию:
реакция комплекс [M(X)2(L)2(L2)] с фосфорным лигандом L1 в спиртовом растворителе для получения комплекса цис-[M(X)2(L1)m(L2)];
в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L представляет собой монодентатный фосфорный лиганд;
L1 представляет собой монодентатный фосфорный лиганд, который отличается от L, или бидентатный фосфорный лиганд;
m составляет 1 или 2, причем:
когда m составляет 1, L1 представляет собой бидентатный фосфорный лиганд;
когда m составляет 2, каждый L1 представляет собой монодентатный фосфорный лиганд; и
L2 представляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа.
M, X, L, L1, m, L2, комплекс [M(X)2(L)2(L2)], комплекс цис-[M(X)2(L1)m(L2)], спиртовой растворитель, условия реакции и выделение комплекса цис-[M(X)2(L1)m(L2)] являются такими, как, в основном, описано выше.
Комплекс цис-[M(X)2(L1)m(L2)] может быть получен комбинированным способом, согласно которому сначала получаются комплексы транс-[M(X)2(L1)m(L2)] или [M(X)2(L)2(L2)] с использованием кетонного растворителя, а затем получается комплекс цис-[M(X)2(L1)m(L2)] с использованием спиртового растворителя. Преимущество осуществления данного способа заключается в том, что может быть получен чистый комплекс цис-[M(X)2(L1)m(L2)]. Это объясняется тем, что способ с использованием кетонного растворителя упрощает удаление свободного фосфорного лиганда, и, таким образом, в качестве продукта получается транс-[M(X)2(L1)m(L2)] или [M(X)2(L)2(L2)] более высокого качества, а способ с использованием спиртового растворителя упрощает обмен одного фосфорного лиганда на другой (если это желательно), а также упрощает изомеризация транс-комплекса в цис-комплекс. Эти преимущества отсутствуют в способах, в которых используется, например, толуол, где получение транс-комплекса и его последующая изомеризация происходит в одном реакторе.
Комплексы, полученные способами согласно настоящему изобретению, являются чистыми, и, если это желательно, они могут использоваться в каталитических реакциях в том состоянии, в котором они получены. Комплексы могут содержать остаточный спирт в небольшом количестве. Катализаторы могут использоваться в каталитических реакциях в том состоянии, в котором они получены, или после дополнительного высушивания. Авторы настоящего изобретения обнаружили, что при высушивании в вакууме спирты легче удаляются, чем ароматические растворители, такие как толуол. Кроме того, комплексы, полученные с использованием способов согласно настоящему изобретению, легче отфильтровываются, и, таким образом, они являются пригодными для крупномасштабного производства.
Согласно еще одному аспекту настоящего изобретения, предлагается комплекс [M(X)2(L)2(L2)], в котором:
M представляет собой рутений или осмий;
X представляет собой анионный лиганд;
L1 представляет собой бидентатный фосфорный лиганд, выбранный из группы, которую составляют: (i) лиганд формулы (Ia) или (Ib):

в которых:
(i) R20 и R21 в каждом случае независимо выбираются из группы, которую составляют незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C5-20-арил и замещенный C5-20-арил;
(ii) лиганд формулы (IIa) или (II):

в которых:
R22 и R23 независимо выбираются из группы, которую составляют незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил;
R24 и R25 независимо выбираются из группы, которую составляют незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил; и
R26 выбирается из группы, которую составляют незамещенный C1-20-алкил и замещенный C1-20-алкил;
(iii) лиганд, выбранный из группы, которую составляют 1,1'-бис(диизопропилфосфино)ферроцен, 1,1'-бис(дициклогексилфосфино)ферроцен и 1,1'-бис(ди-трет-бутилфосфино)ферроцен; и
L2 представляет собой бидентатный N,N-лиганд, выбранный из группы, которую составляют лиганды (1), (2) и (3):

в которых:
R31 и R32, R41 и R42, и R51 и R52 независимо выбираются из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил;
R33 и R34, R43 и R44, и R53 и R54 независимо выбираются из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил;
R35, R45, R46, R55, R56 и R57 независимо выбираются из группы, которую составляют -H, незамещенный C1-20-алкил, замещенный C1-20-алкил, незамещенный C3-20-циклоалкил, замещенный C3-20-циклоалкил, незамещенный C1-20-алкокси, замещенный C1-20-алкокси, незамещенный C5-20-арил, замещенный C5-20-арил, незамещенный C1-20-гетероалкил, замещенный C1-20-гетероалкил, незамещенный C2-20-гетероциклоалкил, замещенный C2-20-гетероциклоалкил, незамещенный C4-20-гетероарил и замещенный C4-20-гетероарил;
c составляет 0, 1, 2, 3 или 4;
d составляет 0, 1, 2 или 3;
e составляет 0, 1, 2, 3, 4 или 5;
f составляет 0, 1 или 2;
g составляет 0, 1 или 2;
h составляет 0, 1, 2, 3 или 4.
M, X, лиганды, имеющие формулы (Ia), (Ib), (IIa), (IIb), 1,1'-бис(диизопропилфосфино)ферроцен, 1,1'-бис(дициклогексилфосфино)ферроцен, 1,1'-бис(ди-трет-бутилфосфино)ферроцен и L2 являются такими, как, в основном, описано выше.
Комплекс [M(X)2(L1)(L2)] может представлять собой комплекс транс- [M(X)2(L1)(L2)] или комплекс цис-[M(X)2(L1)(L2)].
Комплекс может выбираться из группы, которую составляют:
[RuCl2(1,1'-бис(дициклогексилфосфино)ферроцен)(2-(аминометил)пиридин)];
[RuCl2(1,1'-бис(диизопропилфосфино)ферроцен)(2-(аминометил)пиридин)];
[RuCl2(1,1'-бис(ди-трет-бутилфосфино)ферроцен)(2-(аминометил)пиридин)];
[RuCl2(1-[2-дифенилфосфиноферроценил]этилдифенилфосфин)(2-(аминометил)пиридин)]; и
[RuCl2(TolBINAP)(2-(аминометил)пиридин)].
Далее настоящее изобретение будет проиллюстрировано с представлением следующих неограничительных примеров.
Примеры
Все примеры осуществляли в инертной атмосфере с использованием азота высокой чистоты.
Были использованы растворители и реагент 2-(аминометил)пиридин технической чистоты. Используемый в примерах RuCl2(PPh3)3 поставляется на продажу под наименованием Ru-100 компанией Johnson Matthey Catalysis and Chiral Technologies. Если не определяется другое условие, для анализа методом ЯМР использовался CDCl3. Анализ методом ЯМР осуществляли немедленно или вскоре после получения образца.
Сокращения
AMPY - 2-(аминометил)пиридин
DCyPFc - 1,1 '-бис(дициклогексилфосфино)ферроцен
DPEPhos - бис [(2-дифенилфосфино)фенил]эфир
Dppp - 1,3-бис(дифенилфосфино)пропан
Dppb - 1,4-бис(дифенилфосфино)бутан
Dppf - 1,1'-бис(дифенилфосфино)ферроцен
экв. - эквивалент
IPA - изопропанол
л - литр
MEK - метилэтилкетон
мл - миллилитр
RT - комнатная температура
Xantphos - 4,5-бис(дифенилфосфино)-9,9-диметилксантен
Пример 1
Получение транс-RuCl2(dppb)(AMPY)
В круглодонную колбу объемом 1 л вводили, в азотной атмосфере, RuCl2(PPh3)3 (100,0 г) и ацетон (600 мл). Смесь перемешивали при комнатной температуре, и dppb (1,1 экв.) добавляли порциями (по 10,0 г каждая). После перемешивания при комнатной температуре в течение 3 часов добавляли AMPY (1,0 экв.), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Через 18 часов осадок отфильтровывали и высушивали в вакууме, получая желтое твердое вещество. Целевой продукт анализировали методом ЯМР31P (CDCl3, RT).
Получение цис-RuCl2(dppb)(AMPY)
В круглодонную колбу объемом 1 л вводили, в азотной атмосфере, транс-RuCl2(dppb)(AMPY)(73,0 г), dppb (0,5 экв.) и сухой IPA (350 мл). Реакционную смесь кипятили с обратным холодильником в течение ночи. Через 15 часов реакционную смесь охлаждали до комнатной температуры, и осадок отфильтровывали. Осадок собирали в круглодонную колбу и перемешивали в ацетоне (приблизительно 150 мл) при комнатной температуре в течение 2 часов. Осадок отфильтровывали и высушивали в вакууме, получая желтое твердое вещество. Целевой продукт анализировали методом ЯМР31P (CDCl3, RT).
Пример 2
Получение транс-RuCl2(PPh3)2(AMPY)
В круглодонную колбу объемом 1 л вводили RuCl2(PPh3)3 (100,0 г) и ацетон (500 мл). Смесь дегазировали и перемешивали в азотной атмосфере в течение одного часа при комнатной температуре. Каплями добавляли AMPY (1,2 экв.), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Осадок отфильтровывали, промывали ацетоном и высушивали в вакууме, получая желтое твердое вещество. Целевой продукт анализировали методом ЯМР31P (CDCl3, RT).
Получение цис-RuCl2(dppb)(AMPY)
В сосуд Шленка (Schlenk) объемом 400 мл в азотной атмосфере кипятили с обратным холодильником транс-RuCl2(PPh3)2(AMPY)(30,0 г), dppb (1,2 экв.) и сухой IPA (200 мл). Через 2 часа реакционную смесь охлаждали до комнатной температуры и перемешивали в течение одного часа. Осадок отфильтровывали и высушивали в вакууме. Зеленое твердое вещество перемешивали в ацетоне в течение 2 часов при комнатной температуре. Осадок отфильтровывали, но все же сохранялся светло-зеленый цвет, обусловленный свободным фосфином и соответствующим оксидом, и поэтому твердое вещество повторно перемешивали в ацетоне до тех пор, пока не было получено желтое твердое вещество, которое отфильтровывали и высушивали в вакууме. Целевой продукт анализировали методом ЯМР31P (CDCl3, RT).
Пример 3
Получение транс-RuCl2(dppf)(AMPY)
В круглодонную колбу объемом 250 мл вводили, в азотной атмосфере, RuCl2(PPh3)3 (3,155g) и ацетон (60 мл). Смесь перемешивали при комнатной температуре и добавляли dppf (2,0 г). После перемешивания при комнатной температуре в течение 3 часов добавляли AMPY (0,34 мл), и реакционную смесь перемешивали при комнатной температуре в течение субботы и воскресенья. Осадок отфильтровывали и высушивали в вакууме, получая желтое твердое вещество. Целевой продукт анализировали методом ЯМР31P (CDCl3, RT).
Получение цис-RuCl2(dppf)(AMPY)
В сосуд Шленка объемом 400 мл вводили, в азотной атмосфере, транс-RuCl2(dppf)(AMPY) (20,0 г) и сухой IPA (120 мл). Смесь кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры, и осадок отфильтровывали и высушивали в вакууме, получая желтое твердое вещество (19 г). Целевой продукт анализировали методом ЯМР31P (CDCl3, RT).
Пример 4
Получение транс-[(PPh3)2RuCl2AMPY] (AMPY/Ru-100=1,1)
В оборудованный мешалкой стеклянный реактор объемом 2 л вводили 300 г RuCl2(PPh3)3 в виде твердого вещества, а затем добавляли 1,2 л MEK. Перемешивание начинали немедленно, и суспензию перемешивали в течение 4 часов. В отдельном реакторе 150 мл MEK смешивали с 37,225 г AMPY. Эту смесь добавляли в течение 20-минутного периода в суспензию RuCl2(PPh3)3. После завершения добавления во второй реактор повторно вводили 150 мл MEK, и содержимое добавляли в течение периодов по 10 минут в основной реактор. Реакционную смесь перемешивали в течение 17 часов. Полученную густую суспензию фильтровали в вакууме с использованием воронки Бюхнера (Büchner) и фильтровальной бумаги до тех пор, пока продукт не получался в форме влажного осадка на фильтре. (Продолжительность фильтрования составляла менее чем 25 минут). Промывание с использованием MEK продолжали до тех пор, пока фильтрат MEK не становился бесцветным. Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 48 часов. Транс-[(PPh3)2RuCl2AMPY] (255 г) получался в форме тонкого порошка, который содержал 3 мас.% MEK по данным ЯМР1H.
Пример 5
Получение цис-[dpppRuCl2AMPY]
В однолитровый стеклянный реактор, оборудованный мешалкой, эффективным обратным холодильником и дефлегматором, вводили 80,407 г транс-[(PPh3)2RuCl2AMPY] (продукт из примера 4) и 49,495 г лиганда dppp (1,2 экв. по отношению к Ru). Добавляли 600 мл IPA, смесь перемешивали, и суспензию нагревали на масляной бане при температуре 107°C. Это приводило к дефлегмации растворителя (IPA). Вскоре после достижения температуры реакции внешний вид суспендированного твердого вещества изменялся, и оно приобретало ярко-желтый цвет. После того, как нагревание продолжалось в течение 60 часов, его прекращали, и суспензию охлаждали до 50°C. Горячую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Полученный осадок дополнительно промывали 3 раза, используя по 100 мл IPA (аликвоты растворителя нагревали до 50°C перед использованием). Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 60°C в течение 48 часов. После высушивания продукт (70,1 г) сохранял 4 мас.% IPA. Данные ЯМР1H и31P{1H} соответствуют данным литературы: Organometallics, 2005 г., т. 24, с. 1660 (соединение 5).
Пример 6
Получение транс-[dpppRuCl2AMPY]
В однолитровый оборудованный мешалкой стеклянный реактор вводили 80,407 г транс-[(PPh3)2RuCl2AMPY] (продукт из примера 4) и 49,495 г лиганда dppp (1,2 экв. по отношению к Ru). Добавляли 600 мл IPA, смесь перемешивали, и суспензию нагревали на масляной бане при температуре 60°C. После того, как нагревание продолжалось в течение 60 часов, его прекращали, и суспензию охлаждали до 45°C. Горячую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Полученный осадок дополнительно промывали 3 раза, используя по 100 мл MEK (аликвоты растворителя нагревали до 50°C перед использованием). Окрашенные в красный цвет фильтраты MEK отбрасывали. Желтый продукт (68,7 г) высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 48 часов. После высушивания продукт (68,7 г) сохранял MEK.
Идентификацию твердого вещества осуществляли, проводя анализ методом ЯМР1H и31P{1H}, который подтвердил транс-[(dpppRuCl2AMPY]: ЯМР1H: δ 8,37 (1H, CH в положении 6 пиридина AMPY), 7,71-6,62 (23 H, несколько мультиплетов, остаточные CH пиридина и фенила), 4,30 (2H, широкий синглет, CH2-N AMPY), 2,64 и 1,85 (6H, широкие мультиплеты, CH2 координированного dppp), очень широкие резонансные пики NH2. ЯМР1H и31P{1H}: 44,58 (д, J=49 Гц), 34,69 (д, J=49 Гц).
Пример 6 демонстрирует, что использование кетонного растворителя MEK при 60°C обеспечивает обмен лигандов dppp/PPh3, но не изомеризацию полученного транс-[dpppRuCl2AMPY].
Пример 7
Получение цис-[dpppRuCl2AMPY]
В однолитровый стеклянный реактор, оборудованный мешалкой, эффективным обратным холодильником и дефлегматором, вводили 60 г транс-[dppp RuCl2AMPY], полученного в примере 6, и добавляли 3,00 г лиганда dppp и 600 мл IPA. В процессе перемешивания суспензию нагревали на масляной бане при температуре 107°C. Это приводило к дефлегмации растворителя (IPA). После того, как нагревание продолжалось в течение 60 часов, его прекращали, и суспензию охлаждали до 50°C. Горячую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Полученный осадок дополнительно промывали с использованием IPA (аликвоты растворителя нагревали до 50°C перед использованием) до тех пор, пока фильтрат IPA не становился бесцветным. Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 60°C в течение 48 часов. После высушивания продукт (57,3 г) сохранял 4,5 мас.% IPA. Данные ЯМР1H и31P{1H} соответствуют данным, которые были получены в примере 5.
Пример 8
Получение цис-[dppfRuCl2AMPY]
В однолитровый стеклянный реактор, оборудованный мешалкой, эффективным обратным холодильником и дефлегматором, вводили 80,407 г транс-[(PPh3)2RuCl2AMPY] (продукт из примера 4) и 66,527 г лиганда dppf (1,2 экв. по отношению к Ru). Добавляли 600 мл IPA, и в процессе перемешивания суспензию нагревали на масляной бане при температуре 107°C. Это приводило к дефлегмации растворителя (IPA). После того, как нагревание продолжалось в течение 80 часов, его прекращали, и суспензию охлаждали до 50°C. Горячую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Полученный осадок дополнительно промывали 3 раза, используя по 200 мл IPA (аликвоты растворителя нагревали до 50°C перед использованием). Желтый продукт (85,3 г) высушивали при давлении 10 мбар (1000 Па) и температуре 60°C в течение 48 часов. После высушивания продукт (85,3 г) сохранял 3 мас.% IPA. Данные ЯМР1H и31P{1H} соответствуют данным литературы: Chemistry - European Journal, 2011 г., т. 17, с. 3474 (соединение 9).
Пример 9
Получение транс-[dppfRuCl2AMPY]
В однолитровый оборудованный мешалкой стеклянный реактор вводили 100 г RuCl2(PPh3)3 и 63,6 г dppf в виде твердых веществ, а затем добавляли 0,5 л ацетона. Перемешивание начинали немедленно, и суспензию перемешивали в течение 18 часов. После разбавление в 100 мл ацетона 11,280 г AMPY добавляли в течение одночасового периода, а затем добавляли 100 мл ацетона, продолжая интенсивное перемешивание суспензии продукта. Реакционную смесь перемешивали в течение 24 часов. Полученную густую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Промывание ацетоном продолжали до тех пор, пока ацетон фильтрат не становился бесцветным. Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 48 часов. Транс-[dppfRuCl2AMPY] (84 г) получался в форме тонкого порошка, который содержал 4 мас.% ацетона по данным ЯМР1H. Данные ЯМР1H и31P{1H} соответствуют данным литературы: Chemistry - European Journal, 2011 г., т. 17, с. 3474 (соединение 8).
Пример 10
Получение цис-[dppf RuCl2AMPY]
В однолитровый стеклянный реактор, оборудованный мешалкой, эффективным обратным холодильником и дефлегматором, вводили 40 г транс-[(dppfRuCl2AMPY] (продукт из примера 9). Добавляли 800 мл IPA, и в процессе перемешивания суспензию нагревали на масляной бане при температуре 107°C. Это приводило к дефлегмации растворителя (IPA). После того, как нагревание продолжалось в течение 20 часов, его прекращали, и суспензию охлаждали до 50°C. Горячую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Полученный осадок дополнительно промывали 3 раза, используя по 200 мл IPA (аликвоты растворителя нагревали до 50°C перед использованием). Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 60°C в течение 48 часов. После высушивания продукт (39,4 г) сохранял 2 мас.% IPA. Данные ЯМР1H и31P{1H} соответствуют цис-[(dppfRuCl2AMPY], который был получен в примере 8.
Пример 11
Получение транс-[dppbRuCl2AMPY]
В 20-литровый оборудованный мешалкой стеклянный реактор вводили 1000 г RuCl2(PPh3)3 и 490 г dppb в виде твердых веществ, а затем добавляли 13 л ацетона. Перемешивание начинали немедленно, и суспензию перемешивали в течение 4 часов. В отдельном реакторе 1 л ацетона смешивали с 124,03 г AMPY. Эту смесь добавляли в течение 30-минутного периода в суспензию в 20-литровом реакторе. После завершения добавления во второй реактор добавляли дважды по 0,5 л ацетона, и его содержимое добавляли в течение 10-минутных периодов в основной реактор. Реакционную смесь перемешивали в течение 16 часов. Полученную густую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги (Whatman 541) до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Для осуществления процесса фильтрования требовалось 120 минут. Промывание ацетоном продолжали до тех пор, пока ацетоновый фильтрат не становился бесцветным. Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 48 часов. Транс-[dppb RuCl2AMPY] (648 г) получался в форме тонкого порошка, который содержал 4 мас.% ацетона по данным ЯМР1H. Данные ЯМР1H и31P{1H} соответствуют данным литературы: Organometallics, 2005 г., т. 24, с. 1660 (соединение 2).
Пример 12
Крупномасштабное получение транс-[dppbRuCl2AMPY]
В 20-литровый оборудованный мешалкой стеклянный реактор вводили 2000 г RuCl2(PPh3)3 и 980 г dppb в виде твердых веществ, а затем добавляли 13 л MEK. Перемешивание начинали немедленно, и суспензию перемешивали в течение 4 часов. В отдельном реакторе 1 л MEK смешивали с 248,1 г AMPY. Эту смесь добавляли в течение 30 минутного периода в суспензию в 20-литровом реакторе. После завершения добавления во второй реактор добавляли дважды по 0,5 л MEK, и содержимое добавляли в течение 10-минутных периодов в основной реактор. Реакционную смесь перемешивали в течение 16 часов. Полученную густую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги (Whatman 541) до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Для осуществления процесса фильтрования требовалось 10 минут. Промывание с использованием MEK продолжали до тех пор, пока фильтрат MEK не становился бесцветным. Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 48 часов. Транс-[dppbRuCl2AMPY] (1320 г) получался в форме тонкого порошка, который содержал по данным ЯМР 1H 5 мас.% MEK.
Идентификацию твердого вещества осуществляли, проводя анализ методом ЯМР1H и31P{1H}, и данные соответствовали веществу, полученному в примере 11.
Пример 13 (сравнительный)
Крупномасштабное получение [dppbRuCl2AMPY] с использованием толуол в качестве реакционного растворителя
В 20-литровый оборудованный мешалкой стеклянный реактор вводили 2000 г RuCl2(PPh3)3и 980 г dppb в виде твердых веществ, а затем добавляли 13 л толуола. Перемешивание начинали немедленно, и суспензию перемешивали в течение 4 часов. В отдельном реакторе 1 л толуола смешивали с 248,1 г AMPY. Эту смесь добавляли в течение 30 минутного периода в суспензию в 20-литровом реакторе. После завершения добавления во второй реактор добавляли дважды по 0,5 л толуола, и содержимое добавляли в течение 10-минутных периодов в основной реактор. Реакционную смесь перемешивали в течение 16 часов. Полученную густую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги (Whatman 541) до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Для осуществления процесса фильтрования требовалось 510 минут. Промывание толуолом осуществляли только один раз, чтобы не требовалось расходование чрезмерного времени на фильтрование. Полученный осадок на фильтре имел большой объем и сохранял 50 мас.% толуола по сравнению с менее чем 10% в примерах 11 или 12. Осадок на фильтре высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 120 часов, и продукт (1375 г) получался в форме высушенной твердой массы. Его измельчали с помощью ступки и пестика, получая очень тонкий порошок, и идентификацию осуществляли, проводя анализ методом ЯМР1H и31P{1H}, который определил смесь изомеров транс- и цис-[dppbRuCl2AMPY] в соотношении 9/1.
При сравнении настоящего эксперимента с примером 12 можно видеть, что использование толуола вместо кетона в качестве растворителя, имеет ряд недостатков, например, значительно увеличивается продолжительность фильтрования, требуется высушивание продукта при более высокой температуре в течение более продолжительного времени, продукт после высушивания имеет такую форму, которая является менее пригодной для обращения, и требуется дополнительная обработка для получения тонкого порошка, а также цис-изомер присутствует в транс-продукте. Таким образом, данный способ не является подходящим для крупномасштабного производства.
Пример 14
Крупномасштабное получение цис-[dppbRuCl2AMPY]
В стеклянный реактор, оборудованный мешалкой, эффективным обратным холодильником и дефлегматором, вводили 1900 г транс-[dppbRuCl2AMPY] (продукт, изготовленный с использованием ацетона в качестве реакционного растворителя) и 1,9 г dppb. Добавляли 10 л IPA, и в процессе перемешивания суспензию нагревали на масляной бане при температуре 107°C. Это приводило к дефлегмации растворителя (IPA). После того, как нагревание продолжалось в течение 3 часов, его прекращали, и суспензию охлаждали до 50°C. Горячую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Полученный осадок дополнительно промывали дважды, используя по 5 л IPA. Продукт высушивали при давлении 10 мбар (1000 Па) и температуре 60°C в течение 48 часов. После высушивания продукт (1790 г) сохранял 4 мас.% IPA. Данные ЯМР1H и31P{1H} соответствуют данным литературы: Organometallics, 2005 г., т. 24, с. 1660 (соединение 7).
Пример 15
Крупномасштабное получение [dppbRuCl2AMPY]
В 20-литровый оборудованный мешалкой стеклянный реактор вводили 2000 г RuCl2(PPh3)3 и 980 г dppb в виде твердых веществ, а затем добавляли 13 л MEK. Перемешивание начинали немедленно, и суспензию перемешивали в течение 4 часов. В отдельном реакторе 1 л MEK смешивали с 236,8 г AMPY. Эту смесь добавляли в течение 30 минутного периода в суспензию в 20-литровом реакторе. После завершения добавления во второй реактор добавляли дважды по 0,5 л MEK, и содержимое добавляли в течение 10-минутных периодов в основной реактор. Реакционную смесь перемешивали в течение 16 часов. Полученную густую суспензию фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги (Whatman 541) до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Для осуществления процесса фильтрования требовалось 10 минут. Промывание с использованием MEK продолжали до тех пор, пока фильтрат MEK не становился бесцветным. Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 48 часов. Транс-[dppbRuCl2AMPY] (1320 г) получался в форме тонкого порошка, который содержал 3 мас.% MEK по данным ЯМР1H.
Пример 16
Получение цис-[dppbRuCl2AMPY]
В оборудованный мешалкой стеклянный реактор с присоединенным блоком, который обеспечивал одновременную дистилляцию и дефлегмацию растворителя, вводили 42,81 г транс-[(dppbRuCl2AMPY] и 0,105 г dppb. Добавляли 530 мл IPA, и в процессе перемешивания суспензию нагревали на масляной бане при температуре 112°C. В результате этого происходила дистилляция растворителя (IPA), которая продолжалась до тех пор, пока не было собрано 100 мл растворителя. Затем блок переключали на дефлегмацию растворителя, и температуру масляной бани устанавливали на уровне 107°C. После того, как нагревание продолжалось в течение 36 часов, его прекращали, и суспензию охлаждали до 50°C. Суспензию при 50°C фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Полученный осадок дополнительно промывали дважды с использованием по 100 мл IPA. Продукт высушивали при давлении 10 мбар (1000 Па) и температуре 60°C в течение 48 часов. После высушивания продукт (42,7 г) сохранял 5 мас.% IPA.
Пример 17
Получение цис-[dppbRuCl2AMPY]
Нагревали с обратным холодильником в течение 3 часов 30 г транс-[dppbRuCl2AMPY] (полученный с использованием ацетон в качестве реакционного растворителя), 2 г dppb и 200 мл IPA. Полученную суспензию фильтровали и промывали небольшим количеством IPA. Продукт анализировали методом ЯМР31P{1H}, и анализ показал, что продукт составляют цис-[dppb RuCl2AMPY] (менее чем 2% оставшегося транс-изомера). Данные ЯМР1H и31P{1H} соответствуют данным литературы: Organometallics, 2005 г., т. 24, с. 1660 (соединение 7).
Пример 18 (сравнительный)
Получение цис-[dppbRuCl2AMPY]
В течение 5 часов 30 г транс-[dppb RuCl2AMPY], 2 г dppb и 200 мл толуола нагревали для кипячения с обратным холодильником. Полученную суспензию фильтровали. Продукт анализировали методом ЯМР31P{1H}, и анализ показал содержание лишь 20% цис-[dppb RuCl2AMPY] и 80% транс-[dppbRuCl2AMPY]. Фильтрат и осадок на фильтре объединяли и нагревали для кипячения с обратным холодильником в течение дополнительных 15 часов в целях завершения изомеризации.
При сравнении с примерами 17 и 18 можно видеть, что изомеризация транс-[dppbRuCl2AMPY] в цис-[dppbRuCl2AMPY] в изопропаноле происходит в течение менее продолжительного времени (3 часов, а не 20 часов) и при менее высокой температуре (температура кипения изопропанола составляет 82°C, а температура кипения толуола составляет 110-111°C).
Пример 19
Получение [DPEPhosRuCl2PPh3]
В оборудованный мешалкой стеклянный реактор объемом 400 мл вводили 25,9 г RuCl2(PPh3)3 и 16,0 г DPEPhos в виде твердых веществ, а затем добавляли 300 мл MEK. Перемешивание начинали немедленно, и суспензию перемешивали в течение 18 часов. Полученную в результате желто-оранжевую суспензию фильтровали с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Промывание с использованием MEK продолжали до тех пор, пока фильтрат MEK не становился бесцветным. Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 48 часов. Он получался с почти количественным выходом в форме тонкого порошка, который содержал 0,2 мас.% MEK по данным ЯМР1H. Это твердое вещество анализировали методом ЯМР1H и31P{1H}.
Пример 20
Получение [XantPhosRuCl2PPh3]
В оборудованный мешалкой стеклянный реактор объемом 400 мл вводили 24,0 г RuCl2(PPh3)3 и 16,0 г XantPhos в виде твердых веществ, а затем добавляли 300 мл MEK. Перемешивание начинали немедленно, и суспензию перемешивали в течение 18 часов. Полученную в результате желто-оранжевую суспензию фильтровали с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Промывание с использованием MEK продолжали до тех пор, пока фильтрат MEK не становился бесцветным. Желто-оранжевый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 48 часов. Он получался с почти количественным выходом в форме тонкого порошка, который содержал 0,4 мас.% MEK по данным ЯМР1H. Это твердое вещество анализировали методом ЯМР1H и31P{1H}.
Пример 21
Получение [DCyPFcRuCl2AMPY]
В оборудованный мешалкой стеклянный реактор объемом 200 мл вводили 3,2 г RuCl2(PPh3)3 и 2,32 г DCyPFc в виде твердых веществ, а затем добавляли 100 мл насыщенного азотом MEK. Перемешивание начинали немедленно, и суспензию перемешивали в течение 28 часов. Анализ методом ЯМР31P{1H} образца, полученного разбавлением образца из реакционной смеси с использованием C6D6 показывает, что весь DCyPFc прореагировал, и что единственный свободный фосфин представляет собой PPh3, который высвобождается из RuCl2(PPh3)3.
В промежуточный продукт, суспендированный в MEK, добавляли 0,42 г AMPY после разбавления с использованием 10 мл MEK в течение 10-минутного периода. Реакционную смесь перемешивали в течение 60 часов. Полученную густую суспензию продукта каштаново-коричневого цвета фильтровали в вакууме с использованием воронки Бюхнера и фильтровальной бумаги до тех пор, пока не получался продукт в форме влажного осадка на фильтре. Промывание с использованием MEK продолжали до тех пор, пока фильтрат MEK не становился бесцветным. Желтый продукт высушивали при давлении 10 мбар (1000 Па) и температуре 30°C в течение 48 часов. Образец суспендировали в IPA и повторно фильтровали.
Идентификацию твердого вещества осуществляли, используя комбинированный анализ методом1H и31P{1H}. В результате анализа методом31P{1H} обнаруживаются два изомера, которым соответствуют пики при δ=51 м. д. (основной широкий резонансный пик) и δ=48 м. д. (малый широкий резонансный пик). Резонансные пики AMPY для основного комплекса наблюдаются при δ=9,94 (д), 7,73 (т), 7,40 (т), 7,35 (т) (интегрирование всех пиков соответствует 0,75 H) 5,07 (с, 1,5 H); резонансные пики AMPY для неосновного комплекса наблюдаются при δ=9,80 (д), 8,06 (т), 7,93 (т), 7,64 (т) (интегрирование всех пиков соответствует 0,25 H), 5,01 (с, 0,5 H). Два резонансных пика, соответствующие 4 группам CH ферроцена, наблюдаются при δ=4,23 (м) и 4,08 (м). Остальные резонансные пики циклогексила (44) представляют собой широкий ряд мультиплетов при δ=2,2-0,94 м. д.
Пример 22
Получение [Josiphos*RuCl2AMPY]
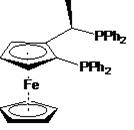
Josiphos*
В оборудованный мешалкой стеклянный реактор объемом 400 мл вводили 10 г RuCl2(PPh3)3 и 6,8 г Josiphos* в виде твердых веществ, а затем добавляли 250 мл насыщенного азотом MEK. Перемешивание начинали немедленно, и суспензию в процессе перемешивания нагревали на масляной бане, температура которой поддерживалась на уровне 75°C, в течение 18 часов. После охлаждения до комнатной температуры получался прозрачный раствор, содержащий в небольшом количестве напоминающий вату оранжевый осадок. Анализ образца реакционной смеси методом ЯМР31P{1H} в CDCl3 показывает, что присутствует свободный PPh3, который, главным образом, высвобождается из RuCl2(PPh3)3, и небольшому количеству соответствует оставшийся Josiphos* (который использовался в избытке). Промежуточный комплекс [Josiphos*RuCl2] (смесь изомеров) наблюдается по характерной картине дублетных резонансных пиков при δ=69,95 (д), 67,0 (д), 65,35 (д), 60,9 (д), 55,05 (д), 52,8 (д), 43,9 (д), 32,8 (д), 8,6 (д), 6,4 (д), как показывает анализ методом ЯМР31P{1H}.
В промежуточный продукт, суспендированный в MEK, добавляли 1,28 г AMPY после разбавления с использованием 100 мл MEK в течение 30-минутного периода. Реакционную смесь перемешивали в течение 35 часов и получали осадок оранжево-коричневого цвета. После фильтрования ничего не оставалось на фильтре из спеченного стекла. Профильтрованный раствор частично упаривали, получая 30 мл раствора. который обрабатывали 300 мл циклогексана и получали продукт в форме желто-коричневых кристаллов, содержащий лишь 10 мас.% PPh3 (4 г) по данным анализа методом ЯМР1H и31P{1H}. Анализ методом ЯМР31P{1H} показывает, что образуются изомеры [Josiphos*RuCl2AMPY], и что полностью происходило превращение промежуточного продукта [Josiphos*RuCl2] под действием AMPY. Анализ упаренных фильтратов показывает, что в них содержится в больших количествах свободный фосфин (предположительно из маточного раствора) и такая же смесь изомеров [Josiphos*RuCl2AMPY]. Анализ методом ЯМР31P{1H}: δ=72,29 (д), 37,98 (д) (основной изомер 1); 60,53 (д), 43,23 (д) (изомер 2); 51,09 (д), 43,75 (д) (изомер 3); 70,64 (д), 35,81 (д) (изомер 4); 71,17 (д), 53,11 (д) (изомер 5); 57,76 (д), 46,94 (д) (изомер 6) и т. д.
Нагревали 1 г образца твердого [Josiphos*RuCl2AMPY] в IPA (1 г в 15 мл IPA) на масляной бане при температуре 102°C в течение 15 часов. В процессе реакции образовался прозрачный красный раствор, который фильтровали, затем упаривали, и остаток высушивали в течение 2 часов при температуре 50°C и давлении 10 мбар (1000 Па). Получался основной изомер [Josiphos*RuCl2AMPY], который имеет чрезвычайно низкую растворимость даже в хлорированных растворителях, как показывает анализ методом ЯМР1H и31P{1H}. Анализ методом ЯМР31P{1H}: δ=72,29 (д), 37,98 (д) (основной изомер 1); 60,53 (д), 43,23 (д) (изомер 2); соотношение изомеров 9/1.
Реферат
Изобретение относится к способу получения комплекса [M(X)(L)(L)]. Способ включает стадию взаимодействие комплекса [M(X)(L)] с фосфорным лигандом Lи бидентатным N,N-лигандом Lв кетонном растворителе для получения комплекса [M(X)(L)(L)]. M представляет собой рутений или осмий. X представляет собой анионный лиганд. L представляет собой третичный фосфиновый лиганд PRRR, в котором R, Rи Rнезависимо выбираются из группы, которую составляют незамещенный C-алкил, замещенный C-алкил, незамещенный C-циклоалкил, замещенный C-циклоалкил, незамещенный C-алкокси, замещенный C-алкокси, незамещенный C-арил, замещенный C-арил, незамещенный C-гетероалкил, замещенный C-гетероалкил, незамещенный C-гетероциклоалкил, замещенный C-гетероциклоалкил, незамещенный C-гетероарил и замещенный C-гетероарил. Lпредставляет собой хиральный или ахиральный монодентатный фосфорный лиганд, который отличается от L, или хиральный или ахиральный бидентатный фосфорный лиганд, в котором с атомом фосфора ковалентно связаны 3 атома углерода или n гетероатомов и 3-n атомов углерода, где n=1, 2 или 3; m составляет 1 или 2, причем когда m составляет 1, Lпредставляет собой бидентатный фосфорный лиганд, когда m составляет 2, каждый Lпредставляет собой монодентатный фосфорный лиганд. Lпредставляет собой бидентатный N,N-лиганд, в котором присутствуют азотсодержащая гетероарильная группа и аминогруппа. Кетонный растворитель представляет собой жидкий кетон, который имеет температуру кипения при атмосферном давлении (т.е. 1,0135⋅10Па), составляющую менее чем 160°С. Гетероарил представляет собой ароматическую карбоциклическую группу, в которой один или несколько атомов углерода независимо замещены одним или несколькими гетероатомами. Также предложены способы получения комплекса [M(X)(L)(L)], комплекса [M(X)L(L)] и комплекса цис-[M(X)(L)(L)]. Изобретение предоставляет улучшенные способы получения комплексов рутения, содержащих P- и N-донорные лиганды, которые являются более пригодными для крупномасштабного производства комплексов рутения. 5 н. и 13 з.п. ф-лы, 22 пр.
Формула
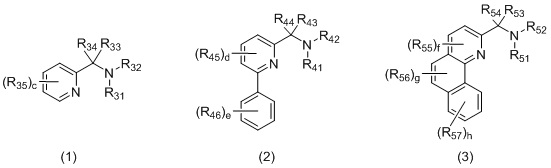
Документы, цитированные в отчёте о поиске
Ферроценильные лиганды для гомогенных энантиоселективных катализаторов гидрирования

Комментарии