Радиофармацевтическое средство для диагностики и лечения (терапии) костных поражений скелета и способ его получения - RU2407746C2
Код документа: RU2407746C2
Описание
Изобретение относится к области химии и медицины, в частности к радиофармацевтическим средствам на основе бисфосфонатов и способу их получения, и может быть использовано для диагностики и лечения в онкологии, а именно в терапии миеломной болезни, костных метастазов при раке молочной железы, легких, щитовидной железы, толстой кишки, тела матки, предстательной железы и как средство снижения гиперкальциемии.
Комплексы радионуклидов с ди- и полифосфонатами обладают способностью к избирательному накоплению в скелете, особенно в зонах патологического костеообразования. Основным преимуществом сцинтиграфии скелета по сравнению с рентгенографической диагностикой является раннее выявление как единичных, так и множественных очагов повышенного накопления при злокачественных новообразованиях костного скелета и метастазах в кости.
Известны фосфатные комплексы99мТс, в частности полифосфат, трифосфат и пирофосфат [G.Subramanian, J.G.Agfee // Radiology - 1971. - Vol.99, - p.192].
Известны также дифосфонаты99мТс, обладающие аналогичными свойствами [Schmitt G.H., Holmes R.A., Isitman A.T. // Radiology - 1974. - Vol.112, - p.733].
В настоящее время в мировой радиологической практике наиболее широко используют99мТс-метилендифосфонат (99мТс-MDP) и99мТс-гидроксиэтилиден-дифосфонат (99мТс-HEDP, в русскоязычной литературе-ОЭДФ) [W.C.Eckelman, W.A.Volkert. // Int.J.Appl.Radiat.lsotopes-1982. - Vol.33, - p.945]. Для получения99мТс используют пертехнетат,99мТс натрия, получаемый из генератора99Мо/99мТс. Тс(VII) - химически наиболее устойчивое состояние технеция, однако пертехненат-ионы не связываются с хелатирующими агентами. Для получения устойчивых соединений восстановленного технеция требуется применение различных восстановителей, таких как ионы олова (II), боргидрид натрия, концентрированная соляная кислота, дитионит натрия, гидразин [Nuclear Medicine. Diagnosis and Therapy // J.C. Harbert, W.C.Eckelman, R.D.Neumann Eds. - Thieme Medical Publishers, Inc., New York, 1990, p.218]. Наиболее часто в качестве восстановителя используют двухлористое олово, которое входит в состав практически всех препаратов99мТс. Поскольку двухлористое олово присутствует в большом избытке по отношению к99мТс, оно поддерживает технеций в восстановленной форме и способствует образованию комплекса восстановленного технеция с лигандами.
Все комплексы технеция с дифосфонатами остеотропны, и поэтому общепринятой является формулировка ″99мТс-фосфонатный комплекс″.
Наряду с99мТс в радионуклидной терапии используют изотопы рения и самария, в частности153Sm-этилендиаминтетраметиленфосфат (153Sm-EDTMP) [Resche l., Catal J.F., Peching A. // Eur. J / Cancer. - 1997. - Vol.33, p.1583], самарий-153-оксабифор [Krylov V.V., Tsyb A.F., Drosdovsky B.Y. // Eur. J. Nucl. Med. and Molec. lmaging. - 2006. - Vol.33, Suppl. 2. - s. 335], рений-186- и рений-188-гидроксиэтилидендифосфонат (186Re-HEDP [Jak M.S.P., Han S.H. Zonnenberg B.A., et al. // J. Nucl. Med. - 1996. - Vol.37. - p.1511],188Re-HEDP [Faintuch B.L., Faintuch S., Muramoto E. // Radiochim. Asta - 2003. - Vol.91. - p.607],188-Re-метилендифосфонат (188Re-MDP [Hashimoto К., Bagiawati S., lzumo M., Kobayashi K. // Appl. Radiat. lsot. - 1996 - Vol.47, No.2, - p.195].
Рений-186 получают в ядерном реакторе по реакции185Re (n,γ)186Re или по реакции186W (p, n)186Re на циклотроне [Jak M.S.P., Han S.H., Zonnenberg B.A. et al. // J. Nucl. Med. - 1996. - Vol.37. - p.1511]. Эти способы достаточно дорогостоящи. Был разработан генератор рения-188, материнским изотопом служил W-188, получаемый из обогащенного по W-186 металлического вольфрама или оксида вольфрама [Knapp F.F. Mirzadeh S., Zamora P.,et al. // Nucl. Med. Commun. - 1996. - Vol.17, - p.268].
Рений также, как и технеций, образует комплексы с различными лигандами. Были изучены процессы образования рения-188 с тремя метиленфосфоновыми кислотами, а именно этилендиамин-N,N,N',N'-тетракис(метиленфосфорная кислота, EDTMP; (этилендиамин-N,N'-бис-(метиленфосфорная кислота, EDBMP); (нитрилотрис-(метиленфосфорная кислота, NTMP). Было отмечено, что в присутствии двухлористого олова все лиганды образуют комплексы при рН<3 [Hashimoto К. The Second Japanese-Russian Seminar on technetium. Shizuoka, Japan, 1999, Abstracts, - p.40].
Кроме дифосфонатов часто в медицинской практике используют бисфосфонаты (БФ) [Боневоленская Л.И. Бисфосфонаты и остеопороз. // Руководство по остеопорозу / под.ред. Л.И.Беневоленской - М., Бинош, Лаборатория знаний. - 2003, - гл.9, - с.196-216.]. Исследования острой, подострой и хронической токсичности БФ показывают, что они в целом относятся к группе малотоксичных веществ, обладающих относительно низкими уровнями острой и хронической токсичности. Не выявлено у них и тератогенных, мутагенных, а также канцерогенных свойств.
Золедроновая кислота является бисфосфонатом и обладает свойством ингибировать костную резорбцию. Антирезорбтивный механизм полностью не ясен. In vitro золедроновая кислота ингибирует активность и индуцирует апоптоз остеокластов. Блокирует остеокластическую резорбцию минерализированной костной и хрящевой ткани.
В статье Storto G., Paone G., Ibello F., et al. // Eur.J. Nucl. Med. And Molec. Imaging. - 2004. - Vol.31, - s. 291 авторы применили комбинированную терапию Sr-89 + золедроновая кислота для уменьшения костных болей при метастазах, вызванных раком молочной железы и простаты, и сравнивали результаты при терапии с использованием одного Sr-89.
В настоящее время для сцинтиграфии скелета (диагностика) используют в основном простейшие дифосфонаты, меченные технецием -99 м общей формулы
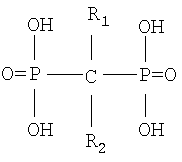
где R1 и R2 означают водород, гидрокси, карбокси, углеводородный радикал, например метилендифосфонат (MDP), оксиэтилидендифосфонат (HEDP) или дикарбоксидифосфонат (DPD) [W.C.Eckelman, W.A.Volkert. // lnt. J. Appl. Radiat. lsotopes - 1982. - Vol.33. - p.945] и дифосфонаты, меченные рением-186 или рением-188, в основном оксиэтилидендифосфонат [Jak M.S.P., Han S.H. Zonnenberg B.A, et al. // J. Nucl. Med. - 1996. - Vol.37 - p.1511],188Re-HEDP [Faintuch B.L., Faintuch S., Muramoto E. // Radiochim. Asta - 2003. - Vol.91,- p.607].
Однако они обладают недостаточно высокой специфичностью и чувствительностью при диагностике и эффективностью при лечении.
Задача настоящего изобретения состоит в устранении вышеперечисленных недостатков.
Поставленная задача решается изобретениями, касающимися композиций на основе бисфосфонатов последнего поколения, в частности заледроновой кислоты, радиофармацевтических средств на их основе, а также способа получения таких радиофармацевтических средств.
Первым объектом заявленного изобретения является радиофармацевтическое средство для диагностики и лечения (терапии) костных поражений скелета, включающее комплекс золедроновой кислоты с изотопом99mТехнеция или188Рения, полученный в присутствии восстанавливающего агента и возможно антиоксиданта.
Данная совокупность общих существенных признаков представляет собой сущность заявляемого устройства. Она необходима и достаточна во всех случаях его реализации.
Кроме того, применительно к заявленному объекту заявитель считает необходимым выделить следующие развития и/или уточнения совокупности его существенных признаков, относящиеся к частным случаям выполнения или использования.
Согласно изобретению в качестве восстанавливающего агента можно использовать галогенид олова (например, дихлорид или дифторид олова), или боргидрид натрия, или дитионид натрия. При этом в качестве галогенида олова можно применять, например, дихлорид или дифторид олова.
В качестве антиоксиданта можно использовать аскорбиновую кислоту или гентизиновую кислоту.
Вторым объектом заявленного изобретения является способ получения радиофармацевтического средства для диагностики и лечения (терапии) костных поражений скелета, заключающийся в том, что получают лиофилизат путем смешения водного раствора золедроновой кислоты и галогенида олова в соляной кислоте и возможно антиоксиданта в токе инертного газа при добавлении гидроксида щелочного металла, далее полученный лиофилизат смешивают с солью металла из группы изотопов, выбранных из группы99mТехнеций или188Рений, с получением комплекса и последующего добавления раствора радионуклида.
Нижеследующие примеры иллюстрируют получение предложенных комплексов и радиофармацевтического средства.
Пример 1
Пример синтеза препарата с технецием-99м:
1. Приготовление лиофилизированного реагента
0,15 г золедроновой кислоты растворяли в 92 мл воды в токе инертного газа. Эту и последующие операции выполняли в токе инертного газа. К полученному раствору добавляли 5 мл раствора дихлорида олова в 1 М соляной кислоте (6-7 мг/мл) и 3 мл 1,5 М раствора NaOH. Полученный раствор реагента фильтровали через фильтр 0,22 мкм и фасовали порциями по 1 мл во флаконы для лекарственных средств. Содержимое флаконов лиофилизировали.
2. Состав лиофилизата во флаконе:
3. Приготовление препарата
Во флакон с лиофилизированным реагентом добавляли 5 мл изотонического раствора натрия пертехнетата,99mТс (740-1480 МБк/мл) из генератора, и выдерживали 20 мин при комнатной температуре.
4. Состав препарата:
Технеция-99м в виде комплекса
(для определения использовали методы ВЭЖХ и ТСХ)
Пример 2.
Синтез препарата с рением-188
1. Приготовление лиофилизированного реагента
0,42 г гентизиновой кислоты растворяли в 60 мл воды. Эту и последующие операции выполняли в токе инертного газа. К полученному раствору добавляли 8 мл раствора дихлорида олова в 1 М соляной кислоте (18 мг/мл) и 40 мл водного раствора золедроновой кислоты (6 мг/мл). Полученный раствор реагента фильтровали через фильтр 0,22 мкм и фасовали порциями по 1 мл во флаконы для лекарственных средств. Содержимое флаконов лиофилизировали.
2. Состав лиофилизированного реагента во флаконе:
3. Приготовление препарата:
а) Во флакон, содержащий 40 мкл перрената натрия с концентрацией 0,8 мг/мл по рению, добавляли 1,5 мл раствора натрия перрената,188Re из генератора. Раствор перемешивали (флакон №2).
б) Во флакон с лиофилизированным реагентом (флакон №1) шприцем вносили все содержимое флакона №2 и перемешивали.
в) Препарат выдерживали при комнатной температуре 2 ч. Перед использованием раствор препарата фильтровали через фильтр 0,22 мкм.
4. Состав препарата:
(для определения использовали методы ВЭЖХ и ТСХ)
Остальные металлокомплексы получают аналогично примерам 1 и 2.
Биологические испытания предложенных металлокомплексов
Эксперименты проводили на интактных беспородных белых крысах и крысах с моделью костной патологии. Костная патология имитировалась переломом бедра.
Для приготовления средства во флакон с лиофилизатом вводили 5,0 мл раствора натрия пертехнетата99mТс из генератора технеция (ФСП 42-0225-4528-03, ФСП 42-0018-2694-02) путем прокола иглой шприца резиновой пробки, после чего флакон встряхивали и выдерживали в течение 20 минут. Средство в объеме 0,2 мл вводили в хвостовую вену. Через 1, 3, 5, 24 часа после введения животных умерщвляли декапитацией и отбирали пробы крови, печень, почки, желудок, правое и левое бедро, мочевой пузырь с содержимым. Содержание радионуклида в органах и тканях определяли методом прямой радиометрии.
Коэффициент дифференциального накопления (КДН) определяли как частное отделения величин концентрации средства в бедренной кости с моделью костной патологии и в здоровой бедренной кости.
Статистическую обработку проводили по методу Стьюдента.
Полученные результаты представлены в Таблицах 1 и 2.
Исследование фармакокинетики средства показало, что для распределения исследуемого средства характерна выраженная остеотропность. После внутривенного введения средства интактным животным через 1 час до 48% введенной активности локализуется в скелете и 45% выводится из организма с мочой. Через 3 часа после введения накопление в скелете составляет 47%, выведение - 30%. Уровень активности в крови быстро снижается и через 5 часов после начала исследования является, практически, следовым.
По значениям коэффициентов дифференциального накопления патология кости/норма средство обеспечивает возможность осуществления остеосцинтиграфии. Это подтверждает функциональную пригодность средства в качестве радиофармацевтического средства для диагностики патологических процессов в костной ткани, сопровождающихся остеобластическими процессами.
В НИИ Урологии было проведено открытое сравнительное исследование по изучению эффективности и безопасности препарата золедроновой кислоты, меченной технецием, при выявлении патологических изменений скелета у пациентов с раком предстательной железы методом остеосцинтиграфии. Изучалась частота совпадений и расхождений результатов остеосцинтиграфии при использовании препаратов, заявленного в качестве изобретения по данной заявке и известного Технефор. Безопасность нового препарата оценивалась на основании анализа частоты нежелательных явлений и побочных эффектов. Полученные результаты свидетельствуют о равноэффективной диагностической значимости исследуемого препарата по заявленному изобретению (через 1 час после введения) и известного препарата Технефор,99mTc (через 3 часа после введения). Не зарегистрировано существенных различий по минимальным значениям KDA 1,48±0,29 vs 1,41±0,52 (р=0,668), и по максимальным значениям KDA 2,22±1,19 vs 1,88±0,82 (р=0,381). В результате клинического исследования препарата по заявленному изобретению была показана его высокая эффективность, безопасность и экономическая целесообразность для остеосцинтиграфии у пациентов с патологическим процессом в костном скелете. Препарат позволил визуализировать как остеокластические, так и остеолитические метастазы, осуществлять дифференциальную диагностику патологических процессов в костях, способствовал определению тактики лечения и контролю его результатов. Остеосцинтиграфия с препаратом по заявленному изобретению позволяет на 67% сократить время исследования и при этом получать более качественные изображения. Новый препарат может быть рекомендован для широкого использования в клинической практике лечебных учреждений на территории РФ.
Исследование фармакокинетики радиофармацевтического препарата99mTc по заявленному изобретению показало, что для физиологического распределения исследуемого РФП характерна выраженная остеотропность. После внутривенного введения препарата интактным животным через 1 ч до 52,5% введенной активности локализуется в скелете и 40% выводится из организма с мочой. Через 3 ч после введения накопление в скелете составляет 48,9%, выведение - 40%. Уровень активности в крови не превышает 1,9% через 1 ч после введения, снижаясь к 24 ч после начала исследования до фоновых величин. В остальных органах также не происходит значимого накопления препарата.
Согласно "Руководству по экспериментальному (доклиническому) изучению новых радиофармацевтических препаратов" препарат по заявленному изобретению с99mTc можно отнести к РФП на основе химических соединений с изученными фармакологическими свойствами, т.к. одним из основных веществ является золедроновая кислота, которая относится к фармакологической группе 8.8 (Корректоры метаболизма костной и хрящевой ткани). В то же время состав радиофармацевтического препарата по изобретению с99mTc не идентичен известным лекарственным формам на основе золедроновой кислоты.
Изученные образцы препарата по изобретению с99mTc были стерильны, апирогенны и не вызывали у животных нежелательных реакций при внутривенном введении. Экспериментальное изучение показало безвредность применения данного препарата.
Из всего вышесказанного можно заключить, что препарат по изобретению с99mTc - первый в мировой практике коммерческий радиофармацевтический препарат (РФП) на основе золедроновой кислоты, предназначенный для выявления патологических изменений костной системы методами ядерной медицины.
Основным отличием от существующих РФП подобного типа является использование в качестве основной субстанции (таргетного носителя) бисфосфоната последнего поколения - золедроновой кислоты, которая обладает максимальной аффинностью (по сравнению с другими используемыми бисфосфонатами) к участкам патологически повышенной резорбции костной ткани, в том числе к очагам метастатического происхождения при новообразованиях различной локализации и происхождения.
С целью оценки эффективности и безопасности препарата по изобретению с99mTc при патологических изменениях скелета у больных раком предстательной железы, нами было предпринято открытое мультицентровое сравнительное исследование результатов остеосцинтиграфии с препаратами по изобретению с99mTc и Технефор,99mTc (известный).
Материалы и методы.
Для оценки чувствительности и безопасности препарата по изобретению с99mTc в исследование было включено 20 пациентов с диагнозом «распространенный рак предстательной железы» после его первоначального обнаружения методами УЗИ, КТ и морфологического подтверждения. В исследование отбирались пациенты с клиническими и/или рентгенологическими признаками патологических изменений костной системы. Изучалась частота совпадений результатов остеосцинтиграфии, проведенной с препаратами по изобретению с99mTc и Технефор,99mTc. Безопасность препаратов оценивалась на основании анализа частоты нежелательных явлений и побочных эффектов.
У всех больных исследуемой группы в разные сроки до включения в исследование был установлен рак предстательной железы. Ранг значений уровня ПСА в сыворотке крови составил 110-2150 нг/мл. У больных было выявлено или предполагалось поражение скелета метастатическим процессом по клиническим данным, а также в результате рентгенологического и радиоизотопного исследований. Больные получали специфическую терапию согласно установленной стадии и форме основного заболевания.
Все пациенты дали письменное информированное согласие на участие в исследовании и соблюдали указания врача. Из протокола были исключены пациенты: с установленной повышенной чувствительностью к препаратам, содержащим99mTc; прошедшие радиологическое исследование с 111In или 67Ga в течение 10 дней перед включением в исследование, а также пациенты, которые, по мнению исследователя, по какой-либо причине не подходили для участия в нем.
Препарат по изобретению с99mTc вводился внутривенно, исходя из расчета 5 МБк на 1 кг массы тела. В данном исследовании сцинтиграфию у всех пациентов проводили через 1 час после инъекции препарата. Технефор,99mТс вводился внутривенно в количестве 5 МБк на 1 кг массы тела пациента, сканирование проводилось через 3 часа после инъекции препарата. Исследование проводилось с использованием гамма-камеры. Интервал между сцинтиграфией с применением препарата по изобретению с99mTc и Технефора,99mTc составлял не менее чем 72 часа.
Изображения, полученные при остеосцинтиграфии с данными препаратами, анализировались врачом-радиологом, оценивались на наличие или отсутствие захвата99mTc в костях скелета. Изображения, полученные с применением этих препаратов, считались положительными, если определялись очаги накопления в костях скелета с разницей накопления радиофармпрепарата в симметричной области более 40% (КДН≥140%). Изображения считались отрицательными в случае отсутствия очагов гиперфиксации радионуклида.
1. Получение лиофилизированных композиций разного состава с изотопом рения
Для восстановления рения (188Re) необходимо использовать большее количество двухлористого олова, чем для восстановления99mTc, и, следовательно, необходимо увеличивать концентрацию золедроновой кислоты в реагенте. Из-за ограниченной растворимости золедроновой кислоты в кислых растворах и образования осадков перед нами стояла задача по выбору условий получения прозрачного раствора реагента. С этой целью были наработаны лиофилизированные композиции с мольным соотношением золедроновая кислота (ЗК): SnCl2 от 1 до 3.
Приготовление раствора реагента (объем 50 мл) заключалось в смешивании в токе инертного газа предварительно приготовленных растворов гентизиновой кислоты, золедроновой кислоты и двухлористого олова в 1 М HCl. Полученные растворы реагентов, если они были мутными или опалесцировали, перед фасованием фильтровали через фильтр Millipore 0,22 мкм. После фильтрования раствор реагента фасовали по 1 мл в стеклянные флаконы и помещали в лиофильную сушку. По окончанию процесса лиофилизации камеру лиофильной сушки заполняли аргоном, флаконы закрывали резиновыми пробками и завальцовывали. Сводные данные по составам растворов реагентов и лиофилизатов представлены в таблицах 3, 4, 5, 10.
2. Приготовление препаратов из лиофилизированных композиций
Во флакон с лиофилизированной композицией вводили подкисленный элюат (раствор Na188ReO4 в 0,9%-ном NaCl) для того, чтобы восстановление прошло за 30 мин. Через 30 мин после восстановления во флакон добавляли 2 мл раствора NaHCO3 (~10 мг/мл). рН препарата 2,0-2,5. Перед введением животным препарат фильтровали через фильтр Millipore 0,22 мкм, для того, чтобы уменьшить содержание гидролизованного восстановленного рения. Радиохимическую чистоту препарата определяли хроматографическим методом путем использования двух систем сразу после восстановления, после добавления NaHCO3 и после фильтрования. В таблицах с данными по изучению биологического поведения препаратов будут представлены данные только по РХЧ препарата после фильтрования (тот препарат, который непосредственно вводили животным). Данные по РХЧ представлены по результатам сканирования хроматограмм.
3. Изучение биологического поведения препаратов, приготовленных из лиофилизированных реагентов
В таблицах представлены данные биологического поведения препаратов. За эталон взята сумма всех органов.
3.1. Мольное отношение [ЗK]/[Sn]=1
При данном мольном соотношении были наработаны лиофилизированные композиции следующего состава:
3.2. Мольное отношение [3K]/[Sn]=2
При данном мольном соотношении были приготовлены лиофилизированные композиции четырех различных составов:
3.3. Мольное отношение [ЗK]/[Sn]=3
При данном мольном соотношении были приготовлены лиофилизированные композиции четырех различных составов:
Реферат
Изобретение относится к радиофармацевтическому средству для диагностики и лечения (терапии) костных тканей скелета, включающему комплекс золедроновой кислоты с изотопами 99mТехнеция или 188Рения, золедроновую кислоту, галогенид олова и возможно антиоксидант - аскорбиновую или гентизиновую кислоту. Изобретение также относится к способу получения радиофармацевтического средства, заключающемуся в том, что лиофилизат, полученный смешением раствора золедроновой кислоты и раствора двухлористого олова в соляной кислоте в атмосфере инертного газа и добавлением гидроксида металла, смешивают с солью металла группы изотопов и раствором радионуклида. 2 н. и 2 з.п. ф-лы, 14 табл.

Комментарии