Производные фосфолипидов, способ их получения, фармацевтическая композиция на их основе и способ получения фармацевтической композиции - RU2126413C1
Код документа: RU2126413C1
Чертежи





Описание
Данное изобретение относится к области фармацевтически ценных веществ и касается обладающих высокой фармацевтической активностью производных фосфолипидов, способа их получения, содержащего их лекарственного средства и способа получения этого средства.
Длинноцепочечные алкилфосфохолины с антимикробной активностью описываются Капе ап и др. Nippon Kayaku Kaishi, 9, 1452/1984/.
Европейская патентная заявка N 108565 /заявитель: TakedФ/
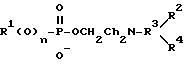
где R1 обозначает алифатический углеводородный остаток с 8-30 C-атомами ,
остатки R2, R3 и R4 являются одинаковыми или разными и обозначают водород или низшие алкильные остатки, или где группа NR2 R3 R4 обозначает циклическую аммониевую группу; и
n обозначает 0 или 1.
Для этих соединений указывается противоопухолевое действие, а также противогрибковое действие.
Согласно изобретению предлагаются производные фосфолипидов общей формулы (1)

причем R5 обозначает линейные или разветвленный алкильный остаток с 10-24 C-атомами, который также может содержать одну - три двойные связи;
A обозначает одинарную связь или одну из групп формул II - VI:
-CH2-CH2-CH2-O- (II);
-CH2-CH2-O- (III);
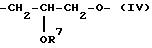


причем R7 обозначает линейную алкильную группу с 1-4 C-атомами, которая также может быть разветвленной.
Группы /II/ - /VI/ ориентируются так, что атом кислорода связывается с атомом фосфора соединения /1/;
X обозначает атом
кислорода или серы или NH, когда A обозначает простую связь;
X обозначает атом кислорода или серы, когда A представляет собой соединение из групп формул /II/ - /VI/;
A1
обозначает линейный или разветвленный алкильный остаток с 2-10 C-атомами, который может быть также ненасыщен, и который может быть замещен галогеном или гидроксильными группами;
R6
обозначает(+) Y R8 R9 R10 с R8 - R10, обозначающими линейные, разветвленные или циклические алкильные
остатки с 1-6 C-атомами,
которые могут быть одинаковыми или разными, или водород;
причем Y обозначает P, As, Sb или Bi
Предлагаемые согласно изобретению соединения можно применять
для терапии опухолей и для
лечения кожных и аутоиммунных заболеваний.
Для терапии заболеваний, вызванных простейшими, пригодны, например, соединения формулы /I/ с Y в значении As и Sb. Сверх того, все соединения особенно пригодны в качестве средств против опухолевых заболеваний.
Предлагаемые согласно изобретению соединения пригодны для терапии заболеваний крови, как например, анемий, которые могут возникать в сочетании с опухолевыми заболеваниями. Далее предлагаемые согласно изобретению соединения можно применять для терапии заболеваний костной системы, например остеопороза.
Далее соединения формулы /I/ можно использовать для терапии вирусных заболеваний и бактериальных инфекций.
Соединения отличаются низкой токсичностью. Так, соединения согласно примеру 3 при одноразовом введении перрорально мыши имеет ЛД50 более чем 1470 мг/кг веса тела.
Соединения по изобретению получают согласно описанному ниже способу.
Первая стадия способа состоит во взаимодействии оксихлорида фосфора со спиртом, тиоспиртом или амином в среде галогенированных углеводородов, насыщенных простых циклических эфиров, ациклических простых эфиров, насыщенных углеводородов с 5-10 C-атомами, жидких ароматических углеводородов, которые также могут быть замещены галогенами (в особенности хлором), или в смесях из вышеупомянутых растворителей, или без растворителей, в случае необходимости в присутствии обычного для этой цели основного вещества.
В качестве галогенированных углеводородов принимают во внимание, например, углеводороды с 1-6 C-атомами, причем один или несколько или все атомы водорода могут быть заменены атомами хлора. Например, используют метиленхлорид, хлороформ, этиленхлорид, хлорбензол, дихлорбензол. В случае, если речь идет о замещенных галогенами ароматических углеводородах, то они предпочтительно замещены одним или двумя атомами галогенов.
В качестве насыщенных циклических простых эфиров можно применять, например, простые эфиры с 5-6-членным кольцом, которые состоят из атомов углерода и одного или двух атомов кислорода. Примерами таких эфиров являются тетрагидрофуран и диоксан.
Ациклические простые эфиры состоят из 2-8 C-атомов и являются жидкими. Например, принимают во внимание: диэтиловый эфир, диизобутиловый эфир, метил-трет.-бутиловый эфир, диизопропиловый эфир.
В качестве насыщенных углеводородов принимают во внимание неразветвленные и разветвленные углеводороды, которые состоят из 5-10 атомов углерода и являются жидкими. Например, принимают во внимание пентан, гексан, гептан, циклогексан.
В качестве ароматических углеводородов принимают во внимание, например, бензол и алкилзамещенные бензолы, причем алкильные заместители состоят из 1-5 C-атомов.
В качестве основных веществ, как для реакции оксихлорида фосфора со спиртом, тиоспиртом или амином, так и также для последующего взаимодействия с солью фосфония, стибония или висмутония, принимают во внимание амины, например, алифатические амины формулы NR6 R7R8, причем R6, R7 и R8 являются одинаковыми или разными и обозначают водород или C1-C6-алкил, или также ароматические амины, как пиридин или пиколин. Далее, можно применять, например, хинолин, диизопропиламин, изохинолин, триэтиламин, основание Хюнига /Hunig, Kissel, Chem. Ber. 91 /380/ 1958/.
При реакции взаимодействия с солью фосфония, стибония или висмутония необходимые здесь основные вещества можно добавлять одновременно или также перед введением соли фосфония, стибония или висмутония. Для этой реакции в каждом случае необходим растворитель; т.е. в случае, если первую стадию реакции осуществляют без какого-либо растворителя, то теперь его нужно добавлять.
Молярное соотношение оксихлорида фосфора к спирту, тиоспирту или амину составляет, например, 1,5:1 - 0,8:1.
В случае, если реакцию оксихлорида фосфора со спиртом, соответственно, тиоспиртом или амином осуществляют в присутствии основного вещества, то количество основного вещества составляет, например, 1-3 моля, в расчете на 1 моль POCl3.
Для последующего взаимодействия с солью фосфония, стибония, или висмутония используемое количество основного вещества составляет, например, 1-5 моль, в расчете на 1 моль спирта, тиоспирта или амина.
Реакционная температура при взаимодействии оксихлорида фосфора со спиртом, тиоспиртом или амином составляет от -30 до +30oC, предпочтительно от -15 до 0oC, в особенности -10 - 0oC.
Время этой реакции составляет, например, 0,5-5 часов, предпочтительно 1-3 часа, в особенности 1,5-2 часа. В случае, если реакцию проводят в присутствии основного вещества, то она протекает в общем быстро /примерно за 30 минут/.
Полученный продукт без выделения и очистки в инертном растворителе вводят во взаимодействие с солью фосфония,
стибония, арсония или висмутония формулы
OH - A1 - R6 ,(VIII)
где A1 и R6 имеют вышеуказанные значения.
Арсенохолин и его соли можно получать, например, согласно данным K. Irgolic, Applied Organometallic Chemistry /1987/, 1. c. 403-412, методикам.
Сообразно с этим, соль фосфония, стибония или висмутония добавляют порциями или сразу полностью.
В качестве кислот соли фосфония, стибония или висмутония принимают во внимание соли с неорганическими кислотами /как, например, серная кислота, соляная кислота/; далее, соли с органическими кислотами как, например, уксусная кислота, п-толуолсульфокислота и подобные.
Эту стадию реакции осуществляют в инертном растворителе. В качестве растворителей здесь принимают во внимание такие же, которые применяют для взаимодействия оксихлорида фосфора со спиртом, тиоспиртом или амином, в случае, если это взаимодействие осуществляют в растворителе.
Затем прикапывают основное вещество растворенным в одном из указанных растворителей или без растворителя.
Предпочтительно в качестве растворителей для основных веществ здесь применяют галогенированные углеводороды, насыщенные циклические простые эфиры, ациклические простые эфиры, насыщенные углеводороды с 5-10 C-атомами, жидкие ароматические углеводороды или смеси из вышеупомянутых растворителей. Здесь речь идет о таких растворителях, которые можно применять для взаимодействия оксихлорида фосфора со спиртом, тиоспиртом или амином.
Благодаря добавке основного вещества температура повышается. Необходимо, чтобы температура поддерживалась в пределах 0-40oC. предпочтительно 10-30oC, в особенности 15-20oC.
Реакционную смесь затем перемешивают еще при 5-30oC, предпочтительно при 15-25oC /например, в течение 1-40 часов, предпочтительно 3-15 часов/.
Гидролиз реакционной смеси осуществляют путем добавки воды, причем температуру нужно поддерживать при 10-30oC, предпочтительно 15-30oC, в особенности 15-20oC.
Вышеупомянутая реакционная смесь гидролиза может содержать основные вещества. В качестве таких основных веществ принимают во внимание карбонаты и гидрокарбонаты щелочных и щелочноземельных металлов.
Для полноты гидролиза затем перемешивают еще 0,5-4 часа, предпочтительно 1-3 часа, в особенности 1,5-2,5 часа, при температуре 10-30oC, предпочтительно 15-25oC, в особенности 18-22oC.
Реакционный раствор затем промывают смесью воды со спиртами /предпочтительно алифатическими насыщенными спиртами с 1-4 C-атомами/, которая может содержать еще основное вещество. Соотношение компонентов в смеси вода: спирт может составлять, например 5 - 0,5, предпочтительно 1-3 /по объему/.
В качестве основных веществ для промывной жидкости принимают во внимание, например, карбонаты и гидрокабонаты щелочных и щелочноземельных металлов, а также аммиак /например, водный аммиак/. Особенно предпочтительно 3%-ный водный раствор карбоната натрия.
В случае необходимости, затем можно осуществлять промывку реакционного раствора с помощью кислого раствора. Кислую промывку предпочтительно осуществляют для удаления непрореагировавших основных частей реакционного раствора, в особенности при применении метиленхлорида в качестве растворителя.
Промывной раствор состоит из смеси воды со спиртами. Предпочтительно принимают во внимание смеси из алифатических насыщенных спиртов с 1-4 C-атомами, причем в случае необходимости в них может присутствовать кислое вещество. Соотношение компонентов в смеси вода : спирт может составлять, например, 5 - 0,5, предпочтительно 1 - 3 /по объему/.
В качестве кислого вещества для промывной жидкости принимают во внимание, например, соляную кислоту, серную кислоту, или винную кислоту и лимонную кислоту. Особенно предпочтителен 10%-ный водный раствор соляной кислоты.
Затем еще раз промывают смесью воды со спиртами. Предпочтительно принимают во внимание смеси из алифатических насыщенных спиртов с 1-4 C-атомами, причем в случае необходимости в них может еще присутствовать основное вещество. Соотношение компонентов в смеси вода:спирт может составлять, например, 5 - 0,5, предпочтительно 1-3.
Промытые фазы затем объединяют и обычным образом сушат, и после этого растворитель [предпочтительно при пониженном давлении, например, 5-100 гПа], в случае необходимости после добавки 150-1000 мл, предпочтительно 300-700 мл, в особенности 450-550 мл, алифатического спирта /в расчете на 1 моль сухого продукта/, удаляют.
В качестве спиртов предпочтительно принимают во внимание насыщенные алифатические спирты с длиной цепи 1-5 C-атомов. Особенно, предпочтительны в качестве спиртов при этом н-бутанол, изопропанол. Целью этой спиртовой обработки является более полное удаление остаточной воды.
Таким образом полученный продукт можно очищать обычным образом /например, путем хроматографии, перекристаллизации/.
Соединения согласно изобретению получают также описанным ниже способом.
Этот способ состоит во введении во взаимодействии циклического сложного триэфира фосфорной кислоты с соединением формулы X или XI. Циклический сложный эфир фосфорной кислоты получают согласно европейскому патенту N 108565 путем взаимодействия циклического хлорангидрида сложного диэфира фосфорной кислоты со спиртом.
Соединение формулы IX:

причем "m" = 2 или 3,
при повышенной температуре и в инертном растворителе вводят во взаимодействие с соединением формулы /X/
YR6 R7 R8 /X/;
[значения радикалов и индексов см. в формуле /1/].
В качестве инертных растворителей принимают во внимание алифатические нитрилы, например, как ацетонитрил, пропионитрил; далее, полярные растворители, как N-метилпирролидон, диметилформамид, диметилацетамид.
Реакционная температура составляет 30-140oC, предпочтительно 50-120oC, особенно 70-100oC.
Можно работать как при атмосферном давлении, так и также при повышенном давлении, причем давление составляет 1000-2000 гПа, предпочтительно 1000-1750 гПа и в особенности 1000-1500 гПа.
Продолжительность реакции составляет 0,5-4 часа; когда работают при повышенном давлении, например, при 1500 гПа и 85oC; то продолжительность реакции составляет 2 часа.
Кроме того, соединения согласно изобретению можно получать также нижеописанным способом.
Взаимодействие активированных производных сложных эфиров фосфорной кислоты.
Этот способ состоит во введении во взаимодействие
гидрофосфата с соединениями общей формулы /XIII/:

причем в формуле /XIII/ R5, X, A, A1 и R6 имеют вышеуказанные значения;
Z обозначает группу согласно формулам /X/ или /XII/.
"HO" в формуле для гидрофосфата может быть заменен галогенидом, тозилатом, мезилатом и трифлатом.
В качестве водоотнимающих средств в реакции конденсации можно применять карбодиимиды как, например, дициклогексилкарбодиимид.
В качестве растворителей для варианта способа принимают во внимание апротонные, полярные растворители как, например, ацетонитрил, диметилформамид, диметилацетамид, диметилсульфоксид, N-метилпирролидон, и хлорированные углеводороды.
Температура составляет, например, 20-80oC, особенно предпочтительно 40-60oC. Продолжительность реакции составляет, например, 4 часа.
Соединения по изобретению
получают также тем, что соединение общей формулы /XII/, которое представляет собой активированный на алифатическом остатке
сложный эфир фосфорной кислоты

где Z1 - хлор, бром, мезилат, тозилат, или иод
/остальные символы имеют вышеуказанные значения/, вводят во взаимодействие с соединением формулы /X/ или формулы /XI/.
Эту реакцию осуществляют известным образом без растворителя или в инертном растворителе при температуре 50-150oC. В качестве растворителей принимают во внимание таковые, указанные в способе 2.
Вслед за указанной выше реакцией осуществляют взаимодействие с кислотосвязующими, соответственно, галогенид-связующими веществами как, например, Ag2CO3, и с основаниями, например, с карбонадами щелочных и щелочноземельных металлов и органическими аминами. В качестве растворителей служат алифатические спирты, например метанол, этанол и изопропанол. Можно работать при повышенной температуре.
При выполнении всех реакций нужно соблюдать обычное в химии металлоорганических веществ исключение влаги и кислорода воздуха.
Все четыре способа можно выполнять с проведением дополнительной стадии очистки. Очистку выше полученного соединения можно осуществлять тем, что остаток, который получают после выпаривания реакционной среды, в случае необходимости при пониженном давлении, растворяют в органическом растворителе /предпочтительно, в низших спиртах с содержанием воды 0-4%, как например, метанол, этанол, изопропанол, н-бутанол/ и обрабатывают с помощью совместного H-OH ионообменника или последовательно с помощью кислого и основного ионообменников. Полученный фильтрат в таком случае перемешивают с совместным H-OH-ионообменником, например, как Амберлит®МВ 3, например, в течение 1-5 часов, предпочтительно 2 часов, при температуре 10-50oC, предпочтительно 20oC. Вместо совместного H-OH ионообменника очистку можно осуществлять также последовательно с помощью кислого ионообменника и основного ионообменника.
В качестве ионообменников можно применять все нерастворимые твердые вещества, которые содержат ионообменивающиеся группы.
Кислыми ионообменниками являются такие, которые содержат, например, кислые группы, как сульфокислотные группы, карбоксильные группы. Примерами являются ионообменники с сульфокислотными группами на полистирольной матрице, как например, Amberlite®1R 120; Dowex®HCR; Duolite®C 20 или Lewatit®S 100. Слабокислыми ионообменниками являются, например, такие, которые на основе матрицы из полиакриловой кислоты как, например, Amberlite® IRC 76, Duolite®C 433 или Relite®CC, содержат группы карбоновой кислоты.
В качестве основных ионообменников принимают
во внимание, например, такие, которые на полимерной матрице /например, полистирольная матрица/ несут
первичные, вторичные, третичные или четвертичные аминогруппы как, например, Duolite®A 101; Duolite®A 102; Duolite®A 348; Duolite®
A 365; Duolite®A 375; Amberlite®1RA 67; Duolite®A 375; Amberlite®1RA 458 и Duolite®A 132.
Совместными
H-OH ионообменниками являются смеси из кислых и щелочных ионообменных смол, как
например, Amberlite® MB 1, Amberlite®MB 2, Amberlite®MB 3 и
Amberlite® MB 6.
Впрочем, нужно сослаться на Ullmann's Encyclopedia of Inductrial Chemistry, 5-е издание /1989/, т. А 14, с. 450, где описаны все имеющиеся в продаже ионообменники, которые можно использовать в способе очистки.
После съема веществ с ионообменной смолы выпаривают при пониженном давлении /например, 20 торр - 200 торр/ при 40-70oC и после этого перекристаллизуют из галогенированных углеводородов, насыщенных алифатических кетонов, смесей спиртов с кетонами или из насыщенных или ароматических углеводородов.
В качестве галогенированных углеводородов для перекристаллизации принимают во внимание, например, углеводороды с 1-6 C-атомами, причем один или несколько или все атомы водорода могут быть заменены на атомы хлора. Например, можно применять метиленхлорид, хлороформ, этиленхлорид, хлорбензол.
В качестве спиртов принимают во внимание насыщенные алифатические спирты с 1-6 C-атомами и 1-3 гидроксильными группами. В качестве кетонов принимают во внимание насыщенные, алифатические кетоны с 3-6 C-атомами.
Соотношение компонентов в смеси спирт:кетон составляет от 1:1 до 1:5 /по объему/. Особенно предпочтительна смесь этанола с ацетоном в соотношении 1:1 /по объему/.
В качестве насыщенных или ароматических углеводородов принимают во внимание: высококипящий петролейный эфир, толуол, ксилол, этилбензол.
Предлагаемые согласно изобретению соединения формулы /1/ отличаются низкой токсичностью при хорошем противоопухолевом действии. Например, соединение согласно примеру 1 в опыте на L 1210-культуре клеток имеет ЭК90 = 2.9 мкг/мл.
ЭК90 представляет собой эффективную концентрацию противоопухолеводействующего вещества, которая ин витро подавляет рост раковых клеток на 90% по сравнению с контрольным опытом без добавки противоопухолеводействующего вещества.
Пример 1
Внутренняя соль
2-[/(октадецилокси)гидроксифосфенил/окси]-As, As, As-триметиларсония: [название согласно номенклатуре ЮПАК] :

2,3 мл /25 ммоль/ оксихлорида фосфора растворяют в 15 мл хлороформа и при 0-5oC по каплям смешивают с раствором 6,1 г /22,5 ммоль/ октадеканола в 25 мл хлороформа, который содержит 8 мл пиридина. Продолжительность добавления составляет от 30 минут до 1 часа. Перемешивают еще 1 час при комнатной температуре и затем добавляют сразу 7,4 г /30 ммоль/ арсенохолинбромида. К этому раствору прикапывают 10 мл пиридина так, чтобы температура не превышала 20-25oC. По окончании добавления дополнительно перемешивают в течение 3 часов при комнатной температуре, после охлаждения до 5-10oC гидролизуют с помощью 4 мл воды и промывают с помощью 20 мл смеси воды с метанолом /1:1/, 20 мл 3%-ного карбоната натрия с метанолом /1:1/, 20 мл 3%-ной лимонной кислоты с метанолом /1:1/ и затем 20 мл смеси воды с метанолом /1:1/. Органическую фазу сушат над сульфатом магния, концентрируют и остаток обрабатывают 96%-ным этанолом. После отфильтровывания перемешивают с 30 г ионообменника Amberkite MB.3. Отсасывают через смесь кизельгура с активным углем, концентрируют в вакууме и кристаллизуют из ацетона. Выход: 2,54 г /23%/.
Элементный анализ приведен в табл. 1.
Тонкослойная хроматограмма [хлороформ/матанол/1M ацетат натрия в 25%-ном аммиаке = 70:40:10] : Rf = 0,53.
Пример 2
Внутренняя соль 2-[[(гексадецилокси)гидроксифосфенил]окси]-As, As, As-триметиларсония: /название согласно номенклатуре ЮПАК/:

Получение аналогично примеру 1; из 2,3 мл /25 ммоль/ оксихлорида фосфора, 5,5 г /22,5 ммоль/ гексадеканола, 8 - 10 мл пиридина и 7,4 г /30 ммоль/ арсенхолинбромида. Очистка путем обработки с помощью 23 г ионообменника Amberlite MB 3 в 96%-ном этаноле. Выход: 1,4 г /13%/.
Элементный анализ приведен в табл. 2.
Тонкослойная хроматограмма (хлороформ/метанол/1М ацетат натрия в 25%-ном аммиаке = 70:40:10): Rf = 0,48.
Пример 3.
Внутренняя соль
2-[[(цис-13-докозенилокси)гидроксифосфенил]окси]-As, As, As-триметиларсония /название согласно номенклатуре ЮПАК/:

Получение аналогично примеру 1, из 2,3 мл /25 моль/ оксихлорида фосфора, 7,3 г /22,5 ммоль/ эруцилового спирта, 8 + 10 мл пиридина и 7,4 /30 ммоль/ арсенохолинбромида. Очистка путем обработки с помощью 23 г ионообменника Amverlite MB 3 в 95%-ном этаноле. Выход: 1,1 г.
Элементный анализ:
Рассчитано, %: C 55,28; H
10,
31
Найдено, %:
C 54,98; H 10,19
C 55,08; H 10,30
Тонкослойная хроматограмма [хлороформ/метанол/1М ацетат натрия в 25%-ном аммиаке = 70:40:10]:Rf=0,52.
Внутренняя соль 2-[[(октадецилокси)гидроксифосфенил] окси]P,P,P-триметилфосфония /название согласно номенклатуре ЮПАК/:

получение аналогично примеру 1: из 4,6 мл /50 ммоль/ оксихлорида фосфора, 12,2 г /45 ммоль/ октадеканола, 16+20 мл пиридина и 12,1 г /60 ммоль/ фосфохолинбромида. Очистка путем обработки с помощью 50 г ионообменника Amberlite MB 3 в 96%-ном этаноле. Выход: 2,1 г /10%/.
Элементный анализ приведен в табл. 3.
Тонкослойная хроматограмма (хлороформ/метанол/1М ацетат натрия в 25%-ном аммиаке = 70:40:10):Rf=0,43.
Пример 5
Внутренняя соль 2-[[(гексадецилокси)гидроксифосфенил]
окси]-P,P,P-триметилфосфония:

Получение аналогично примеру 1: из 4,6 мл /50 ммоль/ оксихлорида фосфора, 10,9 г /45 ммоль/ гексадеканола, 16+20 мл пиридина и 12,1 г /60 ммоль/ фосфохолинбромида. Очистка путем обработки с помощью ионообменника Amberlite MB 3 96%-ном этаноле. Выход: 5,2 г /27%/.
Элементный анализ приведен в табл. 4.
Тонкослойная хроматограмма [хлороформ/метанол/1М ацетат натрия в 25%-ном аммиаке=70:40:10]:Rf=0,43.
Пример 6
Внутренняя соль 2-[[(цис-13-докозенилокси)гидроксифосфенил] окси]-P,P, P-триметилфосфония:

Получение аналогично примеру 1: из 3,5 мл /38 ммоль/ оксихлорида фосфора, 11,2 г /34 ммоль/ эруцилового спирта, 12 + 15 мл пиридина и 9,2 г /46 ммоль/ фосфохолинбромида. Очистка путем обработки с помощью 45 г ионообменника Amberlite MB 3 в 96%-ном этаноле. Выход: 1,9 г /11%/.
Элементный анализ приведен в табл. 5.
Тонкослойная хроматограмма (хлороформ/метанол/1М ацетат натрия в 25%-ном аммиаке = 70:40:10):Rf=0,47.
Пример 7
Внутренняя соль
2-[[(октадецилокси)гидроксифосфенил]окси]-As, As, As-триметилэтиларсония:

Получение аналогично примеру 1: из 3,5 мл /38 ммоль/ оксихлорида фосфора, 9,33 г /35 ммоль/ октадеканола, 12 + 5 мл пиридина и 13,2 г /46 ммоль/ триэтил-/2-гидроксиэтил/-арсонийбромида. Очистка путем обработки с помощью ионообменника Amberlite MB 3 в 96%-ном этаноле и последующей колоночной хроматографии на силикагеле с помощью смеси CH2Cl2/CH3OH/25%-ный аммиак = 70: 40:10. Выход 3.39 /18%/.
Элементный анализ приведен в табл. 6.
Тонкослойная хроматограмма (хлороформ/метанол/25%-ный аммиак = 80:25:5): Rf=0,60.
Пример 8
Внутренняя соль 2-[[(гексадецилокси)гидроксифосфенил]окси]-As, As, As-триэтилэтиларсония:

Получение аналогично примеру 1: из 3,5 мл /38 ммоль/ оксихлорида фосфора, 8,43 г /35 ммоль/ гексадеканола, 12 + 15 мл пиридина и 13,2 г /46 ммоль/ триметил-/2-гидроксиэтил/-арсонийбромида. Очистка путем обработки с помощью ионообменника Amberlite MBB в 96%-ном этаноле и последующей колоночной хроматографии на силикагеле с помощью смеси CH2Cl2/CH3 OH/ 25%-ный аммиак=70: 40:10. Выход: 2,26 г /13%/.
Элементный анализ приведен в табл. 7.
Тонкослойная хроматограмма /хлороформ/метанол/25%-ный аммиак=80:25:5/: Rf=0, 57.
Пример 9
Внутренняя соль 2-[[(цис-13-докозенилокси)гидроксифосфенил]окси]-As, As, As-триэтилэтиларсония:

Получение аналогично примеру 1; из 3,5 мл /38 ммоль/ оксихлорида фосфора, 11,4 г /35 ммоль/ эруцилового спирта, 12 + 15 мл пиридина и 13,2 г /46 ммоль/ триметил-/2-гидроксиэтил/-арсонийбромида. Очистка путем обработки с помощью 30 г ионообменника Amberlite MBB в 96%-ном этаноле и последующей колоночной хроматографии из силикагеле с помощью смеси CH2Cl2/CH3OH/ 25%-ный аммиак = 70:4-:10. Выход: 4,50 г (22%).
Элементный анализ приведен в табл. 8.
Тонкослойная хроматограмма (хлороформ/метанол/25%-ный аммиак = 80:25: 5)Rf=0,57.
Пример 10
Внутренняя соль 3-[[(октадецилокси)гидроксифосфенил]окси]-As, As, As-триметилпропиларсония:

Получение аналогично примеру 1; из 4,0 мл /38 ммоль/ оксихлорида фосфора, 10,8 г /35 ммоль/ октадеканола, 14 + 17 мл пиридина и 13,2 г /53 ммоль/ триметил-(2-гидроксиэтил)-арсонийбромида. Очистка путем обработки с помощью 30 г ионообменника Amberlite MBB в 96%-ном этаноле и последующей колоночной хроматографии на силикагеле с помощью смеси CH2Cl2/CH3OH/ 25%-ный аммиак=70:40:10. Выход: 1,97 г /10%/.
Элементный анализ приведен в табл. 9.
Тонкослойная хроматограмма (хлороформ/метонол/ 25%-ный аммиак=70:40:10): Rf=0,47.
Пример 11
Внутренняя соль
3-[[(гексадецилокси)гидроксифосфенил]окси]-As, As,
As-триметилпропиларсония:
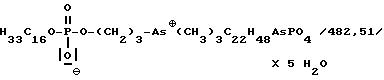
Получение аналогично примеру 1, из 4,0 мл /43 ммоль/ оксихлорида фосфора, 9,7 г /40 ммоль/ гексадеканола, 14+17 мл пиридина и 13,6 г /53 ммоль/ триметил-(3-гидроксиэтил)-арсонийбромида. Очистка путем обработки с помощью 30 г ионообменника Amberlite MBB в 96%-ном этаноле и последующей колоночной хроматографии на силикагеле с помощью смеси CH2Cl2/CH3OH/ 25%-ный аммиак = 70:40:10. Выход: 2,0 г (10%).
Элементный анализ приведен в табл. 10.
Тонкослойная хроматограмма (хлороформ/метанол/ 25%-ный аммиак=70:40:10): Rf =0,47.
Пример 12
Внутренняя соль
3[[(докозенилокси)гидроксифосфенил] окси]-As, As, As-триметилпропиларсония:

Получение аналогично примеру 1; из 4,0 мл /43 ммоль/ оксихлорида фосфора, 13,0 г /40 ммоль/ эруцилового спирта, 14+17 мл пиридина и 13,2 г /53 ммоль/ триметил-(3-гидроксиэтил)-арсонийбромида. Очистка путем обработки с помощью ионообменника Amberlite MBB в 96%-ном этаноле и последующей колоночной хроматографии на силикагеле с помощью смеси CH2Cl2/CH3OH/ 25%-ный аммиак = 70:40:10. Выход: 2,4 г (11%).
Элементный анализ приведен в табл. 11.
Тонкослойная хроматограмма
(хлороформ/метанол/ 25-ный аммиак=70:40:10): Rf=0,50
Пример
13
Внутренняя соль 3-[[(цис-13-докозенилокси)гидроксифосфенил] окси]-P,P, P-триметилпропилфосфония:

Получение аналогично примеру 1; из 4,2 мл /45 ммоль/ оксихлорида фосфора, 13,8 г /42 ммоль/ эруцилового спирта, 14+18 мл пиридина и 12,0 г /56 ммоль/ триметил-(3-гидроксипропил)-арсонийбромида. Очистка путем обработки с помощью 45 г ионообменника Amberlite MBB в 96%-ном этаноле и последующей колоночной хроматографии на силикагеле с помощью смеси CH2Cl2/CH3OH/ 25%-ный аммиак =70:40:10. Выход: 2,93 г (13%).
Элементный анализ приведен в табл. 12.
Тонкослойная хроматограмма (хлороформ/метанол/ 1М ацетат натрия в 25%-ном аммиаке - 70:40:10):Rf=0,25.
Пример 14
Внутренняя соль
3-[[(окатадецилокси)гидроксифосфенил] окси]-P,P,
P-триметилпропилфосфония:

Получение аналогично примеру 1; из 4,2 мл /45 ммоль/ оксихлорида фосфора, 11,4 г /42 ммоль/ октадеканола, 14+18 мл пиридина и 12,2 г /56 ммоль/ триметил-(3-гидроксипропил)-фосфонийбромида. Очистка путем обработки с помощью 56 г ионообменника Amberlite MBB в 96%-ном этаноле и последующей колоночной хроматографии на силикагеле с помощью смеси CH2Cl2/CH3OH/ 25%-ный аммиак = 70:40:10. Выход: 2,27 г /11%/.
Элементный анализ приведен в табл. 13.
Тонкослойная хроматограмма (хлороформ/метанол/1М ацетат натрия в 25%-ном аммиаке =70:40:10):Rf=0,50.
Пример 15
Внутренняя соль
3-[[(гексадецилокси)гидроксифосфенил] окси]-P,P,P-триметилпропилфосфония:

Получение аналогично примеру 1; из 4,2 мл /45 ммоль/ оксихлорида фосфора, 10,2 г /42 ммоль/ гексадеканола, 14+18 мл пиридина и 12,0 г /56 ммоль/ триметил-(3-гидроксипропил)-фосфонийбромида. Очистка путем обработки с помощью 55 г ионообменника Amberlite MBB в 96%-ном этаноле и последующей колоночной хроматографии на силикагеле с помощью смеси CH2Cl2/CH3OH/ 25%-ный аммиак=70:40:10. Выход: 1,86 г (10%).
Элементный анализ приведен в табл. 14.
Тонкослойная хроматограмма (хлороформ/метанол/ 1М ацетат натрия в 25%-ном аммиаке =70:40:10):Rf=0,50.
Пример 16
Внутренняя соль 3-[[(нонадецилокси)гидроксифосфенил]окси]-P,P,P-триметилэтилфосфония:
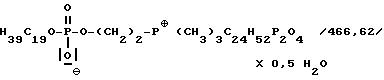
Получение аналогично примеру 1; из 3,2 мл /35 ммоль/ оксихлорида фосфора, 9,10 г /32 ммоль/ монодеканола, 11 + 4 мл пиридина и 8,64 г /43 ммоль/ фосфохолинбромида. Очистка путем обработки с помощью 25 г ионообменника Amberlite MBB в 96%-ном этаноле и последующего кипячения 2 раза в ацетоне. Выход: 1,85 г /12%/.
Элементный анализ приведен в табл 15.
Тонкослойная хроматограмма (хлороформ/метанол/ 1М ацетат натрия в 25%-ном аммиаке = 70:40:10:)Rf=0,58.
Пример 17
Внутренняя соль 2-[[(эйкозилокси-)-гидроксифосфенил]окси]-P,P,P-триметилэтилфосфония:

Получение аналогично примеру 1; из 3,2 мл /35 ммоль/ оксихлорида фосфора, 9,63 г /32 ммоль/ эйкозанола, 11+14 мл пиридина и 8,64 /43 ммоль/ фосфохолинбромида. Очистка путем обработки с помощью 25 г ионообменника Amberlite MBB в 96%-ном этаноле и последующего кипячения 2 раза в ацетоне. Выход: 0,02 г (7%).
Элементный анализ приведен в табл. 16.
Тонкослойная хроматограмма (хлороформ/метанол/ 1М ацетат натрия в 25%-ном аммиаке = 70:40:10):Rf=0,53.
Пример 18
Внутренняя соль 2-[[(нонадецилокси)гидроксифосфенил]окси]-As, As,
As-триметилэтиларсония:

Получение аналогично примеру 1; из 4,6 мл /50 ммоль/ оксихлорида фосфора, 12,8 г /45 ммоль/ нонадеканола, 16+20 мл пиридина и 14,7 г /60 ммоль/ арсенохолинбромида. Очистка путем обработки с помощью 55 г ионообменника Amberlite MBB в 96%-ном этаноле. Выход: 4,05 г (18%).
Элементный анализ приведен в табл. 17.
Тонкослойная хроматограмма (хлороформ/метанол/ 25%-ный аммиак = 80:25: 5):Rf=0,45.
Пример 19
Внутренняя соль 2-[[(эйкозилокси)гидроксифосфенил] окси] -As, As, As-триметилэтиларсония:
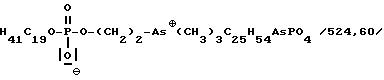
Получение аналогично примеру 1; из 4,6 мл /50 ммоль/ оксихлорида фосфора, 13,4 г /45 ммоль/ эйкозанола, 16+20 мл пиридина и 14,7 г /60 ммоль/ арсенохолинбромида. Очистка путем обработки с помощью 50 г ионообменника Amberlite MBB в 96%-ном этаноле. Выход: 2,81 г (12%).
Элементный анализ приведен в табл. 18.
Тонкослойная хроматограмма (хлороформ/метанол/25%-ный аммиак = 80:25:5): Rf=0,45.
Пример 20
Внутренняя соль
2-[[(гептадецилокси)гидроксифосфенил]окси]-As, As, As-триметилэтиларсония:

Получение аналогично примеру 1; из 4,6 мл /50 ммоль/ оксихлорида фосфора, 11,5 г /45 ммоль/ гептадеканола, 16+20 мл пиридина и 14,7 г /60 ммоль/ арсенохолинбромида. Очистка путем обработки с помощью 35 г ионообменника Amberlite MBB в 96%-ном этаноле и последующего перемешивания в ацетоне. Выход: 1,20 г (6%).
Элементный анализ приведен в табл. 19.
Тонкослойная хроматограмма (хлороформ/метанол/ 1М ацетат натрия в 25%-ном аммиаке = 70:40:10):Rf=0,45.
Пример 21
Внутренняя соль 2-[[(октадецилокси)гидроксифосфенил]окси]-P,P,
-диэтил-P-фенил-этилфосфония:

Получение аналогично примеру 1; из 2,3 мл /25 ммоль/ оксихлорида фосфора, 7,17 г /26,5 ммоль/ октадеканола, 8+10 мл пиридина и 7,28 г /26,5 ммоль/ диэтил-(2-гидроксиэтил)-фенил-фосфонийбромида. Очистка путем обработки с помощью 21 г ионообменника Amberlita MBB в 96%-ном этаноле и двухкратной перекристаллизации из ацетона.
Выход: 1,76 г (13%).
Элементный анализ приведен в табл. 20.
Тонкослойная хроматограмма (хлороформ/метанол/ 25%-ный аммиак - 80:25: 5):Rf=0,37.
Пример 22
Внутренняя соль
2-[[(цис-13-докозенилокси)гидроксифосфенил]окси]-P,
P-диэтил-P-фенил- этилфосфония:
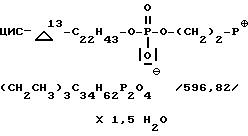
Получение аналогично примеру 1; из 2,3 мл /25 ммоль/ оксихлорида фосфора, 8,6 г /27 ммоль/ эруцилового спирта, 8 + 10 мл пиридина и 7,28 г /27 ммоль/ диэтил-(2-гидроксиэтил)-фенил- фосфонийбромида. Обрабатывают с помощью 30 г ионообменника Amberlita MBB в 96%-ном этаноле и кристаллизуют из ацетона. Выход: 2,53 г (17%).
Элементный анализ приведен в табл. 21.
Тонкослойная хроматограмма (хлороформ/метанол/ 25%-ный аммиак = 80:25: 5):Rf = 0,37.
Пример 23
Внутренняя соль 2-[[[(4'-додецилциклогексил)метилокси]гидроксифосфенил] окси]-As, As,
As-триметилэтиларсония:

Получение аналогично примеру 1; из 2,4 мл /26 ммоль/ оксихлорида фосфора, 6,50 г /23 ммоль/ додецилциклогексилметанола, 9 + 12 мл пиридина и 7,59 г /31 ммоль/ арсенохолинбромида. Очистка путем обработки с помощью 30 г ионообменника Amberlita MBB в 96%-ном этаноле и путем перемешивания в ацетоне. Выход: 1,64 г /14%/.
Элементный анализ приведен в табл. 22.
Тонкослойная хроматограмма (хлороформ/метанол/1M/ацетат натрия в 25%-ном аммиаке = 70:40:10) : Rf = 0,37.
Пример 24
1-O-Октадецил-2-O-метил-рац-глицерофосфоарсенохолин:

Получение аналогично примеру 1; из 3,0 мл /33 ммоль/ оксихлорида фосфора, 10,8 г /30 ммоль/ 1-O-октадецил-2-O-метил-рац-глицерина, 11 + 13 мл пиридина и 9,8 г /40 ммоль/ арсенохолинбромида. Очистка путем обработки с помощью 55 г ионообменника Amberlita MBB в 96%-ном этаноле и путем перемешивания с ацетоном. Выход: 5,83 г /33%/.
Элементный анализ приведен в табл. 23.
Тонкослойная хроматограмма (хлороформ/метанол/1M ацетат натрия в 25%-ном аммиаке = 70:40:10):Rf = 0,57.
Пример 25
1-O-Октадецил-2-O-метил-рац-глицерофосфофосфохолин:

Получение аналогично примеру 1; из 4,6 мл /50 ммоль/ оксихлорида фосфора, 16,1 г /45 ммоль/ 1-O-октадецил-2-O-метил-рац-глицерина, 16 + 20 мл пиридина и 12,1 г /60 ммоль/ фосфохолинбромида. Очистка путем обработки с помощью 45 г ионообменника Amberlite MBB в 96%-ном этаноле и путем перемешивания с ацетоном. Выход: 6,25 г /26%/.
Элементный анализ приведен табл. 24.
Тонкослойная хроматограмма (хлороформ/метанол/1M ацетат натрия в 25%-ном аммиаке = 70:40:10):Rf = 0,52.
Пример 26
Внутренняя соль 2-[[(октадецилокси)гидроксифосфенил]окси]-Sb, Sb,
Sb-триметилэтилстибония:

Получение аналогично примеру 1; из 2,1 мл /23 ммоль/ оксихлорида фосфора, 6,49 г /24,5 ммоль/ октадеканола, 7 + 9 мл пиридина и 7,0 г /24 ммоль/ стибонохолинбромида. Очистка путем обработки с помощью 15 г ионообменника Amberlite MBB и последующей колоночной хроматографии на силикагеле с помощью смеси CH2Cl2/CH3OH/ 25%-ный аммиак = 80:25:5. Содержащие продукты фракции обрабатывают диэтиловым эфиром и концентрируют. Выход: 1,0 г /8%/.
Элементный анализ приведен в табл. 25.
Тонкослойная хроматограмма (хлороформ/метанол/1M ацетат натрия в 25%-ном аммиаке = 70:40:10):Rf = 0,62.
Пример 27
Октадецил-/2-(A-метиларсенанио)-этил/-фосфат

Синтез соединения указанной выше формулы осуществляют аналогично описанному в примере 1. Берут 0,32 мл (3,50 ммоля) оксихлорида фосфора, 0.87 г (3,50 ммоля) октадеканола, 11+14 мл пиридина и 1,22 г (4,28 ммоля) 1-метил-1-(2-гидроксиэтил)арсенанио-бромида. Очистку осуществляют путем обработки ионообменником Амберлит МБ 3, который берут в количестве 2,5 г в 96%-ном этаноле. Затем осуществляют хроматографию на колонке, заполненной силикагелем с CH2Cl2/CH3OH/ 25%-ный раствор аммиака (70:40:10).
Выход 160 мг (10%).
Элементный анализ приведен в табл. 26.
Температура плавления: 185oC
Тонкослойная хроматограмма (CH2Cl2/CH3OH/1M ацетат натрия в 25%-ном аммиаке. 70:40:10).
Rf=0,83.
Согласно способу, описанному в примере 1, получено соединение общей формулы I:

Наименование соединения (Д-51117):
Внутренняя соль 2-[[(октадек-9-ин-1-илокси)гидроксифосфенил]окси]-P,P, P-триметил-этилфосфония.
Физико-химические данные
этого соединения:
Элементный анализ (Д-51117 • 1,5 H2O) приведен в табл.27.
Rf = 0,50 (SiO2, CH2Cl2/CH3OH/1M NaOAc в 25% NH4OH 70:40:10) ЯМР (химическое смещение дельта в ppm) (500 МГц, CDCl3), 0,85 (3H, t, -CH3), 1,30 (18H, m, -(CH2)n-), 1, 45 (4 H, m, -CH2-CC-CH2-), 1,57 (2H, p, -CH2-), 2,12 (9H, d, -P+(CH3)3), 2,75 (2H, m, -CH2-P+), 3,78 (2H, q, CH2-OP(= O)(01-)-O-), 4,22 (2H, m, -O-P(=O)-O-CH2-C-P+).
Результаты биологических испытаний представлены в табл. 28.
Результаты подавления лейшманиоза in vitro при употреблении ALPs представлены в табл. 29.
Описание методики и результаты испытаний на биологическую активность.
Простые эфиры липидов являются важным классом мембранных липидов при лейшманиозах и используются для фиксации кодирующих гликолипидов (например, LPG, GJPLS и т. д.) и гликопротеинов (например, GP63) на промастиготной и амастиготной клеточной оболочки (цитолемме). Поэтому изучали эффективность воздействия аналогов простых эфиров липидов, таких как Мултефосин (HE PC) на лейшманиозный метаболизм, т. к. предполагалось, что такие синтетические аналоги являются новым классом противоопухолевых лекарственных средств и активируют метаболизм простых эфиров липидов и функции мембраны в раковых клетках.
Противолейшманиозная in
vitro активность ряда аналогов простых эфиров липидов сравнивали с активностью простых и сложных эфиров природного происхождения, а также с активностью уже известных
лекарственных средств. Исследовали
воздействие на заражение Leishmania mexicana и Leishmania donovani на стадии промастиготов на коже и внутренних органов. После 24 часов обработки Leishmania
mexicana для различных лекарственных
средств получили следующие значения ЛД50 (мкг/мл):
Пентостам >100; пентамидин 2,0; аминосидин 10,0; сложный эфир липида 2-LPC 45,0;
простой эфир липида Lpaf 27,0; аналоги
простого эфира липида: ET 18 OCH3 1,5; ET PA >128; HE PC 2,0; соединения согласно изобретению:
по примеру 1 1,5
по примеру 4
0,7
по примеру 18 0,8
Активность против лейшманиоза всех кроме одного аналогов простых эфиров липидов оказалась значительно выше, чем у пентостама и аминосидина и почти одинакова
активности пентамидина. Напротив, сложный и
простой эфиры липидов природного происхождения 2-LPC и L-Paf демонстрировали активность против лейшманиоза в 12 раз ниже, чем активность синтетических
аналогов. К тому же аналог простого эфира липида
ET PA был в > 60 раз менее активным, чем его структурные гомологи ET 18 OCH3 или HE PC, что позволяет предположить существование
зависимости цитотоксичности от структуры в
исследуемом классе сложных и простых эфиров липидов.
Активность in vitro этого нового класса лекарственных средств против лейшманиоза в высокой степени сравнима и при поражении на коже, и при поражении внутренних органов, причем как в случае внутриклеточного амастигота, так и в случае внеклеточного промастигота. Таким образом, вполне можно считать подтвержденным предположение о механизме действия, а именно - активизации биосинтеза через простые эфиры липидов - и о механизме трансдукции сигнала - РКС-торможение.
Пример 28 (капсулы по 100 мг)
Берут
1000 г одного из соединений согласно изобретению, а также 684 г моногидрата лактозы ДАВ 10, 345 г микрокристаллической целлюлозы ДАВ 10, 60 г талька, 15 г
высокодисперсного силикагеля ДАВ 10 и 6 г
стеарата магния, просеивают через сито с размером ячеек 0,8 мм и затем перемешивают в смесителе в течение 45 минут.
По 276 мг этой массы дозировали на капсулозаполняющей машине в капсулы из желатины размером 1. Каждая капсула содержит 100 мг соединения согласно изобретению.
Пример 29 (таблетки по 60 мг)
Берут
51,625 г соединения согласно изобретению,
а также 87,575 г моногидрата лактозы ДАВ 10, 48,300 г микрокристаллической целлюлозы ДАВ 10, 2,800 г талька, 1,400 г высокодисперсного силикагеля ДАВ 10 и
просеивают их через сито с размером ячеек 0,8
мм.
Массу перемешивают в подходящем смесителе в течение 10 минут и затем добавляют 0,4 г стеарата магния, который также предварительно просеивают через сито с размером 0,8 мм. Смесь снова перемешивают в течение 5 минут. Образовавшуюся таблеточную массу таблетируют на таблеточной машине в таблетки диаметром 8 мм и весом 180 мг.
Реферат
Описываются соединения формулы I, где R5 линейный или разветвленный C10 - C24-алкильный остаток, который может содержать также от одной до трех двойных и/или тройных связей; А обозначает простую связь или одну из групп формул II-VI, причем R7 обозначает линейную C1 - C4-алкильную группу, и группы II - VI ориентированы так, что атом кислорода связан с атомом фосфора соединения I, X обозначает атом кислорода или серы; А1 обозначает линейный или разветвленный C2 - C10-алкильный остаток, R6-Y(R8R9R10), где R8, R9, R10 одинаковые или разные, обозначают независимо друг от друга водород, линейный, разветвленный или циклический C1 - C6-алкильный остаток, или два остатка могут образовывать цикл, при этом Y обозначает Р, As, Sb, или Bi. Указанные соединения формулы I обладают противоопухолевой и/или противолейшманиозной активностью. Способ заключается в том, что соединение формулы VII, где значения R5, Х и А указаны выше, подвергают взаимодействию с оксихлоридом фосфора, в среде растворителя или в его отсутствии, полученный при этом продукт далее подвергают взаимодействию с соединением формулы VIII НО-А1- R6, где значения А1 и R6 указаны выше, и затем осуществляют гидролиз. Предложена фармацевтическая композиция, обладающая противоопухолевым и/или противолейшманизным действием, содержащая в качестве активного начала по крайне мере одно соединение формулы I в эффективном количестве, а также способ получения фармацевтической композиции, обладающей противоопухолевым и/или противолейшманиозным действием, включающий смешение эффективного количества одного или более соединений общей формулы I с одной или более фармацевтически приемлемыми целевыми добавками с последующей переработкой полученной смеси в обычные лекарственные формы. 4 c. и 2 з.п. ф-лы.

Формула
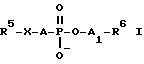
где R5 обозначает линейный или разветвленный C10 - C24-алкильный остаток, который может содержать также от одной до трех двойных и/или тройных связей;
A обозначает простую связь или одну из групп формул II - VI
- CH2 - CH2 - CH2 - O - II
- CH2 - CH2 - O - III



причем R7 обозначает линейную C1 - C4-алкильную группу и группы II - VI ориентированы так, что атом кислорода связан с атомом фосфора соединения I;
X обозначает атом кислорода или серы;
A1 обозначает линейный или разветвленный C2 - C10-алкильный остаток;
R6 обозначает

где R8, R9, R10 - одинаковые или различные, обозначают независимо друг от друга водород, линейный, разветвленный или циклически C1 - C6-алкильный остаток, или два остатка могут образовывать цикл, при этом Y обозначает P, As, Sb или Bi.

где R5, X, A, A1 и R6 имеют значения, указанные в п.1,
отличающийся тем, что подвергают взаимодействию соединение общей формулы VII
R5 - X - A - H, VII
где R5, X и A имеют значения, указанные в п.1,
с оксихлоридом фосфора в среде растворителя или в его отсутствии, полученный продукт далее подвергают взаимодействию с соединением общей формулы VIII
HO - A1 - R6,
где A1 и R6 имеют значения, указанные в п.1,
и затем осуществляют гидролиз.

Комментарии