Производные аминофосфоновых и -фосфиновых кислот, способ их получения и фармацевтические составы на их основе - RU2181362C2
Код документа: RU2181362C2
Чертежи

Описание
Изобретение относится к соединениям формулы I

в которой R1 обозначает гидрокси или алифатический, аралифатический либо ароматический остаток,
Х обозначает двухвалентный алифатический, циклоалифатический, циклоалифатически-алифатический, аралифатический, гетероарилалифатический либо ароматический остаток,
R2 обозначает водород или алифатический либо аралифатический остаток,
alk представляет собой (низш.)алкилиден и
R3, R4 и R5 независимо друг от друга обозначают водород, (низш.)алкил, галоген, трифторметил, циано или нитро,
а также к их солям, способу их получения и к содержащим их фармацевтическим препаратам.
Новыми
соединениями
формулы I являются, например, такие, в которых
a1) R4 имеет значение, отличное от нитро, если Х представляет собой метилен, 3-гидроксибензилиден, 3-метоксибензилиден,
3-пиридилметилен, этилен, оксоэтилен, этилиден, 1,3-пропилен, 1,3-(1-карбокси)пропилен, циклопропилен или 1,4-бутилен, R1 представляет собой гидрокси, alk представляет собой метилен и
R2, R3 и R5 обозначают водород, или если Х представляет собой метилен, R1 представляет собой метил или бензил, alk представляет собой метилен и R2,
R3 и R5 обозначают водород, или если Х представляет собой бутилен, R1 представляет собой гидрокси, alk представляет собой метилен, R2 представляет
собой
метил и R3 и R5 обозначают водород и
б1) R4 имеет значение, отличное от брома, если Х представляет собой метилен или этилиден, R1
представляет
собой гидрокси, alk представляет собой метилен и R2, R3 и R5 обозначают водород, например, такие, в которых
а2) Х имеет значение, отличное от
метилена,
3-гидроксибензилидена, 3-метоксибензилидена, 3-пиридилметилена, этилена, оксоэтилена, этилидена, 1,3-пропилена, 1,3-(1-карбокси) пропилена, циклопропилена и 1,4-бутилена, если R1
обозначает
гидрокси и R2 обозначает водород,
б2) Х имеет значение, отличное от 1,4-бутилена, если R1 обозначает гидрокси и R2 обозначает метил, и
в)
Х имеет
значение, отличное от метилена, если R1 является метилом или бензилом.
Алифатические остатки представляют собой, например, (низш.)алкильные, (низш.)алкенильные либо (низш.)алканоильные остатки.
Аралифатические остатки представляют собой, например, фенил(низш. )алкильные либо нафтил(низш.)алкильные остатки.
Ароматические остатки представляют собой, например, фенильные либо нафтильные остатки.
Двухвалентные алифатические остатки представляют собой, например, (низш. )алкилен, оксо(низш.)алкилен, оксо(низш.)алкенилен, (низш.)алкилиден, полигалоген (низш.)алкилиден, карбокси(низш.)алкилиден, гидрокси(низш.)алкилиден, (низш.)алкокси(низш.)алкилиден либо (низш.)алкилтио-(низш.)алкилиден.
Двухвалентные циклоалифатические остатки представляют собой, например, необязательно сконденсированные с бензольным ядром циклоалкиленовые, циклоалкилиденовые либо циклоалкенилиденовые остатки, такие как 3-6-членный циклоалкилен, 3-6-членный циклоалкилиден либо 3-6-членный бензоциклоалкенилиден.
Двухвалентные циклоалифатически-алифатические остатки представляют собой, например, 3-6-членный циклоалкил(низш.)алкилен либо циклоалкил(низш.) алкилиден.
Двухвалентные аралифатические остатки представляют собой, например, фенил(низш. )алкиленовые, фенил (оксо) (низш.)алкиленовые либо фенил (низш.) алкилиденовые остатки.
Двухвалентные гетероаралифатические остатки представляют собой, например, пирролил (низш. ) алкилиденовые, фурил (низш.) алкилиденовые, тиенил (низш.) алкилиденовые либо пиридил (низш.) алкилиденовые остатки.
Двухвалентные ароматические остатки представляют собой, например, фениленовые либо нафтиленовые остатки.
Циклическая система указанных циклоалкиленовых, циклоалкилиденовых, необязательно сконденсированных с бензольным ядром циклоалкиленовых, циклоалкилиденовых либо циклоалкенилиденовых, циклоалкил(низш.)алкилиденовых, фенил (низш. )алкиленовых, фенил(оксо)(низш.)алкиленовых, фенил (низш.) алкилиденовых, фурил (низш.) алкилиденовых, тиенил (низш.) алкилиденовых, пиридил(низш.)алкилиденовых, фениленовых, нафтиленовых, фенил (низш.)алкильных и нафтил(низш.)алкильных остатков может быть незамещенной или обычным образом замещенной, в частности одно-, дву- либо трехзамещенной, например, (низш.)алкилом, (низш.)алкокси-, фенилокси-, гидроксильной группами, галогеном, трифторметилом, ди(низш. )алкиламино-, (низш.)алканоиламино-, нитро-, карбоксильной, (низш. )алкоксикарбонильной, карбамоильной и/или цианогруппами.
3-6-членный бензоциклоалкенилиден представляет собой, например, инданилиден либо тетрагидронафтилиден, такой как индан-2, 2-илиден.
3-6-членный циклоалкилен представляет собой, например, циклопропилен, 1,2-цикло бутилен, 1,2-циклопентилен либо 1,2-циклогексилен.
3-6-членный циклоалкилиден представляет собой, например, циклопропилиден, циклобутилиден, циклопентилиден либо циклогексилиден.
3-6-членный циклоалкил(низш. )алкилен представляет собой, например, 3-6-членный циклоалкил-С1-С4алкилен, где циклоалкил обозначает, например, циклопропил, циклобутил, циклопентил либо циклогексил.
3-6-членный циклоалкил (низш. )алкилиден представляет собой, например, 3-6-членный циклоалкил-С1-С4алкилиден, где циклоалкил обозначает, например, циклопропил, циклобутил, циклопентил либо циклогексил.
Выше и в последующем под низшими остатками и соединениями имеются в виду, например, такие, которые имеют вплоть до 7, предпочтительно вплоть до 4, атомов углерода (С-атомов).
Карбокси(низш. )алкилиден представляет собой, например, карбокси-С1-С4алкилиден, такой как карбоксиметилен, а также 2-карбоксиэтилиден, 3-карбоксипропилиден либо 4-карбоксибутилиден.
Ди(низш. )алкиламино представляет собой, например, ди-С1-С4алкиламино, такой как диметиламино, диэтиламино, N-этил-N-метиламино, N-пропил-N-метиламино, N-изопропил-N-метиламино либо N-бутил-N-метиламино.
Фурил(низш.)алкилиден представляет собой, например, фурил-С1-С4алкилиден, такой как фурилметилен, а также 2-фурилэтилиден, 3-фурилпропилиден либо 4-фурилбутилиден.
Галоген представляет собой, например, галоген с атомным номером до 35 и 35, такой как фтор, хлор либо бром.
Гидрокси(низш. )алкилиден представляет собой, например, гидрокси-С2-С7алкилиден, прежде всего гидрокси-С2-С4алкилиден, такой как 2-гидроксиэтилиден, 3-гидроксипропилиден либо 4-гидроксибутилиден.
Нафтил(низш. )алкил представляет собой, например, незамещенный или, как указано выше, замещенный нафтил-С1 -C4алкил, такой как нафтилметил, 2-нафтилэтил, 3-нафтилпропил либо 4-нафтилбутил.
(Низш. )алканоиламино представляет собой, например, С1-С7 алканоиламино, такой как ацетиламино, пропиониламино, бутириламино, изобутириламино либо пивалоиламино.
(Низш. )алкенил представляет собой, например, С2-С7 алкенил, предпочтительно С3-С4алкенил, такой как аллил либо бут-2-енил.
(Низш. )алкокси представляет собой, например, С1-С7алкокси, предпочтительно С1-С5алкокси, такой как метокси, этокси, пропилокси, изопропилокси, бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси, пентилокси либо гексилокси- или гептилоксигруппу.
(Низш.)алкоксикарбонил представляет собой, например, С1-С7алкоксикарбонил, предпочтительно С1-С4алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, пропилоксикарбонил, изопропилоксикарбонил либо бутилоксикарбонил, но может представлять собой также изобутилоксикарбонил, втор-бутилоксикарбонил, трет-бутилоксикарбонил либо пентилоксикарбонильную, гексилоксикарбонильную или гептилоксикарбонильную группу.
(Низш. )алкокси(низш. )алкилиден представляет собой, например, С1-С4 алкокси-С1-С4алкилиден, такой как 2-метоксиэтилиден, этоксиметилен, 2-метоксиэтилиден, 2-этоксиэтилиден, 3-метоксипропилиден либо 4-метоксибутилиден.
(Низш. )алкил представляет собой, например, С1-С7алкил, предпочтительно С1-С4алкил, такой как прежде всего метил или, во вторую очередь, этил, пропил, изопропил либо бутил, но может представлять собой также изобутил, втор-бутил, трет-бутил или же С5-С7алкильную группу, такую как пентильная, гексильная либо гептильная группа.
(Низш. )алкилен может быть прямоцепным или разветвленным и может быть связан в любом положении; он представляет собой, например, прямоцепной или разветвленный С1 -С4 алкилен, такой прежде всего, как метилен, а также 1,2-этилен, 1,3- либо 1,2-пропилен или 1,4-, 1,3- либо 2,3-бутилен.
(Низш. )алкилиден может быть прямоцепным или разветвленным и может быть геминально связан в любом положении; он может представлять собой, например, прямоцепной или разветвленный С1-С4алкилен, такой прежде всего, как метилен, 1,1-этилиден, 1, 1- либо 2,2-пропилиден или 1,1-бутилиден.
(Низш.)алкилтио(низш.)алкилиден представляет собой, например, C1-С4алкилтио-С1 -С4алкилиден, такой как метилтиометилен, этилтиометилен, 2-метилтиоэтилиден, 2-этилтиоэтилиден, 3-метилтиопропилиден либо 4-метилтиобутилиден.
Оксо(низш.)алкенилен связан с обозначенным в формуле I N-атомом предпочтительно через несущий оксогруппу С-атом и обозначает, например, соответствующий оксо-С3-С4алкенилен, такой прежде всего, как 1-оксопроп-2-енилен либо 1-оксобут-2-енилен.
Оксо(низш. )алкилен связан с обозначенным в формуле I N-атомом предпочтительно через несущий оксогруппу С-атом и обозначает, например, соответствующий оксо-С2-С4алкилен, такой прежде всего, как 1-оксоэтилен либо 1-оксопропилен, а также 1-оксобутилен.
Фенил(оксо) (низш. )алкилен связан с обозначенным в формуле I N-атомом предпочтительно через несущий оксогруппу С-атом и обозначает, например, соответствующий фенил(оксо)-С2-С4алкилен, такой прежде всего, как 1-оксо-2-фенилэтилен.
Фенил(низш. )алкил представляет собой, например, незамещенный или, как указано выше, замещенный фенил-С1-С4алкил, такой как бензил, 2-фенилэтил, 3-фенилпропил либо 4-фенилбутил.
Фенил (низш.)алкилен представляет собой, например, незамещенный или, как указано выше, замещенный фенил-С2-С4 алкилен, такой как 2-фенилэтилен, 3-фенилпропилен либо 4-фенилбутилен.
Фенил(низш.)алкилиден представляет собой, например, фенил -С1-С4алкилиден, такой как бензилиден, а также 2-фенилэтилиден, 3-фенилпропилиден либо 4-фенилбутилиден.
Полигалоген(низш. )алкилиден представляет собой, например, полигалоген-С1-С4 алкилиден, такой прежде всего, как 2,2, 2-трифторэтилиден.
Пиридил(низш. )алкилиден представляет собой, например, пиридил-C1-С4алкилиден, такой как пиридилметилен, а также 2-пиридилэтилиден, 3-пиридилпропилиден либо 4-пиридилбутилиден.
Пирролил(низш. )алкилиден представляет собой, например, пирролил-C1-С4алкилиден, такой как пирролилметилен, а также 2-пирролилэтилиден, 3-пирролилпропилиден либо 4-пирролилбутилиден.
Тиенил(низш.)алкилиден представляет собой, например, тиенил-С1-С4 алкилиден, такой как тиенилметилен, а также 2-тиенилэтилиден, 3-тиенилпропилиден либо 4-тиенилбутилиден.
Соединения формулы I могут образовывать соли с основаниями. Соединения формулы I с основными группами могут также образовывать кислотно-аддитивные соли и внутренние соли.
К солям соединений формулы I с основаниями относятся, например, их соли с фармацевтически приемлемыми основаниями, такие как нетоксичные соли металлов, образованные с использованием металлов групп Iа, Iб, IIа и IIб, например соли щелочных металлов, прежде всего натрия или калия, соли щелочно-земельных металлов, прежде всего кальция или магния, а также аммониевые соли с аммиаком или органическими аминами либо четвертичными аммониевыми основаниями, в частности с необязательно С-гидроксилированными алифатическими аминами, прежде всего моно-, ди- либо три(низш.)алкиламинами, как, например, метил-, этил- либо диэтламин, моно-, ди- либо три(гидрокси(низш. )алкил)аминами, такими как этаноламин, диэтаноламин либо триэтаноламин, трис(гидроксиметил)нафтильные остатки или 2-гидрокси-трет-бутиламин, либо N-(гидрокси(низш. )алкил) -N, N-ди(низш. )алкиламинами, соответственно N-(полигидрокси(низш.)алкил)-N-(низш.)алкиламинами, такими как 2-(диметиламино)этанол или D-глюкамин или холин, либо четвертичными алифатическими гидроксидами аммония, как, например, гидроксид тетрабутиламмония.
Кислотно-аддитивные соли соединений формулы I представляют собой, например, их фармацевтически приемлемые соли соответствующих минеральных кислот, таких как галогенводородные кислоты, серная кислота или фосфорная кислота, например гидрохлориды, гидробромиды, сульфаты, гидросульфаты или фосфаты, соли соответствующих карбоновых кислот, таких как необязательно гидроксилированные (низш.)алкановые кислоты, например уксусная кислота, гликолевая кислота, пропионовая кислота, молочная кислота или пивалиновая кислота, необязательно гидроксилированные и/или замещенные оксогруппой (низш. )алкандикарбоновые кислоты, например щавелевая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, винная кислота, лимонная кислота, пировиноградная кислота, яблочная кислота, аскорбиновая кислота, а также ароматических, гетероароматических либо алифатических карбоновых кислот, таких как бензойная кислота, никотиновая кислота или миндальная кислота, и соли соответствующих алифатических либо ароматических сульфокислот или N-замещенных сульфаминокислот, например метансульфонаты, бензолсульфонаты, п-толуолсульфонаты или N-циклогексилсульфаминаты (цикламаты). Перечень указанных солей включает как полные, так и неполные соли, т.е. соли с 1, 2 или 3, предпочтительно двумя, эквивалентами основания на моль кислоты формулы I, соответственно соли с 1, 2 или 3 эквивалентами, предпочтительно 1 эквивалентом кислоты на моль основания формулы I.
Для выделения или очистки могут использоваться также фармацевтически неприемлемые соли. Однако в терапевтических целях могут применяться только фармацевтически приемлемые, нетоксичные соли, которые поэтому и отнесены к предпочтительным.
Соединения формулы I обладают ценными фармакологическими свойствами. Они обладают высокой степенью сродства по отношению к рецепторам возбуждающих (электрический/химический сигнал) аминокислот, таким как АМРА-рецепторы, NМDА (каинат)-рецепторы и/или к местам связывания глицина на NMDA-рецепторах. Сродство к указанным рецепторам может быть в зависимости от структуры полным или селективным. Ряд соединений формулы I проявляют прежде всего высокую степень сродства к АМРА- и/или NМDА (каинат) рецепторам и в то же время меньшую степень сродства по отношению к местам связывания глицина на NMDA-рецепторе.
Способность к связыванию получаемых согласно изобретению соединений и их солей может быть подтверждена in vitro радиографическим методом на мембранах головного мозга крыс (мышей) на основании вытеснения [3Н]-АМРА, [3Н] -каината, [3Н]-ДХКК (5,7-дихлоркинуреновая кислота), соответственно [3Н] -MDL 105, 510, и при этом определяют концентрацию (IC50), требуемую для 50%-ного вытеснения.
В целях определения сродства к АМРА-рецепторам можно использовать, например, постановку опыта с пробой рецептора, воспринимающего излучение, как это описано у Ноnоrе Т., Lauridsen J. и Krogsgaard-Larsen в Journ. Neurochem. 38. 173-178 (1981), где для соединений формулы I выявлены IC50 -значения от порядка 0,05 до порядка 5 мкм. Сродство к каинат-рецепторам может быть определено, например, постановкой опыта с пробой рецептора, воспринимающего излучение, описанного у Simon J.R., Contrera J.F. и Kuhn M.J.J. в Neurochem. 26, 141-147 (1975), где для соединений формулы I выявлены IC50-значения от порядка 0,5 до порядка 5 мкм.
Способность к связыванию соединений формулы I по отношению к местам связывания глицина на NMDA-рецепторе может быть определена, например, постановкой опыта с пробой рецептора, воспринимающего излучение, описанного у Baron M. B., Siegel B.W. и др. в Eur. Journ. Pharmacol., Molec. Pharmacol. Section 206, стр. 149-154 (1991) и у Canton Т., Doble и др. в Journ. Pharm. Pharmacol. 44, стр. 812-816 (1992), где использовали мембраны коры головного мозга крыс и гиппокампа крыс. IC50-значение соединений формулы I, выявленное в ходе проведения этого опыта, составляет от порядка 0,005 до порядка 5 мкМ.
Благодаря этим свойствам соединения формулы I обладают ярко выраженным противосудорожным эффектом, который выявляют in vivo, например, на мыши и который проявляется в ярко выраженном защитном действии по отношению к судорогам, вызываемым электрошоком или метразолом, причем в таких исследованиях можно использовать обычную модель мыши, которую подвергают электрошоку или у которой индуцируют метразолом появление судорог, как это описано у Schmutz и др. в Naunyn-Schmiedeberg's Arch. Pharmacol. 342, 61-66 (1990).
Соединения формулы I и их фармацевтически приемлемые соли могут применяться тем самым с высокой эффективностью для профилактики и терапии патологических состояний, реагирующих на блокирование рецепторов эксцитаторных аминокислот, прежде всего на блокирование одного или нескольких из вышеназванных субтипов рецепторов эксцитаторных аминокислот, например, для лечения и профилактики нейродегенеративных заболеваний, таких как заболевания, являющиеся следствием инсульта, гипогликемии, аноксии или поражений головного мозга, проявляющихся в параличе, ишемических заболеваний головного мозга, таких как церебральная ишемия, церебральная ишемия при хирургических операциях на сердце или остановках сердца, перинатальная афиксия, припадки эпилепсии, хорея Хантингтона, болезни Альцгеймера и Паркинсона, амиотрофический боковой склероз, травмы спинного и головного мозга, а также интоксикация, вызванная нейротоксинами или злоупотреблением наркотическими средствами, для терапии и лечения ишемических заболеваний глаз, спазмов сосудов и мышц, связанных, например, с мигренью или местной либо общей спастикой, судорог, связанных, например, с приступами эпилепсии, а также для лечения и профилактики состояний страха и болезненных состояний, связанных, например, с невралгией тройничного нерва.
Изобретение относится в первую очередь к соединениям формулы I, в которой
R1 обозначает гидрокси,
(низш.)алкил, (низш,)алкенил, фенил(низш.)алкил, нафтил(низш.)алкил, фенил или нафтил,
Х обозначает (низш.)алкилен, (низш.)алкилиден, оксо(низш.)алкилен, оксо (низш. ) алкенилен, полигалоген
(низш.) алкилиден, карбокси(низш.)алкилиден, гидрокси (низш. ) алкилиден, (низш. )алкокси (низш. ) алкилиден, (низш. )алкилтио (низш. ) алкилиден, 3-6-членный циклоалкилен, 3-6-членный циклоалкилиден,
3-6-членный бензоциклоалкенилиден, 3-6-членный циклоалкил(низш. )алкилен, 3-6-членный циклоалкил (низш.) алкилиден, фенил (низш.)алкилен, фенил(оксо) (низш. )алкилен, фенил(низш.)алкилиден,
пирролил(низш.)ал-килиден, фурил (низш. ) алкилиден, тиенил (низш. ) алкилиден, пиридил(низш. )алкилиден, фенилен или нафтилен,
R2 обозначает водород, (низш.)алкил, (низш.)алкенил,
фенил (низш.)алкил или нафтил(низш.)алкил,
причем циклическая система указанных циклоалкиленовых, циклоалкилиденовых, необязательно сконденсированных с бензольным ядром циклоалкиленовых,
циклоалкилиденовых либо циклоалкенилиденовых, циклоалкил(низш. )алкилиденовых, фенил(низш. )алкиленовых, фенил(оксо) (низш.)алкиленовых, фенил (низш.)алкилиденовых, фурил(низш.)алкилиденовых, тиенил
(низш.) алкилиденовых, пиридил (низш. ) алкилиденовых, фениленовых, нафтиленовых, фенил (низш. )алкильных и нафтил(низш.)алкильных остатков может быть замещенной, например, (низш.)алкилом,
(низш.)алкокси-, фенилокси-, гидроксильной группами, галогеном, трифторметилом, ди(низш.)-алкиламино-, (низш.)алканоиламино-, нитро-, карбоксильной, (низш.)алкоксикарбонильной, карбамоильной и/или
цианогруппами, alk представляет собой (низш.)алкилиден и
R3, R4 и R5 независимо друг от друга обозначают водород, (низш.)алкил, галоген, трифторметил, циано
или нитро,
и к их солям.
Изобретение относится прежде всего к соединениям формулы I, в которой
R1 обозначает гидрокси, С1-С4алкил,
такой как метил либо бутил, фенил-C1-С4алкил, такой как бензил, или фенил,
Х обозначает прямоцепной или разветвленный С1-С4алкилен, такой как
метилен либо 1,2-этилен, прямоцепной или разветвленный С1-С4алкилиден, такой как 1,1-этилен, 1,1- либо 2,2-пропилиден или 1,1-бутилиден, оксо-С2-С4-алкилен,
такой прежде всего, как 1-оксоэтилен либо 1-оксопропилен, оксо-С3-С4алкенилен, такой как 1-оксопроп-2-енилен либо 1-оксобут-2-енилен, прямоцепной или разветвленный C1
-С4алкилен, такой прежде всего, как метилен, полигалоген- С1-С4алкилиден, такой прежде всего, как 2,2,2-трифторэтилиден, карбокси-С1-С4алкилиден,
такой как карбоксиметилен, гидрокси-С2-С4алкилиден, такой как 3-гидроксипропилиден либо 4-гидроксибутилиден, 3-6-членный циклоалкилен, такой как циклопропилен либо 1,
2-циклогексилен, 3-6-членный циклоалкилиден, такой как циклопропилиден либо циклогексилиден, 3-6-членный бензоциклоалкенилиден, такой как индан-2,2-илиден, незамещенный либо замещенный С1
-С4алкилом, таким как метил, С1-С4алкоксигруппой, такой как метокси, фенилокси, гидрокси, галогеном с атомным номером до 35 и 35, таким как фтор, хлор либо бром,
трифторметилом, ди-С1-С4алкиламиногруппой, такой как диметиламино, С1-С7алканоиламиногруппой, такой как ацетиламино, нитрогруппой, карбоксильной группой,
С1-С4алкоксикарбонилом, таким как метоксикарбонил или этоксикарбонил, карбамоилом и/или цианогруппой фенил(оксо)-С2-С4алкилен, такой как
1-оксо-2-фенилэтилен, или фенил-С1-С4алкилиден, такой как бензилиден, пирролил-С1-С4алкилиден, такой как пирролилметилен, фурил-С1-С4
алкилиден, такой как фурилметилен, тиенил-С1-С4алкилиден, такой как тиенилметилен, или фенилен,
R2 обозначает водород, С1-С4алкил,
такой
как метил, этил, пропил, изопропил либо бутил, незамещенный или замещенный С1-С4алкилом, таким как метил, С1-С4алкоксигруппой, такой как метокси,
гидроксильной группой, галогеном с атомным номером до 35 и 35, таким как фтор, хлор либо бром, трифторметилом, нитрогруппой, карбоксильной группой, С1-С4алкоксикарбонилом, таким
как метоксикарбонил, карбамоилом и/или цианогруппой, фенил-С1-С4алкил, такой как бензил,
alk представляет собой С1-C4алкилиден, такой как метилен
либо 1,1-этилен, и
R3, R4 и R5 независимо друг от друга обозначают водород, С1-С4алкил, такой как метил либо этил, галоген с атомным
номером до 35 и 35, такой как хлор либо бром, трифторметил, циано или нитро,
и к их солям.
Изобретение относится прежде всего к соединениям формулы I, в которой
R1 обозначает гидрокси,
Х обозначает прямоцепной или разветвленный С1-С4алкилиден, такой как метилен, этилиден, этилен, 1,1- либо 2,2-пропилиден или 1,
1-бутилиден,
прямоцепной или разветвленный С1-С4акилен, такой как этилен, 1,2-либо 1,3-пропилен, 1,4- либо 1,2-бутилен, оксо-С2-С4алкилен, такой как
1-оксоэтилен либо
1-оксопропилен, 3-6-членный циклоалкилен, такой как циклопропилен либо 1,2-циклогексилен, или 3-6-членный циклоалкилиден, такой как циклопропилиден либо циклогексилиден,
R2
обозначает водород или С1-С4алкил, такой как метил, этил, пропил, изопропил либо бутил,
alk представляет собой С1-С4алкилиден, такой
как метилен
либо 1,1-этилен, и R3, R4 и R5 независимо друг от друга обозначают водород, С1-С4алкил, такой как метил либо этил, галоген с атомным
номером до
35 и 35, такой как хлор либо бром, трифторметил, циано или нитро,
и к их солям.
Изобретение относится в самую первую очередь к соединениям формулы I, в которой
R1 обозначает гидрокси,
Х обозначает прямоцепной или разветвленный С1-С4алкилиден, такой как метилен, этилиден, этилен, 1,1- либо 2,2-пропилиден или 1,
1-бутилиден,
прямоцепной или разветвленный С1-С4алкилен, такой как этилен, 1,2-либо 1,3-пропилен, 1,4- либо 1,2-бутилен, 3-6-членный циклоалкилен, такой как циклопропилен либо 1,
2-циклогексилен, или 3-6-членный циклоалкилиден, такой как циклопропилиден либо циклогексилиден,
R2 обозначает водород или С1-С4алкил, такой как метил, этил,
пропил, изопропил либо бутил,
alk представляет собой С1-С4алкилиден, такой как метилен,
R4 обозначает водород, С1-С4алкил,
такой как метил либо этил, галоген с атомным номером до 35 и 35, такой как хлор либо бром, трифторметил, циано или нитро и
R3 и R5 обозначают водород,
и к их
солям.
Изобретение относится конкретно к представленным в примерах соединениям формулы I и их солям, к способу их получения, к содержащим их препаратам и к их применению в качестве активных веществ в лекарственных средствах.
Способ получения соединений формулы I
отличается тем, что из соединения формулы II

в которой RA обозначает водород или гидроксизащитную группу, RB представляет собой одну из групп, указанных для R2, или аминозащитную группу и радикалы Rc и RD обозначают идентичные или разные гидроксизащитные групппы, a R1, X, R2, alk, R3, R4 и R5 имеют указанные выше значения, отщепляют гидроксизащитные группы RC и RD, а также необязательно имеющуюся гидроксизащитную группу RA и необязательно имеющуюся аминозащитную группу RB и при необходимости полученное соответственно соединение переводят в другое соединение формулы I, получаемую по способу смесь изомеров разделяют на компоненты и предпочтительный в каждом случае изомер отделяют и/или получаемое по способу свободное соединение переводят в соль или же получаемую по способу соль переводят в соответствующее свободное соединение.
В качестве гидроксизащитных групп RA могут рассматриваться, например, обычные, используемые для промежуточной защиты фосфоновых групп гидроксизащитные группы, такие, в частности, как (низш.)алкил, например метил, этил или изопропил, кроме того, необязательно замещенные фенил (низш.)алкильные группы, такие как бензил, а также три(низш.)алкилсилил, такой как триметилсилил.
В роли гидроксизащитных групп RC и/или RD могут выступать, например, обычные, используемые для промежуточной защиты лактамовых групп гидроксизащитные группы, в частности эфирообразующие группы, такие как (низш.)алкил, предпочтительно метил.
Пригодными аминозащитными группами RB являются, например, используемые обычно для промежуточной защиты аминогрупп защитные группы, такие как производные полуэфира угольной кислоты ацильные группы, такие как (низш. )алкоксикарбонил или необязательно замещенные фенилокси- или фенил (низш. )алкоксикарбонильные группы.
Отщепление вышеназванных защитных групп RC, RD и необязательно RA и/или RB осуществляют обычным образом, например путем обработки кислотой, такой как соляная кислота, например, 1 н.-4 н. соляная кислота, 20-40% бромистоводородной кислотой в уксусной кислоте, или путем обработки три(низш. )алкилгалогенсиланом, таким как триметилбромсилан, либо гекса(низш. )алкилдисилазаном, таким как гексаметилдисилазан, с последующим добавлением (низш. )алканола, такого как этанол, который реагирует с силановым компонентом с высвобождением при этом галогенводорода. Альтернативная возможность отщепления защитных групп состоит в проведении обработки кислотой Льюиса, такой как три(низш.)алкилгалогенсилан, причем для этого могут потребоваться более жесткие условия, в частности температуры в интервале от порядка 50 до порядка 110oС.
Исходные
вещества формулы II получают, например, благодаря тому, что в соответствующем соединении формулы III

нитрогруппу обычным путем, например каталитическим гидрированием в присутствии палладия или никеля Ренея, восстанавливают до аминогруппы, полученный фенилен-1, 2-диамин в кислых условиях, например в присутствии соляной кислоты, с помощью щавелевой кислоты конденсируют с получением соответствующего хиноксалиндиона формулы IV

который взаимодействием с галогенирующим агентом, вводящим галоген Hal, например с фосфороксихлоридом, переводят в соответствующий 2, 3-дигалогенхиноксалин формулы V
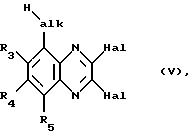
в этом последнем группы Hal обычным путем, например взаимодействием с (низш. )алканолятом щелочного металла, такого как метанолят натрия, заменяют на защищенную гидроксигруппу -ORC, соответственно -ORD, такую как (низш. )алкокси, прежде всего метокси, полученное соединение формулы VI

галогенирующим агентом, вводящим галоген Hal, таким как N-бромсукцинимид, в присутствии азоизобутиронитрила или пероксида дибензоила, в боковой цепи галогенируют с образованием соответствующего соединения формулы VII

и это соединение взаимодействием с азидом, таким как азид натрия, и последующим восстановлением, например, путем обработки трифенилфосфином и водой переводят в соответствующее аминосоединение формулы VIII

которое подвергают реакции конденсации либо с карбонильным соединением формулы Н-Х= O (IX) и затем в присутствии основания, такого как три(низш. )алкиламин, с три(низш.)алкилсилиловым эфиром, таким как триметилсилиловый эфир, соединения формулы Х

либо в присутствии цианоборогидрида натрия непосредственно с соединением формулы XI

Этот вариант способа пригоден прежде всего для получения соединений формулы I, где Х обозначает двухвалентный алифатический, циклоалифатически-алифатический, аралифатический или гегероарилалифатический остаток.
Согласно одной
из модификаций этого варианта способа особенно предпочтительной для получения соединений формулы I, где Х представляет собой (низш. )алкилиден, прежде всего метилен, амин
формулы Х подвергают
взаимодействию с формальдегидом либо отдающим формальдегид агентом с получением соответствующего триазинана формулы XII
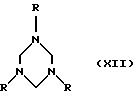

который затем, например, в присутствии основания, такого как три(низш. )алкиламин, подвергают взаимодействию с три(низш.)алкилсилиловым эфиром, таким как триметилсилиловый эфир, соединений формулы X.
Для получения
соединений формулы II, где Х в
α -положении по отношению к аминогруппе несет оксогруппу, аминосоединение VIII предпочтительно в присутствии связывающего воду агента, такого как карбодиимид,
например гидрохлорида
N-(диметиламинопропил)-N'-этилкарбодиимида, подвергают взаимодействию с соответствующим карбоновокислотным соединением формулы XIII

либо в присутствии основного конденсирующего средства осуществляют взаимодействие с реакционноспособным производным, таким как галогенангидрид кислоты или реакционноспособный эфир, указанного соединения.
Для получения соединений формулы II, где Х представляет собой двухвалентный циклоалифатический или
ароматический остаток
предпочтительно исходить из галогенных соединений формулы VII и затем эти последние подвергать по обычной технологии реакции конденсации с соответствующим аминокомпонентом
формулы XIV

Получаемые по способу соединения можно переводить обычным путем в другие соединения формулы I. Так, в частности, в соединения формулы I, где R2 обозначает водород, обычным путем можно вводить алифатические или аралифатические остатки, такие как (низш.)алкильные, (низш.)алкенильные либо (низш. )алканоильные остатки, например, взаимодействием с (низш.)алкилирующим агентом, таким как (низш.)алкилгалогенид, или реакционноспособным производным (низш. )алкановой кислоты, таким как хлорангидрид (низш.)алкановой кислоты, при необходимости в присутствии обычного основного конденсирующего средства.
Другая возможность заключается в том, что соединения формулы I, содержащие этерифицированные или амидированные карбоксильные группы, обычным путем гидролизуют до соответствующих карбоновых кислот или соединения формулы I, содержащие свободную карбоксильную группу, обычным путем этерифицируют или амидируют.
Кроме того, в полученных соединениях формулы I цианогруппу можно переводить обычным путем в карбамоильную группу.
Полученные соли можно по обычной технологии превращать в свободные соединения, например, путем обработки основанием, таким как гидроксид щелочного металла, карбонат либо гидрокарбонат металла, или каким-либо другим вышеназванным связывающим соль основанием, соответственно кислотой, такой как минеральная кислота, например хлористым водородом, или же какой-либо другой вышеназванной связывающей соль кислотой.
Полученные соли могут переводиться по обычной технологии в другие соли, кислотно-аддитивые соли, например, путем обработки соответствующей солью металла, такой как соль натрия, бария или серебра, какой-либо другой кислоты в соответствующем растворителе, в котором образующаяся неорганическая соль не растворима и вследствие этого выделяется из равновесной системы, и в основные соли за счет высвобождения свободной кислоты и повторного высаливания.
Соединения формулы I, включая их соли, могут быть получены также в виде гидратов или включать используемый для кристаллизации растворитель.
В силу того, что между новыми соединениями в свободном виде и в виде их солей существует тесная связь, выше и в последующем под понятием "свободные соединения и их соли" по смыслу и соображениям целесообразности имеются в виду также соответствующие соли, соответственно свободные соединения.
Получаемые смеси диастереомеров и смеси рацематов, исходя из физико-химических различий компонентов, можно разделять по известной технологии на чистые диастереомеры, соответственно рацематы, например, посредством хроматографии и/или фракционной кристаллизации.
Получаемые рацематы можно, кроме того, с помощью известных методов разлагать на оптические антиподы, например, путем перекристаллизации из оптически активного растворителя с помощью микроорганизмов или же взаимодействием полученной смеси диастереомеров, соответственно рацематов с оптически активным вспомогательным соединением, например, соответственно содержащихся в соединениях формулы I кислых, основных или функционально модифицируемых групп с оптически активной кислотой, основанием либо с оптически активным спиртом, на смеси диастереомерных солей, соответственно функциональных производных, таких как сложные эфиры, проводить их разделение на диастереомеры, из которых по соответственно обычной технологии можно высвобождать требуемый в каждом случае энантиомер. Пригодными в этих целях основаниями, кислотами, соответственно спиртами являются, например, оптически активные алкалоидные основания, такие как стрихнин, цинхонин или бруцин, либо D- или L-(1-фенил)этиламин, 3-пипеколин, эфедрин, амфетамин и аналогичные синтезируемые основания, оптически активные карбоновые или сульфоновые кислоты, такие как хинная кислота либо D- или L-винная кислота, D- или L-ди-о-толуилвинная кислота, D- или L-яблочная кислота, D- или L-миндальная кислота, либо D- или L-камфарная сульфокислота, соответственно оптически активные спирты, такие как борнеол либо D- или L-(1-фенил)этанол.
Изобретение относится также к тем вариантам осуществления способа, в которых исходят из соединения, получаемого на какой-либо стадии способа в качестве промежуточного продукта, и проводят недостающие операции, либо применяют исходное вещество в виде соли, либо прежде всего образуют его в условиях реакции.
Новые исходные вещества, специально разработанные для получения соединений по изобретению, и прежде всего те из них, которые обеспечивают получение указанных выше в качестве предпочтительных соединений формулы I, равно как и способы получения этих исходных веществ и их применение в качестве промежуточных продуктов также являются объектом настоящего изобретения.
Под предлагаемыми согласно изобретению фармацевтическими препаратами, содержащими соединения по изобретению или их фармацевтически приемлемые соли, имеются в виду препараты, предназначенные для энтерального, в частности орального, а также ректального и парентерального введения теплокровным, причем фармакологическое активное вещество содержится в этих препаратах как таковое либо вместе с фармацевтически приемлемым носителем. Суточная доза активного вещества зависит от возраста пациента, общего состояния его здоровья, а также от методики введения.
Новые фармацевтические препараты содержат активное вещество в количестве, например, от порядка 10 до порядка 80%, предпочтительно от порядка 20 до порядка 60%. Фармацевтические препараты по изобретению, предназначенные для энтерального, соответственно парентерального введения, могут изготавливаться в соответствующих унифицированных дозированных формах, таких, например, как драже, таблетки, капсулы или суппозитории, а также в ампулах. Их изготавливают по известной технологии, например, с помощью традиционных методов смешения, гранулирования, дражирования, растворения или лиофилизации. Так, в частности, фармацевтические препараты для орального приема можно получать благодаря тому, что активное вещество комбинируют с твердым носителем, полученную смесь необязательно гранулируют и смесь, соответственно гранулят, при необходимости после добавления вспомогательных веществ таблетируют или изготавливают из них сердцевину для драже.
Пригодными для использования в указанных целях носителями являются прежде всего наполнители, такие как сахара, например лактоза, сахароза, маннит или сорбит, целлюлозные препараты и/или фосфаты кальция, например трифосфат кальция или гидрофосфат кальция, кроме того, связующие, такие как крахмальный клейстер, с использованием, например, кукурузного, пшеничного, рисового или картофельного крахмала, желатин, трагант, метилцеллюлоза и/или поливинилпирролидон, при необходимости разрыхлители, такие как вышеназванные крахмалы, далее карбоксиметиловый крахмал, сшитый поливинилпирролидон, агар, альгиновая кислота либо одна из ее солей, такая как альгинат натрия. Вспомогательными средствами служат в первую очередь таковые, способствующие текучести, регуляторы текучести, смазки, например кремниевая кислота, тальк, стеариновая кислота либо ее соли, такие как стеарат магния или кальция и/или полиэтиленгликоль. На сердцевину для драже наносят соответствующее, при необходимости устойчивое к действию желудочного сока покрытие, используя при этом, в частности, концентрированные растворы сахаров, содержащие необязательно гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, лаковые растворы в соответствующих органических растворителях либо в смесях растворителей или, в случае получения покрытий, устойчивых к действию желудочного сока, растворы соответствующих целлюлозных препаратов, таких как фталат ацетилцеллюлозы либо фталат гидроксипропилметилцеллюлозы. При изготовлении таблеток или оболочек для драже могут вводиться добавки красителей или пигментов, например, в целях идентификации или маркировки различных доз активного вещества.
Другим видом фармацевтических препаратов для орального приема являются желатиновые разъемные капсулы, а также мягкие, запаянные капсулы из желатина и пластификатора, такого как глицерин или сорбит. Разъемные капсулы могут содержать в своем составе активное вещество в форме гранулята, например, в смеси с наполнителями, такими как лактоза, связующими, такими как крахмал, и/или веществами, придающими скользкость, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах активное вещество содержится предпочтительно в растворенном либо суспендированном виде в соответствующих жидкостях, таких как жирные масла, парафиновое масло или жидкие полиэтиленгликоли, причем и в этих случаях также могут добавляться стабилизаторы.
В качестве вводимых ректально фармацевтических препаратов могут рассматриваться, например, суппозитории, изготовленные из активного вещества в сочетании с основой. В качестве такой основы пригодны, например, природные либо синтетические триглицириды, парафиновые углеводороды, полиэтиленгликоли или высшие спирты. Кроме того, для ректального введения могут применяться желатиновые капсулы, содержащие в своем составе активное вещество в сочетании с основой. В качестве такой основы могут использоваться, например, жидкие триглицириды, полиэтиленгликоли или парафиновые углеводороды.
Для парентерального введения пригодны в первую очередь водные растворы активного вещества в водорастворимом виде, например в виде водорастворимой соли, а также суспензии активного вещества, такие как соответствующие масляные суспензии для инъекций, причем в этих случаях можно использовать соответствующие липофильные растворители или разбавители, такие как жирные масла, например кунжутное масло, либо эфиры синтетических жирных кислот, например этилолеат или триглицериды; можно использовать также суспензии для инъекций, содержащие в своем составе повышающие вязкость вещества, например Na-КМЦ (натрийкарбоксиметилцеллюлоза), сорбит и/или декстрин, и необязательно также стабилизаторы. Дозировка активного вещества зависит от вида теплокровных, возраста, общего состояния и от методики введения. В обычных случаях назначаемая пациенту весом приблизительно 75 кг примерная суточная доза для орального приема составляет от порядка 10 до порядка 500 мг.
Представленные ниже примеры служат для более подробного и наглядного пояснения изобретения; температуры при этом указаны в градусах Цельсия, а давление - в мбарах.
Пример 1: N-ацетил-N-(7-бром-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил) аминометилфосфоновая кислота
В атмосфере азота 400 мг (0,87
ммоля)
диметилового эфира N-ацетил-N-(7-бром-2,3-диметоксихиноксалин-5-илметил)-α-аминометилфосфоновой кислоты растворяют в 5 мл абсолютного дихлорметана и смешивают при комнатной температуре
с 0,66
мл (5 ммолей) триметилсилилбромида. После перемешивания в течение 16 ч при комнатной температуре добавляют 5 мл этанола и продолжают перемешивание еще в течение 6 ч при комнатной температуре.
Затем
концентрируют досуха. Остаток растворяют с помощью уксусного эфира, смешивают с гексаном до появления легкого помутнения и помещают на ночь в холодильник. Осадок отфильтровывают, сушат под
высоким
вакуумом и в целях последующей очистки растворяют в 10 мл воды и разбавленного едкого натра при рН 10. Затем раствор с помощью 2 н. соляной кислоты устанавливают на рН 1 и помещают на ночь в
холодильник, после чего образуется бесцветный осадок, который отфильтровывают и сушат, получая в результате 134 мг (0,33 ммоля) указанного в заголовке соединения; tпл>280o
C.
Исходный материал можно получить, например, следующим образом:
а) 5-бром-2,3-диаминотолуол
Раствор из 15 г (64,9 ммоля) 4-бром-2-метил-6-нитроанилина в 300 мл
этанола гидрируют в присутствии 1,5 г никеля Ренея в течение 4 ч при температуре приблизительно 27oC. Затем реакционную смесь фильтруют и упаривают. В результате получают указанное в
заголовке соединение в виде масла коричневого цвета.
1H-ЯМР (250 МГц, CDCl3); δ=6,76, 6,73 (2d, 2H), 3,22 (s, 2NH2), 2,14 (s, Me).
б) 7-бром-5-метил-1,2,3,4-тетрагидрохиноксалин-2,3-дион
13,05 г (64,9 ммоля) 5-бром-2,3-диаминотолуола и 6,42 г (1,1 грамм-экв.) щавелевой кислоты оставляют при дефлегмации в
течение 16 ч в
2 н. соляной кислоте для перемешивания. Затем смесь охлаждают, твердое вещество отфильтровывают и промывают водой. Таким путем получают указанное в заголовке соединение в виде твердого
продукта
коричневого цвета.
1H-ЯМР (250 МГц, ДМСО); δ=11,98, 11,32 (2s, 2NH), 7,13 (s, 2H), 2,33 (s, Me).
в) 7-бром-2,3-дихлор-5-метилхиноксалин
17 г
(66,6 ммолей) 7-бром-5-метил-1,2,3,4-тетрагидрохиноксалин-2,3-диона оставляют в 80 мл оксихлорида фосфора в течение 5 ч при дефлегмации и в течение 40 ч при 20oC для
перемешивания. Затем
смесь упаривают и сушат под высоким вакуумом. Остаток осторожно смешивают с насыщенным раствором карбоната калия, твердое вещество отфильтровывают и промывают водой. Таким путем
получают указанное в
заголовке соединение в виде твердого продукта коричневого цвета.
1H-ЯМР (250 МГц, ДМСО); δ=8,16, 7,99 (2в, 2Н), 2,63 (s, Me).
г)
7-бром-5-метил-2,
3-диметоксихиноксалин
2,97 г (129,5 ммолей) натрия растворяют в 100 мл метанола. Этот раствор добавляют к 18,9 г (64,7 ммоля) 7-бром-5-метил-2,3-дихлорхиноксалина в 60 мл
метанола и в течение
20 ч нагревают с обратным холодильником. Затем смесь охлаждают и смешивают с 15 мл воды. Твердое вещество отфильтровывают и промывают метанолом и водой. Таким путем получают
указанное в заголовке
соединение в виде твердого продукта бежевого цвета.
1H-ЯМР (250 МГц, ДМСО); δ=7,73, 7,58 (2d, 2H), 4,05, 4,03 (2s, 2Ме), 2,58 (s, Me).
д)
7-бром-5-бромметил-2,3-диметоксихиноксалин
15 г (53 ммоля) 7-бром-5-метил-2,3-диметоксихиноксалина, 9,9 г (1,05 грамм-экв. ) N-бромсукцинимида и 0,87 г (0,1 грамм-экв.)
азоизобутиронитрила
растворяют в 100 мл тетрахлорметана и в течение 24 ч оставляют при дефлегмации для перемешивания. Затем твердое вещество отфильтровывают и фильтрат разбавляют дихлорметаном. Далее
промывают по одному
разу водой и рассолом соответственно. Органическую фазу сушат над сульфатом магния и упаривают. Остаток перекристаллизовывают с помощью этилового эфира уксусной кислоты и гексана.
Таким путем получают
указанное в заголовке соединение в виде кристаллов, слегка окрашенных в оранжевый цвет.
1H-ЯМР (250 МГц, CDCl3); δ=7,90, 7,68 (2d, 2H), 4,95 (s, 2H). 4,20, 4,13 (2s, 2Me).
е) 5-азидометил-7-бром-2,3-диметоксихиноксалин
К 2,07 г (5,72 ммолей) 7-бром-5-бромметил-2,3-диметоксихиноксалина в 25 мл
диметилформамида добавляют 743 мг (2
грамм-экв.) азида натрия при 20oC. По истечении 3 ч смесь сливают в воду, экстрагируют диэтиловым эфиром, промывают водой и рассолом и сушат над
сульфатом магния. Затем растворитель
выпаривают.
1H-ЯМР (250 МГц, CDCl3); δ=7,92, 7,58 (2d, 2H), 4,80 (s, 2H), 4,13 (2s, 2Me).
ж)
5-аминометил-7-бром-2,3-диметоксихиноксалин
4,47 г (13,8 ммолей) 5-азидометил-7-бром-2,3-диметоксихиноксалина растворяют в 35 мл тетрагидрофурана, после чего добавляют 3,98 г (1,1 грамм-экв.
) трифенилфосфина. Смесь оставляют при 20oC в течение 4 ч для перемешивания. Затем добавляют 746 мг воды и смесь продолжают перемешивать еще в течение 3 ч. Твердое вещество отфильтровывают
и фильтрат экстрагируют этиловым эфиром
уксусной кислоты и раствором карбоната натрия. Органические фазы объединяют, промывают рассолом, сушат над сульфатом магния и упаривают. Остаток
хроматографируют на силикагеле этиловым эфиром уксусной
кислоты/петролейным эфиром в соотношении 1:1.
1H-ЯМР (250 МГц, СDСl3); δ=7,85, 7,53 (2d, 2H), 4,22 (s, 2H), 4,12 (s, 2Me).
з) 1,3,
5-три-N-(7-бром-2.3-диметоксихиноксалин-5-илметил)-[1,3,5]-триазинан
2,98 г (10 ммолей) (7-бром-2,3-диметоксихиноксалин)-5-илметил)амина
растворяют нагреванием в 40 мл этанола. После
охлаждения до комнатной температуры к этому раствору, слегка окрашенному в желтый цвет, добавляют по каплям 1 мл раствора формалина (37%-ного в воде). По
завершении процесса добавления продукт
выпадает в виде бесцветного осадка. После перемешивания в течение 3 ч осадок отфильтровывают. После сушки под высоким вакуумом получают указанное в заголовке
соединение в виде бесцветной
аморфно-кристаллической массы.
1H-ЯМР (300 МГц, СDСl3); δ=7,83 (d, 2,3 Гц, 3Н), 7,72 (d, 2,3 Гц, 3Н), 4,24 (s, 6H), 4,13 (s, 9H), 4,04 (s, 9H) 3,69 (шир. s, 6H). MC(FAB): 930, 932.
и) Диметиловый эфир N-(7-бром-2,3-диметоксихиноксалин-5-илметил) aминoмeтилфocфонoвoй кислоты
В атмосфере азота при
0oС в течение 90 мин
перемешивают 975 мл (10,64 ммолей) диметилфосфита, 1,27 мл (9,19 ммолей) триэтиламина и 1,47 мл (11,6 ммолей) триметилсилилхлорида в 200 мл хлороформа. Затем в течение
1 ч этот раствор при 0oC по каплям добавляют к 3,0 г (3,22 ммоля) растворенного в 200 мл хлороформа 1,3,5-три-N-(7-бром-2,3-диметоксихиноксалин-5-илметил)- [1,3,5] -триазинана. После
перемешивания в течение 16 ч при
комнатной температуре суспензию сливают на охлажденную льдом соляную кислоту (0,1 н. в воде) и смешивают с 3 частями простого эфира. Органическую фазу полностью
экстрагируют встряхиванием с 0,1н.
водной соляной кислотой. Объединенные водные фазы устанавливают с помощью раствора карбоната натрия на рН 12-13 и 6 раз экстрагируют дихлорметаном. После сушки над
сульфатом натрия и концентрирования
органической фазы получают 3,65 г указанного в заголовке соединения в виде кристаллов, слегка окрашенных в желтый цвет.
1H-ЯМР (300 МГц, СDСl3); δ=7,88 (d, 2,3 Гц,1Н), 7,54 (d, 2,3 Гц,1H), 4,25 (s, 2H), 4,15 (s, 3H), 4,14 (s, 3Н), 3,78 (d, 10 Гц, 6Н), 2,95 (d, 13,1 Гц, 2H), MC(ES+) 422, 420 (МН+).
к) Диметиловый эфир N-ацетил-N-(7-бром-2,3-диметоксихиноксалин-5-илметил) аминометилфосфоновой кислоты
Охлажденный до 0oC раствор из 420
мг (1 ммоль) диметилового эфира
N-(7-бром-2,3-диметоксихиноксалин-5-илметил)-α-аминофосфоновой кислоты в 15 мл тетрагидрофурана последовательно смешивают с 0,18 мл (1,3 ммоля) триэтиламина и с
0,13 мл (1,1 ммоля)
ацетилхлорида. Бесцветную суспензию в течение 16 ч перемешивают сначала при 0oC, а затем при комнатной температуре, после чего концентрируют. Остаток растворяют с
помощью дихлорметана и
промывают 0,1 н. соляной кислотой. Органическую фазу сушат над сульфатом натрия, концентрируют и очищают на силикагельной колонке уксусным эфиром в качестве элюента. После
концентрирования и сушки
выделяют 400 мг (0,87 ммоля) указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (300 МГц, СDСl3); δ= 7,91 (d, 2,2 Гц, 0,7Н), 7,89 (d, 2,3 Гц, 0,3Н), 7,59 (d, 2,3 Гц, 0,3Н), 7,32 (d, 2,2 Гц, 0,7Н), 5,22 (s, 0,6H), 5,20 (s, 1,4Н), 4,16 (s, 0,9H), 4,14 (s, 4,2H), 4,13 (s, 0,9H), 3,92 (d, 11,2 Гц, 1,4Н), 3,82 (d, 10, 8 Гц, 1,8Н), 3,79 (d, 10, 9 Гц, 4,2Н), 3,78 (d, 14,2 Гц, 0,6Н), 2,27 (s 0,6Н), 2,20 (s 1,4H), MC(ES+) 464, 462 (МН+).
Пример 2: N-ацетил-N-(7-хлор-2,3-диоксо-1,2,
3,
4-тетрагидрохиноксалин-5-илметил)аминометилфосфоновая кислота
Указанное в заголовке соединение можно получить аналогично примеру 1. Используемый при этом на стадии 1е) промежуточный
продукт
5-бромметил-7-хлор-2,3-диметоксихиноксалин может быть получен, например, следующим образом:
а) 7-хлор-5-метил-1,4-дигидрохиноксалин-2,3-дион
123 г (0,79 моля) 2,
3-диамино-5-хлортолуола и 106,2 г (1,18 моля) щавелевой кислоты нагревают в 800 мл 4 н. соляной кислоты в течение 5 ч с обратным холодильником. Затем реакционной смеси дают остыть, разбавляют водой,
фильтруют на нутче и промывают водой. Затем продукт тщательно перемешивают в горячем этаноле, фильтруют на нутче и фильтрат сушат под вакуумом при 60oC. Таким путем получают указанное в
заголовке соединение в виде слегка окрашенных в сероватый цвет кристаллов с tпл>250oC.
б) 2,3,7-трихлор-5-метилхиноксалин
155 г (0,74 моля)
7-хлор-5-метил-1,4-дигидрохиноксалин-2,3-диона и 321,8 г (1,55 моля) пентахлорида фосфора перемешивают в 950 мл оксихлорида фосфора в течение 36 ч с использованием обратного холодильника. Затем
оксихлорид фосфора отгоняют и остаток сливают на 3 л ледяной воды. Образовавшуюся суспензию тщательно перемешивают, фильтруют на нутче и промывают водой. После сушки фильтрата под вакуумом при 60oC получают в виде коричневатых кристаллов указанное в заголовке соединение, которое без дальнейшей очистки используют на последующей стадии.
в) 7-хлор-2,
3-диметокси-5-метилхиноксалин
30 г (0,121 моля) 2,3,7-трихлор-5-метилхиноксалина помещают в атмосфере аргона при комнатной температуре в 330 мл метанола. Затем добавляют по каплям 67,9 мл (0,
364 моля) приблизительно 5,4-молярного раствора метоксида натрия в метаноле и смесь перемешивают в течение 4,5 ч с использованием обратного холодильника. После охлаждения до 0oC суспензию
фильруют на нутче, фильтровальный остаток промывают метанолом и сушат под вакуумом при 60oC. Таким путем получают указанное в заголовке соединение в виде кристаллов коричневатого цвета с
tпл 94-96oC.
г) 5-бромметил-7-хлор-2,3-диметоксихиноксалин
10,0 г (41,9 ммоля) 7-хлор-2,3-диметокси-5-метилхиноксалина помещают в атмосфере аргона при
комнатной температуре в 160 мл хлорбензола. Затем добавляют 8,6 г (48,2 ммолей) N-бромсукцинимида и 0,69 г (4,2 ммоля) азоизобутиронитрила и перемешивают в течение 18 ч при 80oC. После
охлаждения реакционной смеси до комнатной температуры хлорбензол отгоняют, остаток смешивают с диэтиловым эфиром и образовавшуюся суспензию фильтруют на нутче. Фильтрат концентрируют, остаток
кристаллизуют из н-гексана и в результате получают указанное в заголовке соединение в виде бесцветных кристаллов с tпл 114-116oC.
Пример 3: N-ацетил-N-(7-фтор-2,
3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил) аминометилфосфоновая кислота
Указанное в заголовке соединение можно получить аналогично примеру 1. Используемый при этом на стадии ж) в
качестве промежуточного продукта 5-аминометил-7-фтор-2,3-диметоксихиноксалин может быть получен, например, следующим образом:
а) 2,3-диамино-5-фтортолуол
25 г (0,147 моля)
4-фтор-2-метил-6-нитроанилина в 250 мл тетрагидрофурана гидрируют в присутствии 8 г никеля Ренея при температуре приблизительно 34oC в течение 2 ч. Затем реакционную смесь отфильтровывают
и
концентрируют. Таким путем получают указанное в заголовке соединение в виде коричневого масла.
1H-ЯМР (200 МГц, СDСl3); δ=6,32-6,38 (2Н), 3,25 (s, 2NH2), 2,1 (s, Me).
б) 7-фтор-5-метил-1,2,3,4 -тетрагидрохиноксалин-2,3 -дион
20 г (0,118 моля) 2,3-диамино-5-фтортолуола и 15,8 г (0,176 моля) щавелевой кислоты
перемешивают при дефлегмации в течение 16 ч в 4 н. соляной кислоте. Затем реакционную смесь охлаждают, разбавляют водой, фильтруют на нутче и промывают водой. Таким путем получают указанное в
заголовке соединение в виде кристаллов бежевого цвета с tпл>300oС.
в) 2,3-дихлор-7-фтор-5-метилхиноксалин
25 г (0,129 моля) 7-фтор-5-метил-1,2,3,
4-тетрагидрохиноксалин-2,3-диона помещают в 170 мл оксихлорида фосфора. Затем добавляют 56,3 г (0,27 моля) пентахлорида фосфора и перемешивают в течение 16 ч с обратным холодильником. Избыточный
оксихлорид фосфора из реакционной смеси отгоняют. Темно-коричневый остаток охлаждают и сливают на 1000 мл ледяной воды. Суспензию фильтруют на нутче, промывают большим количеством воды и фильтрат
сушат под вакуумом при 60oC. Таким путем получают указанное в заголовке соединение в виде кристаллов коричневого цвета с tпл 116-120oC.
г)
7-фтор-5-метил-2,3-диметоксихиноксалин
14 г (60,6 ммолей) 2,3-дихлор-7-фтор-5-метилхиноксалина помещают в 165 мл метанола. Затем по каплям добавляют приблизительно 5,4 М раствор метанолата
натрия в метаноле. Далее нагревают до температуры дефлегмации и оставляют на 18 ч для перемешивания. Затем реакционную смесь охлаждают до 0oC, суспензию фильтруют на нутче, промывают
холодным метанолом и фильтрат сушат под вакуумом при 60oC. Сырой продукт перекристаллизовывают из гексана. Таким путем получают указанное в заголовке соединение в виде белых кристаллов с
tпл 107-109oC.
д) 5-бромметил-2,3-диметокси-7-фторхиноксалин
8,4 г (37,8 ммолей) 2,3-диметокси-7-фтор-5-метилхиноксалина, 7,4 г (41,6 ммоля)
N-бромсукцинимида и 0,63 г
(0,38 ммоля) азоизобутиронитрила помещают в 140 мл тетрахлорметана и перемешивают в течение 6 ч с использованием обратного холодильника. Затем реакционную смесь охлаждают,
концентрируют и остаток растворяют с помощью диэтилового эфира. Суспензию отфильтровывают и маточный раствор концентрируют. Полученный сырой продукт перекристаллизовывают из гексана. Таким путем
получают указанное в заголовке соединение в виде белых кристаллов с tпл 122-125oC.
е) 5-азидометил-2,3-диметокси-7-фторхиноксалин
К 4,0 г (13,3 ммолей)
5-бромметил-2,3-диметокси-7-фторхиноксалина в 50 мл диметилформамида добавляют 1,73 г (26,6 ммолей) азида натрия при комнатной температуре и перемешивают в течение 5 ч. Затем реакционную смесь
сливают
на воду, экстрагируют диэтиловым эфиром и промывают водой и
рассолом. Органическую фазу сушат над Na2SO4, фильтруют на нутче и концентрируют. Таким путем
получают
указанное в заголовке соединение в виде белых кристаллов с tпл 75-78oC.
ж) 5-аминометил-2,3-диметокси-7-фторхиноксалин
3,5 г (13,3 ммолей)
5-азидометил-2,3-диметокси-7-фторхиноксалина в 35 мл тетрагидрофурана гидрируют в присутствии 1,75 г никеля Ренея в течение приблизительно 19 ч при комнатной температуре. Затем реакционную смесь
отфильтровывают и концентрируют. Таким путем получают указанное в заголовке соединение в виде кристаллов желтоватого цвета.
1H-ЯМР (300 МГц, ДМСО); δ=7,3-7,5 (2Н), 4,
15 (s, 2H), 4,02 (s, 6H)
Пример 4: Гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)этилфосфоновой кислоты
160 мг (0,37 ммоля)
диметилового эфира N-(7-нитро-2,3-диметоксихиноксалин-5-илметил)-α-(этиламино)этилфосфоновой кислоты растворяют в 8 мл дихлорметана и перемешивают с 0,19 мл (4 грамм-экв.) триметилбромсилана в
течение 1 ч при комнатной температуре. Растворитель и избыточный реагент выпаривают и остаток в течение короткого промежутка времени сушат под высоким вакуумом, растворяют в 5 мл примерно 33%-ного
раствора бромистого водорода в уксусной кислоте и оставляют для перемешивания на 18 ч при комнатной температуре. Затем реакционную смесь разбавляют диэтиловым эфиром, твердое вещество отфильтровывают,
промывают диэтиловым эфиром и сушат. Указанное в заголовке соединение получают в виде твердого продукта бежевого цвета: tпл 191oC (разложение).
Исходный
материал
можно получить, например, следующим образом:
а1) 5-бромметил-2,3-диметоксихиноксалин
Указанное в заголовке соединение можно получить аналогично примерам 1в, 1г, 1д из
5-метил-2,
3-диоксо-1,2,3,4-тетрагидрохиноксалина.
б1) 5-бромметил-7-нитро-2,3-диметоксихиноксалин
25 мл серной кислоты охлаждают до 0oC, после чего добавляют 9,5
г (33,55
ммоля) 5-бромметил-2,3-диметоксихиноксалина. По истечении последующих 10 мин добавляют 3,39 мл (1 грамм-экв.) изопропилнитрата и оставляют для перемешивания в течение 1 ч при 0oC.
Затем
смесь сливают на лед, твердое вещество отфильтровывают и промывают водой. Таким путем получают указанное в заголовке соединение в виде твердого продукта бежевого цвета.
1 H-ЯМР (250 МГц, ДМСО-d6); δ=8,62, 8,40 (2d, 2H), 5,02 (s, 2H), 4,27, 4,19 (2s, 2Me).
в1) 5-[ди-(трет-бутилоксикарбонил)амино] метил-7-нитро-2,
3-диметоксихиноксалин
10 г (30,5 ммолей) 5-бромметил-7-нитро-2,3-диметоксихиноксалина растворяют в 50 мл диметилформамида. Затем добавляют 7,3 г (1,1 грамм-экв.)
ди-трет-бутилиминодикарбоксилата и 14,9 г (1,5 грамм-экв.) карбоната цезия и реакционную смесь нагревают в течение 10 ч до 50oC, после чего охлаждают до комнатной температуры и
экстрагируют
водой и уксусным эфиром. Объединенные органические фазы сушат над сульфатом магния и концентрируют. Указанное в заголовке соединение получают после хроматографии на колонке с помощью
гексана/уксусного
эфира (9:1) в виде желтого масла.
1H-ЯМР (СDСl3, 250 МГц); δ=8,55, 8,08 (2d, 2H), 5,34 (s, 2H), 4,18, 4,16 (2s, 2Me); 1,47 (s, 2 трет-бутил).
г1) 5-аминометил-7-нитро-2,3-диметоксихиноксалин
13,8 г (29,7 ммолей) 5-[ди-(трет-бутилоксикарбонил)амино]метил-7-нитро-2,3-диметоксихиноксалина перемешивают в
60 мл
трифторуксусной кислоты в течение 8 ч при комнатной температуре. Затем реакционную смесь концентрируют при пониженном давлении и красное масло тщательно перемешивают при 0oC с 1 н.
карбонатом калия в течение 1 ч. Желтые кристаллы отфильтровывают, промывают 100 мл воды и 100 мл смеси уксусного эфира и гексана в соотношении 1: 1 и сушат.
1H-ЯМР (СDСl3, 250 МГц); δ=8,57, 8,29 (2d, 2H), 4,33 (s, 2H), 4,20, 4,18 (2d, 2Me).
д1) Диметиловый эфир N-(7-нитро-2,3-диметоксихиноксалин-5-илметил)-α
-аминоэтилфосфоновой
кислоты
500 мг (1,9 ммоля) 5-аминометил-7-нитро-2,3-диметоксихиноксалина, 834 мг (3,7 грамм-экв. ) сульфата магния, 335 мг (1,3 грамм-экв.) карбонта калия и 0,214 мл (2
грамм-экв.)
ацетальдегида оставляют для перемешивания в 15 мл дихлорметана в течение 7 ч при комнатной температуре. Затем реакционную смесь отфильтровывают и фильтрат упаривают. Затем приготавливают
раствор из 0,
32 мл (1,2 грамм-экв. ) триэтиламина, 0,182 мл диметилфосфита и 0,36 мл (1,5 грамм-экв. ) триметилхлорсилана в 10 мл дихлорметана, к которому после перемешивания при 0oC в
течение 1 ч
добавляют полученный выше остаток в 10 мл дихлорметана, после чего реакция продолжается в течение 14 ч. К реакционной смеси добавляют воду и органическую фазу отделяют. Водную фазу дважды
экстрагируют
дихлорметаном и объединенные органические фазы сушат над сульфатом магния. Указанное в заголовке соединение получают после выпаривания растворителя в виде желтой смолы.
1 H-ЯМР (СDСl3, 250 МГц); δ=8,58, 8,34 (2d, 2H); 4,42, 4,34 (2d, 2Н); 4,22, 4,19 (2d, 2Ме), 3,82, 3,80 (2d, 2Ме); 3,04 (m,1H; 1,38 (dd, Me).
Диметиловый эсфир N-(7-нитро-2,3-диметоксихиноксалин-5-илметил)-α-аминоэтилфосфоновой кислоты можно получить также другим путем, описанным ниже.
а2) 2,
3-диметоксихиноксалин-5-карбальдегид
К раствору из 3,7 г (163 ммоля) натрия в 700 мл метанола добавляют 17 мл (188 ммолей) 2-нитропропана. После перемешивания в течение 5 мин добавляют 35,5
г
(125,4 ммолей) твердого 5-бромметил-2,3-диметоксихиноксалина. Затем смесь нагревают в течение 1 ч до температуры дефлегмации и при этом образуется гомогенный раствор. После охлаждения раствор
концентрируют при пониженном давлении. Остаток растворяют с помощью уксусного эфира и 1 н. соляной кислоты, фазы разделяют и органическую фазу промывают водой и рассолом, сушат над сульфатом натрия и
концентрируют. Путем кристаллизации из уксусного эфира указанное в заголовке соединение выделяют в виде белых кристаллов с tпл 137-140oC; ТСХ (тонкослойная хроматография,
этиловый эфир уксусной кислоты/гексан 1:3): Rf=0,45.
б2) 2,3-диметокси-7-нитрохиноксалин-5-карбальдегид
К охлажденному до 0oC раствору из 22 г (100,8
ммолей) 5-бромметил-2,3-диметоксихиноксалина в 88 мл трифторуксусной кислоты последовательно добавляют 44 мл 100%-ной азотной кислоты, 44 мл 97%-ной серной кислоты и 44 мл ангидрида трифторуксусной
кислоты. Смесь выдерживают в течение 2 ч при 0oC, после чего осторожно сливают на смесь из 4 н. едкого натра и льда. Температура при этом не должна превышать 20oC. Далее смесь
экстрагируют уксусным эфиром, органическую фазу промывают водным 1 н. едким натром, водой и рассолом и сушат над сульфатом натрия. После кристаллизации сырого продукта получают 18,8 г указанного в
заголовке соединения в виде кристаллов, слегка окрашенных в желтый цвет.
tпл 147-149oC; ТСХ (SiO2, EtOAc/гексан 1:3): Rf=0,25.
в2) Диметиловый эфир N-(7-нитро-2,3-диметоксихиноксалин-5-илметил)-α-аминоэтилфосфоновой кислоты
150 мг (0,569 ммоля) 2,3-диметокси-7-нитрохиноксалин-5-карбальдегида, 90 мг
(1,04 грамм-экв.) диметилового эфира α -аминоэтилфосфоновой кислоты и 500 мг (7,3 грамм-экв.) сульфата магния растворяют в 5 мл ДМСО и перемешивают в течение 24 ч при комнатной температуре.
Затем реакционную смесь отфильтровывают, фильтрат упаривают и остаток растворяют в 5 мл метанола. К этому раствору добавляют 0,027 мл (1 грамм-экв.) уксусной кислоты, 78 мг (2 грамм-экв. ) ацетата
натрия и 36 мг (1,2 грамм-экв.) цианоборогидрида натрия и оставляют для перемешивания при комнатной температуре в течение 48 ч. Далее реакционную смесь смешивают с 1 н. соляной кислотой, перемешивают
в течение 30 мин, после чего промывают диэтиловым эфиром. Водной фазе с помощью 2 н. раствора гидроксида натрия придают основный характер и экстрагируют уксусным эфиром. Объединенные уксусноэфирные
фазы промывают рассолом, сушат над сульфатом магния и упаривают. Указанное в заголовке соединение получают в виде желтой смолы.
е) Диметиловый эфир N-(7-нитро-2,
3-диметоксихиноксалин-5-илметил)-α-(этиламино) этилфосфоновой кислоты
300 мг (0,75 ммоля) диметилового эфира N-(7-нитро-2,3-диметоксихиноксалин-5-илметил)-α-аминоэтилфосфоновой
кислоты, 0,482 мл (8 грамм-экв.) этилиодида и 1,4 мл (11 грамм-экв.) диизопропилэтиламина оставляют для перемешивания в 10 мл ацетонитрила в течение 24 ч при 70oC. Затем реакционную смесь
упаривают и остаток тщательно перемешивают в диэтиловом эфире. Затем твердое вещество отфильтровывают, промывают диэтиловым эфиром и фильтрат упаривают. Указанное в заголовке соединение получают в
виде масла, окрашенного в коричневатый цвет.
1H-ЯМР (СDСl3, 250 МГц); δ=8,63, 8,54 (2d, 2H); 4,37 (s, 2H); 4,19, 4,17 (2s, 2Me); 3,88, 3,73 (2d, 2Ме); 3, 27 (m,1H) 2,9, 2,7 (2m, 2H); 1,39 (dd, Me); 1,13 (t, Me).
Пример 5: N-ацетил-N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминоэтилфосфоновая кислота
Указанное в заголовке соединение можно получить аналогично примерам 1 и 4, но исходя из диметилового эфира N-(7-нитро-2,3-диметоксихиноксалин-5-илметил)аминоэтилфосфоновой кислоты; tпл
248oC.
Пример 6: (R)-N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-(этиламино) этилфосфоновая кислота
4,24 г (9,9 ммолей)
диметилового
эфира (R)-N-(7-нитро-2,3-диметоксихиноксалин-5-илметил)-α-(этиламино) этилфосфоновой кислоты оставляют для перемешивания в 80 мл 6 н. соляной кислоты в течение 19 ч. Затем
реакционную смесь
упаривают и остаток взмучивают в воде. Указанное в заголовке соединение получают в виде твердого вещества с tпл 218oC (разложение).
Исходные
материалы могут быть
получены, например, следующим образом:
а) Диметиловый эфир (R)-N-(7-нитро-2,3-диметоксихиноксалин-5-илметил)-α-аминоэтилфосфоновой кислоты
5,14 г (19,5
ммолей) 7-нитро-2,
3-диметоксихиноксалин-5-карбальдегида, 3,59 г (1,2 грамм-экв.) диметилового эфира фосфоаланина и 18,8 г (8 грамм-экв. ) сульфата магния перемешивают в 80 мл диметилсульфоксида в
течение 3 ч при
комнатной температуре. Затем реакционную смесь отфильтровывают и упаривают. Остаток растворяют в 100 мл метанола и смешивают с 1,12 мл (1 грамм-экв. ) уксусной кислоты, 3,2 г (2
грамм-экв.) ацетата
натрия и 1,71 г (1,4 грамм-экв. ) цианоборогидрида натрия. Реакционную смесь перемешивают в течение 18 ч при комнатной температуре, смешивают с 1 н. соляной кислотой и
экстрагируют диэтиловым эфиром.
Водной фазе с помощью 4 н. едкого натра придают основный характер и экстрагируют уксусным эфиром. Объединенные органические фазы сушат над сульфатом магния и
упаривают. Указанное в заголовке
соединение получают в виде коричневого масла;
МС (ES+):801 (2М+1), 401 (М+1), 291.
б) Диметиловый эфир (R)-N-(7-нитро-2,
3-диметоксихиноксалин-5-илметил)-α
-(этиламино)этилфосфоновой кислоты
3,4 г (8,5 ммолей) диметилового эфира (R)-N-(7-нитро-2,3-диметоксихиноксалин-5-илметил)-α
-аминоэтилфосфоновой кислоты, 8,9 мл (7,5 грамм-экв.)
этилиодида и 20,9 мл (14,5 грамм-экв.) основания Хюнига перемешивают в 18 мл ацетонитрила и оставляют для перемешивания в течение 18 ч при 55oC. Затем реакционную смесь упаривают и
взмучивают с уксусным эфиром. Выпавшее в осадок твердое вещество отфильтровывают и промывают уксусным эфиром. Указанное в заголовке соединение получают
после упаривания фильтрата и хроматографии на
колонке с помощью уксусного эфира/метанола (в соотношении 95:5) в качестве элемента в виде желтой смолы.
ЯМР (250 МГц, CDCl3); δ (част./млн.)=8,60, 8,52 (2m, 2H); 4, 33 (шир. s, 2H); 4,17, 4,16 (2s, 2Me); 3,83, 3,73 (2d, 2MeO); 3,23 (dq, 1H); 2,88, 2,70 (2m, 2H); 1,38 (dd, Me); 1,11 (t, Me).
Пример 7:
(S)-N-(7-нитро-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)этилсфосфоновая кислота
Указанное в заголовке соединение может быть получено аналогично примеру 6; tпл 219oC
(разложение).
Пример 8: Гидрохлорид (R)-N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновой кислоты
Указанное в заголовке соединение
может быть получено аналогично примеру 6, но без стадии б); tпл 218oC (разложение).
Пример 9: Гидрохлорид (S)-N-(7-нитро-2,
3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновой кислоты
Указанное в заголовке соединение может быть получено аналогично примеру 6, но без стадии б); tпл 218oC (разложение).
Пример 10: (S)-N-(7-бром-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновая кислота
Указанное в
заголовке соединение может
быть получено аналогично примеру 6, но без стадии б) и исходя из 5-бромметил-7-бром-2,3-диметоксихиноксалина; tпл 272oC (разложение).
Пример 11: (S)-N-(7-бром-2,
3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновая кислота
Указанное в заголовке соединение может быть получено аналогично примеру 6, но
без стадии б) и исходя из
5-бромметил-7-бром-2,3-диметоксихиноксалина; tпл 278oC (разложение).
Пример 12
Аналогично примерам 3 и 4 могут быть получены
также следующие соединения
из группы, включающей:
гидробромид N-(7-хлор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-(метиламино)этилфосфоновой кислоты;
гидробромид
N-(7-фтор-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)этилфосфоновой кислоты;
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α
-(метиламино)этилфосфоновой
кислоты, tпл 191oC (разложение);
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминометилфосфоновую кислоту, tпл
272oC (разложение);
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)метилфосфоновой кислоты, tпл 280-285oC
(разложение);
N-(2,
3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-(метиламино)метилфосфоновую кислоту, tпл 286oC (разложение).
Пример 13: Гидробромид N-(2,
3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-β-аминопропилфосфоновой кислоты
Указанное в заголовке соединение может быть получено из
диметилового эфира N-(2,
3-диметокси-7-нитрохиноксалин-5-илметил)-β-аминопропилфосфоновой кислоты аналогично примеру 2 и путем последующей перекристаллизации из диметилформамида с добавлением
этанола и диэтилового
эфира; tпл 282oC (разложение).
Исходный материал можно получить, например, следующим образом:
Диметиловый эфир N-(2,
3-диметокси-7-нитрохиноксалин-5-илметил)-β-аминопропилфосфоновой кислоты
200 мг (0,757 ммоля) 5-аминометил-7-нитро-2,3-диметоксихиноксалина, 547 мг (4,5 грамм-экв. ) сульфата магния и
163 мг (1,3 грамм-экв.) диметил-2-оксопропилфосфоната перемешивают в 8 мл дихлорметана в течение 20 ч при комнатной температуре. Затем добавляют 4 мл метанола, 0,095 мл уксусной кислоты и 52 мг (1,1
грамм-экв.) цианоборогидрида натрия и оставляют для перемешивания в течение 4 ч. Затем реакционную смесь фильтруют и фильтрат экстрагируют водой и рассолом. Органические фазы объединяют, сушат над
сульфатом магния и упаривают. Указанное в заголовке соединение получают в виде коричневого масла.
Пример 14: Гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)
-2-аминофенилфосфоновой кислоты
Указанное в заголовке соединение может быть получено из диэтилового эфира N-(2,3-диметокси-7-нитрохиноксалин-5-илметил)-2-аминофенилфосфоновой кислоты
аналогично примеру 4; tпл 191oC (разложение).
Исходный материал можно получить, например, следующим образом:
Диэтиловый эфир N-(2,
3-диметокси-7-нитрохиноксалин-5-илметил)-2-аминофенилфосфоновой кислоты
190 мг (0,579 ммоля) 5-бромметил-7-нитро-2,3-диметоксихиноксалина, 159 мг (1,2 грамм-экв.) диэтилового эфира
аминофенилфосфоновой кислоты и 0,2 мл (2 грамм-экв. ) диизопропилэтиламина оставляют для перемешивания в 8 мл ацетонитрила в течение 20 ч при дефлегмации. Затем реакционную смесь упаривают и остаток
экстрагируют водой и уксусным эфиром. Объединенные органические фазы сушат с помощью рассола и сульфата магния и упаривают. Указанное в заголовке соединение получают в виде твердого продукта желтого
цвета.
1H-ЯМР (СDСl3, 250 МГц); δ=8,57, 8,29 (2d, 2H); 7,48, 7,25, 6,67, 6,51 (4m, 4H); 4,93 (s, 2H); 4,24, 4,28 (2s, 2Me); 4,10 (m, 2СН2); 1, 32 (m, 2СН3).
Пример 15
Аналогичным путем, как это описано в примерах 1-4, 13 и 14, могут быть получены также следующие соединения из группы, включающей:
N-(7-бром-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминобензилфосфоновую кислоту, tпл > 310oC;
гидробромид N-(7-бромо-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино-3-метилбутилфосфоновой кислоты, tпл 254-256oC;
N-(7-бромо-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α
-аминоизобутилфосфоновую кислоту, tпл 249-251oC;
N-(7-бромо-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино-β-бензилоксиэтилфосфоновую кислоту,
tпл > 280oC, МС (ES-): 484, 482 (М-1);
N-(7-бромо-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминопропилфосфоновую кислоту, tпл 264-266oC;
гидрохлорид диэтилового эфира N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-4-аминобензилфосфоновой кислоты, МС (ES-): 461 (М-Н)-;
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино-(3-гидроксибензил)фосфоновой кислоты, tпл > 280oC;
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино(изопропил)фосфоновой кислоты, tпл 212oC (разложение);
гидробромид N-(2,
3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминобензилфосфоновой кислоты, ТСХ (трет-бутил-ОМе, МеОН, АсОН (80: 18:2)): Rf=0,27;
транс-2- [N-(2,
3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)амино]циклопропилфосфоновую кислоту;
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α
-метиламино(изопропил)фосфоновой кислоты, tпл 212oC (разложение);
гидробромид транс-2-[N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)амино]циклопропилфосфоновой кислоты, tпл > 320oC (разложение);
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино-(3,4,5-триметоксибензил)фосфоновой кислоты, tпл 265oC;
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-аминоциклогексилметилфосфоновой кислоты, tпл 255oC (разложение);
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино-н-бутилфосфоновой кислоты, tпл 230oC (разложение);
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино-3-метилбутилфосфоновой кислоты, tпл 220oC (разложение);
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-аминобензилфосфоновой кислоты, tпл 205oC (разложение);
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино-(3-тиенил)метилфосфоновой кислоты, tпл 205oC (разложение);
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино-(4-метоксикарбонилбензил)фосфоновой кислоты, tпл 270oC;
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино-(4-карбоксибензил)фосфоновой кислоты, tпл > 280oC;
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино-(3-нитробензил)фосфоновой кислоты, tпл 205oC (разложение);
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино-(2-гидрокси-3-метоксибензил)фосфоновой кислоты, tпл > 330oC;
гидробромид N-(7-хлор-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-аминофенилфосфоновой кислоты, tпл > 250oC;
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α
-амино-2-пирролилметилфосфоновой кислоты, tпл > 320oC;
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α
-амино-(3-метилсульфанилпропил)фосфоновой кислоты, tпл 252oC (разложение);
гидробромид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α
-амино-(2-гидрокси-2-метилпропил)фосфоновой кислоты, tпл > 256oC;
гидробромид N-(7-нитро-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-аминофенилфосфоновой
кислоты;
N-(7-хлор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту, tпл >
270oC, МС (ES-): 332 (М-1), 250, 207;
N-(7-фтор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту, tпл > 250oC, [1H]-ЯМР (D2O, 250
МГц):δ (част./млн)=7,1 (m, 2H):4,57 (m, 2Н):3,42 (m, 1H):1,47 (m, 3H).
Пример 16: Гидробромид п-бензил-N-(2,
3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)аминометилфосфиновой кислоты
Указанное в заголовке соединение получают аналогично примеру 1 из диэтилового эфира п-бензил-N-(2,
3-диметокси-7-нитрохиноксалин-5-илметил) аминометилфосфиновой кислоты; tпл 196oC (разложение).
Исходный материал можно получить, например, следующим образом:
а) Этиловый эфир п-бензил-N-(2,3-диметокси-7-нитрохиноксалин-5-илметил) аминометилфосфиновой кислоты
300 мг (1,136 ммоля) 5-аминометил-7-нитро-2,3-диметоксихиноксалина, 0,13 мл (2
грамм-экв.) ацетальдегида, 683 мг (5 грамм-экв.) сульфата магния и 204 мг (1,3 грамм-экв.) карбоната калия оставляют для перемешивания в 8 мл дихлорметана в течение 2 ч при комнатной температуре.
Затем реакционную смесь отфильтровывают и к фильтрату добавляют 0,205 мл (1,3 грамм-экв.) триэтиламина, 0,215 мл (1,5 грамм-экв.) триметилхлорсилана и 209 мг (1 грамм-экв.) этилового эфира
п-бензилфосфиновой кислоты. Реакционную смесь оставляют для перемешивания в течение 18 ч и затем экстрагируют водой и дихлорметаном. Органические фазы объединяют, сушат над сульфатом магния и
упаривают. Таким путем получают указанное в заголовке соединение в виде желтой смолы; МС (ES+): 353, 537 (М+1)+.
Пример 17
Аналогичным путем, как это
описано в примерах 1 и 16, можно получить также соединения из группы, включающей:
п-метил-N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфиновую кислоту,
tпл 226oC (разложение);
п-бензил-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминометанфосфиновую кислоту;
п-метил-(7-нитро-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-аминометанфосфиновую кислоту.
Пример 18: Амид N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-4-фосфономасляной кислоты
Указанное в заголовке соединение может быть получено аналогично примеру 4, но из амида N-(2,3-диметокси-7-нитрохиноксалин-5-илметил)-4-(диметилфосфоно)масляной кислоты; tпл 220-240oC (разложение).
Исходный материал можно получить, например, следующим образом:
а) Амид N-(2,3-диметокси-7-нитрохиноксалин-5-илметил)-4-(диметилфосфоно)масляной
кислоты
К раствору из 150 мг (0,568 ммоля) 5-аминометил-2,3-диметокси-7-нитрохиноксалина и 165 мг (0,738 ммоля) 4-(диметилфосфоно)масляной кислоты в 3 мл метиленхлорида добавляют при
комнатной температуре 163 мг (0,851 ммоля) гидрохлорида N-(диметиламинопропил)-N'-этилкарбодиимида и смесь перемешивают в течение 30 ч. Затем смесь разбавляют метиленхлоридом и промывают 0,2 н.
соляной кислотой и рассолом, концентрируют с помощью ротационного испарителя и остаток сушат под высоким вакуумом. Таким путем получают указанное в заголовке соединение в виде желтой смолы.
Пример 19
Аналогичным путем, как это описано в примере 18, могут быть получены также соединения из группы, включающей
амид N-7-нитро-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-фосфоноуксусной кислоты, tпл 280-283oC (разложение);
амид N-(7-нитро-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-3-фосфонопропеновой кислоты, tпл 240-260oC (разложение);
амид N-(7-нитро-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-фосфоноиндан-2-карбоновой кислоты, tпл 280-290oC (разложение).
Пример 20: Гидробромид N-бензил-N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)аминометилфосфоновой кислоты
0,7 г (1,4 ммоля) диэтилового эфира N-бензил-N-(2,3-диметокси-7-нитрохиноксалин-5-илметил)-α-аминометилфосфоновой кислоты
и 1,1 мл (8,3 ммолей) триметилсилилбромида перемешивают в 7 мл метиленхлорида в течение 16 ч при комнатной температуре. Затем добавляют 7 мл этанола и продолжают перемешивание еще в течение 24 ч при
комнатной температуре. Реакционную смесь упаривают, остаток растворяют в 7 мл уксусной кислоты, далее добавляют 7 мл 33%-ного НВr в уксусной кислоте и смесь перемешивают в течение 4 ч при комнатной
температуре. После добавления 60 мл простого эфира образуется суспензия, которую фильтруют на нутче. Фильтрат промывают простым эфиром и сушат при 60oC под вакуумом. Затем кристаллы
тщательно перемешивают в этиловом эфире уксусной кислоты и повторно отфильтровывают. Таким путем получают указанное в заголовке соединение в виде кристаллов сероватого цвета с tпл
238-240oC (разложение).
Исходный материал можно получить, например, следующим образом:
а) Диэтиловый эфир N-бензил-N-(2,
3-диметокси-7-нитрохиноксалин-5-илметил)аминометилфосфоновой кислоты
1,0 г (3,05 ммоля) 5-бромметил-2,3-диметокси-7-нитрохиноксалина, 1,1 г (3,66 ммоля) гидрохлорида диэтилового эфира
бензиламинометанфосфоновой кислоты и 1,9 мл (10,98 ммолей) N-этилдиизопропиламина тщательно перемешивают в 10 мл диметилформамида в атмосфере аргона в течение приблизительно 18 ч при комнатной
температуре, а затем еще в течение 3 ч при 80oC.
После добавления этилового эфира уксусной кислоты экстрагируют водой и рассолом, водные фазы промывают этиловым эфиром уксусной кислоты, органические фазы объединяют, сушат над сульфатом натрия, фильтруют на нутче и концентрируют. Образующийся после упаривания остаток хроматографируют на силикагеле гексаном/этиловым эфиром уксусной кислоты в соотношении 1:1. В результате получают 0,71 г (46%) диэтилового эфира N-бензил-N-(2,3-диметокси-7-нитрохиноксалин-5-илметил)-аминометилфосфоновой кислоты.
Пример 21
Аналогично примеру 20 получают также следующие соединения из группы, включающей:
N-бензил-N-(7-бром-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминометилфосфоновую
кислоту;
N-бензил-N-(7-хлор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминометилфосфоновую кислоту, tпл 245-248oC (разложение);
N-бензил-N-(2,
3-диоксо-7-фтор-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминометилфосфоновую кислоту.
Пример 22: N-бензил-N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α
-аминоэтанфосфоновая кислота
Указанное в заголовке соединение, tпл 254-257oC (разложение), можно получить, исходя из 5-бромметил-2,3-диметокси-7-нитрохиноксалина и
диэтилового эфира 2-бензиламиноэтанфосфоновой кислоты аналогично примеру 1.
Пример 23: N-(2,3-диоксо-7-фтор-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновая
кислота
Указанное в заголовке соединение можно получить путем сольволиза диметилового эфира N-(2,3-диметокси-7-фторхиноксалин-5-илметил)-α-аминоэтилфосфоновой кислоты аналогично
примеру 1. Исходный материал [диметиловый эфир N-(2,3-диметокси-7-фторхиноксалин-5-илметил-α-аминоэтилфосфоновой кислоты] можно получить аналогично примеру 4д1).
1 H-ЯМР (СDСl3, 300 МГц): δ=7,2-7,4 (2Н), 4,2-4,4 (2Н), 4,12 (s, 6Н), 3,0 (m, 1H), 1,28-1,45 (m, 3H).
Пример 24
Аналогично примерам 1-23 получают также
следующие соединения из группы, включающей:
гидрохлорид (R)-N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-β-аминопропилфосфоновой кислоты, tпл 293o
C (разложение);
гидрохлорид (S)-N-(7-нитpo-2,3-диоксо-l, 2,3,4-тетрагидрохиноксалин-5-илметил)-β-аминопропилфосфоновой кислоты, tпл 295oC (разложение);
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминопропилфосфоновой кислоты, tпл 235oC (разложение);
гидрохлорид N-(2,
3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино(тетрагидропиран-4-ил)фосфоновой кислоты, tпл 310oC (разложение);
дигидрохлорид N-(2,
3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино(пиперидин-4-ил)фосфоновой кислоты, tпл 251oC (разложение);
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,
3,4-тетрагидрохиноксалин-5-илметил)-α-амино(фуран-2-илметил)фосфоновой
кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α
-амино-(2-метокси)этилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-2-циклогексилэтилфосфоновой кислоты;
гидрохлорид N-(2,
3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-β-аминоизопропилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-аминоциклогексилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-2-метилпропилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-аминобутилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-аминогептилфосфоновой кислоты, МС (FB+):415 (М+1);
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-3-фенилоксипропилфосфоновой кислоты, tпл 234oC (разложение);
N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-этиламиноэтилфосфоновую кислоту, tпл 286oC (разложение);
N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-бензиламиноэтилфосфоновую кислоту, tпл 255oC (разложение);
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-2-п-толилэтилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-2-(2-метоксифенил)этилфосфоновой
кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-2-(4-фторфенил)этилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-2-фенилэтилфосфоновой кислоты, tпл 258oC (разложение);
гидрохлорид п-метил-N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-2-фенилэтилфосфиновой кислоты, tпл 258oC (разложение);
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-1-фенилэтилфосфоновой кислоты, tпл 262oC (разложение);
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(фуран-2-ил)этилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(4-фторфенил)этилфосфоновой
кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(4-метоксифенил)этилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(3-метоксифенил)этилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(2-хлорфенил)этилфосфоновой кислоты;
гидрохлорид N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(4-толил)этилфосфоновой
кислоты;
N-бензил-N-(7-бром-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
{ 1-[(7-бромо-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-амино] циклопропил} фосфоновую кислоту, tпл 295oC (разложение);
N-бензил-N-(7-хлор-2,3-диоксо-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
N-бензил-N-(2,3-диоксо-7-фтор-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту.
Пример 25
Аналогично примерам 1-23, исходя из 7-циано-5-метил-2,3-диметоксихиноксалина, могут быть получены также следующие соединения из группы, включающей:
N-(7-циано-2,
3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту, tпл>270oC, Н-ЯМР (ДМСО, 250 МГц); δ = 7,62, 7,47 (2m, 2H); 4,50, 4,40 (2d,
2H); 3,22 (m, 1H); 1,36 (q, Me);
гидрохлорид N-(7-циано-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-этиламиноэтилфосфоновой кислоты, tпл>270oC,
МС
(ES+):353 (М+1).
Исходный материал можно получить, например, следующим образом:
а) 7-циано-5-метил-2,3-диметоксихиноксалин
Раствор из 7 н. (24,72 ммоля)
7-бром-5-метил-2,3-диметоксихиноксалина (пример 1г), 1,74 г цианида цинка (14,83 ммолей) и 1,1 г (0,9 ммоля) тетракис(трифенилфосфин) палладия (0) растворяют в 100 мл ДМФ, дегазируют и далее
обрабатывают в атмосфере азота. Затем смесь нагревают в течение 16 ч до 80oC. После охлаждения реакционную смесь смешивают с 2 н. соляной кислотой и экстрагируют этиловым эфиром уксусной
кислоты. Объединенные органические фазы промывают рассолом, сушат над сульфатом натрия и упаривают. Остаток хроматографируют на силикагеле этиловым эфиром уксусной кислоты/гексаном (в соотношении
9:1-1:1) в качестве элюента; tпл 179-180oC (уксусный эфир/гексан);1H-ЯМР (250 МГц, CDCl3); δ=7,94 (d, J=3, 1H), 7,51 (d, J=3, 1H), 4,18 (s, 3H), 4,
16 (s, 3H), 2,64 (s, 3H); MC (ES+): 230.
Пример 26
Аналогично примерам 1-23, исходя из 7-трифторметил-5-метил-1,4-дигидрохиноксалин-2,3-диона, могут быть получены также
следующие соединения из группы, включающей:
(R)-N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту, [α]D = -19,6° (с=1, МеОН);
(S)-N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту, [α]D = +17,7°
(с=1, МеОН);
(R)-N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)этилфосфоновую кислоту, [α]D = +74° (с= 0,1,
H2O), tпл>270oC;
N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-β-(этиламино)этилфосфоновую кислоту, tпл
230oC (разложение);
(S)-N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)этилфосфоновую кислоту, [α]D = -78° (с = 0,1, H2O), tпл>270oC, MC (ES-):394 (М-1);
гидрохлорид (R)-N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-β
-аминопропилфосфоновой кислоты, tпл 282oC (разложение);
гидрохлорид (S)-N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-β
-аминопропилфосфоновой кислоты, tпл 281oC (разложение);
N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминометилфосфоновую кислоту, tпл
321-323oC (разложение).
Исходный материал можно получить, например, следующим образом:
а) Этиловый эфир N-(2-метил-4-трифторметилфенил)оксаламовой кислоты
Раствор из 37,5 г (214 ммолей) 2-метил-4-трифторметиланилина (DE 2750170 А1) и 44,7 мл (321 ммоль) триэтиламина в 750 мл этилового эфира уксусной кислоты охлаждают с помощью ледяной бани до +3oC. Затем медленно добавляют по каплям этилоксалилхлорид (26,2 мл, 235,5 ммолей) таким образом, чтобы температура не превышала +10oC. Затем продолжают тонкое растирание и
размешивание
еще в течение 2 ч. Смесь смешивают с водой, промывают 10%-ным водным раствором гидрокарбоната натрия и рассолом, сушат над сульфатом натрия и концентрируют. После кристаллизации сырого
продукта
получают 52,75 г указанного в заголовке соединения в виде белых кристаллов с tпл 120-121oC (уксусный эфир/гексан).
1H-ЯМР (300 МГц, СDСl3); δ=8,98 (шир. s, 1H), 8,29 (d, J=8, 1H), 7,53 (d, J=8, 1H), 7,49 (s, 1H), 4,45 (q, J=7, 2H), 1,64 (t, J=7, 3H).
б) Этиловый эфир
N-(2-метил-6-нитро-4-трифторметилфенил)оксаламовой кислоты
К охлажденному льдом раствору из 32,6 г (118,6 ммолей) этилового эфира N-(2-метил-4-трифторметилфенил)оксаламовой кислоты в
концентрированной серной кислоте добавляют маленькими порциями 14,4 г (142,3 ммоля) нитрата калия. После 1,5-часового перемешивания при 0oC смесь осторожно сливают на 900 г льда. Затем
белую суспензию экстрагируют этиловым эфиром уксусной кислоты. Органическую фазу промывают рассолом, сушат над сульфатом натрия и центрифугируют при пониженном давлении. После кристаллизации из
уксусного эфира/гексана получают 35,5 г указанного в заголовке соединения в виде белых кристаллов с tпл 118-120oC.
1H-ЯМР (200 МГц, CDCl3); δ=9,94 (шир. s, NH), 8,17 (s, 1H), 7,81 (s, 1H), 4,45 (q, J=7, 2H), 2,41 (s, 3H), 1,43 (t, J=7, 3H).
в) 7-трифторметил-5-метил-1,4-дигидрохиноксалин-2,3-дион
В
атмосфере азота при 0oC 355 мл 15%-ного раствора трихлорида титана в водной соляной кислоте растворяют в 850 мл воды и 850 мл ацетона. Затем к этому раствору медленно добавляют по каплям
раствор из 35,5 г (110,8 ммолей) этилового эфира N-(2-метил-6-нитро-4-трифторметилфенил)оксаламовой кислоты в 1,7 л ацетона. Образовавшийся фиолетовый раствор перемешивают в течение 16 ч при 0oC. Затем добавляют такое количество 15%-ного раствора трихлорида титана в водной соляной кислоте, пока1H-ЯМР-анализ не подтвердит полное отсутствие эдукта. Далее реакционную смесь
фильтруют на нутче, фильтрат концентрируют и выпавший в осадок твердый продукт повторно отфильтровывают на нутче. Этот сырой продукт промывают разбавленной соляной кислотой и водой. Указанное в
заголовке соединение получают в виде твердого вещества белого цвета.
МС (ES+):245 (М+Н)+.
1H-ЯМР (200 МГц, AMCO-d6); δ=12,1 (s, NH), 11,5 (s, NH), 7,30 (s, 1H), 7,28 (s, 1H), 2,40 (s, 3H).
Пример 27
Таблетки, каждая из которых содержит 50 мг N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино(изопропил)фосфоновой кислоты или ее соли, например гидробромида, могут быть изготовлены следующим образом:
Состав (на 10000 таблеток), г:
Активное вещество - 500
Лактоза - 500,0
Картофельный крахмал - 352
Желатин - 8
Тальк - 60
Стеарат магния - 10
Диоксид кремния
(высокодисперс.) - 20
Этанол - q.s.
Активное вещество смешивают с лактозой и 292 г картофельного крахмала, смесь увлажняют раствором желатина в этаноле и гранулируют, пропуская через сито. После сушки примешивают остальную часть картофельного крахмала, стеарат магния, тальк и диоксид кремния и из смеси прессуют таблетки весом 145,0 мг каждая и с содержанием активного вещества 50,0 мг в каждой, при этом на таблетки при необходимости могут наноситься насечки в целях соблюдения точной дозировки.
Пример 28
Стерильно
профильтрованный
водный раствор желатина с 20% циклодекстринов в качестве средства, способствующего растворимости, содержащий соответственно 3 мг N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α
-амино(изопропил)фосфоновой кислоты или ее соли, например гидробромида, в качестве активного вещества, нагревая, смешивают со стерильным раствором желатина,
содержащим в качестве консерванта фенол, в
асептических условиях таким образом, что в результате получают раствор, 1,0 мл которого имеет следующий состав, мг:
Активное вещество - 3
Желатин - 150,0
Фенол - 4,7
Дистилл. вода с 20% циклодекстринов в качестве средства, способствующего растворимости, мл - 1,0
Пример 29
Для получения стерильной
сухой субстанции, предназначенной для инъекции,
содержащей соответственно 5 мг N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино(изопропил)фосфоновой кислоты или ее соли,
например гидробромида, 5 мг одного из указанных в
представленных выше примерах соединений формулы I в качестве активного вещества растворяют в 1 мл водного раствора с 20 мг маннита и 20%
циклодекстринов в качестве средства, способствующего
растворимости. Раствор стерильно фильтруют и при соблюдении асептических условий заполняют 2-миллилитровую ампулу, подвергают глубокому охлаждению
и лиофилизуют. Перед применением лиофилизат
растворяют в 1 мл дистиллированной воды либо в 1 мл физиологического раствора поваренной соли. Этот раствор применяют для внутримышечного или внутривенного
введения. Указанную композицию можно
разливать также в сдвоенные инъекционные ампулы.
Пример 30
Для изготовления 10000 таблеток с лаковым покрытием, каждая из которых
содержит 100 мг N-(2,3-диоксо-7-нитро-1,2,3,
4-тетрагидрохиноксалин-5-илметил)-α-амино(изопропил)фосфоновой кислоты или ее соли, например гидробромида, можно использовать следующую
технологию:
Активное вещество, г - 1000
Кукурузный крахмал, г - 680
Коллоидная кремниевая кислота, г - 200
Стеарат магния, г - 20
Стеариновая кислота, г
- 50
Натрийкарбоксиметилкрахмал, г - 250
Вода - q.s.
Смесь из одного из указанных в представленных выше примерах соединений формулы I в качестве активного вещества, 50 г кукурузного крахмала и коллоидной кремниевой кислоты перерабатывают совместно с крахмальным клейстером из 250 г кукурузного крахмала и 2,2 кг деминерализованной воды, получая в результате влажную массу. Затем эту массу пропускают через сито с размером ячеек 3 мм и сушат при температуре 45oC в течение 30 мин в сушилке с псевдоожиженным слоем. Высушенный гранулят пропускают через сито с размером ячеек 1 мм, смешивают с предварительно пропущенной через сито (размер ячеек 1 мм) смесью из 330 г кукурузного крахмала, стеарата магния, стеариновой кислоты и натрийкарбоксиметилкрахмала и прессуют слегка выпуклые таблетки.
Пример 31
Аналогично примерам 27-30 можно изготавливать также фармацевтические препараты, содержащие в своем
составе какое- либо другое соединение из числа описанных в примерах 1-26.
Результаты испытаний заявленных соединений приведены в таблице.
Реферат
Изобретение относится к соединениям формулы (I)

в которой R1 обозначает гидрокси или алифатический, аралифатический либо ароматический остаток; Х - двухвалентный алифатический, циклоалифатический, циклоалифатически-алифатический, аралифатический, гетероарилалифатический либо ароматический остаток; R2 - водород или алифатический либо аралифатический остаток; alk - (низш.)алкилиден; R3, R4 и R5 независимо друг от друга - водород, (низш.)алкил, галоген, трифторметил, циано или нитро, а также их соли. Указанные соединения и их соли могут применяться для лечения патологических состояний, реагирующих на блокирование рецепторов эксцитаторных аминокислот, и для получения предназначенных для этих целей фармацевтических препаратов. 3 с. и 6 з.п. ф-лы, 1 табл.
Формула

в которой R1 обозначает гидрокси или алифатический, аралифатический либо ароматический остаток;
Х - двухвалентный алифатический, циклоалифатический, циклоалифатически-алифатический, аралифатический, гетероарилалифатический либо ароматический остаток;
R2 - водород или алифатический либо аралифатический остаток;
alk - (низш. )алкилиден;
R3, R4 и R5 независимо друг от друга - водород, (низш. )алкил, галоген, трифторметил, циано или нитро, при условии, что а1) R4 имеет значение, отличное от нитро, если Х - метилен, 3-гидроксибензилиден, 3-метоксибензилиден, 3-пиридилметилен, этилен, оксоэтилен, этилиден, 1,3-пропилен, 1,3-(1-карбокси)пропилен, циклопропилен или 1,4-бутилен, R1 - гидрокси, alk - метилен и R2, R3 и R5 - водород, или, если Х - метилен, R1 представляет собой метил или бензил, alk - метилен и R2, R3 и R5 - водород, или если Х - бутилен, R1 - гидрокси, alk - метилен, R2 - метил и R3 и R5 - водород и б1) R4 имеет значение, отличное от брома, если Х - метилен или этилиден, R1 - гидрокси, alk - метилен и R2, R3 и R5 - водород,
и их соли.
N-ацетил-N-(7-бром-2, 3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил) аминометилфосфоновую кислоту;
N-ацетил-N-(7-хлор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминометилфосфоновую кислоту;
N-ацетил-N-(7-фтор-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)аминометилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -(этиламино)этилфосфоновую кислоту;
N-ацетил-N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил) аминоэтилфосфоновую кислоту;
(R)-N-(7-нитро-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α -(этиламино)этилфосфоновую кислоту (CGP 79356);
(S)-N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)этилфосфоновую кислоту;
(R)-N-(7-нитро-2, 3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
(S)-N-(7-нитро-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
(R)-N-(7-бром-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
(S)-N-(7-бром-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -аминоэтилфосфоновую кислоту;
N-(7-хлор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -(метиламино)этилфосфоновую кислоту;
N-(7-фтор-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)этилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-(метиламино)этилфосфоновую кислоту;
N-(2,3-диoкco-7-нитpo-1,2,3,4-тeтpaгидpoxинoкcaлин-5-илмeтил)аминометилфосфоновую кислоту;
N-(2, 3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -(этиламино)метилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -(метиламино)метилфосфоновую кислоту;
N-(2,3-диoкco-7-нитpo-l, 2,3, 4-тeтpaгидpoxинoкcaлин-5-илмeтил)-β-аминопропилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-2-аминофенилфосфоновую кислоту;
N-(7-бромо-2, 3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминобензилфосфоновую кислоту;
N-(7-бромо-2, 3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино-3-метилбутилфосфоновую кислоту;
N-(7-бромо-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино-β -бензилоксиэтилфосфоновую кислоту;
N-(7-бромо-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-аминоизобутилфосфоновую кислоту;
N-(7-бромо-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-аминопропилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-4-аминобензилфосфоновую кислоту;
N-(2, 3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -амино-(3-гидроксибензил)фосфоновую кислоту;
N-(2,3-диoкco-7-нитpo-1,2,3,4-тeтpaгидpoxинoкcaлин-5-илмeтил)-α -амино(изопропил)фосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-аминобензилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-метиламино (изопропил) фосфоновую кислоту;
транс-2-[N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)амино] циклопропилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -амино- (3,4,5-триметоксибензил)фосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-аминоциклогексилметилфосфоновую кислоту;
N-(2, 3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино-н-бутилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -амино-3-метилбутилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -аминобензилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-амино-(3-тиенил)метилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α -амино-(4-метоксикарбонилбензил)фосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -амино-(4-карбоксибензил)фосфоновую кислоту;
N-(2, 3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино-(3-нитробензил)фосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2, 3,4-тетрагидрохиноксалин-5-илметил)-α -амино-(2-гидрокси-3-метоксибензил)фосфоновую кислоту;
N-(7-хлор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-аминофенилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-амино-2-пирролилметилфосфоновую кислоту;
N-(2,3-диoкco-7-нитpo-l, 2,3, 4-тeтpaгидpoxинoкcaлин-5-илмeтил)-α -амино-(3-метилсульфанилпропил)фосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -амино-(2-гидрокси-2-метилпропил)фосфоновую кислоту;
N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-аминофенилфосфоновую кислоту;
N-(7-хлор-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
N-(7-фтор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
п-бензил-N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)аминометилфосфиновую кислоту;
п-метил-N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -аминоэтилфосфиновую кислоту;
п-бензил-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминометанфосфиновую кислоту;
п-метил-(7-нитро-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-аминометанфосфиновую кислоту;
амид N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-4-фосфономасляной кислоты;
амид N-(7-нитро-2, 3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-2-фосфоноуксусной кислоты;
амид N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-3-фосфонопропеновой кислоты;
амид N-(7-нитро-2, 3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-фосфоноиндан-2-карбоновой кислоты;
N-бeнзил-N-(2,3-диoкco-7-нитpo-l, 2,3,4-тeтpaгидpoxинoкcaлин-5-илметил) аминометилфосфоновую кислоту;
N-бензил-N-(7-бром-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)аминометилфосфиновую кислоту;
N-бензил-N-(7-хлор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил) аминометилфосфоновую кислоту;
N-бензил-N-(2,3-диоксо-7-фтор-1,2,3,4-тетрагидрохиноксалин-5-илметил) аминометилфосфоновую кислоту;
N-бензил-N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-аминоэтанфосфоновую кислоту;
N-(2,3-диоксо-7-фтор-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
(R)-N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-β-аминопропилфосфоновую кислоту;
(S)-N-(7-нитро-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-β -аминопропилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминопропилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-амино(тетрагидропиран-4-ил)фосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино (пиперидин-4-ил)фосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-амино(фуран-2-илметил)фосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-амино-(2-метокси)этилфосфоновую кислоту;
N-(2,3-диoкco-7-нитpo-l, 2,3,4-тeтpaгидpoxинoкcaлин-5-илмeтил)-2-амино-2-циклогексилэтилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-β-аминоизопропилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-2-аминоциклогексилфосфоновую кислоту;
N-(2,3-диoкco-7-нитpo-l, 2,3,4-тeтpaгидpoxинoкcaлин-5-илмeтил)-2-амино-2-метилпропилфосфоновую кислоту;
N-(2, 3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-аминобутилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-аминогептилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-3-фенилоксипропилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-2-этиламиноэтилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-бензиламиноэтилфосфоновую кислоту;
N-(2, 3-диoкco-7-нитpo-l, 2,3,4-тeтpaгидpoxинoкcaлин-5-илмeтил)-2-амино-2-п-толилэтилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-2-амино-2-(2-метоксифенил)этилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-2-(4-фторфенил)этилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-2-фенилэтилфосфоновую кислоту;
п-метил-N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-2-амино-2-фенилэтилфосфиновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-1-фенилэтилфосфоновую кислоту;
N-(2, 3-диoкco-7-нитpo-l, 2,3,4-тeтpaгидpoxинoкcaлин-5-илмeтил)-2-амино-1-(фуран-2-ил)этилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(4-фторфенил)этилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(4-метоксифенил)этилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(3-метоксифенил)этилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(2-хлорфенил)этилфосфоновую кислоту;
N-(2,3-диоксо-7-нитро-1,2,3,4-тетрагидрохиноксалин-5-илметил)-2-амино-1-(4-толил)этилфосфоновую кислоту;
{ 1-[(7-бромо-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-амино] циклопропил} фосфоновую кислоту;
N-бензил-N-(7-бром-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α -аминоэтилфосфоновую кислоту;
N-бензил-N-(7-хлор-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
N-бензил-N-(2,3-диоксо-7-фтор-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
N-(7-циано-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
N-(7-циано-2,3-диоксо-7-фтор-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-этиламиноэтилфосфоновую кислоту;
(R)-N-(7-трифторметил-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α -аминоэтилфосфоновую кислоту;
(S)-N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-аминоэтилфосфоновую кислоту;
(R)-N-(7-трифторметил-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)этилфосфоновую кислоту;
N-(7-трифторметил-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-β-(этиламино)этилфосфоновую кислоту;
(S)-N-(7-трифторметил-2,3-диоксо-1,2,3,4-тетрагидрохиноксалин-5-илметил)-α-(этиламино)этилфосфоновую кислоту;
(R)-N-(7-трифторметил-2,3-диоксо-1,2,3, 4-тетрагидрохиноксалин-5-илметил)-β-аминопропилфосфоновую кислоту;
(S)-N-(7-трифторметил-2,3-диоксо-1,2,3,4 -тетрагидрохиноксалин-5-илметил)-β-аминопропилфосфоновую кислоту;
N-(7-тpифтopмeтил-2,3-диoкco-1,2,3,4-тeтpaгидpoxинoкcaлин-5-илметил)аминометилфосфоновую кислоту и их соли.

в которой R1 обозначает гидрокси или алифатический, аралифатический либо ароматический остаток;
Х - двухвалентный алифатический, циклоалифатический, циклоалифатически-алифатический, аралифатический, гетероарилалифатический либо ароматический остаток;
R2 - водород или алифатический либо аралифатический остаток;
alk - (низш. )алкилиден;
R3, R4 и R5 независимо друг от друга - водород, (низш. )алкил, галоген, трифторметил, циано или нитро при условии, что al) R4 имеет значение, отличное от нитро, если Х - метилен, 3-гидроксибензилиден, 3-метоксибензилиден, 3-пиридилметилен, этилен, оксоэтилен, этилиден, 1,3-пропилен, 1,3-(1-карбокси)пропилен, циклопропилен или 1,4-бутилен, R1 - гидрокси, alk - метилен и R2, R3 и R5 - водород, или, если Х представляет собой метилен, R1 - метил или бензил, alk - метилен и R2, R3 и R5 - водород, или, если Х представляет собой бутилен, R1 - гидрокси, alk - метилен, R2 - метил и R3 и R5 - водород и б1) R4 имеет значение, отличное от брома, если Х - метилен или этилиден, R1 - гидрокси, alk - метилен и R2, R3 и R5 - водород,
и их солей, отличающийся тем, что из соединения формулы II
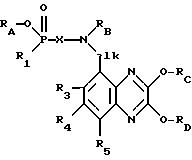
в которой RA обозначает водород или гидроксизащитную группу;
RB представляет собой одну из групп, указанных для R2, или аминозащитную группу;
радикалы RC и RD обозначают идентичные или разные гидроксизащитные группы;
R1, X, R2, alk, R3, R4 и R5 имеют указанные выше значения,
отщепляют гидроксизащитные группы Rc и RD, а также необязательно имеющуюся гидроксизащитную группу RA и необязательно имеющуюся аминозащитную группу RB и при необходимости полученное соответственно соединение переводят в другое соединение формулы I, получаемую по способу смесь изомеров разделяют на компоненты и предпочтительный в каждом случае изомер отделяют, и/или получаемое по способу свободное соединение переводят в соль, или же получаемую по способу соль переводят в соответствующее свободное соединение.

Комментарии