Физиологически активные бис-(диалкиламиды) фосфорилзамещенных 1,4-дикарбоновых кислот и способ их получения - RU2440361C1
Код документа: RU2440361C1
Описание
Настоящее изобретение относится к области органической химии и может быть использовано в медицине как новые физиологически активные вещества, в частности, обладающие нейропротекторной активностью.
Синтез новых соединений в ряду замещенных диамидов 1,4-дикарбоновых кислот является актуальной задачей, т.к. многие из них обладают различными видами биологической активности и могут найти применение в медицинской практике [В.О. Козьминых. Синтез и биологическая активность замещенных амидов и гидразидов 1,4-дикарбоновых кислот (обзор). Хим.-фарм. журнал. 2006. Т. 40. № 1. С. 9-17]. Наиболее подробно исследованы амиды и диамиды непредельных 1,4-дикарбоновых кислот, а также янтарной кислоты и ее гомологов.
Известно получение диалкиламидов α,ω-дикарбоновых кислот из соответствующих моноамидов, СО и аминов [M.C. Cesa, R.A. Dubbert, J.D. Burrington. 1,6 Hexanediamides from 3-pentenamides. EP 186 950]. Таким же способом получены наиболее близкие к заявляемым соединениям алкилзамещенные диамиды янтарной кислоты [J. Kadelka, H.-H. Schwarz, Process for the preparation of substituted succinic acid amides. US Pat. № 4 588 833].
Незамещенные диамиды янтарной кислоты получены также из соответствующего диэфира янтарной кислоты и аминов в спирте в присутствии алкоголятов щелочных металлов [V.P. Kucesky. Method of making amides of dimethylamine and piperazine. US Pat № 3 288 794].
Влияние гетероатомных заместителей в метиленовых фрагментах молекулы на биологическую активность практически не изучалось, т.к. методы синтеза таких соединений разработаны недостаточно.
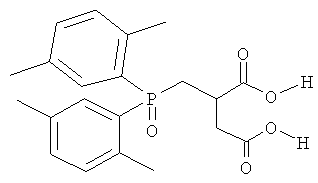
Известен способ получения лишь одного соединения из заявляемой группы бис-(диалкиламидов) фосфорилзамещенных 1,4-дикарбоновых кислот, а именно 1,4-бис-(дибутиламида) 2-(дифенилфосфинил)-янтарной кислоты. [А.Н. Туранов, В.К. Карандашев, А.Н. Яркевич, З.В. Сафронова, А.В. Харитонов, Н.И. Родыгина, А.М. Федосеев. Экстракция U(VI), Th(IV), Pu(IV), Am(III) и редкоземельных элементов из азотнокислых растворов оксидами дифенил(диалкилкарбамоилметил)фосфинов с заместителями в метиленовом мостике. Радиохимия. 2004. Т.46. Вып. 5. С. 427-432]. Было обнаружено, что полученное соединение проявляет экстракционные свойства.
Способ получения вышеупомянутого соединения, принятый нами за прототип, включает следующие операции: прибавление по каплям раствора гексабутилтриамидофосфита (Bu2N)3Р к суспензии 2-дифенилфосфинил-янтарной кислоты в толуоле и последующее нагревание реакционной смеси в течение 2 ч при кипении толуола, т.е. при 110°С. При этом в результате образуется смесь соединений, требующая разделения методом колоночной хроматографии, что в итоге позволяет получить целевое соединение с выходом около 40%.
Задачей настоящего изобретения является с одной стороны, расширение арсенала средств, обладающих физиологической активностью. С другой стороны, не менее важной задачей является разработка метода их синтеза, обеспечивающего получение таких соединений с высокими выходами.
Поставленная задача достигается за счет обнаружения группы бис-(диалкиламидов) фосфорилзамещенных 1,4-дикарбоновых кислот, представленных общей формулой (I),

в которой каждый заместитель R может быть прямой или разветвленный низший алкил, незамещенный или замещенный фенил, где заместителями фенильной группы выбраны из соединений: галогены в количестве от 1 до 5 атомов; низшие алкильные группы в количестве от 1 до 5 групп; низшие алкоксигруппы в количестве от 1 до 5 групп; диалкиламиногруппы в количестве от 1 до 5 групп; Y представляет прямую связь или метиленовую группу; заместитель R' может быть прямой или разветвленный низший алкил; обладающих нейропротекторными свойствами.
Авторами изобретения неожиданно было найдено, что заявляемые соединения общей формулы (I), содержащие широкий набор устойчивых фосфиноксидных фрагментов, благодаря обнаружению у них новых свойств, которые не вытекают из химической структуры этих соединений, могут найти применение в медицине в качестве нейропротекторных соединений.
Наиболее предпочтительными соединениями формулы (I) являются:
N1,N1,N4,N4-тетрабутилдиамид 2-(дифенилфосфинил)-янтарной кислоты;
N1,N1,N4,N4-тетрабутилдиамид 2-[(2-метилфенил)-фосфинил]-янтарной кислоты;
N1,N1,N4,N4-тетрабутилдиамид 2-[бис-(2,5-диметилфенил)-фосфинил]-янтарной кислоты;
Nl,Nl,N4,N4-тетрабутилдиамид 2-[бис-(4-диметиламинофенил)-фосфинил]-янтарной кислоты;
Nl,Nl,N4,N4-тетрабутилдиамид 2-[бис-(4-хлорфенил)-фосфинил]-янтарной кислоты;
N1,N1,N4,N4-тетрабутилдиамид 2-[бис-(4-метоксифенил)-фосфинил]-янтарной кислоты;
Nl,Nl,N4,N4-тетрабутилдиамид 2-(ди-н-бутилфосфинил)-янтарной кислоты;
N1,N1,N4,N4-тетрабутилдиамид 2-[бис-(4-метоксифенил)-фосфинилметил]-янтарной кислоты;
Nl,Nl,N4,N4-тетрабутилдиамид 2-[бис-(2,5-диметилфенил)-фосфинилметил]-янтарной кислоты;
N1,N1,N4,N4-тетраэтилдиамид 2-(дифенилфосфинилметил)-янтарной кислоты.
Еще одним аспектом изобретения является способ получения бис-диалкиламидов фосфорилзамещенных 1,4-дикарбоновых кислот общей формулы (I), позволяющий получать целевые соединения с выходом до 75-95%.
Отличие предлагаемого способа заключается в следующем. Заявитель обнаружил, что при проведении реакции в диапазоне температур 20-80°С в органических растворителях, выбранных из группы ароматических углеводородов или предельных углеводородов, образуются с высокими выходами лишь целевые продукты, а не смеси соединений, т.к. в этом диапазоне температур реакция не осложняется побочными процессами декарбоксилирования, однако протекает с достаточно высокой скоростью.
Этот метод является универсальным и может быть применен для синтеза всего ряда заявляемых соединений (схема 1):

Методы синтеза исходных фосфорилзамещенных 1,4-дикарбоновых кислот общей формулы (II) разработаны заявителем, и в настоящее время они являются доступными соединениями [А.Н.Яркевич, З.В.Сафронова, А.Н.Пушин, С.О.Бачурин, Н.С.Зефиров. Способ получения фосфорилированных 1,4-дикарбоновых кислот. Патент РФ 2405789 по заявке 2008129151. А.Н. Яркевич, З.В. Сафронова, А.Н. Пушин, С.О. Бачурин, Н.С. Зефиров. Способ получения солей фосфорилированных 1,4-дикарбоновых кислот. Патент РФ по заявке 2008129150. Решение о выдаче патента от 25.11.2010].
Гексаалкилтриамидофосфиты (R'2N)3P также являются известными соединениями, которые получают в промышленных масштабах из доступного сырья.
Общая методика синтеза бис-(диалкиламидов) фосфорилзамещенных 1,4-дикарбоновых кислот, представленных формулой (I), состоит в следующем.
Расчетное или взятое с избытком количество гексаалкилтриамидофосфита (R'2N)3P (III) прибавляют к раствору/суспензии фосфорилзамещенной 1,4-дикарбоновой кислоты в безводном растворителе и перемешивают реакционную массу при температуре 20-80°С до завершения реакции. Органический раствор промывают водой, высушивают Na2SO4 и растворитель удаляют в вакууме. Полученный маслообразный продукт перед проведением биологических испытаний дополнительно очищают хроматографированием на колонке силикагеля L 100/160 ммк, элюент - хлороформ или смесь бензол-ацетон 3:1, после чего вещества в большинстве случаев закристаллизовываются. Синтезированные соединения представляют собой устойчивые маслообразные или кристаллические вещества, хорошо растворимые в большинстве органических растворителей.
Приведенные ниже примеры иллюстрируют способ синтеза, заявляемый в настоящем изобретении и характеристики конкретных соединений, полученных заявляемым способом, но не ограничивают применение данного изобретения.
Пример 1. ПолучениеN1,N1,N4,N4-тетрабутилдиамида 2-(дифенилфосфинил)-янтарной кислоты [C6H5]2P(O)CH(CH2CONBu2)CONBu2 ( соединение1).
Раствор 1.08 г (0.0026 моль) гексабутилтриамидофосфита (Bu2N)3P в 2 мл безводного бензола прибавили по каплям к суспензии 0.96 г (0.0030 моль) 2-дифенилфосфинил-янтарной кислоты в 15 мл безводного бензола и нагревали смесь 1 ч при слабом кипении растворителя. Реакционную смесь промыли водой (3х7мл), высушили Na2SO4 и растворитель удалили в вакууме. Получили 1.45 г соединения (1) в виде масла, выход 90%. Продукт очистили хроматографированием на колонке силикагеля L 100/160 ммк. Хлороформом элюировали 1.30 г (80%) N1,N1,N4,N4-тетрабутилдиамида-2-(дифенилфосфинил)-янтарной кислоты в виде масла. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.84 м (12Н, 4CH3); 1.20 м (8H, 4CCH2CCN); 1.36 м (8H, 4CCCH2CN); 2.60 м, 1H и 3.00 м, 1Н (СН2СР); 3.16 м (8Н, 2CH2NCH2); 4.32 м (1Н, СНР); 7.50 м, 6Н, 7.86 м, 2Н и 8.06 м, 2Н (2C6H5). Спектр ЯМР31P (CDCl3, δ, м.д.): 31.97.
Пример 2. N1,N1,N4,N4-тетрабутилдиамид 2-[(2-метилфенил)-фосфинил]-янтарной кислоты [2-CH3C6H4]2P(O)CH(CH2CONBu2)CONBu2 (соединение 2)
Синтезировали аналогично соединению (1) из 0.83 г (0.002 моль) (Bu2N)3P и 1.04 г (0.003 моль) 2-[(2-метилфенил)-фосфинил]-янтарной кислоты. Получили 1.55 г соединения (2), выход 91%, масло. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.94 м (12Н, 4CH3); 1.28 м (8H, 4CCH2CCN); 1.44 м (8H, 4CCCH2CN); 2.48 с, 3Н и 2.56 с 3Н (2СН3-Ar); 3.04 м (4Н, CH2NCH2) и 3.40 м (4Н, CH2NCH2); 3.18 м, 1Н и 3.62 м, 1Н (СН2СР); 4.72 м (1Н, СНР); 7.12 м, 1Н, 7.10-7.90 м (8Н, 2С6Н4). Спектр ЯМР31P (CDCl3, δ, м.д.): 38.96.
Пример 3. N1,N1,N4,N4-тетрабутилдиамид 2-[бис-(2,5-диметилфенил)-фосфинил]-янтарной кислоты [2,5-(CH3)2C6H4]2P(O)CH(CH2CONBu2)CONBu2(соединение 3)
Синтезировали аналогично соединению (1) из 0.83 г (0.002 моль) (Bu2N)3P и 0.86 г (0.0023 моль) 2-[бис-(2,5-диметилфенил)-фосфинил]-янтарной кислоты. Получили 1.30 г соединения (3), выход 95%, масло. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.82 м (12Н, 4CH3); 1.20 м (8H, 4CCH2CCN); 1.36 м (8H, 4CCCH2CN); 2.22 с, 3H, 2.30 с, 6Н и 2.38 с, 3Н (4СН3-Ar); 2.50 м, 1Н и 3.50 м, 1Н (СН2СР); 2.96 м (4Н, CH2NCH2) и 3.32 м (4Н, CH2NCH2); 4.65 м (1Н, СНР); 7.10-7.60 м (6Н, 2С6Н3). Спектр ЯМР31P (CDCl3, δ, м.д.): 38.05.
Пример 4. N1,N1,N4,N4-тетрабутилдиамид 2-[бис-(4-диметиламинофенил)-фосфинил]-янтарной кислоты (4-Me2NC6H4)2P(O)CH(CH2CONBu2)CONBu2 (соединение 4)
Синтезировали аналогично соединению (1) из 0.83 г (0.002 моль) (Bu2N)3P и 0.97 г (0.0024 моль) 2-[бис-(4-диметиламинофенил)-фосфинил]-янтарной кислоты. Получили 1.25 г соединения (4), выход 83%, т. пл. 92°С. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.87 м (12Н, 4CH3); 1.25 м (8H, 4CCH2CC); 1.50 м (8H, 4CCCH2C); 2.60 м, 1Н и 2.90 м, 1Н (СН2СР); 3.00 с, (12Н, 2CH3NCH3); 3.20 м (8Н, 2CH2NCH2); 4.24 м (1Н, СНР); 6.70 м, 4Н и 7.72 м, 4Н (2С6Н4). Спектр ЯМР31P (CDCl3, δ, м.д.): 33.44.
Пример 5. N1,N1,N4,N4-тетрабутилдиамид 2-[бис-(4-хлорфенил)-фосфинил]-янтарной кислоты (4-ClC6H4)2P(O)CH(CH2CONBu2)CONBu2 (соединение 5)
Синтезировали аналогично соединению (1) из 0.83 г (0.002 моль) (Bu2N)3P и 0.97 г (0.0025 моль) 2-[бис-(4-хлорфенил)-фосфинил]-янтарной кислоты. Получили 1.40 г соединения (5), выход 92%, т. пл. 60°С. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.86 м (12Н, 4CH3); 1.20 м (8H, 4CCH2CCN); 1.40 м (8H, 4CCCH2CN); 2.65 м, 1Н и 2.95 м, 1Н (СН2СР); 3.08 м (4Н, CH2NCH2); 3.26 м (4Н, CH2NCH2); 4.30 м (1Н, СНР); 7.45 м, 4Н, 7.78 м, 2Н и 8.10 м, 2Н (2С6Н4). Спектр ЯМР31P (CDCl3, δ, м.д.): 30.73.
Пример 6. N1,N1,N4,N4-тетрабутилдиамид 2-[бис-(4-метоксифенил)-фосфинил]-янтарной кислоты [4-CH3OC6H4]2P(O)CH(CH2CONBu2)CONBu2 (соединение 6)
Синтезировали аналогично соединению (1) из 0.83 г (0.002 моль) (Bu2N)3P и 0.95 г (0.0025 моль) 2-[бис-(4-метоксифенил)-фосфинил]-янтарной кислоты. Получили 1.21 г соединения (6), выход 81%, масло. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.83 м (12Н, 4CH3); 1.18 м (8H, 2CCH2CH2C); 1.32 м (8H, 2CCH2CH2C); 2.58 м, 1Н и 3.12 м, 1Н (2H, СН2Р); 3.18 м (8Н, 2CH2NCH2); 3.85 м (6Н, 2CH3O); 4.26 м (1Н, СНР); 6.95 м, 4Н, 7.75 м, 2Н и 7.96 м, 2Н (2C6H4). Спектр ЯМР31P (CDCl3, δ, м.д.): 31.96.
Пример 7. N1,N1,N4,N4-тетрабутилдиамид 2-(ди-н-бутилфосфинил)-янтарной кислоты (n-C4H9)2P(O)CH(CH2CONBu2)CONBu2 (соединение 7)
Синтезировали аналогично соединению (1) из 0.43 г (0.0012 моль) (Bu2N)3P и 0.33 г (0.0012 моль) 2-(ди-н-бутил-фосфинил)-янтарной кислоты. Получили 0.59 г соединения (8), выход 98%, т. пл. 46°С. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.80 м (18Н, 6CH3); 1.20-1.80 м (28H, 6CCH2CH2CN+ CH2PCH2); 2.50 м, 1Н и 4.00 м, 1Н (СН2СР); 3.10-3.60 м (9Н, 2CH2NCH2 +СНР); Спектр ЯМР31P (CDCl3, δ, м.д.): 50.60.
Пример 8. N1,N1,N4,N4-тетрабутилдиамид 2-[бис-(4-метоксифенил)-фосфинилметил]-янтарной кислоты [4-CH3OC6H4]2P(O)CH2CH(CH2CONBu2)CONBu2 (соединение 8)
Синтезировали аналогично соединению (1) из 0.83 г (0.002 моль) (Bu2N)3P и 1.18 г (0.003 моль) 2-[бис-(4-метоксифенил)-фосфинилметил]-янтарной кислоты. Получили 1.70 г соединения (9), выход 92%, т. пл. 65°С. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.85 м (12Н, 4CH3); 1.00-1.58 м (16H, 4CCH2CH2C); 2.24-2.90 м (4H, СН2Р+СН2СО); 3.20 м (8Н, 2CH2NCH2); 3.56 м (1Н, СНСР); 3.80 с (6Н, 2СН3О); 6.90 м, 4Н и 7.68 м, 4Н (2C6H4). Спектр ЯМР31P (CDCl3, δ, м.д.): 31.38.
Пример 9. N1,N1,N4,N4-тетрабутилдиамид 2-[бис-(2,5-диметилфенил)-фосфинилметил]-янтарной кислоты [2,5-(CH3)2C6H4]2P(O)CH2CH(CH2CONBu2)CONBu2(соединение 9).
Синтезировали аналогично соединению (1) из 0.83 г (0.002 моль) (Bu2N)3P и 0.78 г (0.002 моль) 2-[бис-(2,5-диметилфенил)-фосфинилметил]-янтарной кислоты. Получили 1.04 г соединения (10), выход 85%, масло. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.85 м (12Н, 4CH3); 1.28 м (8H, 4CCH2CCN); 1.42 м (8H, 4CCCH2CN); 2.20 с, 2.22 с, 2.34 с и 2.36 с, 12Н (4СН3-Ar); 2.60-3.00 м (4Н, CH2CCH2); 3.18 м (4Н, CH2NCH2); 3.58 м (1Н, СНСР); 7.08 м 2H, 7.22 м, 2Н и 7.68 м, 2Н (6Н, 2С6Н3). Спектр ЯМР31P (CDCl3, δ, м.д.): 32.28.
Пример 10. N1,N1,N4,N4-тетраэтилдиамид 2-(дифенилфосфинилметил)-янтарной кислоты [C6H5]2P(O)CH2CH(CH2CONEt2)CONEt2 (соединение 10)
Синтезировали аналогично соединению (1) из 0.49 г (0.002 моль) (Et2N)3P и 0.65 г (0.002 моль) 2-(дифенилфосфинилметил)-янтарной кислоты. Получили 0.81 г N1,N1,N4,N4-тетраэтилдиамида 2-(дифенилфосфинилметил)-янтарной кислоты (11), выход 91%, т. пл. 116°С. Спектр ЯМР1Н (CDCl3, δ, м.д.): 0.90-1.10 м (12Н, 4CH3); 2.40-2.70 м и 2.85 м (4H, СН2Р+СН2СО); 3.06-3.42 м (8Н, 2CH2NCH2); 3.60 м (1Н, СНСР); 7.52 м, 6Н и 7.80 м, 4Н (2C6H4). Спектр ЯМР31P (CDCl3, δ, м.д.): 31.08.
Исследование физиологической активности заявляемых соединений на примере проявления ими нейропротекторной активности.
Нейропротекторное действие синтезированных веществ исследовано на Р2-фракции синаптосом коры мозга крыс, как удобной модели in vitro для оценки способности различных соединений влиять на захват ионов кальция в нервные окончания. В настоящем изобретении заявителем использован метод определения захвата45Са2+в синаптосомы коры мозга крыс при стимуляции глутаминовой кислотой.
Синаптосомы получали по стандартной методике Хайоша из коры мозга новорожденных крысят (9-10 дней) линии Вистар [Hajos F. // Brain Res., 1975, Vol. 93, N 3, P. 485-489]. Мозг гомогенизировали (стекло-тефлон) в 10 объемах охлажденной 0,32 М сахарозы (900 об/мин). Гомогенат центрифугировали 10 мин при 1500 g. Полученный супернатант центрифугировали 20 мин при 10000 g. Для аккумуляции радиоактивной метки Р2-фракцию синаптосом суспендировали в инкубационном буфере А: NaCl 132 мМ, KCl 5мМ, HEPES 5 мМ, глюкоза 10 мМ, pH 7,4 (концентрация белка 1,5-2 мг/мл). Концентрация Са2+ в конечном объеме составляла 1.25 мМ (1.4 мкКu/мл). Для стимуляции захвата45Са2+ в синаптосомы использовали 200 мкМ глутамат. Через 5 мин инкубации с глутаматом при 37°С захват45Са2+ останавливали фильтрованием через фильтры GF/B (Whatman, Англия), промывая три раза холодным буферным раствором Б: KCl 145 мМ, трис 10 мМ, трилон Б 5.4 мМ, pH 7.4 [Петрова Л.Н., Бачурин С.О. // Бюл. эксп. биол. и мед., 2006г., т.142, № 7, с. 51-54]. Пробы анализировали с помощью жидкостного сцинтилляционного бета-анализатора (Россия). Все опыты ставились в 3 параллельных пробах в 2-3 независимых экспериментах. Количество захваченного в синаптосомы45Са2+ определяли по разнице в содержании метки при стимуляции захвата глутаматом и без стимуляции агонистом и выражали в % от контроля (контроль принимали за 100%).
Специфический захват45Са2+определяли по следующей формуле:
К(43/21)= [(Са4 - Са3)/(Са2 - Са1)]·100%, где
Са1 - захват45Са2+ в контроле (без глутамата и тестируемого соединения),
Са2 - захват45Са2+в присутствии глутамата,
Са3 - захват45Са2+в присутствии тестируемого соединения (без глутамата),
Са4 - захват45Са2+в присутствии глутамата и тестируемого соединения.
Статистическую обработку результатов проводили по критерию Стьюдента.
Титрование веществ проводили при концентрации 100 мкМ. Соединения 1-9 которые оказывали ингибирующее действие на захват45Са2+ в синаптосомы коры мозга крыс, исследовали подробно при четырех различных концентрациях для определения параметра IC50 (концентрация вещества, при которой происходит 50%-ное ингибирование захвата кальция).
В Таблице 1 представлены данные по исследованию захвата45Са2+ в синаптосомы коры мозга крыс при стимуляции глутаматом в присутствии заявляемых бис-(диалкиламидов) фосфорилированных 1,4-дикарбоновых кислот (соединения 1-10) и ближайших структурных аналогов заявляемых соединений - фосфорилированных 1,4-дикарбоновых кислот и их эфиров (соединения 11-15), а также одноосновных функциональных аналогов - фосфорилированных амидов одноосновной уксусной кислоты (ацетамиды 16-18).
Как видно из приведенной таблицы, представители заявляемых соединений (соединения 1-10) в изученных концентрациях полностью или в значительной степени ингибируют захват кальция в синаптосомы мозга крыс при стимуляции глутаматом, что подтверждает их исключительные нейропротекторные свойства.
Определенные для соединений 1-10 значения IC50 также подтверждают высокую нейропротекторную активность заявляемых соединений.
Проведенные по стандартной методике определения значений LD50>100 мг/кг для соединений 1-10 позволяют отнести их к малотоксичным соединениям.
В отличие от заявляемых соединений (1-10), исследования их аналогов, демонстрируют лишь незначительное изменение уровня захвата кальция по сравнению с контролем (соединения 11-18).
Таким образом, проведенные исследования подтверждают, что авторами изобретения были обнаружены у заявляемой группы соединений новые неожиданные свойства, которые не вытекают из химической структуры этих соединений и ранее известных свойств.
Таблица 1.
Исследование захвата45Са2+ в синаптосомы коры мозга крыс при стимуляции глутаматом в присутствии бис-(диалкиламидов) фосфорилированных 1,4-дикарбоновых кислот (соединения 1-10) и их аналогов (соединения 11-18) .
Реферат
Изобретение относится к новым нейропротекторам, представляющим собой бис-диалкиламиды фосфорилзамещенных 1,4-дикарбоновых кислот формулы [I] и способу их получения из соответствующих кислот формулы [II]. ! ! где R - прямой или разветвленный низший алкил, незамещенный или замещенный фенил, где заместителями фенильной группы могут быть галогены в количестве от 1 до 5 атомов, низшие алкильные группы в количестве от 1 до 5 групп, низшие алкоксигруппы в количестве от 1 до 5 групп, диалкиламиногруппы в количестве от 1 до 5 групп; Y - прямая связь или метилен, R' - прямой или разветвленный низший алкил. Способ синтеза соединений формулы [I] отличается проведением реакции кислот формулы [II] с гексаалкилтриамидофосфитами общей формулы (R'2N)3P, где R' имеют вышеуказанные значения, в среде ароматических или предельных углеводородов в диапазоне температур 20-80°С. Предложены новые нейропротекторы и новый упрощенный способ их получения с хорошими выходами. 2 н. и 10 з.п. ф-лы, 1 табл.
Формула

в которой каждым заместителем R может быть прямой или разветвленный низший алкил, незамещенный или замещенный фенил, где заместителями фенильной группы могут быть галогены в количестве от 1 до 5 атомов, низшие алкильные группы в количестве от 1 до 5 групп, низшие алкоксигруппы в количестве от 1 до 5 групп, диалкиламиногруппы в количестве от 1 до 5 групп, Y представляет прямую связь или метиленовую группу, заместителем R' может быть прямой или разветвленный низший алкил.

в которой R и Y имеют значения, представленные в п.1, с гексаалкилтриамидофосфитами общей формулы (R'2N)3Р, в которой R' имеют значения, представленные в п.1, при нагревании в органическом растворителе, выбранном из ряда ароматических углеводородов или предельных углеводородов, отличающийся тем, что реакцию проводят в диапазоне температур 20-80°С.

















Комментарии