Металлоценовые соединения, способы их получения - RU2201935C2
Код документа: RU2201935C2
Описание
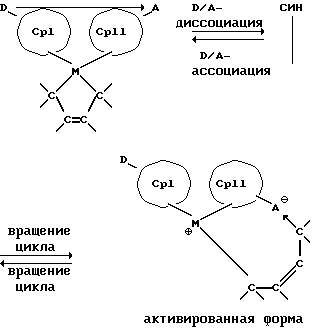
Данное изобретение касается металлоценовых соединений, в которых переходный металл комплексно связан с двумя анионными циклопентадиенильными лигандами (карбанионами) и
оба карбаниона связаны друг с другом, по крайней мере, одним мостиком, состоящим из донора и акцептора. Образующаяся между донорным (D) и акцепторным атомами (А) координационная связь создает в
донорной группе положительный (частичный) заряд, а в акцепторной группе - отрицательный (частичный) заряд:
Δ+D Δ-A
[донорная группа --> акцепторная группа].
Кроме того, изобретение касается способов получения подобных новых металлоценовых соединений.
Металлоцены и их применение в качестве катализаторов при полимеризации олефинов известны давно (заявка на европейский патент ЕР-А 129368 и цитированная там литература). Далее, из заявки на европейский патент ЕР-А '368 известно, что металлоцены в комбинации с системой алюминийалкил/вода в качестве сокатализаторов представляют собой эффективную систему для полимеризации этилена (так, например, из 1 моля триметилалюминия и 1 моля воды образуется метилалюмоксан (МАО). Уже с успехом использовались и другие стехиометрические соотношения (международная заявка WO 94/20506)). Также уже известны металлоцены, циклопентадиенильные кольца которых ковалентно связаны друг с другом мостиком. В качестве примера многочисленных патентов и заявок в этой области следует упомянуть заявку на европейский патент ЕР-А 704461, в которой упомянутая там связующая группа представляет собой замещенную метиленовую или этиленовую группу, силиленовую группу, замещенную силиленовую группу, замещенную гермиленовую группу или замещенную фосфиновую группу. В европейском патенте ЕР '461 в качестве катализаторов полимеризации для олефинов предусмотрены связанные мостиками металлоцены. Несмотря на многочисленные патенты и заявки в этой области, сохраняется желание улучшить катализаторы, отличающиеся высокой активностью, таким образом, чтобы количество катализатора, остающегося в полимере, могло быть незначительным и одновременно пригодным для полимеризации и сополимеризации олефинов в термопласты и в эластомерные продукты, а также для полимеризации и сополимеризации диолефинов, при необходимости, с олефинами.
Задачей данного изобретения является расширение арсенала высокоэффективных катализаторов на основе металлоценов.
Преимущество предлагаемых соединений формулы (I) заключается в том, что они получаются из мостиковых металлоценовых соединений, у которых мостиковое связывание обоих циклопентадиенилсодержащих лигандов создается одной, двумя или тремя донорно-акцепторными связями, в которых в каждом случае между донорным и акцепторным атомами образуется координационная или так называемая дативная связь, которая, по крайней мере, формально приобретает ионный характер. Обратимость донорно-акцепторной связи допускает, наряду с обозначенным стрелкой между D и А состоянием мостикового связывания, также и безмостиковое состояние, в котором обе π-системы вследствие свойственной им энергии вращения могут, например, поворачиваться на 360 угловых градусов по отношению друг к другу, не нарушая целостность металлического комплекса. После завершения полного поворота донорно-акцепторная связь снова "защелкивается". При наличии нескольких доноров и/или акцепторов такое "защелкивание" может происходить уже после поворота меньше, чем на 360 угловых градусов. Поэтому для того, чтобы охватить оба состояния связывания, металлоцены согласно изобретению изображаются только с помощью двойной стрелки и формульных блоков (Iа) и (Iб).
Поставленная задача решается металлоценовыми соединениями формулы (I)
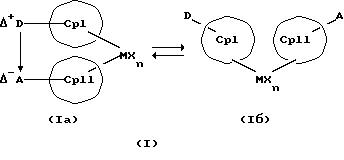
в которой
СрI и СрII представляют собой два одинаковых или различных карбаниона с циклопентадиенилсодержащей структурой, в которых атомы водорода, от одного до всех, могут быть замещены на одинаковые или различные остатки из группы линейного алкила с 1-20 атомами углерода или разветвленного алкила с 3-20 атомами углерода, которые однократно, или многократно, или исчерпывающе могут быть замещены галоидом, 1-3-кратно-фенилом, а также 1-3-кратно - винилом, арила с 6-12 атомами углерода, галоидарила с 6-12 атомами углерода, металлорганических заместителей, таких как силил, триметилсилил, ферроценил, а также могут быть однократно или двукратно замещены на D и А,
Δ+D означает донорную группу, где
D означает донорный атом, который может дополнительно нести заместители и который в данном состоянии связывания обладает, по меньшей мере, одной свободной электронной парой,
Δ-А означает акцепторную группу, где
А означает акцепторный атом, который может дополнительно нести заместители и который в данном состоянии связывания имеет дефицит электронной пары,
причем D и А связаны обратимой координационной связью такого типа, что донорная группа получает положительный или частичный положительный заряд, а акцепторная группа - отрицательный или частичный отрицательный заряд,
М означает переходный металл III, IV, V или VI подгруппы периодической системы элементов (Менделеева), включая лантаниды и актиниды,
Х означает анионный эквивалент и
n в зависимости от заряда М означает число ноль, один, два, три или четыре.
Кроме того, изобретение касается способов
получения металлоценовых соединений формулы (I), которые отличаются тем, что или подвергают взаимодействию друг с другом соединения формул (II) и (III)
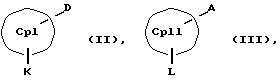
или соединения формул (IV) и (V)
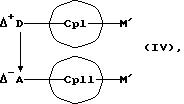
MXn+2, (V)
с отщеплением М'Х в присутствии апротонного растворителя или соединения формул (VI) и (VII)
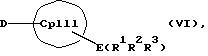
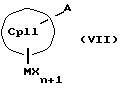
или соединения формул (VIII) и (IX)
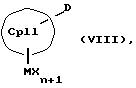

или соединения формул (X) и (V)
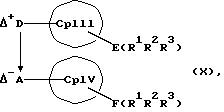
MXn+2, (V)
или соединения формул (XI) или (VI) и (V) в присутствии соединения формулы (XII) и (XIII)

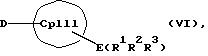
MXn+2 (V)
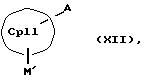

с отщеплением E(R1R2R3)X и F(R4R5R6)X в отсутствие или в присутствии апротонного растворителя, причем
CpI, CpII, D, A, M, X и n имеют вышеуказанное значение,
СрIII и CpIV представляют собой два одинаковых или различных незаряженных фрагмента молекулы с циклопентадиенсодержащей структурой, а CpI и CpII одинаковы,
M' означает катионный эквивалент (щелочноземельного) щелочного металла или Т1,
К означает M' (соединение XI), a L означает MXn+1 (соединение VII) или К означает MXn+1 (соединение VIII), а L означает M' (соединение XII),
Е и F независимо друг от друга каждый означает один из элементов Si, Ge или Sn
и
R1, R2, R3, R4, R5 и R6 независимо друг от друга каждый означает неразветвленный или разветвленный алкил с 1-20 атомами углерода, арил с 6-12 атомами углерода, а также арил с 6-12 атомами углерода, замещенный алкилом с 1-6 атомами углерода и алкил с 1-6 атомами углерода, замещенный арилом с 6-12 атомами углерода, винил, алкил или галоид,
причем, кроме того, в формулах (VI), (IX), (X) вместо E(R1R2R3) и F(R4 R5R6) может находиться водород, и в этом случае Х может также означать амидный анион типа R2N, или карбанион типа R3N, или алкоголятный анион типа RO, и причем, кроме того, соединения формул (II, где К означает М') или (VI) в присутствии соединений формул (III, где L означает М') или (IX) можно подвергать взаимодействию непосредственно с соединением переходного металла формулы (V). В дальнейшем два аниона могут быть связаны в дианион с возможным промежуточным образованием одноатомного или многоатомного мостика.
При реакции (VI) с (III, где L означает MXn+1) или (II, где К означает MXn+1) с (IX) или (X) с (V) по упомянутому последним варианту образуется структура (I) с отщеплением амина R2NH, или R2NE(R1R2R3), или R2NF(R4R5R6), либо углеводородного соединения формулы R3СН, или R3 CE(R1R2R3), или R3CF(R4R5R6), либо простого эфира ROE(R1R2R3), или ROF(R4R5R6), в которых органические остатки R являются одинаковыми или различными и независимо друг от друга каждый представляет собой алкил с 1-20 атомами углерода, арил с 6-12 атомами углерода, замещенный или незамещенный аллил, бензил или водород. Примерами отщепляющегося амина или углеводорода, простого эфира, силана, станнана или германа являются диметиламин, диэтиламин, ди-(н-пропил)-амин, ди-(изопропил)-амин, ди-(трет.-бутил)-амин, трет.-бутиламин, циклогексиламин, анилин, метилфениламин, ди-(аллил)-амин или метан, толуол, триметилсилиламин, тетраметилсилан и им подобные.
Также соединения формул (II, где К означает М') или (VI) можно подвергать взаимодействию непосредственно с соединением переходного металла формулы (V) в присутствии соединений формул (III, где L означает М') или (IX).
Кроме того, изобретение касается применения описанных металлоценовых соединений в процессе гомополимеризации или сополимеризации одного или нескольких олефинов, изоолефинов, алкинов или диолефинов в качестве мономеров или в процессе полиприсоединения с размыканием цикла в газовой фазе, в фазе раствора, в фазе высокого давления или в фазе суспензии при температуре от -60 до +250oС, предпочтительно до +200oС, и давлении от 0,5 до 5000 бар, предпочтительно от 1 до 3000 бар, и в присутствии или в отсутствие насыщенных или ароматических углеводородов или насыщенных или ароматических галоидоводородов и в присутствии или в отсутствие водорода, причем эти металлоценовые соединения используются в качестве катализаторов в количестве от 101 до 1012 моля каждого мономера на моль металлоцена и причем, кроме того, с ними можно работать в присутствии кислот Льюиса, кислот Бренстеда или кислот Персона, либо дополнительно в присутствии оснований Льюиса.
Такими кислотами Льюиса являются, например, бораны или аланы, такие как алкилы алюминия, галоидиды алюминия, алкоголяты алюминия, органические соединения бора, сложные эфиры борной кислоты, или соединения бора, или алюминия, которые содержат в качестве заместителей как остатки галоидидов, так и алкилы или арилы или остатки алкоголятов, а также их смеси или трифенилметильный катион. Особенно предпочтительными являются алюмоксаны или смеси содержащих алюминий кислот Льюиса с водой. В соответствии с современными представлениями, все кислоты действуют как ионизирующие агенты, которые способствуют образованию катиона металлоцения, заряд которого компенсируется объемным, плохо координирующим анионом.
Металлоценовые соединения формулы (I) согласно изобретению могут существовать как в мономерной, димерной, так и в олигомерной форме.
Металлоценовые соединения согласно изобретению могут отдельно применяться в качестве особо чистых веществ для (со)полимеризации. Однако можно также их получать и применять in situ в реакторе для (со)полимеризации известным специалисту способом.
Первый и второй карбанионы СрI и СрII с циклопентадиенильным кольцом могут быть одинаковыми или различными. Циклопентадиенильное кольцо может быть, например, из группы циклопентадиена, замещенного циклопентадиена, индена, замещенного индена, флуорена и замещенного флуорена. В качестве заместителей следует назвать от одного до четырех в циклопентадиеновом или наконденсированном бензольном кольце. Этими заместителями могут быть алкил с 1-20 атомами углерода, такой как метил, этил, пропил, изопропил, бутил или изобутил, гексил, октил, децил, додецил, гексадецил, октадецил, эйкозил, алкокси с 1-20 атомами углерода, такой, метокси, этокси, пропокси, изопропокси, бутокси или изобутокси, гексокси, октилокси, децилокси, додецилокси, гексадецилокси, октадецилокси, эйкозилокси, галоид, такой как фтор, хлор или бром, арил с 6-12 атомами углерода, такой как фенил, алкилфенил с 1-4 атомами углерода в алкильной части, такой как толил, этилфенил, изопропилфенил, изобутилфенил, трет.-бутилфенил, ксилил, галоидфенил, такой как фтор-, хлор-, бромфенил, нафтил или бифенилил, силил с тремя органическими остатками, такой как триметилсилил, ферроценил, а также D или А, такие как определено выше. Кроме того, наконденсированные ароматические кольца могут быть частично или полностью гидрированы так, что сохраняется только двойная связь, которая является общей как для наконденсированного, так и для циклопентадиенильного кольца. Бензольные кольца, кроме того, могут содержать одно или два дополнительных наконденсированных бензольных кольца, как в индене или флуорене. И еще помимо этого, циклопентадиеновое или циклопентадиенильное кольцо и наконденсированное бензольное кольцо могут совместно содержать дополнительное наконденсированное бензольное кольцо. Такие циклопентадиеновые кольца в виде анионов являются превосходными лигандами для переходных металлов, причем каждый циклопентадиенильный карбанион указанного незамещенного или замещенного типа компенсирует положительный заряд металла, находящегося в центре комплекса. Отдельными примерами таких карбанионов являются: циклопентадиенил, метил-циклопентадиенил, 1,2-диметил-циклопентадиенил, 1,3-диметил-циклопентадиенил, инденил, фенилинденил, 1,2-диэтил-циклопентадиенил, тетраметил-циклопентадиенил, этил-циклопентадиенил, н-бутил-циклопентадиенил, н-октил-циклопентадиенил, β-фенилпропил-циклопентадиенил, тетрагидроинденил, пропил-циклопентадиенил, трет.-бутил-циклопентадиенил, бензил-циклопентадиенил, дифенилметил-циклопентадиенил, триметилгермил-циклопентадиенил, триметилстаннил-циклопентадиенил, трифторметил-циклопентадиенил, триметилсилил-циклопентадиенил, пентаметил-циклопентадиенил, флуоренил, тетрагидрофлуоренил или октагидрофлуоренил, бензоаннелированные по шестичленному циклу флуоренилы и инденилы, N,N-димeтилaминo-циклопентадиенил, диметилфосфино-циклопентадиенил, метокси-циклопентадиенил, диметилборанил-циклопентадиенил, (N,N-диметиламинометил)-циклопентадиенил.
Наряду с обязательно имеющейся первой донорно-акцепторной связью между D и А, могут образоваться дополнительные донорно-акцепторные связи, если в качестве заместителей соответствующих циклопентадиеновых систем имеются дополнительные D и/или А. Все донорно-акцепторные связи отличаются изображенной выше обратимостью. В случае нескольких D или А они могут занимать различные из названных положений. В соответствии с этим, изобретение охватывает как мостиковые состояния молекул (Iа), так и безмостиковые состояния (Iб). Количество D- и А-групп может быть одинаковым или различным. В предпочтительном варианте СрI и СрII связаны только одним донорно-акцепторным мостиком.
Наряду с D/A-мостиками согласно изобретению могут также существовать ковалентные мостики. В этом случае D/A-мостики повышают пространственную жесткость и термостойкость катализатора. При чередовании замкнутой и разомкнутой D/A-связи становятся доступными цепи полимеров с более высокой и более низкой стереорегулярностью. Такие цепи у сополимеров могут иметь различные химические составы.
В качестве донорных групп используют, прежде всего, такие, у которых донорный атом D является элементом 5, 6 или 7 главной подгруппы периодической системы элементов (Менделеева) и имеет, по
меньшей мере, одну свободную электронную пару, причем донорный атом в случае элементов 5. главной подгруппы находится в состоянии связи с заместителями, а в случае элементов 6. главной подгруппы может
находиться в таком состоянии; донорные атомы 7 главной подгруппы не несут заместителей. Это поясняется на примере фосфора Р, кислорода О и хлора Сl в качестве донорных атомов, причем "зам." означают
подобные вышеупомянутые заместители, а "-Ср" представляет собой связь с пентадиенилсодержащим карбанионом, линия со стрелкой, которая в формуле (I) имеет указанное значение координационной связи, и
прочие линии означают имеющиеся электронные пары:
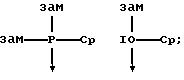

В качестве акцепторных групп прежде всего используют такие, акцепторный атом А которых является элементом 3 из главной подгруппы периодической системы элементов (Менделеева), таким как бор, алюминий, галлий, индий и таллий, находится в состоянии связи с заместителями и имеет дефицит электронов.
D и А связаны координационной связью, которую также называют дативной связью, причем D принимает положительный (частичный) заряд, а А -отрицательный (частичный) заряд.
Вследствие этого имеется различие между донорным атомом D и донорной группой или между акцепторным атомом А и акцепторной группой. Координационная D-->A-связь устанавливается между донорным атомом D и акцепторным атомом А. Донорная группа представляет собой единое целое из донорного атома D, возможно, имеющихся заместителей и из имеющихся электронных пар; соответственно, акцепторная группа представляет собой единое целое из акцепторного атома А, заместителей и имеющегося дефицита электронов.
Связь между донорным или акцепторным атомом и циклопентадиенил-содержащим карбанионом может быть прервана группами-спейсерами, то есть могут образоваться системы: D-спейсер-Ср или А-спейсер-Ср. В третьем из приведенных выше примеров формул =C(R)- представляет собой один такой спейсер между О и Ср. Спейсерами, например, являются: диметилсилил, диэтилсилил, ди(н-пропил)силил, диизопропилсилил, ди(н-бутил)силил, ди(трет.-бутил)силил, ди(н-гек-сил)силил, метилфенилсилил, этилметилсилил, дифенилсилил, ди(п-трет.-бутил-фенэтилсилил), н-гексилметилсилил, циклопентаметиленсилил, циклотетраметиленсилил, циклотриметиленсилил, диметилгерманил, диэтилгерманил, фениламино, трет.-бутиламино, метиламино, трет.-бутилфосфино, этилфосфино, фенилфосфино, метилен, диметилметилен (изопропилиден), диэтилметилен, этилен, диметилэтилен, диэтилэтилен, дипропилэтилен, пропилен, диметилпропилен, ди-этилпропилен, 1,1-диметил-3,3-диметилпропилен, тетраметилдисилоксан, 1,1,4,4-тетраметилдисилилэтилен, дифенилметилен. В предпочтительном варианте D или А связаны с циклопентадиенилсодержащим карбанионом без спейсера.
D или А независимо друг от друга могут находиться в циклопентадиеновом (циклопентадиенильном) кольце или в наконденсированном бензольном кольце или в другом заместителе колец СрI и СрII. В случае нескольких D или А они могут занимать различные из вышеупомянутых положений.
Заместителями у донорных атомов N, P, As, Sb, Bi, О, S, Se или Те и у акцепторных атомов В, AI, Ga, In или TI, например, являются: циклоалкил с 1-12 атомами углерода, такой как метил, этил, пропил, изопропил, циклопропил, бутил, изобутил, трет.-бутил, циклобутил, пентил, неопентил, циклопентил, гексил, циклогексил, изомерные гептилы, октилы, нонилы, децилы, ундецилы, додецилы; соответствующие им алкоксигруппы с 1-12 атомами углерода; винил, бутенил, аллил; арил с 6-12 атомами углерода, такой как фенил, нафтил или бифенилил, бензил, которые могут быть замещены галоидом, одной или двумя алкильными группами с 1-4 атомами углерода, алкоксигруппами с 1-4 атомами углерода, сульфонатом, нитрогруппой или галоидалкилгруппой, алкилкарбоксигруппой с 1-6 атомами углерода в алкильной части, алкилкарбонилом с 1-6 атомами углерода в алкильной части или цианогруппой (например, перфторфенил, м,м'-бис(трифторметил)-фенил, триалкилсилил с 1-20 атомами углерода в каждой алкильной группе, три-арилсилил с 6-12 атомами углерода в каждой арильной группе и аналогичные известные специалисту заместители); аналогичные арилоксигруппы; инденил; галоид, такой как фтор, хлор, бром и йод, 1-тиенил, дизамещенная аминогруппа, такая как диалкиламино с 1-12 атомами углерода в каждой алкильной группе, дифениламино, триалкилсилил с 1-12 атомами углерода в каждой алкильной группе, NаSО3-арил, такой как NаSО3-фенил и NаSO3-толил, фенилэтинил; алифатический и ароматический силил с 1-20 атомами углерода, алкильные заместители которого, наряду с вышеупомянутыми, дополнительно могут представлять собой октил, децил, додецил, стеарил или эйкозил, а арильные заместители - фенил, толил, ксилил, нафтил или бифенилил; такими замещенными силильными группами, которые связаны с донорным или с акцепторным атомом, например, являются (триметилсил)метил, алкил(фенил)амино с 1-12 атомами углерода в каждой алкильной части, (алкилнафтил)амино с 1-12 атомами углерода в каждой алкильной части, ди(алкилфенил)амино с 1-12 атомами углерода в каждой алкильной части, арилокси с вышеуказанными арильными группами с 6-12 атомами углерода, перфторалкил с 1-8 атомами углерода, перфторфенил. Предпочтительными заместителями являются: алкил с 1-6 атомами углерода, циклоалкил с 5-6 атомами углерода, фенил, толил, алкокси с 1-6 атомами углерода, арилокси с 6-12 атомами углерода, винил, аллил, бензил, перфторфенил, фтор, хлор, бром, диалкиламино с 1-6 атомами углерода в каждой алкильной группе, дифениламине.
Донорными группами являются такие, у которых свободная электронная пара локализована на N, P, As, Sb, Bi, О, S, Se, Те, F, Cl, Br, I; из них предпочтительными являются N, P, О, S. В качестве примеров донорных групп следует назвать: (CH3)2N-, (C2H5)2N-, (С3H7)2N-, (C4H9)2N-, (C6H5)2N-, (СН3)2Р-, (С2Н5)2Р-, (С3Н7)2Р-, (изо-С3Н7)2P-, (С4Н9)2Р-, (трет. -С4H9)Р-, (цикло-С6Н11)2Р-, (С6Н5)2Р-, (СН3)(С6Н5)Р-, (СН3О)2Р-, (С2Н5О)2Р-, (С6Н5О)2Р-, (СН3-С6Н4О)2Р-, ((СН3)2N)2P-, метилсодержащие фосфиногруппы, СН3О-, СН3S-, С6Н5S-, -С(С6Н5)=O, -С(СН3)=O, -OSi(СН3)3, -OSi(СН3)2-трет. -бутил, в которых N и Р несут по одной свободной электронной паре, а О и S - по две свободных электронных пары, причем в обоих упомянутых последними примерах дважды связанный кислород связан через группу-спейсер, а также через такие системы, как пирролидоновое кольцо, причем роль спейсера играют также отличные от N члены цикла.
Акцепторными группами являются такие, у которых не
хватает одной электронной пары у В, AI, Ga, In или TI, предпочтительно у В, AI или Ga; в качестве примеров следует назвать: (СН3)2В-, (С2Н5)2В-,
Н2В, (С6Н5)2В-,
(СН3)(С6Н5)В-, (винил)2В-, (бензил)2В-, Сl2В-, (СН3
О)2В-, Cl2Al-; (СН3)2А1-, (изо-С4Н9)2А1-, (С1)(С2Н5)А1-, (СН3)2Gа-, (С3Н7)2Gа-,
((CH3)3Si-CH2)2Ga-, (винил)2Gа-, (С6Н5)2Gа-, (СН3)2In-, ((СН3)3Si-СН2)2In-, (циклопентадиенил)2In.
Кроме того, используют такие донорные и акцепторные группы, которые
содержат хиральные центры или в которых два заместителя образуют цикл с D-или А-атомом. Примерами этого являются
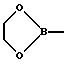
или
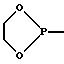
Предпочтительными донорно-акцепторными мостиками между СрI и СрII являются, например, следующие:

M означает переходный металл из 3, 4, 5 или 6 подгруппы периодической системы элементов (Менделеева), включая лантаниды и актиниды; к примеру, следует назвать: Se, Y, La, Sm, N, Lu, Ti, Zr, Hf, Th, V, Nb, Та, Cr. Предпочтительными являются Ti, Zr, Hf, V, Nb и Та.
При образовании металлоценовой структуры согласно вышеуказанной формуле (I) каждый положительный заряд переходного металла М компенсируется одним циклопентадиенилсодержащим карбанионом. Еще остающиеся на центральном атоме М положительные заряды насыщаются дополнительными, чаще всего, одновалентными анионами, два из которых, одинаковые или различные, также могут быть связаны друг с другом (дианионы


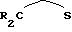

или

причем мостик имеет указанное выше значение. В дополнение к этому, особенно предпочтительными для компенсации заряда являются слабые или некоординирующие анионы вышеуказанного типа.
Активирование с помощью таких объемных анионов удается, например, путем взаимодействия D/A-металлоцена с трис-(пентафторфенил)-бораном, трифенилбораном, трифенилалюминием, тритил-тетракис-(пентафторфенил)-боратом или N, N-диалкилфениламмоний-тетракис-(пентафторфенил)-боратом или с соответствующими фосфониевыми или сульфониевыми солями боратов, или с солями (щелочноземельных) щелочных металлов, таллиевыми или серебряными солями боратов, карборанов, тозилатов, трифлатов, перфторкарбоксилатов, таких как трифторацетат, или с соответствующими кислотами. При этом предпочтительно используют D/A-металлоцены, анионный эквивалент которых Х представляет собой алкильную, арильную или бензильную группы. Такие производные можно также получать "in situ" таким образом, что D/A-металлоцены подвергают взаимодействию с другими анионными эквивалентами X, такими как фтор, хлор, бром, OR, NR2 и так далее, прежде всего, с алкиленом алюминия, литийорганическими соединениями этиленовой природы или соединениями Гриньяра, либо с алкиленом цинка или свинца. Получаемые из них продукты взамодействия можно активировать вышеназванными боранами или боратами без предварительного выделения.
Индекс n, в зависимости от заряда переходного металла М, принимает значение ноль, один, два, три или четыре, предпочтительно ноль, один или два. Вышеуказанные металлы побочных групп в зависимости, в частности, от их принадлежности к побочным группам, могут принимать значения валентностей зарядов именно от двух до шести, предпочтительно от двух до четырех, два из которых в каждом случае компенсируются карбанионами металлоценового соединения. Согласно этому, в случае La+3 индекс n принимает значение один, а в случае Zr4+ - значение два; у Sm2+ n равно нулю.
В способе получения металлоценовых соединений формулы (I) можно подвергать взаимодействию друг с другом или по одному соединению вышеуказанных формул (II, где К означает М') и (III, где L означает MXn+1), или по одному соединению вышеуказанных формул (II, где К означает MXn+1) и (III, где L означает М'), или по одному соединению вышеуказанных формул (IV) и (V), или по одному соединению вышеуказанных формул (VI) и (III, где L означает MXn+1), или по одному соединению вышеуказанных формул (II, где К означает MXn+1) и (IX), или по одному соединению вышеуказанных формул (X) и (V) с выделением или отщеплением соединений: щелочной металл-Х, щелочноземельный металл-Х2, силил-Х, гермил-Х или НХ в апротонном растворителе при температурах от -78 до +120oС, предпочтительно от -40 до +70oС, и молярном соотношении (II, где К означает М'):(III, где L означает MXn+1) или (II, где К означает MXn+1):(III, где L означает М'), или (IV):(V), или (VI):(III, где L означает MXn+1), или (II, где К означает MXn+1):(IX), или (X):(V) 1:0,5-2, предпочтительно 1: 0,8-1,2, особенно предпочтительно 1:1. В случаях взаимодействия (VI) с (III, где L означает MXn+1), или (II, где К означает MXn+1) с (IX), или (X) с (V) можно отказаться от апротонного растворителя, если (VI), (IX) или (X) в условиях реакции является жидким. Примерами таких выделяющихся или отщепляемых соединений являются: хлориды таллия и лития, бромид, фторид и иодид лития, хлорид и бромид натрия, хлорид и фторид калия, хлорид и бромид магния, хлорид и фторид кальция, триметилхлорсилан, триэтилхлорсилан, три-(н-бутил)-хлорсилан, трифенилхлорсилан, триметилхлоргерман, триметилхлорстаннан, диметиламин, диэтиламин, дибутиламин и другие соединения из вышеприведенного примера замещения, известные специалисту.
Таким образом, соединения формулы (II, где К означает М') или (II, где К означает MXn+1) представляют собой карбанионы с циклопентадиенильным кольцом, которые содержат 1-3 ковалентно связанные донорные группы, используемые для образования D/A-мостиковой связи, а в качестве противоиона для отрицательного заряда циклопентадиенильного кольца содержат катион. Соединения формулы (VI) являются незаряженными циклопентадиеновыми кольцами с 1-3 донорными группами, также используемыми для образования D/A-мостиковой связи, но с легко отщепляемыми уходящими группами E(R1R2 R3), такими как силил-, германил- или станнил-группы или водород, вместо ионных групп.
Второй компонент для образования металлоценовых соединений согласно изобретению, а именно соединение формулы (III, где L означает MXn+1) или (III, где L означает М'), также представляет собой карбанион с циклопентадиенильным кольцом, который является одинаковым или различным с циклопентадиенильным кольцом соединения (II, где К означает М') или (II, где К означает MXn+1), однако вместо донорных групп он несет 1-3 акцепторные группы, используемые для образования D/A-мостиковой связи. Соответственно, соединения формулы (IX) являются незаряженными циклопентадиеновыми кольцами с 1-3 используемыми для образования D/A-мостиковой связи акцепторными группами и с также легко отщепляемыми уходящими группами F(R4R5R6).
Абсолютно аналогичным образом соединения формул (IV) или (X) представляют собой исходные вещества с заранее образованной D*А-связью, которые означают карбанионы-противокатионные соединения или незаряженные циклопентадиеновые кольца с в совокупности возможными 1-3 D А-связями, и которые реакцией с соединениями формулы (V) дают металлоценовые соединения (I).
Оба исходных вещества способа согласно изобретению, а именно (II, где К означает М') и (III, где L означает MXn+1), или (II, где К означает MXn+1) и (III, где L означает М'), или (IV) и (V), или (VI) и (III, где L означает MXn+1), или (II, где К означает MXn+1) и (IX), или (X) и (V) спонтанно реагируют при их соединении с одновременным образованием донорно-акцепторной группы D- А- или комплексированием катиона металла М с отщеплением М'Х, или E(R1R2R3)X, или F(R4R5R6)X, или НХ. При изображении донорно-акцепторной группы заместители у D и А для наглядности опускали.
М' является катионным эквивалентом (щелочноземельного) щелочного металла, такого как литий, натрий, калий, 1/2 Mg, 1/2 Ca, 1/2 Sr, 1/2 Ва, или таллий.
Растворители для способа согласно изобретению являются апротонными, полярными или неполярными, такими как алифатические и ароматические углеводороды или алифатические и ароматические галоидуглеводороды. В принципе, используют также и другие апротонные растворители, известные специалисту, однако в целях упрощения обработки такие растворители со слишком высокими температурами кипения являются менее предпочтительными. Типичными примерами растворителей являются: н-гексан, циклогексан, пентан, гептан, петролейный эфир, толуол, бензол, хлорбензол, метиленхлорид, диэтиловый эфир, тетрагидрофуран, простой диметиловый эфир этиленгликоля.
Исходные вещества формул (II, где К означает М'), (III, где L означает MXn+1), (II, где К означает MXn+1) и (III, где L означает М') для способа согласно изобретению могут быть получены известными в литературе способами или способами-аналогами. Так, например, аналогично описанному в J. of Organometallic Chem. , (1971), 29, 227, распространенный триметилсилил-циклопентадиен сначала подвергается взаимодействию с бутиллитием и затем - с триметилсилилхлоридом с образованием бис(триметилсилил)-циклопентадиена. Его можно снова подвергать взаимодействию с трихлоридом бора (аналогично описанному в J. of Organometallic Chem., (1979), 169, 327), который в заключение можно подвергать взаимодействию с тетрахлоридом титана с образованием трихлорида дихлорборилциклопентадиенилтитана аналогично описанному в J. of Organometallic Chem., (1979), 169, 373. Это названное последним соединение уже представляет собой прототип соединений формулы (III, где L означает MXn+1); его можно далее селективно подвергать взаимодействию с триметилалюминием, причем оба атома хлора, связанные с атомом бора, замещаются метальными группами, и при этом образуется еще одно соединение формулы (III, где L означает MXn+1). Аналогично описаниям способа в J. Am. Chem. Soc., (1983) 105, 3882 и в Organometallics, (1982), 1, 1591 распространенный реагент циклопентадиенилталлий можно подвергать взаимодействию с хлордифенилфосфином и далее - с бутиллитием, при этом получают прототип соединений формулы (II, где К означает М').
В качестве дополнительного примера следует упомянуть образование диметилстаннил-дифенилфосфин-индена путем взаимодействия индена сначала с бутиллитием, как это уже указано выше, и затем - с хлордифенилфосфином; дальнейшее превращение, сначала вновь с бутиллитием и затем - с хлортрибутилоловом, приводит к упомянутому соединению, которое в результате последующего взаимодействия с тетрахлоридом циркония приводит к образованию трихлорида дифенилфосфино-инденил-циркония как представителя соединений формулы (II, где К означает MXn+1). Подобные синтезы и способы получения известны специалисту, работающему в области химии металлоорганических и элементоорганических соединений и опубликованы в многочисленных литературных источниках, из которых выше в качестве примеров приведены лишь некоторые.
Металлоценовые соединения согласно изобретению исключительно пригодны в качестве катализаторов в процессах гомо- и сополимеризации одного
или нескольких олефинов с 2-40 атомами углерода или для сополимеризации одного или нескольких олефинов с 2-40 атомами углерода с одним или несколькими изоолефинами с 4-8 атомами углерода, алкиненами с
2-8 атомами углерода или диолефинами с 4-8 атомами углерода в газовой фазе, в фазе раствора, в массовой фазе, в фазе высокого давления или в фазе суспензии при температуре от -60 до +250oС
и давлении от 0,5 до 5.000 бар, причем с ними можно работать в присутствии или в отсутствие линейных и разветвленных насыщенных, или ароматических, или алкилзамещенных ароматических углеводородов с
4-20 атомами углерода, либо насыщенных или ароматических галоидуглеводородов с 2-10 атомами углерода. Подобные процессы полимеризации можно осуществлять в одном или нескольких реакторах в
периодическом режиме или, предпочтительно, непрерывно. "В случае нескольких реакторов или реакционных зон можно работать в различных условиях полимеризации. На моль металлоценовых соединений
подвергают превращению от 101 до 1012 молей (со)мономера. Металлоценовые соединения согласно изобретению можно использовать вместе с сокатализаторами. Количественное соотношение
между металлоценовым соединением и сокатализатором составляет от 1 до 100.000 молей сокатализатора на моль металлоцена. Сокатализаторами являются, например, алюмоксановые соединения. Под ними понимают
такие соединения формулы (XIV),
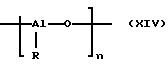
в которой
R означает алкил с 1-20 атомами углерода, арил с 6-12 атомами углерода или бензил и
n означает число от 2 до 50, предпочтительно от 10 до 35.
Точно так же можно использовать смесь различных алюмоксанов или смесь их предшественников (алкилов или галоидидов алкилалюминия) в комбинации с водой (в газообразной, жидкой, твердой или связанной форме, приблизительно, как кристаллизационная вода). Воду можно вводить также в виде (остаточной) влаги полимеризационной среды, мономера или носителя, такого как силикагель.
Выходящие за пределы квадратных скобок формулы (XIV) связи в качестве концевых групп олигомерных алюмоксанов содержат R-группы или АIR2-группы. Такие алюмоксаны, как правило, существуют в виде смеси нескольких из них с различной длиной цепи. Точные исследования выявили также алюмоксаны с циклической или корзиночной структурой. Алюмоксаны являются распространенными соединениями. В частном случае, когда R означает метил, речь идет о метилалюмоксанах (МАО).
Другими сокатализаторами являются алкилы алюминия, алкилы лития или магнийорганические соединения, такие как соединения Гриньяра или частично гидролизованные борорганические соединения. Предпочтительными сокатализаторами являются алюмоксаны.
Активирование сокатализатором или создание объемного некоординирующего или слабо координирующего аниона можно осуществлять в автоклаве или в отдельном реакционном сосуде (предварительное получение). Активирование может происходить в присутствии или в отсутствие одного или нескольких подлежащих полимеризации мономеров. Активирование можно осуществлять в алифатическом, или ароматическом, или галоидированном растворителе или суспендирующем агенте, либо на поверхности катализатора-носителя.
Металлоценовые соединения и алюмоксаны можно применять не только как таковые в гомогенной форме, но и по отдельности или вместе в гетерогенной форме на носителях. При этом материал носителя может быть неорганической или органической природы, таким как силикагель, окись алюминия, хлорид магния, хлорид натрия, производные целлюлозы, крахмал и полимеры. При этом на носитель можно вначале помещать как металлоценовое соединение, так и алюмоксан, и в каждом случае вслед за этим добавлять остальные компоненты. Равным образом можно активировать металлоценовые соединения алюмоксаном и в гомогенной и гетерогенной форме и после этого активированное металлоценовое соединение помещать на носитель.
Носители предпочтительно подвергают предварительной термической и/или химической обработке для того, чтобы установить определенное содержание воды или определенную концентрацию ОН-групп или удерживать их по возможности низкими. Предварительная химическая обработка может, например, заключаться во взаимодействии носителя с алкилом алюминия. Перед использованием неорганических носителей их обычно нагревают от 100 до 1000oС в течение 1-100 часов. Величина поверхности такого неорганического носителя, в частности, из кремнезема (SiO2), находится между 10 и 1000 м2/г, предпочтительно между 100 и 800 м2/г. Диаметр частиц находится между 0,1 и 500 мкм, предпочтительно между 10 и 200 мкм.
Подлежащими превращению путем гомо- и сополимеризации олефинами, изоолефинами, алкинами и диолефинами являются, например,
этилен, пропилен, бутен-1, изобутен, пентен-1, гексен-1, октен-1, 3-метилбутен-1, 3-метилпентен-1, 4-метилгексен-1, 1,3-бутадиен, изопрен, 1,4-гексадиен, 1,5-гексадиен и 1,6-октадиен, хлоропрен,
ацетилен, метилацетилен. С α,ω-δ и олефинами можно, кроме того, проводить циклизующую полимеризацию, при которой, например, из 1,5-гексадиена образуется поли-(метилен-1,
3-циклопентан):
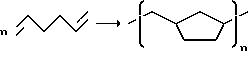
Если при этом использовать триалкилсилил-замещeнные α,ω-δ и олефины, можно путем аналогичного полимеризации превращения дополнительно ввести функциональную группу. Такие олефины и диолефины могут быть далее замещены, например, фенилом, замещенным фенилом, галоидом, этерифицированной карбоксильной группой, группой ангидрида кислоты; соединениями такого типа являются, например, стирол, метилстирол, хлорстирол, фторстирол, инден, 4-винилбифенил, винилфлуорен, винилантрацен, метилметакрилат, этилакрилат, винилсилан, триметилаллилсилан, винилхлорид, винилиденхлорид, тетрафторэтилен, изобутилен, винилкарбазол, винилпирролидон, акрилонитрил, простой виниловый эфир и сложный виниловый эфир. Кроме того, возможны реакции полиприсоединения с размыканием цикла согласно изобретению, например, лактонов, таких как ε-капролактон или δ -валеролактон, или лактамов, таких как ε-капролактам. Предпочтительными мономерами являются: этилен, пропилен, бутен, гексен, октен, 1,5-гексадиен, 1,6-октадиен, метилметакрилат, ε -капролактон, δ-валеролактон и ацетилен. Можно осуществлять упомянутые сополимеризации в присутствии водорода, примерно до установления молярных масс.
Осуществляемые с металлоценовыми соединениями согласно изобретению гомо- или сополимеризации или полиприсоединения проводятся в адиабатических или в изотермических условиях в области приведенных температур и давлений. При этом речь идет о способе высокого давления в автоклавах или в трубчатых реакторах, о способе в растворе, а также о полимеризации в массе, о способе в фазе суспензии в реакторах с мешалкой или в петлевых реакторах, а также о способе в газовой фазе, причем давление для фазы суспензии, фазы раствора и газовой фазы не выходит за пределы 65 бар. Подобные полимеризации можно также осуществлять в присутствии водорода. Все эти способы давно известны и специалисту знакомы. Металлоценовые соединения согласно изобретению обладают тем преимуществом, что путем подбора заместителей они могут быть получены как в растворимой форме, которая может быть нанесена на носители, так и в нерастворимой форме. Растворимые металлоценовые соединения применяют для автоклавного способа и способа в растворе; гетерогенные металлоценовые соединения применяют, например, в газовой фазе.
Благодаря донорно-акцепторному мостику металлоценовые соединения согласно изобретению делают возможным раскрытие обоих циклопентадиенильных колец определенным образом по типу "клюва", причем наряду с высокой активностью гарантированы высокая стереоселективность, контролируемое распределение молекулярной массы и типовое внедрение сомономеров. Вследствие определенного раскрытия циклов по типу "клюва" имеется также место для объемного сомономера. Высокая однородность в распределении молекулярной массы является, кроме того, следствием единого и конкретного места происходящей путем вставки (внедрения) полимеризации (катализатор с одним типом активных центров).
D/A-Структура может вызывать экстра-стабилизацию катализаторов относительно высоких температур, так что катализаторы можно также применять в области высоких температур от 80 до 250oС, предпочтительно от 80 до 180oС. Возможная термическая диссоциация донорно-акцепторной связи является обратимой и благодаря этому процессу самоорганизации и механизму самовосстановления приводит к особо высокоценным свойствам катализатора. Термическая диссоциация делает, например, возможным целенаправленное расширение распределения молекулярной массы, благодаря чему полимеры лучше поддаются обработке. Этот эффект наступает также при таких катализаторах, при которых СрI и СрII соединены одной ковалентной связью и одним D/A-мостиком. D/A-Металлоценовые структуры согласно изобретению делают, например, возможным недостижимый с помощью классических катализаторов объем бездефектного полиэтиленового образования. Соответственно, полимеризаты этилена могут иметь чрезвычайно высокие температуры плавления, например, выше 135-160oC (максимум кривой по методу дифференциальной сканирующей калориметрии (ДСК)). Такие линейные полиэтилены, которые образуются непосредственно в процессе полимеризации и имеют температуры плавления от 140 до 160oС (максимум ДСК-кривой), предпочтительно от 142 до 160oС, особенно предпочтительно от 144 до 160oС, являются новыми. Такие новые высокоплавкие полиэтилены по сравнению с известными полиэтиленами обнаруживают, например, улучшенные механические свойства и теплостойкость (стерилизуемость при применении в медицине) и благодаря этому открывают возможности применения, которые до настоящего времени для полиэтилена казались невозможными и были осуществимы, например, только с использованием высокотактического полипропилена. Другими отличительными показателями являются высокие энтальпии плавления и высокие молярные массы полиэтилена.
Хотя в широком интервале температур происходит снижение молярной массы полиэтилена при повышении температуры полимеризации, значительного снижения активности не происходит, и полиэтилены с высокими молярными массами и высокими температурами плавления продолжают представлять технический интерес.
Далее, было обнаружено, что металлоценовые соединения согласно изобретению с подходящей симметрией вызывают у подходящих мономеров региоспецифическую (изотактическую, синдиотактическую) полимеризацию, однако в верхней части вышеуказанного температурного интервала инициируют у подобного мономера возрастающее неспецифическое атактическое связывание мономерных единиц. Это явление полностью еще не изучено, однако в соответствии с наблюдением можно утверждать, что координационные связи, которые приобретают ионный характер, такие как донорно-акцепторные связи, в металлоценовых соединениях согласно изобретению проявляют возрастающую обратимость при более высокой температуре. Так, например, при сополимеризации этилена и пропилена было установлено, что при одинаковом составе исходной смеси сомономеров при более низкой температуре полимеризации образуется сополимер с высоким содержанием пропилена, в то время как с повышением температуры полимеризации содержание пропилена уменьшается до тех пор, пока, наконец, при более высокой температуре образуется полимер с преобладающим содержанием этилена.
Обратимую диссоциацию и ассоциацию D/A-структуры и, возможно, происходящую вследствие этого встречную ротацию Ср-колец можно схематично изобразить следующим
образом:

Другое ценное свойство металлоценовых соединений согласно изобретению заключается в возможности самоактивации и в связи с этим - в отказе от дорогих сокатализаторов, прежде всего, в случае дианионных

Место связи между переходным металлом М и водородом или замещенным, или незамещенным углеродом, например, еще связанным углеродом показанного на примере формулы бутадиендиильного дианиона, является затем местом внедрения олефина для полимеризации.
Кроме того, предназначенные для применения π-комплексные или металлоценовые соединения согласно изобретению пригодны для получения как термопластических, так и эластомерных полимеризатов различными, указанными выше способами, причем являются доступными как высококристаллические полимеры с оптимальной областью плавления, так и аморфные полимеры с оптимальной температурой стеклования.
Примеры
Все реакции проводят в строго
анаэробных условиях с применением техники Шленка или высоковакуумной техники. Используют сухие и насыщенные аргоном растворители. Химические сдвиги δ приведены в м.д. относительно
соответствующего стандарта:1H (тетраметилсилан),13С (тетраметилсилан),31Р(85% Н3РO4),11В (эфират бортрифторида - 18,1 м.д.).
Отрицательные значения означают сдвиг в более высокое поле.
Пример 1
Бис-(триметилсилил)-циклопентадиен (соединение 1)
В реакционную колбу вносят 14,7 г (0,106 моля)
триметилсилил-циклопентадиена (фирмы Fluka) и 150 мл тетрагидрофурана (ТГФ), охлаждают до 0oС и в течение 20 минут прибавляют по каплям 47,4 мл раствора бутиллития в н-гексане (2,3 М; общее
количество 0,109 моля). По окончании прибавления желтый раствор перемешивают еще один час, после чего охлаждение убирают, раствор перемешивают еще один час при комнатной температуре и охлаждают до
-20oС. Затем прибавляют по каплям в течение 10 минут 14,8 мл (0,117 моля) триметилсилилхлорида и реакционную смесь перемешивают два часа при -10oС. Затем охлаждение убирают,
реакционный раствор нагревают до комнатной температуры с последующим перемешиванием в течение еще одного часа. Реакционную смесь фильтруют через целит, фильтр промывают гексаном и от объединенных
фильтратов гексан удаляют в вакууме. Из сырого продукта после перегонки при 26oС под давлением 0,4 мбар получают 19 г чистого соединения 1 (85% от теории). Температура кипения и данные
ЯМР-спектра соответствуют литературным данным (J. Organometallic Chem. , 29 (1971), 227; там же 30 (1971), С57; J. Am. Chem. Soc. , 102 (1980), 4429; J. Gen. Chem. USSR, Eng. Transl., 43 (1973), 1970;
J. Chem. Soc., Dalton Trans., 1980, 1156.
1Н-ЯМР (400 мГц), (дейтер. бензол) δ: 6,74 (м., 2Н), 6,43 (м., 2Н), -0,04 (с., 18Н).
Пример 2
Триметилсилил-циклопентадиенил-дихлорборан (соединение 2)
В круглодонную колбу, снабженную охлаждающей баней с сухим льдом, вносят 16 г (0,076 моля) соединения 1. 8,9 г (0,076 моля)
Трихлорида бора конденсируют в трубке Шленка при -78oС, после чего прибавляют по каплям в течение 5 минут в круглодонную колбу. Реакционную смесь медленно в течение 1 часа нагревают до
комнатной температуры и затем выдерживают еще два часа при температуре до 55-60oС. Все летучие соединения удаляют в вакууме (3 мм Hg = 4 мбар). Последующей перегонкой при 39oС и
давлении 0,012 мбар выделяют 14,1 г соединения 2 (85% от теории).
1H-ЯМР-спектр соответствует литературным данным и показывает, что получен ряд изомеров (см. J.Organometallic Chem. 169 (1979), 327).
11В-ЯМР (64,2 мГц), (дейтер. бензол) δ: +31,5.
Пример 3
Дихлорборанил-циклопентадиенил-титантрихлорид (соединение
3)
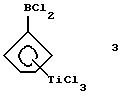
В трубку Шленка объемом 250 мл помещают 11,4 г (0,052 моля) соединения 2 и 100 мл метиленхлорида. Полученный раствор охлаждают до -78oС и прибавляют к нему по каплям в течение 10 минут 9,8 г (5,6 мл, 0,052 моля) тетрахлорида титана. Полученный красный раствор медленно нагревают до комнатной температуры и перемешивают еще 3 часа. Растворитель удаляют в вакууме и получают продукт грязно-желтого цвета. К сырому твердому веществу приливают 200 мл гексана, полученный желтый раствор фильтруют и в течение ночи охлаждают в холодильнике; получают 12,3 г (79% от теории) соединения 3 в виде желтых кристаллов. Следует указать на то, что в работе, описанной в J.Organometallic Chem. 169 (1979), 373, был получен выход 62% от теории, причем реакцию проводили в углеводородном растворителе, таком как петролейный эфир или метилциклогексан.
1Н-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 7,53 (т., J=2,6 Гц, 2Н), 7,22 (т., J=2,6 Гц, 2Н).11B-ЯМР (64,2 мГц), (дейтер. метиленхлорид) δ: +33.
Пример
4
Диметилборанил-циклопентадиенил-титантрихлорид (соединение 4)
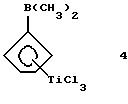
В круглодонной колбе растворяют 2,37 г (0,079 моля) соединения 3 в 100 мл гексана. Полученный раствор охлаждают до 0oС и добавляют к нему по каплям 4 мл 2М раствора триметилалюминия (0,008 моля) в толуоле. По окончании добавления охлаждение убирают и все летучие компоненты удаляют в вакууме. Остающееся твердое вещество желтого цвета растворяют в пентане, твердые компоненты отфильтровывают, а прозрачный фильтрат охлаждают до -78oС; при этом получают 1,5 г (74% от теории) соединения 4. Следует отметить, что в J. Organometallic Chem., 169 (1979), 373 сообщается о выходе 87% от теории, причем в качестве алкилирующего средства использовали тетраметилолово; однако оказалось невозможным получить соединение 4 без примеси образующегося хлорида триметилолова.
1Н-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 7,48 (т., J=2,5 Гц, 2Н), 7,23 (т. , J=2,5 Гц, 2Н), 1,17 (с., 6Н).11В-ЯМР (64,2 мГц), (дейтер. метиленхлорид) δ: +56.
Пример 5
Дифенилфосфин-циклопентадиенил-литий (соединение 6)
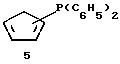

В колбу объемом 500 мл загружают 50 г (0,186 моля) циклопентадиенил-таллия (фирмы Fluka) и 300 мл диэтилового эфира. Суспензию охлаждают до 0oС и прибавляют к ней по каплям в течение 10 минут 34,2 мл (0,186 моля) дифенилхлорфосфина. Затем суспензию нагревают до комнатной температуры, перемешивают в течение одного часа и фильтруют через фритту. Растворитель отгоняют в вакууме и выделяют 39,5 г (85% от теории) промежуточного продукта, дифенилфосфино-циклопентадиена, соединения 5. Затем 18,6 г (0,074 моля) соединения 5 разбавляют толуолом и охлаждают до 0oС. К полученному раствору в течение 10 минут прибавляют 33,2 мл 2,24 М раствора бутиллития (0,074 моля) в гексане. После нагревания до комнатной температуры и перемешивания в течение 2 часов из желтого раствора выпадает осадок, который отфильтровывают и промывают толуолом и затем - гексаном. После высушивания в вакууме получают 13,2 г соединения 6 (70% от теории) в виде коричневатого порошка (см. J. Am. Chem. Soc. , 105 (1983), 3882; Organometallics, 1 (1982), 1591).
1Н-ЯМР (400 мГц), (дейтер. тетрагидрофуран) δ: 7,3 (м., 4Н), 7,15 (м., 6Н), 5,96 (м., 2Н), 5,92 (м., 2Н).31Р-ЯМР (161,9 мГц), (дейтер. тетрагидрофуран) δ: -20.
Пример 6
Бис-(циклопентадиенил)-титандихлорид, содержащий дифенилфосфино-диметилборанил-мостиковую связь (соединение 7)

В круглодонную колбу вносят 0,36 г (0,00139 моля) соединения 6 и 20 мл толуола. Образующийся раствор охлаждают до -20oС и прибавляют к нему по каплям в течение 20 минут раствор 0,36 г (0,00139 моля) соединения 4 в 20 мл толуола. По окончании прибавления раствор нагревают в течение 2 часов до комнатной температуры и перемешивают при этой температуре еще 1 час. Нерастворимое вещество отделяют фильтрацией через фритту, а растворитель отгоняют в вакууме. Затем красное маслянистое твердое вещество промывают гексаном, который декантируют, твердое вещество снова сушат в вакууме и получают 0,28 г (42% от теории) соединения 7 в виде красного порошка.
1H-ЯМР (300 мГц), (дейтер. метиленхлорид) δ: 7,6-7,3 (уш.м., 10Н), 6,92 (м. , 2Н), 6,77 (м., 4Н), 6,60 (м., 2Н), 0,29 (д., Jрн=19 Гц, 6Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 17,1 (уш.).11В-ЯМР (64,2 мГц), (дейтер. метиленхлорид) δ: -29 (уш.).
Пример 7
Трибутилстаннил-дифенилфосфино-инден (соединение 8)
В круглодонную колбу вносят 10 г (0,086 моля) индена, разбавляют 200
мл диэтилового эфира и охлаждают до -20oС. К полученному раствору прибавляют 36 мл 2,36 М раствора бутиллития (0,085 моля) в н-гексане, причем раствор тотчас принимает
желтую окраску.
Охлаждение убирают, реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение еще одного часа. После этого охлаждают до 0oС и добавляют 19 г (15,9 мл, 0,086 моля)
дифенилхлорфосфина, что приводит к образованию осадка. Охлаждение снова убирают, раствору дают нагреться до комнатной температуры, после чего перемешивают в течение еще одного часа. Затем раствор
снова охлаждают до -20oС и прибавляют к нему по каплям 36 мл (0,085 моля) бутиллития в н-гексане. По окончании прибавления охлаждение снова убирают, и температура снова поднимается до
комнатной, после чего раствор перемешивают еще 1,5 часа. Затем снова охлаждают до 0oС и добавляют по каплям 28 г (0,086 моля) хлорида трибутилолова. Полученную суспензию нагревают до
комнатной температуры и перемешивают еще 1,5 часа, после чего фильтруют через фритту и растворитель удаляют в вакууме. Выделяют 46,9 г (92% от теории) соединения 8 в виде тяжелого желтого масла.
1H-ЯМР (400 мГц), (дейтер. хлороформ) δ: 7,5-7,3 (м., 6Н), 7,28 (уш. с., 6Н), 7,14 (псевдо дт, 7,3 Гц/1,0 Гц, 1Н), 7,8 (т., J=7,3 Гц, 1Н), 6,5 (уш. м., 1Н), 4,24 (уш. с., 1Н), 1,4-1,25 (м., 6Н), 1,25-1,15 (м., 6Н), 0,82 (т., J=7,2 Гц, 9Н), 0,53 (т., J=8 Гц, 6Н).31Р-ЯМР (161,9 мГц), (дейтер. хлороформ) δ: -20,6.
Пример 8
Дифенилфосфино-инденил-цирконийтрихлорид (соединение 9)
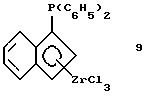
Раствор 37 г (0,0628 моля) соединения 8 в 300 мл толуола прибавляют в течение 3 часов при комнатной температуре к суспензии 14,6 г тетрахлорида циркония (99,9%-ный, 0,0628 моля, фирмы Aldrich) в 100 мл толуола. Образующийся раствор тотчас приобретает красный цвет, который медленно переходит в оранжевый и, наконец, в желтый. После 4-часового перемешивания желтый осадок отфильтровывают и промывают сначала толуолом и затем - гексаном. Твердое вещество сушат в вакууме и получают 15,3 г (50% от теории) соединения 9 в виде свободно текучего желтого порошка. Выход сразу повышается до величины более 70%, если работают при более низкой температуре, например, 30 минут при -30oС и 5 часов при 0oС. Продукт реакции можно далее очищать вымыванием остающегося соединения олова в экстракторе Сокслета с использованием пентана (время экстракции: 8 часов).
Пример 9
Инденил-циклопентадиенил-цирконийдихлорид, содержащий дифенилфосфинодихлорборанил-мостиковую связь (соединение 10)
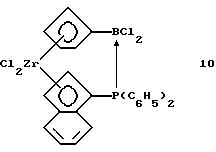
В трубку Шленка помещают 4,43 г (0,089 моля) очищенного соединения 9 в 100 мл толуола. К полученной суспензии прибавляют 1,95 г (0,0089 моля) соединения 2. Желтую суспензию перемешивают 6 часов при комнатной температуре, образующийся беловатый осадок выделяют фильтрацией и определяют, что он практически чистый. Получают 4,1 г, 75% от теории соединения 10.
1Н-ЯМР (500 мГц), (дейтер. метиленхлорид) δ: 7,86 (псевдо ддд, J= 8,5/2,5/1 Гц, 1Н), 7,75-7,55 (м., 10Н), 7,35 (псевдо ддд, J=8,5/6,9/0,9 Гц, 1Н), 7,32 (уш. т., J=3,1 Гц, 1Н), 7,22 (псевдо ддд, J=8,8/6,8/1,1 Гц, 1Н), 7,06 (псевдо ддд, J=3,4/3,4/0,8 Гц, 1Н), 6,92 (м., 1Н), 6,72 (м., 1Н), 6,70 (уш. м, 1Н), 6,61 (псевдо к, J= 2,3 Гц, 1Н), 6,53 (уш.д., 8,57 Гц, 1Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 6,2 (уш.м.).11B-ЯМР (64,2 мГц), (дейтер. метиленхлорид) δ: -18(уш.).
Пример 10
Инденил-циклопентадиенил-цирконийдихлорид, содержащий дифенилфосфино-диметилборанил-мостиковую связь (соединение 11)

К 1,5 г (0,00247 моля) соединения 10) из примера 9 приливают 50 мл толуола. Полученную суспензию охлаждают до 0oС и в течение 5 минут добавляют к ней по каплям 1,2 мл 2 М раствора триметилалюминия (0,0024 моля) в гексане. По окончании добавления охлаждение убирают и раствору дают нагреться комнатной температуры в течение двух часов при перемешивании. Выпадающий осадок отфильтровывают, из фильтрата растворитель отгоняют в вакууме и выделяют 0,37 г, (26% от теории) соединения 11 в виде коричневатого твердого вещества.
31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 14,6.11В-ЯМР (64,2 мГц), (дейтер. метиленхлорид) δ: -28.
Пример 11
Триметилсилил-инден (соединение 12)

В круглодонную колбу, содержащую 100 мл тетрагидрофуран и охлажденную до 0oС, вносят 25 мл индена (0,213 моля, перегнанного в вакууме над гидридом кальция). В течение 20 минут добавляют по каплям 94 мл 2,3 М раствора бутиллития (0,216 моля) в гексане. По окончании добавления перемешивают 20 минут, затем нагревают до комнатной температуры и перемешивают еще 30 минут. После охлаждения до -20oС прибавляют по каплям 27,5 мл (0,216 моля) триметилхлорсилана, при этом образуется слегка мутный оранжевый раствор. Через 1 час перемешивания при -10oС и 1,5ч - при 0oС нагревают до комнатной температуры и растворитель удаляют в вакууме. После повторного растворения в гексане отфильтровывают хлорид лития, а гексан удаляют в вакууме. Перегонка продукта реакции (0,045 мбар, 58-60oС) приводит к получению 26,6 г (66% от теории)соединения 12.
1Н-ЯМР (400 мГц), (дейтер. хлороформ) δ: 7,49 (т., J=7,6 Гц,1Н), 7,28 (ддд, J= 7,3/7,2/1 Гц, 1Н), 7,21 (ддд, J=7,3/7,3/1,1 Гц, 1Н), 6,96 (дд, J= 5,6/1,2 Гц, 1Н), 6,69 (дд, J=5,3/1,8 Гц, 1Н), 3,56 (с., 1Н), 0,0 (с., 9Н).
Пример 12
Бис-(триметилсилил)-инден
(соединение 13)
В круглодонную колбу, содержащую 100 мл тетрагидрофурана и охлажденную до 0oС, вносят 25,4 г (0,135 моля) соединения 12. В течение 20 минут добавляют 59 мл 2,3 М
раствора бутиллития (0,136 моля) в гексане. По окончании добавления перемешивают 20 минут, затем нагревают до комнатной температуры. После перемешивания в течение 30 минут охлаждают до -20o
С и прибавляют по каплям 17,3 мл (0,136 моля) триметилхлорсилана, при этом образуется слегка мутный оранжевый раствор. Перемешивают 1 час при 0oС и 1 ч при комнатной температуре, после чего
растворитель удаляют в вакууме. После повторного растворения в гексане хлорид лития отфильтровывают, а гексан удаляют в вакууме. Получают 32 г (90% от теории) соединения 13 в виде масла. См. J.
Organometal. Chem. , 23, (1970), 407; там вместо тетрагидрофурана использован гексан.
1Н-ЯМР (400 мГц), (дейтер. хлороформ) δ: 7,62 (д., J=7,6 Гц,1Н), 7,52 (д. , J= 7, 5 Гц,1Н), 7,23 (ддд, J=7,35/7,3/0,9 Гц, 1Н), 6,9 (д., J=1,7 Гц, 1Н), 3,67 (д., J=1,6 Гц, 1Н). 0,38 (с., 9Н), 0,0 (с., 9Н).
Пример 13
Триметилсилил-дихлорборанил-инден
(соединение 14)
Аналогичным способом, как при получении соединения 2, в круглодонную колбу, охлажденную до -30oС и снабженную охлаждаемым сухим льдом обратным холодильником, вносят
12,3 г (0,047 моля) соединения 13. Сюда же добавляют 5,6 г (0,046 моля) трихлорида бора. По окончании добавления охлаждение убирают, реакционной смеси дают нагреться до комнатной температуры и
перемешивают 3 часа. Затем в течение 6 часов температуру повышают до 55oС. После охлаждения и удаления летучих компонентов в вакууме получают сырой продукт. Перегонкой в высоком вакууме
выделяют очищенный продукт реакции, основной изомер которого идентифицируют следующим образом:
1Н-ЯМР (200 мГц), (дейтер. хлороформ) δ: 8,3 (д., J=7 Гц, 1Н), 8,1 (д., J= 1,8
Гц, 1H), 7,5 (дд, J=7,0/1,2 Гц, 1Н), 7,4 (м., 3Н), 4,0 (д., J=1,8 Гц, 1Н), 0,1 (с., 9Н).11В-ЯМР (64,2 мГц), (дейтер. метиленхлорид) δ: 38 (уш.).
Пример 14
Бис-(инденил)-цирконийдихлорид, содержащий дифенилфосфино-дихлорборанил-мостиковую связь (соединение 15)
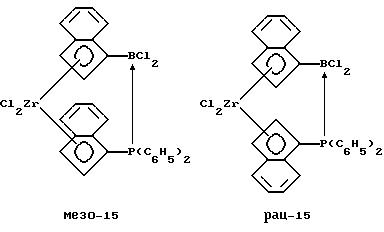
К суспензии 8,3 г (0,017 моля) соединения 9 в 200 мл толуола прибавляют 4,5 г (0,017 моля) соединения 14, смесь нагревают до 50oС и перемешивают 5 часов. После охлаждения и фильтрации приливают 200 мл гексана, после чего из прозрачного желтого раствора выпадает осадок, который отфильтровывают и сушат в вакууме. Согласно рентгеноструктурному анализу продукт реакции идентифицируют как мезо-изомер соединения 15. Определяют, что длина Р-->В-связи составляет 2,01
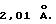
Пример 15
N,N-Диметил-0-(метилсульфонил)-гидроксиламин (соединение 16)
(CH3)2NOSO2CH3 16
В 70 мл
метиленхлорида, содержащего 20 г (0,2 моля) триэтиламина, суспендируют 9,0 г (0,092 моля) гидрохлорида N,N-диметил-0-гидроксиламина и охлаждают до -10oС. К охлажденной суспензии медленно,
по каплям прибавляют 9,5 г (0,083 моля) метилсульфонилхлорида, растворенного в 70 мл метиленхлорида. По окончании прибавления перемешивают 1 час, после чего приливают ледяную воду и отделяют
органическую фазу. Водную фазу промывают эфиром. Промывной эфир и метиленхлоридную фракцию объединяют, сушат над сульфатом натрия и растворитель удаляют в вакууме при -10oС. Выделяют 5,9 г
(46% от теории) соединения 16 в виде масла, которое хранят при -20oС. См. Angew. Chem. Int. Ed. Engl., 17 (1978), 687.
1H-ЯМР (400 мГц), (дейтер. хлороформ) δ: 3,03 (с., 3Н), 2,84 (с., 6Н).
Пример 16
N,N-Диметиламино-циклопентадиенил-литий (соединение 17)
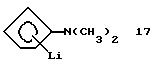
Раствор 3 г (0,0042 моля) циклопентадиениллития в 30 мл тетрагидрофурана медленно, при -30oС прибавляют к раствору 5,9 г (0,042 моля) соединения 16 в 20 мл тетрагидрофурана. Затем смесь нагревают до -20oС и перемешивают 30 минут, после чего при этой же температуре добавляют 1,8 мл 2,3 М раствора бутиллития (0,042 моля) в гексане. Образующийся осадок отфильтровывают и промывают 2 раза по 20 мл гексана. После высушивания в вакууме получают 2,0 г (40% от теории) соединения 17 в виде белого порошка. См. Angew. Chem. Int. Ed. Engl., 19 (1980), 1010.
1H-ЯМР (400 мГц), (тетрагидрофуран) δ: 5,34 (уш.д., J=2,2 Гц, 2Н), 5,15 (уш.д., J=2,2 Гц, 2Н), 2,56 (с., 6Н).
Пример 17
Бис-(циклопентадиенил)-титандихлорид, содержащий диметиламино-диметилборанил-мостиковую связь (соединение 18)
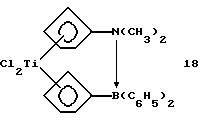
Раствор 0,18 г (0,7 ммоля) соединения 4 в 10 мл толуола прибавляют в течение 10 минут при -20oС к суспензии 0,081 г (0,7 ммоля) соединения 17 в 10 мл толуола, при этом образуется раствор глубокого красного цвета. После подогревания в течение 2 часов до комнатной температуры раствор фильтруют и растворитель удаляют в вакууме. После повторного растворения образующегося красного порошка в 10 мл теплого толуола и отфильтровывания нерасторимого вещества раствор выдерживают в течение ночи в холодильнике; при этом образуется 0,1 г (43% от теории) соединения 18 в виде красных игл.
1H-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 6,85 (т., J=2,3 Гц, 2Н), 6,15 (т. , J=2,3 Гц, 2Н), 6,1 (т.. J=2,8 Гц, 2Н), 5,57 (т., J=2.8 Гц, 2Н), 1,98 (с., 2Н), 0,35 (с., 6Н).11В-ЯМР (64,2 мГц), (дейтер. метиленхлорид) δ: 2,8 (уш.).
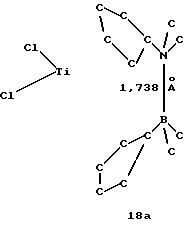
Формула 18а показывает результат рентгеноструктурного анализа.
Пример 18
Трибутилстаннил-диизопропилфосфино-инден (соединение 19)
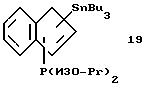
В круглодонную колбу, содержащую 3,8 г (0,033 моля) индена, приливают 100 мл эфира и охлаждают до -20oС. К полученному раствору прибавляют в течение 5 минут добавляют 14,4 мл 2,3 М раствора бутиллития (0,033 моля) в гексане, при этом образуется желтый раствор. После снятия охлаждения раствор нагревают до комнатной температуры и перемешивают 1,5 часа. Затем охлаждают до 0oС и добавляют 5,0 г (0,033 моля) хлордиизопропилфосфина, в результате чего выпадает осадок. После снятия охлаждения раствор нагревают до комнатной температуры, перемешивают 1 час, затем охлаждают до -20oС и прибавляют по каплям 14,4 мл 2,3 М раствора бутиллития (0,033 моля) в гексане. По окончании добавления охлаждение убирают, раствор медленно нагревают до комнатной температуры и перемешивают 1,5 часа. После охлаждения до 0oС прибавляют по каплям 10,1 г (0,031 моля) хлорбутилолова. Образующуюся суспензию нагревают до комнатной температуры и перемешивают 1,5 часа. Эфир удаляют в вакууме, а сырой продукт реакции снова растворяют в гексане, фильтруют и фильтрат сушат в вакууме; получают 16,6 г (97% от теории) соединения 19 в виде тяжелого желтого масла. Идентифицируют 2 изомера в соотношении 1,5:1. Основной изомер идентифицируют следующим образом:
1H-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 7,71 (д., J=7,2 Гц,1Н), 7,41 (д. , J=7,3 Гц,1Н), 7,13 (м., 2Н), 6,96 (м., 1Н), 4,28 (с. с примесью соединений олова, 1Н), 2,21 (м., 1Н), 1,54 (м., 1Н), 1.45-0,65 (м., 39Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: -11,3. Побочный изомер идентифицируют следующим образом:1Н-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 7,6 (д., J=7,4 Гц,1Н), 7,46 (д., J=7,2 Гц,1Н), 7,26 (т., J=7,5 Гц, 1Н), 7,1 (м. , 1Н), 6,71 (м. , 1Н), 3,48 (м., 1Н), 2,21 (м., 1Н), 1,54 (м., 1Н), 1,45-0,65 (м., 39Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: -11,5.
Пример 19
Диизопропилфосфино-инденил-цирконийтрихлорид (соединение 20)

Раствор 15,0 г (0,029 моля) соединения 19 в 50 мл толуола прибавляют при -78oС к суспензии 6,7 г (0,029 моля) 99, 9%-ного тетрахлорида циркония в 300 мл толуола. По окончании прибавления реакционную смесь перемешивают 0,5 часа при -30oС и 4 часа при 0oС. Образующийся желтый осадок отфильтровывают и промывают толуолом и гексаном. Твердое вещество сушат в вакууме и получают 8,8 г (71% от теории) соединения 20 в виде свободно текучего желтого порошка. Порошок очищают удалением остающихся соединений олова путем экстракции введенным при кипении с обратным холодильником толуолом в течение 3 часов при давлении 40 мбар с последующей очисткой пентаном в течение 2 часов в экстракторе Сокслета. Вследствие нерастворимости образующегося соединения1H-ЯМР-спектр не получен.
Пример 20
Инденил-циклопентадиенил-цирконийдихлорид, содержащий
диизопропилфосфино-дихлорборанил-мостиковую связь (соединение 21)
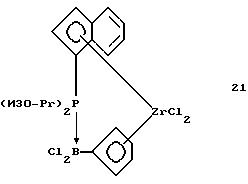
В трубку Шленка помещают 0, 52 г (0,0012 моля) соединения 20 и 30 мл толуола. К этой суспензии в течение 5 минут прибавляют 0,27 г (0,0012 моля) соединения 2. Желтую суспензию перемешивают 3 часа при комнатной температуре, при этом образуется слегка мутный раствор. Осадок отделяют фильтрацией, упариванием светло-желтого толуольного фильтрата в вакууме выделяют 0,47 г (87% от теории) продукта реакции в виде беловатого твердого вещества.
1Н-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 7,84 (псевдо dd, J==8,5, 0,8 Гц, 1Н), 7,73 (д., J=8,8 Гц, 1Н), 7,5 (псевдо дт, J=7,8, 0,8 Гц, 1H), 7,38 (м. , 2Н), 6,98 (м., 1Н), 6,67 (м., 1H), 6,64 (м., 1H), 6,54 (м., 1H), 6,29 (м. . 1H), 3,39 (септет, J=7,1 Гц, 1H), 2,94 (м, 1H), 1,68 (дд, JH-P= 18,1 Гц. J= 7,2 Гц, 3Н), 1,64 (дд, JH-P=17,4 Гц, J=7,2 Гц, 3Н), 1,45 (дд, JH-P= 15 Гц, J=7,2 Гц, 3Н), 1,33 (дд, JH-P=14,6 Гц, J=7,3 Гц, 3Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 23,1 (уш.м.).11В-ЯМР (80 мГц), (дейтер. метиленхлорид) δ: -14,8 (уш.д., J=110 Гц).
Пример 21
Трибутилстаннил-диметилфосфино-инден (соединение 22)
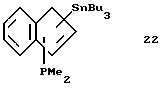
В круглодонную колбу, содержащую 5,5 г (0,047 моля) индена, приливают 150 мл эфира и охлаждают до -20oС. К полученному раствору прибавляют за 5 минут 20,8 мл 2,3 М раствора бутиллития (0,048 моля) в гексане, при этом раствор окрашивается в желтый цвет. Охлаждение убирают, раствор нагревают до комнатной температуры и перемешивают в течение 1 часа. После охлаждения реакционной смеси до -30oС прибавляют в течение 20 минут 4,6 г (0,048 моля) хлордиметилфосфина в 30 мл эфира, при этом выпадает осадок. После 2-часового перемешивания при -20oС прибавляют по каплям 20,8 мл 2,3 М раствора бутиллития (0,048 моля) в гексане. По окончании прибавления охлаждение убирают, раствор медленно нагревают до комнатной температуры и перемешивают 1,5 часа. После охлаждения суспензии до 0oС прибавляют по каплям 15,6 г (0,048 моля) хлортрибутилолова. Образующуюся суспензию нагревают до комнатной температуры и перемешивают 1,5 часа. Эфир удаляют в вакууме, а сырой продукт реакции снова растворяют в гексане, фильтруют и фильтрат концентрируют и сушат в вакууме; получают 17,4 г (78% от теории) соединения 22 в виде тяжелого желтого масла.
1H-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 7,67 (д., J=7,5 Гц,1Н), 7,47 (д. , J=7,4 Гц, 1Н), 7,18 (м., 2Н), 6,83 (м., 1Н), 4,28 (с. с примесью соединений олова, 1Н), 1,43-0,78 (м., 33Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: -61,6.
Пример 22
Диметилфосфино-инденил-цирконийтрихлорид (соединение 23)

К суспензии 8,5 г (0,036 моля) 99,9%-ного тетрахлорида циркония в 200 мл толуола прибавляют при -78oС раствор 17,0 г (0,037 моля) соединения 22 в 50 мл толуола. По окончании прибавления реакционную смесь перемешивают 0,5 часа при -30oС и 4 часа при 0oС. Образующийся желтый осадок отфильтровывают и промывают толуолом и гексаном. Твердое вещество сушат в вакууме и получают 8,3 г (61% от теории) соединения 23 в виде свободно текучего желтого порошка. Порошок очищают путем удаления остающихся соединений олова экстракцией вводимым при кипении толуолом в течение 3 часов при давлении 40 мбар и затем - пентаном в течение 2 часов в экстракторе Сокслета; получают 7,2 г (выход 53% от теории) продукта реакции. Вследствие нерастворимости этого соединения его1H-ЯМР-спектр не получен.
Пример 23
Инденил-циклопентадиенил-цирконийдихлорид, содержащий диметилфосфино-дихлорборанил-мостиковую связь (соединение 24)
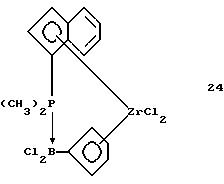
В трубку Шленка помещают 30 мл толуола и 0,55 г (0,0015 моля) соединения 23. К полученной суспензии в течение 5 минут прибавляют 0,31 г (0,0014 моля) соединения 2. Желтую суспензию перемешивают 6,5 часов при комнатной температуре, при этом образуется слегка мутный раствор. Осадок отделяют фильтрацией, из светло-желтого толуольного фильтрата растворитель удаляют в вакууме и выделяют продукт реакции в виде беловатого твердого вещества. После его промывания гексаном и сушки в вакууме получают 0,54 г (76% от теории) соединения 24 в виде бесцветного твердого вещества.
1Н-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 7,84 (псевдо дд, J=7,4, 1,0 Гц, 1Н), 7,60 (м., 2Н), 7, 51 (м., 1Н), 7.38 (м., 1Н), 6,93 (м., 1Н), 6,71 (м, 1Н), 6,66 (м, 1Н), 6,49 (м., 1Н), 6,30 (уш.с, 1Н), 2,11 (д,.JH-P=11,9 Гц, 3Н), 1,94 (д., JH-P=11,9 Гц, 3Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: -5,9 (уш.м.).11В-ЯМР (80 мГц), (дейтер. метиленхлорид) δ: -14,6 (уш.д., JH-P=126 Гц).
Пример 24
2-Метилинден (соединение 26)


В круглодонную колбу помещают 38,7 г (0,29 моля) 2-инданона и 300 мл эфира. В другую колбу вносят 96,7 мл 3,0 М раствора метилмагниййодида (0,29 моля) в эфире, разбавленного 150 мл эфира. Затем раствор 2-инданона приливают через канюлю к раствору метилмагниййодида с такой скоростью, чтобы поддерживалось кипение; при этом образуется осадок. По окончании добавления суспензию перемешивают еще 4 часа при кипении и охлаждают до 0oС, после чего медленно приливают 100 мл насыщенного раствора хлорида аммония. Продукт реакции экстрагируют эфиром и сушат над сульфатом магния. После удаления растворителя в вакууме получают 30,1 г (70% от теории) 2-метил-2-инданола (соединение 25) в виде маслянистого твердого вещества.
1 Н-ЯМР (400 мГц), (дейтер. хлороформ) δ: 7,15 (уш.м., 4Н), 3,01 (с., 2Н), 2,99 (с., 2Н), 1,5 (с., 3Н); ОН переменный.
В круглодонную колбу с ловушкой Дина-Старка вносят 25,5 г (0, 17 моля) соединения 25, 3,2 г (0,017 моля) n-толуолсульфокислоты и 300 мл гексана. Полученную суспензию выдерживают 3 часа при кипении. После охлаждения гексановую фракцию декантируют и растворитель удаляют в вакууме, при этом остается масло, которое перегоняют в короткой дистилляционной колонне при 45oС и давлении 0,03 мбар и получают 15 г (68% от теории) соединения 26.
1Н-ЯМР (400 мГц), (дейтер. хлороформ) δ: 7,33 (д., J=7,6 Гц, 1Н), 7,21 (м. , 2Н), 7,06 (псевдо дт, J=7,2, 1,4 Гц, 1Н), 6,45 (уш.с., 1H), 3,25 (с., 2Н), 2,12 (с., 3Н).
Использованная литература
1. Morrison H., Giacherio D.J. Org. Chem., 1982, 47, 1058.
2. Ready Т.Е., Chien J. С. W., Rausch M.D. J. Organom. Chem., 519, 1996, 21.
3. Wilt, Pawlikowki, Wieczorek. J. Org. Chem., 37, 1972, 824.
Пример 25
Трибутилстаннил-диизопропилфосфино-2-метилинден (соединение 27)

В круглодонную колбу, содержащую 5,08 г (0,039 моля) 2-метилиндена 26, приливают 150 мл эфира и охлаждают до -20oС. К этому раствору в течение 5 минут прибавляют 17,0 мл 2,3 М раствора бутиллития (0,039 моля) в гексане, при этом реакционный раствор окрашивается в желтый цвет. После снятия охлаждения раствор нагревают до комнатной температуры, перемешивают 1 час, затем охлаждают до -20oС и в течение 5 минут прибавляют 5,8 г (0,039 моля) хлордиизопропилфосфина, в результате чего образуется осадок. Охлаждение убирают и реакционную смесь перемешивают 1 час при комнатной температуре. После охлаждения до -20oС добавляют по каплям 17,0 мл 2,3 М раствора бутиллития (0,039 моля) в гексане. По окончании добавления охлаждение убирают, раствор медленно нагревают до комнатной температуры и затем перемешивают 1,5 часа. После охлаждения до 0oС добавляют по каплям 12,4 г (0,038 моля) хлортрибутилолова. Образующуюся суспензию нагревают до комнатной температуры и перемешивают 1,5 часа. Эфир удаляют в вакууме, сырой продукт реакции снова растворяют в гексане, фильтруют и фильтрат концентрируют и сушат в вакууме; получают 20,4 г (98% от теории) соединения 27 в виде тяжелого желтого масла. Методом31Р-ЯМР идентифицируют два изомера.
31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: -5,9 и -6,6 в соотношении 2:1.
Пример 26
Диизопропилфосфино-2-метилинденил-цирконийтрихлорид
(соединение 28)
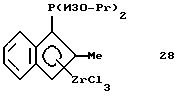
Раствор 17,7 г (0,033 моля) соединения 27 в 100 мл метиленхлорида прибавляют в течение 10 минут при температуре -25oС к суспензии 7,7 г (0,033 моля) 99,9%-ного тетрахлорида циркония в 200 мл метиленхлорида. По окончании прибавления реакционную смесь медленно, в течение 3 часов перемешивают, нагревают до 10oС, в результате чего образуется прозрачный оранжевый раствор. Через 1 час при комнатной температуре растворитель удаляют в вакууме, а образующееся масло промывают два раза по 50 мл гексана и получают маслянистый сырой продукт (соединение 28), который непосредственно используют для получения соединения 29. Вследствие нерастворимости этого соединения его1Н-ЯМР-спектр не получен.
Пример 27
2-Метилинденил-циклопентадиенил-цирконийдихлорид, содержащий диизопропилфосфино-дихлорборанил-мостиковую
связь (соединение 29)

В круглодонную колбу, содержащую 0,025 моля неочищенного соединения 28 в 200 мл, вносят при 0oС в течение 5 минут 5,5 г (0,025 моля) соединения 2. Перемешивают 1 час при 0oС и толуольную фракцию декантируют с образующегося масла. После удаления толуола в вакууме к маслянистому твердому веществу приливают 100 мл гексана, в результате чего образуется 7,4 г (54% от теории) желтого порошка с чистотой около 90%. Продукт реакции очищают далее в экстракторе Сокслета вводимым при кипении пентаном. Конечный продукт представляет собой светло-желтый порошок.
1Н-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 8,67 (уш.д., J=7,6 Гц, 1Н), 7,71 (м., 1Н), 7,35 (м., 2Н), 6,62 (уш.с., 1Н), 6,54 (уш.с., 1Н), 6,47 (м., 1Н), 6,33 (м., 1Н), 6,06 (уш.с., 1Н), 3,3 (уш.м., 1Н), 3,2 (уш.м., 1Н), 2,6 (с.. 3Н), 1,78 (дд, J=7,1 Гц, JH-P=15,3 Гц, 3Н), 1,70 (дд,J=7,2Гц, JH-P=15,7 Гц, 3Н), 1,57 (дд, J=7,1 Гц, JH-P=15,3 Гц, 3Н), 1,12 (дд, J=7,1 Гц,.JH-P= 14,0 Гц, 3Н).31 Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 28,4 (уш.м.).11В-ЯМР (80 мГц), (дейтер. метиленхлорид) δ: -14,3 (уш.д., JP-B=106 Гц).
Пример 28
Бис-(триметилсилил)-дифенилфосфино-циклопентадиен (соединение 30)
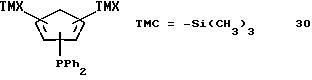
К раствору 40,2 г (0, 19 моля) соединения 1 в 500 мл эфира прибавляют в течение 10 минут при 0oС 76,6 мл 2,5 М раствора бутиллития (0,19 моля) в гексане. По окончании прибавления охлаждение убирают и раствор перемешивают 1 час при комнатной температуре. После охлаждения до 0oС добавляют в течение 10 минут 42,2 г (0,19 моля) хлордифенилфосфина, затем охлаждение убирают и суспензию нагревают до комнатной температуры. После 1-часового перемешивания при комнатной температуре эфир удаляют в вакууме, а продукт реакции снова растворяют в гексане. После отфильтровывания соли гексан удаляют в вакууме и получают 69,1 г (91% от теории) соединение 30 в виде масла.
1H-ЯМР (400 мГц), (дейтер. хлороформ) δ: 7,45 (м., 4Н), 7,35 (м., 6Н), 6,8 (м., 1Н), 6,65 (м., 1Н), 6,6 (м., 1Н), 0 (с., 18Н).31Р-ЯМР (161,9 мГц), (дейтер. хлороформ) δ: -19,5.
Пример 29
Триметилсилил-дифенилфосфино-циклопентадиенил-цирконийтрихлорид
(соединение 31)
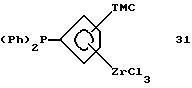
Раствор 69,1 г (0,175 моля) соединения 30 в 200 мл метиленхлорида приливают через канюлю к суспензии 41,5 г (0,178 моля) 99,9%-ного тетрахлорида циркония в 200 мл метиленхлорида и перемешивают 8 часов при комнатной температуре. В течение этого времени раствор мутнеет. Твердое вещество отфильтровывают, промывают сначала два раза по 20 мл толуола и затем - два раза по 20 мл гексана и сушат в вакууме. Получают 35 г (39% от теории) продукта реакции в виде светло-жeлтого порошка. Вследствие нерастворимости этого соединения его1Н-ЯМР-спектр не получен.
Пример 30
Триметилсилилпиклопентадиенил-циклопентадиенил-цирконийдихлорид,
содержащий дифенилфосфино-дихлорборанил-мостиковую связь (соединение 32)
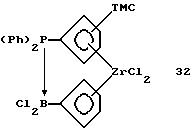
Раствор 2,6 г (0,012 моля) соединения 2 в толуоле прибавляют при 0oС к суспензии 5,6 г (0,011 моля) соединения 31 в 100 мл толуола. После 5-часового перемешивания при 0oС желто-коричневое твердое вещество отфильтровывают. Из беловатого фильтрата толуол удаляют в вакууме. Остающееся твердое вещество промывают пентаном и получают 5,5 г (81% от теории) соединения 32 в виде крайне нестойкого на воздухе беловатого порошка.
1H-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 7,8-7,5 (м., 10Н), 7,06 (м. , 1Н), 6,92 (м, 1H), 6,83 (м., 1Н), 6,75 (м., 2Н), 6,68 (м., 1Н), 6,63 (м., 1Н), 0,26 (с., 9Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 0 (уш.м. ).11В-ЯМР (80 мГц), (дейтер. метиленхлорид) δ: -16,3 (уш.д.,, JB-P =82 Гц).
Пример 31
Диизопропилфосфино-циклопентадиенил-литий (соединение 33)

В круглодонную колбу, содержащую 1,68 г (0,023 моля) циклопентадиенил-лития, приливают 50 мл эфира. После охлаждения до -20oС прибавляют по каплям 3,6 г (0,023 моля) хлордиизопропилфосфина. По окончании прибавления охлаждающую баню нагревают до 0oС и реакционную смесь перемешивают 1 час. Затем эфир удаляют в вакууме, продукт реакции растворяют в толуоле и раствор фильтруют. После промывания фритты два раза по 10 мл толуола реакционную смесь охлаждают до -20oС и приливают к ней 9,3 мл 2,5 М раствора бутиллития (0,023 моля) в гексане, небольшую фракцию образующегося при этом оранжевого раствора отбирают для ЯМР-исследований; после удаления толуола в вакууме и промывания остающегося масла гексаном получают соединение 33 в виде светло-жeлтого твердого вещества.
1Н-ЯМР (400 мГц), (тетрагидрофуран) δ: 5,89 (м., 2Н), 5,83 (уш.с., 2Н), 1,86 (м., 2Н), 1,0-0,8 (м., 12Н).
Основное количество вещества используют непосредственно для получения соединения 34.
Пример 32
Бис-циклопентадиенил-титанхлорид, содержащий диизопропилфосфинодиметилборанил-мостиковую
связь (соединение 34)

Раствор 6,1 г (0,023 моля) соединения 4 в 50 мл толуола прибавляют при -78oС к толуольному раствору 0,023 моля соединения 33 из вышеприведенной реакции. После 30-минутного перемешивания при -78oС охлаждение убирают и раствор перемешивают еще 2 часа при комнатной температуре. Затем твердое вещество отфильтровывают, толуол удаляют в вакууме, после чего к красному маслянистому продукту реакции приливают гексан. Образующийся при этом красный осадок отфильтровывают, промывают два раза по 20 мл гексана и сушат в вакууме. Получают 5,95 г (61%, считая на CpLi) соединения 34 в виде красного порошка.
1H-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 6,96 (м., 2Н), 6,94 (псевдо т., J=2,4 Гц, 2Н), 6,59 (м., 2Н), 6,42 (м., 2Н), 2,58 (м., 2Н), 1,44 (дд, J= 7,3 Гц, jh-p= 14,7 Гц, 6Н), 1,27 (дд, J=7,2 Гц, jh-p= 13,1 Гц, 6Н), 0,31 (д. , JH-P= 16,4 Гц, 6Н).1P-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 28,7 (уш.м.).11В-ЯМР (80 мГц), (дейтер. метиленхлорид) δ: -29,7 (уш.м.).
Пример 33
Диметилфосфино-трибутилстаннил-2-метилинден (соединение 35)

В круглодонную колбу, содержащую 6,76 г (0,052 моля) 2-метилиндена (соединение 26), приливают 100 мл эфира и охлаждают до -20oС. К этому раствору прибавляют в течение 5 минут 21 мл 2,5 М раствора бутиллития (0,052 моля) в гексане, при этом образуется желтый раствор. Охлаждение убирают, раствор нагревают до комнатной температуры и перемешивают еще 1 час. После охлаждения реакционной смеси до -20oС к ней в течение 5 минут прибавляют 5,0 г (0,052 моля) хлордиметилфосфина, при этом выпадает осадок. Затем охлаждение убирают и реакционную смесь перемешивают 1 час при комнатной температуре, после чего охлаждают до -20oС и прибавляют к ней по каплям 21,0 мл 2,5 М раствора бутиллития (0,052 моля) в гексане. По окончании прибавления охлаждение убирают, раствор медленно нагревают до комнатной температуры и перемешивают 1,5 часа. После охлаждения до 0oС прибавляют по каплям 16,9 г (0,052 моля) хлортрибутилолова. Образующуюся суспензию нагревают до комнатной температуры и перемешивают 1,5 часа. После удаления эфира в вакууме сырой продукт реакции снова растворяют в гексане, фильтруют и фильтрат концентрируют и сушат в вакууме; получают 24,3 г (98% от теории) соединения 35 в виде тяжелого желтого масла.
31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: -68,5 (с.).
Пример 34
Диметилфосфино-2-метилинденил-цирконийтрихлорид (соединение 36)
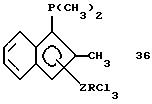
Раствор 17,4 г (0,036 моля) соединения 35 в 100 мл толуола прибавляют в течение 10 минут при 0oС к суспензии 8,5 г (0,036 моля) 99,9%-ного тетрахлорида циркония в 100 мл толуола. По окончании прибавления реакционную смесь медленно в течение 1 часа нагревают до комнатной температуры, после чего перемешивают 6 часов при этой температуре. Затем желтый осадок отфильтровывают, промывают два раза по 20 мл толуола и два раза по 20 мл гексана и сушат в вакууме. Далее порошок очищают путем удаления остающихся соединений олова экстракцией вводимым при кипении толуолом в течение 3 часов при давлении 40 мбар и затем - пентаном в течение 2 часов в экстракторе Сокслета. Получают 5,8 г (41% от теории) соединения 36 в виде ярко-жeлтого порошка. Вследствие нерастворимости этого соединения его1Н-ЯМР-спектр не получен.
Пример 35
2-Метилинденил-циклопентадиенил-цирконийдихлорид, содержащий
диметилфосфино-дихлорборанил-мостиковую связь (соединение 37)
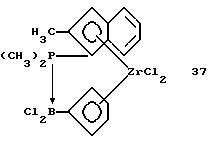
В круглодонную колбу, содержащую 4,8 г (0,012 моля) соединения 36 в 125 мл толуола, прибавляют в течение 5 минут при комнатной температуре 2,7 г (0,012 моля) соединения 2. После 7-часового перемешивания темно-жeлтое твердое вещество отфильтровывают, промывают два раза по 20 мл гексана и сушат в вакууме; получают 5,5 г (89% от теории) соединения 37 в виде светло-жeлтого твердого вещества.
1H-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 8,39 (д., J=8,5 Гц, 1Н), 7,71 (м., 1Н), 7,4 (м., 2Н), 6,64 (м., 2Н), 6,46 (псевдо к., J=5,3, 2,9 Гц, 1Н), 6,37 (м., 1Н), 6,08 (м., 1Н), 2,51 (с., 3Н), 2,1 (д., JB-P=12 Гц, 3Н), 2,0 (д, JB-P=12 Гц, 3Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 5,3 (уш.м.);11B-ЯMP (80 мГц), (дейтер. метиленхлорид) δ: -16,5 (уш.д., JB-P=116 Гц).
Пример 36
Дициклогексилборанил-циклопентадиенил-литии (соединение 39)
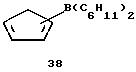

Использованная литература
1. Herberich G.E., Fischer A. Organometallics, 1996, 15, 58.
К 20 мл циклопентадиенил-натрия (2М в тетрагидрофуране; 0,04 моля) в 100 мл гексана прибавляют при -78oС 40 мл 1М раствора хлордициклогексилборана (0,04 моля) в гексане. После снятия охлаждения реакционную смесь нагревают до комнатной температуры и перемешивают 1 час. После фильтрования и удаления растворителя в вакууме получают 9,1 г (94% от теории) соединения 38 в виде желтого масла, которое непосредственно используют в синтезе соединения 39.
В круглодонную колбу, содержащую 40 мл ТГФ, вносят 5,3 г (0,038 моля) 2,2,6,6-тетраметилпиперидина. После охлаждения до -20oС и добавления 15 мл 2,5 М раствора бутиллития (0,038 моля) в гексане смесь перемешивают 1 час при -20oС и затем охлаждают до -78oС. К этому раствору прибавляют в течение 10 минут 9,1 г (0,038 моля) соединения 38 в 20 мл гексана. Охлаждение убирают и раствор перемешивают 1 час при комнатной температуре. После удаления растворителя в вакууме и добавления гексана перемешивают еще 2 часа, при этом образуется белая суспензия, которую отфильтровывают и сушат в вакууме. Получают 4,6 г (50% от теории) соединения 39 в виде белого порошка.
11В-ЯМР (80 мГц), (тетрагидрофуран) δ: 43,9.
Пример 37
Триметилсилилциклопентадиенил-циклопентадиенил-цирконийдихлорид, содержащий дифенилфосфино-дициклогексилборанил-мостиковую связь (соединение 40)
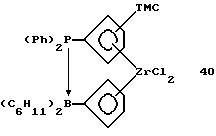
В колбу Шленка, содержащую 1,4 г (0,0056 моля) соединения 39 и 2,9 г (0,0056 моля) соединения 31 и охлажденную до -20oС приливают 100 мл толуола. После снятия охлаждения суспензию перемешивают 6 часов при комнатной температуре и фильтруют. Растворитель удаляют в вакууме, остающееся маслянистое твердое вещество промывают гексаном и отфильтровывают. После сушки в вакууме получают 1,9 г (48% от теории) соединения 40 в виде твердого вещества розового цвета.
1Н-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 7,6-7,2 (уш.м., 10), 7,04 (уш. с., 1Н), 6,95 (м., 1Н), 6.82 (м., 1Н), 6,76 (уш.с., 1Н), 6,66 (м., 1Н), 6,63 (м. , 1Н), 6,52 (м, 1Н), 1,6-1,1 (уш.м., 22Н), 0,26 (с., 9Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 16,3.11B-ЯМР (80 мГц), (дейтер. метиленхлорид) δ: -13,8.
Пример 38
4,7-Метилинден (соединение 41)
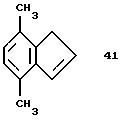
Использованная литература
1. Erker G. и др. Tetrahedron, 1995, 51, 4347.
30% Раствор 153 г (2,8 моля) метилата натрия в метаноле разбавляют 60 мл метанола, охлаждают до 0oС и к этому раствору прибавляют 34 г (0,52 моля) циклопентадиена. Через 15 минут добавляют по каплям 39 г (0,34 моля) 2,5-гександиона, после чего охлаждение убирают и реакционную смесь перемешивают 2 часа при комнатной температуре. Затем приливают 200 мл воды и 200 мл эфира. Эфирный слой отделяют, промывают водой и раствором хлорида натрия, после чего сушат над сульфатом натрия. После удаления растворителя в вакууме и перегонки при 65oС и давлении 0,1 мбар получают 40 г (81% от теории) соединения 41, в виде оранжевого масла.
1H-ЯМР (400 мГц), (дейтер. хлороформ) δ: 7,35-7,27 (м., 2Н), 7,23 (д., J=7,6 Гц, 1Н), 6,82 (м., 1Н), 3,51 (с., 2Н), 2,75(с., 3Н), 2,63 (с., 3Н).
Пример 39
Диизопропилфосфино-трибутилстаннил-4,7-диметилинден (соединение 42)

В круглодонную колбу, содержащую 5,0 г (0,035 моля) 4,7-диметилиндена (соединение 41), приливают 100 мл эфира и охлаждают до -20oС. К этому раствору прибавляют в течение 5 минут 14 мл 2,5 М раствора бутиллития (0,035 моля) в гексане, при этом образуется желтый раствор. Охлаждение убирают, раствор нагревают до комнатной температуры и перемешивают 1 час. После охлаждения реакционной смеси до -20oС к ней прибавляют в течение 5 минут 5,3 г (0,035 моля) хлордиизопропилфосфина, в результате чего образуется осадок. Затем охлаждение убирают и реакционную смесь перемешивают 1 час при комнатной температуре. После охлаждения до -20oС прибавляют по каплям 14,0 мл 2,5 М раствора бутиллития (0,035 моля) в гексане. По окончании прибавления охлаждение убирают, раствор медленно нагревают до комнатной температуры и перемешивают 1,5 часа. После охлаждения до 0oС добавляют по каплям 11,4 г (0,035 моля) хлортрибутилолова. Образующуюся суспензию нагревают до комнатной температуры и перемешивают 1,5 часа. Эфир удаляют в вакууме, сырой продукт снова растворяют в гексане, фильтруют и фильтрат концентрируют в вакууме; получают 16,0 г (83% от теории) соединения 42 в виде тяжелого желтого масла.
31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: -9.
Пример 40
Диизопропилфосфино-4,7-диметилинденил-цирконийтрихлорид (соединение 43)
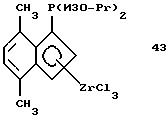
Раствор 16,0 г (0,029 моля) соединения 42 в 100 мл метиленхлорида прибавляют в течение 10 минут при -20oС к суспензии 6,4 г (0,029 моля) 99,9%-ного тетрахлорида циркония в 100 мл метиленхлорида. По окончании прибавления реакционную смесь медленно, в течение двух часов нагревают до комнатной температуры и перемешивают еще 2 часа при этой температуре. Затем твердое вещество отделяют фильтрацией, а растворитель удаляют в вакууме; получают сырой продукт (соединение 43) в виде масла, которое непосредственно используют для получения соединения 44.
Пример
41
4,7-Диметилинденил-циклопентадиенил-цирконийдихлорид, содержащий диизопропилфосфино-дихлорборанил-мостиковую связь (соединение 44)

В круглодонную колбу, содержащую 10,6 г (0,023 моля) соединения 43 в 125 мл толуола, прибавляют в течение 5 минут при 0oС 5,0 г (0, 023 моля) соединения 2. После 1,5-часового перемешивания при 0oС охлаждение убирают, а суспензию перемешивают еще 3 часа при комнатной температуре. Затем растворимую в толуоле фракцию тяжелого масла, образующегося во время реакции, декантируют, концентрируют в вакууме досуха и получают тяжелое масло. После добавления к нему 100 мл гексана перемешивают и отфильтровывают тeмно-жeлтый осадок, который сушат в вакууме. Получают 6,3 г (48% от теории) соединения 44 в виде тeмно-жeлтого порошка. Продукт реакции можно далее очистить осаждением углеводородным растворителем из раствора в метиленхлориде.
1Н-ЯМР (400 мГц), (дейтер. метиленхлорид) δ: 8,03 (псевдо т., J=8,5 Гц, 1Н), 7,22 (д., J=7 Гц, 1Н), 7,08 (д., J=7,1 Гц, 1Н), 7,02 (м., 1Н), 6,77 (м, 1Н), 6,70 (м., 1Н), 6,58 (м., 1Н), 6,44 (уш.с., 1Н), 3,51 (м., 1Н), 3,82 (м. , 1Н), 2,64 (с. , 3Н), 2,50 (с., 3Н), 1,77 (дд, J=7,2 Гц, ; JH-P=16,3 Гц, 3Н), 1,69 (дд, J=7,1 Гц, JH-P=15,2 Гц, 3Н), 1,58 (дд. J=7,1 Гц, JH-P=15,5 Гц, 3Н), 1,28 (дд, J= 7,2 Гц, JH-P= 14,5 Гц, 3Н).31Р-ЯМР (161,9 мГц), (дейтер. метиленхлорид) δ: 28,4 (уш.м.).11В-ЯМР (80 мГц), (дейтер. метиленхлорид) δ: -15,3 (д., JP-B=107 Гц).
Все остальные металлоценовые соединения, подпадающие под вышеприведенную формулу I, содержащие в качестве донорных атомов D элементы, такие как N, Р, As, Sb, Bi, О, S, Se, Те, F, Cl, Br, или I, в качестве акцепторных атомов А - элементы, такие как В, Al, Ga, In, или Т1, в качестве М - элементы, такие как Sc, Y, La, Sm, Nd, Lu, Ti, Zr, Hf, Th, V, Nb, Та или Сr и содержащие карбанионы СрI и СрII, замещенные арилом с 6-12 атомами углерода, галоидарилом с 6-12 атомами углерода или алкилом с 1-20 атомами углерода, который в свою очередь может быть замещен галогеном, фенилом или винилом, получают аналогичным примерам 1 до 41 образом.
Пример 42
Полимеризация этилена
В разогретый в вакууме сухой, не содержащий кислорода, с магнитным перемешиванием струйный автоклав V4A засасывают 50 мл сухого бескислородного толуола.
Предварительно получают в толуоле в течение 15 минут при комнатной температуре D/A-металлоценовый катализатор (соединение 10) с МАО (метилалюмоксан, 10%-ный в толуоле, молярная масса 900 г/моль) в
атомном (молярном) соотношении Al/Zr= 66.666: 1. Аликват, содержащий 1,5•10-7 моля циркония и 1,0•10-2 моля алюминия в 6,8 мл, нагнетают в автоклав в строго
безвоздушных условиях с последующим впрыскиванием дополнительно 50 мл толуола. Затем полимеризуют этилен при его постоянном давлении 10 бар в течение 1 часа при комнатной температуре, причем
внутренняя температура повышается до 42oС. После сброса давления в автоклаве реакционную смесь вносят в 500 мл этанола и 50 мл концентрированной водной соляной кислоты и перемешивают в
течение ночи. Полимеризат отфильтровывают, тщательно промывают этанолом и сушат до постоянного веса при 100oС в сушильном шкафу с циркулирующим воздухом. Выход полиэтилена составляет 2,9 г,
что соответствует активности катализатора 19,3 тонн полимера на моль циркония в час. Характеристическая вязкость η, измеренная в о-дихлорбензоле при 140oС, составляет 4,36 дл/г.
ДСК-Измерением устанавливают температуру плавления 139oС и теплоту плавления 164 Дж/г.
Пример 43
Сополимеризация этилена и пропилена
В разогретый в
вакууме при 100oС сухой, не содержащий кислорода перемешиваемый автоклав V4A засасывают 50 мл сухого бескислородного толуола. Предварительно в толуоле в течение 15 минут при комнатной
температуре получают D/A-металлоценовый катализатор (соединение 10) с МАО (метилалюмоксан, 10%-ный в толуоле, молярная масса 900 г/моль) в атомном/молярном соотношении Al/Zr=50.000:1. Аликват,
содержащий 4•10-7 моля циркония и 2•10-2 моля алюминия в 14,7 мл, нагнетают в автоклав в строго безвоздушных условиях, после чего дополнительно впрыскивают 50 мл
толуола. Затем нагнетают 4,3 г пропилена, с помощью этилена устанавливают в автоклаве постоянное давление до 10 бар и проводят полимеризацию в течение 1 часа при 25oС и перемешивании. После
сброса давления в автоклаве высоковязкую реакционную смесь вносят при перемешивании в смесь 500 мл этанола и 50 мл концентрированной водной соляной кислоты (37%-ной). Суспензию выпадающего при этом
белого полимера перемешивают еще 14 часов, после чего твердое вещество выделяют фильтрованием, тщательно промывают этанолом и сушат при 100oС до постоянного веса. Выход сополимера этилена и
пропилена составляет 3,4 г, что соответсвует активности катализатора 8,5 тонн сополимера на моль циркония в час. С помощью ИК-спектроскопии устанавливают содержание пропилена 40 мас.%.
Характеристическая вязкость η, измеренная в о-дихлорбензоле при 140oС, составляет 1,81 дл/г. ДСК-Измерением устанавливают температуру стеклования Тс=-38oС и теплоту
замерзания -54oС.
Пример 44
Сополимеризация этилена и пропилена
Следующий эксперимент по полимеризации проводят, как описано в вышеупомянутом примере 43,
однако температура полимеризации составляет 70oС. Содержание D/A-цирконоцена (соединение 10) - 4•10-7 моля при количестве алюминия 1•10-2 моля. Атомное
(молярное) соотношение Al/Zr составляет 25.000:1. Выход полимера 5,8 г, что соответствует активности катализатора 14,5 тонн сополимера на моль циркония в час. Характеристическая вязкость η,
измеренная в о-дихлорбензоле при 140oС, составляет 1,10 дл/г. В соответствии с ДСК-измерением этилен-пропиленовый каучук имеет температуру замерзания -64oС и температуру
стеклования Тс=-60oС.
Примеры 45-48
Полимеризация этилена
Следующие эксперименты по полимеризации этилена проводят, как описано в примере 42, однако в
качестве катализатора применяют D/A-металлоцен 7 и используют различные количества МАО. Количество титана составляет 1•10-6 моля, автоклав нагревают приблизительно до 100o
С. Соотношение Al/Zr варьируют между 1.250, 2.500, 5.000, 10.000. Во всех четырех экспериментах активность катализатора составляет приблизительно от 3 до 4 тонн полиэтилена на моль титана в час.
Примеры 49-52
Полимеризация этилена
Эксперимент проводят, как описано в примере 48. Количество титана (соединение 7) составляет 1•10-6 моля, соотношение
Al/Zr=10.000. Автоклав нагревают до различных температур и в качестве характеристик полимеров определяют характеристическую вязкость η и температуру плавления Тпл.
Т: КТ до 60oC; η=7,2 дл/г; Тпл=143oС.
Т: КТ до 80oC; η=4,6 дл/г; Тпл=142oС.
Т: КТ до 100oC; η=3,2 дл/г; Тпл=144oС.
Т: КТ до 120oC; η=2,2 дл/г; Тпл=140oС.
(КТ = комнатная
температура)
Пример 53
Полимеризация этилена
Эксперимент проводят в соответствии с примером 42, однако использованным в качестве катализатора D/A-металлоценом является
соединение мезо-15. Количество циркония составляет 5•10-7 моля, количество алюминия - 5• 10-7 моля. После загрузки катализатора и этилена автоклав нагревают до
температуры около 120oС. После 30-минутной полимеризации выделяют 4,3 г полиэтилена, что соответствует активности катализатора около 17 тонн полиэтилена на моль циркония в час.
Характеристическая вязкость η, измеренная в о-дихлорбензоле при 140oС, составляет 1,9 дл/г.
Пример 54
Полимеризация этилена
Эксперимент проводят,
как описано в примере 42, однако при этом 100 мл толуола загружают непосредственно в автоклав. Автоклав нагревают до 80oС, впрыскивают катализатор и устанавливают давление этилена до 10
бар. В качестве катализатора используют 1•10-6 моля соединения 18 в 2,4 мл толуола, которое предварительно получают с 5•10-3 моля МАО в 3,3 мл толуола. Внутренняя
температура повышается от 80oС до 94oС. Через 30 минут полимеризацию прекращают. Выход полиэтилена составляет 3,5 г, что соответствует активности катализатора около 7 т полимера
на моль катализатора в час. Характеристическая вязкость η, измеренная в о-дихлорбензоле при 140oС, составляет 2,95 дл/г. ДСК-измерением установлены температура плавления 139oС и теплота плавления 165 Дж/г.
Пример 55
Полимеризация этилена
Эксперимент проводят в соответствии с примером 54, однако при этом устанавливают внутреннюю
температуру до 100oС. В качестве катализатора используют 5•10-7 моля соединения 24 в 0,4 мл хлорбензола, которое предварительно получают с 5•10-3 моля
МАО в 3,3 моля толуола. Внутренняя температура поднимается до 100-120oС. После 30-минутной полимеризации образуется 6,2 г полиэтилена, что соответствует активности катализатора около 25
тонн полимера на моль катализатора в час. Характеристическая вязкость η, измеренная в о-дихлорбензоле при 140oС, составляет 1,85 дл/г.
Пример 56
Полимеризация этилена
Эксперимент проводят в соответствии с примером 55, однако при этом в качестве катализатора используют соединение 21. В этом случае внутренняя температура поднимается от
100 до 128oС. Выход полиэтилена через 30 минут составляет 7,9 г, что соответствует активности катализатора около 31,6 тонн на моль катализатора в час. Характеристическая вязкость η в
о-дихлорбензоле при 140oС составляет 1,01 дл/г.
Пример 57
Полимеризация этилена
Эксперимент проводят в соответствии с примером 54, причем, однако,
полимеризацию начинают при 20oС. При этом катализатором служит металлоцен 32. Для этого 2,5•10-7 моля катализатора предварительно получают с 2,5• 10-3
моля МАО в толуоле. Внутренняя температура поднимается от 20 до 34oС. После 30-минутной полимеризации образуется 1,3 г полиэтилена, что соответствует активности катализатора около 10,4 тонн
полимера на моль катализатора в час. Характеристическая вязкость η составляет 5,3 дл/г. ДСК-Измерением при 1. нагреве со скоростью 20 кал/мин получают температуру плавления 153oС.
При 2. нагреве после резкого охлаждения образца со скоростью 320 кал/мин устанавливают максимум плавления при 146oС.
Аналогичные результаты достигаются также при использовании всех остальных металлоценовых соединений, подпадающих под вышеприведенную формулу I, содержащих в качестве донорных атомов D элементы, такие как N, P, As, Sb, Bi, О, S, Se, Те, F, Cl, Br, или I, в качестве акцепторных атомов А - элементы, такие как В, Al, Ga, In, или Т1, в качестве М - элементы, такие как Sc, Y, La, Sm, Nd, Lu, Ti, Zr, Hf, Th, V, Nb, Та или Cr и содержащих карбанионы СрI и CpII, замещенные арилом с 6-12 атомами углерода, галоидарилом с 6-12 атомами углерода или алкилом с 1-20 атомами углерода, который в свою очередь может быть замещен галогеном, фенилом или винилом.
Реферат
Изобретение относится к металлоценовым соединениям формулы (I), в которой СрI и СрII представляют собой карбанионы с циклопентадиенилсодержащей структурой, D представляет собой донорный атом и А-акцепторный атом, причем D и A связаны обратимой координационной связью таким образом, что донорная группа получает положительный (частичный) заряд, а акцепторная группа - отрицательный (частичный) заряд, М означает переходный металл III, IV, V или VI подгрупп Периодической системы элементов (Менделеева), Х означает анионный эквивалент, n в зависимости от заряда М означает число ноль, один, два, три или четыре. Соединения I могут использоваться в качестве катализаторов для (со)полимеризации олефинов, изоолефинов, алкинов и/или диолефинов или для полиприсоединения с раскрытием цикла. Типичный рентгеноструктурный анализ представлен формулой (18а). 7 c. и 6 з.п.ф-лы.
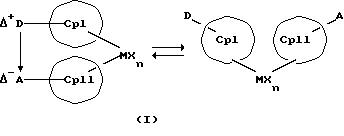
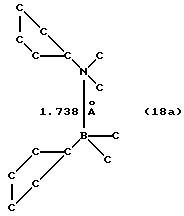
Формула
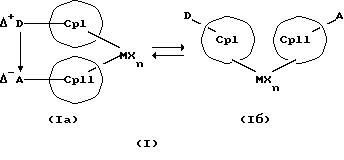
в которой CpI и CpII представляют собой два одинаковых или различных карбаниона с циклопентадиенилсодержащей структурой, в которых атомы водорода, от одного до всех, могут быть замещены на одинаковые или различные остатки из группы линейного алкила с 1-20 атомами углерода или разветвленного алкила с 3-20 атомами углерода, которые однократно, или многократно, или исчерпывающе могут быть замещены галоидом, 1-3-кратно фенилом, а также 1-3-кратно винилом, арила с 6-12 атомами углерода, галоидарила с 6-12 атомами углерода, металлорганических заместителей, таких, как силил, триметилсилил, ферроценил, а также могут быть однократно или двукратно замещены на D и А; Δ+D означает донорную группу, где D означает донорный атом, который может дополнительно нести заместители и который в данном состоянии связывания обладает, по меньшей мере, одной свободной электронной парой; Δ-А означает акцепторную группу, где А означает акцепторный атом, который может дополнительно нести заместители и который в данном состоянии связывания имеет дефицит электронной пары, причeм D и А связаны обратимой координационной связью такого типа, что донорная группа получает положительный или частичный положительный заряд, а акцепторная группа - отрицательный или частичный отрицательный заряд;
М означает переходный металл III, IV, V или VI подгрупп Периодической системы элементов (Менделеева), включая лантаниды и актиниды;
Х означает анионный эквивалент;
n в зависимости от заряда М означает число ноль, один, два, три или четыре.

6. Металлоценовые соединения по п.1, отличающиеся тем, что М означает Sc, Y, La, Sm, Nd, Lu, Ti, Zr, Hf, Th, V, Nb, Та или Сr, предпочтительно Ti, Zr, Hf, V, Nb или Та.
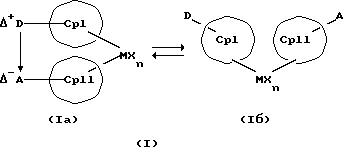
в которой СрI и CpII представляют собой два одинаковых или различных карбаниона с циклопентадиенилсодержащей структурой, в которых атомы водорода, от одного до всех, могут быть замещены на одинаковые или различные остатки из группы линейного алкила с 1-20 атомами углерода или разветвленного алкила с 3-20 атомами углерода, которые однократно, или многократно, или исчерпывающе могут быть замещены галоидом, 1-3-кратно фенилом, а также 1-3-кратно винилом, арила с 6-12 атомами углерода, галоидарила с 6-12 атомами углерода, металлорганических заместителей, таких, как силил, триметилсилил, ферроценил, а также могут быть однократно или двукратно замещены на D и А;
Δ+D означает донорную группу, где D означает донорный атом, который может дополнительно нести заместители и который в данном состоянии связывания обладает, по меньшей мере, одной свободной электронной парой;
Δ-А означает акцепторную группу, где А означает акцепторный атом, который может дополнительно нести заместители и который в данном состоянии связывания имеет дефицит электронной пары, причем D и А связаны обратимой координационной связью такого типа, что донорная группа получает положительный или частичный положительный заряд, а акцепторная группа - отрицательный или частичный отрицательный заряд;
М означает переходный металл III, IV, V или VI подгрупп Периодической системы элементов (Менделеева), включая лантаниды и актиниды;
Х означает анионный эквивалент;
n в зависимости от заряда М означает число 0-4,
отличающийся тем, что соединение формулы (II)
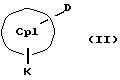
подвергают взаимодействию с соединением формулы (III)
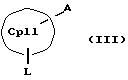
где А, D, СрI и CpII имеют вышеуказанное значение;
К означает М', a L означает МХn+1 или К означает MXn+1, a L означает М', при этом М, Х и n имеют вышеуказанное значение, а М' означает катионный эквивалент щелочного или щелочноземельного металла или Т1, в присутствии апротонного растворителя с отщеплением М'Х.
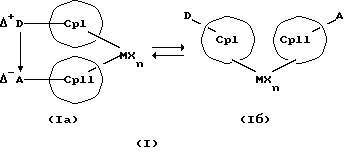
в которой CpI и CpII представляют собой два одинаковых или различных карбаниона с циклопентадиенилсодержащей структурой, в которых атомы водорода, от одного до всех, могут быть замещены на одинаковые или различные остатки из группы линейного алкила с 1-20 атомами углерода или разветвленного алкила с 3-20 атомами углерода, которые однократно, или многократно, или исчерпывающе могут быть замещены галоидом, 1-3-кратно фенилом, а также 1-3-кратно винилом, арила с 6-12 атомами углерода, галоидарила с 6-12 атомами углерода, металлорганических заместителей, таких, как силил, триметилсилил, ферроценил, а также могут быть однократно или двукратно замещены на D и А;
Δ+D означает донорную группу, где D означает донорный атом, который может дополнительно нести заместители и который в данном состоянии связывания обладает, по меньшей мере, одной свободной электронной парой;
Δ-А означает акцепторную группу, где А означает акцепторный атом, который может дополнительно нести заместители и который в данном состоянии связывания имеет дефицит электронной пары, причем D и А связаны обратимой координационной связью такого типа, что донорная группа получает положительный или частичный положительный заряд, а акцепторная группа - отрицательный или частичный отрицательный заряд;
М означает переходный металл III, IV, V или VI подгрупп Периодической системы элементов (Менделеева), включая лантаниды и актиниды;
Х означает анионный эквивалент;
n в зависимости от заряда М означает число 0-4,
отличающийся тем, что соединение формулы (IV)
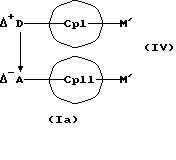
где А, D, СрI и CpII имеют вышеуказанное значение;
М' означает катионный эквивалент щелочного или щелочноземельного металла или Т1,
подвергают взаимодействию с соединением формулы (V)
MXn+2, (V)
где М, Х и n имеют вышеуказанное значение,
в присутствии апротонного растворителя с отщеплением М'Х.
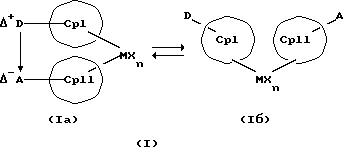
в которой CpI и СрII представляют собой два одинаковых или различных карбаниона с циклопентадиенилсодержащей структурой, в которых атомы водорода, от одного до всех, могут быть замещены на одинаковые или различные остатки из группы линейного алкила с 1-20 атомами углерода или разветвленного алкила с 3-20 атомами углерода, которые однократно, или многократно, или исчерпывающе могут быть замещены галоидом, 1-3-кратно фенилом, а также 1-3-кратно винилом, арила с 6-12 атомами углерода, галоидарила с 6-12 атомами углерода, металлорганических заместителей, таких, как силил, триметилсилил, ферроценил, а также могут быть однократно или двукратно замещены на D и А;
Δ+D означает донорную группу, где D означает донорный атом, который может дополнительно нести заместители и который в данном состоянии связывания обладает, по меньшей мере, одной свободной электронной парой;
Δ-А означает акцепторную группу, где А означает акцепторный атом, который может дополнительно нести заместители и который в данном состоянии связывания имеет дефицит электронной пары, причeм D и А связаны обратимой координационной связью такого типа, что донорная группа получает положительный или частичный положительный заряд, а акцепторная группа - отрицательный или частичный отрицательный заряд;
М означает переходный металл III, IV, V или VI подгрупп Периодической системы элементов (Менделеева), включая лантаниды и актиниды;
Х означает анионный эквивалент;
n в зависимости от заряда М означает число 0-4,
отличающийся тем, что соединение формулы (VI)
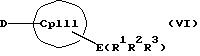
где D имеет вышеуказанное значение;
CpIII представляет собой незаряженный фрагмент молекулы с циклопентадиенсодержащей структурой, а в остальном соответствует значению СрI;
Е означает один из элементов Si, Ge или Sn;
R1, R2 и R3 независимо друг от друга каждый означает неразветвленный или разветвленный алкил с 1-20 атомами углерода, арил с 6-12 атомами углерода, а также арил с 6-12 атомами углерода, замещенный алкилом с 1-6 атомами углерода и алкил с 1-6 атомами углерода, замещенный арилом с 6-12 атомами углерода, винил, алкил или галоид,
подвергают взаимодействию с соединением формулы (VII)
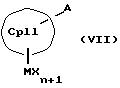
где СрII, М, Х и n имеют вышеуказанное значение,
в отсутствии или в присутствии апротонного растворителя с отщеплением E(R1R2R3)X, причeм в формуле (VI) вместо E(R1R2R3) может быть водород, и в этом случае Х в формуле (VII) может также означать амидный анион типа R2N-, или карбанион типа R3N-, или алкоголятный анион типа RO-.
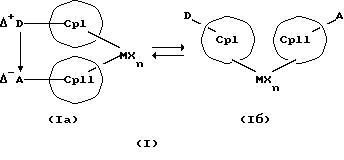
в которой CpI и СрII представляют собой два одинаковых или различных карбаниона с циклопентадиенилсодержащей структурой, в которых атомы водорода, от одного до всех, могут быть замещены на одинаковые или различные остатки из группы линейного алкила с 1-20 атомами углерода или разветвлeнного алкила с 3-20 атомами углерода, которые однократно, или многократно, или исчерпывающе могут быть замещены галоидом, 1-3-кратно фенилом, а также 1-3-кратно винилом, арила с 6-12 атомами углерода, галоидарила с 6-12 атомами углерода, металлорганических заместителей, таких, как силил, триметилсилил, ферроценил, а также могут быть однократно или двукратно замещены на D и А;
Δ+D означает донорную группу, где D означает донорный атом, который может дополнительно нести заместители и который в данном состоянии связывания обладает, по меньшей мере, одной свободной электронной парой;
Δ-А означает акцепторную группу, где А означает акцепторный атом, который может дополнительно нести заместители и который в данном состоянии связывания имеет дефицит электронной пары, причeм D и А связаны обратимой координационной связью такого типа, что донорная группа получает положительный или частичный положительный заряд, а акцепторная группа - отрицательный или частичный отрицательный заряд;
М означает переходный металл III, IV, V или VI подгрупп Периодической системы элементов (Менделеева), включая лантаниды и актиниды;
Х означает анионный эквивалент;
n в зависимости от заряда М означает число 0-4,
отличающийся тем, что соединение формулы (VIII)
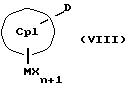
где D, CpI, M, X и n имеют вышеуказанное значение,
подвергают взаимодействию с соединением формулы (IX)

где А имеет вышеуказанное значение;
CpIII представляет собой незаряженный фрагмент молекулы с циклопентадиенсодержащей структурой, а в остальном соответствует значению CpI;
F означает один из элементов Si, Ge или Sn;
R4, R5 и R6 независимо друг от друга каждый означает неразветвленный или разветвленный алкил с 1-20 атомами углерода, арил с 6-12 атомами углерода, а также арил с 6-12 атомами углерода, замещенный алкилом с 1-6 атомами углерода и алкил с 1-6 атомами углерода, замещенный арилом с 6-12 атомами углерода, винил, алкил или галоид,
в отсутствии или в присутствии апротонного растворителя с отщеплением F(R4R5R6)X, причeм в формуле (IX) вместо F(R4R5R6)X может быть водород, и в этом случае Х в формуле (VIII) может также означать амидный анион типа R2N-, или карбанион типа R3N-, или алкоголятный анион типа RO-.

в которой CpI и CpII представляют собой два одинаковых или различных карбаниона с циклопентадиенилсодержащей структурой, в которых атомы водорода, от одного до всех, могут быть замещены на одинаковые или различные остатки из группы линейного алкила с 1-20 атомами углерода или разветвленного алкила с 3-20 атомами углерода, которые однократно, или многократно, или исчерпывающе могут быть замещены галоидом, 1-3-кратно фенилом, а также 1-3-кратно винилом, арила с 6-12 атомами углерода, галоидарила с 6-12 атомами углерода, металлорганических заместителей, таких, как силил, триметилсилил, ферроценил, а также могут быть однократно или двукратно замещены на D и А;
Δ+D означает донорную группу, где D означает донорный атом, который может дополнительно нести заместители и который в данном состоянии связывания обладает, по меньшей мере, одной свободной электронной парой;
Δ-А означает акцепторную группу, где А означает акцепторный атом, который может дополнительно нести заместители и который в данном состоянии связывания имеет дефицит электронной пары, причeм D и А связаны обратимой координационной связью такого типа, что донорная группа получает положительный или частичный положительный заряд, а акцепторная группа - отрицательный или частичный отрицательный заряд;
М означает переходный металл III, IV, V или VI подгрупп Периодической системы элементов (Менделеева), включая лантаниды и актиниды;
Х означает анионный эквивалент;
n в зависимости от заряда М означает число 0-4,
отличающийся тем, что соединение формулы (X)

где А и D имеют вышеуказанное значение;
СрIII и CpIV представляют собой два одинаковых или различных неразряженных фрагмента молекулы с циклопентадиенсодержащей структурой, а в остальном соответствуют значению CpI и СрII,
Е и F независимо друг от друга каждый означает один из элементов Si, Ge или Sn;
R1, R2, R3, R4, R5 и R6 независимо друг от друга каждый означает неразветвленный или разветвленный алкил с 1-20 атомами углерода, арил с 6-12 атомами углерода, а также арил с 6-12 атомами углерода, замещенный алкилом с 1-6 атомами углерода, и алкил с 1-6 атомами углерода, замещенный арилом с 6-12 атомами углерода, винил, алкил или галоид,
подвергают взаимодействию с соединением формулы (V)
MXn+2, (V)
где М, Х и n имеют вышеуказанное значение,
в отсутствии или в присутствии апротонного растворителя с отщеплением E(R1R2R3)X и F(R4R5R6)X, причeм в формуле (X) вместо E(R1R2RЗ) и F(R4R5R6) может быть водород, и в этом случае Х в формуле (V) может также означать амидный анион типа R2N- или карбанион типа R3N- или алкоголятный анион типа RO-.
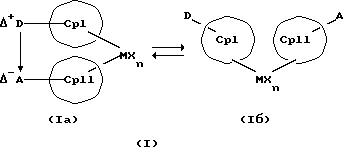
в которой CpI и CpII представляют собой два одинаковых или различных карбаниона с циклопентадиенилсодержащей структурой, в которых атомы водорода, от одного до всех, могут быть замещены на одинаковые или различные остатки из группы линейного алкила с 1-20 атомами углерода или разветвлeнного алкила с 3-20 атомами углерода, которые однократно, или многократно, или исчерпывающе могут быть замещены галоидом, 1-3-кратно фенилом, а также 1-3-кратно винилом, арила с 6-12 атомами углерода, галоидарила с 6-12 атомами углерода, металлорганических заместителей, таких, как силил, триметилсилил, ферроценил, а также могут быть однократно или двукратно замещены на D и А;
Δ+D означает донорную группу, где D означает донорный атом, который может дополнительно нести заместители и который в данном состоянии связывания обладает, по меньшей мере, одной свободной электронной парой;
Δ-А означает акцепторную группу, где А означает акцепторный атом, который может дополнительно нести заместители и который в данном состоянии связывания имеет дефицит электронной пары, причем D и А связаны обратимой координационной связью такого типа, что донорная группа получает положительный или частичный положительный заряд, а акцепторная группа - отрицательный или частичный отрицательный заряд;
М означает переходный металл III, IV, V или VI подгрупп Периодической системы элементов (Менделеева), включая лантаниды и актиниды;
Х означает анионный эквивалент;
n в зависимости от заряда М означает число 0-4,
отличающийся тем, что соединение формулы (XI) или (VI)
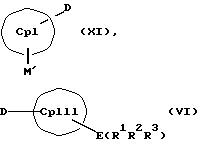
где D и СрI имеют вышеуказанное значение;
М' означает катионный эквивалент щелочного или щелочноземельного металла или Т1;
СрIII представляет собой незаряженный фрагмент молекулы с циклопентадиенсодержащей структурой, а в остальном соответствует значению CpI;
Е означает один из элементов Si, Ge или Sn;
R1, R2, R3 независимо друг от друга каждый означает неразветвленный или разветвленный алкил с 1-20 атомами углерода, арил с 6-12 атомами углерода, а также арил с 6-12 атомами углерода, замещенный алкилом с 1-6 атомами углерода, и алкил с 1-6 атомами углерода, замещeнный арилом с 6-12 атомами углерода, винил, алкил или галоид,
подвергают взаимодействию с соединением формулы (V)
MXn+2, (V)
где М, Х и n имеют вышеуказанное значение,
в присутствии соединения формулы (XII) или (XIII)
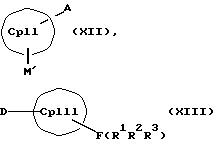
где A, M' и CpIII имеют вышеуказанное значение;
F имеет значение радикала Е;
R4, R5 и R6 имеют значение радикалов R1, R2 и R3, при этом Е и F, а также R1-R6 могут иметь различное значение,
в отсутствии или в присутствии апротонного растворителя с отщеплением E(R1R2R3)X и F(R4R5R6)X, причeм в формулах (VI) и (XIII) вместо E(R1 R2R3) и F(R4R5R6) может быть водород, и в этом случае Х в формуле (V) может также означать амидный анион типа R2N-, или карбанион типа R3N-, или алкоголятный анион типа RO-.

Комментарии