Производные гуанидиналкил-1,1-бис-фосфоновой кислоты, способ их получения, лекарственное средство и способ его получения - RU2124519C1
Код документа: RU2124519C1
Чертежи

Описание
Остеопороз представляет собой часто встречающееся костное заболевание. Различные формы остеопороза приводят к сильной потере костной ткани, так что в конце концов теряется механическая стабильность кости. У здоровых людей скорость, с которой образуются остеокласты и остеопласты, развивается так, что образование костей и резорбция костей находится в равновесии. При остеопорозе равновесие нарушается, что приводит к разрушению костей.
1. Maier (Phosphorus and Sulfur, 1981, 11, с. 311-322) описывает при получении аминометилендифосфинатов в качестве промежуточного соединения тетраэтиловый эфир 1-/аминоиминометил/-метан-1,1- бис-фосфоновой кислоты. Никакого применения для этого промежуточного продукта не указывается.
В стремлении получить эффективные соединения для лечения и профилактики остеопороза с незначительными побочными действиями в настоящее время неожиданно найдено, что предлагаемые согласно изобретению гуанидиналкил-1,1-бис-фосфоновые кислоты уменьшают резорбцию костей.
Предметом
изобретения являются производные гуанидиналкил-1,1- бис-фосфоновой кислоты в виде таутомеров формулы Ia, Iб, Iв:



где
R1 - означает водород;
R2 - означает водород или группу:

где
R18 - линейный или разветвленный C1 - C5-алкил;
R3 - водород;
R4 - водород;
R5 - водород;
X - водород;
R6 и R7 - водород;
R8, R9, R10, R11 одинаковые или различные и независимо друг от друга означают водород, линейный или разветвленный C1 - C5-алкил;
l = 0 - 4; m = 0 или 1,
n = 0 - 4, причем сумма чисел l, m, n равна 4 или меньше,
за исключением соединения: тетраэтиловый эфир 1-//амино- имино-метил/-амино/-метан-1,1-бис-фосфоновой кислоты.
Предпочтительны согласно изобретению соединения формул Ia, Iб, Iв, в которых R1, R2, R3, R4, R5, R6, R7, представляют собой водород, R8, R9, R10, R11 являются одинаковыми или различные и независимо друг от друга означают водород, линейный или разветвленный C1-C4 алкил; 1 означает 0-4; m означает 0 или 1; n означает 0-4, причем сумма чисел l, m, n равна 4 или меньше, за исключением соединения тетраэтиловый эфир 1-//амино- иминометил/-амино/-метан-1,1-бис-фосфоновой кислоты.
Наиболее предпочтительны соединения формул Ia, Iб, Iв, в которых R означает атом водорода;
R2 означает группу:

или бензимидазол;
R18 означает линейный или разветвленный C1-C4-алкил;
R3, R4, R5, R6 и R7 означают водород;
R8, R9, R10, R11 являются одинаковыми или различными и независимо друг от друга означают водород, линейный или разветвленный C1-C4-алкил;
l означает 0-3;
m означает 0 или 1;
n означает 0-3;
причем сумма l, m, n равна 4 или меньше.
За исключением соединения тетраэтиловый эфир 1-//амино- иминометил/-амино/-метан-1,1-бис-фосфоновой кислоты.
Наибольший интерес вызывают соединения,
представляющие собой: тетраэтиловый эфир 2-/О,О-диизобутилфосфорил/-аминоиминометил/- амино/-этан-1,1, -бис-фосфоновой кислоты;
2-[[(аминоаминометил)-амино]-этан-1,1-бис-фосфоновую кислоту;
тетраэтиловый эфир 2-[(бензимидазол-аминоиминометил)-амино]- этан-1,1-бис-фосфоновой кислоты;
2-[(бензимидазоламиноиминометил)-амино]-этан-1,1-бис-фосфоновую кислоту,
4-[(аминоиминометил)-амино]-бутан-1,1-бис-фосфоновую кислоту.
Предлагаемые согласно изобретению производные гуанидиналкил- 1,1-бис-фосфоновой кислоты в виде таутомеров формулы Ia, Iб,
Iв по п.1, где R8 и R9 - независимо друг от друга обозначают линейный или разветвленный C1-C5-алкил, R10 и R11 - одинаковые или
различные независимо друг от друга означают водород, линейный или разветвленный C1-C5-алкил, сумма чисел l, m, n равна 2, получают путем взаимодействия соединения формулы:

где значения R8-R11 приведены выше, Y означает водород, с соединением формулы IVа или IVб.


где
Z - аминогруппа;
R1, R2, R3 приведены выше.
При осуществлении способа предпочтительно использовать эквимолярное количество или вплоть до трехкратного избытка компонентов, в случае необходимости в инертном растворителе, как диметилсульфоксид (ДМСО), диметилформамид (ДМФ), толуол, (C1-C4)алканол, тетрагидрофуран (ТГФ), диоксан или диэтиловый эфир. Температура реакции составляет примерно 25-100oC, предпочтительно в присутствии растворителя 25o C или соответствует температуре кипения растворителя, в особенности 70oC. Время реакции составляет 6-48 часов, предпочтительно 12-24 часа. Окончание реакции можно определять, например, с помощью тонкослойной хроматографии.
Изобретение также относится к лекарственным средствам, ингибирующим выделение кальция из костной ткани при профилактике и лечении остеопороза, которые содержат по меньшей мере одно соединение формул Ia, Iб, Iв и/или по меньшей мере одну из физиологически совместимых солей соединения формул Ia, Iб, Iв или тетраэтиловый эфир 1-//аминоиминометил/-амино/-метан-1,1-бис-фосфоновой кислоты, наряду с физиологически приемлемыми вспомогательными веществами и носителями, разбавителями и/или другими биологически активными веществами.
Изобретение относится, далее, к применению соединений формул 1а, 1б или 1в и/или их физиологически совместимых солей для профилактики и лечения остеопороза.
Предлагаемые согласно изобретению лекарственные средства можно вводить внутривенно, внутримышечно, интраперитонеально, подкожно, внутрисуставно, периартикулярно, ректально, местно, на кожу, через нос или орально.
Получение предлагаемых согласно изобретению лекарственных средств для профилактики и лечения остеопороза осуществляют тем, что по меньшей мере из одного соединения формулы 1а, 1б или 1в и/или одной из его физиологически приемлемых солей вместе с вспомогательными веществами и/или носителями получают пригодную для приема форму.
Для оральных форм введения можно применять такие вспомогательные вещества, как крахмалы, например картофельный, кукурузный или пшеничный крахмалы; целлюлозу, соответственно ее производные, в особенности микрокристаллическую целлюлозу; диоксид кремния; различные сахара, как молочный сахар; карбонат магния и/или фосфаты кальция. Предпочтительно к оральным формам добавляют вспомогательные вещества, которые улучшают совместимость компонентов. С целью лучшей совместимости можно употреблять капсулы, нерастворимые в желудочном соке. Может быть предпочтительным добавление к готовой форме компонента комбинированного препарата, пролонгирующего средства, в случае необходимости в форме проницаемых мембран, как, например, на основе целлюлозы или полистирольной смолы или ионообменника.
Применяемая дозировка предлагаемого в изобретении лекарственного средства зависит от различных факторов, как форма введения, и состояние, вес и тяжесть заболевания пациента. Суточная доза примерно 5000 мг предлагаемого согласно изобретению лекарственного средства, однако, может превышаться только кратковременно. Предпочтительная суточная доза, примерно 10-2500 мг. Введение суточной дозы предполагаемого в изобретении лекарственного средства может осуществляться в форме единичной дозы или в виде нескольких маленьких доз. Предпочтительно введение в 3-8 доз в день.
Изобретение поясняется подробнее примерами. Процентные данные относятся к объемным процентам, если не указано ничего другого.
Пример 1: Получение диэтилфосфитгуанидина
9,6 г (100 ммоль)
Гуанидингидрохлорида обрабатывают 8 г (200 ммоль) гидроксида натрия, которые растворены в 50 мл воды, и 20 мл этанола и охлаждают до 0oC. Добавляют раствор 13,8 г (100 ммоль) диэтилфосфита
в 50 мл четыреххлористого углерода и перемешивают 24 часа при 25oC. Затем добавляют 30 мл воды и экстрагируют метиленхлоридом (3 х 30 мл). Органические фазы объединяют и сушат (K2
CO3). После обработки на роторном испарителе получают масло, которое частично кристаллизуется. Сырой продукт перекристаллизуют из 100 мл уксусного эфира. Получают, после отсасывания,
бесцветный продукт. Выход: 5,7 г (24% от теории). Т.пл.: 112-113oC.
Анализ: рассчитано, % C = 30,6, H = 7,2 N = 21,4
найдено, % C = 30,2, H = 6,9 N = 21,7
31P-ЯМР - спектроскопия: (D2O) δ P = 8,54 м.д.
Пример 2: Получение диизобутилфосфитгуанидина
9,6 г (100 ммоль) Гуанидингидрохлорида обрабатывают 8,
0 г (200 ммоль) гидроксида натрия, которые растворены в 50 мл воды, и 20 мл этанола и охлаждают до 0oC. Сюда же прикапывают в течение 15 минут раствор 16,2 г (834 ммоль) дизобутилфосфита в
50 мл четыреххлористого углерода. Затем снимают охлаждение и перемешивают дополнительно 4 часа при 25oC. Органическую фазу отделяют и получению водную фазу экстрагируют еще 2 раза по 50 мл
флороформом. Объединенные экстракты сушат над карбонатом калия. После обработки на роторном испарителе и высушивания получают 18,3 г сырого продукта, который перекристаллизуют из 180 мл этилацетата.
Выход: 13,3 г (64,7%). Т.пл. 152-156oC.
Анализ: рассчитано, % C 43,0 H 8,83 N 16,7
найдено, % 42,8 8,70 16,5
1H-ЯМР-спектроскопия (CDCl3): 0,93 (д., 7,5 гц, 12H, алифатические)
1,90 (м.ц, 2H, алифатические); 3,65 (т., 7,5 гц, алифатические).
31P-ЯМР-спектроскопия: (CDCl3): δ P = 7,87 м.д.
Пример 3: Получение тетраэтилового эфира 2-//О,О- диизобутилфосфорил/-/аминоиминометил/-амино/-этано-1,1-бис-фосфоновой кислоты
10 г (40 ммоль)
Диизобутилфосфитгуанидина и 12,4 г (41 ммоль) тетраэтилового эфира винилфосфоновой кислоты растворяют в 150 мл ТГФ. К этому раствору добавляют 0,5 г карбоната калия и кипятят 8 часов. После отгонки и
удаления на роторном испарителе растворителя получают 24 г сырого вещества в виде масла. Вещество хроматографируют на колонке с силикагелем. В качестве растворителя служит уксусный эфир с 20% этанола.
Выход: 11,4 г (51% от теории).
Анализ: рассчитано, % C 41,3 H 8,0 N 7,6
найдено, % 41,1 8,0 7,4
1H-ЯМР-спектроскопия (CDCl3): 0,95 (д., 7,5 гц,
12 H, алифатические);
1,34 (мп., 12H, алифатические); 1,92 (мц., 2H, алифатические); 3,45 (м. ц. , 1H); 3,82 (т.д., 2H); 3,74 (м.ц., 4H); 4,10-4,28 (м., 8H, алифатические).
31P-ЯМР-спектроскопия (CDCl3): δ P1 = 9,11; δ P2 = 21,94 м.д.
Пример 4: Получение
2-фталоил-этан-1-моноэтилфосфонат-1- бисэтилфосфоната
30 г (146 ммоль) Фталоилглицина, 26,8 г (225 ммоль) тионилхлорида и 1 мл ДМФ объединяют и при интенсивном перемешивании в течение 4-х
часов нагревают при 50-55oC. По окончании газовыделения избыточный тионилхлорид удаляют при пониженном давлении. К полученному хлорангидриду кислоты затем медленно прикапывают 49,9 г (300
ммоль) триэтилфосфита, 41,4 г (296 ммоль) диэтилфосфита и 2 г триэтиламина. Благодаря добавке указанных компонентов реакционная температура достигает 60-70oC. После добавки реакционная
температура повышается медленно до 115oC так, что газовыделение не прерывается. После достижения 115oC эту температуру поддерживают следующий час и после этого легкокипящую
часть удаляют при 80oC в высоком вакууме (примерно 10-3 торр). Сырой продукт очищают на колонке с силикагелем с помощью уксусного эфира в качестве растворителя. При этом получают
чистое вещество в виде светло-желтого масла. Выход: 28,4 г (46,1% от теории).
Анализ: рассчитано, % C 46,1 H 5,5 N 3,7
найдено, % 45,8 5,5 3,3
31
P-ЯМР-спектроскопия (CDCl3): δ P1 = -0,58; δ P2=16,63 м.д.
Пример 5: Получение 2-амино-этан-1-моноэтилфосфонат-1- бисэтилфосфоната
8 г (19,1 ммоль) 1-Фталоил-этан-1-моноэтилфосфонат-1- бисэтилфосфоната растворяют в 50 мл этанола и смешивают в 1,34 г (21,4 ммоль) гидразингидрата и кипятят в течение часа. После удаления
растворителя остается бесцветный остаток. Его растирают при 0oC в 35 мл 5 н уксусной кислоты и образующийся осадок отделяют. Фильтрат при 0oC подщелачивают с помощью 2 н раствора
гидроксида натрия до pH 7 и экстрагируют 3 раза по 60 мл метиленхлорида. В водной фазе устанавливают pH 9 и снова экстрагируют 2 раза 50 мл метиленхлорида. Экстракты объединяют и промывают 3 раза с
помощью 80 мл 10%-ного раствора хлорида натрия. Затем органическую фазу сушат над сульфатом магния, отфильтровывают и обрабатывают на роторном испарителе. Сырой продукт очищают на колонке с
силикагелем с помощью этанола в качестве растворителя. При этом получают продукт в виде светло-желтого масла. Выход: 3,4 г (61,8% от теории).
Анализ: рассчитано, % C 33,3 H 7,3 N 4,
8
найдено, % 33,6 7,1 4,6
31P-ЯМР-спектроскопия (CDCl3): δ P1 = -0,39; δ P2 = 18,85 м.д.
Пример 6: Получение
2-//аминоиминометил/-амино/-этан-1,1- бис-фосфоновой кислоты
1 г (1,8 ммоль) Тетраэтилового эфира 2-/О,О-диизобутилфосфорил/- -/аминоиминометил/-амино/-этано/-этан-1,1-бис-фосфоновой кислоты
в 20 мл концентрированной соляной кислоты кипятят с обратным холодильником в течение 5 часов. Одновременно этанол, который образуется, отгоняется. Затем удаляют избыточную соляную кислоту. Остающееся
масло перемешивают в 30 мл ацетона с 10% метанола и удаляют декантацией. После этого кипятят с 20 мл метанола (10% воды) и оставляют стоять в течение 24-х часов для кристаллизации. Бесцветные
кристаллы отсасывают и высушивают. Выход: 0,35 г (79,5% от теории). Т.пл. 230oC (при разложении).
Анализ: рассчитано, % C 14,6 H 4,5 N 17,0
найдено, % 14,3 4,8 17,
4
1H-ЯМР-спектроскопия (D2O): 1,92 (т.т., 1H); 3,54 (т.д., 2H).
31P-ЯМР-спектроскопия: (NaOD): δ P1 = 18,88 м.д.
Пример 7: Получение 4-//аминоиминометил/амино/бутан-1,1- бис-фосфоновая кислота
Раствор 0,69 г (2 ммоль) тетраэтилового эфира 4-аминобутан-1,1- бис-фосфоновой кислоты (согласно
патенту ФРГ 3 225 469 AI, 05.01.1984 и 0,402 г (2 ммоль) нитрата 3,5-диметилпиразол-1-карбоксамидина в 10 мл ДМФ кипятят в течение 3-х часов. Затем ДМФ отгоняют в вакууме, и остаток растворяют в воде.
После экстракции диэтиловым эфиром и уксусным эфиром (органические экстракты отбрасывают) водную фазу перегоняют в вакууме. Остается темное масло (0,89 г). Его в течение 8 часов кипятят в 15 мл
концентрированной соляной кислоты. Избыточную соляную кислоту отгоняют и остаток смешивают с небольшим количеством воды, ДМФ и ацетона. Осадок отсасывают и высушивают в вакууме.
Выход: 137 мг. Т.пл. 190-195oC. Масс-спектроскопия: m/z = M + H = 274.
Пример 8: Получение тетраэтилового эфира 2-/4-трифторметан/- фенилэтан-1,1-бис-фосфоновой кислоты
50
мл Абсолютного тетрагидрофурана охлаждают до -10oC и медленно прикапывают в него 7,42 г (39 ммоль) тетрахлорида титана, сюда же добавляют 2,84 (16,3 моль) п-трифторметанбензальдегида и 5,63
г (19,6 ммоль) тетраэтилового эфира метандифосфоновой кислоты и оставляют реакционную температуру повышаться до 0oC. После этого в реакционную смесь прикапывают 7,75 г (76,6 ммоль)
триэтиламина, причем температура не превышает 5oC. Затем смесь перемешивают 3 часа при комнатной температуре и после этого добавляют 100 мл льда с водой. Полученную смесь экстрагируют
диэтиловым эфиром (3х200 мл). Объединенные эфирные экстракты промывают водой до тех пор, пока не получают нейтральный экстракт. Затем эфирную фазу промывают насыщенным раствором хлорида натрия и сушат
над сульфатом натрия. Сырой продукт очищают на колонке с силикагелем с помощью ацетона. Получают светло-желтое масло. Выход: 2,5 г (34,7% от теории).
Анализ: рассчитано, % C 45,9 H 5,
6
найдено, % 46,4 5,3
1H-ЯМР-спетроскопия (CDCl3): 1,14-1,43 (м., 12H); 3,94-4,32 (м., 8H); 7,64-7,84 (м.,4H, ароматические); 8,18-8,45 (м., 1H,
алифатический).
Пример 9: Получение тетраэтилового эфира N,N-дибензиламинометан-1,1-бис-фосфоновой кислоты
197,3 г (1 ммоль) Дибензиламина и 171,9 г (1,16 моль) ортоэтилового
эфира муравьиной кислоты и 290 г (2,1 моль) диэтилфосфита в течение 3-х часов нагревают при 150oC при одновременной отгонке этанола. Затем легкокипящую часть удаляют в высоком вакууме
(примерно 10-3 торр) и сырой продукт очищают на колонке с силикагелем с помощью уксусного эфира в качестве растворителя. Получают 197 г сырого продукта. 60 г очищают на колонке с
силикагелем с помощью уксусного эфира в качестве растворителя, причем получают чистое вещество в виде светло-желтого масла. Выход: 20,8 г (40,7% от теории).
Анализ: рассчитано, % C 57,
1 H 7,3 N 2,9
найдено, % 57,4 7,4 3,2
Пример 10: Получение тетраэтилового эфира 1-аминометан-1,1- бис-фосфоновой кислоты
17,1 г (35,4 ммоль) Тетраэтилового эфира N,
N-дибензиламинометан- 1,1-бис-фосфоновой кислоты растворяют в 170 мл этанола и добавляют 3,4 г 5%-ного Pd/C. Гидрирование осуществляют при нормальном давлении. После поглощения 100 мл водорода снова
добавляют 3,4 г 5%-ного Pd/C и полностью заканчивают гидрирование при нормальном давлении и комнатной температуре (продолжительность реакции примерно 16 часов). После этого катализатор отфильтровывают
и отсасывают. После удаления растворителя получают 10,9 г сырого продукта. Очистку осуществляют через колонку с силикагелем с помощью этанола в качестве растворителя. Выход 9,9 г (92,5% от теории).
Анализ: рассчитано, % C 35,7 H 7,7 N 4,6
найдено, % 35,3 8,1 4,5
31P-ЯМР-спектроскопия (CDCl3): δ P = 20,48 м.д.
Пример 11:
Получение О,О-диизобутилфосфорил-S-этил- изотиомочевины
18,5 г (0,1 моль) Гидробромида S-этилизотиомочевины растворяют в 50 мл воды, 20 мл этанола и 8 г (0,2 моль) гидроксида натрия и
охлаждают до 0oC. В течение 10 минут прикапывают раствор 19,4 г (0,1 моль) диизобутилфосфита в 50 мл четыреххлористого углерода. Затем снимают охлаждение и проводят реакцию при комнатной
температуре и перемешивают следующие 4 часа. После отделения органической фазы водную фазу еще раз экстрагируют 2 раз 100 мл хлороформа, сушат над карбонатом калия, отфильтровывают и обрабатывают на
роторном испарителе. Получают 0,0-диизобутилфосфорил-S-этил-изотиомочевину в виде окрашенного в оранжевый цвет масла. Выход: 24,9 г (84,1% от теории).
Анализ: рассчитано:% C 44,5 H 8,5
N 9,5
Найдено:% 44,8 8,1 9,3
31P-ЯМР-спектроскопия: (CDCl3): δ P = 4,29 м.д.
Пример 12: Получение 2-//аминоиминометил/-этан-1,
1-бис- фоновой кислоты из 2-амино-этан-1-моноэтил-фосфонат-1-бис- этилфосфоната
4 г (13,8 ммоль) 2-Амино-этан-1-моноэтилфосфонат-1-бис- этилфосфоната и 4,15 г (14 ммоль) 0,
0-диизобутилфосфорил-S-этил- изотиомочевины растворяют в 40 мл ДМФ и кипятят. Спустя 6 часов ДМФ удаляют и получают сырую смесь, обрабатывают далее, как описано в примере 3, и вводят во взаимодействие
далее. Выход: 1,8 г.
31P-ЯМР-спектроскопия: (NaOD): δ P = 18,9 м.д.
Пример 13: Синтез тетраэтилового эфира 4-бис-/1,
1- диметилэтоксикарбонил/-аминоиминометил/-амино/-бутан-1,1- бис-фосфоновой кислоты
Предстадия тетраэтилового эфира 4-аминобутан-1,1-бис-фосфоной кислоты получается как описано в патенте ФРГ
3255469 A1, N,N-бис-/1,1-Диметилэтоксикарбонил/-S-метилизотиомочевину получают как описано в литературном источнике K. Niwak, Roczniki, Chem. Ber. 43, (1), 23, 1969.
Раствор 1,8 г (6,2 ммоль) N,N-бис-/1,1-диметилэтоксикарбонил/-S-метилизотиомочевины и 4,4 г (12,7 ммоль) тетраэтилового эфира 4-аминобутан-1,1-бис-фосфоновой кислоты в 50 мл ТГФ нагревают при 40oC в течение 2-х дней. Затем органическую фазу промывают насыщенным раствором NaCl, сушат над сульфатом магния и ТГФ удаляют при пониженном давлении. Полученный сырой продукт хроматографируют на флоризиле (60-100 меш). Растворитель состоит из метиленхлорида с метанолом = 98:2. При этом получают 21,95 г (81%) чистого вещества в виде бесцветного масла.
ИК-спектроскопия (CHCl3): ν
= 3300, 3285 (=C-NH); 1722, 1636 (C=O); 1617 (C=N) см-1
1H-ЯМР-спектроскопия (CDCl3): 1,34 (т., 12H, OCH2CH3); 1,49 (с., 18H, CH3); 1,8-2,1 (м., 4H, N-CH2CH2CH2CH); 2,33 (тт, P-CH-P); 3,45 (м., 2Н, N-CH2); 4,19 (м., 8H, OCH2CH3).
Пример 14.
Синтез 4-/аминоиминометил/амино/-бутан-1,1- бис-фосфоновой кислоты
Раствор 0,92 г (2,56 ммоль) тетраэтилового эфира 4-/бис-/1,1-диметилэтоксикарбонил/-аминоиминометил/-амино/- бутан-1,
1-бис-фосфоновой кислоты в 15 мл концентрированной соляной кислоты кипятят в течение 12 часов. После концентрирования остаток смешивают с этанолом. Осадок отсасывают при пониженном давлении и
высушивают при пониженном давлении. Перекристаллизация осуществляется из смеси этанола с водой. Выход: 115 мг. Т.пл. 260oC.
Анализ: рассчитано,%: C 21,8 H 5,5 N 15,3 22,4
найдено,% 22,0 5,6 14,9 22,5
1H-ЯМР-спектроскопия (D2O) NaOD): 1,60 (т., 1H, P-CH-P); 1,79 (м., 4H, CH2CH2); 3,11 (м., 2H, N-CH2
).
Масс-спектроскопия: m/z = M + H++ = 276
Пример 15. Синтез тетраэтилового эфира 2-//бензимидазоламиноиминометил/-амино/-этан-1,1-бис-фосфоновой кислоты
2,
0 г (11,4 ммоль) Свежеперекристаллизованного бензимидазолгуанидина вместе с 3,4 г тетраэтилового эфира этилиден-1,1-бис-фосфоновой кислоты в 50 мл этанола кипятят в течение 30 минут. После этого
этанол удаляют в вакууме. Путем добавки диэтилового эфира к полученному маслу получают целевой продукт в форме бесцветного порошка. Выход: 4,9 г. Т.пл. 143oC.
Анализ:
рассчитано,% C 45,47 H 6,57 N 3,10
найдено,% 45,1 5,9 3,2
1H-ЯМР-спектроскопия: (CDCl3) ТМС: 1,11-1,29 (м., 12H, OCH2CH3); 3,75-3,93 (тт,
1H, метин-H); 3,96-4,11 (м., 8H, OCH2CH3); 4,50-4,61 (м., 2H, -CH2-); 7,00-7,11 (2H, ароматические H); 7,18-7,29 (м., 1H, ароматические H); 7,36-7,43 (м., 1H,
ароматические H).
31Р-ЯМР-спектроскопия (CDCl3): 21,43 м.д.
Пример 16: Синтез 2-//бензимидазоламиноиминометил/-амино/-этан- 1,1-бис-фосфоновой
кислоты
1 г (2,1 ммоль) продукта из примера 15 в течение 4,5 часов кипятят с обратным холодильником вместе с 20 мл концентрированной соляной кислоты. После удаления избыточной соляной кислоты
в вакууме, полученное вязкое масло перекристаллизуют из воды. Получают целевое соединение в виде бесцветного порошка. Выход: 250 мг Т.пл. выше 230oC.
Анализ: рассчитано,% C
33,07 H 4,16 N 19,28
найдено,% 32,8 3,9 19,5
1H-ЯМР-спектроскопия: (D2O) NaOD = 2,63-2,83 (тт, 1H, метин-H); 4,43-4,63 (м. , 2H, -CH2-); 7,00-7,09 (2H,
ароматические H); 7,33-7,47 (м., 1H, ароматический H); 7,57-7,70 (1H, ароматический H).
31H-ЯМР-спектроскопия (D2O/NaOD): 18,55 м.д.
Активность
предлагаемых в изобретении соединений обнаруживается ин витро в следующих опытах:
Резорбция костей определяется по анализу выделения 45Ca из черепной оболочки эмбриональных крыс,
которые имеют возраст 20 дней. Кости маркируют тем, что беременным крысам инъекцируют 200 μ Кю/кг45CaCl2, за 2 дня до вскрытия черепной оболочки плода.
1.
Культивирование костей
Черепные оболочки плодов делят на две половины. Одна половина черепной оболочки служит контролем, другая половина инкубируется с предлагаемыми согласно изобретению
соединениями.
Каждая половина черепа культивируется в стерильной пластиковой чашке. Среда для культивирования (BGJb-среда, Gibco) содержит по 1 мл 10%-ной эмбриональной телячьей сыворотки, пенициллин-стрептомицина (10000 ед/л, Gibco) и аскорбиновой кислоты (50 мг/л). Половины черепа инкубируют при 37oC, в газовой атмосфере из 5% CO2 и 95% кислорода. Спустя 48 часов среду для культивирования заменяют свежей, добавляют предлагаемые в изобретении соединения и паратороид-гормон (10-7 М) и инкубируют следующие 48 часов. К контролю добавляют паратироид-гормон (10-7 М, Сигма). В конце эксперимента определяется активность45Ca в культуральной среде и в костях. Результаты таблицы показывают ингибирование выделения45Ca в культуральной среде в процентах. Результаты представляют собой среднее значение из 3-5 экспериментов.
Пример 17: Приготовление таблеток
Смесь 100 г активного
ингредиента, 570 г лактозы и 200 г крахмала тщательно смешивают и увлажняют раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона приблизительно в 200 мл воды. Влажную смесь просеивают,
сушат и вновь просеивают. Добавляют 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Все смешивают и спрессовывают в таблетки, получая 10 000 таблеток, каждая из которых
содержит 10 мг активного ингредиента.
Пример 18: Приготовление капсул
20 г активного ингредиента, 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактоза, 0,8 г диоксида
кремния и 1,2 г стеарата магния смешивают друг с другом. Полученный смесью далее заполняют 1000 подходящих твердых желатиновых капсул, каждая из которых содержит 20 мг активного ингредиента.
Дозировка лекарственного средства зависит от различных факторов, например, форма введения средства, состояние, вес и тяжесть заболевания пациента. Для людей весом 70 кг предпочтительна суточная доза примерно 10-2500 мг.
Реферат
Производные гуанидиналкил-1,1-бисфосфоновой кислоты в виде таутомеров формул Iа, Iб или Iв, где R1, R3, R4, R5, R6 и R7 - водород, R2 - водород, бензимидазол или группа -P(O)-(OR18)2; R18 - C1-5алкил; X - водород, R8, R9, R10, R11 - H, C1-5алкил; l = 1-4, m = 0 или 1, n = 0-4, причем сумма чисел l, m, n равна 4 или меньше, за исключением соединения тетраэтиловый эфир 1-[(амино-иминометил)] -метан-1,1-бис-фосфоновой кислоты. Соединения формулы I эффективны для лечения и профилактики остеопороза с незначительными побочными действиями. 2 c. и 5 з.п.ф-лы, 1 табл.


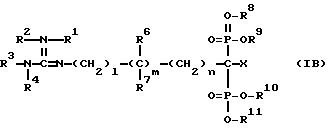
Формула



где R1 - водород;
R2 - водород или группа:

R3 - водород;
R4 - водород;
R5 - водород;
X - водород;
R6 и R7 - водород;
R8, R9, R10, R11 одинаковые или различные и независимо друг от друга означают водород, линейный или разветвленный C1 - C5 -алкил;
l = 0 - 4;
m = 0 или 1;
n = 0 - 4,
причем сумма чисел l, m, n равна 4 или меньше, за исключением соединения: тетраэтиловый эфир 1-//амино-иминометил/-амино/-метан-1,1-бисфосфоновой кислоты.
m = 0 или 1;
n = 0 - 4,
причем сумма чисел l, m, n равна 4 или меньше, за исключением соединения: тетраэтиловый эфир 1-[(амино-иминометил)-амино]-метан-1,1-бисфосфоновой кислоты.

или бензимидазол; R18 означает линейный или разветвленный C1 - C4 -алкил; R3, R4, R5, R6 и R7 означают водород; R8, R9, R10, R11 являются одинаковыми или различными и независимо друг от друга означают водород, линейный или разветвленный C1 - C4 -алкил; l означает 0 - 3; m означает 0 или 1; n означает 0 - 3, причем сумма чисел l, m, n равна 4 или меньше, за исключением соединения тетраэтиловый эфир 1-[(амино-иминометил)-амино]-метан-1,1-бисфосфоновой кислоты.
5. Способ получения производных гаанидин-алкил-1,1-бисфосфоновой кислоты в виде таутомеров формулы 1а, 1б, 1в по п.1, где R8 и R9 независимо друг от друга обозначают линейный или разветвленный C1 - C5 алкил; R10, R11 одинаковые или различные и независимо друг от друга означают водород, линейный или разветвленный C1 - C5 -алкил, сумма чисел l, m, n равна 2, отличающийся тем, что соединение формулы:

где значения R8 - R11 приведены выше, Y означает водород, подвергают взаимодействию с соединением формулы IVa или IVб:


где z - аминогруппа;
R1, R2, R3 приведены в п.1.
12.12.91 по пп.1 - 7, кроме R2-бензимидазол;
09.04.92 по пп. 1 - 7, где R2 бензимидазол.

Комментарии