Производные гуанидиналкил-1,1-бис-фосфоновых кислот и способ их получения - RU2114855C1
Код документа: RU2114855C1
Чертежи
Описание
Изобретение относится к производным гуанидиналкил-1,1-бис фосфоновой кислоты, способу их получения и к их применению.
Лечение заболеваний костной системы приобретает все более возрастающее значение. Так, например, часто встречающимся заболеванием костей является остеопороз. При различных формах остеопороза происходит слишком сильная потеря костной ткани, так что в конце концов теряется механическая устойчивость кости. У здоровых людей норма, с которой образуются остеокласты и остеопласты, составлена таким образом, что остеогенез и костная резорбция находятся в равновесии. Остеопороз нарушает равновесие, так что это приводит к рассасыванию костной ткани.
Уже известно, что производные гуанидиналкил-1,1-бис-фосфоновой кислоты применяются для профилактики и/или лечения остеопороза (Европейский патент 0546548).
В стремлении получить другие эффективные соединения для лечения и профилактики остеопороза с небольшими побочными действиями было найдено, что гаунидиналкил-1,1-бис фосфоновые кислоты по изобретению уменьшают костную резорбцию.
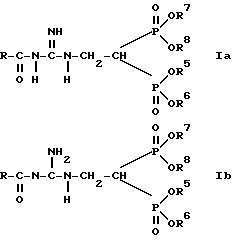
Изобретение относится, следовательно, к соединению таутомерной формулы 1а, 1б, или 1с


и/или к физиологически переносимой соли соединения формулы 1а, 1б или 1с;
при этом
R имеет следующее значение:
1) остаток формулы V

при этом
R11 или R12 имеют следующее значение:
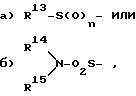
при этом
R13 обозначает
1) (C1 - C6)-алкил,
2) (C5 - C7)-циклоалкил,
3) циклопентилметил,
4) циклогексилметил,
5) фенил,
6) фенил, замещенный однократно-трехкратно через
6.1 атом фтора,
6.2 атом хлора,
6.3 метил или
6.4 метокси,
при этом
n представляет целое число 0, 1 или 2,
при этом
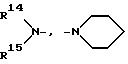
R14 и R15- одинаковые или различные и имеют независимо друг от друга нижеследующее значение:
1) атом водорода,
2) (C1-C6) - алкил,
3) фенил,
4) фенил, замещенный однократно или двукратно через
4.1 атом фтора,
4.2 атом хлора
4.3 метил или
4.4 метокси,
5) -(CH2)m - фенил, причем m представляет целое число 1 - 4 или
6) -(CH2)m - фенил, причем m представляет целое число 1 - 4 и фениловый остаток замещен однократно или двукратно через указанные в 4.1 - 4.4 остатки,
7) R14 и R15 образуют вместе прямую или разветвленную цепь с 4-7 атомами углерода, цепь может быть дополнительно прервана через
7.1 O,
7.2 S или
7.3 NR10,
при этом R10 обозначает
1) атом водорода или
2) метил или
8) R14 и R15 вместе с атомом азота, с которым они связаны, образуют
8.1 дигидроиндоловое,
8.2 тетрагидрохинолиновое или
8.3 тетрагидроизохинолиновое кольцо,
и соответственно другой заместитель обозначает R11 или R12
a) атом водорода,
б) атом галогена, как атом фтора, атом хлора, атом брома или атом йода,
c) (C1 - C4)-алкил,
d) (C1 - C4)-алкокси,
e) фенокси,
f) фенокси, одно-трехкратно замещенный через
1) атом фтора или атом хлора,
2) метил или
3) метокси,
g) R13 - S(O)n, при этом n представляет целое число 0,1 или 2 и R23 имеет вышеназванное значение или

при этом
R14 и R15 имеют указанное значение или
11) остаток формулы VI
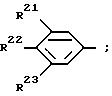
при этом
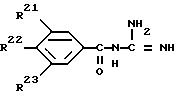
R21, R22 или R23 имеют следующее значение:
а) атом водорода,
б) атом галогена, как атом фтора, атом хлора, атом брома, атом йода, или
с) (C1 - C12)-алкил,
причем один из заместителей R21, R22 или R23 может обозначать также
1) N3,
2) CN,
3) OH,
4) (C1 - C10)-алкокси,
5) R24 - CnH2n-Om,
при этом
m обозначает число 0 или 1,
n обозначает число 0, 1, 2 или 3,
R24 представляет
1) CpF2p+1
при этом p обозначает число 1, 2 или 3, если n обозначает число 0 или 1,
2) (C3 - C12)-циклоалкил,
3) фенил,
4) пиридит,
5) хинолил или
6) изохинолил,
причем циклическая система остатков 3) - 6) не замещена или замещена остатком из группы
3.1 атом фтора,
3.2 атом хлора,
3.3 CF3,
3,4 - метил
3,5 - метокси или
3.6 NR25R26
при этом R25 и R26- одинаковые или различные и независимо друг от друга имеют значение
3.6.1 атом водорода или
3.6.2 (C1 - C4)-алкил, или
III) остаток формулы VII

при этом
R31, R32, R33 или R34 имеют следующее значение:
а) атом водорода,
б) атом галогена, как атом фтора, атом хлора, атом брома или атом йода,
c) -CN,
d) -NO2,
e) -N3,
f) - (C1 - C6)-алкил, с прямой или разветвленной цепью или
g) R35 - CnH2n-Z-,
при этом n обозначает число 0, 1, 2, 3, 4, 5 или 6, и алкиленовая цепь -CnH2n- прямая или разветвленная, и C-атом может быть замещен через O-, S- или N-атом, R35 представляет
1) атом водорода,
2) (C3 - C6)-алкенил,
3) (C5 - C8)-циклоалкил,
4) (C5 - C8)-циклоалкил с замещенной гидроксигруппой или метиленовая группа замещена через O-, S или N-атом, или
5) фенил, незамещенный или замещенный 1-3 остатками из группы
5.1 атом галогена, как атом фтора, атом хлора, атом брома или атом йода,
5.2 CF3,
5.3 CH3-S(O)x,
при этом x обозначает число 0, 1 или 2,
5.4 R36 - Wy
при этом R36 обозначает атом водорода, метил или этил, W обозначает O-атом, NH или NCH3 и y обозначает 0 или 1,
5.5 CmF2m+1 при этом m представляет число 1, 2 или 3,
5.6 пиридил,
5.7 хинолил или
5.8 изохинолил,
Z представляет
1) -CO-,
2) -CH2-,
3) -[CH(OH)]q-,
при этом q представляет число 1, 2 или 3,
4) -[C(CH3)(OH)]q -,
при этом q представляет число 1, 2 или 3,
5) -O-,
6) -NH-,
7)

8) -S(O)x-,
при этом X представляет 0, 1 или 2,
9) -SO2-NH- или

X имеет нижеследующее значение
а) N или
б) C-R37,
при этом R37 обозначает атом водорода, (C1 - C4-алкил или (C2 - C4)-алкенил,
Y имеет нижеследующее значение
а) NH,
б) -N-(C1-C6)-алкил,
с) -N-(C2-C4 )-алкенил или
d) R35 - Cn-H2n-Z-,
при этом R35, n и Z имеют определение, как в пункте g), R5, R6, R7 и R8 одинаковые или различные в независимости друг от друга имеют следующее значение
а) атом водорода,
б) (C1 - C5)-алкил, с прямой или разветвленной цепью, или
с) фенил.
Если заместители R11, R12, R21, R22, R23, R24, R25, R26, R31, R32, R33, R34 или R35 содержат один или несколько центров асимметрии, то как соединения с S-конфигурацией, так и соединения с R-конфигурацией принадлежат к изобретению. Соединения могут существовать как оптические изомеры, диастереоизомеры, рацематы или как их смеси.
Указанные алкильные остатки могут быть как с прямой цепью, так и с разветвленной цепью.
Предпочитают соединение формулы 1а, 1б или 1с, и/или физиологически переносимую соль соединения формулы 1а, 1б или 1с, причем R имеет следующее значение:
1) остаток формулы V; при этом R11 имеет следующее значение:
а) атом фтора,
б) атом хлора,

при этом R14 и R15 имеют названное значение,
d) R13 - S(O)n - при этом n обозначает 0, 1 или 2, или
e) фенокси, при этом R12 имеет следующее значение:
a) R13 - S(O), при этом n обозначает 0, 1 или 2, или

II) остаток формулы VI; при этом R21, R22 или R23 имеют следующее значение:
a) атом водорода,
b) атом галогена, как атом фтора, атом хлора или атом брома или
c) (C1 - C8)-алкил,
причем один из заместителей R21, R22 или R23 может обозначать также
1) OH,
2) (C1 - C6)-алкокси,
3) R24 - CnH2n-Om,
при этом m обозначает число 0 или 1, n обозначает число 0, 1, 2 или 3,
R24 обозначает
1) CpF2p+1,
при этом p обозначает число 1, если n обозначает число 0 или 1,
2) (C5 - C7)-циклоалкил,
3) фенил,
4) пиридил,
5) хинолил или
6) изохинолил,
причем циклическая система остатков 3) - 6) не замещена или замещена остатком из группы
3.1 атом фтора,
3.2 атом хлора,
3.3 CF3,
3.4 CH3 или
3.5 метокси, или
III) остаток формулы VII; при этом R31, R32, R33 или R34 имеют нижеследующее значение: а) атом водорода,
b) атом галогена, как атом фтора, атом хлора, атом брома или атом йода,
c) (C1 - C6)- алкил, с прямой или разветвленной цепью,
или
d) R35 - CnH2n-Z-,
при этом n представляет число 0,1 или 2, и алкиленовая цепь -CnH2n- прямая или разветвленная и C-атом может быть замещен через O-, S-или N-атом,
R35 представляет
1) атом водорода,
2) (C5 - C8)-циклоалкил,
3) (C5 - C8)-циклоалкил, замещенный гидроксигруппой, или метиленовая группа замещена через O-, S-или N-атом, или
4) фенил, незамещенный или замещенный 1-3 остатками из группы
4.1 атом галогена, как атом фтора, атом хлора, атом брома или атом йода,
4.2 CF3,
4.3 CH3-S(O)x
при этом x представляет 0,1 или 2,
4.4 R36-Wy,
при этом R36 обозначает атом водорода, метил или этил, W представляет O-атом, NH или NCH3 и y обозначает 0 или 1,
4.5 Cm F2m+1,
при этом m обозначает число 1,2 или 3,
4.6 пиридил,
4.7 хинолил или
4.8 изохинолил,
Z представляет
1) -CO-,
2) -CH2-,
3) -[CH(OH)]q-,
q при этом обозначает число 1, 2 или 3,
4) -[C(CH3)(OH)]q-, при этом g обозначает число 1, 2 или 3,
5) -O- или
6) -S(O)x-,
при этом x обозначает 0, 1 или 2,
X имеет следующее значение
a) N или
b) CH,
y имеет нижеследующее значение
a) -N-(C1 - C6) -алкил,
b) -N-(C2 - C4) -алкенил или
c) R35 - Cn-H2n-Z-,
при этом R35 , n и Z определены, как в пункте
d) R5, R6, R7 и R8 одинаковые или различные и независимо друг от друга имеют следующее значение
a) атом водорода или
b) (C1 - C5-алкил, с прямой или разветвленной цепью, и физиологически переносимые соли соединения формулы 1a, 1b или 1 c.
Особенно
предпочитают соединение формулы 1a, 1b или 1c, причем R11 имеет следующее значение:
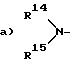
при этом R14 или R15 одинаковые или различные и независимо друг от друга имеют следующее значение
1) атом водорода или
2) (C1 - C4)-алкил, или
R14 и R15 образуют вместе (C4 - C7)-алкильную цепь, или
b) R13 - S-,
при этом R13 представляет
a) фенил или
b) фенил, замещенный хлором в пара-положении,
при этом R12 имеет нижеследующее значение:
a) CH3-SO2-,
b) H2 N - SO2-,
c) фенокси или
d) фенокси, замещенный хлором в пара-положении,
R5, R6, R7 и R8 одинаковые или различные и имеют независимо друг от друга нижеследующее значение
a) атом водорода или
b) (C1 - C4)-алкил,
и физиологически переносимые соли соединения формулы 1a, 1b или 1C.
Особенно предпочитают:
сложный тетраэтиловый эфир 2-[(метил-2-индолилкарбонил)- (аминоиминометил)амино)] -этан-1,1-бис-фосфоновой кислоты,
2-[(1-метил-2-индолилкарбонил)-(аминоиминометил)амино)] -этан- 1,1-бис-фосфоновую кислоту, 2-[(3-метилсульфонил-4-пиперидилбензоил)- (аминоиминометил)амино)] -этан-1,1-бис-фосфоновую кислоту, сложный
тетраэтиловый эфир 2-[(3-метилсульфонил-4-пиперидил-бензоил)- (аминоиминометил)амино)] -этан-1,1-бис-фосфоновой кислоты, сложный тетраэтиловый эфир 2-[(3,5-дихлор-бензол). (аминоиминометил)-амино)]
-этан-1,1-бис-фосфоновой кислоты и 2-[(3,5-дихлор-бензол)-(аминоиминометил)-амино)]-этан-1,1-бис-фосфоновую кислоту.
Соединения по изобретению можно получить, например, следующим образом.
Соединение формулы IV

причем
R5, R6, R7 и R8 имеют названное в формуле Ia значение, вступают во взаимодействие с
A) соединением формулы III

в присутствии инертного растворителя до соединения формулы Ia, Ib и Ic, причем R11 и R12 имеют названное в формуле Ia, Ib и Ic значение, и в случае необходимости
B) сложный эфир бис-фосфоновой кислоты соединения формулы Ia, Ib или 1c превращают в соответствующую бис-фосфоновую кислоту или
соединение формулы IV, причем R5, R6, R7 и R8 имеют названное в формуле 1a значение, вступает во взаимодействие
C) с соединением формулы VIII
в присутствии инертного растворителя до соединения формулы Ia, Ib или Ic, причем R21, R22 и R23 имеют названное в формуле Ia, Ib или Ic значение, и в случае необходимости
D) сложный эфир бис-фосфоновой кислоты соединения формулы Ia, Ib или Ic превращают в соответствующую бис-фосфоновую кислоту или
соединение формулы IV, причем R5, R6, R7 и R8 имеют названное в формуле 1a значение, вступает во взаимодействие
E) с соединением формулы IX

в присутствии инертного растворителя до соединения формулы Ia, Ib или Ic, причем R31, R32, R33 и R34 имеют названное в формуле Ia, Ib или Ic значение, и в случае необходимости
F) сложный эфир бис-фосфоновой кислоты соединения формулы Ia, Ib или Ic превращают в соответствующую бис-фосфоновую кислоту.
При варианте способа A) лучше всего действовать таким образом, что соединение формулы III в эквимолярном количестве или в избытке до трехкратного количества вступает во взаимодействие в случае необходимости в инертном растворителе, как диметилсульфоксид (DMSO), диметилформамид (DMF), толуол, (C1 - C4)-алканол, тетрагидрофуран (THF), диоксан или простой диэтиловый эфир, с соединением формулы IV при добавке основания, как карбонат калия, карбонат натрия, гидроокись калия, триэтиламин, диэтиламин или на выбор также без добавки основания до соединения формулы Ia, Ib или Ic. Температуры реакции составляют около 25 - 100oC, преимущественно при применении растворителя при 25oC и при точке кипения растворителя, особенно при 70oC. Время реакции составляют 6 - 48 ч, предпочтительно 12 - 24 ч. Окончание реакции можно определять, например, при помощи тонкослойной хроматографии.
Для выделения и для очистки продуктов реакции формулы Ia, Ib или Ic реакционную смесь можно очищать на колонке с силикагелем со смесью растворителей из уксусного эфира и спирта, объемное отношение составляет, например, 6: 1. Полученные соединения формулы Ia, Ib или Ic можно превращать в соответствующие бис-фосфоновые кислоты гидролизом (вариант способа B), например нагреванием при флегме в концентрированной соляной кислоте или обработкой сильными кислотами или триметилсилилгалогенидом в безводном растворителе и последующим гидролизом. Безводную бромистоводородную кислоту в уксусной кислоте можно применять непосредственно или после соответствующего разбавления, или применяют триметилсилилйодид, растворенный в растворителе, как четыреххлористый углерод, диметилформамид. хлороформ или толуол. Гидролиз можно проводить при охлаждении или при нагревании, например можно превращать сложный эфир с триметилсилилгалогенидом при охлаждении при -10oC или ниже и получают частично омыленный продукт.
Исходные соединения варианта способа A) для соединений III и IV можно получать простым образом из литературы способами (Европейский патент 0 298 553; Европейский патент 0 416 499).
При варианте способа C) лучше всего действовать таким образом, что соединение VIII и эквимолярном количестве или в избытке до трехкратного количества в случае необходимости в инертном растворителе, как диметилсульфоксид (DMSO), диметилформамид (DMF), толуол, (C1 - C4)-алканол, тетрагидрофуран (THF), диоксан или простой диэтиловый эфир, вступает во взаимодействие с соединением формулы IV при добавке основания, как карбонат калия, карбонат натрия, гидроокись калия, триэтиламин, диэтиламин или на выбор также без добавки основания до соединения формулы Ia, Ib или Ic. Температуры реакции составляют около 25 - 100oC, преимущественно при применении растворителя приблизительно между 25oC и точкой кипения растворителя, особенно при 70oC. Времена реакции составляют 6 - 48 ч, предпочтительно 12 - 24 ч. Окончание реакции можно определять, например, при помощи тонкослойной хроматографии.
Для выделения и очистки продуктов реакции формулы Ia, Ib и Ic реакционную смесь можно очищать на колонке с силикагелем со смесью растворителей из уксусного эфира и спирта, объемное отношение составляет, например, 6:1. Полученные соединения формулы Ia, Ib или 1c можно превращать в соответствующие бис-фосфоновые кислоты гидролиза (вариант способа D), например, нагреванием при флегме в концентрированной соляной кислоте или обработкой с сильными кислотами или триметилсилилгалогенидом в безводном растворителе и последующим гидролизом. Безводную бромистоводородную кислоту в уксусной кислоте можно применять непосредственно или после соответствующего разбавления, или применяют триметилсилилйодид, растворенный в растворителе, как четыреххлористый углерод, диметилформамид, хлороформ или толуол. Гидролиз можно проводить при охлаждении или при нагревании, например, можно превращать сложный эфир с триметилсилилгалогенидом при охлаждении при -10oC или ниже и получают частично омыленный продукт.
Исходные соединения варианта способа C) для соединения формулы IV можно получать простым образом известными из литературы способами (Европейский патент 0 298 553; Европейский патент 0 416 499).
Соединения
формулы VIII можно получать в результате того, что соединение формулы II
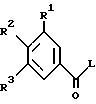
вступают во взаимодействие с гуанидином, где R1 - R3 имеют указанное значение и L обозначает легко нуклеофильно замещаемую остаточную группу.
Активированные производные кислоты формулы II, где L обозначает алкокси-, преимущественно метоксигруппу, феноксигруппу, фенилтио-, метилтио-, 2-пиридилтиогруппу, азотный гетероцикл, преимущественно 1-имидазолил, выгодно получать известным образом из взятых за основу хлорангидридов карбоновой кислоты (формула II, L = Cl), которые со своей стороны можно получать снова известным образом из взятых за основу карбоновых кислот (формула II, L = OH), например, при помощи хлористого тионила. Наряду с хлорангидридами карбоновой кислоты формулы II (L = Cl) можно получать также другие активированные производные кислоты формулы II известным образом непосредственно из взятых за основу производных бензойной кислоты (формула II, L = OH), как, например, сложный метиловый эфир формулы II с L = OCH3 обработкой газообразной HCl в метаноле, имидазолиды формулы II обработкой карбонилдиимидазолом (L = 1-имидазолил, Staab, Angew. Chem. Int. Ed. Eng 1 1,351-367 (1962)), смешанные ангидриды II с Cl-COOC2 H5 или тозилхлоридом в присутствии триэтиламина в инертном растворителе, как и активирования бензойных кислот с дициклогексилкарбодиимидом (DCC) или O-[(циано(этоксикарбонил)метилен)амино] -1,1,3,3- тетраметилуронийтетрафторборатом ("TOTU") (Weiss u. Krommer, Chemiker Zeitung 98, 817 (1974)). Ряд подходящих методов для получения активированных производных карбоновой кислоты формулы II приведен при указании литературного источника J. March, Advanced Organic Chemistry, третье издание (John Wiley & Sons, 1985), стр. 350.
Превращение активированного производного карбоновой кислоты формулы II с гаунидином происходит известным образом в протонном или апротонном полярном, но инертном органическом растворителе. При этом при превращении сложных метиловых эфиров бензойной кислоты (II, L = OMe) с гуанидином метанол и тетрагидрофуран сохраняют между 20oC и точкой кипения этих растворителей. При большинстве превращений соединений II с обессоленным гуанидином было выгодно работать в апротонных инертных растворителях, как тетрагидрофуран, диметоксиэтан, диоксан. Но при употреблении основания, как, например, NaOH в качестве растворителя при превращении II применяют также воду.
Если L = Cl, выгодно работать при добавке ловушки кислоты, например, в форме избыточного гуанидина для связывания галоидоводородной кислоты.
Часть взятых за основу производных бензойной кислоты формулы II известны и описаны в литературе. Неизвестные соединения формулы II можно получать известными из литературы методами.
Карбоновые кислоты или их сложные эфиры формулы II (напр. = L-OH или -O- метил) с R2 в значении галогена или R3 в значении нитро могут служить как разнообразные исходные соединения для других карбоновых кислот формулы II, причем галоген в положении R2 весьма легко заменяют известным образом на многочисленные нуклеофильные реактивы, как фенолы или спирты R4-CnH2n-OH или их соли щелочного металла с образованием соответствующих производных бензойной кислоты. Таким же образом нитрогруппы после восстановления до соответствующей аминобензойной кислоты в результате реакций Зандмейера или Ульмана могут приводить к желаемым галогено-замещенным производным бензойной кислоты. Хлор, бром или йод во многих случаях можно вводить в соответствующую бензойную кислоту также в результате прямого галогенирования при помощи катализатора Фриделя-Крафтса известным образом.
В варианте Е) лучше всего действовать таким образом, что соединение формулы IX в эквимолярном количестве или в избытке до трехкратного количества превращают в случае необходимости в инертном растворителе, как диметилсульфоксид (DMSO), диметилформамид (DMF), толуол, (C1 - C4)-алканол, тетрагидрофуран (THF), диоксан или простой диэтиловый эфир, с соединением формулы IV при добавке основания, как карбонат калия, карбонат натрия, гидроокись калия, триэтиламин, диэтиламин или на выбор также без добавки основания, до соединения формулы Ia, Ib или Ic. Температуры реакции составляют около 25-100o C, преимущественно при применении растворителя температуры реакции составляют от 25oC до точки кипения растворителя, особенно около 70oC. Времена реакции составляют 6 - 48 ч, предпочтительно 12 - 24 ч. Окончание реакции можно определять, например, при помощи тонкослойной хроматографии.
Для выделения и для очистки продуктов реакции формулы Ia, Ib или Ic реакционную смесь можно очищать на колонке с силикагелем со смесью растворителей из уксусного эфира и/или спирта, объемное отношение составляет, например, 6: 1. Полученные соединения формулы Ia, Ib или Ic можно превращать в соответствующие бис-фосфоновые кислоты гидролизом (вариант способа F), например нагреванием при флегме в концентрированной соляной кислоте, или обработкой сильными кислотами или триметилсилилгалогенидом в безводном растворителе и последующим гидролизом. Безводную бромистоводородную кислоту в уксусной кислоте можно применять непосредственно или после соответствующего разбавления, или применяют триметилсилилйодид, растворенный в растворителе, как четыреххлористый углерод, диметилформамид, хлороформ или толуол. Гидролиз можно проводить при охлаждении или при нагревании, например можно превращать сложный эфир с триметилсилилгалогенидом при охлаждении при -10oC или ниже, и получать частично омыленный продукт.
Исходные соединения варианта способа А) для соединения формулы IV можно получать простым образом известными из литературы способами (Европейский патент 0298553; Европейский патент 0416499).
Соединения формулы IX, можно получать известным образом (патент ФРГ 4326005.5).
Изобретение относится также к лекарственным средствам, которые содержат по меньшей мере эффективное количество по меньшей мере соединения формулы Ia, Ib или Ic и/или по меньшей мере одной из физиологически переносимых солей соединения формулы Ia, Ib или Ic, наряду с пригодным в фармации и физиологически переносимыми вспомогательными веществами и веществами-носителями, разбавителями и/или другими активными веществами.
Далее изобретение относится к применению соединений формулы Ia, Ib или Ic и/или их физиологически переносимых солей для получения лекарственного средства для профилактики и лечения дегенеративных заболеваний костной системы.
Изобретение относится кроме того к применению соединений формулы Ia, Ib или Ic и/или их физиологически переносимых солей для получения лекарственного средства для лечения заболеваний с повышенной костной резорбцией, особенно остеокарцином и метастазами, болезни Педжета, гиперкальцимии или остеопороза.
Лекарственные средства согласно изобретению можно назначать поверхностно, через кожу, в ном, внутривенно, внутримышечно, внутрибрюшинно, подкожно, внутрь суставов, периартикулярно, ректально или орально.
Лекарственные средства согласно изобретению для профилактики и лечения остеопороза получают в результате того, что по меньшей мере соединение формулы Ia, Ib или Ic и/или одну из их физиологически переносимых солей в данном случае при помощи вспомогательных веществ и/или веществ-носителей приводят в подходящую форму введения. Вспомогательные вещества и вещества-носители принадлежат к группе носителей, консервирующих средств и других обычных вспомогательных веществ.
При этом соединение формулы Ia, Ib и Ic можно применять одно или вместе со вспомогательными галеновыми препаратами, как в ветеринарной медицине, так и в медицине.
Специалисту известно какие вспомогательные вещества пригодны для желаемого рецепта лекарственных средств. Наряду с растворителями, средствами для образования геля, основами для свечей, вспомогательными веществами для таблеток и другими носителями активного вещества можно применять, например, антиокислители, диспергирующие средства, эмульгаторы, пеногасители, вещества, улучшающие вкус, консерванты, агенты растворения или красители.
Для оральной формы применение активные соединения перемешивают с подходящими для этого добавками, как вещества-носители, стабилизаторы или инертные растворители, и переводят обычными методами в подходящие формы введения, как таблетки, драже, вставные капсулы, водные, спиртовые или масляные растворы. В качестве инертных носителей можно применять, например гуммиарабик, магнезию, карбонат магния, фосфат калия, молочный сахар, глюкозу или крахмал, особенно кукурузный крахмал. При этом можно приготовлять как сухой, так и влажный гранулят. В качестве маслянистых веществ-носителей или в качестве растворителей применяют, например, растительные или животные масла, как подсолнечное масло или рыбий жир.
Для подкожного или внутривенного применения активные соединения при желании с обычными для этого веществами, как агенты растворения, эмульгаторы или другие вспомогательные вещества, растворяются, образуют суспензию или эмульсию. В качестве растворителей принимают, например во внимание: воду, физиологический раствор хлористого натрия или спирты, например этанол, пропанол, глицерин, наряду с этим также растворы сахара, как растворы глюкозы или маннита, или также смесь из различных названных растворителей.
В качестве фармацевтического состава для назначения в форме аэрозолей при разбрызгивателей применяются, например растворы, суспензии или эмульсии активного вещества формулы Ia, Ib или Ic в фармацевтически невызывающем опасений растворителе, как особенно этанол или вода, или в смеси таких растворителей. Состав по мере надобности может содержать также еще другие фармацевтические вспомогательные вещества, как поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также рабочий газ. Такая рецептура содержит активное вещество обычно в концентрации 0,1 - 10, особенно 0,3 - 3 мас.%.
Дозировка назначаемого активного вещества формулы 1а, 1б или 1с и частота назначения зависят от силы действия и от продолжительности действия примененного соединения; кроме того, также от вида и степени заболевания, которое лечат, а также от пола, возраста, массы и от индивидуальной предрасположенности млекопитающего или человека, которого лечат.
Применяемая дозировка лекарственных средств по изобретению зависит от различных факторов, как форма введения медикамента и состояние, масса и тяжесть заболевания пациента. Однако суточная доза около 5000 мг должна превышаться только на короткое время. В качестве суточной дозы предпочитают 10 - 2500 мг для человека массой 70 кг. Назначение суточной дозы лекарственных средств по изобретению можно проводить в форме отдельного назначения или за несколько маленьких доз. Предпочитают назначение за 3 - 8 доз в сутки.
Ниже изобретение поясняют подробнее на основании примеров. Данные в процентах относятся к объемным процентам, если нет других указаний.
Пример 1. Получение сложного тетраэтилового эфира 2-[(3-метилсульфонил-4-пиперидил-бензоил)-(аминоиминометил)амино] -этан-1,1- бисфосфоновой кислоты.
3,24 г (10 ммолей) (3-метилсульфонил-4-пиперидил-бензоил)-(аминоиминометил)амина и 3,0 г (10 ммолей) сложного тетраэтилового эфира винилдифосфоновой кислоты растворяют в 40 мл абсолютного тетрагидрофурана. Для этого добавляют 0,5 г (3,6 ммоля) сухого карбоната калия и нагревают 3,5 ч в атмосфере защитного газа до кипения. Затем снова добавляют 0,33 г (2,4 ммоль) карбоната калия и нагревают еще 2 ч. до кипения. Потом перемешивают реакционную смесь еще 16 ч при комнатной температуре. После отфильтровывания и отделения растворителя получают 4,5 г сырого вещества. Вещество подвергают хроматографии на колонке с силикагелем. В качестве растворителя служит уксусный эфир с 10% этанола.
Выход: 3,2 г (52% от теории).
Точка плавления 148-152oC.
31 P-NMR-спектроскопия (NMR - ядерный магнитный резонанс) : (CDCl3) dP = 21,77 ппм.
Пример 2. Получение 2-[(3-метилсульфонил-4-пиперидил-бензоил)- (аминоиминометил)амино]-этан-1,1-бис-фосфоновой кислоты.
1,5 г (2,4 ммоль) сложного тетраэтилового эфира 2-[(3-метил- cульфонил-4-пиперидил-бензоил)-(аминоиминометил)амино)] -этан- 1,1-бис-фосфоновой кислоты из примера 1 растворяют в 60 мл абсолютного диоксана при 60oC. Затем доводят реакционный раствор до комнатной температуры и добавляют 1,64 г (10,8 ммоль) бромтриметил-силана. Перемешивают 16 ч при комнатной температуре и нагревают затем еще 4 ч до 60oC. Потом отделяют растворитель и низкокипящий компонент при 0,1 торр/40oC. К остатку добавляют затем 15 мл воды и смесь перемешивают 4 ч при комнатной температуре. Образовавшийся остаток отфильтровывают и промывают несколько раз этанолом. Затем кипятят полученный при этом остаток в 20 мл метанола и 1 мл воды.
Выход: 460 мг (38% от теории).
Точка плавления 209oC.
31P-NMR-спектроскопия:
(NaOD/D2O) 19,13 мпп.
Пример 3. Получение сложного тетраэтилового эфира 2-[(3, 5-дихлор-бензоил-(аминоиминометил)амино]]-этан-1,1-бис- фосфоновой кислоты.
650 мг (2,4 ммоль (3,5-дихлор-бензоил)-(аминоиминометил)амина и 730 мг (2,4 ммоль) сложного тетраэтилового эфира винилдифосфоновой кислоты растворяют в 30 мл толуола и 6 мл диметилформамида (DMF). Туда добавляют 0,17 г (2,4 ммоля) сухого карбоната калия и нагревают 21 ч до кипения. Затем реакционный раствор фильтруют и вращают. Получают 1,8 г сырого продукта. Вещество очищают на колонке с силикагелем. В качестве растворителя служит ацетон.
Выход: 450 мг (35% от теории).
Точка плавления 146-149oC.
31P-NMR-спектроскопия:
(CDCl3) 21,73 ппм.
Пример 4. Получение 2-[(3, 5-дихлор-бензоил)- (аминоиминометил)амино)]-этан-1,1-бис-фосфоновой кислоты.
350 мг (0,62 ммоль) сложного тетраэтилового эфира 2-[(3,5-дихлор-бензоил)-(аминоиминометил)амино)]-этан-1, 1-бис- фосфоновой кислоты растворяют в 20 мл ацетонитрила. Добавляют в атмосфере аргона 0,3 г йодида натрия и 0,41 мл (3,10 ммоль) бромтриметилсилана. Перемешивают 16 ч при комнатной температуре и затем 1 ч при 40oC. Потом отфильтровывают образовавшийся бромид натрия и отделяют маточный раствор от растворителя и низкокипящих компонентов при 0,1 торр/40oC. К остатку добавляют 20 мл хлористого метилена и снова отсасывают от образованного твердого вещества. Хлористый метилен отделяют при 0,1 торр/40oC.
Затем добавляют 15 мл воды и перемешивают 15 мин при комнатной температуре. Воду удаляют при 12 торр/60oC. К полученному остатку добавляют затем 10 мл изопропанола и добавляют около 1-2 мл воды. Все это нагревают 5 мин. После охлаждения отсасывают бесцветные кристаллы и сушат в вакууме при 12 торр.
Выход: 170 мг (60%).
Точка плавления 267oC.
31
Р-NMR-спектроскопия:
(NaOD/D2O) δ31P=19,09 ппм.
1H-NMR-спектроскопия:
(NaOD/D2) δ = 1,90 (tt,2
JPH=14 Гц,3JPH=6 Гц, 1H); 3,48 (td,3JPH=14 Гц,3JHH=6 Гц, 2H; 7,45 (S, 1H); 7,54 (S2H).
C13
-NMR-спектроскопия:
(NaOD/D2O) δ = 43,8 (C-1); 44,1 (C-2); 129,9 (C-3'); 133,0 (C-4); 136,7 (C-5, O-5'); 142,0 (C-6); 162,5 (C-Gua); 174,9 (C=0).
MS-спектроскопия:
m/e= 419
Пример 5. Получение сложного тетраэтилового эфира 2-[(1-метил-2-индолилкарбонил)-(аминоиминометил)амино)] - этан-1,1-бисфосфоновой кислоты.
1,0 г (3,9 ммоль) (1-метил-2-индолилкарбонил-гуанидин-гидрохлорида) и 1,2 г (4 ммоля) сложного тетраэтилового эфира винилдифосфоновой кислоты растворяют в 40 мл тетрагидрофурана (THF) и 15 мл диметилформамида (DMF). Туда добавляют 0,55 г (4 ммоля) сухого карбоната калия и нагревают 21 ч до кипения. Затем реакционную смесь фильтруют и вращают. Получают 2,0 г сырого продукта. Вещество очищают на колонке с силикагелем. В качестве растворителя служит этанол.
Выход: 1,4 г (70% от теории).
31P-NMR-спектроскопия:
(CDCI3)
δ = 21,98 ппм.
Пример 6. Получение 2-[(1-метил-2-индолилкарбонил)- (аминоиминометил)амино)]-этан-1,1-бис-фосфоновой кислоты.
1 г (1,8 ммоль) 2-[(1-метил-2-индолилкарбонил)- (аминоиминометил)амино] -этан-1,1-бис-фосфоновой кислоты из примера 5 растворяют в 40 мл ацетонитрила. Туда добавляют в атмосфере аргона 0,6 г йодида натрия и 1,2 мл (90 ммоль) бромтриметилсилана. Перемешивают 16 ч при комнатной температуре и затем 1 ч при 40oC. Потом отфильтровывают образовавшийся бромид натрия и отделяют маточный раствор от растворителя и низкокипящих компонентов при 0,1 торр/40oC. К остатку добавляют 20 мл хлористого метилена и снова отсасывают от образованного твердого вещества. Хлористый метилен отделяют при 0,1 торр/40oC. Затем добавляют 15 мл воды и перемешивают 15 мин при комнатной температуре. Воду удаляют при 12 торр/60oC. К полученному остатку добавляют затем 10 мл изопропанола и добавляют около 1-2 мл воды. Все это нагревают 5 мин. После охлаждения отсасывают бесцветные кристаллы и сушат при 12 торр.
Выход: 300 мг (38%).
31P-NMR-спектроскопия:
(NaOD/D2O) δ P=18,07 ппм.
1H-NMR-спектроскопия:
(NaOD/D2O) δ = 1,98 (tt,2JPH = 14 Гц,3JHH = 6 гц, IH); 3,65(td3JPH = 14 Гц,3JHH = 6 Гц, 2H); 7,08-8,56 (ароматические углеводороды - H, 5).
13C-NMR-спектроскопия:
(NaOD/D2O) δ = 32,5 (C-1); 41,8 (C-2); 41,9 (C-3); 103,2 (C-4); 105,2 (C-5); 120,2 (C-6); 122,0 (C-7); 124,1 (C-8); 126,2 (C-9);
137,8 (C-10); 139,2 (C-11); 139,7 (C-12); 160,8 (C-Gua); 172,2 (C=0).
MS-спектроскопия:
m/e=419.
Пример 7. Получение сложного тетраэтилового эфира 2-[(3-метилсульфонил-4-фенокси-бензоил)-(аминоиминометил)амино] - этан-1,1-бис-фосфоновой кислоты.
1,8 г (4,86 ммоль) (3-метилсульфонил-4-фенокси-бензоил)- (аминоиминометил)амина и 1, 46 г (4,86 ммоля) сложного тетраэтилового эфира винилдифосфоновой кислоты превращают, как описано в примере 1.
Вещество подвергают хроматографии на колонке с силикагелем. В качестве растворителя служит уксусный эфир: ацетон = 1:1.
Выход: 800 мг (26%).
Точка плавления 145oC.
31P-NMR-спектроскопия:
(CDCl3) δ31P= 22,10 ппм.
1H-NMR-спектроскопия:
(CDCl3) δ = 1,35 (t, 12H); 3,31 (S, 3H); 4,0 (mc, 2H); 4,20 (mc, 9H);
6,88 (d, 1H); 7,13 (mc, 2H); 7,24 (mc, 1H); 7,42 (mc, 2H); 8,35 (d, 1H); 8,89 (S, 1H) ппм.
13C-NMR - спектроскопия:
(CDCl3) δ = 16,43; 29,30; 37,89;
43,36; 53,87; 63,14; 117,25; 120; 36; 125,33; 129,72; 130,25; 155,06; 157,82; 175,0 ппм.
Пример 8. Получение сложного тетраэтилового эфира 2-[(3-метилсульфонил-4-N, N-диэтиламино-бензоил)-(аминоиминометил)амино] - этан-1,1-бис-фосфоновой кислоты.
1,0 г (2,9 ммоль) (3-метилсульфонил-4-N-N-диэтиламинобензоил)- (аминоиминометил)амина и 0,9 г (2,9 ммоль) сложного тетраэтилового эфира винилдифосфоновой кислоты превращают, как описано в примере 1.
Вещество подвергает хроматографии на колонке с силикагелем. В качестве растворителя служит уксусный эфир: ацетон = 1:1.
Выход:1,2 г (66,6%).
Точка плавления 121oC.
31P-NMR-спектроскопия:
(CDCl3)
δ31P = 22,12 ппм.
1H-NMR-спектроскопия:
(CDCl3) δ =1,07 (t, 6H); 1,35 (t, 12H); 3,18 (q, 4H); 3,34 (S, 3H); 3,98 (mc, 2H); 4,20
(mc, 9H); 7,32 (d, 1H); 8,36 (d, 1H); 8,92 (S, 1H) ппм.
13C-NMR-спектроскопия:
(CDCl3) δ 12,09; 16,38; 38,20; 42,59; 48,37; 63,34; 124,46; 137,21;
136,99; 153,34; 175,64 ппм.
Пример 9. Получение 2-[(3-метилсульфонил-4-фенокси-бензоил)- (аминоиминометил)амино]-этан-1,1-бис-фосфоновой кислоты.
350 мг (0,55 ммоль) сложного тетраэтилового эфира 2-[(3-метилсульфонил-4-фенокси-бензоил)-(аминоиминометил)амино] - этан-1,1-бис-фосфоновой кислоты из примера 7 превращают, как описано в примере 2.
Продукт после гидролиза отсасывают 40 мл воды и промывают 30 мл ацетона.
Выход: 150 мг (52,4%).
Точка плавления 242oC.
31
P-NMR-спектроскопия:
(NaOD/D2O) δ31P = 17,65 ппм.
1H-NMR-спектроскопия:
(NaOD/D2O) δ = 2,04 (tt, 1H); 3,50
(S, 1H); 3,65 (td, 2H); 7,06 (d, 1H); 7,26 (d, 2H); 7,38 (mc, 1H); 7,54 (mc, 2H); 8,20 (mc, 1H); 8,55 (m, 1H) ппм.
Пример 10. Получение 2-[(3-метилсульфонил-4-N, N-диэтиламино- бензоил)-(аминоиминометил)амино]-этан-1,1-бис-фосфоновой кислоты.
600 мг (0,92 м ммоль) сложного тетраэтилового эфира 2-[(3-метилсульфонил-4-N, N-диэтиламино-бензоил)-(аминоиминометил)-амино)] -этан-1,1-бис-фосфоновой кислоты из примера 8 превращают, как описано в примере 2.
После гидролиза с 30 мл воды продукты отсасывают и затем смешивают с ацетоном.
Выход: 483 мг (100%).
Точка плавления 181oC.
31P-NMR-спектроскопия.
(NaOD/D2O) δ31P = 17,70 ппм.2JPH = 20,9 Гц,3JPH = 14,2 Гц).
1H-NMR-спектроскопия:
(NaOD/D2
O) δ =1,03 (t, 6H); 2,11 (tt, 1H); 3,12 (q, 4H); 3,53 (S, 3H); 3,65 (td, 2H); 7,58 (d, 1H); 8,26 (mc, 1H); 8,58 (m, 1H) ппм.
Пример 11. Эффективность соединений согласно изобретению доказывают в пробирке в следующих опытах.
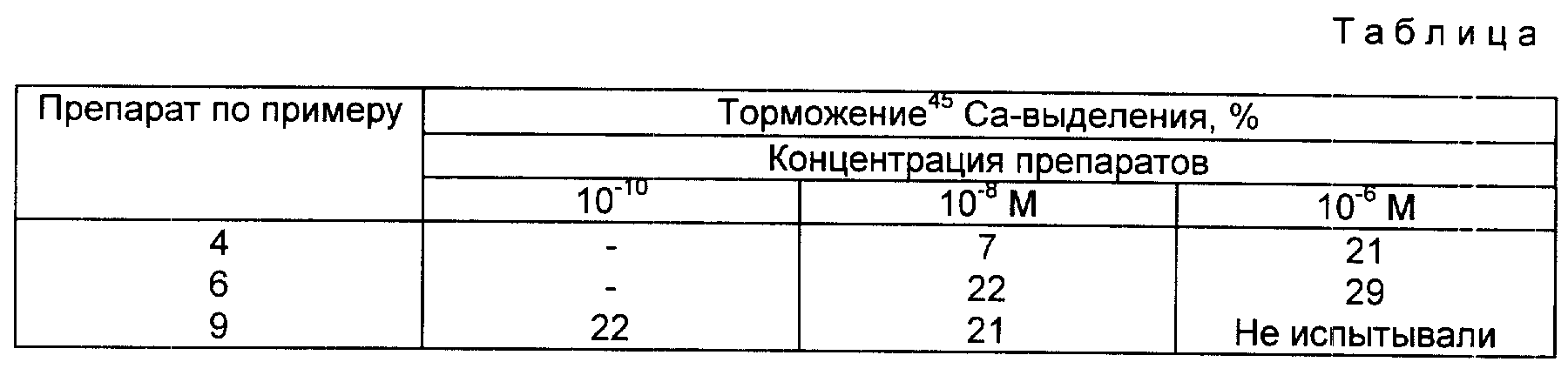
Костную резорбцию определяют на основании анализа45Ca-выделения из черепной коробки эмбриональных крыс, возрастом 20 дней. На кости наносят маркировку, причем беременным крысам впрыскивают 200 микрокюри/кг45CaCl2, за 2 дня до этого вскрывают черепную коробку зародышей.
1. Культивирование костей.
Черепную коробку зародышей делят на две половины. Одна половина черепной коробки служит для контроля, другая половина инкубируется соединениями согласно изобретению.
Каждую половину черепа культивируют в стерильной пластиковой чашке. Питательная среда (BGSb-среда, Gibco) содержит по 1 мл 10% эмбриональной сыворотки теленка, пенициллинстрептомицина (100000 ед./л, Gibco) и аскорбиновую кислоту (50 мг/л). Половины черепа инкубируют при 37oC, в газовой атмосфере 5% CO2 и 95% O2. Через 48 ч питательную среду заменяют свежей, добавляют соединения согласно изобретению и паратироид-гормон (10-7 M) и инкубируют еще 48 ч. Для контроля добавляют паратироид. Гормон (10-7 M сигма).
В конце эксперимента определяют активность45Ca в питательной среде и в кости.
Результаты в таблице показывают торможение45Ca - выделения в питательную среду в процентах. Результаты представляют среднее значение 3 - 5 экспериментов.
Реферат
Использование: в медицине для предотвращения костной ресорбции. Сущность изобретения: производные гуанидиналкил-1,1-бис-фосфоновых кислот ф-лы /1/ и их таутомерные формы, где R - а/двузамещенный фенил с заместителями R11 и R12 - R13SO2-, R14R15N-, пиридинил, фенокси, галоген, R13, R14, R15 - C1-C6-алкил, в/ N - замещенный индолил, R5-R8 водород или1-C6-алкил. Реагент 1. Соединение ф-лы /II/, где R5 - R8 имеют указанные значения. Реагент 2: соединение ф-лы /III/. Условия реакции: в среде инертного растворителя.

Формула

где R - a) остаток формулы

где R11 и R12 имеют следующие значения: R13-SO2-,
фенокси или галоген, где R13, R14 и R15 - C1 - C6-алкил, b) остаток формулы

где R16 - C1 - C6-алкил;
R5, R6, R7 и R8 - водород или C1 - С6-алкил.

где R5, R6, R7 и R8 имеют названные в формуле Ia согласно п.1 значения,
вступает во взаимодействие с соединением формулы

в присутствии инертного растворителя до соединения формулы Ia, Ib или Ic, причем R11 и R12 имеют названные в формулах Ia, Ib, Ic значения и, в случае необходимости, сложный эфир бис-фосфоновой кислоты соединения формул Ia, Ib или Ic превращают в соответствующую бис-фосфоновую кислоту, или соединение формулы IV, где R5, R6, R7 и R8 имеют названные в формуле Ia значения, вступает во взаимодействие с соединением формулы
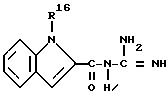
где R16 имеет названные в п.1 значения,
в присутствии инертного растворителя до соединения формулы Ia, Ib или Ic и, в случае необходимости, сложный эфир бис-фосфоновой кислоты соединения формул Ia, Ib и Ic превращают в соответствующую бис-фосфоновую кислоту.
02.12.92 - R представляет собой

где R11 и R12 - R13-SO2, R14R15N- или

R13, R14, R15 - C1 - C6-алкил;
13.05.93 - R представляет собой

где R11 и R12 - фенокси или галоген;
23.09.93 - R - N-замещенный индолил.

Комментарии