Содержащие четвертичный азот фосфонаты для лечения анормального кальциевого и фосфатного метаболизма, а также профилактики и лечения зубных налетов и зубных камней, фармацевтические композиции и способ лечения - RU2126414C1
Код документа: RU2126414C1
Описание
Изобретение относится к новым содержащим четвертичный азот фосфонатным соединениям, включающим бисфосфонаты, фосфоналкилфосфинаты, фосфонкарбоксилаты и фосфонсульфонаты, предпочтительно бисфосфонаты и фосфоналкилфосфинаты. Это изобретение также относится к фармацевтическим композициям, содержащим эти новые соединения, а также к методу лечения или профилактики некоторых нарушений костного метаболизма, характеризующихся анормальным кальциевым и фосфатным метаболизмом, с помощью использования соединения или фармацевтической композиции настоящего изобретения. Конкретно, изобретение касается метода лечения или профилактики остеопороза и артрита, в частности ревматоидного артрита и остеоартрита с использованием соединения или фармацевтической композиции настоящего изобретения. Это изобретение также относится к фармацевтическим композициям, содержащим эти новые соединения, а также к методу лечения или профилактики зубных налетов, камней и гингивита. В частности, это изобретение относится к методу лечения или профилактики в образовании зубного налета и зубных камней с использованием соединения или фармацевтической композиции настоящего изобретения.
Ряд патологических состояний, которым подвержены теплокровные животные, включают анормальный кальциевый и фосфатный метаболизм. Такие состояния можно подразделить на две большие категории.
1. Состояния, которые характеризуются аномальной мобилизацией кальция и фосфата, приводящей к общей или специфической потере костной ткани, такие как остеопороз или болезнь Педжета, или к чрезвычайно высокому содержанию кальция и фосфата в жидкостях тела, такому как гиперкальцемия при начале образования опухоли. Такие состояния иногда называют патологической диминерализацией твердых тканей.
2. Состояния, которые вызывают или являются результатом аномального отложения кальция и фосфата в организме, такие как артрит, включая ревматоидный артрит и остеоартрит. Такие состояния называют здесь патологическими кальцификациями.
Первая категория включает большинство обычных метаболических нарушений кости, остеопороз; остеопороз является состоянием, при котором твердая ткань кости теряется непропорционально развитию новой костной ткани. Остеопороз обычно определяют как уменьшение количества костной ткани или атрофию скелетной ткани. Костные и мозговые пространства становятся больше, фиброзное связывание уменьшается, и компактная кость становится ломкой. Остеопороз можно подразделить на подклассы, такие как постклимактерический, старческий, вызванный лекарственным препаратом (например, адренокортикоидами в стероидной терапии); вызванный болезнью (артрит и опухоль) и пр., однако проявления его фактически одинаковы. Существуют два типа остеопороза: первичный и вторичный. "Вторичный остеопороз" является результатом отдельного патологического процесса или агента. Однако приблизительно 90% всех случаев остеопороза представляют собой "первичный остеопороз". Такой первичный остеопороз включает постклимактерический остеопороз, связанный с возрастом (затрагивающий большинство пожилых людей в возрасте 70 - 80 лет), и идиопатический остеопороз, поражающий мужчин и женщин среднего и более молодого возраста.
У некоторых людей, страдающих остеопорозом, разрежение костной ткани настолько велико, что вызывает механическое повреждение костной структуры. Костные переломы часто происходят в области бедра и позвоночника у женщин, страдающих постклимактерическим остеопорозом. Может также развиться кифоз (аномально увеличенный изгиб грудного отдела позвоночника).
Считают, что механизм потери костной ткани в остеопорозе включает нарушение баланса в процессе "костной реконструкции". Реконструкция костей происходит в течение всей жизни, обновляя скелет и поддерживая прочность кости. Эта реконструкция включает эрозию и заполнение дискретных участков на поверхности костей организованной группой клеток, названных "основные многоклеточные единицы" или "ОМЕ". ОМЕ в основном состоят из "остеокластов", "остеобластов" и их клеточных предшественников. В цикле реконструкции кость подвергается резорбции в месте "активированных" ОМЕ с помощью остеокласта, образуя резорбционную полость. Эта полость затем заполняется костью с помощью остеобласта.
Обычно у взрослых цикл реконструкции приводит к небольшому дефициту костной ткани из-за неполного заполнения резорбционной полости. Таким образом, даже у здоровых взрослых людей с возрастом происходит потеря костной ткани. Однако при остеопорозе количество ОМЕ, которые активизируются, может увеличиваться. Эта повышенная активизация ускоряет реконструкцию кости и приводит к аномально высокому разрежению кости.
Хотя его этиология не совсем ясна, существует много факторов риска, которые, как считают, связаны с остеопорозом. Они включают низкий вес тела, низкое потребление кальция, недостаточную физическую активность и недостаток эстрогена.
Распространенное лечение остеопороза состоит преимущественно во введении кальция и эстрогена.
Вторая категория, включающая состояния, которые характеризуются аномальным отложением кальция и фосфата, охватывает прогрессивный миозит, кальциноз, и такие заболевания, как артриты, включая ревматоидный артрит и остеоартрит, невриты, бурситы, тендиниты и состояния, которые предрасполагают пораженные ткани к отложению на них кальция.
Помимо остеопороза разрежение кости может быть результатом ревматоидного артрита и остеоартрита. Ревматоидный артрит является хроническим, систематическим и суставным воспалительным нарушением, характеризующимся ослаблением суставных капсул и связок, сопровождающимся разрушением хрящей, связок, сухожилий и кости и снижением вязкости и другими изменениями в синовиальной жидкости. Симптомы ревматоидного артрита включают систематическую слабость, усталость, локальную боль, затруднение движений и слабость, опухание и деформацию суставов. Ревматоидный артрит наиболее часто встречается у женщин от 40 до 60 лет.
Патогенез ревматоидного артрита, ведущий к разрушению суставов, характеризуется двумя фазами: 1) экссудативной фазой, включающей микроциркуляцию и синовиальные клетки, которые позволяют входить белкам плазмы и клеточным элементам в сустав и 2) фазой хронического воспаления, которое происходит в подсиновиальной и субхрящевой кости, характеризующейся образованием паннуса (грануляционной ткани) в суставном пространстве, эрозией кости и разрушением хряща. Паннус может образовывать спайки и грануляционную ткань, которые вызывают деформацию суставов, характерную для ревматоидного артрита.
Этиология ревматоидного артрита остается не выясненной. Предполагают вовлечение инфекционных агентов, таких как бактерии и вирусы. В настоящее время существует гипотеза о том, что причиной ревматоидного артрита является вирус Эпштейна-Барра (ЕВУ).
Современное лечение ревматоидного артрита состоит в основном в симптоматическом ослаблении боли введением нестероидных противовоспалительных лекарств. Нестероидное противовоспалительное лечение эффективно в основном на ранних стадиях ревматоидного артрита; маловероятно, что такое лечение будет подавлять суставное воспаление, если болезнь длится более года. Золото, метотрексат, иммуносупрессанты и кортикостероиды также давали ограниченные результаты в лечении.
С другой стороны, остеоартрит представляет собой нарушение невоспалительного характера в суставах, характеризующееся повреждением и эрозией суставного хряща, а также образованием новой кости на суставной поверхности. В процессе прогрессирования остеоартрита поверхность суставного хряща разрушается, и его частицы попадают в синовиальную жидкость, которая в свою очередь стимулирует фагоцитоз клетками макрофагов. Таким образом со временем остеоартрит вызывает воспалительную реакцию. Общие клинические симптомы остеоартрита включают хрящевые и костные увеличения пальцевых суставов, затруднение движений после сна и боль при движении.
Общее симптоматическое лечение остеоартрита включает назначение анальгетиков, противовоспалительных препаратов, стероидов и физиотерапию.
Зубные налеты и камни
Зубные отложения представляют собой шероховатый вязкий налет на зубах, который образуется из слюны, бактерий и частиц пищи и который появляется на зубах в
местах неровностей или краев. Налеты могут вызвать гингивит и порчу зубов и могут служить основой для образования камней, известных как зубные камни, твердых кальцинированных отложений, если они будут
накапливаться.
Зубной камень образуется, когда минеральные соли из слюны, в основном фосфор и кальций, внедряются в зубной налет, образуя твердые жесткие отложения. Камни имеют тенденцию откладываться у отверстий слюнных каналов: на язычных поверхностях нижних резцов и на дистальных поверхностях верхних коренных зубов. По мере развития зрелого камня он становится видимым как белое или желтоватое образование, если не окрашивается или не обесцвечивается каким-либо внешним агентом. Кроме того, что камень не эстетичен, он постоянно покрывается налетом. Токсины в налете и камень раздражают десну, вызывая воспаление и рецессию, что может привести к другим осложнениям.
Предлагалось множество химических и биологических агентов для снижения образования камней или их удаления после образования. Химический подход к снижению образования камня обычно включает ингибирование роста кристаллов, что препятствует образованию камня. Хелатирование ионов кальция разрушает камень путем удаления кальция, но это нежелательно, поскольку также удаляется обычная кальцированная ткань. Механическое удаление этого материала периодически дантистом является древней процедурой в зубном кабинете.
Было предложено множество производных фосфокислоты для использования в лечении и профилактике заболеваний, причиной которых является анормальный метаболизм кальция и фосфата. Например, во многих ссылках, которые сюда включены, раскрываются композиции, содержащие полифосфонаты, в частности дифосфонаты, такие как этан-1-гидрокси-1, 1-дифосфокислота ("EHDP") и их использование для снижения аномальных отложений и мобилизации кальция и фосфата в тканях животных: патент США 3683080, выданный 8 августа 1972 г. и патент США 4230700, выданный 28 октября 1980 г., оба Francis и патент США 4868164 Ebetino, выданный 19 сентября 1989 г. Многочисленные другие работы описывают гетероциклические замещенные фосфокислоты, полезные в лечении остеопороза и/или артрита, которые включены сюда в качестве ссылок. Это следующие источники: U.S. Patent 5, 071, 840, to Ebetino et al., issued December 10, 1991; U. S. Patent 4,858,164, to Ebetino, et al., issued September 19, 1989; U.S. Patent 5,104,863, to Benedict, et al., issued April 14, 1992; U.S. Patent 4,267,108, to Blum et al., issued May 12, 1981; U.S. Patent 4,746,654 to Breliere et al., issued May 24, 1988; U.S. Patent 4,876,247, to Barbier et al. , issued October 24, 1989, and European Patent Application Publication No. 100,718, of Breliere, published February 15, 1984; European Patent Application Publication No. 170,228, of Boehringer Mannheim GmbH, published February 5, 1986; European Patent Application Publication No. 186,405, of Benedict and Perkins, published July 2, 1986; European Patent Application Publication No. 298,553, of Ebetino, published January 11, 1989; U.S. Patent 4,754,993, to Bosies et al., issued November 15, 1998; U.S. Patent 4,939,130, to Jaeggi et al., issued July 3, 1990; U.S. 4,971,958 to Bosies et al. , issued November 20, 1990; WO 90/12017, Dunn et al., published October 18, 1990; WO 91/10646, Youssefyeh, R., et al., published July 25, 1991; AU-A-26738, Jaeggi, publication date June 15, 1989; AU-A-45467/89 of Ciba-Geigy, publication date May 31, 1990.
Наконец, в патенте США 4208401 Bauman, выданном 17 июня 1980 г., раскрываются замещенные четвертичные бисфосфонаты аммония негетероциклического кольца, полезные в качестве противокамневых агентов.
Выложенная заявка DE 4011777 Jaeggi от 18 октября 1990 г. раскрывает замещенный дифосфонат гетероциклического кольца, в котором указанным гетероциклическим кольцом может быть замещенный низший алкил. Указанное гетероциклическое кольцо связано мостиковой связью с группой фосфокислоты через четвертичный некольцевой атом азота. DE' 777 раскрывает также то, что соединения заметно замедляют резорбцию кости и поэтому пригодны для лечения остеопороза, воспалительных заболеваний и заболеваний, связанных с перерождением суставов, перидонтита и гиперпаратиреоза. Эти патенты и заявки включены сюда в качестве ссылок.
Однако ни в одной из этих ссылок не раскрывается полезность гетероциклического фосфонатного соединения, содержащего четвертичный азот, в профилактике и лечении как остеопороза, артрита, так и зубных камней, налетов и гингивита.
Соединения настоящего изобретения обладают "остео-защитной" активностью в месте разрушения сустава в состоянии артрита, и эта активность является дополнительным преимуществом при лечении артрита над препаратами, просто облегчающими симптомы воспаления. Используемый здесь термин "остео-защитная активность" означает активность, изменяющая патологический процесс на кости и окружающей ее мягкой тканью в месте разрушения сустава.
Неожиданно было выявлено, что гетероциклические фосфонатные соединения настоящего изобретения, которые содержат кватернизированный атом азота, обладают более сильной антирезорбтивной активностью и терапевтической полезностью в лечении и профилактике остеопороза, артрита (включая ревматоидный артрит и остеоартрит) и зубных камней, налетов, чем фосфонатные соединения с гетероциклическим кольцом, которые не содержат кватернизированного атома азота. Кроме того, соединения настоящего изобретения демонстрируют необычные свойства растворимости. Таким образом, соединения настоящего изобретения гораздо легче абсорбируются при пероральном приеме. Чем легче абсорбируется соединение, тем более эффективным оно может быть при более низких дозах. Более низкие дозы обычно более предпочтительны, поскольку снижаются нежелательные побочные действия.
Поэтому целью изобретения является получение новых, более сильнодействующих соединений, которые полезны в лечении остеопороза, а также как противоартритные агенты (в лечении остеоартрита и ревматоидного артрита) и в лечении и профилактике зубных камней и налетов. Другая цель изобретения - получение фармацевтических композиций для лечения и профилактики остеопороза и артрита, особенно ревматоидного артрита и остеоартрита. Кроме того, целью настоящего изобретения является метод лечения или профилактики остеопороза, ревматоидного артрита и остеоартрита, а также методы лечения или профилактики зубных налетов и камней.
Эти и другие цели настоящего изобретения будут очевидны из подробного раскрытия, предложенного ниже.
Настоящее изобретение относится к содержащим четвертичный азот
гетероциклическим соединениям фосфонатов и их фармацевтически приемлемым солям и сложным эфирам с общей формулой

в которой m и n являются целыми числами от 0 до 10; m + n - от 0 до 10;
а) Q - ковалентная связь или когруппа, выбранная из O, S, NR1;
в) Y - N+(R8)2 или C(R1)2 и если Y - C(R1)2, по меньшей мере один R2 должен быть N+(R8)3;
с) Z - насыщенный или ненасыщенный, или ароматический, моноциклический или полициклический карбоцикл или гетероцикл, содержащий один или несколько гетероатомов, выбранных из O, S, или N;
(d) R - COOH; PO3H2; SO3H или P(O)(OH)R4, в котором R4 - замещенный или незамещенный алкил с 1 - 8 атомами углерода;
(е) каждый R1 выбирается из группы, состоящей из нуля; SR6; R9SR6; водорода; гидрокси; замещенного или незамещенного С1 - C8 алкила; -OR3; -CO2R3; -O2CR3; -NR32; -N/R3/C/O/R3; -C/O/N/R3/2; галогена; -C/O/R3; арилалкила; нитро; замещенного или незамещенного арила и их комбинаций.
(f) каждый R2 представляет собой один или несколько заместителей на Z группе, независимо выбранных из группы, состоящей из N+/R8/3; SR6; R9SR6; водорода; замещенного или незамещенного C1 - C8алкила; -OR3, -CO2R3, -O2CR3, -NR32, -N/R3/C/O/R3, -C/O/N/R3/2, галогена, гидрокси, -C/O/R3, арилалкила, нитро, замещенного или незамещенного арила.
(g) каждый R3 независимо выбирается из группы, состоящей из водорода, замещенного или незамещенного алкила, имеющего от 1 до 8 атомов углерода и R9SR6.
(h) R5 выбирается из группы, состоящей из водорода, галогена, SR6, R9SR6, амино, гидрокси, и замещенного или незамещенного C1 - C8 алкила.
(i) каждый R6 независимо выбирается из группы, состоящей из H, -C/O/R7, -C/S/R7, -C/O/N/R7/2, -C/S/N/R7/2, -C/S/OR7, -C/O/OR7, в которых R7 - водород или замещенный или незамещенный C1 - C8 алкил.
(j) каждый R8 независимо выбирается из группы, состоящей из нуля,
замещенного или незамещенного алкила, имеющего 1 - 35 атомов углерода, замещенного или незамещенного фенила, бензила или R9SR6, и
(k) R9 - замещенный или
незамещенный C1 - C8 алкил.
В этой общей структуре Z является моноциклической или полициклической насыщенной или ненасыщенной гетероциклической группой, и Y - N+/R8/2 или C/R1/2. Кроме того, m и n и m + n представляют собой целые числа от около 0 до около 10 и Q представляет собой ковалентную связь или группу, выбранную из группы, состоящей из кислорода, серы или NR1. Далее в этой общей структуре каждый R1 независимо выбирается из множества заместителей, предпочтительнее всего из R9SR6 и водорода. Каждый R2 является заместителем на гетероциклическом кольце, выбранным из множества заместителей, предпочтительно N+C/R8/3, C1 - C8алкила, амино, гидрокси, алкокси или R9SR6. Когда Y - C/R1/2, по меньшей мере один R2 должен быть N+/R8/3. Каждый R независимо выбирается из COOH, SO3H, PO3H2 и P/O//OH/R4, в котором R4 является низшей алкильной группой. R5 выбирается из множества заместителей, наиболее предпочтительными являются водород, гидрокси, галоген и амино. R6 выбирается из множества заместителей, наиболее предпочтительны H и -C/O/R7 и -C/S/R7, в которых R7 представляет собой замещенный или незамещенный C1 - C8алкил. R8 выбирается из замещенного или незамещенного C1 - C35алкила, предпочтительно C1 - C8алкила; замещенного или незамещенного фенила, бензила, или R9 SR6. R9 является замещенным или незамещенным C1 - C8алкилом, предпочтительно C1 - C4алкилом.
Настоящее изобретение далее относится к фармацевтическим композициям, содержащим безопасное и эффективное количество соединения изобретения и фармацевтически приемлемые носители или наполнители. И наконец, изобретение касается методов лечения или профилактики патологических состояний, характеризуемых аномальным метаболизмом кальция и фосфатов, таких как остеопороз, ревматоидный артрит и остеоартрит у людей или других млекопитающих, и к методам лечения или профилактики зубных камней, налетов и гингивита. Этот метод предполагает введение человеку или другому млекопитающему, нуждающемуся в таком лечении, безопасного и эффективного количества соединения или композиции настоящего изобретения.
Далее представлен перечень определений для терминов, используемых в настоящем изобретении.
"Гетероатом" - атом азота, серы или кислорода. Группы, содержащие один или несколько гетероатомов, могут содержать разные гетероатомы.
"Алкил" является незамещенной или замещенной, прямой или разветвленной, насыщенной или ненасыщенной углеводородной цепью, причем эта углеводородная цепь может быть насыщенной, имеющей от 1 до 8 атомов углерода, и предпочтительно, если не указано иначе, от 1 до 4 атомов углерода; эта углеводородная цепь может быть ненасыщенной с 2 - 8 атомами углерода и предпочтительно, если не указано иначе, с 2 - 4 атомами углерода. Соответственно термин "алкил", используемый здесь, охватывает алкенильные углеводородные ненасыщенные цепи, имеющие по меньшей мере одну олефиновую двойную связь и алкинильные углеводородные ненасыщенные цепи, имеющие по меньшей мере одну тройную связь. Предпочтительные алкильные группы включают, но не ограничены до метила, этила, пропила изопропила и бутила.
"Карбоциклическое кольцо или карбоцикл", используемые здесь, подразумевают ненасыщенное, насыщенное, незамещенное или замещенное или ароматическое углеводородное кольцо. Карбоциклы могут быть моноциклическими или полициклическими. Моноциклические кольца обычно содержат от 3 до 8 атомов, предпочтительно от 5 до 7 атомов; полициклические кольца содержат два кольца и от 6 до 16, лучше от 10 до 12 атомов, а которые с тремя кольцами - от 13 до 17, предпочтительно от 14 до 15 атомов.
"Гетероалкил" представляет собой незамещенную или замещенную, насыщенную цепь, имеющую от 3 до 8 членов и включающую атомы углерода и один или два гетероатома.
"Гетероциклическое кольцо" или "гетероцикл" здесь означает незамещенное или замещенное, насыщенное, ненасыщенное или ароматическое кольцо, включающее атомы углерода и один или несколько гетероатомов в кольце. Гетероциклические кольца могут быть моноциклическими или полициклическими. Моноциклические кольца обычно содержат от 3 до 8 атомов, лучше от 5 до 7 атомов. Системы полициклического кольца, состоящие из двух колец, обычно содержат от 6 до 16, предпочтительно от 10 до 12 атомов. Системы полициклического кольца, состоящие из трех колец, обычно включают от 13 до 17 атомов, предпочтительно от 14 до 15 атомов. Половина гетероциклического кольца может состоять из гетероциклов или гетероциклов и карбоциклов. Каждая половина гетероциклического кольца должна иметь по меньшей мере один атом азота. Если не указано иначе, любые дополнительные гетероатомы могут независимо выбираться из азота, серы и кислорода.
"Арил" представляет собой ароматическое карбоциклическое кольцо. Предпочтительные арильные группы включают, но не ограничены фенилом, толилом, ксилилом, куменилом и нафтилом.
"Гетероарил" является ароматическим гетероциклическим кольцом. Предпочтительные гетероарильные группы включают, но не ограничиваются тиэнилом, фурилом, пирролилом, пиридинилом, пиразинилом, оксазолилом, тиазолилом, хинолинилом, пиримидинилом и тетразолилом.
"Алкокси" - атом кислорода, имеющий углеродный цепной заместитель, где углеводородная цепь является алкильной или алкенильной (например, -О-алкил, или -О-алкенил). Предпочтительные группы алкокси включают, но не ограничиваются метокси, этокси, пропокси и алкилокси.
"Гидроксиалкил" означает замещенную углеводородную цепь, которая имеет гидрокси заместитель (например, -OH), и может иметь другие заместители. Предпочтительные гидроксиалкильные группы включают, но не ограничиваются, гидроксиэтил и гидроксипропил.
"Карбоксиалкил" - замещенная углеводородная цепь, которая имеет карбокси заместитель (например, СООН) и может иметь другие заместители. Предпочтительные карбоксиалкильные группы включают карбоксиметил, карбоксиэтил и их кислоты и сложные эфиры.
"Аминоалкил" - углеводородная цепь (т.е. алкил), замещенная аминовой частью (например, NH-алкил-), такой как минометил.
"Алкиламино" - аминогруппы, имеющая один или два алкильных заместителя (например, -N-алкил), такой как диметиламино.
"Алкиниламино" - аминогруппа, имеющая один или два алкинильных заместителя (т.е. -N-алкинил).
"Алкениламино" - аминогруппы с 1 или 2 алкенильными заместителями.
"Алкилимино" - иминогруппа, имеющая один или два алкильных заместителя (т.е. -N-алкил-).
"Арилалкил" - алкильная группа, замещенная арильной группой. Предпочтительные арилалкильные группы включают бензил и фенилэтил.
"Ариламино" - аминогруппа, замещенная арильной группой (например, -NH-арил).
"Арилокси" - атом кислорода, имеющий арильный заместитель (например, -О-арил).
"Ацил" или "карбонил" включает двойную связь углерод-кислород, т.е. Р-С(=О). Предпочтительные ацильные группы включают, но не ограничены ацетилом, пропионилом, бутаноилом и бензоилом.
"Ацилокси" - атом кислорода, имеющий ацильный заместитель (т.е. -О-ацил), например -О-С/=О/-алкил.
"Ациламино" - аминогруппа, имеющая ацильный заместитель (т.е. -N-ацил), например, -NH-/C=O/-алкил.
"Гало", "галоген" или "галид" представляет собой атом хлора, брома, фтора или иода. Предпочтительными галидами являются хлор, бром и фтор.
Упоминаемая здесь "низшая" углеводородная часть (например, "низший" алкил) - углеводородная цепь, содержащая от 1 до 6, предпочтительно от 1 до 4 атомов углерода, если не оговорено иначе.
Кроме того, употребляемый здесь термин "тио-заместитель" (SR6 или R9SR6) включает тиолы [-SH], где R6=Н; тиоэфиры [-SC/O/R7 ], где R6=C/O/R7; дитиоэфиры [-SC/S/R7] , где R6= C/S/ • R7; тиокарбаматы [-SC/O/N/R7/2], где R6= C/O/N/R7/2; дитиокарбаматы [-SC/S/N/R7/2], где R6=C/S/N/R7/2; тиокарбонаты [= SC/O/OR7] , где R6 =C/O/OR7; и дитиокарбонаты [-SC/S/OR7], где R6=C/S/OR7. R7 - водород или замещенный или незамещенный C1 - C8алкил. Любые из SR6 заместителей могут сами замещаться R9, где R9 - замещенный или незамещенный C1 - C8алкил. Соответственно, дополнительные тио-заместители, обозначенные R9SR6, представляют собой алкилтиолы, алкилтиоэфиры, алкилдитиоэфиры, алкилтиокарбаматы, алкилдитиокарбаматы, алкилтиокарбонаты и алкилдитиокарбонаты.
Термины "бисфосфонат" или "бисфосфокислота" относятся к тем фосфонатам или фосфокислотам, которые имеют две фосфонатные группы, присоединенные к тому же атому углерода и взаимозаменяются терминами "дифосфонат" и "дифосфокислоты". В структурах, описанных здесь, R является PO3H2.
Под "фармацевтически приемлемой солью" понимается катионная соль, образованная с любой кислотной группой (т.е. карбоксильной) или анионная соль, полученная с любой основной группой, (т.е. амино). Многие такие соли известны в области техники и описаны в международной патентной публикации 87/05279, Johnston и др., опубликованной 11 сентября 1987 г. и включенной сюда в качестве ссылки. Предпочтительные катионные соли включают соли щелочного металла (такие, как соли натрия и калия) и соли щелочно-земельных металлов (таких, как магния и кальций). Предпочтительные анионные соли включают галогенид (такой, как хлорид), соли ацетата и фосфата.
"Биогидролизуемый сложный эфир" представляет собой эфир содержащих четвертичный азот гетероциклических фосфонатных соединений, который не влияет на терапевтическую активность соединений, или который легко преобразуется в организме человека или животного. Многие такие эфиры известны и описаны в международной патентной публикации 87/05297 Johnston и др. Такие сложные эфиры включают сложные эфиры низшего алкила, сложные эфиры низшего ацилоксиалкила (такие, как ацетоксиметил, ацетоксиэтил, аминокарбонилоксиметил, пивалоилоксиметил и пивалоилоксиэтиловые эфиры), сложные эфиры лактонила (такие, как эфиры фталидила и тиофталидила), сложные эфиры низшего алкоксиацилоксиалкила (такие, как эфиры метоксикарбонилоксиметила, этоксикарбонилоксиэтила, и изопропоксикарбонилоксиэтила), сложные эфиры алкоксиалкила, сложные эфиры холина и сложные эфиры ациламиноалкила (такие, как эфиры ацетамидометила).
Как говорилось выше, группы заместителя могут сами замещаться. Такое замещение может быть осуществлено одним или несколькими заместителями. Такие заместители включают, но не ограничиваются до указанных в C.Hansch и A.Leo, Substituent Constants for Correlation Analysic in Chemistry, Biology (1979), включенной сюда в качестве ссылки. Предпочтительные заместители включают, но не ограничиваются, алкил, алкенил, алкокси, гидрокси, оксо, амино, аминоалкил (например, аминометил и т.п.), циано, гало, карбокси, алкоксиацетил (например, карбоэтокси и пр.), тио, тиол, арил, циклоалкил, гетероарил, гетероциклоалкил, (пиперидинил, морфолинил, пиперазинил, пирролидинил и пр.), имино, тиоксо, гидроксиалкил, арилокси, арилалкил и их комбинации.
Четвертичные азотсодержащие гетероциклические соединения
Соединениями настоящего изобретения являются
содержащие четвертичный азот соединения фосфоната и их фармацевтически приемлемые соли и сложные эфиры, в которых атом углерода, содержащий фосфокислоту, связан с атомом углерода в моноциклической или
полициклической части гетероциклического кольца. Связь атома углерода, содержащего фосфокислоту, с гетероциклической кольцевой частью может быть осуществелена через ковалентную связь (предпочтительно
одинарную связь), или с помощью цепи длиной от 1 до 10 атомов. Если связь осуществляется через связывающую цепь, эта цепь может вся состоять из атомов углерода, может быть атомом азота или
азотосодержащей цепью, атомом кислорода или кислородосодержащей цепью или атомом серы или серосодержащей цепью. Атомы углерода и азота в связующих цепях могут независимо быть незамещенными или
замещенными одним или несколькими заместителями, выбранными из метила, этила, пропила, SR6, R9SR6. Предпочтительны незамещенные атомы углерода и азота в цепи.
Предпочтительны также цепи длиной в один атом, т.е. -CH2 -, -NH- -S- и -O-.
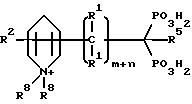
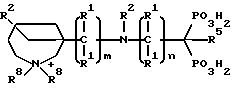
Для соединений, в которых атом серы, азота или кислорода в связующей цепи соединен с гетероциклической кольцевой частью, этот атом серы, азота или кислорода соединен с кольцевым атомом углерода и не связан непосредственно с атомом азота кольца. Для соединений, в которых углерод в связующей цепи связан с гетероциклическим кольцом, этот углерод может соединяться с кольцевым атомом углерода или непосредственно с атомом азота кольца. Атом углерода который имеет присоединенную к нему группу фосфокислоты, может быть незамещенным (напр., атом водорода), или замещенным. Углерод фосфокислоты может содержать две группы фосфоната, что дает соединение бисфосфоната; группу фосфоната и группу карбоксилата, что дает соединение фосфонокарбоксилата; группу фосфоната и группу сульфоната, что дает соединение фосфоносульфоната; группу фосфината и группу фосфоната, что дает соединение фосфоноалкилфосфината. Кроме того, атомы углерода могут быть в гетероциклическом кольце незамещены или замещены независимо одним или несколькими заместителями. Атом азота в гетероциклическом кольце может быть /Y = N+/R8/2/ или может не быть /Y = C/R1/2/ кватернизован, но гетероциклсодержащее соединение фосфоната должно содержать четвертичный атом азота по меньшей мере в одном из Y или R2 заместителях. Соответственно, либо Y = N+/R8/2, либо по меньшей мере один из R2 = N+ /R8/3.
Таким образом содержащие четвертичный азот насыщенные и ненасыщенные гетероциклические соединения фосфоната настоящего изобретения и их фармацевтически
приемлемые соли и сложные эфиры имеют общую структуру:

В этой общей структуре Z представляет четвертичную кольцевую азотосодержащую насыщенную, ненасыщенную или ароматическую моноциклическую или полициклическую карбоциклическую или гетероциклическую кольцевую группу. Указанная гетероциклическая кольцевая часть содержит один или несколько дополнительных гетероатомов, выбранных из кислорода, серы или азота. Группа Z в соединениях настоящего изобретения может быть гетероциклической кольцевой частью, указанная гетероциклическая кольцевая часть может иметь один или несколько гетероатомов, выбранных из O, S, или N; по меньшей мере один может быть четвертичным азотом.
Z часть может быть моноциклической, гетероциклической или карбоциклической кольцевой частью с 3 - 8 атомами, или она может быть полициклической гетероциклической или карбоциклической кольцевой частью с 7 - 17 атомами. Данная полициклическая кольцевая часть может содержать либо два, либо больше гетероциклов, два или больше карбоциклов, один карбоцикл и один или больше гетероциклов, либо один гетероцикл и одно или несколько карбоциклических колец. Предпочтительно Z гетероциклическая кольцевая часть содержит по меньшей мере один четвертичный атом азота и предпочтительно моноциклической Z частью являются: пиримидин, пиперидин, пиридин, хинолин, пирролопиридин, хиноксалин и инидазопиридин.
В этой общей структуре Y является членом циклической части и может быть N+/R8/2 или C/R1/2. Q представляет собой ковалентную связь (предпочтительно одинарную) или группу, выбранную из кислорода, -NR1- или серы. Кроме того, m и n и m + n - целые числа от 0 до 10 и предпочтительно, если m + n = 0 или 1. Q может быть ковалентной связью, кислородом, серой или -NR1; предпочтительно, если Q - ковалентная связь; m + n = 0, 1, 2 или 3. R группами, описанными здесь, могут быть COOH, SO3H, PO3H2 или P/O//OH/R4, где R4 - C1 - C8алкил; предпочтительно R является PO3H2 или P/O//OH/R4.
R1 выбирается из нуля, SR6, R9SR6, водорода, галогена, замещенного и незамещенного C1 - C8алкила, арилалкила, нитро, замещенного и незамещенного арила, гидрокси, -OR3, -CO2R3, -O2 • CR3, -NR32, -N/R3/C/O/R3, -C/O/N/R3/2, -C/O/R3 и их комбинаций, в которых R3 - водород, алкил, имеющий 1 - 8 атомов углерода и R9SR6, где R9 - C1 - C8алкил. R6 - Н, -C/O/R7, C/S/R7, C/S/NR7, -C/S/OR7, -C/O/NR7, -C/O//OR/7, в которых R7 - нуль, водород или замещенный или незамещенный C1 - C8алкил. Более того, когда содержащее четвертичный азот соединение фосфоната является тио-замещенным, предпочтительно R6 является H, -C/S/R7 или -C/O/R7 .
Однако, если n = 0 и Q - кислород, сера или азот, R5 выбирается из водорода, R9SR6, или алкила, имеющего от 1 до 8 атомов углерода.
Предпочтительно R1 выбирать из SR6, R9SR6, водорода, хлора, метила, этила, гидрокси, незамещенного амино, /N-метил/-амино, /N,N-диметил/амино, -CO2H и их фармацевтически приемлемых солей, -CO2CH3 и -CONH2. Предпочтительно R1 выбирается из SR6, R9SR6, водорода, метила, хлора, амино и гидрокси. Более предпочтительно, из SR6, R9SR6, водорода, гидрокси или амино.
Гетероциклическая кольцевая часть в соединениях настоящего изобретения может быть незамещенной на атомах углерода независимо одним или несколькими заместителями /R2/. Группы R2 могут быть на том же самом атоме углерода или на различных атомах гетероциклической кольцевой части.
Таким образом, группы R2 являются заместителями на одном или нескольких атомах углерода гетероциклической кольцевой части, независимо выбранными из N+/R8/3, SR6, R9SR6, водорода, гидрокси, галогена, алкила, имеющего от 1 до 8 атомов углерода, -OR3, -CO2R3, -O2CR3, -NR32, -N/R3/C/O/R3, -C/O/N/R3/2, -C • /O/R3, нитро, арилалкила, замещенного и незамещенного арила и их комбинаций, в которых R3 - водород, замещенный или незамещенный алкил или R9SR6.
Предпочтительные R2 заместители независимо выбираются из N+/R8/3, SR6, R9SR6, водорода, метила, этила, гидрокси, незамещенного амино, /N-метил/амино, /N, N-диметил/амино, хлора, метокси, этокси, нитро, -CO2H, -CO2CH3, -CONH2 и их комбинаций. Более предпочтительные R2 заместители независимо выбираются из SR6, R9SR6, водорода, метила, амино, хлора, метокси, гидрокси и их комбинаций. Еще более предпочтительные заместители R2 независимо выбираются из R9SR6, SR6, водорода, амино, и метила.
R5 выбирается из группы, состоящей из водорода, галогена, замещенного или незамещенного алкила, имеющего от 1 до 8 атомов углерода, R9SR6, гидрокси и амино. Если n = 0 и Q - кислород, сера или азот, тогда R5 выбирается из группы, состоящей из водорода, замещенного или незамещенного алкила с 1 - 8 атомами углерода или R9SR6.
Каждая R8 группа независимо выбирается из группы, состоящей из нуля, замещенного или незамещенного алкила с 1 - 35 атомами углерода, фенила, бензила или R9SR6. В этой общей структуре R8 заместитель присоединен к четвертичному гетероатому азота Z части (когда Y = N+/R8/2). Z часть, как указывалось выше, может быть карбоциклом или гетероциклом и может быть либо насыщенной, ненасыщенной, либо ароматической. Будет ли гетероциклическая Z часть насыщенной, ненасыщенной или ароматической, будет определять количество R8 заместителей, которые необходимы для кватернизации гетероатома азота, когда Y = N+/R8/2. Когда Z представляет собой ненасыщенную или ароматическую моноциклическую или полициклическую гетероциклическую кольцевую часть, азот гетероциклического кольца кватернизуется только одним R8 заместителем. Таким образом, когда Z часть является ненасыщенной или ароматической, моноциклической или полициклической гетероциклической кольцевой частью, одним из R8 заместителей может быть нуль. Когда Z часть представляет собой насыщенную моноциклическую или полициклическую гетероциклическую кольцевую часть, азот гетероциклического кольца кватернизуется двумя R8 заместителями. Следовательно, когда Z часть является насыщенной моноциклической или полициклической гетероциклической кольцевой частью, ни один из R8 не может быть нулем, чтобы образовать четвертичный азот гетероциклического кольца. Как указывалось выше, по меньшей мере один из Y или R2 должен содержать четвертичный атом азота, соответственно если Y - C/R1/2, по меньшей мере один из R2 должен быть N+/R8 /3.
Введение R8 половины на гетероатом азота приводит к образованию четвертичной азото-содержащей части, подходящей в качестве R2 заместителя или в качестве Y.
Предпочтительным R8 для соединений настоящего изобретения, полезных в лечении или профилактике нарушений кальциевого и фосфатного обмена, является замещенный или незамещенный алкил с 1 - 10 углеродами и R9SR6. Предпочтительным R8 для соединений настоящего изобретения, полезных для лечения или профилактики зубных камней, налетов и гингивита, является незамещенный или замещенный алкил, имеющий 10 - 20 атомов углерода.
Кроме того, в упомянутых общих структурах, если m = 0 и Q - кислород, азот или сера, связь Q части с азотосодержащей гетероциклической Z частью предпочтительно ограничивается следующим образом. Q часть связана с гетероциклическим кольцом на атоме углерода и не связана непосредственно с атомом азота в гетероциклическом кольце.
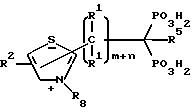
Предпочтительные соединения дифосфонопиридина настоящего изобретения могут иметь следующую общую структуру:

Предпочтительны также соединения дифосфонопиридина, в которых связующая цепь имеет гетероатом, т.е. Q = S, O или R



Предпочтительные соединения настоящего изобретения, в которых Z является полициклическим гетероциклом, включают соединения со следующей структурой:




Соединения настоящего изобретения могут также иметь следующую общую структуру:







Специфические примеры соединений настоящего изобретения включают:
соль 2-(-2-окси-2,2-дифосфоноэтил)-1,1-диметилпиперидин иодида;
3-(2-окси-2,2-дифосфоноэтил)-1-метилпиридин иодид; ;
3-(2-окси-2, 2-дифосфоноэтил)-1-метилпиридин гидроксид;
3-(2,2-дифосфоноэтил)-1-этилпиридин хлорид;
3-(2,2-дифосфоноэтил)-1-(2-меркаптоэтил)пиридин хлорид;
2-(2-окси-2, 2-дифосфоноэтил)-1-метилпиридин гидроксид;
3-(3-окси-3,3-дифосфоноэтил)-1-метилпиридин-гидроксид;
соль 3-(2,2-дифосфоно-2-оксиэтил)-1,1-диметилпиперидин иодида;
3-(2, 2-дифосфоноэтил)-1-гептилпиридин хлорид;
3-(2,2-дифосфоноэтил)-1-метилпиридин хлорид;
3-(2,2-фосфонометилфосфиноэтил)-1-метилпиридин иодид;
3-(2-фосфоно-2-сульфоноэтил)-1-метилпиридин хлорид;
3-(2-карбокси-2-фосфоноэтил)-1-метилпиридин хлорид;
2-дифосфонометил-1,1-диметилпиперидин хлорид;
3-дифосфонометил-1, 1-диметилпиперидин хлорид;
4-дифосфонометил-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфоноэтил)-1,1-диметилпиперидин хлорид;
3-(2,2-дифосфоноэтил)-1,1-диметилпиперидин хлорид;
4-(2,2-дифосфоноэтил)-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфоноэтил)-1-метил-1-(2-меркаптоэтил)пиперидин хлорид;
3-(2, 2-дифосфоноэтил)-1-метил-1-(2-меркаптоэтил)пиперидин хлорид;
4-(2,2-дифосфоноэтил)-1-метил-1-(2-меркаптоэтил)пиперидин хлорид;
2-/2,2-дифосфоно-1-(2-меркаптоэтил)этил/-1, 1-диметилпиперидин хлорид;
3-/2,2-дифосфоно-1-(3-меркаптопропил)этил/-1,1-диметилпиперидин хлорид;
4-/2,2-дифосфоно-1-(2-ацетилтиоэтил)этил/-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфоно-2-оксиэтил)-1,1-диметилпиперидин хлорид;
3-(2,2-дифосфоно-2-оксиэтил)-1,1-диметилпиперидин хлорид;
4-(2,2-дифосфоно-2-оксиэтил)-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфоно-2-оксиэтил)-1,1,3-триметилпиперидин хлорид;
2-(2,2-дифосфоно-2-оксиэтил)-1,1,5-триметилпиперидин хлорид;
2-(2,2-дифосфоноэтил)-1,1,3-триметилпиперидин хлорид;
2-(2,2-дифосфоноэтил)-1,1,5-триметилпиперидин хлорид;
2-(3,3-дифосфонопропил)-1,1-диметилпиперидин хлорид;
3-(3,3-дифосфонопропил)-1,1-диметилпиперидин хлорид;
4-(3, 3-дифосфонопропил)-1,1-диметилпиперидин хлорид;
2-(3,3-дифосфоно-3-оксипропил)-1,1-диметилпиперидин хлорид;
3-(3,3-дифосфоно-3-оксипропил)-1,1-диметилпиперидин хлорид;
4-(3, 3-дифосфоно-3-оксипропил)-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфонопропил)-1,1-диметилпиперидин хлорид;
3-(2,2-дифосфонопропил)-1,1-диметилпиперидин хлорид;
4-(2, 2-дифосфонопропил)-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфоно-2-аминоэтил)-1,1-диметилпиперидин хлорид;
3-(2,2-дифосфоно-2-аминоэтил)-1,1-диметилпиперидин хлорид;
4-(2, 2-дифосфоно-2-аминоэтил)-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфоно-2-аминоэтил)-1,1,3-триметилпиперидин хлорид;
2-(2,2-дифосфоно-2-аминоэтил)-1,1,3-триметилпиперидин хлорид;
3-(2,2-дифосфоно-2-аминоэтил)-1,1,5-триметилпиперидин хлорид;
2-(2,2-дифосфоно-2-(метиламино)этил)-1,1-диметилпиперидин хлорид;
2-(4,4-дифосфоно-4-оксибутил)-1,1, 3-триметилпиперидин хлорид;
2-(4,4-дифосфоно-4-оксибутил)-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфоно-2-оксиэтил)-3-карбокси-1,1-диметилпиперидин хлорид;
2-(2, 2-дифосфоно-2-оксиэтил)-5-карбокси-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфоноэтил)-1-метилпиперидин хлорид;
4-(2,2-дифосфоноэтил)-1-метилпиперидин хлорид;
2-(2, 2-дифосфоно-2-оксиэтил)-1-метилпиперидин хлорид;
4-(2,2-дифосфоно-2-оксиэтил)-1-метилпиперидин хлорид;
2-(3,3-дифосфонопропил)-1-метилпиперидин хлорид;
4-(3, 3-дифосфонопропил)-1-метилпиперидин хлорид;
2-(3,3-дифосфоно-1-оксипропил)-1-метилпиперидин хлорид;
4-(3,3-дифосфоно-1-оксипропил)-1-метилпиперидин хлорид;
2-(2, 2-дифосфоно-2-аминоэтил)-1-метилпиперидин хлорид;
3-/(дифосфонометил)оксо/-1,1-диметилпиперидин хлорид;
4-/(дифосфонометил)оксо/-1,1-диметилпиперидин хлорид;
3-/(2, 2-дифосфоноэтил)оксо/-1,1-диметилпиперидин хлорид;
4-/(2,2-дифосфоноэтил)оксо/-1,1-диметилпиперидин хлорид;
3-/(дифосфонометил)тио/-1,1-диметилпиперидин хлорид;
4-/(дифосфонометил)тио/-1,1-диметилпиперидин хлорид;
и их фармацевтически приемлемые соли и сложные эфиры.
Предпочтительные соединения настоящего изобретения включают:
3-(2-окси-2,2-дифосфоноэтил)-1-метилпиперидин иодид;
3-(2-окси-2,2-дифосфоноэтил)-1-метилпиперидин гидроксид;
3-(2,2-дифосфоноэтил)-1-(2-меркаптоэтил)пиридин хлорид;
соль
2-(2-окси-2,2-дифосфоноэтил)-1,1-диметилпиперидин иодида;
соль (2,2-дифосфоно-2-оксиэтил)-1,1-диметилпиперидин иодида;
3-(2,2-дифосфоноэтил)-1-гептилпиридин хлорид;
3-(2,
2-дифосфоноэтил)-1-метилпиридин хлорид;
2-(2,2-дифосфоноэтил)-1,1-диметилпиперидин хлорид;
3-(2,2-дифосфоноэтил)-1,1-диметилпиперидин хлорид;
4-(2,2-дифосфоноэтил)-1,
1-диметилпиперидин хлорид;
2-(2,2-дифосфоно-2-оксиэтил)-1,1-диметилпиперидин хлорид;
3-(2,2-дифосфоно-2-оксиэтил)-1,1-диметилпиперидин хлорид;
4-(2,2-дифосфоно-2-оксиэтил)-1,
1-диметилпиперидин хлорид;
2-(2,2-дифосфоно-2-оксиэтил)-1,1,3-триметилпиперидин хлорид;
2-(2,2-дифосфоно-2-оксиэтил)-1,1,5-триметилпиперидин хлорид;
2-/2,
2-дифосфоно-1-(2-меркаптоэтил)этил/-1,1-диметилпиперидин хлорид;
3-/2,2-дифосфоно-1-(3-меркаптоэтил)этил/-1,1-диметилпиперидин хлорид;
2-(2,
2-дифосфоноэтил)-1-метил-1-(2-меркаптоэтил)пиперидин хлорид;
3-(2,2-дифосфоноэтил)-1-метил-1-(2-меркаптоэтил)пиперидин хлорид;
4-(2,
2-дифосфоноэтил)-1-метил-1-(2-меркаптоэтил)пиперидин хлорид;
Наиболее предпочтительные соединения настоящего изобретения включают:
3-(2-окси-2,2-дифосфоноэтил)-1-метилпиридин иодид;
3-(2-окси-2,2-дифосфоноэтил)-1-метилпиридин гидроксид;
3-(2,2-дифосфоноэтил)-1-(2-меркаптоэтил)пиридин хлорид;
2-/2,2-дифосфоно-1-(2-меркаптоэтил)этил/-1,1-диметилпиперидин
хлорид;
3-/2,2-дифосфоно-1-(3-меркаптопропил)этил/-1,1-диметилпиперидин хлорид;
2-(2,2-дифосфоноэтил)-1-(2-меркаптоэтил)пиперидин хлорид;
3-(2,
2-дифосфоноэтил)-1-(2-меркаптоэтил)пиперидин хлорид.
Чтобы определить и оценить фармакологическую активность, проводилось тестирование соединений фосфоната на животных с использованием различных методик, известных специалистам. Так, антирезорбционную активность in vivo можно продемонстрировать, используя пробу, предназначенную для испытания способности этих соединений ингибировать резорбцию кости, которая характеризует нарушение обмена кальция и фосфата. Один такой тест, известный в этой области техники, это модель Шенка. Другим известным в этой области тестом является тест на адъювантный артрит. In vitro также используется тест на ингибирование роста кристаллов гидроксиапатита. Эти и другие приемлемые тесты на фармакологическую активность раскрываются и/или упоминаются в Shinoda и др., Calcified Tissue Intern. 35, стр. 87 - 99 (1983); Shenk и др., Calcified Tissue Research 11, стр. 96 - 214 (1973); Russell и др., Calcified Tissue Research 6, стр. 83 - 96 (1970); Muhlbauer и Fleisch, Mineral Electrolyte M. 5, стр. 296 - 303 (1981); Nancollas и др. Oral. Biol. 5, 73 (1970); патенте США 3683080 Francis, выданном 8 августа 1972 г., патенте США 4134969, выданном Schmidt-Dunker 16 января 1979 г.; и в публикации европейской патентной заявки 189662 от 6 августа 1986; все эти источники включены сюда полностью в качестве ссылок. Некоторые из этих тестов на фармакологическую активность также описаны подробнее в примерах, приведенных ниже.
Кроме того, эти соединения настоящего изобретения используются в лечении или профилактике патологических состояний, характеризующихся нарушением обмена кальция и фосфата, они могут иметь другое применение. Например, их можно использовать в профилактике образования камней и/или налетов на зубах. Кроме того, считают, что они могут быть полезны как агенты сканирования кости после мечения их 99-м технетием. Они также полезны в качестве секвестирующих агентов для ионов поливалентного металла, в частности ионов ди- (напр. , кальция и магния) и тривалентных (напр., индий) металлов. Их можно применять в качестве связующих компонентов в моющих и чистящих средствах или для обработки воды. Они также полезны в качестве стабилизаторов соединений. И наконец, их можно применять как гербициды, которые нетоксичны для животных.
Замещенные гетероциклом содержащие четвертичный азот фосфонаты, вводимые в фармацевтические композиции настоящего изобретения, можно получить по следующим неограниченным примерам 1 - 16.
Композиции, содержащие новые
содержащие четвертичный азот соединения
Новые содержащие четвертичный азот соединения фосфоната настоящего изобретения можно вводить людям или другим млекопитающим различными способами,
включающими, но не ограниченными ими, пероральные дозированные формы и инъекции (внутривенные, внутримышечные, внутриперитональные и подкожные). Многие другие лекарственные формы, содержащие новые
содержащие четвертичный азот соединения фосфоната настоящего изобретения, могут быть легко приготовлены специалистом в данной области с использованием подходящих фармацевтических наполнителей, как
описано ниже. Пероральные лекарственные формы наиболее предпочтительны при условии соблюдения больным режима и схемы лечения.
Термин "фармацевтическая композиция", используемый здесь, означает комбинацию, состоящую из безопасного и эффективного количества активного ингредиента содержащего четвертичный азот фосфонатного соединения, или их смесей и фармацевтически приемлемых наполнителей.
Выражение "безопасное и эффективное количество", используемое здесь, означает количество соединения или композиции достаточно большое для того, чтобы существенно и положительно изменить симптомы и/или состояние пациента, но достаточно малое для того, чтобы избежать серьезных побочных эффектов (разумное соотношение пользы/риска) в пределах погрешности медицинской оценки. Безопасное и эффективное количество активного ингредиента для использования в фармацевтических композициях будет варьироваться в зависимости от конкретного подлежащего лечению состояния, возраста и физического состояния пациента, степени заболевания, длительности лечения, характера сопутствующего лечения, конкретного используемого активного ингредиента, конкретного используемого фармацевтически приемлемого наполнителя и других подобных факторов, исходя из знаний и опыта лечащего врача.
Термин "фармацевтически приемлемые наполнители" здесь включает любой физиологически инертный, фармакологически неактивный материал, с которым знакомы специалисты, и который совместим с физическими и химическими характеристиками конкретного активного ингредиента, содержащего четвертичный азот соединения фосфоната, выбранного для использования. Фармацевтически приемлемые наполнители включают, но не ограничиваются, полимерами, смолами, пластификаторами, наполнителями, связующими, смазывающими веществами, глидантами, разрыхлителями, растворителями, со-растворителями, буферными системами, ПАВ, консервантами, ароматизирующими и подслащающими агентами, красителями и пигментами и агентами, регулирующими вязкость.
Термин "пероральная форма дозировки" здесь означает любую фармацевтическую композицию, предназначенную для систематического введения индивидууму в желудочно-кишечный тракт через рот. Вводимая форма может быть в виде таблетки, с покрытием или без него, раствора, суспензии или капсулы с покрытием или без него.
Термин "инъекция" означает здесь введение любой фармацевтической композиции систематически человеку или другому млекопитающему в виде раствора или эмульсии, содержащей активный ингредиент, с помощью укола через кожу для доставки указанного раствора или эмульсии в кровеносную систему индивидуума либо внутривенной, внутримышечной, внутрибрюшинной, либо подкожной инъекцией.
Дозу
систематического введения может контролировать специалист регулированием одного или нескольких из следующих параметров:
а) активный ингредиент;
b) фармацевтически приемлемые
наполнители, если они не влияют на активность конкретного выбранного активного ингредиента;
с) тип наполнителя, толщина и проницаемость (свойства набухания) указанных наполнителей;
d) зависимые от времени состояния наполнителя самого по себе (или в наполнителях);
e) размер частиц гранилурованного активного ингредиента и
f) состояние наполнителей в зависимости
от pH.
По собственному выбору можно варьировать, в частности, растворимость, кислотность и способность к гидролизу различных активных ингредиентов содержащих четвертичный азот фосфонатов, таких как соли кислотного присоединения, соли, образуемые с карбоксильной группой, например соли щелочного металла, щелочно-земельного металла и пр. и сложные эфиры, например алкиловые, ариловые, аралкиловые. Кроме того, могут быть созданы подходящие pH условия внутри пероральных форм дозировок добавлением подходящего буфера к активному ингредиенту в соответствии с желаемой скоростью высвобождения активного ингредиента.
Наиболее приемлемые формы для введения композиций, действующих на зубные камни и налеты, представляют собой: средства для чистки зубов (включающие зубные пасты и порошки), эликсиры, жидкости для полоскания рта и спреи, гели и жевательную резинку. Предпочтительны композиции изобретения в виде средств для чистки зубов. Компоненты зубных паст обычно включают чистящее вещество (от 10 до 50%), ПАВ (от 0,5 до 10%), загуститель (от 0,1 до 5%), увлажнитель (10 - 55%), отдушку (от 0,04 до 2%), подслащивающий агент (0,1 - 3%), краситель (0,01 - 0, 5%) и воду (20 - 45%). Средства для чистки зубов могут также включать безопасное и эффективное количество источника иона фтора, который обычно присутствует в форме водорастворимого соединения фтора. Это водорастворимое соединение фтора входит в композиции изобретения в количестве достаточном, чтобы дать концентрацию фтора от 0,005 до 2,0% по весу. Предпочтительными источниками фтора являются фторид натрия, подкисленный фосфатфторид, монофторофосфат натрия. Патент США 3678154, выданный 18 июня 1972 г. Widder и др. раскрывает такие соли, а также другие и включен сюда как ссылка.
Другими предпочтительными композициями изобретения являются полоскания для рта и спреи. Компоненты таких полосканий и спреев включают воду (от 45% до 95%), этанол (от 0% до 25%), увлажнитель (от 0% до 50%), ПАВ (от 0,01% до 7%), отдушку (от 0,04 до 2%), подсластитель (от 0,1 до 3%), краситель (от 0,001 до 0,5%). Такие полоскания или спреи могут также включать один или несколько агентов (от 0,15 до 3%), действующих на камни и на налеты (от 0,1 до 5%).
Другие предпочтительные композиции изобретения - растворы для ротовой полости. Компоненты таких растворов обычно включают воду (от 90 до 99%), консервант (0,01 - 0,5%), загуститель (от 0 до 5%), отдушку (0,04 - 2%), подсластитель (0,1 - 3%) и ПАВ (0 - 50%).
Гелевые композиции для перорального назначения как правило содержат воду (0 - 99%), увлажнитель, такой как глицерин (от 0 до 99%), загуститель (0,1 - 5%), отдушку (0,04 - 2%) и подсластитель (0,01 - 0,5%).
Композиции жевательной резинки включают одно или несколько оснований для жвачки (от 50 до 90%), отдушку (0,04 - 2%), подсластитель (0,01 - 20%).
Как уже говорилось ранее, фармацевтически приемлемые наполнители включают, но не ограничиваются до смол, наполнителей, связующих и смазывающих веществ, растворителей, глидантов, разрыхлителей, сорастворителей, веществ ПАВ, консервантов, посластителей, отдушек, буферных систем, фармацевтических красителей или пигментов и агентов, придающих вязкость.
Предпочтительным растворителем является вода.
Отдушки, используемые здесь, включают те, которые описаны в Remington's Pharmaceutical Sciences 18 издание, Mack Publish. Company, 1990, стр. 1288 - 1300, включена сюда как ссылки. Фармацевтические композиции, пригодные для использования, обычно содержат от 0 до 2% отдушек.
Особенно хорошо использовать в качестве отдушек вещества, полезные также в лечении или профилактике зубных камней или налетов, такие, как ментол, масло грушанки, масло перечной мяты, курчавой мяты или масло луковичное. Отдушки обычно включены в композиции для удаления камней и налетов в количестве от 0 до 3%, а лучше от 0,04 до 2% по весу.
Красители или пигменты, которые используются здесь, включают те, которые описаны в Справочнике фармацевтических наполнителей, стр. 81 - 90, 1986 г. американской Ассоциации фармацевтов и фармацевтического общества Великобритании, который включен сюда ссылкой. Здесь фармацевтические композиции обычно содержат от 0 до 2% пигментов.
Предпочтительные сорастворители включают, но не ограничиваются ими, этанол, глицерин, пропиленгликоль, полиэтиленгликоль. Фармацевтические композиции настоящего изобретения включают от 0 до 50% сорастворителей.
Предпочтительные буферные системы включают, но не ограничены уксусной, борной, угольной, фосфорной, янтарной, яблочной, винной, лимонной, бензойной, молочной, глицериновой, глутановой и глутаминовой кислотой и их натриевыми, калиевыми и аммониевыми солями. Наиболее предпочтительны фосфорная, винная, лимонная и уксусная кислоты и их соли. Фармацевтическая композиция настоящего изобретения обычно содержит от 0 до 5% буферных систем.
Предпочтительные ПАВ включают, но не ограничиваются ими, полиоксиэтилен сорбитан эфиры жирных кислот, полиоксиэтилен моноалкилэфины моноэфиров сахарозы и эфиры и сложные эфиры ланолина, соли алкил сульфата, соли натрия, калия и аммония жирных кислот. Фармацевтические композиции настоящего изобретения включают 0 - 2% ПАВ. Предпочтительные ПАВ для соединений настоящего изобретения, полезные в лечении или профилактике зубных камней или налетов, включают те ПАВ, которые достаточно стабильны и образуют пену в достаточно широком диапазоне pH, включая немыльные анионные, неионные, цвитерионные и амфотерные органические синтетические моющие средства. Многие подходящие ПАВ раскрыты в патентах США 4051234, выданном 27 сентября 1977 г. Gieske и др. и 3959458, выданном 25 мая 1976 г. Agricola, Briner, Granger, оба они включены сюда в качестве ссылок. Такие ПАВ обычно присутствуют в композициях изобретения от 0 до 10%, лучше от 0,2 до 5%.
Их можно использовать также как агенты, придающие растворимость, с тем, чтобы помочь сохранить компоненты в растворе, например, отдушки, ПАВ, пригодные для этой цели, включают полисорбаты и полиоксамеры.
Предпочтительные консерванты включают, но не ограничены фенолом, алкил сложными эфирами, парагидроксибензойной кислотой, о-фенилфенолбензойной кислотой и их солями, борной кислотой и ее солями, сорбиновой кислотой и ее солями, хлорбутанолом, бензиловым спиртом, тимерозалом, фенилртутным ацетатом и нитратом, нитромерсолом, хлоридом бензалкония, хлоридом цетилпиридином, метил парабеном и пропил парабеном. Наиболее предпочитаются соли бензойной кислоты, хлорид цетилпиридина, метил парабен и пропил парабен. Композиции настоящего изобретения обычно включают от 0 до 2% консервантов.
Предпочтительные подсластители включают, но не ограничиваются ими, сахарозу, глюкозу, сахарин, сорбитол, маннитол и аспартам. Наиболее предпочтительны сахароза и сахарин. Композиции настоящего изобретения включают 0 - 5% подсластителей.
Агенты, регулирующие вязкость, включают, но не ограничены ими, метилцеллюлозу, карбоксиметилцеллюлозу натрия, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу алгината натрия, карбомер, повидон, аравийскую, ксантамовую камедь и другие и трагакант. Наиболее предпочтительны метилцеллюлоза, карбомер, ксантановая камедь, повидон, карбоксиметилцеллюлоза натрия и силикат глинозема магния. Композиции настоящего изобретения включают 0 - 5% агентов, регулирующих вязкость.
Предпочтительные наполнители включают, но не ограничены ими, лактозу, маннитол, сорбитол, трехосновной фосфат кальция, двухосновной фосфат кальция, прессуемый сахар, крахмал, сульфат кальция, декстро и микрокристаллическую целлюлозу. Наполнители входят в композиции изобретения в количестве 0 - 75%.
Предпочтительные смазывающие вещества включают, но не ограничиваются до стеарата магния, стеариновой кислоты и талька. Они входят в композиции в количестве 0,5 - 2%.
Глиданты включают, но не ограничены до талька и коллоидального диоксида кремния. Композиции настоящего изобретения включают 1 - 5% таких веществ.
Разрыхлители включают, но не ограничены до крахмала, крахмал гликолята натрия, кросповидона, кроскармелозы натрия и микрокристаллической целлюлозы. Эти вещества входят в композиции от 4 до 15%.
Связующие вещества включают, но не ограничиваются до камеди, трагаканта, гидроксипропилцеллюлозы, желатинированного крахмала, желатина, повидона, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, метилцеллюлозы, раствора сахара, таких как сахарозы и сорбита и этилцеллюлозы. Композиции настоящего изобретения включают 1 - 10% связующих веществ.
При приготовлении пероральных композиций, используемых в лечении и профилактике зубных камней и налетов, желательно к зубным пастам добавлять связующие и/или загущающие агенты. Такие агенты, например, включают карбоксивиниловые полимеры, полисахаридные камеди, такие как ксантамовая, каррагинан, гидроксиэтилцеллюлоза и водорастворимые соли эфиров целлюлозы, такие как натрий карбоксиметилцеллюлоза и натрий карбоксиметил гидроксиэтил целлюлоза. Можно использовать также природные камеди, такие как карайя, гуммиарабик и трагакант. Для улучшения структуры как часть сгустителя можно использовать коллоидальный силикат глинозема магния или мелко измельченный кремний. Эти сгустители и связующие агенты обычно присутствуют в количествах от 6%, предпочтительно от 0,1% до 5 вес.%.
Другой необязательный компонент в приготовлении пероральных композиций - увлажнитель. Увлажнитель служит для того, чтобы поддерживать зубные пасты в увлажненном состоянии и не давать им затвердевать при соприкосновении с воздухом. Некоторые увлажнители могут также придавать приятный аромат композициям полосканий для рта и зубным пастам. Увлажнитель составляет обычно 0 - 70%, лучше от 2 до 55% от веса композиции. Подходящие увлажнители включают пищевые многоатомные спирты, такие как глицерин, сорбит, ксилит, полиэтиленгликоль и пропиленгликоль, лучше сорбит и глицерин.
Также могут использоваться добавки в зубных пастах для придания им матовости. Подходящие добавки включают диоксид титана и некоторые шлифующие вещества, например, силикат глинозема магния.
Предпочтительные шлифующие зубы вещества, используемые в приготовлении средств для чистки зубов, включают, например, кремнеземы, содержащие гели и осадки, карбонат кальция, дигидрат ортофосфата дикальция, пирофосфат кальция, трикальций фосфат, полиметафосфат кальция, нерастворимый полиметафосфат кальция, гидратглинозем и смолистые шлифующие материалы, такие как из мельченные продукты конденсации мочевины и формальдегида, и другие материалы, такие как те, которые раскрыты в патенте США 3070510, Gooley и др., выданном 25 декабря 1962 г., включенном сюда ссылкой. Можно использовать смеси шлифующих средств.
Шлифующие средства для зубов из кремнезема различных типов обеспечивают исключительное действие очистки и шлифовки зубов, не повреждая эмаль или дентин. Поэтому желательно их использование.
Средний размер частиц абразивного шлифующего материала составляет от 0,1 до 30 мкм, предпочтительнее от 5 до 15 мкм. Шлифующим материалом может быть осажденный кремнезем или силикагели, такие как силикаксерогели, описанные в патенте США 3538230, выданном 2 марта 1970 г., Pader и др. И 3862307, от 21 июня 1975 г., DiGiulio, они включены сюда как ссылки. Предпочтитаются силикаксерогели под товарным наменованием SyloidR компании W.R.Grace and Co., Davidson Chemical Division. Предпочитительные материалы из осажденного кремнезема включают материалы Huber Corporation под торговым наименованием LeodentR 119. Эти кремнеземовые абразивы описаны в патенте США 4340583, Wason, выданном 20 июня 1982 г. и включенном сюда ссылкой.
Могут использоваться смеси абразивов. Количество абразивного или шлифующего материала в композициях, описанных здесь, колеблется от 6 до около 70%, предпочтительно от 15 до 50%, если эта зубная паста. Более высокое содержание, до 90%, может использоваться в зубном порошке.
Соединения настоящего изобретения могут составлять от 0,1 до 99,9% по весу фармацевтических композиций настоящего изобретения. Предпочтительно соединения настоящего изобретения составляют от 20% до около 80 вес.% фармацевтических композиций, полезных в лечении или профилактике остеопороза и артрита, включая ревматоидный артрит и остеоартрит.
Соответственно, фармацевтические композиции настоящего изобретения, полезные в лечении или профилактике остеопороза и артрита, включающего ревматоидный артрит и остеоартрит, содержат от 15 до 95% активного ингредиента, содержащего четвертичный азот соединения фосфоната или его смеси; 0 - 2% отдушек; 0 - 50% сорастворителей; 0 - 5% буферных систем; 0 - 2% ПАВ; 0 - 2% консервантов; 0 - 5% подсластителей; 0 - 5% агентов вязкости; 0 - 75% наполнителей; 0,5 - 2% смазывающих веществ; 1 - 5% глидантов; 4 - 15% разрыхлителей и 1 - 10% связующих.
Композиции настоящего изобретения, предназначенные для лечения или профилактики зубных налетов и камней, предпочтительно включают водные растворы соединений настоящего изобретения. Такие композиции обычно содержат от 0,5% до 10% по весу, предпочтительно от 0,1% до 5% по весу, а лучше от 0,5 до 3 вес.% соединения настоящего изобретения. В препарате для полоскания зубов наиболее предпочтительная концентрация соединения изобретения составляет около от 1 до 20% по весу.
Подходящие фармацевтические композиции описаны здесь в примерах 19 - 21. Зубные композиции описаны в примерах 22 - 23. Специалист в данной области может использовать описанные здесь примеры для достижения более широкого диапазона фармацевтических композиций.
Выбор фармацевтического наполнителя, используемого вместе с содержащими четвертичный азот соединениями фосфоната в настоящих композициях, в основном определяется способом его введения. Если соединение предназначено для инъекции, предпочтительным фармацевтическим носителем будет стерильный физиологический раствор, pH которого доведено до 7,4. Однако, лучший способ введения фосфонатов - пероральный и лучшей формой дозировки будет таблетка, капсула и другие формы, содержащие от 0,1 мг Р до 600 мг Р соединений фосфокислоты, описанных здесь. Фармацевтические носители, приемлемые для приготовления форм для перорального назначения, хорошо известны в данной области. Их выбор будет зависеть от вторичных соображений, таких как вкус, стоимость, стабильность хранение и не является критичным для целей данного изобретения и не вызывает затруднений у специалистов в данной области.
Термин "мг Р", используемый здесь, означает вес атомов фосфора, присутствующих в количестве соединения фосфокислоты настоящего изобретения. Эта единица используется, чтобы стандартизировать количество соединений фосфокислоты настоящего изобретения, используемых в фармацевтических композициях и методах лечения и профилактики. Например, 3-(2,2-дифосфоноэтил)-1-(2-меркаптоэтил)пиридин хлорид имеет молекулярный вес 363,7 г/моль, 17% которого 963 г/моль) приходится на вес двух атомов фосфора, присутствующих в этой молекуле. Поэтому рассчитано, что один миллиграм этого соединения имеет 0,17 мг Р. Итак, чтобы получить фармацевтическую композицию, содержащую 0,17 мг Р этого соединения, композиция должна содержать 1 мг соединения; и чтобы ввести дозу в 0,17 мг Р этого соединения пациенту весом 50 кг, пациенту следует ввести 50 миг соединения.
Фармацевтически приемлемый наполнитель, используемый вместе с фосфонатами изобретения, используется в концентрации, достаточной, чтобы единица дозировки имела приемлемый размер. Носители, как правило, включают от 0,1 до 99,9% по весу от общей композиции, и чаще от 30 до 80%.
Способ лечения или профилактики заболеваний, связанных с нарушением обмена кальция и фосфата
Другой аспект настоящего изобретения представляет собой
способы лучения или профилактики заболеваний, связанных с аномальным метаболизмом кальция и фосфата. Кроме того, изобретение относится к способу лечения и профилактики образования зубных налетов и
зубных каменей. Такие способы включают введение человеку или другому млекопитающему, нуждающемуся в таком лечении, безопасного и эффективного количества соединения фосфоната настоящего изобретения.
Предпочтительный способ введения - пероральный, но другие известные способы введения также применяются, например, дерматомукозальные (кожное, ректальное и другие применения) и парентеральное (подкожная, внутримышечная, внутривенная, внутрисуставная инъекция и другие). Ингаляция также включена в способ введения. Таким образом, конкретные способы введения включают без ограничения пероральный, трансдермальный, слизистый, подъязычный, внутримышечный, внутривенный, внутриперитональный и подкожный способы, а также местное применение.
Термин "аномальный метаболизм кальция и фосфата" здесь означает (1) состояния, которые характеризуются аномальной мобилизацией кальция и фосфата, ведущей к общему или специфическому разрежению костной ткани или избыточно высокому содержанию кальция и фосфата в жидкостях тела; и (2) состояния, которые являются причиной или следствием аномального отложения кальция или фосфата в теле. Первая категория включает, но не ограничивается до остеопороза, болезни Педжета, гиперпаратиреоза, гиперкальцемии злокачественного происхождения, гетеротопического окостенения и метастазов остеолита костей. Вторая категория включает, но не ограничивается до прогрессивного миозита с образованием костной ткани, кальциноза общего и таких заболеваний, как артрит (включая ревматоидный артрит и остеоартрит), неврит, бурсит, тендонит и другие воспалительные состояния, которые провоцируют пораженную ткань к отложению кальция и фосфата.
Термин "ревматоидный артрит" здесь означает хроническое системное воспалительное нарушение суставов неясной этиологии. Оно характеризуется разрушением суставных хрящей, связок, сухожилий и кости.
Термин "остеоартрит" здесь означает невоспалительное нарушение двигательных суставов. Оно характеризуется разрушением и эрозией суставных хрящей и образованием новой костной ткани на поверхности сустава.
Термины "лицо риска" и "лицо, нуждающееся в таком лечении", здесь означают любого человека или млекопитающего, который подвергается значительному риску аномального метаболизма кальция или фосфата, если его не лечить и любого человека или другого млекопитающего, страдающего аномальным метаболизмом кальция и фосфата. Например, женщины постклимактерического периода, лица, перенесшие стероидную терапию; лица, подвергающиеся лечению некоторыми противосудорожными препаратами; пациенты, страдающие заболеванием Педжета, гиперпаратиреозом, гиперкальцемией злокачественного происхождения или метастазакми, разрушающими костную ткань; лица, страдающие одной или несколькими формами остеопроза; лица, принадлежащие к группе населения с повышенным риском развития остеопороза, например, женщины постклимактерического периода, мужчины свыше 65 лет, и лица, принимающие лекарства, вызывающие остеопороз как побочный эффект; лица, страдающие прогрессивным миозитом с окостенением или общим кальцирозом; и лица, страдающие артритом, остеоартритом, ревматотидным артритом, невритом, бурситом, тендонитом и другими состояниями, которые предрасполагают к отложению в тканях кальция и фосфата.
"Безопасное и эффективное количество" здесь означает количество соединения или композиции изобретения достаточно большое, чтобы значительно положительно изменить состояние больного, но достаточно низкое, чтобы избежать серьезных побочных эффектов (при разумном соотношении пользы/риска) в пределах погрешности медицинской оценки. Безопасное и эффективное количество соединений фосфоната будет разным в зависимости от конкретного состояния, возраста и физического состояния пациента, серьезности состояния, длительности лечения, характера сопутствующего лечения, конкретного используемого фосфоната и других факторов, исходя из знаний и опыта лечащего врача. Разовые дозы в методах лечения нарушений обмена кальция и фосфата могут колебаться от 0,01 мг Р до 3500 мг Р, или от 0,002 до 70 мг Р/кг веса тела (при весе 50 кг). Предпочтительные разовые дозировки составляют от 1 мг Р 60 мг Р, или от 0,02 до 12 г Р/кг веса тела (при весе 50 кг). В день назначают до 4 разовых доз. Дозы более 500 мг Р/кг (ежедневные) могут дать нежелательное побочное действие. Более высокие дозировки в этом диапазоне конечно требуются в случае перорального назначения из-за ограниченной абсорбции.
Дозированные формы соединений настоящего изобретения, используемые в лечении или профилактике зубных налетов и камней, включают средства для чистки зубов, такие, как зубные пасты и зубные порошки, содержащие 0,05 - 10 вес. % соединения настоящего изобретения, и растворы, такие, как полоскание для рта, содержащие 0,05 - 5 вес.% соединения настоящего изобретения. Следующие примеры описывают далее и демонстрируют предпочтительные варианты в объеме настоящего изобретения. Примеры даны только в целях иллюстрации, и их не следует рассматривать как ограничивающие изобретение, так как возможно множество вариаций, не выходящих за рамки объема изобретения.
Пример 1
Синтез 3-(2,2-дифосфоноэтил)-1-этилпиридин хлорида

I. Синтез 2-/(3-пиридинилэтилиден)бис(фосфокислота)тетраэтил эфира.
К смеси 60% гидрида натрия в минеральном масле (4,00 г, 0, 10 мМ) в ДМСО (155 мл) добавляется тетраэтилметилендифосфонат (30 г, 0,10 мМ) в ДМСО (20 мл) при 0oC. Реакционная смесь перемешивается 30 минут при 0oC, а затем 30 минут при комнатной температуре. Затем эта смесь доставляется по каплям через воронку к 3-пиколилхлориду (0,11 мМ) в ДМСО (100 мл) при комнатной температуре. Реакционная смесь перемешивается еще 12 часов при комнатной температуре, затем реакция гасится добавлением насыщенного водного хлорида аммония. Упомянутая реакционная смесь экстрагируется метиленхлоридом и органические экстракты соединяются, высушиваются над сульфатом натрия, фильтруются и концентрируются при пониженном давлении. Продукт очищается мгновенной хроматографией с 5% в метиленхлориде на силикагеле.
II. Синтез тетраэтил-3-(2,2-дифосфоноэтил)-1-этил пиридина.
К раствору тетраэтил-2-(3-пиридинил)этилиден-1,1-бисфосфонат-тетраэтил эфира (1,96 г, 5,17 мМ) в ацетоне (10 мл) добавляется иодэтан (4,03 г, 25,86 мМ). Реакционная смесь нагревается с обратным холодильником в атмосфере азота 24 часа. Реакционная смесь концентрируется при пониженном давлении и сырой остаток растирается с гексанами и затем с диэтилэфиром. Таким образом в виде гигроскопического твердого вещества оранжевого цвета (2,28 г) получен продукт присоединения N-этилпиридина с 83% выходом.
III. Синтез
тетраэтил-3-(2,2-дифосфоноэтил)-1-этилпиридин хлорида
Сложные эфиры фосфоната гидролизуются кипячением с обратным холодильником (2,18 г, 4,08 мМ) в 6N HCl (30 мл) в течение 12 часов в
атмосфере азота. Реакционная смесь охлаждается и затем концентрируется при пониженном давлении. Чистый продукт получается растиранием с диэтиловым эфиром.
Пример 2
Синтез
3-(2,2-дифосфоноэтил)-1-(2-меркаптоэтил) пиридин хлорида

I. Синтез тетраэтил-3-(2, 2-дифосфоноэтил)-1-(2-ацетилтиоэтил)пиридин бромида.
К раствору тетраэтил 2-/3-пиридинил этилиден/-1,1-бис/фосфокислота/тетраэтилового эфира, полученного, как описано в Примере 1 (часть 1) выше (3,16 г, 8,35 мМ) в ацетоне (20 мл) добавляется S-ацетил-2-бромоэтантиол (3,82 г, 20,88 мМ). Реакционная смесь нагревается с обратным холодильником в течение 24 часов в атмосфере азота. Реакционная смесь концентрируется при пониженном давлении и сырой остаток растирается с гексанами и затем с диэтиловым эфиром. Далее остаток очищается мгновенной хроматографией на силикагеле 20% метанолом в метиленхлориде. Таким образом четвертичный продукт присоединения получают в виде желтого масла (1,69 г).
II. Синтез 3-(2,2-дифосфоноэтил)-1-(2-меркаптоэтил)пиридин хлорида.
Сложные эфиры фосфоната гидролизуются кипячением с обратным холодильником (1,45 г, 5,10 мМ) в 6N HCl (35 мл) в течение 20 часов в атмосфере азота. Реакционная смесь охлаждается им концентрируется. Продукт получается в чистом виде растиранием с диэтиловым эфиром.
Пример 3
Синтез 3-(2-гидрокси-2,2'-дифосфоноэтил)-1-метил-пиридин иодида
динатрия

I. Синтез /1-гидрокси-2-(3-пиридинил)этилиден/-бис(фосфокислоты).
В 250 мл 3-х горловую колбу с круглым дном, снабженную обратным холодильником и капельной воронкой, добавляется гидрохлорид 3-пиридилуксусной кислоты (1,74 г, 10 мМ), фосфористая кислота (2,46 г, 30 мМ) и 50 мл хлоробензола. Колба помещается в кипящую водяную баню ит по каплям из капельной воронки к реакционной смеси добавляется трихлорид фосфора (4,0 г, 30 мМ). Все это перемешается 3 часа при 100oC и входе этой реакции образуется желтое вязкое масло. После 3 часов реакционная смесь охлаждается в ледяной бане и избыток хлорбензола декантируется. Масло гидролизуется в 100 мл 1N HCl всю ночь, охлаждается и выравшие кристаллы фильтруются и промываются этанолом. Фильтрат выпаривается до масла и для растворения масла добавляется небольшое количество воды. Для инициирования кристаллизации добавляется этанол. Выпавшие кристаллы фильтруются и промываются этанолом и соединяются с первой партией кристаллов для получения 2,1 г продукта перекристаллизации из горячей воды.
II. Синтез соли 3-(2-гидрокси-2,2-дифосфоноэтил)-1-метил пиридин иодида.
К раствору /1-гидрокси-2-(3-пиридинил)этилиден/бис(фосфонокислоты) (0,5 г, 1,77 мМ) в 4,4 мл 1N NaOH добавляется 14 мл дистиллированной воды. К смеси добавляется метил иодид в этаноле (12 мл) (1,215 г, 8,83 мМ). pH реакционной смеси 6,0. Смесь нагревается всю ночь при 80oC. Растворители выпариваются и остаток растирается с ацетоном. Продукт перекристаллизуется из воды и этанола для получения 3-(2-гидрокси-2,2-дифосфоноэтил)-1-метил пиридин иодида, динатриевой соли.
Пример 4
Синтез 3-(2-гидрокси-2,2-дифосфоноэтил)-1-метил-пиридин гидроксида, внутренней соли

Соль 3-(2-гидрокси-2,2-дифосфоноэтил)-1-метил пиридин иодида динатрия, полученная, как описано в примере 3 выше, (0,42 г, 0,89 мМ) в 6N HCl (40 мл) нагревается с обратным холодильником 12 часов. Реакционная смесь охлаждается и затем промывается хлорофором (5 • 40 мл) для удаления иода. Водный слой концентрируется при пониженном давлении. Сырой остаток растирается с ацетоном для получения нужной внутренней соли (255 мг) в виде бледно-желтого твердого вещества с выходом 85%.
Пример 5
2-(2-гидрокси-2,
2-дифосфоноэтил)-1-метилпиридин гидроксид, внутренняя соль, мононатриевая соль

I. Синтез /1-гидрокси-2-(2-пиридинил)этилиден/бис-(фосфокислоты).
В 250 мл 3-х горловую колбу с круглым дном, снабженную обратным холодильником, капельной воронкой, добавляются гидрохлорид 2-пиридилуксусной кислоты (1,74 г, 10 мМ), фосфористая кислота (2,46 г, 30 мМ) и 50 мл хлоробензола. Колба помещается в кипящую водяную баню и по каплям из капельной воронки к реакционной смеси добавляется трихлорид фосфора (4,08 г, 30 мМ). Все это перемешивается 3 часа при 100oC и в ходе реакции образуется желтое вязкое масло. После 3 часов реакционная смесь охлаждается в ледяной бане и избыток хлорбензола декантируется. К маслу добавляется 100 мл воды и эта смесь нагревается с обратным холодильником в течение ночи. После флегмации смесь охлаждается и начинает осаждать продукт. Этот осадок фильтруется и промывается этанолом для получения первого выхода кристаллов. Чтобы получить второй выход кристаллов, фильтрат выпаривается до масла и к маслу добавляется небольшое количество воды до тех пор, пока оно не растворится. Для индуцирования кристаллизации добавляется этанол. Второй выход кристаллов фильтруется и промывается этанолом и соединяется с первым выходом для получения общего выхода в 1,87 г после перекристаллизации из горячей воды.
II. Синтез 2-(2-гидрокси-2,2-дифосфоноэтил)-1-метил пиридин гидроксида, внутренней соли, мононатриевой соли.
/1-гидрокси-2-(2-пиридинил)этилиден/бис(фосфокислота) (3,53 мМ, 1,0 г) растворяется в 8,8 мл 1N раствора гидроксида натрия и 8,8 мл дистиллированной воды. К этому добавляется иодометан (17,67 мМ, 1,1 мл) в 18 мл этанола. Эта реакционная смесь нагревается при 80oC до завершения реакции. Растворитель концентрируется в вакууме и остаток перекристаллизуется из этанола и воды, чтобы получить 0,92 г 2-(2-гидрокси-2,2-дифосфоноэтил)-1-метил пиридин гидроксида, внутренней соли, соли мононатрия.
Пример 6
3-(3-гидрокси-3,
3-дифосфонопропил)-1-метилпиридин гидроксид, внутренняя соль

I. Синтез 3-(3-пиридинил)пропановой кислоты.
β-(3-пиридил)-акрилдовая кислота (10 г) помещается в сосуд гидрогенизации Парра со 150 мл ледяной уксусной кислоты, 100 мл абсолютного этанола и большим количеством катализатора палладий-на-углероде. Раствор встряхивается при 50 ф/д2(3,51 кг/см2) водорода и подвергается повторному давлению до тех пор, пока не прекратится поглощение водорода (приблизительно 3 часа). Раствор фильтруется через целит, промывается этанолом и растворитель выпаривается в вакууме и азеотропируется толуолом, чтобы получить желаемый продукт в виде белых кристаллов.
II. Синтез /-1-гидрокси-3-(3-пириднил)пропилиден/-бис(фосфокислоты).
В 250 мл 3-х горловую колбу с круглым дном, снабженную обратным холодильником и капельной воронкой, добавляется 3-пиридилпропионовая кислота (12,03 г, 79,6 мМ), фосфористая кислота 919,6 г, 239 мМ) и 50 мл хлорбензола. Колба помещается в 100oC баню и к реакционной смеси по каплям добавляется трихлорид фосфора (20,88 мл, 239 мМ). Реакционная смесь перемешивается 3 часа, образуется смолистое масло, и в это хлорбензол декантируется и добавляется 100 мл 1N HCl и смесь нагревается с обратным холодильником в течение ночи, при 100oC. Раствор охлаждается и белый осадок, который образуется, фильтруется и промывается этанолом и эфиром, чтобы получить 16,9 г желаемого продукта.
III. Синтез 3-/3-гидрокси-3,3-дифосфонопропил/-1-метил пиридин гидроксида, внутренней соли.
/1-гидроксид-3-(3-пиридинил)пропилиден/бис(фосфокислота) (3,37 мМ, 1,0 г) растворяется в 8,4 мл 1N NaOH раствора с 29 мл дистиллированной воды. Иодметан (16,83 мМ, 1,05 мл) добавляется в 19 мл этанола. Эта реакционная смесь нагревается при 80oC в течение ночи. Растворитель выпаривается в вакууме и остаток растирается с ацетоном, затем перекристаллизуется из этанола и воды, чтобы получить 0,5 г 3-(3-гидрокси-3,3-дифосфонопропил)-1-метил пиридин гидроксид, внутреннюю соль.
Пример 7
Синтез 3-(2,2-дифосфоноэтил)-1-гептилпиридин хлорида
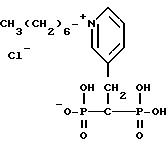
Вышеупомянутое соединение получают и синтезируют, как описано ниже.
I. Синтез тетраэтил-3-(2,2-дифосфоноэтил)-1-гептил пиридин иодида.
Раствор 2-/(3-пиридинил)этилиден/ бис(фосфокислота) тетраэтил эфира (4,0 г, 10,5 мМ) получают, как описано в Примере I (часть I) ниже, и 1-иодгептан (7,14 г, 31,6 мМ) в сухом ацетоне (25 мл) нагревается с обратным холодильником 72 часа в азоте. Реакционная смесь выпаривается в вакууме до сухости. Остаток растирается 2 раза в диэтиловом эфире, фильтруется и высушивается в вакуумной сушилке, чтобы получить продукт присоединения N-гептила (6,37 г).
II. Синтез 3-(2,Ю2-дифосфоноэтил)-1-гептилпиридин хлорида.
Продукт присоединения N-гептила (6,20 г, 10,2 мМ) нагревается с обратным холодильником в 6N хлористоводородной кислоте (62 мл) 48 часов. Реакционная смесь выпаривается в вакууме до сухости, добавляется ацетон ит смесь выпаривается в вакууме во второй раз. Остаток растирается в этаноле, чтобы получить твердое вещество желтого цвета, которое собирается фильтрацией, промывается диэтиловым эфиром и высушивается в вакуумной сушилке, чтобы получить 29% (для двух стадий) N-гептил пиридин бисфосфокислоты (1,19 г).
Пример 8
3-(2,
2-дифосфоноэтил)-1-метилпиридин хлорида
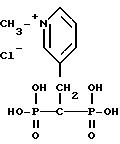
Вышеупомянутое соединение получают и синтезируют, как описано ниже.
I. Синтез тетраэтил-3-(2,2-дифосфоноэтил)-1-метилпиридин иодида.
Раствор, содержащий тетраэтиловый эфир 2-/(3-пиридинил)этилиден/ бис(фосфокислоты) (5,0 г, 13,2 мМ), полученный, как описано в Примере 1 (часть I) выше, иодметан (5,60 г, 39,5 мМ) и сухой ацетонетрил (32 мл), нагреваются с обратным холодильником 72 часа. Реакционная смесь выпаривается в вакууме до сухости, добавляется ацетон и смесь выпаривается до сухости во второй раз. Сырой продукт растирается в смеси гексан/диэтиловый эфир, собирается фильтрацией в атмосфере азота и высушивается в вакуумной сушилке, чтобы получить 5,0 г продукта присоединения N-метил пиридина.
II. Синтез 3-(2,2-дифосфоноэтил)-1-метилпиридин хлорида.
Сложные эфиры фосфоната гидролизуются нагреванием с обратным холодильником N-метилированного продукта присоединения (5,0 г, 13,1 мМ) в 6N хлористоводородной кислоте (54 мл) в течение 48 часов. Реакционная смесь выпаривается в вакууме до сухости, добавляется ацетон и смесь выпаривается в вакууме до сухости во 2-ой раз. Остаток растирается в этаноле, чтобы получить твердое вещество, которое собирается фильтрацией. Сырой продукт растирается в минимальном количестве воды и обрабатывается древесным углем, затем фильтруется через целит. Фильтрат выливается в этанол, чтобы осадить продукт, который собирается фильтрацией и высушивается в вакуумной сушке, чтобы получить N-метилированную бисфосфокислоту (1,05 г, 25%-ый выход для двух стадий).
Пример 9
Синтез
3-(2-фосфоно-2-метилфосфоноэтил)-1-метилпиридин иодида

Вышеупомянутое соединение получают и синтезируют как опимсано ниже.
I. Синтез 2-(3-пиридинилэтилиден)фосфонометил фосфокислоты, триэтилового эфира.
Используя фактически ту же методику, что описана в примере 1 (часть I) выше, триэтиловый эфир метилен фосфонометилфосфината, полученный, как описано Henning, H. G. и Petzold, G. В Z.Chem. т.5, стр. 419 (1965), преобразуется в триэтиловый эфир 2-(3-пиридинилэтилиден)-фосфонометилфосфокислоты.
II. Синтез триэтил-3-(2-фосфоно-2-метилфосфоноэтил)-1-метилпиридин иодида.
Триэтиловый эфир 2-(3-пиридинил)этилиден фосфонометил фосфокислоты (2,32 г, 6,64 мМ) и иодометан (9,42 г, 6,44 мМ) нагревается с обратным холодильником 24 часа в сухом ацетоне (23 мл) в атмосфере азота. Реакционная смесь выпаривается в вакууме до сухости, добавляется ацетон и смесь выпаривается в вакууме до сухости во второй раз, чтобы получить N-метилированный продукт присоединения (2,60 г).
III. Синтез 3-(2-фосфоно-2-метилфосфоноэтил)-1-метилпиридин иодида.
Продукт присоединения N-метил пиридина (2,60 г, 6,20 мМ) нагревается с обратным холодильником в 6N соляной кислоты в течение 18 часов. Реакционная смесь выпаривается в вакууме до сухости, добавляется метанол и смесь выпаривается до сухости во второй раз. Сырой продукт растворяется в минимальном объеме воды и затем фильтруется через силикагель. Водный фильтрат выпаривается в вакууме, чтобы получить 0,5 г (для двух стадий выход 25%) N-метил пиридин фосфонометилфосфиновой кислоты.
Пример 10
Синтез
3-(2-фосфоно-2-сульфоноэтил)-1-метилпиридин хлорида

I. Синтез триэтил-2-(3-пиридинил)этилиден-1-фолсфоно-1-сульфоната.
К смеси NaH (1,10 мМ) 40% в масле и толуоле (10 мл) добавляется этиловый эфир диэтоксифосфинил метан сульфокислоты (1мМ), полученный, как указано Carretero и др. Tetrahedron, т.43, стр. 5125 - 5134 (N 21) 1987, при 0oC в атмосфере азота. После перешивания в течение 30 минут реакционная смесь добавляется по каплям через воронку к 3-пиколил хлориду (1,00 мМ) в толуоле (50 мл) при комнатной температуре. Перемешивание продолжается 12 часов, реакционная смесь выливается в воду и слои разделяются. Водный слой экстрагируется диэтилом дважды, и соединенные органические слои промываются насыщенным водным хлоридом натрия. Продукт отделяется от непрореагировавших исходных материалов мгновенной хроматографией на силикагеле 10%-ным изопропиловым спиртом в метиленхлориде. Это дает выход фосфоносульфоната в виде бледно-желтого масла.
II. Синтез триэтил-3-(2-фосфоно-2-сульфоноэтил)-1-метилпиридин иодида.
Раствор, содержащий триэтил-2-(3-пиридинил)этилиден-1-фосфоно-1-сульфонат (5,0 мМ), иодометан (25,0 мМ) и сухой ацетонитрил (100 мл) нагревается в обратным холодильником 72 часа. Реакционная смесь выпаривается в вакууме до сухости, добавляется ацетон и смесь выпаривается до сухости второй раз. Сырой продукт растирается в смеси гексан/диэтиловый эфир, собирается фильтрацией в атмосфере азота и высушивается в вакуумной сушке до получения продукта присоединения N-метил пиридина.
III. Синтез 3-(2-фосфоно-2-сульфоэтил)-1-метилпиридин хлорида.
Соль N-метилпиридина (0,3 мМ) гидролизуется в кипящей с обратным холодильником 6N соляной кислоте (10 мл) на протяжении 12 часов Реакционная смесь выпаривается в вакууме до сухости. Сырой продукт растворяется в минимальном количестве воды и обрабатывается древесным углем, затем фильтруется через целит. Фильтрат фильтрацией и высушивается в вакуумной сушке для получения 3-(2-фосфоно-2-сульфоэтил)-1-метилпиридин хлорида.
Пример 11
Синтез 2-(2-гидрокси-2,2-дифосфоноэтил)-1,1-диметил
пиперидин иодида
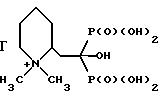
I. Синтез /1-гидрокси-2-(2-пиперидинил)этилиден/-бис(фосфокислоты), мононатриевой соли.
/1-гидрокси-2-/2-пиридинил)этилиден/-бис(фосфокислота), полученная как описано в примере 5, часть I, выше (2,5 г, 0,0088 мМ) добавляется к 50 мл воды и pH доводится до 6,0 50% NaOH. Этот раствор помещается в 500 мл сосуд гидрогенизации Парра и добавляется приблизительно 1 г 10% катализатора Pd/C. Сосуд Парра помещается на аппарат гидрогенизации Парра и подвергается давлению H2 в 45 ф/д2 (3,164 кг/см2). После 4 часов добавляется еще катализатор и давление вновь доводится до 45 ф/д2 и реакция протекает в течение ночи. Раствор фильтруется через цеолит, промывается водой и выпаривается до чистого масла. К маслу добавляется этанол (30 мл) и смесь мягко нагревается с обратным холодильником 48 часов, чтобы превратить масло в порошкообразный белый осадок. Он фильтруется и промывается этанолом.
II. Синтез соли 2-(2-гидрокси-2,2-дифосфоноэтил)-1,1-диметилпиперидин иодида.
Соли /1-гидрокси-2-(2-пиридинил)этилиден/бис(фосфокислоты) мононатрия (3,5 мМ) растворяется в смеси ДМСО (10 мл) и воды (50 мл). К этому добавляется метил иодид (35,0 мМ) и раствор нагревается с обратным холодильником в атмосфере азота 3 дня. Реакционная смесь концентрируется при пониженном давлении и четвертичный продукт очищается из воды и изопропанола.
Пример 12
Синтез 3-(2,2-дифосфоно-2-гидроксиэтил)-1,1-диметил пиперидин иодида

I. Синтез /1-гидрокси-2-(3-пиперидинил)этилиден бис(фосфокислоты), мононатриевой соли.
1-гидрокси-2-(3-пиридинил)этилиден бис(фосфокислоты), полученная, как описано в примере 3, часть I, выше (2,0 г, 0,0071 мМ) добавляется к 50 мл воды и pH доводится до 6,0 50% NaOH. Этот раствор помещается в 500 мл сосуд гидрогенизации Парра и добавляется приблизительно 1 г 10% катализатора Pd/C. Сосуд Парра помещается в гидрогенизатор Парра и подвергается давлению H2 в 45 фунт/дюйм2. После 4 часов добавляется еще катализатор и давление вновь доводится до 45 ф/д2 и реакция протекает в течение ночи. Раствор фильтруется через целит, промывается водой и выпаривается до чистого масла. К маслу добавляет этанол (30 мл) и смесь подвергается мягкой флегмации 1 час для преобразования масла в порошкообразный белый осадок. Он фильтруется и промывается этанолом.
II. Синтез 3-(2,2-дифосфоно-2-гидроксиэтил)-1,1-диметил пиперидин иодида.
Используя фактически ту же методику, что описана в Примере II, часть II, выше, соль мононатрия /1-гидрокси-2-(3-пиперидинил)этилиден/бис(фосфокислоты) превращают в 3-(2,2-дифосфоно-2-гидроксиэтил)-1, 1-диметилпиперидин иодид.
Пример 13
Синтез 3-(2-карбокси-2-фосфонэтил)-1-метилпиридин хлорида

Вышеуказанное соединение готовится и синтезируется так, как описано здесь ниже.
I. Синтез триметил-2-фосфоно-3-(3-пиридил)пропаноата.
Раствор А готовится добавлением 2,00 г (0,050 М) NaH (60% в минеральном масле) медленно к раствору в 8,09 мл (0,050 М) триметил фосфоноацетата в 50 мл безводного ДМСО, чтобы свести к минимуму пенообразование. Реакционная смесь имеет вид светло-желтого раствора. (Все вышеуказанное делается при температуре окружающей среды в посуде из стекла, высушенной в печи в атмосфере азота).
К смеси из 8,20 г (50 М) 3-пиколил хлорид гидрохлорида в 50 мл безводного диметилсульфоксида в атмосфере азота медленно добавляется (в течение 5 минут, чтобы снизить пенообразование) 2,0 г (50 М) NaH (60% в минеральном масле). Реакционная смесь перемешивается 75 минут. В течение 40 минутного периода к этой реакционной смеси добавляется Раствор А. Полученный раствор перемешивается при температуре окружающей среды 18 часов. Растворитель удаляется в вакууме до получения вязкого красно-коричневого материала. Указанный материал забирается в 100 мл насыщенного (водного) раствора NH4Cl и экстрагируется 3 • 100 мл метиленхлорида. Экстракты соединяются, высушиваются MgSO4, и выпариваются до сухости в вакууме до получения 11,3 г масла. Минеральное масло экстрагируется из этого 3 • 100 мл гексана и получается 9,6 г красно-коричневого материала. Он очищается подготовильной ВЭЖХ, используя ацетон как элюэнт на силикагелевой колонне. Регенерируется 2,5 г нужного продукта.
II. Синтез 3-(2-карбокси-2-фосфоноэтил)-1-метилпиридин хлорида.
Раствор из 2,5 г (0,009 М) триметил 2-фосфоно-3-(3-пиридил) пропаноата и 2,25 мл (.020 М) метил иодида в 5 мл сухого тетрагидрофурана перемешивается при окружающей температуре 18 часов. В течение этого времени образуется смола. Растворитель выливается и смола промывается 2 • 10 мл сухого эфира.
Сложноэфирные группы гидролизуются растворением смолы в 25 мл 6N HCl и флегмацией полученного раствора в течение 3 часов. Раствор охлаждается, и экстрагируется 3 • 8 мл CHCl3, который удалил часть I2. Водный слой выпаривается в вакууме для получения коричневатой смолы. Она растворяется в 20 - 25 мл горячего абсолютного этанола. Раствор охлаждается и добавляется 10 - 15 мл сухого ацетона. После 14 часового перешивания при температуре окружающей среды образуется твердое вещество. Оно отфильтровывается и промывается ацетоном и затем эфиром с получением 2,0 г твердого вещества бледно-желтого цвета, которое дальше очищается смешиванием с 10 мл безводного этанола в течение 2,5 часов, затем фильтруется и промывается 3 мл этанола, затем 10 мл ацетона и эфиром. Так получают 1,82 г (выход 71%) 3-(2-карбокси-2-фосфоноэтил)-1-метилпиридин хлорид.
Пример 14
Синтез соли 3-(3,3-дифосфонопропил)-1-гексадецилпиридина динатриевой соли

I. Синтез тетраэтилового эфира /3-2-пиридинил/пропилиден/бис(фосфокислоты).
Фениллитий (79 мл, 1,96 М в эфире, 0,155 М) в 200 мл сухого бензола охлаждается до 0oC и по каплям в 50 мл бензола добавляется 2-пиколин (12,3 г, 0,132 М). Реакция перемешивается 3 часа и в 50 мл бензола по каплям добавляется тетраэтил этенилиден-бис(фосфонат). Реакционная смесь нагревается доя комнатной температуры и перемешивается в течение ночи. С охлаждением добавляется 1N HCl (132 мл) и слои разделяются. pH водной фазы доводится до 10 и делается несколько экстракций этилацетатом. Соединенные экстракты высушиваются над сульфатом натрия, затем фильтруются и выпариваются до получения 47,2 г тетраэтилового эфира /3-2-пиридинил/пропилиден/бис(фосфокислоты). Этот сырой продукт очищается частями до использования мгновенной хроматографией 7% MeOH/CHCl3. Например, 13,2 г продукта хроматографируется двумя частями для получения 8,2 г очищенного продукта.
II. Синтез 3-(3,3-дифосфонопропил)-1-гексадецилпиридин иодида, тетраэтилового эфира.
Тетраэтил бис(фосфонат), полученный, как описано в части I, (8,2 г, 20,9 мМ) полощется в 50 мл ацетонитрила. Добавляется иодогексадекан (22 г, 62,5 мМ) и смесь нагревается с обратным холодильником 3 дня. Растворитель выпаривается и остаток помещается на сухой 10-ти дюймовый слой силикагеля, который затем элюируется 5% MeOH/CHCl3. Избыток иодогексадекана элюируется в первых трех фракциях. Продукт собирается в несколько фракций. Первые три фракции соединяются, чтобы получить 5,3 г продукта и следующие 8 фракций соединяются, чтобы получить 7,8 г продукта, что в общем получают 13,1 г.
III. Синтез 3-(3,3-дифосфонопропил)-1-гексадецилпиридина, динатриевой соли.
Тетрасложный эфир (7,8 г, 10,5 мМ) нагревается с обратным холодильником в 75 мл 6N HCl 2 дня. Реакционная смесь охлаждается и экстрагируется этилацетатом. Водная фаза выпаривается, добавляется метанол и раствор вновь выпаривается до получения 5,4 г продукта. Добавляется 1N гидроксида натрия 917 мл) и pH доводится до 7. Раствор высушивается заморозкой и получают 5,6 г 3-(3, 3-дифосфонопропил)-1-гексадецилпиридин динатриевую соль (79%).
Пример 15
Синтез (7-дифосфоногидроксиметил)-2-метил-2-пиридин иодида

I. Синтез N-(2,2-диэтоксиэтил)-N-/(3-метоксифенил)метил/-4-метилбензосульфонамида.
m-анизальдегид (112 г, 0,82 М) и аминоацетальдегид диэтил ацеталь (115 г, 0,86 мМ) в бензоле (2,6 л) нагреваются с обратным холодильником в атмосфере азота 3 часа. Затем концентрацией при пониженном давлении удаляется приблизительно 1,8 л бензола. Остающийся раствор помещается в реактор гидрогенизации Парра и гидрогенизируется при комнатной температуре до тех пор, пока не произойдет захват теоретического количества водорода (56 фунт). Затем раствор фильтруется через целит и фильтрат концентрируется при пониженном давлении. Полученное масло растворяется в пиридине (1 л) и к нему по каплям добавляется п-метоксибензол сульфонил хлорид (172 г, 0,90 М) в пиридине (600 мл). Реакционная смесь перемешивается 3 дня при комнатной температуре и затем концентрируется при пониженном давлении. Остаток выливается в ледяную воду и перемешивается при 0oC 1 час. Водная смесь экстрагируется диэтиловым эфиром (6 • 500 мл). Соединенные органические экстракты промываются насыщенным водным NaCl, высушиваются над сульфатом магния, фильтруются и концентрируются при пониженном давлении для получения продукта (312 г) в виде желтого масла (выход 93%).
II. Синтез 7-метоксиизохинолина
В
двухлитровую колбу с круглым дном, снабженную магнитной мешалкой, конденсатором и входом для азота добавляется (75 г, 0,184 М) N-(2,2-диэтоксиэтил)-N-/(3-метоксифенил)метил/-4-метил бензолсульфонамид,
1,0 л диоксана и 200 мл 6N HCl. Эта суспензия перемешивается и нагревается с обратным холодильником в азоте 18 часов. Затем реакционный раствор медленно выливается в 1 л H2O и
перемешивается еще 30 минут, затем экстрагируется эфиром (2 • 500 мл). pH водного слоя доводится до 8 гидроксидом аммония. Продукт экстрагируется дихлорметаном. Соединенные органические
экстракты высушиваются над MgSO4, фильтруются и выпариваются до получения 30 г масла. Сырой продукт очищается хроматографией с 12,0% ацетоном в дихлорметане для получения продукта (19,7 г)
с выходом 67%.
III. Синтез 7-гидроксиизохинолина.
В двухлитровую трехгорлую колбу с круглым дном, снабженную магнитной мешалкой и дополнительной воронкой добавляется 19,7 г (0,124 М) 7-метоксиизохинолина и 800 мл сухого дихлорметана. Этот раствор перемешивается и охлаждается до -75oC сухой баней из льда/ацетона, и с поддержанием температуры -75oC по каплям добавляется 628 мл (0,628 М) 1,0 М трибромида бора в дихлорметане. После этого суспензия перемешивается 18 часов с медленным увеличением температуры до комнатной. Реакционная суспензия выливается в 1 л ледяной воды и перемешивается 1 час. Слои разделяются и затем водный слой доводится с кислотного до нейтрального (pH 7) посредством 1N NaOH. В осадок выпадают желтые кристаллы, они отфильровываются, высушиваются воздухом и получают 14,5 г желтого твердого вещества с выходом 81%.
IV. Синтез 7-гидрокси-8-нитроизохинолина.
В 300 л колбу с круглым дном добавляется 14,5 г (0,1 М) 7-гидроксиизохинолина и 100 мл нагретого тетраметиленсульфона. Коричневая суспензия перемешивается и к ней частями добавляется 18,6 г (0,14 М) тетрафторобората нитрона при охлаждении (ледяная баня). Реакционная смесь перемешивается 3 часа. Затем реакция гасится 100 мл метанола, выпаривается до сухости и дважды растирается в эфире для осаждения вещества темного цвета (19,0 г, 100%).
V. Синтез хлористоводородной соли 8-амино-7-гидроксилизохинолина.
Реактор гидрогенизации загружается 7-гидрокси-8-нитроизохинолином (28,5 г, 0,15 М), 5% Pd на углероде (6,0 г) и этанолом (725 мл). Шлам гидрогенизируется до тех пор, пока прекращается захват водорода (40 фунт/дюйм2/2,8 кг/см2). Далее реакционная смесь фильтруется через целит и фильтрат концентрируется при пониженном давлении. Остаток растворяется в метаноле. Добавление эфирной-CHI осаждает продукт в виде хлористоводородной соли (19 г) с выходом 65%.
VI. Синтез 7-гидрокси-8-изохинолиндиазон хлорида.
К HCl соли 8-амино-7-гидроксиизохинолина (4,94 г, 0,025 М) в этанольной HCl при 0oC по каплям добавляется раствор трет-бутилнитрила 917,46 мл), этанол (790 мл) и вода (58 мл). После завершения добавления раствор перемешивается еще 2 часа при 0oC. Продукт осаждается из реакционной смеси добавлением диэтилорвого эфира (2 л). Продукт собирается фильтрацией и промывается диэтиловым эфиром для получения нужного продукта (2,6 мг) с выходом 50%.
VII. Синтез 2-пиридин-7-карбоновой кислоты, метиловый эфир.
7-гидрокси-8-изохинолиндиазон хлорид (0,50 г, 2,4 мМ) и бикарбонат натрия (302 мг, 3,6 мМ) в безводном метаноле (650 мл) облучаются лампой солнечного света в 275 ватт при 0oC 3 часа. Сырой остаток растворяется в воде и продукт экстрагируется метиленхлоридом. Соединенные органические экстракты высушиваются над сульфатом магния, фильтруются и концентрируются при пониженном давлении для получения продукта в виде твердого вещества оранжевого цвета (210 мг) с выходом 50%.
VIII. Синтез дигидро-2-пиридин-7-карбоновой кислоты, метиловый эфир.
Сосуд для гидрогенезации загружается метиловым эфиром 2-пиридин-7-карбоновой кислоты (0,8 г, 4,57 мМ), 5% Pd на углероде (2,0 г, влажный) и метанолом (125 мл). Суспензия гидрогенезируется (40 фунт/дюйм2/2,8 кг/см2) до тех пор, пока не прекратится поглощение водорода. Реакционная смесь фильтруется через целит и затем выпаривается до сухости, чтобы получить продукт (430 мг) с выходом 53%.
IX. Синтез дигидро-2-пиридин-7-карбоновой кислоты, HCl соли.
Метиловый эфир дигидро-2-пиридин-7-карбоновой кислоты (0,53 г, 3,0 М) нагревается при 58oC в 1N NaOH (3,1 мл) и метаноле (30 мл) 2,5 часа. Раствор выпаривается до сухости в вакууме и полученный остаток перемешивается в этанольный HCl для осаждения продукта. Нужный продукт собирается фильтрацией.
X. Синтез /1-гидрокси-(дигидро-2-пиридин-7-ил-метилен/ бис(фосфокислоты).
К трихлориду фосфора (1,19 г, 8,63 мМ) добавляется суспензия из дигидро-2-пиридин-7-карбоновой кислоты, HCl соли (0,54 г, 2,88 мМ), фосфористой кислоты (708 мг, 8,63 мМ) и хлорбензола (10 мл). Реакционная смесь перемешивается и нагревается при 105oC 4 часа. Затем смесь охлаждается до комнатной температуры и хлорбензол декантируется. К сырому остатку добавляется 1N HCl (10 мл) и смесь всю ночь нагревается с обратным холодильником. Затем реакционная смесь концентрируется при пониженном давлении и растирается в ацетоне, чтобы получить желаемый продукт (107 мг) с хорошей чистотой.
XI. Синтез (7-дифосфоногидроксиметил)-2-метил-2-пиридин иодида.
Используя фактически ту же методику, что описана в Примере 3, часть II, выше, /1-гидрокси-(дигидро-2-пиридин-7-ил)метилен/-бис(фосфокислота) преобразуется в /7-дифосфоногидроксиметил/-2-метил-2-пиридин иодид.
Пример 16
Синтез 3-(2,2-дифосфоноэтил)-N, N, N-триметил-бензоламин гидроксида, внутренней соли

3-(2,2-дифосфоноэтил)-фенил-триметил-аммоний соль синтезируется, как описано ниже.
I. Синтез тетраэтил эфира 2-(3-нитрофенилэтилиден)бис(фосфокислоты).
В высушенную пламенем колбу с круглым дном объемом в 50 мл в атмосфере азота добавлялось 1,12 г гидрида калия (35% в масле, 10,59 мМ), который вначале промывался пентаном. Добавляется сухой толуол (10 мл) и суспензия охлаждается до 0oC. По каплям добавляется тетраэтил метилен дифосфонат (3,31 г, 9,63 мМ) и когда добавление завершается, смесь перемешивается при комнатной температуре 1 час. 3-нитробензил бромид (2,09 г, 9,63 мМ) растворяется в 10 мл толуола в 100 миллилитровой колбе и в нее добавляется анионный раствор и все перемешивается всю ночь при комнатной температуре. Реакционная смесь фильтруется через целит и затем концентрируется при пониженном давлении. Сырой остаток очищается подготовительной жидкостной хроматографией до получения тетраэтилового эфира 2-(3-нитрофенилэтилиден)бис(фосфокислоты).
II. Синтез 2-(3-аминофенилэтилиден)бис(фосфокислоты).
Тетраэтиловый эфир 2-(3-нитрофенилэтилиден)бис(фосфокислоты) растворяется в этаноле (50 мл) и к этому добавляется 10% палладий на углероде (0,50 г). Реакционная смесь встряхивается под давлением (40 ф/д2) в сосуде гидрогенизации Парра 2 часа до полного поглощения водорода. Реакционная смесь фильтруется через целит. Целит промывается свежим этанолом и затем промывочные воды фильтрата и этанола соединяются и концентрируются при пониженном давлении. Остаток растворяется в хлороформе и затем продукт присоединения амино изолируется в виде HCl соли экстракцией в 6N HCl. Водный слой, содержащий амино продукт в виде тетраэтилового эфира нагревается с обратным холодильником в течение 12 часов в атмосфере азота. Реакционная смесь охлаждается, обрабатывается древесным углем и затем фильтруется через целит. Фильтрат концентрируется при пониженном давлении для получения би фосфокислоты.
III. Синтез соли 3-(2,2-дифосфоноэтил)-фенил-триметил аммония.
2-/3-аминофенилэтилиден/бис/фосфокислота/ растворяется в воде (10 мл) и этаноле (2 мл). К этой смеси добавляется в избытке иодметан и реакционная смесь нагревается с обратным холодильником в атмосфере азота 48 часов. Реакционная смесь охлаждается и концентрируется при пониженном давлении и сырой остаток перекристаллизуется из воды и этанола, чтобы получить соль бензоламина в виде твердого вещества белого цвета.
Пример 17
Модель Шенка
Соединения оценивались на ингибирование костной резорбции и ингибирование минерализации in vivo на модельной системе на животных,
известной в области метаболизма кости как Модель Шенка. Общие принципы этой модели раскрыты у Shinoda и др. Calcif. Tissue Int. 35, 87 - 99 (1983); и у Shenk и др. Calcif. Tussue Res. 11, 196 - 214
(1973), которые включены сюда в качестве ссылки.
Материалы и методы:
Животные.
Самцы-сосунки крыс 17-дневного возраста (30 г) Sprague Dawley (Charles River Breeding Laboratories) были транспортированы вместе с матерями и помещены в пластиковые клетки также вместе с матерями по прибытии. В возрасте 19 дней крысята, получающие без ограничения пищу и воду статистически делятся на контрольные группы и группы для лечения, содержащие семь животных на группу. В первый и снова на седьмой день всем животным делалась внутрибрюшинная инъекция ("1 Р") кальцеина (1% раствор в 0,9% физрастворе; с дозировкой 0,2 мл/100 г веса тела). На четвертый день всем животным делалась ВБ инъекция гидрохлорида тетрациклина (1% раствор в 0,9% физрастворе; дозировка 0,2 мл/100 г веса тела). Эти соединения активно маркируют минерализацию кости и хряща.
Дозы растворов и методика дозирования.
Все растворы для подкожной инъекции готовятся в 0,9% нормальном физрастворе и доводятся до pH 7,4 с использованием NAOH и/или HCl. Расчет дозирующего раствора делается пересчетом массы порошка (основанной на молекулярном весе, гидратации) активного материала в мг/мл тела на мг Р/кг. Концентрации основаны на дозировании 0,2 мл/100 г веса тела. Все соединения вводят с дозировкой 0,01, 0,1, 1,0 и 10,0 мг Р/день в течение 7 дней. Соединения, демонстирующие активность при 0,01 мг Р/кг/день затем тестировались при логарифмических снижениях до 0,001 мг/Р/кг/день. Корректировка дозы в зависимости от изменений веса тела делалась ежедневно.
Аутопсия, обработка ткани и гистоморфометрия
На 8 день после начала дозирования все животные были умерщвлены ВБ передозировкой пентабарбитола.
Большеберцовые кости отделялись и помещались в 70% этиловый спирт. Одна большеберцовая кость дегидрировалась в очищенных растворах этанола и погружалась в метил метакрилат, как описано у Шенка,
Methods of Calcified Tissue Preparation/G.R.Dickson, Editor, Elsevier Seience Publ., The NetherLands, 1984/, раскрытия которых включены сюда ссылкой полностью. Большеберцовая кость разделялась
продольно по мегафизу. Образцы окрашивались с одной стороны нитратом серебра и помещались на предметные стекала для оценки анализатором Quantimet Image/Cambridge Instruments, Inc./ с использованием
как освещения, так и ультрафиолетового света. Содержимое метафизной трабекулярной кости измерялось в участке между меткой флюоресценции и пластиной роста: выражалось как процент от общей площади
(кость + мозг). Ширина пластины эпифизного роста была получена как средняя величина 10 измерений на одинаковом расстоянии поперек среза.
Статистическая оценка данных делалась с использованием параметрического и непараметрического анализа дисперсии и суммарного теста Вилкоксона для определения статистически значительного эффекта в сравнении с контрольными животными. Модель Шенка дает данные для торможения резорбции кости in vivo с помощью этих соединений.
Пример 18
Модель стимулированного артрита
Существует много моделей артрита у
животных, среди них - артрит, вызванный стимулятором с использованием Mycobacterium butyricum. Эта модель во многих отношениях имитирует ревматоидный артрит у человека (опухание суставов, связанное с
попаданием клеток и паннуса в суставное пространство, резорбцией кости и высвобождением хемотоксических факторов и липосомальных составляющих в суставное пространство) /1,2/. Ряд профилактических и
терапевтических исследований указывает на потенциальное использование противовоспалительных лекарств /3, 4/ и дифосфонатов при артрите /5, 6/.
1. Pearson, C., Wood F. (1959), Studies of Polyarthritis and Other Lesions Induced by Injection of Mycobacterial Adjuvant. 1. General Clinical and Pathological Characteristics and Some Modifying Factors, Arth. Rheum., 2 : 440 - 459.
2. Blackman, A., Burns, J.W., Framer, J.B., Radziwonik, H., Westwick, J. (1977), An X-ray Analysis of Adjuvant Arthritis in the Rat/ The Effect of Prednisolone and Indomethacin, Agents and Actions, 7 : 145 - 151.
3. Winter, C.A., Nuss, G.W. (1966), Treatment of Adjuvant Arthritis in Rats with Anti-inflammatory Drugs, Arth. Rheum., 9 : 394 - 404.
4. Winder, C.V., Lembke, L.A., Stephens, M.D. (1969), Comparative Bioassay of Drugs in Adjuvant-Induced Arthritis in Rats: Flufenamic Acid, Mefenamic Acid, and Phenylbutazone, Arth. Rheum., 12 : 472 - 482.
5. Francis, M.D., Flora, L. King, W.R. (1972), The Effects of Disodium Ethane-1-Hydroxy-1-Diphosphonate on Adjuvant Induced Arthritis in Rats, Calcif. Tiss. Res., 9 : 109 - 121.
6. Flora, L. (1979), Comparative Antiinflammatory and Bone Protective Effects of Two Diphosphonates in Adjuvant Arthritis, Arth. Rheum, 22 : 340 - 346.
Стимулированный артрит представляет собой сильный целлюлит и синовит, вызванный у самйцов крыс (либо вила Sprague Dawley либо Lewis/ одноразовый подкожный инъекцией (ПК) Mycobacterium butyricum (8 мг/мл) в минеральном масле на 0 день. Соединения дозировались один раз в день либо перорально (peros), либо парентерально (ПК) и тестировались либо по профилактическому (с 0 дня), либо терапевтическому протоколу (с 9-го или 10-го или 14-го дней). Противоартритная эффективность измерялась по снижению объема лапы, потере веса тела, разрежению костной ткани или образованию реактиванной новой кости в сравнении с контрольными животными, которым назначался только физраствор. Лечение можно прекратить и исследовать реакцию "вспышки" (быстрого усиления воспаления), что указывает на способность соединения обеспечивать эффективность.
Материалы и методы
А. Животные.
Используемыми животными были самцы крыс Lewis (LEW). По прибытии крысы произвольным образом перемешивалось с помощью генератора случайных чисел они помещались в проволочные подвесные клетки. Пища и вода давалась без ограничений в течение всего исследования. Уход за животными и их содержание осуществлялось в соответствии с государственными и федеральными инструкциями. Каждая крыса идентифицировалась по номеру на передней стороне клетки и на хвосте животного.
B. План эксперимента.
В первый день у всех крыс были замерены вес тела (ВТ) и объем задних лап с помощью метода перемещения ртути с использованием датчика давления, связанного с компьютером. В 0 день артрит был вызван с использованием MFA (Mycobacterium butyricum) (Мб) 4,4 мг/кг в масле следующим образом: крысы анестезировались и получали однократно инъекции MFA подкожно в основании хвоста в асептических условиях.
С этого момента в разные дни, обычно дважды в неделю измерялся вес тела и объем лапы. Для профилактического протокола крысы произвольно разделялись на группы по 8 - 10 крыс и лечение начинали с 0 дня и продолжали ежедневно до окончания. Для терапевтического протокола крысы произвольно делились на группы по 8 - 10 крыс в соответствии с их PV на 10 день. Дозировка начиналась с 10 дня и продолжалась ежедневно в клетки из обувных коробок с мягкой подстилкой до 10 дней.
Растворы для дозирования
А. Для лекарств, не поддающихся окислению.
Лекарственные препараты взвешивались на калиброванных весах и затем смешивались с дистиллированной водой в мерной колбе. Затем раствор доводился до pH 7,4 0,1N NaOH. Далее раствор фильтровался через стерильный фильтр в 0,45 мМ в стерильный контейнер для хранения. Когда не использовался, раствор хранился в холодильнике.
B. Для лекарств, поддающихся окислению.
Лекарства взвешивались на колиброванных весах и затем смешивались с деоксигенированной водой в мерной колбе. Полученный раствор фильтруется через стерильный фильтр в 0,45 мМ в стерильный контейнер. При неиспользовании маточный раствор хранится в холодильнике. Ежедневно определенное количество раствора берется из маточного раствора в небольшой дозирующий стакан и затем pH доводится до 7,4 в соответствии с предварительно сделанным расчетом. При необходимости можно в дальнейшем разбавлять раствор (деоксигенированной водой).
Количество лекарства рассчитывалось на основе молекулярного веса, чистоты соединения, количества, основанного на мг/кг веса тела и гужной окончательной концентрации в мг/Р/кг. Дозируемый объем на крысу составил 0,1 мг/100 г веса тела подкожно в виде инъекции в паховую складку животного. Меняя стороны через день или 1 мл/200 г ВТ перорально с использованием изогнутой стальной дозирующей трубки. Корректировка в связи с изменением веса тела делалась ежедневно.
C. Радиография, аутопсия и отбор ткани
После окончания каждая крыса умерщвлялась
1 мл SocombR внутрибрюшино (ВБ). Сразу же делался рентгеновский снимок всего тела с помощью рентгеновского аппарата Torrox 120D на МА = 5, ISUP = 50 и время = 60 сек. На неэкранированной
медицинской пленке Kodak. Задние ноги каждой крысы удалялись и погружались в 10% буферный формалин вместе с кусочком печени, почки, селезенки и тимуса. Берцово-тарзальные суставы декальцифицировались
в 4% ЭДТК, pH 7,4 и стандартным способом заливались в парафиновые блоки и окрашивались Н + Е. Части органов подвергались аналогичной обработке.
Гистологические срезы оценивались качественно на поражение мягкой и костной ткани с использованием светокикроскопии. Делались рентгеновские снимки по костной резорбции (КР) в 6 анатомических участках трабекулярной кости в каждой задней ноге и 4-х участках каждой передней ноги по шкале 0 - 3 с произвольным счетом 0 - 60 для всех 4 ног. По реактивированному образованию новой кости (РНК) рентгеновские снимки градуируются по шкале 0 - 3 дня поперечных и серединных поверхностей большеберцовой кости и затем 0 - 2 для всех других областей, упомянутых выше с произвольным счетом 0 - 44.
D. Статистический
анализ
Данные анализа по объему лап, резорбции кости и реактивированному образованию новой кости получают с помощью Т-теста Стьюдента и односторонним анализом вариантности Tukeys (SAS) /12/.
Различия считаются значительными при pH = 0,05 или меньше.
Эта модель обеспечивает данные in vivo по эффективности противоартритных соединений с точки зрения уменьшения разрежения костной ткани на лапах и реактивированного образования новой кости в сравнении с животными, которые получали физраствор.
Пример 19
Капсулы готовятся со следующим составом:
Активный ингредиент:
3-(2,2-дифосфоноэтил)-1-(2-меркаптоэтил) пиридин хлорид - 350,0
Наполнители:
Лактоза - 90,0
Микрокристаллическая целлюлоза - 60,0
Стеарат магния - 1,0
Капсулы с указанной композицией готовятся с использованием традиционных методов, как описано ниже.
Активный ингредиент смешивается с микрокристаллической целлюлозой в специальном смесителе приблизительно 10 минут. Полученная смесь пропускается через молотковую дробилку с экраном в 80 меш. Затем смесь вновь переносится в смеситель с двойным корпусом вместе с лактозой и смешивается еще 15 минут. Полученная смесь прессуется на поршневой капсульной расфасовочной машине.
Любое из соединений, приготовленных по примерам 1 - 13 и примеру 15, может быть введено вместо активного ингредиента в капсулу, подготовленную выше.
Пример 20
приготовление таблеток со следующей композицией:
Активный ингредиент: - мг на таблетку
Соль 3-(2-гидрокси-2,2-дифосфоноэтил/-1-метилпиридин иодид динатрия - 700,00
Наполнители:
Лактоза (высушенная распылением) - 200,
0
Крахмал (1500) - 100,0
Стеарат магния - 25,0
Таблетки с указанной композицией готовятся традиционными методами.
Активный ингредиент измельчается в шаровой мельнице приблизительно 30 минут. Затем измельченный активный ингредиент смешивается в смесителе с двойной лопастью с высушенной лактозой приблизительно 20 минут. К смеси добавляется крахмал и смешивание происходит еще 15 минут. Смесь прессуется в таблетки на стандартном таблетирующем прессе. Активный ингредиент в вышеприготовленных таблетках можно заменить на любое из соединений в примерах 1 - 13 и 15.
Пример 21
Растворы для инъекций готовятся традиционными методами с использованием 10,0 мл физиологического раствора и 7,0 мг Р внутренней соли 3-(2-гидрокси-2,
2-дифосфоноэтил)-1-метилпиридина, с pH 7,4.
Ежедневная инъекция в течение 4-х дней дает значительное снижение злокачественной гиперкальцемии у пациентов с весом приблизительно 70 кг.
Любым из соединений, полученных в примерах 1 - 16, можно заменить активный ингредиент в инъекционном растворе, приготовленном выше.
Пример 22
Далее
предлагается композиция для зубной пасты.
Компонент - вес.%
3-(3,3-дифосфонопропил)-1-гексадецилпиридин, соль динатрия - 2,0
Сорбит - 33,0
Сахарин - 0,46
Кремнезем - 22
NaF - 0,243
Глицерин - 9
NaOH (50% раствор) - 0,2
Карбопол - 0,2
Келтрол - 0,6
TiO2 - 0,2
Алкил сульфат
натрия - 4
PEG 6 - 3
FDuC Blue#I (1% раствор) - 0,05
Отдушка - 1,1
Вода
Сначала механически смешиваются TiO2, кремнезем, карбопол и Х-смола
(Келтрол). Все это твердые вещества. На второй стадии растворяется активный ингредиент (2% пиридин дифосфонат) в воде и доводится pH до 7. Затем растворить NaF, сорбит, сахарин, глицерин, PEG 6 и FDuC
Blue#I (1% раствор) в водной смеси. Затем добавляются алкил сульфат натрия (28% раствор), NaOH и наконец отдушка к водной смеси. Затем добавляется твердая смесь, тщательно вымешивается паста
(температура не должна превышать 150 F) и проверяется, хорошо ли растворились Х-смола и карбопол. Проверяется окончательное pH на этой стадии и при необходимости доводится до 7,0. Данную операцию
осуществляют перемешиванием суспензии 1 : 4 средства в воде и проверкой pH всплывающего слоя.
Пример 23
Ниже представлена композиция для полоскания рта.
Компонент - вес%
3-(3,3-дифосфонопропил)-1-гексадецилпиридин, соль динатрия - 0,1
EtOH (200%) - 16,25
ПАВ (Tween 80) - 0,12
Глицерин - 10
Сахарин - 0,06
Отдушка - 0,041
FuDC Blue#I (1% раствор) - 0,022
FuDC Yellow#5 (1% раствор) - 0,018
Бензойная кислота - 0,0045
Бензоат натрия - 0,054
Вода
Вначале растворяют активный компонент (скажем, 0,5%) в воде и доводят pH до 7 с помощью NaOH при необходимости. Затем добавляют EtOH, глицерин, сахарин FuDC Blue#I, FuDC Yell.#5, бензойную кислоту и
Na бензоат. Растворяют отдушку в ПАВ и добавляют эту смолу к указанным ингредиентам. Проверяют pH и при необходимости регулируют его.
Пример 24
Мужчина кавказской
национальности с весом приблизительно 92 кг в возрасте 72 лет, периодически сильными болями и опуханием правого колена. Приблизительно после одного года постоянно возрастающего дискомфорта он посещает
врача, который ставит клинический диагноз остеоартрита правого колена, который затем подтверждается рентгеновским обследованием.
После периода облегчающей терапии различными средствами, включающими аспирин, напросен и кетопрофен, симптомы заболевания продолжали ухудшаться и его состояние также ухудшилось. Он вновь обратился к своему лечащему врачу, который предписывает таблетки, приготовленные, как в примере 20, дважды в день до или после еды в течение 3-х месяцев. После трехмесячного лечения клинические симптомы боли и опухания, особенно при длительной ходьбе, значительно улучшились. После 3-х месячного курса с дозировкой 2 таблетки ежедневно лечение было продолжено с половиной первоначально предписанной дозировки (т.е. по одной таблетке в день) на неопределенный период.
Пример 25
Негритянка с весом приблизительно 65 кг в возрасте 55 лет пришла с жалобами на опухание и деформацию пальцевых суставов обеих рук, при этом
наблюдалась частичная потеря силы и подвижности в пальцах и руках. После визуального и рентгеновского обследования и различных клинических анализов, одобренных Американской ассоциацией ревматологов
(АРА) был поставлен диагноз ревматоидного артрита.
После безуспешного лечения противоболевой и противовоспалительной терапией ее врач предписывает таблетки, приготовленные по примеру 20 дважды в день за два часа до или после еды в течение 4 месяцев. После одного месяца лечения симптомы опухания суставов заметно снизились и подвижность пальцев увеличилась. Она продолжала лечение в течение оставшихся 4-х месяцев, после чего лечащий врач продлил лечение еще на 2 месяца.
Пример 26
Девочка испанка в возрасте 12 лет весом в 37 кг пришла к врачу с
идиопатическим юношеским ревматоидным артритом. Ее симптомы включали заметное воспаление многих суставов, осложненное температурой и болезненностью, с указанием на быстрое и патологическое нарушение
функции суставов.
Ее лечащий врач направляет девочку к ревматологу, который немедленно прописывает агрессивную терапию IV назначением раствора, приготовленного, как описано в Примере 21, в течение 3 дней по одной инъекции в день через капельницу 2 часа. После завершения IV режима врач предписывает таблетки по Примеру 20 в течение 2-х месяцев, в течение которых наступает значительное улучшение со снижением боли и улучшением двигательной способности. В последующие два месяца врач снижает дозировку до 3/4 от первоначальной пероральной дозы, предписывая по 3 таблетки на два дня, т.е. один день 2 таблетки и второй - 1 таблетка, и так попеременно. В конце этого режима дозировка вновь снижается до 1/4 первоначальной дозы и назначением капсул по Примеру 19, по 1 капсуле каждый день еще 4 месяца.
Пример 27
17-летний кавказский юноша впервые за 5 лет приходит к зубному врачу на профилактический осмотр. Визуальное исследование ротовой полости
пациента выявляет образование налетов и зубных камней на язычных поверхностях нижних резцов и на дистальной поверхности верхних коренных зубов. При обычной механической чистке не удалось удалить
налеты и камни. Врач предложил пациенту прополоскать рот 15 мл 0,1% перорального раствора 3-(3,3-дифосфонопропил)-1-гексадецилпиридина, солью динатрия, приготовленного, как описано в Примере 23, в
течение одной минуты. Налет и камни легко и безболезненно удалились механическими средствами. После этого дантист предписывает профилактическое лечение, состоящее в чистке зубов средством, содержащим
3(3,3-дифосфонопропил)-1-гексадецилпиридин, соль динатрия, приготовленным по Примеру 22. Такое профилактическое лечение состоит в ежедневной чистке зубов щеткой в течение 3 минут данным средством для
чистки зубов в течение 3-х месяцев. В конце этого периода проблемы образования налетов и камней у пациента были решены. Пациенту рекомендуется регулярно чистить зубы обычной зубной пастой и ежедневно
полоскать рот жидкостью против образования камней и налетов на зубах, которая представляет собой 0,1% раствор 3-(3,3-дифосфонопропил)-1-гексадецилпиридина, динатриевой соли.
Пример
28
60-летняя негритянка, страдающая болезненным гингивитом, впервые за 10 лет посещает дантиста. Визуальное исследование обнаруживает сильное образование налетов и камней по линии десен.
Механическое удаление оказалось очень болезненным для пациентки. Врач предложил ей прополоскать рот трижды, по одной минуте каждый раз 10 мл 0,1% раствора 3-(3,3-дифосфонопропил)-1-гексадецилпиридина,
соли динатрия. После этого налеты и камни легко были удалены без усилий механическими средствами. После этого дантист предписал лечение, состоящее в чистке зубов дважды в течение одной минуты
ежедневно средством, содержащим 2,0 вес% 3-(3,3-дифосфонопропил)-1-гексадецилпиридина, соль динатрия. Такое лечение продолжалось 6 месяцев. Посещение врача после этого подтвердило, что проблемы камней
и налетов под контролем и гингивит улучшился. Врач предписывает ежедневное полоскание рта 10 мл 0,1% раствора 3-(3,3-лифосфонопропил)-1-гексадецилпиридина, соли динатрия и ежедневную чистку зубов
пастой, содержащей 2 вес% соли динатрия 3-(3,3-лифосфонопропил)-1-гексадецилпиридина.
Пример 29
60-летняя женщина кавказской национальности весом 62 кг испытывает острую боль
в области спины. Ее врач с помощью рентгенолога ставит диагноз раздавливание позвонка L1 по причине потери костной ткани из-за остеопороза. Пациентке предписывается в течение 3 месяцев лечение,
состоящее в режиме ежедневной дозировки 700 мг таблетки, приготовленной по методике, описанной в Примере 20. Капсула с 700 мг принимается за два часа до еды или через два часа после еды. После 3-х
месяцев дозировка снизилась до 350 мг капсулы, приготовленной по Примеру 19, которая принималась через день еще три месяца. Следующие 6 месяцев врач назначает другой режим лечения, ежедневный прием
100 мг капсулы по Примеру 19. После этого пациентка больше не испытывает боли в спине. Рентгеновские снимки не выявляют никакого дополнительного раздавливания.
Пример 30
После падения у 75-летней восточной женщины весом 53 кг обнаружен перелом бедра. Она госпитализирована и поставлен диагноз остеопороз. Предписан режим лечения инъекциями кальцитонина. Эти инъекции
очень болезненны и пациентка отказывается от них. Лечащий врач переводит ее на пероральную терапию фосфонатами. Ей дважды в день в течение месяца даются таблетки по 700 мг, приготовленные по примеру
20. Затем еще два месяца она ежедневно принимает по такой таблетке, а потом еще три месяца ей назначается по 100 мг капсуле Примера 19 ежедневно. Последующее посещение врача не выявляет значительного
снижения минеральной плотности в костях рук, как определила фотонабсорбтиметрия.
Пример 31
85-летний американец, белый, весом 65 кг пожаловался врачу на сильную боль в спине.
На рентгене обнаружилась множественная недостаточность костной ткани в телах позвонков из-за остеопороза. Пациенту предписывается двухмесячный режим лечения лечения с ежедневным приемом таблетки в 700
мг и капсулы в 350 мг с разницей во времени в 8 часов, приготовленных по методике Примеров 20 и 19 соответственно. После двух месяцев такого лечения доза была снижена до капсулы только раз в день еще
на 2 месяца. После рентгеновского снимка было обнаружено дополнительное раздавливание. Еще 6 месяцев пациент принимал ежедневно капсулу по 100 мг. В конце этого периода значительного снижения
плотности костной ткани не наблюдалось.
Реферат
Изобретение относится к новым содержащим четвертичный азот соединениям фосфонатов и их фармацевтически приемлемым солям и сложным эфирам, имеющим общую структуру I. Кроме того, изобретение также относится к фармацевтическим композициям, содержащим эффективное и безопасное количество соединения настоящего изобретения и фармацевтически приемлемые носители. И, наконец, оно также относится к способам лечения или профилактики патологических состояний, характеризуемых нарушениями кальциевого и фосфатного обмена, такими, как остеопороз, ревматоидный артрит и остеоартрит у людей или других млекопитающих, и к методам лечения или профилактики зубных камней, зубных налетов и гингивита. Этот метод включает введение человеку или другому млекопитающему, нуждающемуся в таком лечении, безопасного и эффективного количества соединения или композиции настоящего изобретения. 5 с. и 5 з.п. ф-лы.

Формула

где m и n представляют собой целые числа от 0 до 10, m + n составляет от 0 до 10;
Q - ковалентная связь;
Y - N+(R8)2 или C(R1)2 и, если Y - C(R1)2, по меньшей мере один R2 должен быть N+ (R8)3;
Z - ненасыщенный или ароматический моноциклический карбоцикл или моноциклический или полициклический гетероцикл, содержащий такой гетероатом, как азот;
R представляет COOH, SO3H, PO3H2 или P(O)(OH)R4, где R4 представляет C1 - C8-алкил;
R1 представляет собой водород или отсутствует;
R2 каждый представляет собой один или несколько заместителей на Z части, независимо выбранных из группы, состоящей из водорода или N+(R8)3;
R5 выбирается из группы, состоящей из водорода или гидроксила;
R6 представляет водород;
R8 каждый независимо выбирается из группы, состоящей из замещенного или незамещенного C1 - C35-алкила, или R9SR6 или отсутствует;
R9 - замещенный или незамещенный C1 - C8-алкил,
и их фармацевтически приемлемые соли, полезные в лечении и профилактике анормального метаболизма кальция и фосфатов.
29.05.92 по п.2;
30.04.93 по пп.1, 3 - 8.

Комментарии