Способ получения диастереоизомерной пары фосфинилуксусной кислоты - RU2044740C1
Код документа: RU2044740C1
Описание
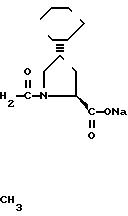
Фосиноприлнатрий, т. е. мононатриевая соль [I[S*(R)*] 2α
4β]-4- циклогексил-1-[[[2-метил-1-(1-оксопропокси)пропокси)] 4- фенилбутил)фосфинил]ацетил]-L-пролина, имеющая формулу

В патенте США N 4337201 [1] Петрилло Джр. описывает различные фосфинил-аланоил замещенные пролины, обладающие ингибирующей активностью в отношении ингиотензин-превращающего фермента, в том числе фосиноприл.
Петрилло Джр. и др. в патенте США N 4873356 [2] раскрывают способ получения фосиноприла путем взаимодействия сложного эфира фосфиновой кислоты формулы
R1
-

X






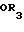
Указывается, что эту реакцию проводят в присутствии органического основания, такого как триэтиламин (является предпочтительным), пиридин, трипропиламин, диазабициклоундецен, или любых других органических оснований и органического растворителя, такого как толуол (является предпочтительным), ацетонитрил, дихлорметан, этиловый эфир, тетрагидрофуран или диоксан, и в оптимальном варианте в присутствии такого катализатора, как сульфат тетрабутиламмония и йодид натрия.
Получаемый диэфир фосфиновой кислоты затем
гидрогенизируют с образованием пары рацемических смесей, которые разделяют путем фракционной кристаллизации с целью получения одной рацемической смеси. Эту рацемическую смесь обрабатывают разделяющим
агентом, таким как I-цинхонидин, или другим оптически активным амином с целью выделения целевого промежуточного продукта





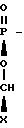





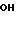
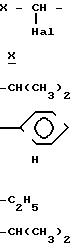
Этот промежуточный продукт, где R1 представляет собой фенилбутил; n 0, R2 водород, У этил; Х изопропил, затем соединяют с хлористоводородной солью 4-транс-циклогексил 1-пролина в присутствии связывающего агента с получением фосиноприла.
Данное изобретение имеет целью улучшение эффективности процесса
получения гипотензивного агента фосиноприла и родственных соединений. В соответствии с предлагаемым усовершенствованием, сложный эфир фосфиновой кислоты формулы
R1-

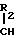

X


Этот полученный промежуточный продукт затем гидрогенизируют с целью удаления эфирной группы R3 путем обработки водородом в присутствии катализатора, такого
как палладий на угле, с получением смеси двух диастереоизомерных пар. Целевая диастереоизомерная пара содержит соединения формул (IIIА) и (IIIВ)


















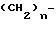
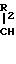

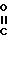


Нежелательная диастереоизомерная пара содержит соединения формул (IIIC) и (IIID):







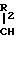











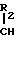




Использование в процессе 4-метилморфолина, хинуклидина, 1-метилпиролидина или цинхонидина приводит к увеличению отношения изомеров III A/B и III С/D c 1,2 в случае применения триэтиламина до примерно 1,5. Это увеличение количества получаемой целевой диастереоизомерной пары III А/В увеличивает эффективность получения конечного целевого продукта.
В формулах (I) (III):
R1 низший алкил, циклоалкил, арил, арил-низший алкил или циклоалкил-низший алкил;
n 0 или 1;
R2
водород, низший алкил или арил-низший алкил;
R3- -
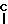



R4 низший алкил, низший алкокси, фенил, -

Х водород, низший алкил или фенил;
У водород, низший алкил, низший алкокси или фенил.
Термин "низший алкил", использованный в данной заявке в своем собственном значении или для обозначения части большей группы, относится к группам с прямой или разветвленной цепочкой, имеющим 1-7 атомов углерода, предпочтительно к группам с прямой или разветвленной цепочкой, содержащим 1-4 атома углерода, таким как метил, этил, н-пропил, изопропил, н-бутил, t-бутил и т.д.
Термин "циклоалкил", используемый в данной заявке в своем собственном значении или в виде части большей группы, относится к насыщенным кольцам, содержащим 3-7 атомов углерода, например циклопропилу, циклобутилу, циклопентилу, циклогексилу и циклогептилу.
Термин "арил", используемый в данном описании в своем собственном значении или в виде части большей группы, относится к фенилу, 1-нафтилу или 2-нафтилу и фенилу, 1-нафтилу или 2-нафтилу, имеющим один, два или три заместителя, выбираемых из низшего алкила, содержащего 1-4 атома углерода, низшего алкокси, содержащего 1-4 атома углерода, низшего алкилтио, содержащего 1-4 атома углерода, гидрокси, нитро, амино, ди-(низший алкил, содержащий 1-4 атома углерода) амино, гидрокси, СI, Вr, F или СF4. Предпочтительными арильными группами являются фенил и монозамещенный фенил.
Термины "низший алкокси" и "низший алкилтио", используемые в данной заявке, относятся к группам низших алкилов присоединенным к 0 или S.
Термины "арил-низший алкил" и "циклоалкил-низший алкил", использованные в данной заявке, относятся к арильным и циклоалкильным группам, определенным выше, которые присоединены к вышеописанной низшей алкильной группе, т.е.

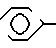





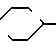

Данное изобретение относится к усовершенствованному способу получения ингибиторов ангиотензин-превращающего фермента, который раскрыт в патентах США N 4337201 и N 4384123 Петрилло Джр. В частности, это изобретение направлено на усовершенствование способа получения сложного фосфинатного эфира формулы (IIIа). Этот эфир, в котором R1представляет собой


В соответствии с предлагаемым усовершенствованным способом, сложный эфир фосфиновой кислоты формулы (1), в частности тот, где R3представляет собой бензил, подвергают взаимодействию с галогензамещенным сложным эфиром формулы (II) в органическом растворителе в присутствии 4-метилморфолина, диазабициклооктана, хинуклидина, 1-метилпиролидина или цинхонидина, а затем гидрогенизируют с целью удаления эфирной группы R3и получения смеси соединений формул (IIIA), (IIIВ), (IIIС) и (IIID), в которой соотношение диастереизомерных пар III А/В и III С/D cоставляет примерно 1,5.
Сложный эфир фосфиновой кислоты формулы (1) и галогензамещенный сложный эфир формулы (II), используют в молярном соотношении примерно 0,1:1 1:1, предпочтительно 0,2: 1 0,3:1, а реакцию проводят при температуре 40-138оС, предпочтительно около 95оС, в течение 18-96 ч.
После удаления защитной группы посредством гидрогенолиза рацемическую смесь соединений формул (IIIА) и
(IIIВ) затем обрабатывают разделяющим агентом, таким как L-цинхонидин, который является предпочтительным, или другим традиционным разделяющим агентом, например оптически активным амином, в присутствии
органического растворителя, такого как этилоацетат, этиловый спирт или тетрагидрофуран. Эту стадию осуществляют при температуре 25-80оС в течение 2-12 ч, при этом разделяющий агент и
рацемическая смесь используются в молярном соотношении 2: 1 0,2:1; предпочтительно 1:1 0,5:1. Полученная разделенная соль имеет следующую структуру







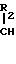




Обработка сильной кислотой, такой как соляная или серная, или кислой солью, например кислым сульфатом калия, позволяет отделить соединение формулы (IIIА) от соединения формулы (IIIВ).
Отделенную кислоту формулы (IIIА), где R1 представляет собой




Реакцию связывания соединений формул (IIIА) и (V) проводят, используя указанные соединения в молярном соотношении примерно 0,5 1 2 1 при температуре приблизительно (-20) -30оС в течение 2-12 ч.
Примеры сложных эфиров фосфиновых кислот, являющихся исходными материалами формулы (1) по предлагаемому способу, включают, но не
ограничиваются следующими соединениями:



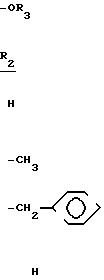





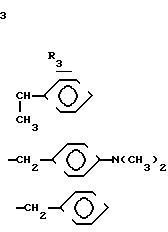
Перечень примеров галогензамещенных сложных эфиров, являющихся исходными материалами формулы (II) по предлагаемому способу, включает, но не ограничивается следующими соединениями:


Следующий пример иллюстрирует изобретение.
Мононатриевая соль [I[S(R*)] 2 α, 4 β ]-4-циклогексил-1-[[[2-метил-1-(1-оксопропок- си)пропокси](4 -фенилбутил)фосфинил)]-ацетил]-1-пролина.
а) [[2-метил-1-(1-оксопропокси)пропокси](4-фенилбутил)]фосфинил]
уксусная кислота (диастереоизомерная пара)
Фенилметиловый сложный эфир [гидрокси(4-фенилбутил)фосфинил] уксусной кислоты (100 г, 0,29 моль), 4-метилморфолин (59,3 г, 0,58 моль) и толуол (150
мл) поместили в колбу объемом 500 мл с круглым дном и тремя горлышками, снабженную мешалкой, конденсатором и нагревательной сеткой. Смесь перемешивали в течение 15 мин с тем, чтобы обеспечить
растворение.
Добавили эфир пропаноиновой кислоты и 1-хлоро-2-метилпропила (104,6 г, 0,58 моль) и смесь нагрели до 95оС. Реакцию осуществляли при перемешивании при указанной температуре до тех пор, пока с помощью высокоэффективной жидкостной хроматографии не было установлено завершение алкилирования (18-19 ч).
Раствор охладили до температуры 25о С, отфильтровали в вакууме через фильтровальную воронку из оплавленного стекла (средней пористости, 250 мл) и осадок из гидрохлорида 4-метил-морфолина промыли толуолом (100 мл, 25оС).
Фильтрат и промывочный раствор соединили и поместили в колбу объемом 500 мл с круглым дном и тремя горлышками, снабженную газодисперсионной трубой, механической мешалкой, конденсатором, трубкой для выпуска газа и находящуюся в водяной бане при температуре 45оС. Смесь перемешивали при скорости 625 оборотов/мин, и в течение 15 мин через раствор продували азот.
К раствору добавили палладий на угольном носителе (5% 2,5 г в сухом виде или 5,0 г при 50% -ной влажности) и барботировали через него водород под давлением 1 фунт/кв дюйм. Гидрогенолиз, как показала высокоэффективная жидкостная хроматография, завершился через 3 ч. Через раствор продули азот для удаления избыточного водорода. Раствор отфильтровали через Нуflo (воронка Брюхнера 7 см, 4 г) и осадок промыли толуолом (25 мл).
Промывочный раствор и фильтрат соединили и экстрагировали одной порцией водного 5% -ного раствора бикарбоната натрия (20 г бикарбоната натрия в 380 мл воды). Водный экстракт подкислили до рН 3,0 с помощью концентрированной хлористоводородной кислоты (33 мл) и экстрагировали метилизобутилкетоном (400 мл, одно экстрагирование). Объем раствора метилизобутилкетона уменьшили до 200 мл (40оС максимум), после чего внесли целевую диастереоизомерную пару при температуре 30оС. Суспензию перемешивали в течение 2 ч при температуре 30оС, а затем постепенно охладили до температуры 0оС в течение 1 ч. После этого суспензию охладили до -10оС. Суспензию выдержали при температуре -10оС в течение 2 ч, продукт собрали с помощью вакуумной фильтрации и промыли холодным (-10оС) метилизобутилкетоном (три порции по 30 мл).
Повторную кристаллизацию осуществляли путем растворения продукта в метилизобутилкетоне (75 мл) при температуре 70-80оС. Раствор в горячем виде отфильтровали и внесли в него чистый продукт при температуре 50оС. Затем его охладили до температуры 0оС в течение 2 ч. Раствор выдержали при этой температуре в течение 3 ч. Кристаллы отделяли посредством вакуумной фильтрации, промыли холодным (ОоС) метилизобутилкетоном (две порции по 30 мл) и высушили на воздухе в течение 15 мин. После сушки под вакуумом в течение 16 ч при температуре 26оС общий выход твердой [[2-метил-1-(1-оксопропокси)-пропокси] (4-фенилбутил)фосфинил] уксусной кислоты составил 49 г (примерно 44% исходя из средней величины для трех экспериментов).
Анатилитческий расчет
для С19Н29О6Р:
С 59,36; Н 7,60; Р 8,06
Обнаружено: С 59,60; Н 7,86; Р 8,07.
б) [R-(R, *S*)] [[2-метил-1-(1-оксипропокси)пропокси] -(4- фенибутил)фосфинил]уксусная кислота.
К интенсивно перемешиваемой суспензии l-цинхонидина (980 г, 3,33 моль) в 6 л этилацетата при температуре 45оС постепенно добавили диастереоизомерный продукт из части а (1275,5 г, 3,33 моль) и продолжали перемешивание еще в течение 2,5 ч при постоянном нагревании полученной суспензии соли до температуры 70оС, когда было достигнуто полное растворение.
После фильтрации (Нyflo) через небольшое количество нерастворимого материала в раствор была внесена затравка, и он был охлажден. Отделившийся кристаллический продукт затем отфильтровали, промыли смесью этилацетата и изопропилового эфира (1200 мл в соотношении 1:1) и высушили в вакууме, получив 1897,2 г соли цинхонидина, внедренной в целевой изомер; температура плавления 106-109оС; [α]D -59,3о (С= 1, метанол); [a]365 -237,6о (С 1, метанол). Этот материал соединили с аналогичным образом приготовленным материалом (136,8 г) и весь продукт общим весом 2014 г подвергли рекристаллизации из 10,18 л кипящего этилацетата, получив после фильтрации, промывания смесью растворителей, использовавшейся ранее, и высушивания в вакууме 1162 г цинхонидиновой соли целевого изомера; температура плавления 120-122оС (ден), [a] -45,2о (С=1, метанол); [α365-185,5о (С 1, метанол). Образец (10 г) рекристаллизовали дважды из ацетонитрила и три раза из этилацетата, в результате по- лучили аналитический образец цинхонидиновой соли [R-(R, *S*)]-[[2-метил-1-(1-оксопропокси)-пропокси] (4-фенилбутил)фосфинил] уксусной кислоты, (1:1); температура плавления 125-126оС (ден); [α]D -42,2о (С1, метанол); [α]365 -178,8о (С 1, метанол).
Аналитический расчет для С19Н29О6 С19Н22N2O:
С
67,23; Н 7,57; N 4,13
Обнаружено: С 67,17; Н 7,62; N 4,14.
К перемешиваемому раствору этой цинхонидиновой соли (406,8 г, 0,6 моль) в смеси с этилацетатом (4800 мл) и водой (2700 мл) по каплям добавили раствор кислого сульфата калия (180 г) в воде (700 мл) при рН 2,3. Органический слой отделили, промыли соляным раствором (1 х 1000 мл) и высушили над сульфатом магния (в течение 2 ч). Объединенные водные фазы повторно экстрагироовали этилацетатом (3 х 1500 мл) и обрабатывали, как указано выше. Объединенные порции промывочного этилацетата отфильтровали и сконцентрировали в вакууме. Остаток азеотропировали толуолом (3 х 1300 мл) и затем высушивали в вакууме в течение трех дней. В результате получили 230,4 г [R-(R,*S*)] [[2-метил-1-(1-оксопропокси)пропокси](4-фенилбутил)-фосфинил]уксусную кислоту.
в) Мононатриевая соль [I(S*(R*)] 2 α, 4 β -4-циклогексил-1- [[[2-метил-1-(1-оксопропокси)пропокси](4-фенилбутил)фосфи- нил]ацетил] -R-пролина.
Суспензию свободной кислоты из части б) (230,4 г, 0,6 моль) и гидрата гидроксибензотриазола, высушенной в вакууме при температуре 80оС в течение 24 ч (101,1 г 0,66 моль), в дихлорметане производства фирмы "Bordick α Jacksoh" (высушенной просеиванием) (6 л) охладили в ванне из льда и ацетона и обработали N,N'-дициклогексилкарбодиимидом (136 г, 0,66 моль). Смесь подогрели до комнатной температуры и перемешивали в течение 3 ч. Затем смесь охладили в ванне из льда и ацетона и обработали моногидрохлоридной солью (транс)-4-циклокексил-L-пролина (154,2 г, 0,66 моль) и вслед за этим диизопропилэтиламином (170,7 г, 1,32 моль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Затем смесь охладили, обработали водой (1 л) и сконцентрировали в вакууме для удаления дихлорметана. Остаток разбавили эфиром (3600 мл) и водой (3600 мл) и отфильтровали. Фильтрат подкислили до рН 1,8 с помощью 10%-ной хлористоводородной кислоты. Эфирный слой отделили, а водный слой промыли этилацетатом (3 х 2 л). Объединенные органические слои промыли 5%-ным КНSO4 (3 х 1 л), водой (3 х x1 л) и соляным раствором (1 л), высушили над сульфатом магния и сконцентрировали в вакууме, получив 398,9 г сырого продукта.
Сырой продукт растворили в ацетоне (4393 мл), обработали раствором натриевой соли 2-этилгексаноиновой кислоты (117,3 г) в ацетоне (1468 мл), затем перемешивали при комнатной температуре в течение ночи. Полученный осадок собрали посредством фильтрации, промыли ацетоном (3 х 400 мл) и гексаном (1 л), а затем высушили в вакууме, получив 277 г мононатриевой соли [1[S*,(R*)] 2 α, 4β -4-циклогексил-1-[[[2-метил-1-(1-оксопропокси)пропокси]-(4-фенил- бутил)фосфинил] ацетил] -L-пролина; температура плавления 195-196оС; [α]D= -5,1о (С2, метанол).
Аналитический расчет для С30Н45NO7P ˙Na
C 61,53; Н 7,75; N 2,39; Р 5,29.
Обнаружено: С 61,69; Н 7,89; N 2,34; Р 5,1.
Реферат
Использование: в качестве полупродукта для получения гипотензивного средства. Сущность изобретения: продукт [R-(R*,S*)] - [[2-метил-1(1-оксопропокси)пропокси] (4-фенилбутил)-фосфинил] уксусная кислота. Б.Ф. C19H29O6P выход 44% Реагент 1: Реагент 2: Условия реакции: в среде инертного органического растворителя при 40-138 °С в присутствии органического основания -4-метилморфолина с последующей гидрогенизацией образующегося продукта в виде смеси четырех изомеров, отделением целевой диастереоизомерной пары путем экстрагирования метилизобутилкетоном и фракционной кристаллизацией. 1 з.п. ф-лы. Реагент 1 C6H5-(CH2)4-P(O)(OH)-CH2C(O)OCH2C6H5 Реагент 2 (CH3)2CH-CH(Cl)-OC(O)C2H5
Формула
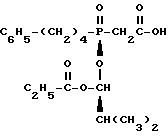
взаимодействием бензилового эфира фосфинилуксусной кислоты формулы

с хлорсодержащим эфиром пропионовой кислоты формулы
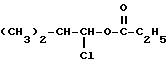
в среде инертного органического растворителя при нагревании в присутствии органического основания гидрогенизацией образующегося продукта в виде смеси четырех изомеров с последующим отделением целевой диастереоизомерной пары путем экстрагирования метилизобутилкетоном и фракционной кристаллизацией, отличающийся тем, что в качестве органического основания используют 4-метилморфолин и нагревание ведут до 40-138oС.

Комментарии