Новые фосфиновые кислоты и их серосодержащие производные и способы их получения - RU2451021C2
Код документа: RU2451021C2
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в целом относится области органической химии. Более конкретно, настоящее изобретение предлагает новые фосфиновые кислоты и их серосодержащие производные, а также способы их получения. Такие новые соединения находят применение в качестве экстрагентов для металлов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящее изобретение предлагает соединения, определенные формулой (I):
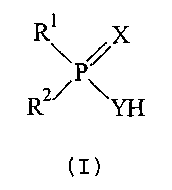
где:
R1 и R2 являются разными и каждый из R1 и R2 независимо друг от друга выбирают из:
(а) -CH2-CHR3R4, где R3 представляет собой метил или этил; и R4 представляет собой необязательно замещенный алкил или гетероалкил; и
(b) -CR3(CH2R5)R6, где
R3 представляет собой метил или этил; и
R5 представляет собой Н или необязательно замещенный алкил или гетероалкил, и R6 представляет собой необязательно замещенный алкил или гетероалкил; или
R5, R6 и этиленовая группа, с которой они связаны, образуют пяти- или шестичленное, необязательно замещенное, циклоалкильное или гетероциклоалкильное кольцо;
и каждый из Х и Y независимо друг от друга представляет собой О или S.
Таким образом, в вариантах осуществления настоящее изобретение предлагает следующие соединения формулы (I):
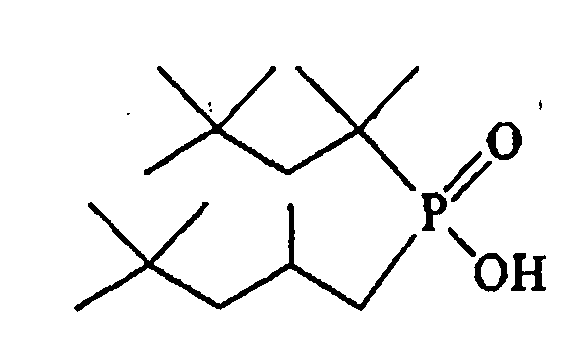
(а) (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновая кислота;
(b) (1,1,3,3-тетраметилбутил)-(2-этилгексил)фосфиновая кислота;
(с) (2,4,4-триметилпентил)-(2-этилгексил)фосфиновая кислота;
(d) (2,4,4-триметилпентил)-(1-метил-1-этилпентил)фосфиновая кислота; и
(е) (1-метил-1-этилпентил)-(2-этилгексил)фосфиновая кислота;
и их моно- и дитиопроизводные, а также их соли.
Как описано в изобретении, соединения формулы (I) могут быть получены, например, за счет введения вторичного фосфина формулы (II):
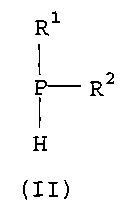
в реакцию (i) с окислителем с получением соответствующей фосфиновой кислоты; (ii) с серой с получением соответствующей дитиофосфиновой кислоты; и (iii) с ограниченным количеством окислителя с получением соответствующего фосфиноксида, который затем вводят в реакцию с серой с получением соответствующей монотиофосфиновой кислоты.
В другом аспекте, настоящее изобретение предлагает способ получения вторичного фосфина формулы (II), где R1 и R2 принимают описанные выше значения, а R2 представляет собой -CH2CHR3R4, где способ включает введение первичного фосфина формулы R1PH2 в реакцию с олефином формулы СН2=CHR3R4 в условиях свободнорадикальной реакции.
По другому аспекту настоящее изобретение предлагает способ получения вторичного фосфина формулы (II), где R1 и R2 принимают определенные выше значения, а R2 представляет собой -CR3(CH2R5)R6, где способ включает введение первичного фосфина формулы R1PH2 в реакцию с олефином формулы HR5C=CR3R6 в присутствии кислотного катализатора.
Некоторые вторичные фосфиновые соединения формулы (II) являются новыми соединениями. Следовательно, в вариантах осуществления настоящее изобретение предлагает следующие вторичные фосфиновые соединения:
(а) (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфин;
(b) (1,1,3,3-тетраметилбутил)-(2-этилгексил)фосфин;
(с) (2,4,4-триметилпентил)-(2-этилгексил)фосфин;
(d) (2,4,4-триметилпентил)-(1-метил-1-этилпентил)фосфин; и
(е) (1-метил-1-этилпентил)-(2-этилгексил)фосфин.
По другому аспекту настоящее изобретение предлагает применение соединения формулы (I) или его соли в качестве экстрагента для металлов.
По другому аспекту настоящее изобретение предлагает способ экстракции металла из металлсодержащего раствора, который включает введение в контакт указанного раствора с соединением формулы (I), обеспечение возможности для образования соединением формулы (I) комплекса с металлом и извлечение комплекса. В вариантах осуществления соединение формулы (I), в котором Х и Y оба представляют собой О, или его соль, могут быть использованы, чтобы селективно экстрагировать кобальт (II) из водного раствора, содержащего кобальт (II) и никель (II).
ПОДРОБНОЕ ОПИСАНИЕ
Значения R1 и R2 выбирают так, чтобы получать соединения формулы (I), которые имеют низкие температуры плавления. Для многих вариантов применения соединения формулы (I) используют в их жидком состоянии. Соответственно, соединения формулы (I), которые являются жидкими при комнатной температуре (например, в пределах температурного интервала приблизительно от 15 до 25°С, более конкретно при температуре приблизительно 15°C, приблизительно 20°C и приблизительно 25°C), как правило, приемлемы для вариантов применения, которые реализуются при комнатной температуре или при температуре, близкой к комнатной температуре, тогда как соединения формулы (I), которые плавятся при низкой температуре (например, при температурах менее чем приблизительно 30°С, приблизительно 40°С, приблизительно 50°С, приблизительно 60°С, приблизительно 80°С, приблизительно 100°С, приблизительно 150°С), как правило, приемлемы для вариантов применения, которые реализуются при немного повышенных температурах (то есть выше температуры плавления соединения формулы (I)). Следовательно, значения для заместителей R1 и R2 выбирают так, чтобы R1 и R2 были разными, так как получаемая в результате асимметрия имеет тенденцию повышать температуру плавления соединения.
Разветвление представляет собой еще один фактор, определяющий температуру плавления. Конкретно, температура плавления имеет тенденцию падать по мере повышения степени разветвления заместителей R1 и R2. По определению, каждый заместитель R1 и R2 независимо друг от друга разветвлен у альфа- или бета-атома углерода, но дополнительное разветвление может иметь место у альфа- или омега-атома углерода или в любой промежуточной точке. Разветвление у альфа-атома углерода и/или бета-атома углерода может улучшить способность органической фосфиновой кислоты селективно связывать кобальт в сравнении с никелем и/или кальцием за счет повышения стерической затрудненности вокруг центрального атома фосфора, следовательно, делая благоприятным координирование фосфиновой кислоты с кобальтом (II).
Присутствие одного или нескольких хиральных центров в заместителях R1 и R2 имеет тенденцию понижать температуру плавления за счет возникновения смеси стереоизомеров.
Температура плавления имеет тенденцию расти по мере увеличения числа атомов углерода в соединении, поэтому R1 и R2 обычно выбирают так, чтобы соединение формулы (I) содержало не более 20 атомов углерода. Однако для некоторых целей (таких как экстракция металла из водных растворов) желательны соединения формулы (I), которые являются гидрофобными или «несмешиваемыми с водой». Определение «несмешиваемые с водой», как подразумевают, описывает соединения, которые образуют двухфазную систему при смешении с водой, но не исключают ни соединения, которые растворяются в воде, ни соединения, которые растворяют воду, при условии, что образуется двухфазная система. Для этих целей могут быть использованы соединения формулы (I), которые суммарно содержат приблизительно 12 атомов углерода или больше.
Для многих вариантов применения (таких, как экстракция металлов) заместители R1 и R2 выбирают так, чтобы получить соединения, которые смешиваются (предпочтительно во всех пропорциях) с органическим растворителем, используемым в конкретном варианте применения. Смешиваемость соединений формулы (I) в конкретном органическом растворителе может быть легко определена (например, на глаз) без проведения интенсивных исследований.
Заместители R1 и R2 могут содержать гетероатомы (например, углеродная цепочка может прерываться одним или несколькими атомами, выбранными из числа N, O и S) или содержать дополнительные заместители (такие, как гидроксильная группа, атом галогена, алкокси-, алкилтио-, карбокси- и ацетильная группы) при условии, что заместители или гетероатомы не вмешиваются в получение или применимость соединений изобретения, что может быть легко определено с помощью рутинных экспериментов, не требующих высокой квалификации. Однако присутствие гетероатомов и дополнительных заместителей, вероятно, повышает затраты. Следовательно, для многих целей заместители R1 и R2 не содержат гетероатомов или не несут дополнительных заместителей.
Таким образом, для многих целей каждый из заместителей R1 и R2 независимо друг от друга представляет собой алкильную группу или циклоалкильную группу, которые состоят только из атомов водорода и атомов углерода, такие как: С5-С16-алкильная группа, то есть алкильная группа, которая имеет суммарно от 6 до 16 атомов углерода (то есть 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 атомов углерода) и часто от 6 до 10 атомов углерода; или С5-С16-циклоалкильная группа, например пяти- или шестичленное кольцо, замещенное, по меньшей мере, одной алкильной группой (то есть R3 и необязательно одной или несколькими дополнительными алкильными группами), так что указанная циклоалкильная группа имеет суммарно от 6 до 16 атомов углерода (то есть 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16) и часто от 6 до 10 атомов углерода. В данном случае определение «алкил» включает линейные и разветвленные алкильные радикалы.
Заместители R3, R4, R5 и R6 выбраны так, чтобы обеспечить желаемые значения для заместителей R1 и R2. Например, когда R1 представляет собой С5-16-алкил формулы -CR3(CH2R5)R6 и R3 и R5 оба представляют собой метил, то R6 представляет собой С1-12-алкил. Заместители R4, R5 и R6 могут быть разветвленными.
Таким образом, подходящими значениями для заместителей R1 и R2 являются: 2,4,4-триметилпентил; 1,1,3,3-тетраметилбутил; 2-этилгексил и 1-метил-1-этилпентил.
(I) СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ФОРМУЛЫ (I):
Соединения формулы (I) могут быть получены с использованием известных химических реакций. Например, вторичные фосфины формулы (II):
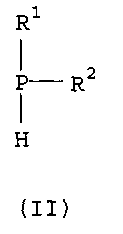
где R1 и R2 имеют определенные выше значения, могут быть получены путем присоединения первичного фосфина к олефину или посредством катализируемого кислотой присоединения, или в условиях свободнорадикальной реакции. Затем вторичный фосфин может быть введен в реакцию: (i) с окислителем с получением фосфиновой кислоты; (ii) с серой с получением дитиофосфиновой кислоты или (iii) с ограниченным количеством окислителя с получением фосфиноксида, который затем может быть введен в реакцию с серой с получением монотиофосфиновой кислоты.
Условия свободнорадикальной реакции могут быть полезны для получения вторичного фосфина, который имеет группу R, замещенную у бета-атома углерода, так как условия свободнорадикальной реакции предпочтительнее присоединения фосфина к первичному атому углерода, такому как концевой атом углерода 1-алкена.
Кислотный катализатор может быть использован для получения вторичного фосфина, который имеет группу R, замещенную у альфа-атома углерода, так как кислотный катализатор способствует присоединению фосфина к третичному атому углерода.
(А) ПОЛУЧЕНИЕ ВТОРИЧНЫХ ФОСФИНОВ В УСЛОВИЯХ СВОБОДНОРАДИКАЛЬНОЙ РЕАКЦИИ
Способы присоединения фосфинов к олефинам в условиях свободнорадикальной реакции известны. Например, в патенте США № 4374780 описан способ получения бис(2,4,4-триметилпентил)фосфиновой кислоты путем свободнорадикального присоединения двух молей 2,4,4-триметилпентена-1 к фосфину, после чего следует окисление пероксидом водорода.
То есть способ получения вторичного фосфина формулы (II):

где R1 и R2 имеют определенные выше значения и R2 представляет собой -СН2-CHR3R4, включает, например, введение первичного фосфина формулы R1PH2 в реакцию с олефином формулы СН2=CR3R4 в условиях свободнорадикальной реакции.
Свободнорадикальные инициаторы известны в данной области и специалист может выбрать подходящий свободнорадикальный инициатор для использования в описанной выше реакции. Можно упомянуть азобисинициаторы свободнорадикальной реакции, такие как азобисизобутилнитрил.
Реакция присоединения фосфина не имеет особенных температурных ограничений и будет протекать в широком интервале температур. Следовательно, температурный интервал для проведения реакции, как правило, выбирают на основании периода полураспада используемого инициатора. Например, в случае азобисизобутилнитрила реакция может быть проведена при температурах, находящихся в интервале приблизительно от 40 до 110°С, предпочтительно приблизительно от 60 до 90°С.
Для снижения образования нежелательных третичных фосфинов реакцию следует проводить с молярным избытком первичного фосфина.
Например, (2,4,4-триметилпентил)(2-этилгексил)фосфин может быть получены путем присоединения:
(а) (2,4,4-триметилпентил)фосфина к 2-этилгекс-1-ену или
(b) 2-этилгексилфосфина к (2,4,4-триметил)пентену-1
в условиях свободнорадикальной реакции, как описано выше.
(В) ПОЛУЧЕНИЕ ВТОРИЧНЫХ ФОСФИНОВ ПУТЕМ КАТАЛИЗИРУЕМОГО КИСЛОТОЙ ПРИСОЕДИНЕНИЯ
Способы присоединения фосфинов к олефинам за счет катализируемого кислотой присоединения известны (см., например, патент США № 2584112). Например, в патенте США № 5925784 описан способ получения бис(1,1,3,3-тетраметилбутил)фосфиновой кислоты путем катализируемого кислотой присоединения фосфина к диизобутилену, после чего следует окисление пероксидом водорода.
Таким образом, способ получения вторичного фосфина формулы (II):

где R1 и R2 имеют определенные выше значения и R2 представляет собой -CR3(CH2R5)R6, включает, например, введение первичного фосфина формулы R1PH2 в реакцию с олефином формулы HR5C=CR3R6 в присутствии кислого катализатора.
Стадию катализируемого кислотой присоединения можно проводить в присутствии протонируемого органического растворителя (то есть органического растворителя, который содержит гидроксигруппу (ОН)), такого как гликоль или простой эфир гликоля. Примерами подходящих для этих целей гликолей или эфиров гликолей являются: этиленгликоль, глицерин и глим.
Кислый катализатор может представлять собой любую сильную неокисляющую кислоту. Алкилсульфоновые кислоты (в том числе, но без ограничения ими, метансульфоновая кислота и толуолсульфоновая кислота) предпочтительны вследствие их доступности, низкой стоимости и совместимости с большинством нержавеющих сталей (которые обычно используют для изготовления промышленных реакторов). Однако другие сильные неокисляющие кислоты, такие как HCl и Н3РО4, могут быть использованы в способе изобретения, хотя HCl будет требовать проведения реакции в реакторе, устойчивом к галогенам. Мольное отношение кислотного катализатора к первичному фосфину составляет приблизительно от 1:1 до 5:1, предпочтительно приблизительно 1,5:1,0. Мольный избыток кислотного катализатора может улучшить выход, но увеличивает стоимость процесса.
В общем случае, стадия катализируемого кислотой присоединения может быть проведена путем добавления кислотного катализатора в реактор, содержащий первичный фосфин и олефин в инертной атмосфере (например, в атмосфере азота) при атмосферном давлении и при повышенной температуре (например, приблизительно от 50 до 160°С, предпочтительно от 75 до 125°С) и проведения реакции в течение приблизительно от 2 до 88 часов (предпочтительно приблизительно от 8 до 20 часов). Повышенные температуры могут улучшить выход и уменьшить время реакции. Продукты реакции могут быть проанализированы с использованием стандартных способов, например с помощью газовой хроматографии (ГХ) или спектроскопии ядерного магнитного резонанса (ЯМР).
Присутствие избытка олефина может повысить выход на стадии присоединения фосфина, но может привести к образованию димеров или тримеров олефина. Алкилфосфин может присутствовать в избытке, но избыток алкилфосфина, как правило, будут удалять до проведения окисления. Следовательно, в большинстве случаев в реакции будет присутствовать олефин и первичный фосфин в мольном отношении в интервале приблизительно от 0,5:1 до 3:1, предпочтительно приблизительно 1,5:1,0.
По окончании стадии катализируемого кислотой присоединения реакционную смесь можно обработать (например, промывкой водным основанием, выделением органической фазы и удалением любых непрореагировавших исходных материалов и растворителя в вакууме при повышенной температуре (например, приблизительно при 80°С)) с получением сырого вторичного фосфина, который может быть использован непосредственно на стадии окисления без дополнительной очистки.
Олефин может представлять собой один вид или смесь двух родственных олефиновых видов, каждый из которых имеет третичный атом углерода, связанный двойной связью с соседним атомом углерода. Например, диизобутилен обычно коммерчески доступен в виде смеси (2,4,4-триметил)пентена-1 и (2,4,4-триметил)пентена-2. В присутствии кислотного катализатора первичный фосфин может быть присоединен к обоим видам олефина у их бета-атома углерода, который является третичным.
Например:
(а) (2,4,4-триметилпентил)-(1,1,3,3-тетраметил)фосфин может быть получен путем введения (2,4,4-триметилпентил)фосфина в реакцию с диизобутиленом в присутствии кислотного катализатора;
(b) (1,1,3,3-тетраметилбутил)-(2-этилгексил)фосфин может быть получен путем введения 2-этилгексилфосфина в реакцию с диизобутиленом в присутствии кислотного катализатора;
(c) (2,4,4-триметилпентил)-(1-метил-1-этилпентил)фосфин может быть получен путем введения (2,4,4-триметилпентил)фосфина в реакцию с 2-этилгексеном-1 в присутствии кислотного катализатора; и
(d) (1-метил-1-этилпентил)-(2-этилгексил)фосфин может быть получен путем введения 2-этилгексилфосфина в реакцию с 2-этилгексеном-1 в присутствии кислотного катализатора.
(С) ОКИСЛЕНИЕ ВТОРИЧНОГО ФОСФИНА
Вторичные фосфины, описанные выше, могут быть окислены с получением соответствующих фосфиновых кислот.
На молекулярном уровне окисление вторичного фосфина протекает в две стадии. Вначале вторичный фосфин окисляется до фосфиноксида, который затем окисляется с образованием фосфиновой кислоты. На практике полное окисление вторичного фосфина может быть проведено в одной реакции. Вторичный фосфин может быть окислен, например, за счет введения его в реакцию с окислителем (предпочтительно с пероксидом водорода) в присутствии кислотного катализатора (например, серной кислоты) и воды при атмосферном давлении и при повышенной температуре (например, приблизительно от 50 до 110°С, предпочтительно приблизительно от 80 до 100°С) в течение приблизительно от 4 до 16 часов или до окончания реакции. Более низкие температуры замедляют реакцию, приводя к более продолжительному времени реакции. Однако более высокие температуры имеют тенденцию удалять одну алкильную группу, что приводит к образованию некоторого количества побочного продукта моноалкилфосфиновой кислоты. Ход реакции можно контролировать, например, с помощью спектроскопии31Р ЯМР.
Подходящим окислителем является пероксид водорода, который представляет собой недорогой и удобный окислитель. Стереохимия реакции окисления диктует, чтобы в этой реакции два эквивалента пероксида водорода реагировали с одним эквивалентом фосфина. Однако присутствие избытка пероксида водорода может повышать выход (то есть сдвигает реакцию окисления к окончанию) при небольшой дополнительной стоимости. Поэтому во многих случаях пероксид водорода будет присутствовать в избытке к вторичному фосфину, например, отношение эквивалентов находится в интервале приблизительно от 2:1 до 4:1, предпочтительно равно приблизительно 3:1.
По окончании реакции реакционная смесь может быть обработана (например, промывкой водным основанием (например, гидроксидом натрия), затем водной кислотой (например, серной кислотой), затем сушкой в вакууме при повышенной температуре (например, приблизительно при 80°С), что дает жидкий продукт, который содержит целевую фосфиновую кислоту.
Описанный выше способ, как правило, дает жидкий конечный продукт, который содержит целевую фосфиновую кислоту, а также некоторое количество побочных продуктов. Когда процесс проводят при соответствующих условиях, целевая фосфиновая кислота может быть основным компонентом (например, 80-95% масс. или более) конечного жидкого продукта.
Жидкий конечный продукт предписанного способа может быть использован в процессах экстракции металла без дополнительной очистки, так как большинство побочных продуктов, как ожидается, не мешает процессу экстракции. Однако стадия окисления может привести к получению побочных продуктов фосфиновой кислоты (то есть R1PO(OH)2 и R2PO(OH)2), которые могут, например, уменьшать селективность конечного продукта для кобальта в сравнении с кальцием и никелем. Если желательно, то условия реакции (особенно температура, как отмечалось выше) могут быть выбраны так, чтобы минимизировать получение побочных продуктов фосфиновой кислоты. Если желательно, то конечный жидкий продукт может быть промыт с помощью одной или нескольких водно-щелочных промывок для уменьшения количества монофосфиновых кислот до приемлемого уровня, например приблизительно до 1% или менее.
(D) РЕАКЦИЯ ВТОРИЧНЫХ ФОСФИНОВ ИЛИ ФОСФИНОКСИДОВ С СЕРОЙ
Вторичные фосфины, описанные выше, также могут быть использованы для получения соответствующих монотиофосфиновых кислот и дитиофосфиновых кислот.
Дитиофосфиновые кислоты могут быть получены, например, путем введения вторичного фосфина в реакцию с серой в соответствии с известными способами (например, которые описаны в патенте США № 5925784 или в патенте GB902802). Только что описанные вторичные фосфины могут быть введены в реакцию с серой, водой и основным реагентом, таким как гидроксид аммония, с получением соли соответствующей вторичной дитиофосфиновой кислоты, такой как ее аммонийная соль. Реакции этого типа обычно проводят при температурах в интервале приблизительно от 0 до 100°С, предпочтительно приблизительно от 15 до 75°С. Полученная таким образом соль может реагировать с кислотой, такой как HCl, разбавленная серная кислота или метансульфоновая кислота, с получением вторичной дитиофосфиновой кислоты. Эти реакции, как правило, протекают при температурах в интервале приблизительно от -30 до 75°С, предпочтительно приблизительно от 10 до 50°С.
Монотиофосфиновые кислоты могут быть получены, например:
(i) введением вторичного фосфина в реакцию с ограниченным количеством окислителя с получением вторичного фосфиноксида; и
(ii) введение вторичного фосфиноксида в реакцию с серой с получением монотиофосфиновой кислоты.
Подходящий способ получения монотиофосфиновых кислот описан, например, в патенте США № 4555368. Если говорить кратко, то вторичный фосфин может быть окислен с образованием соответствующих органических дифосфиноксидов без образования значительных количеств соответствующей органической дифосфиновой кислоты. Для достижения такого результата реакция окисления может быть проведена при постепенном или нарастающем добавлении окислителя при скорости, которая обеспечивает контролируемую температуру приблизительно от 40 до 60°С и предпочтительно приблизительно от 50 до 55°С. Количество окислителя должно быть достаточным, чтобы окислить по существу весь вторичный фосфин, и обычно используется эквимольное количество окислителя. Время добавления может меняться в зависимости от исходных количеств используемого вторичного фосфина. Как правило, окисление в условиях контролируемой температуры может быть достигнуто с помощью постепенного или наращиваемого добавления окислителя в течение периода приблизительно от 1 до 3 часов.
Выбор конкретного окислителя не имеет решающего значения, пока он эффективно окисляет вторичный фосфин до вторичного фосфиноксида. Пероксид водорода является предпочтительным окислителем для применения в рассматриваемом случае, так как он недорог, относительно доступен, а при его использовании температура и скорость реакции окисления легко контролируются.
После превращения по существу всего вторичного фосфина в соответствующий вторичный фосфиноксид, полученный вторичный фосфин может быть нагрет до повышенной температуры приблизительно от 60 до 90°С и предпочтительно приблизительно от 65 до 75°С и может быть добавлен избыток серы и избыток гидроксидного соединения, чтобы превратить вторичный фосфиноксид в соответствующий монотиофосфинат. Реакцию сульфурирования в присутствии основания можно проводить при температурах приблизительно от 60 до 90°С, и реакции дают проходить по существу до окончания. Как правило, реакция может быть завершена в течение приблизительно от 1 до 5 часов при температурах от 60 до 90°С.
Полученная монотиофосфиновая кислота может подвергаться таутомеризации, протекающей между следующими таутомерами:
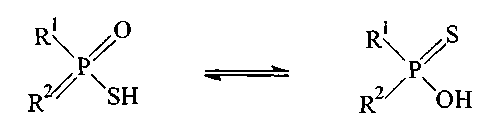
(II) ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ФОРМУЛЫ I
В данной области техники известно, что органические фосфиновые кислоты могут быть использованы для экстракции металлов, в особенности экстракции кобальта (II) (см., например, патенты США № 4373780, 4353883, 4348367 и 5925784). Органические фосфиновые кислоты, как известно, также могут быть использованы для экстракции других металлов, таких как редкоземельные металлы, актиниды и металлы платиновой группы.
Органические моно- и дитиофосфиновые кислоты, как установлено, также могут быть использованы в качестве экстрагентов для металлов (см., например, патенты США №№ 5028403 и 4721605). Кислотность таких фосфорсодержащих кислот растет с повышением содержания серы, что имеет тенденцию повышать способность кислоты экстрагировать металлы из растворов, имеющих низкое значение рН, но также имеет тенденцию увеличивать проблемы при последующей их отпарке из металла.
Таким образом можно отметить, что соединения формулы (I) могут быть использованы в качестве экстрагентов для металлов (например, для выделения ряда металлов из водных растворов, содержащих такие металлы отдельно или в комбинации с другими менее желательными металлами). В вариантах осуществления изобретения соединения формулы (I) могут быть использованы в процессах экстракции кобальта.
Бис(2,4,4-триметилпентил)фосфиновая кислота (раскрытая в патенте США № 4374780 и продаваемая Cytec Industries, Inc. под названием CYANEX 272) широко используется для выделения кобальта и/или никеля или из сульфатной, или из низкохлоридной среды. CYANEX 272 может селективно связывать кобальт, при этом одновременно не вступать в реакцию с кальцием, магнием и никелем, которые часто присутствуют в водных растворах, содержащих кобальт (II). CYANEX 272 также часто используют для разделения тяжелых редкоземельных металлов и для селективного отделения железа и цинка из растворов кобальта. Однако CYANEX 272 имеет некоторые ограничения и недостатки. В частности, CYANEX 272 становится излишне вязким и с ним становится трудно работать, когда он насыщается кобальтом, и в результате в промышленных процессах обычно его насыщают только до 70-75% от его максимальной теоретической емкости.
В описанных в изобретении примерах (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновая кислота (которая представляет собой соединение формулы (I), представленное в приведенных в изобретении примерах), как установлено, имеет емкость насыщения кобальтом, сравнимую с емкостью CYANEX 272, но в отличие от CYANEX 272 не становится чрезмерно вязким даже при максимальным насыщении кобальтом. Следовательно, в вариантах осуществления изобретения (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновая кислота в промышленных процессах обеспечивает насыщение кобальтом до 100% от теоретической емкости, то есть улучшение относительно CYANEX 272 порядка 25-30% без возникновения проблем, связанных с вязкостью. Улучшенная практическая емкость насыщения кобальтом и/или уменьшение проблем вязкости (как это наблюдается в примерах с (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислотой, описанных в изобретении) может улучшить общую эффективность и производительность при некоторых вариантах применения, таких как промышленные процессы экстракции кобальта (II).
В примерах, описанных в данном изобретении, (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновая кислота, как установлено, также лучше, чем CYANEX 272, при удалении кальция. В промышленных процессах экстракции кобальта кобальт, как правило, извлекают путем его отпарки из органической фазы с помощью серной кислоты. Совместная экстракция с кальцием нежелательна, так как это может привести к образованию гипса на межфазной границе органической фазы и водной фазы во время стадии отпарки кобальта из органической фазы и, следовательно, это может мешать процессу и снижать продуктивность стадии отпарки. Следовательно, в вариантах осуществления изобретения улучшенное удаление кальция (как это наблюдается с (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислотой) может уменьшить количество кальция, который подвергается совместной экстракции в процессах экстракции кобальта, что может улучшить продуктивность и эффективность стадии отпарки кобальта.
Кроме того, в примерах, представленных в изобретении, (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновая кислота, как показано, более селективна для кобальта в сравнении с никелем, чем CYANEX 272.
В патенте США № 5925784 раскрыта бис(1,1,3,3-тетраметилбутил)фосфиновая кислота и указано, что это соединение находит применение в качестве агента для отделения кобальта и/или никеля. Однако некоторые свойства бис(1,1,3,3-тетраметилбутил)фосфиновой кислоты ограничивают ее промышленное применение; например, она является твердой при комнатной температуре и имеет ограниченную растворимость в ароматических и алифатических растворителях, обычно используемых в промышленности в случае процессов экстракции кобальта. Напротив, в соответствии с настоящим изобретением значения R1 и R7 могут быть выбраны так, чтобы получить соединения формулы (I), которые являются жидкими при комнатной температуре и/или смешиваемыми (предпочтительно во всех пропорциях) с ароматическими и алифатическими растворителями, используемыми при экстракции кобальта.
Соединения формулы (I) могут быть использованы для экстракции кобальта в соответствии с известными способами (например, описанными в патентах США №№ 5925784, 4353883 и 4348367). Например, (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновая кислота может непосредственно заменять CYANEX 272, хотя может быть необходимо отчасти модифицировать процесс, чтобы приспособить его к различиям между химическими и физическими свойствами этих соединений. Специалист в данной области сможет адаптировать такие известные способы, чтобы ввести использование соединений формулы (I) с помощью обычных экспериментов без проведения значительных исследований.
Все публикации и патентные заявки в данном описании включены в качестве ссылки, как если бы каждая отдельная публикация или каждая отдельная заявка специально и отдельно были представлены как включенные в качестве ссылки.
Цитирование любой публикации состоит в раскрытии сути изобретения до даты подачи заявки и не должно рассматриваться как допущение, что настоящее изобретение не имеет права на датирование задним числом такой публикации ввиду предшествующего изобретения.
ПРИМЕРЫ:
ПРИМЕР 1: СИНТЕЗ (2,4,4-ТРИМЕТИЛПЕНТИЛ)-(1,1,3,3-ТЕТРАМЕТИЛБУТИЛ)ФОСФИНОВОЙ КИСЛОТЫ
Конечный продукт данного второго синтеза (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты далее называют «Партия 1».
(I) Синтез (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфина
В трехгорлую колбу в атмосфере азота добавляют 2,4,4-триметилпентилфосфин (302,7 г, 99% ГХ, 2,07 моль, 1,0 экв.), диизобутилен (смесь 2,4,4-триметилпентена-1 и 2,4,4-триметилпентена-2; 348,3 г, 3,11 моль, 1,5 экв.) и диэтиленгликоль (295 г, массовое отношение ~0,97). Смесь нагревают до 80°С, в это время в колбу с помощью капельной воронки в течение 50 минут медленно по каплям добавляют метансульфоновую кислоту (298,9 г, 3,11 моль, 1,5 экв.). Смесь дополнительно нагревают до кипения с обратным холодильником при 120°С и вываривают в течение ночи (16 часов).
Реакционную смесь охлаждают и добавляют толуол (300 мл), затем медленно добавляют водный раствор NaOH (125 г в 500 г воды, 3,11 моль, 1,5 экв.) так, чтобы температура реакции удерживалась ниже 60°С. После интенсивного перемешивания содержимое переносят в делительную воронку, чтобы получить четкое фазовое разделение. Затем собирают органическую фазу и растворитель, и непрореагировавшие исходные материалы отпаривают в вакууме при 80°С. Полученный продукт (452 г, выход 85%) представляет собой прозрачную бесцветную жидкость, которую анализируют с помощью31Р ЯМР и ГХ. Результаты:31Р ЯМР: δ -23,54 (дублет) и ГХ/МС: время удерживания (m/e) 12,70 минут (258).
(II) Синтез (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты:
В трехгорлую круглодонную колбу с каталитическим количеством серной кислоты (5 г, 1% относительно массы воды) добавляют воду (500 г, массовое отношение 1,0 относительно объема диалкилфосфина). В колбе создают атмосферу азота и снабжают устройством механического перемешивания. В реакционную емкость добавляют (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфин (443 г, 1,7 моль, 1,0 экв. со стадии (I), приведенной выше) с образованием двухфазной системы, в которой верхний слой представляет собой органическую фазу. Реакционную смесь затем нагревают до 50°С при перемешивании и в атмосфере азота. Источник нагревания удаляют и водный раствор ~25% пероксида водорода (700 г, 5,2 моль, 3,0 экв.) медленно по каплям добавляют в реакционную смесь, обеспечивая медленное и постоянное повышение температуры и исключая значительные и внезапные изменения температуры. После добавления одного эквивалента Н2О2 (~50 минут) прикладывают внешний источник нагревания, чтобы получить температуру реакции ≥95°С перед добавлением второго эквивалента Н2О2 таким же образом (~45 минут). В этот момент добавляют избыток Н2О2, чтобы гарантировать полное окисление исходного материала. Реакционную смесь вываривают при температуре ≥95°С в течение ночи (16 часов), и в это время экстрагируют образец для проведения анализа31Р ЯМР, чтобы определить окончание реакции. Результаты:31Р ЯМР: δ 63,53.
По окончании реакции к смеси добавляют толуол (~200 мл), чтобы уменьшить вязкость органического слоя. Органическую фазу затем промывают равным объемом воды. Затем органическую фазу дополнительно промывают водным раствором NaOH (100 г в 1 л воды) до получения значения pH~7-8. Водный слой удаляют и фосфиновую кислоту восстанавливают кислотной промывкой (H2SO4 в воде, 10 г/л). Целевой продукт затем отпаривают водой и сушат в вакууме при 80°С, получают прозрачную бесцветную жидкость (405 г, выход 82%).
Пример 2: СИНТЕЗ (2,4,4-ТРИМЕТИЛПЕНТИЛ)-(1,1,3,3-ТЕТРАМЕТИЛБУТИЛ)ФОСФИНОВОЙ КИСЛОТЫ
Конечный продукт данного второго синтеза (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты далее называют «Партия 2».
(I) Синтез (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфина
В трехгорлую колбу в атмосфере азота добавляют 2,4,4-триметилпентилфосфин (412,4 г, 2,82 моль, 1,0 экв.), диизобутилен (смесь 2,4,4-триметилпентена-1 и 2,4,4-триметилпентена-2; 474,3 г, 4,23 моль 1,5 экв.) и диэтиленгликоль (413,3 г, массовое отношение ~0,1). Смесь нагревают до 80°С, в это время в колбу с помощью капельной воронки в течение 50 минут медленно по каплям добавляют метансульфоновую кислоту (407,6 г, 2,24 моль, 1,5 экв.). Смесь дополнительно нагревают при кипении с обратным холодильником при 113°С в течение ночи (16 часов).
Реакционную смесь охлаждают и добавляют толуол (400 мл), затем медленно добавляют водный раствор NaOH (174,8 г в 500 г воды, 4,37 моль, 1,5 экв.) так, чтобы температура реакции удерживалась ниже 60°С. После интенсивного перемешивания содержимое переносят в делительную воронку с дополнительными 500 мл воды и 300 мл толуола. Наблюдается четкое фазовое разделение и водный слой удаляют, после чего дополнительно промывают органический слой 1 л воды. Органическую фазу собирают, растворитель и непрореагировавшие исходные материалы отпаривают в вакууме при 80°С. Полученный продукт (562 г, выход 77%) представляет собой прозрачную бесцветную жидкость, которую анализируют с помощью31Р ЯМР и ГХ. Результаты:31Р ЯМР: δ -24,74 (дублет) и ГХ/МС: время удерживания (m/e) 14,98 минут (258).
(II) Синтез (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты
В трехгорлую круглодонную колбу с каталитическим количеством серной кислоты (5,8 г, 1% относительно массы воды) добавляют воду (578 г, массовое отношение ~1,0 относительно объема диалкилфосфина). В колбе создают атмосферу азота и снабжают устройством механического перемешивания. В реакционную емкость добавляют (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфин (556,9 г, 2,16 моль, 1,0 экв. со стадии (I), приведенной выше) с образованием двухфазной системы, в которой верхний слой представляет собой органическую фазу. Реакционную смесь затем нагревают до 50°С при перемешивании и в атмосфере азота. Источник нагревания удаляют и водный раствор ~25% пероксида водорода (889,8 г, 6,54 моль, 3,0 экв.) медленно по каплям добавляют в реакционную смесь, обеспечивая медленное и постоянное повышение температуры и исключая значительные и внезапные изменения температуры. После добавления одного эквивалента Н2О2 (~120 минут) прикладывают внешний источник нагревания, чтобы получить температуру реакции ≥95°С перед добавлением второго эквивалента Н2О2 таким же образом (~90 минут). В этот момент добавляют избыток Н2О2, чтобы гарантировать полное окисление исходного материала. Реакционную смесь вываривают при температуре ≥95°С в течение ночи (16 часов), в это время экстрагируют образец для проведения анализа31Р ЯМР, чтобы определить окончание реакции. Результаты:31Р ЯМР: δ 63,52.
По окончании реакции к смеси добавляют толуол (~500 мл), чтобы уменьшить вязкость органического слоя. Водную фазу удаляют и органическую фазу обрабатывают водным раствором NaOH (100 г в 1 л воды) до получения значения рН ~7-8. Водный слой удаляют, а фосфиновую кислоту восстанавливают кислотной промывкой (H2SO4 в воде, 100 г/л). Целевой продукт затем отпаривают водой и сушат в вакууме при 80°С, получают прозрачную бесцветную жидкость (551,7 г, выход 88%). Отбирают образец для анализа ЯМР и метилируют для анализа с помощью ГХ/МС. Результаты: пик31Р ЯМР: δ 65,73 и ГХ/МС: время удерживания (m/e) 19,02 минут (272).
ПРИМЕР 3
Два образца нового экстрагента, (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновую кислоту (Партия 1 и Партия 2), исследуют с помощью сочетания газовая хроматография/масс-спектрометический детектор (ГХ/МС), чтобы полностью охарактеризовать активный ингредиент, а также все другие минорные компоненты и примеси. Кислотные компоненты вначале превращают в их метиловые эфиры, чтобы обеспечить возможность их элюирования из газохроматографической колонки.
1. ЭКСПЕРИМЕНТ
Два образца (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты (Партия 1 и Партия 2) взвешивают с точностью до 0,1 мг и разбавляют толуолом до конечной концентрации 20% масс. Аликвоту раствора в 500 мкл вводят в реакцию с равным объемом метилирующего реагента (диметилацеталя N,N-диметилформамида) и 0,2 мкл полученной смеси впрыскивают в газовый хроматограф.
2. РЕЗУЛЬТАТЫ
Результаты анализа с помощью ГХ/МС (% площади) для каждого компонента 2 образцов (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты (Партия 1 и Партия 2) представлены в таблице 1.
3. ОБСУЖДЕНИЕ
Хроматограммы двух образцов (2,4,4-триметилпентил)-(1,1,3,3-метилбутил)фосфиновой кислоты (партия 1 и партия 2) одинаковы по составу компонентов и присутствующих примесей и незначительно отличаются по количеству компонентов. Помимо основного компонента ((2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты), данные анализа указывают на присутствие соответствующих примесей, а именно диалкилфосфиновых кислот, моноалкилфосфиновых кислот и фосфиноксидов. Присутствие моноалкилфосфиновых кислот должно быть сведено до минимума, так как они склонны снижать селективность кобальт/никель экстрагента.
ПРИМЕР 4: Описание (2,4,4-триметилпентил)-(1,1,3,3-метраметилбутил)фосфиновой кислоты
Приведенные ниже испытания включают изучение свойств нового экстрагента (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты (ОПЫТ 1) и CYANEX 272. В опытах изучена экстракция одиночных металлов из растворов сульфатов и их обоюдная селективность как функции pH, емкости насыщения кобальтом и вязкости органических растворов как функции насыщения кобальтом.
ЧАСТЬ А - ЭКСТРАКЦИЯ ИЗ СУЛЬФАТНЫХ РАСТВОРОВ ОДИНОЧНОГО МЕТАЛЛА ПРИ ПЕРЕМЕННЫХ ЗНАЧЕНИЯХ pH
А.1. ЭКСПЕРИМЕНТ
Водные растворы одиночного металла готовят путем растворения взвешенного количества соответствующей соли, сульфата и взвешенного количества сульфата натрия в деионизированной воде. Концентрация металла в каждом растворе составляет 0,001М за исключением концентрации Fe(III), которая составляет 0,0015М. Концентрация сульфата натрия составляет 0,5М для всех растворов. Изучены металлы: Co(II), Ni(II), Ca(II), Mg(II), Mn(II), Zn(II), Fe(III) и Cu(II).
Органические растворы готовят путем разбавления (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты или CYANEX 272 до 0,1М фосфиновой кислоты с помощью разбавителя ISOPAR M. ISOPAR M представляет собой алифатический (>99,5%) углеводородный разбавитель, коммерчески доступный от фирмы Imperial Oil, Канада.
Равновесные распределения различных металлов между органической и водной фазами как функции pH определены при 50°С путем введения в контакт равных объемов (300 мл) двух фаз в стакане с рубашкой и при механическом перемешивании. Температуру раствора во время экстракции поддерживают при 50°С с помощью циркулирующей бани. Значение pH устанавливают путем добавления известного объема или гидроксида натрия, или серной кислоты к водной фазе. Время контакта 15 минут используют между каждым изменением значения pH. Образцы каждой фазы (15 мл) отбирают и анализируют.
Равновесное значение pH водных очищенных образцов измеряют с использованием рН-электрода в ROSS комбинации, калиброванного при комнатной температуре с помощью буферных растворов с pH 1,00 (буфер хлорид калия - соляная кислота), 4,00 (буфер дифталата калия) и 7,00 (буфер одноосновный фосфат калия - гидроксид натрия).
Для всех опытов водные образцы анализируют с помощью атомной абсорбционной спектроскопии (ААС, AAS). Концентрацию металла в органической фазе для каждого образца получают вычитанием концентрации очищенного образца из начальной концентрации металла в исходном растворе.
А.2. РЕЗУЛЬТАТЫ
Помимо кобальта, никеля и кальция, также изучены другие металлы (то есть цинк, железо, марганец и магний). Однако нет существенных различий между (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислотой и CYANEX 272 в случае этих металлов и поэтому численные данные для них не представлены. Численные данные в случае экстракции кобальта, кальция и никеля как функции pH при использовании (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты и CYANEX 272 представлены в таблице 2. Данные таблицы 3 показывают значения рН50 для каждого металла при использовании (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты («ОПЫТ») и CYANEX 272, а также значения ΔрН50 (ΔрН50=рН50Со-рН50металлы) соответственно. Значения рН50 определяют с использованием log коэффициента распределения, log D, и путем построения графика значений как функции pH. Коэффициент распределения, D, определяется как отношение суммарного содержания металла в органической фазе к содержанию металла в водной фазе.
Полученные результаты показывают селективность (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты для комбинаций кобальт-никель, кобальт-цинк, кобальт-железо и кобальт-кальций. Кроме того, (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновая кислота проявляет существенное увеличение селективности в сравнении с CYANEX 272 для кобальта в сравнении как с кальцием, так и с никелем. Такая более высокая селективность может иметь большое преимущество в установках экстракции растворителем за счет снижения образования гипса в системе.
ЧАСТЬ В - ЕМКОСТЬ НАСЫЩЕНИЯ КОБАЛЬТОМ И ВЯЗКОСТЬ
В.1 ОПЫТ ПО ОПРЕДЕЛЕНИЮ ЕМКОСТИ НАСЫЩЕНИЯ КОБАЛЬТОМ
Водный раствор готовят путем растворения взвешенного количества сульфата кобальта в деионизированной воде. Концентрация металла в растворе составляет 40 г/л. Органические растворы получают путем разбавления экстрагента (2,4,4-триметилфенил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты или CYANEX 272 до 0,14М фосфиновой кислоты с помощью разбавителя ISOPAR M. ISOPAR M представляет собой алифатический (>99,5%) углеводородный разбавитель, коммерчески доступный от фирмы Imperial Oil, Канада.
Равновесные распределения кобальта между органической и водной фазами в виде функции рН определяют при 50°С путем введения в контакт водного объема (250 мл) и органического объема (50 мл), получая отношение водной фазы к органической фазе, равное 5. Две фазы вводят в контакт в стакане с рубашкой и перемешивают с помощью механического перемешивания. Температуру раствора во время экстракции поддерживают при 50°С с помощью циркулирующей бани. Значение pH устанавливают путем добавления к водной фазе известного объема гидроксида натрия. Необходимо постоянное значение pH 6,13±0,03 в течение 15 минут, чтобы обеспечить максимальное насыщение металлом. Фазы разделяют и органическую фазу фильтруют через разделяющую фазы (P/S) бумагу, чтобы гарантировать, что отсутствует захваченная водная фаза. Концентрацию металла в органической фазе определяют путем отпарки с помощью 100 г/л H2SO4 при использовании равных объемов обеих фаз (40 мл) в течение 5 минут при комнатной температуре. Отпаренную жидкость собирают в пробирке. Аликвоту (35 мл) отпаренной органической фазы отпаривают второй раз с равным объемом (35 мл) свежей кислоты. Эту процедуру повторяют третий раз с использованием 30 мл отпаренной органической фазы и 30 мл свежей кислоты.
Три отпаренные жидкости хранят отдельно и анализируют индивидуально с помощью ICP. Концентрации в трех отпаренных жидкостях суммируют для определения количества загруженного кобальта. Всего проведено три опыта по насыщению (ОПЫТ 1, ОПЫТ 2 и ОПЫТ 3).
Равновесное значение pH водных образцов измеряют так, как ранее описано в приведенном выше разделе.
В.2 ОПЫТЫ ПО ОПРЕДЕЛЕНИЮ ВЯЗКОСТИ ОРГАНИЧЕСКИХ РАСТВОРОВ КАК ФУНКЦИИ НАСЫЩЕНИЯ КОБАЛЬТОМ
Водный раствор готовят путем растворения взвешенного количества сульфата кобальта в деионизированной воде. Концентрация металла в растворе составляет 40 г/л.
Органические растворы готовят путем разбавления взвешенного количества экстрагента или CYANEX 272 (200 г, Партия № WE2060451) или (2,4,4-триметилфенил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты (200 г, ОПЫТ 3) до 20% (масс./масс.) с помощью разбавителя ISOPAR M. Эти растворы делят на две равные порции, чтобы получить различные процентные значения насыщения по кобальту.
Равновесные распределения кобальта между органической и водной фазами определяют, как ранее описано в приведенном выше разделе, за исключением того, что температура равна комнатной температуре и отношение водной фазы к органической фазе равно единице (по 500 мл для каждой фазы). Необходимо постоянное значение pH 5,90±0,02 и pH 6,05±0,02 для CYANEX 272 и (2,4,4-триметилфенил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты (ОПЫТ 3) соответственно в течение 15 минут, чтобы обеспечить максимальное насыщение металлом. Фазы разделяют и органическую фазу центрифугируют в течение 30 минут при 3000 об/мин, чтобы гарантировать отсутствие захваченной водной фазы и осадка.
Затем готовят образцы путем смешения образца 100% насыщения и образца 0% насыщения при различных объемах так, чтобы можно было измерить вязкости при насыщении кобальтом 0%, 10%, 30%, 45%, 60%, 75%, 90% и 100% при различных температурах.
Образцы испытывают с использованием реометра AR1000N (TA Instruments). Используют метод ступенчатого потока с интервалами 90 сек в интервале от 10 до 60°С. В большинстве случаев точки данных получают, по меньшей мере, каждые 10°С. Температурный контроль (±0,1°С) обеспечивается с помощью плитки Пельтье. Конфигурация образуется 60 мм конусом и пластиной с углом 2°. Все образцы, как установлено, являются ньютоновскими, то есть их вязкости не зависят от скорости сдвига. Таким образом, все представленные опыты с переменными температурами проведены при одной и той же скорости сдвига (500/сек).
В.3 РЕЗУЛЬТАТЫ
Расчетную концентрацию кобальта в органической фазе определяют для трех образцов (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты (ОПЫТ 1, ОПЫТ 2 и ОПЫТ 3) и CYANEX 272 и полученные результаты представлены в таблице 4.
Полученные результаты указывают на незначительное различие в емкости насыщения двух экстрагентов, причем CYANEX 272 имеет немного более высокую максимальную емкость насыщения кобальтом, чем (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновая кислота.
Приведенные ниже две таблицы (5 и 6) показывают вязкость как (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты, так и CYANEX 272. Полученные результаты показывают, что вязкость меняется незначительно с изменением насыщения раствора кобальтом для (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты. С другой стороны, имеет место большое повышение вязкости между 75, 90 и 100% насыщением раствора кобальтом в случае образцов CYANEX 272. С практической точки зрения это означает, что 100% насыщение кобальтом может быть достигнуто с помощью (2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)фосфиновой кислоты, тогда как CYANEX 272 ограничен 70-75% насыщением кобальтом для ограничения проблемы вязкости.
Реферат
Настоящее изобретение относится к экстрагентам металлов формулы (I) и их солям, способу получения соединений формулы (I) из фосфинов формулы (II) ! ! где R1 и R2 различны и представляют собой -CH2-CHR3R4 или -CR3(CH2R5)R6, где R3 - метил или этил, R4 и R6 - необязательно замещенный алкил или гетероалкил, R5 - Н, необязательно замещенный алкил или гетероалкил, или R5, R6 и этиленовая группа, с которой они связаны, образуют необязательно замещенное пяти- или шестичленное циклоалкильное или гетероциклоалкильное кольцо, заместители выбраны из алкила, гидроксила, галогена, алкоксила, алкилтиогруппы, карбоксигруппы и ацетильной группы; Х и Y независимо представляют собой О или S за исключением (2,4,4-триметилпентил)-(1-метилциклогексил)фосфиновой кислоты или (2,4,4-триметилпентил)-(1-этилциклогексил)фосфиновой кислоты или их серосодержащих производных. Способ включает получение фосфина формулы (II) путем взаимодействия фосфина формулы R1PH2 с олефином формул CH2=CHR3R4 или HR5C=CR3R6 и последующее взаимодействие полученного фосфина с окислителем или серой или его окисление до фосфиноксида с последующей обработкой серой. Предложены новые соединения формулы (I), являющиеся эффективными экстрагентами металлов, новый эффективный способ их получения. 6 н.и 16 з.п.ф-лы, 4 пр., 6 табл.
Формула
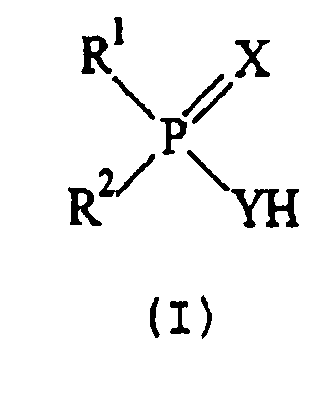
и его соли,
где R1 и R2 являются разными, и каждый из R1 и R2 независимо друг от друга выбирают из:
(a) -CH2-СНR3R4, где R3 представляет собой метил или этил; и R4представляет собой алкил или гетероалкил, необязательно замещенный группой, выбранной из алкила, гидроксила, галогена, алкоксила, алкилтиогруппы, карбоксигруппы и ацетильной группы; и
(b) -CR3(CH2R5)R6,
где R3 представляет собой метил или этил; и
R5 представляет собой Н, алкил или гетероалкил, необязательно замещенный группой, выбранной из алкила, гидроксила, галогена, алкоксила, алкилтиогруппы, карбоксигруппы и ацетильной группы, а R6представляет собой алкил или гетероалкил, необязательно замещенный группой, выбранной из алкила, гидроксила, галогена, алкоксила, алкилтиогруппы, карбоксигруппы и ацетильной группы; или
R5, R6 и этиленовая группа, с которой они связаны, образуют пяти- или шестичленное циклоалкильное или гетероциклоалкильное кольцо, необязательно замещенное группой, выбранной из алкила, гидроксила, галогена, алкоксила, алкилтиогруппы, карбоксигруппы и ацетильной группы;
и каждый Х и Y независимо друг от друга представляет собой О или S;
при условии, что соединение формулы (I) не является (2,4,4-триметилпентил)-(1-метилциклогексил)фосфиновой кислотой, или (2,4,4-триметилпентил)-(1-этилциклогексил)фосфиновой кислотой, или их серосодержащими производными.
(1,1,3,3-тетраметилбутил)-(2-этилгексил)фосфиновой кислоты;
(2,4,4-триметилпентил)-(2-этилгексил)фосфиновой кислоты;
(2,4,4-триметилпентил)-(1-метил-1-этилпентил)фосфиновой кислоты;
(1-метил-1-этилпентил)-(2-этилгексил)фосфиновой кислоты;
(2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)дитиофосфиновой кислоты;
(2,4,4-триметилпентил)-(1,1,3,3-тетраметилбутил)монотиофосфиновой кислоты;
(1,1,3,3-тетраметилбутил)-(2-этилгексил)дитиофосфиновой кислоты;
(1,1,3,3-тетраметилбутил)-(2-этилгексил)монотиофосфиновой кислоты;
(2,4,4-триметилпентил)-(2-этилгексил)дитиофосфиновой кислоты;
(2,4,4-триметилпентил)-(2-этилгексил)монотиофосфиновой кислоты;
(2,4,4-триметилпентил)-(1 -метил-1 -этилпентил)дитиофосфиновой кислоты;
(2,4,4-триметилпентил)-(1-метил-1-этилпентил)монотиофосфиновой кислоты;
(1-метил-1-этилпентил)-(2-этилгексил)дитиофосфиновой кислоты; и
(1-метил-1-этилпентил)-(2-этилгексил)монотиофосфиновой кислоты.
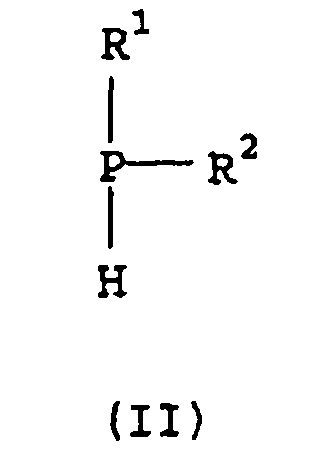
где R1 имеет значения, определенные в п.1;
R2 представляет собой -CH2CHR3R4, где R3 и R4 являются такими, как определено в п.1; и
где способ включает введение первичного фосфина формулы R'PH2 в реакцию с олефином формулы CH2=CHR3R4 в условиях свободно-радикальной реакции.

где R1 имеет значения, определенные в п.1;
R2 представляет собой -CR3(CH2R5)R6, где R3, R5 и R6 являются такими, как определено в п.1; и
где способ включает введение первичного фосфина формулы R1PH2 в реакцию с олефином формулы HR5C=CR3R6 в присутствии кислотного катализатора при условии, что соединение формулы (II) не является (2,4,4-триметилпентил)-(1-метилциклогексил)фосфином или (2,4,4-триметилпентил)-(1-этилциклогексил)фосфином.
(a) получение вторичного фосфина в соответствии со способом по п.12 или 13; и
(b) введение вторичного фосфина в реакцию:
(i) с окислителем с получением соответствующей фосфиновой кислоты;
(ii) с серой с получением соответствующей дитиофосфиновой кислоты; или
(iii) количеством окислителя, достаточным для окисления, по существу, всего вторичного фосфина с получением соответствующего фосфиноксида, который затем вводят в реакцию с серой с получением соответствующей монотиофосфиновой кислоты,
получая таким образом соединение формулы (I).

Комментарии