Твердая композиция, содержащая аморфный софосбувир - RU2016142819A
Код документа: RU2016142819A
Формула
1. Твердая композиция, содержащая софосбувир, имеющий структурную формулу (I),
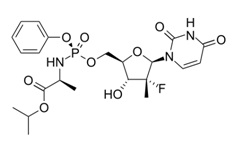
и, по меньшей мере, одно фармацевтически приемлемое матриксное химическое соединение, где, по меньшей мере, 99 мас.% софосбувира, содержащегося в этой композиции, находится в аморфной форме, по меньшей мере, 99 мас.% твердой композиции состоит из софосбувира и, по меньшей мере, одного матриксного химического соединения, и где эта твердая композиция содержит софосбувир в количестве, по меньшей мере, 55 мас.% от общей массы софосбувира и, по меньшей мере, одного матриксного химического соединения.
2. Твердая композиция по п.1, содержащая софосбувир в количестве в диапазоне от 55 до 90 мас.%, более предпочтительно, в диапазоне от 60 до 85 мас.%, более предпочтительно, в диапазоне от 70 до 80 мас.% от общей массы софосбувира и, по меньшей мере, одного матриксного химического соединения.
3. Твердая композиция по п.1 или 2, где в изотерме адсорбции-десорбции, по меньшей мере, одного фармацевтически приемлемого матриксного химического соединения разность масс Am(десорбции) при относительной влажности 75% и температуре 25°C больше или равна, предпочтительно больше, разности масс Am(адсорбции) при относительной влажности 75% и температуре 25°C, определенных при помощи измерения динамической сорбции паров.
4. Твердая композиция по любому из пп. 1-3, где, по меньшей мере, одно матриксное химическое соединение выбрано из группы, состоящей из гидрофильных водорастворимых полимеров, неорганических адсорбентов на основе кремния и комбинации двух или более из них.
5. Твердая композиция по любому пп. 1-4, где, по меньшей мере, одно матриксное химическое соединение содержит, по меньшей мере, один неорганический адсорбент на основе кремния, предпочтительно состоит из, по меньшей мере, одного неорганический адсорбент на основе кремния, где, по меньшей мере, один неорганический адсорбент на основе кремния, предпочтительно, выбран из группы, состоящей из диоксида кремния, силикатов и комбинации двух или более из них, где диоксид кремния предпочтительно выбран из группы, состоящей из высокодисперсного диоксида кремния, осажденного диоксида кремния, гелеобразного диоксида кремния, коллоидного диоксида кремния и комбинации двух или более из них, и где силикаты предпочтительно представляют собой алюмосиликаты, предпочтительно содержащие, по меньшей мере, один элемент щелочного металла и/или, по меньшей мере, один элемент щелочноземельного металла, более предпочтительно, по меньшей мере, один элемент щелочноземельного металла, более предпочтительно, магний, где, более предпочтительно, по меньшей мере, 90 мас.%, более предпочтительно, по меньшей мере, 95 мас.%, более предпочтительно, по меньшей мере, 99 мас.%, по меньшей мере, одного неорганического адсорбент на основе кремния находится в аморфной форме.
6. Твердая композиция по п.5, где, по меньшей мере, одно матриксное химическое соединение имеет значение pH в диапазоне от 6,0 до 9,0, более предпочтительно, в диапазоне от 6,5 до 8,5, более предпочтительно, в диапазоне от 7,0 до 8,0.
7. Твердая композиция по любому из пп. 1-4, где, по меньшей мере, одно матриксное химическое соединение содержит, по меньшей мере, один гидрофильный водорастворимый полимер, предпочтительно, состоит из, по меньшей мере, одного гидрофильного водорастворимого полимера, где, по меньшей мере, один гидрофильный водорастворимый полимер предпочтительно содержит, более предпочтительно, состоит из производного целлюлозы, выбранного из группы, состоящей из гидроксиалкилалкилцеллюлоз и смеси двух или более из них, по меньшей мере, один гидрофильный водорастворимый полимер предпочтительно содержит, более предпочтительно, состоит из гидроксипропилметилцеллюлозы (ГПМЦ).
8. Твердая композиция по любому из пп. 1-7, где, по меньшей мере, 99,5 мас.%, предпочтительно, по меньшей мере, 99,9 мас.% софосбувира, содержащегося в композиции, находится в аморфной форме, и где, по меньшей мере, 99,5 мас.%, предпочтительно, по меньшей мере, 99,9 мас.% твердой композиции состоит из софосбувира и, по меньшей мере, одного матриксного химического соединения.
9. Твердая композиция по любому из пп. 1-8, содержащая менее 0,1 мас.%, предпочтительно, менее 0,01 мас.%, более предпочтительно, менее 0,001 мас.% поверхностно-активного вещества.
10. Твердая композиция по любому из пп. 1-9, имеющая стабильность в условиях влажности, составляющую, по меньшей мере, 95%, предпочтительно, по меньшей мере, 98%, более предпочтительно, по меньшей мере, 99%, где стабильность в условиях влажности определяется как количество твердого аморфного софосбувира, которое присутствует в твердой композиции после воздействия на нее относительной влажности 75% и температуре 40°C в течение 8 недель, по отношению к количеству твердого аморфного софосбувира, которое присутствует в твердой композиции перед указанным воздействием.
11. Твердая композиция по любому из пп. 1-10, представляющая собой твердую дисперсию.
12. Фармацевтическая композиция, содержащая твердую композицию по любому из пп. 1-11, указанная фармацевтическая композиция предпочтительно представляет собой пероральную лекарственную форму, предпочтительно, таблетку.
13. Способ получения твердой композиции, содержащей софосбувир, имеющий структурную формулу (I),

и, по меньшей мере, одно фармацевтически приемлемое матриксное химическое соединение, предпочтительно для получения твердой композиции по любому из п.п. 1-11, указанный способ включает в себя внедрение софосбувира в матрикс, состоящий из, по меньшей мере, одного фармацевтически приемлемого матриксного химического соединения, начиная с растворения софосбувира в, по меньшей мере, одном растворителе, где массовое отношение софосбувира к, по меньшей мере, одному матриксному химическому соединению составляет, по меньшей мере, 5,5:4,5, предпочтительно, находится в диапазоне от 6:4 до 8,5:1,5, более предпочтительно в диапазоне от 7:3 до 8:2.
14. Способ получения твердой композиции, содержащей софосбувир, имеющий структурную формулу (I),

и, по меньшей мере, одно фармацевтически приемлемое матриксное химическое соединение, предпочтительно для получения твердой композиции по любому из п.п. 1-11, указанный способ включает в себя внедрение софосбувира в матрикс, состоящий из, по меньшей мере, одного фармацевтически приемлемого матриксного химического соединения, путем расплавления, по меньшей мере, одного фармацевтически приемлемого матриксного химического соединения в твердой форме вместе с софосбувиром в твердой форме, предпочтительно, при помощи термоплавкого способа, более предпочтительно, при помощи метода экструзии горячего расплава, где массовое отношение софосбувира к, по меньшей мере, одному матриксному химическому соединению составляет, по меньшей мере, 5,5:4,5, предпочтительно, находится в диапазоне от 5,5:4,5 до 9:1, предпочтительно, в диапазоне от 6:4 до 8,5:1,5, более предпочтительно в диапазоне от 7:3 до 8:2.
15. Способ по п.22 или 23, где в изотермах адсорбции-десорбции этого, по меньшей мере, одного матриксного химического соединения разность масс Am(десорбции) при относительной влажности 75% и температуре 25°C больше или равна, предпочтительно больше, разности масс Am(адсорбции) при относительной влажности 75% и температуре 25°C, определенных при помощи измерения динамической сорбции паров.
16. Способ по любому из пп. 13-15, где, по меньшей мере, одно матриксное химическое соединение выбрано из группы, состоящей из гидрофильных водорастворимых полимеров, неорганических адсорбентов на основе кремния и комбинации двух или более из них.
17. Способ по любому из пп. 13, или 15, или 16, где, по меньшей мере, один растворитель выбран из группы, состоящей воды, органического растворителя и комбинации двух или более из них, где органический растворитель предпочтительно выбран из группы, состоящей из C1-C4 спиртов, C1-C2 галогенизированных углеводородов, C3-C6 кетонов, C2-C6 простых эфиров, C3-C5 сложных эфиров и комбинации двух или более из них.
18. Способ по любому из пп. 13 или 15-17, где, по меньшей мере, одно матриксное химическое соединение выбрано из группы, состоящей из гидрофильных водорастворимых полимеров и комбинации двух или более из них, и где внедрение включает в себя получение раствора софосбувира и, по меньшей мере, одного матриксного химического соединения в, по меньшей мере, одном растворителе, где, по меньшей мере, один растворитель предпочтительно выбран из группы, состоящей из воды, C1-C4 спиртов, C1-C2 галогенизированных углеводородов, C3-C6 кетонов, C2-C6 простых эфиров, C3-C5 сложных эфиров и комбинации двух или более из них, указанное внедрение предпочтительно также включает в себя сушку раствора, предпочтительно путем лиофилизации этого раствора или сушки распылением этого раствора.
19. Способ по любому из пп. 13 или 15-17, где, по меньшей мере, одно матриксное химическое соединение выбрано из группы, состоящей из неорганических адсорбентов на основе кремния и комбинации двух или более из них, и где внедрение включает в себя диспергирование, по меньшей мере, одного матриксного химического соединения в растворе, где, по меньшей мере, один растворитель предпочтительно выбран из группы, состоящей из воды, C1-C3 кетонов, C1-C2 галогенизированных углеводородов, C3-C4 спиртов, C2-C6 простых эфиров, C3-C5 сложных эфиров и комбинации двух или более из них, указанное внедрение предпочтительно также включает в себя сушку дисперсии, предпочтительно путем фильтрации этой дисперсии или выпаривания этой дисперсии, предпочтительно с последующей вакуумной сушкой.
20. Способ по любому из пп. 13 или 15-19, где, раствор софосбувира в, по меньшей мере, одном растворителе получают из софосбувира, который, по меньшей мере, на 95 мас.%, предпочтительно, по меньшей мере, на 99 мас.%, более предпочтительно, на 99,9 мас.% находится в аморфной форме, где софосбувир предпочтительно получают способом, включающим в себя
(i) получение софосбувира в, по меньшей мере, одной кристаллической форме или в аморфной форме или в виде смеси, по меньшей мере, одной кристаллической формы и аморфной формы, предпочтительно, получение софосбувира, который, по меньшей мере, на 95 мас.%, предпочтительно, по меньшей мере, на 99 мас.%, более предпочтительно, по меньшей мере, на 99,9 мас.% находится в, по меньшей мере, одной кристаллической форме;
(ii) растворение, по меньшей мере, части софосбувира, полученного в соответствии с пунктом (i), в, по меньшей мере, одном растворителе с получением раствора, содержащего софосбувир;
(iii) лиофилизацию или быструю сушку, по меньшей мере, части раствора, полученного в соответствии с пунктом (ii), при необходимости после концентрирования, предпочтительно быструю сушку с получением софосбувира, который, по меньшей мере, на 95 мас.%, предпочтительно, по меньшей мере, на 99 мас.%, более предпочтительно, по меньшей мере, на 99,9 мас.% находится в своей аморфной форме,
где, по меньшей мере, один растворитель в соответствии с пунктом (ii) выбран из группы, состоящей из воды, C1-C3 кетонов, C1-C2 галогенизированных углеводородов, C1-C4 спиртов, C2-C6 простых эфиров, C3-C5 сложных эфиров и комбинации двух или более из них, более предпочтительно, из группы, состоящей из воды, C1-C4 спиртов, C1-C3 кетонов и комбинации двух или более из них, где, более предпочтительно, по меньшей мере, один растворитель содержит, более предпочтительно, состоит из ацетона, и где быстрая сушка предпочтительно осуществляется путем сушки распылением или грануляции распылением, более предпочтительно, путем сушки распылением.
21. Способ получения фармацевтической композиции, предпочтительно, пероральной лекарственной формы, более предпочтительно, таблетки, указанный способ включает в себя
(a) получение твердой композиции, по любому из пп. 1-11, предпочтительно получение твердой композиции способом по любому из пп. 13-20;
(b) смешивание твердой композиции из пункта (a), предпочтительно полученной в соответствии с пунктом (a), с, по меньшей мере, одним фармацевтически приемлемым вспомогательным веществом.
22. Твердая композиция, которую получают, или которая может быть получена при помощи способа по любому пп. 13-20.
23. Фармацевтическая композиция, которую получают, или которая может быть получена при помощи способа по п.21.
24. Твердая композиция по любому из пп. 1-11 или 22 или фармацевтическая композиция по п.12 или 23 для применения в способе лечения гепатита C у человека.
25. Применение фармацевтически приемлемого химического соединения для стабилизации аморфного софосбувира, имеющего структурную формулу (I),

предпочтительно в твердой композиции, предпочтительно в твердой дисперсии и/или в фармацевтической композиции, где в изотерме адсорбции-десорбции этого фармацевтически приемлемого химического соединения разность масс Am(десорбции) при относительной влажности 75% и температуре 25°C больше или равна, предпочтительно больше, разности масс Am(адсорбции) при относительной влажности 75% и температуре 25°C, определенных при помощи измерения динамической сорбции паров, где фармацевтически приемлемое химическое соединение выбрано из группы, состоящей из гидрофильных водорастворимых полимеров, неорганических адсорбентов на основе кремния и комбинации двух или более из них.
26. Способ получения софосбувира, который, по меньшей мере, на 95 мас.%, предпочтительно, по меньшей мере, на 99 мас.%, более предпочтительно, по меньшей мере, на 99,9 мас.% находится в своей аморфной форме, включающий в себя
(i) получение софосбувира в, по меньшей мере, одной кристаллической форме или в аморфной форме или в виде смеси, по меньшей мере, одной кристаллической формы и аморфной формы, предпочтительно, получение софосбувира, который, по меньшей мере, на 95 мас.%, предпочтительно, по меньшей мере, на 99 мас.%, более предпочтительно, по меньшей мере, на 99,9 мас.% находится в, по меньшей мере, одной кристаллической форме;
(ii) растворение, по меньшей мере, части софосбувира, полученного в соответствии с пунктом (i), в, по меньшей мере, одном растворителе с получением раствора, содержащего софосбувир;
(iii) быструю сушку, предпочтительно сушку распылением, по меньшей мере, части раствора, полученного в соответствии с пунктом (ii), при необходимости после концентрирования, с получением софосбувира, который, по меньшей мере, на 95 мас.%, предпочтительно, по меньшей мере, на 99 мас.%, более предпочтительно, по меньшей мере, на 99,9 мас.% находится в своей аморфной форме.
27. Способ получения софосбувира, который, по меньшей мере, на 95 мас.%, предпочтительно, по меньшей мере, на 99 мас.%, более предпочтительно, по меньшей мере, на 99,9 мас.% находится в своей аморфной форме, включающий в себя
(i) получение софосбувира в, по меньшей мере, одной кристаллической форме или в аморфной форме или в виде смеси, по меньшей мере, одной кристаллической формы и аморфной формы, предпочтительно, получение софосбувира, который, по меньшей мере, на 95 мас.%, предпочтительно, по меньшей мере, на 99 мас.%, более предпочтительно, по меньшей мере, на 99,9 мас.% находится в, по меньшей мере, одной кристаллической форме;
(ii) расплавление софосбувира, полученного в соответствии с пунктом (i), способом расплавления, предпочтительно термоплавким способом, более предпочтительно, методом экструзии горячего расплава, с получением софосбувира, который, по меньшей мере, на 95 мас.%, предпочтительно, по меньшей мере, на 99 мас.%, более предпочтительно, по меньшей мере, на 99,9 мас.% находится в своей аморфной форме.

Комментарии