Фосфорно-серные огнезащитные добавки и полимерные системы, содержащие их - RU2497826C1
Код документа: RU2497826C1
Описание
Настоящая заявка имеет приоритет на основании предварительной патентной заявки США № 60/876787, поданной 12 декабря 2006 года.
Настоящая заявка относится к огнезащитным добавкам для органических полимеров и, в частности, к фосфорно-серным огнезащитным добавкам.
Огнезащитные добавки обычно добавляют к полимерным продуктам, применяемым в строительстве, автомобилестроении, электронной промышленности, в слоистых электротехнических материалах, проводах и кабелях, текстильных материалах и в других областях применения. Огнезащитные добавки повышают ограничивающий кислородный индекс (LOI) полимерных систем, в результате чего изделия, изготовленные из таких полимерных систем, могут выдерживать стандартные испытания на горючесть. В качестве огнезащитных добавок для органических полимеров можно применять различные бромированные соединения с низкой молекулярной массой (<~1500 г/моль). Многие из этих соединений, такие как гексабромциклододекан и полибромированные дифениловые простые эфиры являются предметом постоянной общественной обеспокоенности, что может привести к ограничениям их применения и побуждает к поискам замены для них.
Различные фосфорные соединения применяли в качестве огнезащитных добавок. Они включают в себя органические фосфаты, фосфонаты и фосфорамиды, некоторые из которых описаны в патентах США №№ 4070336 и 4086205, а также в "The Chemistry and Use of Flame Retardants" (Химия огнезащитных средств и их применение), J.W. Lyons, глава 2: Chemistry of Fire Retardants Based on Phosphorous (Химия огнезащитных средств на основе фосфора) p. 29-74 (1987). Другой коммерчески доступной огнезащитной добавкой является 2,2'-оксибис[5,5-диметил-1,3,2-диоксафосфоринан-2,2'-дисульфид], который имеет структуру:

Эти соединения предоставляют умеренную устойчивость к воспламенению и обычно менее эффективны, чем гексабромциклододекан или другие бромированные огнезащитные добавки.
Желательно предоставить альтернативные огнезащитные добавки для органических полимеров, и в частности, для вспененных полимеров. Огнезащитная добавка должна быть способной повышать LOI полимерной системы, когда она включена в полимер на разумно низких уровнях. Сходным образом, огнезащитная добавка должна быть способной придавать хорошие огнегасящие свойства полимерной системе, опять же, когда она присутствует на разумно низком уровне. Поскольку во многих случаях огнезащитную добавку наиболее традиционно добавляют в расплав органического полимера или (в качестве альтернативы или дополнения), она присутствует на последующих технологических операциях с расплавом, огнезащитная добавка должна быть термостабильной при температуре расплавленного полимера. Это относится к диапазону при 150°С и выше, и часто выше 220°С. Предпочтительны огнезащитные добавки, имеющие низкую токсичность.
Настоящее изобретения в одном аспекте представляет собой полимерную композицию, содержащую горючий полимер, в который подмешано эффективное количество фосфорно-серной добавки, представленной структурой I:

в которой Х означает кислород или серу, Т означает ковалентную связь, кислород, серу или -NR4-, где R4означает водород, алкил, инертно замещенный алкил или группу P(X)[(X)'mR]2, при условии, что по меньшей мере один из X и T означает серу, каждый X' независимо означает кислород или серу, каждое m независимо равно нулю или 1, когда X' означает кислород, и равно нулю, 1 или 2, когда X' означает серу, n равно по меньшей мере 1 и, предпочтительно, по меньшей мере 2, каждый R независимо означает незамещенную или инертно замещенную гидрокарбильную группу, или R-группы совместно образуют незамещенную или инертно замещенную двухвалентную органическую группу, и А означает органическую связующую группу.
Соединения согласно структуре (I) часто демонстрируют весьма полезные и неожиданные сочетания свойств, включая во многих случаях очень низкую токсичность для млекопитающих и превосходную гидролитическую и термическую стабильность. Их термостабильность дает возможность включать их в высокотемпературные полимерные материалы и технологические операции. Неожиданно было обнаружено, что многие из этих материалов придают исключительную огнезащитную эффективность, когда их добавляют ко многим полимерам и полимерным пенообразным структурам, особенно пенообразным материалам ароматических поливиниловых типов.
В некоторых вариантах осуществления фосфорно-серная добавка представлена структурой II или III:

где R, X, T, A и n являются такими, как описано выше, опять при условии, что по меньшей мере один из X и T означает серу.
В других вариантах осуществления фосфорно-серная добавка представлена структурой IV:

где X, X', T, n и A являются такими, как описано выше, каждый R2 независимо означает водород, алкил или инертно замещенный алкил, и R3 означает ковалентную связь или двухвалентную связующую группу. В структуре IV каждый R2, предпочтительно, означает водород и R3, предпочтительно, означает алкиленовый дирадикал, не имеющий водородов на атомах углерода, связанных непосредственно с соседними группами (R2)2C. R3, более предпочтительно, означает (диалкил)метилен, и наиболее предпочтительно, (диметил)метилен.
В других вариантах осуществления фосфорно-серная добавка представлена структурой V:

где X, X', T, A и n являются такими, как определено выше.
В других отношениях настоящее изобретение означает фосфорно-серные соединения. В некоторых вариантах осуществления фосфорно-серное соединение представлено структурой III. В других вариантах фосфорно-серное соединение является представленным структурой IV или структурой V. В других вариантах осуществления фосфорно-серное соединение представлено структурами I или II, где Т означает кислород, серу или -NR4-, где R4 означает водород, алкил или инертно замещенный алкил и A означает
(1) органический полимер;
(2) органическую группу, связанную со связующим звеном -T- через бензильный углерод, включая органические группы, представленные структурой VI,
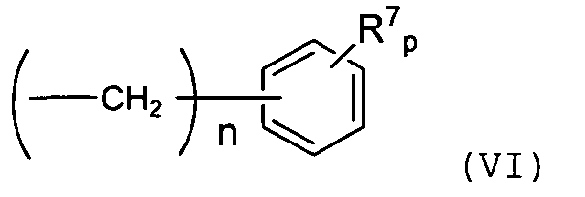
где R7 означает H, гидрокарбил или инертный заместитель, и p равно 6-n;
(3) органическую группу, связанную со связующим звеном -T- через акриловую или метакриловую группу, такую, как представлено структурой VII

где R8 означает -CH3 или -H и A2 означает органическую связующую группу;
(4) остаток сложного эфира диола или двухосновной кислоты (такой как сложный эфир малеиновой кислоты или сложный эфир фумаровой кислоты), имеющий неароматическую углерод-углеродную ненасыщенность после добавления фосфорно-серной группы к углерод-углеродной двойной связи этого сложного эфира;
(5) остаток жирной кислоты или ее сложного эфира (включая триглицерид жирной кислоты), в котором жирная кислота имеет по меньшей мере один углерод-углеродный ненасыщенный центр после добавления фосфорно-серной группы к такому углерод-углеродному ненасыщенному центру, или
(6) ароматическую группу, связанную со связующим звеном -Т- через ароматический углеродный атом.
Фосфорно-серная добавка характеризуется тем, что она имеет по меньшей мере одну фосфорно-серную группу, которая содержит атом фосфора, связанный по меньшей мере с двумя, и предпочтительно, по меньшей мере с тремя атомами серы, кислорода или азота, при условии, что по меньшей мере один из этих атомов является атомом серы. Данная группа может содержать единственный атом серы, включая фрагменты следующих типов (структура VIII):

Фосфорно-серная группа может содержать два атома серы, связанных с атомом фосфора, включая фрагменты следующих типов (структура IX):

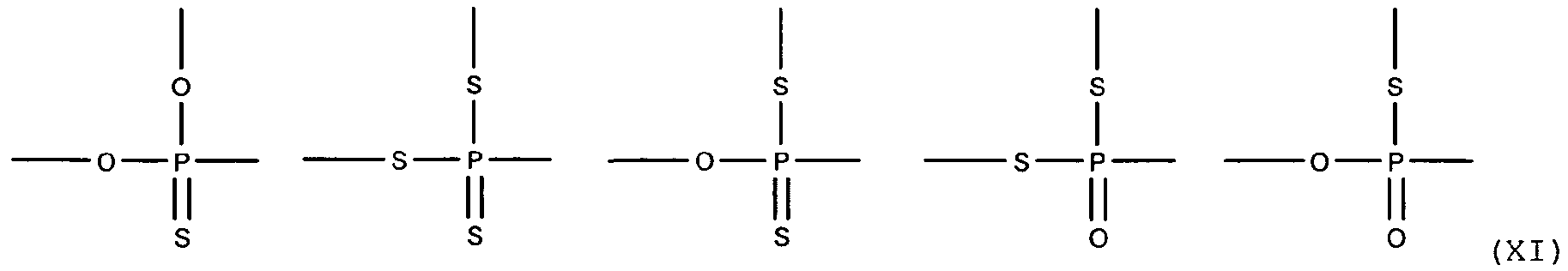
Фосфорно-серная группа может содержать 3 или 4 атома серы, связанных с атомом фосфора, как показано в структуре Х:

В дополнение, фосфорно-серная группа включает в себя фрагменты, в которых атом фосфора прямо связан с углеродным атомом (группы А и/или группы R, как описано выше), как показано в структуре XI:
Таким образом, определенные полезные типы подходящих негалогенированных фосфорно-серных добавок можно представить структурой II и III:

где R, X, T, A и n являются такими, как описано выше, и по меньшей мере один из X и T означает серу. В структурах II и III, предпочтительно, Т означает кислород или серу, наиболее предпочтительно, серу. X означает, предпочтительно, серу, и n, предпочтительно, равно по меньшей мере 2.
В структурах I, II или III группы R могут быть, например, незамещенными или инертно замещенными алифатическими, циклоалифатическими или ароматическими группами.
В настоящей заявке «инертным» заместителем является такой, который не создает нежелательного ухудшения огнезащитных свойств добавки. Соединение, содержащее инертный заместитель, называют «инертно замещенным». Инертным заместителем может быть, например, группа, содержащая кислород, такая как простой эфир, сложный эфир, карбонил, гидроксил, карбоновая кислота или оксирановая группа и т.п. Инертным заместителем может быть группа, содержащая азот, такая как первичная, вторичная или третичная аминогруппа, иминогруппа, амидная группа или нитрогруппа. Инертный заместитель может содержать другие гетероатомы, такие как сера, фосфор, кремний (как в силановых или силоксановых группах) и т.п. Предпочтительно, инертный заместитель не является галогеном и не содержит галоген.
Гидрокарбильная группа, для целей настоящего изобретения, является группой, которая, за исключением инертных заместителей, содержит только атомы водорода и углерода. Гидрокарбильная группа может быть алифатической, алициклической, ароматической или некоторой комбинацией двух или более из этих типов.
R-группы в структурах I, II или III представляют собой, предпочтительно, незамещенный или инертно замещенный низший алкил, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил и т.п. Более предпочтительно, две R-группы совместно образуют двухвалентный органический радикал, который завершает кольцевую структуру связующим звеном -(X')m-P-(X')m-, -O-P-O- или -S-P-О-, соответственно, как показано, например, выше в структуре IV. Особенно предпочтительной фосфорно-серной добавкой является соединение, представленное структурой XII:

где X, n, R2, R3 и A являются такими, как описано выше (предпочтительно, X означает серу). В структурах IV и XII группы R2, предпочтительно, представляют собой водород или низший алкил и, более предпочтительно, водород. R3, предпочтительно, означает гидрокарбильную группу с прямой или разветвленной цепью, -O- или ковалентную связь. Более предпочтительные группы R3 представляют собой гидрокарбильные группы, которые являются попарно дизамещенными на атоме углерода, или атомы углерода, которые связаны непосредственно с группами R2C. Группа R3, наиболее предпочтительно, означает метилен, замещенный двумя алкилами, как в случае, когда группа R3 означает (диметил)метилен.
Особенно предпочтительный тип фосфорно-серной добавки представлен структурой XIII:

где X, n и A являются такими, как указано выше. Предпочтительно, Х означает серу.
Другой тип фосфорно-серной добавки представлен структурой V:

в которой каждый X', T и X, предпочтительно, означает серу, и A и n являются такими, как определено выше.
Группа A в структурах I, II, III, IV, V, XII и XIII означает органическую связующую группу. Органическая связующая группа может иметь множество разнообразных возможных структур. Органическая связующая группа ковалентно связана со связующим звеном -T- (в структурах I-V и XIII) или атомом -S- (в структуре XII). Связующее звено -T- или -S- может быть связано с атомом углерода или гетероатомом на органической связующей группе А, но, предпочтительно, оно связано с атомом углерода. Этим атомом углерода, предпочтительно, является первичный или вторичный атом углерода (т.е. связанный с одним или двумя другими атомами углерода), но, менее предпочтительно, он является третичным атомом углерода (т.е. одним атомом, связанным с тремя другими атомами углерода).
Одним типом органической связующей группы А является незамещенная или инертно замещенная гидрокарбильная группа. Органическая связующая группа А может содержать любое число атомов углерода, хотя, предпочтительно, молекулярная масса в расчете на фосфорно-серную группу не превышает примерно 2000 Да, более предпочтительно, не превышает примерно 1500 Да и особенно она составляет менее 1000 Да. Фосфорно-серная добавка может содержать от 5 до 50% или более серы по массе, и когда А означает органический полимер, фосфорно-серная огнезащитная добавка, предпочтительно, содержит от 5 до 30% серы по массе. Органическая связующая группа А может быть алифатической (линейной или разветвленной), алициклической, ароматической или некоторой комбинацией этих типов. Валентность органической связующей группы А равна n. В каждой из структур I-V, XII и XIII n, предпочтительно, равно по меньшей мере 2.
Органическая связующая группа А может быть линейным или разветвленным, замещенным или незамещенным алкиленовым радикалом, имеющим валентность, равную n. В алкиленовом радикале может содержаться любое число атомов углерода. Пример добавки, имеющей группу А, которая является замещенным (в данном случае, простыми эфирными группами) алкиленовым радикалом, представлен структурой XIV:

Органическая связующая группа А может быть ненасыщенной гидрокарбильной группой. В таком случае она, предпочтительно, связана со связующим звеном -T- каждой фосфорно-серной группы через аллильный или бензильный атом углерода. Примеры соединений, в которых фосфорно-серная группа связана с аллильным углеродом, представлены структурами XV и XVI, где X, R, R2 и R3 являются такими, как определено выше.

В структурах XV и XVI группы R2, предпочтительно, представляют собой водород или низший алкил и, более предпочтительно, водород, и группы R3 представляют собой гидрокарбильные группы, которые являются попарно дизамещенными на атоме углерода, или атомы углерода, которые связаны непосредственно с группами R2C, предпочтительно, метиленом, замещенным двумя алкилами, особенно (диметил)метиленом.
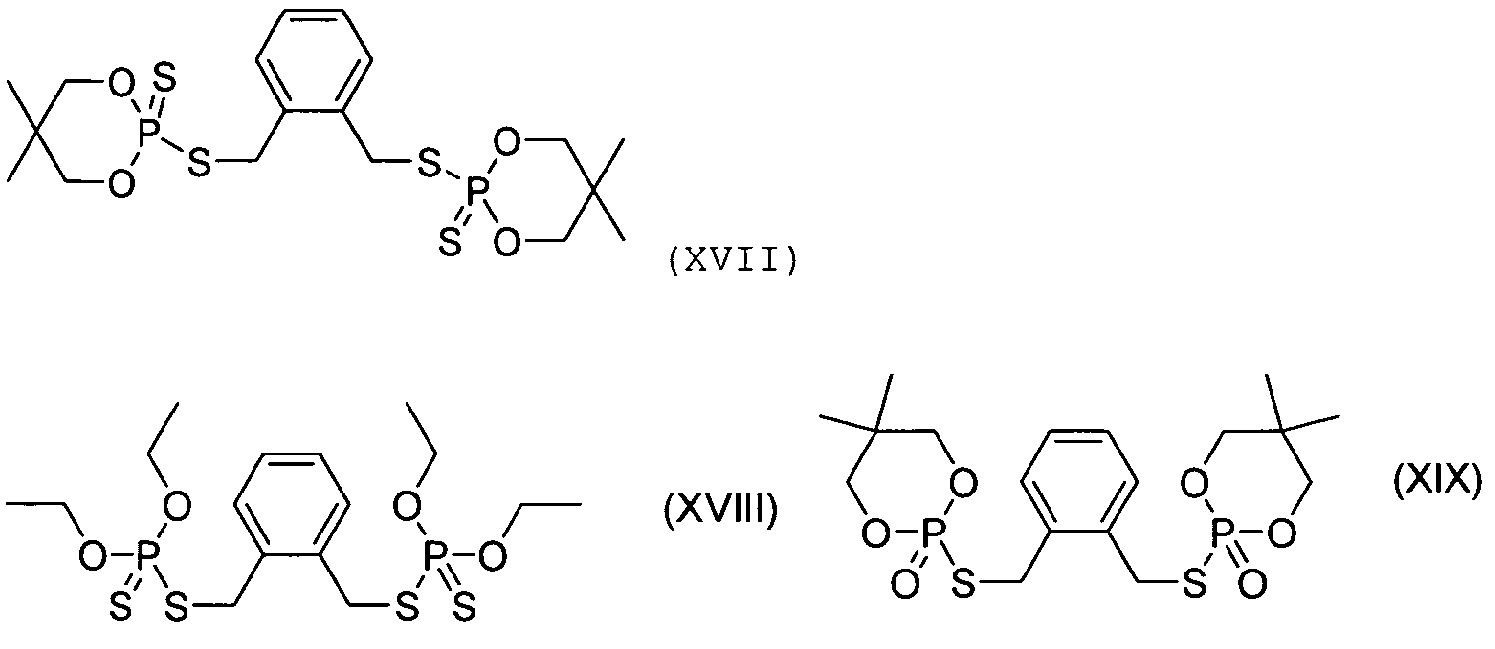
Другой тип связующей группы А для структур I-V, XII и XIII, которая связана со связующим звеном -T- или -S- (если это возможно) через бензильный атом углерода, представлен выше структурой VI. Конкретные примеры фосфорно-серных добавок, содержащих этот тип группы А, показаны в следующих структурах XVII-XXIII:


Для фосфорно-серных групп также возможно прямое связывание с ароматическим кольцом группы А.
Другим типом органической связующей группы А в структурах I-V, XII и XIII является остаток соединения, имеющего акрилатные или метакрилатные группы, после добавления фосфорно-серного исходного материала по углерод-углеродной двойной связи акрилатных или метакрилатных групп. В таком случае связующая группа А может быть представлена вышеуказанной структурой VII. Конкретным типом фосфорно-серной огнезащитной добавки этого типа является продукт реакции акрилатного сложного эфира полиольного соединения с 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиолом.
Еще одним другим типом органической связующей группы А в структурах I-V, XII и XIII является остаток ненасыщенной жирной кислоты или сложного эфира такой кислоты (включая, что следует отметить, триглицерид такой жирной кислоты, в котором по меньшей мере некоторая часть составляющей жирной кислоты содержит углерод-углеродную ненасыщенность), причем этот остаток означает то, что остается после добавления фосфорно-серного исходного материала по углерод-углеродной двойной связи жирной кислоты или сложного эфира. Примерами таких триглицеридов являются растительные масла, такие как соевое, канола, оливковое или кукурузное масло.
Еще одним другим типом органической связующей группы А в структурах I-V, XII и XIII, после добавления фосфорно-серной группы по углерод-углеродной двойной связи, является остаток малеинового или фумарового сложного эфира или эфира, образованного из другого диола или двухосновной кислоты, имеющей неароматическую углерод-углеродную ненасыщенность. Конкретным типом фосфорно-серной огнезащитной добавки этого типа является продукт реакции двойного малеинового сложного эфира с 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиолом.
Другие органические связующие группы А могут содержать различные гетероатомы, включая кислород, фосфор, серу, азот и т.п. Примером связующей группы А, содержащей фосфор и кислород, является фосфиновый фрагмент, представленный структурой XXIV:

где каждый R5 означает алкил или инертно замещенный двухвалентный алкил, предпочтительно, этилен или метилен. Среди органических связующих групп А, содержащих гетероатомы, имеются гетероциклические соединения, содержащие гетероатом в кольцевой структуре. Гетероциклические соединения могут быть алифатическими или ароматическими. Особенно интересны гетероциклические ароматические соединения. Примером такого гетероциклического ароматического соединения является фосфазеновая или триазиновая структура:

которая может быть замещенной фосфорно-серной группой при любом кольцевом углероде или при всех кольцевых углеродах.
Некоторые фосфорно-серные добавки согласно настоящему изобретению включают в себя те из любых структур I-V, XII или XIII, в которых органическая связующая группа А представляет собой органический полимер. Полимерные органические связующие группы А, связанные с боковыми фосфорно-серными группами, являются предпочтительными вариантами осуществления настоящего изобретения. Многие органические полимеры могут служить в качестве связующей группы А при условии, что органический полимер, который применяют для образования органической связующей группы А, имеет функциональные группы, способные реагировать с образованием связи со связующим звеном -T- или -S- (если это возможно) фосфорно-серной группы.
Полимер или сополимер, который образует группу А, может иметь среднемассовую молекулярную массу от примерно 500 до 300000 или более. Однако, те из них, которые имеют меньшие среднемассовые молекулярные массы, такие как 1000-20000, особенно 2000-10000, проявляют склонность к лучшему диспергированию во многих полимерах, особенно стирольных гомополимерах и сополимерах, и могут быть более эффективными при предоставлении огнезащитных свойств.
Подходящий тип органического полимера, применимый для образования органической связующей группы А, содержит или может быть модифицирован таким образом, чтобы содержать алифатическую углерод-углеродную ненасыщенность, способную реагировать с образованием связи с фосфорно-серной группой. Примеры органических полимеров, содержащих алифатическую углерод-углеродную ненасыщенность, включают в себя гомополимеры сопряженного диена, такого как бутадиен, изопрен или циклопентадиен, или сополимеры двух или более сопряженных диенов или по меньшей мере одного сопряженного диена и по меньшей мере одного другого сополимеризуемого мономера. Примеры последнего типа включают в себя сополимеры бутадиена или изопрена и винилового ароматического мономера, такого как стирол. Другим примером органического полимера, содержащего алифатическую углерод-углеродную ненасыщенность, является полимер или сополимер мономера, имеющего две этиленово-ненасыщенные группы с неодинаковой реактивностью, такие как аллилакрилат, аллилметакрилат и т.п. Более реактивная из этих групп может быть полимеризована в большей степени (преимущественно), что ведет к образованию полимера, имеющего этиленовую ненасыщенность в боковых группах. Еще одним примером органического полимера, имеющего алифатическую углерод-углеродную ненасыщенность, является сложный полиэфир ненасыщенной алифатической двухосновной кислоты, такой как малеиновая кислота или фумаровая кислота (или соответствующих двойных сложных эфиров или ангидридов).
Для введения алифатической ненасыщенности в органический полимер его можно модифицировать многими способами, и такие модифицированные полимеры можно применять для образования органической связующей группы А. Традиционным путем введения такой ненасыщенности является реакция реактивной группы, находящейся на органическом полимере, с ненасыщенным соединением, содержащим этиленовую ненасыщенность и совместно реагирующую группу, которая реагирует с реактивной группой на органическом полимере с образованием связи. Например, акриловые, акрилатные, метакриловые и метакрилатные соединения различных типов могут реагировать с реактивными группами, такими как гидроксил, сложный эфир, первичные или вторичные аминогруппы и им подобные, для введения акрилатной или метакрилатной функции в органический полимер.
Другие органические полимеры, которые можно применять для образования органической связующей группы А, содержат другие типы реактивных центров, посредством которых полимер можно связать со связующим звеном -T- или атомом -S- фосфорно-серной группы. Примеры таких групп включают в себя эпоксидные группы и галогеновые заместители (в частности, хлор или бром).
Для образования органической связующей группы А можно применять много разнообразных эпоксидных смол. Примеры этих смол включают в себя диглицидильные простые эфиры многоатомных фенольных соединений, таких как резорцин, катехин, гидрохинон, бисфенол, бисфенол А, бисфенол АР (1,1-бис(4-гидроксилфенил)-1-фенилэтан), бисфенол F, бисфенол K, тетраметилбифенол, диглицидильные простые эфиры алифатических гликолей и простые полиэфиры гликолей, такие как диглицидильные простые эфиры C2-24-алкиленгликолей и поли(этиленоксид)- или поли(пропиленоксид)гликолей; полиглицидильные простые эфиры фенол-формальдегидных новолачных смол, фенол-формальдегидные смолы, замещенные алкилами (эпоксидные новолачные смолы), фенол-гидроксибензальдегидные смолы, крезол-гидроксибензальдегидные смолы, дициклопентадиен-фенольные смолы, дициклопентадиен-замещенные фенольные смолы и т.п.
Органические полимеры, применимые для образования органической связующей группы А и замещенные галогенами, включают в себя, например, полимеры и сополимеры галогенированных мономеров, таких как винилхлорид, винилиденхлорид, винилбензилхлорид и т.п. В качестве альтернативы, галогенные группы можно вводить в предварительно полученный полимер различными способами. Отмечено, что полимеры винилбензилхлорида образуют фосфорно-серные добавки, в которых фосфорно-серная группа (одна или более) связаны с бензильным атомом углерода.
Особенно интересной органической полимерной связующей группой А является (после добавления фосфорно-серной группы к углерод-углеродной двойной связи полимера) остаток полимера или сополимера сопряженного диена и особенно полимера или сополимера бутадиена или изопрена с по меньшей мере одним виниловым ароматическим мономером, таким как стирол. Сополимеры могут быть статистических или блочных типов. Особенно интересными блочными типами являются диблок-сополимеры и триблок-сополимеры, которые содержат центральный полибутадиеновый блок и концевые полистирольные блоки. Диблок-сополимеры несколько более предпочтительны, чем триблочные типы, при применении для образования органической связующей группы А, в частности, при применении с поливиниловыми ароматическими материалами, такими как полистирол. Перед введением фосфорно-серных групп сополимер содержит по меньшей мере 10% по массе полимеризованного бутадиена. Бутадиен полимеризуется с образованием двух типов повторяющихся единиц. Один тип, называемый в настоящем документе термином «1,2-бутадиеновые звенья», принимает форму

и тем самым вводит в полимер боковые ненасыщенные группы. Второй тип, называемый в настоящем документе термином «1,4-бутадиеновые звенья», принимает форму -CH2-CH=CH-CH2- и вводит ненасыщенность в главную цепь полимера. Бутадиен/виниловый ароматический полимер, применяемый в качестве органической связующей группы А, предпочтительно, содержит по меньшей мере некоторое число 1,2-бутадиеных единиц до добавления фосфорно-серной группы. По меньшей мере 10%, предпочтительно, по меньшей мере 15% и, более предпочтительно, по меньшей мере 20% и, даже еще более предпочтительно, по меньшей мере 25% бутадиеновых единиц в бутадиен/виниловом ароматическом полимере являются 1,2-бутадиеновыми единицами до добавления фосфорно-серной группы. 1,2-бутадиеновые звенья могут составлять по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60% или по меньшее мере 70% бутадиеновых единиц в бутадиен/виниловом ароматическом сополимере до добавления фосфорно-серной группы. Доля 1,2-бутадиеновых единиц может превышать 85% или даже превышать 90% бутадиеновых единиц в исходном сополимере. Способы получения бутадиен/виниловых ароматических полимеров с контролируемым содержанием 1,2-бутадиена описаны в публикациях J. F. Henderson and M. Szwarc в Journal of Polymer Science (D, Macromolecular Review), Volume 3, page 317 (1968), Y. Tanaka, Y. Takeuchi, M. Kobayashi and H. Tadokoro в J. Polym. Sci. A-2, 9, 43-57 (1971), J. Zymonas, E. R. Santee and H. James Harwood в Macromolecules, 6, 129-133 (1973) и H. Ashitaka et al., в J. Polym. Sci. Polym. Chem. 21, 1853-1860 (1983).
Полимеры одного или более сопряженных диенов могут быть подвергнуты бромированию, например, N-бромсукцинимидом, что дает аллильно бромированные полимеры. Такие аллильно бромированные полимеры могут привести к связующим группам А, в которых группа А связана со связующим звеном -T- или -S- через аллильные атомы углерода.
Фосфорно-серные добавки в большинстве случаев можно получать непосредственно, применяя простые химические способы. Фосфорно-серные исходные материалы легко получать, приводя спирт в контакт с P2S5, который легко доступен в качестве смазывающего средства и сырьевого материла для производства биоцидов. Спирт имеет структуру POH, где R является таким, как определено в структуре I выше. Получаемый исходный фосфорно-серный материал имеет структуру XXV, как следует ниже.

где X и R являются такими, как определено выше. Двухатомные спирты, имеющие форму HO-C(R2)2-R3-C(R2)20H (где R2 и R3 являются такими, как определено с учетом структуры IV, указанной выше), могут реагировать с P2S5 с образованием циклического фосфорно-серного исходного материала, имеющего структуру XXVI:

где X, X', R2 и R3 являются такими, как определено выше. Соединения этого типа можно получать, применяя способы, описанные в Chauhan, H. P. S.; Bhasin, C. P.; Srivastava, G.; Mehrotra, R. C, "Synthesis and characterization of 2-mercapto-2-thioxo-1,3,2-dioxaphospholanes and dioxaphosphorinanes" (Синтез и характеризация 2-меркапто-2-тиоксо-1,3,2-диоксафосфоланов и диоксафосфоринанов), Phosphorus and Sulfur and the Related Elements (Фосфор и сера и родственные элементы) (1983), 15(1), 99-104 и в Edmundson, "Cyclic Organophosphorus Compounds-Ill, Some Sterically Hindered Pyrophosphates" (Циклические органофосфорные соединения. III. Некоторые стерически затрудненные пирофосфаты), Tetrahedron, 1965, 2379-2387. Особенно предпочтительным фосфорно-серным исходным материалом является:

где X является таким же, как определено выше, и, предпочтительно, означает серу.
Фосфорно-серные исходные соединения могут быть преобразованы в соответствующие аминные соли посредством смешивания с первичным, вторичным или, предпочтительно, третичным аминным соединением, и получаемые в результате этого аминные соли могут реагировать с органическим галогенидом, образуя фосфорно-серное огнезащитное вещество. Последовательность реакций традиционно проводят в растворителе для исходных материалов, возможно, при комнатной температуре, при слегка пониженной температуре или при несколько повышенной температуре ниже температуры разложения исходных материалов. Подходящей является температура от 10 до 100°С. Реакцию можно схематично проиллюстрировать идеализированной реакционной схемой XXVII.

где каждый R13 независимо означает водород, гидрокарбил или инертно замещенный гидрокарбил, X" означает галоген, предпочтительно, хлор или бром, и R, n, A и X являются такими, как определено выше.
Фосфорно-серные исходные соединения можно также получать прямой реакцией с электрофилами, такими как орто-диксилилдихлорид, 1,4-дибром-2-бутен, без начального получения аммонийной соли, как описано Kaboudin, B.; Norouzi, H., Synthesis, 2004, 12, 2035-2039.
Реагентом AX"n может быть, например, алкан или алкен, замещенный одним или более, предпочтительно, двумя или более, предпочтительно, 2-4 атомами галогена, которым, наиболее предпочтительно, является хлор или бром. Примеры таких замещенных алканов и алкенов включают в себя 1,4-бутандихлорид, 1,4-бутандибромид, 1,2-этилендихлорид, 1,2-этилендибромид, 1,2-пропилендихлорид, 1,2-пропилендибромид, 1,4-дибром-2-бутен, 1,4-дихлор-2-бутен и т.п. Вместо этого, реагентом AX"n может быть ароматическое соединение, замещенное одной или более галоидоалкильными группами, особенно бромметильной или хлорметильной группами и необязательно другими заместителями в кольце. Примеры таких ароматических соединений включают в себя бензилхлорид, o- м- или п-ксилилдихлорид, o-, м- или п-ксилилдибромид, 1,2,4,6-тетра(бромметил)бензол, 1,2,4,6-тетра(хлорметил)бензол, 1,2,3,4,5,6-гекса(бромметил)бензол, 1,2,3,4,5,6-гекса(хлорметил)бензол, 1,3,5-трис(бромметил)-2,4,6-триметилбензол, 1,3,5-трис(хлорметил)-2,4,6-триметилбензол, поли(винилбензилхлорид), поли(винилбензилбромид) и сополимеры поли(винилбензилхлорида) и/или поли(винилбензилхлорида) по меньшей мере с одним другим сополимеризуемым мономером, полимеры и сополимеры винилхлорида и винилиденхлорида и т.п.
При другом способе производства фосфорно-серных добавок фосфорно-серный исходный материал приводят в прямой контакт с соединением, имеющим одну или более алифатических углерод-углеродных двойных связей, как схематически показано на реакционной последовательности XXVIII. Реакцию можно проводить в растворителе для исходного материала и при любой удобной температуре ниже температуры разложения исходных материалов. Подходящей является температура от 0 до 100°С. Реакционная последовательность XXVIII является следующей:

где

Ненасыщенное соединение может содержать только одну углерод-углеродную двойную связь или может содержать две или более таких двойных связей. Если присутствуют множественные двойные связи, они могут быть сопряженными или могут не быть таковыми, но по меньшей мере одна из них не является ароматической. Двойные связи могут присутствовать в неароматической кольцевой структуре. Примеры подходящих олефиновых соединений включают в себя, например этилен, пропилен, 1- или 2-бутен, 1- или 2-пентен, высшие альфа-олефины, такие как 1-гексен и 1-октен, бутадиен, изопрен, циклопентен, циклопентадиен, дициклопентадиен, 1,5,9-додекатриен, стирол, дивинилбензол, тривинилбензол, этилиденнорборнен, норборнен, норборнадиен, винилциклогексан, циклооктадиен, 1,6-октадиен, соединения и аддукты, содержащие акрилатные и/или метакрилатные группы, полимеры и сополимеры бутадиена и/или изопрена (включая блок-сополимеры и статистические сополимеры бутадиена с виниловым ароматическим мономером, таким как стирол) и т.п.
Фосфорно-серный исходный материал можно привести в контакт с оксирановым соединением, таким как эпоксидная смола, как описано выше, для производства фосфорно-серного огнезащитного соединения, применимого в настоящем изобретении. В этом случае группа -T-H реагирует с эпоксигруппой, раскрывая эпоксидное кольцо и образуя -ОН-группу (соответствующую кислородному атому оксиранового кольца). Эту реакцию можно проводить в растворителе для исходных материалов при температуре от несколько ниже комнатной до температуры разложения исходных материалов. Подходящей является температура от 10°С до 100°С. При желании, эту реакцию можно катализировать.
Фосфорно-серную добавку можно применять в качестве огнезащитной добавки для множества горючих полимеров. Термин «горючий» в настоящем документе просто означает, что полимер способен сгореть. Горючий полимер может быть термопластичным или термореактивным полимером.
Интересные горючие полимеры включают в себя полиолефины, такие как полиэтилен (включая сополимеры этилена, такие как сополимеры этилена с α-олефином, полипропилен и т.п.); поликарбонаты и смеси поликарбонатов, такие как смесь поликарбоната со сложным полиэфиром, акрилонитрил-стрирол-бутадиеновая смола, стирол-акрилонитрильная смола или полистирол; полиамиды; сложные полиэфиры; эпоксидные смолы; полиуретаны; полиизоцианураты и виниловые ароматические полимеры (включая виниловые ароматические гомополимеры, виниловые ароматические сополимеры, смеси одного или более виниловых ароматических гомополимеров и/или виниловых ароматических сополимеров с другим полимером, таким как поли(фениленоксидная) смола и виниловые ароматические полимеры, модифицированные каучуком); винил-эфирные смолы; термопластичные или термореактивные винил-эфирные смолы, а также другие воспламеняемые полимеры, в которых можно растворить или диспергировать фосфорно-серную добавку.
Особенно интересными полимерами являются полиолефины. Полиолефиновые полимеры - это полимеры или интерполимеры, содержащие повторяющиеся звенья, полученные полимеризацией α-олефина. Особенно подходящие α-олефины имеют от 2 до примерно 20 углеродных атомов, предпочтительно, от 2 до 8 углеродных атомов, и включают в себя этилен, пропилен, 1-бутен, 4-метил-1-пентен, 1-гексен, 1-октен и т.п. Предпочтительные α-олефиновые полимеры являются гомополимерами этилена или пропилена и интерполимерами этилена с C3-C8-α-олефином. α-Олефиновый полимер может также содержать, в полимеризованной форме, один или более других мономеров, способных к интерполимеризации с α-олефином и содержащих алифатическую или циклоалифатическую группу. Такие мономеры включают в себя, например, винилацетат, акриловую кислоту, метакриловую кислоту, сложные эфиры акриловой или метакриловой кислоты и ангидриды кислот, такие как малеиновый ангидрид. α-Олефиновый полимер, предпочтительно, содержит по меньшей мере 75% по массе, предпочтительно, по меньшей мере 95% по массе, полимеризуемых α-олефиновых мономеров. Более предпочтительно, α-олефиновый полимер является интерполимерным полимером по меньшей мере 85% по массе полимеризованного этилена и до 15% по массе другого α-олефина. Особенно подходящие α-олефиновые полимеры включают в себя полиэтилен низкой плотности (LDPE) - термин, используемый в настоящем описании для обозначения полиэтиленовых гомополимеров, производимых в процессе свободно-радикальной полимеризации при высоком давлении. В настоящем изобретении можно также применять такие продукты, как линейный полиэтилен низкой плотности (LLDPE) и полиэтилен высокой плотности (HDPE). Можно также применять LLDPE-полимеры, имеющие однородное распределение сомономеров, описанные, например, в патенте США № 3645992, выданном Elston, и в патентах США №№ 5026798 и 5055438, выданных Canich. Другим применимым типом α-олефинового полимера является существенно линейный олефиновый полимер, как описано в патентах США №№ 5272236 и 5278272, включенных в настоящий документ посредством ссылки. Еще одним подходящим α-олефиновым полимером является гомополимер или интерполимер пропилена. Интерполимер пропилена может быть интерполимером пропилена и одного или более других мономеров, таких как другой α-олефин, винилацетат, метилакрилат, этилакрилат, метилметакрилат, акриловая кислота, итаконовая кислота, малеиновая кислота и малеиновый ангидрид.
Другим особенно интересным горючим полимером является виниловый ароматический полимер.
«Виниловый ароматический» полимер - это полимер ароматического соединения, имеющего полимеризуемую этиленово-ненасыщенную группу, связанную непосредственно с углеродным атомом ароматического кольца. Подходящие виниловые ароматические полимеры включают в себя гомополимеры виниловых ароматических мономеров и их сополимеры с одним или более сополимеризуемыми этиленово-ненасыщенными соединениями (составляющими до 50% по массе). Виниловый ароматический полимер или сополимер можно применять отдельно или в виде смеси с другим виниловым ароматическим полимером или сополимером и/или с полимером другого типа (таким как, например, поли(фениленоксид) или поли-1,6-(2,6-диметилфениловый) эфир. Виниловый ароматический полимер, предпочтительно, имеет среднемассовую молекулярную массу от 100000 до 350000, измеренную с использованием хроматографии по размерам молекул. Подходящие виниловые ароматические мономеры включают в себя незамещенные материалы, такие как стирол, дивинилбензол и винилнафталин, а также соединения, замещенные на этиленово-ненасыщенной группе (такие как, например, альфа-метилстирол) и/или замещенные в кольце. Замещенные в кольце виниловые ароматические мономеры включают в себя такие соединения, которые имеют галоген, алкоксил, нитрогруппу или незамещенные или замещенные алкильные группы, связанные непосредственно с углеродным атомом ароматического кольца. Примеры таких замещенных в кольце виниловых ароматических мономеров включают в себя 2- или 4-бромстирол, 2- или 4-хлорстирол, 2- или 4-метоксистирол, 2- или 4-нитростирол, 2- или 4-метилстирол, этилстирол и 2,4-диметилстирол. Подходящие сополимеризуемые мономеры включают в себя акриловую кислоту, метакриловую кислоту, этакриловую кислоту, малеиновую кислоту, итаконовую кислоту, акрилонитрил, малеиновый ангидрид, метилакрилат, этилакрилат, бутилакрилат, пропилакрилат, метилметакрилат, винилацетат, виниловый спирт, определенные амиды и бутадиен. Интересны вспененные полимеры любого из этих типов.
Термопластичные и термореактивные винил-эфирные смолы, описанные, например, в “Vinyl Ester Polymers”, Encyclopedia of Polymer Science and Engineering, Mark et al., ed., Vol. 17, pp. 393-445 (1989), также особенно интересны.
Особенно интересным горючим полимером является полимер или сополимер винилового ароматического мономера, такой как стирольный полимер или сополимер, как описано выше, стирол-акрилонитрильный полимер (SAN), полистирол, модифицированный каучуком (такой как ударопрочный полистирол) или стирол-акрилонитрил-бутадиеновая (ABS) смола. Полистирол является особенно предпочтительным горючим полимером.
Другим особо интересным горючим полимером является статистический, блок- или графт-сополимер бутадиена и по меньшей мере одного винилового ароматического мономера. Среди них предпочтительны блок-сополимеры; особенно предпочтительны диблок- или триблок-сополимеры бутадиена и стирола.
Горючий полимер может быть (как до, так и после включения фосфорно-серной добавки) в форме готового изделия любого типа, включая, без ограничения, пленку, листовой материал, волокно, пенообразный материал или формованное изделие.
Вспененные горючие полимеры любого из вышеописанных типов особенно интересны, поскольку они находят применение в автомобилестроении и в строительстве, где характеристики противопожарной безопасности особенно важны. Вспененный горючий полимер обычно имеет плотность пены от примерно 0,5 до примерно 30 фунтов на кубический фут (pcf) (8-480 кг/м3), особенно от примерно 0,8 до примерно 10 pcf (от 12,8 до 160 кг/м3), и, наиболее предпочтительно, от примерно 1 до примерно 4 pcf (от 16 до 64 кг/м3). Вспененный горючий полимер можно производить любым подходящим способом, включая экструзионные способы, реактивное вспенивание и вспенивание гранулированного полимера. Фосфорно-серные добавки согласно настоящему изобретению часто подходят для производства экструдированных вспененных полимеров, поскольку эти соединения во многих случаях имеют достаточную термостабильность, как показывает тест на температуру 5%-ной потери массы, описанный ниже, чтобы их можно было вводить в процесс экструзии пены, посредством которого получают пенообразный материал. Особенно предпочтительными горючими полимерами являются экструдированный пенополистирол и вспененный гранулированный полистирол.
Достаточное количество фосфорно-серной добавки применяют для улучшения эффективности горючего полимера в одном или более стандартных тестов на огнестойкость. Одним из таких тестов является определение ограничивающего кислородного индекса (LOI), который оценивает минимальное содержание кислорода в атмосфере, необходимое для поддержания горения полимера. LOI традиционно определяют согласно стандарту ASTM D2863. Горючий полимер, содержащий фосфорно-серное соединение, предпочтительно, имеет LOI, равный по меньшей мере 2%, более предпочтительно, по меньшей мере 3%, - более, чем соответствующая величина одного горючего полимера. Когда горючим полимером является полистирол, LOI смеси полистирола с огнезащитной добавкой составляет по меньшей мере 20%, более предпочтительно, по меньшей мере 23% и, даже более предпочтительно, по меньшей мере 25%. Другим тестом является измерение времени до прекращения горения, известное как FP-7, которое определяют согласно способу, описанному A. R. Ingram в J. Appl. Poly. Sci. 1964, 8, 2485-2495. Этот тест измеряет время, необходимое для прекращения горения пламени, когда в определенных условиях образец полимера подвергают воздействию пламени, после чего источник пламени удаляют. Обычно значения FP-7 должны быть как можно более низкими. Для полистирольного полимера, содержащего огнезащитную добавку, описанную в настоящем документе, желательно, чтобы значение FP-7 составляло менее 10 секунд, предпочтительно, менее 5 секунд, даже более предпочтительно, менее 2 секунд. Обычно эти результаты можно получить тогда, когда фосфорно-серная огнезащитная добавка составляет от 1 до примерно 15, предпочтительно, от 1 до примерно 6% по массе комбинированного горючего полимера.
Во многих случаях удобно смешивать фосфорно-серную огнезащитную добавку с расплавленным горючим полимером, как до, так и во время другой технологической операции с расплавом (такой как экструзия, вспенивание, формование и т.д.). Поэтому фосфорно-серная огнезащитная добавка, предпочтительно, является термостабильной при температуре, при которой обрабатывают расплавленный полимер. Для многих горючих полимеров эта температура находится выше 150°С, и для многих горючих полимеров, вызывающих особых интерес (таких как полистирол), она находится выше 200°С или даже выше 220°С, или еще выше.
Полезным показателем термостабильности является температура 5%-ной потери массы, которую измеряют термогравиметрическим анализом следующим образом: ~10 мг фосфорно-серной огнезащитной добавки анализируют с использованием прибора модели Hi-Res TGA 2950 (TA Instruments) или эквивалентного устройства в потоке газообразного азота (60 мл/мин) при скорости нагрева 10°С/мин в диапазоне от комнатной температуры (номинально 25°С) до 600°С. Проводят мониторинг потери массы образца в течение стадии нагревания, и температуру, при которой образец теряет 5% своей первоначальной массы, обозначают как температуру потери 5% массы (5% WLT). Этот способ предоставляет температуру, при которой образец претерпевает кумулятивную потерю массы, составляющую 5 масс.% от исходной массы образца. Фосфорно-серная добавка, предпочтительно, демонстрирует 5% WLT, равную по меньшей мере той температуре, при которой горючий полимер подвергают обработке в расплаве (для его смешивания с фосфорно-серной огнезащитной добавкой или для обработки смеси при изготовлении из нее изделия, такого, как пенообразный материал, экструдированная деталь, формованная деталь или т.п.). Когда ее применяют в операции обработки расплава с горючим полимером, фосфорно-серная огнезащитная добавка должна иметь 5% WLT, равную по меньшей мере 150°С. Предпочтительно, 5% WLT составляет по меньшей мере 200°С, более предпочтительно, по меньшей мере 225°С, даже более предпочтительно, по меньшей мере 240°С, и еще более предпочтительно, по меньшей мере 250°С, особенно когда горючим полимером является полистирол.
Фосфорно-серную добавку можно смешивать с горючим полимером, применяя и другие способы, такие как подмешивание в раствор горючего полимера, добавление в процессе суспензионной полимеризации или эмульсионной полимеризации или другими путями. Термостабильность фосфорно-серной добавки является менее важной, если горючий полимер не обрабатывают в расплаве в присутствии фосфорно-серной добавки, поскольку в таких случаях фосфорно-серную добавку обычно не подвергают таким высоким температурам при технологических операциях.
Полимерные смеси согласно настоящему изобретению могут включать в себя другие добавки, такие как другие огнезащитные добавки, термостабилизаторы, стабилизаторы, повышающие устойчивость к ультрафиолетовому свету, затравочные вещества, антиоксиданты, пенообразователи, наполнители, поперечно-сшивающие или прививаемые вещества, поглотители кислоты и окрашивающие средства.
Полимерные смеси, содержащие фосфорно-серные огнезащитные добавки согласно настоящему изобретению, можно обрабатывать в расплаве или в растворе для производства широкого ассортимента продуктов. Интересны вспененные (ячеистые или расширенные) продукты, поскольку их применяют в различных областях строительной и автомобилестроительной промышленности, в которых противопожарная безопасность является особенно важной. Вспененные (расширенные) виниловые ароматические полимеры и бутадиеновые полимеры и сополимеры, как описано выше, являются особенно интересными. Согласно настоящему изобретению можно также производить неячеистые полимеры.
Следующие примеры представлены для иллюстрирования настоящего изобретения, но не для ограничения его объема. Все части и процентные доли даны по массе, если не указано иначе.
Пример 1
К перемешиваемому раствору 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (10,0 г, 50 ммоль) в толуоле (70 мл) добавляли триэтиламин (5,0 г, 50 ммоль) для образования соли триметиламмония. Смесь нагревали до 45°C. К полученной смеси добавляли 1,4-дибромбут-2-ен (5,34 г, 25 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение 1 часа. Затем раствор промывали насыщенным водным раствором бикарбоната натрия (50 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая белое твердое вещество. Неочищенный продукт диспергировали в этаноле (40 мл) и фильтровали, получая 8,7 г (80%) белого твердого вещества, 2,2'-[2-бутен-1,4-диилбис(метилтио)]бис[5,5-диметил-1,3,2-диоксафосфоринан]-2,2'-дисульфида, имеющего структуру:
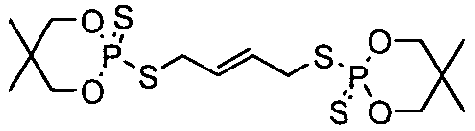
Термостабильность 2,2'-[2-бутен-1,4-диилбис(метилтио)]бис[5,5-диметил-1,3,2-диоксафосфоринан]-2,2'-дисульфида оценивали термогравиметрическим анализом, как описано выше. В этом тесте образец демонстрировал 5% WLT при 241°C. Протонный и31P ЯМР данного образца показывали следующие пики:
1H ЯМР(300 МГц, CDCl3) δ: 5,82 (м, 2H), 4,17 (м, 4H), 3,95 (м, 4H), 3,62 (м, 4H), 1,24 (с, 6H), 0,93 (с, 6H).
31P ЯМР (CDCl3 vs. H3PO4) δ: 89,23.
Часть образца смешивали в расплаве с полистирольной смолой при соотношении масс 4:96. Затвердевшие смешанные расплавы измельчали лабораторной дробилкой Wiley с 3-мм ситом. Аликвоты измельченных смесей по 25-27 г штамповали под давлением в пластины размером 100 мм × 100 мм × 1,5 мм, применяя гидравлический плоский пресс Pasadena (модель BL444-C-6M2-DX2357), работавший при температуре, установленной на 180°C при продолжительности приложенного давления, равной 5 мин, и при приложенном давлении, равном 25000 фунтов на квадратный дюйм (psi) (172 МПа). Формованные пластины разрезали на полосы для определения ограничивающего кислородного индекса (LOI) и FP-7. LOI оценивали согласно стандарту ASTM D 2863, и он был найден равным 26,5%. FP-7 оценивали, как описано выше; эта величина была найдена равной 1,9 с.
10%-ный (по массе) концентрат, в расчете на массу концентрата, фосфорно-серной добавки в полистироле получали, смешивая 2,2'-[2-бутен-1,4-диилбис(метилтио)]бис[5,5-диметил-1,3,2-диоксафосфоринан]-2,2'-дисульфид и полистирол. Смесь компаундировали в расплаве с полистиролом, используя конический двушнековый экструдер Haake RHEOCORD™ 90, снабженный скручивающей головкой. Экструдер имел три температурные зоны, работавшие при температурах, установленных на 135°C, 170°C и 180°C; температура сопла головки была установлена на 180°С. Экструдированные материалы охлаждали в водяной бане и разрезали на гранулы длиной приблизительно 5 мм. Эти гранулы преобразовывали в пенообразный материал, используя последовательно 25-мм одношнековый экструдер с тремя нагревательными зонами, отделением для смешивания со вспенивающим средством, отделение для охлаждения и регулируемое 1,5-мм щелевое сопло. Три нагревательные зоны работали при температурах, установленных на 115°C, 150°C и 180°C, зона смешивания работала при температуре, установленной на 200°C. Диоксид углерода (4,5 части по массе на 100 частей по массе объединенной массы гранулированного концентрата и дополнительного гранулированного полистирола) вводили в отделение смешивания со вспенивающим средством, применяя два различных шприцевых насоса RUSKA™ (Chandler Engineering Co.). Гранулы концентрата и гранулы дополнительного полистирола смешивали в сухом виде с 0,05 масс.%, в расчете на массу сухой смеси, стеарата бария, применявшегося в качестве шнековой смазки. Соотношение гранул концентрата и гранул дополнительного полистирола выбирали таким образом, чтобы конечная концентрация огнезащитной добавки составляла 4,2 масс.%. Сухую смесь добавляли в загрузочную воронку экструдера и вводили при скорости 2,3 кг/ч. В отделении смешивания поддерживали давление выше 1500 psi (10,4 МПа) для получения однородно перемешанного полимерного геля и для образования пены с однородным сечением. Холодильники понижали температуру вспениваемого геля до 120-130°С. Отверстие сопла регулировали таким образом, чтобы поддерживать противодавление по меньшей мере 1000 psi (6,9 МПа). Вспениваемый гель расширялся при выходе из сопла с образованием пенополистирола с объемной плотностью ~2,5 pcf (~40 кг/м3). LOI для этой пены составлял 24,7%, и FP-7 равнялось 4,9 с.
Пример 2
Смесь N,N-диэтилэтанаминия, 5,5-диметил-1,3,2-диоксафосфоринан-2-тиолат-2-оксида (7,5 г, 27 ммоль) и 1,4-дибромбутена (2,84 г, 13,2 ммоль) диспергировали в 50 мл этанола и кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Полученный остаток растворяли в метиленхлориде (100 мл), промывали водой (40 мл), сушили и концентрировали, получая 3,60 г (66%) белого твердого вещества, 2,2'-[2-бутен-1,4-диилбис(метилтио)]бис[5,5-диметил-1,3,2-диоксафосфоринан]-2,2'-диоксида, имеющего структуру:

Значение 5% WLT для этого материала составляло 255°C. Пластины, изготовленные из смеси 4% продукта в 96% полистирола, имели LOI, равный 22%, и значение FP-7, равное 5,7 с.
Пример 3
К перемешиваемому раствору аммонийной соли О,О-диэтилового сложного эфира дитиофосфорной кислоты (15,8 г, 78 ммоль) в этаноле (130 мл) при 80°C порциями добавляли 1,4-дибром-2-бутен (7,55 г, 35 ммоль). Полученную смесь охлаждали, разбавляли водой (150 мл) и экстрагировали метиленхлоридом (3 × 100 мл). Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая 15 г (99%) O,O'-диэтилового сложного эфира S-[4-(диэтокси-тиофосфорилсульфанил)-бут-2-енил]дитиофосфорной кислоты, имеющего структуру:

Пример 4
К перемешиваемому раствору 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (8,0 г, 40 ммоль) в толуоле (70 мл) добавляли триэтиламин (4,0 г, 40 ммоль). Смесь нагревали до 45°C. К полученной смеси добавляли о-ксилилдихлорид (3,51 г, 20 ммоль) и затем смесь нагревали при кипячении с обратным холодильником в течение 1 часа. Раствор промывали насыщенным водным раствором бикарбоната натрия (50 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая белое твердое вещество. Неочищенный продукт диспергировали в этаноле (40 мл) и фильтровали, получая 7,8 г (78%) белого твердого вещества, 2,2'-[1,2-фениленбис(метилтио)]бис[5,5-диметил-1,3,2-диоксафосфоринан]-2,2'-дисульфида, имеющего структуру:
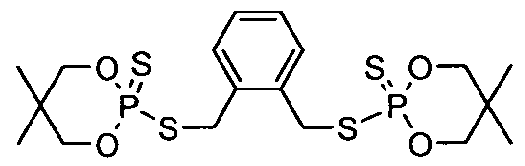
Значение 5% WLT для этого материала составляло 240°C. Протонный,13C и31P ЯМР этого образца показывали следующие пики:
1H ЯМР (CDCl3) δ: 7,40 (м, 2H), 7,25 (м, 2H), 4,32 (д, J=12 Гц, 4H), 4,11 (м, 4H), 3,88 (м, 4H), 1,24 (с, 6H), 0,86 (с, 6H).
13C ЯМР (CDCl3) δ: 135,22, 135,12, 131,20, 128,76, 77,75, 77,64, 34,57, 34,54, 32,72, 32,64, 22,34, 22,14.
31P ЯМР (CDCl3) δ: 87,49.
Пластины, изготовленные из смеси 3% продукта в 97% полистирола, имели LOI, равный 23%, и значение FP-7, равное 3,5 с. Полистирольная пена, полученная из такой же смеси, демонстрирует LOI, равный 23,3%, и значение FP-7, равное 5,3 с.
Пример 5
Смесь N,N-диэтилэтанаминия, 5,5-диметил-1,3,2-диоксафосфоринан-2-тиолат-2-оксида (6,2 г, 22 ммоль) и о-ксилилдихлорида (1,94 г, 11 ммоль) диспергировали в 50 мл этанола и кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Полученный остаток растворяли в метиленхлориде (100 мл), промывали водой (40 мл), сушили и концентрировали, получая 3,6 г (70%) белого твердого вещества, 2,2'-[1,2-фениленбис(метилтио)]бис[5,5-диметил-1,3,2-диоксафосфоринан]-2,2'-диоксида, имеющего структуру:

Значение 5% WLT для этого материала составляет 247°C. Пластины, изготовленные из смеси 2,5% продукта в 97,5% полистирола, имели LOI, равный 21,5%, и значение FP-7, равное 11,4 с.
Пример 6
Соль О,О-диэтилдитиофосфат аммония (14,13 г, 69,50 ммоль) отвешивали в химический стакан и затем растворяли в этаноле (130 мл). Затем стакан помещали в горячую водяную баню (80°C) и включали перемешивание. Когда содержимое стакана достигало 80°С, порциями добавляли α,α'-дихлор-о-ксилол (5,53 г, 31,59 ммоль). Реакцию перемешивали при 80°C в течение 3 часов, по истечение которых в реакционном стакане накапливался осажденный хлорид аммония. Содержимое стакана выливали в отдельную воронку и добавляли деионизованную воду для растворения хлорида аммония. Для экстрагирования продукта, S,S'-(1,2-фенилендиметилен)-О,О,О',О'-тетраэтилфосфородитиоата, из водно-этанольной фазы применяли метиленхлорид (3 раза). Отделенную органическую фазу сушили над безводным MgSO4. Метиленхлорид отфильтровывали от MgSO4 и выпаривали в роторном испарителе, оставляя масло. Затем масло помещали в вакуум на несколько часов для удаления всего оставшегося этанола. После стояния масла в течение нескольких дней в колбе образовывались кристаллы S,S'-(1,2-фенилендиметилен)-О,О,О',О'-тетраэтилфосфордитиоата. Эти кристаллы отделяли; было найдено, что они имели точку плавления при 33-34,5°C. Продукт имел 5% WLT при 225°C. Идеализированная схема реакции представлена следующим образом:

Пример 7
К перемешиваемому раствору 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (9,70 г, 48 ммоль) в толуоле (110 мл) добавляли триэтиламин (4,80 г, 48 ммоль). Смесь нагревали до 45°C. К полученной смеси добавляли 1,2,4,6-тетра(бромметил)бензол (5,0 г, 11 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем толуольный раствор фильтровали и осадок диспергировали в насыщенном водном растворе бикарбоната натрия (100 мл). Осадок отфильтровывали и сушили, получая белое твердое вещество, 2,2',2",2'"-[1,2,4,6-фенилентетра(метилтио)]тетра[5,5-диметил-1,3,2-диоксафосфоринан]-2,2',2",2"'-сульфид. Выход 9,4 г (93%). Структура продукта представлена следующим образом:

Значение 5% WLT для этого материала составляет 281°C. Пластины, изготовленные из смеси 2,8% продукта в 97,2% полистирола, имели LOI, равный 24,3%, и значение FP-7, равное 5,6 с.
Пример 8
К перемешиваемому раствору 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (8,19 г, 41 ммоль) в толуоле (110 мл) добавляли триэтиламин (4,2 г, 41 ммоль). Смесь нагревали до 45°C. К полученной смеси добавляли 1,3,5-трис(бромметил)-2,4,6-триметилбензол (5,0 г, 13 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем раствор разбавляли метиленхлоридом (150 мл), промывали насыщенным водным раствором бикарбоната натрия (100 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая белое твердое вещество. Неочищенный продукт перекристаллизовывали из ацетонитрила, получая 8,0 г (85%) белого твердого вещества, 2,2',2"-[2,4,6-триметил-1,3,5-фенилентрис(метилтио)]трис[5,5-диметил-1,3,2-диоксафосфоринан]-2,2',2"-дисульфида. Продукт имеет следующую структуру:

Значение 5% WLT для этого материала составляет 283°C. Пластины, изготовленные из смеси 3,1% продукта в 96,9% полистирола, имели LOI, равный 24,2%, и значение FP-7, равное 2,8 с. Полистирольная пена (плотность 2,54 pcf, ~40 кг/м3), полученная из такой же смеси, демонстрировала LOI, равный 27%, и значение FP-7, равное 1,1 с.
Пример 9
Эпоксидную новолачную смолу с объявленным Mn, равным 570, содержавшую приблизительно 3,6 эпоксидных единиц на одну молекулу, (10,4 г) растворяли в 50 мл толуола при перемешивании. К этому раствору добавляли 11,2 г 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфида вместе с дополнительными 40 мл толуола. Смесь перемешивали в атмосфере азота. Спустя 30 минут добавляли 50 мл метиленхлорида с образованием однородной смеси. После перемешивания в течение 18 часов при комнатной температуре продукт получали осаждением в 600 мл гексана. Продукт сушили в течение ночи в вакуумном сушильном шкафу при 70°С. Идеализированная схема реакции представлена следующим образом:

5% WLT для этого материала составляет 239°C.
Пример 10
Ненасыщенный сложный полиэфир получали из циклогександиметанола (смесь 1,4- и 1,3-изомеров, 50/50), диметилмалеата и изофталевой кислоты. Молярное отношение малеат/изофталат составляло 48:52, среднемассовая молекулярная масса ненасыщенного сложного полиэфира (по данным гельпроникающей хроматографии, относительно полистирола) равнялась 2620, и его температура стеклования (Tg) составляла 20°С. Ненасыщенный сложный полиэфир (30,0 г) и безводный пиридин (4 мл) растворяли в 100 мл метиленхлорида и к раствору добавляли терефталоилхлорид (4,5 г). После перемешивания в атмосфере азота в течение 1 часа добавляли метанол (5 мл). Раствор полимера промывали 100 мл 1,0 н HCl и продукт выделяли осаждением в метаноле (1 л). Продукт сушили в течение ночи в вакуумном сушильном шкафу при 50°С. Полученный ненасыщенный сложный полиэфир (15,0 г) и 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфид (8,0 г, 40 ммоль) растворяли в 20 мл 1,2-дихлорэтана и раствор кипятили с обратным холодильником в течение 19 часов. Раствор разбавляли добавлением 75 мл 1,2-дихлорэтана и продукт выделяли осаждением в 500 мл метанола. Продукт сушили в течение ночи в вакуумном сушильном шкафу при 50°С. Среднемассовая молекулярная масса продукта равнялась 5620. Его Tgсоставляла 50°C. Значение 5% WLT этого продукта равнялось 276°C. Идеализированная структура повторяющихся звеньев этого полимера представлена следующим образом:

Пластины, изготовленные из смеси 19% продукта в 81% полистирола, имели LOI, равный 24,3%, и значение FP-7, равное 1,3.
Пример 11
В 500-мл трехгорлую круглодонную колбу, снабженную мешалкой, обратным холодильником, подачей азота и капельной воронкой, добавляли 38,18 г (0,195 моль) 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфида и 60 мл толуола, образуя белую суспензию. Затем колбу нагревали до 85°C, образуя раствор. Затем к нагретому раствору по каплям в течение 40 минут добавляли стирол-бутадиен-стирольный (SBS) триблок-сополимер (10 г, 0,097 моль), растворенный в 80 мл толуола при комнатной температуре. SBS-сополимер, применявшийся в этом примере, содержал центральный полибутадиеновый блок, имевший в среднем 53 мономерных звена, из которых примерно 22% были 1,4-бутадиеновыми единицами и 78% были 1,2-бутадиеновыми единицами. В среднем, концевые полистирольные блоки были длиной в 23-24 мономерных звена. Затем реакцию перемешивали в атмосфере азота в течение 68 часов при 85°C. После этого реакционный раствор охлаждали, разбавляли 200 мл толуола и промывали два раза водным КОН и один раз водой. Затем раствор полимера осаждали в метаноле и сушили в течение 5 часов в вакуумном сушильном шкафу при 40°С. Полимер повторно растворяли в 200 мл толуола, дважды промывали водой, сушили над MgSO4, второй раз осаждали в 2 л метанола и сушили в течение ночи в вакуумном сушильном шкафу при 40°С. Собирали 19,36 г белого порошка полимера (выход 67,12%). Идеализированная схема реакции представлена следующим образом:

Протонный ЯМР в CDCl3 показал, что 5% алифатических двойных связей исходного полимера не прореагировали. Анализ с помощью гельпроникающей хроматографии в ТГФ в сравнении с полистирольными стандартами показал, что произошло связывание небольшого количества полимера, поскольку продукт имеет Mn, равный 128560, и Mw, равный 147330.
Значение 5% WLT этого продукта составляло 242°C. Пластины, изготовленные из смеси 3,6% продукта в 96,4% полистирола, имели LOI, равный 24,2%, и значение FP-7, равное 4,2 с.
Пример 12
Фосфорно-серные группы вводили в SB-диблок-сополимер способом, аналогичным описанному в Примере 11. В 500-мл трехгорлую круглодонную колбу, снабженную мешалкой, обратным холодильником с подачей азота и капельной воронкой, добавляли 27,85 г (0,14 моль) 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфида и 45 мл толуола (белая суспензия). Реакционную смесь погружали в масляную баню, установленную на 85°С, и 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфид растворяли в толуоле. Затем к нагретому раствору добавляли по каплям в течение 35 минут стирол-бутадиеновый диблок-сополимер (10 г полимера, 0,07 моль полибутадиенового блока), растворенный в 80 мл толуола при комнатной температуре. Реакции давали возможность нагреться и смесь перемешивали в атмосфере азота в течение 70 часов. Реакционный раствор охлаждали, разбавляли 200 мл толуола и промывали два раза водным КОН и один раз водой. Полимер осаждали в 2 л метанола и сушили в течение ночи в вакууме при 70°С. Полимер повторно растворяли в 250 мл толуола, сушили над MgSO4, фильтровали, осаждали в 2 л метанола и сушили в течение ночи в вакуумном сушильном шкафу при 70°С. Собирали 18,13 г белого порошка полимера (выход 76%).
SB-диблок-сополимер в данном примере имеет полибутадиеновый блок со средней длиной в 38 мономерных единиц. Примерно 29% бутадиеновых единиц составляют 1,4-звенья. Полистирольный блок имеет длину примерно 62 единицы. Продукт представлен идеализированной структурой, которая не отражает 1,2- и 1,4-бутадиеновые структуры в продукте:
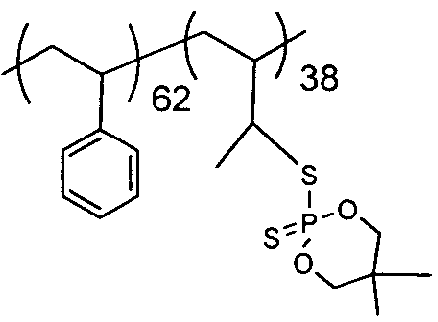
Температура 5% WLT для этого продукта составляет 260°C. Пластины, изготовленные из смеси 8,4% продукта в 91,6% полистирола, имели LOI, равный 25%, и значение FP-7, равное 1,3 с.
Пример 13
В 500-мл трехгорлую круглодонную колбу, снабженную мешалкой, обратным холодильником с подачей азота и капельной воронкой, добавляли 19,82 г (0,10 моль) 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфида и 45 мл толуола с образованием белой суспензии. К этой суспензии добавляли триэтиламин (10,12 г, 0,10 моль) и суспензию нагревали до 45°С для образования раствора. Затем к нагретому раствору добавляли по каплям поли(винилбензилхлорид) (15 г, 0,098 моль), растворенный в 80 мл толуола при комнатной температуре. После завершения добавления полимера реакционную смесь нагревали при кипячении с обратным холодильником в течение 100 минут. Реакционный раствор охлаждали, разбавляли 100 мл хлороформа и промывали четыре раза 300 мл воды. Затем раствор полимера сушили над MgSO4, фильтровали, концентрировали и осаждали в 2 л метанола. Полученный белый порошок полимера собирали фильтрованием и сушили в течение ночи в вакуумном сушильном шкафу при 70°С, получая 27,2 г продукта. Идеализированная схема реакции представлена следующим образом:

Продукт имел Mn, равный 51859, Mw, равный 120880, и PDI, равный 2,33, измеренные с помощью гельпроникающей хроматографии в ТГФ против полистирольных стандартов. Его 5% WLT составляла 292°C. Пластины, изготовленные из смеси 3,8% продукта в 96,2% полистирола, имели LOI, равный 22%, и значение FP-7, равное 3,8.
Пример 14
В 500-мл трехгорлую круглодонную колбу, снабженную мешалкой, обратным холодильником с подачей азота и капельной воронкой, добавляли 41,82 г (0,21 моль) 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфида и 60 мл толуола с образованием белой суспензии. Суспензию нагревали до 85°С для образования раствора. Затем к нагретому раствору по каплям добавляли в течение 40 минут стирол-бутадиен-стирольный (SBS) триблок-сополимер (10 г, 0,105 моль), растворенный в 80 мл толуола при комнатной температуре. 10% бутадиеновых единиц этого полимера были 1,2-бутадиеновыми единицами, и 90% были 1,4-бутадиеновыми единицами. Реакционную смесь перемешивали в атмосфере азота в течение 71 часа при 85°С. Затем реакционный раствор охлаждали, разбавляли 400 мл толуола и промывали два раза водным КОН и один раз водой. После этого раствор полимера сушили над MgSO4, осаждали в 2 л метанола и сушили в течение ночи в вакуумном сушильном шкафу при 40°C. Полимерный продукт (23 г) растворяли в 1 л тетрагидрофурана (THF), получая мутный белый раствор, который фильтровали через 0,45-мкм фильтр HVHP под давлением воздуха 10-20 psi (0,7-1,4 атм). Чистый фильтрат полимера осаждали второй раз в 2 л метанола. Белый полимерный продукт собирали фильтрованием и сушили в течение ночи в вакуумном сушильном шкафу при 40°C. Собирали 13,4 г белого порошка полимера (выход 43,5%). Идеализированная схема реакции представлена следующим образом:

Протонный ЯМР в CDCl3 показал, что 11,7% алифатических углерод-углеродных двойных связей в первоначальном полимере остались непрореагировавшими. Анализ с помощью гельпроникающей хроматографии в ТГФ против полистирольных стандартов показал, что произошло связывание небольшого количества полимера. Продукт имел Mn, равный 124860, Mw, равный 137030, и полидисперсность, равную 1,097. Значение 5% WLT для этого продукта составляло 244°C. Пластины, изготовленные из смеси 3,6% продукта в 96,4% полистирола, имели LOI, равный 22,3%, и значение FP-7, равное 4,2 с.
Пример 15
В 250-мл трехгорлую круглодонную колбу, снабженную мешалкой, обратным холодильником с подачей азота и капельной воронкой, добавляли 8,36 г (0,042 моль) 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфида, 3 г стирол-бутадиен-стирольного (SBS) триблок-сополимера (0,021 моль полибутадиенового блока) и 40 мл толуола с образованием белой суспензии. Реакционную смесь погружали в масляную баню, установленную на 110°С, и все твердые вещества растворяли в толуоле. Реакционной смеси давали возможность нагреться и затем ее перемешивали в атмосфере азота в течение 69 часов. Реакционный раствор охлаждали до 40°С и разбавляли 50 мл толуола. Непосредственно в неочищенный раствор добавляли триэтиламин (2,98 мл, 0,021 моль) и реакции давали возможность перемешиваться в атмосфере азота при 40°С в течение 1 часа, в течение которого образовывался осадок. Неочищенную смесь пропускали через слой диоксида кремния и фильтрат полимера концентрировали в роторном испарителе. Затем полимерный раствор осаждали в 1 л метанола и сушили в течение ночи в вакууме при 70°C. Собирали 5,78 г белого порошка полимера (выход 80,5%).
Идеализированная схема реакции представлена следующим образом:

Значение 5% WLT для этого материала составляло 248°C. Пластины, изготовленные из смеси 7,8% продукта в 92,2% полистирола, имели LOI, равный 24,5%, и значение FP-7, равное 0,9 с.
Пример 16
К перемешиваемому раствору триэтиламмонийной соли 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (18,77 г, 63 ммоль) в 150 мл пиридина добавляли трисхлорметилфосфиноксид (3,50 г, 18 ммоль). Смесь нагревали до 105°C в течение 2 часов. Полученный темно-желтый раствор разбавляли метиленхлоридом (300 мл), промывали водой (1 л), разбавленным раствором HCl (1 M, 250 мл) и насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая светло-желтое твердое вещество. Полученный неочищенный материал сначала очищали, диспергируя в теплом ацетонитриле и охлаждая в ледяной бане с последующим фильтрованием, получая бледно-желтое твердое вещество. Перекристаллизация из метанола давала 3,96 г (выход 33%) белого продукта, трис[2-метилентио-(5,5-диметил-1,3,2-диоксафосфоринан-2-тиоксо)фосфиноксида, который представлен структурой:

Значение 5% WLT для продукта составляло 243°C. Пластины, изготовленные из смеси 2,7% продукта в 97,3% полистирола, имели LOI, равный 22,8%, и значение FP-7, равное 4,4 с.
Пример 17
Смесь цианурхлорида (1,84 г, 10 ммоль) и аммонийной соли 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (7,10 г, 33 ммоль) в 75 мл ацетонитрила кипятили с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Полученное твердое вещество разбавляли 150 мл метиленхлорида и промывали водным насыщенным раствором бикарбоната натрия (100 мл). Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая желтое твердое вещество. Этот материал очищали, растворяя в метиленхлориде (100 мл), фильтруя через силикагель и удаляя растворитель при пониженном давлении, получая 4,60 г (67%) белого твердого вещества, 2,2',2"-[s-триазин-2,4,6-трис(тио)]трис[(5,5-диметил-1,3,2-диоксафосфоринан)-2,2',2"-сульфида], имеющего структуру:

Значение 5% WLT для продукта составляло 249°C. Пластины, изготовленные из смеси 2,7% продукта в 97,3% полистирола, имели LOI, равный 23,8%, и значение FP-7, равное 4 с.
Пример 18
Серу (3,52 г, 110 ммоль) добавляли порциями к раствору N-бензил-N-5,5-диметил-1,3,2-диоксафосфоринан-2-ил)-5,5-диметил-1,3,2-диоксафосфоринан-2-амина (10,2 г, 27 ммоль) и смеси давали возможность перемешиваться в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Остаток диспергировали в хлороформе (100 мл), фильтровали и фильтрат хранили в морозильной камере в течение ночи. Холодную реакционную смесь опять фильтровали и фильтрат концентрировали, получая белое твердое вещество. Перекристаллизация этого твердого вещества в этаноле давала 4,81 г (40%) белого твердого вещества, N-бензил-N-(5,5-диметил-2-сульфидо-1,3,2-диоксафосфоринан-2-ил)-5,5-диметил-1,3,2-диоксафосфоринан-2-амин-2-сульфида, имеющего структуру:

Значение 5% WLT для этого материала составляло 202°C. Пластины, изготовленные из смеси 4,8% продукта в 95,2% полистирола, имели LOI, равный 23, и значение FP-7, равное 1,1 с.
Пример 19
Смесь неопентилгликоля (13,8 г, 132 ммоль) и о-ксилилтетрахлортиофосфата (24,7 г, 66 ммоль) диспергировали в хлорбензоле (250 мл), содержавшем пиридин (1 мл), и нагревали до 115°C в течение 10 часов. Аликвоту проверили посредством31P ЯМР и обнаружили, что смесь все еще содержала исходные материалы. Реакционную смесь нагревали и перемешивали в течение следующих 15 часов. Реакционную смесь концентрировали при пониженном давлении, получая липкое твердое вещество коричневого цвета. Это твердое вещество растворяли в 120 мл смеси этилацетата с гексаном (1:1) и хроматографировали на силикагеле, получая желтовато-коричневое твердое вещество (20,5 г). Это твердое вещество промывали смесью этилацетата с гексаном (1:3, 50 мл), получая 7 г светло-серого твердого вещества. Другие 2 г материала получали, концентрируя фильтрат и промывая материал смесью этилацетата с гексаном. Объединенный выход составлял 32% [1,2-фениленбис(метилен)]бис[5,5-диметил[1,3,2]диоксафосфоринан]2,2'-дисульфида, имеющего структуру:

Значение 5% WLT для этого материала составляло 284°C. Пластины, изготовленные из смеси 5,1% продукта в 94,9% полистирола, имели LOI, равный 22,8%, и значение FP-7, равное 1,2 с.
Пример 20
Смесь 1,4-дибромбутана (2,42 г, 11 ммоль) и аммонийной соли 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (6,50 г, 30 ммоль) в 50 мл этанола кипятили с обратным холодильником в течение 4 часов. Затем реакционную смесь охлаждали, разбавляли 100 мл хлороформа и промывали водным насыщенным раствором бикарбоната натрия (100 мл). Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая 4,71 г (93%) белого твердого вещества, 2,2'-[1,4-бутилбис(метилтио)]бис[5,5-диметил-1,3,2-диоксафосфоринан]-2,2'-дисульфида. Продукт имеет следующую структуру:
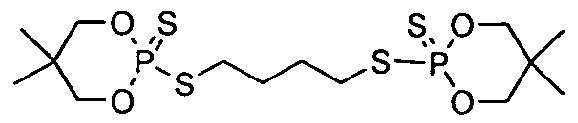
Значение 5% WLT для этого материала составляло 244°C. Пластины, изготовленные из смеси 2,9% продукта в 97,1% полистирола, имели LOI, равный 22,6, и значение FP-7, равное 7,1 с.
Пример 21
Бицикло[2,2,1]2,5-гептадиен (0,92 г, 10 ммоль) добавляли к перемешиваемому раствору 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (4,0 г, 20 ммоль) в 40 мл толуола. В результате этого происходила экзотермическая реакция, повышавшая температуру реакционной смеси до 56°С с образованием белого осадка. Реакционную смесь дополнительно нагревали до 70°С в течение часа и затем ей давали охлаждаться до комнатной температуры. Фильтрование этой смеси давало 4,5 г продукта, 2,2'-[бицикло[2,2,1]гептан-2,5-диилбис(тио)]бис[5,5-диметил-1,3,2-диоксафосфоринан]-2,2'-дисульфида. С применением ЖХ/МС данное соединение было характеризовано как бис-аддукт, имеющий структуру:
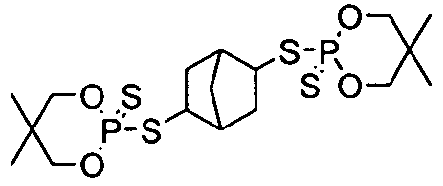
Значение 5% WLT для этого материала составляло 264°C. Пластины, изготовленные из смеси 3% продукта в 97% полистирола, имели LOI, равный 23%, и значение FP-7, равное 3,9 с.
Пример 22
Смесь триакрилата пентаэритрита и тетраакрилата пентаэритрита, имеющую среднюю функциональность акрилата, равную 3,4, и эквивалентную массу, равную 89,34 г/эквивалент, добавляли вместе со 100 мл метиленхлорида в 500-мл одногорлую круглодонную колбу, снабженную магнитной мешалкой и подачей азота. Добавляли 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиол (10,96 г, 0,055 моль) и полученному гомогенному раствору давали возможность перемешиваться в течение 48 часов. Дополнительно добавляли 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиол (1,0 г, 0,005 моль) и смеси давали возможность перемешиваться в течение следующих 48 часов. В этой точке ЯМР-анализ показал, что прореагировало 93% акрилатных групп. Растворитель удаляли из реакционной смеси в роторном испарителе, нагретом до 80°С. Оставшийся материал помещали в вакуумный сушильный шкаф на ~16 часов при 80°С. Получали 13,6 г (выход выделенного вещества составлял 85%) прозрачного, бесцветного как вода, стекловидного материала. Идеализированная схема реакции (с образованием четырехчленного аддукта) представлена следующим образом:

Значение 5% WLT для этого материала составляло 274°C. Пластины, изготовленные из смеси 3,5% продукта в 96,5% полистирола, имели LOI, равный 23,3%, и значение FP-7, равное 3,5 с.
Пример 23
В 250-мл трехгорлую круглодонную колбу добавляли диэтилмалеат (0,1 моль, 17,2 г). При перемешивании добавляли 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиол (0,1 моль, 19,8 г) и полученную смесь нагревали в течение 2 часов при 100°C. Идеализированная схема реакции представлена следующим образом:

Значение 5% WLT для этого продукта составляло 218°C. Пластины, изготовленные из смеси 4,6% продукта в 95,4% полистирола, имели LOI, равный 23,2%, и значение FP-7, равное 0,2 c.
Пример 24
Перемешиваемый раствор 1,9-декадиена (5,0 г, 36,1 ммоль) и 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (14,33 г, 72,3 ммоль) в толуоле (75 мл) нагревали до 80°C в течение 6 часов.31P-ЯМР-анализ аликвоты показал присутствие исходного тиола, а также моно- и бис-аддуктов. Смесь концентрировали до половины ее объема и нагревали в течение следующих 6 часов при 80°C. Смесь разбавляли метиленхлоридом, экстрагировали водным насыщенным бикарбонатом натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая масло, которое медленно затвердевало, давая 18,5 г (96%) 2,2'-[декан-2,9-диилбис(тио)]бис(5,5-диметил-1,3,2-диоксафосфоринан)-2,2'-дисульфида. Продукт имел следующую структуру:

Значение 5% WLT для этого продукта составляло 239°C. Пластины, изготовленные из смеси 6,3% продукта в 93,7% полистирола, имели LOI, равный 24,3%, и значение FP-7, равное 2,6 c.
Пример 25
5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиол (8,0 г, 40,4 ммоль) растворяли в толуоле (100 мл). Добавляли триэтиламин (3,8 г, 40,4 ммоль) и смеси давали возможность перемешиваться в течение 10 минут. Затем добавляли бромдифенилметан (10,5 г, 42,4 ммоль) и реакционную смесь нагревали до 80°C в течение 2 часов. ВЭЖХ-анализ аликвоты показал, что бтльшая часть исходного бромистого соединения переработана. Реакционную смесь разбавляли метиленхлоридом (100 мл) и промывали водным насыщенным раствором бикарбоната натрия (100 мл). Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая белое твердое вещество. Неочищенный материал перекристаллизовывали из толуола. Выход 2-[(дифенилметил)тио]-5,5-диметил-1,3,2-диоксафосфоринан-2-сульфида составлял 13,2 г (95%). Данное соединение имело следующую структуру:

Значение 5% WLT для этого продукта составляло 238°C. Пластины, изготовленные из смеси 8,3% продукта в 91,7% полистирола, имели LOI, равный 26%, и значение FP-7, равное 0,4 c.
Пример 26
N,N-Диэтилэтанаминий-6H-дибенз[c,e][1,2]оксафосфорин-6-меркапто-6-оксид (8,0 г, 22,9 ммоль) растворяли в метиленхлориде (75 мл), содержавшем 1,4-дибромбут-2-ен (2,45 г, 11,5 ммоль), и полученную смесь кипятили с обратным холодильником. После 3 часов кипячения с обратным холодильником бтльшая часть исходного материала была переработана. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия (100 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая 4,6 г (73%) 6,6'-[(2Е)-бут-2-ен-1,4-диилбис(тио)]бис(6H-дибенз[c,e][1,2]оксафосфорин-6,6'-диоксида в виде белого твердого вещества со следующей структурой:

Значение 5% WLT для этого продукта составляло 270°C. Пластины, изготовленные из смеси 6,4% продукта в 93,6% полистирола, имели LOI, равный 24,8%, и значение FP-7, равное 1 c.
Пример 27
К перемешиваемому раствору 1,4-бис[диметил[2-(5-норборнен-2-ил)этил]силил]бензола (5,0 г, 11,5 ммоль) в 40 мл толуола добавляли 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиол (4,56 г, 23 ммоль). Смесь нагревали до 80°C в течение 6 часов. Затем прозрачную реакционную смесь промывали водным раствором бикарбоната натрия (100 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая масло, которое медленно затвердевало, превращаясь в белое твердое вещество (9,2 г, 96%). Структура продукта, 2,2'-{1,4-фениленбис[(диметилсиландиил)этан-2,1-диилбицикло[2,2,1]гептан-6,2-диилтио]}бис(5,5-диметил-1,3,2-диоксафосфоринан)-2,2'-дисульфида, была следующей:

Значение 5% WLT для этого продукта составляло 285°C. Пластины, изготовленные из смеси 4,9% продукта в 95,1% полистирола, имели LOI, равный 21,7%, и значение FP-7, равное 4,4 c.
Пример 28
К перемешиваемому раствору 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (2,06 г, 10 ммоль) в толуоле (40 мл) добавляли триэтиламин (0,10 г, 10 ммоль). Смесь нагревали до 45°С и добавляли 5,5-диметил-2[(4-хлорметилфенил)метил]-1,3,2-диоксафосфоринан-2-оксид (3,00 г, 10 ммоль). Затем смесь нагревали до 90°C в течение 4 часов. Раствор промывали насыщенным водным раствором бикарбоната натрия (50 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая белое твердое вещество, 4,3 г (92%). Продукт, 2-({4-[(5,5-диметил-2-оксидо-1,3,2-диоксафосфоринан-2-ил)метил]бензил}тио)-5,5-диметил-1,3,2-диоксафосфоринан-2-сульфид, имел следующую структуру:
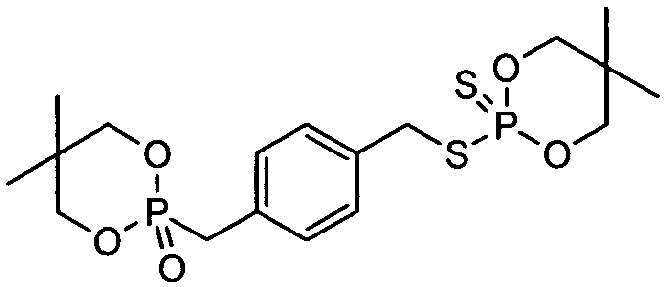
Значение 5% WLT для этого материала составляло 257°C. Пластины, изготовленные из смеси 4,8% продукта в 95,2% полистирола, имели LOI, равный 21,7%, и значение FP-7, равное 2,9 с.
Пример 29
К перемешиваемой суспензии 6Н-дибенз[c,e][1,2]оксафосфорин-6-оксида (10 г, 46,3 ммоль) в 100 мл толуола добавляли по каплям триэтиламин (4,68 г, 46,3 ммоль). Затем небольшими порциями добавляли серу (1,48 г, 46,3 ммоль). Реакционной смеси давали возможность перемешиваться при 45°С в течение 1 часа. К реакционной смеси добавляли о-ксилилдихлорид (4,05 г, 23,1 ммоль) и затем реакционную смесь нагревали до 90°C в течение 5 часов. Реакционную смесь охлаждали и концентрировали при пониженном давлении и остаток разбавляли метиленхлоридом (120 мл). Метиленхлоридный раствор промывали водным раствором бикарбоната натрия (1×100 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая белое твердое вещество. Продукт дополнительно очищали, фильтруя через силикагель с метиленхлоридом и этилацетатом (8:2) в качестве элюента, получая 8,2 г (59%) 6,6'-[1,2-фениленбис(метилентио)]бис(6Н-дибенз[c,e][1,2]оксафосфорин)-6,6'-диоксида, в виде белого твердого вещества со следующей структурой:
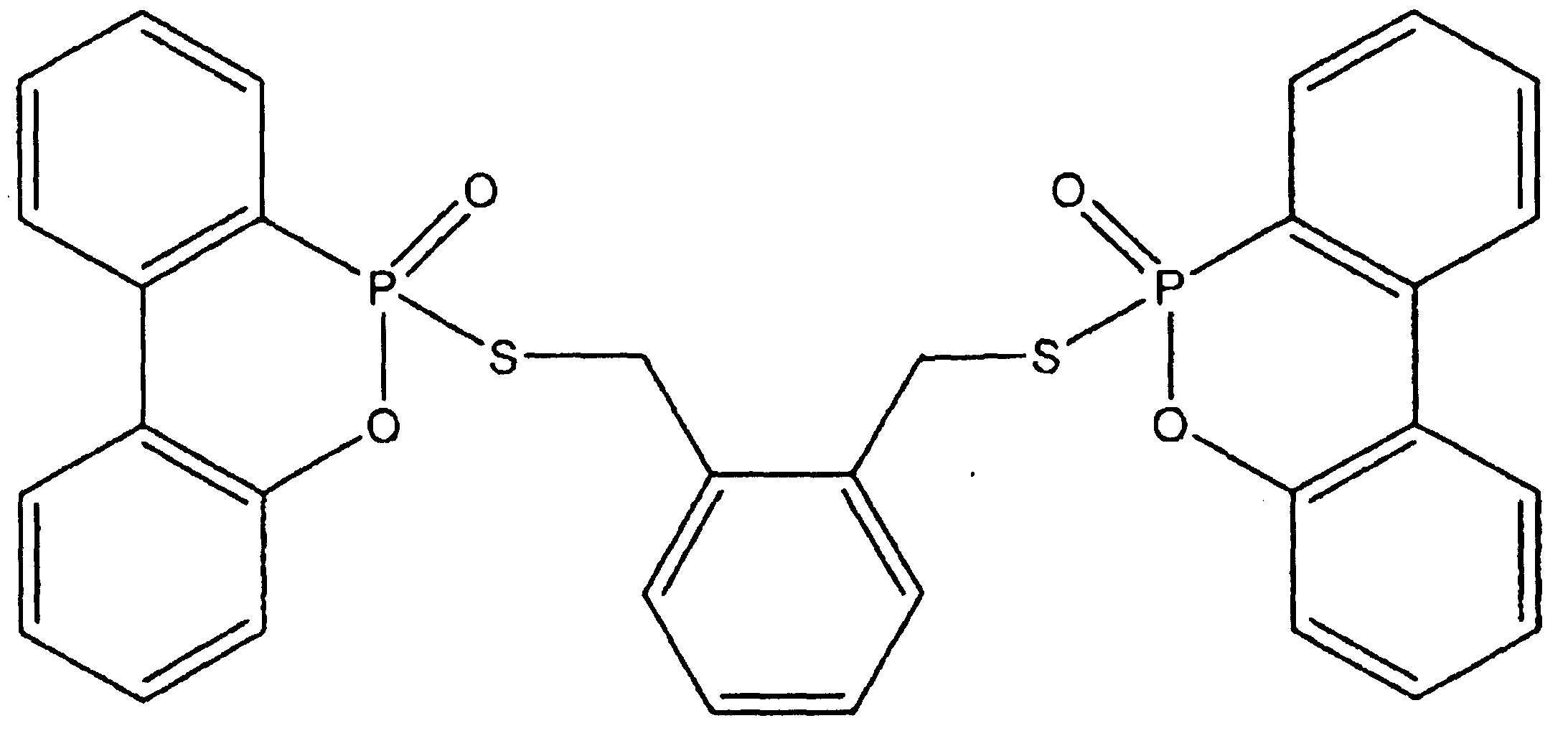
Значение 5% WLT для этого материала составляло 262°C. Пластины, изготовленные из смеси 7% продукта в 93% полистирола, имели LOI, равный 24,8, и значение FP-7, равное 3,2 с.
Пример 30
К перемешиваемой суспензии 6Н-дибенз[c,e][1,2]оксафосфорин-6-оксида (10 г, 46,3 ммоль) в 100 мл толуола добавляли по каплям триэтиламин (4,68 г, 46,3 ммоль), затем небольшими порциями добавляли серу (1,48 г, 46,3 ммоль). Реакционной смеси давали возможность перемешиваться при 45°C в течение 1 часа. К реакционной смеси добавляли 1,3,5-трис(бромметил)-2,4,6-триметилбензол (6,09 г, 15,3 ммоль), после чего смесь нагревали до 90°C в течение 5 часов. Реакционную смесь охлаждали и затем концентрировали при пониженном давлении и остаток разбавляли метиленхлоридом (120 мл). Метиленхлоридный раствор промывали водным раствором бикарбоната натрия (100 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая 13,1 г (95%) продукта, 6,6',6"-[(2,4,6-триметилбензол-1,3,5-триил)трис(метилентио)]трис(6Н-дибензо-[c,e] [1,2]оксафосфорин)-6,6',6"-триоксида, в виде светло-серого твердого вещества. Предполагают следующую структуру:

Значение 5% WLT для этого материала составляло 219°C. Пластины, изготовленные из смеси 6,2% продукта в 93,8% полистирола, имели LOI, равный 24,8%, и значение FP-7, равное 0,1 с.
Пример 31
Тетрааллилпентаэритрит (6,03 г, 20,3 ммоль) (полученный способом согласно Nougier, R. M. and Mchich J., Org. Chem. 1985, 50, 3296-3298. "Alkylation of Pentaerythritol and Trimethylolpropane, Two Very Hydrophilic Polyols, by Phase-Transfer Catalysis" - «Алкилирование пентаэритрита и триметилолпропана, двух очень гидрофильных полиолов, посредством межфазного катализа») и 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиол (19,91 г, 100,6 ммоль) добавляли в 250-мл круглодонную колбу в атмосфере азота. Реакционную смесь нагревали в течение 48 часов, после чего ЯМР-анализ показал полное преобразование аллильных групп исходного материала. Продукт растворяли в смеси 50 мл метиленхлорида и 50 мл эфира и экстрагировали последовательно 50 мл насыщенного NaHCO3, дитионитом (25 мл, 10% водн.) и 20 мл NaHCO3. После каждой экстракции образующуюся эмульсию разрушали добавлением 20 мл насыщенного раствора NaCl в каждую экстракцию. Водный слой декантировали и органическую фазу сушили над безводным MgSO4. Затем раствор фильтровали через слой диоксида кремния (3,1 × 7,5 см) и промывали 50 мл метиленхлорида. Выпаривание в роторном испарителе и сушка в вакууме давали 22 г неочищенного продукта в виде прозрачного масла.1H и31P ЯМР характеризовали продукт как смесь диастереомеров. Реакцию можно схематически представить в следующем виде:

Значение 5% WLT для этого продукта составляло 241°C. Пластины, изготовленные из смеси 4,6% продукта в 95,4% полистирола, имели LOI, равный 23,5%, и значение FP-7, равное 2,0 с.
Пример 32
В 500-мл трехгорлую круглодонную колбу, снабженную мешалкой, обратным холодильником с подачей азота и капельной воронкой, добавляли 76,96 г (0,388 моль) 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфида, 7 г (0,129 моль) полибутадиенового гомополимера, растворенного в 60 мл толуола, и 140 мл толуола. Полибутадиеновый полимер содержал 20% 1,4-бутадиеновых единиц и 80% 1,2-бутадиеновых единиц. Реакционную смесь погружали в масляную баню, установленную на 85°C, и все твердые вещества растворяли в толуоле. Реакционной смеси давали возможность нагреться и перемешиваться в атмосфере азота в течение 75 часов. Затем реакционный раствор охлаждали до 40°C. В неочищенный раствор добавляли триэтиламин (37,35 мл, 0,268 моль) и затем реакционной смеси давали возможность перемешиваться в атмосфере азота при 40°С в течение 1 часа. Образовывался белый осадок. Толуол удаляли из неочищенной смеси в роторном испарителе. ТГФ (200 мл) добавляли непосредственно к белому липкому твердому веществу и смеси давали возможность перемешиваться при комнатной температуре в течение ночи. Белое твердое вещество отфильтровывали от раствора ТГФ и фильтрат осаждали в 5 л метанола. Белый осадок полимера сушили в течение ночи в вакууме при 70°С, повторно растворяли в 100 мл ТГФ и повторно осаждали в 2 л метанола. Полимер собирали фильтрованием и сушили в течение ночи в вакуумном сушильном шкафу при 65°C. Собирали 26,85 г белого порошка полимера (выход 82%).
1H ЯМР в CDCl3 показал, что 8,8% первоначальных углерод-углеродных двойных связей оставались непрореагировавшими: δ 5,46 (винил), 5,18 (винил), 4,25 (2H, неопентил), 3,97 (2H, неопентил), 3,76 (1H), 3,50 (1H), 1,78 (-CH2- главной цепи), 1,51 (-CH2- главной цепи), 1,25 (3H, -CH3), 0,97 (3H, -CH3).31P ЯМР (CDCl3): с, 90,95 м.д.
Идеализированная схема реакции имеет следующий вид:

Значение 5% WLT для этого продукта составляло 252°C. Пластины, изготовленные из смеси 4,6% продукта в 95,4% полистирола, имели LOI, равный 23%, и значение FP-7, равное 2,3 с.
Пример 33
К перемешиваемому раствору гексакис(бромметил)бензола (2,0 г, 3,2 ммоль) и 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиола (3,9 г, 19,8 ммоль) в толуоле (100 мл) добавляли триэтиламин (2,0 г, 19,8 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 6 часов и затем охлаждали и фильтровали. Образовавшийся осадок растворяли в метиленхлориде (100 мл) и промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая 2,2',2",2'",2"",2'""-[бензол-1,2,3,4,5,6-гексаилгексакис(метилентио)]гексакис(5,5-диметил-1,3,2-диоксафосфоринан)-2,2',2",2'",2"",2"'"-гексасульфид в виде белого твердого вещества (4,2 г, 99%). Предполагают следующую структуру продукта:
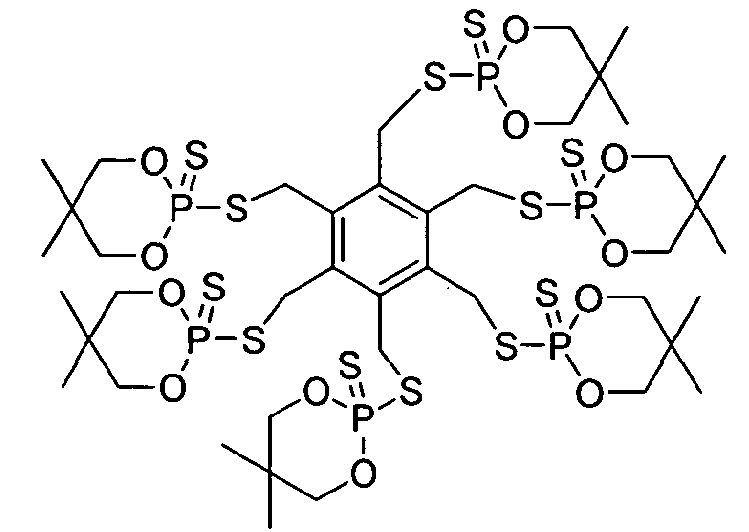
Значение 5% WLT для этого материала составляло 262°C. Пластины, изготовленные из смеси 5,3% продукта в 94,7% полистирола, имели LOI, равный 24,3%, и значение FP-7, равное 1,4 с.
Пример 34
Ненасыщенный сложный полиэфир получали из циклогександиметанола (смесь 1,4- и 1,3-изомеров, 50/50) и диметилфумарата. Среднемассовая молекулярная масса ненасыщенного сложного полиэфира (по данным гельпроникающей хроматографии, относительно полистирола) равнялась 16400, и его температура стеклования (Tg) составляла 16°C. Ненасыщенный сложный полиэфир (10,0 г) и безводный пиридин (2 мл) растворяли в 30 мл метиленхлорида и к раствору добавляли уксусный ангидрид (3,0 г). После перемешивания в атмосфере азота в течение 24 часов раствор полимера промывали 30 мл воды и продукт выделяли осаждением в метаноле (250 мл). Продукт сушили в течение 5 часов в вакуумном сушильном шкафу при 70°C. Полученный ненасыщенный сложный полиэфир (5,0 г) и 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфид (4,4 г, 22 ммоль) растворяли в 10 мл 1,2-дихлорэтана и раствор кипятили с обратным холодильником в течение 23 часов. Раствор разбавляли, добавляя 70 мл 1,2-дихлорэтана, раствор промывали 30 мл воды, содержавшей 1,0 г бикарбоната натрия. Продукт выделяли осаждением в 500 мл метанола. Продукт сушили в течение ночи в вакуумном сушильном шкафу при 50°C. Среднемассовая молекулярная масса продукта равнялась 8800. Его Tg составлял 45°C. Значение 5% WLT для этого продукта составляло 271°C. Идеализированная структура повторяющихся звеньев данного полимера представлена следующим образом:

Пластины, изготовленные из смеси 10% продукта в 90% полистирола, имели LOI, равный 25,0%, и значение FP-7, равное 0,6 с.
Пример 35
Аллиловый простой эфир м-крезолового новолака получали из м-крезолового новолака (со среднемассовой молекулярной массой, равной 1600) и аллилбромида. м-Крезоловый новолак (9,80 г) растворяли в 70 мл N,N-диметилформамида (DMF) и к раствору добавляли гидрид натрия (2,5 г) в течение 30 минут. Затем к этой смеси добавляли (в течение 30 минут) аллилбромид (14,9 г). После перемешивания в атмосфере азота в течение ночи реакционную смесь фильтровали, разбавляли 70 мл толуола и промывали 70 мл воды. Полученный раствор полимера концентрировали и сушили в течение ночи в вакуумном сушильном шкафу при 60°C, получая 13,0 г аллилового простого эфира м-крезолового новолака со среднемассовой молекулярной массой, равной 1650. Аллиловый простой эфир м-крезолового новолака (8,0 г) и 5,5-диметил-2-меркапто-1,3,2-диоксафосфоринан-2-сульфид (14,8 г, 75 ммоль) растворяли в 10 мл толуола и нагревали в течение 18 часов при 100°C. Полученную смесь разбавляли в 70 мл толуола и затем промывали 50 мл воды, содержавшей 4 г бикарбоната натрия. Продукт выделяли, выпаривая толуол, и дополнительно сушили в течение ночи в вакуумном сушильном шкафу при 70°C. Среднемассовая молекулярная масса продукта равнялась 3100. Его Tg составляла 450°C. Значение 5% WLT для этого продукта составляло 277°C. Идеализированная структура повторяющихся единиц данного полимера представлена следующим образом:

Пластины, изготовленные из смеси 9,4% продукта в 90,6% полистирола, имели LOI, равный 24,8%, и значение FP-7, равное 0,2 с.
Пример 36
N,N'-метиленбисакриламид (7,0 г, 0,045 моль) в 70 мл тетрагидрофурана (THF) добавляли в 250-мл трехгорлую круглодонную колбу, снабженную магнитной мешалкой и подачей азота. Добавляли 5,5-диметил-2-тиоксо-[1,3,2]диоксафосфоринан-2-тиол (18,0 г, 0,091 моль) и полученной смеси давали возможность перемешиваться в течение 24 часов. Продукт выделяли, выпаривая THF и затем перекристаллизовывая из 300 мл толуола. Полученный продукт представлял собой кристаллическое белое твердое вещество с точкой плавления при 65°C. Идеализированная структура имела следующий вид:
Значение 5% WLT для этого материала составляло 220°C. Пластины, изготовленные из смеси 6,9% продукта в 93,1% полистирола, имели LOI, равный 24,5%, и значение FP-7, равное 0,8 с.
Пример 37
Триэтиламин (2,02 г, 20 ммоль) добавляли к перемешиваемому раствору 1,3-бис(хлорметилфенил)бензола (3,27 г, 10 ммоль) и 5,5-диметил-1,3,2-диоксафосфоринан-2-тиола (3,96 г, 20 ммоль) в толуоле (70 мл). Смесь нагревали при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали и промывали водным раствором бикарбоната натрия (100 мл), сушили и концентрировали, получая 2,2'-{1,3-фениленбис[(фенилметилен)тио]}бис(5,5-диметил-1,3,2-диоксафосфоринан)-2,2'-дисульфид в виде белого твердого вещества. Выход продукта составлял 4,8 г (74%). Продукт имел следующую структуру:

Значение 5% WLT для этого материала составляло 259°C. Пластины, изготовленные из смеси 8,1% продукта в 91,9% полистирола, имели LOI, равный 25,8%, и значение FP-7, равное 1 с.
Пример 38
К суспензии 2,4,8,10-тетраокса-3,9-дифосфаспиро[5.5]ундекан-3,9-дисульфида (3 г, 11,5 ммоль) в метиленхлориде (50 мл) добавляли триэтиламин (2,33 г, 23 ммоль), затем порциями добавляли серу (0,74 г, 23 ммоль). Смеси давали возможность перемешиваться в течение 1 часа при 40°С. Добавляли бромдифенилметан (5,7 г, 23 ммоль) и смесь нагревали до 45°C в течение 4 часов. Реакционную смесь промывали насыщенным раствором бикарбоната натрия, сушили над безводным MgSO4 и концентрировали при пониженном давлении, получая 5,42 г (72%) продукта в виде белого твердого вещества. Продукт имел следующую структуру:

Значение 5% WLT для этого материала составляло 240°C. Пластины, изготовленные из смеси 8,2% продукта в 91,8% полистирола, имели LOI, равный 26,7%, и значение FP-7, равное 1,4 c.
Реферат
Настоящее изобретение может быть использовано в химии полимеров и относится к фосфорно-серному соединению, представленному структуройи способу получения вспененного полимера, который включает образование расплавленной смеси горючего термопластичного или термореактивного полимера, по меньшей мере, одного вспенивающего средства и указанного фосфорно-серного соединения под давлением с последующим экструдированием расплавленной смеси. Предложена новая эффективная огнезащитная добавка для полимеров и новый эффективный способ получения вспененного полимера. 2 н.п. ф-лы, 38 пр.
Формула


Комментарии