Новые фторалкилзамещенные циклотрисилоксаны, их использование для получения новых полимеров и новые полимеры - RU2230747C2
Код документа: RU2230747C2
Описание
Настоящее изобретение относится к новым фторалкилзамещенным циклотрисилоксанам, к новым гомополимерам и блоксополимерам, полученным из упомянутых циклотрисилоксанов, и к их получению.
Предпосылки изобретения
Публикации и другие материалы, использованные в настоящем документе для разъяснения предпосылок изобретения, и, в частности, случаи приведения дополнительных подробностей в отношении реализации на практике включаются для справки.
Единственным коммерчески доступным фторалкилсилоксаном является поли(трифторпропилметилсилоксан). Его получают из циклотри(трифторпропилметилсилоксана) по механизму анионной или катионной полимеризации с раскрытием цикла. Из мономера чистого цис-изомера получен кристаллический фторалкилметилполисилоксан (Kuo С.-М., Saam J.C., Taylor R.B., Polymer Int., (1994), 33, 187; Battjes, К.Р., Kuo, С.-Н., Miller, R.L.; Saam, J.C., Macromolecules, (1995) 28, 790). Предшественником циклотри-(трифторпропилметилсилоксана) является трифторпропилметилдихлорсилан, обычно получаемый в результате проведения катализируемой платиной H2PtCl6) реакции гидросилилирования между метилдихлорсиланом и 3,3,3-трифторпропеном (Tarrant Р.Т., Dyckes G.W., Dunmirе R., Butler G.B., J. Am. Cheim. Soc., (1957) 79, 6536). Реакцию также использовали для получения бис(трифторпропил)дихлорсилана с использованием дихлорсилана вместо метилдихлорсилана. В отличие от нефторированных алкенов (этен, пропен), которые при получении двузамещенного кремния дают хорошие выходы в диапазоне от 60 до 79% (Petrov A.D., Ponomarenko V.A., Odabashyan G.V., Izv. Akad. Nauk USSR, (1959), 443), 3,3,3-трифторпропен дает только низкие выходы, а именно 26-36% (Petrov A.D., Ponomarenko V.A.; Odabashyan G.V., Izv. Akad. Nauk SSSR, (1962), 174). Бис(1Н,1Н,2Н-перфторгексил)дихлорсилоксан получали с общим выходом 42%, используя двухстадийный способ, где для проведения реакции гидросилилирования между дихлорсиланом и 1Н,1Н,2Н-перфторгексаном использовали как Со2(СО)8, так и цикловинилметилсилоксановый комплекс платины (Out G.J.J. Klok H.-A., Schwegler L., Frey H., Moller M., Macromol. Chem. Phys., (1995) 196, 185). Высокие выходы были получены для радикальной реакции, катализируемой УФ-светом (Geyer A.M., Haszeldine R.N., Leedham К., Marklow R.J., J. Chem. Soc., (1957), 4472; McBee E.T., Roberts C.W., Judd G.F., Chao T.S., J. Am. Chem. Soc., (1955) 77, 1292; Haszeldine R.N., Brit. 895, 592, 05-02-1962).
Из метилдихлорсилана и пентафторстирола с выходом 70% получали 3-(пентафторфенил)этилметилдихлорсилан (Boutevin В., Pietrasanta V., Youssef В., J. Fluor. Chem., (1986) 31, 57). В результате проведения реакции гидросилилирования между пентафторстиролом и циклическими соединениями, содержащими диметилсилоксильные и метилсилоксильные звенья, Matsui et al. получили циклические соединения, содержащие как диметилсилоксильные, так и 3-(пентафторфенил)этилметилсилоксановке звенья (Nagase Y., Ochiai J., Matsui К., Polymer, (1988) 29, 740). Полимеризацию таких циклических соединений катализировали гидроксидом тетраметиламмония, полимер Mw/Mn = 38000/21000 г/моль. См. схему 1.
Matsui, проведя совместный гидролиз в простом эфире, получил также из диметилдихлорсилана и 3,3, 3-трифторпропилметилдихлорсилана или 1Н,1Н,2Н,2Н-перфтордецилметилдихлорсилана гетероциклические соединения. Полимеризацию проводили так же, как и в предыдущем случае.
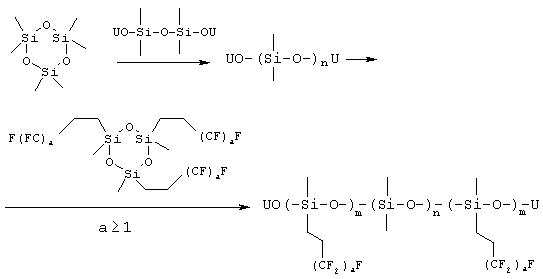
В публикации европейского патента ЕР 0563902 автора Dow Corning (Kobayashi, Н., ЕР 0563902 A1, 03-30-1993) описывается способ получения блоксополимеров из циклических мономеров D3 (т.е. циклотрисилоксана) и типа D3, содержащих 1Н,1Н,2Н,2Н-перфторалкилметилсилоксановые группы и/или винилметилсилоксановые группы. См. схему 2.
Патент США 4814418 (Miyake Н.; Shin-ya S.; Furukawa Y., US 4814418, 03-21-1989) описывает сходную методику, но вместо последовательного присоединения мономеров авторы присоединяли их одновременно, что приводило к получению неблочного сополимера. Этот патент охватывает использование циклических тримеров {[F(CF2)aC2H4](СН3)SiO}3 и {[H(CF2)aC2H4](СН3)SiO}3 (а=1...16) с или без Dx (х=3...6) и/или D (x=3...6, Vi = алкенильная группа). В патенте также заявлены более высокомолекулярные полимеры, получаемые с использованием комбинации межфазного катализатора/инициатора вместо одного только инициатора. Межфазным катализатором является соль четвертичного аммония или фосфония, и его можно описать формулами R4N+X- или R4P+ X-, где R представляет собой алкильную, циклоалкильную или фенильную группу, X- представляет собой Сl- или Вr-.
Схема 1
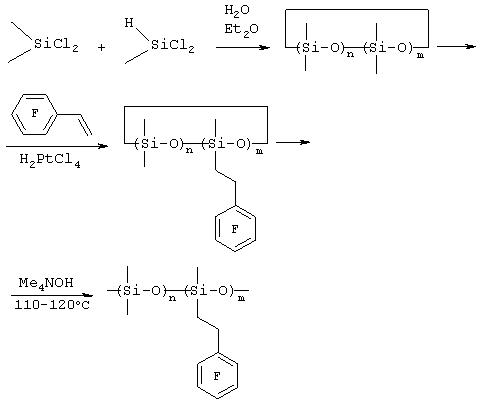
Схема 2
Цели и краткое изложение изобретения
Целью настоящего изобретения является создание новых фторалкилзамещенных циклотрисилоксанов и новых полимеров, получаемых из них, либо гомополимеров, получаемых в результате анионной или катионной полимеризации, либо блоксополимеров, получаемых в результате анионной полимеризации упомянутых фторалкилзамещенных циклотрисилоксанов.
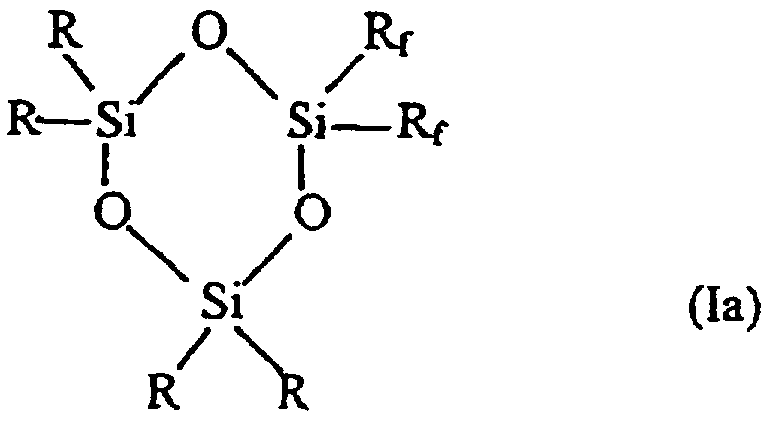
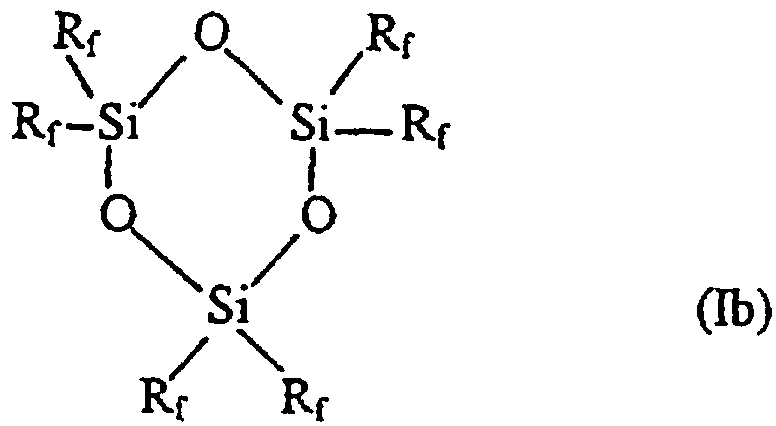
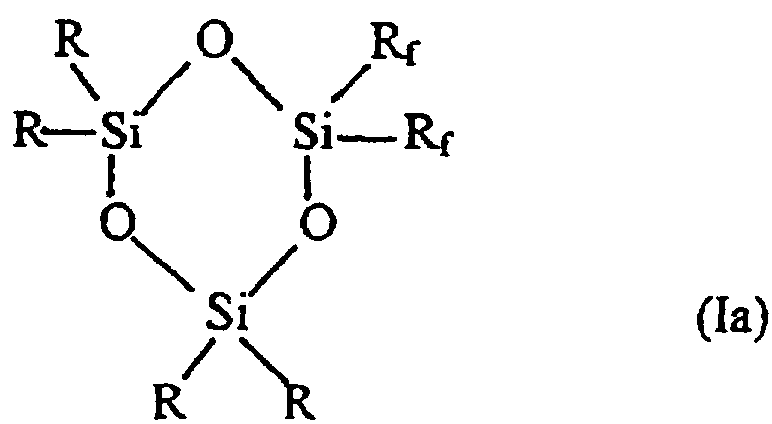
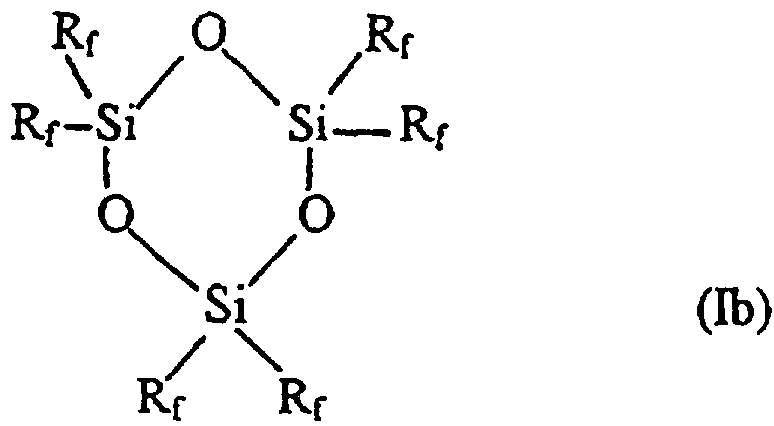
Таким образом, в соответствии с одним аспектом данное изобретение относится к новому фторалкилзамещенному циклотрисилоксану, описываемому формулами (Iа) и (Ib)
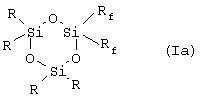
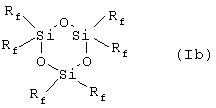
где R представляет собой низший алкил, содержащий от 1 до 4 углеродных атомов, a Rf описывается формулой (СН2)2-(CR’2)n-CR’3, где все или некоторые заместители R’ представляют собой F, причем оставшиеся заместители R’ представляют собой Н, a n представляет собой целое число, изменяющееся в диапазоне от 0 до 8, при том условии, что Rf не может представлять собой (СН2)2-СF3 в соединении, описываемом формулой (Ib).
В соответствии с еще одним аспектом данное изобретение относится к способу получения гомополимера, где упомянутое соединение, описываемое формулами (Iа) или (Ib), подвергают анионной или катионной полимеризации в массе или в подходящем растворителе для получения упомянутого гомополимера.
В соответствии со следующим аспектом изобретение относится к способу получения блоксополимера или статистического сополимера, где, по меньшей мере, два из соединений, описываемых формулами (Iа), (Ib), и циклотрисилоксана, описываемого формулой (II),
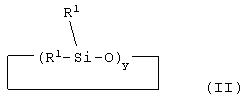
где y представляет собой 3, 4 или 5, а все или некоторые заместители R1 представляют собой алкил, содержащий от 1 до 4 углеродных атомов, винил или фенил, или где один R1 представляет собой Rf, определенный ранее, а оставшиеся заместители R1представляют собой алкил, содержащий от 1 до 4 атомов С, винил или фенил, подвергают анионной или катионной полимеризации с получением упомянутого блочного или статистического сополимера.
Изобретение также относится к новым гомополимерам, блокеополимерам и статистическим сополимерам.
Подробное описание изобретения
Наиболее предпочтительными соединениями, описываемыми формулами Iа и Ib, являются те соединения, у которых каждый из заместителей R’ в (СН2)2-(CR’2)n-CR’3 (Rf) представляет собой F.
Полимеризацию можно проводить либо в массе, либо в подходящем растворителе.
Катионную полимеризацию предпочтительно инициировать с помощью трифторметансульфоновой кислоты.
Анионную полимеризацию предпочтительно инициировать с помощью литийсодержащего основания, например, дилитийдифенилсиланолята или дилитийтетраметилдисилоксанолята.
Полимеризацию соединений Ia, Ib и II можно проводить в любом порядке друг по отношению к другу. Перед инициированием полимеризации их можно также смешать друг с другом.
Изобретение будет описано более подробно в разделе, посвященном эксперименту, в следующих неограничивающих примерах.
Эксперимент.
Спектроскопический анализ.
Спектры1H,13С,19F и29Si ЯМР были получены на спектрометре Bruker AMX-500 MHz. Для получения спектров использовали сорокапроцентные (масс./об.) растворы в ацетоне-d6 . Спектры13С и19F ЯМР получали с широкополосной протонной развязкой. Для получения спектров29Si ЯМР использовали последовательность инверсных стробирующих импульсов развязки с задержкой 60 секунд. В качестве внутреннего стандарта для спектров1H,13С,19F и29Si ЯМР использовали тетраметилсилан (TMS), а для спектров19F-СFСl3. На ИК-спектрометре с Фурье-преобразованием Perkin Elmer Spectrum 2000 регистрировали ИК-спектры чистых пленок на пластинках из NaCl.
Пример 1.
Получение 1,1-бис(1’Н,1’Н,2’Н,2’Н-перфтороктил)-3,3,5,5-тетраметилциклотрисилоксана.
a) Бис(1’Н,1’Н,2’Н,2’Н-перфтороктил)дихлорсилан.
В трубку высокого давления Асе на 24 часа помещали дихлорсилан (5,2 мл, 63 ммоль), 1Н,1Н,2Н-перфтор-1-октен (27,7 мл, 126 ммоль), 3 капли 10% H2PtCl6 в растворе ТГФ/МеОН и 100 мкл комплекса Pt/дивинилтетраметилдисилоксан в толуоле. В результате перегонки получали 13,0 г нужного продукта, температура кипения 96°С/0,2 мм. Выход 27,5%.
1H ЯМР δ : 1.66 (м., 4Н), 2.47 (м., 4Н).13С ЯМР δ: 11.04, 25.61 (т., J=24 Гц), 106-123 (м.).19F ЯМР δ: -122.55 (м., 4F), -119.46 (шир. с., 4F), -119.09 (шир. с., 4F), -118.07 (шир. с., 4F), -111.89 (п., 4F, J=15 Гц), -77.63 (т., 6F, J=10 Гц).29Si ЯМР δ: 32.63. ИК ν: 2956, 2910, 2877, 1444, 1410, 1364, 1319, 1296, 1237, 1202, 1146, 1121, 1073, 1019, 902, 812, 708, 649, 566, 533 см-1.
b) 1,1-бис (1’H,1’H,2’H,2’Н-перфтороктил)-3,3,5,5-тетраметилциклотрисилоксан.
В раствор, состоящий из Et3N (8,0 мл, 57 ммоль) и 100 мл Et2O, в течение 1 часа одновременно прикалывали бис (1’Н,1’Н,2’Н,2’Н-перфтороктил)дихлорсилан, полученный на стадии
а) (20,0 г, 25 ммоль) в 15 мл Et2O и тетраметилдисилоксандиол (Harris G.I., J. Chem. Soc. 1963, 5978) (4,19 г, 25 ммоль) в 15 мл Et2O. После фильтрования раствор промывали водой, высушивали над MgSO4, а растворители удаляли упариванием. Фракционная перегонка давала 11,33 г (выход 50,7%), температура кипения 113°С/0,2 мм, температура плавления 56°С. Реакцию проводили при комнатной температуре.
1H ЯМР δ: 0.21 (с., 12Н), 1.01 (м., 4Н), 2.29 (м., 4Н).13С ЯМР δ: 0.68, 5.98, 25.51 (т., JC-F=23 Гц), 106-123 (м.).19F ЯМР δ: -127.05 (c., 4F), -124.21 (c., 4F), -123.56 (c., 4F), -122.53 (с., 4F), -117.00 (т., 4F, J=16 Гц), -82.16 (т., 6F, J=10 Гц).29Si ЯМР δ: -13.35 (1Si), -7.08 (2Si). ИК ν: 2969, 2947, 2913, 1445, 1367, 1316, 1260, 1247, 1212, 1185, 1145, 1067, 1020, 808, 735, 691, 648, 605, 566, 528 см-1.
Пример 2.
Анионная полимеризация 1,1-бис (1’H,1’H,2’H,2’Н-перфтороктил)-3,3,5,5-тетраметилциклотрисилоксана.
Инициатор для анионной полимеризации.
Проводя обработку дифенилсиландиола н-бутиллитием в ТГФ, получали дилитийдифенилсиланолят. В качестве индикатора использовали стирол (Battjes К.Р.; Kuo, C.-H., Miller R.L.; Saam J.C., Macromolecules, (1995) 28, 790).
Для того, чтобы увеличить растворимость инициатора при проведении низкотемпературных полимеризаций, вместо дифенилсиландиола можно использовать тетраметилдисилоксандиол.
Мономер (1,1-бис(1’Н,1’Н,2’Н,2’Н-перфтороктил)-3,3,5,5-тетраметилциклотрисилоксан) (2,0 г, 2,3 ммоль) и инициатор (159 мкл, 40 мкмоль) для прохождения реакции оставляли при комнатной температуре в 0,6 мл ТГФ на 2,5 часа. Используя триметилхлорсилан, в полимер вводили концевые замыкающие группы, полимер три раза высаживали из СFСl3 при помощи раствора гексаны/ацетон. После высушивания в вакууме получали 1,95 г (выход 98%). Тg=-64°С.
1H ЯМР δ: 0.19 (м., 12Н), 0.94 (м., 4Н), 2.23 (м., 4Н).13С ЯМР δ: 1.10, 6.02, 25.67 (т., J=23 Гц), 102-125 (м.).19F ЯМР δ: 126.45 (4F), -123.34 (4F), -122.99 (4F), -121.96 (4F), -116.29 (4F), -81.47 (6F).29Si ЯМР δ: -26.35, -26.21, -25.85, -25.80, -25.76, -20.84, -20.337, -20.25, -20.02, -19.97, -19.77, -19.62, -19.60, -19.54, -19.45, -19.21, -18.84. ИК ν: 2966, 2912, 1444, 1423, 1420, 1363, 1352, 1317, 1296, 1264, 1240, 1210, 1197, 1167, 1146, 1119, 1104, 1073, 1018, 950, 905, 844, 807, 747, 738, 707, 651, 566, 532 см-1.
Пример 3
Катионная полимеризация 1,1-бис(1’Н,1’Н, 2’Н,2’Н-перфтороктил) -3,3,5,5-тетраметилциклотрисилоксана.
Мономер (1,1-бис (1’Н,1’H,2’Н,2’Н-перфтороктил)-3,3,5,5-тетраметилциклотрисилоксан) (2,0 г, 2,3 ммоль) и СFСl3 (1 мл) герметично закрывали в пробирке объемом 10 мл, оснащенной магнитной мешалкой и резиновой мембраной. Систему охлаждали до -9°С и впрыскивали 2 мкл раствора, состоящего из 50 мкп трифторметансульфоновой кислоты и 2 мл толуола. Полимеризации давали возможность идти в течение 1 часа, после чего полимер высаживали так, как описано выше, получая в результате 1,7 г (85%). Свойства полимера были теми же, что и приведенные выше.
Пример 4.
Гексакис (1’Н,1’Н,2’Н,2’Н-перфтороктил)циклотрисилоксан.
В круглодонную колбу объемом 50 мл, оснащенную капельной воронкой объемом 10 мл, помещали раствор, состоящий из бис(1,1,2,2-тетрагидроперфтороктил)дихлорсилана (10,6 г, 13,4 ммоль) и 25 мл сухого СНСl3. В течение 30 минут в раствор по каплям при комнатной температуре добавляли ДМСО (2,10 г, 26,9 ммоль) в 6 мл СНСl3 и смесь оставляли на 5 часов для прохождения реакции. После этого колбу охлаждали до 0°С и верхний слой декантировали (Lu P., Paulasaari J.K., Weber W.P., Organometallics (1996) 15, 4649; Goossens J.C., French Patent 1456981, Oct. 1, 1964, СА: 67:54259 (1967)). Нижний слой один раз промывали 30 мл СНСl3. Результаты анализа методом29Si ЯМР показали, что необработанный сырой продукт реакции состоит из мономера, относящегося на 81% к типу D3 (циклотрисилоксан) и на 19% к типу D4 (циклотетрасилоксан). Перегонку продукта проводили на аппарате для перегонки с коротким дистиллятором. Собирали гексакис(1’Н,1’Н,2’Н, 2’Н-пер-фтороктил)циклотрисилоксан (6,00 г, выход 61%), температура кипения 200°С/0,01 мм.
1H ЯМР δ: 1.19 (м., 8Н), 2.37 (м., 8Н).13С ЯМР δ: 6.51, 25.84 (т., JC-F=24 Гц), 107.61-122.55 (м.).19F ЯМР δ: -126.16 (с., 8F), -123.02 (c., 8F), -122.64 (c., 8F), -121.61 (c., 8F), -115.95 (т., 8Н, J=13 Гц), -81.31 (т., 12F, J=11 Гц).29Si ЯМР δ: - 10.27 (с., 3Si). ИК ν: 2981, 2950, 2913, 2871, 1443, 1422, 1353, 1318, 1298, 1238, 1192, 1144, 1074, 1012, 952, 909, 897, 811, 777, 747, 727, 708, 651, 566, 528 см-1.
Пример 5.
Сополимер бис(1’Н,1’Н,2’Н,2’Н-перфтороктил)силоксана и диметилсилоксана.
В пробирку, оснащенную магнитной мешалкой с тефлоновым покрытием и резиновой мембраной, помещали гексакис (1’Н,1’Н,2’Н,2’Н-перфтороктил) циклотрисилоксан (0,78 г, 0,35 ммоль), октаметилциклотетрасилоксан (1,05 г, 3,6 ммоль) и трифторметансульфоновую кислоту (40 мкл, 0,24 ммоль). Систему нагревали до 100°С и оставляли на 7 часов для прохождения реакции. Пробирку и ее содержимое охлаждали до комнатной температуры. Для нейтрализации кислоты добавляли гексаметилдисилазан (100 мкл, 0,47 ммоль). Необработанный сырой раствор полимера был мутным. Его два раза промывали ацетоном, перфторгексаном, толуолом и метанолом и высушивали в вакууме в течение 6 часов. Таким путем получали прозрачный бесцветный материал, Мw/Мn=20010/13190, Тg=-123°С, 0,50 г (27%).
1H ЯМР δ: 0.11 (с., 24Н), 1.01 (м., 1.33Н), 2.25(м., 1.33Н).13С ЯМР δ: 1.35, 5.96, 25.41 (м.), 106.78-121.76 (м.).19F ЯМР δ: -126.37 (2F), -123.17 (2F), -122.98 (2F), -121.96 (2F), -116.12 (2F), -81.29 (3F).29Si ЯМР δ: -26.66 (6.5Si), -24.82 (4.5Si), - 24.18 (10.0Si), -23.52 (5.4Si), -21.99 (100.0Si), -21.74 (7.9Si), -21.56 (8.3Si), -21.14 (7.7Si), -20.67 (2.6Si), -20.38 (6.4Si), -20.18 (9.2Si), -19.31 (3.4Si), -18.71 (7.4Si), -18.30 (1.4Si), -4.76 (1.9Si). ИК ν: 2964, 2908, 1262, 1240, 1210, 1146, 1096, 1020, 865, 802, 746, 707.
ТГА (в N2): полимер устойчив до 250°С, 90% остается при 345°С. При 430°С остается 50% материала. Выше 500°С остаток составляет 32%.
Необходимо понимать, что способы настоящего изобретения могут быть осуществлены в виде множества вариантов реализации, только небольшая часть из которых была описана в настоящем документе. Для специалиста в соответствующей области будет очевидным то, что существуют и другие варианты реализации, и что они не отклоняются от сущности изобретения. Таким образом, описанные варианты реализации являются иллюстративными, и их не нужно рассматривать в качестве ограничений.
Реферат
Описываются новые фторалкилзамещенные циклотрисилоксаны формулы (1а) и (1b)
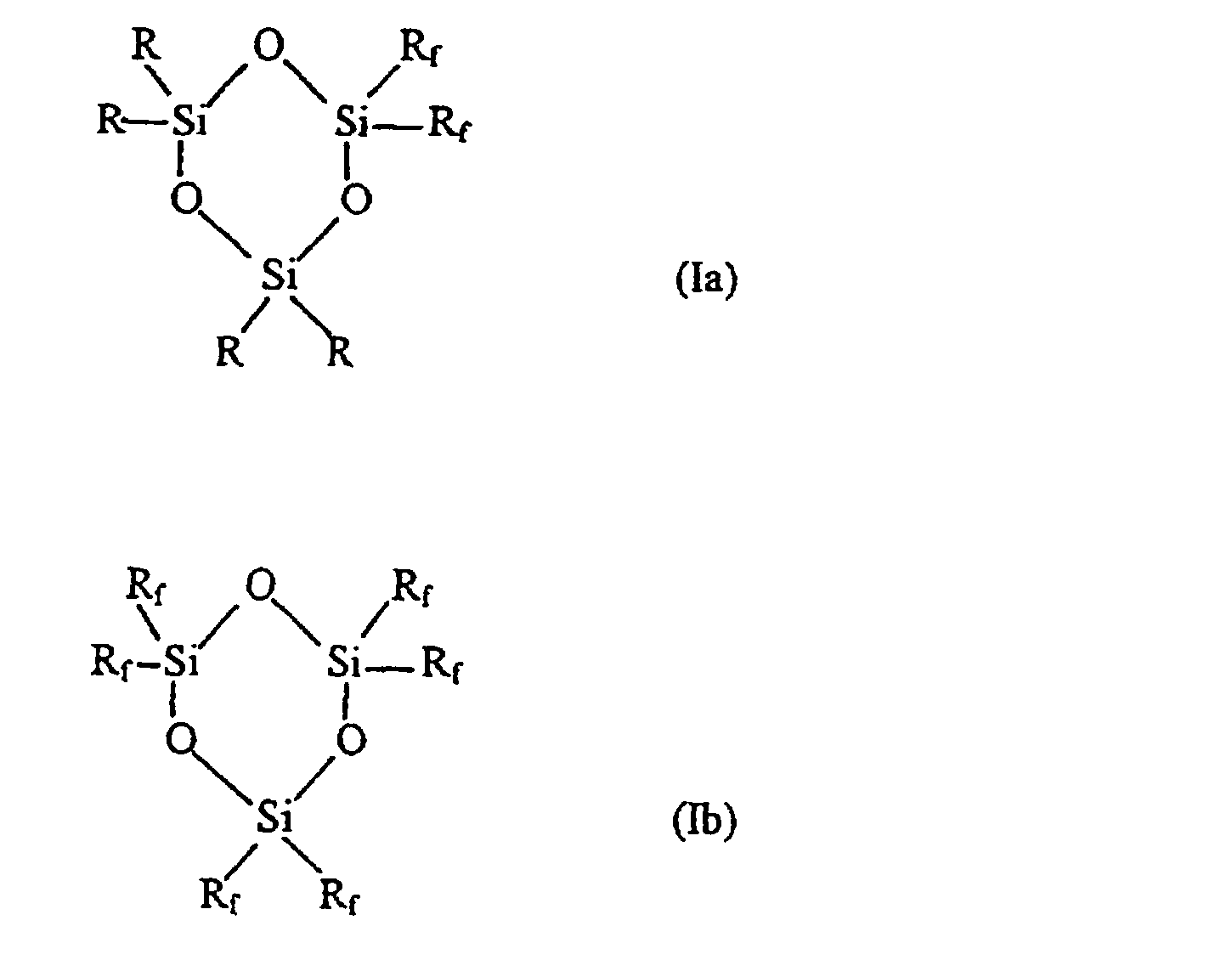
способ их получения и их использование для получения новых гомополимеров, блок-сополимеров и статистических сополимеров. 5 с. и 7 з.п. ф-лы.
Формула
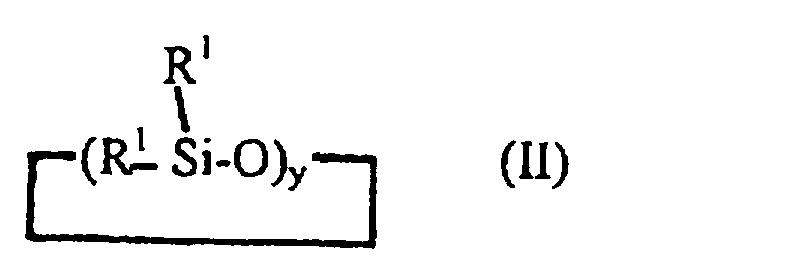

Комментарии