Силилирование ароматических соединений без переходных металлов - RU2651570C2
Код документа: RU2651570C2
Чертежи





















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет патентных заявок США с серийными №№ 61/708931, зарегистрированной 2 октября 2012 года, 61/818573, зарегистрированной 2 мая 2013 года, и 61/865870, зарегистрированной 14 августа 2013 года, содержание каждой из которых полностью включено в качестве ссылки для всех целей.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится к способам силилирования субстратов, содержащих ароматические группы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0003] В последние годы возможность силилирования органических молекул привлекает существенное внимание, вследствие пригодности силилированных материалов сами по себе или в качестве промежуточных соединений для других важных используемых материалов, например, в применениях агрохимических, фармацевтических и электронных материалов. Кроме того, возможность функционализировать ароматические соединения с конденсированными циклами органосиланами предоставляет возможности извлечения выгоды из представляющих интерес свойств этих материалов.
[0004] Исторически, силилирование ароматических соединений проводили посредством процессов со свободными радикалами включающих термически, фотохимически или иным образом полученные источники радикалов. Известно, что ароматические соединения реагируют с силанами в газовой фазе при 500-850°C, в жидкой фазе под автономно формирующимся при 350-500°C давлением, в присутствии пероксидов при 135°C в условиях конденсации в газовой фазе и с использованием реакции с электрическим разрядом. Такие условия реакций недоступны для нелетучих или термочувствительных материалов.
[0005] Недавно описано опосредованное переходными металлами силилирование ароматических связей C-H различными системами, описанными на основе, например, катализаторов Co, Rh, Ir, Fe, Ru, Os, Ni, Pd и Pt. Но в определенных приложениях в области электротехники присутствие даже небольших уровней таких примесей может негативно отражаться на характеристиках силилированных материалов. Подобным образом, в определенных приложениях в области фармацевтики приделы примесей переходных металлов являются достаточно строгими, и возможность их устранения в полной мере обеспечивает преимущества при постсинтетической обработке.
[0006] В настоящем изобретении используют преимущества открытий, описанных в настоящем документе, для устранения по меньшей мере части проблем, ассоциированных с известными ранее способами.
СУЩНОСТЬ
[0007] В различных вариантах осуществления настоящего изобретения предоставлены химические системы для силилирования органических соединений, где каждая система содержит смесь (a) по меньшей мере одного органосилана и (b) по меньшей мере одного сильного основания, где указанная система по существу не содержит соединения переходного металла.
[0008] В других вариантах осуществления предоставлены способы, где способ включает приведение органического субстрата, содержащего ароматическую группу, в контакт со смесью (a) по меньшей мере одного органосилана и (b) по меньшей мере одного сильного основания в условиях, подходящих для силилирования субстрата; где указанная смесь и субстрат по существу не содержат соединения переходного металла.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0009] Настоящая заявка будет более понятна при чтении совместно с приложенными фигурами. С целью иллюстрации объекта изобретения представлены изображения иллюстративных вариантов осуществления объекта изобретения; однако описанный в настоящем документе объект изобретения не ограничен описанными конкретными способами, устройствами и системами. Кроме того, фигуры не обязательно нарисованы в масштабе. На фигурах:
[0010] Фиг.1A и 1B иллюстрируют примеры некоторых из реакций, доступных в способах, описываемых в настоящем документе.
[0011] Фиг.2-15 представляют собой спектры1H и13C ЯМР или спектры HSQC некоторых соединений, получаемых способами, описываем в настоящем документе. Если не указано иначе, спектры получают для соединений, растворенных в CDCl3 при 300 МГц (1H) и 126 МГц (13C). Пики, маркированные звездочками, считают ассоциированными с примесями в соответствующем образце.
[0012] Фиг.2 представляют собой спектры (A)1H и (B)l3C ЯМР толуола и продукты его триэтилсилилирования.
[0013] Фиг.3 представляют собой спектры (A)1H и (B)13C ЯМР мезителена и продукт его триэтилсилилирования.
[0014] Фиг.4 представляют собой спектры (A)1H и (B)13C ЯМР простого о-триэтилсилилдифенилового эфира.
[0015] Фиг.5 представляют собой спектры HSQC (A) 2-метоксинафталина и (B) продукта его реакции с триэтилсиланом, как описано в примере 6.7.2; охарактеризованного как триэтил-(3-метоксинафталин-2-ил)силан.
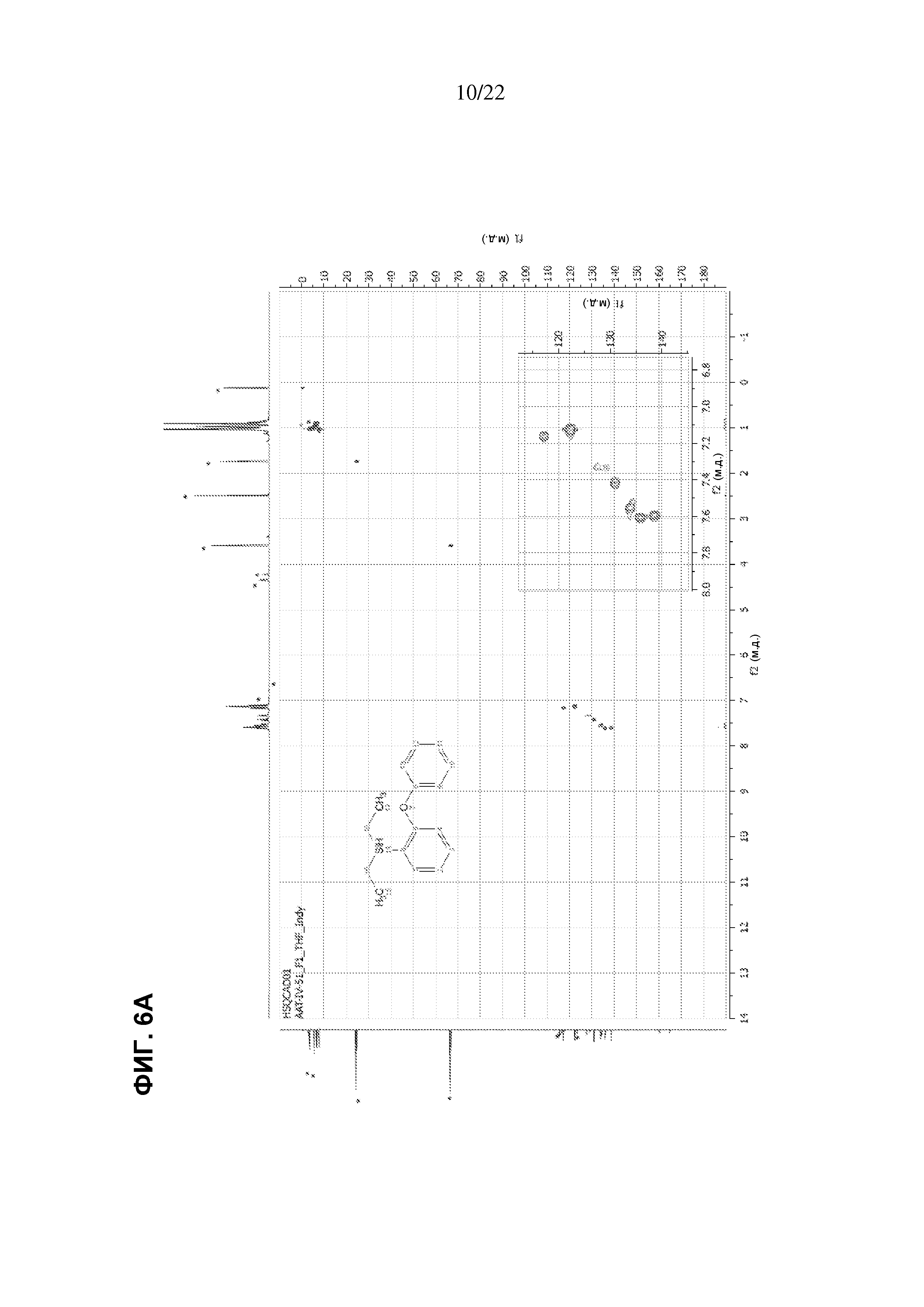
[0016] Фиг.6A и B представляют собой спектры HSQC двух продуктов реакции между простым дифениловым эфиром и диэтилсиланом, как описано в примере 6.7.3.
[0017] Фиг.7 представляют собой спектры HSQC (A) тиоанизола (B) продукта его реакции с триэтилсиланом, как описано в примере 6.7.4.
[0018] Фиг.8 представляет собой спектры HSQC продукта реакции N-метилиндола с триэтилсиланом, как описано в примере6.9.1, охарактеризованного как 1-метил-2-(триэтилсилил)-1H-индол.
[0019] Фиг.9 представляет собой спектры HSQC продукта реакции N-метилиндола с триэтилсиланом, как описано в примере 6.9.2, охарактеризованного как 1-метил-3-(триэтилсилил)-1H-индол.
[0020] Фиг.10 представляет собой спектры HSQC продукта реакции 1-метил-1H-пирроло[2,3-b]пиридина с триэтилсиланом, как описано в примере 6.9.6, охарактеризованного как 1-метил-2-(триэтилсилил)-1H-пирроло[2,3-b]пиридин.
[0021] Фиг.11 представляет собой спектры HSQC продукта реакции 1,2-диметилметилиндола с триэтилсиланом, как описано в примере 6.9.8.
[0022] Фиг.12 представляет собой спектры HSQC продукта реакции 1-фенилпиррола с триэтилсиланом, как описано в примере6.9.10, охарактеризованного как 9,9-диэтил-9H-бензо[d]пирроло[1,2-a][1,3]азасилол.
[0023] Фиг.13 представляет собой спектры HSQC продукта реакции бензофурана с триэтилсиланом, как описано в примере 6.9.11, охарактеризованного как бензофуран-2-илтриэтилсилан.
[0024] Фиг.14A-B представляют собой спектры HSQC (A) бензотиофена и (B) продукта его реакции с триэтилсиланом, как описано в примере 6.9.12, охарактеризованного как бензо[b]тиофен-3-илтриэтилсилан.
[0025] Фиг.15 представляет собой спектры HSQC продукта реакции дибензотиофена с триэтилсиланом, как описано в примере 6.9.14, охарактеризованного как 4-(триэтилсилил)дибензотиофен.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0026] Настоящее изобретение основано на группе реакций, каждая из которых основана на простых смесях органосиланов и сильных оснований, которые совместно формируют системы in situ (структура и характер активных компонентов пока неизвестны), способную к силилированию ароматических молекул в жидкой фазе без присутствия переходных металлов-катализаторов, облучения УФ или электрических (включая плазменные) разрядов. Эти реакции рассматриваются как значительный прогресс в разработке практических способов получения продуктов, важных для фармацевтических и электротехнических применений. Важно, что эта реакция представляет большой интерес, так как в ней в качестве побочного продукта образуются только экологически безвредные силикаты и устранены стоки токсических металлов, как можно наблюдать почти во всех других подходах, предлагаемых в литературе в этом отношении. Значительные гибкость и региоспецифичность, демонстрируемые по меньшей мере некоторыми из этих систем, обеспечивают полезный инструмент в наборе химиков в этих областях.
[0027] Настоящее изобретение можно легче понять на основании приведенного ниже описания, взятого вместе с сопровождающими фигурами и примерами, которые все формируют часть настоящего изобретения. Следует понимать, что настоящее изобретение не ограничено конкретными продуктами, способами, условиями или параметрами, описанными или представленными в настоящем документе, и что терминология, используемая в настоящем документе, предназначена с целью описания конкретных вариантов осуществления исключительно в качестве примера и не предназначена ни для какого ограничения описываемого в заявке изобретения. Подобным образом, если конкретно не указано иначе, любое описание возможного механизма или способа действия или причины улучшения предназначено исключительно для иллюстрации, и изобретение, описанное в настоящем документе, не следует ограничивать правильностью или неправильностью любого такого предполагаемого механизма или способа действия или причины улучшения. На всем протяжении этого текста принято, что описания относятся к композициям и способам получения и использования указанных композиций. То есть, когда в описании описаны или в пункте формулы изобретения приведены характеристика или вариант осуществления, ассоциированные с композицией или способом получения или использования композиции, следует понимать, что такое описание или пункт формулы изобретения предназначены для расширения этих характеристик или варианта осуществления до вариантов осуществления в каждом из этих контекстов (т.е. композиций, способов получения и способов использования).
[0028] В настоящем описании формы единственного числа включают указание на множественное число, а указание конкретного числового значения включает по меньшей мере это конкретное значение, если по контексту явно не требуется иначе. Таким образом, например, указание на "материал" представляет собой указание по меньшей мере на один из таких материалов и их эквивалентов, известных специалистам в данной области, и т.д.
[0029] Когда значение выражено в виде приближения посредством использования ключевого слова "приблизительно", следует понимать, что конкретное значение составляет другой вариант осуществления. Как правило, использование термина "приблизительно" означает приближения, которые могут варьировать в зависимости от желаемых свойств, которые необходимо получать посредством описываемого объекта изобретения, и его необходимо истолковывать в конкретном контексте, в котором его используют на основе его функции. Специалист в данной области легко может это истолковать. В некоторых случаях одним из неограничивающих способов определения пределов слова "приблизительно" может являться количество значащих цифр, используемых для конкретного значения. В других случаях, для определения заданного диапазона, предлагаемого термином "приблизительно", для каждого значения можно использовать градации, используемые в ряде значений. Когда они приведены, все диапазоны являются включительными и комбинируемыми. То есть указания значений, приведенных в диапазонах, включают каждое значение в этом диапазоне.
[0030] Следует понимать, что определенные признаки изобретения, которые для ясности описаны в настоящем документе в рамках отдельных вариантов осуществления, также могут быть представлены в комбинации в одном варианте осуществления. То есть, если это не является явно несовместимым или конкретно не исключено, подразумевают, что каждый отдельный вариант осуществления можно комбинировать с любым другим вариантом(ами) осуществления, и такую комбинацию следует рассматривать, как другой вариант осуществления. И наоборот, различные признаки изобретения, которые для краткости описаны в рамках одного варианта осуществления, также могут быть представлены раздельно или в любой подкомбинации. Наконец, хотя вариант осуществления может быть описан как часть ряда этапов или часть более общей структуры, каждый указанный этап сам по себе также можно рассматривать как независимый вариант осуществления, комбинируемый с другими.
[0031] Переходные термины "содержащий", "по существу состоящий из" и "состоящий" предназначены для их общего обозначения в значениях, принятых в патентной лексике; т.е. (i) "содержащий", который является синонимом "включающему", "вмещающему" или "характеризующемуся", является включительным или незамкнутым и не исключает дополнительных, неперечисленных элементов или этапов способов; (ii) "состоящий из" исключает любой элемент, этап или ингредиент, не указанный в пункте; и (iii) "по существу состоящий из" ограничивает пределы пункта указанными материалами или этапами "и тем, что существенно не влияет на основную и новую характеристику(и)" описываемого в заявке изобретения. Варианты осуществления, описываемые посредством фразы "содержащие" (или ее эквивалентов), также предоставляют, в качестве вариантов осуществления, варианты осуществления, которые независимо описаны посредством "состоящий из" и "по существу состоящий из". Для вариантов осуществления, предоставленных посредством "по существу состоящий из", основная и новая характеристика(и) легко реализуемы в способах (или системах, используемых в таких способах или композициях, получаемых в них) силилирования ароматических органических молекул.
[0032] Если не указано иначе, когда представлен список, следует понимать, что каждый отдельный элемент этого списка и любая комбинация из этого списка представляют собой отдельный вариант осуществления. Например, список вариантов осуществления, представленный как "A, B или C" следует понимать, как включающий варианты осуществления, "A", "B", "C", "A или B", "A или C", "B или C" или "A, B или C".
[0033] На всем протяжении этого описания, предусмотрено, что слова имеют их нормальное значение, как понимают специалисты в соответствующей области. Однако во избежание разногласий конкретно определены или уточнены значения некоторых терминов.
[0034] Как используют в настоящем документе, как правило, термин "алкил" относится к неразветвленной, разветвленной или циклической насыщенной углеводородной группе, хотя и не обязательно, содержащей от 1 до приблизительно 24 атомов углерода, предпочтительно от 1 до приблизительно 12 атомов углерода, такой как метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная, трет-бутильная, октильная, децильная и т.п., а также циклоалкильная группы, такие как циклопентил, циклогексил и т.п. Как правило, хотя снова не обязательно, алкильные группы в настоящем документе содержат от 1 до приблизительно 12 атомов углерода. Термин "низший алкил" означает алкильную группу с 1-6 атомами углерода, а конкретный термин "циклоалкил" означает циклическую алкильную группу, как правило, содержащую от 4 до 8, предпочтительно от 5 до 7, атомов углерода. Термин "замещенный алкил" относится к алкильным группам, замещенным одной или несколькими группами заместителей, а термины "содержащий гетероатомы алкил" и "гетероалкил" относятся к алкильным группам, в которых по меньшей мере один атом углерода замещен гетероатомом. Если не указано иначе, термины "алкил" и "низший алкил" включают неразветвленные, разветвленные, циклические, незамещенные, замещенные и/или содержащие гетероатомы алкильные и низшие алкильные группы, соответственно.
[0035] Как используют в настоящем документе, термин "алкилен" относится к дифункциональной неразветвленной, разветвленной или циклической алкильной группе, где "алкил" является таким, как определено выше.
[0036] Как используют в настоящем документе, термин "алкенил" относится к неразветвленной, разветвленной или циклической углеводородной группе с количеством атомов углерода от 2 до приблизительно 24, содержащей по меньшей мере одну двойную связь, такой как этенил, н-пропенил, изопропенил, н-бутенил, изобутенил, октенил, деценил, тетрадеценил, гексадеценил, эйкозенил, тетракозенил и т.п. Предпочтительные алкенильные группы в настоящем документе содержат от 2 до приблизительно 12 атомов углерода. Термин "низший алкенил" означает алкенильную группу с 2-6 атомами углерода, а конкретный термин "циклоалкенил" означает циклическую алкенильную группа, предпочтительно содержащую от 5 до 8 атомов углерода. Термин "замещенный алкенил" относится к алкенильным группам, замещенным одной или несколькими группами заместителей, а термины "содержащий гетероатомы алкенил" и "гетероалкенил" относятся к алкенильным группам, в которых по меньшей мере один атом углерода замещен гетероатомом. Если не указано иначе, термины "алкенил" и "низший алкенил" включают неразветвленные, разветвленные, циклические, незамещенные, замещенные и/или содержащие гетероатомы алкенильные и низшие алкенильные группы, соответственно.
[0037] Как используют в настоящем документе, термин "алкенилен" относится к дифункциональной неразветвленной, разветвленной или циклической алкенильной группе, где "алкенил" является таким, как определено выше.
[0038] Как используют в настоящем документе, термин "алкинил" относится к неразветвленной или разветвленной углеводородной группе с количеством атомов углерода от 2 до приблизительно 24, содержащей по меньшей мере одну тройную связь, такой как этинил, н-пропинил и т.п. Предпочтительные алкинильные группы в настоящем документе содержат от 2 до приблизительно 12 атомов углерода. Термин "низший алкинил" означает алкинильную группу с 2-6 атомами углерода. Термин "замещенный алкинил" относится к алкинильной группе, замещенной одной или несколькими группами заместителей, а термины "содержащий гетероатомы алкинил" и "гетероалкинил" относятся к алкинилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не указано иначе, термины "алкинил" и "низший алкинил" включают неразветвленную, разветвленную, незамещенную, замещенную и/или содержащую гетероатомы алкинильную и низшую алкинильную группу, соответственно.
[0039] Как используют в настоящем документе, термин "алкокси" означает алкильную группу, связанную одинарной, концевой простоэфирной связью; т.е. "алкоксигруппу" можно представить как -O-алкил, где алкил является таким, как определено выше. "Низшая алкоксигруппа" означает алкоксигруппу, содержащую от 1 до 6 атомов углерода. Аналогично, "алкенилокси" и "низшая алкенилокси" соответственно относятся к алкенильной и низшей алкенильной группе, связанной одинарной, концевой простоэфирной связью, а "алкинилокси" и "низшая алкинилокси" соответственно относятся к алкинильной и низшей алкинильной группе, связанной одинарной, концевой простоэфирной связью.
[0040] Термин "ароматическая" относится к циклическим группам, которые удовлетворяют правилу Хюккеля 4n+2 для ароматичности, и включает арильные (т.е. карбоциклические) и гетероарильные (так называемые гетероароматические) структуры, включающие арильные, аралкильные, алкарильные, гетероарильные, гетероаралкильные или алкгетероарильные группы или их олигомерные или полимерные аналоги.
[0041] Как используют в настоящем документе и если не указано иначе, термин "арил" относится к ароматическим заместителю или структуре, содержащим одно ароматическое кольцо или несколько ароматических колец, которые конденсированы, непосредственно связаны или связаны опосредованно (так, что различные ароматические кольца связаны с общей группой, такой как метиленовая или этиленовая группа). Если не модифицировано иным образом, термин "арил" относится к карбоциклическим структурам. Предпочтительные арильные группы содержат от 5 до 24 атомов углерода, а особенно предпочтительные арильные группы содержат от 5 до 14 атомов углерода. Иллюстративные арильные группы содержат одно ароматическое кольцо или два конденсированных или связанных ароматических кольца, например, фенил, нафтил, бифенил, дифениловый эфир, дифениламин, бензофенон и т.п. "Замещенный арил" относится к арильной группе, замещенной одной или несколькими группами заместителей, а термины "содержащий гетероатомы арил" и "гетероарил" относятся к арильным заместителям, в которых по меньшей мере один атом углерода замещен гетероатомом, как более подробно описано ниже.
[0042] Как используют в настоящем документе, термин "арилокси" относится к арильной группе, связанной одинарной, концевой простоэфирной связью, где "арил" является таким, как определено выше. "Арилоксигруппу" можно представить как -O-арил, где арил является таким, как определено выше. Предпочтительные арилоксигруппы содержат от 5 до 24 атомов углерода, а особенно предпочтительные арилоксигруппы содержат от 5 до 14 атомов углерода. Примеры арилоксигрупп в качестве неограничивающих примеров включают фенокси, о-галогенфенокси, м-галогенфенокси, п-галогенфенокси, о-метоксифенокси, м-метоксифенокси, п-метоксифенокси, 2,4-диметоксифенокси, 3,4,5-триметоксифенокси и т.п.
[0043] Термин "алкарил" относится к арильной группе с алкильным заместителем, а термин "аралкил" относится к алкильной группа с арильным заместителем, где "арил" и "алкил" являются такими, как определено выше. Предпочтительные алкарильные и аралкильные группы содержат от 6 до 24 атомов углерода, а особенно предпочтительные алкарильные и аралкильные группы содержат от 6 до 16 атомов углерода. Алкарильные группы включают, например, п-метилфенил, 2,4-диметилфенил, п-циклогексилфенил, 2,7-диметилнафтил, 7-циклооктилнафтил, 3-этил-циклопента-1,4-диен и т.п. Примеры аралкильных групп в качестве неограничивающих примеров включают бензил, 2-фенилэтил, 3-фенилпропил, 4-фенилбутил, 5-фенилпентил, 4-фенилциклогексил, 4-бензилциклогексил, 4-фенилциклогексилметил, 4-бензилциклогексилметил и т.п. Термины "алкарилокси" и "аралкилокси" относятся к заместителям формулы -OR, где R представляет собой алкарил или аралкил, соответственно, как только что определено.
[0044] Термин "ацил" относится к заместителям формулы -(CO)-алкил, -(CO)-арил или -(CO)-аралкил, а термин "ацилокси" относится к заместителям формулы -O(CO)-алкил, -O(CO)-арил или -O(CO)-аралкил, где "алкил", "арил и "аралкил" являются такими, как определено выше.
[0045] Термины "циклический" и "цикл" относятся к алициклическим или ароматическим группам, которые могут быть или могут не быть замещенными и/или содержащими гетероатомы, и которые могут быть моноциклическими, бициклическими или полициклическими. Термин "алициклический" используют в общепринятом смысле для обозначения алифатической циклической группы в противоположность ароматической циклической группе, и она может быть моноциклической, бициклической или полициклической. Термин "ациклический" относится к структуре, в которой в кольцевой структуре не содержится двойная связь.
[0046] Термины "галогеновый", "галогенид" и "галоген" используют в общепринятом для обозначения заместителей в виде хлора, брома, фтора или иода.
[0047] "Гидрокарбил" относится к одновалентным гидрокарбильным радикалам, содержащим от 1 до приблизительно 30 атомов углерода, предпочтительно от 1 до приблизительно 24 атомов углерода, наиболее предпочтительно от 1 до приблизительно 12 атомов углерода, включающих неразветвленные, разветвленные, циклическые, насыщенные и ненасыщенные группы, такие как алкильные группы, алкенильные группы, арильные группы и т.п. Термин "низший гидрокарбил" означает гидрокарбильную группу с 1-6 атомами углерода, предпочтительно 1-4 атомами углерода, а термин "гидрокарбилен" означает двухвалентную гидрокарбильную группу, содержащую от 1 до приблизительно 30 атомов углерода, предпочтительно от 1 до приблизительно 24 атомов углерода, наиболее предпочтительно от 1 до приблизительно 12 атомов углерода, включающую неразветвленные, разветвленные, циклические, насыщенные и ненасыщенные группы. Термин "низший гидрокарбилен" означает гидрокарбиленовую группу с 1-6 атомами углерода. "Замещенный гидрокарбил" относится к гидрокарбилу, замещенному одной или несколькими группами заместителей, а термины "содержащий гетероатомы гидрокарбил" и "гетерогидрокарбил" относятся к гидрокарбилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Подобным образом, "замещенный гидрокарбилен" относится к гидрокарбилену, замещенному одной или несколькими группами заместителей, а термины "содержащий гетероатомы гидрокарбилен" и гетерогидрокарбилен" относятся к гидрокарбилену, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не указано иначе, термин "гидрокарбил" и "гидрокарбилен" следует понимать как включающие замещенные и/или содержащие гетероатомы гидрокарбильные и гидрокарбиленовые группы, соответственно.
[0048] Термин "содержащий гетероатомы", например, как в "содержащей гетероатомы гидрокарбильной группе" относится к молекуле углеводорода или к гидрокарбильному фрагменту молекулы, в котором один или несколько атомов углерода замещены атомом, отличным от углерода, например, азотом, кислородом, серой, фосфором или кремнием, как правило, азотом, кислородом или серой. Подобным образом, термин "гетероалкил" относится к алкильному заместителю, который содержит гетероатомы, термин "гетероциклический" относится к циклическому заместителю, который содержит гетероатомы, термины "гетероарил" и "гетероароматический", соответственно, относятся к "арильному" и "ароматическому" заместителя, которые содержат гетероатомы, и т.п. Следует отметить, что "гетероциклическая" группа или соединение могут быть или могут не быть ароматическими, и дополнительно, что "гетероциклы" могут быть моноциклическими, бициклическими или полициклическими, как описано выше в отношении термина "арил". Примеры гетероалкильных групп включают алкоксиарил, замещенный алкилсульфанилом алкил, N-алкилированный аминоалкил и т.п. Неограничивающие примеры гетероарильных заместителей включают пирролил, пирролидинил, пиридинил, хинолинил, индолил, пиримидинил, имидазолил, 1,2,4-триазолил, тетразолил и т.д., а примеры содержащих гетероатомы алициклических групп представляют собой пирролидино, морфолино, пиперазино, пиперидино и т.д.
[0049] Как используют в настоящем документе, термины "субстрат" или "органический субстрат" предназначены для обозначения отдельных низкомолекулярных соединений (иногда описываемых как "органические соединения") и олигомеров и полимеров, содержащих такие "ароматические группы". Термин "ароматические группы" предназначен для обозначения частей соединений, олигомеров или полимеров, содержащих указанные ароматические структуры. В случаях когда они представлены в виде структур, группы содержат по меньшей мере то, что представлено, а также содержат дополнительные функциональные группы, заместители или и то, и другое, включая в качестве неограничивающих примеров функциональную группу, описанную в настоящем документе как "Fn".
[0050] Под "замещенным", например, как в "замещенном гидрокарбиле", "замещенном алкиле", "замещенном ариле" и т.п., как указано в некоторых из приведенных выше определений, подразумевают то, что в гидрокарбильной, алкильной, арильной, гетероарильной или другой группе по меньшей мере один атом водорода, связанный с атомом углерода (или другим атомом), замещен одним или несколькими неводородными заместителями. Примеры таких заместителей в качестве неограничивающих примеров включают: функциональные группы, обозначаемые в настоящем документе как "Fn", такие как галоген (например, F, Cl, Br, I), гидроксил, сульфгидрил, C1-C24-алкокси, C2-C24-алкенилокси, C2-C24-алкинилокси, C5-C24-арилокси, C6-C24-аралкилокси, C6-C24-алкарилокси, ацил (включая C1-C24-алкилкарбонил (-CO-алкил) и C6-C24-арилкарбонил (-CO-арил)), ацилокси (-O-ацил, включая C2-C24-алкилкарбонилокси (-O-CO-алкил) и C6-C24-арилкарбонилокси (-O-CO-арил)), C2-C24-алкоксикарбонил ((CO)-O-алкил), C6-C24-арилоксикарбонил (-(CO)-O-арил), галогенкарбонил (-CO)-X, где X представляет собой галоген), C2-C24-алкилкарбонато (-O-(CO)-O-алкил), C6-C24-арилкарбонато (-O-(CO)-O-арил), карбокси (-COOH), карбоксилато (-COO-), карбамоил (-(CO)-NH2), моно-(C1-C24-алкил)-замещенный карбамоил (-(CO)NH(C1-C24-алкил)), ди-(C1-C24-алкил)-замещенный карбамоил (-(CO)-N(C1-C24-алкил)2), моно-(C1-C24-галогеналкил)-замещенный карбамоил (-(CO)-NH(C1-C24-алкил)), ди-(C1-C24-галогеналкил)-замещенный карбамоил (-(CO)-N(C1-C24-алкил)2), моно-(C5-C24-арил)-замещенный карбамоил (-(CO)-NH-арил), ди-(C5-C24-арил)-замещенный карбамоил (-(CO)-N(C5-C24-арил)2), ди-N-(C1-C24-алкил),N-(C5-C24-арил)-замещенный карбамоил, тиокарбамоил (-(CS)-NH2), моно-(C1-C24-алкил)-замещенный тиокарбамоил (-(CO)-NH(C1-C24-алкил)), ди-(C1-C24-алкил)-замещенный тиокарбамоил (-(CO)-N(C1-C24-алкил)2), моно-(C5-C24-арил)-замещенный тиокарбамоил (-(CO)-NH-арил), ди-(C5-C24-арил)-замещенный тиокарбамоил (-(CO)-N(C5-C24-арил)2), ди-N-(C1-C24-алкил),N-(C5-C24-арил)-замещенный тиокарбамоил, карбамидо (-NH-(CO)-NH2), циано(-C≡N), цианато (-O-C=N), тиоцианато (-S-C=N), формил (-(CO)-H), тиоформил (-(CS)-H), амино (-NH2), моно-(C1-C24-алкил)-замещенный амино, ди-( C1-C24-алкил)-замещенный амино, моно-(C5-C24-арил)-замещенный амино, ди-(C5-C24-арил)-замещенный амино, C1-C24-алкиламидо (-NH-(CO)-алкил), C6-C24-ариламидо (-NH-(CO)-арил), имино (-CR=NH, где R=водород, C1-C24-алкил, C5-C24-арил, C6-C24-алкарил, C6-C24-аралкил и т.д.), C2-C20-алкилимино (-CR=N(алкил), где R=водород, C1-C24-алкил, C5-C24-арил, C6-C24-алкарил, C6-C24-аралкил и т.д.), арилимино (-CR=N( арил), где R=водород, C1-C20-алкил, C5-C24-арил, C6-C24-алкарил, C6-C24-аралкил и т.д.), нитро (-NO2), нитрозо (-NO), сульфо (-SO2OH), сульфонат (SO2O-), C1-C24-алкилсульфанил (-S-алкил; также называемый "алкилтио"), C5-C24-арилсульфанил (-S-арил; также называемый "арилтио"), C1-C24-алкилсульфинил (-(SO)-алкил), C5-C24-арилсульфинил (-(SO)-арил), C1-C24-алкилсульфонил (-SO2-алкил), C1-C24 моноалкиламиносульфонил-SO2-N(H)-алкил), C1-C24 диалкиламиносульфонил-SO2-N(алкил)2, C5-C24-арилсульфонил (-SO2-арил), борил (-BH2), бороно (-B(OH)2), боронато (-B(OR)2, где R представляет собой алкил или другой гидрокарбил), фосфоно (-P(O)(OH)2), фосфонато (-P(O)(O)2), фосфинато (P(O)(O-)), фосфо (-PO2) и фосфин (-PH2); и гидрокарбильные группы C1-C24-алкил (предпочтительно C1-C12-алкил, более предпочтительно C1-C6-алкил), C2-C24-алкенил (предпочтительно C2-C12-алкенил, более предпочтительно C2-C6-алкенил), C2-C24-алкинил (предпочтительно C2-C12-алкинил, более предпочтительно C2-C6-алкинил), C5-C24-арил (предпочтительно C5-C24-арил), C6-C24-алкарил (предпочтительно C6-C16-алкарил) и C6-C24-аралкил (предпочтительно C6-C16-аралкил). В этих структурах заместителей, "алкильная", "алкиленовая", "алкенильная", "алкениленовая", "алкинильная", "алкиниленовая", "алкокси", "ароматическая", "арильная", "арилокси", "алкарильная" и "аралкильная" группы необязательно могут быть фторированы или перфторированы. Кроме того, указание спиртов, альдегидов, аминов, карбоновых кислот, кетонов или других подобных реакционноспособных функциональных групп также включает их защищенные аналоги. Например, указание гидрокси или спирта также включает заместители, где гидрокси защищен ацетилом (Ac), бензоилом (Bz), бензилом (Bn, Bnl), простым β-метоксиэтоксиметиловым эфиром (MEM), диметокситритилом, [бис-(4-метоксифенил)фенилметилом] (DMT), простым метоксиметиловым эфиром (MOM), метокситритил-[(4-метоксифенил)дифенилметилом, (MMT), простым п-метоксибензиловым эфиром (PMB), простым метилтиометиловым эфиром, пивалоилом (Piv), тетрагидропиранилом (THP), тетрагидрофураном (THF), тритилом (трифенилметилом, Tr), простым силиловым эфиром (наиболее широкоиспользуемые простые силиловые эфиры включают простые триметилсилиловый (TMS), трет-бутилдиметилсилиловый (TBDMS), три-изо-пропилсилилоксиметиловый (TOM) и триизопропилсилиловый (TIPS) эфиры), этоксиэтиловые эфиры (EE). Указание аминов также включает заместители, где амин защищен BOC-глициновой, карбобензилокси (Cbz), п-метоксибензилкарбониловой (Moz или MeOZ), трет-бутилоксикарбониловой (BOC), 9-флуоренилметилоксикарбониловой (FMOC), ацетиловой (Ac), бензоиловой (Bz), бензиловой (Bn), карбаматной, п-метоксибензиловой (PMB), 3,4-диметоксибензиловой (DMPM), п-метоксифениловой (PMP), тозиловой (Ts) группой или сульфонамидной (Nosyl & Nps) группой. Указание заместителя, содержащего карбонильную группу, также включает заместители, где карбонил защищен ацетальной или кетальной, ацилальной или диатановой группой. Указание заместителя, содержащего карбоксильную или карбоксилатную группу, также включает заместители, где карбоксильная или карбоксилатная группа защищена образованным ею сложным метиловым эфиром, сложным бензиловым эфиром, трет-бутиловым сложным эфиром, сложным эфиром 2,6-двузамещенного фенола (например, 2,6-диметилфенол, 2,6-диизопропилфенол, 2,6-ди-трет-бутилфенол), сложным силиловым эфиром, ортоэфиром или оксазолином.
[0051] Под "функционализированным", как в "функционализированном гидрокарбил", "функционализированным алкилом", "функционализированным олефином", "функционализированным циклическим олефином" и т.п., подразумевают, что в гидрокарбиле, алкиле, ариле, гетероариле, олефине, циклическом олефин или другой группе по меньшей мере один атом водорода, связанный с атомом углерода (или другим атомом) замещен одной или несколькими функциональными группами, такими как функциональные группы, описываемые в настоящем документе и выше. Термин "функциональная группа" предназначен для включения любых функциональных групп, которые подходят для применений, описываемых в настоящем документе. В частности, как используют в настоящем документе, функциональная группа обязательно должна обладать способностью реагировать или связываться с соответствующими функциональными группами на поверхности субстрата.
[0052] Кроме того, указанные выше функциональные группы, если конкретная группа допускает, могут быть дополнительно замещены одной или несколькими дополнительными функциональными группами или одной или несколькими гидрокарбильными группами, такими как группы конкретно перечисленные выше. Аналогично, указанные выше гидрокарбильные группы могут быть дополнительно замещены одной или несколькими функциональными группами или дополнительными гидрокарбильными группами, такими как конкретно перечисленные группы.
[0053] "Необязательный" или "необязательно" означает, что описанное далее условие может выполняться или нет так, что описание включает варианты, когда условие выполняется, и варианты, когда оно не выполняется. Например, фраза "необязательно замещенный" означает, что неводородный заместитель может присутствовать на данном атоме или нет, и, таким образом, описание включает структуры, где неводородный заместитель присутствует, и структуры, где неводородный заместитель не присутствует.
[0054] Как используют в настоящем документе, термин "силилирование" относится к образованию связей углерод-кремний, как правило, в положении, ранее занимаемом связью углерод-водород, как правило, неактивированной связью C-H. Полагают, что возможность непосредственного замещения связи C-H связью C-Si в условиях, описываемых в настоящем документе, является беспрецедентной.
[0055] Настоящее изобретение включает варианты осуществления, относящиеся к химическим системам и способам силилирования ароматических соединений и ароматических групп. Конкретные варианты осуществления относятся к химическим системам силилирования ароматических соединений и ароматических групп, где каждая система содержит смесь (a) по меньшей мере одного органосилана и (b) по меньшей мере одного сильного основания, где указанная система предпочтительно по существу не содержит соединений переходных металлов.
[0056] Установлено, что системы и реакции, которые обеспечивают силилирование ароматических соединений и ароматических группы в различных условиях (в основном при повышенных температурах температуры), также способны к расщеплению связи C-O, C-N, C-S в ароматических субстратах. Это последнее свойство восстановительного расщепления является объектом совместно поданной и совместно рассматриваемой патентной заявки США, Attorney Docket CTEK-0128 (CIT-6328), зарегистрированной 2 октября 2013 года, озаглавленной "Transition-Metal-Free Reductive Cleavage of Aromatic C-O, C-N, and C-S Bonds by Activated Silanes", которая также полностью включена в качестве ссылки для всех целей. Механизм, посредством которого действуют системы и способы пока еще не понят, например, является ли силилирование промежуточным этапом или побочным продуктом реакций расщепления (некоторые наблюдения свидетельствуют, что не является), но, по-видимому, относительным вкладом каждого направления можно манипулировать посредством условий реакции. Например, при сходстве или равенстве других факторов и с определенными исключениями, по-видимому, повышенные температуры и более длительное время реакции действуют в направлении предпочтительного расщепления связей C-O, C-N, C-S по сравнению с реакциями силилирования (которое происходит при относительно небольших температурах). Подобным образом, отсутствие водорода и молекул-доноров водорода (даже при повышенных температурах) и использование субстехиометрических количеств сильного основания (относительно органосилана) по-видимому, благоприятствует реакциям силилирования и неблагоприятно для расщепления C-X.
[0057] Как используют в настоящем документе, термин "по существу не содержит соединений переходных металлов" предназначен для отражения того, что система эффективна для намеченной цели силилирования ароматических соединений и ароматических группы в относительно умеренных условиях, описываемых в настоящем документе, даже в отсутствие любого экзогенного (т.е. преднамеренно добавляемого или иначе) переходного металла-катализатора(ов). Хотя в определенных вариантах осуществления предусмотрено, что переходные металлы, включая переходные металлы, способные к катализу реакций силилирования, могут присутствовать в системах или способах, описываемых в настоящем документе, на уровнях, обычно ассоциируемых с такой каталитической активностью, присутствие таких металлов (даже как катализаторов или обычных соединений) не требуется и во многих случаях нежелательно. По этой причине в предпочтительных вариантах осуществления системы и способы "по существу не содержат соединений переходных металлов". Если не указано иначе, в дальнейшем, термин "по существу не содержит соединений переходных металлов" определен для отражения того, что общий уровень переходных металлов в системе силилирования, независимо или в присутствии органического субстрата, составляет менее чем приблизительно 50 м.д., как измеряют посредством ICP-MS, как описано в примере 2 ниже. В дополнительных вариантах осуществления также предусмотрено, что концентрация переходных металлов составляет менее чем приблизительно 100 м.д., 50 м.д., 30 м.д., 25 м.д., 20 м.д., 15 м.д., 10 м.д. или 5 м.д. до приблизительно 1 м.д. или 0 м.д. Как используют в настоящем документе, термин "переходный металл" определен для включения Co, Rh, Ir, Fe, Ru, Os, Ni, Pd, Pt, Cu или их сочетаний. В дополнительных конкретных независимых вариантах осуществления концентрация Ni, как измеряют посредством ICP-MS, составляет менее 25 м.д., менее 10 м.д., менее 5 м.д. или менее 1 м.д.
[0058] Эти системы, как правило, содержат углеводородов или растворители на основе простых эфиров. Как описано в настоящем документе, показано, что растворители, такие как бензол, толуол, мезителен и тетрагидрофураны (включая 2-метилтетрагидрофуран) хорошо работают.
[0059] Хотя необходимости ограничивать доступ воды и кислорода к системе может и не быть, в некоторых вариантах осуществления химическая система находится и способ проводят в среде, по существу не содержащей воды, кислорода или ни воды, ни кислорода. Если не указано иначе, термин "по существу не содержит воды" относится к уровням воды менее чем приблизительно 500 м.д., а "по существу не содержит кислорода" относится к уровням кислорода, соответствующих парциальным давлениям менее 133,3 Па. Когда указано, в дополнительных независимых вариантах осуществления может быть предусмотрено, что "по существу не содержит воды" относится к уровням воды менее 1,5%, 1%, 0,5%, 1000 м.д., 500 м.д., 250 м.д., 100 м.д., 50 м.д., 10 м.д. или 1 м.д., а "по существу не содержит кислорода" относится к уровням кислорода, соответствующим парциальным давлениям менее 6,7 кПа, 1,3 кПа, 0,7 кПа, 133,3 Па, 66,7 Па, 33,3 Па, 13,3 Па, 6,7 Па или 1,3 Па.
[0060] Как используют в настоящем документе для описания систем и способов, термин "органосилан" относится к соединению или реагенту, содержащему по меньшей мере одну связь кремний-водород (Si-H). Органосилан может дополнительно содержать связь кремний-углерод, кремний-кислород, кремний-азот или их сочетание, и может быть мономерным или содержаться в олигомерном или полимерном каркасе, включая связь с гетерогенной или гомогенной подложкой. В определенных вариантах осуществления эти органосилан могут включать по меньшей мере одно соединение формулы (I) или формулы (II):

где: m представляет собой 1, 2 или 3, предпочтительно 1;
[0061] n находится в диапазоне приблизительно от 5 до приблизительно 500, приблизительно от 10 до приблизительно 100 или приблизительно от 25 до приблизительно 50; и
[0062] каждый R независимо представляет собой необязательно замещенный C1-12-алкил или -гетероалкил, необязательно замещенный C5-20-арил или -гетероарил, необязательно замещенный C6-30-алкарил или -гетероалкарил, необязательно замещенный C6-30-аралкил или -гетероаралкил, необязательно замещенный -O-C1-12-алкил или -гетероалкил, необязательно замещенный -O-C5-20-арил или -гетероарил, необязательно замещенный -O-C6-30-алкарил или -гетероалкарил или необязательно замещенный -O-C6-30-аралкил или -гетероаралкил, и, если он является замещенным, заместители могут представлять собой фосфонато, фосфорил, фосфанил, фосфино, сульфонато, C1-C20-алкилсульфанил, C5-C20-арилсульфанил, C1-C20-алкилсульфонил, C5-C20-арилсульфонил, C1-C20-алкилсульфинил, C5-C20-арилсульфинил, сульфонамидо, амино, амидо, имино, нитро, нитрозо, гидроксил, C1-C20-алкокси, C5-C20-арилокси, C2-C20-алкоксикарбонил, C5-C20-арилоксикарбонил, карбоксил, карбоксилато, меркапто, формил, сложный C1-C20-тиоэфир, циано, цианато, тиоцианато, изоцианат, тиоизоцианат, карбамоил, эпокси, стиренил, силил, силилокси, силанил, силоксазанил, боронато, борил или галоген или металлсодержащую или металлоидсодержащую группу, где металлоид представляет собой Sn или Ge, где заместители необязательно могут обеспечивать связь с нерастворимым или минимально растворимым субстратом, содержащим оксид алюминия, диоксид кремния или углерод. Иллюстративные, неограничивающие органосиланы включают (R)3SiH, где R представляет собой C1-6-алкил, в частности триэтилсилан и трибутилсилан, смешанные арилалкилсиланы, такие как PhMe2SiH, и полимерные материалы, такие как полиметилгидросилоксан (PMHS).
[0063] Как используют в настоящем документе, термин "сильное основание" относится к соединению с большой аффинностью к атомам водорода, особенно, но не только, в неводных средах. В конкретных независимых вариантах осуществления по меньшей мере одно сильное основание включает гидрид или алкоксид щелочного металла. Таким образом, следует понимать, что это определение не ограничено только классической моделью конъюгирующая кислота-основание, так как конъюгирующей кислотой гидрида может быть молекулярный водород. Одной из мер этой "сильной аффинности" может являться то, что сильное основание, если оно реагирует с водой, может реагировать до практически законченного формирования его гидроксида. Можно считать, что другие "сильные основания" включают соединения алкиллития или ионы амидов, например, бис(триметилсилил)амид калия.
[0064] По-видимому, существует иерархия активности, связанная с противоионами сильных оснований, так, что использования гидридов цезия и калия и алкоксидов является предпочтительным. Иллюстративные гидриды, пригодные по настоящему изобретению, включают гидрид кальция и гидрид калия. Подобным образом, в примере 6.5, таблице 2, пунктах 13 и 24 можно наблюдать действие температуры на эффективность реакции с гидридами, где реакция дибензофурана с KH, проводимая при 100°C, приводит к относительно высоким уровням силилирования и низким уровням образования монорасщепленного продукта, бифенил-2-ола, тогда как проведение подобного эксперимента при 165°C приводит к существенному количественному преобразованию преимущественно в продукт бифенил-2-ол.
[0065] Пригодные алкоксиды включают алкоксиды, содержащие неразветвленные или разветвленные C1-12-алкильные группы или C5-10-ароматические или -гетероароматические группы, например, метоксид, этоксид, пропоксид, бутоксид, 2-этилгексилоксид или бензилоксид. Каждый из них по-видимому обладает сравнимой реакционноспособностью (см., например, пример 6.5, таблицу 2, сравнить с пунктами 17, 25-26 и 28). Кроме того, на уровень активности химической системы также влияет выбор противокатиона, так что предпочтительными являются алкоксиды калия или цезия. Более конкретно, показано, что в этой роли особенно эффективны метоксид, этоксид и трет-бутоксид калия и 2-этилгексилалкоксид цезия. Для сравнения, реакция Et3SiH с трет-бутоксидом лития или натрия не обеспечивает силилирования дибензофурана (см., например, пример 6.5, таблицу 2, пункты 29-31) что свидетельствует о том, что противоион играет важную роль в получение активных силилирующих групп и, возможно, в активации простого эфира субстрата или в обоих случаях. Подобным образом, проведение реакции с трет-бутоксидом калия в присутствии достаточного количества 18-краун-6, действующего в качестве хелатора калия, приводит почти к полному ингибированию реакции.
[0066] Хотя полагают, что относительные количества органосилана и сильного основания, при условии, что оба присутствуют в достаточных количествах, не очень важны, в определенных вариантах осуществления органосилан и по меньшей мере одно сильное основание присутствуют вместе в молярном отношении друг к другу в диапазоне приблизительно от 20:1 до приблизительно 1:1. В других вариантах осуществления эти отношения могут составлять порядка приблизительно от 5:1 до приблизительно 1:1, приблизительно от 3:1 до приблизительно 1:1 или приблизительно от 3:2 до приблизительно 1:1. По-видимому, реакциям силилирования также благоприятствуют такие условия, когда основание присутствует в субстехиометрическом отношении к субстрату, от 0,01:1 до 0,9:1, особенно для более активных систем. Кроме того в определенных вариантах осуществления предусмотрено, что основание присутствует по отношению к субстрату в соотношении приблизительно от 0,01:1 до приблизительно 0,6 или приблизительно от 0. 1:1 до приблизительно 0,6.
[0067] В дополнительных вариантах осуществления предусмотрены системы, дополнительно содержащие соединения на основе N (предпочтительно хелатирующие средства на основе N), включая, например, необязательно замещенный тетраалкилэтилендиамин (например, тетраметилэтилендиамин), необязательно замещенные производные 1,10-фенантролина, необязательно замещенные производные 2,2'-бипиридина и необязательно замещенные производные 4-диметиламинопиридина. См., например, пример 6.9.6 и таблицу 4.
[0068] До этого момента изобретение было описано относительно химической системы, способной к силилированию ароматических соединений или групп, но также следует понимать, что изобретение также включает способы проведения этих преобразований. Таким образом, различные дополнительные варианты осуществления включают способы, где органический субстрат, содержащий ароматическую группу, приводят в контакт с любой из химических систем, описанных выше, в условиях, подходящих для силилирования по меньшей мере части субстрата. Таким образом, в определенных вариантах осуществления предусмотрены способы, где каждый способ включает приведение органического субстрата, содержащего ароматическую группу, в контакт со смесью (a) по меньшей мере одного органосилана и (b) по меньшей мере одного сильного основания в условиях, подходящих для силилирования субстрата; где указанная смесь и субстрат по существу не содержат соединения переходного металла. Как правило, эти варианты осуществления проводят в жидкой фазе в условиях без облучения УФ-светом или электрических или плазменных разрядов.
[0069] В некоторых вариантах осуществления условия, подходящие для силилирования органического субстрата, включают нагревание субстрата со смесью (a) по меньшей мере одного органосилана и (b) по меньшей мере одного сильного основания до температуры в диапазоне приблизительно от 10°C до приблизительно 165°C. В некоторых случаях, можно использовать температуры в диапазоне приблизительно от 20°C, приблизительно 30°C, приблизительно 40°C, приблизительно 50°C, приблизительно 60°C или приблизительно 80°C до приблизительно 165°C, приблизительно 150°C, приблизительно 125°C, приблизительно 100°C или приблизительно 80°C. Любую из температур, описанных в примерах, можно считать независимым вариантом осуществления. Стандартная продолжительность реакции может находиться в диапазоне приблизительно от 2 часов, приблизительно от 4 часов, приблизительно от 6 часов или приблизительно от 10 часов до приблизительно 28 суток, до приблизительно 14 суток, до приблизительно 7 суток, до приблизительно 4 суток, до приблизительно 3 суток, до приблизительно 48 часов, до приблизительно 24 часов, до приблизительно 12 часов или до приблизительно 6 часов.
[0070] Как описано выше, характеристики, описанные как значимые для химических систем силилирования ароматических соединений и ароматических групп также значимы для способов силилирования этих ароматических соединений и ароматических групп. Например, в различных вариантах осуществления способы предусматривают, что система по существу не содержит воды, кислорода или ни воды, ни кислорода.
[0071] В других вариантах осуществления по меньшей мере один органосилан включает органосилан формулы (I) или формулы (II):

где m представляет собой 1, 2 или 3 (предпочтительно 1);
n представляет собой число от 10 до 100; и
каждый R независимо представляет собой необязательно замещенный C1-12-алкил или -гетероалкил, необязательно замещенный C5-20-арил или гетероарил, необязательно замещенный C6-30-алкарил или -гетероалкарил, необязательно замещенный C6-30-аралкил или -гетероаралкил, необязательно замещенный -O-C1-12-алкил или -гетероалкил, необязательно замещенный -O-C5-20-арил или -гетероарил, необязательно замещенный -O-C6-30-алкарил или -гетероалкарил или необязательно замещенный -O-C6-30-аралкил или -гетероаралкил, и, если он является замещенным, заместители могут представлять собой фосфонато, фосфорил, фосфанил, фосфино, сульфонато, C1-C20-алкилсульфанил, C5-C20-арилсульфанил, C1-C20-алкилсульфонил, C5-C20-арилсульфонил, C1-C20-алкилсульфинил, C5-C20-арилсульфинил, сульфонамидо, амино, амидо, имино, нитро, нитрозо, гидроксил, C1-C20-алкокси, C5-C20-арилокси, C2-C20-алкоксикарбонил, C5-C20-арилоксикарбонил, карбоксил, карбоксилато, меркапто, формил, сложный C1-C20-тиоэфир, циано, цианато, тиоцианато, изоцианат, тиоизоцианат, карбамоил, эпокси, стиренил, силил, силилокси, силанил, силоксазанил, боронато, борил, или галоген или металлсодержащую или металлоидсодержащую группу, где металлоид представляет собой Sn или Ge, где заместители необязательно могут обеспечивать связь с нерастворимым или минимально растворимым субстратом, содержащим оксид алюминия, диоксид кремния или углерод.
[0072] В других вариантах осуществления органосилан представляет собой (R)3SiH, где R представляет собой C1-6-алкил, предпочтительно Et3SiH или Et2MeSiH. По меньшей мере одно сильное основание может включать гидрид щелочного металла, как описано выше, например, гидрид кальция или гидрид калия. По меньшей мере одно сильное основание может включать алкоксид щелочного металла, как описано выше, например, где по меньшей мере один алкоксид содержит неразветвленную или разветвленную C1-12-алкильную группу или C5-10-арильную или -гетероарильную группу, предпочтительно метоксид, этоксид, пропоксид, бутоксид или 2-этилгексилалкоксид. Катион щелочного металла предпочтительно представляет собой калий или цезий. В наиболее предпочтительных вариантах осуществления органосилан представляет собой триэтилсилан, триметилсилан, диэтилметилсилан, диэтилсилан, диметилсилан, диметилэтилсилан, этилдиметилсилан, диметилфенилсилан, диэтилфенилсилан, а сильное основание представляет собой трет-бутоксид калия. Другие комбинации или представленные в качестве примера реагенты представляют дополнительные варианты осуществления в этом отношении.
[0073] В определенных вариантах осуществления органосилан (или мономерный эквивалент) и по меньшей мере одно сильное основание присутствуют вместе в молярном отношении друг к другу в диапазоне приблизительно от 20:1 до приблизительно 1:1. В определенных вариантах осуществления по меньшей мере одно сильное основание и органический субстрат присутствуют вместе в молярном отношении друг к другу в диапазоне приблизительно от 0,01:1 до приблизительно 5:1. Но предпочтительно основание относительно органического субстрата присутствует в субстехиометрических количествах, т.е. в соотношении от 0,01:1 до 0,9:1. Таким образом, способы можно рассматривать как каталитические в отношении сильного основания.
[0074] Кроме того, в отношении способов, термин "по существу не содержит соединений переходных металлов" имеет те же значения и связанные варианты осуществления, как описано выше для химической системы; т.е. отражает, что способы эффективно проводят в отсутствие любого преднамеренно добавленного переходного металла-катализатора(ов). Если не указано иначе, при описании способа или системы термин определен для отражения того, что общий уровень переходного металла, как измеряют посредством ICP-MS, как описано в примере 2 ниже, составляет менее чем приблизительно 50 м.д. В дополнительных вариантах осуществления также предусмотрено, что концентрация переходных металлов составляет менее чем приблизительно 100 м.д., 50 м.д., 30 м.д., 25 м.д., 20 м.д., 15 м.д., 10 м.д. или 5 м.д. до приблизительно 1 м.д. или 0 м.д. относительно массы всей системы (т.е. и относительно системы силилирования, и системы силилирования и органического субстрата). Как используют в настоящем документе, термин "переходный металл" определено для обозначения Co, Rh, Ir, Fe, Ru, Os, Ni, Pd, Pt, Cu или их сочетаний. В дополнительных конкретных независимых вариантах осуществления концентрация Ni, как измеряют посредством ICP-MS, составляет менее 25 м.д., менее 10 м.д., менее 5 м.д. или менее 1 м.д. Отмечая, что определенные варианты осуществления химической системы могут включать по меньшей мере один органосилан и сильное основание, следует понимать, что в независимых вариантах осуществления предусмотрено, что при рассмотрении этих комбинаций смесей уровни переходных металлов поддерживают ниже уровней, только что описанных выше.
[0075] В дополнительных вариантах осуществления предусмотрено, что способы дополнительно включают использование субстехиометрических количеств (относительно субстрата) соединений на основе N (предпочтительно хелатирующие средства на основе N), включая, например, необязательно замещенный тетраалкилэтилендиамин (например, тетраметилэтилендиамин), необязательно замещенные производные 1,7-фенантролина, необязательно замещенные производные 1,10-фенантролина, необязательно замещенные производные 2,2'-бипиридина и необязательно замещенные производные 4-диметиламинопиридина. см., например, пример 6.9.6.
[0076] Способы являются достаточно гибкими в отношении субстратов, и для них подходят субстраты, содержащие арильные и гетероарильные группы. Иллюстративные субстраты, содержащие арильные группы, включают субстраты, содержащие необязательно замещенные бензол (включая мезителен и толуол), бифенил, нафталин, антрацен или полиароматические циклические структуры более высших порядков. Эти чистые углеводородные субстраты, как правило, требуют для силилирования кольцевых атомов углерода более вынужденных условий, чем для гетероарильных систем. См. пример 6.4. Однако возможность функционализировать эти углеводородные циклические структуры является важнейшей характеристикой этих способов и систем.
[0077] Когда арильная или гетероарильная группа содержит альфа-метильную или -метиленовую связь C-H, как в необязательно замещенной C1-6-алкильной группе (примером которой является метильные группы толуола, мезителена, 1,2 диметилиндола или 2,5-диметилтиофена в примерах), по-видимому, реакция проходит с формированием альфа-силанов при температурах более низких, чем требуется для силилирования циклических атомов углерода. Как используют в настоящем документе, термин "альфа-углерод" относится к первому атому углерода, расположенному экзоциклически относительно ароматической группы, и "альфа", как в "альфа-метиле или -метилене" предназначена для обозначения метила или метилена на первом экзоциклическом атоме углерода, непосредственно связанном с ароматическим кольцом. Термин "альфа-силан" относится к силану, связанному с альфа-углеродом. Термин "альфа" считают включающим бензильные атомы углерода для 6-членных арильных ароматических соединений. Способы, приводящие к такому силилированию, входят в объем настоящего изобретения.
[0078] Для других экзоциклических кольцевых заместителей, включая экзоциклические кольцевые заместители с экзоциклической ароматической связью C-X, как правило, реакцию проводят способами, описываемыми в настоящем документе. Термин "экзоциклический" относится к положению O, N или S по отношению к ароматической циклической системе. Например, термин "экзоциклический" относится к связи, в которой углерод находится в ароматическом кольце система, а соответствующие атомы кислорода, азота или серы не находятся, и (в случае азота) наоборот. Например, фенол, диметиланилин, 1-метил-1H-пиррол и бензотиол содержат экзоциклические ароматические связи C-O, C-N и C-S, соответственно. Иллюстративные органическ субстраты включают, но не ограничены ими, группы необязательно замещенных простых фениловых эфиров, фениламинов, фенилсульфидов, простых нафтиловых эфиров, нафтиламинов или нафтилсульфидов, N-алкил- или N-арилпирролы или их сочетания.
[0079] Когда X представляет собой O или N, реакция предпочтительно проходит с силилированием кольца в орто-положении или по соседнему углероду относительно углерода, содержащего экзоциклическую связь C-X. По-видимому, богатые электронами системы или электронодонорные группы или заместители, как правило, являются более реакционноспособными, чем бедные электронами системы или электроноакцепторные группы или заместители; последние могут требовать более вынужденных условий, чем предыдущие, но следует отметить, что более вынужденные условия, получаемые посредством более высоких температур, могут приводить к стимуляции направления расщепления C-X, см., например, совместно поданную патентную заявку США, обозначенную как Attorney Docket CTEK-0128 (CIT-6328), зарегистрированную 2 октября 2013 года, озаглавленную "Transition-Metal-Free Reductive Cleavage of Aromatic C-O, C-N, and C-S Bonds by Activated Silanes". Анизол и 2-метоксинафталин демонстрируют особое предпочтение орто-положению, и эта избирательность обеспечивает основание lkz вариантов осуществления, включающих селективное орто-силилирование таких субстратов. См., например, примеры 6.4 и 6.7. Представляет интерес и отличается от описанного выше, что субстраты с экзоциклической ароматической связью C-X, где X представляет собой S-алкил, обеспечивают отличающуюся реакционноспособность, демонстрируя склонность к силилированию алкильной группы, а не ароматической циклической системы. См., например, пример 6.7.4. Этот профиль реакционноспособности обеспечивает основу для вариантов осуществления, включающих β-силилирование таких субстратов.
[0080] В определенных вариантах осуществления способы применяют для органического субстрата, содержащего гетероарильную группу. Неограничивающие гетероарильные группы включают необязательно замещенные фуран, пиррол, тиофен, пиразол, имидазол, триазол, изоксазол, оксазол, тиазол, изотиазол, оксадиазол, пиридин, пиридазин, пиримидин, пиразин, триазон, бензофуран, бензопиррол, бензотиофен, изобензофуран, изобензопиррол, изобензотиофен, индол, изоиндол, индолизин, индазол, азаиндол, бензизоксазол, бензоксазол, хинолин, изохинолин, циннолин, хиназолин, нафтиридин, 2,3-дигидробензофуран, 2,3-дигидробензопиррол, 2,3-дигидробензотиофен, дибензофуран, ксантен, дибензопирол, дибензотиофен. В более предпочтительных вариантах осуществления субстрат содержит группу, содержащую необязательно замещенные группы фурана, пиррола, тиофена, пиразола, имидазола, бензофурана, бензопиррола, бензотиофена, индола, дибензофурана азаиндола, ксантена, дибензопиррола или дибензотиофена. В независимых вариантах осуществления предусмотрено, что способы приводят к силилированным продуктам, замещенным, как описано в настоящем документе.
[0081] В других конкретных вариантах осуществления способы используют для субстратов, содержащих следующие группы:

где X представляет собой N-R", O или S;
Y представляет собой H, N(R")2, O-R" или S-R";
p представляет собой число от 0 до 4, от 0 до 3, от 0 до 2 или от 0 до 1;
R' представляет собой функциональную группу "Fn", как описано выше, или (R')p представляет собой конденсированную алициклическую, гетероалициклическую, арильную или гетероарильную группу; и
R" представляет собой защитную аминогруппу или необязательно замещенные алкил, арил, гетероарил, алкарил или алкгетероарил, предпочтительно необязательно замещенные C1-C6-алкил, фенил, толил, бензил или фенэтил.
[0082] В определенных более конкретных вариантах осуществления способа используют для органических субстратов, содержащих следующие группы:



где X, Y, R', R" и p являются такими, как определено выше. Следует отметить, что обозначение

в каждом случае, предназначено для учета замещения в любом из ароматических колец.
[0083] По-видимому, гетероарильные группы реагируют в способах по изобретению в условиях, которые являются более мягкими, чем для соответствующих им арильных групп, так, что в смешанных арил-гетероарильных системах, реакции, как правило, преимущественно проходят с силилированием гетероарильного кольца. Например, как показано в примерах от 6.9.1 до 6.9.7 и от 6.9.11 до 6.9.13, силилирование проходит преимущественно в гетероциклической части молекулы. Однако и как показано в примере 6.9.9, где арильная группа расположена проксимально (предположительно первой) относительно силилированного гетероарила, силилирование этой арильной группы происходить при значительно более мягких условиях, чем условия, необходимые для системы только с арильными группами (см. примеры 6.7.3 и 6.9.10). Эта возможность получения силилированных кольцевых структур из гетероарильных предшественников является другим полезным свойством и вариантами осуществления настоящего изобретения.
[0084] Также, по-видимому, 5-членные гетероарильные группы реагируют в способах по изобретению в условиях, которые являются более мягкими, чем даже для 6-членных гетероарильных групп. Например, как показано в примере 6.9.6, N-метилазаиндол подвергается силилированию преимущественно в 5-членной гетероциклической части молекулы. И оба кольца подвергаются силилированию в условиях значительно более мягких, чем выявлено для пиридина.
[0085] Реакции силилирования с субстратами, содержащими 5-членные гетероарильные группы, также обеспечивают необычайно высокую и очевидно регулируемую региоселективность. Субстраты, содержащие 5-членные гетероарильные, содержащие O или N, могут подвергаться силилированию по положению C-2 или C-3 в зависимости от времени и температуры. Не намереваясь быть связанным правильностью или неправильностью любой конкретной теории, по-видимому, силилирование в положении C-2 представляет кинетический результат реакции, тогда как силилирование в положении C-3 предпочтительно термодинамически. Представляет интерес, что субстраты, содержащие 5-членные гетероарильные кольца, содержащие S, по-видимому, преобразуются непосредственно и преимущественно в положении C-3. Хотя описание приводится на основе "кинетического" и "термодинамического" путей, что силилирование в положении C-3 обязательно проходит через промежуточное соединение C-2, является неясным. Фактически, в экспериментах с использованием 1,2-диметилиндола и 2,5-диметилтиофена, где положения C-2 блокированы метильными группами, реакция преимущественно протекала с силилированием альфа-метильной группы без признаков силилирования в положении C-3.
[0086] Если не указано иначе, указание на силилирование в конкретном положении предназначено для обозначения региоселективности или региоспецифичности продукта в этом положении более чем приблизительно 80%. Но в других вариантах осуществления предусмотрено, что региоспецифичность в этом положении составляет более чем приблизительно 50%, более чем приблизительно 75%, более чем приблизительно 90% или более чем приблизительно 95%.
[0087] Продукты по способам по изобретению пригодны в ряде агрохимических, фармацевтических и электротехнических приложений, как описано ниже. Они также обеспечивают промежуточные соединения, пригодные для последующего синтеза. Использования ароматических силанов, таких как ароматические силаны, описываемые в настоящем документе, представляют собой пригодные синтоны для получения биарильных/биароматических соединений, например, с использованием способов связывания Хиямы, общеизвестных в данной области. Специалист в данной области без излишнего экспериментирования легко может объединить руководства по этим способам связывания Хиямы со способами, представленными в настоящем документе, для получения биарильных/биароматических соединений, и такие способы получения рассматривают, как входящие в объем настоящего изобретения. Также, Болл с коллегами (Ball et al., Science 28 September 2012: Vol. 337 no. 6102 pp. 1644-1648, включенная в настоящий документ в качестве ссылки для указания катализаторов, способов и субстратов) недавно описали другой способ для связывания триалкилсиланов с использованием катализаторов с золотом, такой как способы, описываемые в настоящем документе, для получения биарильных/биароматических соединений. Специалист в данной области также без излишнего экспериментирования также легко может объединить руководства по связыванию Болла, включая по меньшей мере вторичные арильные соединения, указанные или предлагаемые в ссылке на Болла, для получения биарильных соединений, и такие способы и получения рассматривают, как входящие в объем настоящего изобретения. В таких вариантах осуществления силилированный продукт по настоящему изобретению, выделенный или получаемый in situ, дополнительно подвергают реакции в условиях (включая присутствие подходящего переходного металла-катализатора), подходящих для связывания силилированного продукта со вторым ароматическим соединением с получением биарильного продукта. Как определено в настоящем документе, вторичное ароматическое соединение содержит необязательно замещенную ароматическую группу, включая необязательно замещенные арильные и гетероарильные группы, где термины "необязательно замещенный", "ароматический", "арил" и "гетероарил" имеют те же определения как уже описано в настоящем документе.
[0088] Также известно, что преобразованные ароматические силаны, такие как ароматические силаны, описываемые в настоящем документе, преобразуются в ароматические гидроксисоединения, хорошо известными способами окисления Флеминга-Тамао. Специалист в данной области также без излишнего экспериментирования может легко объединить указания по этим способам окисления Флеминга-Тамао с указаниями, предоставленными в настоящем документе, для получения гидроксилированных ароматических соединений и такие способы и получения рассматривают, как входящие в объем настоящего изобретения. В таких вариантах осуществления ароматические силилированные продукты по настоящему изобретению, выделенные или получаемые in situ, дополнительно подвергают реакции в условиях (включая присутствие катализатора из подходящего переходного металла), подходящих для преобразования силилированного продукта в гидроксилированные ароматические продукты.
[0089] Также, возможность настоящего изобретения обеспечивать силилат для получения заместителей по альфа-углероду (или β-силильных групп в случае экзоциклической серы) также предусматривает, что эти продукты можно использовать в качестве синтонов для реакции олефинирования Петерсона. Известная простота депротонирования альфа-метиленового протона при соседстве с кремнием силана ("эффект альфа-кремния") с образованием альфа-силильного карбаниона может образовывать подходящего предшественника для этой реакции олефинирования. Специалист в данной области, также без излишнего экспериментирования, может легко объединить указания по этой реакции олефинирования Петерсона со способами, предоставленными по настоящему документу, для замены альфа-силильной группы на альфа-олефины, и такие способы и получения рассматривают, как входящие в объем настоящего изобретения. В таких вариантах осуществления ароматические силилированные продукты по настоящему изобретению, выделенные или получаемые in situ, дополнительно подвергают реакции в условиях, подходящих (включая присутствие подходящего переходного металла-катализатора) для преобразования силилированного продукта в ароматические альфа-олефиновые продукты.
[0090] Приводимое ниже перечисление вариантов осуществления предназначено для дополнения, а не для замены или отмены предыдущих описаний.
[0091] Вариант осуществления 1. Химическая система для силилирования органического субстрата, содержащего ароматическую группу, где указанная система содержит смесь (a) по меньшей мере одного органосилана и (b) по меньшей мере одного сильного основания, где указанная система предпочтительно по существу не содержит соединений переходных металлов.
[0092] Вариант осуществления 2. Система по варианту осуществления 1, где соединение переходного металла присутствует в количестве менее 10 м.д. относительно массы всей системы.
[0093] Вариант осуществления 3. Химическая система по вариантам осуществления 1 или 2, дополнительно содержащая необязательно замещенный тетраалкилэтилендиамин (например, тетраметилэтилендиамин), необязательно замещенное производное 1,7-фенантролина, необязательно замещенное производное 1,10-фенантролина, необязательно замещенное производные 2,2'-бипиридина или необязательно замещенное производное 4-диметиламинопиридина.
[0094] Вариант осуществления 4. Система по любому из вариантов осуществления 1-3, которая по существу не содержит воды, кислорода или ни воды, ни кислорода.
[0095] Вариант осуществления 5. Система по любому из вариантов осуществления 1-4, где по меньшей мере один органосилан включает органосилан формулы (I) или формулы (II):

где: m представляет собой 1, 2 или 3; n представляет собой число от 10 до 100; и каждый R независимо представляет собой необязательно замещенный C1-12-алкил или -гетероалкил, необязательно замещенный C5-20-арил или -гетероарил, необязательно замещенный C6-30-алкарил или -гетероалкарил, необязательно замещенный C6-30-аралкил или -гетероаралкил, необязательно замещенный -O-C1-12-алкил или -гетероалкил, необязательно замещенный -O-C5-20-арил или -гетероарил, необязательно замещенный -O-C6-30-алкарил или -гетероалкарил или необязательно замещенный -O-C6-30-аралкил или -гетероаралкил, и, если он является замещенным, заместители могут представлять собой фосфонато, фосфорил, фосфанил, фосфино, сульфонато, C1-C20-алкилсульфанил, C5-C20-арилсульфанил, C1-C20-алкилсульфонил, C5-C20-арилсульфонил, C1-C20-алкилсульфанил, C5-C20-арилсульфанил, сульфонамидо, амино, амидо, имино, нитро, нитрозо, гидроксил, C1-C20-алкокси, C5-C20-арилокси, C2-C20-алкоксикарбонил, C5-C20-арилоксикарбонил, карбоксил, карбоксилато, меркапто, формил, сложный C1-C20-тиоэфир, циано, цианато, тиоцианато, изоцианат, тиоизоцианат, карбамоил, эпокси, стиренил, силил, силилокси, силанил, силоксазанил, боронато, борил или галоген или металлсодержащую или металлоидсодержащую группу, где металлоид представляет собой Sn или Ge, где заместители необязательно могут обеспечивать связь с нерастворимым или минимально растворимым субстратом, содержащим оксид алюминия, диоксид кремния или углерод.
[0096] Вариант осуществления 6. Система по варианту осуществления 5, где органосилан представляет собой (R)3SiH, где R представляет собой C1-6-алкил.
[0097] Вариант осуществления 7. Система по любому из вариантов осуществления 1-6, где по меньшей мере одно сильное основание включает гидрид или алкоксид щелочного металла.
[0098] Вариант осуществления 8. Система по любому из вариантов осуществления 1-7, где по меньшей мере одно сильное основание включает гидрид щелочного металла.
[0099] Вариант осуществления 9. Система по варианту осуществления 8, где по меньшей мере одно сильное основание включает гидрид кальция или гидрид калия.
[0100] Вариант осуществления 10. Система по любому из вариантов осуществления 1-7, где по меньшей мере одно сильное основание включает алкоксид щелочного металла.
[0101] Вариант осуществления 11. Система по варианту осуществления 10, где по меньшей мере один алкоксид содержит неразветвленную или разветвленную C1-12-алкильную группу или C5-10-ароматическую или -гетероароматическую группу.
[0102] Вариант осуществления 12. Система по варианту осуществления 11, где по меньшей мере один алкоксид включает метоксид, этоксид, пропоксид, бутоксид или 2-этилгексилалкоксид.
[0103] Вариант осуществления 13. Система по любому из вариантов осуществления 7-12, где основание гидрида или алкоксида щелочного металла представляет собой алкоксид калия или цезия.
[0104] Вариант осуществления 14. Система по любому из вариантов осуществления 1-13, где органосилан представляет собой триэтилсилан, а сильное основание представляет собой трет-бутоксид калия.
[0105] Вариант осуществления 15. Система по любому из вариантов осуществления 1-14, где органосилан и по меньшей мере одно сильное основание присутствуют вместе в молярном отношении друг к другу в диапазоне приблизительно от 20:1 до приблизительно 1:1.
[0106] Вариант осуществления 16. Система по любому из вариантов осуществления 1-15, дополнительно содержащая органическое ароматическое соединение, где указанное соединение представляет собой растворитель, субстрат или и растворитель, и субстрат.
[0107] Вариант осуществления 17. Система по варианту осуществления 16, где органическое соединение включает необязательно замещенные бензол, бифенил, нафталин или антраценовую циклическую структуру.
[0108] Вариант осуществления 18. Система по варианту осуществления 16 или 17, где органическое ароматическое соединение включает гетероарильную группу.
[0109] Вариант осуществления 19. Система по варианту осуществления 18, где органическое ароматическое соединение включает необязательно замещенные группы фурана, пиррола, тиофена, пиразола, имидазола, триазола, изоксазола, оксазола, тиазола, изотиазола, оксадиазола, пиридина, пиридазина, пиримидина, пиразина, триазона, бензофурана, бензопиррола, бензотиофена, изобензофурана, изобензопиррола, изобензотиофена, индола, изоиндола, индолизина, индазола, азаиндола, бензизоксазола, бензоксазола, хинолина, изохинолина, циннолина, хиназолина, нафтиридина, 2,3-дигидробензофурана, 2,3-дигидробензопиррола, 2,3-дигидробензотиофена, дибензофурана, ксантена, дибензопирола или дибензотиофена.
[0110] Вариант осуществления 20. Система по варианту осуществления 18 или 19, где органическое ароматическое соединение включает необязательно замещенные группы фурана, пиррола, тиофена, пиразола, имидазола, бензофуранаа, бензопиррола, бензотиофена, индола, азаиндола, дибензофурана, ксантена, дибензопиррола, дибензотиофена или пространственно-затрудненного дибензофуранаа, дибензопиррола или дибензотиофена.
[0111] Вариант осуществления 21. Система по любому из вариантов осуществления 16-20, где органическое ароматическое соединение содержит по меньшей мере одну из следующих групп:

где X представляет собой N-R", O или S;
Y представляет собой H, N(R")2, O-R" или S-R";
p представляет собой число от 0 до 4, 0 до 3, 0 до 2 или 0 до 1;
R' представляет собой функциональную группу "Fn", как описано выше, или (R')p представляет собой необязательно замещенную конденсированную алициклическую, гетероалициклическую, арильную или гетероарильную группу; и
R" представляет собой защитную аминогруппу или необязательно замещенные алкил, арил, гетероарил, алкарил или алкгетероарил, предпочтительно необязательно замещенные C1-C6, алкил, фенил, толил, бензил или фенэтил.
[0112] Вариант осуществления 22. Система по любому из вариантов осуществления 16-21, где субстрат содержит по меньшей мере одну из следующих групп:


где X, Y, R', R" и p являются такими, как определено выше. Следует отметить, что обозначение

в каждом случае, предназначено для учета замещения в любом из ароматических колец.
[0113] Вариант осуществления 23. Система из способа по любому из вариантов осуществления 16-21, где ароматическое органическое соединение содержит по меньшей мере одну альфа-метильную или -метиленовую связь C-H, где указанный способ приводит к образованию альфа-силана.
[0114] Вариант осуществления 24. Способ силилирования субстрата, содержащего ароматическую группу, где указанный способ включает приведение определенного количества органического субстрата в контакт с системой по любому из вариантов осуществления 1-23.
[0115] Вариант осуществления 25. Способ, включающий приведение органического субстрата, содержащего ароматическую группу, в контакт со смесью (a) по меньшей мере одного органосилана и (b) по меньшей мере одного сильного основания в условиях, подходящих для силилирования субстрата; где указанная смесь и субстрат предпочтительно по существу не содержат соединений переходных металлов.
[0116] Вариант осуществления 26. Способ по варианту осуществления 25, где соединение переходного металла присутствует в количестве менее 10 м.д. относительно массы всей системы.
[0117] Вариант осуществления 27. Способ по вариантам осуществления 25 или 26, где смесь дополнительно содержит необязательно замещенный тетраалкилэтилендиамин (например, тетраметилэтилендиамин), необязательно замещенное производное 1,7-фенантролина, необязательно замещенное производное 1,10-фенантролина, необязательно замещенные производные 2,2'-бипиридина или необязательно замещенное производное 4-диметиламинопиридина.
[0118] Вариант осуществления 28. Способ по любому из вариантов осуществления 25-27, который по существу не включает воды, кислорода или ни воды, ни кислорода.
[0119] Вариант осуществления 29. Способ по любому из вариантов осуществления 25-28, где по меньшей мере один органосилан включает органосилан формулы (I) или формулы (II):

где m представляет собой 1, 2 или 3 (предпочтительно 1);
n представляет собой число от 10 до 100; и
каждый R независимо представляет собой необязательно замещенный C1-12-алкил или -гетероалкил, необязательно замещенный C5-20-арил или -гетероарил, необязательно замещенный C6-30-алкарил или -гетероалкарил, необязательно замещенный C6-30-аралкил или -гетероаралкил, необязательно замещенный -O-C1-12-алкил или -гетероалкил, необязательно замещенный -O-C5-20-арил или -гетероарил, необязательно замещенный -O-C6-30-алкарил или -гетероалкарил или необязательно замещенный -O-C6-30-аралкил или -гетероаралкил, и, если он является замещенным, заместители могут представлять собой фосфонато, фосфорил, фосфанил, фосфино, сульфонато, C1-C20-алкилсульфанил, C5-C20-арилсульфанил, C1-C20-алкилсульфонил, C5-C20-арилсульфонил, C1-C20-алкилсульфинил, C5-C20-арилсульфинил, сульфонамидо, амино, амидо, имино, нитро, нитрозо, гидроксил, C1-C20-алкокси, C5-C20-арилокси, C2-C20-алкоксикарбонил, C5-C20-арилоксикарбонил, карбоксил, карбоксилато, меркапто, формил, сложный C1-C20-тиоэфир, циано, цианато, тиоцианато, изоцианат, тиоизоцианат, карбамоил, эпокси, стиренил, силил, силилокси, силанил, силоксазанил, боронато, борил или галоген или металлсодержащую или металлоидсодержащую группу, где металлоид представляет собой Sn или Ge, где заместители необязательно могут обеспечивать связь с нерастворимым или минимально растворимым субстратом, содержащим оксид алюминия, диоксид кремния или углерод.
[0120] Вариант осуществления 30. Способ по любому из вариантов осуществления 25-29, где органосилан представляет собой (R)3SiH, где R независимо представляет собой C1-6-алкил.
[0121] Вариант осуществления 31. Способ по любому из вариантов осуществления 25-30, где по меньшей мере одно сильное основание включает гидрид или алкоксид щелочного металла.
[0122] Вариант осуществления 32. Способ по любому из вариантов осуществления 25-31, где по меньшей мере одно сильное основание включает гидрид щелочного металла.
[0123] Вариант осуществления 33. Способ по варианту осуществления 32, где по меньшей мере одно сильное основание включает гидрид кальция или гидрид калия.
[0124] Вариант осуществления 34. Способ по любому из вариантов осуществления 25-33, где по меньшей мере одно сильное основание включает алкоксид щелочного металла.
[0125] Вариант осуществления 35. Способ по варианту осуществления 34, где по меньшей мере один алкоксид содержит неразветвленную или разветвленную C1-12-алкильную группу или C5-10-арильную или -гетероарильную группу.
[0126] Вариант осуществления 36. Способ по варианту осуществления 35, где по меньшей мере один алкоксид включает метоксид, этоксид, пропоксид, бутоксид или 2-этилгексилалкоксид.
[0127] Вариант осуществления 37. Способ по любому из вариантов осуществления 31-36, где гидрид или алкоксид щелочного металла представляет собой алкоксид калия или цезия.
[0128] Вариант осуществления 38. Способ по любому из вариантов осуществления 25-37, где органосилан представляет собой триэтилсилан, а сильное основание представляет собой трет-бутоксид калия.
[0129] Вариант осуществления 39. Способ по любому из вариантов осуществления 25-28, где органосилан и по меньшей мере одно сильное основание присутствуют вместе в молярном отношении друг к другу в диапазоне приблизительно от 20:1 до приблизительно 1:1.
[0130] Вариант осуществления 40. Способ по любому из вариантов осуществления 25-39, где по меньшей мере одно сильное основание и субстрат присутствуют вместе в молярном отношении друг к другу в диапазоне приблизительно от 0,01:1 до приблизительно 5:1, предпочтительно в диапазоне приблизительно от 0,01:1 до приблизительно 0,9:1.
[0131] Вариант осуществления 41. Способ по любому из вариантов осуществления 25-40, где органический субстрат содержит необязательно замещенные бензол, бифенил, нафталин или антраценовую циклическую структуру.
[0132] Вариант осуществления 42. Способ по любому из вариантов осуществления 25-41, где органический субстрат содержит экзоциклическую ароматическую связь C-X, где X представляет собой N, O или S.
[0133] Вариант осуществления 43. Способ по любому из вариантов осуществления 25-42, где органический субстрат содержит экзоциклическую ароматическую связь C-X и силилирование происходит в орто-положении относительно экзоциклической связи C-X, где X представляет собой N, O или S.
[0134] Вариант осуществления 44. Способ по любому из вариантов осуществления 25-43, где органический субстрат содержит гетероарильную группу.
[0135] Вариант осуществления 45. Способ по любому из вариантов осуществления 25-44, где субстрат содержит необязательно замещенные группы фурана, пиррола, тиофена, пиразола, имидазола, триазола, изоксазола, оксазола, тиазола, изотиазола, оксадиазола, пиридина, пиридазина, пиримидина, пиразина, триазона, бензофурана, бензопиррола, бензотиофена, изобензофурана, изобензопиррола, изобензотиофена, индола, изоиндола, индолизина, индазола, азаиндола, бензизоксазола, бензоксазола, хинолина, изохинолина, циннолина, хиназолина, нафтиридина, 2,3-дигидробензофурана, 2,3-дигидробензопиррола, 2,3-дигидробензотиофена, дибензофурана, ксантена, дибензопирола или дибензотиофена.
[0136] Вариант осуществления 46. Способ по любому из вариантов осуществления 25-45, где субстрат содержит необязательно замещенные группы фурана, пирролаа, тиофена, пиразола, имидазола, бензофурана, бензопиррола, бензотиофена, индола, азаиндола, дибензофурана, ксантена, дибензопиррола или дибензотиофена.
[0137] Вариант осуществления 47. Способ по любому из вариантов осуществления 25-46, где органический ароматический субстрат содержит по меньшей мере одну из следующих групп:

где X представляет собой N-R", O или S;
Y представляет собой H, N(R")2, O-R" или S-R";
p представляет собой число от 0 до 4,0 до 3, 0 до 2 или 0 до 1;
R' представляет собой функциональную группу "Fn", как описано выше, или (R')p представляет собой необязательно замещенные конденсированную алициклическую, гетероалициклическую, арильную или гетероарильную группу; и
R" представляет собой защитную аминогруппу или необязательно замещенные алкил, арил, гетероарил, алкарил или алкгетероарил, предпочтительно необязательно замещенные C1-C6-алкил, фенил, толил, бензил или фенэтил.
[0138] Вариант осуществления 48. Способ по любому из вариантов осуществления 25-47, где субстрат содержит по меньшей мере одну из следующих групп:

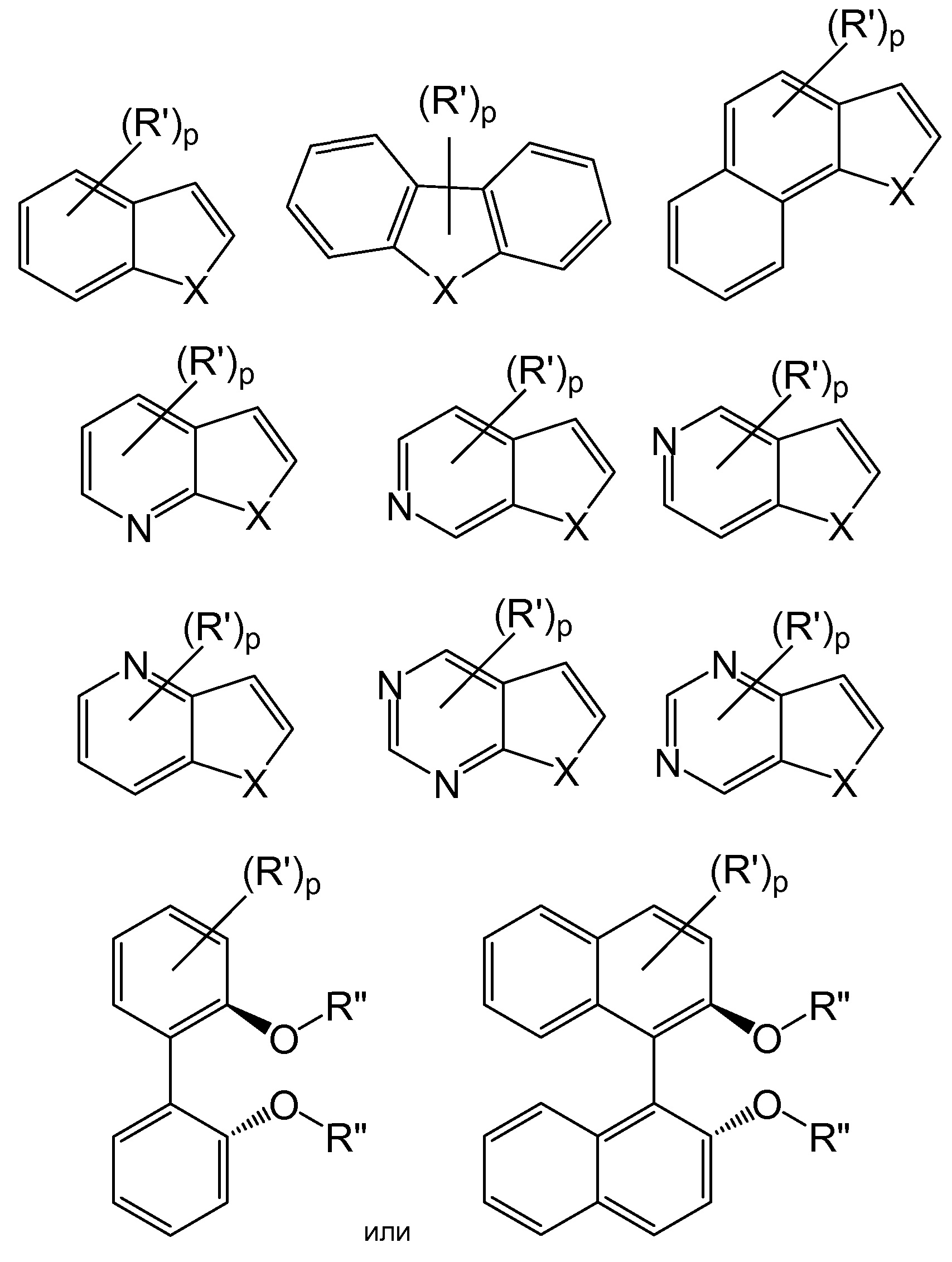
где X, Y, R', R" и p являются такими, как определено выше. Следует отметить, что обозначение

в каждом случае, предназначено для учета замещения в любом из ароматических колец.
[0139] Вариант осуществления 49. Способ по любому из вариантов осуществления 25-48, где органический субстрат содержит гетероарильную группу структуры:

и силилирование происходит в положении C-2 гетероарильного кольца.
[0140] Вариант осуществления 50. Способ по любому из вариантов осуществления 25-49, где органический субстрат содержит гетероарильную группу структуры:

и силилирование происходит в положении C-3 гетероарильного кольца.
[0141] Вариант осуществления 51. Способ по любому из вариантов осуществления 25-50, где ароматический субстрат содержит по меньшей мере одну альфа-метильную или -метиленовую связь C-H, где указанный способ приводит к образованию альфа-силана.
[0142] Вариант осуществления 52. Способ по любому из вариантов осуществления 25-51, где ароматический субстрат является полимерным.
[0143] Вариант осуществления 53. Способ по любому из вариантов осуществления 25-52, где ароматический силилированный продукт дополнительно подвергают реакции в условиях, подходящих для связывания силилированного продукта со вторым ароматическим соединением с получением биарильного продукта.
[0162] Вариант осуществления 54. Способ по любому из вариантов осуществления 25-52, где ароматический силилированный продукт дополнительно подвергают реакции в условиях, подходящих для преобразования силилированного продукта в ароматический гидроксилированный продукт.
[0144] Вариант осуществления 55. Способ по любому из вариантов осуществления 25-52, где ароматический силилированный продукт дополнительно подвергают реакции в условиях, подходящих для преобразования силилированного продукта в ароматический альфа-олефиновый продукт.
ПРИМЕРЫ
[0145] Приводимые ниже примеры предоставлены для иллюстрации некоторых из принципов, описанных в настоящем описании. Хотя полагают, что каждый пример предоставляет конкретные отдельные варианты осуществления композиции, способов получения и использования, ни один из примеров не следует рассматривать как ограничивающий более общие варианты осуществления, описываемые в настоящем документе.
[0146] В приводимых ниже примерах, проведена работа для обеспечения точности в отношении используемых чисел (например, количества, температуры и т.д.), но следует учитывать определенные экспериментальные ошибки и отклонения. Если не указано иначе, температура приведена в градусах Цельсия, давление является атмосферным или близким к нему.
[0147] Пример 1: Общая информация
[0148] Если не указано иначе все реакции проводили в сухой лабораторной посуде в атмосфере аргона с использованием стандартных способов работы с линией Шленка или в перчаточной камере в разреженной среде в атмосфере азота. Мезителен (чистота, >99,0% (GC)) кипятили с обратным холодильником над натрием/бензофеноном, затем перегоняли. Тетрагидрофуран очищали пропусканием через очистную колонку с растворителем, затем дополнительно перегоняли над смесью натрия-калия и дегазировали аргоном. Все другие растворители очищали пропусканием через очистные колонки с растворителями и дополнительно дегазировали аргоном. Растворители для ЯМР для всех чувствительных к воздушной среде экспериментов сушили над CaH2 и при пониженном давлении переносили или перегоняли в сухую колбу Шленка и затем дегазировали аргоном. Триэтилсилан (99%) приобретали в Sigma-Aldrich, кипятили с обратным холодильником над молекулярными ситами, а затем перегоняли. Затем перед использованием его дегазировали посредством трех циклов замораживания-прокачивания-оттаивания, а затем пропускали через нейтральный оксид алюминия. Дейтеротриэтилсилан (97 атомных % D) приобретали в Sigma-Aldrich и перед использованием дегазировали посредством трех циклов замораживания-прокачивания-оттаивания и другие коммерчески доступные жидкие реагенты обрабатывали аналогично. Фенилдиметилсилан (>98%), этилдиметилсилан (98%) и диэтилсилан (99%) приобретали в Sigma-Aldrich и перегоняли над CaH2 и перед использованием дегазировали посредством трех циклов замораживания-прокачивания-оттаивания. Другие коммерчески доступные жидкие реагенты обрабатывали аналогично. 1-метилиндол (>97%), бензофуран(99%), тианафтен (98%), 1-метоксинафталин (> 98%), анизол (99%) и тиоанизол (99%) приобретали в Sigma-Aldrich и перед использованием перегоняли. 2-метоксинафталин дважды перекристаллизовывали из кипящего Et2O. 1-фенилпиррол (99%) растворяли в Et2O и пропускали через активированный оксид алюминия. Простой эфир удаляли при пониженном давлении и твердый остаток дважды перекристаллизовывали из смеси 3:1 абсолютного EtOH/воды. 1-фенилпиррол (99%), простой дифениловый эфир (>99%), дибензотиофен (>99%) приобретали в Sigma-Aldrich и использовали в таком виде, как получали. 4-метоксипиридин (97%) и 2,6-диметоксипиридин (98%) приобретали в Sigma-Aldrich, несколько раз пропускали через нейтральный, активированный оксид алюминия и перед использованием подвергали 3 циклам замораживания-прокачивания-оттаивания. 1-метил-7-азаиндол получали способом Cheve, G. et al., Medchemcomm 2012, 3, 788. KOt-Bu степени возгонки (99,99%) приобретали в Sigma-Aldrich и перед использованием подвергали возгонке при пониженном давлении (4 Па, 160°C). Прост ди-4-(метил)фениловый эфир, 1-нафтол, 2-нафтол, 4-трет-бутиланизол, 4-метиланизол, 1,3-дифеноксибензол, 2-метоксинафталин и 1,0М раствор THF фторида тетрабутиламмония приобретали в Sigma-Aldrich и использовали в том виде, как получали. 4-(метокси)дибензофуран, Простой ди-4-(трет-бутил)фениловый эфир, простые нафтиловые эфиры, простой 4-(фенил)фенилфенилвый эфир, 2-этоксинафталин, 2-неопентилоксинафталин, 2-трет-бутилоксинафталин синтезировали способами из литературы. Стандартные эксперименты ЯМР-спектроскопии проводили на спектрометре Varian Mercury (1H, 300 МГц), Varian Inova 400 МГц, спектрометре Varian 500 МГц, оборудованном зондом AutoX или спектрометре Varian 600 МГц, оборудованном зондом Triax. Химические сдвиги регистрировали в м.д. со сдвигом в сторону слабого поля от Me4Si с использованием пика остаточного растворителя в качестве внутреннего стандарта. Спектры анализировали и обрабатывали с использованием MestReNova версии 7. Анализы GC-FID проводили на газовом хроматографе Agilent 6890N, оборудованном капиллярной колонкой HP-5 (5%-фенил)-метилполисилоксан (Agilent). Анализ GC-MS проводили на газовом хроматографе Agilent 6850, оборудованном капиллярной колонкой HP-5 (5%-фенил)-метилполисилоксан (Agilent). Масс-спектры с высоким разрешением (EI и FAB) получали на масс-спектрометрическом оборудовании California Institute of Technology. Спектры EPR регистрировали на спектрометры Bruker EMS.
[0149] Пример 2: Анализ ICP-MS
[0150] Анализ ICP-MS проводили с использованием масс-спектрометрического оборудования California Institute of Technology со 100 мг образцов дибензофурана, триэтилсилан, мезителена и трет-бутоксида калия, которые добавляли в 50 мл пробирки для расщепления DigiTUBE (SCP Science) с последующим добавлением в каждую пробирку для расщепления 3,0 мл азотной кислоты Plasma Pure (SCP Scicncc) и нагреванием при 75°C в течение 36 часов. После расщепления каждый образец разбавляли с использованием воды Nanopure/Milli Q до 50 мл и анализ образца проводили на спектрометре ICPMS HP 4500. Полуколичественный анализ проводили с использованием для калибровки раствора лития, иттрия, церия и талия 10 м.д. Каждый образец анализировали дважды и предоставляли средние результаты измерений. (Таблица 1).
[0151] Пример 3: Общий способ
[0152] В перчаточную камеру помещали 4 мл флакон с завинчивающейся крышкой с соответствующим субстратом (0,1-0,5 ммоль, 1 эквив.), основанием (0,1-5 эквив.) и магнитной мешалкой с последующим добавлением растворителя (1 мл) и триэтилсилана (1-5 эквив.) шприцем. Реакционную пробирку закрывали покрытой тефлоном завинчивающейся крышкой и нагревали при данной температуре и в течение определенного времени внутри перчаточной камеры. После охлаждения до комнатной температуры, реакционную смесь цвета от черно-красного до черного разбавляли простым диэтиловым эфиром (3 мл) и осторожно гасили 1 мл 1 Н водной HCl. Добавляли тридекан (внутренний стандарт для GC), органический слой разделяли и водный слой экстрагировали простым эфиром (3 мл) до тех пор, пока контроль TLC не переставал выявлять присутствия активных в УФ-излучении соединений в экстрактах. Объединенные органические слои пропускали через тонкий слой целита и подвергали анализам GC/FTD, GC/MS и1H-ЯМР. Если не указано иначе, в препаративных экспериментах выделяли и характеризовали только продукты с общим выходом, превосходящим 2%. В случае простых нафтилалкиловых эфиров использовали другой способ обработки. После охлаждения реакционную смесь разбавляли дихлорметаном (5 мл) и осторожно гасили 2 мл 1н водной HCl. Добавляли тридекан и смесь переносили в делительную воронку. Органическую фазу разделяли и водный слой экстрагировали дихлорметаном (3 мл). Объединенные органические слои сушили над безводным MgSO4 и фильтровали. Для всех реакций продукты идентифицировали с использованием GC/MS и GC/FTD и ЯМР при сравнении с достоверными образцами. Следовые растворимые побочные продукты, наблюдаемые при восстановлении простых нафтилалкиловых эфиров, включали нафталин, 1,2,3,4-тетрагидронафталин и 5,6,7,8-тетрагидро-2-нафтол.
[0153] В большинстве случаев перед характеристикой посредством ЯМР и/или GC-MS посредством независимого спектрального анализа или посредством сравнения с достоверными образцами или посредством обоих способов продукты выделяли и очищали. В тех случаях, когда продукт не выделяли и не очищали, характеристику проводили на основе анализов GC-MS и/или GC-FID.
[0154] Пример 4: Синтез и характеристика избранных соединений
[0155] Пример 4.1: 4-(триэтилсилил)дибензофуран (3)
[0156] Указанное в заголовке соединение получали по аналогии с протоколом синтеза 4-(триметилсилил)дибензофурана Kelly и коллег; Bckele, H., et al., J. Org. Chem., 1997, 62, 2259. Данные для (3): бесцветное масло.1H-ЯМР (500 МГц, CDCl3): δ 7,99-7,96 (м, 2Har), 7,59 (д-like, J=10 Гц, 1Har), 7,54 (дд, J=2, 5 Гц, 1Har), 7,48-7,44 (м, 1Har), 7,37-7,33 (м, 2Har), 1,03 (м, 15H, 3CH2CH3).13C-ЯМР (126 МГц, CDCl3) δ 161,30, 156,05, 133,57, 126,92, 122,52, 122,48, 121,58, 120,68, 111,75, 7,63, 3,59. HRMS: [C18H22OSi] рассчитано 282,1440; измерено 282,1444.
[0157] Пример 4.2: 4,6-бис(триэтилсилил)дибензофуран (4)
[0158] К растворe дибензофурана (2,00 г, 11,9 ммоль, 1 эквив.) и тетраметилэтилендиамина (11,1 мл, 29,7 ммоль, 2,5 эквив.) в тетрагидрофуране (50 мл) медленно добавляли трет-бутиллитий (17,5 мл 1,7M раствора в пентан, 29,8 ммоль, 2,5 эквив.) при -78°C в атмосфере аргона. Смеси позволяли достигать температуры окружающей среды и перемешивание продолжали в течение 4 час с последующим добавлением хлортриэтилсилана (10,1 мл, 60 ммоль, 5 эквив.). Полученную смесь перемешивали при температуре окружающей среды в течение дополнительных 16 час. После гашения реакции раствором насыщенного хлорида аммония (40 мл) и экстракции простым диэтиловым эфиром (3×30 мл) объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния (гексан) и полученный продукт перекристаллизовывали из смеси метанола и изопропанола (1:1) с получением 4,6-бис(триэтилсилил)дибензофурана (1,28 г, 2,45 ммоль, 28%) в виде бесцветных игл. Данные для (4): бесцветные иглы. Т.плавл. = 59-61°C.1H-ЯМР (300 МГц, CDCl3) δ 7,97 (дд, J=3, 9 Гц, 2Har), 7,54 (дд, J=3, 9 Гц, 2Har), 7,33 (т, J=9 Гц, 2Har), 1,07-0,95 (м, 30H, 6CH2CH3).13C-ЯМР (126 МГц, CDCl3) δ 160,90, 133,48, 122,87, 122,34, 121,57, 120,03, 7,66, 3,52. HRMS: [C24H36OSi2] рассчитано 396,2305; измерено 396,2321.
[0159] Пример 4.3: 3-(триэтилсилил)бифенил-2-ол (5)
[0160] Указанное в заголовке соединение получали посредством расщепления 3 (см. ниже). Данные для (5): белое тверд вещество. Т.плавл. = 44-46°C1H-ЯМР (300 МГц, CDCl3) δ 7,52-7,40 (м, 5Har), 7,36 (дд,7=3, 9 Гц, 1Har), 7,23 (дд, J=3, 6 Гц, 1Har), 6,98 (т, J=9 Гц, 1Har), 5,41 (с, 1H, OH), 1,02-0,96 (м, 9H, CH3), 0,91-0,83 (м, 6H, CH2).13C-ЯМР (75 МГц, CDCl3) δ 157,25, 137,51, 135,97, 131,30, 129,58, 129,39, 128,01, 127,17, 123,04, 120,40, 7,79, 3,69. HRMS: [C18H24OSi] рассчитано 284,1596; измерено 284,1583.
[0161] Пример 4.4: (3'-триэтилсилил)бифенил-2-ол (6)
[0162] Указанное в заголовке соединение получали посредством расщепления 3 (см. ниже). Данные для (6): бесцветное масло.1H-ЯМР(500 МГц, CDCl3): δ 7,57-7,56 (м, 1Har), 7,54-7,52 (м, 1Har), 7,49-7,44 (м, 2Har), 7,28-7,24 (м, 2Har), 7,02-6,99 (м, 2Har), 5,24 (с, 1H, OH), 0,98 (т, J=10 Гц, 9H, CH3), 0,82 (кв, J=15 Гц, 6H, CH2).13C ЯМР (126 МГц, CDCl3): δ 153,44, 139,07, 136,12, 134,71, 133,76, 130,23, 129,36, 129,08, 128,53, 128,44, 120,80, 115,72, 7,43, 3,31. HRMS: [C18H24OSi] рассчитано 284,1596; измерено 284,1585.
[0163] Пример 4.5: 3,3'-бис(триэтилсилил)бифенил-2-ол (7)
[0164] Указанное в заголовке соединение получали в соответствии с общим способом, нагревая дибензофуран (1, 840 мг, 5,0 ммоль, 1 эквив.) с KOt-Bu (1,12 г, 10 ммоль, 2 эквив.) и Et3SiH (4,0 мл, 25 ммоль, 5 эквив.) в 20 мл толуола в течение 20 часов при 100°C. После обработки водным кислотным раствором неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием гексана и гексана-простого эфира (10:1) с получением среди прочих выделенных продуктов 20 мг (0,05 ммоль, 1%) 7. Данные для (7): маслянистое твердое вещество1H-ЯМР (300 МГц, CDCl3): δ 7,53-7,44 (м, 2Har), 7,46-7,44 (м, 2Har), 7,36 (дд, J=1,5, 7,5 Гц, 1Har), 7,23 (дд, J=1,5, 7,5 Гц, 1Har), 6,98 (т, J=7 Гц, 1Har), 5,42 (с, 1H, OH), 1,01-0,96 (м, 18H, 6CH3) 0,91-0,77 (м, 15H, 6CH2).13CNMR(75 МГц, CDCl3): δ 157,37, 139,45, 136,61, 135,87, 135,09, 133,86, 131,38, 129,57, 128,71, 127,55, 122,97, 120,36, 7,80, 7,57, 3,69, 3,46. HRMS: [C24H38OSi2] рассчитано 398,2461; измерено 396,2470.
[0165] Пример 4.6: простой о-триэтилсилилдифениловый эфир
[0166] Простой о-триэтилсилилдифениловый эфир получали модифицированным способом Финка на 30 ммоль шкале на основе простого дифенилового эфира. После добавления Et3SiCl реакционную смесь перемешивали при 40°C в течение 4 часов с последующей водной обработкой и перегонкой при пониженном давлении с получением указанного в заголовке соединения в виде бесцветного масла с выходом 88%.1H-ЯМР (500 МГц, CDCl3: δ 7,47 (дд, J=7,0, 1,5 Гц, 1Har), 7,35-7,31 (м, 2Har), 7,30-7,25 (м, 1Har), 7,10-7,06 (м, 1Har), 7,02-6,97 (м, 2Har), 6,79 (д, J=8,0, 1Har), 0,95 (т-like, J=8,5 Гц, 9H), 0,83 (кв-like, J=8,0 Гц, 6H).13C-ЯМР (126 МГц, CDCl3: δ 162,33, 157,39, 136,57, 130,58, 129,86, 129,82, 127,76, 123,34, 123,08, 122,86, 119,04, 117,22, 7,71, 3,55. HRMS: [C18H24SiO] рассчитано 284,1596, измерено 284,1587.
[0167] Пример 5: Эксперименты EPR
[0168] Дибензофуран (1, 16,8 мг, 0,1 ммоль, 1 эквив.), KOt-Bu (22,5 мг, 0,2 ммоль, 2 эквив.) и Et3SiH (80 микролитров, 0,5 ммоль, 5 эквив.) нагревали в 0,4 мл толуола в течение 1 часа при 100°C в перчаточной камере. После этого реакционную смесь разбавляли 0,8 мл толуола и фильтровали в пробирку EPR. Выясняли, что реакционная смесь является активной в EPR и записывали спектр в пределах срока 20 мин после фильтрования (фиг.2). В контрольном эксперименте, регистрируемом без дибензофурана, наблюдали тот же сигнал, только с меньшей интенсивностью. Эти результаты соответствуют реакционноспособным радикалам, которые задокументированы для реакций гомолитического ароматического замещения. Выявлено, что добавление 1,10-фенантролина в сочетании с KOt-Bu является вредным, так как преобразования 1 не наблюдали.
[0169] Пример 6: Избранные реакции
[0170] Пример 6.1: Реакции 4-(триэтилсилил)дибензофурана

[0171] Реакцию проводили в соответствии с общим способом, нагревая 4-Et3Si-дибензофуран (3, 141 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (112 мг, 1 ммоль, 2 эквив.) и Et3SiH (401 микролитров, 2,5 ммоль, 5 эквив.) в 2 мл толуола в течение 20 часов при 100°C. После обработки водным кислотным раствором неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием гексана и гексана-простого эфира (10:1) с выделением 2-фенилфенола (2, 30 мг, 0,177 ммоль, 35%), 2-триэтилсилил-6-фенилфенола (5, 37 мг, 0,134 ммоль, 26%), 2-(3-триэтилсилилфенил)фенола (6, 17 мг, 0,063 ммоль, 12%). Количества неизрасходованного 3, а также продуктов 1, 4 и 7 получали с использованием постхроматографического анализа GC-FID соответствующих смешанных фракций.
[0172] Пример 6.2: Исследование силилированных дибензофуранов в качестве промежуточных соединений в отношении расщепления связей C-O: попытки расщепления с использованием KOt-Bu
[0173] Исходное вещество 3 (14,1 мг, 0,05 ммоль, 1 эквив.) нагревали с KOt-Bu (5,6 мг или 11,2 мг, 1 или 2 эквив., соответственно) в 0,8 мл д-толуола при 100°C в течение 20 часов в пробирке J. Young в атмосфере азота. Контроль прохождения реакции посредством1H-ЯМР продемонстрировал отсутствие преобразования 3 в обоих случаях. Подобным образом, исходные вещества 3 (28,2 мг, 0,1 ммоль, 1 эквив.) или 4 (39,6 мг 0,1 ммоль, 1 эквив.) нагревали с KOt-Bu (36,6 мг) в 0,3 мл мезителена при 160°C в течение 20 часов. Последующий анализ неочищенных реакционных смесей посредством GC-FID или1H-ЯМР выявил 3% преобразование до 1 в случае 3 и 5% преобразование до 3 из 4.
[0174] Пример 6.3: Реакции 4-(метокси)дибензофурана при повышенной температуре


[0175] Реакцию проводили в соответствии с общим способом, нагревая 4-MeO-дибензофуран (8, 89 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (112 мг, 1 ммоль, 2 эквив.) и Et3SiH (401 микролитров, 2,5 ммоль, 5 эквив.) в 2 мл толуола в течение 20 часов при 100°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием гексана и гексана-простого эфира с восстановлением неизрасходованного исходного вещества 8 (3 мг, 0,015 ммоль, 3%) и выделением дибензофурана (1, 8,4 мг, 0,05 ммоль, 10%; так как фракции 1 содержали небольшие количества исходного 8, количественный анализ проводили посредством1H-ЯМР с CH2Br2 в качестве внутреннего стандарта), 1,1'-бифенил-2-ола (2, 4,3 мг, 0,025 ммоль, 5%), 4-Et3Si-дибензофурана (3, 11 мг, 0,039 ммоль, 8%), 2-метокси-6-фенил-фенола (9, мг, 0,025 ммоль, 5%), 2-(3'-метоксифенил)фенола (10, 47 мг, 0,235 ммоль, 47%). Примечание: охарактеризовывали только соединения с выходом, превосходящим 2%. Спектральные распределения1H- иl3C-ЯМР 9 и 10 соответствовали литературным отчетам.
[0176] Пример 6.4: триэтилсилилирование аренов при повышенных температурах
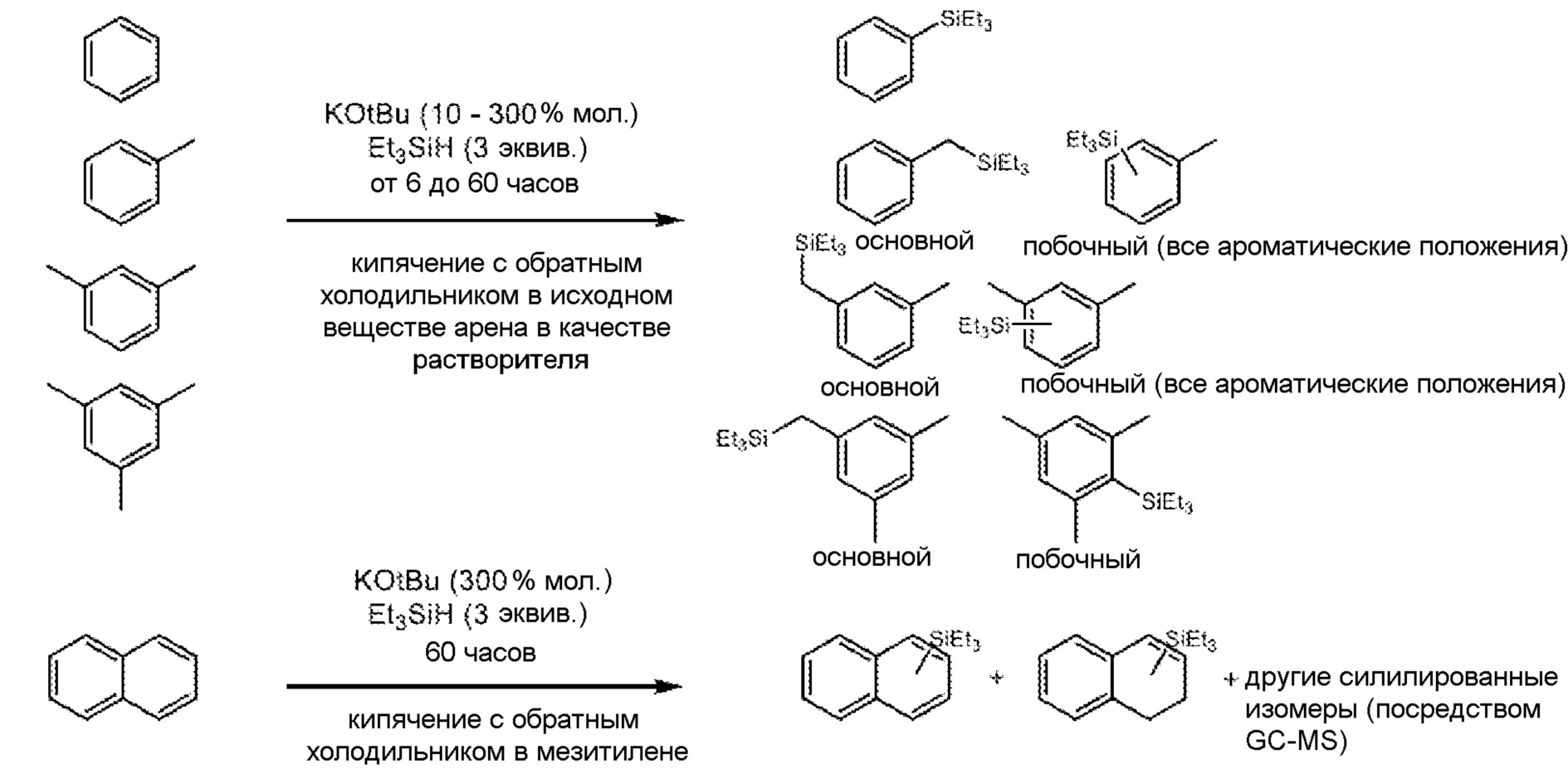
[0177] Во многих случаях образование получаемых из растворителя силилированных продукты наблюдали при повышенных температурах в течение экспериментов, направленных на расщепление связей C-O, C-N или C-S, при использовании в качестве растворителей толуола или мезителена при повышенных температурах, используемых в реакциях восстановительного расщепления. Так как отделить получаемые продукты от соответствующих им исходных растворителей посредством колоночной хроматографии или перегонки было невозможным, с этого момента оценить их выходы было сложно, но их ориентировочно оценивали в диапазоне 5-10% на основе Et3SiH. В случае толуола подлинность продуктов подтверждали посредством сравнения полученных спектров ЯМР с литературными данными (Rychnovsky, et al. J. Org. Chem. 2003, 68, 10135.) Таким образом, сделано заключение, что основным продуктом является бензилтриэтилсилан (17), что также соответствует анализу GC-MS характера фрагментации изомерных продуктов. Подобным образом, по-видимому, силилирование мезителена происходит преимущественно в бензильном (или альфа) положении. HRMS [C15H26Si] рассчитано 234,1804, измерено 234,1804).
[0178] Ароматические амины также поддаются силилированию. В следующем случае, посредством GC-MS идентифицирована следующая схема, действующую в приведенных условиях:

По-видимому при более низких температурах эта реакция приводит к смеси продуктов с невозможностью идентифицировать один отдельный продукт. Возможно, хотя и не подтверждено, что очевидное нормальное предпочтения для силилирования в орто-положении относительно экзоциклического амина было ингибировано вследствие стерических объемных затруднений, ассоциированных с двумя метильными группами.
[0179] Пример 6.5: Силилирование дибензофурана при повышенных температурах
[0180] Если не указано иначе эксперименты проводили с использованием общих способов, описанных в примерах 1 и 3. Выходы были воспроизводимы в пределах ±2%. В данном эксперименте примечательно, что низкие уровни основания, особенно субстехиометрические количества основания относительно субстрата, даже при этих повышенных температурах приводили к высочайшим выходам силилированных продуктов относительно продуктов расщепления.
[0181] Пример 6.6: Силилирование простых арилалкиловых эфиров при повышенных температурах
[0182] Силилирование простых арилалкиловых эфиров при повышенных температурах проводили в условиях, используемых для простых диариловых эфиров для исследования селективности расщепления связи C-O sp2 в сравнению со связью sp3. При повышенных температурах в этих экспериментах реакция 2-метоксинафталина приводила к 2-нафтолу в качестве главного продукта с умеренным выходом (схема 1). Анализ GC-MS неочищенной реакционной смеси вместе с 2-метилнафталином выявил присутствие следовых количеств нафталина и дополнительных восстановленных молекул, включая продукты частичного восстановления ароматических групп. Также детектировали соединения, предположительно происходящие вследствие силилирования 2-нафтола. Подобным образом, расщепление 2-этоксинафталена в тех же условиях приводила к образованию 2-нафтола с немного большим выходом, но с теми же или аналогичными побочными продуктами. Исследовали пространственно стерически затрудненные простые эфиры для исследования приспособляемости и возможного механизма расщепления связи C-O. Несмотря на наличие большого алкильного заместителя рядом с кислородом простого эфира, реакция 2-неопентилоксинафталина приводила к образованию 2-нафтола приблизительно с тем же выходом, что и при менее объемных субстратах. Даже 2-трет-бутилоксинафтален расщеплялся с образованием ожидаемого нафтола с выходом 55% (схема 1). Контрольные эксперименты, проводимые в идентичных условиях, но без триэтилсилана приводили к получению 2-нафтола в случаях 2-этокси- и 2-трет-бутилоксинафталена, хотя и со значительно сниженными выходами. Так как 2-метокси- и 2-неопентилоксисубстраты оставались интактными при таких расщеплениях без силанов, вероятно действующим являлся механизм отщепления b. При попытке восстановления 4-трет-бутил- и 4-метиланизолов в стандартных условиях выходы соответствующих фенолов были высокими, вероятно вследствие более трудного силилирования замещенного фенильного кольца вследствие стерических затруднений (схема2).
Схема 1
Восстановительное расщепление простых арилалкиловых эфиров при повышенных температурах

[0183] Суммарно, селективность расщепления связи C-O алкила контрастирует с селективностью, наблюдаемой в катализируемых Ni и бораном реакций расщепления C-O, где происходит восстановление C-O арила. Также характерно, что в этих условиях наблюдали только следовые количества продуктов гидрирования нафталиновых колец, что контрастирует с результатами ионного гидрирования на основе силанов, изложенного в литературе.
[0184] Информативным является сравнение с результатами, представленными выше, расщеплений метоксизамещенных простых диариловых эфиров 8 и 11 (схема 2). Хотя простые арилалкиловые эфиры демонстрируют строгое предпочтение в отношении восстановления связей кислорода с алкилами по сравнению со связями кислорода с арилами, оба метоксисубстрата на схеме 2 демонстрируют обращенную региоселективность, демонстрируя почти исключительно продукты разрыва связей кислорода с арилами. Не намереваясь быть связанным правильностью этой теории, этот эффект можно приписать присутствию донорного атома кислорода в орто-положении со связью C-O, претерпевающей разрыв. Поддержкой этого заключения является высокая селективность восстановительного открытия кольца производного дибензофурана 8, которое в основном приводит к 10. Подобным образом, наблюдают предпочтительное образование фенола и анизола со сходной селективностью в отношении фенолов 12 и 13 при расщеплении модели лигнина 11. Можно предполагать, что этот эффект можно объяснить резонансной стабилизацией положительного заряда атома кислорода происходящей при электрофильной активации связи C-O, которая претерпевает разрыв. Для тестирования этой гипотезы соединение 3 подвергали условиям реакции и выделяли фенолы 5 и 6 с открытым кольцом вместе с десилилированными продуктами 1 и 2 (схема 2, вставка C). В отсутствие резонансной стабилизации, селективность расщепления возвращалась в пользу изомера 5. Также следует отметить, что, таким образом, как показывает образование 1 и 2, в типичных условиях реакции реакция силилирования обратима. После иллюстрации потенциала для восстановления моделей лигнина 4-O-5 8 и 11, этот способ тестировали с использованием олигомерного простого эфира 14, содержащего шесть связей Car-O (схема 2, вставка D). Примечательно, что при 165°C достигали количественного преобразования мезителена 14 и получали фенол, бензол, резорцинол и другие неидентифицированные продукты только с 0,5 эквивалентами силана на связь арил-кислород.
[0185] На схеме 2, соединения 1-7 относятся к соответствующим соединениям, описанным в примере 5.9.
[0186]
Схема 2
Способ A: Et3SiH (5) KOt-Bu (2), 100°C, 20 часов в толуоле
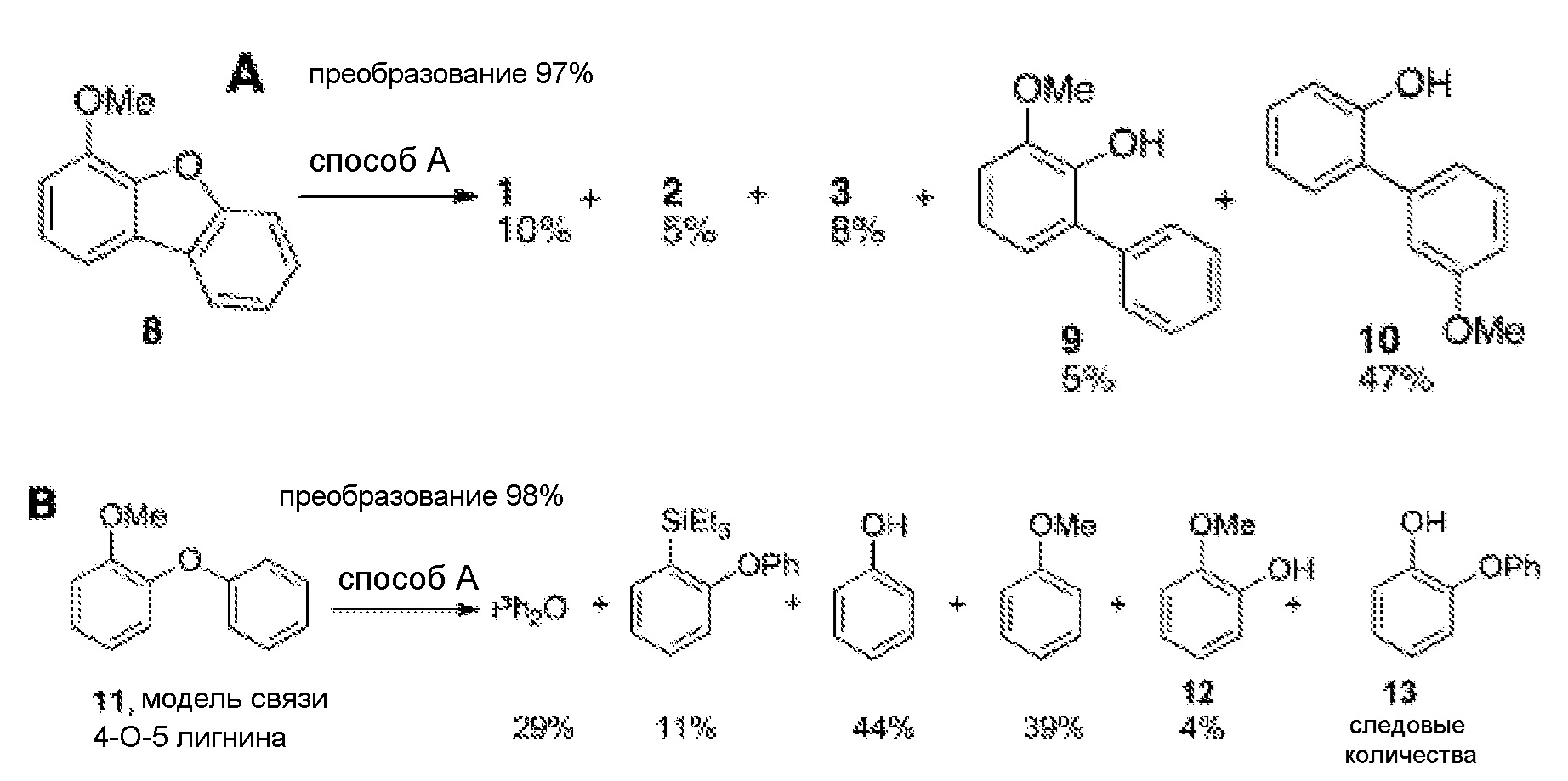
[0187]
Схема 2
Способ B: Et3SiH (3) KOt-Bu (3), 165°C, 20 часов в мезителене


[0188] Пример 6.7: Силилирование простых арилалкиловых эфиров и тиоэфиров при температуре окружающей среды
[0189] Пример 6.7.1: триэтил(2-метоксифенил)силан

[0190] Реакцию проводили в соответствии с общим способом, нагревая анизол (54 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (11 мг, 0,1 ммоль, 0,2 эквив.) и Et3SiH (239 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 65°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием гексана (изократического) с получением 59 мг (54%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 7,40-7,17 (м, 2H), 7,01-6,81 (м, 2H), 3,77 (с, 3H), 1,02-0,85 (м, 9H), 0,87-0,74 (м, 6H).13C-ЯМР (126 МГц, THF-d8) δ 164,58, 135,52, 130,42, 123,92, 120,08, 109,23, 54,09, 6,93, 3,22.
[0191] Пример 6.7.2: триэтил(3-метоксинафталин-2-ил)силан

[0192] Реакцию проводили в соответствии с общим способом, нагревая 2-метоксинафталин (79 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (19,6 мг, 0,18 ммоль, 0,35 эквив.) и Et3SiH (319 микролитров, 2,0 ммоль, 4 эквив.) в 1 мл тетрагидрофурана в течение 48 часов при 65°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с элюцией гексаном (изократическим) с получением 79 мг (58%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 7,84 (с, 1H), 7,78-7,73 (д, 1H), 7,73-7,68 (д, 1H), 7,38 (ддд, J=8,2, 6,8, 1,3 Гц, 1H), 7,27 (ддд, J=8,1, 6,8, 1,2 Гц, 1H), 7,15(с, 1H), 3,90 (с, 3H), 1,01-0,90 (м,9H), 0,68-0,53 (м,6H).13C-ЯМР (126 МГц, THF-d8) δ 163,03, 137,88, 136,83, 130,10, 128,58, 128,09, 127,29, 127,21, 124,03, 104,57, 55,25, 8,02, 7,48. HRMS: [C17H24OSi] рассчитано 272,1608, измерено 272,1596. Спектры HSQC 2-метоксинафталин и его продукта реакции предоставлены на фиг.5.
[0193] Представляет интерес, что реакция, начинаясь с 1-метоксинафталина не приводит к силилированному продукту:

Реакцию проводили в соответствии с общим способом, нагревая 1-метоксинафталин (79 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (11,2 мг, 0,1 ммоль, 0,1 эквив.) и Et3SiH (240 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 65°C. Реакционную смесь разбавляли простым диэтиловым эфиром (1 мл), гасили водой (0,5 мл) и органическую фазу анализировали посредством анализов GC-MS, GC-FID и1H-ЯМР. Анализ посредством GC-MS и GC-FID (стандарт тридекан) выявил образование продукта расщепления C-O арила нафталина и продукта расщепления связи C-O алкила нафтола с выходом 13 и 8 процентов соответственно, причем до полного исключения любых силилированных молекул.
[0194] Пример 6.7.3 Силилирование простого дифенилового эфира

[0195] Реакцию проводили в соответствии с общим способом, нагревая простой фениловый эфир (85 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (11 мг, 0,10 ммоль, 0,2 эквив.) и Et2SiH2 (194 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 65°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием смеси 80:2 гексана:триэтиламина с получением 68 мг (20%) указанного в заголовке соединения в виде бесцветного маслянистого твердого вещества.1H-ЯМР (500 МГц, THF-d8) δ 7,64-7,57 (м, 2H), 7,55 (дд, J=7,3, 1,8 Гц, 1H), 7,41 (ддд, J=8,3, 7,2, 1,8 Гц, 1H), 7,15 (дд, J=8,3, 1,0 Гц, 1H), 7,14-7,09 (м, 2H), 4,34 (Si-H) (p-like, J=1,2 Гц, 1H), 1,06-0,95 (м, 12H), 0,92-0,82 (м, 8H).13CNMR (126 МГц, THF-d8) δ 166,04, 161,43, 139,74, 137,00, 135,55, 135,05, 132,12, 130,19, 128,79, 123,56, 123,37, 118,41, 9,06, 7,93, 6,70, 4,83. HRMS: [C20H27OSi2] рассчитано 339,1601, измерено 339,1607.
[0196] Вторая фракция реакционной смеси давала 34 мг (39%) циклического производного.1H-ЯМР (500 МГц, THF-d8) δ 7,57-7,50 (м, 2H), 7,40 (ддд, J=8,3, 7,2, 1,8 Гц, 2H), 7,15 (дд, J=8,6, 0,7 Гц, 2H), 7,11 (тд, J=7,2, 1,0 Гц, 2H), 0,99-0,95 (м, 4H), 0,92-0,86 (м, 6H).13C-ЯМР (126 МГц, THF-d8) δ 161,54, 134,96, 132,07, 123,41, 118,80, 117,39, 7,95, 6,72. HRMS: [C16H19OSi] рассчитано 255,1205, измерено 255,1206. Спектры HSQC этих продуктов реакции предоставлены на фиг.6A и 6B.
[0197] Получали третью фракцию, содержащую продукт с низким выходом (приблизительно 7%) спектральные характеристики которого по-видимому соответствуют структуре моносилилированного продукта, представленного выше.
[0198] Пример 6.7.4: триэтил((фенилтио)метил)силан

[0199] Реакцию проводили в соответствии с общим способом, нагревая тиоанизол (62 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (11 мг, 0,1 ммоль, 0,2 эквив.) и Et3SiH (239 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 65°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием гексана (изократического) с получением 81 мг (68%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 7,31-7,26(м,2H), 7,25-7,19 (м, 2H), 7,11-7,01 (м, 1H), 1,03 (т, J=7,9 Гц, 9H), 0,78-0,60 (м, 6H).l3C-ЯМР (126 МГц, THF-d8) δ 140,73, 128,31, 125,69, 124,19, 13,01, 6,62, 3,06. HRMS: [C13H21SSi] рассчитано 237,1140, измерено 237,1133. Спектры HSQC тиоанизола и его продукта реакции предоставлены на фиг.7A и 7B.
[0200] Пример 6.8: Эксперименты с гетероарильными соединениями с C-N и C-S при повышенных температурах
[0201] Также проводили эксперименты с гетероарильными соединениями с C-N и C-S. В случае соединений, содержащих связи C-N, реакционноспособность, по-видимому, являлась сходной с реакционноспособностью, наблюдаемой для связей C-O, и обоснованно ожидалось, что способы в широком диапазоне, используемые для последнего приводят к реакционноспособности сходной с первым:


[0202] В случае соединений, включающих соединения с C-S, способы, по-видимому, как правило, приводят к полному десульфурированию молекул. Это различие в реакционноспособностях может отражать различия в энергиях связей между связями C-O, C-N и C-S (ср. энергии диссоциации связи C-X в феноле (111), анилине (104) и тиофеноле (85), все в ккал/моль). Особый интерес представляет десульфурирование даже пространственно-затрудненных дибензотиофенов в относительно мягких условиях. Ни в одном из этих преобразований не детектировали единственные продукты C-S:


[0203] Пример 6.9: Эксперименты с гетероарильными соединениями при температуре окружающей среды
[0204] Проводили ряд экспериментов в условиях окружающей среды (65°C или ниже) для тестирования региоселективности нескольких из наиболее реакционноспособных гетероарильных соединений. Условия тестирования и результаты приведены ниже. Выходы всех реакций определяли или посредством выделения (хроматография на силикагеле или перегонка колба-в-колбу) или посредством анализов GC-FID или ЯМР с использованием внутреннего стандарта для количественного анализа. Следует отметить, что выявлено, что силилированные по C-3 гетероарены в некоторых случаях имеют тенденцию к протодесилилилированию на силикагеле. В этих случаях использовали перегонку колба-в-колбу или, альтернативно, хроматографию на силикагеле с добавляемым к элюенту приблизительно 3% триэтиламином или комбинацию этих способов. Продукты идентифицировали как указано посредством1H-,13C-ЯМР и спектроскопии гетероядерного одноквантового взаимодействия (HSQC) или GC-MS или посредством комбинации любого из них, где возможно использование сравнений с достоверными образцами.
[0205] Пример 6.9.1: 1-метил-2-(триэтилсилил)-1H-индол

[0206] Реакцию проводили в соответствии с общим способом, нагревая N-метилиндол (66 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (8,4 мг, 0,08 ммоль, 0,15 эквив.) и Et3SiH (239 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 48 часов при 23°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с элюцией гексаном (изократическим) с получением 88 мг (72%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 7,50 (дт, J=7,9, 1,0 Гц, 1H), 7,32 (д кв, J=8,3, 0,9 Гц, 1H), 7,11 (ддд, J=8,2, 6,9, 1,2 Гц, 1H), 6,97 (ддд, J=7,9, 7,0, 0,9 Гц, 1H), 6,68 (д, J=0,9 Гц, 1H), 3,84 (с,3H), 1,06-0,98 (м, 9H), 0,98- 0,92 (м, 6H).13C-ЯМР (126 МГц, THF-d8) δ 140,48, 136,86, 128,70, 121,44, 120,05, 118,51, 112,96, 108,71, 32,18, 6,83, 3,63. Спектр HSQC этого продукта реакции предоставлен на фиг.8.
[0207] Пример 6.9.2: 1-метил-3-(триэтилсилил)-1H-индол

[0208] Реакцию проводили в соответствии с общим способом, нагревая N-метилиндол (66 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (56 мг, 0,5 ммоль, 1 эквив.) и Et3SiH (88 микролитров, 0,55 ммоль, 1,1 эквив.) в 1 мл тетрагидрофурана в течение 312 часов при 23°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с элюцией гексаном (изократическим):NEt3 в соотношении 95:5 с получением 103 мг (84%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 7,63 (дт, J=7,9, 1,0 Гц, 1H), 7,32 (дт, J=8,2, 0,9 Гц, 1H), 7,15 (с, 1H), 7,12 (ддд, J=8,2, 7,0, 1,1 Гц, 1H), 7,01 (ддд, J=8,0, 7,0, 1,1 Гц, 1H), 3,78 (с, 3H), 1,06-0,95 (м, 9H), 0,95-0,83 (м, 6H).l3C-ЯМР (126 МГц, THF-d8) δ 138,63, 135,94, 133,37, 121,44, 120,88, 118,79, 108,96, 104,39, 31,61, 7,04, 4,11. Спектр HSQC этого продукта реакции предоставлен на фиг.9.
[0209] Пример 6.9.3: 2-(этилдиметилсилил)-1-метил-1H-индол

[0210] Реакцию проводили в соответствии с общим способом, нагревая тиоанизол (62 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (11 мг, 0,1 ммоль, 0,2 эквив.) и EtMe2SiH (198 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 48 часов при 23°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием гексана (изократического) с получением 80 мг (74%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 7,48 (д, J=7,9 Гц, 1H), 7,31 (дд, J=8,4, 1,0 Гц, 1H), 7,10 (ддд, J=8,2, 6,9, 1,2 Гц, 1H), 6,95 (ддд, J=7,9, 6,9, 0,9 Гц, 1H), 6,64 (д, J=0,9 Гц, 1H), 3,84 (с, 3H), 1,05-0,95 (м, 3H), 0,89 (д, J=7,9 Гц, 2H), 0,38 (с, 6H).13C-ЯМР (126 МГц, THF-d8) δ 140,45, 138,94, 128,58, 121,45, 120,10, 118,51, 113,53, 111,90, 108,67, 32,17, 7,37, 6,77, -3,67. HRMS: [C13H19NSi] рассчитано 217,1280; измерено 217,1287.
[0211] Пример 6.9.4: 1-бензил-2-(триэтилсилил)-1H-индол

[0212] Реакцию проводили в соответствии с общим способом, нагревая 1-бензилиндол (62 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (11 мг, 0,1 ммоль, 0,2 эквив.) и Et3SiH (239 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 48 часов при 23°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием гексана (изократического) с получением 50 мг (31%) указанного в заголовке соединения в виде бесцветного маслянистого твердого вещества.1H-ЯМР (500 МГц, THF-d8) δ 7,56 (ддд, J=7,7, 1,3,0,7 Гц, 1H), 7,25-7,07 (м, 4H), 7,02 (ддд, J=8,2, 6,9, 1,3 Гц, 1H), 6,98 (ддд, J=7,9, 6,9, 1,1 Гц, 1H), 6,92-6,86 (м, 2H), 6,80 (д, J=0,9 Гц, 1H), 5,52 (с, 2H), 1,06-0,88 (м, 9H), 0,85-0,69 (м, 6H).
[0213] Пример 6.9.5: 1-бензил-2-(этилдиметилсилил)-1H-индол

[0214] Реакцию проводили в соответствии с общим способом, нагревая 1-бензилиндол (104 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (17 мг, 0,15 ммоль, 0,3 эквив.) и EtMe2SiH (198 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 25°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием смеси гексана:простого диэтилового эфира:триэтиламина в соотношении 80:1:4 соответственно с получением 107 мг (73%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 7,55 (ддд, J=7,7, 1,4, 0,8 Гц, 1H), 7,22-7,16 (м, 2H), 7,16-7,09 (м, 2H), 7,02 (ддд, J=8,2, 6,9, 1,4 Гц, 1H), 6,97 (ддд, J=8,0, 6,9, 1,2 Гц, 1H), 6,86 (ддд, J=7,2, 1,3, 0,7 Гц, 2H), 6,78 (д, J=0,9 Гц, 1H), 5,51 (д, J=1,1 Гц, 2H), 0,95-0,90 (м, 3H), 0,24 (с, 6H).13C-ЯМР (126 МГц, THF-d8) δ 141,31, 140,50, 139,94, 130,09, 129,39, 127,90, 126,71, 122,96, 121,45, 120,10, 113,93, 110,81, 50,62, 8,50, 7,93, -2,40. HRMS: [C19H23NSi] рассчитано 293,1600, измерено 293,1590.
[0215] Пример 6.9.6: 1-метил-2-(триэтилсилил)-1H-пирроло[2,3-b]пиридин

[0216] Реакцию проводили в соответствии с общим способом, нагревая N-метил-1H-пирроло[2,3-b]пиридин (66 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (11 мг, 0,1 ммоль, 0,2 эквив.) и Et3SiH (239 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 45 часов при 35°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием пошаговой градиентной элюции (начиная со 100% гексана и пошагово увеличивая полярность элюента до 30% EtOAc в гексане) с получением 89 мг (73%) указанного в заголовке соединения в виде бледно-желтого масла.1H-ЯМР (500 МГц, THF-d8) δ 8,45-7,95 (м, 1H), 7,97-7,66 (м, 1H), 6,95 (дд, J=7,7, 4,6 Гц, 1H),6,68(с, 1H), 3,94 (с, 2H), 1,05-1,00 (м, 9H), 0,97 (тд, J=7,1, 1,7 Гц, 6H).13C-ЯМР (126 МГц, THF-d8) δ 150,95, 142,87, 137,82, 127,38, 120,13, 114,79, 110,76, 30,27, 6,74, 3,31. HRMS: [C14H23N2Si] рассчитано 247,1642, измерено 247,1631. Спектр HSQC этого продукта реакции предоставлен на фиг.10.
[0217] Пример 6.9.7: Эффект тетраметилэтилендиамина (ТМЕДА)
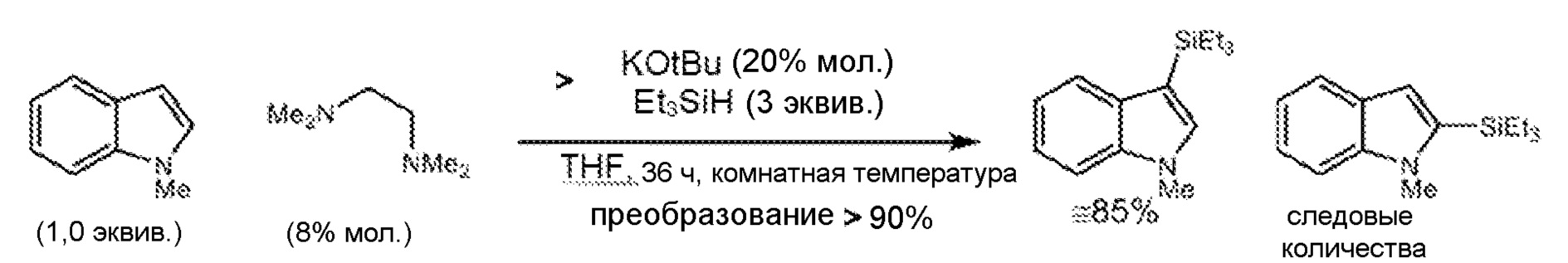
[0218] Пример 6.9.8: Силилирование N-метил-2-метилиндола

[0219] Реакцию проводили в соответствии с общим способом, нагревая 1,2-диметилиндол (73 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (17 мг, 0,15 ммоль, 0,3 эквив.) и Et3SiH (319 микролитров, 2,0 ммоль, 4 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 65°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием смеси гексана:простого диэтилового эфира:триэтиламина в соотношении 80:1:4, соответственно, с получением 74 мг (57%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 7,35-7,29 (м, 1H), 7,19 (дд, J=8,1, 0,9 Гц, 1H),6,97 (ддд, J=8,2, 7,1, 1,2 Гц, 1H), 6,90 (ддд, J=8,0, 7,1, 1,1 Гц, 1H), 6,06 (д, J=0,8 Гц, 1H), 3,64 (с, 3H), 2,25 (д, J =0,7 Гц, 2H), 0,96 (т, J=7,9 Гц, 9H), 0,71-0,58 (м, 6H).13C-ЯМР (126 МГц, THF-d8) δ 139,50, 138,30, 129,69, 120,24, 119,70, 119,47, 109,27, 98,96, 29,75, 11,73, 7,62, 4,16. HRMS: [C16H25NSi] рассчитано 259,1756, измерено 259,1754. Спектр HSQC этого продукта реакции предоставлен на фиг.11.
[0220] Пример 6.9.9: Силилирование N-метилпиррола

[0221] Пример 6.9.10: 9,9-диэтил-9H-бензо[d]пирроло[1,2-a][1,3]азасилол

[0222] Реакцию проводили в соответствии с общим способом, нагревая 1-фенилпиррол (161 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (11 мг, 0,1 ммоль, 0,2 эквив.) и Et2SiH2 (194 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 60°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием гексана (изократического) с получением 97 мг (85%) смеси, содержащей приблизительно 7:1 смеси указанного в заголовке соединения и исходного вещества в виде бесцветного маслянистого твердого вещества.1H-ЯМР (500 МГц, THF-d8) δ 7,51 (ддд, J=7,1, 1,5, 0,6 Гц, 1H), 7,47 (дд, J=2,6, 1,1 Гц, 1H), 7,43-7,39 (м, 1H), 7,38-7,33 (м, 1H), 7,04 (тд, J=7,2, 1,0 Гц, 1H), 6,45 (дд, J=3,2, 1,1 Гц, 1H), 6,29 (т, J=2,9 Гц, 1H), 1,00-0,94 (м, 6H), 0,94- 0,86 (м, 4H).13C-ЯМР (126 МГц, THF-d8) δ 134,81, 131,71, 130,28, 124,66, 120,80, 118,47, 118,18, 114,05, 112,42, 111,28, 7,91, 5,18. HRMS: [C14H18NSi] рассчитано 228,1213, измерено 228,1208. Спектр HSQC этого продукта реакции предоставлен на фиг.12.
[0223] Пример 6.9.11: Бензофуран-2-илтриэтилсилан

[0224] Реакцию проводили в соответствии с общим способом, нагревая бензофуран (59 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (19,6 мг, 0,18 ммоль, 0,35 эквив.) и Et3SiH (239 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 45 часов при 60°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с элюцией гексаном (изократического) с получением 44 мг (38%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, Ацетон-d6) δ 7,64 (ддд, J=7,7, 1,3,0,7 Гц, 1H), 7,53 (дд, J=8,2, 0,9 Гц, 1H), 7,30 (ддд, J=8,3, 7,2, 1,3 Гц, 1H), 7,22 (ддд, J=7,7, 7,2, 1,0 Гц, 1H), 7,16 (д, J=1,0 Гц, 1H), 1,09-0,98 (м, 9H), 0,92-0,84 (м, 6H). Спектр HSQC этого продукта реакции предоставлен на фиг.13.
[0225] Пример 6.9.12: Бензо[b]тиофен-3-илтриэтилсилан

[0226] Реакцию проводили в соответствии с общим способом, нагревая тианафтен (66 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (8,4 мг, 0,08 ммоль, 0,15 эквив.) и Et3SiH (239 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 50 часов при 23°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с элюцией гексаном:триэтиламином в соотношении 80:2 с получением 103 мг (83%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 7,90-7,85 (м, 1H), 7,84-7,76 (м, 1H), 7,53 (д, J=0,8 Гц, 1H), 7,34-7,20 (м, 2H), 1,08-0,99 (м, 9H), 0,95-0,80 (м, 6H).13C-ЯМР (126 МГц, THF-d8) δ 144,78, 142,34, 139,12, 132,97, 125,10, 124,84, 124,34, 122,91, 7,84, 5,10. HRMS: [C14H20SSi] рассчитано 248,1051, измерено 248,1055. Спектр HSQC этого продукта реакции предоставлен на фиг.14.
[0227] Пример 6.9.13: Бензо]b]тиофен-3-илдиметил(фенил)силан

[0228] Реакцию проводили в соответствии с общим способом, нагревая тианафтен (66 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (8,4 мг, 0,08 ммоль, 0,15 эквив.) и PhMe2SiH (239 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 48 часов при 65°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с элюцией гексаном (изократическим) с получением 102 мг (76%) указанного в заголовке соединения в виде бледно-желтого маслянистого твердого вещества.1H-ЯМР (500 МГц, CDCl3) δ 7,94-7,87 (м, 1H), 7,85-7,78 (м, 1H), 7,71-7,58 (м, 2H), 7,51 (д, J=0,8 Гц, 1H), 7,46-7,39 (м, 3H), 7,38-7,30 (м, 2H), 0,69 (с, 6H).l3C-ЯМР (126 МГц, CDCl3) δ 144,01, 141,12, 140,18, 137,29, 134,13, 132,41, 129,70, 128,09, 124,45, 124,18, 123,69, 122,33, -1,42. HRMS: [C16H16SSi] рассчитано 268,0743, измерено 268,0742.
[0229] Пример 6.9.14: Силилирование дибензотиофена

[0230] Реакцию проводили в соответствии с общим способом, нагревая дибензотиофен (92 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (5,6 мг, 0,05 ммоль, 0,1 эквив.) и Et3SiH (160 микролитров, 1,0 ммоль, 2 эквив.) в 1 мл 1,4-диоксана в течение 14 часов при 75°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием смеси гексана:триэтиламина в соотношении 80:2 с получением 51 мг (34%) указанного в заголовке соединения в виде бесцветного масла.1H-ЯМР (500 МГц, THF-d8) δ 8,26-8,22 (м, 2H), 7,90-7,86 (м, 1H), 7,59 (дд, J=7,1, 1,3 Гц, 1H), 7,47-7,41 (м, 3H), 1,11-1,02 (м, 6H), 1,02-0,95 (м, 9H).13C-ЯМР (126 мГц, THF-d8) δ 146,49, 140,15, 136,57, 136,06, 134,74, 131,79, 127,63, 125,30, 124,86, 123,53, 123,39, 122,48, 7,94, 3,98. HRMS: [Cl8H22SSi] рассчитано 255,1205, измерено 255,1206, Спектр HSQC этого продукта реакции предоставлен на фиг.15.
[0231] Пример 6.9.15: Силилирование 2,5-диметилтиофена

[0232] Реакцию проводили в соответствии с общим способом, нагревая 2,5,диметилтиофен (56 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (11,2 мг, 0,1 ммоль, 0,2 эквив.) и Et3SiH (3 эквив.) в тетрагидрофуране в течение 45 часов при 65°C. При GC-MS смеси неочищенных продуктов выявили пик масс, ассоциированный с моносилированным производным. Данные1H-ЯМР соответствовали образованию 2-метил-5-(триэтилсилилметил)тиофена.1H-ЯМР (500 МГц, THF-d8) δ 6,52-6,42 (м, 1H), 6,41-6,29 (м, 1H), 2,35 (с, 3H), 2,23 (с, 2H), 1,00-0,92 (м, 9H), 0,63-0,53 (м, 6H).13C-ЯМР (126 МГц, THF-d8) δ 140,78, 136,28, 125,96, 124,03, 15,73, 15,45, 7,97, 4,08. HRMS: [C12H22SSi] рассчитано 226,1212, измерено 226,1220.
[0229] Пример 6.9.16: Силилирование пиридина

[0233] Реакцию проводили в соответствии с общим способом, нагревая пиридин (40 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (17 мг, 0,15 ммоль, 0,3 эквив.) и Et3SiH (240 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 65°C. После водной обработки неочищенную реакционную смесь очищали посредством хроматографии на диоксиде кремния с использованием смеси гексана:простого диэтилового эфира:триэтиламина в соотношении 80:1:4, соответственно, с получением 14 мг (15%) указанного в заголовке соединения в виде бесцветного маслянистого твердого вещества.1H-ЯМР (500 МГц, THF-d8) δ 8,99-8,16 (м, 2H), 7,62-7,07 (м, 2H), 1,01-0,93 (м, 6H), 0,91-0,79 (м, 4H).13C-ЯМР (126 МГц, THF-efe) δ 149,88, 129,76, 129,29, 7,70, 3,66. HRMS: [C11H20NSi] рассчитано 194,1365, измерено 194,1367.
[0229] Пример 6.9.16: Попытка силилирования 4-метоксипиридина
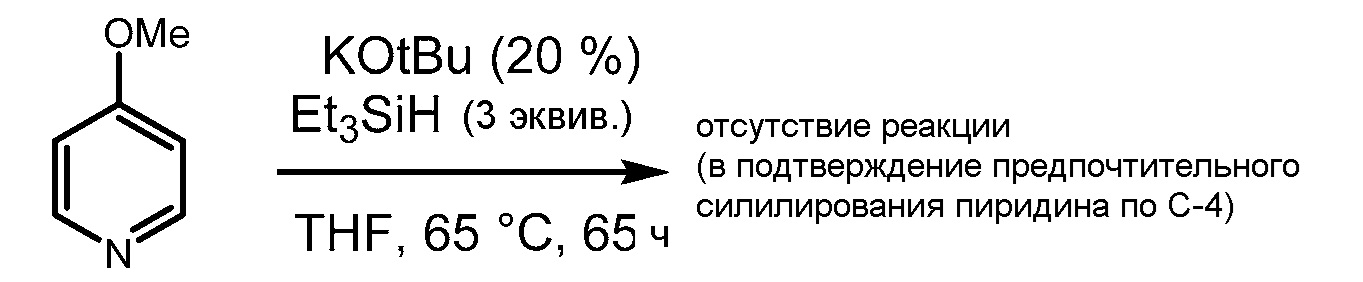
[0234] Реакцию проводили в соответствии с общим способом, нагревая 4-метоксипиридин (55 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (17 мг, 0,15 ммоль, 0,3 эквив.) и Et3SiH (240 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 65°C. Реакционную смесь разбавляли простым диэтиловым эфиром (1 мл), гасили водой (0,5 мл) и органическую фазу анализировали посредством анализов GC-MS, GC-FID и1H-ЯМР и не выявили видимого преобразования исходного вещества в силилированные продукты.
[0229] Пример 6.9.17: Попытка силилирования 2,6 диметоксипиридина

[0235] Реакцию проводили в соответствии с общим способом, нагревая 2,6-диметоксипиридин (70 мг, 0,5 ммоль, 1 эквив.), KOt-Bu (17 мг, 0,15 ммоль, 0,3 эквив.) и Et3SiH (240 микролитров, 1,5 ммоль, 3 эквив.) в 1 мл тетрагидрофурана в течение 65 часов при 65°C. Реакционную смесь разбавляли простым диэтиловым эфиром (1 мл), гасили водой (0,5 мл) и органическую фазу анализировали посредством анализов GC-MS, GC-FID и1H-ЯМР. Анализ GC-MS выявил основные пики масс, соответствующие образованию 2 силилированных изомеров продукта, а также нескольких неидентифицированных продуктов.
[0236] Пример 7. Оценка основных активаторов
[0237] Действие различных оснований оценивали в приводимых ниже номинальных условиях с результатами, предоставленными в таблице 3:

[0238] Как можно видеть в таблице 3, типичные активаторы кремния, такие как соли фторидов не способны катализировать реакции, описываемые в настоящем документе. Ни один из TBAF, KF, CsF, Me4NF, NaF не приводит к преобразованию субстрата.
[0239] Представляет интерес, что хотя соли KOR по-видимому являются превосходными катализаторами для преобразования силилирования (где KOt-Bu превосходит все остальные, и где эффективность других алкоксидов калия коррелирует с ослаблением основности), каждый из NaOR и LiOR, где R представляет собой Me, Et, iPr, tBu, приводит к 0% преобразования. Это демонстрирует критичную, хотя и неизвестную роль катиона калия в этой реакции.
[0240] Примечательно, что добавление 18-краун-6 в качестве хелатора калия в эквимолярном KOt-Bu количестве приводит к 0% преобразования субстрата в стандартных условиях, таким образом, предоставляя дополнительное свидетельство важной роли катиона калия. Представляет интерес, что другие потенциальные хелаторы не ингибируют, а во многих случаях улучшают выход и селективность систем. Этот эффект до конца не понят. Не намереваясь быть связанным правильностью этой или любой другой теории, предположено, что возможно эти лиганды хелатировали катион калия. Продемонстрировано, что подложки-лиганды на основе бипиридина, а также TMEDA (не показано) являются наиболее эффективными для обеспечения высокой селективности и эффективности в реакции силилирования. Это поддерживается реакцией с 1,7-фен, который не способен хелатировать калий, приводя к меньшему выходу продукта.
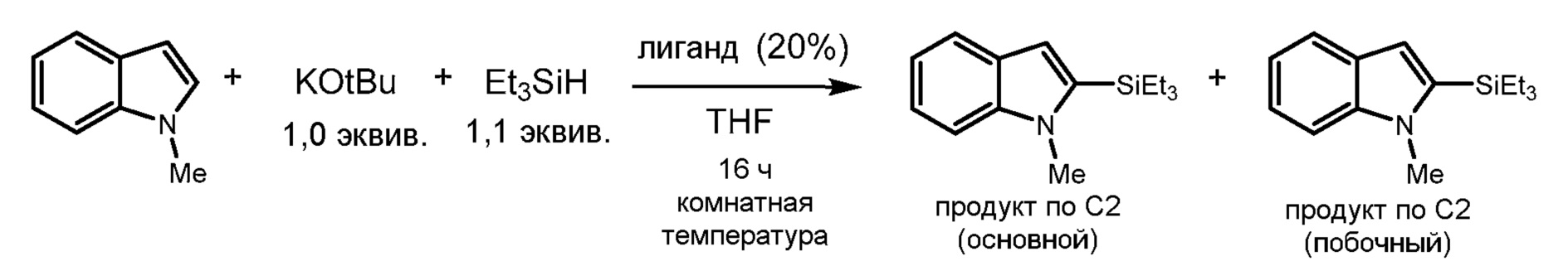
[0241] Активность систем и способов по изобретению была достаточно независима от различий в добавленных количествах основания. Например, в модельной системе N-метилиндола, уменьшение добавляемого количества основания только незначительно снижало эффективность. Примечательно, что даже снижение KOt-Bu до 1% мол. было эффективно и приводило к получению основного продукт C2 с выходом 65% и соответствующей селективностью по C2 89%. Это добавления является даже меньшим или равным тому добавлению, которое необходимо для современных основанных на переходных металлах систем силилирования ароматических связей C-H.

[0242] Как понятно специалистам в данной области, в соответствии с этими указаниями возможны многочисленные модификации и вариации настоящего изобретения и все они предусмотрены настоящим документом. Например, в дополнение к вариантам осуществления, описываемым в настоящем документе, в настоящем изобретении предусмотрено и заявлены варианты изобретения, являющиеся результатом комбинации признаков изобретения, перечисленных в настоящем документе и признаков цитируемых ссылок на известный уровень техники, которые дополняют признаки настоящего изобретения. Подобным образом, следует понимать, что любые описанные материал, характеристику или изделие можно использовать в комбинации с любыми другими материалом, характеристикой или изделием, и такие комбинации рассматривают, как находящиеся в объеме настоящего изобретения.
[0243] Описания каждого патента, патентной заявки и публикации, цитируемых или описанных в настоящем документе, полностью включены в настоящий документ в качестве ссылки для всех целей.
Реферат
Изобретение относится к способам силилирования субстратов, содержащих ароматические группы. Предложен способ силилирования, включающий приведение органического субстрата, содержащего ароматическую группу, в контакт со смесью по меньшей мере одного органосилана, содержащего по меньшей мере одну связь кремний-водород (Si-H), по меньшей мере одну связь кремний-углерод (Si-С) и необязательно по меньшей мере одну связь кремний-кислород (Si-О) или связь кремний-азот (Si-N); и по меньшей мере одного сильного основания, включающего алкоксид калия, алкоксид цезия, гидрид калия, гидрид кальция и бис(триметилсилил)амид калия, в условиях, подходящих для силилирования субстрата с получением силилированного продукта. Технический результат – предложенный способ не требует присутствия соединений переходных металлов, обеспечивая его фармацевтическую применимость. 2 н. и 33 з.п. ф-лы, 22 ил., 4 табл., 7 пр.
Формула

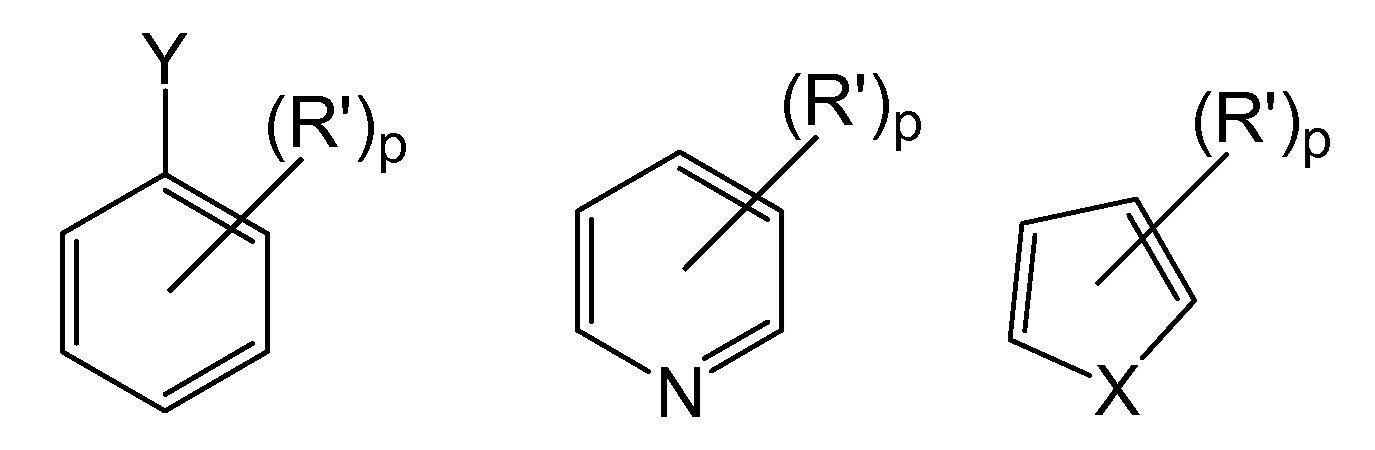
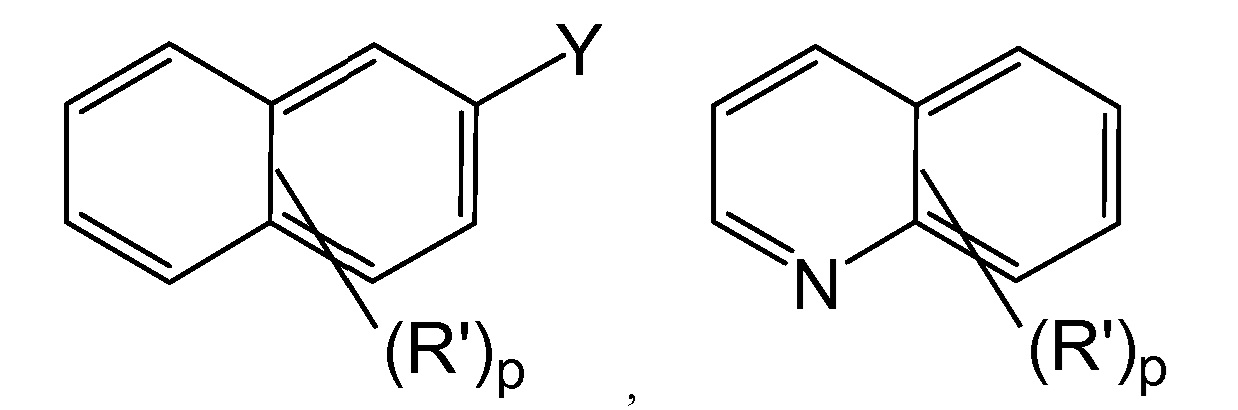



Документы, цитированные в отчёте о поиске
Функционализованные нанотрубки
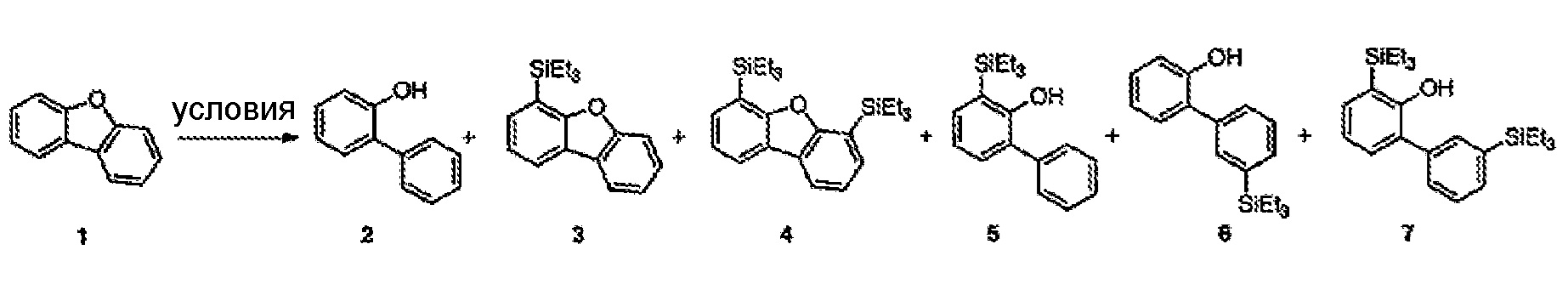

Комментарии