Небелковые конъюгатные соединения бороновой кислоты и способ их получения - RU2076127C1
Код документа: RU2076127C1
Описание
Изобретение относится к новым соединениям, полезным в качестве агента для мечения, более конкретно, к новым красителям, максимум поглощения которых лежит при или вблизи красной границы видимого спектра.
Агенты для мечения часто требуются при изучении образцов крови, например, при измерениях гликозилированного гемоглобина как доли оценки уровня глюкозы в крови пациентов, страдающих от сахарного диабета. Такие агенты описаны, например, в заявках на патент Германии и DE-A-3720736 и США US-A-4861728 и обычно содержат бороновую кислоту в качестве реагентов, которая способна взаимодействовать с цис-диольной группировкой гликозильного фрагмента и которая связана с флуоресцентным и/или окрашивающим красителем, например, диазоконъюгатом или флуоресцеином, родамином или фикобилипротеином. Оценка или количественное определение флуоресценции или поглощения, например, путем измерения отражающей способности (рефлексометрией) дает меру уровней гликозилированного гемоглобинга в образцах крови.
Неудобство применения фикобилипротеиновых конъюгатов бороновых кислот заключается в том, что у большей части гликозилированных гемоглобинов гликозильный фрагмент, который в основном присоединен к N-концевой аминокислоте "Valine" бета-цепи, эффективно локализован в узлом "кармане" гемоглибиновой молекулы и, следовательно, не является легко доступным для высокомолекулярных реагентов.
Другие ранее предложенные окрашенные метки, такие как флуоресцеин и родамин, имеют тот недостаток, что их спектр поглощения значительно перекрывается со спектром поглощения гемоглобина; это может помещать или серьезно затормозить эффективное спектроскопическое количественное определение метки.
Изобретение основано на открытии новых классов соединений для мечения, которые имеют максимум поглощения при длине волны не менее, чем 600 нм, при которой гемоглобин имеет минимальное поглощение.
Согласно одному аспекту изобретения обеспечиваются небелковые конъюгированные соединения бороновой кислоты, имеющие максимум поглощения не менее чем при 600 нм. Такие соединения, например, могут быть представлены формулой (1).
V W В(ОН)2 (1)
где V является хромофорным и/или
флуорофорным фрагментом,
показывающим максимум поглощения и/или эмиссии не менее, чем при 660 нм и W является связывающей органической группой.
Следует отметить, что диоксиборильный
остаток также может
существовать в анионной форме
-B(OH)
в зависимости от рН и
содержания электролита
в применяемых реагентных композициях, и что такие соединения должны рассматриваться в пределах объема формулы (1).
Конъюгаты бороновой кислоты изобретения используются в спектроскопических исследованиях, относящихся к оценке или количественному определению цис-диолов, в частности гликозилированных фрагментов, например, протеинов, в присутствии гемоглобина, так как практически не происходит перекрывания спектров поглощения гемоглобина и хромофора.
Атом бора остатка бороновой кислоты выгодно присоединен к фенильной группе, например, аминофенильной группе, такой как м-аминофенильная группа. В зависимости от желаемой для бороновой кислоты величины рКа фенильная группа может быть необязательно дополнительно замещена, например, одним или более заместителями, которые влияют на величину pKa без стерического наложения на связывание между остатком бороновой кислоты и целевым цис-диолом. Примеры электроноотталкивающих заместителей, которые могут быть применены для увеличения степени ионизации и, следовательно, константы ассоциации бороновой кислоты с мишенью цис-диолами, такими как гликозилированные фрагменты, включают нитро, низшие алкокси, такие как метокси или этокси, и ацильные группы, такие как формил или низший алканоил. Типичные бороновые кислоты этого типа включают 2-нитро-5-аминофенилбороновую кислоту и соответствующие 3-нитро- и 4-нитроизомеры. В общем любые такие фенильные или замещенные фенильные группы могут быть связаны непосредственно с хромофорным и/или флуорофорным фрагментом V, так что фенильная группа представляет собой группу W в формуле (1), или через связывающие или спейсерные группы, например, как это известно из данного уровня техники.
Полезной группой
соединения согласно изобретению
являются соединения формулы (II)
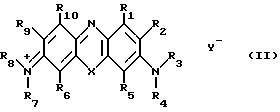
где Х является атомом кислорода или серы, Y- является анионом (например, ионом галоида, такого как хлор или бром, или ионом пергалоата, таким как перхлорат), и R1 R10 каждый выбран среди атомов водорода и органических групп, или R1 и R2 и/или R9 и R10 вместе с атомами, к которым они присоединены, могут образовывать конденсированные моноциклические или полициклические кольцевые системы, при условии, что по крайней мере один из R3 и R4 и по крайней мере один из R7 и R8 отличны от водорода, и что по крайней мере один из R1 R10 является органической группой, содержащей остаток бороновой кислоты.
Когда любой из R1 R10 представляет собой органическую группу, они могут быть выбраны, например, среди алкила, алкенила и алкинила, например, содержащих до 6 атомов углерода, таких как метил, этил, н-пропил, изопропил, н-бутил, втор. бутил, трет.бутил, винил, аллил, этинил, или пропаргил; циклоалкила или циклоалкенила, например, содержащих 5 7 атомов углерода, таких как циклопентил, циклогексил, циклогептил, циклогексенил или циклопентадиенил; арильных групп, например, содержащих 6 12 атомов углерода, таких как фенил, толил или нафтил; гетероциклических колец, например, 5 7 членных насыщенных и ненасыщенных колец, содержащих по крайней мере один гетероатом, выбранный среди кислорода, азота и серы, таких как фурил, тиенил, пиридил, пиримидил, пиридазил, тиазолил, тиазинил, триазинил, пирролит, имидазолил, пиразолил, пирролидинил, пиперидинил, пиперазинил или морфолинил; низших (например, С1-4) алкилов, замещенных любой из ранее описанных циклоалкильных, циклоалкенильных, арильных и или гетероциклических групп; любая из ранее приведенных групп прерывается и/или замещена одним или более гетероатомов, например, таким образом, что содержит одну или более простых эфирных, простых тиоэфирных, амино, амидо, карбонильных или тиокарбонильных групп; или любая из ранее приведенных групп несет один или более заместителей, которые могут быть выбраны, например, среди гидроксила, меркапто, амино, галоида, нитро, азидо, карбокси, циано и изотиоцианато, или любой другой заместитель, совместимый с остатком бороновой кислоты.
В действительности, если нет других указаний, в соединениях изобретения алкильные, алкенильные и алкениленовые фрагменты будут содержать до 6 атомов углерода, а циклические группы будут включать 5 7-членные циклы.
Другой полезной группой соединений, охватываемых формулой (II), благодаря их гидрофильным свойствам, являются соединения формулы (III).
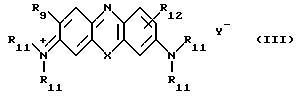
(где Х и Y- имеют указанные ранее значения, каждый R11 независимо является низшим) например, С1-6 (алкилом, таким как метил или этил, а R12 является органической группой, содержащей остаток бороновой кислоты). Cледует отметить, что в свете симметрии резонансно-стабилизированных кольцевых систем заместителей R12 в 1-, 2- и 4-положениях являются эквивалентными соответствующим заместителям в 9-, 8- и 6-положениях соответственно.
Примеры групп R12, которые могут находиться в таких соединениях (III), включают следующие:
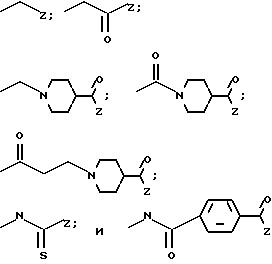
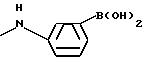
где Z является группой, содержащей остаток бороновой кислоты, например, остаток аминофенилбороновой кислоты, такой как группа
Другой полезный класс гидрофильных соединений (II) может быть представлен формулой (IV)
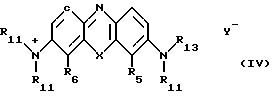
(где Х, Y- и R11 имеют указанные ранее значения, а R13 является органической группой, содержащей бороновый остаток, например, уже ранее описанный. Снова следует отметить, что органическая группа, содержащая остаток бороновой кислоты, оказывает идентичное действие, независимо от того, является ли заместитель 3- амино или 7-имино группировкой.
Примеры органических групп, содержащих остаток бороновой кислоты,
которые могут присутствовать в таких соединениях (IV),
включают
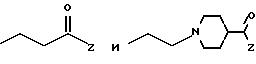
где Z имеет указанные ранее значения.
Другой полезной категорией
соединений согласно изобретению являются те соединения, у которых V происходит от трифенилметанового красителя, например, как представлено
формулой
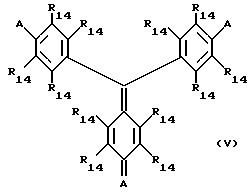
в которой каждый R14 независимо является атомом водорода, органической группой (например, как приведено здесь ранее для R1 - R10) или (предпочтительно гидрофильной) замещающей группой (например, гидроксилом, карбоксилом, сульфо или хлорсулфонилом), а по крайней мере две из А групп являются ауксохромными группами, любая не-ауксохромная А группа является такой же, как приведено для R14. Предпочтительные ауксохромные группы включают амин/иминные системы, представленные системами N(R)2N+(R)2 и NHR/N+HR (где каждый R является органической группой, например, как приведено здесь ранее для R1 R10, предпочтительно низшей алкильной группой, такой как метил или этил), одними или в сочетании с О/ОН. Фрагмент W-B(OН)2 может быть, например, присоединен к одному из фенильных колец, например, быть связанным через такую группу, как карбоксил или сульфо-, или к одной из групп R в амин/иминной ауксохромной системе. Следует отметить, что другие резонансные структуры, которые могут быть приведены, также входят в область формулы (V).
Другая полезная категория соединений согласно изобретению включает те соединения, у которых V происходит от
фталоцианинового
красителя, например, как представлено формулой (VI)
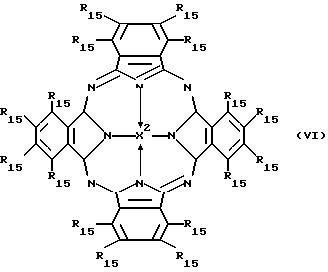
в которой каждый R15 независимо является атомом водорода, органической группой (например, как приведено здесь ранее для R1 - R10) или (предпочтительно водосолюбилизирующейся) замещающей группой (например карбокси, сульфо, хлорсульфонил, окси, фенокси или аминогруппы) и Х2 является двумя атомами водорода или атомом металла (например, алюминия, кадмия, хрома, меди, галлия, германия, магния, фосфора, кремния, олова или цинка), который может, если соответствует валентность (≥ 3), нести один или более аксиальных лигандов (например, окси или галоид, в частности хлор).
Еще одна полезная категория соединений согласно изобретению включает соединения, у которых V происходит от цианинового или мероцианинового красителя, например, как представлены
формулами
(VII) или (VIII), соответственно:
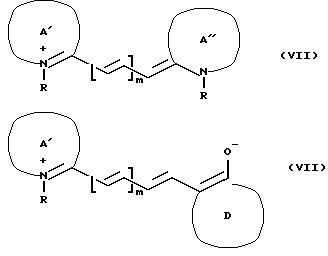
и соответствующими альтернативными резонансными структурами. В приведенных выше формулах A'и A" представляют собой кватернизованные гетероатомные основания, Д представляет кетометиленовое ядро, R имеет указанные ранее значения, и m является целым числом, например 1 3, обычно 2 или 3. Примеры красителей этого типа включают соединения формулы (IX).

в которой m и R имеют указанные ранее значения, Х3 является гетероатом, таким как кислород или сера, или необязательно моно- или дизамещенной метиленовой группой, и каждый R16 независимо является атомом водорода, органической группой (например, как указано выше для R1 R10) или (предпочтительно водосолюбилизирующейся) замещающей группой, или соседние R16 группы вместе с атомами углерода, к которым они присоединены, могут образовать конденсированные моноциклические или полициклические кольцевые системы. Повышающие водосолюбилизацию заместители являются желательными для присутствия, например один или более R16, предпочтительно, чтобы такой заместитель был карбоксиметилом, который будет соединяться с аминосодержащими молекулами, такими как м-аминофенилбороновая кислота, с малыми изменениями или без них в абсорбционных характеристиках цианинового хромофора.
Типичный дополнительный
класс конюъгатов азиновых красителей согласно изобретению и типичная препаративная последовательность приведены на следующей реакционной схеме:

где каждый А2 представляет собой группу формулы M/R/2/H+/R/2, NHR/N+HR или O/ОН cистемой, как было определено ранее.
Конъюгаты бороновой кислоты согласно изобретению могут быть получены в соответствии с изобретением при взаимодействии соответственно функционализированного красителя, имеющего необходимые спектральные характеристики, с одни или более реагентами, служащими для введения остатки бороновой кислоты. Такие остатки, как фенилбороновая кислота, обычно синтезируют из аминофенилбороновой кислоты, предпочтительно м-аминофенилбороновой кислоты, при сочетании с остатком молекулы, эффективной для образования, например, иона диазония, силанизацией или при использовании сочетающего агента (например, как описано в общей химической литературе), такого как глутаровый альдегид, карбодиимид, цианогенгалоид или сукцинимид. Предпочтительные аспекты настоящего способа включают (i) реакцию м-аминофенилбороновой кислоты с красителем, содержащим карбоксильную группу, в присутствии карбодиимида, такого как 1-этил-3-(3-диметиламинопропил)карбодиимид (ЕДС), чтобы получить соединение (I), содержащее амидо-связанную группу фенилбороновой кислоты; (ii) активацию красителя, содержащего карбксильную группу, методом смешанного ангидрида, например, при реакции с галоформатным сложным эфиром (например, низшим алкилгалоформатом, таким как изобутилхлорформат), перед реакцией с м-аминофенилбороновой кислотой, чтобы получить амид-связанную группу фенилбороновой кислоты; (iii) реакцию м-аминофенилбороновой кислоты с предшественником, содержащим изотиоцианатную группу, чтобы получить соединение (I), содержащие связанную через тиомочевину группу фенилбороновой кислоты; и (iv) активацию красителя, содержащего сульфогруппу, например, путем превращения в сульфонилгалоид, такой как хлорид, например, при реакции с галоидирующим агентом, таким как оксалилхлорид или оксихлорид фосфора, перед реакцией с м-аминофенилбороновой кислотой, чтобы получить связанную через сульфонамид группу фенилбороновой кислоты.
Феноксазиновые предшественники, используемые для получения соединений формул (II) (IV), например, могут быть получены по таким реакционным последовательностям, как приведено
ниже:

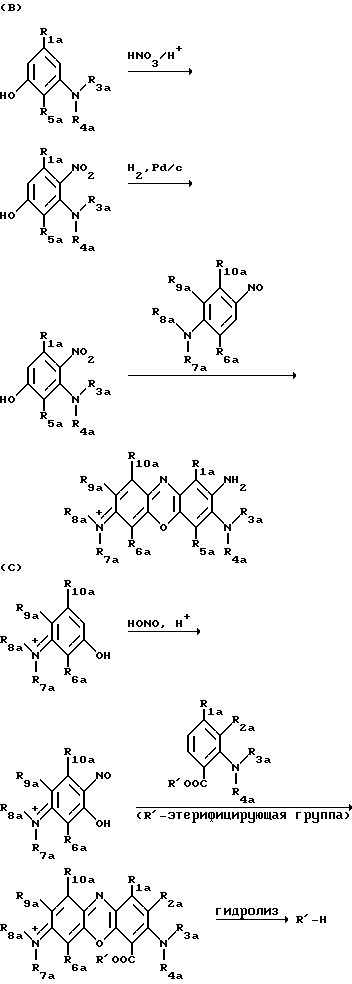
Эта схема может быть модифицирована путем взаимообмена групп R16 и R'OCC, чтобы получить 1-карбоксифункционализированный фениксазиновый предшественник.
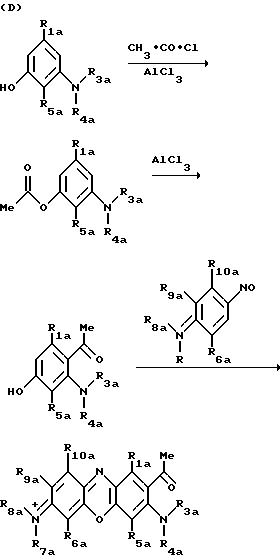
В приведенных выше схемах R1а R10a имеют приведенные ранее для R1 R10 значения с тем исключением, что они не содержат остатка бороновой кислоты, желательного в конечном продукте (II).
Фенотиазиновые предшественники могут быть получены по аналогичным методикам или с применением методов, общеизвестных в области получения тиазиновых красителей.
Феноксазиновые и фенотиазиновые предшественники, полученные таким образом, у
которых один из R3а и R4а или один из R7а и R8а является атомом водорода, могут быть введены в реакцию, например, с алкилгалоидом, чтобы ввести
N-присоединенную функционализированную группу или функционализированную спейсерную группу, например, как показано на следующей реакционной схеме:

с последующим гидролизом для получения соединения, в котором R' H.
Альтернативно и предпочтительно, когда все R3а,
R4а, R7а и R8а являются другими, чем водород, функционализированные группы (необязательно включающими спейсерные группы) могут быть присоединены к атому углерода
фенотиазиновой кольцевой системы по реакции Манниха, например, как показано на следующей реакционной схеме:
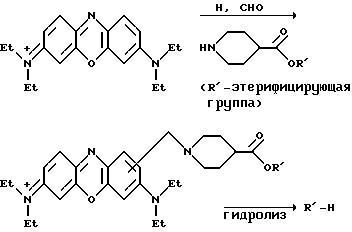
Такие предшественники, содержащие карбоксильную группу, могут быть легко введены в реакцию, например, с м-аминофенилбороновой кислотой, чтобы получить соединения (II), содержащие связанную через амид группу фенилбороновой кислоты.
2-аминофеноксизиновые или фенотиазиновые предшественники, например, полученные по последовательности (В) выше, могут быть, например,
диазотированы, а затем введены в реакцию с тиоцианатом щелочного металла, чтобы получить соответствующее 2-изотиоцианатное соединение. Этот продукт может быть введен в реакцию с нуклеофильной
амино-содержащей молекулой, такой как м-аминофенилбороновая кислота или функционализированный спейсер, например, как показано в любой из следующих реакционных схем:
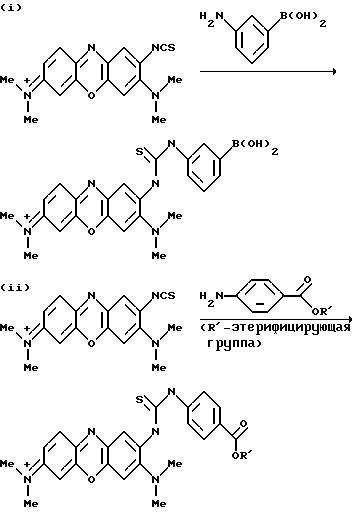
c последующим гидролизом, чтобы получить соединение, в котором R' Н.
1- или 4-карбокси феноксазиновые или
фенотиазиновые предшественники, например, полученные по последовательности (С), могут быть введены в реакцию непосредственно с, например, аминофенилбороновой кислотой в присутствии растворимого
карбодиимида, или сначала могут быть модифицированы введением функционализированной спейсорной группы, например, как показано на следующей реакционной схеме:
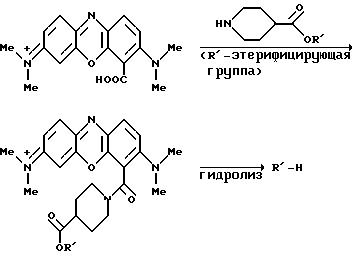
2-Ацетилфеноксазиновые или фенотиазиновые предшественники, например, полученные по последовательности Д, могут быть, например, введены в реакцию Манниха, чтобы ввести N-связывающую спейсерную группу, как показано на следующей реакционной схеме:
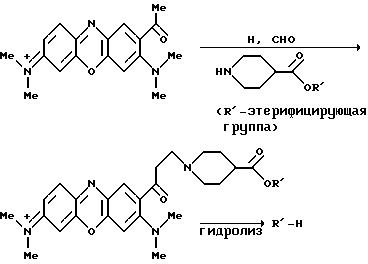
Предшественники феноксазина и фенотиазина, например, традиционно полученные фенотиазиновые красители, такие как 3-диметиламино-7-диметилимонофенотиазоний, могут подобным образом быть введены в реакцию Манниха для присоединения к кольцу аминосодержащей функционализированной группы, например, использование м-аминофенилборной кислоты в качестве амина, как показано на следующей реакционной схеме:
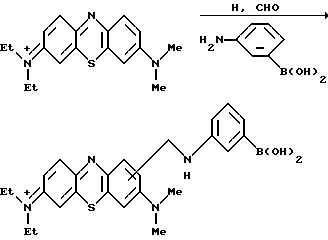
В cоответствии с другим признаком изобретения обеспечиваются соединения формулы (II), как определено здесь ранее, с такой модификацией, чтобы по крайней мере один из R1 R10 являлся органической группой, содержащей активированный фрагмент, другой чем остаток бороновой кислоты, указанный активированный фрагмент может вступать в реакцию в мягких химических условиях с целевой функциональной группой в соединении, которое должно быть помечено, давая в результате ковалентное связывание указанного соединения (II) с соединением, которой должно быть помечено, указанное соединение (II) имеет максимум поглощения при не более чем 600 нм.
Природа активированного фрагмента, имеющего по крайней мере в одной из групп R1 R10, будет разумеется зависеть от природы целевой функциональной группы, которая должна быть помечена; соответствующие группы могут быть легко подобраны по литературным данным. Примеры активированных производных с определенной активностью по отношению к аминогруппам включают, например, N-оксисукцинимидные активные сложные эфиры, имидо сложные эфиры, изотиоцианаты и нитроарилгалоиды. Активированные производные с определенной активностью по отношению к cульфогидрильным группам включают малеимиды, пиридилдисульфиды, тиофталимиды и активные галоидные соединения. Когда целевая функциональная группа представляет собой олефиновую или ароматическую углерод-углеродную двойную связь, карбоновые предшественники, такие как диазоалканы и диазиридины, и нитреновые предшественники, такие как азиды, могут быть полезными активными фрагментами.
Активированный фрагмент может быть соединен с остальной частью феноксазина или фенотиазина (II) или непосредственно, через связывающую группу (например, содержащую одну или более аминных или амидных групп), или через спейсерный фрагмент (например, как известно из имеющегося уровня техники).
Эти соединения (II) изобретения, благодаря их характеристическим максимумам поглощения при длинах волн по крайней мере 600 нм, могут быть использованы в качестве хромофоров (и, когда соответствует, в качестве флуорофоров) в различных применения с метками, особенно в присутствии гемоглобина и других обычно трудно спектроскопически определяемых веществ. Они также являются полезными во флуорометрических способах как с единичной, как и с множественными метками, поскольку их флуоресцентная эмиссия находится в красной области спектра, где фон флуоресценции является менее заметным. Следовательно соединения обладают полезными применениями в качестве генерирующей сигнал молекулы в широком наборе аналитических методик, основанных на измерении поглощения, отражения и флуоресценции, особенно в методиках, включающих изучение образцов цельной крови. Они также являются полезными в качестве флуоресцентных зондов в таких методиках, как флуоресцентная микроскопия, флуоро-гистохимическое исследование и флуоресценция выхода и анализа активированных клеток.
Такие соединения (II) могут быть получены согласно изобретению при взаимодействии предшественника таким образом, чтобы генерировать целевой активный фрагмент. Так, например, предшественник, содержащий гидроксильную группу, может быть активирован при обработке таким реагентом, как цианогенгалоид, триазин, периодат, бисоксиран, трезихлорид или тозилхлорид. Предшественник, содержащий аминогруппу, может быть активирован, например, диазотированием или при взаимодействии с бифункциональным агентом, таким как диальдегид. Предшественники, содержащие карбоксильную группу, могут быть активированы, например, N-оксисукцинимидным сложным эфиром, малеимидом, карбодиимидом или карбонилдиимидазолом или методом смешанного ангидрида.
В свете другого аспекта изобретения также обеспечивается применение указанных здесь выше конъюгатов бороновой кислоты в процедуре анализа крови, например, как описано в приведенном выше уровне техники или в WO-A-90/13818.
Пример 1. Конъюгат
феноксазин бороновая кислота
а) м-Формамидофенол
Смесь 100 г м-аминофенола и 150 г муравьиной кислоты кипятят
с обратным холодильником в течение 1,5 ч, а затем выпаривают досуха при
пониженном давлении (90 95oC, 10 15 мм рт.ст.). Твердый материал сушат при 100oC, 10 мм рт.ст. в течение
1,5 ч. Получают 117 г целевого соединения с т.пл. 112oC.
б) м-(N-метиламино)фенол
При постоянном перемешивании прибавляют порциями 13,8 г продукта раздела (а) в
течение 1 ч к раствору 9,5 г литийалюминийгидрида в 180 мл сухого
тетрагидрофурана при 15 20oC. Смесь кипятят с обратным холодильником в течение 0,5 ч, охлаждают до -5oC и
медленно прибавляют 385 мл 3Н НСl. Уменьшают объем пасты до 300 мл на
роторном испарителе при 60 70oC, прибавляют 400 мл воду и пасту снова упаривают до конечного объема 400 мл. К
оставшейся серой пасте прибавляют 2 г активированного угля и 10 г Целита,
полученную в результате смесь фильтруют и прибавляют 60 мл 40-го гидроксида натрия. Наконец раствор дважды экстрагируют,
каждый раз 100 мл эфира, экстракт сушат до вязкого масла, а затем перегоняют.
Получают 9,3 г целевого соединения в виде масла.
в) м-(N-2-этоксикарбонилэтил-N-метиламино)фенол
Смесь 9,3 г продукта раздела (б) выше, 27,4 г этил-3-бромпропионата, 12,6 г
бикарбоната натрия и 120 мл ацетона кипятят с обратным холодильником в течение 43 ч. Затем прибавляют новую порцию 27,4 г
этил-3-бромпропионата и кипятят раствор с обратным холодильником еще 72 ч.
Наконец раствор охлаждают и фильтруют. Фильтрат выпаривают досуха (10 мм рт.ст. 85 90oC) и остаток солюбилизируют
в 50 мл СНСl3:EtOAc 9:1. После хроматографии на оксиде кремния с
использованием СНСl3:EtOAc 9:1 в качестве элюента получают 3,8 г целевого соединения.
г) Аддукт хлорида цинка с 3-(N-2-этоксикарбонилэтил-N-метиламино) -6-(4-N, N-диметиламинофенилимино) циклогекса-2,4-диеном.
Смесь 6,6 г продукта из раздела (в) выше 4,5 г 4-нитрозо-N, N-диметиланилина и 4,9 г хлорида цинка в 88 мл метанола кипятят с обратным холодильником в течение 3 ч. Отфильтровывают твердый материал, дважды промывают 25 мл метанола и сушат при 50oC и 10 мм рт.ст. Получают 11,6 г целевого соединения.
д)
3-Диметиламино-7-(N-метил-N-2-этоксикарбонилэтиламино)- феноксазонил
Растворяют 1,0 г продукта раздела (г) выше в 50 мл
уксусной кислоты, нагревают при 70oC и затем прибавляют 180
мг нитрита натрия. Раствор выдерживают при 70oC при постоянном перемешивании 6 ч, затем охлаждают, фильтруют и
выпаривают досуха. Остаток растворяют в 40 мл воды и фильтруют. Наконец
фильтрат выпаривают досуха при 60oC и 10 мм рт.ст. Получают 0,6 г целевого соединения.
е)
Диметиламино-7-(N-метил-N-2-карбоксиэтилимино) феноксазоний
Продукт
раздела (д) гидролизуют эквимолярным количеством водного гидроксида натрия в 80-м диоксане, выделяют целевой продукт
ионообменной хроматографией.
ж) Конъюгация с м-аминофенилбороновой
кислотой
Прибавляют 9,0 мг (2,29•10-5 моль) продукта раздела (е) выше к 1000 мкл сухого
диметилформамида и раствор охлаждают до -10oC. Прибавляют 2,78 мг (2,
75•10-5 моль) N-метилморфолина и 3,76 мг (2,75 • 10-5 моль) изобутилхлорформата при
-10oC и выдерживают на льду в течение 0,5 ч. Прибавляют 14,2 мг (9,
17•10-5 моль) м-аминофенилбороновой кислоты и дополнительно 2,78 мг (2,75•10-5 моль)
N-метилморфолина и выдерживают реакционную смесь 2 ч при 4oC и 4 ч
при комнатной температуре. Выделяют 4 мг конъюгата фенилбороновая кислота/феноксазин хроматографией с обратимой фазой.
Максимум поглощения λmax этого продукта в видимой части спектра
был зарегистрирован при 642 нм при коэффициенте молярной экстинкции ε > 70 000 л/моль•cм.
Пример 2. Конъюгат трифенилметановый краситель-аминобороновая кислота
а) Ксиленцианол, который может быть представлен формулой:
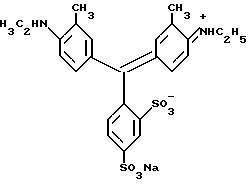
(75 мг, 80 чистоты, 1, 11•10-4 моль) сушат всю ночь при 100oC. Прибавляют 205 мкл (2,24•10-3 моль) оксихлорида фосфора и выдерживают смесь при комнатной температуре в условиях исключения влаги. После 24 ч при этой температуре смесь несколько раз промывают сухим н-гексаном, чтобы проэкстрагировать нежелательный желтый побочный продукт реакции и непрореагировавший оксихлорид фосфора. Когда гексановый экстракт будет бесцветным к экстракту ксиленцинолсульфонилхлорида прибавляют хлороформ. Наконец 15 мл хлороформенного экстракта промывают 5 раз порциями по 1 мл холодной воды затем выпаривают досуха при пониженном давлении и в условиях отсутствия влаги.
Твердый материал немедленно солюбилизируют в 200 мкл N,N-диметилформамида (ДMФ), к этому раствору прибавляют 17 мг (1,10•10-4 моль) моногидрата 3-аминофенилбороновой кислоты в 100 мкл ДМФ. Смесь оставляют на 5 мин, после чего прибавляют 2 мл 0,75 М буфера карбонат натрия/бикарбонат натрия (рН 10,0) при постоянном перемешивании и оставляют раствор при комнатной температуре на 3 12 ч. Контролируют рН раствора и сохраняют его между 8 и 9,5.
Конъюгаты бороновой кислоты выделяют с помощью хроматографии на обратимой фазе, главным образом в виде моно(фенилбороновая кислота)-функционализированный краситель, λmax 619 нм/ ε > 70000.
б) Повторяют процедуру раздела (а) этого примера с тем исключением, что используют 22 мг (2,1•10-4 моль) моногидрата 2-нитро-5-аминофенилбороновой кислоты вместо 3-аминофенилбороновой кислоты, получают главным образом моно(фенилбороновая кислота)-функционализированный краситель с подобными спектральными свойствами как у продукта раздела (а).
Пример 3. Конъюгат фталоцианиновый краситель-бороновая
кислота
Cушат 100 мг (1,12o10-4 моль)
хлоралюминийфталоцианинтетрасульфоната всю ночь при 100oC. Прибавляют 410 мкл (4,18•10-3 моль)
оксихлорида фосфора и выдерживают смесь при комнатной температуре в условиях
исключения влаги. После 24 ч при этой температуре твердый материал несколько раз промывают в сумме 10 мл н-гексана, чтобы
удалить непрореагировавший оксихлоридфосфора.
Оставшийся твердый фталоцианинсульфонилхлорид сушат при пониженном давлении в условиях исключения влаги, а затем немедленно солюбилизируют в 500 мкл ДМФ. К этому раствору прибавляют 20 мг (1,29•10-4 моль) моногидрата 3-аминофенилбороновой кислоты в 100 мкл ДМФ. Смесь оставляют на 5 мин, после чего прибавляют 2 мл 0,75 М буфера карбонат натрия/бикарбонат натрия (рН 10,0). Реакционную смесь выдерживают при комнатной температуре при постоянном перемешивании в течение 3 12 ч, в течение этого времени контролируют рН и выдерживают его между 8 и 9,5. Выделяют конъюгаты бороновой кислоты хроматографией с обратимой фазой, главным образом в виде моно(фенилбороновая кислота) функционализированный краситель, lmax 767 нм /ε ≈ 160000.
Пример 4.
Kонъюгат цианиновый краситель-бороновая кислота
Прибавляют 470 мкл (5,13•
10-3 моль) оксихлорида фосфора к 100 мг (1,29•10-4 моль) цианинового красителя
2-[7-(1,3-дигидро-1,1-диметил-3)-4-сульфобутил] -2Н-бенз(е)индол-2-илиден-(1,3,
5-гептатриенил)-1,1-диметил-3-(4- сульфобутил)-1Н-бенз(е)индолиний гидроксида, внутренней соли, натриевой соли
(коммерчески известному как IR 125 или индоцианиновый зеленый) и полученную в результате
смесь инкубируют при комнатной температуре в условиях исключения влаги в течение 24 ч. Темно-коричневый раствор
затем выливают на измельченный лед и оставляют на 5 мин. IR-125 сульфонилхлорид
экстрагируют хлороформом и промывают экстракт пять раз порциями по 1 мл холодной воды, затем выпаривают досуха при
пониженном давлении в условиях исключения влаги.
Полученный в результате твердый материал немедленно солюбилизируют в 500 мкл ДМФ, к этому раствору прибавляют 17 мг (1,10•10-4 моль) моногидрата 3-аминофенилбороновой кислоты в 100 мкл ДМФ. Смесь оставляют на 5 мин, после чего прибавляют 2 мл 0,75 М буфера карбонат натрия/бикарбонат натрия при постоянном перемешивании и инкубируют раствор при комнатной температуре в течение 3 12 ч, в течение этого времени контролируют рН раствора и сохраняют его между 8 и 9,5. Выделяют конъюгаты бороновой кислоты хроматографией на обратимой фазе, главным образом в виде моно(фенилбороновая кислота) функционализированный краситель, lmax 799 нм/ε≈ 200000.
Пример 5.
Kонъюгат цианиновый краситель бороновая кислота
К реактивному сукцинимидил
сложному эфиру-цианиновому красителю Су 5•18 (1,3•10-7 моль) прибавляют 2 мг
3-аминофенилбороновой кислоты в 0,5 мл 0,1 М буфера карбонат натрия/бикарбонат натрия (рН 9,3) с
последующим перемешиванием. Смесь выдерживают при постоянном перемешивании при комнатной температуре в
течение 4 ч, выделяют наконец конъюгат фенилбороновой кислоты хроматографией на обратимой фазе,
lmax 652 нм/ε ≈ 200000.
Пример 6. Измерение гликозилированного
гемоглобина в цельной крови с использованием конъюгата флотациониновый краситель бороновая
кислота
Образец цельной крови смешивают с буфером реакции гемолиза (рН 9,4), содержащим 160 мМ
пиперазина, 0,07 Тритона Х-100, 9,4 этанола (обьем/объем) и конъюгат фталоцианин-бороновая
кислота, полученный по методике примера 3, при конечной концентрации 2,1•10-5М. Конечная
концентрация гемоглобина составляет примерно 2 мг/мл. Цельная кровь подвергается гемолизу и
образуется осадок. Осажденный гемоглобин отфильтровывают и измеряют его отражение при 685 и 470 нм на
cканирующем приборе фирмы Шимадзу (Япония) Scanner модель СS 9000. Отношение показателей
отражения при 685 и 470 нм расчитывают и определяют процент гликолизированного гемоглобина к суммарному
гемоглобину из калибровочной кривой, полученной при использовании стандартных растворов
гемоглобина и гликолизированного гемоглобина.
Пример 7. Измерение гликолизированного гемоглобина
в цельной крови при использовании конъюгата ксиленцианол-бороновая кислота
Повторяют процедуру примера 6 с тем исключением, что используют конъюгат ксиленцианол-бороновая кислота, полученный
по методике примера 2, при концентрации 2,1•10-5 вместо конъюгата
фталоцианинового красителя, и измеряют отражательную способность при 635 и 470 нм.
Реферат
Предложены агенты для мечения, представляющие собой небелковые конъюганты бороновой кислоты, имеющие максимум поглощения не менее, чем при 600 нм, причем указанная метка обеспечивается, например, азиновым, трифенилметановым, цианиновым или фталоцианиновым красителем. Метки такого типа являются полезными для оценки и количественного определения цис-диодов, таких как гликозилированный гемоглобин, за счет практически полного отсутствия перекрывания со спектром гемоглобина. Оксазиновые и тиазиновые красители, имеющие подобные характеристики поглощения и содержащие другие активированные фрагменты, подобным образом являются полезными агентами для мечения, особенно в присутствии гемоглобина. 2 с и 7 з.п.ф-лы.
Формула
V W B(OH)2,
где V остаток цианинового, фталоцианинового, азинового или трифенилметанового красителя с максимумом поглощения или испускания не менее чем при 600 нм;
W связывающая органическая группа.

где X атом кислорода или серы;
Y- анион;
R1 R10 атом водорода или небелковая, органическая группа, или R1 и R2, и/или R9 и R10 могут вместе с атомами углерода, к которым они присоединены, образовывать конденсированную моноциклическую или полициклическую кольцевую систему при условии, что по крайней мере один из R3 и R4 и по крайней мере один из R7 и R8 отличны от водорода и по крайней мере один из R1 R10 является органической группой, содержащей остаток бороновой кислоты.
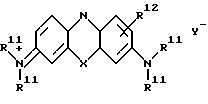
где X и Y имеют указанные в п. 4 значения, каждая группа R11 независимо С1 C6 алкилом, а R12 органическая группа, содержащая остаток бороновой кислоты.
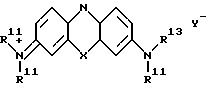
где X и Y имеют указанные в п. 4 значения, каждая группа R11 органическая группа, содержащая остаток бороновой кислоты.

Комментарии