Способ получения 7-амино-3-замещенной метил- @ -цефем-4-карбоновой кислоты или ее кислотно-аддитивных солей - SU1308198A3
Код документа: SU1308198A3
Описание
Изобретение отис-сится к получению новых производных цефалоспоринов, а именно 7-амико-3-:-1амещенный метил-д - цефем-4-карбоиовой кислоты общей формулы
S
nJ-NО Т
COORi
R, где R - атом водорода или сложно- эфирная защитная группа; незамещенная тетразолилгруп- па, или замещенная бромом, низшим алкилом, метилтио- группой, карбоэтоксигруппой, фенилом, адетамидо-, карбо- этоксиметил- и аминогруппой, незамещенная 1, 25 4-триазо- 20 лилгруппа или замещенная хлором, низшим алкилом, ме- тилтиогруппой, карбоэтоксигруппой , или ацетамидогрупБ . В 16 мл метанола суспензировали 1,76 г кристаллов, полученных вы- гае в А и к суспензии добавляли 1,13 г моногидрата пара-толуолсульфокислоты, получая раствор, после чего тут же медленно добавили 4,6 г дифенилдиа- зометана. Проводили реакцию при комнатной температуре в течение 18 мин. После завершения реакции растворитель удаляли перегонкой при пониженном давлении. Полученный остаток растворяли в смешанном растворителе из 30 мл этилацетата и 30 мл воды и рН полученного раствора доводили до 8 добавлением бикарбоната натрия. Затем органический слой отделяли и сушили над безводным сульфатом магния
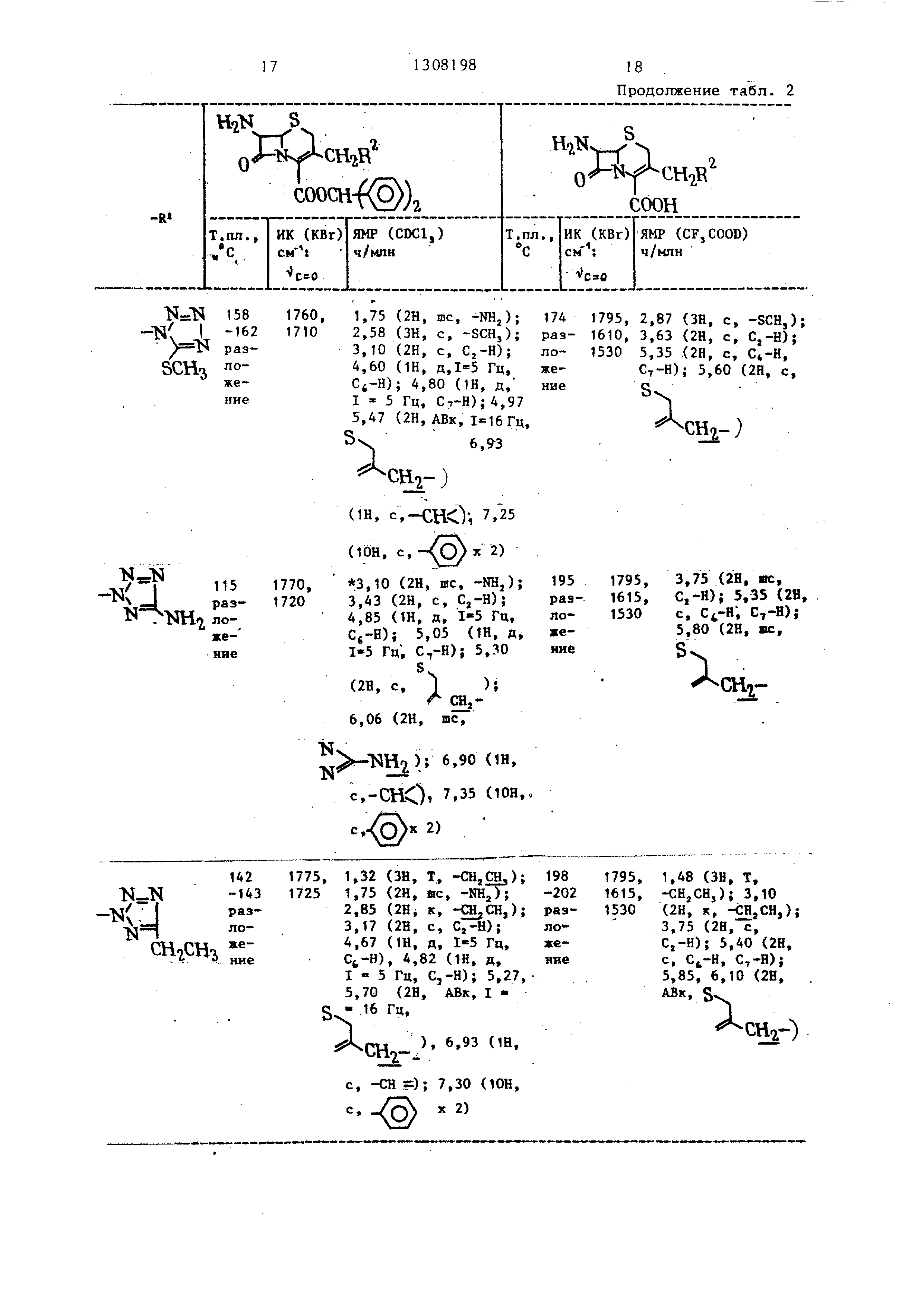
и растворитель отгоняли при пониженной; 4-циано 5-фенил-1,2,3- ном давлении. Полученный остаток -триазолилгруппа; 4,5-дикар- подвергали очистке на хроматографической колонке (силикагеле С-200 Ва- ко; проявляющий растворитель бензол: этилацетат - 4:1 по объему), получая 0,78 г дифенилметилового эфира 7-амино-З- 2- (5-метил- 1 ,2,3,4-тетразолил) метил - - -цефем-4-карбоновой кислоты (т.пл. 157-1бО°С с разложением) и 0,14 г дифенилметилового эфира 7-амибометокси-1 , 2,3-триазол- - -ил-группа, или 4-дифенилме- тилоксикарбонил-1,2,3-триа- золилгруппа, присоединенные -30 к экзометиленовой группе в 3 положении цефемового кольца через углерод-азотную связь.
40
или ее кислотно-аддитивных солей, яв-35 но-3- 1-(5-метил-1,2,3,4-тетразолил)
метил - -цефем-4-карбоновой кислоты (т.пл. 92°С с разложением).
ИК- и ЯМР-спектры дифенилметилового эфира 7-амино-3- 2-(5-метил-1, 2, 3,4-тетразолил)метил J -д -цефем-4- -карбоновой кислоты приведены ниже.
ИК-спектр (КВг) л)-;, 1770, 1720.
ЯМР-спектр (CDClj) млн.долей: 1,75 (2Н mc-NHj); 2,48 (ЗН, с, -СНз); 3,20 (2Н, с, ); 4,70 (Ш, д, I 5 Гц, ); 4,8-7 (1Н, д, Гц, С,-Н); 5,30-5,72 (2Н, АВк, Гц, с 6,92 (1Н, с, -сне ); 7,80
ляющихся промежуточными соединениями в синтезе цефалоспоринов, обладающих антибактериальными свойствами.
Цель изобретения - создание на основе известных методов способа получения новых соединений, обладающих ценными фармакологическими свойствами .
П р и м е р 1. А. В 13 мл сульфо- лана суспензировали 2,72 г 7-амино- цефалоспорановой кислоты и к полученной суспензии добавляли 14,2 г комплекса трифторида бора и серного эфира и 1,0 г 5-метил-1,2,3,4-тетразола, после чего реакционную смесь подвергали реакции при комнатной температу .ре в течение 17 ч. После завершения реакции реакционную смесь вводили в 15 М.П ледяной воды. рН смеси регулировали до 3,5 доба&пением 28 мас.% водного аммиака при охлаждении льдом. Выпавшие в осадок кристаллы сстбирали на фильтре, последовательно промывали 5 мл РОДЫ и - мл ацетона и затем
45
50
(101,
с,
X 2).
55
Здесь и далее в спектрах ЯМР: с - синглет; д - дублет; Т - триплет; R- квантет; м - мультиплет; шс - ширп кий синглет; дд - двойной .чублет ; I - ИНТ енс:ивн ость.
0
сушили, получая 1,76 г смеси 7-ами- HO-3- ci -(5-метил-1,2,3,4--тетразолил) метил -л -цефем-4-карбоновой кислоты и 7-амино-З- С1-(5-метил-1,2,3,4-тет- разолил)метил j -д -цефем-4-карбоно- вой кислоты в виде кристаллов.
Б. В 16 мл метанола суспензировали 1,76 г кристаллов, полученных вы- гае в А и к суспензии добавляли 1,13 г моногидрата пара-толуолсульфокислоты, получая раствор, после чего тут же медленно добавили 4,6 г дифенилдиа- зометана. Проводили реакцию при комнатной температуре в течение 18 мин. После завершения реакции растворитель удаляли перегонкой при пониженном давлении. Полученный остаток растворяли в смешанном растворителе из 30 мл этилацетата и 30 мл воды и рН полученного раствора доводили до 8 добавлением бикарбоната натрия. Затем органический слой отделяли и сушили над безводным сульфатом магния
ЯМР-спек 1,75 (2Н mc 3,20 (2Н, с 5 Гц, ,-Н); 5,30 с 6
50
(101,
с,
X 2).
Здесь и далее в спектрах ЯМР: с - синглет; д - дублет; Т - триплет; R- квантет; м - мультиплет; шс - ширп кий синглет; дд - двойной .чублет ; I - ИНТ енс:ивн ость.
313081
Для фенилметилового эфира 7-амино- (5-метил-1,2,3,4-тетразолил)ме- тил -4 -цефем-4-карбоновой кислоты; ИК-спектр (КВг) л) „1770,
1725.
ЯМР-спектр (CDClj) млн.долей: 1,80 (2Н, С, -NHj); 2,15 (ЗН, с, -CH,); 3,30 (2Н, с, Сз-Н); 4,70 (1Н, д, I 5 Гц, С(,-Н); 4,85 (1Н, д, Гц, ); 5,00, 5,38 (2Н, АВк, Гц О
г
г)6 ,00 (1Н, с, СН ); 7,30
х 2).
35
В, В смешанном растворителе 0,5 мл. анизола и 5 мл трифторуксусной кислоты растворяли 0,462 г дифенилмети- лового эфира 7-амино-3- -(5-метил-1, 2,3,4-тетразолил)метил - з-цефем-4- -карбоновой кислоты, полученный раствор подвергали реакции при комнатной температуре в течение одного часа. 25 После завершения реакции растворитель отгоняли в вакууме, и к полученному остатку добавляли 10 мл воды и 10 мл этилацетата. рН смеси доводили до 3 добавлением 28 мас.% водного аммиака при охлаждении льдом. Затем водный слой отделяли и рН доводили до 3,5 добавлением двунормальной соляной кислоты при охлаждении льдом. Выпавшие в осадок кристаллы отфильтровывали , последовательно промывали,5 мл воды и 5 мл ацетона и затем сушили, Было получено 0,26 г 7-амино-3-С2-(5- -метил-1,2,3,4-тетразолил)метил3-л - -цефем-4-карбоновой кислоты с т.пл. JQ с разложением.
ИК-спектр (КВг) см : , 1610, 1530.
ЯМР-спектр (СРзСООБ) млн.долей: 2, 70 (ЗН. с. -CHj); 3;73 (2Н, с, ),5,40 (2Н,с,,С7-Н); 5,80;6,12
(2Н, АВк, I 16 Гц ;5 -CHj-).
Повторяя описанную методику из 0,462 г дифенилметилового эфира 7-ами-5о но-3- 1-(5-метил-1,2,3,4-тетразолил) метил -л -цефем-4-карбоновой кислоты было получено 0,25 г 7-амино-3- 1-(5- -метил-1,2,3,4-тетразолил)метилJ- - -цефем-4-карбоновой кнЬлоты с т.пл. 55 105°С с разложением.
ИК-спектр (КВг) Vr-n 5, 1615, 1580.
98
ЯМР-спектр (CFjCOOb) мл-.долей:
5
О
5
5
5 Q
2,95 (Н, с, -CHj); 3,90 (2Н, гас, Cj-H); 5,45 (2Н, с, ) (С-,-Н) ; 5,57, 5,92 (2Н, АВк, I 16 Гц,
)-сн,-).
Пример 2. В 19 мл трифторуксусной кислоты растворяли 2,72 г 7- -аминоцефашоспориновой кислоты и к полученному раствору добавляли 7,1 г комплекса трифторида бора и серного эфира и 0,75 г 1,2,4-триазола. Реакцию проводили при комнатной температуре -в течение 7 ч. После завершения реакции растворитель отгоняли перегонкой в вакууме, и к полученному остатку добавляли 15 мп воды. рН полученной смеси доводили до 3,5 добавлением 28 мас.% водного аммиака при охлаждении льдом. Вьщелившиеся кристаллы собирали фильтрованием, последовательно промывали 5 мл воды и 5 мл ацетона и затем сушили, получая 2,5 г 7-амино-З- Cl-(1,2,4-триазолил)метилЗ- 4 -цефем-4-карбоновой кислоты с т.пл. с разложением.
ИК-спектр (КВг) см .j, 1790, 1610, 1530.
ЯМР-спектр (CFjCOOD) млн.долей: 4,00 (2Н, шс, Cj-H); 5,47 (2Н, шс,
Cj,-H, ); 8,70 (1Н, с,
N ,vN
-Н); 9,80 (1Н, с, „ / -Н).
N /
N
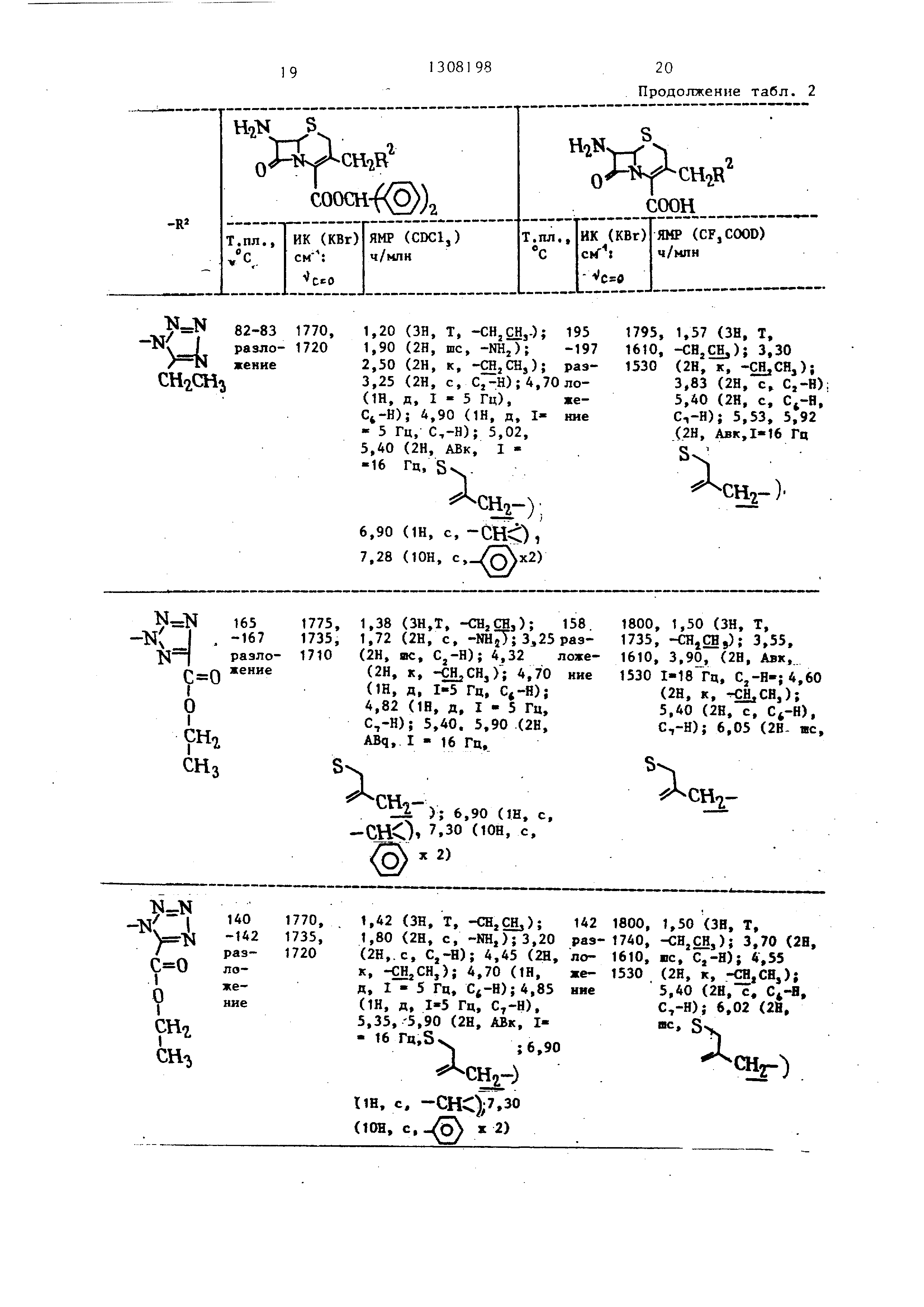
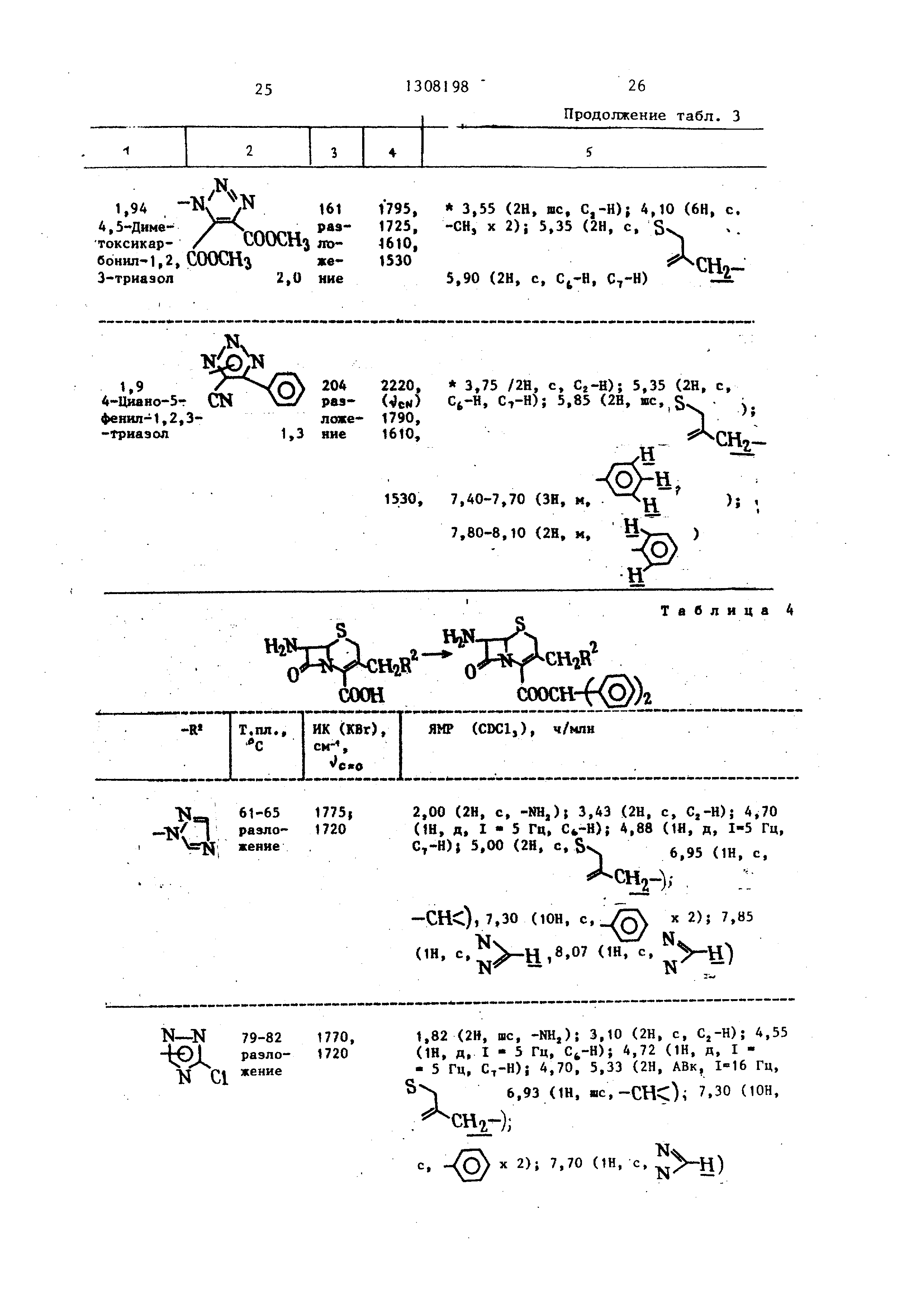
П р и м е р 3. Используя указанные ниже тетразолы, осуществляли реакцию и обработку в соответствии с примером 1 (А) или с примером 2, в результате чего получали продукты, указанные в табл. 1 (в табл. 1 7-АСА является 7-аминоцефалоспориновой кислотой ) . Далее продукты, перечисленные в табл. 1, этерифицировапи и затем деэтирифицировали способом, описанным в примере 1 (Б) и (В). Бьши получены сложные эфиры и карбоновые кислоты, перечисленные в табл. 2.
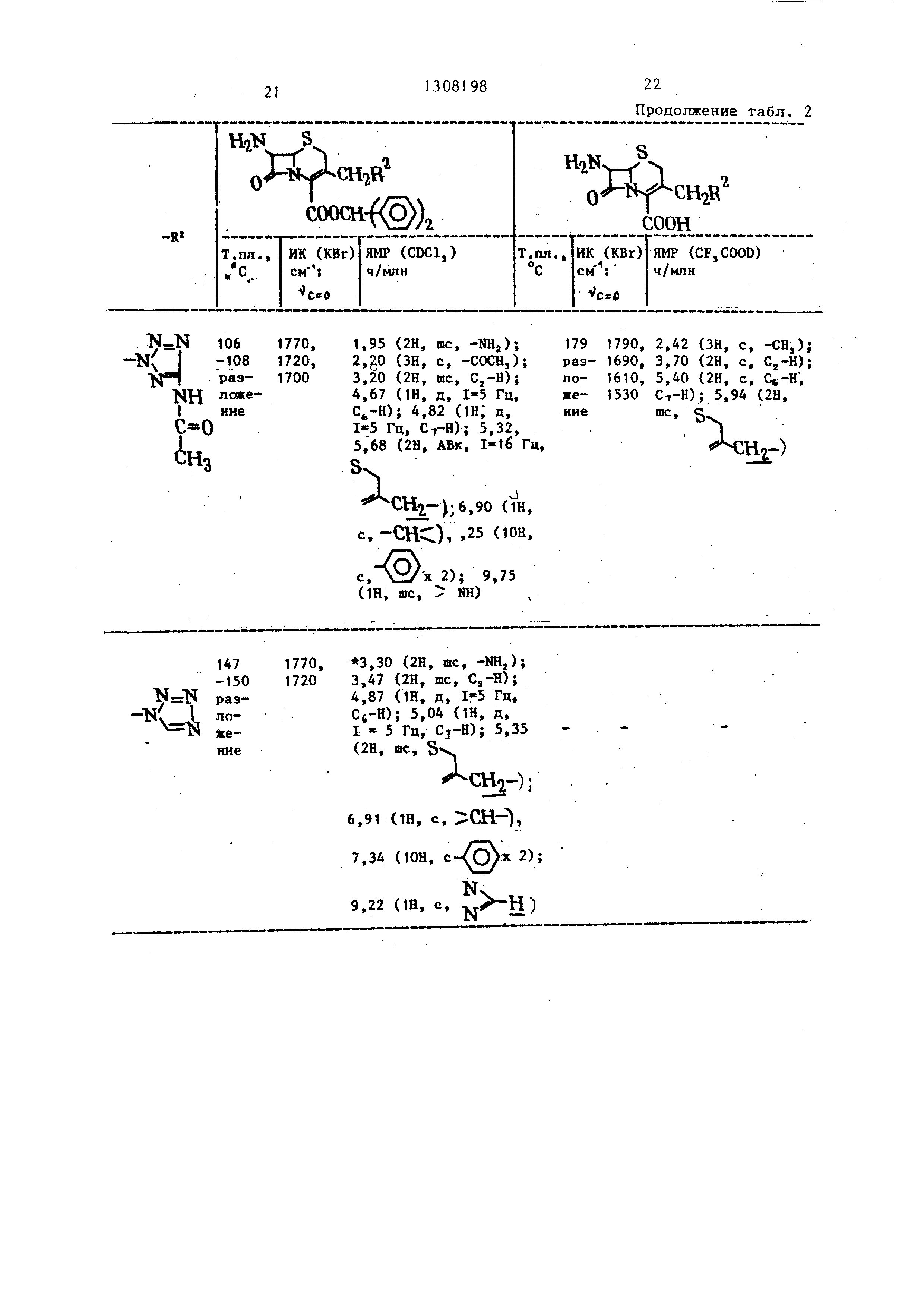
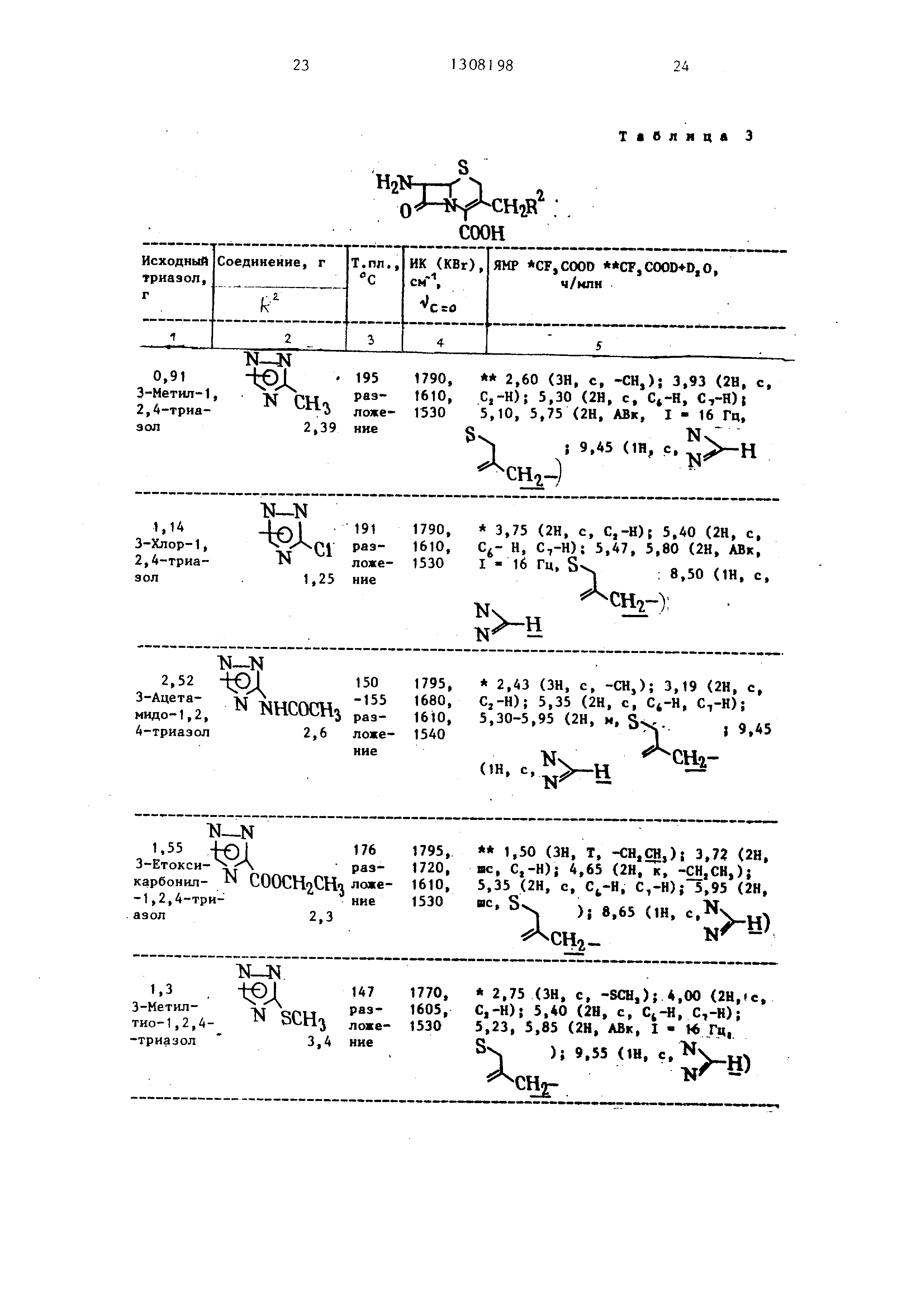
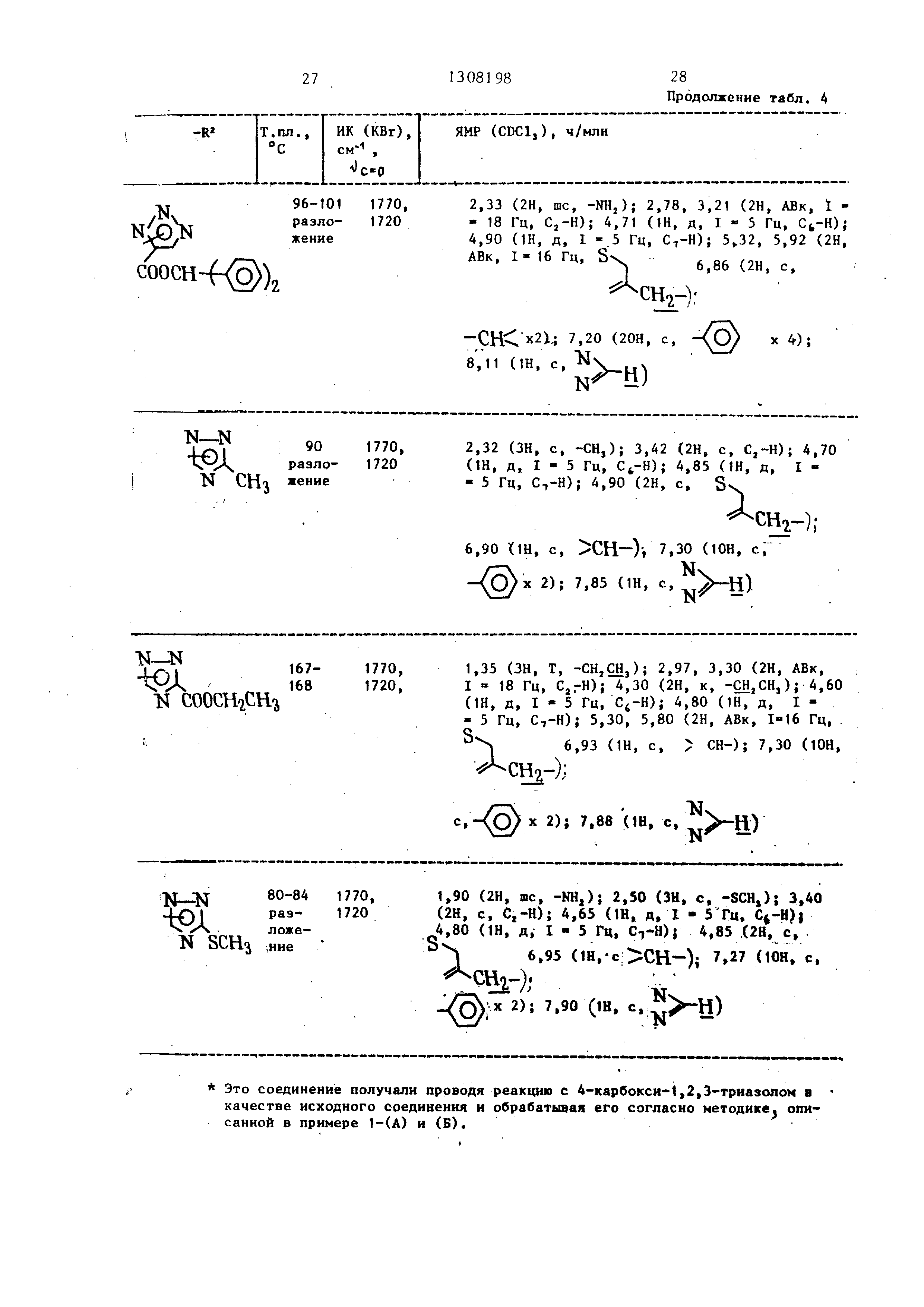
П р и м е р 4. Используя указанные тетразолы, реакцию и обработку проводили в соответствии с примером 1 (А) или примером 2, получая соединения , указанные в табл. 3. Карбоновые кислоты этерифицировали способом аналогичным описанному в примере 1 (Б), получая соединения, показанные в табл. 4. 2,72 г 7-АСА (7-аминоце51308198 6
фалоспориновая кислота) исполъзова- (1Н, д, I 5 Гц, ); 5,32 (1Н, д, ли в качестве исходного материала.
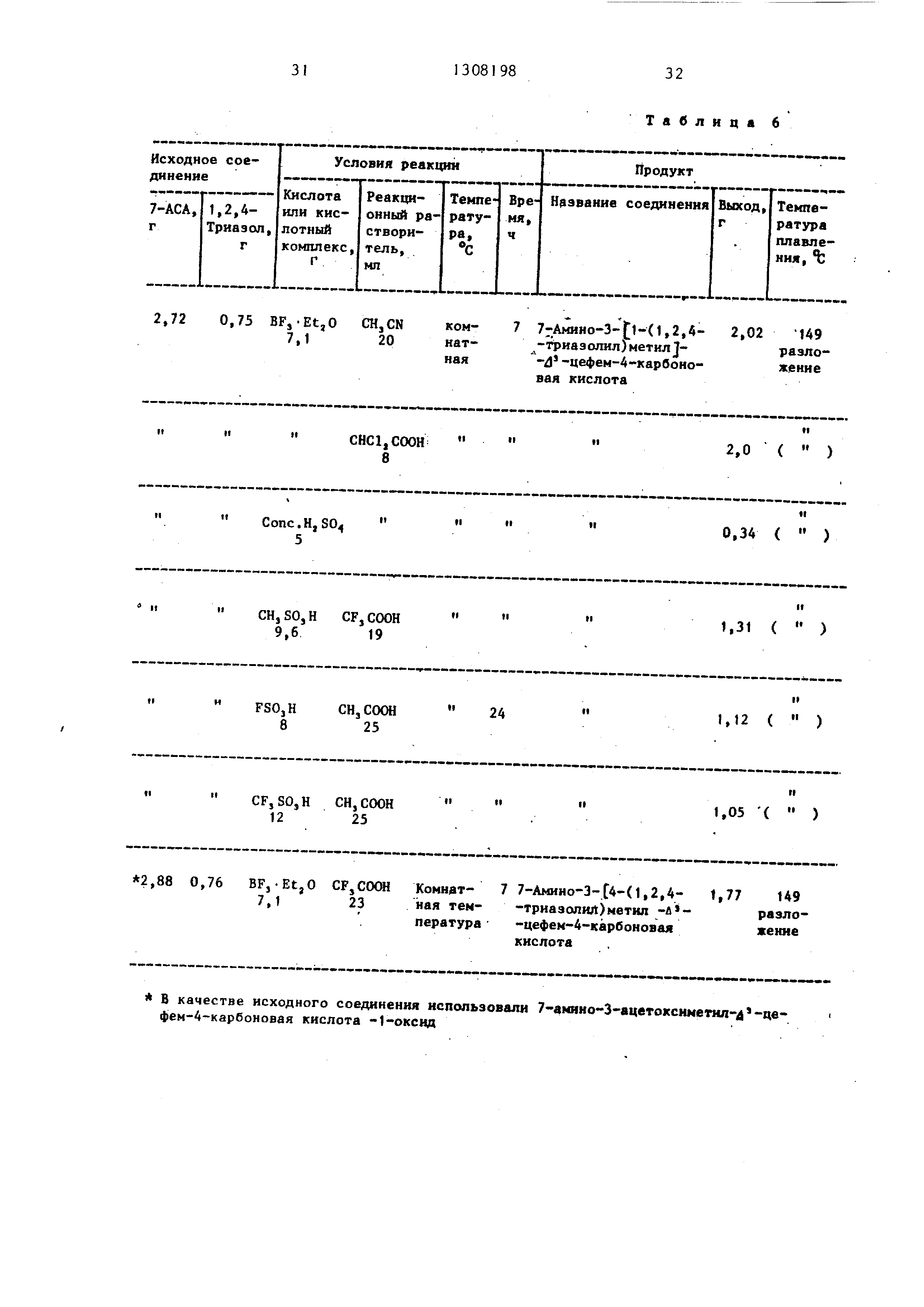
Пример 5. Реакцию проводили в соответствии с методикой примера 1 при условиях, указанных в табл, 5, в результате чего бьти получены соединения , перечисленные в табл. 5.
П р и N е р 6, При условиях, перечисленных в табл. 6 проводили реакцию
Гц, ); 5,38, 5,82 (2Н, АВк, I 16 Гц, -CHj-); 5,91 (2Н, шс
- ); 6,70-7,50 (2Н, м о) ) ;
8,49 (1Н, с, -СН N-).
Б. В смеси растворителей из 50 мл четырехнормальной соляной кислоты и
аналогично примеру 2, получая в результате соединения, указанные в табл. 6, где 7-АСА - 7-аминоцефало- спориновая. кислота.
Пример 7. Повторяли реакцию и обработку по примеру 2, за исключением того, что вместо 7-аминоцефа- лоспориновой кислоты использовали в качестве исходных веществ соединения перечисленные в табл. 7.
В результате получали продукты, представленные в табл. 7.
20 дили до 7,0 28 мас.% водного аммиака при охлаждении льдом. Органический слой отделяли и сушили над безводным сульфатом магния. Затем при перемешивании и охлаждении льдом добавляли
Пример8. А.К суспензии
2,96 г 7-амино-3- 2-(5-метил-1,2,3,4-
-тетразолил)метил лЗ-цефем-4-карбо- 25 раствор 1 г сухого хлористого водо- новой кислоты в 15 мл диметилформами- в 20 нп серного эфира, и отделя- да добавляли 1,34 г салицилового аль- белый порошок. Порошок отфильтро- дегида, и смесь реагировала при комнатной температуре в течение одного
часа. Реакционную смесь охлаждали зо хлороформа, получая 3,67 г (выход льдом: и к ней добавляли 0,96 г три- g2 2%) хлоргидрата пивалоилоксимети- этиламина и 2,42 г пивалоилоксиметилвывали , тщательно промывали серным эфиром и перекристаллизовывали из
лового эфира 7-амино-3- 2-(5-метил-1, 2,3,4-тетразолил)метил -(1 -цефем-4- -карбоновой кислоты с т.пл. 149 - 35 с разложением.
йодида, после чего полученная смесь реагировала в течение 20 мин,. После завершения реакции реакционную смесь вводили в смешанный растворитель из 150 мл воды и 150 мл этилацетата. рН регулировали до 7,0 бикарбонатом натрия , органический слой отделяли, промывали двумя порциями 100 мл воды и
сушили над безводным сульфатом магния . Затем растворитель отгоняли при пониженном давлении. Изопропиловый спирт добавляли к остатку, и получае
мые кристаллы отфильтровывали и затем е g
перекристаллизовывали из изопропило- , 78-5 92 вого спирта. Было получено 2,73 г -СООСН О-)
(2Н, м.
(выход 53,1%) пивалоилоксиметилового эфира 7-(2-оксибензилиденамино)-3- 2Пример9 . В20млЫ, N-ди- (5-метил-1,2,3,4-тетразолил)метил - Q метилформамида суспендировали 2,96 г
-Л -цефем-4-карбоновой кислоты т.пл. 136-137°С с разложением.
ИК-спектр (КВг) см : 1770, 1765, 1750.
ЯМР-спектр (CDClj) млн.долей: 1,23 (9Н, с, -С(СНз)з); 2,51 (ЗН, с, N
}-СН.,); 3,30 (2Н, с, ); 5,08 N
7-амино-3- 2-(5-метил-1,2,3,4-тетра- золил)метил З-Л -цефем-4-карбоновой кислоты. Затем суспензию превращали в раствор путем добавления 1,1 г три зтиламина при охлаждении льдом. Затем к раствору добавляли 2,7 г пива- лоилоксииодида и полученную .:месь подвергали реакции при 0-5 С в течение часа. После завершения реакции
(1Н, д, I 5 Гц, ); 5,32 (1Н, д,
Гц, ); 5,38, 5,82 (2Н, АВк, I 16 Гц, -CHj-); 5,91 (2Н, шс
- ); 6,70-7,50 (2Н, м о) ) ;
8,49 (1Н, с, -СН N-).
Б. В смеси растворителей из 50 мл четырехнормальной соляной кислоты и
25 мл серного эфира перемешивали при 10-Т5 С в течение часа 5, 14 г пивало- илоксиметилоБого эфира 7-(2-оксибен- зилиденамино)(5-метил-1,2,3,4- -тетразолил)метил -4 -цефем-4-карбоновой кислоты, полученной вьше в (А). Затем водный слой отделяли и промывали двумя порциями 30 мл серного зфи- ра, после чего к водному слою добавляли 100 МП серного эфира и рН доводили до 7,0 28 мас.% водного аммиака при охлаждении льдом. Органический слой отделяли и сушили над безводным сульфатом магния. Затем при перемешивании и охлаждении льдом добавляли
раствор 1 г сухого хлористого водо- в 20 нп серного эфира, и отделя- белый порошок. Порошок отфильтро-
раствор 1 г сухого хлористого водо- в 20 нп серного эфира, и отдел белый порошок. Порошок отфильтро
хлороформа, получая 3,67 г (выход g2 2%) хлоргидрата пивалоилоксимети
вывали, тщательно промывали серным эфиром и перекристаллизовывали из
хлороформа, получая 3,67 г (выход g2 2%) хлоргидрата пивалоилоксимети-
лового эфира 7-амино-3- 2-(5-метил-1, 2,3,4-тетразолил)метил -(1 -цефем-4- -карбоновой кислоты с т.пл. 149 - с разложением.
ИК-спектр (КВг) -. 1773, 1741, 1730.
ЯМР-спектр (d -DMCO) млн.долей: 1,18 (9Н, с, -С(СНз)з); 2,44 (ЗН, с,
N
) -СНз); 3,60 (2Н, с, ); 5,23
N
g
, 78-5 92 -СООСН О-)
(2Н, с, Сб-Н, С-,-Н); 5,62 (2Н, с,
(2Н, м.
Пример9. В20млЫ, N-диилформамида суспендировали 2,96 г
метилформамида суспендировали 2,96 г
7-амино-3- 2-(5-метил-1,2,3,4-тетра- золил)метил З-Л -цефем-4-карбоновой кислоты. Затем суспензию превращали в раствор путем добавления 1,1 г три- зтиламина при охлаждении льдом. Затем к раствору добавляли 2,7 г пива- лоилоксииодида и полученную .:месь подвергали реакции при 0-5 С в течение часа. После завершения реакции
713
реакционную смесь вводили в смешанный растворитель из 250 мл воды и 200 мл этилацетата, и рН доводили до 7,0 бикарбонатом натрия. После удаления нерастворимого вещества органи- ческий слой отделяли и сушили над безводным сульфатом магния при пониженном давлении. После промывки остатка серным эфиром остаток растворяли в 30 мл этилацетата и раствор 1 г сухого хлористого водорода в 30 мл серного эфира добавляли к полученному раствору при охлаждении льдом и перемешивании. Выпавшие кристаллы собирали фильтрованием, тщательно про- мывали серным эфиром и затем пере- кристаллизовывали из хлороформа, получая 2,72 г (выход 60,9%) хлоргидра- та пивалоилоксиметилового эфира 7-ами но-3- 2-(5-метил-1,2,3,4-тетразолил) метил -д -цефем-4-карбоновой кислоты с т.пл. 149-151 с с разложением.
ИК-спектр (КВг) см : л|(--о 1773, 1741, 1730.
ЯМР-спектр (dt -DMCO) млн. долей: 1,18(9Н, с, -С(СНз)з); 2,44 (ЗН, с, -CHj); 3,60 (2Н, с, -Cj-H); 5,23 (2Н, с, Cfe-H, С7-Н); 5,62 (2Н, с.
) );- 5,78-5,92 (2Н, м, -COOCHjO-).
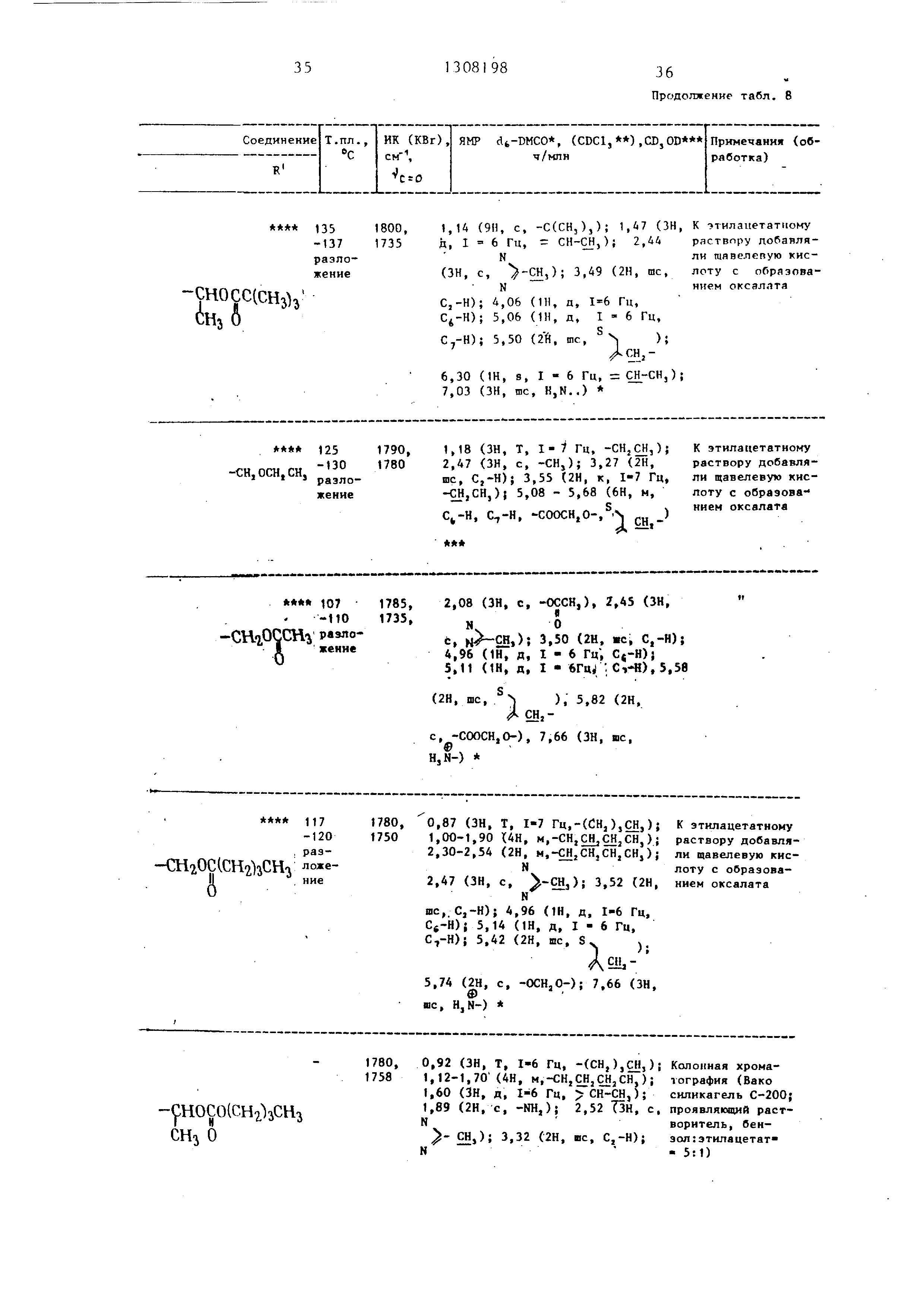
Используя различные соединения в качестве исходных и осуществляя реакцию в соответствии с описанной выше процедурой, получали соединения пере
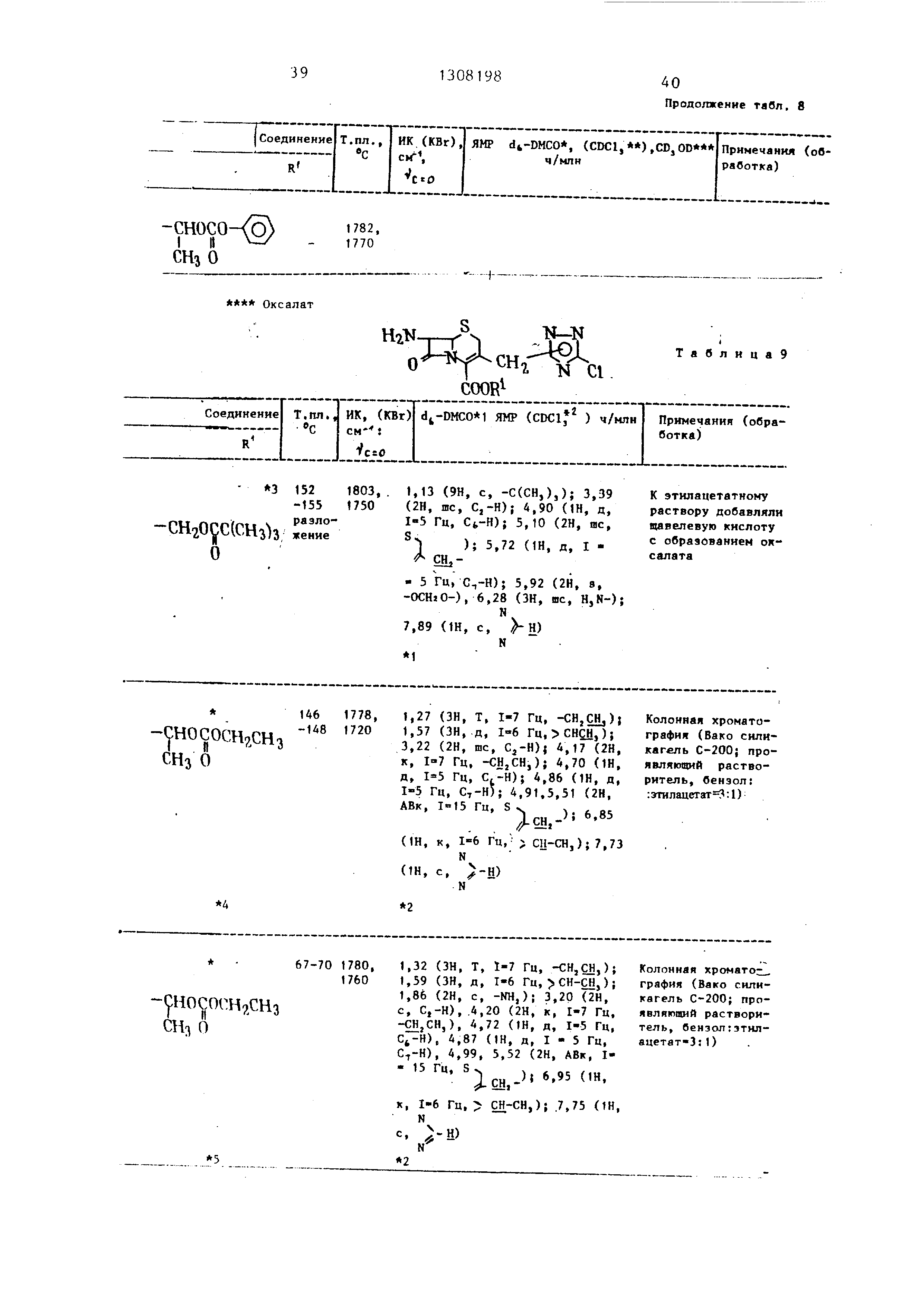
численные в табл. 8 и 9. I
Формула изобретения
1. Способ получения 7-амино-З-за- мещенной метил-л -цефем-4-карбоновой кислоты общей формулы
ia
(
ч .
COORi
де R - атом водорода или сложнопфирная защитная группа; R - незамещенная тетразрлилгруппа , или замещенная бромом , низшим алкилом, метилтиогруппой , карбоэтоксигруппой , фенилом, ацетами- ДО-, карбоэтоксиметил- или аминогруппой; незамещенная 1, 2,- ч-триазолилгруппа, или
8
замещенная хлором, низшим алкилом, метилтиогруппой, карбоэтоксигруппой или аце- тамидогруппой; 4-циано-5- -фенил-1,2,3-триазолилгруп- па, 4,5-дикарбометокси-1,2, 3-триазол-1-ил-группа, или 4-дифенил-метилоксикарбо- нил-1,2,3-триазолилгруппа, присоединенные к экзамети- леновой группе в 3 положении цефемового кольца через углерод-азотную связь, ее кислотно-аддитивных солей, личающийся тем, что це- спорановую кислоту общей формулы
Пг
O Nf CHaOCOOHi
имеет указанные значения;
или
0.
5 где
подвергают взаимодействию с незамещенными тетразолом или 1,2,4-триазо- лом, или замещенными соответствующи30 ми группами, указанными для R2 в органическом растворителе, в присутствии протонной кислоты или кислоты Льюиса, или комплексного соединения кислоты Льюиса при температуре от
j комнатной до 60°С с последующим, в случае необходимости, удалением слож- ноэфирной группы или этерификацией карбоксильной группы и выделением целевого продукта в свободном виде или
0 в виде кислотно-аддитивной соли.
2. Способ по п. 1, отлича ю- щ и и с я тем, что в качестве протонной кислоты используют серную кислоту , метансульфоновую кислоту, фтор5 серную кислоту или трифторметансуль- фоновую кислоту.
3.Способ по п. 1, отличающийся тем, что в качестве кислоты Льюиса используют трехфтористый
0 бор, а в качестве комплексного соединения кислоты Льюиса - зфираты трех- фтористого бора.
4.Способ по п. 1, отличающийся тем, что в качестве орга5 нического растворителя используют уксусную кислоту, трифторуксусную кислоту , дихлоруксусную кислоту или их сложные эфиры или нитриты, нитроме- тан, этилхлораЦетат или сульфолан.
«iH « l M4 MWOT«
соединение I
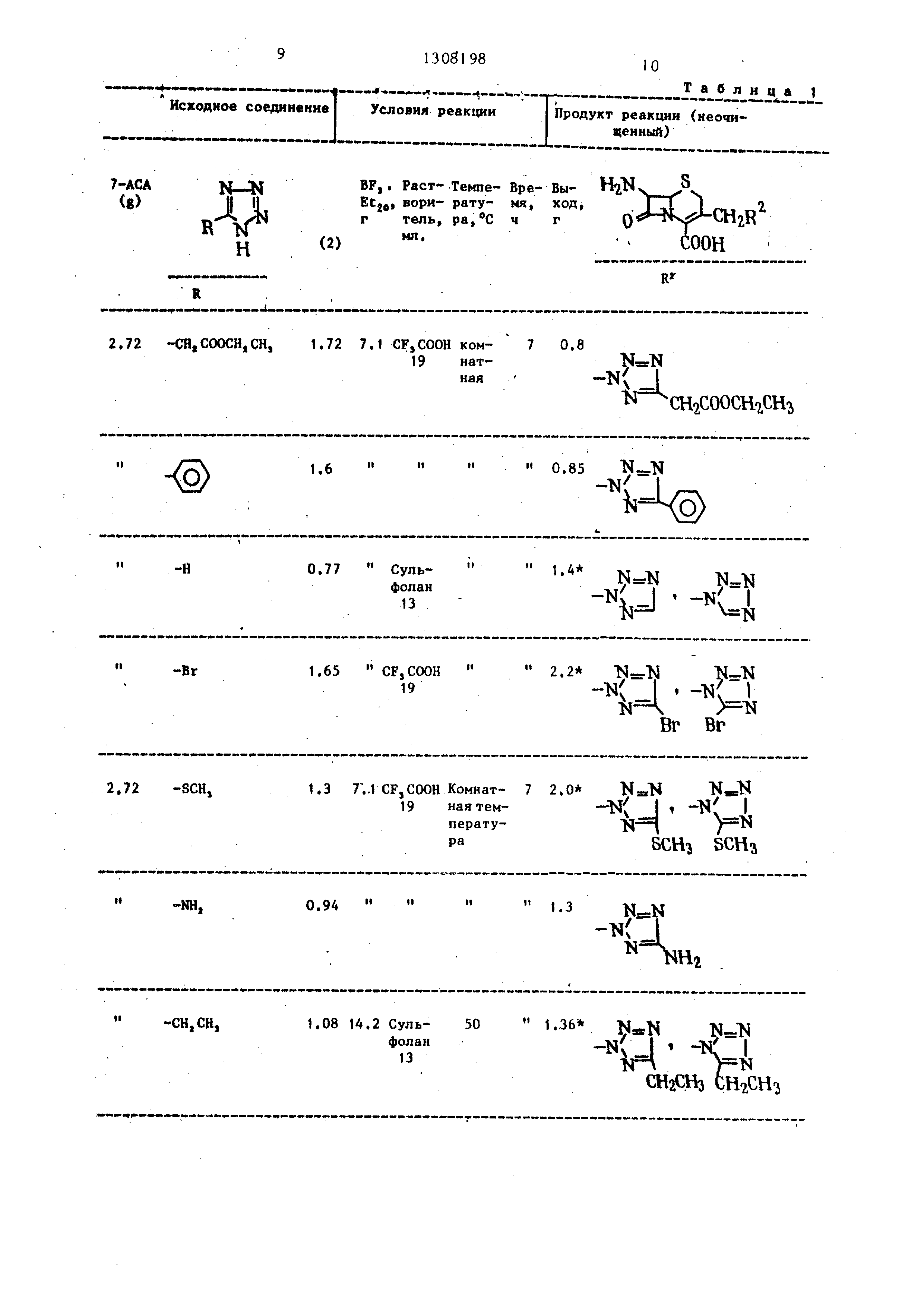
Исходное соединение I Условия реакции
7-АСА N-N Раст- Темпе- Вре-Вы- V- N.
Cg) И II ECje, вори- рату- мя., ГГГ 1о
R / O V Z
(2) МП.. ,
Н
Rr
2,72 -СН,СООСН,СН, 1.72 7.1 CF,COOH ком- 7 0.8
19 нат-NerN
.6 0.85 N.- N
-Н0.77 Суль- 1.4
N NN--N
Г. - -Ny
-Br1.65 CFjCOOH 2.2 Ы- МN N
Л4 -.
Вг Вг
1.3 7;.1CF,COOH Комнат- 7 2.0
19 наятем- ч J
перату- N /-
2.72 -SCH,
19
р«scH SCHa
-NH,0.94 1.3|4a N
N(
-CH,CH,1.08 14.2 Суль- 50 1.36 ЦвКК-Т
фолан-ил/ I . жт/ I
13
-V
, JH L
Продукт реакции ( ценный)
СНтСООСНгСН
(
H
HI
ЦвКК-Т
-ил/ I . жт/ I
-V
Ш2СНз tHoC
ШаСИз
ение|
Исходное соединениеУсловия реакции
-COOCHgCH,
1.56
2.72 -NHCOCH,
1.4 7.1 CFjCOOH koMHar-i 7 1.0 19 нал
Это вещество получали в виде смеси 1-замещеняого и 2-замещенного продуктов. Такие сырые продукты реагировали и обрабатывались тем хе способом, что в примере 1 (Б) с целью вьщеления эфиров соответствующих 1-замещенного и 2-замещенного продуктов. Свойства таких соединений представлены в табл. 2.
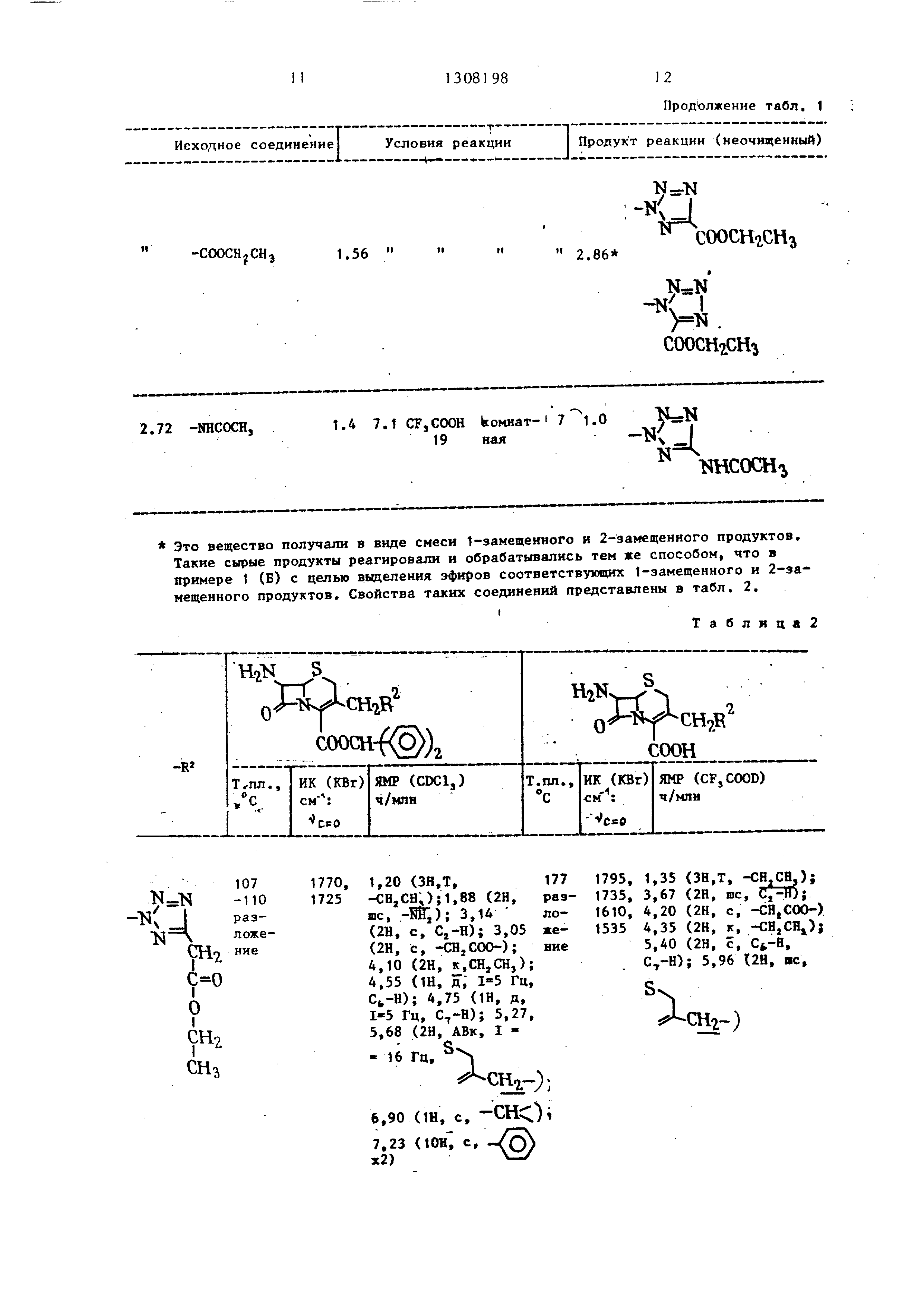
U.
СНг
О
снг
Шг
107 -110 разложение
1770, 1,20 (ЗН,Т,177
1725 -СН,СВ;);1,88 {2Н, раз- шс, ); 3,1А ло- {2Н, с, Cj-H); 3,05 же- (2Н, с, -CHjCOO-); ние 4,10 (2Н, к,СН,СН,); 4,55 (Ш, д,- 1-5 Гц, Сь-Н); 4,75 (1Н, д, 1-5 Гц, ); 5,27, 5,68 (2Н, АВк, I - 16 Гц,
Аснг-);
6,90 (Ш, с. -CHOi
7,23 (10Н, с, -/oS х2)
ПродЬлжение табл. 1
Продукт реакции (неочищенный)
2.86
СООСНгСН
N
-X I
)5 . COOCH CH
K
-Ж J
.
NHCOCH
Таблица2
1,35 (ЗНД, -СН.СЯ.);
3,67 (2Н, шс,
4,20 (2Н, с, -CHjCOO-)
4,35 (2Н, к, -CHjCHj)j 5,40 (2Н, с, Ci,-a, С,-Н); 5,96 (2Н, ис.
ДсН2-)
v.
Д-СНп- 6.90
1Н, c,),7,23
{15Н Гц, с,УО)
6,97(1Н,с, -СНО; 7,30 (lOH,))i
8,43 (1н. .цУ
9«N
Вг
75-78 1770, 1,87 (2Н, с, -Ш,);
разло- 1720 3,2А (2Н, с, Cj-H);
жение4,68 (1Н, д,1-5 Гц,
); 4,87 {1Н, д, 1-5 Гц, Ci-H); 5,30,
5,77 (2Н, АВк, I S . - 16 Гц, );
Аса,1790 , 3,60 (2Н, arc. С,-В); 1610, 5,ДО (2Н, с, CfH, 1530 C,-H)j 5,9А (2Н,
8
Лснг
6,92 (1Н, c,-CHOi 7,27 (ЮН, с,X 2)
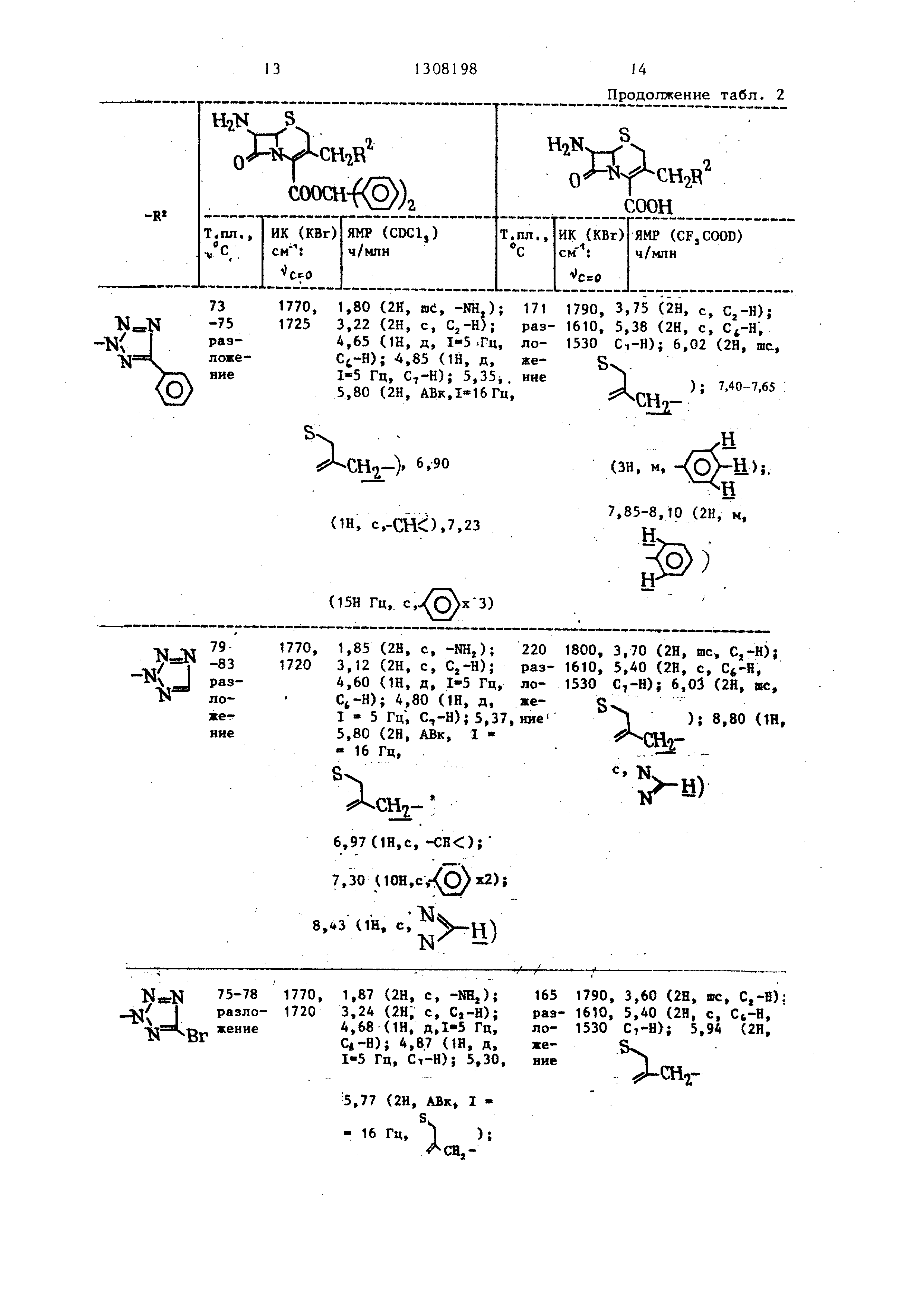
96-98 разложение
Вг
1770, 1,85 (2Н, с, -Ш,);
17203,20 (2Н, с, Cj-H);
4,75 1Н, д, 1 - - 5 Гц, Ci-H); А,88 (1Н, д, 1-5 ГЦ, С,-Н); 5,03, 5,67 (2Н, АВк, 1-16 Гц,
h
Аснг- 58 (1Н, с, -СНО,
7,30 (ЮН, с, X 2)
1-16 Гц,.
м«
6,90 (1Н, с,-СНО
7,25 (ЮН, )
М ТЯ158
)NраэSCHrjло1760 , 1710
же- ние
1,75 (2Н, шс, -NHj);174
2,58 (ЗН, с, -SCHj);раз3 ,10 (2Н, с, Cj-H);ло4 ,60 (1Н, д, Гц,жеCi-H ); 4,80 (1Н, д, ние I « 5 Гц, C7-H)j 4,97 5,47 (2Н, АВк, Гц,
)
(1Н, c.-ClK)-, 7,25
(10Н, с.
N-JN
u
115
раз . . ложе1770 , 1720
яие
3,10 (2Н, шс, -NHj); 3,43 (2Н, с, С,-Н); 4,85 (1Н, д, 1-5 Гц, Cj-H); 5,05 (1Н, д, 1-5 Гц, С,-Н); 5,30
S. (2Н, с, 1);
CHj- 6,06 (2Н, шс7
N
--МН2); 6,90 (ш,
с,-СИО 35 с, 2)
174
разложение
1795, 2,87 (ЗН, с, -SCH,); 1610, 3,63 (2Н, с, С,-Н); 1530 5,35 .(2Н, с, Ct-H, CT-H); 5,60 (2Н, с,
1
снг-}
2)
1795, 3,75 (2Н, шс, 1615, Cj-H); 5,35 {2Н, 1530 с, С7-Н); 5,80 (2Н, шс.
1
Я
ШгСН 142 -143 раз- лоние
1775, 1,32 (ЗН, Т, -CHjCHj);198
1725 1,75 (2Н, ис, -NH.,);-202
2,85 (2Hi к, ,);раз3 ,17 (2Н, с, С,-Н);ло4 ,67 (Ш, д, 1-5 Гц,жеС -Н ), 4,82 (1Н, д,ние I - 5 Гц, Cj-H); 5,27,- 5,70 (2Н, АВк, 1 - S - 16 Гц,
СН
с, -СН ); 7,30 (ЮН, с, -/О X 2)
1,48 (ЗН, Т, -CHjCH,); 3,10 (2Н, к, -CHjCH,); 3,75 (2Н, с, С,-Н); 5,40 (2Н, с, , ); 5,85, 6,10 (2Н,
АВк, §.
X
СНг-)
4
82-83 1770, разло- 1720 жение
же- ние
1,20 (ЗН, Т, -CHjCHj-); 195 1,90 (2Н, шс, -NHj); -197 2,50 (2Н, к, -CHjCHj); раэ- 3,25 (2Н, с, Cj-H); 4,70 ло- (1Н, д, I - 5 Гц), Ci-B); 4,90 (1Н, д, 1ж - 5 Гц, С,-Н); 5,02, 5,40 (2Н, АВк, I - -16 Гц, Sx.
%-)i
6,90 (1н, с, ),
7,28 (ЮН, с,)
1795, 1,57 (ЗН, Т, 1610, -CHjCHj); 3,30 1530 (2Н, к, -CHjCH,); 3,83 (2Н, с, С,-Н); 5,40 (2Н, с, Cj-H, Сл-Н); 5,53, 5,92 (2Н, АВК,1-16 Гц
1
сн,-)
J мл
о
СНг СНя
1651775,
-1671735,
разло-1710 жение
1,38 (ЗН,Т, -CHjCH,); 158 1,72 (2Н, с, -NHTT; раз- (2Н, шс, Cj-H); 4,32 ложе- (2Н, к, -CHjCH,) ; 4,70 ние (Ш, д, 1-5 Гц, Cj-H); 4,82 (1Н, д, I - 5 Гц, С,-Н); 5,40. 5,90 (2Н, ABq, I - 16 Гц,
X
1); 6,90 (Ш, с, -СНО °« 3
Hi
1,42 (ЗН, т, -CHjCH,); 142 1800, 1,80 (2Н, с, -Ш,);3,20 раз- 1740,
ние
(2Н,.с, С,-Н); 4,45 (2Н, ло- к, -CHjCH,); 4,70 (1Н, д, 1 - 5 Гц, С4-Н);4,85 (1Н, д, 1-5 Гц, ), 5,35, 5,90 (2Н, АВк, I- -16Гц,.
) Гш, с, -СНСу.зо
(10Н, с,-/О «2)
1610, 1530
1800, 1,50 (ЗН, Т, 1735, -CHjOT,); 3,55, 1610, 3,90, (2Н, АВК, 1530 1-18 Гц, С.,-Н-;4,60 (2Н, к, СН,СН,); 5,40 (2Н, с, ), С,-Н); 6,05 (2Н- юс.
lAcHoСНт ,1800 , 1740,
1610, 1530
1,50 (ЗН, т, -CHjCH,); 3,70 (2Н, шс, Cj-H); 4,55 (2Н, к, -CH,CB,)j 5,40 (2Н, с, , С,-Н); 6.02 (2В,
«ь-:)
N.N106
( I-108
-цНp«3I4Hло вь
1770, 1720, 1700
ние
i
О Нз
1,95 (2Н, шс, -NHjj); 2,go (ЗН, с, -СОСН,); 3,20 (2Н, шс, Cj-H);
4.67(1Н, д, 1-5 Гц, ); 4,82 (1Н; д, 1«5 Гц, Ct-H); 5,32,
5.68(2Н, АВк, 1-1б Гц,
1
);6,90 (Ш, с,-сне.), .25 (10Н,
S)
2); 9,75
(1Н, шс.
147 -150 N раз 4 °же- ние
1770, 3,30 (2Н, шс, -NHj);
1720 3,47 (2Н, шс, ); 4,87 {1Н, д, 1-5 Гц, Ct-H); 5,04 (1Н, д, 1-5 Гц, Сз-Н); 5,35 (2Н, шс, S-v
); 6,91 (ш, с, ::::СН-,
7,34 (ЮН, 2); 9,22 (1Н, с, )
1790, 2,42 (ЗН, с, -СИ,); 1690, 3,70 (2Н, с, );
5,40 {2Н, с, Сь-н;
Ci-H); 5,94 (2Н,
.C.S.
1610, 1530
Hj-)
2); 9,75
: ш)
H2lJy-r Ч г
: соон
1,
N-J
-tm.
195
N СНч
i ложе- 2,39 ние
1, -
И-N
-IftX
К
191
С1
ложе1 ,25 ние
150
N-N
2,52 iOl 3-Ацета- -мирпри 155 мияо-1,2, NHLUCH раз- 4-триазол2,6 ложение
N-N
1.35 176
3-Етокси- T, разкарбонил- СООСНгШз ложе- -1,2,4-триние
азол
2,3
N-N
tPxl
N4PUР
btH ложе3 ,4ние
Таблица 3
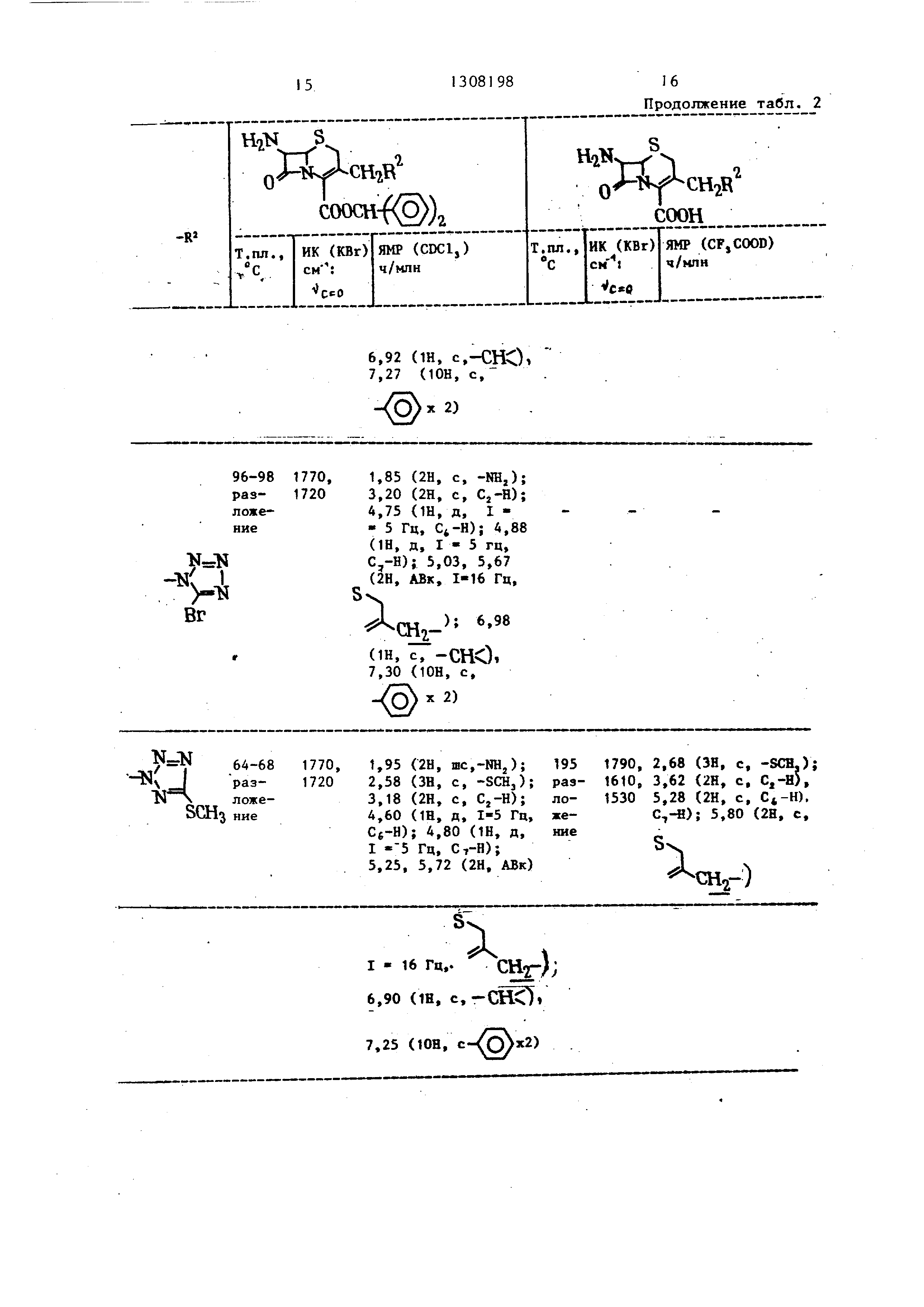
2,60 ЗН, с, -СН,); 3,93 (2Н, с, С,-Н); 5,30 (2Н, с, , C,-H)j 5,10, 5,75 (2Н, АВк, 1-16 Гц,
,9,45(1Н, с,-Н
СН,4
3,75 (2Н, с, С,-Н); 5,ДО (2Н, с, Н, ): 5,47, 5,80 (2Н, АВк, 1.16Гц, Sv :8,50(1Н, с,
ГН-
);
2,43 (ЗН, с, -СН,); 3,19 (2Н, с, С,-Н); 5,35 (2Н, с, , ); 5,30-5,95 (2Н, м, Sv..., 9,45
KT.А.ГН« (1н, с,
СНг
1795, 1,50 (ЗН, Т, -СН,СН,); 3,7 (2Н,
1720,шс, С,-Н); 4,65 (2Н, к, -СН,СН,)}
1610,5,35 (2Н, с, , С,-Н); 5,95 (2Н,
и
2,75 (ЗН, с, -SCH,); 4,(Ю (2Н,(с, С,-Н); 5,40 (2Н, с, , С,-Н); 5,23, 5,85 (2Н, АВк, I - 1« Гц,
), 9,55(Ш, c.
CHjrN Дх
иЛк
N.IN,61
/,лгчпи / CuOCHj
ООСНз
2,0 ние
яо- же1795 , 1725, 1610, 1530
1,9 /С 204 2220, 3,75 /2Н, с, ); 5,35 (2Н, с, -Циаио-5т CN :±7 рез- (си) Cfc-H, С,-Н); 5,85 (2Н, шс, § . : «нил-1,2,3-ложе- 1790,
4
феяип
-триаэол
1,3 яие 1610,
,н- Ьг
3,55 (2Н, шс, С,-Н); 4,10 (6Н, с. -СН, X 2); 5,35 (2Н, с, Sv,
5 ,90 (2Н, с, , ) tii.
,35 (2Н, с, шс, § . :
,н- Ьг
®.
1530, 7,40-7,70 (ЗН, м, 1
7,80-8,10 (2Н, и, )
М
н
i%-f г
соон
Ц 1-Ь5 1775| -./ разло- 1720
N-A:
жение
2,00 (2Н, с, -NHj); 3,43 (2Н, с, С,-Н); 4,70 (Ш, д, I - 5 Гц, ); 4,88 (1Й, д, 1-5 Гц, С,-Н), 5,00 2Н, C,,95 (1Н, с,
СНп-А.
);
ШС), 7,30 (ЮН, с.
);
/PJ X 2); 7,85
-1Л. N.
(1Н, с,Н,«.07 (Ш, с, VH)
N-N 79-82 - OlраэлоN Cl «
1770,1,82 (2Н, шс, -NH,); 3,10 (2Н, с, ); 4,55
1720(1Н, д, I - 5 Гц, Cfc-H); 4,72 (1Н, д, I - 5 Гц, C,-H)i 4,70, 5,33 {2Н, АВк, 1-16 Гц.
,93 (Ш, с,-ШС); 7.30 (ЮН.
снг-);
К
-(З 2); 7,70 (1Н. с. )
Таблица 4
сНгГ соосн (2Н, с, 4,88 (1Й
СНп-А.
);
К
-(З 2); 7,70 (1Н. с. )
««ие
90 разло1770 , 1720
гСЩ
167- 168
1770, 1720,
N-IT80-8
4О1Р
х .ложеN SCH -ние
1770,1,90 (2Н, шс, -NH,); 2,50 (ЗН, с, -SCH,); 3,40
1720(2Н, с, С,-Н); 4,65 (Ш, д, I 5 Гц. )
4,80 (1Н, д, I - 5 Гц, СтН)} 4,85 .(2Н, с,
6,95 (1Н,); 7,27 (ЮН, с,
).
О):х 2) ; 7,90 (Ш, с,-Н)
Это соединение получали проводя реакцию с 4-карбокси-1,2,3-трназопом в качестве исходного соединеиия и обрабатывая его согласно методике, описанной в примере 1-(А) и (Б).
-СНСх2Х 7,20 (20Н, с,
)
8,11 (Ш, с,
X 4);
2,32 (ЗН, с, -СН,); 3,42 (2Н, с, С,-Н); 4,70 (1Н, Д. I - 5 Гц, ); 4,85 (1Н, д, I - - 5 Гц, С-,-Н); 4,90 (2Н, с, SN
снг-);
6,90 ПН, с, ХН-, 7,30 (ЮН, сГ
-(О/х 2); 7,85 (Ш, с, /-Н)
1,35 (ЗН, Т, -CHjCHj); 2,97, 3,30 (2Н, АВк, I 18 Гц, CjrH); 4,30 (2Н, к, -CHjCH,); 4,60 (1Н, д, I - 5 Гц, )} 4,80 (1Н, д, I - - 5 Гц, С,-Н); 5,30, 5,80 (2Н, АВк, Гц,
6,93 (1Н, с, СН-); 7,30 (ЮН,
);
}
2); 7.88 (IB, с, -Ц)
2,72 1,0 BF,-Et,0, Сулфолан 50 4 1,9 3 0,3/0,7 7,1 13
IIII
BF, EtjO Этилком- 20 2,1 3
14,2ацетат нат27 ная
м и
BFj EtjO Нитроне- 20 1,5 3 0,63/0,1 14,2 тан 27
0,92 ВРз EtjO Трифтор- 7,1 уксусная кислота 19
1,0Conc.HjSQ, Уксусная 604 0,4 3
2,5кислота
27
2,72 1,26 BF, 3,39 Этил- ком- 16 1,44 4
хлораце- нат- тат 15 ная
2,52 BF, 6,78 Этил- хлор- ацетат 30
1 (а): 7-Аьдано-3-С2-(5-метил-1,2,3,4-тетразсшил)метил -й -цефем-4-кар6оновая кислота 2 (Ь): 7-Амино-З- 1-(5-метил-1,2,3,4-тетразолил)метил -а -цефем-4-карбоновая кислота
3 Сырой продукт - смесь (а) и Ь) 4 Сырой продукт - соединение (а)
5 Полученный по реакции сырой продукт подвергали реакции и обрабатывали тем же методом, что описан в примере 1 (А) с образованием бенэгидрилового эфира каждого из веществ (а) и (Ь).
т а в
лица 5
0,95/0,15
7 1,5 30,71/0,05
0,1/0,03
16 1,28 4
2,72 0,75 BF,-EtjO CH,CNком7 ,120натная
СНС1,СООН 8
Conc.HjSO
5
СН,so,Н CF,СООН 9,619
FSOjH 8
CHjCOOH 25
CF, SOjH CHjCOOH 1225
2,8a 0,76 BFj-Et,0 CFjCOOT Комнат- 7 7-Амино-3- 4-(1,2,4-t,77 149
7,1 23 иая тем- -триазолил)мвтил -л -разлопература -цефем-4-1сарбоноваяженне кислота
В качестве исходного соединения использовали 7-амиио 3-ацетохсиметил-4 -цефем-4-карбоновая кислота -1-оксид
Таблице 6
7-A tHHo-3-{;i-(1,2,«- -триазолил)метилJ- -J -цефем-4-карбоно- вая кислота
2,02 -149 разложение
2,0 ( )
0,34 ( )
II11
1,31 ( )
24
1,12 ( )
II 11
1,05 ( )
33
1308198
-карбоновой кислоты
7-амино-3- 1-(1, 2,4-триазолил)метил - д -цефем-4- -карбоновой кислоты
H N-r-f N.
0 -№ СНг-Х J
Дпглт,
COORi
-(fHOCOCH CH СНзО
1775, 1758
1,28 (ЗН,т, I - 7 Гц,,-CHjCH,) J Колонная хрома1 ,58 (ЗН,д, 1 - 6 Гц, СНСН,); тография (Вако
2,02 (2Н,шс, -NH,); 2,51 (ЗН, ---
с, -CHj);3,33 (2Н, мс, С,-Н)|
4,20 (2Н,к, 1 - 7 Гц, -CH,CHj);
А,90 2К,шс, , С,-нТ; 5,6t (2Н, шс, S V. 6,69 - 7,06
Я СН.силикагель C-200 проявляющий pgcT воритель бензол этипацетат 3:1)
(1Н
34 Таблица
149 1790, (с раз- 1610, ложением) 1530
Таблица 8
СНз
тография (Вако
---
силикагель C-200j проявляющий pgcT- воритель бензол; этипацетат 3:1)
. «,
1788, 1,80 (2Н, с, -NH,); 2,42 (1,5Н, 1740с, -СН,); 2,49 t1,5H, с, -СН,)s
3,27 (1Н, с , Cj-H); 3,30 (1Н, с, С,-Н); 4,62-4,95 (2Н, м, , ); 5,30, 5,65 (2Н, АЙк, I
- 17 Гц, S
);
7,37 (0,5Н,
СН,с , - СН); 7,42 (0,5Н, с, СН); 7,54-7,87 (4Н,. м, )
, -NH,); 2,42 (1,5Н, ,49 t1,5H, с, -СН,)s
, Cj-H); 3,30 (1Н, с, -4,95 (2Н, м, , , 5,65 (2Н, АЙк, I
);
7,37 (0,5Н,
СН, 135 1800, -137 1735
разложение
-сносс(снзЬ
СНз о
1251790, 1,18 (ЗН, Т, 1- Гц, -CHjCH,); К этилацетатному
-1301780 2,47 (ЗН, с, -СН,); 3,27 (2Н, раствору добавля -СН,ОСН,СН, рззло- шс, С,-Н)} 3,55 (2Н, к, 1-7 Гц, жение-CH,CH,)j 5,08 - 5,68 (6Н, м,
, с,-н, -сосен,o-,S ,д)
ли щавелевую кис лоту с образова нием оксалата
1071785,
-ПО 1735,
-СНгОССН-Ь Р-ало- I жение
117 -120
. раз-CHiOCiCHiljCH-i ложе- А.ие
1780, 0,87 (ЗН, Т, 1-7 ru,-(CHj),СН,); К этилацетатиому 1750 1,00-1,90 UH, M,-CH,CHjCHjCH,); раствору доСавля- 2,30-2,54 (2Н, M,-CHjCHjCH,CHj)j ли щавелевую кисN
лоту с обраэова-
ли I у 1 j j tayui
2,47 (ЗН, с, VcHj); 3,52 (2Н, нием оксалата
N
- рНОСО{СН2,ЪСНз
СНз о
1780, 0,92 (ЗН, Т, 1-6 Гц, -(CH,),CH,)iКолонная хрома1758 1,12-1,70 (4Н, м,-СН,СНзСНзСН,);гография (Вако
1,60 (ЗН, д, 1-6 Гц, СН-СН,);силикагель С-200,
1,89 (2Н, с, -НИ,); 2,52 ТЗН, с,проявляющий растNворитель , ,); 3,32 (2Н, ис, C,-H)jэол:этилацетатN- 5:1)
Продолжение табл. 8
1,14 (9Н, с, -С(СН,),); 1,47 (ЗН,К этилаиетатиому
д, I 6 Гц, CH-CH,)j 2,44рлствпру побавляNли шявелепую кис (ЗН, с, -СН,); 3,49 (2Н, ос,лоту с обраэоваNнием оксзлята С,-Н); 4,06 (1И, д, Гц, ); 5,06 (1Н, д, I 6 Гц,
С,-Н); 5,50 (2 ft, шс, N );
/СН,6 ,30 (Ш, 8, I - 6 Гц, gbCHj); 7,03 (ЗН, шс, K,N..)
раствору добавля
ли щавелевую кислоту с образова нием оксалата
-осей,), 7,45 (ЗН,
О
3,50 (2Н, шс; с,-И); 1-6 Гц; Cj-H)j 1 бГц : С-,-Н),5,58
(2Н, шс.
), 3,82 (2Н,
J
Л сн,с , -СООСН,0-), 7,66 (ЗН, вс,
Ф H,N-)
0,87 (ЗН, Т, 1-7 ru,-(CHj),СН,); 1,00-1,90 UH, M,-CH,CHjCHjCH,); 2,30-2,54 (2Н, M,-CHjCHjCH,CHj)j N
2,47 (ЗН, с, VcHj); 3,52 (2Н,
N
шс,.С,-Н); 4,96 (1Н, д, 1-6 Гц, Ce-H)j 5,14 (1Н, д, 1-6 Гц, C,-H)j 5,42 (2Н, шс, S j.
леи,-
5,74 (2Н, с, -OCHjO-); 7,66 (ЗН, шс, H,N-)
118 1800, -CH,0(CH,)jCH, -120 1700 разложение
1770, 1,55 (9Н, с, -C(CH,),)j 1,66 (ЗН, 1750 д, I 6 Гц, CH-CH,)t 2,20 (2Н,
N с, -NH,); 2,60 (ЗН, с, -С1Ь
N
3,44 (2Н, юс, Cj-H); 4,98 (1Н, д, I - 5 Гц, CI-H); 5,11 (1Н, д, 1 - 5 Гц, )j 5,80 (2Н, .jJi
7,10 1Н, к, 1 6 Гц, дьсн,)
136
1810,
-СНОСС(
снг
CHj
Ь разло- женне
pOCC(
О) о
-CHOCHg)
1775, 1735
JHOCO-4Hi ШзО
Продолжение тавл. 8
4,14 (2Н.Т,1-6 ru.-CHjCHjCHjCHj); 4,78 (Ш, д, 1-5.Гц, )j 4,91 (1Н, д; I « 5 Гц, ); 5,44, 5,77 (2Н, АВк, I 15 Гц,
); 6,96 (Ш, к, 1-6 Гц,
дн, C№-CHj)
0,87 (ЗН,Т,1-7 Гц,-СНзСН2СН,СНз), К этилацетатному 1,,75 (4H,M,-CHjgijCHjCH3); раствору добавляNли щавелевую кис2 ,48 (ЗН, с, -CHj); 3,52 (2Н, лоту с обрааоваNнием оксалата
шс, C,-H)j 3,64 (2Н, Т, 1-7 Гц, -CH,CH,CH,CHj)} 5,00 (1Н, д, I - - 5 Гц, Ct-H); 5,17 (Ш, д, I 5 Гц, );5,44(2Н,с,-ОСН,0-);
5,64 (2Н, с, S
СМ2 ); 7,83
(ЗН, ПК, -NH,)
-сносоЧО;
CHjO
1782, 1770
Оксалат
ISI-N
.LOI оМ/-сн,-
COOR
3 152
-155
Н20уС1СНзЪ; жеииГ О
1803,. 1,13 (9Н, с, -С(СН,),); 3,39
1750 (2Н, шс, С,-Н)г 4,90 (1Н, д,
1-5 Гц, Cfc-H); 5,10 (2Н, ис,
l ); 5,72 (1Н, д, I - CHj- 5 Гц, С-,-Н); 5,92 (2Н, 8, -OCHiO-), 6,28 (ЗН, шс, HjN-);
ч
7,89 (1Н, с, -Н)
N
1
НОСОСН СНз
снз о
4
146 1778, 1,27 (ЗН, Т, 1-7 Гц, -CH,CHj);
-148 1720 1,57 (ЗН, д, 1-6 Гц, CHQH,); 3,22 (2Н, шс, )j 4,17 (2Н, к, 1-7 Гц, -CHjCH,); 4,70 (1Н, д, Гц, С,-И); 4,86 (1Н, д, 1-5 Гц, Ст-Н); 4,91,5,51 (2Н, АВк, Гц, S , . е. ач «., «5
(1Н, к, 1-6 Гц,- ; СН-СН,); 7,73
N (1Н, с, -Н)
N
2
67-70 1780, 1,32 (ЗН, Т, 1-7 Гц, -CHjCH,); 1760 1,59 (ЗН, д, 1-6 Гц, СН-СН,);
1,86 (2Н, с, -NH,); 3,20 (2Н,
СНзс. С,-И),.4,20 (2Н, к, 1-7 Гц,
-СН,СН,), 4,72 (1Н, д, 1-5 Гц, ), 4,87 (1Н, д, I - 5 Гц, ), 4,99, 5,52 (2Н, АВк, ,( «
5
2
ISI-N
.LOI ,-
Таблица9
К этилацетатному раствору добавляли павелевую кислоту с образованием ок- салата
Колонная хроматография (Вако сили- кагель С-200; проявляющий растворитель , бензол; :этилацетат :1)Колонная хромато:: графия (Вако сили- кагель С-200; про- являпшнй растворитель , бензол;этил- ацетат-3:1)
СН-СН,); .7,75 (1Н,
3
128 1773, 0,90 (ЗН, Т, 1-7 Гц,-(СН,),СН,)jК этилацетатному
-135 1720 1,)5-1,71 (4H,M,-CHjCH,CH,CH,)}раствору добавля1 3,30-3,65 (АН, н, С,-Н,ли щавелевую кис-СНзСН ,СН,СН,)} 4,95-5,40 6Н,лоту для обраэом , -ОСН,0-, , ,вания оксапата
S ). 8,01 (1Н, с,
сн.N
1- Н); 8,84 (ЗН, шс, -NH,) К
3
-CM-O-C-CtCH I,,
I II сн, о
132 1782, 1,17 (9Н, с, -СССН,),); 1,50К этилацетатному
-136 1740 (ЗН, д, Гц, -СИ-);раствору добавляли
щавелевую кислоту
- с образованием
3,49 (2Н, шс, Cj-H); 4,97-5,19оксалата (4Н, м, Cj-H, , Sv ..
i-cH,6 ,70-7,08 (1Н, м, -СН-);
I CHj
N
8,04 (Ш, с, -Н).
N
Оптический изомер
3Оксалат
4Верхний «оппонент
5Нижний компонент
Редактор В.Ковтун
Составитель И. Бочарова
Техред М.ХоданичКорректор А.Зимокосов
Заказ 645/58
Тираж 372Подписное
ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
, м, -СН-)
N
I CHj
-Н).







Реферат
Изобретение касается замещенных :цефем-4-карбоновой кислоты, в частности 7-амнно-З-замещенной метил-д - -цефем-4-карбоновой кислоты (ЗЦК) общей формулы 1 HjN Г1 о N-C I ,СН2 Е.2 C(0)CR где R,H, сложноэфирная запщтная группа; Rj-тетразолил, не- или замещенный бромом, низшим алкилом, метилтиогруп- пой, карбоэтоксигруппой, фенилом, адетамидо-, карбозтокси-метил- или V.ч i Kp iKLiTf iiA аминогруппой; 1,2,4-триазолил, не- или замещенный хлором, низшим алкилом , метилтио-, карбоэтокси- или аце- тамидогруппой; 4 -диано-5-фенил-1,2, 3-триазолил; 4,5-дикарбометокси-1,2, З-триазол-1-ил или 4-дифенилметш1ок- сикарбонил-1,2,3-триазолил, которые присоединены к экзометиленовой группе в 3-м положении дефемового кольца через углерод-азотную связь, или ее кислотно-аддитивных солей. ЗЦК являются промежуточными продуктами в синтезе дефалоспоринов, обладающих антибактериальной активностью. Цель - создание новых веществ указанного класса, обладающих денными фармакологическими свойствами. Получение ЗЦК ведут из соответствующей цефалоспора- новой кислоты (вместо Rj группа Z -ОС(О)СНз) и не- или замещенного 1,2,4-тетразола в среде органического растворителя в присутствии кислоты Льюиса или ее комплекса, или протонной кислоты при температуре от комнатной до 60°С с последующим, в случае необходимости, удалением слож- ноэфирной группы или этерификацией карбоксильной группы и вьщелением ЗЦК в свободном виде или в виде кислотно-аддитивной соли. В качестве каталитических кислот используют Hj SO, метансульфоновую, фторсерную, тря- фторметансульфоновую кислоты или BFj, или его эфираты. В качестве растворителя используют CHjCOOH, CFjCOOH, Clj CUCOOH или их сложные эфиры,или нитрометан, этилхлорацетат или суль- фолан. 9 табл. § СУ) 00 о оо ;о 00 сн

Формула


Комментарии