7-амино-3-замещенный метил- @ -цефем-4-карбоновая кислота в качестве промежуточных продуктов в синтезе 7-ациламидоцефалоспоринов,проявляющих антибактериальные свойства - SU1350166A1
Код документа: SU1350166A1
Описание
1
Изобретение относится к новым химическим соединениям, а именно к 7-амино-З-замещенной метил-л -цефем- -4-карбоновой кислоте общей формулы
H N-p/l
СНгНг COORi
где R, - водород, дифенилметил,
пивалоилоксиметил или пивал оилоксиэ.тил;
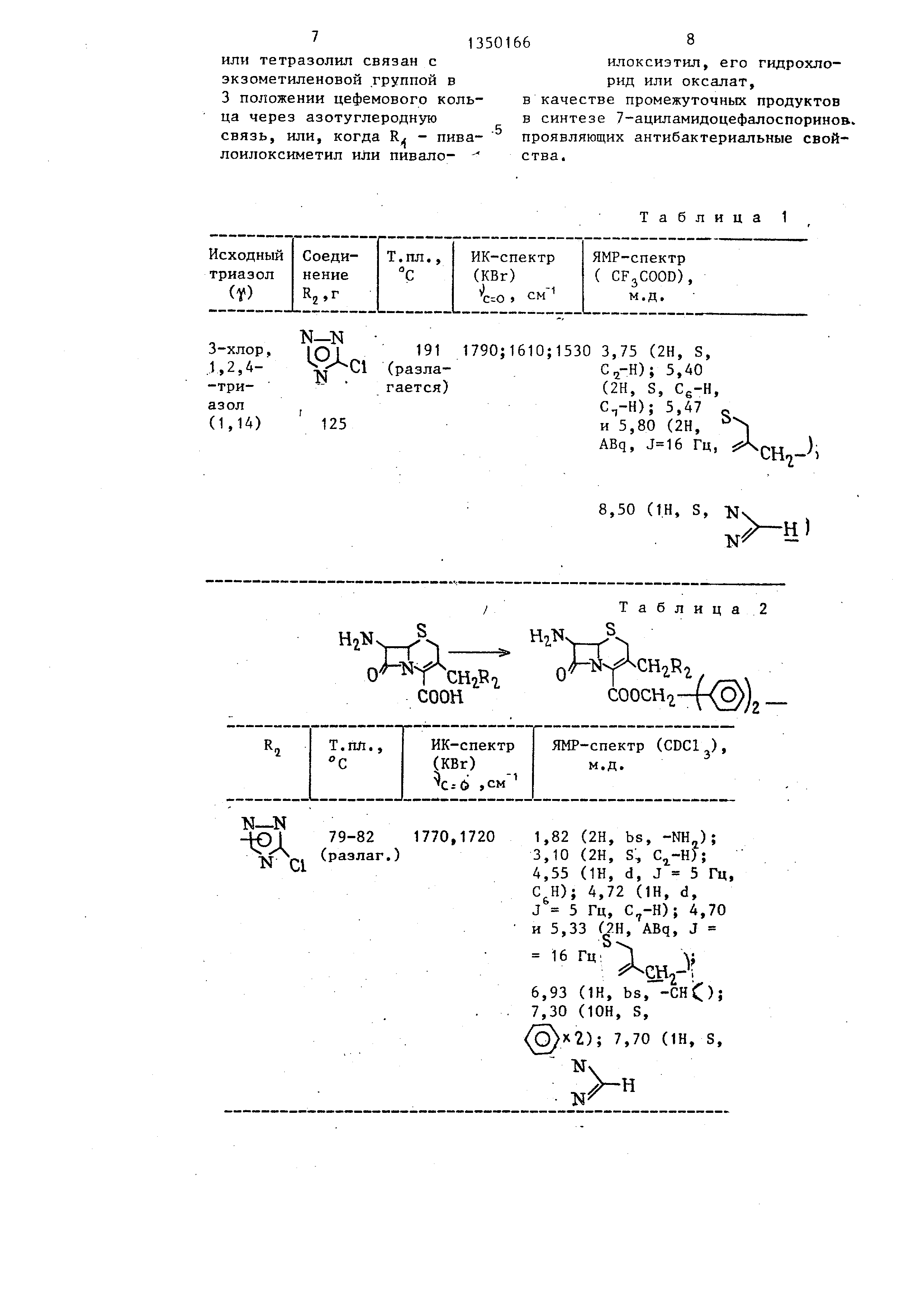
Rj - З-хлор-1,2,4-триазолил или 5-метил-Т,2,3,4-тетразолил, причем указанный триазолил или тетразолил связан с экзометиленовой группой в 3 положении цефемового кольца через азотуглеродную связь, или, когда R, - пивалоилоксиметил или пивало- илоксиэтил, его гидрохлорид или оксалат.
10
15
в качестве промежуточных продуктов в синтезе 7-ациламидоцефалоспоринов, проявляющих антибактериальные свойства .
Цель изобретения - поиск новых це- фалоспориновьпс соединений в качестве промежуточных соединений для синтеза цефалоспоринов, обладающих широким антибактериальным спектром при низкой токсичности.
Пример 1.А. В13мл сульфо- лана суспендируют 2,72 г 7-аминоцефа- лоспориновой кислоты (определена как 7-АСА) и к полученной суспензии добавляют 14,2 комплекса трифторида бора и серного эфира и 1,0 г 5-метил- -1,2,3,4-тетразола, после чего реакционную смесь подвергают взаимодействию при комнатной температуре в течение 17 ч. После завершения реакции реакционную смесь вьшиваюФ в 15 мл .ледяной воды. рН смеси доводят до 3,5 добавлением 28%-ного водного аммиака при охлаждении льдом. Выпавшие в осадок кристаллы собирают на фильтре , последовательно промьшают 5 мл воды и 5 мл ацетона и затем сушат, получая 1,76 г смеси 7-амино-3- 2- -(5-ме,тил-1,2,3,4-тетразолил)метил1- - 4-цефем-4-карбоновой кислоты и 7-амино-3-11-(5-метш1-1,2,3,4-тетра- золил)-метилу-& -цефем-4-карбоковой кислоты в виде кристаллов.
Б. В 18 мл метанола суспендируют 1,76 г кристгшлов, полученных на стадии Лик суспензии добавляют 1,13 г
1350166 . 2
моногидрата п-толуоксульфокислоты, . получая раствор, после чего туда же медленно добавляют 4,6 г .дифенилди- азометана. Проводят реакцию при комнатной температуре в течение 15 мин. После завершения реакции растворитель удаляют перегонкой при пониженном давлении. Полученный остаток растворяют в смешанном растворителе из - 30 мл зтилацетата и 30 мл воды и рН полученного раствора доводят до В добавлением бикарбоната натрия. Затем органический слой отделяют и сушат над безводным сульфатом натрия, растворитель отгоняют при пониженном давлении . Полученный остаток подвергают очистке на хроматографической колонке (силикагель G - 200 Вако; проявляющий растворитель бензол-этилацетат 4:1 по объему), получая 0,79 г дифе- нилметилового эфира 7-амино-3- 2-(5- -метил-1,2,3,4-тетразолил)-метил - -Л -цефем-4-карбоновой кислоты (т.пл. 157-160 С с разложением) и 0,14 г ди- фенилметилового эфира 7-амино-3- 1- -(5-метил-1,2,3,4-тетразолил)-метил - -6 -цефем-4-карбоновой кислоты (т.пл. 92°С с разложением).
Для дифенилметилового эфира 7-ами- но-3- 2-(5-метил-1,2,3,4 тетразолш1)- -метил -л-цефем-4-карбоновой кислоты:
ИК-спектр (КВг) -0 см 1720.
20
25
30
1770;
35
ЯМР-спектр (CDC1J, м.д.: 1,75
СНр;
40
(2Н, шс, - NH,); 2,48 (ЗН, с, 3,20 (2Н, с, Cj-H)} 4,70 (1Н, д J 5 Гц, Се-Н); 4,37 (1Н, д, J 5 Гц, ); 5,30 и 5,72 (2Н, ABq,
J 16 Гц,
45
); 6,92 (1Н, с,
ШгСН ); 7,30 (ЮН, с, 2(рН).
Для дифенилметилового эфира 7-ами- но-3- 1-(5-метил-1,2,3,4-тетразолил)- -метил -А -цефем-4-карбоновой кислоты:
ИК-спектр (KBr)V „ см
50
1725.
-1
, .1770, 1,80
ЯМР-спектр (CDC1 ), м.д.: (2Н, с, -NH ); 2,15 (ЗН, с, - СН ); 3,30 (2Н, с, ); 4,70 (1Н, д, J 5 Гц, Се-Н); 4,85 (1Н, д, J 5 Гц, С,-Н); .5,00 и 5,38 (2Н, ABq, 55 S
J 16 Гц,
СН ); 7,30 (ЮН, с.
); 6,90 (1Н, с, 2).
1770;
ЯМР-спектр (CDC1J, м.д.: 1,75
СНр;
0
(2Н, шс, - NH,); 2,48 (ЗН, с, 3,20 (2Н, с, Cj-H)} 4,70 (1Н, д J 5 Гц, Се-Н); 4,37 (1Н, д, J 5 Гц, ); 5,30 и 5,72 (2Н, ABq,
J 16 Гц,
5
); 6,92 (1Н, с,
ШгСН ); 7,30 (ЮН, с, 2(рН).
Для дифенилметилового эфира 7-ами- но-3- 1-(5-метил-1,2,3,4-тетразолил)- -метил -А -цефем-4-карбоновой кислоты:
ИК-спектр (KBr)V „ см
0
1725.
-1
, .1770, 1,80
ЯМР-спектр (CDC1 ), м.д.: (2Н, с, -NH ); 2,15 (ЗН, с, - СН ); 3,30 (2Н, с, ); 4,70 (1Н, д, J 5 Гц, Се-Н); 4,85 (1Н, д, J 5 Гц, С,-Н); .5,00 и 5,38 (2Н, ABq, 5 S
J 16 Гц,
СН ); 7,30 (ЮН, с.
); 6,90 (1Н, с, 2).
в. в смешанном растворителе из 0,5 мл анизола и 5 мл трифторуксус- ной кислоты растворяют 0,462 г ди- фенилметилового эфира 7-амино-3- 2- -(5-метш1-1,2,3,4-тетразолил)-метил3- -Д-цефем-4-карбоновой кислоты и полученньм раствор подвергают взаимодействию при комнатной температуре в течение 1 ч. После завершения реакции растворитель отгоняют в вакууме и к полученному остатку добавляют 10 мл воды и 10 мл этилацетата, рН смеси доводят до 8 добавлением 28%-ного водного аммиака при охлаждении льдом. Затем водный слой отделяют и рН доводят до 3,5 добавлением нормальной соляной кислоты при охлаждении льдом. Выпавшие в осадок кристаллы отфильтровывают, последовательно промьшают 5 мл воды и 5 мл ацетона и затем сушат. Было получено 0,26 г 7-амино-3- 2-(5 метил- -1,2,3,4-тетразолил)-метил -л-цефем- -4-кар&оновой кислоты, т.пл. 178°С (с разложением).
триазолил присоединен к экзометил вой группе в положении 3 цефемог кольца через связь углерод - азот но не известно, какие из атомов а 1,2,4-триазолильной группы присое динены к экз.ометиленовой группе в положении 3 цефемового ядра. Кроме
10
с-о
см
ИК-спектр (КВг) 1610; 1530.
ЯМР-спектр. (), м.д
;/
ТОГО, положение заместителя в 1,2 -триазолильной группе определяется указанием положения заместителя в используемом соединении. Соединени в которых 3-ацет, З-хлор-1,2,4-три азол присоединены к экзометиленово
15 группе в положении 3 цефемового яд имену отся ... -3- Г (3-хлор-1,2,4-тр азолил)-метил....
П D и м е р 3. Используя метод - ку примера 1, изменяя условия реак ции, получают результаты, приведен в табл.3 (q - 7-амино-3- 2-(5- -метил-1,2,3,4-тетразолил)-метил - - Л-цефем-4-карбоновая кислота; Ь - 7-амино-3- 1-(5-метил-1,2,3,425 -тетразолил)-метил - л -цефем-4-кар новая кислота).
20
1790; 2,70
(ЗН, с, - СН,); 3,73 (2Н, с, С ,-Н8);
Пример 4. В 20 мл Н,Ы-дим тилформамида суспендируют 2,96 г 30 7-амино-3- 2-(5-метш1-1,2,3,4-тетр золил) -метил -л -цефем-4-карбоново кислоты. Затем суспензию превращаю в раствор путем добавления 1j1 г триэтиламина при охлаждении льдом,
5,40 (2Н, c, Cg-H, С,-Н); 5,80 и 6,12 (2Н, ABq, J 16 Гц, ).
Повторяя описанную методику, из
0,462 г дифенилметилового зфира
7-амино-3-(1-(5-метш1-1,2,3,4-тетра- 35 раствору добавляют 2,7 г йодистого
золил)-метил -л -цефем-4-карбоновой
кислоты получают 0,25 г 7-амино-З- 1- (5-метил-1,2,3,4-тетразолил)-метил - л-цефем-4-карбоновой киспивалоилоксиметила и полученную сме подвергают взаимодействию при в течение 1 ч. После завершения реа ции реакционную смесь вводят в раст
лоты, т.пл. 195 С (с разложением), ИК-спектр (КВг) 1795;
1615; 1530.
ЯМР-спектр (CFjCOOD), м.д.: 2,95
i(3H, с, - СН ); 3,90 (2Н, шс, С,-Н);
5,45 (2Н, с, С -Н, С -Н), 5,67 и
5,92 (2Н, ABq, Sx, ).
X
снгПример 2. Используя указанные триазолы, реакцию и обработку
40 воритель из 250 мл вода И 200 мл этилацетата и рН смеси доводят до 7,0 бикарбонатом натрия. После удаления нерастворимого вещества органический слой отделяют и сушат над
45 безводным сульфатом магния при. пони- женном давлении. После промьшки осадка серным эфиром остаток растворяют в 30 мл зтилацетата и раствор 1 г сухого хлористого водорода в
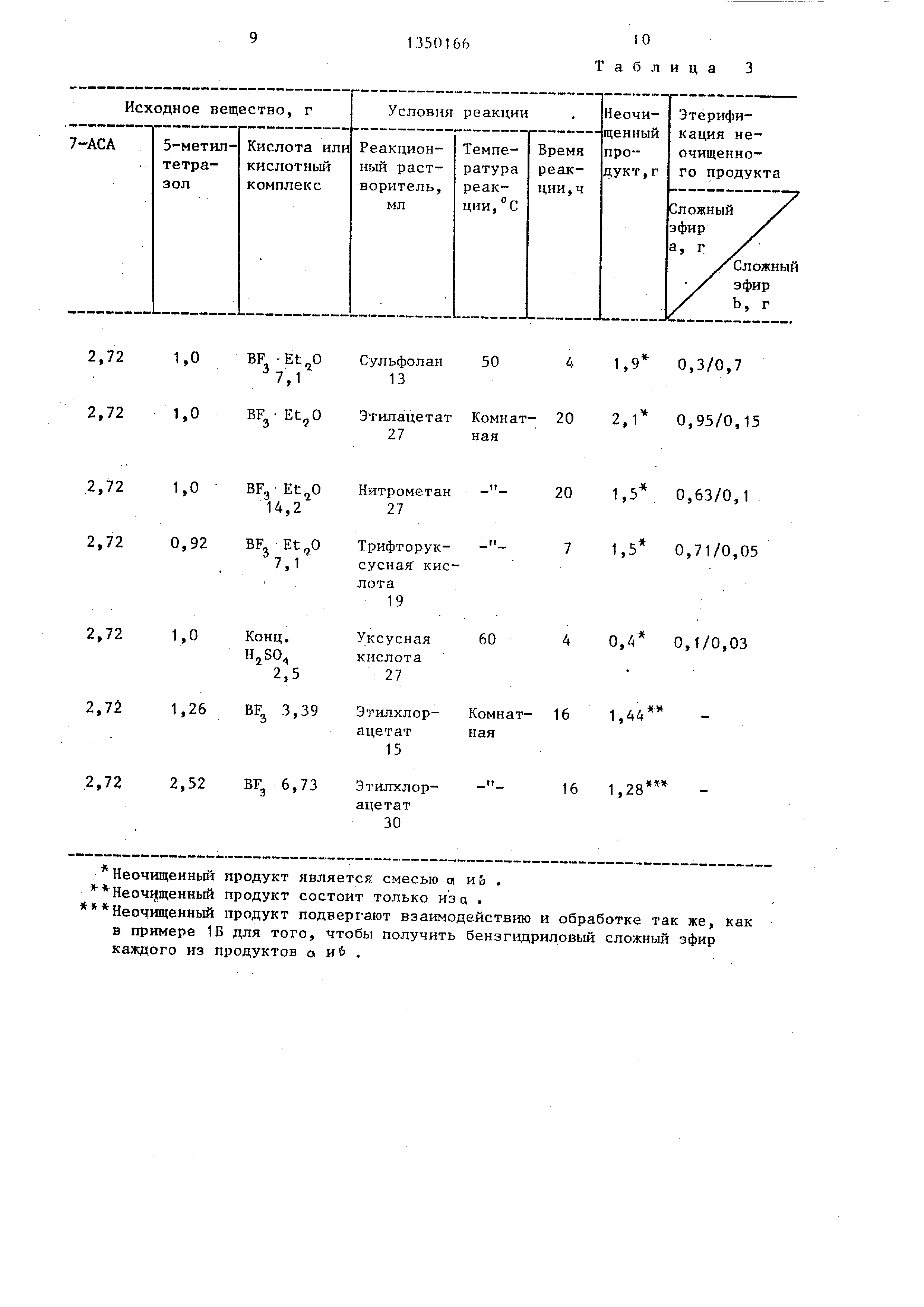
проводят в соответствии с примером lAg 50 серного зфира добавляют к полуполучая соединения, указанные в табл.1. КарбоНовые кислоты этерифи- цируют способом, аналогичным описанному в примере 1Б, получая соединения , указанные в табл.2 (2,72 г 7-АСА используют в качестве исходного материала).
Положение связи 1,2,4-триазолил не определяется, поскольку 1,2,4
)66
триазолил присоединен к экзометилено- вой группе в положении 3 цефемого кольца через связь углерод - азот, но не известно, какие из атомов азота 1,2,4-триазолильной группы присоединены к экз.ометиленовой группе в положении 3 цефемового ядра. Кроме
ТОГО, положение заместителя в 1,2,4- -триазолильной группе определяется указанием положения заместителя в используемом соединении. Соединения, в которых 3-ацет, З-хлор-1,2,4-три- азол присоединены к экзометиленовой
группе в положении 3 цефемового ядра, имену отся ... -3- Г (3-хлор-1,2,4-трн- азолил)-метил....
П D и м е р 3. Используя методи- ку примера 1, изменяя условия реакции , получают результаты, приведенные в табл.3 (q - 7-амино-3- 2-(5- -метил-1,2,3,4-тетразолил)-метил - - Л-цефем-4-карбоновая кислота; Ь - 7-амино-3- 1-(5-метил-1,2,3,4-тетразолил )-метил - л -цефем-4-карбо- новая кислота).
Пример 4. В 20 мл Н,Ы-диме- тилформамида суспендируют 2,96 г 30 7-амино-3- 2-(5-метш1-1,2,3,4-тетразолил ) -метил -л -цефем-4-карбоновоЙ кислоты. Затем суспензию превращают в раствор путем добавления 1j1 г триэтиламина при охлаждении льдом, к
пивалоилоксиметила и полученную смесь подвергают взаимодействию при в течение 1 ч. После завершения реакции реакционную смесь вводят в раст40 воритель из 250 мл вода И 200 мл этилацетата и рН смеси доводят до 7,0 бикарбонатом натрия. После удаления нерастворимого вещества органический слой отделяют и сушат над
45 безводным сульфатом магния при. пони- женном давлении. После промьшки осадка серным эфиром остаток растворяют в 30 мл зтилацетата и раствор 1 г сухого хлористого водорода в
ченному раствору при охлаждении льдом и перемешивании. Выпавшие кристаллы собирают фильтрованием, тщательно промывают серным эфиром и за- тем перекристаллизовывают их хлороформом , получая 2,72 г (выход 60,9%) хлористоводородного пивалоилоксимети . лрвого эфира 7-амино-3-Г2-(5-метил- -1.2.3.4-тетразолш1)-метил1-й -цефем-г
-4-карбоновой кислоты, т.пл. 149- 151°С (с разложением).
ИК-спектр (КВг) v) сьГ 1: 1773; 1741; 1730,.
ЯМР-спектр (dg- DMCO), м.д.: 1,18 (9Н, с, С(СН ) ); 2,44 (ЗН, с, - СНд); 3,60 (2Н, с, Cj-H); 5,23 (2H,j с, Cg-H, ); 5,62 (2Н, с,
XCH J 5,78-5,92 (2Н, м,
- сосен о-).
Полученное соединение суспендируют в воде и подвергают обработке гидрокарбонатом натрия, чтобы получить следующее соединение: пивало- илметил-7-амино-3 2-(5-метнл-1,2, 3,4-тетразолил)-метил -л -цефем-4- -карбоксилат.
ИК-спектр. (КВг) ) , см
1780; 1750.
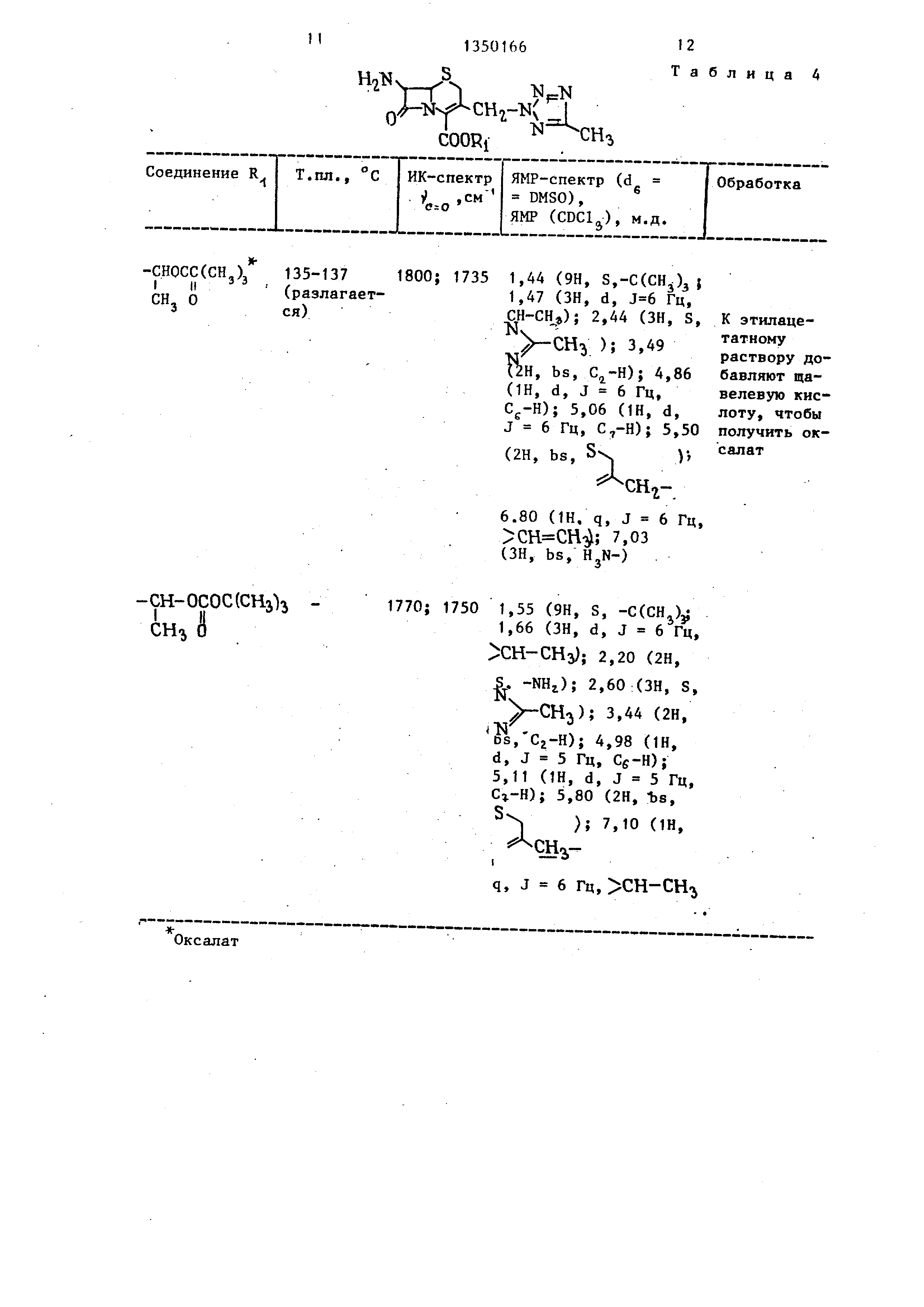
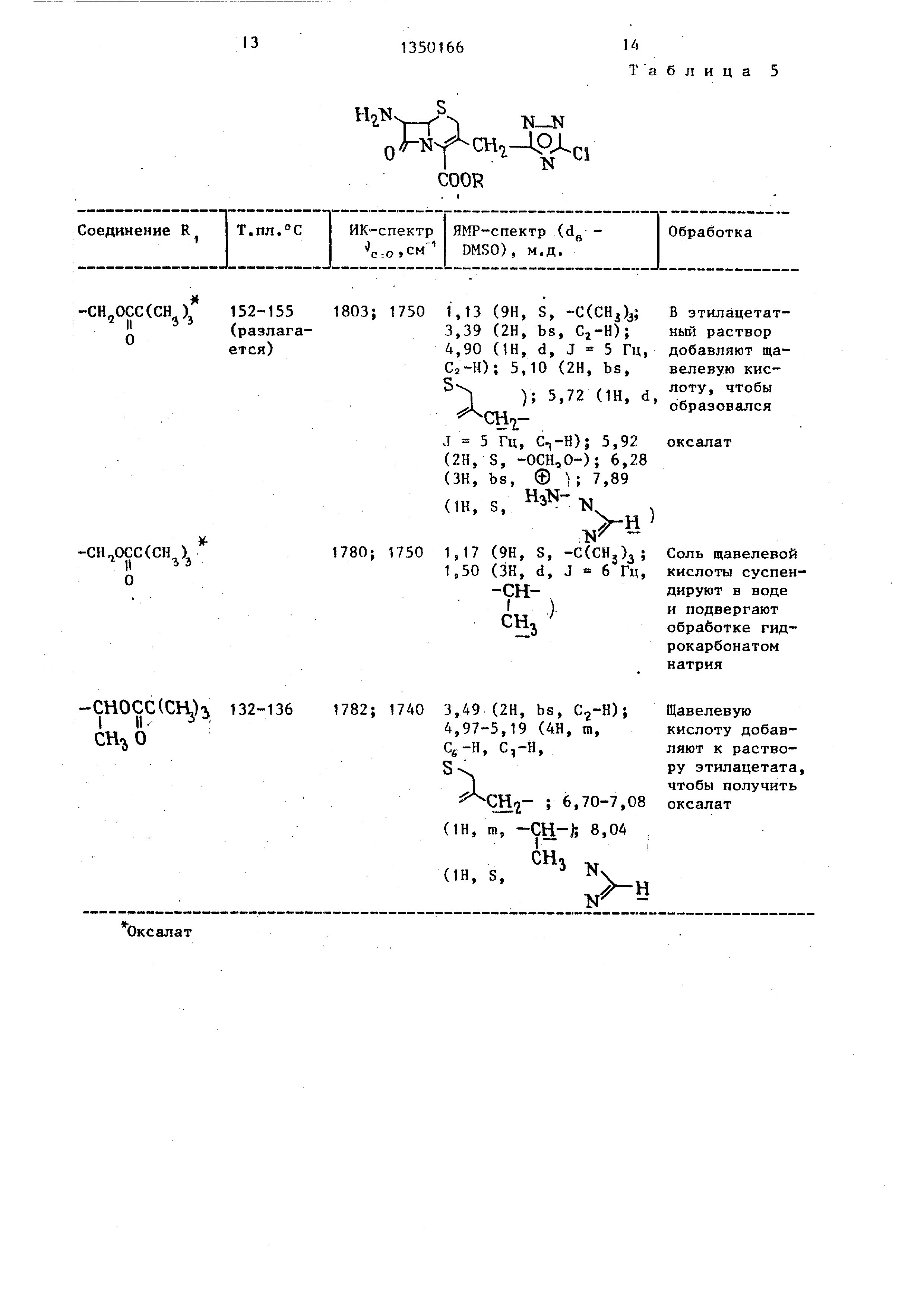
Используя различные соединения в качестве исходных и осуществляя реакцию в соответствии с описанной вьше методикой получают соединения, перечисленные в табл.4 и 5.
Испытания фармакологического действия типичных цефалоспоринов, полученных из промежуточных соединений указанной общей формулы.
Антибактериальная активность (табл.6).
В соответствии со стандартным способом культуру, полученную культивированием бактерий в бульоне вытяжки сердца (производимом Эйкен Кагакуши) при в течение 20.ч, высевали в агар вытяжки сердца (производимый Эйкен Кагакуши) и культивировали при 37°С в течение 20 ч, после .чего рост бактерий проверяли визуально. Минимальная ингибирующая концентрация, при кото.рой подавлялся рост бактерий, обозначалась как МИК (мкг/мл). Количество инокулирозан- ных бактерий 10 клеток/пластина (10 клеток/мл).
Испытуемые соединения:
А - (2-амино-тиазол-4-ил)- -2-(син)-метоксииминоацетамидо -3- (5-метил-1,2,3,4-тетразолил)- -метил -л-цефем-4-карбоновая кислота;
В - 7-12-(2-аминотиазол -4-ил)- -2-(син)-метоксииминоацета. - (З-хлор-1,2,4-триазолш1)-метил - -й -цефем-4-кареюновая кислота.
Положение связи 1,2,4-триазолш1 не определяется, поскольку 1,2,4
20
350166 . .
-триазолил присоединен к экзомети- леновой группе в положении 3 цефе- мового кольца через связь углерод - азот, но не известно какие из атомов азота 1,2,4-триазолильной группы присоединены к зкзометиленовой группе в положении 3 цефемового ядра. Кроме того, положение заместителя в 10 1,2,4-триазолильной группе определяется указанием положения заместителя в используемом соединении. Соединения , в которых 3-ацет, З-хлор-1, 2,4-триазол присоединены к экзомети- .с леновой группе в положении 3 цефемового ядра, именуются ,, -3-t(3-хлор- -1,2,4-триазолил)-метил -,.,.
Эксперимент с пероральным введением .
Каждое испытуемое соединение вводили через рот мьшзамг (ICR, мужские особи, 4 недельные) при дозировке 2 мг на особь и определяли выделение соединения с мочой. Результаты пред- 25 ставлены в табл, 7. После всасывания живым организмом все испытуемые соединения легко отщепляли эфирную группу , давая соответствующие свободные карбоновые кислоты. Следовательно, количественно определяли свободные карбоновые кислоты, поступающие в мочу , и, брали как извлечение из мочи.
Способ введения: испытуемое соединение суспензировали в 0,5% CMC растворе и затем вводили перорально. Количественный анализ проводили методом бумажного диска с испытуемыми бактериями, перечисленными в табл,7,
Испытание на острую токсичность.
Для определения острой токсичности испытуемью соединения вводили внутривенно - мьппам вида ICR (мужские особи, возраст 4 над.) и орально крысам SDK (возраст 6 нед,).
Результаты сведены в табл,8.
30
40
45
Формула изобретения
3
7-Амино-З-замещенный метил-U- -цефем-4-карбоновая кислота общей
50 формулы-м J
Ji N-r-/
cooRi
где R - водород, дифеНилметил, пива- 55 лоилоксиметил или пивалоилоксиэтил;
R - З-хлор-1,2,4-триазолШ1 или 5-метил-1,2,3,4-тетразолил, причем указанный триазолил
713501668
или тетразолил связан силоксиэтил, его гидрохлоэкзометиленовой группой врид или оксалат,
3 положении цефемового коль-в качестве промежуточных продуктов
ца через азотуглероднуюв синтезе 7-ациламидоцефалоспоринов..
связь, или, когда R. - пива- проявляющих антибактериальные свойлоилоксиметил или пивало- - ства.
,
N-N
IPJL 1790;1610;1530 3,75 (2Н, S,
(разлаБ
125
гается)
); 3,40 (2Н, S, Сб-Н ); 5,47 и 5,80 (2Н, ABq, Гц
Таблица 1
3,75 (2Н, S,
); 3,40 (2Н, S, Сб-Н, ); 5,47 „ и 5,80 (2Н, ABq, Гц,
,50 (1Н, S, К
Таблица 2
Hi NsJ v
соои
H,N.S
соосн





Реферат
Изобретение касается замещенных кислот цефемового ряда, в частности соединений общей формулы 0 П -TSf-CK.Ci4 где К - C(0) М - CH, R, - во- дород; дифенилметил, пивалоилокси- метил (или этил); R,., - З-хлор-1,2,4- -триазолил или 5-метил-1,2,3,4-тетра- золил, которые связаны с зкзометиле- новой группой в положении 3 цефемового кольца через азотуглеродную связь, или, когда R, - пивалоилокси- метил (или этил), его гидрохлорида или оксалата, - промежуточных продуктов в синтезе 7-ациламидоцефало- споринов, проявляющих антибактери- : альные свойства. Цель - получение новых промежуточных веществ для синтеза цефалоспоринов, обладающих широким антибактериальным спектром действия при низкой токсичности. Синтез новых веществ ведут, например , из 4-аминоцефалоспориновой кислоты и комплекса BFg , серного эфира и 5-метил-1,2,3,4-тетразола. Испытания полученньк из указанных промежуточных веществ цефалоспоринов показывают их антибактериальную активность в отношении широкого спектра бактерий при минимальной йнгибирую- щей концентрации 2 мг на одну особь (мьщ1ь). После всасьгеания испытуемый цефалоспорин легко отщепляет эфирную группу, давая свободные кислоты, которые с.мочой удаляются из организма . 8 табд. (Л 00 ел 65 Ot

Формула


Комментарии