Диастереомеры соединения цефема и их физиологически приемлемые соли, диастереомерно чистые соли соединения цефема и способ их получения - RU2075480C1
Код документа: RU2075480C1
Чертежи

Описание
Настоящее изобретение относится к новым соединениям, а именно диастереоизомерам
1-(изопропоксикарбонилокси)-этилового эфира-(6R, 7R)-7-[2-(2-аминотиазол-4-ил)-2-(Z)-метоксиимино)-ацетамидо-(-3- (метоксиметил)-3-цефем-4-карбоновой кислоты, способным всасываться кишечным трактом и
имеющим общую формулу I
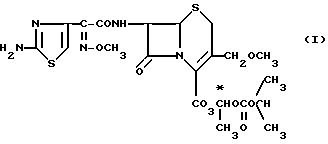
и их физиологически приемлемым солям.
Известны (патент США N 4486425) (эфиры (6R, 7R)-7- [2-(2-аминотиазол-4-ил)-2-(Z)-(метоксиимино)ацетамидо]-3- (-метоксиметил)-3-цефем-4-карбоновой кислоты. Особый интерес из них представляет эфир формулы I, поскольку он хорошо всасывается кишечным трактом различных видов животных и человека и после ресорбции снова быстро и полностью расщепляется ферментами организма с образованием обладающего антибиотической активностью цефалосфорина со свободными карбоксильными группами. Это соединение известно под названием цефподоксим проксетил (Drugs of the Future 14, 73, 1989).
Эфир формулы I содержит два асимметричных атома углерода с (R)-конфигурацией в 6- и 7-положениях цефемового каркаса, а также асимметричный атом углерода в 1-положении этилоксиэфирной группы -O-CH-(CH3)-O-. Указанные соединения (патент США N 4486425) получены в виде смесей диастереомеров относительно асимметричного атома углерода 1-этилоксиэфирной группы -O-CH-(CH3)-O-. Аналогичные смеси диастереомеров имеют место и в случае, например, цефотиам-гексила (Drugs of the Future 13, 230, 1988), цефуроксим-аксетила (Drugs of the Future 10, 112, 1985), бакцефузонама (N.A. Kuck и др. Proc 14-ый Int. Congr. Chemother. 2, 1137, 1985) и BMY28271 (The Jornal of Antibiotics 43, 1564, 1990).
Известно, что конфигурация находящейся в 1-положении этилэфирной группы -O-CH(CH3)-O- не оказывает влияния на количество всасываемого кишечным трактом соединения. В частности, это экспериментально показано на примере диастереомеров цефотиам-гексетила (T. Nighimura и др. The Jornal of Antibiotics 40, 81-90, 1987).
В случае цефотиам-гексетила оба стереоизомера разделяют хроматографически. Такой способ, однако, связан с большими потерями и не всегда применим, поскольку оба диастереомера, например, в случае цефподоксим проксетила, слишком близки по своим физическим свойствам, чтобы их можно было разделить с помощью хроматографии. Кроме того, оба стереоизомера или их смесь в условиях хроматографического разделения на колонке могут разлагаться.
Поэтому индивидуальные диастереоизомеры цефподоксим проксетила до сих пор не описаны. Отсутствуют и препаративные способы, с помощью которых можно направленно получать отдельные диастереоизомеры пролекарства класса цефалоспориновых эфиров, являющихся, как, например, цефподоксим проксетил, производными 1-этилоксиэфирного остатка -O-CH(CH3)-O-.
Поэтому совершенно неожиданным оказалось, что индивидуальные диастереоизомеры формулы I явно различаются по своей способности всасываться кишечным трактом, и, таким образом, лучше всасывающиеся диастереоизомеры обладают более высокой биологической активностью, чем цефподоксим проксетил, представляющий собой смесь диастереоизомеров.
Целью настоящего изобретения является получение диастереомерно чистых 1-(изопроксикарбонилокси)-тиловых эфиров (6R, 7R)-7- [2-(2-аминотиазол-4-ил)-2-(Z)-метокси-имино)-ацетамидо-(3-(метоксимет- ил) -3-цефем-4-карбоновой кислоты, обладающих более высокой биологической активностью.
Поставленная цель достигается диастереомерно чистыми соединениями формулы I, у которых группаN-OCH3 находится в син-положении. Предпочтительным является более полярный из двух диастереоизомеров, обладающий более высокой биологической активностью.
Предметом настоящего изобретения являются также диастереомерно чистые соли общей формулы II

в которых HX означает одно- или многоосновную кислоту, а Х - неорганический или органический физиологически приемлемый анион.
В значении неорганической кислоты НХ может представлять, например, стехиометрические количества HCl, HBr, HJ, HBF4, HNO3, HClO4, H2SO4 или H3PO4. В качестве органических кислот РХ означает алифатические или ароматические кислоты. Наиболее предпочтительными являются неорганические кислоты HCl, HBr и H2SO4, а также органические кислоты, метансульфо-, этансульфо-, бензолсульфо-, п-толуолсульфо- и 4-этилбензолсульфокислоты.
Предметом настоящего изобретения является также способ
получения диастереомерно чистых соединений формулы I и их солей формулы II, отличающийся тем, что получают промежуточное соединение формулы III
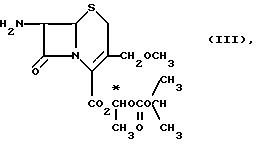
переводят в соответствующие соли формулы IV

добавкой раствора 0,2 2 эквивалентов одно- или многоосновной кислотой HY, где Y органический или неорганический анион, с последующим получением чистых диастереоизомеров формулы IV фракционной кристаллизацией с последовательным осаждением диастереоизомера с меньшей растворимостью и затем диастереоизомера с большей растворимостью, переводом полученных чистых диастереоизомеров формулы IV в чистые диастереоизомеры формулы III с последующим их превращением в чистые диастереоизомеры формулы I взаимодействием с соединением общей формулы V
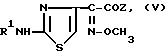
где R1 означает атом водорода или аминозащищающую группу, например формил, трет. -бутоксикарбонил, хлорацетил, феноксиацетил, фенилацетил, аллилоксикарбонил, бензилоксикарбонил и 4-нитробензилоксикарбонил, а
Z означает удаляемую группу, обычную в химии бета-лактамов активирующую группу, например n-толуолсульфонил, I-бензотриазол-илокси- или меркаптобензотиазолильную группы.
В качестве неорганической кислоты HY означает, например, HCl, HBr, HI, HF, HNO3, HClO4, HSCN, H2SO4 или H3PO4. В качестве органической кислоты HY означает алифатические или ароматические сульфокислоты, карбоновые или фосфоновые кислоты. Так, например, можно использовать следующие органические кислоты: бензолсульфо-, п-толуолсульфо-, 4-этилбензолсульфо-, 4-хлор-бензолсульфо-, 4-бромбензолсульфо-, 2-мезитиленсульфо, 4-бифенилсульфо-, нафталин-1,5-дисульфо-, метансульфо-, этансульфо-, додецилсульфо-, камфарасульфо-кислоты и щавелевую кислоту.
Предпочтительными кислотами являются HCl, HBr бензолсульфокислота, п-толуолсульфокислота, 4-этилбензолсульфокислота и 4-бифенилсульфокислота.
В качестве органического растворителя можно использовать, например, простые и сложные эфиры, спирты, кетоны, нитрилы, хлорированные углеводороды, углеводороды, а также их смеси.
Предпочтительными растворителями являются, например, бензол, толуол, этилацетат, бутилацетат, метанол, этанол, н-пропанол, изопропанол, третбутанол, диизопропиловый эфир, ацетон, ацетонитрил и дихлорметан и их смеси.
В качестве растворителя в случае неорганических кислот можно, кроме того, использовать воду, если она смешивается с органическими растворителями. Растворы HCl и HBr в органических растворителях могут быть получены, например, путем пропускания через них газообразного хлористого или бромистого водорода. Растворы HCl и HBr в органических растворителях могут быть также получены из ацетилгалогенидов, галогенидов фосфора и оксигалогенидов фосфора и спирта (галоген Cl, Br).
Добавление кислого компонента осуществляют при температуре примерно -10oC+50, предпочтительно при +10oC+30oC. В зависимости от природы кислого компонента и растворителя смесь перемешивают для полноты осаждения в течение до примерно еще 10 часов. В отдельных случаях для полноты осаждения смесь следует охлаждать до температуры от комнатной до примерно -78oC.
Соединения настоящего изобретения обладают способностью всасываться кишечным трактом, положительный эффект которого заключается в повышенной резорбции кишечным трактом более полярного диастереоизомера формулы I, что иллюстрируется таблицей 1.
В таблице 1 приведены количества обнаруженной через 0 24 часа (6R, 7R)-7-2-(2-аминотиазол-4-ил)-2- (Z)-(метоксиимино)-ацетамидо-3-(метоксиметил)-3-цефем-4-карбоновой кислоты в моче собак после орального введения диастереиозомерного пролекарства (доза: 10 мг/кг в расчете на биологически активное вещество).
Таблица 2 показывает при испытаниях на животных значительно лучшую степень всасывания диастереомера В, чем смесь диастереомеров А+В и диастереомер А.
В соответствии с настоящим изобретением соединения общей формулы I вводятся орально в виде обычных фармацевтических препаратов, например капсул, таблеток, порошков, сиропов или суспензий.
Величина дозы зависит от возраста, симптомов и веса пациентов, а также продолжительности курса лечения. Как правило, однако, она находятся в пределах от примерно 0,2 до примерно 5, предпочтительно от примерно 0,5 до примерно 3 г в день. Предпочтительно вводить соединения в виде частичных доз, например 2 4 раза в день, причем такая отдельная частичная доза может содержать 50 500 мг активного вещества.
Оральные препараты могут содержать обычные носители и/или разбавители. Так, например, в случае капсул или таблеток могут использоваться связующие, например желатин, сорбитол, поливинилпирролидон или карбоксиметилцеллюлоза, разбавители, например лактоза, сахароза, крахмалы, фосфат кальция или полиэтиленгликоль, скользящие добавки, например тальк или стеарат натрия. В случае жидких препаратов, например водных или масляных суспензий, подходящими являются сиропы или другие аналогичные формы.
Более подробно изобретение поясняется нижеследующими примерами получения диастереомерно чистых соединений формул I и II, которыми, однако, не ограничивается объем его защиты.
Экспериментальная часть.
Пример 1.
n-Толуолсульфонат 1-(изопропоксикарбонилокси) этилового эфира (6R, 7R)-7-амино-3-метилоксиметил-3-цефем-4-карбоновой кислоты (смесь
диастереоизомеров)
1,22 г (5 ммолей) (6R, 7R)-7-амино-3-метоксиметил-3-цефем-4-карбоновой кислоты суспендируют в атмосфере аргона в 15 мл дихлорметана и путем добавления 0,75 мл (5 ммолей)
DBU* переводят ее в раствор. К полученному раствору добавляют при 0oC 1,43 г (5,5 ммоля) 1-иод-этокси(изопропоксикарбонилового эфира) (The Journal of Antibiotics, 40, 370, 1987),
перемешивают смесь в течение еще 40 минут при 0oC и 30 минут при 20oC и разбавляют ее для дальнейшей переработки 50 мл этилацетата. Промывали ее насыщенным водным раствором
NaHCO3 и NaCl, высушивают MgSO4 и упаривают органическую фазу в вакууме.
Сырой продукт растворяют в 5 мл этилацетата и добавляют к полученному раствору при 20oC раствор 1,0 г (5,3 ммоля) и моногидрата п-толуолсульфокислоты в 5 мл этилацетата. Затем добавляют еще 10 мл диизопропилового эфира, охлаждают смесь до 0oC и отсасывают выпадающий в осадок продукт.
Выход: 1,93 г (71% от теоретич. выхода).
1H-ЯМР (DMCO-d6, 270 МГц): d 1,25 (м. 6H, C(CH3)2);
1,50
(д. 3H, CH-CH3), 2,30 (с. 3H, арил-CH3),
3,23 (с. 3H, CH2OCH3), 3,70 (2H, м, -CH2),
4,21 (м. CH2OCH3), 4,
81 (м. 1H, O-CH(CH3)2,
5,25 (м. 2H, H-6 и H-7), 6,81 и 6,85 (2хкв, 1H,
O-CH(CH3)-O), 7,11 и 7,48 (2хкв, 4H, арил-H),
9,05 (шир. с. 2H,
NH2).
Тонкослойная хроматография(толуол)этилацетат 1+1/, Rf 0,34 (диастереоизомер A) (и 0,26/диастереоизомер B).
Высокопроизводительная жидкостная хроматография, C18 нуклеозил 7 мкм, вода (+ 0,1% NH4OAc) + (метанол-вода 80:20) + (0,1% NH4OAc) (45:55,1 мл/мин 10,8 мин/диастереоизомер A), 9,1 мин (диастереоизомер B).
Пример 2.
1-Изопропоксикарбонилоксиэтиловый эфир (6R, 7R)-7-амино-3-метоксиметил-цефем-4-карбоновой кислоты (смесь диастереизомеров).
2,53 г (4,6 ммоля) смеси диастереоизомеров в соответствии с примером 1 растворяют в смеси этилацетата и 5%-ного водного раствора NaHCO3 и перемешивают смесь в течение 5 минут. После этого фазы разделяют, органическую фазу промывают насыщенным водным раствором NaCl, высушивают MgSO4 и упаривают в вакууме. Выход: 1,74 (100% от теоретического).
Пример 3.
1) n-Толуолсульфонат 1-(изопропоксикарбонилокси)этилового эфира (6R, 7R)-7-амино-3-метоксиметил-3-цефем-4-карбоновой кислоты (диастереоизомера)
1,74 г (4,63 ммоля)
смеси диастереоизомеров в соответствии с примером 2 растворяют в 4 мл этилацетата и добавляют к полученному раствору 0,44 г (2,32 ммоля) моногидрата п-толуолсульфокислоты в 3 мл этилацетата. К смеси
добавляют еще 3 мл диизопропилового эфира и отсасывают выпадающий в осадок продукт. Фильтрат обрабатывают таким же образом, как это описано ниже в данном примере (II).
Выход: 0,904 г (36% от теоретич.) диастереоизомера A (в виде п-толуолсульфоната).
1Н-ЯМР (ДМСО-d6, 270 МГц): d 1,25 (м. 6H, C(CH3)2);
1,50 (д. 3H,
CH-CH3), 2,30 (с. 3H, арил-CH3),
3,23 (с. 3H, CH2OCH3), 3,69 (2H, ABкв,S-CH2),
4,21 (м. CH2OCH3), 4,79
(м. 1H, O-CH(CH3)2),
5,25 (м. 2H, H-6 и H-7), 6,84 (кв. 1H, O-(CH)CH3)-O),
7,11 и 7,48 (2хд, 4H, арил-H), 8,9 (шир. с. 2H, NH2).
Тонкослойная хроматография (толуол)этилацетат 1 + 1/:Rf 0,34
Высокопроизводительная жидкостная хроматография: C18 нуклеозил 7 мкм, вода (+0,1% NH4OAc) +
(метанол-вода 80 20) (0,1% NH4OAc) (45 55, 1 мл/мин 10,8 мин (диастереоизомер A)). 2) n-Толуолсульфонат 1-(изопропоксикарбонил)этилового эфира (6R,
7R)-7-амино-3-метоксиметил-3-цефем-4-карбоновой кислоты (диастереоизомер B).
Полученный в примере 3 (1) фильтрат смешивают с раствором 0,44 г (2,32 ммоля) моногидрата n-толуолсульфокислоты в 3 мл этилацетата и отсасывают выпадающий в осадок продукт.
Выход: 0,534 г (21% от теоретич.) диастереоизомера B (в виде n-толуолсульфоната).
1Н-ЯМР (ДМСО-d6, 270 МГц): d 1,25 (м. 6H, C(CH3)2);
1,50 (д. 3H, CH-CH3), 2,30 (с. 3H, арил-CH3),
3,23 (с. 3H, CH2OCH3), 3,69 (2H, м. S-CH2),
4,21 (м. CH2OCH3), 4,79 (м. 1H, O-CH(CH3)2),
5,25 (м. 2H, H-6 и H-7), 6,84 (кв,
1H, O-CH(CH3)-O); 7,11 и 7,48 (2зд, 4H, арил-H),
8,9 (шир. с. 2H, NH2).
Тонкослойная хроматография (толуол)этилацетат 1 + 1/:Rf 0,26
Высокопроизводительная жидкостная хроматография: нуклеозил 7 мкм, вода (+0,1% NH4OAc) + (метанол-вода 80 20) + (0,1% NH4OAc) (45 55 1 мл/мин 9,1 мин
(диастереомер B)).
Пример 4.
1) Гидрохлорид 1-(изопропоксикарбонил)этилового эфира (6R,7R)-7-амино-3-метоксиметил-3-цефем-4-карбоновой кислоты (диастереоизомер B).
1,71 г (4,57 ммоля) смеси диастереоизомеров в соответствии с примером 2 растворяют в 4 мл этилацетата и добавляют к полученному раствору 0,914 мл (2,28 ммоля) 2,45 М изопропанольного раствора соляной кислоты. Образующийся осадок отсасывают, а фильтрат обрабатывают описанным ниже (пример 4(2)) способом.
Выход: 0,628 г (41% от теоретич.) диастереоизомера B (в виде гидрохлорида).
1Н-ЯМР (ДМСО-d6, 270 МГц): d 1,25 (м. 6H, C(CH3)2);
1,48 (д. 3H, CH-CH3), 3,23 (с. 3H, CH2
OCH3),
3,68 (2H, м. S-CH2), 4,21 (с. CH2OCH3),
4,81 (м. 1H, O-CH(CH3)2), 5,21 (кв, 2H, H-6 и H-7),
6,85
(2кв, 1H, O-CH(CH3)-O),
9,2 (шир. с. 2H, NH2).
Тонкослойная хроматография (толуол)этилацетат 1 + 1/:R 0,26.
Высокопроизводительная жидкостная хроматография: C18 нуклеозил 7 мкм, вода (+0,1% NH4OAc) + (метанол-вода 80 20) + (0,1% NH4OAc) (45 55, 1 мл/мин 9,1 мин/диастереоизомер B).
2) n-Толуолсульфонат 1-(изопропоксикарбонил)этилового эфира (6R, 7R)-7-амино-3-метоксиметил-3-цефем-4-карбоновой кислоты (диастереоизомер A).
Полученный в примере 4(1) фильтрат смешивают с раствором 0,573 г (3,0 ммоля) моногидрата n-толуолсульфокислоты в 3 мл этилацетата, и выпадающий в осадок продукт отсасывают.
Выход: 0,808 г (38% от теоретич.) диастереоизомера A (в виде n-толуолсульфоната, идентичного продукту в соответствии с примером 3(1)).
Пример 5.
1-(Изопропоксикарбонилокси)этиловый эфир (6R, 7R)-7-амино-3-метоксиметил-3-цефем-4-карбоновой кислоты (диастереоизомер A).
4,83 г (8,8 ммоля) диастереоизомера в соответствии с примером 4(2) растворяют в смеси 80 мл этилацетата и 153 мл воды с добавкой 0,96 г (11,45 моля) NaHCO3 и перемешивают в течение 5 минут. Разделяют фазы, промывают органическую фазу насыщенным раствором NaCl, высушивают ее MgSO4 и концентрируют в вакууме.
Выход: 3,29 г (100% от теоретич.).
Пример 6.
1-(Изопропоксикарбонилокси) этиловый эфир (6R, 7R)-7- амино-3-метоксиметил-3-цефем-4-карбоновой кислоты (диастереоизомер В).
4,99 г (12,0 ммоля) диастереоизомера В в соответствии с примером 4 (1) растворяют в смеси 110 мл этилацетата и 219 мл воды с добавкой 1,36 г (16,28 ммоля) NaHCO3 и перемешивают раствор в течение 5 минут. После этого фазы разделяют, органическую фазу промывают насыщенным раствором NaCl, высушивают MgSO4 и концентрируют в вакууме.
Выход: 4,49 г (100% от теоретич).
Пример 7.
1-(Изопропоксикарбонилокси)этиловый эфир (6R, 7R)-7-2-[2-аминотиазол-4-ил-(2-(Z)-метоксиимино)ацетамидо] -3- метоксиметил-3-цефем-4-карбоновой кислоты (диастереоизомер А).
3,29 г (8,8 ммоля) диастереоизомера А в соответствии с примером 5 растворяют в 22 мл сухого дихлорметана в атмосфере аргона и добавляют к полученному раствору 3,19 г (9,11 ммоля) 2-(2-аминотиазол-4-ил)-2-(Z)-(метоксиимино)меркаптобензотиазолилацета- та. Суспензию перемешивают в течение еще часа при 20oC, разбавляют затем 200 мл этилацетата, дважды подвергают экстракции водой, высушивают MgSO4 и отгоняют растворитель в вакууме. Остаток подвергают очистке с помощью колоночной хроматографии SiO2 толуол(этилацетат).
Выход: 1,1 г (22% от теоретич.) диастереоизомера А.
1H-ЯМР
(ДМСО-d6, 270 МГц):d 1,23 ( дв. д. 6Н, C(CH3)2),
1,49 (д. 3Н, CH-CH3), 3,21 (с. 3Н, CH2OCH3)),
3,48 (2H, ABкв.
S-CH2, 3,83 (с. 3Н, N-OCH3))
4,14 (c. CH2OCH3), 4,80 (м. 1Н, O-CH(CH3)2,
5,21 (д. 1Н, Н-6), 5,82 (дв.д. 1Н, Н-7),
6,72 (с. 1Н, тиазол-Н), 6,80 (кв, 1Н, O-CH(CH3-O),
7,2 (шир.с. 2Н, NH2), 9,59 (д. 1Н, CONH).
Высокопроизводительная жидкостная хроматография: С18 нуклеозил, 7 мкм, вода + 1,2-диметоксиэтан / + ЭДТА 10 мг/л, + 0,2% н-метилморфолин + HClO4, pH 3,34/ 68:32 1,5 мл/мин, 12,6 мин(диастереоизомер А).
Пример 8.
1-(Изопропоксикарбонилокси)этиловый эфир (6R, 7R)-7-[2-(2-аминотиазол-4-ил)-2-(Z)-(метоксиимино)ацетамидо] -3- метоксиметил-3-цефем-4-карбоновой кислоты (диастереоизомер В)
4,49 г (12,0
ммолей) диастереоизомера в соответствии с примером 6 растворяют в 30 мл сухого дихлорметана в атмосфере аргона и добавляют к полученному раствору 4,39 г (12,42 ммоля)
2-(2-аминотиазол-4- ил)-2-(Z)-(метоксиимино)-меркаптобензотиазолилацетата. Суспензию перемешивают в течение еще часа при 20oC, после чего разбавляют 200 мл этилацетата, дважды подвергают
экстракции водой, высушивают MgSO4 и отгоняют растворитель в вакууме. Остаток подвергают очистке с помощью колоночной хроматографии (SiO2, толуол(этилацетат)).
Выход: 4,6 г (69% от теоретич.) диастереоизомера В.
1H-ЯМР (ДМСО-d6, 270 МГц): d 1,25 (дв.д. 6Н, C(CH3)2);
1,50 (д. 3Н, CH-CH3, 3,21 (с. 3Н, CH2OCH3),
3,53 (2H, ABq, S-CH2), 3,85 (с. 3H, N-OCH3),
4,14 (с. CH2OCH3), 4,81(м. 1Н,
O-CH(CH3)2,
5,19 (д. 1Н, Н-6), 5,81 (дв.д. 1Н, Н-7),
6,72 (с. 1Н, тиазол-Н), 6,83 (кв, 1Н, O-CH(CH3)-O),
7,2(шир.с. 2Н, NH2), 9,
59(д. 1Н, CONH).
Высокопроизводительная жидкостная хроматография: С18 нуклеозил, 7 мкм, вода + 1,2-диметоксиэтан / + ЭДТА 10 мг/л, + 0,2% н-метилморфолин, + HClO4, pH 3, 34/ 68:32, 1,5 мл/мин, 9,7 мин (диастереоизомер В).
Пример 9.
1-(Изопропоксикарбонилокси)этиловый эфир (6R, 7R)-7-[2-(2-аминотиазол-4-ил)-2-(Z)-(метоксиимино)ацетамидо] -3- метоксиметил-3-цефем-4-карбоновой кислоты (смесь диастереоизомеров, цефподоксим проксетил).
4,26 г (17,5 ммоля) (6R, 7R)-7-амино-3-метоксиметил-3-цефем-4-карбоновой кислоты суспендируют в атмосфере аргона в 40 мл дихлорметана и с помощью добавки 2,65 г (17,5 ммоля DBU) переводят в раствор. При 0oC добавляют к полученному раствору 4,96 г (19,2 ммоля) 1-иодэтилоксиизопропоксикарбонилового эфира (The Journal of Antibiotics 40, 370, 1987) и перемешивают смесь в течение еще 60 минут при 0oC и 20 минут при 20oC. После этого к ней добавляют 6,4 г (18,3 ммоля) 2-(2-аминотиазол-4-ил)-2(Z)-(метоксиимино)-меркаптобензотиазолилацета- та, перемешивают суспензию в течение еще 2 часов при 20oC, разбавляют 200 мл этилацетата, дважды подвергают экстракции водой, высушивают MgSO4 и отгоняют растворитель в вакууме. Остаток подвергают очистке с помощью колоночной хроматографии (SiO2 толуол / этилацетат).
Выход: 3,42 г (35% от теоретич.) смеси диастереоизомеров А АВ.
1Н-ЯМР(ДМСО-d6, 270 МГц): d 1,25 (м. н 6Н, C(CH3)2);
1,49 (м. 3H, CH-CH3), 3,21 (с. 3H, CH2OCH3),
3,54 (2H, ABq, S-CH2), 3,85 (с. 3H, N-OCH3),
4,14 (с. CH2OCH3), 4,80 (м. 1H, O-CH(CH3)2,
5,21 (м. 1H, H-6), 5,82 (м. 1H, H-7), 6,72 (с. 1H, тиазол-H), 6,80 и 6,83 (2х, 1H, O-CH(CH3-O)
7,2
(шир. с. 2H, NH2) 9,6 (м. 1H, CONH).
Высокопроизводительная жидкостная хроматография: C18 нуклеозил, 7 мкм, вода + 1,2-диметоксиэтан / + ЭДТА 10 мг/л + 0,2% н-метилморфолин, + HClO4, pH 3,34/ 68:32, 1,5 мл/мин, 12,6 мин (диастереоизомер A) 9,7 мин (диастереизомер B).
Пример 10.
1-(Изопропоксикарбонилокси)этил-(6R, 7R)-7- [2-(2-аминотиазол-4-ил)-2-(Z)-(метоксиимино)-ацетамидо]-3-метоксиметил -3-цефем-4-карбоксилат n-толуолсульфонат (диастереомер Ax n-TsOH).
200 мг (0,36 ммоль) диастереомера A примера 7 растворяют в 0,5 мл н-пропанола при 70oC и обрабатывают 66 мг (0,35 ммоль) n-толуолсульфокислоты моногидрата в 0,17 мл н-пропанола. Раствор перемешивают при 70oC в течение 10 мин, выпаривают до 0,18 мл и смешивают с 2 мл диизопропилового эфира. Осадок фильтруют и сушат в вакууме (P2O5).
Получают: 198 мг (0,27 ммоль, 74%)
диастереомера A n-толуолсульфоната
1H NMR (DMSO-d6, MHz): δ 1,24 (dd, 6H, C(


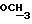



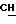

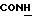
Пример 11.
1-(Изопропоксикарбонилокси)этил-(6R, 7R)-7- [2-(2-аминотиазол-4-ил)-2(Z)-(метоксиимино)-ацетамидо] -3-метоксиметил- -3- цефем-4-карбоксилат n-толуолсульфонат (диастереомер Bx n-TsOH).
200 мг (0,36 ммоль) диастереомера B примера 8 растворяют в 0,5 мл н-пропанола при 70oC и обрабатывают 66 мг (0,35 ммоль) n-толуолсульфокислоты моногидрата в 0,17 мл н-пропанола. Раствор перемешивают при 70oC в течение 10 мин, выпаривают в вакууме, растворяют в 0,3 мл н-пропанола и смешивают с 2 мл диизопропилового эфира.
Осадок фильтруют и сушат в вакууме (P2O5).
Получение: 215 мг (0,29 ммоль, 80%) диастереомера В n-толуолсульфоната
1H NMR (DMSO-d6, MHz): δ 1,25 (dd, 6H, C(


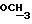

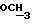

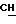

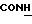
Реферат
Сущность изобретения: диастереомеры соединения цефема формулы (I) или его диастереомерно чистые соли общей формулы (II), где HX - одно- или многоосновная органическая или неорганическая физиологически приемлемая кислота, получают путем превращения соединения цефема формулы (III) в соответствующую соль обработкой раствором 0,2 - 2,0 эквивалентов одно- или многоосновной органической или неорганической кислоты HY. Затем методом фракционной кристаллизации проводят последовательно осажденные диастереомера с меньшей растворимостью, а затем диастереомера с большей растворимостью. Переводят выделенные диастереомерно чистые соли в чистые диастереомеры формулы (III) и превращают их в чистые диастереомеры формулы (I) путем ацилирования. В случае необходимости диастереомеры формулы (1) переводят в диастереомеры формулы (II). Формулы (I), (II) и (III) приведены в формуле изобретения. 3 с. и 2 з. п. ф-лы, 2 табл.
Формула

и их физиологически приемлемые соли.

где НХ одно- или многоосновную кислоту;
Х неорганический или органический физиологически приемлемый анион.

переводят в соответствующие соли общей формулы IV

где HY одно- или многоосновная кислота;
Y органический или неорганический анион,
путем обработки раствором 0,2 2,0 эквивалентов одно- или многоосновной кислоты HY, где Y имеет указанные значения, с последующим получением чистых диастереомеров общей формулы IV фракционной кристаллизацией с последовательным осаждением сначала диастереомера с меньшей растворимостью, а затем - диастереомера с большей растворимостью, переводом полученных чистых диастомеров общей формулы IV в чистые диастереомеры формулы III с последующим их превращением в чистые диастереомеры формулы I взаимодействием с соединением общей формулы V

где R1 атом водорода или аминозащищающая группа;
Z уходящая группа,
и в случае необходимости диастереомеры формулы I переводят в диастереомеры общей формулы II.

Комментарии