Способ получения пенициллинов - SU547176A3
Код документа: SU547176A3
Описание
(54) СПОСОБ ПОЛУЧЕНИЯ ПЕНИЦИЛЛИНОЗ
Способ заключается в том, что получают пеиициллины формулы I
ОН
Сп
4
С СНз
N
N
00
СООВ,
CgHs
где RI - бензил, л-пптробепзнл, трпхлорэтпл или /1-бромфенацил, фенацпл, R2-тpиxлopэтил, взаимодействием производпого D-феиилглицина формулы II
R,O-CS-NH-CH-COOM,
СеН,
где R2 - трихлорэтил, М - щелочпой металл
пли триэтиламмониевый ион,
с ироизводпым пенициллина G формулы III
( Нз
Т In IЬИз
С1
-NЧ
О
COOKj
где RI имеет ириведеииые значения, в среде растворителя или в смеси растворителей ирн темнературе О-30°С.
В формуле II М - щелочной металл, алифатический или циклический третичный аммоииевый радикал, алкпльиые части которого содержат 1-4 атома углерода, так же как триэтил аммоний, М-алкилпииеридиний, или 1 -алкилморфол1пп1Й.
Реакцию осуществляют в таком органическом растворителе, как ацетоннтрил, бензол или толуол, или в таких смесях оргаиических растворителей, как смесь ацетоп1ггрнл-бензол .
В формулах II и III защитиым радикалом RI карбоновой кислоты, легко удаляемым без затрапшания остальной части молекулы, может быть, иапример, беизильиый, /г-иитробензильиый , 2,2,2-трнхлорэтнльный, трнфенилметил ьный, диметилсилильцый, триметил сил ильный , фенацильпый, п-бромфеиацильный, ацетильный , нроиионильный бутиральный, бензонльный , сукцииильпый, метансульфоннльный, «-толуолсульфонильиый, метилфосфииильиый, метоксифосфинильный, днметилфосфинильиый, диметокснфосфнннльный хлорэтоксифосфнн ил ьный, дихлорэтокснфосфинильный, фенилфосфннильиый , феноксифосфинильпый, дифенилфосфинильный , дифеноксифосфинильный, 4-метил-1,3,2-диоксифосфорапильный, 1,3,2-диоксафосфораиильный и 1,3,2-беизодиоксафосфоранильный . В зависимости от обстоятельств эти радикалы могут быть удалены гидролизом , гидрогенолизом, ацидолизом или воздействием тиофенолята щелочного металла.
Продукты, соответствуюи;не формуле IL нолучают ири действии продукта фо)мулы IV
з-„СН„-СН (R) -OCSZ,
где п. О-2, Y - галоген, R-Н или фенильиый радикал и Z - атом хлора или остаток О-CH(R)-CHnY;j n, в котором и и Y имеют указанные зиачепия, на производное фенилгл щипа формулы V
HaN-СН-СООМ,
СеН,
где М имеет указаииые значения.
Обычно, реакцию осуществляют в ииертиом оргаиичесом раствори1еле, ири температуре от - 5 до + 25°С.
Продукты формулы IV получают, иаиример, действием тиофосгена на сиирт общей формулы VI
Y3-nCHn-CH{R)-On,
где Y, п и R имеют указанные значения.
Продукты формулы III получают сиособами , ои1 саииыми в патенте 2.
Обработку продукта формулы I основанием осуществляют в водной, водно-сниртовой среде или в среде органнческого растворителя. Например, можно использовать смес1з пирндпп-вода . Одпако иаилучи ие результаты иолучают при исиользоваиии первичпого пли вторичного амина или дналкиламииоалкиламииа , который должен быть выбраи таким образом, чтобы в ироцессе реакции не размыкалась (5-лактамная связь иенициллинового цикла. Особеино выгодно использовать такой первичный алифатический амин, как иентилам 1и пли гексиламни, такой нервичный циклоалифатический амии, как циклоиентил-, циклогекспл- плп фенетнламии. Нз иаиболее иригодиых диалкилампиоалкиламинов можно назвать диметиламиио-2-октилам11н, диметилами но-3-иропи.:1ампп илп диэтилампио-З-пропи;амин .
Реакцию осуи1ествляют в таких ппертных ароматических органических растворителях, как бензол, толуол или ксилолы, таких иростых эфирах, как днэтпловый эфир илп тетра5 гпдрофурап, таком сложном эфире, как этилацетат , или галогенпрованном углеводороде, таком как хлороформ. Температура реакции обычно О-25°С. Удаление защитной группы амииной функ0 цип осуи1ествляют в мягких условиях, ири которых ие затрагивается остаток молекулы. Предиочтптельно нспользуют цинк или сплав цинка в такой кислоте, как уксусная.
Удаление защитной груииы Ri функцни карбоновой кислоты осуществляют обычными способами в зависимости от значений R.
Порядок удаления защитных радикалов амнииой функцни и функции карбоновой кислоты ие имеет значения, их удалять можно даже одновременно, в частности, когда символы RI и R2 имеют одио и то же значенне.
Пример 1. К раствору 58 г трихлорэтнлового эфира иенициллииа G в 2250 см безводного беизола, выдерживаемому Г1ри5°С,до5 бавляют 40 см- ннридина, затем но канлям за
2 ч при температуре -5°С. добавляют раствор 27,5 г пятихлористого фосфора в 600 см безводного толуола. Реакционную смесь перемешивают в течение 1 ч при - 5°С, затем ее быстро фильтруют и фильтрат выливают в 600 СМ ледяной воды. Отделенную органическую фазу промывают последовательио 2 раза по 250 см охлажденного и насыщенного раствора хлористого натрия, 250 см 57о-ного водного охлал денного раствора бикарбоната натрия и 250 см охлажденного и насыщенного хлористым натрием раствора, затем высушивают над сульфатом магния при 0°С. После фильтрования, добавляют за несколько минут раствор 44 г трихлорэтилокситиокарбонилфенилглицината калия в 450 см аиетонитрила. Продолжают перемешивание реакционной смеси в течение 16 ч при 20°С, затем концентрируют ее досуха при пониженном давлении (12 мм рт. ст.) при 30°С. Полученный остаток извлекают 100 см бензола. Нерастворимую часть отделяют фильтрованием и фильтрат хроматографируют на колонне диаметром б и высотой 47 см, заполненной 500 г силикагеля (0,05-0,20 мм, рН-нейтральный), применяя в качестве элюента бензол. Получают фракции по 125 см. Фракции 8-75 объединяют и концентрируют досуха при давлении 12 мм рт. ст. и 30°С. Получают таким образом 38 г трихлорэтил (2-бензил-2-окси-5-оксо-4-фенпл3-трихлорэтилокситиокарбонил-1 - пмидазолидинил ) -6-пенициллината.
Rf 0,76 (силикагель, объемная смесь хлоросЬорм - этилацетат 85-15).
Найдено, %: С 44,2; Н 3,5; N 5,5; С1 26,85; S 7,95.
Вычислено, %: С 44,07; Н 3,44; N 5.31; С1 26,91; S 8.11. Спектр ядерного магнитного резонанса (СОСЬ) 1,4 (сЗН)--СНз; 1.45 (с, ЗН)-СН.,; 3,25 и 4.55 (ABJ 14,2Н) -СН,- в 2; 4.1 (с 1Н)-СИ- в 4. 4,4 и 5.1 (ABJ 12,2Н) CIsCCH OCC-. 4,55 Сс 1Н) Н- в 3; 4.7 (ABJ 11,2Н)-СН,- в 3; 5,1 (g, т 4.1Н)- в 5; 5,5 (е. ) Н- в 6; 6,5(с1Н)ОН; 7,0-7,4(м 10Н). ИКспектр fnacTBOp бромоформа) 1795, 1760. 1745, 1460 и 315 СМ-.
Фракции 111 - 160 хроматографироваппя объединяют и концентрируют досуха при давлении 12 мм рт. ст. и 30°С и, таким образом, рекупирируют 25,5 г трихлорэтилового эфира пенициллина.
Трихлорэтилокситиокарбонил - D - а - фенилглицин может быть получен согласно одному из следующих способов;
1) К 31 г D-a-фепилглипппа п смеси 206 см1 Н. раствора едкого натра и 200 см диэтилового эфира, охлажденному до -2°С, добавляют раздельно, но каплям за 30 мин при );)аствоп трихлорэтилхлортиоформиата в 200 см дпоксана и 206 см 1 н. раствора едкого натра. Перемешивают при 20°С в течение 5 ч, затем добавляют 250 см дистиллированной воды и полученную смесь промывают 4 раза по 250 см эфира. В водной фазе устанавливают рН 2 путем добавления 10%-ного раствора фосфорной кислоты и экстрагируют 4 раза по 200 этилацетата. Эфирные экстракты высушивают над cyльфaтo т патрия в присутствии древееиого угля, затем концентрируют досуха при понижеппом давлеппп (12 мм рт. ст.) п 50°С. Получают таким образом 55 г масла, желтого цвета. Это масло извлекают 2 раза по 500 см- кипящего циклогексана , отделяют нерастворимую часть фильтрованием . Охлажденный фильтрат оставляют для кристаллизации продукта, который отделяют фильтрованием и высушивают при давлении 0,3 мм рт. ст. и 200°С. Получают таким
образом 10,35 г трихлорэтилокситиокарбонилD-a-фенилглицина . Маточные воды этого продукта концентрируют досуха при давлении 12 мм рт. ст. 1 50°С, остаток извлекают 100 СМ хлористого метилена и медленно добавляют 400 см петролейного эфира (т. кии. 70-100°С); после отделения кристаллов фильтрованием , получают вторую порцию 10,15 г трихлорэтилокситпокарбонил - D-a - фенилглицина , плавяшегося при 135-138°С.
Найдено, %; С 38,7; Н 3,25; N 4,1; S 8.85; С1 30,3.
С 38,56; Н 2,94; К 4,09;
%:
Вычислено,
59,36; С1 31,04.
Врашательная способность 137,4° (с 1, дпметилформамид).
Трихлорэтплхлортиоформиат получают следующим образом.
К раствору 95 см тиофосгена в 2 л бензола
добавляют по каплям, за 2 ч при 30°С раствор 92 г трихлорэтанола в смеси 100 см- пиридина и 1 л бензола. Реакцнонную смесь перемешивают в течение 16 ч ирп 20°С, затем добавляют 15 г древесного угля и переметипвают еще в течение 15 мин, затем нерастворимую часть отделяют фильтрованием п промывают 4 раза по 100 см- бензола. Фильтрат охлаждают до 0°С, затем промывают 2 раза по 750 см- ледяной воды. Органическую фазу отделяют . высуи1ивают над сульфатом иатрия и копцептрпруют при давлении 12 мм рт. ст. и 40°С. Остаток перегоняют при давлеиии 12 мм рт. ст. и получают таким образом 47 г трихлорэтилхлортиоформиата (т. пл. 85°О.
2) К раствору 70,36 г Оа-фенилглиццна в 466 см 1 н. раствора едкого натра добавляют за 5 мин раствор 155 г трихлорэтилтиокарбоната в 800 см апетонитрила. Реакциоиную смесь перемеппшают при 20°С в течение 16 ч.
затем рН доводят до 10 путем добавления 50 см- 1 и. раствора едкого натра и 400 см воды и иромывают 4 раза по 600 см эфпра. Подкисляют водиую фазу добавле1П1ем 510 слг 1 и. соляной кислоты. Декантируют масло, которое экстрагируют 4 раза по 800 см- эфпра. Объединенные органнческпе экстракты промывают 3 раза по 400 см- воды, высушивают над c ьфaтoм натрия, затем концентрируют досуха при поппнченном давлении (12 мм рт. ст.)
при температуре ниже 30°С. Получают таким образом 154 г масла желтого Ц1зета, которое растворяют в 290 слг хлористого метилена. К медленно добавляют до этому раствору очень начала кристаллизации 1100 см- иетролейиого эфира (т. кип. 70--110°С), затем 1180 см иетроленного эфира (т. кии. 70-100°С). После иолучасового иере.меиппзаиия, появивигиеся кристаллы отделяют фильтроваиием, иромывают 2 раза 100 см- петролейного эфира (т. кип. .70-100°С) и высушивают ири иоиижеином давлении (0,3 мм рт. ст.) ири 20°С. Таким образо.м получают 76 г трихлорэтилокситиокарбонил-Оа-фенил глицина, плавящегося при 140°С. Концентрируя маточные жидкости предыдущего продукта, получают вторую порцию весом 30 г. Трихлорэтилтиокарбонат может быть получен следующим образом; К раствору 95 см тиофосгеиа в 2 .i бензола, добавляют по каплям за 2 ч и при 20°С раствор 184 г трихлорэтанола в смеси 200 см пиридина и 1 л бензола. Продолжают перемешивание реакционной смеси в течение 16 ч при 20°С, затем добавляют 15 г древесного угля . Смесь перемешивают в течение 15 мин, затем нерастворимую часть отделяют фильтроваиием и иромывают 4 раза ио 100 см беизола . Фильтрат охлаждают до 0°С, затем иромывают 4 раза по 750 см .тедяной воды. Органический раствор высуиишают иад сульфатом натрия, затем концентрируют ири поиижеином давлении (12 мм рт. ст.) ПРИ 40°С. Остаток перегоняют иод вакуумом (12 мм рт. стЛ. Получают 164 г трихлорэтилтиокарбоиата (т. кип. - 150°С) 12 мм рт. ст. Пример 2. К раствору 56.5 г cheHaiM noвого эфира иеи1И1илл11иа G в 1 .т безводного бензола ири 5°С добавляют 40 см пириди затем ио каплям за 1 ч 30 мин и ири - 5°С добавляют раствор 27,5 г иятихлористого фосфора в 300 слг безводного толуола. Реакпнопную смесь перемешивают в течение 1 ч ИРИ - 5°С, затем быстро фильтруют и фильтпят выливают в 600 см ледяной воды. Отделеггную органическую фазу иромывают последовательно 2 раза ио 250 см- ледяного. насыи рнного раствора хлористого натрия, 250 см 5%ного водного ледяного раствора бикарбоиата натрня и 250 см ледяного и насышениого раствора бикарбоната натрия н 250 см ледяного и пасышениого раствора хлористого натрия, затем высуигивают иад сульфатом магиия при 0°С. После фильтрования, добавляют за иесколько минут раствор 38,05 г трихлорэтилокситиокарбонил-Оа-фенилглидината калия в 350 см ацетоиитрила. Продолжают иеремешивание реакционной смеси в течение 16 ч ири 20°С затем концентрируют ее досуха при пониженном давлении (12 мм рт, от,) ири 30°С Полученный остаток извлекают 100 см бензо ла, отделяют нерастворимую часть фнльтро ваннем н хроматогпафируют фильтрат на ко лонке диаметром 6 и высотой 37 см, запол ненной 500 г силикпгеля (0,05-0,20 мм, рН- ейтральиое). Сиачала элюируют 500 см бенола и элюат удаляют. Затем элюируют объмной смесью бензол : этилацетат 96 : 4, соирая фракции ио 125 см-1 фракции 10-60 бъодиияют и коииентрируют досуха ири ноижеииом давлеиии (12 мм рт. ст.) ири 30°С. 1(;лучают таким образом 35 г фенацил(2-бенИЛ-2-ОКСИ-5-ОКСО-4 - феиил-3-трихлорэтилоксиг;окарбоиил - 1 - имидазо,тидинил)-6-пеницилииата . Rr 0,61 (силикагель, хлороформ-этиланеат 80-20 ио объему) ЯМР-спектр (CDCl.,). ,45 (с-ЗН)-СН; 1,б (с-ЗН)-СНз,- 3,3 н 4,5 (АВ,т 14,2А)-СНг в 2; 4,1 (с, 1Н)-СН- 4; 4,35 и 5,05 (АВ,,2Н) CbCCHgOCS-: ,55 (c-lH) Н- в 3; 5,1 (jj, т 4,1Н) Н- в 5. ,2-5,7 (м-ЗН) Н- в 6 и СН. в 3; 6,45 (С-1Н)-ОН; 7,0-7,6 (м-13Н) СвН. и ароматический в ВКСО-; 7,6-8,0 (м-2Н) ароматические в а к СО-, ИК-сиектр (определение в растворе бромоЛорма ). Характеристические иолосы 1790, 1745, 1700, 1460 и 815 см-Ч Кроме того, фракции 61 и следующие, ПОЛУ чеиные при предыдуи1ей хпоматогпафии, объединяются , концентрируются досуха ипи поииженном давлении 12 мм рт. ст. ири 30°С; таким образом рекуиернруют 16 г фенацилоного эфира иеинциллина. П р и м ер 3. К раствору 51,2 г беизи ового эфира иениииллииа G в смеси 400 см- безпо/иого беичола и 200 см- безводного толуола ир.и - 10°С добавляют 38,9 см пиридина, -,.,-,.0-, ,,0 капля 1 за 40 .М1ш и ири темиературе от ло -2°С, добавляют раствор 26,2 г гятихлористого фосфора в 350 см безводного толуола Реакционную смесь иеремеипшают в 1 ч ири -5°С, затем выливают в .:1еяной воды. Отделениую органиЛазу иромывают последовательно тсдяпого и насыщеииого раствора хлонатрия , 500 см водного ледяного 5%чого раствопа бикарбоната натрия и 250 см Л1: дяпого и FiacbuueHHoro раствора хлористого |ттпия. Органическую dia3y высушивают над сульсЬатом магиия ири 0°С. После фильтрования добавляют за несколько мигпт рпствоо 41 г трихлорэтилокситиокарбонил - Da - фенилглисииата калия в 550 см ачетоиитрила. ПРО . перемешивание реак.ипочнпй смеси в течение 16 ч ири 20°С. Образовавгиийся осядок отделяют фильтроваиием и фильт пт концентрируют досуха при поиижениом давлении (12 мм рт. ст.) ири 30°С. Пол чеиный остаток растворяют в 500 см бензол и хроматографируют на колонке диаметром 5 и высотой 37 см, заполненной 50 г силикагеля (0,05-0.20 мм, рН нейтральное). Сначала элюируют 500 см бензола и элюат удаляют. Затем ЭЛЮИРУЮТ объемной смесью бензол-этилацетат 96-4. собирая сЬракини по 100 фракции 10-43 объединяют и концеитрирз ют досуха при пониженном давлении 12 мм рт. ст. при ЗОС. Получают таким образом 53,2 г бензил (2-бенЗИЛ-2-ОКСИ-5-ОКСО-4 - фенил-3-трихлорэтилокси9 тиокарбонил- - имидазолидинил)- 6-пеннциллината . Rt 0,80 (силикагель, объемная смесь хлороформ-этилацетат 85-15). Найдено, %: С 54,6; Н 4,55; К 5,65; С1 14,10. Вычислено, %: С 54,2, Н 4,28, N 5,61, S CI 14,20. . ЯМР-спектр (СОС1з). 1,42 (с-6Н)-СН; 3.3 Н 4,5 (АВт- 14,2Н)-СН2- в 2; 4,1 (с-1Н)- -СН Б 4; 4,45 (с-1Н)Н в 3; 4,38 и 5,05 (АВт 12,2Н)С1зССН2-OOS-;5,1(с-5,2Н) - -СН2- в 3; 5,1 (g,T 4,1Н)Н- в 5; 5,5 (g,T 4,lH)H- в 6; 6,45 (с, 1Н)-ОН; 7,0- 7,4 м. 15Н-СбНэ. ИК-спектр (онределение в растворе бромоформа ), характеристические нолосы 1790, 1740, 1455 и 815 . П р и м е р 4. К раствору 3,4 см- днметилформамида в 230 см бензола нри 30°С добавляют 4,4 г фосгена в течение 50 мин. По окончании добавления фосгена выдерживают при хорошем перемешивании в течение 25 мин, затем проиускают ток азота с такой скоростью, чтобы удалить неиреврашенный фосген. Затем к полученной таким образом суспензии белого цвета добавляют при 30°С 1,6 см- пиридина , затем 4,65 г трихлорэтилового эфира пенициллина G в виде раствора в 10 см хлористого метилеиа. Оставляют при перемешивании в течение 5 ч. После быстрого фильтрования через уголь до осветления, фильтрат промывают два раза 4 см в целом охлажденным водным насыщенным раствором хлорпстого натрия, затем один раз 25 см ледяного водного 5%-ного раствора бикарбоната натрия и снова два раза 50 см в целом раствором хлорпстого натрия . Фильтрат высушивают над сульфатом натрия, затем выливают в раствор 3,42 г трихлорэтилокситиокарбонил-D - фенплглнцина в 20 см ацетонитрила и предварительно обрабатывают 1,4 СМ безводного трпэтиламина. Оставляют реагировать в течение 15 ч. Отфильтровывают хлористый триэтиламмоний. фильтрат хроматографируют на колонке, заполненной 75 г силикагеля (0,05-0,20 мм, рН нейтральное ). Получают таким образом 5,4 г трихлорэтпл- (2-бензил-2 - окси-5-оксо - 4-феиил-Зтрихлорэтилокситиокарбонил - 1-импдазолидииил )-6-пенпциллата. Пример 5. Раствор 1,87 г трихлорэтилового эфира пенициллина G и 0,7 см безводиого пирилтина в 72 см- толуола и 4 см- бензола ирн перемешивании за 50 мин ири 24°С выливают в суснензию 2.05 г комилекса диметплформамид-хлористый тионил в 15 см бензола . Смесь неремешпвают в течение 24 ч. Получают суспензию коричневого цвета. Смесь охлаждают до 3°С и носле декантации иромывают иоследовательно ледяным насыщенным раствором хлористого натрия (2 раза 20 см г. целом) затем ледяным 5%-ным раствором бикарбоната натрия (один раз 10 см-) и, наконец , ледяным насын:енным раствором хлорпстого натрия (2 раза 20 см в ц,елом). Орга
10 ическую фазу высушивают над сульфатом атрия. После фильтрования к ней быстро доавляют при температуре около 20°С раствор ,52 г трихлорэтилокситпокарбонил-О-фениллицината калня в 1,2 см ацетонитрила. Смесь ыдерживают ири неременпшанни в течение 15 ч ирп 20°С. затем концентрируют досуха ри поппженном давлеиии, при 30°С. Полуенный остаток извлекают 5 см бензола. Поученный раствор хроматографируют на колонне диаметром 2 и высотой 31 см, заполненный 48 г снликагеля (0,05-0,20 мм, рП нейтральное ), элюнруя объемной смесью бензол - этилацетат 95-1. После концентрирования элюатов, иолучают 2,35 г трихлорэтил-(2-бенЗИЛ-2-ОКСИ-5 - оксо-4-фенил-З-трихлорэтилокситиокарбонил-1 - имидазолидинил)-6 - пенициллпната . Используемый комплекс диметилформамид-хлористый тионил может быть получен следующим образом. В отсутствие влаги и при температуре около 20°С за 15 мин добавляют раствор 1,9 см свежеперегнанного хлорнстого тиоипла в 5 см безводного бензола к смеси 1,8 см диметилформам1 да и 20 см- бензола. После 30 мни перемешивання прн температуре около 20°С смесь концентрируют досуха ирп пониженном давлении (3 мм пт. ст.). ПолучеинЕяй остаток извлекают 20 слг бензола, и смесь снова концентрируют досуха Hpii понижениом давлении; эту OHCpaiiiiio затем повторяют еи1,е два раза. Полученный окончательно остаток иромывают декантироваиием 5 раз в целом 100 см- беизола и окончательно получе1П1ый остаток иысушнвают ирп пониженном давлси.и. Ф о р N V л а и 3 о б р е т е и и я Способ получения пеипциллнпов формулы СеНэСНг-СN . К, RI - бензнл. /г-нптробензпл. трпхлорэтнл НЛП /г-бромфенацил, фенацил, R2 - трпхлорэтпл, о т л и ч а ю ni, и и с я тем. что ироизводиое D-фенплглицина формулы R::0-CS -NH-СП- СООМ. где R2-имеет приведенное значе Ц1е, а М - атом щелочного металла или триьтиламмэниевьп нон. 1 волят в реакцню с производным псипциллина формулы СбН5-СН7(к-И где Ri - имеет приведенные значения. в среде растворителя или смеси растворителей при . Источники информации, принятые во вни .мание нри экснертизе:5 12 1. Патент США № 3079307, кл. 260-239.1, 1963 г. 2. Патент Бельгии N° 763589, кл, А 61 К, 1971 г.




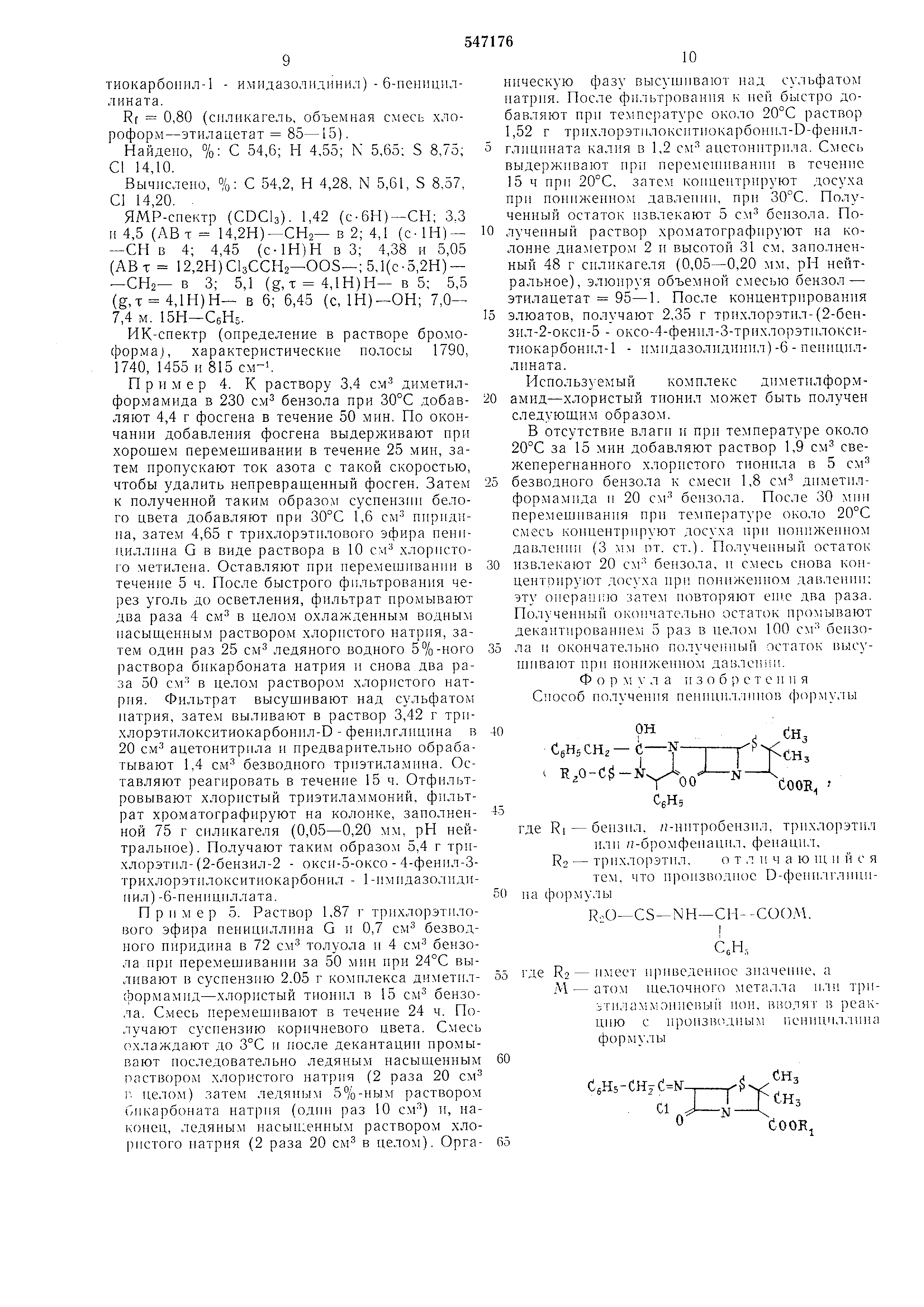

Реферат

Формула
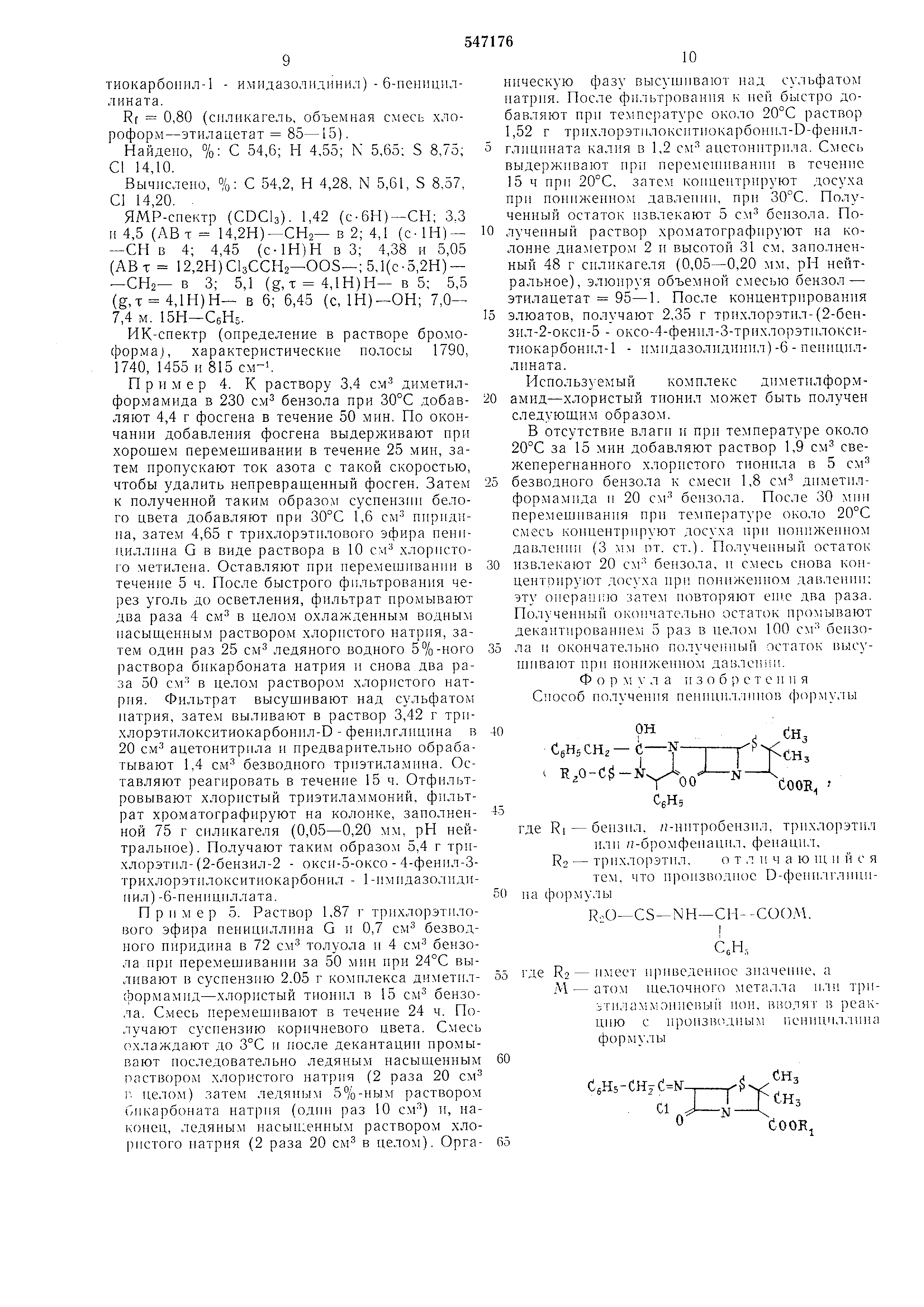

Комментарии