Производные бензоксазепина, фармацевтическая композиция на их основе и их применение в качестве стимуляторов рецептора амра - RU2279434C2
Код документа: RU2279434C2
Описание
Настоящее изобретение относится к производным бензоксазепина, к содержащим их фармацевтическим композициям и к использованию этих производных бензоксазепина при лечении неврологических и психических заболеваний.
В центральной нервной системе (ЦНС) млекопитающих передача нервных импульсов осуществляется путем взаимодействия нейромедиатора, который высвобождается нейроном-передатчиком, и рецептора на поверхности нейрона-приемника, что вызывает возбуждение нейрона-приемника. В ЦНС наиболее представленным нейтромедиатором является L-глутамат. Он опосредует главный возбуждающий путь у млекопитающих и называется возбуждающей аминокислотой (EAA). Возбуждающие аминокислоты имеют огромное физиологическое значение, играя роль в различных физиологических процессах, таких как обучение и запоминание, развитие синаптической адаптации, двигательный контроль, дыхание, сердечно-сосудистая регуляция и сенсорная чувствительность.
Рецепторы, реагирующие на глутамат, называются рецепторами возбуждающих аминокислот (рецепторы EAA). Эти рецепторы классифицируются на два основных типа: (1) «ионотропные» рецепторы, которые непосредственно связаны с открывающимися катионными каналами клеточной мембраны нейронов, и (2) «метаболические» рецепторы, связанные с G-белком, которые связаны со сложными системами вторичных мессенжеров, влияющих на усиление гидролиза фосфоинозитида, активацию фосфолипазы D, увеличение или снижение образования ц-АМФ и изменение функции ионных каналов.
Ионотропные рецепторы могут быть разделены по фармакологическим свойствам на три подтипа, которые характеризуются по деполяризующей активности в отношении селективных агонистов N-метил-D-аспартата (NMDA), α-амино-3-гидрокси-5-метилизокасазол-4-пропиновой кислоты (AMPA) и каиновой кислоты (KA).
Активация синаптических рецепторов AMPA вызывает потенциал-независимый, быстрый (˜1 мс до максимума ответа) возбуждающий постсинаптический поток (быстрый EPSC), тогда как активация синаптических рецепторов NMDA генерирует потенциал-зависимый, медленный (˜ 20 мс до максимума ответа) возбуждающий поток. Региональное распределение рецепторов AMPA в мозге наводит на мысль, что рецепторы AMPA опосредуют синаптический перенос в областях, которые, вероятно, ответственны за когнетивную способность и память.
Полагают, что активация рецепторов AMPA агонистами приводит к конформационным перестройкам рецептора, что вызывает быстрое открытие и закрытие ионного канала. Степень и продолжительность активации канала может либо снижаться лекарственными препаратами, которые, таким образом, действуют как отрицательные аллостерические модуляторы (например, GYKI 52466), либо повышаться лекарственными препаратами, которые в этом случае действуют как положительные аллостерические модуляторы.
Структурный класс положительных модуляторов рецептора AMPA, получаемых из анирацетама (например, CX 516), называется Ампакины. Таким образом, положительные модуляторы рецептора AMPA могут связываться с глутаматным рецептором и, при последующем связывании с агонистом рецептора, давать ионный поток через рецептор с повышенной продолжительностью активации.
Нарушения в нейропередаче глютамата могут быть связаны со многими неврологическими и психическими заболеваниями человека. Терапевтическая эффективность положительных модуляторов рецептора AMPA при лечении неврологических и психических заболеваний описана Yamada, K. A. (Exp. Opin. Invest. Drugs, 2000, 9, 765-777), Lees, G. J. (Drugs, 2000, 59, 33-78) и Grove S. J. A. et al. (Exp. Opin. Ther. Patents, 2000, 10, 1539-1548).
Были обнаружены и недавно описаны Grove S. J. A. et al. (supra) разнообразные классы соединений, которые повышают активность рецепторов AMPA. В качестве прототипа ампакина рассматривался N-анизоил-2-пирролидинон (анирацетам; Roche) (Ito, I. et al., J. Physio. 1990, 424, 533-543), вскоре после этого в качестве модуляторов АМРА (Yamada, K. A. и Rothman, S. M., J. Physio., 1992, 458, 385-407) были обнаружены некоторые сульфонамиды (примером служит циклотиазид; Eli Lilly & Co). Как описано в международной патентной заявке WO 94/02475 (The Regents of the University of California), на основе структуры анирацетама Lynch, G. S. и Rogers, G. A. обнаружили его производные, которые имеют повышенную активность и стабильность. Позже, в WO 96/38414 (Rogers, G. A. and Nilsson, L.; CORTEX Pharmaceuticals), были описаны другие ампакины в форме бензоилпиперидинов и пирролидинов, а затем, как описано в WO 97/36907 (Rogers G. A. и Lynch. G., The Regents of the University of California; CORTEX Pharmaceuticals), соединения, в которых амидная функциональная группа конформационно ограничена в бензоксазиновой кольцевой системе или, как описано в WO 99/51240 (Rogers G. A. and Johnstrom, P., The Regents of the University of California), в ацилбензоксазиновой кольцевой системе. В качестве модуляторов рецептора АМРА в WO 99/42456 (NEUROSEARCH A/S) были описаны производные бензоксазина со сходной структурой и, в частности, 1,2,4-безотиадиазин-1,2-диоксиды, структурные производные циклотиазидаTM.
Положительные модуляторы AMPA рецептора находят широкое применение в лечении людей. Например, увеличение числа возбуждающих синапсов может компенсировать потерю синапсов или рецепторов, связанных со старческими заболеваниями и заболеваниями мозга (болезнь Альцгеймера, например). Увеличение активности, связанной с рецепторами AMPA, может вызывать более быструю обработку мультисинаптическими цепями, обнаруженными в областях высшего мозга и, таким образом, могут давать увеличение познавательной активности и интеллектуальных способностей. Кроме того, предполагают, что ампакины, вероятно, могут использоваться в качестве агентов, улучшающих память, улучшать способности у субъектов с затрудненными сенсорномоторными реакциями и у субъектов с замедленными познавательными функциями, зависящих от мозговых сетей, использующих рецепторы AMPA, при лечении депрессий, алкоголизма и шизофрении, и для улучшения восстановления субъектов после получения травмы.
С другой стороны, было обнаружено, что активация возбуждающих рецепторов AMPA у экспериментальных животных (например, высокие дозы некоторых модуляторов AMPA, особенно тех, которые являются возможными ингибиторами рецепторной десенсибилизации), может вызывать припадки и также возможно другие побочные эффекты проконвульсантов (Yamada, K. A., Exp. Opin. Invest. Drugs, 2000, 9, 765-777). Принимая во внимание возможность эксайтотоксичности при активации рецептора AMPA (особенно с помощью модуляторов тиадиазидного класса), остается потребность в разработке модуляторов, имеющих адекватный терапевтический индекс.
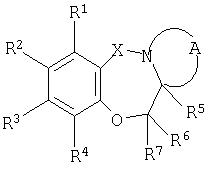
Поэтому настоящее изобретение относится к производным бензоксазепина общей формулы I

Формула I
где
X представляет собой CO или SO2;
R1, R2, R3 и R4 независимо выбраны из H, (C1-4)алкила, (C1-4)алкилокси, (C1-4)алкилокси(C1-4)алкила, CF3, галогена, нитро, циано, NR8R9, NR8COR10 и CONR8R9;
R5, R6 и R7 независимо представляют собой H или (C1-4)алкил;
R8 и R9 независимо представляют собой H или (C1-4)алкил; или R8 и R9 вместе с атомом азота, к которому они присоединены, образуют 5- или 6-членное насыщенное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O, S или NR11;
R10 представляет собой (C1-4)алкил;
R11 представляет собой (C1-4)алкил.
A представляет собой остаток 4-7-членного насыщенного гетероциклического кольца, необязательно содержащего атом кислорода, кольцо необязательно замещенное 1-3 заместителями, выбранными из (C1-4)алкила, (C1-4)алкилокси, гидрокси, галогена и оксо; или к его фармацевтически приемлемой соли;
при условии, что исключены
соединения формулы I, где X представляет собой CO; каждый R1-R7 представляет собой H, и A представляет собой (CH2)3 или (CH2)4;
соединения формулы I, где X представляет собой CO; R1 представляет собой H; R2 представляет собой метил; каждый R3-R7 представляет собой H; и A представляет собой (CH2)3;
соединения формулы I, где X представляет собой CO; R1 и R2 представляют собой H; R3 представляет собой метил; каждый R4-R7 представляет собой H; и A представляет собой (CH2)3;
соединения формулы I, где X представляет собой CO; каждый R1-R3 представляет собой H; R4 представляет собой метил; каждый R5-R7 представляет собой H; и A представляет собой (CH2)3; и
соединения формулы I, где X представляет собой CO; каждый R1-R4 представляет собой H; R5 представлят собой метил; R6 и R7 представляют собой H; и A представляет собой (CH2)3.
Бензоксазепины, для которых, по существу, не найдена защита, описаны Schultz, A. G. et al (J. Am. Chem Soc. 1988,110,7828-7841), где производные этих бензоксазепинов, описанные в качестве промежуточных продуктов, не имеют какой-либо фармакологической активности.
Бензоксазепины формулы I, включая бензоксазепиноны, описанные ранее Schultz et al. (supra), были найдены как положительные модуляторы рецептора AMPA, которые могут использоваться при лечении неврологических и психических заболеваний, для которых необходимо увеличение синаптических ответов, опосредованных рецепторами AMPA.
Под термином (C1-4)алкил, как используется в описании формулы I, понимают разветвленную или неразветвленную алкильную группу, содержащую 1-4 атома углерода, такую как бутил, изобутил, четвертичный бутил, пропил, изопропил, этил и метил.
В определении (C1-4)алкилокси, термин (C1-4)алкил имеет такое же значение, как описано выше.
Под термином (C1-4)алкилокси(C1-4)алкил понимают
(C1-4)алкильную группу, замещенную (C1-4)алкилокси, значение обоих такое же, как описано выше.
Под термином галоген понимают F, Cl, Br или I.
В описании формулы I, R8 и R9, вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное насыщенное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O, S или NR11. Примерами таких заместителей гетероциклического кольца являются пиперидино, пирролидино, морфолино, N-метилпиперазино, N-этилпиперазино и тому подобное.
В описании формулы I, A представляет собой остаток 4-7-членного насыщенного гетероциклического кольца, необязательно, содержащего атом кислорода, что обозначает, что A является бивалентным радикалом, содержащим 2-5 атомов углерода, таким как этилен, 1,3-пропилен, 1,4-бутилен, 1,5-пентилен, один атом углерода которого может быть замещен кислородом. Примерами 4-7-членных гетероциклических колец, образованных остатком A вместе с атомом азота и атомом углерода, к которым присоединен A, являются азетидин, пирролидин, пиперидин, оксазолидин, изоксазолидин, морфолин и азациклогепатан.
Предпочтительным является производное бензоксазепина формулы I, где X представляет собой CO, соединения которого являются безоксазепинонами.
Более предпочтительными производными являются производные бензоксазепина формулы I, где X представляет собой CO, и где R5, R6 и R7 представляют собой H; и A представляет собой (CH2)3.
Особенно предпочтительными являются производные бензоксазепина формулы I, где X представляет собой CO, один или несколько R1, R2, R3 и R4 является галогеном, предпочтительно фтором, и, где R5, R6 и R7 представляют собой H; и A представляет собой (CH2)3.
Особенно предпочтительными соединениями по данному изобретению являются:
(R)-7-фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он;
(S)-7-фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1, 4]бензоксазепин-5-он;
(S)-9-фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он;
(R)-9-фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1, 4]бензоксазепин-5-он;
(S)-6-фтор-2,3, 11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он.
Производные бензоксазепина по данному изобретению могут быть получены способами, которые в общих чертах известны в данной области органической химии. Более конкретно, такие соединения могут быть получены способами, описанными A. G.Schultz et al (J. Am. Chem. Soc. 1988, 110, 7828-7841), или модифицированными способами.

Формула II
Производные бензоксазепина формулы I, например, могут быть получены циклизацией соединения формулы II, где значения X, A и R1-R7 такие же, как описано ранее, где любая функциональная группа с кислотным водородом, защищена любой защитной группой, и где Q представляет собой гидрокси, галоген или (Cl-4)алкилокси, после чего любую защитную группу, если она присутствует, удаляют. Реакция циклизации соединения, где Q представляет собой галоген или (C1-4)алкилокси, может проводиться в присутствии основания, такого как гидрид натрия или карбонат цезия, в растворителе, таком как диметилформамид, и при температуре 0-200°C, предпочтительно 25-150°C. В случае соединений формулы II, где Q представляет собой гидроксигруппу, циклизация может осуществляться в условиях Митсунобу (Mitsunobu) (Mitsunobu, O., Synthesis 1981, 1), используя трифенилфосфин и диалкилазодикарбоксилат, такой как диизопропилазодикарбоксилат, в растворителе, таком как тетрагидрофуран.
Подходящие защитные группы для функциональных групп, которые временно защищены в процессе синтеза, хорошо известны в данной области, например, из Wuts, P. G. M. и Greene, T. W.: Protective Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999.

Соединения формулы II могут быть получены конденсацией соединения формулы III, где значения R1-R4 и Q такие же, как описаны ранее, и M представляет собой карбоновую кислоту или ее активированное производное, такое как карбоновый эфир или карбоновый галогенангидрид, предпочтительно хлорид или бромид, или M представляет собой сульфонилгалогенид, такой как фторид, хлорид или бромид, с соединением формулы IV, где значения R5-R7 и A такие же, как описаны ранее.
Когда M представляет собой карбоновую кислоту, реакция конденсации, то есть ацилирование, может осуществляться с помощью связывающего реагента, такого как, например, карбонилдиимидазол, дициклогексилкарбодиимид и тому подобное, в растворителе, таком как диметилформамид или дихлорметан.
Когда M представляет собой галогенид карбоновой кислоты или сульфонилгалогенид, конденсация с производным амина IV может проводиться в присутствии основания, например триэтиламина, в растворителе, таком как метиленхлорид.
Когда M представляет собой производное сложного эфира карбоновой кислоты, конденсация с производным амина формулы IV может непосредственно проводиться при пониженной температуре, например при около 50-200°C. Данная конденсация также может проводиться с использованием кислоты Льюиса, например трихлорида алюминия, как описано D. R. Barn et al (Biorg. Med. Chem. Lett., 1999, 9, 1329-34).
Получение соединений формулы I может осуществляться способами, описанными выше, используя двухстадийный процесс с одной загрузкой, что означает, что соединение формулы II, образующееся при реакции конденсации соединения формулы III и соединения формулы IV, не выделяют из реакционной смеси, а в дальнейшем обрабатывают основанием с получением соединений формулы I.

Формула V
Соединения формулы II могут также быть получены в результате взаимодействия соединения формулы V, где R1-R5, X и A такие, как определено выше, и T представляет собой водород,
C(1-4)алкил или алкилокси, с реагентом на основе
C(1-4 )алкилметалла, например, реагентом Гриньяра, в растворителе, таком как тетрагидрофуран.
Соединение формулы II, где R6 представляет собой водород и R7 представляет собой C(1-4)алкильную группу, может быть получено из соединения формулы V, где T представляет собой C(1-4 )алкильную группу, путем восстановления, например, боргидридом натрия, в растворителе, таком как этанол.
Соединение формулы V, где X представляет собой CO и T представляет собой алкилоксигруппу, может быть получено из соединения формулы III, где M представляет собой хлорангидрид карбоновой кислоты и алканоламинимин, полученный из алкилгликолята, как описано D. E. Thurston et al (J. Chem. Soc., Chem. Commun., 1990, 874-876).
Соединение формулы V может быть получено реакцией присоединения формулы III, где значения R1-R4, M и Q такие же, как описаны выше, и соединения формулы VI, где значения R5, A и T такие же, как описаны выше, используя способы, описанные выше, для присоединения соединений формулы III и IV.

Формула VI
Соединения формулы III, IV и VI могут быть получены из коммерческих источников с помощью описанных в литературе способов или модифицированных способов, описанных в литературе, известных специалистам в данной области.
Специалисту в данной области также понятно, что различные соединения формулы I могут быть получены путем преобразования функциональных групп, соответствующих определенным заместителям R1-R4.
Например, взаимодействием (C1-4)алкилового спирта с соединением формулы I, где значения X, A и R5-R7 такие же, как описаны выше, и где один из R1 -R4 является удаляемой группой, такой как фтор или хлор, но ими не ограничиваясь, в присутствии основания, такого как гидрид натрия, с получением соединений формулы I, где один из R1-R4 является (C1-4)алкилокси.
Соединения формулы I, где один или несколько R1-R4 представляют собой CONR8R9, могут быть получены преобразованием соединения формулы I, где один или несколько R1-R4 представляют собой бром или йод, в соответствующие сложные эфиры карбоновой кислоты, используя палладий (II), например дихлорбис(трифенилфосфин)палладия, катализирующий реакцию карбонилирования, как описано A. Schoenberg et al (J. Org. Chem. 1974, 39, 3318). Омыление сложных эфиров карбоновой кислоты, используя, например, гидроксид натрия в тетрагидрофуране/воде, и связывание карбоновой кислоты и амина формулы NHR8R9, используя в качестве связывающего агента, например, карбонилдимидазол, дает соединения формулы I, где один или несколько R1-R4 представляют собой CONR8R9. Карбоновая кислота, предшествующая соединениям формулы I, где один или несколько R1 -R4 представляют собой CONR8R9, может быть получена окислением соединения формулы I, где один или несколько R1-R4 представляют собой метильную группу, используя окислитель, например триоксид хрома. Соединения формулы I, где один или несколько R1-R4 представляют собой CONR8R9, могут быть получены с помощью палладия (II), такого как дихлорбис(трифенилфосфин)палладия, который катализирует карбонилирование соединения формулы I, где один или несколько R1-R4 представляют собой бром или йод, в присутствии амино формулы NHR8R9, используя способ, описанный A. Schoenberg и R. F. Heck (J. Org. Chem. 1974, 39, 3327).
Соединение формулы I, где один или несколько R1-R4 представляют собой CN, может быть получено из соединения формулы I, где один или несколько R1-R4 представляют собой CONH2, путем дегидрирования с помощью дегидрирующего агента, например оксихлорида фосфора. Соединение формулы I, где один или несколько R1-R4 представляют собой CN, могут быть получены из соединения формулы I, где один или несколько R1-R4 представляет собой бром или йод, используя палладий (0), который катализирует реакцию цианизации, как описано M. Alterman и A. Hallberg (J. Org. Chem. 2000, 65, 7984).
Соединение формулы I, где один или несколько R1-R4 представляют собой NR8R9, может быть получено из соединения формулы I, где один или несколько R1-R4 представляют собой фтор или хлор, путем замещения галогена на амин формулы NHR8R9. Соединение формулы I, где один или несколько R1-R4 представляют собой NR8R9, могут быть получены из соединения формулы I, где один или несколько R1-R4 представляют собой хлор, бром или йод, путем реакции аминирования, которая катализируется палладием, с амином формулы NHR5R9, как описано J. P. Wolfe et al (J. Org. Chem. 2000, 65, 1158). Соединение формулы I, где один или несколько R1-R4 представляют собой NR8R9, и один из R8 или R9 представляет собой водород, может быть получено из соединения формулы I, где один или несколько R1-R4 представляют собой NR8R9 и оба R8 и R9 представляют собой H, путем алкилирования атома азота вместе с алкилирующим агентом формулы R9Y, где Y представляет собой удаляемую группу, такую как алкил или арилсульфонат, хлор, бром или йод. Соединение формулы I, где один или несколько R1-R4 представляют собой NR8R9 и оба R8 и R9 представляют собой H, может быть получено из соединения формулы I, где один или несколько R1-R4 представляют собой нитро, путем восстановления, например восстановлением, которое катализируется палладием, с водородом. Соединение формулы I, где один или несколько R1-R4 представляют собой NR8COR10, могут быть получены из соединения формулы I, где один или несколько R1-R4 представляют собой NHR8 путем обработки ацилирующим агентом, таким как C(1-5)хлорангидрид или ангидрид, например уксусный ангидрид, в растворителе, таком как пиридин.
Обработка соединения формулы I, где A представляет собой остаток 4-7-членного насыщенного гетероциклического кольца, замещенного 1-3 гидроксигруппами, с помощью основания, такого как гидрид натрия, в растворителе, таком как тетрагидрофуран, с помощью алкилирующего агента формулы C(1-4)алкилY, где Y такой, как описано выше, дает соединение формулы I, где A представляет собой остаток 4-7-членного насыщенного гетероциклического кольца, необязательно замещенного 1-3 алкилоксигруппами.
В соединении формулы I, где A представляет собой осадок 4-7-членного насыщенного гетероциклического кольца, замещенного 1-3 гидроксигруппами, гидроксигруппа(ы) могут быть замещены галогеном путем обработки галогенирующим агентом, таким как трифторид (диэтиламино)серы (DAST) или сочетанием тетрагалогенид углерода-трифенилфосфин.
Сходным образом, соединение формулы I, где A представляет собой остаток 4-7-членного насыщенного гетероциклического кольца, необязательно замещенного 2 группами галогена того же атома углерода, может быть получено из соответствующего оксопроизводного обработкой галогенирующим агентом, таким как DAST.
Окисление соединения формулы I, где A представляет собой остаток 4-7-членного насыщенного гетероциклического кольца, необязательно замещенного 1-3 гидроксигруппами, окислительным агентом, таким, как используется в окислении по Сверну (Swern), как описано R. E. Ireland и D. W. Norbeck (J. Org. Chem. 1985, 50, 2198-2200), дает соединения формулы I, где A представляет собой остаток 4-7-членного насыщенного гетероциклического кольца, необязательно замещенного 1-3 оксогруппами.
Производные бензоксазепина формулы I и их соли содержат, по крайней мере, один центр хиральности и поэтому существуют в виде стереоизомеров, включая энантиомеры, и, если приемлемо, диастереомеры. В рамках настоящего изобретения находятся вышеуказанные стереоизомеры и каждый отдельный энатиомер R и S соединения формулы I и его солей, по существу свободные, то есть связанные с менее 5%, предпочтительно менее 2%, в частности, менее 1% каждого энантиомера, и смеси таких энантиомеров в любых пропорциях, включая рацемические смеси, содержащие по существу равные количества двух энантиомеров. Способы ассиметрического синтеза, с помощью которых получают чистые стереоизомеры, хорошо известны в данной области, например, синтез с хиральной индукцией или с использованием исходных хиральных промежуточных продуктов, энантиоселективные энзиматические преобразования, разделение стереоизомеров или энантиомеров, используя хроматографию на хиральной основе. Такие способы описаны, например, в Chirality in Industry (опубликовано A. N. Collins, G. N. Sheldrake and J. Crosby, 1992; John Wiley). Характерными способами, применимыми для стереоселективного получения производных бензоксазепинов по данному изобретению, являются способы, описанные Schultz, A. G. et al. (J. Am. Chem Soc. 1988, 110, 7828-7841).
Фармацевтически приемлемые соли могут быть получены обработкой свободного основания соединения формулы I с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота и серная кислота, или с органической кислотой, такой как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и тому подобное.
Соединения по данному изобретению могут существовать в несальватированных, а также в сальватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. Вообще, для целей настоящего изобретения рассматриваемые сальватированные формы эквиваленты несальватированным формам.
Настоящее изобретение, кроме того, относится к фармацевтическим композициям, содержащим производное бензоксазепина общей формулы I, или его фармацевтически приемлемую соль, в смеси с фармацевтически приемлемыми вспомогательными, и, необязательно, другими терапевтическими агентами. Под термином «приемлемые» понимают совместимость с другими ингредиентами композиции и безвредность их для пациента. Композиции включают в себя формы, подходящие для перорального, подъязычного, подкожного, внутривенного, внутримышечного, местного или ректального введения, и тому подобное, все в единичных лекарственных формах для введения.
Для перорального введения, активные вещества могут быть представлены в виде стандартных лекарственных форм, таких как таблетки, капсулы, порошки, гранулы, растворы, суспензии и тому подобное. Для парентерального введения, фармацевтическая композиция по данному изобретению может быть помещена в контейнеры, содержащие разовую или дробную дозу, например, инъекционная жидкость в заранее определенном количестве, например, в герметичных пузырьках и ампулах, и также может храниться в виде высушенного сушкой (лиофилизированного) продукта, к которому требуется добавить только стерильный жидкий носитель, например воду, перед использованием.
Смешанный с такими фармацевтически приемлемыми вспомогательными веществами, например, как описано в основной ссылке, Gennaro, A. R. et al., Remington: The Science и Practice of Pharmacy (20-е издание, Lippincott Williams & Wilkins, 2000, особенно смотри часть 5: Pharmaceutical Manufacturing), активный агент может быть спрессован в виде твердых стандартных лекарственных форм, таких как пилюли, таблетки, или преобразован в капсулы или суппозитории. С помощью фармацевтически приемлемых жидкостей активный агент может применяться в виде жидкой композиции, например в виде инъекционного препарата, в виде раствора, суспензии, эмульсии или спрея, например назального спрея.
Для получения твердых дозированных стандартных лекарственных форм рассматривается использование обычных добавок, таких как наполнители, красители, полимерные связывающие агенты и тому подобные. Вообще, может использоваться любая фармацевтически приемлемая добавка, которая не влияет на функцию активных соединений. Подходящие носители, вместе с которыми могут вводиться активные агенты по данному изобретению в виде твердых композиций, включают в себя лактозу, крахмал, производные целлюлозы и тому подобное или их смеси, используя подходящие количества. Для парентерального введения могут использоваться водные суспензии, изотонические солевые растворы и стерильные растворы для инъекций, содержащие фармацевтически приемлемые диспергирующие агенты и/или смачивающие агенты, такие как пропиленгликоль или бутиленгликоль.
Данное изобретение, кроме того, относится к фармацевтической композиции, описанной выше, в сочетании с упаковочными материалами, подходящими для указанной композиции, указанный упаковочный материал включает в себя инструкции по применению композиции для использования, описанного выше.
Бензоксазепины по данному изобретению являются стимуляторами рецептора AMPA, что может быть определено по увеличению устойчивого состояния потока, вызванного применением глутамата в обычном способе фиксации потенциала целой клетки в присутствии бензоксазепина (смотри пример 30 и таблицу I). Соединения могут использоваться для лечения неврологических и психических заболеваний, для которых необходимо увеличение синаптических ответов, опосредованных рецепторами AMPA, таких как нейродегенеративные расстройства, когнитивные дисфункции или дисфункции памяти, нарушение запоминания и обучения, такие, которые могут быть результатом возрастных изменений, расстройства памяти, травмы, инсульта, эпилепсии, болезни Альцгеймера, депрессии, шизофрении, психических расстройств, тревожного состояния, сексуальных дисфункций, аутизма или расстройств или заболеваний в результате действия невротических агентов или токсикомании, и алкогольной интоксикации.
Соединения по данному изобретению могут вводиться людям в дозе 0,001-50 мг на кг веса тела, предпочтительно в дозе 0,1-20 мг на кг веса тела.
Данное изобретение проиллюстрировано следующими примерами.
Пример 1
(R)-7-Фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он
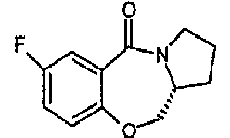
В раствор 2,5-дифторбензойной кислоты (1,0 г; 6,325 ммоль) в диметилформамиде (5 мл) добавляли 1,1'-карбонилдиимидазол (1,07 г; 6,64 ммоль) и раствор перемешивали при комнатной температуре в течение 1 часа, затем добавляли (R)-(-)-2-пирролидинметанол (0,655 мл; 6,64 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего осторожно добавляли 60% гидрид натрия в минеральном масле (0,507 г; 12,7 ммоль) и смесь нагревали до 120°C в течение 2 часов. Реакционную смесь осторожно разбавляли водой и экстрагировали этилацетатом и органический слой промывали водой, затем сушили (Na2SO4) и упаривали с получением сырого продукта. Растирание в порошок с эфиром и фильтрация давали указанное в заголовке соединение (0,29 г).
Т.пл.: 85-86°C; EIMS: m/z=222,2 [M+H]+
Пример 2
(S)-7-Фтор-2,3,11,11a-тетрагидро-1H, 5H-пирроло[2,1-c][1, 4]бензоксазепин-5-он

Пример 3
Способ, описанный в примере 1, в дальнейшем использовали для получения нижеследующих соединений:
3A: (R)-9-Фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 2,3-дифторбензойной кислоты и (R)-(-)-2-пирролидинметанола. Т.пл.: 94-95°C; EIMS: m/z=222,1 [M+H]+
3B: (S)-9-Фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 2, 3-дифторбензойной кислоты и (S)-(+)-2-пирролидинметанола. Т.пл.: 92-93°C; EIMS: m/z=222,2 [M+H]+
3C: (R)-8-Трифторметил-2,3,11,11a-тетрагидро-1H, 5H-пирроло[2,1-c][1, 4]бензоксазепин-5-он получали из 2-фтор-4-трифторметилбензойной кислоты и (R)-(-)-2-пирролидинметанола. Т.пл.: 92-94°C; EIMS: m/z=272,2 [M+H]+
3D: (S)-8-Трифторметил-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 2-фтор-4-трифторметилбензойной кислоты и (S)-(+)-2-пирролидинметанола. Т.пл.: 95-96°C; EIMS: m/z=272,1 [M+H]+
3E: (R)-6-Фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 2,6-дифторбензойной кислоты и (R)-(-)-2-пирролидинметанола. Т.пл.: 146-148°C; EIMS: m/z=222,2 [M+H]+
3F: (S)-8-хлор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 2,4-дихлорбензойной кислоты и (S)-(+)-2-пирролидинметанола. Т.пл.: 105-106°C; EIMS: m/z=238,2 [M+H]+
3G: (S)-7-хлор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 2, 5-дихлорбензойной кислоты и (S)-(+)-2-пирролидинметанола. Т.пл.: 124-126°C; EIMS: m/z=238 [M+H]+
3H: (±)-3-Фтор-6,6a,7,8,9,10-гексагидро-12H-пиридо[2,1-c][1, 4]бензоксазепин-12-он получали из 2,5-дифторбензойной кислоты и 2-пиперидинметанола и выделяли в виде смолистого продукта. EIMS: m/z=236 [M+H]+
3I: (R)-7-Бром-2,3,11, 11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 5-бром-2-хлорбензойной кислоты и (R)-(-)-2-пирролидинметанола. Т.п.: 115-116°C; EIMS: m/z=284 [M+H]+
3J: (S)-7-Бром-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 5-бром-2-хлорбензойной кислоты и (S)-(+)-2-пирролидинметанола. Т.пл.: 115-116°C; EIMS: m/z=284 [M+H]+
3K: (R)-7-Нитро-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 5-нитро-2-хлорбензойной кислоты и (R)-(-)-2-пирролидинметанола. Т.пл.: 169-170°C; EIMS: m/z=249 [M+H]+
3L: (S)-7-Нитро-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из 5-нитро-2-хлорбензойной кислоты и (S)-(+)-2-пирролидинметанола. Т.пл.: 170-171°C; EIMS: m/z=249 [M+H]+
Пример 4
(R)-8-хлор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1, 4]бензоксазепин-5-он
К раствору 2,4-дихлорбензойной кислоты (1,21 г; 6,325 ммоль) в диметилформамиде (5 мл) добавляли 1,1'-карбонилдиимидазол (1,07 г; 6,64 ммоль) и раствор перемешивали при комнатной температуре в течение 1 часа перед добавлением (R)-(-)-2-пирролидинметанола (0,655 мл; 6,64 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем растворитель удаляли в вакууме и остаток очищали хроматографией на силикагеле (элюируя 5% метанолом в дихлорметане) с получением промежуточного амида, который не характеризовали, а непосредственно использовали в следующей стадии. К раствору этого амида (0,6 г) в диметилформамиде добавляли карбонат цезия (1,5 г). Смесь нагревали при 150°C в течение 2 часов, затем охлаждали до комнатной температуры. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали водой и сушили (Na2SO4). Растворитель упаривали и удаляли. Сырой продукт очищали хроматографией на силикагеле (элюируя 5% метанолом в дихлорметане). Полученное прозрачное масло кристаллизовали отстаиванием и растирали в порошок с гептаном. Фильтрация давала указанное в заголовке соединение (0,22 г). Т.пл.: 92-94°C; EIMS: m/z=238,1 [M+H]+
Пример 5
Способ, описанный в примере 4, в дальнейшем использовали для получения: (S)-8-фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-она из 2,4-дифторбензойной кислоты и (S)-(+)-2-пирролидинметанола. Т.пл.: 75-76° C; EIMS: m/z=222,2 [M+H]+
Пример 6
(±)-3-Трифторметил-6,6a,7,8,9,10-гексагидро-12H-пиридо[2,1-c][1,4]бензоксазепин-12-он
К раствору 2-фтор-4-(трифторметил)бензойной кислоты (1,31 г; 6,325 ммоль) в диметилформамиде (5 мл) добавляли 1,1'-карбонилдиимидазол (1,08 г; 6,64 ммоль) и раствор перемешивали при комнатной температуре в течение 1 часа, затем добавляли 2-пиперидинметанол (0,765 г; 6,64 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем добавляли карбонат цезия (4,12 г) и смесь нагревали до 120°C в течение 4 часов. Разбавленный водой продукт экстрагировали этилацетатом и промывали водой. Органический слой сушили (Na2SO4), и упаривание растворителя в вакууме давало сырой продукт, который кристаллизовали из 5% эфира в гептане с получением указанного в заголовке соединения (0,83 г). Т.пл.: 103-104°C; EIMS: m/z=286 [M+H]+
Пример 7
Способ, описанный в примере 6, в дальнейшем использовали для получения нижеследующих соединений:
7A: (±)-4-фтор-6,6a,7,8,9, 10-гексагидро-12Н-пиридо[2,1-c][1,4]бензоксазепин-12-он получали из 2,3-дифторбензойной кислоты и 2-пиперидинметанола в виде смолы. EIMS: m/z=235,8 [M+H]+
7B: (+)-3-Фтор-6, 6a,7,8,9,10-гексагидро-12H-пиридо[2,1-с][1,4]бензоксазепин-12-он получали из 2,4-дифторбензойной кислоты и 2-пиперидинметанола в виде смолы. EIMS: m/z=236,2 [M+H]+
7C: (±)-1-Фтор-6,6a,7,8,9,10-гексагидро-12H-пиридо[2,1-с][1,4]бензоксазепин-12-он получали из 2,6-дифторбензойной кислоты и 2-пиперидинметанола. Т.пл. 133-134°C; EIMS: m/z=236,2 [M+H]+
Пример 8
(S)-9-Хлор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он
К раствору хлорид 3-хлор-2-фторбензоила (2,2 г; 11,4 ммоль) в диметилформамиде (5 мл) добавляли триэтиламин (1,7 мл; 11,7 ммоль) и (S)-(+)-2-пирролидинметанол (1,13 мл; 11,4 ммоль). Смесь перемешивали в течение 1 часа, затем добавляли карбонат цезия (7, 4 г; 22,7 ммоль) и реакционную смесь нагревали при 120°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры, затем разбавляли водой и экстрагировали этилацетатом. Органические вещества промывали водой, упаривали и сушили (Na2SO4) в вакууме. Сырой продукт очищали с помощью хроматографии на силикагеле (элюируя 5% метанолом в дихлорметане). При удалении растворителя чистый амид кристаллизовался и после добавления гептана/эфира собирали указанное в заголовке соединение (0,26 г). Т.пл. 89-90°C; EIMS: m/z=238 [M+H]+
Пример 9
Способ, описанный в примере 8, в дальнейшем использовали для получения нижеследующих соединений:
9A: (S)-6-Фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2, 1-c][1,4]бензоксазепин-5-он получали из хлорида 2,6-дифторбензоила и (S)-(+)-2-пирролидинметанола. Т.пл. 149-150°C; EIMS: m/z=222,2 [M+H]+
9B: (S)-6-Хлор-2,3,11, 11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из хлорида 2,6-дихлорбензоила и (S)-(+)-2-пирролидинметанола. Т.пл. 113-115°C; EIMS: m/z=238,2 [M+H]+
9C: (S)-6-Трифторметил-2,3,11,11a-тетрагидро-1Н,5Н-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из хлорида 2-фтор-6-трифторметилбензоила и (S)-(+)-2-пирролидинметанола. Т.пл. 175-176°C; EIMS: m/z=272,2 [M+H]+
9D: (S)-7-Трифторметил-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали из хлорида 2-фтор-5-трифторметилбензоила и (S)-(+)-2-пирролидинметанола. Т.пл. 120-121°C; EIMS: m/z=272,4 [M+H]+
9E: (S)-8,9-Дифторметил-2,3,11,11a-тетрагидро-1Н,5Н-[2,1-c][1, 4]бензоксазепин-5-он получали из 2,3,4-трифторбензойной кислоты и (S)-(+)-2-пирролидинметанола. Т.пл. 142-143°C; EIMS: m/z=272,2 [M+H]+
Пример 10
(S)-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][5,1,4]бензтиаоксазепин-5-диоксид
К раствору хлорида 2-фторбензолсульфонила (1,7 г; 8,8 ммоль) в метиленхлориде (50 мл) добавляли триэтиламин (1,8 мл; 12,9 ммоль) и (S)-(+)-2-пирролидинметанол (1,07 мл; 10,7 ммоль). Смесь перемешивали в течение 7 часов, затем разбавляли метиленхлоридом, и промывали 2M хлористоводородной кислотой, и органический слой сушили (Na2SO4). Упаривание растворителя давало сырой сульфонамид, который переносили в 100 мл диметилформамида и добавляли 1,0 г 60% гидрида натрия в минеральном масле. Смесь перемешивали в течение ночи, и последующее упаривание растворителя, и обработка водой, и затем очищение хроматографией на силикагеле (элюируя этилацетатом) давало указанное в заголовке соединение в виде смолы;1H ЯМР (400 мГц; CDCl3) δ 1,93-2,00 (м, 3H), 2,20-2,27 (м, 1H), 3,05-3,09 (м, 1H), 3,58-3,63 (м, 1H), 3,94 (дд, 1H), 4,18-4, 21 (м, 1H), 4,76 (дд, 1H), 7,09 (дд, 1H), 7,19 (дд, 1H), 7,43 (дд, 1H), 7,84 (дд, 1H); EIMS: m/z=240 [M+H]+
Пример 11
(S)-8-Метокси-2,3,11,11a-тетрагидро-1Н, 5Н-пирроло[2, 1-c][1,4]бензоксазепин-5-он
Раствор (S)-8-фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-она (0,5 г; 2,14 ммоль), полученного, как описано в примере 5A, и метоксида натрия (0,244 г; 4,52 ммоль) в диметилформамиде (2 мл) нагревали при 110°C в течение 3 часов. Реакционную смесь разбавляли водой и экстрагировали этилацетатом и органический слой промывали водой, затем сушили (Na2SO4) и упаривали в вакууме. Сырой продукт очищали хроматографией на силикагеле (элюируя 5% метанолом в дихлорметане) с получением указанного в заголовке продукта. Т.пл. 104-106°C; EIMS: m/z=234 [M+H]+
Пример 12
Гидрохлоридная соль (S)-8-(1-пирроло)-2,3,11,11a-тетрагидро-1Н, 5Н-порроло[2,1-c][1, 4]бензоксазепин-5-она
Раствор (S)-8-фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-она (0,5 г; 2,14 ммоль), полученного, как описано в примере 5A, в пирролидине (1 мл) нагревали с обратным холодильником в течение 4 часов. Реакционную смесь разбавляли водой, и экстрагировали этилацетатом, и промывали водой, затем сушили (Na2SO4) и упаривали в вакууме. Сырой продукт очищали с помощью хроматографии на силикагеле (элюируя 5% метанолом в дихлорметане) и затем кристаллизовали из 5% дихлорметана в эфире. Чистый продукт растворяли в дихлорметане и преобразовывали в гидрохлоридную соль с HCl в эфире, затем добавляли эфир к осадку указанного в заголовке продукта (0,18 г). Т.пл.169-176°C; EIMS: m/z=273 [M+H]+
Пример 13
(S)-7-амино-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-с][1,4]бензоксазепин-5-он
Раствор (S)-7-нитро-2,3,11,11a-тетрагидро-1H, 5H-пирроло[2,1-c][1, 4]бензоксазепин-5-она (7,4 г), полученного, как описано в примере 3L, в этаноле (100 мл) и метаноле (50 мл) гидрировали над 10% палладием на активированном угле при давлении водорода, равном 2 бар, до прекращения поглощения водорода. Смесь фильтровали до удаления катализатора и упаривали досуха в вакууме. Сырой продукт пропускали через короткую колонку с силикагелем (элюируя 10% метанолом в дихлорметане) с получением указанного в заголовке продукта (6,1 г). EIMS: m/z=219 [M+H]+
Пример 14
(S)-N-(2,3,11, 11a-тетрагидро-5-оксо-1Н,5Н-[2,1-a][1, 4]бензоксазепин-7-ил)ацетамид

Раствор вещества примера 13 (2,29 ммоль) и уксусного ангидрида (0,237 мл; 2,5 ммоль) в пиридине (5 мл) оставляли при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и экстрагировали в этилацетат, промывали водой, затем сушили (Na2SO4) и упаривали в вакууме. Сырой продукт кристаллизовали из 5% дихлорметана в гептане с получением указанного в заголовке продукта (140 мг). Т.пл. 185-187°C; EIMS: m/z=261 [M+H]+
Пример 15
(S)-7-(Пиперидинокарбонил)-2,3,11,11a-тетрагидро-1Н,5Н-пирроло[2,1-с][1, 4]бензоксазепин-5-он

Раствор (S)-7-бром-2,3,11,11a-тетрагидро-1H,5H-пирроло[2, 1-c][1,4]бензоксазепин-5-она (0,56 г; 2 ммоль), полученного, как описано в примере 3J, вместе с пиперидином (2 мл) и дихлорбис(трифенилфосфин)палладием (II) (63 мг) нагревали при 110°C в атмосфере угарного газа в течение ночи. Упаривание, разделение осадка между водой и дихлорметаном и упаривание органического слоя с последующей очисткой с помощью хроматографии, элюируя 5% метанолом в дихлорметане, и кристаллизация из этилацетат/петролейного эфира давала 400 мг указанного в заголовке продукта. Т.пл. 140-140,5°C; EIMS: m/z=315 [M+H]+
Пример 16
Способ, описанный в примере 15, далее использовали для получения следующих соединений:
16A: (S)-7-(морфолинокарбонил)-2,3,11,11a-тетрагидро-1Н,5Н-пирроло[2,1-с][1, 4]-бензоксазепин-5-он
Указанное в заголовке соединение получали, используя в качестве реагента морфолин вместо пиперидина. Т.пл. 158-161°C; EIMS: m/z=317 [M+H]+
16B: Гидрохлоридная соль (S)-7-(N-этилпиперазинокарбонил)-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-с]-[1,4]бензоксазепин-5-она
Указанное в заголовке соединение получали, используя в качестве реагента N-этилпиперазин вместо пиперидина, и выделяли как гидрохлоридную соль путем кристаллизации из ацетон-эфира. Т.пл. >200°C; EIMS: m/z=344 [M+H]+
Пример 17
17A: (S)-7-(аминокарбонил)-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он
К раствору (S)-7-бром-2,3,11,11a-тетрагидро-1H, 5H-пирроло[2,1-c][1, 4]бензоксазепин-5-она (5 г; 17,76 ммоль), полученному, как описано в примере 3J, в диметилсульфоксиде (80 мл), добавляли ацетат палладия (225 мг; 1 ммоль), 1, 3-бис(дифенилфосфино)пропан (413 мг; 1 ммоль), триэтиламин (5 мл; 36 ммоль) и метанол (4 мл). После перемешивания в атмосфере аргона до растворения всех твердых продуктов реакционную смесь в сосуде несколько раз очищали угарным газом и сосуд помещали в атмосферу угарного газа (баллон). Смесь затем нагревали при 100°C и перемешивали в течение ночи. Добавляли дополнительные порции ацетата палладия (0,50 ммоль) и 1, 3-би(дифенилфосфино)пропана (0,50 ммоль) и смесь перемешивали при 100°C в течение еще 6 часов. После добавления охлажденной воды (200 мл) водный раствор экстрагировали тремя 75 мл-овыми порциями этилацетата. Объединенные экстракты сушили (Na2SO4) и растворитель упаривали при пониженном давлении. Полученное коричневое масло очищали колоночной хроматографией, элюируя этилацетатом. Дополнительное очищение путем перекристаллизации из диэтилового эфира давало метил (S)-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1, 4]бензоксазепин-5-он-7-карбоксилат (3,13 г) в виде белого кристаллического твердого продукта.
К раствору этого метилового эфира (2,54 г; 9,73 ммоль) в метаноле (40 мл) добавляли 4M гидроксида натрия (12 мл). Смесь нагревали при кипячении с обратным холодильником в течение 1,5 часов и затем оставляли охлаждаться до комнатной температуры. Метанол упаривали при пониженном давлении и водный раствор подкисляли водным 1M HCl. Полученный осадок отфильтровывали и сушили в вакууме с получением (S)-2,3,11,11а-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он-7-карбоновой кислоты (2,39 г) в виде белого твердого продукта.
Раствор вышеуказанного производного карбоновой кислоты (2,38 г; 9,64 ммоль) в тионилхлориде (10 мл) нагревали при кипячении в течение 1,5 часов. Избыток тионилхлорида упаривали при пониженном давлении с получением хлорида (S)-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он-7-карбоновой кислоты (2,56 г) в виде светло-желтого твердого продукта.
Раствор хлорангидрида (1,02 г; 3,85 ммоль) в дихлорметане (8 мл) добавляли в перемешанный 38% водный раствор аммония (5 мл). После перемешивания в течение 20 минут дихлорметан удаляли при пониженном давлении. Образовавшийся белый осадок собирали фильтрацией и сушили в вакууме с получением указанного в заголовке соединения (886 мг) в виде белого твердого продукта. Т.пл.: 287-290° C; EIMS: m/z=247,4 [M+H]+
17B: (R)-7-(Аминокарбонил)-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он получали в соответствии со способом примера 18A, используя в качестве исходного продукта продукт, полученный в примере 3I. Т.пл.: 290-295°C, EIMS: m/z=247,2 [M+H]+
Пример 18
(R)-7-(метиламинокарбонил)-2,3,11, 11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он
Раствор хлорида (R)-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1, 4]бензоксазепин-5-он-7-карбоновой кислоты (0,330 г; 1,24 ммоль), полученный, как описано в примере 17A, используя в качестве исходного продукта продукт, полученный в примере 3l, в дихлорметане (3 мл) по каплям добавляли в перемешанный 10% раствор метиламина в тетрагидрофуране. Смесь перемешивали при комнатной температуре в течение еще 1 часа и затем упаривали досуха при пониженном давлении. Остаток помещали в дихлорметан (20 мл) и промывали 0,5M HCl (2×20 мл). Слой дихлорметана сушили (MgSO4) и растворитель упаривали при пониженном давлении. Перекристаллизация сырого продукта из этилацетата/диэтилового эфира давала указанное в заголовке соединение (0,262 г) в виде белого твердого продукта. Т.пл.: 186-189°C; EIMS: m/z=261,0 [M+H]+
Пример 19
(R)-7-Циано-2,3,11, 11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он
К перемешанному раствору вещества, полученному в примере 17B (1,57 ммоль), в диметилформамиде (5 мл) в атмосфере азота добавляли оксихлорид фосфора (731 мкл; 7,85 ммоль). Смесь перемешивали в течение 0,5 часов при 80°C. После добавления охлажденной воды (20 мл) и перемешивания образовывался белый осадок. Осадок собирали фильтрацией, промывали водой и сушили в вакууме с получением указанного в заголовке соединения (261 мг). Т.пл.: 164-165°C; EIMS: m/z=229,0 [M+H]+
Пример 20
20A: (11R, 11aS)-11-Этил-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он
К 2-хлорбензойной кислоте (10 г; 63,9 ммоль) в диметилформамиде (100 мл) в атмосфере азота добавляли карбонилдиимидазол (10,9 г; 67,1 ммоль) и раствор перемешивали в течение 1 часа при комнатной температуре. Добавляли (S)-(+)-2-пирролидинметанол (7,56 мл, 76,6 ммоль) и смесь перемешивали при 40°C в течение 18 часов. Растворитель удаляли при пониженном давлении и сырой продукт очищали хроматографией на силикагеле (элюируя 50%-75% этилацетатом в гептане) с получением (S)-1-(2-хлорбензоил)-2-пирролидинметанола (10,2 г), который непосредственно использовали в следующей стадии.
Тетрагидрофуран (24 мл) охлаждали до -60°C при перемешивании и добавляли оксалилхлорид (1,15 мл, 13,2 ммоль). Затем по каплям добавляли диметилсульфоксид (0,98 мл, 13,8 ммоль). Смесь перемешивали в течение 20 минут, затем раствор 1-(2-хлорбензоил)-2-пирролидинметанола (3,0 г, 12,5 ммоль) в тетрагидрофуране (24 мл) по каплям добавляли в течение 15 минут. Еще через 15 минут смесь обрабатывали триэтиламином (7,0 мл, 50,1 ммоль). Перед охлаждением до -78°C смесь быстро нагревали до 0°C. Бромид этилмагния (3,0 M в диэтиловом эфире; 16,7 мл, 50,1 ммоль) по каплям добавляли к энергично перемешиваемой реакционной смеси. Реакционную смесь нагревали до -40°C в течение 1 часа, снова охлаждали до -78°C и затем осторожно обрабатывали этанолом (5 мл), а затем насыщенным раствором хлорида аммония. Смесь оставляли нагреваться до комнатной температуры и затем экстрагировали этилацетатом (приблизительно 150 мл). Органический слой сушили (Na2 SO4) и концентрировали с получением сырого продукта (2S,αRS)-1-(2-хлорбензоил)-α-этил-2-пирролидинметанола в виде смеси диастереоизомеров. Сырой продукт растворяли в диметилформамиде (100 мл) в атмосфере азота. Порциями добавляли гидрид натрия (60% дисперсия в минеральном масле; 1,0 г, 25,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут и затем нагревали до 120°C в течение 5 часов, после чего температуру снижали до 80°C и перемешивали еще 16 часов. Реакционную смесь оставляли охлаждаться до комнатной температуры и затем гасили метанолом (10 мл) и перемешивали в течение 10 минут. Растворители удаляли при пониженном давлении. Осадок помещали в воду (50 мл) и экстрагировали дихлорметаном (2× 50 мл) с получением продукта в виде сырой смеси диастереоизомеров (отношение приблизительно 30:70). Флэш-хроматография на силикагеле (элюируя от 0% до 80% этилацетатом в гептане) давала указанное в заголовке соединение (80 мг) в виде бесцветного масла;1H-ЯМР (400 МГц; CDCl3) δ 4,24 (1H, дт, J 10,5, 2,3 Гц, 11-H); EIMS: m/z=232[M+H]+
20B: (11S,11aS)-11-Этил-2,3,11,11a-тетрагидро-1H, 5H-пирроло[2,1-c][1,4]бензоксазепин-5-он
Дополнительная элюция смеси, полученной в примере 20A, давала указанное в заголовке соединение, которое перекристаллизовывали из этилацетата/гептана с получением белого кристаллического продукта. Т.пл.: 118-119°C;1H-ЯМР (400 МГц; CDCl3) δ 4,04 (1H, тд, J 9,8, 2,5Гц, 11H); EIMS: m/z=232 [M+H]+.
Пример 21
21A: (6RS,6aSR)-2-Бром-6-метил-6,6a,7,8,9,10-гексагидро-12H-пиридо[2,1-c][1,4]бензоксазепин-12-он

Указанное в заголовке соединение получали в соответствии со способом примера 20A, используя 5-бром-2-хлорбензойную кислоту, (RS)-2-пиперидинметанол и метилмагний бромид. Т.пл.: 105-106°C; EIMS: m/z=312 [M+H]+
21B: (6RS,6aRS)-2-Бром-6-метил-6,6a,7, 8,9,10-гексагидро-12H-пиридо[2, 1-c][1,4]бензоксазепин-12-он
Этот энантиомер получали дополнительной элюцией смеси, полученной из примера 21A, с выходом небольшого количества продукта. Т.пл.: 105-107°C; EIMS:m/z=312 [M+H]+.
Пример 22
6,6a-Дигидро-12H-морфолино[3,4-c][1,4]бензоксазепин-12-он

Раствор морфолин-3-карбоновой кислоты (4,035 г; 30,8 ммоль) в этаноле (250 мл) насыщали газообразным HCl, затем перемешивали в течение недели. Растворитель упаривали и осадок помещали в воду и подщелачивали (pH ˜ 10) с помощью гидрокарбоната натрия и карбоната натрия. Смесь затем экстрагировали дихлорметаном (7×), объединенные экстракты сушили (Na2SO4) и растворитель упаривали с получением этилморфолин-3-карбоксилата (746 мг). EIMS: m/z=160,4 [M+H]+. Это производное сложного эфира и алюмогидрид лития (1M в ТГФ, 9,4 мл, 9,4 ммоль) осторожно объединяли в атмосфере азота и после добавления кипятили с обратным холодильником. Через 5 часов реакционную смесь охлаждали до комнатной температуры и осторожно гасили, по каплям добавляя воду, охлажденную на льду, затем фильтровали и промывали дихлорметаном. Раствор упаривали с получением 3-(гидроксиметил)морфолина (409 мг). EIMS: m/z=118,2 (M+H)+.
К раствору 3-(гидроксиметил)морфолина (345 мг; 2,95 ммоль) в дихлорметане (10 мл) осторожно добавляли 2-фторбензоилхлорид (0,35 мл; 2,95 ммоль) и триэтиламин (0,62 мл; 4,42 ммоль) и реакционную смесь перемешивали в течение 0,5 часов. Продукт объединяли с 4н. NaOH (10 мл), и гидролизовали любым сложным эфиром, и органический слой экстрагировали (дихлорметан, 3×). Объединенные органические слои сушили (Na2SO4) и растворитель упаривали с получением масла, которое очищали флэш-хроматографией на колонке с силикагелем (градиент элюирования, дихлорметан-метанол от 1:0 до 9:1) с получением 4-(2-фторбензоил)-3-(гидроксиметил)морфолина (165 мг; 0,69 ммоль), EIMS: m/z=240,2 (M+H)+. Этот продукт и карбонат цезия (0,544 г) нагревали до 120°C в растворе диметилформамида (10 мл) в атмосфере азота в течение 4 часов. Растворитель упаривали, и осадок помещали в воду, и экстрагировали дихлорметаном (3×). Комбинированные дихлорметановые экстракты сушили (Na2SO4) и растворитель упаривали с получением сырого твердого продукта, который очищали флэш-хроматографией на силикагеле, элюируя эфиром с получением указанное в заголовке соединение (77 мг). Т.пл.: 105-107°C; EIMS: m/z=220,2 (M+H)+ .
Пример 23
(S)-1,2,10, 10a-Тетрагидроазетидин[2,1-c][1,4]бензоксазепин-4-он

N-Метилморфолин (1,35 мл, 12 ммоль) добавляли в перемешанный раствор (S)-азетидин-2-карбоновой кислоты (1,08 г; 10 ммоль) и ди-трет-бутилдикарбоната (3, 03 г; 14 ммоль) в 1,4-диоксан:воде (1:1, 30 мл), охлажденный до 0° C. Систему оставляли перемешиваться в течение 18 часов при температуре, медленно поднимающейся до комнатной температуры. Добавляли раствор насыщенного бикарбоната натрия (15 мл), охлажденный до 5°C, и систему промывали этилацетатом (3×75 мл). Водную фазу затем подкисляли до pH 3, добавляя гидросульфат калия. Водную фазу затем экстрагировали этилацетатом (3×100 мл), эти органические слои объединяли, сушили (MgSO4), фильтровали и растворитель удаляли в вакууме с получением продукта (S)-N-трет-бутоксикарбонил-азетидин-2-карбоновой кислоты (2,15 г) в виде вязкого масла. EIMS: m/z=201 (M+H)+. Комплекс бор-ТГФ (1M раств., 35 мл, 35 ммоль) медленно добавляли к перемешанному раствору вышеуказанной карбоновой кислоты в сухом тетрагидрофуране, охлажденном до <5°C в атмосфере азота. Реакционную смесь оставляли перемешиваться в течение 18 часов при температуре, медленно поднимающейся до комнатной температуры. Затем по каплям добавляли 10% водный раствор гидросульфата калия (10 мл). Летучие компоненты упаривали в вакууме и оставшуюся взвесь экстрагировали этилацетатом (3×75 мл). Объединенную органическую фазу сушили (MgSO4), фильтровали и растворитель удаляли в вакууме с получением продукта (S)-N-трет-бутоксикарбонил-2-гидроксиметилазетидина в виде вязкого масла (1,48 г, 74%), m/z [M+Na]+ 210.
К перемешиваемому раствору (S)-N-трет-бутоксикарбонилазетидин-2-илметанола (1,17 г, 6,25 ммоль) в дихлорметане (8 мл), охлажденному до -5°C в атмосфере азота, добавляли трифторуксусную кислоту (5 мл). Реакционную смесь перемешивали в течение 18 часов при температуре, медленно повышающейся до комнатной. Растворитель и избыток кислоты удаляли в вакууме с получением продукта соли трифторацетата (S)-2-гидроксиметилазетидина в виде вязкого масла (1,26 г). Триэтиламин (0,61 мл, 4,38 ммоль) медленно добавляли в раствор 0,19 г соли трифторацетата (S)-2-гидроксиметилазетидина (0,94 ммоль) и 2-фторбензоилхлорида (0,16 мл, 1,30 ммоль) в дихлорметане (8 мл), охлажденный до -5°C и в атмосфере азота. Реакционную смесь перемешивали в течение 18 часов при температуре, медленно повышающейся до комнатной температуры. Добавляли воду (15 мл) и дихлорметан (20 мл) и слои разделяли. Водный слой еще раз промывали дихлорметаном (20 мл) и объединенные органические слои сушили (MgSO4), фильтровали и растворитель удаляли в вакууме. Сырок остаток очищали хроматографией на силикагеле, используя в качестве элюанта этилацетат:петролейный эфир (40/60) 1:1, с получением (S)-N-(2-фторбензоил)-2-гидроксиметилазетидина (0,15 г; 0,72 ммоль) в виде вязкого масла, EIMS: m/z=192 [(M+H)-H2O]+
Сырой продукт растворяли в сухом диметилформамиде (5 мл) и к перемешиваемому раствору добавляли безводный карбонат цезия (0,28 г, 0,87 ммоль). Температуру повышали до 110°C и реакционную смесь перемешивали в течение 18 часов. После охлаждения диметилформамид удаляли в вакууме. Затем осадок помещали в воду (20 мл) и экстрагировали дихлорметаном (2×25 мл). Объединенные органические слои сушили (MgSO4), фильтровали и растворитель удаляли в вакууме. Сырой остаток очищали хроматографией на силикагеле, используя в качестве элюанта этилацетат:петролейный эфир (40/60) 4:1, с получением продукта, указанного в заголовке (50 мг) в виде белого твердого продукта. Т.пл.: 148-149°C;1H-ЯМР (400 МГц; CDCl3) δ 2,11-2,17 (м, 2H), 2,54-2,58 (м, 2H), 4,07-4,16 (м, 1H), 4,19 (дд, 1H), 4,28-4,32 (м, 1H), 4,45 (дд, 1H), 4,65-4,79 (м, 1H), 6,97 (д, 1H), 7,05 (дд, 1H), 7,38 (ддд, 1H), 8,11 (дд, 1H); EIMS: m/z=190 [M+H]+
Пример 24
2,11,11a-Тригидро-3,3-диметилоксазолидинил[2,1-c][1,4]бензоксазепин-5-он

2-Амино-2-метил-1-пропанол (9,54 мл, 0,10 моль) добавляли к перемешанному раствору этилглиоксилата (50% раствор в толуоле, 21 мл, 0,10 моль) в дихлорметане (100 мл) в присутствии молекулярных сит размером 4Е. Реакционную смесь перемешивали в атмосфере азота в течение 16 часов, после чего систему фильтровали через Dicalite® и еще раз промывали дихлорметаном. Упаривание растворителя в вакууме давало этиловый эфир (1,1-диметил-2-гидроксиэтилимино)уксусной кислоты (17,0 г) в виде масла (EIMS: m/z=174 [M+H]+ ). К перемешанному раствору вышеописанного этилового эфира (0,87 г, 5,00 ммоль) в дихлорметане (8 мл), охлажденному до ˜5°C и в атмосфере азота, добавляли 2-фторбензоилхлорид (0,60 мл, 5, 00 ммоль) и затем пиридин (0,96 мл, 12,0 ммоль). Через 1,5 час добавляли воду (20 мл), слои разделяли и водную фазу еще раз промывали дихлорметаном (30 мл). Объединенную органическую фазу затем промывают 1 н. соляной кислоты (25 мл), затем сушили (MgSO4), фильтровали и растворитель удаляли в вакууме. Сырой остаток очищали хроматографией на силикагеле, используя в качестве элюанта дихлорметан, с получением этилового эфира 3-(2-фторбензоил)-4,4-диметилоксазолидин-2-карбоновой кислоты (0,64 г) в виде масла, EIMS: m/z=296 [M+H]+
Избыток боргидрида лития добавляли к перемешиваемому раствору этилового эфира 3-(2-фторбензоил)-4,4-диметилоксазолидин-2-карбоновой кислоты (0,47 г; 1,58 ммоль) в сухом диэтиловом эфире (5 мл). Затем добавляли сухой толуол (8 мл) и систему нагревали до 100°C. Через 2 часа диэтиловый эфир отгоняли в соответствии H. C. Brown et al (J. Org.Chem., 1982, 47(24), 4702). Через 6 часов нагревания систему оставляли охлаждаться и затем толуол удаляли в вакууме. Затем добавляли водный раствор кислоты (5 н. HCl:H2О=1:3 об/об; 8 мл) и систему перемешивали при комнатной температуре в течение 1 часа. Карбонат калия затем добавляли в насыщенный водный раствор, который затем экстрагировали диэтиловым эфиром (2×25 мл). Объединенные органические слои сушили (MgSO4), фильтровали и растворитель удаляли в вакууме. Сырой остаток очищали хроматографией на силикагеле, используя в качестве элюанта дихлорметан:метанол, 19:1. Это давало (±)-3-(2-фторбензоил)-4, 4-диметил-2-гидроксиметилоксазолидин (0,30 г) в виде вязкого масла, EIMS: m/z=254 [M+H]+
Карбонат цезия (0,60 г, 1,85 ммоль) добавляли к перемешиваемому раствору вышеописанного оксазолидина (0,31 г, 1,23 ммоль) в сухом диметилформамиде (5 мл). Реакционную смесь нагревали до 130°C и перемешивали в течение 18 часов. После охлаждения диметилформамид удаляли в вакууме, добавляли воду (10 мл) к остатку, который затем экстрагировали дихлорметаном (3×30 мл). Объединенные органические слои сушили (MgSO4), фильтровали и растворитель удаляли в вакууме. Сырой остаток очищали хроматографией на силикагеле, используя в качестве элюента петролейный эфир (40/60):этилацетат (4:1) (об/об), с получением указанного в заголовке продукта (0, 23 г) в виде белого воскообразного твердого вещества.
Т.пл.: 65,5-66,5°C;1H-ЯМР (400 МГц; CDCl3) δ 1,59 (c, 3H), 1,64 (c, 3H), 3,76 (д, 1H), 3,90 (д, 1H), 4,02 (дд, 1H), 4,54 (дд, 1H), 5,18 (дд, 1H), 6,96 (д, 1H), 7,08 (ддд, 1H), 7,36 (ддд, 1H), 8,06 (дд, 1H); EIMS: m/z=234[M+H]+
Пример 25
(2R, 11aS)-2-Гидрокси-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он

В перемешиваемую взвесь (3R,5,S)-3-гидрокси-5-гидроксиметилпирролидина (3,67 г; 23,9 ммоль) (M. W. Reed et al, J. Med.Chem., 1995, 38, 4587-4596) и диизопропилэтиламина (9,3 мл; 52,58 ммоль) в безводном дихлорметане (30 мл) в атмосфере азота по каплям добавляли 2-фторбензоилхлорид (3,8 г; 23,9 ммоль), поддерживая температуру ниже 25°C с помощью ледяной бани. Смесь оставляли перемешиваться при комнатной температуре в течение ночи и затем упаривали при пониженном давлении. Полученную смесь помещали в этилацетат (100 мл), промывали водой (2×50 мл) и сушили (Na2SO4). Растворитель упаривали при пониженном давлении и остаток очищали флэш-хроматографией, элюируя 1:9 метанолом в дихлорметане, с получением промежуточного амида (5,2 г) в виде бесцветного масла, EIMS: m/z=240,2 [M+H]+. Этот амид (21,76 ммоль) суспендировали в диметилформамиде (70 мл) и добавляли карбонат цезия (8,5 г; 26,1 ммоль) и суспензию перемешивали в атмосфере азота при 110°C в течение 16 часов. Смесь затем упаривали досуха при пониженном давлении и остаток затем помещали в 100 мл этилацетата. Раствор промывали водой (80 мл) и водный слой затем повторно экстрагировали этилацетатом (100 мл). Объединенные органические экстракты затем промывали насыщенным солевым раствором (2×50 мл) и сушили (Na2SO4). Растворитель упаривали при пониженном давлении и остаток еще раз очищали флэш-хроматографией, элюируя 7% MeOH в метиленхлориде, с получением указанного в заголовке соединения (2,2 г) в виде белого кристаллического продукта.1H-ЯМР (400 МГц; CDCl3) δ 2,75-2,87 (м, 1H), 2,02 (д, 1H), 2,2-2,30 (м, 1H), 3,857 (д, 2H), 4,03-4,07 (м, 1H), 4,24 (кв., 1H), 4,48 (д, 1H), 4, 55 (с, 1H), 6,97 (д, 1H), 7,06 (т, 1H), 7,36 (т, 1H), 8,109 (т, 1H); EIMS: m/z=220,2 [M+H]+
Пример 26
(2S,11aS)-2-Фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2, 1-c][1,4]бензоксазепин-5-он
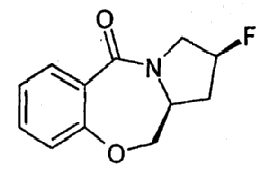
Раствор вещества, полученного в примере 25 (200 мг; 0,91 ммоль), в сухом этилацетате (10 мл) охлаждали до -50°C и по каплям добавляли трифторид(диэтиламино)серы (191 мг; 1,19 ммоль). Полученный раствор перемешивали при -50°C в течение 1 часа и затем оставляли медленно нагреваться до комнатной температуры в течение 3 часов. Смесь затем выливали в насыщенный водный раствор NaHCO3 (50 мл) и еще раз добавляли этилацетат (50 мл). После окончания перемешивания органический слой разделяли, последовательно промывали водой (50 мл) и насыщенным солевым раствором (50 мл) и сушили (Na2SO4). Растворитель упаривали при пониженном давлении и остаток очищали флэш-хроматографией с получением указанного в заголовке соединения в виде светло-желтого кристаллического твердого продукта (60 мг).1 H-ЯМР (CDCl3) δ 2,13-2,48 (м, 2H), 3,79 (кв.д, 1H), 4,09 (т, 1H), 4,25-4,35 (м, 2H), 4,43-4,49 (м, 1H), 5,333 (д, 1H), 7,04 (д, 1H), 7,15 (т, 1H), 7,41 (дд, 1H), 7,88 (дд, 1H); EIMS: m/z=222,2 [M+H]+
Пример 27
(S)-2-Оксо-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он

К перемешиваемому раствору оксалилхлорида (0,52 мл; 5,94 ммоль) в сухом дихлорметане (15 мл), охлажденному до -78°C, добавляли раствор диметилсульфоксида (0,81 мл, 11,42 ммоль) в сухом дихлорметане (2 мл). Перемешивание продолжали в течение 10 минут, затем по каплям добавляли раствор вещества (1 г), полученного в примере 25 (4,57 ммоль) в сухом дихлорметане (10 мл). Смесь перемешивали еще 15 минут, затем добавляли триэтиламин (3,8 мл; 27,3 ммоль). После перемешивания при -78°C еще 10 минут смесь оставляли нагреваться до 0°C, затем добавляли этилацетат (50 мл) и воду (50 мл). После завершения перемешивания органический слой разделяли, последовательно промывали 1М HCl (50 мл) и насыщенным солевым раствором (50 мл) и сушили (Na2SO4). Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя 3% MeOH в метиленхлориде, с получением указанного в заголовке продукта (220 мг), который один раз перекристаллизовывали из минимального количества горячего этилацетата.1H-ЯМР (CDCl3) δ 2,41 (дд, 1H), 2,87-2,93 (м, 1H), 4,15-4,33 (м, 3H), 4,45-4,49 (м, 2H), 7,06 (д, 1H), 7,18 (т, 1H), 7,44 (дд, 1H), 8,03 (дд, 1H); EIMS: m/z=218,4 [M+H]+
Пример 28
(2S)-2, 2-Дифтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он

К раствору вещества, полученному в примере 27, в метиленхлориде (5 мл) добавляли трифторид диэтиламиносеры (245 мг; 1,5 ммоль). Реакционную смесь перемешивали в течение 2 дней при комнатной температуре, затем гасили добавлением льда, и промывали водой (10 мл) и насыщенным раствором бикарбоната натрия (10 мл), и сушили (Na2SO4). Упаривание и очищение флэш-хроматографией, элюируя 19:1 метиленхлоридом-эфиром, давало указанное в заголовке соединение в виде не совсем белого твердого вещества (63 мг). Т.пл.: 116,5-119, 5°C; EIMS: m/z=240,0 [M+H]+
Пример 29: Электрофизиология потенциала целой клетки.
A: Клеточная культура.
Нейроны гипокампа получали у эмбрионов или 1-3-дневных крыс Спрега-Даули (Sprague Dawley), которых обезглавливали и головы немедленно помещали в охлажденный на льду HBS (HEPES Буферированный раствор: 130 мМ NaCl, 5,4 мМ KCl, 10 мМ HEPES, 1,0 мМ MgCl2, 1,8 CaCl2, 25 мМ глюкоза, pH доводили до 7,4). Цельный мозг вырезали и помещали на предварительно стерилизованный бумажный фильтр, размоченный в HBS, и мозжечок удаляли. Мозг разрезали, добавляли ферментный раствор (0, 5 мг/мл протеаза X и 0,5 мг/мл протеаза в HBS) и затем оставляли в течение 40 минут при комнатной температуре для ферментации перед растиранием. Клетки ресуспендировали и затем подсчитывали с получением конечной концентрации 1,5×106 на мл. Клетки разделяли на аликвоты на покровном стекле, обработанном поли-D-лизином и Matrigel®, и инкубировали при 37°C в течение 1-2 часов. После завершения инкубации к каждой лунке на покровном стекле добавляли 1 мл растущей среды и клетки возвращали в инкубатор. Через 3-5 дней добавляли ингибитор митоза цитозин арабинозид (5 мкМ) и клетки возвращали в инкубатор до проведения анализа.
B: Запись в методе пэтч-кламп.
Для измерения токов, вызванных глутаматом, в постнатальных нейронах гипокампа, находящихся в культуре в течение 4-7 дней, использовали центрифугирование цельных клеток метода пэтч-клампа (Hamill et al., Pflügers Arch. 1981, 39, 85-100). Стеклянное покровное стекло, содержащее культуру, переносили в записывающую камеру (Warner Instrument Corp., Hamden, CT), установленную на платформе инвертированного микроскопа (Nikon, Kingston, UK). Записывающая камера содержала 1-2 мл экстрацеллюлярного раствора (145 мМ NaCl, 5,4 мМ KCl, 10 мМ HEPES, 0,8 мМ MgCl2, 1,8 CaCl2 , 10 мМ глюкоза и 30 мМ сахароза, рН доводили до 7, 4 с помощью 1M NaOH), и он непрерывно перфузировался со скоростью 1 мл/мин. Запись проводили при комнатной температуре (20-22°C), используя усилитель Axopatch 200B (Axon Instruments Ltd., Foster City, CA). Данные получали и анализировали с помощью Signal software (Cambridge electronic Design Ltd., Cambridge, UK). Пипетки были сделаны из GC120F-10 стекла (Harvard Apparatus, Edenbridge UK), используя модель электродного выталкивателя P-87 (Sutter Instruments Co., Novarto, CA). Патч-электроды имели обычное сопротивление между 3-5 M Ω, когда были погружены во внутриклеточный раствор (140 мМ глюконата калия, 20 мМ HEPES, 1,1 мМ EGTA, 5 мМ фосфокреатин, 3 mM ATP, 0,3 мМ GTP, 0,1 мМ CaCl2, 5 мМ MgCl2, pH доводили до 7,4 с помощью KOH).
Клетки фиксировали электрическим напряжением с фиксирующим потенциалом -60 mV и наносили глутамат (0,5 мМ), используя 12-канальное полускоростное устройство для нанесения препарата (DAD-12, Digitimer Ltd., Welwyn Garden City, UK). Агонист глутамата наносили в течение 1 с каждые 30 с. Ответ не затухал в течение времени, применяя центрифугирование целых клеток. В перерыве между нанесениями подавали насыщенный солевой раствор для промывки любого отработанного объема в системе. При каждом нанесении графически изображали статические токи на основании разницы с основной линией и устойчивым состоянием тока и усредняли за промежуток 300 мс.
Готовили два раствора соединения в экстрацеллюлярном растворе, один с глутаматом и один без него. Протокол был следующим: 10 секунд нанесение соединения, 1 секунда нанесение соединения + глутамата и затем 10 секунд промывка насыщенным солевым раствором, затем 10 секунд перерыв. Если соединение было нерастворимым, то в качестве вспомогательного растворителя использовали 0,5% DMSO. Результаты представлены на таблице как процент увеличения устойчивого состояния потока при 10 мкМ концентрации соединения по данному изобретению в экстрацеллюлярном растворе.
Пример 30
Дифференциальное увеличение слабых реакций, 72 секунды (DRL72)
Крысы предварительно находились в стандартной оперантной камере для проведения процедуры DRL72 в соответствии с Andrews et al (Andrews JS, Jansen JHM, Linders S, Princen A, Drinkenburg WHIM, Coenders CJH и Vossen JHM (1994). Effects of imipramine and mirtazapine on operant performance in rats. Drug Development Research, 32: 58-66). Длительность исследования составляла 60 минут без ограничения числа испытаний. Каждое испытание начинали с раздражения светом выше подвижного рычага. При ответной реакции на рычаг подавали шарик пищи только по истечении 72 секунд. Если ответная реакция была до истечения 72 секунд, то все повторяли и не давали вознаграждения. Число шариков пищи, которые давали в качестве вознаграждения, и число нажатий на рычаг записывали и использовали для подсчета результативных баллов. Исследуемые соединения вводили внутрибрюшинно за 30 минут перед началом исследования. Введение антидепрессантов увеличивало число шариков пищи, которые давали в качестве вознаграждения, и увеличивало число нажатий на рычаг (Andrews et al, 1994).
(S)-9-Фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он (пример 3В) имел антидепрессантные характеристики.
Пример 31
Ингибирование повышенной гиперлокомоторной активности, вызванной амфетамином
Мыши вводили подкожной инъекцией лекарственный препарат или носитель, как контроль. Через 30 минут мыши вводили подкожной инъекцией 1,5 мг/кг сульфат д-амфетамина или насыщенный водный раствор и сразу помещали в инфракрасные локомоторные боксы, в которых измеряли локомоторную активность (продолжительный луч, разделенный на два соседних луча) и стереотипность поведения (повторяющиеся импульсные прерывающиеся лучи) в течение 60 минут. Эксперимент анализировали, используя в экспериментальном сеансе 3-Way ANOVA, в качестве переменных - инфракрасные локомоторные боксы и обработку, и в случае обработки, значимые эффекты окончательно оценивали тестом Tukey (HSD). (S)-2,3,11, 11a-тетрагидро-1H,5H-пирроло[2,1-c][1,4]бензоксазепин-5-он и (R)-9-фтор-2,3,11,11a-тетрагидро-1H,5H-пирроло[2,1-c][1, 4]бензоксазепин-5-он (примеры 3A) имел антипсихотически-подобную активность, что было показано ингибированием гиперлокомоторной активности, вызванной амфетамином.
Реферат
Настоящее изобретение относится к органической химии, конкретно к производным бензоксазепина. Описываются производное бензоксазепина общей формулы I

где Х представляет собой СО или SO2; R1, R2, R3 и R4 независимо выбраны из Н, (С1-4)алкила, (С1-4 )алкилокси, (С1-4)алкилокси(С1-4)алкила, CF3, галогена, нитро, циано, NR8R9, NR8COR10 и CONR8R9; R5, R6 и R7 независимо представляют собой Н или (С1-4)алкил; R8 и R9 независимо представляют собой Н или (С1-4)алкил; или R8 и R9 вместе с атомом азота, к которому они присоединены, образуют 5- или 6-членное насыщенное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из О, S или NR11; R10 представляет собой (С1-4)алкил; R11 представляет собой (С1-4)алкил; А представляет собой остаток 4-7-членного насыщенного гетероциклического кольца, необязательно содержащего атом кислорода, где кольцо необязательно замещено 1-3 заместителями, выбранными из (С1-4)алкила, (С1-4)алкилокси, гидрокси, галогена и оксо; или к его фармацевтически приемлемой соли; при условии, что исключены соединения формулы I, где Х представляет собой СО; каждый R1-R7 представляет собой Н, и А представляет собой (СН2)3 или (СН2)4; соединения формулы I, где Х представляет собой СО; R1 представляет собой Н; R2 представляет собой метил; каждый R3-R7представляет собой Н; и А представляет собой (СН2)3; соединения формулы I, где Х представляет собой СО; R1 и R2 представляют собой Н; R3 представляет собой метил; каждый R4-R7 представляет собой Н; и А представляет собой (СН2)3; соединения формулы I, где Х представляет собой СО; каждый R1-R3 представляет собой Н; R4 представляет собой метил; каждый R5 -R7 представляет собой Н; и А представляет собой (CH2)3; и соединения формулы I, где Х представляет собой СО; каждый R1-R4 представляет собой Н; R5 представляет собой метил; R6 и R7представляют собой Н; и А представляет собой (СН2)3. Также описываются фармацевтические композиции, содержащие указанные производные и применение этих производных бензоксазепина при лечении неврологических заболеваний и психических расстройств, которые чувствительны к увеличению ответов, опосредованных рецепторами АМРА в центральной нервной системе. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 3 н. и 5 з.п. ф-лы, 1 табл.
Формула


Комментарии