N-бут-3-енил-норбупренорфин и способы его применения - RU2003129531A
Код документа: RU2003129531A
Реферат
1. Соединение структуры (I)
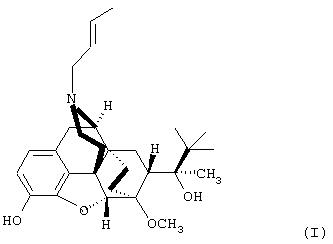
его фармакологически приемлемая соль, производное в виде простого эфира, сложноэфирное производное, кислотное производное, энантиомер, диастереомер, рацемат, полиморфная форма или сольват.
2. Композиция, содержащая (а) соединение по п.1.
3. Композиция по п.2, дополнительно содержащая: (b) вспомогательное лекарственное вещество, (c) антиоксидант, (d) буферное вещество, (e) носитель, (f) краситель, (g) разбавитель, (h) агент, вызывающий дезинтеграцию, (i) наполнитель, (j) заполнитель, (k) вкусовую добавку, (l) желирующий агент, (m) смазывающее вещество, (n) нейтрализующий агент, (о) консервант, или (p) комбинацию любых вышеуказанных веществ.
4. Композиция по п.3, содержащая эффективное количество, оказывающее агонизирующее действие на опиатные рецепторы.
5. Композиция по п.4, в которой указанный опиатный рецептор является μ-рецептором.
6. Композиция по п.3, содержащая эффективное аналгезирующее количество указанного соединения.
7. Композиция по п.3, содержащая эффективное седативное количество указанного соединения.
8. Композиция по п.3, содержащая количество указанного соединения, эффективное против кашля.
9. Композиция по п.3, содержащая количество указанного соединения, эффективное для снижения синдрома отмены опиоида.
10. Композиция по п.3, содержащая количество указанного соединения, эффективное для снижения наркотической зависимости.
11. Композиция по п.2, содержащая 50 мас.% или более указанного соединения, предпочтительно 90 мас.% или более указанного соединения, более предпочтительно 99,9 мас.% или более указанного соединения.
12. Композиция по п.3, содержащая указанное соединение в количестве, достаточном для достижения максимальной концентрации указанного соединения в крови от приблизительно 20 пикограммов/мл до приблизительно 10 нанограммов/мл.
13. Единичная дозированная форма, содержащая композицию по п.2.
14. Дозированная форма по п.13, выбранная из группы, включающей таблетки, пилюли, капсулы, болюсы (шарики), порошки, гранулы, стерильные парентеральные растворы, стерильные парентеральные суспензии, эликсиры, микстуры, дозированные аэрозоли, жидкие спреи, капли, ампулы, автоинжекторные приспособления, суппозитории, дозированные формы для трансдермального введения и лиофилизированные композиций.
15. Дозированная форма по п.13, которая является дозированной формой с замедленным высвобождением.
16. Дозированная форма по п.13, содержащая 50 мас.% или более указанного соединения, предпочтительно 90 мас.% или более указанного соединения, более предпочтительно 99,9 мас.% или более указанного соединения.
17. Способ стимулирования опиатных μ-рецепторов пациента, который в этом нуждается, причем указанный способ включает введение пациенту эффективного количества композиции по п.2, оказывающего агонизирующее воздействие на опиатные μ рецепторы.
18. Способ по п.17, отличающийся тем, что введение выбирают из группы, включающей пероральное, внутривенное, внутримышечное, подкожное, трансдермальное, легочное, офтальмологическое, введение через слизистую оболочку и введение через слизистую оболочку рта.
19. Способ по п.17, отличающийся тем, что он обеспечивает введение указанного соединения в количестве, достаточном для достижения максимальной концентрации указанного соединения в крови приблизительно 10 нанограммов/мл.
20. Способ предотвращения и/или лечения болевых ощущений пациента, который в этом нуждается, отличающийся тем, что он включает введение пациенту эффективного аналгезирующего количества композиции по п.2.
21. Способ по п.20, отличающийся тем, что введение выбирают из группы, включающей пероральное, внутривенное, внутримышечное, подкожное, трансдермальное, легочное, офтальмологическое, введение через слизистую оболочку и введение через слизистую оболочку рта.
22. Способ по п.20, отличающийся тем, что указанный способ обеспечивает введение указанного соединения в количестве, достаточном для достижения максимальной концентрации указанного соединения в крови пациента приблизительно 10 нанограммов/мл.
23. Способ по п.20, отличающийся тем, что указанные болевые ощущения могут быть как умеренными, так и сильными.
24. Способ достижения седативного эффекта у пациента, который в этом нуждается, отличающийся тем, что указанный способ включает введение пациенту эффективного седативного количества композиции по п.2.
25. Способ по п.24, отличающийся тем, что введение выбирают из группы, включающей пероральное, внутривенное, внутримышечное, подкожное, трансдермальное, легочное, офтальмологическое, введение через слизистую оболочку и введение через слизистую оболочку рта.
26. Способ по п.24, отличающийся тем, что указанный способ обеспечивает указанное соединение в количестве, достаточном для достижения максимальной концентрации указанного соединения в крови пациента приблизительно 10 нанограммов/мл.
27. Способ лечения кашля у пациента, который в этом нуждается, отличающийся тем, что указанный способ включает введение пациенту количества композиции по п.2, эффективного для прекращения кашля.
28. Способ по п.27, отличающийся тем, что указанный способ обеспечивает введение указанного соединения в количестве, достаточном для достижения максимальной концентрации указанного соединения в крови пациента от приблизительно 20 пикограммов/мл до приблизительно 10 нанограммов/мл.
29. Способ снятия синдрома отмены опиоида (абстинентного наркотического синдрома) и/или лечения опиоидной зависимости у пациента, который в этом нуждается, отличающийся тем, что указанный способ включает введение пациенту количества композиции по п.2, эффективного для снятия синдрома отмены опиоида.
30. Способ по п.29, отличающийся тем, что указанный способ обеспечивает указанное соединение в количестве, достаточном для достижения максимальной концентрации указанного соединения в крови пациента от приблизительно 20 пикограммов/мл до приблизительно 10 нанограммов/мл.
31. Набор, включающий композицию по п.2, контейнер, этикетку и инструкции по применению.

Комментарии