Способы получения 14-гидроксинорморфинонов, промежуточные соединения - RU2183636C2
Код документа: RU2183636C2
Чертежи




































Описание
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
1. Область, к которой
относится изобретение
Настоящее изобретение относится к способам преобразования норморфинона и его производных, которые могут быть синтезированы из морфина, в
соответственные
14-гидроксинорморфинон и его производные, включая оксикодон, оксиморфон, нороксиморфон и налтрексон. Нороксиморфон является ключевым промежуточным соединением для изготовления важных
наркотических
обезболивающих и антагонистических средств. Помимо этого, настоящее изобретение касается создания новых промежуточных соединений.
2. Уровень техники
14-Гидрокси-замещенные
морфиновые производные являются важными наркотическими обезболивающими и/или антагонистическими средствами. Эти лекарственные средства включают оксикодон, оксиморфон, налбуфин,
налоксон и налмефен.
Они легко синтезируются из тебаина, который представляет собой второстепенный компонент опиумной смолы (камедь). Поскольку запасы тебаина ограничены, а спрос на него растет,
стоимость тебаина высока.
Вследствие этого было предпринято множество взаимоисключающих попыток, ставивших своей целью получить 14-гидроксиморфиновые производные. Указанные попытки получения таких
наркотических средств,
имеющих в своей основе 14-гидрокси группу, из легко доступных и имеющихся в изобилии исходных материалов морфина и кодеина (второстепенный компонент опиумной смолы, который
также может быть
синтезирован посредством метилирования морфина) суммарно сводятся к следующему:
(1) преобразование кодеина в тебаин посредством дигидрокодеинона (выход 5,4%, Г. Раппопорт и
др. "Журнал
Американского Химического Общества", т. 89, 1967 г. , стр. 1942 и Г. Рапопорт и др. "Журнал Органической Химии", т. 15, 1950 г. , стр. 1103), кодеинона (выход 20%, И. Секи,
"Химико-Фармакологический
Бюллетень", т. 18, 1970 г., стр. 671, и Г. Рапопорт и др. "Журнал Американского Химического Общества", т. 77, 1955 г., стр. 490), или 6-метилового эфира кодеина (с
использованием двуокиси марганца,
выход 67%, Р.Б. Барбер и др. "Журнал Медицинской Химии", т. 18, 1975 г., стр. 1074);
(2) окисление кодеинон пирролидинил ди-энамина в 14-гидроксикодеинон
(выход 30-40%, И. Секи "Бюллетень
Химической Фармакологии", т. 18, 1970 г., стр. 671);
(3) прямое аллиловое окисление кодеина в соответственные 14-гидрокси производные посредством хромовой
кислоты (Х.Л. Халмс и др. "Журнал
Американского Химического Общества", т. 69, 1947 г., стр. 1966), двуокиси марганца (И. Браун и др. "Журнал Химического Общества", 1960 г., стр. 4139), и двуокиси
селена плюс т-бутил гидроген пероксид
(М.А. Шварц и др. "Журнал Медицинской Химии", т. 24, 1981 г., стр. 1525); и
(4) шести-этапная трансформация кодеина в нороксикодон (выход 52%) и в
нороксиморфон (выход 43%) с использованием
образованного фотохимическим способом синглетного кислорода (М.А. Шварц и др., "Журнал Медицинской Химии", т. 24, 1981 г., стр. 1525); и
(5)
получение нороксиморфона из морфина через
посредство промежуточного соединения с карбаматовой защитой на азотном атоме (положение 17), или карбаматовой защитой в положении 3 и карбаматовой защитой в
положении 17 норморфинон диэнол ацетата с
МСРВА при существенном отсутствии воды (выход 37%, Воллейс, патент США 5112975). Этим процессам свойственны недостатки, сводящиеся либо к низким выходам,
длительным этапам, не податливости к
постепенному увеличению выходов, либо к необходимости использования тяжелых металлов, пагубно воздействующих на окружающую среду.
Поэтому целью настоящего изобретения является создание методов конверсии норморфинона и его производных в соответственные 14-гидроксинорморфинон и его производные. Другой целью настоящего изобретения является создание способов, позволяющих получать относительно высокие выходы указанных требуемых продуктов. Еще одной целью настоящего изобретения является создание методов, которые были бы безопасны для окружающей среды и позволили бы исключить использование тяжелых металлов.
Другой целью настоящего изобретения является создание способов, в которых в качестве исходного материала вместо редкого могли бы быть использованы морфин или кодеин. Кодеин представляет собой компонент опиумной смолы (камедь) и может быть также получен путем метилирования морфина, осуществляемого с использованием известных приемов.
Еще одной целью настоящего изобретения является обусловить использование водной системы на этапе окисления для образования 14-гидроксинорморфинона, что не только благоприятно для окружающей среды, но также и желательно при проведении последующей реакции гидрогенизирования, исключая необходимость выделения промежуточного соединения 14-гидроксинорморфинона.
Другой целью настоящего изобретения является получение определенных промежуточных соединений, которые являются новыми составами.
Еще одной целью настоящего изобретения является получение промежуточных соединений для определенных продуктов, таких как оксикодон, оксиморфон, налтрексон и нороксиморфон.
Эти и другие цели станут очевидными для специалистов в данной отрасли техники в свете приведенного ниже раскрытия настоящего изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В более широком смысле настоящее
изобретение относится к способам получения 14-гидроксинорморфинонов
формулы

и их определенных производных как указано ниже. В вышеприведенной формуле R выбирается из группы, состоящей из нижнего алкила с 1-7 атомами углерода, циклоалкилалкила с 3-6 кольцевыми атомами углерода, бензила и замещенного бензила формулы

где Q и Q' выбираются отдельно из группы, состоящей из водорода, нижнего алкила, трифторметила, нитро, диалкиламина, циана;
R - предпочтительно есть метил (когда желательными продуктами являются оксикодон и оксиморфон), циклопропилметил (когда в качестве желательных продуктов требуются налтрексон и налмефен), циклобутилметил (когда в качестве желательного продукта требуется налбуфин) и бензил (когда в качестве желательных продуктов требуются налоксон, налтрексон, налбуфин или налмефен);
R' - метил, этил, 2-(4-морфолинил)этил, бензил, замещенный бензил (как определено выше), бензилоксикарбонил или группа с формулой
R''C(O)-,
где R'' - низший алкил с 1-4 атомами углерода;
R' - предпочтительно, метил (когда в качестве желательного продукта требуется оксикодон), бензил (когда в качестве желательных продуктов требуются оксиморфон и 14-гидроксил-норморфиноны), или ацил (когда в качестве желательного продукта требуется оксиморфон) и R''- метил;
из соответственных норморфинонов формулы

где R и R' имеют значения, определенные выше;
путем взаимодействия норморфинонов (как это определено выше), следуя любому из нижеследующих способов (1) или (2):
(1) непосредственно с окисляющим веществом - перекисью водорода - при температуре от примерно 15oС до примерно 70oС, предпочтительно в диапазоне от 40oС до 50oС в присутствии кислоты, такой как муравьиная кислота, винная кислота, уксусная кислота или других неорганических кислот, предпочтительно муравьиной кислоты; в подходящем не реактивном растворителе, таком как вода, уксусная кислота, THF, DMSO или в смеси растворителей, такой как ЕТОАс/НО, пригодной для растворения или суспендирования реактантов, предпочтительно водой, в течение временного периода от 1 до 24 часов, зависящего от масштаба реакции; или
(2) двухэтапным путем первоначально с ацилгалоидным соединением формулы
R''C(O)X,
где R'' имеет значение, определенное выше, и предпочтительно - метил;
Х-Cl или Вr, предпочтительно Cl;
или с уксусным ангидридом формулы
[R''C(O)2]O,
где R'' имеет значение, определенное выше;
а на втором этапе - с соответственной кислотной солью формулы
R''COOM,
где R'' - имеет значение, определенное выше,
М - атом натрия или калия, предпочтительно атом натрия;
с или без сорастворителя, такого как толуол, DMF или DMAC, предпочтительно толуол;
с нагреванием при температуре от примерно 60oС до примерно 150oС, предпочтительно 110oС в течение временного периода от 1 до 24 часов, в зависимости от объема партии, для получения диэнол ацилата формулы

где R, R' и R'' имеют значения, определенные выше;
с последующим взаимодействием указанного диэнол ацилата либо с окисляющим веществом в условиях, описанных в привязке к способу (1), либо с пероксидом кислоты, таким как 3-хлорпероксибензойная кислота (МСРВА) в слабой кислоте, такой как уксусная кислота или муравьиная кислота, с водой или без нее и с соразбавителем или без него для содействия в растворении указанного пероксида кислоты и указанного реактанта.
РАСКРЫТИЕ
ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ
Воплощения настоящего изобретения рассматриваются со ссылкой на
различные примеры реакций, через посредство которых может быть получен 3(O)-замещенный- и/или
17(N)-замещенный-14-гидроксинорморфинон. Указанные R, R' и R'' имеют значения, определенные выше.
Получение ключевых характерных свойств становится возможным посредством соединения
нескольких существенно важных новых концепций и методов, заключающихся в
(а) преобразовании 17(N),
3(O)-замещенного норморфинона формулы

в соответственный 14-гидрокси-17(N),3(O)-замещенный норморфинон формулы

с перекисью водорода в водной системе в присутствии кислоты;
(б) преобразовании 17(N), 3(O)-замещенного-норморфинона формулы

в соответственный 14-гидрокси-17(N), 3(O)-замещенный норморфинон формулы

с окисляющим средством, выбранным из водной перекиси водорода или перекиськарбоксильной кислоты в водной системе в присутствии слабой органической кислоты;
(в) окислительной реакции для образования 14-гидрокси-17(N), 3(O)-замещенного-норморфинона формулы
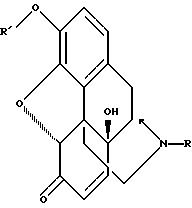
в уксусной водной системе, что весьма желательно для последующего этапа каталитического гидрогенизирования;
(г) 14-гидрокси 3(O)-замещенный и/или 17(N)-замещенный норморфинон формулы
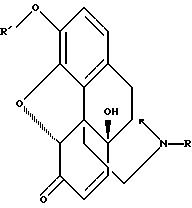
может и далее взаимодействовать особым образом для образования оксикодона, оксиморфона, налтрексона и нороксиморфона. Последний является общим промежуточным соединением для налоксона, налтрексона, налмефена и налбуфина;
(д) выбор предпочтительной группы замещения зависит от класса желанного продукта с тем, чтобы такой выбор способствовал облегчению проведения процесса и рациональному потреблению растворителя и реагента.
К преимуществам указанного метода- предмета настоящего изобретениям, предназначенного
для получения оксикодона, относится, наряду с остальным, нижеследующее:
(а)
использование широко распространенного в настоящее время исходного материала - кодеина, который является
второстепенным компонентом опиумной камеди и который также может быть получен путем
метилирования морфина с помощью известных приемов. Этот метод не требует деметилирования N-метил группы на позицию
17 кодеина, защиты азота-17 норкодеина и норкодеинона с помощью карбамата и
последующего создания незащищенности 14-гидрокси-N-этоксикарбонилноркодеинона, и, наконец, ре-метилирования этого же азота
как это описано в патентах США 4472253; 4639520 и 4795813;
(б)
использование водной системы при окислении норморфинонов или норморфинон диэнол ацелатов не только благоприятно для окружающей
среды, но и также желательно для последующей реакции гидрогенизирования
поскольку отпадает необходимость выделять промежуточный 14-гидроксикодеинон. Основной азот на позиции 17 протонируется в
кислотной водной системе. Это в значительной степени способствует высокой
растворимости реактанта продукта.
Этот новый путь синтезирования обеспечивает получение высоких выходов, достаточную надежность и прямой цикл обработки и контроля на каждом этапе синтеза, а также существенное снижение издержек синтезирования оксикодона, оксиморфона, нороксиморфона, налтрексона и налбуфина.
Так, для синтезирования оксикодона из кодеина, согласно
настоящему изобретению, указанный исходный материал формулы

преобразуется в кодеинон формулы

посредством метода, известного из источников предшествующих знаний, такого как Сверн окисление (ДМSO/кислотный галоид или кислотный ангидрид). В соответствии с указанным первым методом настоящего изобретения кодеинон взаимодействует с перекисью водорода в воде в присутствии кислоты при температуре от примерно 15oС до примерно 70oС в течение временного периода, зависящего от масштаба реакции, для обеспечения получения хороших выходов 14-гидроксикодеинона. Полученный таким путем 14-гидроксикодеинон гидрогенирируется в той же самой реакционной среде с катализатором для обеспечения хорошего выхода оксикодона. Предпочтительно, чтобы температура находилась в пределах между примерно 40oС и примерно 50oС, и кислотой была муравьиная кислота.
Последовательность этапов по указанному первому методу синтезирования оксикодона из морфина или кодеина может быть проиллюстрирована схемой 1, приведенной в конце описания.
В вышеуказанном случае и в последующих реакционных преобразованиях, которые приведены ниже, написанное через черточку двузначное число, которое появляется под каждой формулой, соответствует тому же самому указателю, появляющемуся после наименования каждого из таких примеров. Соответственно растворители, реактанты, температуры, временные периоды и выход указываются в примерах в привязке к каждому этапу общей реакции. Настоящим изобретением было обнаружено, что выходы промежуточных продуктов существенно увеличивались посредством первоначального ацилирования норморфинонов в соответственные диэнол ацилаты и последующего окисления указанных ацилатов в соответственные 14-гидроксинорморфиноны в противоположность прямому окислению норморфинонов в соответственные 14-гидроксинорморфиноны.
Хотя такой метод и включает дополнительный этап, тем не менее указанный более высокий выход с лихвой это оправдывает. Например, окисление кодеинон диэнол ацетата в 14-гидроксикодеинон дает выход порядка 70-80% после хроматографии, в то время как прямое окисление кодеинона в 14-гидроксикодеинон дает около 40% выхода.
Соответственно, согласно второму методу настоящего изобретения кодеинон вначале преобразовывается в кодеинон диэнол ацетат посредством методов, описанных в источниках предшествующих знаний (DE 902257, 1957 г. и M-S Brown, JCS, 1960г. , стр. 4139), а затем кодеинон диэнол ацетат взаимодействует с перекисью водорода в условиях, указанных в привязке к первоначальному процессу получения 14-гидроксикодеинона, который гидрогенезируется в оксикодон с самыми высокими выходами.
Альтернативно, кодеинон диэнол ацетат взаимодействует с пероксидкислотным окисляющим средством в водной или не водной системе со слабой кислотой при комнатной температуре для образования 14-гидроксикодеинона с самым высоким выходом.
С другой стороны, указанный продукт-14-гидроксикодеинон- в своей реакционной смеси пригоден для следующей реакции, катализаторного гидрогенезирования, без выделения 14-гидроксикодеинона путем добавления катализатора и гидрогенезирования смеси с последующим выделением оксикодона.
Предпочтительно пероксидкислотным окисляющим средством является 3-хлорпербензойная кислота, пербензойная кислота, пероксиуксусная кислота; хотя более предпочтительна 3-хлорпербензойная кислота.
Для растворения указанного окисляющего средства используется не вступающий во взаимодействие сорастворитель, такой как этил ацетат, тетрагидрофуран, диоксан.
Предпочтительной слабой кислотой является уксусная кислота или муравьиная кислота, которая также служит как растворитель.
Проведение реакции с водой, или без воды, или щавелевой кислоты не отражается на выходе.
Последовательность этапов по второму методу, при котором кодеинон преобразуется в кодеинон диэнол ацетат в ходе синтезирования оксикоона из морфина, может быть проиллюстрирована схемой 2, приведенной в конце описания.
Для синтезирования оксиморфона из морфина согласно настоящему изобретению
(а) первый этап сводится к защите фенольного гидрокси на позиции-3 морфина для образования
3(O)-защищенного-морфина формулы

где Р= P1 или P2, Р - подходящая защищающая группа, которая стабильна в условиях реакции и легко удаляется умеренным гидролизом с кислотой или основанием (для Р1) или в условиях каталитического гидрогенирования (для P2). P1 включает ацил, бензоил и алкоксикарбонил. Р2 включает бензил, замещенный бензил и бензилоксикарбонил.
(б) второй этап сводится к окислению
3(O)-защищенного-морфина в 3(O)-защищенный-морфинон формулы

посредством любого известного метода, такого как окисление Сверн (DMSO/кислотный галоид или кислотный ангидрит).
(в) третий этап сводится к преобразованию 3(O)-защищенного-морфинона в 14-гидрокси-3-(O)-защищенный-морфинон с использованим приемов согласно настоящему изобретению как это указано при преобразовании кодеинона в 14-гидроксикодеинон при синтезировании оксикодона.
Промежуточное вещество -3(O)-защищенный кодеинон диэнол ацилат является новым соединением формулы

где Р и Р'' имеют значение, определенное выше; предпочтительно P1 - ацетил и P2 - бензил.
(г) в зависимости от конкретной защитной группы, Р1 или Р2, четвертый этап сводится либо
(i) к получению вначале 7,8-двойной связи у
3-(O)-Р2-защищенного морфинона и последующего удаления защитной группы
посредством кислоты или основного гидролиза для получения оксиморфона, либо
(ii) к гидрогенезированию 7,
8-двойной связи и одновременно к устранению защиты 3-(O)-Р-защищенного морфинона для
получения оксиморфона.
Такое синтезирование оксиморфона из морфина, где Р1 - ацетил может быть проиллюстрировано схемой 3, приведенной в конце описания.
Написанное через черточку двузначное число, которое обозначено под каждой формулой, идентифицирует соответственные приведенные ниже примеры. Синтезирование оксиморфона из морфина, где P2 -бензил может быть проиллюстрировано схемой 4, приведенной в конце описания.
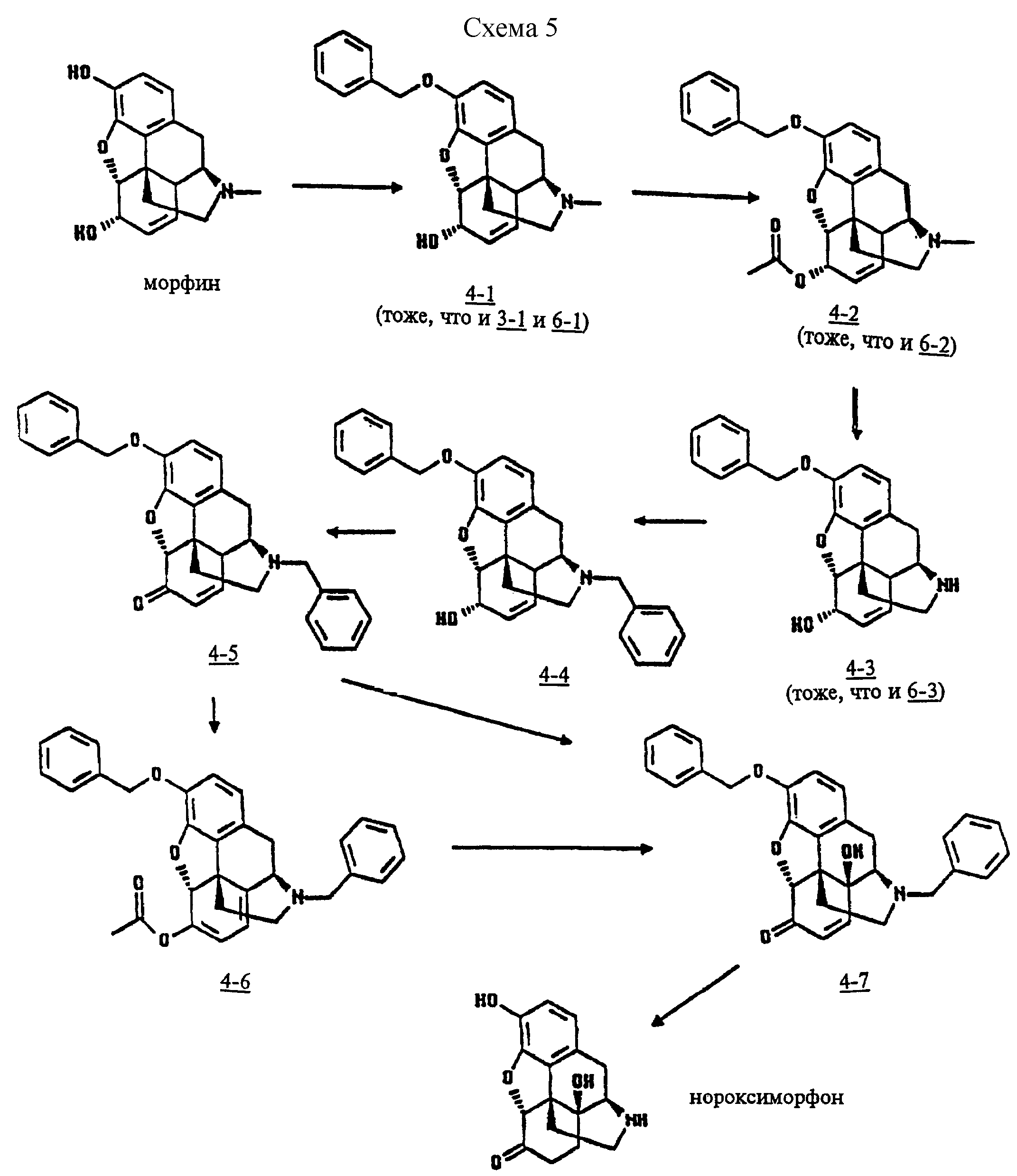
Для синтезирования
нороксиморфона из морфина, в соответствии с другим воплощением настоящего изобретения,
морфин преобразуется в 3-бензилморфин, который ацелируется в 6-ацетил-3-бензилморфин формулы

6-ацетил есть 3-бензилморфин-N-диметилирован 1-хлорэтил хлористой солью муравьиной кислоты или циан бромидом с последующим кислотным гидролизом в 3-бензилнорморфин. 3-бензилнорморфин взаимодействует с галоидным бензилом в присутствии основания, такого как натрий или калиевый бикарбонат для получения 3,17-дибензилнорморфинона, нового соединения, посредством окисления Сверы.
Применяя указанные условия согласно настоящему изобретению 3,17-дибензилнорморфинон окисляется в 3, 17-дибензил-14-гидроксинорморфинон либо путем прямого взаимодействия с перекисью водорода в муравьиной кислоте, либо путем первоначального преобразования в 3,17-дибензилнорморфинон диэнол ацилат, новое соединение, и последующего взаимодействия последнего с перекисью водорода в муравьиной кислоте или пероксикислоте как это указано при синтезировании оксикодона. Не прибегая к выделению 3, 17-дибензил-14-гидроксинорморфинона из его реакционной смеси это соединение гидрогенизируется для удаления указанных двух бензиловых групп и одновременного восстановления 7,8-двойной связи и получения хороших выходов нороксиморфона.
Указанное синтезирование нороксиморфона из морфина может быть проиллюстрировано схемой 5, приведенной в конце описания.
Для синтезирования 3-метилналтрексона из кодеина последний, согласно настоящему изобретению, преобразуется в 6-ацетилкодеин, который N-деметилируется в 6-ацетилноркодеин хлоргидрат с последующим алкилированием азота для образования 17-циклопропилметилноркодеина. Последний окисляется в 17-циклопропилметилноркодеинон. Как указано, при синтезировании оксикодона, согласно настоящему изобретению, 17-циклопропилметилноркодеинон преобразуется в 14-гидрокси-17-циклопропилметилноркодеинон посредством либо окисления перекисью водорода в муравьиной кислоте, либо первоначального преобразования в 17-циклопропилметилноркодеинон диэнол ацетат, новое соединение, с последующим окислением гидроперекисью или МСРВА.
14-гидрокси-17-циклопропилметилноркодеинон гидрогенезируется в 3-метилналтрексон. 3-метилналтрексон может быть деметилирован в налтрексон посредством BBr - ранее известным методом.
Указанная реакция может быть проиллюстрирована схемой 6, приведенной в конце описания.
Для синтезирования налтрексона из морфина, согласно настоящему изобретению, морфин преобразуется в 3-бензилнорморфин, как это описано выше, в процессе синтезирования нороксиморфона.
3-бензилнорморфин взаимодействует с галоидным циклопропилметилом для получения 3-бензил-17-циклопропилметилнорморфина, нового соединения, которое окисляется в 3-бензил-17-циклопропилметилнорморфинон, новое соединение, посредством окисления Сверн. Соблюдая условия, предусмотренные настоящим иобретением, 3-бензил-17-циклопропилметилнорморфинон окисляется в 3-бензил-17-циклопропилметил-14-гидроксинорморфинон либо путем прямого взаимодействия с перекисью водорода в муравьиной кислоте, либо посредством первоначального преобразования в 3-бензил-17-циклопропилметилнорморфинон диэнол ацилат, новое соединение, с последующим взаимодействием последнего с перекисью водорода в муравьиной кислоте или пероксикислоте, как это указано в случае синтезирования оксикодона. Не прибегая к выделению 3-бензил-17-циклопропилметил-14-гидроксинорморфинона из его реакционной смеси осуществляется гидрогенезирование этого соединения с целью удаления бензиловой группы и одновременного восстановления 7, 8-двойной связи для получения хорошего выхода налтрексона.
Синтезирование налтрексона иллюстрируется схемой 7, приведенной в конце описания.
Общая схема (8) синтезирования нороксиморфона и морфина, где Р, Q, Q и R имеют значения, указанные выше, схема 8 приведена в конце описания.
Как указывалось выше определенные промежуточные соединения, обнаруженные в процессе синтезирования желаемых конечных продуктов, являются сами по себе новыми соединениями.
Эти соединения приведены в пунктах притязаний.
Примеры, иллюстрирующие настоящее изобретение, приведены в конце текста.
Реферат
Описываются способы получения 14-гидроксинорморфинонов, включая оксикодон, нороксиморфон, налтрексон путем окисления диенол ацилатов норморфинона с использованием водной среды в присутствии слабой кислоты, что упрощает процесс. Нороксиморфон - ключевой промежуточный продукт для получения ряда анальгетиков и антагонистов наркотических веществ. Описываются также новые промежуточные соединения. 3 с. и 21 з.п. ф-лы.
Формула

где R выбирают из группы, состоящей из низшего алкила с 1-7 атомами углерода, циклоалкил-метил с 3-6 кольцевыми атомами углерода, бензила;
R' выбирают из группы, состоящей из бензила, R"C(О), где R" - низший алкил с 1-4 атомами углерода,
включающий взаимодействие норморфинон диенол ацилатов общей формулы

где R и R' имеют вышеуказанные значения,
с окисляющим средством при температуре от примерно 15 до примерно 70oС, в присутствии слабой кислоты и водного или органического растворителя для растворения указанных реагентов в течение времени, достаточного для образования 14-гидроксинорморфинонов.

где R выбирают из группы, состоящей из низшего алкила с 1-7 атомами углерода, циклоалкилметила с 3-6 кольцевыми атомами углерода, бензила;
R' выбирают из группы, состоящей из бензила R"С(О), где R" - низший алкил с 1-4 атомами углерода,
включающий взаимодействие норморфинонов общей формулы

где R' и R" имеют вышеуказанные значения,
с перекисью водорода при температуре от примерно 15 до около 70oС в присутствии кислоты и водосодержащего растворителя до растворения указанного реагента в течение времени, достаточного для образования 14-гидроксинорморфинона.
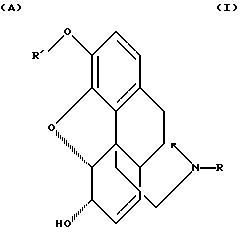
где R' выбирают из группы, состоящей из замещенной и незамещенной бензиловых групп формулы

где Q и Q1 независимо выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина и циана;
R выбирают из группы, состоящей из R', и циклоалкил - низшего алкила с 3-6 кольцевыми атомами углерода формулы
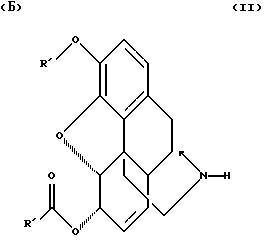
где R' выбирают из группы, состоящей из алкила с 1-7 атомами углерода и замещенного и незамещенного бензила формулы

где Q и Q' независимо выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина, циана;
R' - алкил с от 1 до 4 атомами углерода
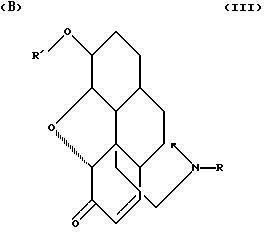
где R выбирают из группы, состоящей из алкила с 1-7 атомами углерода, циклоалкил - низшего алкил с 3-6 кольцевыми атомами углерода и замещенного и незамещенного бензила формулы

где Q и Q' независимо выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина, циана;
R' выбирают из группы, состоящей из замещенного и незамещенного бензила, как определено выше, и R"С(О)-, где R" - алкил с 1-4 атомами углерода, и при условиях, что (1) оба R и R' не могут одновременно быть метилом, (2) когда R - метил, то R' - не может быть бензилом, и (3) когда R' - метил, то R не может быть циклопропилметилом;

где R выбирают из группы, состоящей из алкила с 1-7 атомами углерода, циклоалкил - низшего алкила с 3-6 кольцевыми атомами углерода и замещенного и незамещенного бензила формулы

где Q и Q' независимо выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина, циана;
R' выбирают из группы, состоящей из R и R"С(О)-, где R"- алкил с 1-4 атомами углерода, при условии, что R, R' и R" не являются все одновременно низшим алкилом,

где R выбирают из группы, состоящей из замещенного незамещенного бензила формулы

где Q и Q' раздельно выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина, циана и циклоалкил - низшего алкила с 3-6 кольцевыми атомами углерода;
R' - замещенный и незамещенный бензил, как определено выше,
в качестве промежуточного продукта.

где R' выбирают из группы, состоящей из замещенного и незамещенного бензила формулы

где Q и Q' независимо выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина, циана;
R выбирают из группы, состоящей из R' и циклоалкил - низшего алкила с 3-6 кольцевыми атомами углерода:
15. Соединение по п. 13 формулы II
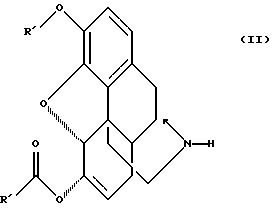
где R' выбирают из группы, состоящей из алкила с 1-7 атомами углерода и замещенного и незамещенного бензила формулы

где Q и Q' раздельно выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина, циана;
R" - алкил с 1-4 атомами углерода.

где R выбирают из группы, состоящей из алкила с 1-7 атомами углерода, циклоалкил - низшего алкила с 3-6 кольцевыми атомами углерода и замещенного и незамещенного бензила формулы

где Q и Q' независимо выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина и циана,
R' выбирают из группы, состоящей из R"С(О)-, где R" - алкил с 1-4 атомами углерода и, при условиях, что (1) оба R и R' не могут быть одновременно метилом; (2) когда R - метил, то R" не может быть бензилом, (3) когда R' - метил, то R не может быть циклопропилметилом.

где R выбирают из группы, состоящей из алкила с 1-7 атомами углерода, циклоалкил - низшего алкила с 3-6 кольцевыми атомами углерода и замещенного и незамещенного бензила формулы
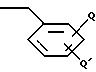
где Q и Q' независимо выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина и циана;
R' выбирают из группы, состоящей из R и R"С(О)-, где R" - алкил с 1-4 атомами углерода, при условии, что R, R' и R" не могут быть все одновременно низшим алкилом.
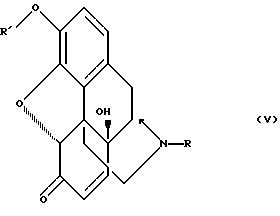
где R выбирают из группы, состоящей из замещенного и незамещенного бензила формулы

где Q и Q' независимо выбирают из группы, состоящей из водорода, низшего алкила, трифторметила, нитро, диалкиламина, циана и циклоалкилнизшего алкила с 3-6 кольцевыми атомами углерода;
и R' - замещенный и незамещенный бензил, как определено выше.

Комментарии