Тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианины кобальта и никеля - RU2620270C1
Код документа: RU2620270C1
Чертежи
Описание
Изобретение относится к химической промышленности, а именно к получению новых производных фталоцианина, конкретно, металлокомплексов тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианина с кобальтом и никелем, которые:
1) обладают красящей способностью по отношению к полистиролу и капрону;
2) могут быть использованы в качестве исходных соединений для синтеза металлокомплекса тетра-4-{4-[1-метил-1-(4-сульфофенил)этил]фенокси}тетра-5-нитрофталоцианина с кобальтом, проявляющего каталитическую активность при окислении серосодержащих органических соединений.
Известен тетра-3-(4-кумилфенокси)фталоцианин [George R.D., Snow A.W. Synthesis 3-Nitrophthalonitrile and Tetra-α-substituted Phthalocyanines // J. Heterocyclic Chemistry. 1995. Vol. 32. Issue 2. pp. 495-498].
Однако в литературе отсутствуют сведения о проявлении тетра-4-(4-кумилфенокси)фталоцианином и его металлокомплексами с медью, кобальтом, никелем, цинком, магнием, палладием, платиной, свинцом и висмутом красящей способностью по отношению к полистиролу и капрону.
Кроме того, ничего не известно о возможности использования данного соединения в качестве исходных для получения металлокомплексов фталоцианина, обладающих красящей способностью по отношению к шерстяным волокнам и проявляющих каталитическую активность при окислении серосодержащих органических соединений.
Кроме того, известны тетра-4-(4-кумилфенокси)фталоцианин и его металлокомплексы с медью, кобальтом, никелем, цинком, магнием, палладием, платиной, свинцом и висмутом [Patent USH477. Barger W.R., Jarvis N.L., Snow A.W., Wohltjen H. Monolayer-forming substituted phthalocyanine compounds and method of preparation thereof, по заявке №767,925 от 21.08.1985 г., опубликованной 07.06.1988 г. Int. CI. 4 С09В 47/30; С09В 47/04; U.S. CI. 540/140; 540/122; Field of Search 540/122,140], которые могут быть использован в качестве материалов для получения тонких пленок Ленгмюра-Блоджетт.
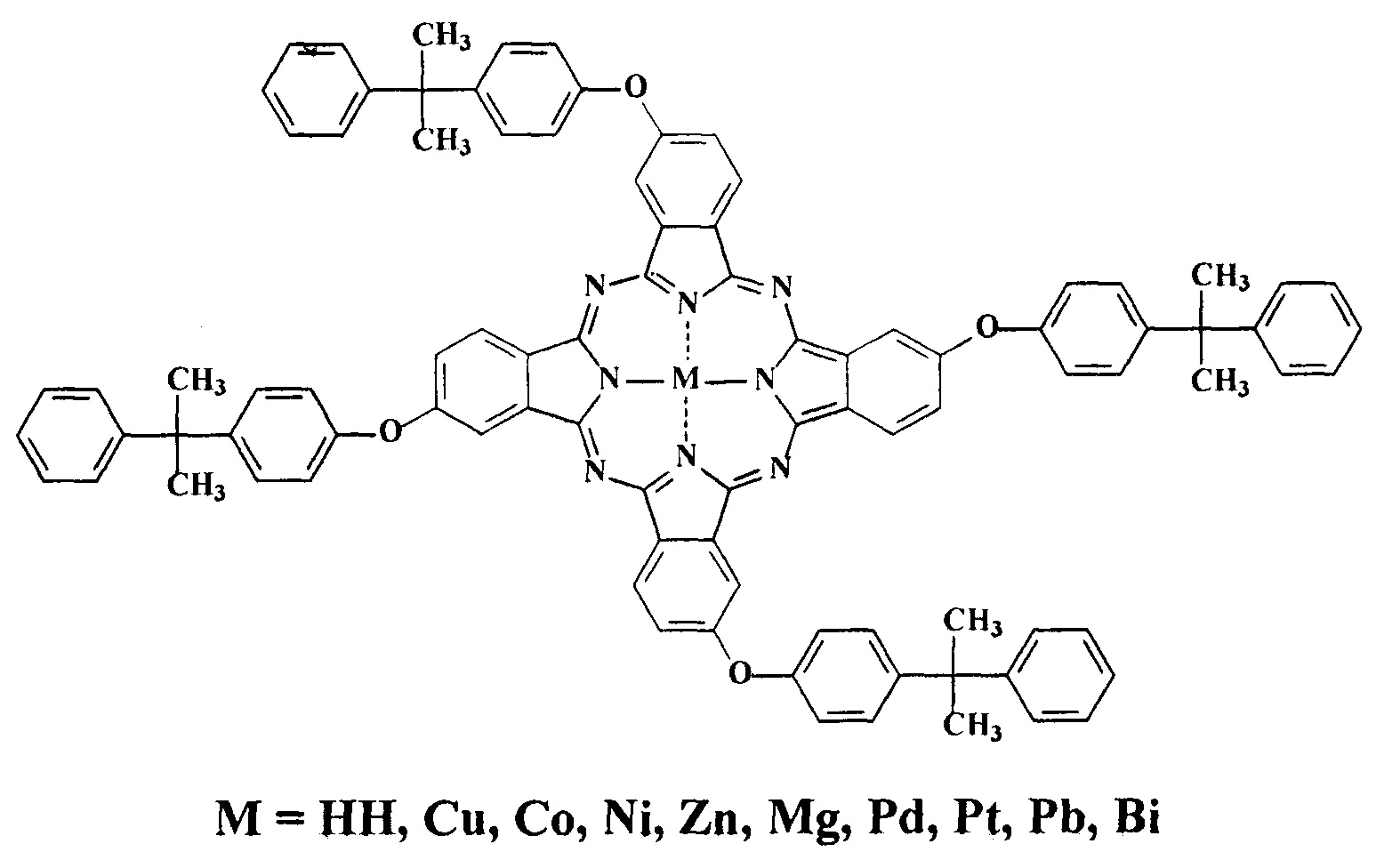
При этом в литературе отсутствуют сведения о проявлении тетра-4-(4-кумилфенокси)фталоцианином и его металлокомплексами с медью, кобальтом, никелем, цинком, магнием, палладием, платиной, свинцом и висмутом красящей способностью по отношению к полистиролу и капрону.
Кроме того, данные соединения не могут быть использованы в качестве исходных для получения металлокомплексов фталоцианина с медью, обладающего красящей способностью по отношению к шерстяным волокнам, и с кобальтом, проявляющего каталитическую активность при окислении серосодержащих органических соединений.
Наиболее близким структурным аналогом является тетра-4-(1-бензотриазолил)тетра-5-[4-(1-метил-1-фенилэтил)фенокси]фталоцианин и его металлокомплексы с медью, никелем, кобальтом и эрбием [Знойко С.А., Майзлиш В.Е., Шапошников Г.П., Абрамов И.Г. Синтез и исследование смешаннозамещенных фталоцианинов с фрагментами бензотриазола // Изв. Вузов. Химия и хим. технология. 2012. Т. 55. №12. С. 13-27].
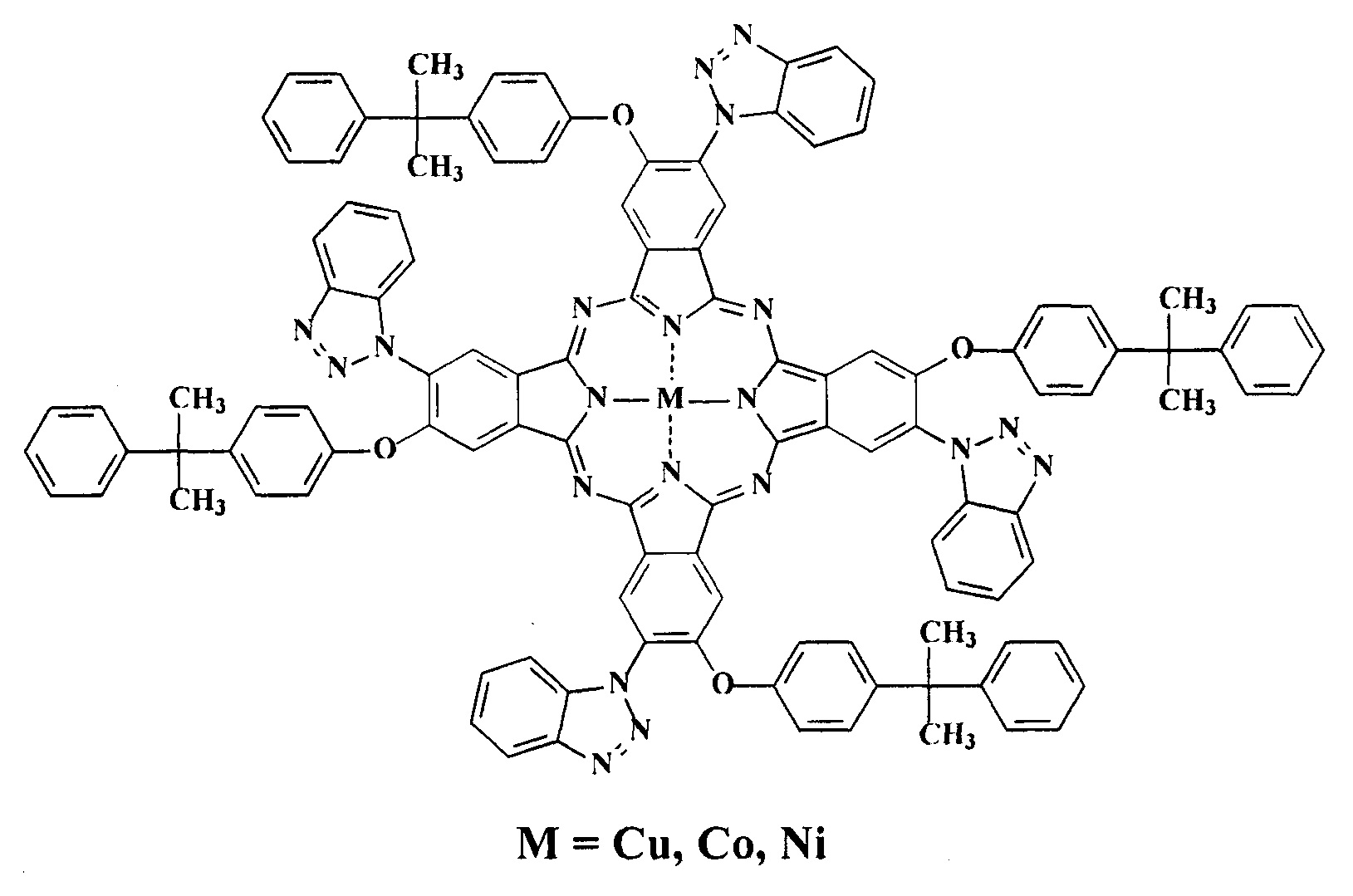
Данные соединения способны окрашивать полистирол в зеленый цвет, но не проявляют красящих свойств по отношению к капрону.
Изобретательская задача состояла в поиске нового соединения, обладающего красящей способностью по отношению к полистиролу и капрону, которое является промежуточным соединением в синтезе металлокомплекса фталоцианина с кобальтом, проявляющего каталитическую активность при окислении серосодержащих органических соединений.
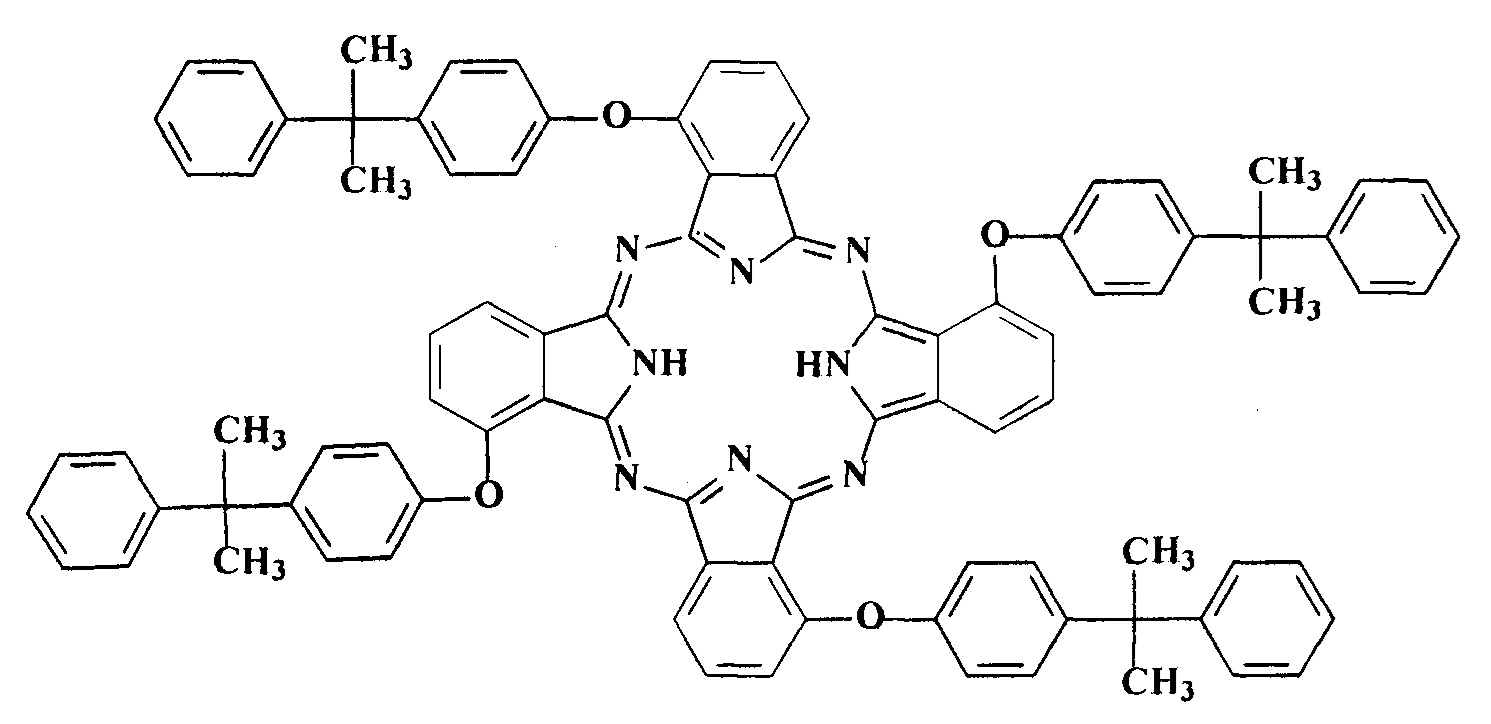
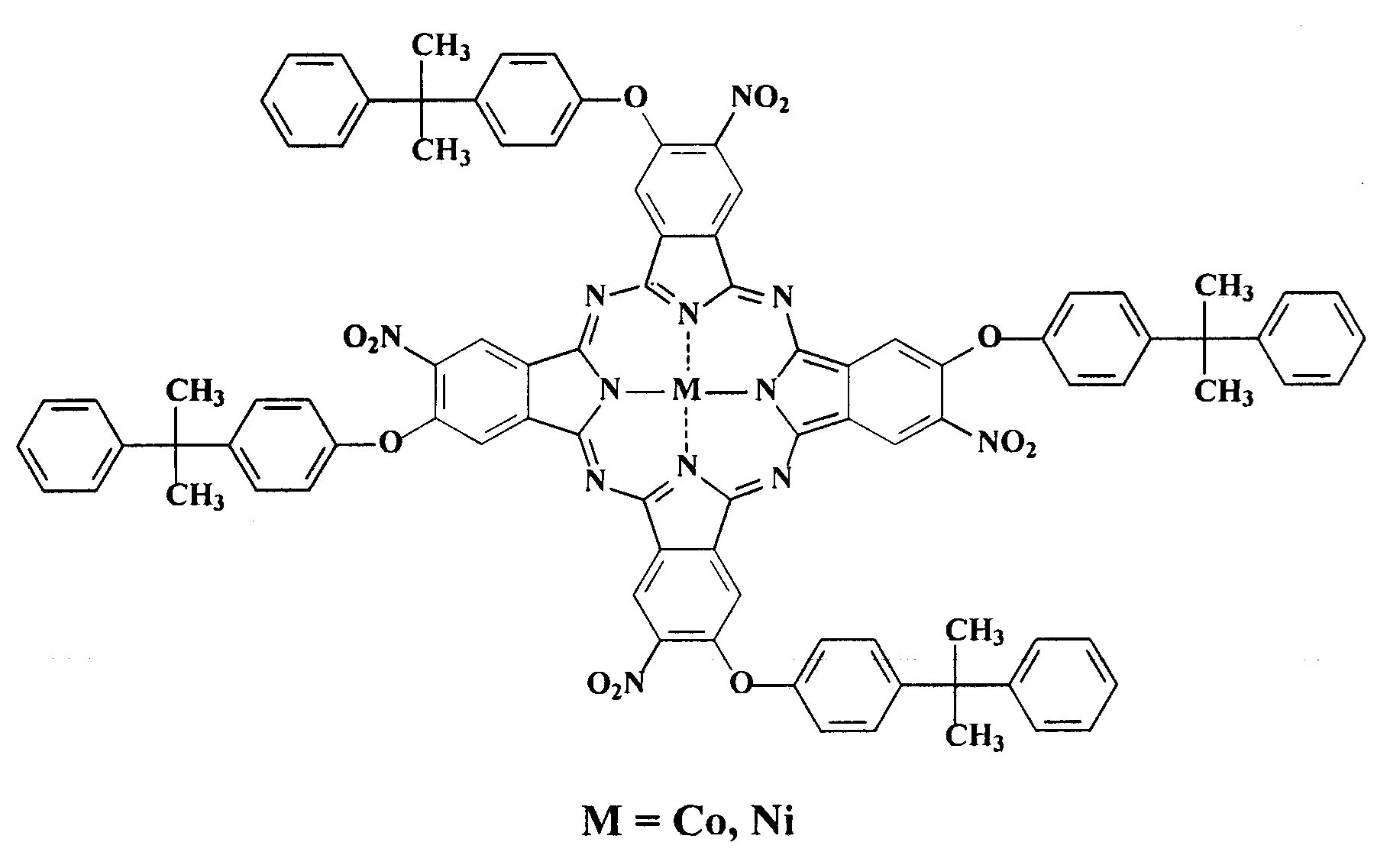
Поставленная задача решена синтезом тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианинами кобальта и никеля общей формулы:
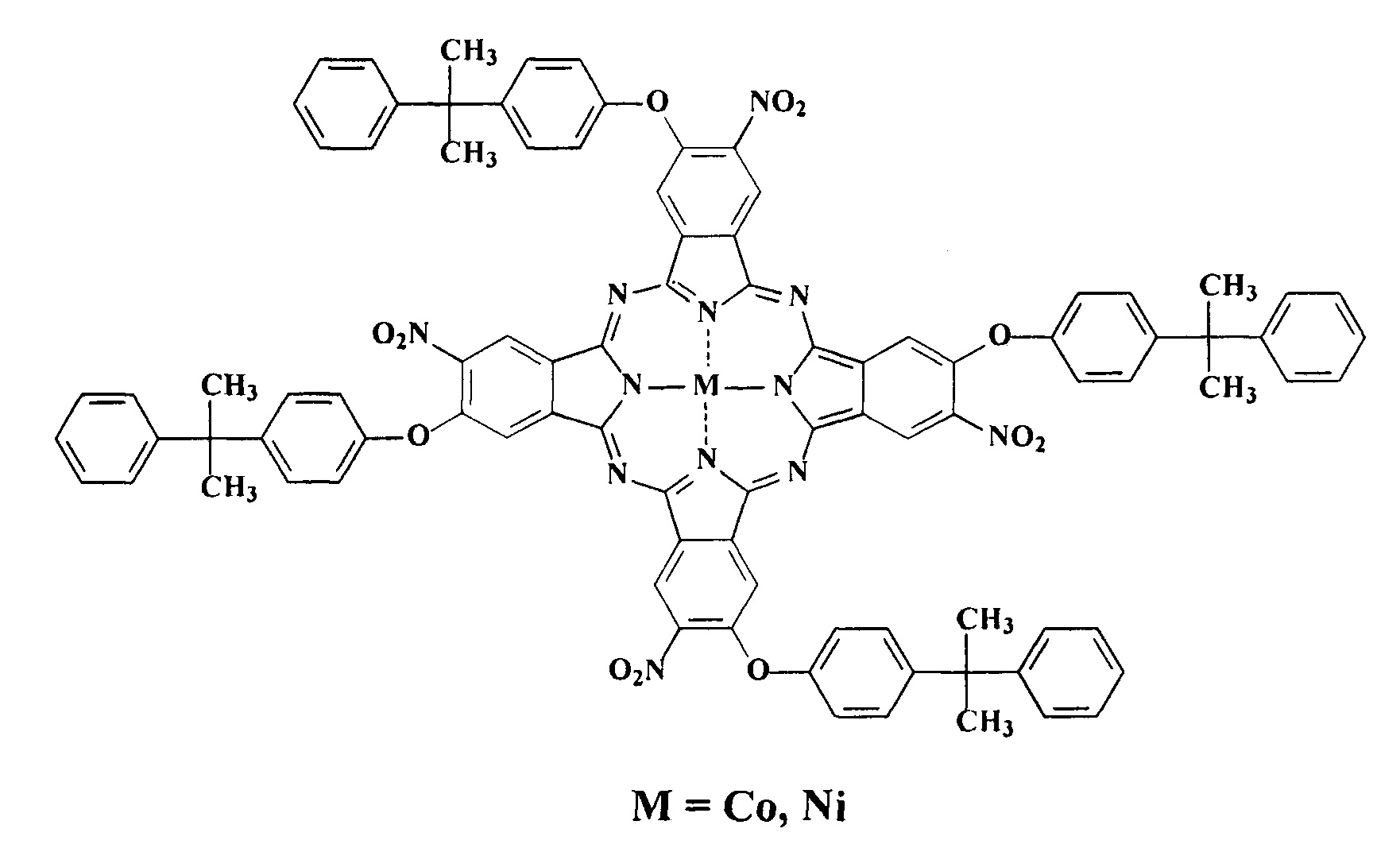
Структура этих соединений доказана данными элементного анализа, ИК,1H ЯМР и электронной спектроскопии, MALDI-TOF спектрометрии.
Так, в ИК-спектрах заявляемых соединений присутствуют полосы, характерные для валентных колебаний соответствующих функциональных групп: 2964-2923 и 2850-2866 см-1 (СН3), 1346-1352 см-1 (симметричные колебания NO2), 1542-1551 см-1 (асимметричные колебания NO2) [Дайер Дж. Р. Приложение абсорбционной спектроскопии органических соединений / Пер. с англ. Иванова В.Т. М.: Химия. 1970. 164 с]. В масс-спектрах синтезированных металлокомплексов фталоцианинов с никелем и кобальтом обнаружены сигналы целевых молекулярных ионов с m/z=1597.82; 1591.89; 1593.44, соответственно.
Краткое описание чертежей
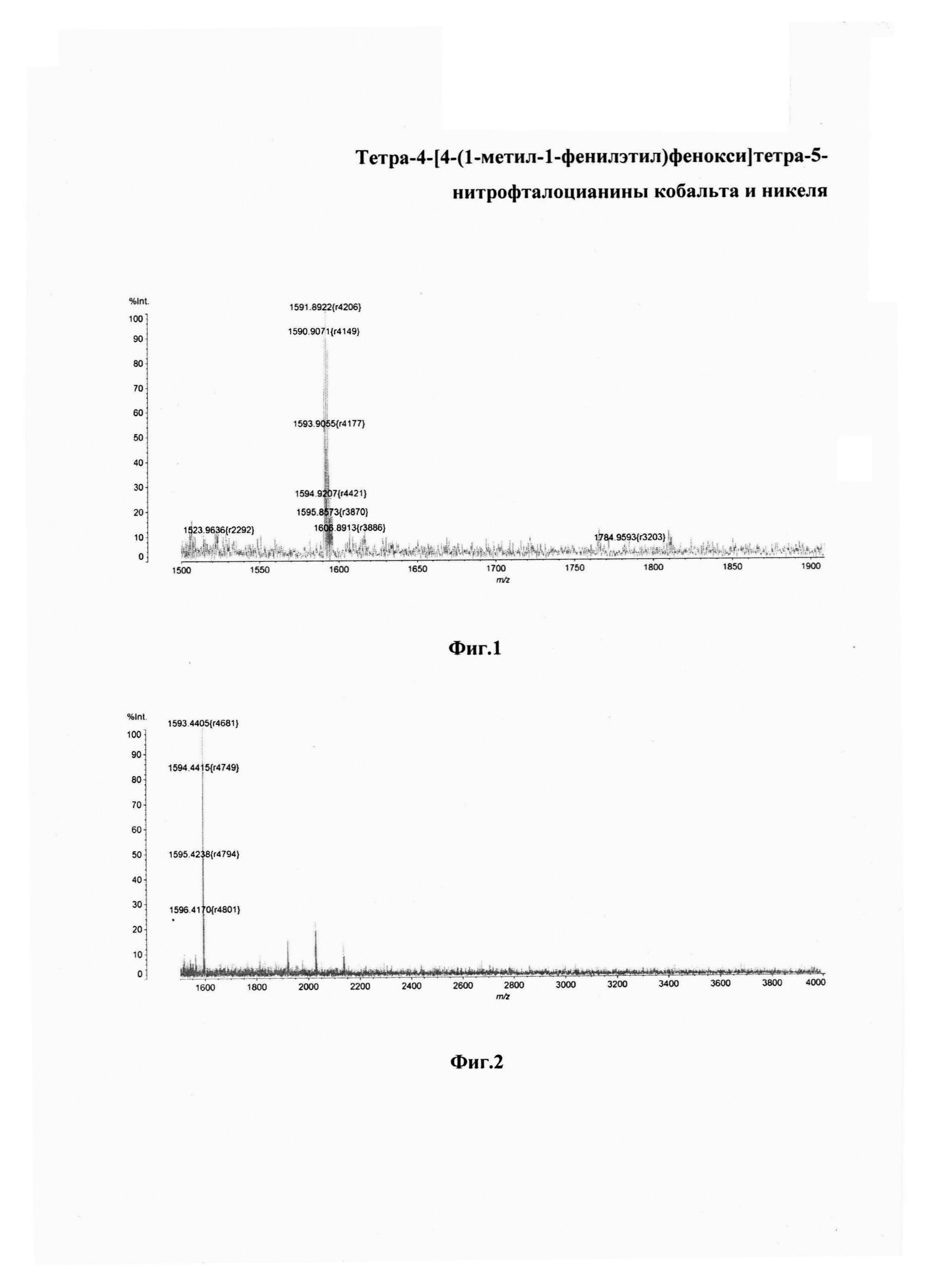
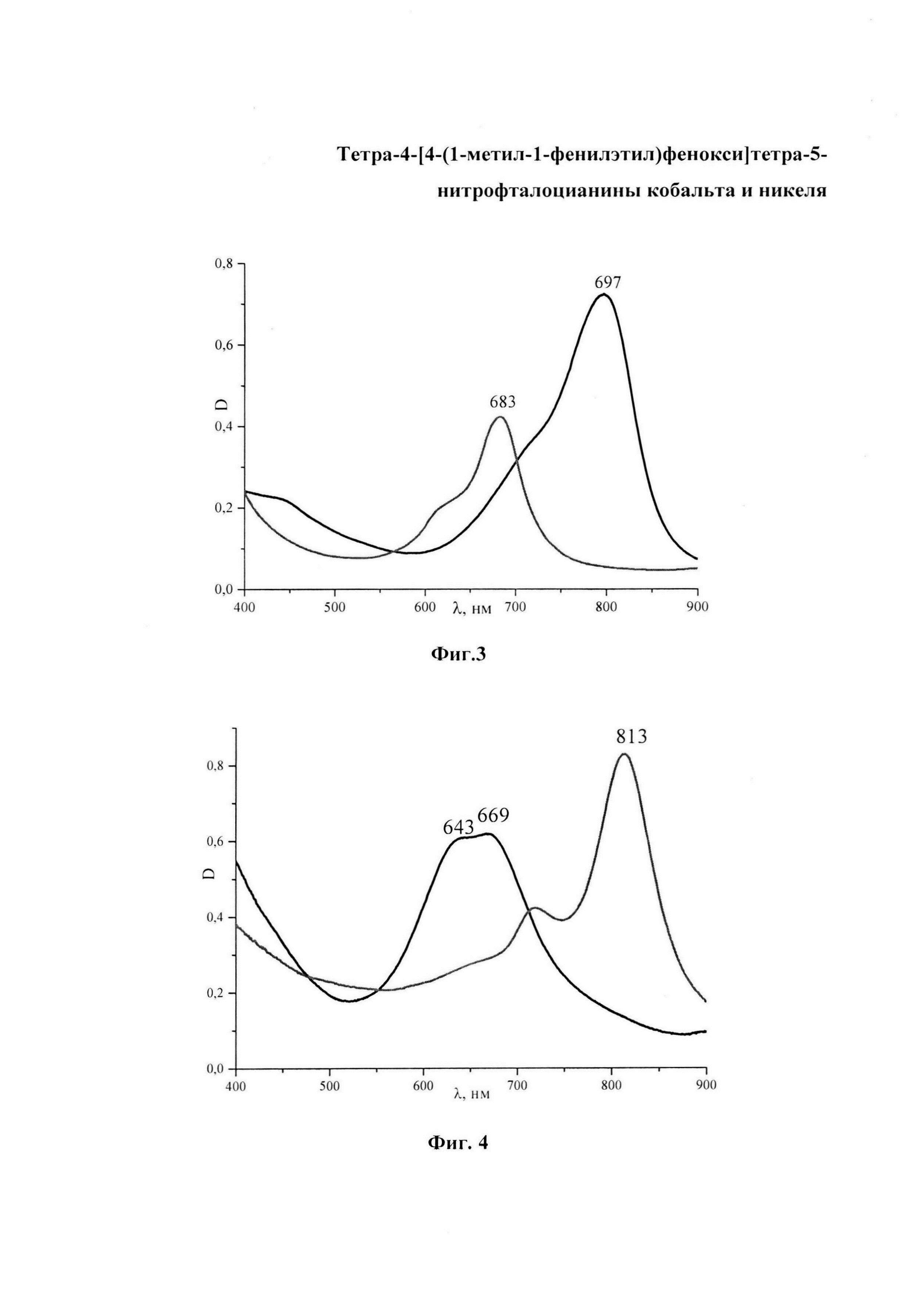
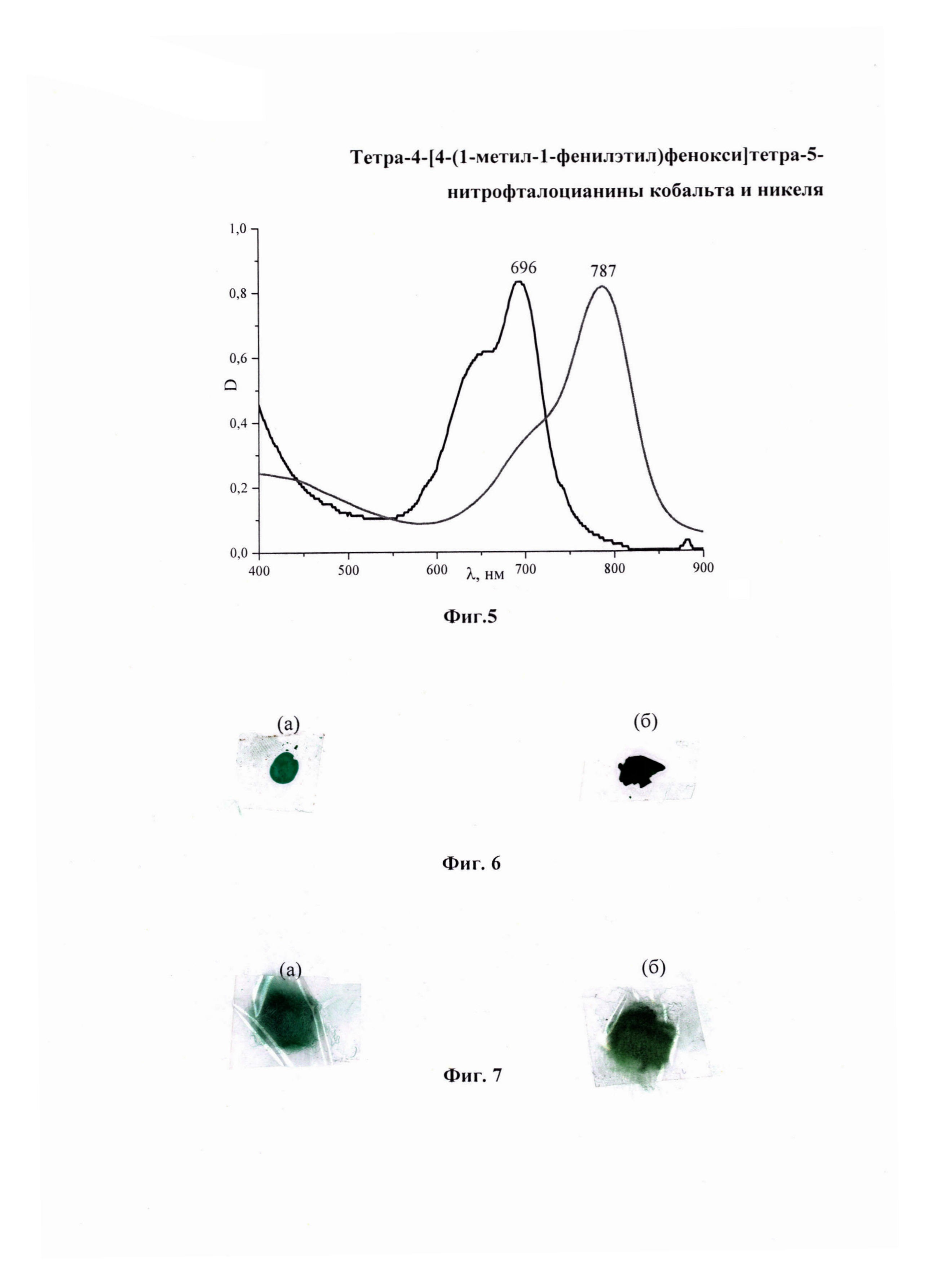
На фиг. 1 изображен MALDI-TOF масс-спектр тетра-4-[4-(1-метил-1-фенилэтил)фенокси]-5-нитрофталоцианина кобальта; на фиг. 2 - MALDI-TOF масс-спектр тетра-4-[4-(1-метил-1-фенилэтил)фенокси]-5-нитрофталоцианина никеля; на фиг. 3 - ЭСП тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианина кобальта в ДМФА и H2SO4; на фиг. 4 - ЭСП тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианина никеля в ДМФА и H2SO4; на фиг. 5 - ЭСП тетра-4-{4-[1-метил-1-(4-сульфофенил)этил]фенокси}тетра-5-нитрофталоцианина кобальта в ДМФА и H2SO4; на фиг. 6 - образцы полистирола, полученные по примеру 4, окрашенные (а) - тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианином кобальта, (б) - тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианином никеля; на фиг. 10 - образцы капрона, полученные по примеру 5, окрашенные (а) - тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианином кобальта, (б) - тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианином никеля.
Изобретение позволяет получить следующие преимущества.
1. Металлокомплексы тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианины с кобальтом и никелем обладают красящей способностью по отношению к полистиролу и капрону.
2. Применяемость заявляемых соединений для синтеза водорасторимого фталоцианина иллюстрируется получением металлокомплекса тетра-4-{4-[1-метил-1-(4-сульфофенил)этил]фенокси}тетра-5-нитрофталоцианина с кобальтом с выходом 72%, проявляющего каталитическую активность при окислении серосодержащих органических соединений.
Заявляемое соединение может быть получено следующим образом.
Для синтеза заявляемого соединения используют следующие вещества:
- хлорид кобальта - ГОСТ 5852-70;
- ацетат никеля - ТУ 6-09-02-516-91
- 4-[4-(1-метил-1-фенилэтил)фенокси]-5-нитрофталонитрил, однако, поскольку это соединение является новым и не выпускается промышленностью, оно было получено следующим способом: из 4-бром-5-нитрофталодинитрила [Шишкина О.В., Майзлиш В.Е., Шапошников Г.П., Любимцев А.В., Смирнов Р.П., Бараньски А. «Галогенонитрофталимиды и фталодинитрилы на их основе» // Журнал общей химии. 1997. Т. 67. Вып. 5. С. 842-845.] путем нуклеофильного замещения атома брома на 4-(1-метил-1-фенилэтил)феноксигруппу, синтезируют целевой фталонитрил. Синтез осуществлялся следующим способом.
Синтез 4-[4-(1-метил-1-фенилэтил)фенокси]-5-нитрофталонитрила:
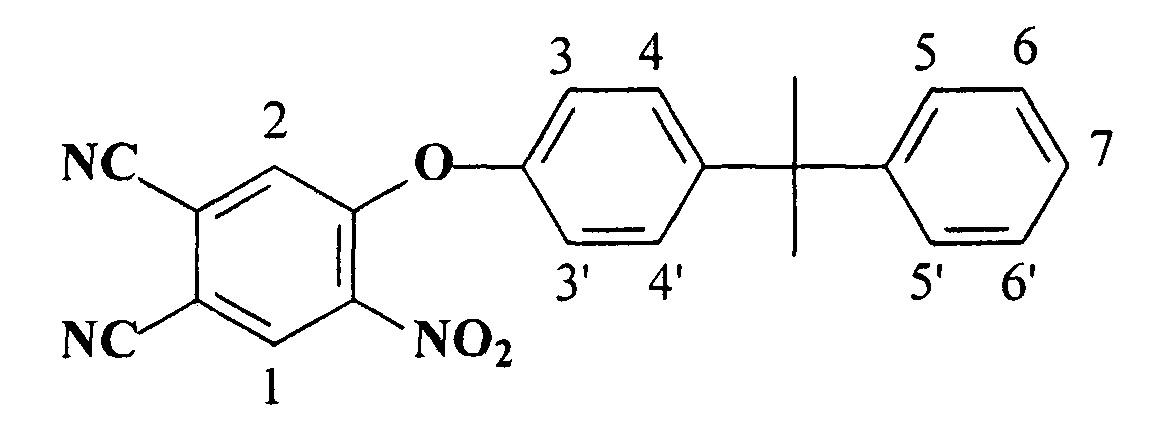
В 30 мл ДМФА растворяли 2.52 г (1 ммоль) 4-бром-5-нитрофталонитрила [Шишкина О.В., Майзлиш В.Е., Шапошников Г.П., Любимцев А.В., Смирнов Р.П., Бараньски А. «Галогенонитрофталимиды и фталодинитрилы на их основе» // Журнал общей химии. 1997. Т. 67. Вып. 5. С. 842-845.] и 2.12 г (1 ммоль) 4-(1-метил-1-фенилэтил)фенола, к полученному раствору прибавляли раствор 1.19 г (1 ммоль) K2CO3 в 5 мл воды и перемешивали при 25°С в течение 30 минут. Полученный осадок отфильтровывали на бумажном фильтре, промывали 2-пропанолом, затем водой до исчезновения выраженного запаха 2-пропанола и сушили на воздухе при 70-80°С.
Выход: 3.15 г (91%).
Найдено, %: С - 71.95, Н - 5.00, N - 10.74; C23H17N3O3;
Вычислено: С - 72.05, Н - 4.47, N - 10.96.
Масс-спектр, m/z = 383.22 [М]+, вычислено - 383.41.
ИК спектр, см-1: 2922, 2850 (-СН3), 2229 (-CN), 1527 (асим. -NO2), 1341 (симм. -NO2), 1210 (Ar-О-Ar).
ЯМР1Н спектр, δ, м.д.: 8.33 (с, H1, 1Н), 7.87 (д, Н2, 1Н), 7.05 (м, Н3,4, 4Н), 7.12 (м, Н5-7, 5Н), 1.76 (с, -СН3, 6Н).
Полученный 4-[4-(1-метил-1-фенилэтил)фенокси]-5-нитрофталонитрил - желтый порошок, растворимый в ацетоне, хлороформе, бензоле, ДМФА и нерастворимый в воде.
Пример 1. Синтез тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианина кобальта
Тщательно растертую смесь 0.38 г (0.1 ммоль) 4-[4-(1-метил-1-фенилэтил)фенокси]-5-нитрофталонитрила, 0.05 г (0.8 ммоль) мочевины и 0.57 г (0.2 ммоль) CoCl2⋅6Н2О нагревали при 185°С в течение 2 часов. По окончании процесса реакционную массу промывали разбавленной соляной кислотой для удаления продуктов разложения мочевины, затем водой до исчезновения реакции на хлорид-анионы с нитратом серебра, затем сушили на воздухе при 70-80°С, затем растворяли в хлороформе и подвергали колоночной хроматографии на оксиде алюминия, элюируя хлороформом. Получено твердое вещество темно-зеленого цвета, нерастворимое в воде, хорошо растворимое в хлороформе и ДМФА.
Выход: 0.33 г. (92%).
Найдено, %: С - 69.21, Н - 4.11, N - 10.42; C92H68CoN12O12;
Вычислено: С - 69.39, Н - 4.30, N - 10.55.
Масс-спектр: m/z=1591.89 [М]+, вычислено - 1591.44 (Фиг. 1).
ИК спектр, (KBr)/см-1: 2953, 2935, 2850 (СН3), 1538 (NO2, ассим.), 1352 (NO2, сим.), 1242 (Ar-О-Ar).
ЭСП λmax, нм: в ДМФА 683; ЭСП в H2SO4 797 (Фиг. 3).
Пример 2. Синтез тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианина никеля
Тщательно растертую смесь 0.38 г (0.1 ммоль) 4-[4-(1-метил-1-фенилэтил)фенокси]-5-нитрофталонитрила, 0.05 г (0.8 ммоль) мочевины и 0.97 г (0.2 ммоль) Ni(CH3COO)2⋅4H2O нагревали при 185-190°С в течение 2 часов. По окончании процесса реакционную массу промывали разбавленной соляной кислотой для удаления продуктов разложения мочевины, затем водой до исчезновения реакции на хлорид-анионы с нитратом серебра, затем сушили на воздухе при 70-80°С, затем растворяли в хлороформе и подвергали колоночной хроматографии на оксиде алюминия, элюируя хлороформом. Получено твердое вещество темно-зеленого цвета, нерастворимое в воде, хорошо растворимое в хлороформе и ДМФА.
Выход: 0.32 г (84%).
Найдено, %: С 69.16, Н 4.42, N 10.18; C92H68NiN12O12;
Вычислено: С 69.40, Н 4.30, N 10.56.
Масс-спектр, m/z = 1593.44 [М+Н]+, вычислено - 1592.32 (Фиг. 2).
ИК спектр, (KBr)/см-1: 2964, 2929, 2866 (СН3), 1542 (NO2, ассим.), 1346 (NO2, сим.), 1251 (Ar-О-Ar).
ЯМР1H спектр, δ, м.д. (CDCl3): 8.29 (с, H1, 4Н), 7.83 (м, Н2, 4Н), 7.22 (м, Н5, 6, 7, 24Н), 7.08 (м, Н3, 4, 16Н), 1.65 (с, -СН3, 24Н).
ЭСП λmax, нм: в ДМФА 643, 669; ЭСП в H2SO4 813 (Фиг. 4).
Пример 3. Использование тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианина кобальта в качестве исходного соединения для синтеза тетра-4-{4-[1-метил-1-(4-сульфофенил)этил]фенокси}тетра-5-нитрофталоцианина кобальта
Тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианин кобальта (160 мг, 0.1 ммоль) подвергали взаимодействию со смесью 2 мл (18 ммоль) хлорсульфоновой кислоты и 2 мл (18 ммоль) тионилхлорида при комнатной температуре в течение 2 часов. По окончании перемешивания реакционную смесь выливали на лед, обработанный хлористым натрием. Выпавший осадок собирали на фильтре Шотта, высушивали в эксикаторе над серной кислотой в течение 3 суток. Полученный сульфохлорид экстрагировали ацетоном, растворитель отгоняли, затем кипятили с водой до полного растворения, растворитель отгоняли. Окончательная очистка осуществлялась колоночной хроматографией: элюент - ДМФА, сорбент - силикагель М 60. Полученные продукты - твердые вещества темно-зеленого цвета, растворимые в ДМФА, воде, аммиаке, водно-щелочных растворах.
Выход: 137 мг (72%).
Найдено, %: С 57.71, N 8.56, Н 3.96, S 6.38; C92H68CoN12O24S4.
Вычислено: С 57.77, N 8.79, Н 3.58, S 6.70.
ИК спектр (KBr)/см-1: 2919, 2852 (СН3), 1504 (NO2, асим.), 1340 (NO2, сим.), 1172 (S=O), 1020 (C-S).
ЭСП λmax, нм: в ДМФА 696; ЭСП в H2SO4 787 (Фиг. 5).
Пример 4. Использование тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианинов кобальта и никеля в качестве жирорастворимого красителя для крашения полистирола
0.1 г Полистирола растворяли при нагревании в 1 мл хлороформа и добавляли 1 мл хлороформа, в котором растворено 0.002 г тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианина кобальта или никеля. Раствор кипятили в течение 3 минут и полученную массу выливали в форму.
Образцы прилагаются (Фиг. 6).
Пример 5. Использование тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианинов кобальта и никеля в качестве красителя для капрона
0.002 г Тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианинов кобальта и никеля растворяли при нагревании в 5 мл хлороформа и добавляли 25 мг синтетического волокна (капрон). Раствор кипятили в течение 3 минут, окрашенное волокно отжимали и сушили на воздухе.
Образцы прилагаются (Фиг. 7).
Пример 6. Использование тетра-4-{4-[1-метил-1-(4-сульфофенил)этил]фенокси}тетра-5-нитрофталоцианина кобальта в качестве гомогенного катализатора окисления соединений серы
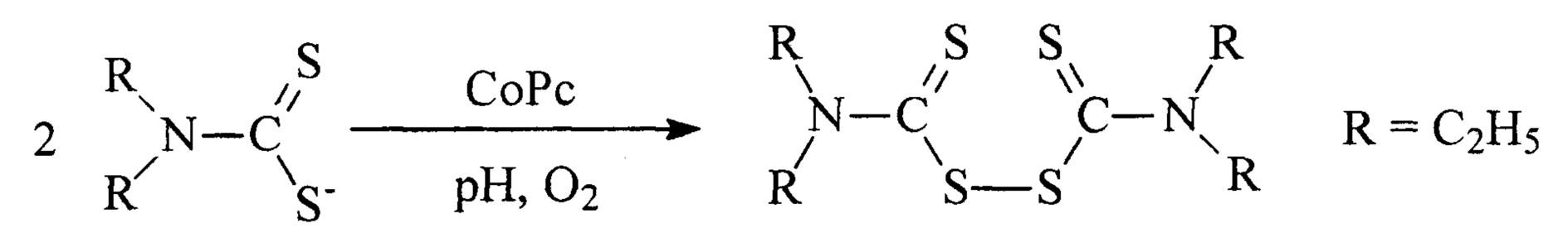
Каталитическую активность оценивают по величине эффективной константы скорости окисления N,N-диэтилдитиокарбамата натрия (ГОСТ 8864-71) кислородом воздуха при рН 7.6 и температуре 20-40°С (kэф). Окисление ведут при нормальном давлении в металлическом реакторе периодического действия объемом 650 мл, снабженном термометром, обратным холодильником, отводом для отбора проб и барботером для подачи воздуха со скоростью - 2 л/мин, обеспечивающей протекание процесса в кинетическом режиме. В реактор загружают 600 мл раствора N,N-диэтилдитиокарбамата натрия с концентрацией 0.1 г/л. Для определения текущей концентрации диэтилдитиокарбамата натрия пробу объемом 2 мл переносят в колбу на 25 мл и добавляют 4 мл 0,02 н CuSO4. Раствор сульфата меди готовят, используя реактив в соответствии с ГОСТ 19347-99. При добавлении сульфата меди к отобранной пробе образуется густой темно-коричневый осадок медного комплекса. Смесь перемешивают одну минуту. Затем к полученному раствору добавляют 5 мл хлороформа, 2-3 капли 50% уксусной кислоты и взбалтывают 1.5 минуты. Медный комплекс диэтилдитиокарбамата экстрагируют в слой хлороформа. Органический слой переносят в мерную колбу объемом 25 мл, а из оставшегося водного раствора комплекс экстрагируют повторно для повышения точности анализа. Собранный раствор медного комплекса доводят до метки хлороформом. Из этой колбы отбирают 2 мл раствора, переносят в другую мерную колбу объемом 25 мл и снова доводят до метки хлороформом. На спектрофотометре при длине волны 436 нм определяют оптическую плотность раствора и рассчитывают концентрацию N,N-диэтилдитиокарбамата на основании калибровочной прямой. Каталитическая активность тетра-4-{4-[1-метил-1-(4-сульфофенил)этил]фенокси}тетра-5-нитрофталоцианина кобальта измеренная при концентрации катализатора 8.16⋅10-4 моль/л и рН 8 приведена в таблице 1.
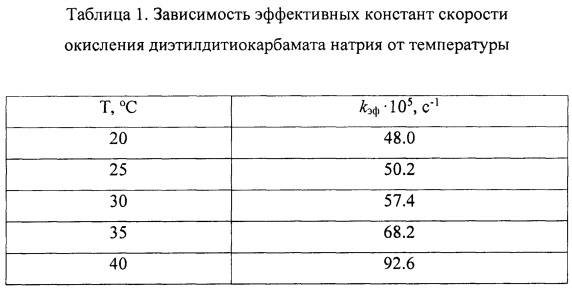
Из таблицы 1 видно, что при повышении температуры проведения процесса окисления происходит увеличение значения константы скорости окисления N,N-диэтилдитиокарбамата натрия (kэф).
Реферат
Изобретение относится к тетра-4-[4-(1-метил-1-фенилэтил)фенокси]тетра-5-нитрофталоцианинам кобальта и никеля общей формулыСоединения обладают красящей способностью по отношению к полистиролу и капрону и могут быть использованы в качестве исходных соединений для синтеза металлокомплекса тетра-4-{4-[1-метил-1-(4-сульфофенил)этил]фенокси}тетра-5-нитрофталоцианина с кобальтом, проявляющего каталитическую активность при окислении серосодержащих органических соединений. 7 ил., 1 табл., 6 пр.
Формула

Комментарии