Металлокомплексы окта-4,5-(4-сульфофенилсульфанил)фталоцианина с медью, цинком и кобальтом - RU2640303C1
Код документа: RU2640303C1
Чертежи






Описание
Изобретение относится к химической промышленности, а именно к получению новых производных фталоцианина, конкретно металлокомплексов окта-4,5-(4-сульфофенилсульфанил)фталоцианина с медью, цинком и кобальтом, обладающих красящей способностью по отношению к шерстяным и шелковым волокнам. При этом металлокомплекс окта-4,5-(4-сульфофенилсульфанил)фталоцианина с кобальтом проявляет каталитическую активность при окислении серосодержащих органических соединений.
Известны тетра-4-(фенилсульфанил)фталоцианин и его металлокомплексы с медью, никелем, кобальтом, цинком, алюминием [Деркачева В.М., Лукьянец Е.А. Фталоцианины и родственные соединения. XVIII. Фенокси- и фенилтиозамещенные фталоцианины // Журнал общей химии. 1980. Т. 50. №10. С. 2313-2316]
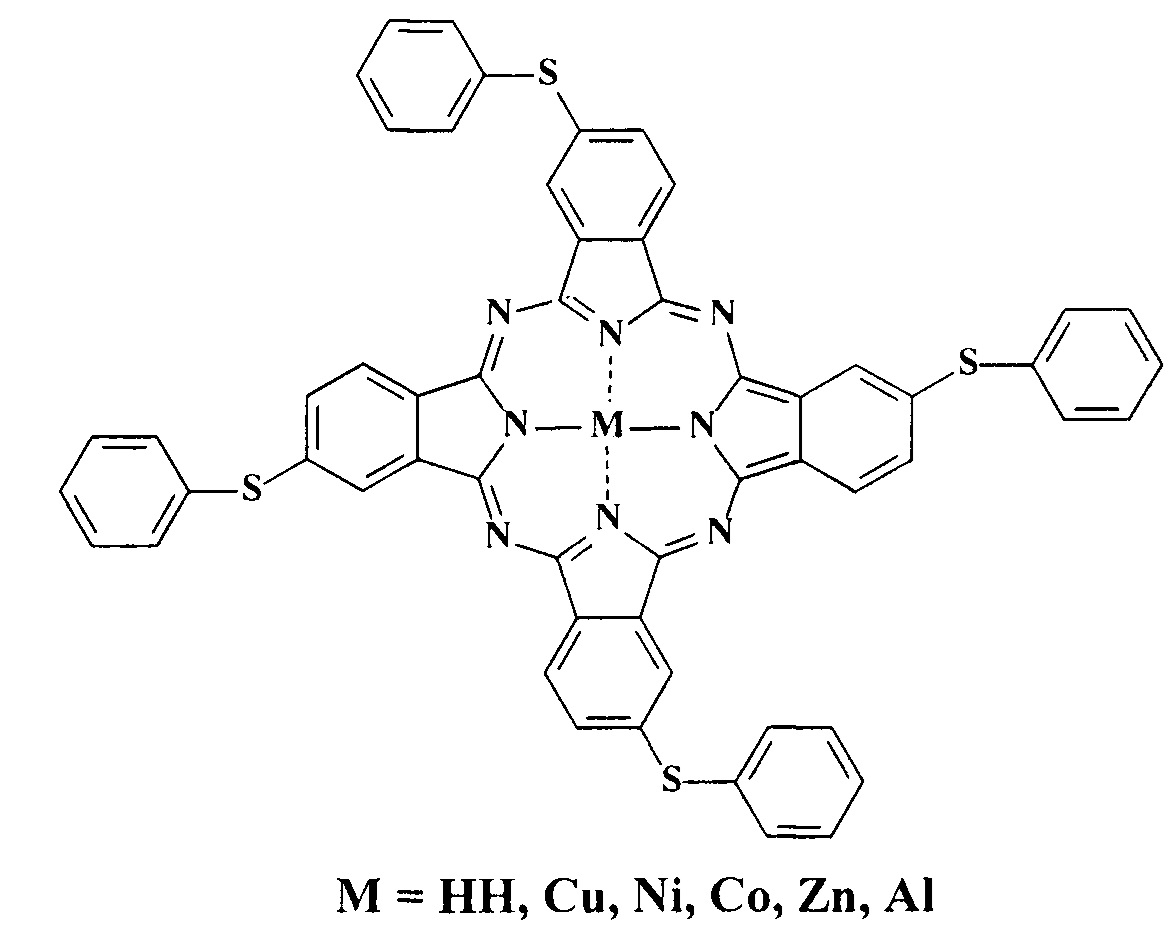
При этом тетра-4-(фенилсульфанил)фталоцианин и его металлокомплексы с медью, никелем, кобальтом, цинком, алюминием не растворимы в воде и не проявляют красящей способности по отношению к шерстяным и шелковым волокнам и не обладают каталитической активностью при гомогенном жидкофазном окислении серосодержащих органических соединений.
Еще одним структурным аналогом являются металлокомплексы тетра-(3,6-дихлор-4,5-дифенилсульфанил)фталоцианина с медью и цинком [Volkov K.А., Avramenko G.V., Negrimovskii V.M., Luk'yanets E.A. Phthalocyanines and Related Compounds: XLIII. Synthesis of Poly [phenyl(alkyl)sulfanyl] Substituted Phthalonitriles and Some Phthalocyanines Based Thereon // Russian Journal of General Chemistry. 2007. Vol. 77. N. 6. P. 1108-1116. DOI: 10.1134/S107036320706028X]

Данные соединения способны проявлять люминесцентные свойства, но не обладают растворимостью в воде и ничего не известно об их способности окрашивать шерстяные и шелковые волокна. Также ничего не известно о способности указанных соединений проявлять каталитическую активность при жидкофазном гомогенном окислении серосодержащих органических соединений.
Другим близким структурным аналогом является металлокомплекс тетра-[4-нитро-5-(4-сульфофенилсульфанил)]фталоцианина с кобальтом [Shishkina O.V., Maizlish V.E., Shaposhnikov G.P. Nucleophilic Substitution in 4-Bromo-5-nitrophthalodinitrile: IV. 5-Nitro-4-(phenylthio)phthalodinitrile and Octa-substituted Metal Phthalocyanines Based Thereon // Russian Journal of General Chemistry. Vol. 71. N. 2. 2001, pp. 243-245] формулы

обладающий растворимостью в воде и водно-щелочных средах. Однако ничего не известно о способности данного соединения окрашивать шерстяные и шелковые волокна и каталитической активности в реакциях жидкофазного гомогенного окисления серосодержащих органических соединений.
Наиболее близким структурным аналогом является металлокомплекс окта-4,5-(фенилсульфанил)фталоцианина с титаном [Таu P., Nyokong Т. Synthesis and photophysical properties of octa-substituted phthalocyaninato oxotitanium(IV) derivatives // J. Porphyrins Phthalocyanines 2006. Vol. 10. P. 1040-1048. DOI: 10.1142/S1088424606000399]
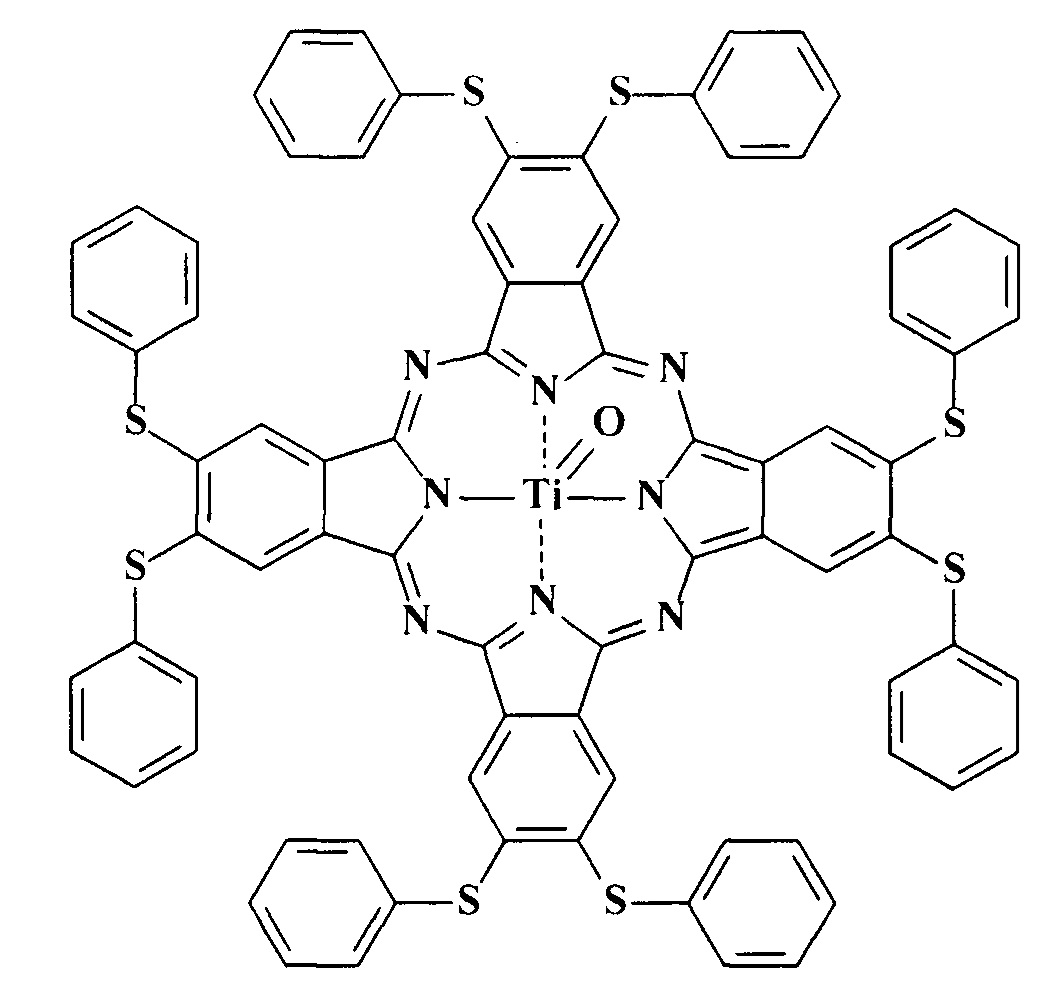
Данное соединение способно проявлять люминесцентные свойства, но не обладает растворимостью в воде и ничего не известно о его способности окрашивать шерстяные и шелковые волокна. Также ничего не известно о способности указанного соединения проявлять каталитическую активность при жидкофазном гомогенном окислении серосодержащих органических соединений.
Изобретательская задача состояла в поиске новых соединений, обладающих красящей способностью по отношению к шерстяным и шелковым волокнам и проявляющих каталитическую активность при окислении серосодержащих органических соединений.
Поставленная задача решена синтезом металлокомплексов окта-4,5-(4-сульфофенилсульфанил)фталоцианинов с медью, цинком и кобальтом общей формулы

проявляющих красящую способность по отношению к шерстяным и шелковым волокнам и каталитическую активность при окислении серосодержащих органических соединений.
Структура этих соединений доказана данными элементного анализа, ИК,1Н ЯМР и электронной спектроскопии, MALDT-TOF спектрометрии.
Краткое описание чертежей
На фиг. 1 изображен MALDI-TOF масс-спектр окта-4,5-(фенилсульфанил)фталоцианина меди; на фиг. 2 - электронный спектр поглощения окта-4,5-(фенилсульфанил)фталоцианин меди в ДМФА и H2SO4; на фиг. 3 - MALDI-TOF масс-спектр окта-4,5-(фенилсульфанил)фталоцианина цинка; на фиг. 4 - электронный спектр поглощения окта-4,5-(фенилсульфанил)фталоцианина цинка в ДМФА, хлороформе и H2SO4, спектр испускания в хлороформе; на фиг. 5 - MALDI-TOF масс-спектр окта-4,5-(фенилсульфанил)фталоцианина кобальта; на фиг. 6 - электронный спектр поглощения окта-4,5-(фенилсульфанил)фталоцианина кобальта в ДМФА и хлороформе; на фиг. 7 - MALDI-TOF масс-спектр окта-4,5-(4-сульфофенилсульфанил)фталоцианина меди; на фиг. 8 - электронный спектр поглощения окта-4,5-(фенилсульфанил)фталоцианина меди в ДМФА и Н2О; на фиг. 9 - MALDI-TOF масс-спектр окта-4,5-(4-сульфофенилсульфанил)фталоцианина цинка; на фиг. 10 - электронный спектр поглощения окта-4,5-(фенилсульфанил)фталоцианина цинка в ДМФА, С2Н5ОН и Н2О, спектр испускания в С2Н5ОН; на фиг. 11 - MALDI-TOF масс-спектр окта-4,5-(4-сульфофенилсульфанил)фталоцианина кобальта; на фиг. 12 - электронный спектр поглощения окта-4,5-(4-сульфофенилсульфанил)фталоцианина кобальта в ДМФА и Н2О; на фиг. 13 - образцы полученные по примеру 7, где (а) - шерсть и (б) шелк, окрашенные окта-4,5-(4-сульфофенилсульфанил)фталоцианином меди, (в) - шерсть и (г) - шелк, окрашенные окта-4,5-(4-сульфофенилсульфанил) фталоцианином цинка, (д) - шерсть, окрашенная окта-4,5-(4-сульфофенилсульфанил)фталоцианином кобальта.
Изобретение позволяет получить следующие преимущества.
1. Металлокомплексы окта-4,5-(4-сульфофенилсульфанил)фталоцианина с медью, цинком и кобальтом проявляют красящие свойства по отношению к шерстяным и шелковым волокнам.
2. Металлокомплекс окта-4,5-(4-сульфофенилсульфанил)фталоцианина с кобальтом проявляет каталитическую активность при окислении серосодержащих органических соединений.
Заявляемые соединения могут быть получены следующим образом.
Для синтеза заявляемых соединений используют следующие вещества:
- ацетат меди - ГОСТ 5852-70;
- ацетат цинка - ГОСТ 5823-78;
- хлорид кобальта - ГОСТ 5852-70;
- 4,5-(фенилсульфанил)фталонитрил, полученный по известной методике [Koptyaev А.I., Galanin N.E., Shaposhnikov G.P. Synthesis and Spectral Properties of Low-Symmetry Phenoxy(chloro) and Phenylsulfanyl(chloro) Substituted Phthalocyanines // Macroheterocycles. 2015. V. 8. N 2. P. 156-161. DOI: 10.6060/mhc140925g].
Пример 1. Синтез окта-4,5-(фенилсульфанил)фталоцианина меди.
Тщательно растертую смесь 0.35 г (1 ммоль) 4,5-ди(фенилсульфанил)фталонитрила, 50 мг (0.8 ммоль) мочевины и 0.11 г (0.5 ммоль) ацетата меди моногидрата нагревают при 178°С в течение 2 часов. По окончании процесса реакционную массу растворяют в хлороформе и подвергают колоночной хроматографии на оксиде алюминия, элюируя хлороформом. Получают твердые вещества темно-зеленого цвета, не растворимые в воде, хорошо растворимые в хлороформе, ацетоне и ДМФА.
Выход: 0.30 г (87%).
Масс-спектр, m/z 1442.00 [М+Н]+, вычислено 1441.34 (Фиг. 1).
Найдено, %: С 66.53; Н 3.84; N 7.62; S 17.55. C80H48CuN8S8.
Вычислено, %: С 66.67; Н 3.36; N 7.77; S 17.79.
ЭСП λmах, нм: ДМФА 704 (Фиг. 2, кривая 1); H2SO4 974 (Фиг. 2, кривая 2).
Пример 2. Синтез окта-4,5-(фенилсульфанил)фталоцианина цинка.
Тщательно растертую смесь 0.35 г (1 ммоль) 4,5-ди(фенилсульфанил)фталонитрила, 50 мг (0.8 ммоль) мочевины и 0.12 г (0.5 ммоль) ацетата цинка дигидрата нагревают при 185°С в течение 2 часов. По окончании процесса реакционную массу растворяют в хлороформе и подвергают колоночной хроматографии на оксиде алюминия, элюируя хлороформом. Получают твердые вещества темно-зеленого цвета, не растворимые в воде, хорошо растворимые в хлороформе, ацетоне и ДМФА.
Выход: 0.28 г (80%).
Масс-спектр, m/z 1441.99 [М-Н]+, вычислено 1443.17 (Фиг. 3).
Найдено, %: С 66.40; Н 3.72; N 7.55; S 17.21. C80H48ZnN8S8.
Вычислено, %: С 66.58; Н 3.35; N 7.76; S 17.77.
ЭСП λmах, нм: ДМФА 636, 708 (Фиг. 4, кривая 1); хлороформ 642, 710 (Фиг. 4, кривая 2), H2SO4 960 (Фиг. 4, кривая 3). Спектр испускания в хлороформе: 729 (Фиг. 4, кривая 4).
Пример 3. Синтез окта-4,5-(фенилсульфанил)фталоцианина кобальта.
Тщательно растертую смесь 0.35 г (1 ммоль) 4,5-ди(фенилсульфанил)фталонитрила, 50 мг (0.8 ммоль) мочевины и 0.12 г (0.5 ммоль) хлорида кобальта гексагидрата нагревают при 185°С в течение 2 часов. По окончании процесса реакционную массу растворяют в хлороформе и подвергают колоночной хроматографии на оксиде алюминия, элюируя хлороформом. Получают твердые вещества темно-зеленого цвета, не растворимые в воде, хорошо растворимые в хлороформе, ацетоне и ДМФА.
Выход: 0.30 г (86%).
ИК спектр, ν, см-1: 1569 (С-Сскел), 1511 (-N=), 1245 (САr-H), 691 (C-S-C), 644 (С-Ндеф.).
Масс-спектр, m/z 1439.34 [М+3Н]+, вычислено 1436.73 (Фиг. 5).
Найдено, %: С 66.33; Н 3.68; N 7.63; S 17.66. C80H48CoN8S8.
Вычислено, %: С 66.88; Н 3.37; N 7.80; S 17.85.
ЭСП λmах, нм: ДМФА 687 (Фиг. 6).
Пример 4. Синтез окта-4,5-(4-сульфофенилсульфанил)фталоцианина меди.
В двухгорловой колбе объемом 100 мл, снабженной обратным холодильником, готовят смесь 2 мл (18 ммоль) хлорсульфоновой кислоты и 2 мл (18 ммоль) тионилхлорида, затем при интенсивном перемешивании вносят 0.29 г (0.2 моль) окта-4,5-(фенилсульфанил)фталоцианина меди и перемешивают при 20°С в течение 0.5-1 часа. Затем реакционную массу выливают на лед, обработанный хлоридом натрия. Выпавший осадок собирают на фильтре Шотта и сушат в эксикаторе над серной кислотой в течение 3 суток. Затем целевые соединения экстрагируют ацетоном, растворитель отгоняют. Полученный сульфохлорид экстрагируют ацетоном, растворитель отгоняют, затем кипятят с водой до полного растворения, растворитель отгоняют. Окончательную очистку осуществляют колоночной хроматографией: элюент - ДМФА, сорбент - силикагель М 60. Полученный продукт - твердое вещество темно-зеленого цвета, растворимое в ДМФА, воде, аммиаке, водно-щелочных растворах.
Выход: 172 мг (83%).
Масс-спектр: 2191 [M+2K+Na]+, вычислено 2092 (Фиг. 7).
ИК спектр, ν, см-1: 3536 (ОН), 1611 (С-Сскел), 1530 (-N=), 1163 (S=O), 1289 (СAr-Н), 712 (С-Ндеф.), 691 (C-S-C).
Найдено, %: С 46.12; Н 2.53, N 5.27; S 24.41. C80H48CuN8O24S16.
Вычислено, %: С 46.16; Н 2.32; N 5.38; S 24.64.
ЭСП λmах, нм: ДМФА 707 (Фиг. 8, кривая 1); H2SO4 941 (Фиг. 8, кривая 2).
Пример 5. Синтез окта-4,5-(4-сульфофенилсульфанил)фталоцианина цинка.
В двухгорловой колбе объемом 100 мл, снабженной обратным холодильником, готовят смесь 2 мл (18 ммоль) хлорсульфоновой кислоты и 2 мл (18 ммоль) тионилхлорида, затем при интенсивном перемешивании вносят 0.29 г (0.2 моль) окта-4,5-(фенилсульфанил)фталоцианина цинка и перемешивают при 20°С в течение 0.5-1 часа. Затем реакционную массу выливают на лед, обработанный хлоридом натрия. Выпавший осадок собирают на фильтре Шотта и сушат в эксикаторе над серной кислотой в течение 3 суток. Затем целевые соединения экстрагируют ацетоном, растворитель отгоняют, затем кипятят с водой до полного растворения, растворитель отгоняют. Окончательную очистку осуществляют колоночной хроматографией: элюент - ДМФА, сорбент - силикагель М 60. Полученный продукт - твердое вещество темно-зеленого цвета, растворимое в ДМФА, воде, аммиаке, водно-щелочных растворах.
Выход: 171 мг(82%).
ИК спектр, ν, см-1: 3533 (ОН), 1614 (С-Сскел), 1530 (-N=), 1161 (S=O), 1289 (СAr-H), 712 (С-Ндеф.), 692 (C-S-C).
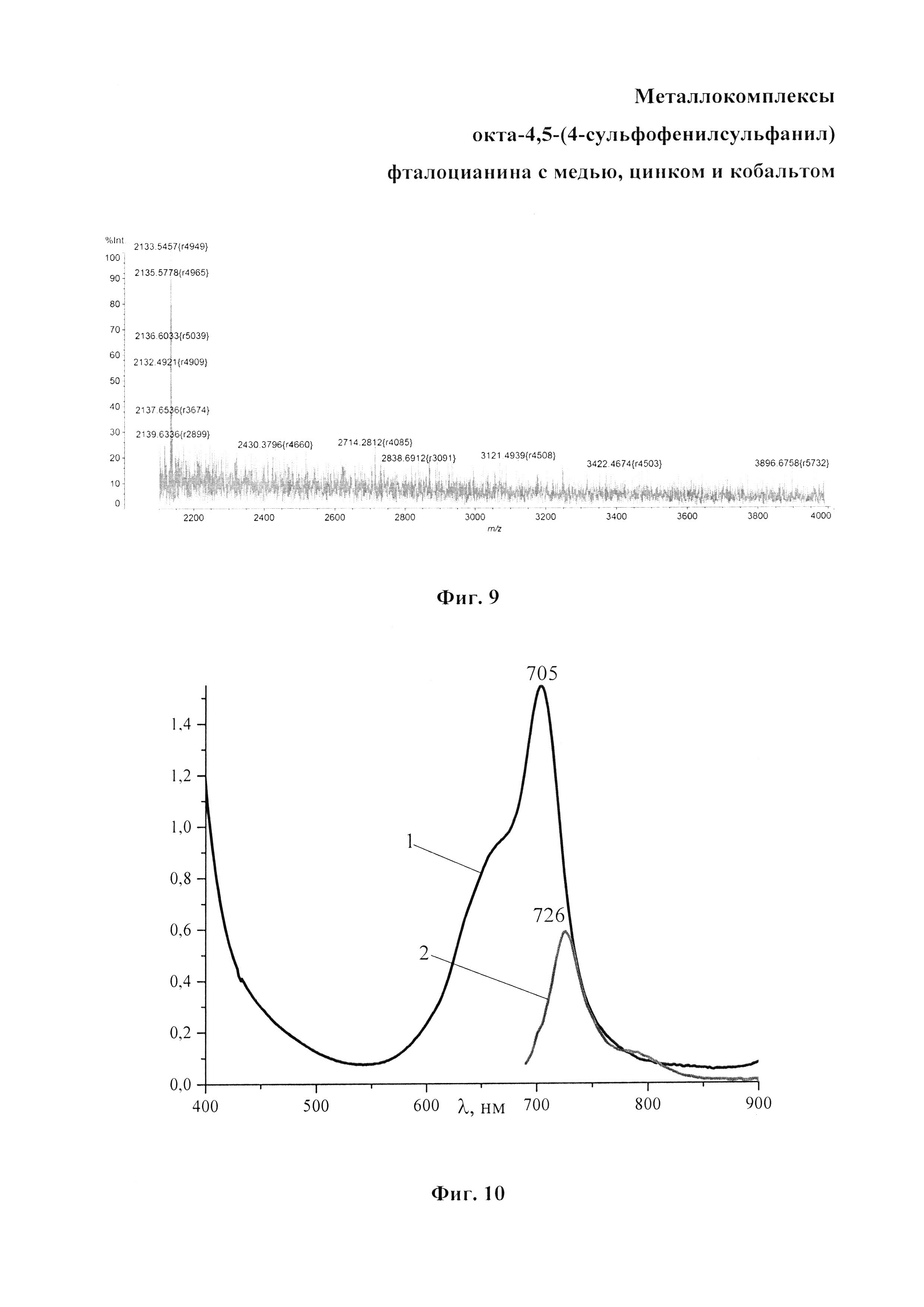
Масс-спектр: 2133 [М+К-Н]+, вычислено 2094 (Фиг. 9).
Найдено, %: С 46.05; Н 2.65, N 5.21; S 24.24. C80H48ZnN8O24S16.
Вычислено, %: С 46.18; Н 2.32; N 5.38; S 24.62.
ЭСП λmах, нм: ДМФА 638, 709 (Фиг. 10, кривая 1); С2Н5ОН 705 (Фиг. 10, кривая 2); H2SO4 945 (Фиг. 10, кривая 3). Спектр испускания в С2Н5ОН 726 (Фиг. 10, кривая 4).
Пример 6. Синтез окта-4,5-(4-сульфофенилсульфанил)фталоцианина кобальта.
В двухгорловой колбе объемом 100 мл, снабженной обратным холодильником, готовят смесь 2 мл (18 ммоль) хлорсульфоновой кислоты и 2 мл (18 ммоль) тионилхлорида, затем при интенсивном перемешивании вносят 0.28 г (0.2 моль) окта-4,5-(фенилсульфанил)фталоцианина кобальта и перемешивают при 20°С в течение 0.5-1 часа. Затем реакционную массу выливают на лед, обработанный хлоридом натрия. Выпавший осадок собирают на фильтре Шотта и сушат в эксикаторе над серной кислотой в течение 3 суток. Затем целевые соединения экстрагируют ацетоном, растворитель отгоняют, затем кипятят с водой до полного растворения, растворитель отгоняют. Окончательную очистку осуществляют колоночной хроматографией: элюент - ДМФА, сорбент - силикагель М 60. Полученный продукт - твердое вещество темно-зеленого цвета, растворимое в ДМФА, воде, аммиаке, водно-щелочных растворах.
Выход: 164 мг(78%).
ИК спектр, ν, см-1: 3564 (ОН), 1613 (С-Сскел), 1532 (-N=), 1160 (S=O), 1290 (СAr-H), 712 (С-Ндеф.), 693 (C-S-C).
Масс-спектр, m/z 522.61 [М]4-, вычислено 2089.79 [М] или 522.45 [М]4- (Фиг. 11).
Найдено, %: С 45.84; Н 2.80, N 5.24; S 24.34. C80H48CoN8O24S26.
Вычислено, %: С 46.26; Н 2.33; N 5.39; S 24.65.
ЭСП λmах, нм: ДМФА 703 (Фиг. 12, кривая 1), вода (Фиг. 12, кривая 2).
Пример 7. Использование металлокомплексов окта-4,5-(4-сульфофенилсульфанил)фталоцианина с медью, цинком и кобальтом и тетра-4-нитротетра-5-(4-сульфофениилсульфанил)фталоцианина кобальта в качестве красителя для шерсти и шелка.
В 60 мл воды растворяют 2 г глауберовой соли и добавляют 1 мл концентрированной серной кислоты, затем 0.2 г испытуемых фталоцианинов и вносят 1 г шерсти или шелка. Полученную смесь нагревают до кипения и проводят крашение 50-60 минут. По окончании образец промывают теплой водой и высушивают.
Образцы прилагаются (Фиг. 13).
Пример 8. Использование металлокомплекса окта-4,5-(4-сульфофенилсульфанил)фталоцианина с кобальтом в качестве гомогенного катализатора окисления соединений серы.

Каталитическую активность оценивают по величине эффективной константы скорости окисления N,N-диэтилдитиокарбамата натрия (ГОСТ 8864-71) кислородом воздуха при рН 7.6 и температуре 25°С (kэф). Окисление ведут при нормальном давлении в металлическом реакторе периодического действия объемом 650 мл, снабженном термометром, обратным холодильником, отводом для отбора проб и барботером для подачи воздуха со скоростью - 2 л/мин, обеспечивающей протекание процесса в кинетическом режиме. В реактор загружают 600 мл раствора N,N-диэтилдитиокарбамата натрия с концентрацией 0.1 г/л. Для определения текущей концентрации N,N-диэтилдитиокарбамата натрия пробу объемом 2 мл переносят в колбу на 25 мл и добавляют 4 мл 0,02 н CuSO4. Раствор сульфата меди готовят, используя реактив в соответствии с ГОСТ 19347-99. При добавлении сульфата меди к отобранной пробе образуется густой темно-коричневый осадок медного комплекса. Смесь перемешивают одну минуту. Затем к полученному раствору добавляют 5 мл хлороформа, 2-3 капли 50% уксусной кислоты и взбалтывают 1.5 минуты. Медный комплекс диэтилдитиокарбамата экстрагируют в слой хлороформа. Органический слой переносят в мерную колбу объемом 25 мл, а из оставшегося водного раствора комплекс экстрагируют повторно для повышения точности анализа. Собранный раствор медного комплекса доводят до метки хлороформом. Из этой колбы отбирают 2 мл раствора, переносят в другую мерную колбу объемом 25 мл и снова доводят до метки хлороформом. На спектрофотометре при длине волны 436 нм определяют оптическую плотность раствора и рассчитывают концентрацию N,N-диэтилдитиокарбамата на основании калибровочной прямой.
Каталитическая активность окта-4,5-(4-сульфофенилсульфанил)фталоцианина кобальта измеренная при концентрации катализатора может быть оценена с помощью эффективной константы скорости окисления диэтилдитиокарбамата натрия, измеренная при рН=7.6 и концентрации катализатора 6.5×10-5 моль/л, которая составляет 12.5.
Реферат
Изобретение относится к металлокомплексам окта-4,5-(4-сульфофенилсульфанил)фталоцианина с медью, цинком и кобальтом общей формулыУказанные металлокомплексы обладают красящей способностью по отношению к шерстяным и шелковым волокнам. 13 ил., 8 пр.
Формула


Комментарии