Производные индолопирролокарбазола, способы их получения и соединение - RU2117671C1
Код документа: RU2117671C1
Чертежи
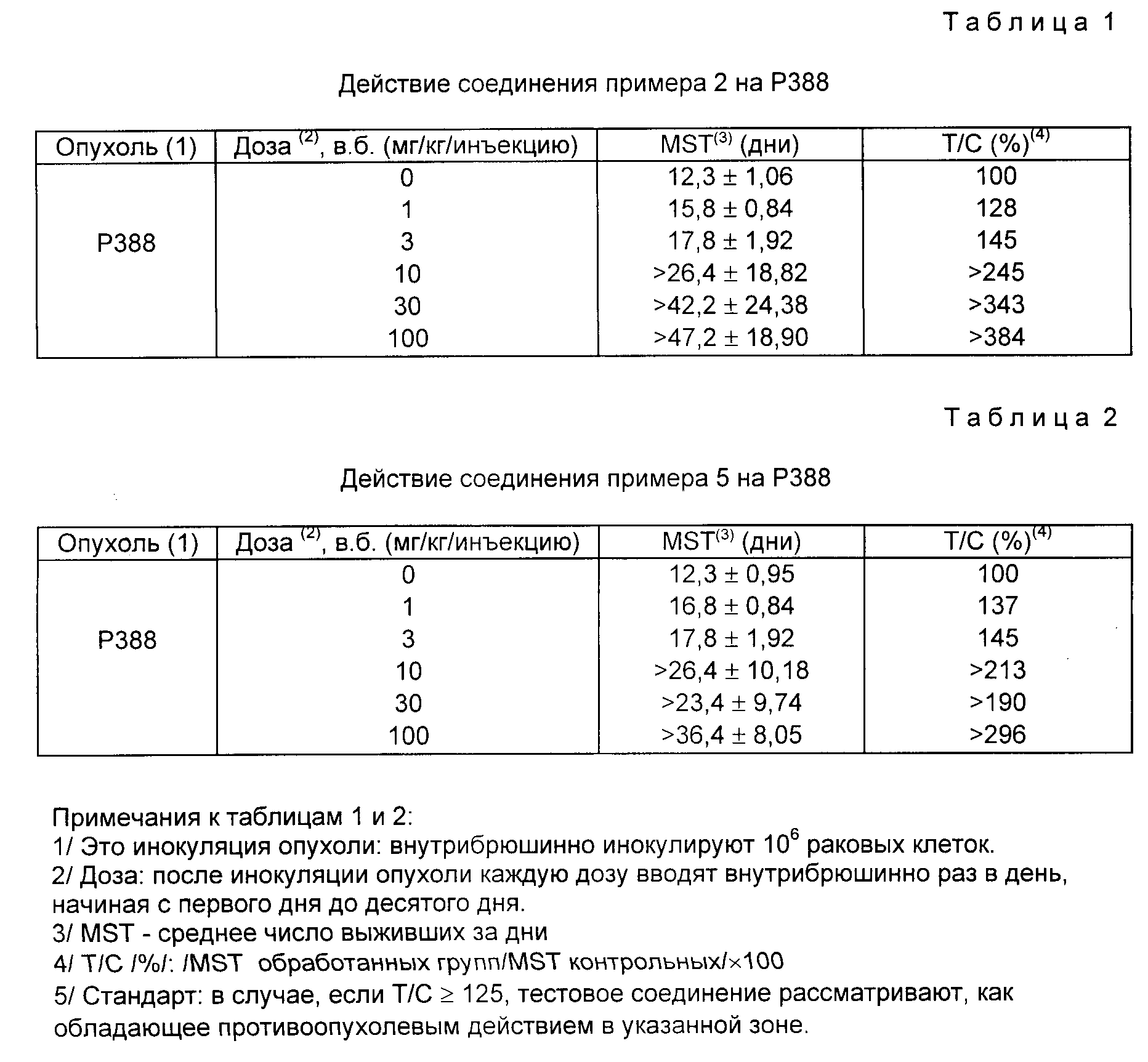
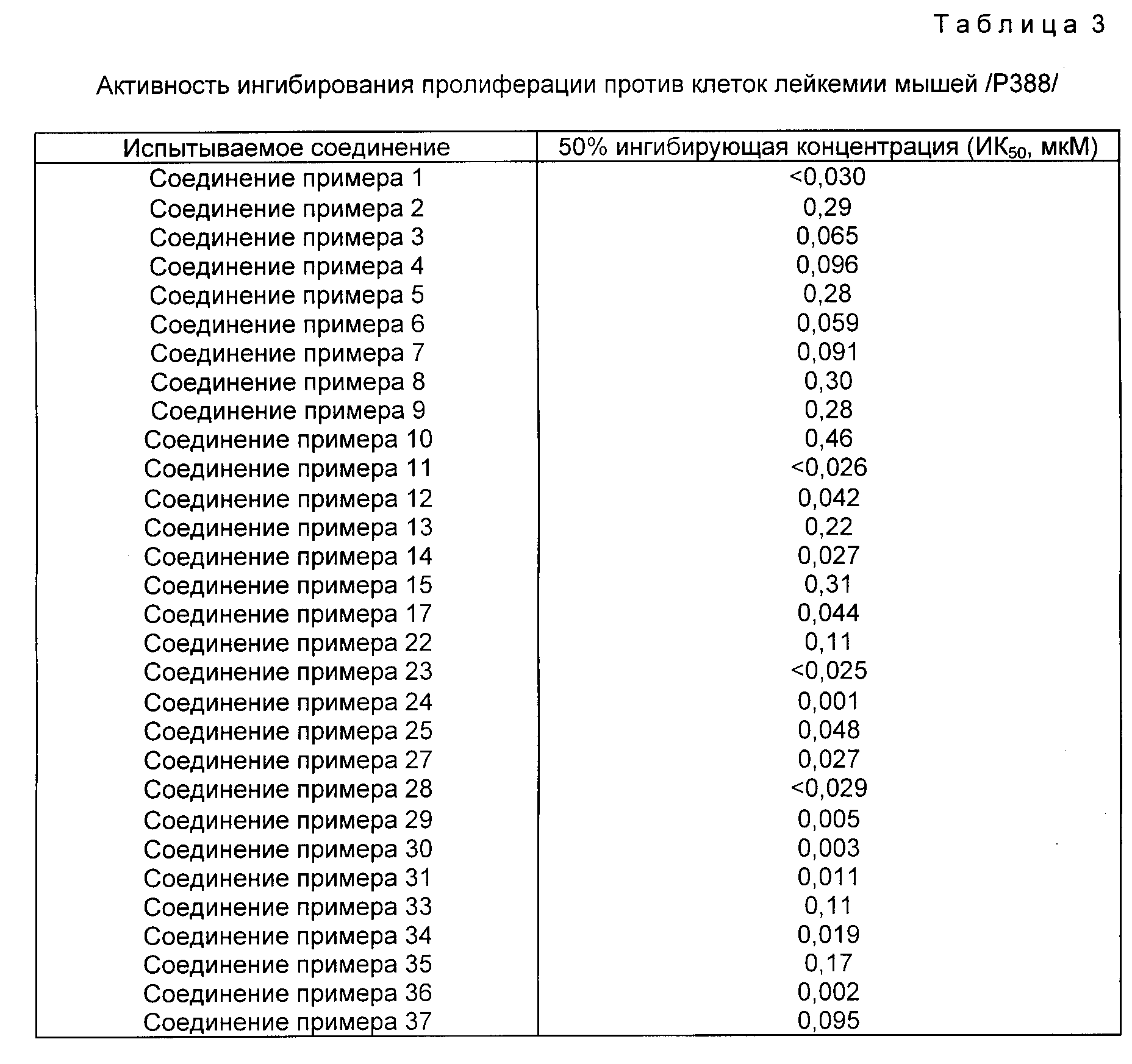
Описание
Пример 35
Соединение,
представленное формулой 37

25 мг соединения, полученного в примере А, растворяют в 1,5 мл N, N-диметилформамида, добавляют 30 мг альфа-пиколиногидразида, и полученную смесь перемешивают при 80oC в течение 2 ч. Ее смешивают с 50 мл этилацетата, и полученную смесь промывают последовательно водой, а затем насыщенным солевым раствором, дегидратируют безводным сульфатом натрия и концентрируют досуха. Остаток растворяют в 1 мл метанола, обрабатывают на хроматографической колонке Сефадекс LH-20 /1,8 x 15 см/ и элюируют метанолом. Фракции, содержащие целевой продукт концентрируют досуха до получения 30 мг указанного в заглавии соединения, представленного формулой 37.
Rf величина: 0,58 /Кизельгель 60F254 продукт Merck Co, проявляющий растворитель: хлороформ:метанол:тетрагидрофуран = 2:1:1/.
FAB-Масс-спектр /м/z/:640 /M+H/+
1H-ЯМР /300 МгГц, DMCO-d6/ δ мд: 11,43 /1Н, с/, 11,02 /1Н, с/, 10,45 /1Н, с/, 10,07 /1Н, с/, 8,82 /1Н, д, J=4,2 Гц/, 8,75 /1Н, д, J=7,3 Гц/, 7,3 Гц/, 8,48
/1Н, д, J=7,9 Гц/, 8,12 /2Н, м/, 7,75 /1Н, м/, 7,20 /2Н, т, J=7,0 Гц/, 7,00-7,15 /3Н, м/, 5,45 /1Н, д, J=6,3 Гц/, 5,40 /1Н, шир. с/, 5,25 /1Н, д, J=6,3 Гц/, 4,96 /1Н, шир. с/, 4,04 /2Н, м/, 3,76 /1Н,
м/, 3,55-3,72 /2Н, м/, 3,42 /1Н, м/.
Пример 36
Соединение, представленное формулой 38
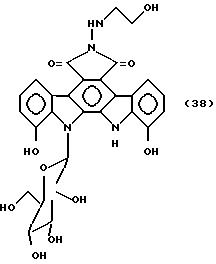
30 мг соединения, полученного в примере А, растворяют в 1 мл N,N-диметилформамида, добавляют 30 мг 2-гидразиноэтанола, и полученную смесь перемешивают при 80oC в течение 2 ч. Ее концентрируют досуха. Остаток растворяют в 1 мл метанола, обрабатывают на хроматографической колонке Сефадекс LH-20 /1,8 x 20 см/ и элюируют метанолом. Фракции, содержащие целевой продукт, концентрируют досуха до получения 32 мг указанного в заглавии соединения, представленного формулой 38, Rf величина : 0,32 /Кизельгель 60F254, продукт Merck Co проявляющий растворитель: хлороформ:метанол = 2:1/.
1H ЯМР /300 МгГц, DMCO-d6/ δ мд: IP, 91 /1Н, с/, 10,35 /1Н, с/, 9,98 /1Н, шир. с/, 8,70 /1Н, д, J=6,7 Гц/, 8,53 /1Н, д, J=6,9 Гц/, 7,18 /2Н, т, J= 7,6 Гц/, 6,99-7,06 /3Н, м/, 5,76 /1Н, т, J=5,2 Гц/, 5,41 /1Н, д, J=5,6 Гц/, 5,32 /1Н, шир. с/, 5,20 /1Н, д, J=5,2 Гц/, 4,98/4,98 /1Н, шир. с/, 4,51 /1Н, т, J=4,9 Гц/, 3,96-4,06 /2Н, м/, 3,73 /1Н, м/, 3,55-3,70 /4Н, м/, 3,39 /1Н, м/, 3,12 /2Н, м/.
Пример 37
Соединение, представленное формулой 39

40 мг соединения, полученного в примере А, растворяют в 2 мл N,N-диметилформамида, добавляют 10 мг 1-аминопиролидингидрохлорида и 0,1 мл водного раствора бикарбоната натрия, и полученную смесь перемешивают при 80oC в течение 2 ч. К этому добавляют 40 мл воды, и полученную смесь экстрагируют этилацетатом /40 мл x 2/. Полученный этилацетатный слой дегидратируют безводным сульфатом натрия и концентрируют досуха. Остаток растворяют в 1 мл метанола, обрабатывают хроматографически на колонке Сефадекс LH-20 /1,8 x 20 см/ и элюируют метанолом. Фракции, содержащие целевой продукт, концентрируют досуха до получения 10,0 мг указанного в заглавии соединения, представленного формулой 39.
Rf величина: 0,33 /Кизельгель 60F254, продукт Merck Co, проявляющий растворитель: хлороформ:метанол = 4:1/.
FAB-Масс-спектр /м/z/:589 /M+H/+
1H ЯМР /300 МгГц,
DMCO-d6/,

Пример 38
Соединение, представленное формулой 40

90 мг 6-бензилоксиметил-1,11-бензилокси-12,13-дегидро-5Н-индоло [2,3-a] пирроло[3,4-c] карбазол-4,7/6Н/-диона, соединение, раскрытое в PCТ/W 091/18003, 1,3 г оксида серебра и 550 мг молекулярных сит 4А суспендируют в 30 мл безводного бензола. После кипячения с обратным холодильником в течение 20 мин прикапывают раствор 416,4 мг α -бром-3-деокси-3-азодо-2,4,6-триацетил-Д-глюкозы в 5 мл безводного бензола за 10 мин. Затем кипячение с обратным холодильником продолжают в течение 2 дн, нерастворимый материал отфильтровывают на Целите. Полученный фильтрат концентрируют досуха, и остаток растворяют в 150 мл этилацетата, промывают последовательно 0,2 н. соляной кислотой, водой, а затем насыщенным солевым раствором, дегидратируют безводным сульфатом натрия, и концентрируют досуха. Полученный остаток растворяют в 5 мл хлороформа, обрабатывают на хроматографической колонке Сефадекс LH-20 /3,0 x 80 см/, и элюируют хлороформом. Фракции, содержащие целевой продукт, концентрируют досуха, а остаток очищают с помощью препаративной тонкослойной хроматографии /н-гексан:ацетон:тетрагидрофуран = :1:0,1; Rf : 0,5/, затем толуол:ацетон = 10:1 /Rf : 0,5/ /до получения 9,2 мг 6/бензолоксиметил-1,11-дибензилокси-12,13-дигидро-13-/ β -D-глюкопиранозил/-5Н-индоло-[2,3-a]пирроло-[3,4-c]карбазол-5,7-/6Н/-диона.
9,2 мг полученного соединения растворяют в 1 мл гидразинмоногидрата, и полученный раствор перемешивают при комнатной температуре в течение 4 ч. Его смешивают с 30 мл этилацетата, и полученную смесь промывают последовательно 0,2 н. соляной кислотой, водой, а затем насыщенным солевым раствором, дегидратируют безводным сульфонатом натрия и концентрируют досуха. Полученный остаток растворяют в 0,5 мл тетрагидрофурана - 1 мл метанола, добывают палладиевую чернь, и полученную смесь перемешивают в потоке водорода при комнатной температуре в течение 3 ч. Нерастворимую часть отфильтровывают на Целите, к полученному фильтрату добавляют 1,5 мл 10% смеси хлористый метиле/метанол, и полученную смесь концентрируют досуха. Остаток растворяют в 0,5 мл метанола, обрабатывают хроматографически на колонке Сефадекс LH-20 /1,0 x 15 см/, и элюируют метанолом. Фракции, содержащие целевой продукт, концентрируют досуха до получения 2,0 мг указанного в заглавии соединения: представленного формулой 40.
Rf значение: 0,5 /Кизельгель 60F254, проявляющий растворитель: н-бутанол:уксусная кислота: вода = 4:1:1/.
FAB-Масс-спектр /м/z/:534 /M+H/+
1H ЯМР /400 МгГц,
DMCO-d6/, δ мд: 10,80 /1Н, с/, 10,48 /1Н, с/, 10,20 /1Н, с/, 8,79 //1Н, д, J=7,9 Гц/, 8,52 /3Н, шир. с/, 8,50 /1Н, д, J=9,2 Гц/, 7,61 /1Н, д, J=6,6 Гц/, 7,16 /1Н, дд, J=9,2 9,2 Гц/,
7,10 /1Н, дд, J=9,2 9,2 Гц/, 7,05 /1Н, дд, J=9,2 Гц/, 7,00 /1Н, дд, J= 9,2 9,2 Гц/, 6,42 /1Н, д, J= 5,2 Гц/, 6,16 /1Н, д, J=3,9 Гц/, 5,18 /1Н, лир/, 4,93 /1Н, шир/, 4,40 /1Н, м/, 4,16 /1Н, м/, 4,03
/1Н, м/ 3,78 /1Н, м/, 3,68 /1Н, м/, 3,42 /1Н, м/.
Пример 39
Соединение, представленное формулой 41.

30 мг соединения, полученного в примере А, растворяют в 1,5 мл N,N-диметилформамида, добавляют 60 мг цианоацетатогидразида, и полученную смесь перемешивают при 80oC в течение 9 ч. Эту смесь смешивают с 30 мл этилацетата, полученную смесь промывают последовательно водой, затем насыщенным солевым раствором, затем этилацетатный слой дегидратируют безводным сульфатом натрия и концентрируют досуха. Полученный остаток растворяют в небольшом количестве метанола, обрабатывают на хроматографической колонке Сефадекс LH-20 /1,5 x 15 см/ и элюируют метанолом. Фракции, содержащие целевой продукт, концентрируют досуха до получения 27,8 мг указанного в заглавии соединения, представленного формулой 41.
Rf значение: 0,53 /Кизельгель 60F254, продукт Merck Co, проявляющий растворитель: хлороформ:метанол:тетрагидрофуран = 3:1:0,1.
FAB-Масс-спектр /м/z/:601 /M+H/+
1H ЯМР /300
МгГц, DMCO-d6/, δ /мд/: 11,14 /1Н, с/, 11,01 /1Н, с/, 10,42 /1Н, с/, 10,04 /1Н, с/, 8,65 /1Н, д, J=7,6 Гц/, 8,47 /1Н, д, J=7,6 Гц/, 7,21 /2Н, т, J=7,6 Гц/, 7,05 /3Н, т, J=7,6 Гц/, 5,
41 /2Н, д, J=4,5 Гц/, 5,19 /1Н, д, J=6,8/, 4,90 /1Н, д, J=6,8 Гц/, 4,13 /2Н, с/, 4,04 /2Н, шир./, 3,75 /1Н, м/, 3,64 /2Н, м/, 3,43 /1Н, м/.
Пример 40
Соединение,
представленное формулой 42

1 г 12,13-дигидро-1,11-дигидрокси-13-/ β -D-глюкопиранозил/ -5Н-индоло[2,3-a] пирроло[3,4-c] карбазол-5,7/6Н/-диона растворяют в 25 мл тетрагидрофурана, и добавляют эфирный раствор избытка диазометана; полученную смесь перемешивают при 4oC в течение ночи, и образующийся желтый осадок собирают фильтрованием. Его растворяют в 3 мл гидразинмоногидрата, и полученный раствор оставляют реагировать при комнатной температуре в течение 1,5 ч. После завершения реакции добавляют 200 мл очищенной воды, и полученный осадок собирают фильтрованием, промывают последовательно очищенной водой, а затем метанолом, и сушат при пониженном давлении, в результате чего получают 683,4 мг указанного в заглавии соединения, представленного формулой 42.
1 г 12,13-дигидро-1,11-дигидрокси-13-/
FAB-Масс-спектр /м/z/:563 /M+H/+
1H ЯМР /300 МгГц, DMCO-d6/, δ мд: 10,9 /1Н, с/, 8,87 /1Н, д, J=7,8 Гц/, 8,65 /1Н, д, J=7,8 Гц/, 7,35 /1Н, т, J=7,8 Гц/,
7,23 /1Н, т, J=7,8 Гц/, 7,25 /1Н, д, J=7,8 Гц/, 7,18 /1Н, д, J=7,8 Гц/, 6,90 /1Н, д, J=9,3 Гц/, 5,40 /1Н, шир. с/, 5,18 /1Н, шир. с/, 5,00 /2Н, шир. с/, 4,90 /2Н, шир. с/, 4,06 /6Н, с/, 4,0 /2Н, м/, 3,
78 /1Н, м/, 3,63 /2Н, м/, 3,42 /1Н, м/.
Пример 41
Соединение, представленное формулой 43

708,8 мг указанного в заглавии соединения, представленного формулой 43, получают из 679 мг соединения, полученного в примере 40, по способу примера 2.
Высокоэффективная жидкостная хроматография: Время удерживания 10,9 минут /колонка Хроматолекс ODS, внутренний диаметр 4,6 мм, длина 250 мм, детектор УФ, 310 нм, скорость потока 1 мл/мин, подвижная фаза ацетонитрил:вода = 2,8 --> ацетонитрил:вода = 6:4, линейный градиент, 30 мин/.
FAB-Масс-спектр /м/z/:618 /M/+
1H-ЯМР /400МгГц/,
DMCO-d6/, δ мд: 13,5 /1Н, шир. с/, 11,1 /1Н, с/, 9,01 /1Н, с/, 8,83 /1Н, д, J= 7,8 Гц/, 8,63 /1Н, д, J=7,8 Гц/, 7,39 /1Н, т, J=7,8 Гц/, 7,37 /1Н, т, J=7,8 Гц/, 7,29 /1Н, д, J=7,8
Гц/, 7,22 /1Н, д, J=7,8 Гц/, 6,94 /1Н, д, J=9,3 Гц/, 5,43 /1Н, д, J=5,4 Гц/, 5,22 /1Н, д, J=5,4 Гц/, 5,01 /1Н, шир. с/, 4,93 /1Н, д, J=5,4 Гц/, 4,07 /6Н, с/, 4,05 /1Н, м/, 3,96 /1H, м/, 3,79 /1Н, м/,
3,60 /3Н, м/, 3,44 /1Н, м/.
Пример 42
Соединение, представленное формулой 44
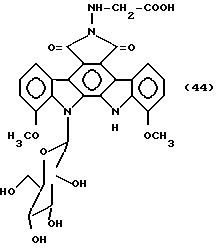
704 мг соединения полученного в примере 41, растворяют в 10 мл N,N-диметилформамида, добавляют 60 мг 10% палладия на угле /Pd-C/, и полученную смесь гидрируют при комнатной температуре в течение 6 ч при перемешивании, реакционную смесь фильтруют, используя лист фильтровальной бумаги, на котором распределен Целит, для удаления Pd-C. К полученному фильтрату добавляют 200 мл этилацетата, и полученную смесь экстрагируют 50 мл водного раствора бикарбоната натрия /pH 8/. pH водного слоя доводят до 2, и экстрагируют этилацетатом. Этилацетатный слой экстрагируют 2% водным раствором бикарбоната натрия /70 мл/. Этот слой 2% водного раствора бикарбоната натрия концентрируют при пониженном давлении, адсорбируют на колонке Диайон HP-20 /внутренний диаметр 3 см, длина 30 см/, промывают водой, а затем элюируют 300 мл метанола. Метанольный элюат концентрируют досуха, остаток растворяют в небольшом количестве N,N-диметилформамида, и полученный раствор обрабатывают на препаративной высокоэффективной жидкостной хроматографической колонке /колонка: Хроматолекс ODS, внутренний диаметр 20 мл, длина 250 мм, детектор УФ 310 нм, скорость потока 9 мл/мин, подвижная фаза ацетонитрил: вода = 25:75/. Фракции, содержащие целевой продукт, концентрируют досуха, а остаток растворяют в небольшом количестве воды, обрабатывают на хроматографической колонке Сефадекс G-15 /внутренний диаметр 3 см, длина 63 см/, и элюируют водой: метанолом = 9:1. Фракции, содержащие целевой продукт, концентрируют, а затем сушат вымораживанием до получения 84,2 мг натриевой соли указанного в заглавии соединения, представленного формулой 44.
HPLC Время удерживания 8,9 мин /колонка Хроматолекс ODS внутренний диаметр 4,6 мм, длина 250 мм, детектор УФ 310 нм, скорость потока 1 мл/мин, подвижная фаза ацетонитрил:вода:трифторуксусная кислота = 300:700:1/.
FAB-Масс-спектр /м/z/:643 /M+Na/+
1H ЯМР /400 МгГц,
DMCO-d6/ δ мд: 10,9 /1Н, шир. с/, 8,85 /1Н, д, J=7,8 Гц/, 8,62 /1Н, д, J=7,8 Гц/, 7,33 /1Н, т. J=7,8 Гц/, 7,31 /1Н, т, J=7,8 Гц/, 7,24 /1Н, д, J=7,8 Гц/, 7,16 /1Н, д, J=7,8 Гц/, 6,89
/1Н, д, J=9,3 Гц/, 5,63 /1Н, шир. с/, 5,42 /1Н, шир. с/, 5,10 /1Н, шир. с/, 4,99 /1Н, шир. с/, 4,06 /6Н, с/, 4,02 /2Н, м/, 3,80 /1Н, м/, 3,67, т, J=8,8 Гц/, 3,58 /1Н, м/, 3,42 /1Н, т, J=8,3 Гц/, 3,34
/2Н, с/.
Пример 43
Соединение, представленное формулой 45

23,8 мг указанного в заглавии соединения, представленного формулой 45, получают из 70 мг соединения, полученного в примере 4, по способу примера 2.
FAB-Масс-спектр /м/z/:641 /M+H/+
1H ЯМР /400 МгГц, DMCO-d6/,
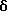
Пример 44
Соединение, представленное формулой 46

210 мг указанного в заглавии соединения, представленного формулой 46, получают из 1 г соединения, полученного в примере 43, по способу примера 42.
FAB-Масс-спектр /м/z/: 643/M+H/+
1H ЯМР /500 МгГц, DMCO-d6/, δ мд: 10,7 /Н, с/, 9,26 /1Н, д, J=7,8 Гц/, 9,09 /1Н, д, J=7,8 Гц/, 7,74 /1Н, д,
J=7,8/, 7,71 /1H, д, J=7,8 Гц/, 7,46 /2Н, т, J=7,8 Гц/, 6,93 /1Н, д, J=9,2 Гц/, 6,00 /1Н, шир. с/, 5,42 /1Н, шир. с/, 5,3/1H, шир. с/, 5,03 /1Н, шир. с/, 3,96 /2Н, шир. с/, 3,85 /2Н, с/, 3,83 /1Н, м/,
3,59 /3Н, с/, 3,50-3,70 /3Н, м/.
Пример 45
Соединение, представленное формулой 47:

48,2 мг указанного в заглавии соединения, представленного формулой 47, получают из 51,4 мг соединения, полученного в примере 4, по способу примера 5.
FAB-масс-спектр
/м/z/: 613 /M+H/+
1H ЯМР /400 МгГц, DMCO-d6/, δ мд: 10,9 /1Н, шир. с/, 10,8 /1Н, шир. с/, 9,20 /1Н, м/, 9,03 /1Н, м/, 8,48 /1Н, с/, 7,75 /1Н, д, J=7,8
Гц/, 7,70 /1Н, д, J= 7,8 Гц/, 7,45 /2Н, т, J=7,8 Гц/, 6,9 /1Н, шир.т. J=9,3 Гц/, 5,41 /2Н, м/, 5,04 /1Н, д, J=5,9 Гц/, 3,99 /2Н, шир. с/, 3,86 /1Н, м/, 3,60 /3Н, с/, 3,52-3,67 /3Н, м/.
Пример 46
Соединение, представленное формулой 48

13 мг указанного в заглавии соединения, представленного формулой 48, получают из 14,1 мг соединения, полученного в примере 4 по способу примера 6.
FAB-Масс-спектр /м/z/: 627 /M+H/+
1
H ЯМР /500 МгГц, DMCO-d6/:

Пример 47
Соединение,
представленное формулой 49:
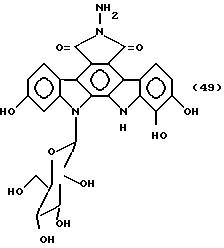
1 мл гидразинмоногидрата добавляют к 3,2 мг 12,13-дигидро-2, 10-дигидрокси-13-/ β -D-глюкопиранозил/-5Н-индоло [2,3-a]-пирроло[3,4-c]карбазол-5,7/6Н/диона, и полученную смесь перемешивают при комнатной температуре в течение 2 ч. Ее распределяют между слоями этилацетат-0,2 н. соляная кислота, и этилацетатный слой промывают последовательно водой, затем насыщенным солевым раствором, и концентрируют досуха. Полученный остаток растворяют в небольшом количестве метанола, обрабатывают на хроматографической колонке Сефадекс LH-20 /1,0 x 5 см/ и элюируют метанолом. Фракции, содержащие целевой продукт, концентрируют досуха до получения 3,0 мг указанного в заглавии соединения, представленного формулой 49.
Rf величина: 0,22 /Кизельгель 60F254, продукт Merck Co, проявляющий растворитель: хлороформ:метанол:тетрагидрофуран = 3:1:1/.
FAB-Масс-спектр /м/z/: 534 /M/+
1H ЯМР /300 МгГц, DMCO-d6/, δ мд: 11,16 /1Н, с/, 9,76 /1Н,
с/, 9,73 /1Н, с/, 8,90 /1Н, д, J=7,3 Гц/, 8,82 /1Н, д, J=7,3 Гц/, 7,18 /1Н, д, J=2,0 Гц/, 6,98 /1Н, д, J=2,0 Гц/, 6,83 /2Н, дт, J=2,0 7,3 Гц/, 5,97 /1Н, д, J=7,2 Гц/, 5,84 /1Н, т, J=3,3 Гц/, 5,32 /1Н,
д, J=5,3 Гц/, 5,10 /1Н, д, J=5,3 Гц/, 4,93 /1Н, д, J= 5,2 Гц/, 4,90 /2Н, с, 4,04-3,86 /2Н, м/, 3:78 /1Н, м/, 3,60-3,35-3Н/м/.
Пример 48
Соединение, представленное формулой
50:
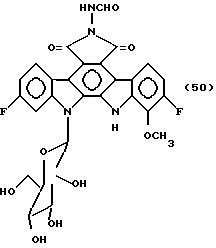
0,4 мл гидразингидрата добавляют к 7,1 мг 2,10-дифторо-12,13- дигидро-13-/ β -D-глюкопиранозил/-5Н-индоло[2,3-a] -пирроло[3,4-c] карбазол-5,7-/6Н/-диона, и полученную смесь перемешивают при комнатной температуре в течение 40 мин. К этому добавляют 1,34 мл концентрированной соляной кислоты, и полученную смесь экстрагируют этилацетатом. Этилацетатный слой промывают водой и концентрируют. Остаток растворяют в 3,7 мл N,N-диметилфомамида и 0,37 мл концентрированной соляной кислоты, и полученный раствор перемешивают при комнатной температуре в течение ночи. Его распределяют между этилацетатом и водой, и этилацетатный слой концентрируют досуха. Полученный остаток растворяют в небольшом количестве этанола и обрабатывают на хроматографической колонке Сефадекс LH-20, и элюируют этанолом. Фракции, содержащие целевой продукт, концентрируют досуха до получения 4,6 мг указанного в заглавии соединения, представленного формулой 50.
FAB-Масс-спектр /м/z/: 566 /M/+
1H ЯМР /400 МгГц, DMCO-d6/, δ мд: 11,9
/1Н, с/, 10,8 /1Н, шир. с/, 9,07 /1Н, дд, J=5,8 8,8 Гц/, 9,01 /1Н, дд, J=5,9 9,8 Гц/, 8,45 /1Н, с/, 7,93 /1Н, шир. с/ J=8,8 Гц/, 7,44 /1Н, шир. д, J=8,8 Гц/, 7,27 /2Н, м/, 6,28 /1Н, д. J=8,8 Гц/,6,20
/1Н, шир. с/, 5,42 /1Н, шир. с/, 5,13 /1Н, шир. д, J=5,4 Гц/, 4,96 /1Н, д, J=5,4 Гц/, 4,09 /1Н, шир. д, J=7,3 Гц/, 3,94 /2Н, м/, 3,83 /1Н, шир. д, J=7,3 Гц/, 3,58 /1Н, м/, 3,45 /1Н, м/.
Пример 49
Соединение, представленное формулой 51
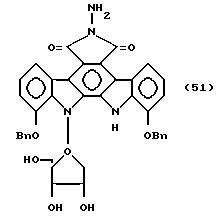
где Bn представляет бензильную группу.
100 мг 6-бензилоксиметил-11,11-дибензилокси-12,13-дигидро-5Н-индоло[2,3-a] пирроло[3,4-c]карбазол-5,7/6Н/-диона, 1,4 г оксида серебра и 0,7 г молекулярных сит 4А суспендируют в 40 мл безводного бензола, полученную суспензию кипятят с обратным холодильником в течение 20 мин, а затем прикапывают раствор 1-бром-2,3,5-три-O-ацетил-D-рибозы в 10 мл безводного бензола за промежуток времени 10 мин. Полученную смесь кипятят далее с обратным холодильником в течение 3 ч, и затем нерастворимую часть удаляют фильтрованием, используя Целит.
Полученный фильтрат концентрируют досуха, и остаток растворяют в 100 мл этилацетата, и полученный раствор промывают последовательно 0,2 н. соляной кислотой, водой, и насыщенным солевым раствором, сушат над безводным сульфатом натрия и концентрируют досуха. Полученный остаток растворяют в хлороформе, обрабатывают на хроматографической колонке Сефадекс LH-20 /2,5 x 20 см/ и элюируют хлороформом. Фракции, содержащие целевой продукт, концентрируют досуха, а остаток обрабатывают на хроматографической колонке с силикагелем /2,5 x 25 см/ и элюируют смесью толуол-этилацетат /3:1/. Фракции, содержащие продукт, концентрируют досуха. Остаток очищают с помощью далее препаративной тонкослойной хроматографии /толуолэтилацетат = 5:1 /Rf = 0,6// до получения 20,8 мг 6-бензилоксиметил-1,11-дибензолокси-12, 13-/ β -D-рибофураносил/ -5Н-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7/6Н/диона.
20,8 мг этого соединения растворяют в 2 мл гидразинмоногидрата, и полученный раствор перемешивают при комнатной температуре в течение 2 ч. Его смешивают с 30 мл этилацетата, полученную смесь последовательно промывают 0,2 г соляной кислотой, водой, а затем насыщенным солевым раствором, и концентрируют досуха. Полученный остаток растворяют в метаноле, обрабатывают на хроматографической колонке Сефадекс LH-20 /1,0 x 15 см/ и элюируют метанолом. Фракции содержащие целевой продукт, концентрируют досуха, а остаток очищают с помощью препаративной тонкослойной хроматографии /хлороформ:метанол = 10: 1/ /Rf = 0,5 / /до получения 2,9 мг указанного в заглавии соединения, представленного формулой 51.
Rf величина : 0,5 /Кизельгель 60F254, продукт Merck Co, проявляющий растворитель: хлороформ:метанол = 10:1/.
FAB-Масс-спектр
/м/z/: 684 /M/+
1H ЯМР /300 МгГц/, DMCO-d6/,

Пример 50
Соединение, представленное формулой 52.
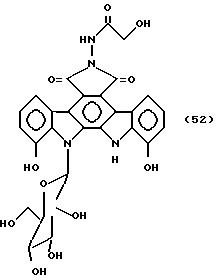
33,0 мг соединения, полученного в примере А, растворяют в 3 мл N,N-диметилформамида, добавляют 8,4 мг гидроксиацетогидразина, и полученную смесь перемешивают при 80oC в течение 2 дн. Ее концентрируют досуха, а полученный остаток растворяют в небольшом количестве метанола, обрабатывают на хроматографической колонке Сефадекс LH-20 /1,5 x 25 см/ и элюируют метанолом. Фракции, содержащие целевой продукт, концентрируют досуха, а остаток растворяют в 30 мл этилацетата. Полученный остаток растворяют в 30 мл этилацетата. Этот раствор промывают водой, и этилацетатный слой сушат над безводным сульфатом натрия и концентрируют досуха. Остаток растворяют в небольшом количестве метанола, обрабатывают на хроматографической колонке Сефадекс LH-20 /1,5 - 15 см/, и элюируют метанолом. Фракции, содержащие целевой продукт, концентрируют досуха до получения 29,0 мг указанного в заглавии соединения, представленного формулой 52.
FAB-Масс-спектр /м/z/: 593 /M+H/+
1H ЯМР /300 МгГц, DMCO-d6/, δ мд: 11,00 /1Н, с/, 10,55 /1Н, с/, 10,41 /1Н, с/, 10,02 /1Н, с/, 8,63 /1Н, д, J=7,8 Гц/,
8,47 /1Н, д, J=7,8 Гц/, 7,20 /2Н, т, J=7,8 Гц/, 7,04 /3Н, м/, 5,88 /1Н, т, J=7,0 Гц/, 5,41 /1Н, д, J=6,2 Гц/, 5,35 /1Н, шир/, 5,20 /1Н, д, J=6,2 Гц/, 4,90 /1Н, д, J=6,2 Гц/, 4,16 /2Н, д, J=5,7 Гц/, 4,
03 /2Н, м/, 3,74 /1Н, м/, 3,59-3,68 /2Н, м/, 3,39 /1Н, м/.
Пример 51
Соединение, представленное формулой 53:

35 мг соединения, полученного в примере А, растворяют в 1,0 мл N,N-диметилформамида. Добавляют 0,5 мл насыщенного водного раствора бикарбоната натрия, и полученную смесь перемешивают при 80oC в течение дня. Ее концентрируют, а остаток растворяют в небольшом количестве метанола и обрабатывают на хроматографической колонке Сефадекс LH-20 /1,5 x 15 см/, и элюируют метанолом. Фракции, содержащие целевой продукт, концентрируют досуха до получения 20,8 мг указанного в заглавии соединения, представленного формулой 53. P величина: 0,5 /Кизельгель 60F254, проявляющий растворитель: хлороформ: метанол:тетрагидрофуран = 2:1:1/
FAB-Масс-спектр /м/z/: 563 /M+H/+
1H ЯМР /300 МгГц, DMCO-d6/, δ мд: 10,90 /1Н, с/, 10,35 /1Н, с/, 9,96 /1Н, с/, 8,72 /1Н, д, J=7,9 Гц/, 8,54 /1Н, д, J=7,9 Гц/, 7,17 /2Н, т, J=7,9 Гц/, 7,03 /3Н, м/, 5,72 /1Н, т, J=4,8 Гц/, 5,41 /1Н, д, J= 6,3 Гц/, 5,35 /1Н, т, J=4,0 Гц/, 5,21 /1Н, д, J=4,0 Гц/, 4,87 /1Н, д, J=6,3 Гц/, 3,96-4,09 /2Н, м/, 3,73-3,77 /1Н, м/, 3,58/3,67 /2Н, м/, 3,37-3,45 /1Н, м/, 3,07 /2Н, м/, 1,09 /3Н, т, J=7,1 Гц/.
Пример 52
50 г соединения примера 5 растворяют в растворе, в котором растворена Japanese Pharmacopoeia в 400 г дистиллированной воды для инъекций, и полученный раствор фильтруют
для удаления бактерий, используя фильтр 0,2 мкм. Порции по 5 мл фильтрата помещают в промытые и стерилизованные ампулы обычным способом, и ампулы закрывают и герметизируют для получения растворов для
инъекций, содержащих 250 мг соединения примера 5 в каждой из ампул. Препарат вводят с помощью агента для внутреннего вливания, в который добавляют 5 или 10 мл этого препарата для инъекций /то есть,
250 - 500 мг соединения примера 5/, и разбавляют 500 мл такой жидкости для вливания, как глюкоза /5%/.
Реферат
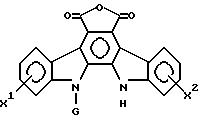
Изобретение относится к производным индолопирролокарбазола общей формулы
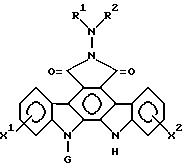
в которой R1 и R2 - каждый независимо H, низший алкил, низший алкенил, фенил, фенилалкил, пиридил или имидазолинил, причем каждая из групп низшего алкила, низшего алкенила, фенила, фенилалкила имеет необязательно от 1 до 5 заместителей, выбранных из карбокси, карбамоила, циано и гидроксигруппы; или группа -Y - R2, где Y - карбонил, тиокарбонил или сульфонил, и R3 - H, низший алкил, трифторметил, фенил, низшая алкокси, гидразино, амино, фениламино, карбамоил или пиридильная группа, причем низшая алкильная или фенильная группа имеют необязательно 1 - 4 заместителей таких, как гидроксигруппа, смежные гидроксигруппы, защищенные алкиленовой группой, карбокси или цианогруппа или R1 и R2 взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу, возможно, гидроксилзамещенную низшую алкильную группу, G - пентозная или гексозная группа, X1 и X2 независимо H или галоген, OH, низшая алкокси- или бензилоксигруппа. Соединения обладают превосходным противоопухолевым действием. 5 с. и 3 з.п. ф-лы, 3 табл.
Формула
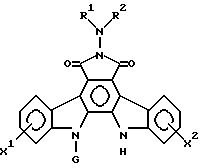
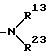
в которой R1 и R2 каждый независимо - водород, низшая алкильная, низшая алкенильная, фенильная, фенилалкильная, пиридильная или имидазолинильная группы, причем каждая из низшей алкильной, низшей алкенильной, фенильной и фенилалкильной групп имеет (необязательно) 1 - 5 заместителей, выбранных из карбокси, карбамоильной, циано- и гидроксигруппы, или группа общей формулы
- Y - R3,
в которой Y - карбонильная, тиокарбонильная или сульфонильная группа;
R3 - водород, низшая алкильная, трифторметильная, фенильная, низшая алкокси, гидразино, амино, фениламино, карбамоильная или пиридильная группы, причем низшая алкильная и фенильная группа имеют (необязательно) 1 - 4 заместителей, таких как гидроксигруппа, смежные гидроксигруппы, защищенные алкиленовой группой, карбокси- и цианогруппы,
или R1 и R2, взятые вместе - низшая алкилиденовая группа, которая может иметь карбоксильную группу, или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу, имеющую (необязательно) гидроксилзамещенную низшую алкильную группу;
G - пентозная или гексозная группа;
X1 и X2 каждый независимо - водород или галоген, гидроксигруппа, низшая алкокси- или бензилоксигруппа,
или их фармацевтически приемлемые соли.

в которой R11 и R21 каждый независимо - водород, низшая алкильная, низшая алкенильная, фенильная, фенилалкильная, пиридильная или имидазолинильная группы, причем каждая из низшей алкильной, низшей алкенильной, фенильной и фенилалкильной групп имеют (необязательно) 1 - 5 заместителей, выбранных из карбокси, карбамоильной, циано- и гидроксигруппы; или группа общей формулы
-Y - R31,
в которой Y - карбонильная, тиокарбонильная или сульфонильная группы;
R31 - водород, низшая алкильная, трифторметильная или фенильная группы, причем низшая алкильная и фенильная группы имеют (необязательно) 1 - 4 заместителей, таких, как гидрокси- или карбоксигруппа,
или R11 и R21, взятые вместе, представляют низшую алкилиденовую группу, которая может иметь карбоксильную группу; или R11 и R21, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу;
G1 - группа формулы
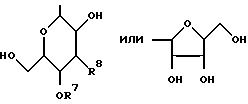
X11 и R21 присоединены к индолопирролокарбазольному кольцу в 1- или 2- и 10- или 11- положении соответственно, и каждый независимо - водород или галоген, гидрокси-, низшая алкокси- или бензилоксигруппы.
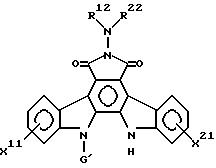
в которой R12 - водород или низшая алкильная группа;
R22 - водород, низшая алкильная группа, которая может иметь 1 - 3 заместителя, выбранных из группы, состоящей из карбокси-, карбамоильных, гидрокси- и цианогрупп; фенильная или фенилалкильная группа, необязательно замещенная гидрокси- или карбоксигруппой; имидазолинильная группа или группа
-Y - R32,
в которой Y - карбонильная, тиокарбонильная или сульфонильная группы, и, когда Y - карбонильная или тиокарбонильная группа, тогда R32 - водород, низшая алкильная, трифторметильная или фенильная группы, причем низшая алкильная и фенильная группы имеют (необязательно) 1 - 4 заместителя, таких, как гидроксигруппа, смежные гидроксигруппы, защищенные алкиленовой группой, и когда Y - сульфонильная группа, тогда R32 - низшая алкильная или фенильная группа;
или R12 и R22, взятые вместе, - низшая алкилиденовая группа, содержащая карбоксигруппу, или R12 и R22, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу;
G1, X11 и X21 имеют значения по п.2.

в которой X1, X2 и G имеют значения по п.1,
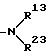
подвергают взаимодействию с соединением общей формулы P

в которой R13 и R23 имеют значения по п.1 соответственно для R1 и R2, при условии, что R13 и R23 взятые вместе, не являются низшей алкилиденовой группой, которая может иметь карбоксильную группу,
с получением соединения общей формулы Ic
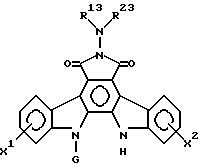
в которой R13, R23, X1, X2 и G имеют указанные значения,
с последующим, если необходимо, формилированием, алкилированием, алкенилированием, карбомоилированием, тиокарбамоилированием, алканоилированием или сульфонилированием аминогруппы
в соединении формулы Ic, когда R13 и R23 оба - водород, или конденсацией соединения Ic с соединением общей формулы IV
OHC - R6,
в которой R6 - карбоксигруппа или низшая алкильная группа, замещенная карбоксильной группой,
и, если необходимо, двойные связи в соединении Ic восстанавливают, когда R13 и R23 имеет двойную связь, и, если необходимо, полученное соединение I превращают в фармацевтически приемлемую соль.

в которой X1, X2 и G имеют значения по п.1,
подвергают взаимодействию с соединением общей формулы P

в которой R13 и R23 имеют значения по п.1 соответственно для R1 и R2, при условии, что R13 и R23, взятые вместе, не являются низшей алкилиденовой группой, которая может иметь карбоксильную группу, с получением соединения общей формулы Ic в п. 5 с последующим, если необходимо, формилированием, алкилированием, алкенилированием, карбамоилированием, тиокарбамоилированием, алканоилированием или сульфонилированием аминогруппы
в соединении формулы Ic, когда R13 и R23 оба - водород, или конденсацией соединения формулы Ic с соединением общей формулы IV
R6 - CHO,
в которой R6 - карбоксильная или низшая алкильная группа, замещенная карбоксильной группой,
с последующим, если необходимо, восстановлением двойных связей в соединении общей формулы Ic и, если необходимо, полученное соединение общей формулы I превращают в фармацевтически приемлемую соль.

в которой X1, X2 и G имеют значения по п.1,
обрабатывают основанием.
в которой X1, X2 и G имеют значения по п.1,
и его производное, в котором функциональные группы защищены.
01.09.92 - все признаки по п. 1 формулы, кроме R1 и R2 независимо представляют низшую алкильную группу, причем каждая из низшей алкенильной группы имеет (необязательно) 1 - 5 заместителей, выбранных из карбомоильной или цианогруппы, R3 представляет трифторметильную группу, фенильную, низшую алкокси-, гидразино-, фениламинокарбамоил или пиридильную группу, причем фенильная группа имеет (необязательно) 1 - 4 заместителя, таких, как атом галогена, гидроксигруппа, смежные гидроксигруппы, защищенные алкиленовой группой, карбокси-, цианогруппа, или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу, имеющую (необязательно) гидроксилзамещенную низшую алкильную группу, X1 и X2 каждый независимо - бензилоксигруппа, G - пентозная группа, все признаки по п.2 формулы, кроме: R11 и R21 каждый независимо - низшая алкенильная группа, каждая из низшей алкенильной группы имеет (необязательно) 1 - 5 заместителей, выбранных из карбамоильной, цианогруппы, R31 - трифторметильная или фенильная группа, имеющая (необязательно) 1 - 4 заместителя, таких как гидроксильная или карбоксильная группа, R11 и R21 взятые вместе с атомом азота, к которому они присоединены образуют пиперазинильную или пирролидинильную группу, X11 и X21 каждый независимо - бензилоксигруппа, все признаки по п.3 формулы, кроме: R22 - низшая алкильная группа, которая может иметь 1 - 3 заместителя, выбранных из карбамоильных или цианогрупп, и когда Y - карбонильная или тиокарбонильная группа, тогда R32 - трифторметильная или фенильная группа, причем фенильная группа имеет (необязательно) 1 - 4 заместителя, таких, как гидроксильная группа, смежные гидроксигруппы, защищенные алкиленовой группой, и когда Y - сульфонильная группа, тогда R32 - фенильная группа; или R12 и R22 взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу; все признаки по п. 4; все признаки по п.5, кроме стадии алкенилирования соединения Ic; все признаки по п.6, кроме стадии алкенилирования соединения Ic;
18.02.92 - все признаки по п.1 формулы, кроме: R1 и R2 каждый независимо представляют низшую алкенильную, фенильную, фенилалкильную, пиридильную или имидазолинильную группы, причем каждая из низшей алкенильной, фенильной и фенилалкильной групп имеет (необязательно) 1 - 5 заместителей, выбранных из карбамоильной, циано- или гидроксигрупп, Y - тиокарбонильная или сульфонильная группа, R3 - трифторметильная, фенильная, низшая алкокси, гидразино-, амино-, фениламино-, карбамоильная или пиридильная группы, причем низшая алкильная и фенильная группы имеют (необязательно) 1 - 4 заместителя, таких, как атом галогена, гидроксигруппа, смежные гидроксигруппы, защищенные алкиленовой группой, карбокси- и цианогруппа, или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу, имеющую (необязательно) гидроксилзамещенную низшую алкильную группу, G - пентозная группа, X1 и X2 каждый независимо - бензилоксигруппа; все признаки по п.2, кроме: R11 и R21 каждый независимо - низшая алкенильная, фенильная, фенилалкильная, пиридильная или имидазолильная группы, причем каждая из низшей алкенильной, фенильной и фенилалкильной группы имеют (необязательно) 1 - 5 заместителей, выбранных из карбамоильной, циано- и гидроксигруппы; Y - тиокарбонильная или сульфонильная группа, R31 - трифторметильная или фенильная группа, причем низшая алкильная и фенильная группы имеют (необязательно) 1 - 4 заместителя, таких, как гидрокси- или карбоксигруппа; или R11 и R21, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу; X11 и X21 - бензилоксигруппы; все признаки по п.3 формулы, кроме: R22 - низшая алкильная группа, которая может иметь 1 - 3 заместителя, выбранных из карбамоильных, гидрокси-, цианогрупп, фенильная или фенилалкильная группа, необязательно замещенная гидрокси- или карбоксигруппой, или имидазолинильная группа, Y - тиокарбонильная или сульфонильная группа, и когда Y - тиокарбонильная группа, тогда R32 - трифторметильная или фенильная группа, причем низшая алкильная и фенильная группы имеют (необязательно) 1 - 4 заместителя, таких, как гидроксигруппа, смежные гидроксигруппы, замещенные алкиленовой группой, и когда Y - сульфонильная группа, тогда R32 - низшая алкильная или фенильная группа, или R12 и R22, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу; все признаки по п. 4 формулы, все признаки по п.5 формулы, все признаки по п.6 формулы, кроме стадии алкилирования, алкенилирования, карбамоилирования, тиокарбомоилирования или сульфонирования аминогруппы в соединении Ic, все признаки по п.7 формулы;
29.11.91 - все признаки по п.1 формулы, кроме: R1 и R2 представляют низшую алкенильную, фенильную, фенилалкильную, пиридильную или имидазолинильную группы, причем каждая из низшей алкенильной, фенильной и фенилалкильной групп имеет (необязательно) 1 - 5 заместителей, выбранных из карбамоильной, циано- и гидроксигруппы, или группу общей формулы -Y -R3, в которой Y - карбонил, тиокарбонильная или сульфонильная группа, R3 - водород, низшая алкильная, трифторметильная, фенильная, низшая алкокси, гидразино, амино, фениламино, карбамоильная или пиридильная группы, причем низшая алкильная и фенильная группы имеют (необязательно) 1 - 4 заместителя, таких, как гидроксигруппа, смежные гидроксигруппы, защищенные алкиленовой группой, карбокси и циано, или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирродинильную группу, имеющую (необязательно) гидроксилзамещенную низшую алкильную группу, G - пентозная группа, X1 и X2 каждый независимо - бензилоксигруппа; все признаки по п.2 формулы, кроме: R11 и R21 каждый независимо - низшая алкенильная, фенильная, фенилалкильная, пиридильная или имидазолильная группы, причем каждая из низшей алкенильной, фенильной и фенилалкильной групп имеет (необязательно) 1 - 5 заместителей, выбранных из карбамоильной, циано- и гидроксигруппы, или группу -Y - R31, в которой Y - карбонильная, тиокарбонильная или сульфонильная группы, и R31 - водород, низшая алкильная, трифторметильная или фенильная группы, причем низшая алкильная и фенильная группа имеет (необязательно) 1 - 4 заместителя, таких, как гидрокси- или карбоксигруппа; или R11 и R21, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу, X11 и X21 каждый независимо - бензилоксигруппа, все признаки по п.3 формулы, кроме: R22 - низшая алкильная группа, которая может иметь 1 - 3 заместителя, выбранных из группы, состоящей из карбамоильных, гидрокси- и цианогрупп, фенильная или фенилалкильная группа, необязательно замещенная гидрокси- или карбоксигруппой, имидазолинильная группа, -Y - R32, в которой Y - карбонильная, тиокарбонильная или сульфонильная группы, и когда Y - карбонильная или тиокарбонильная группа, тогда R32 - водород, низшая алкильная, трифторметильная или фенильная группы, причем низшая алкильная и фенильная группы имеют (необязательно) 1 - 4 заместителей, таких, как гидроксигруппа, смежные гидроксигруппы, защищенные алкиленовой группой, и когда Y - сульфонильная группа, тогда R32 - низшая алкильная или фенильная группа, или R12 и R22, взятые вместе с атомом азота, к которому они присоединены, образуют пиперазинильную или пирролидинильную группу, и G, X11 и X21 имеют значения по п.2; все признаки по п.4; все признаки по п.5; все признаки по п.6, кроме стадии формилирования, алкилирования, алкенилирования, карбамоилирования, тиокарбамоилирования, алканоилирования или сульфонилирования аминогруппы

в соединении формулы Ic, когда R13 и R23 оба - водород,
и, если необходимо, полученное соединение общей формулы I превращают в фармацевтически приемлемую соль; все признаки по п.7 формулы.

Комментарии