(Z)-5-замещенные-3-(гидрокси(арил)метилен)-3а-(фенилтио)-3,3а-дигидропирроло[1,2-a]хиноксалин-1,2,4(5h)-трионы, обладающие противомикробной активностью - RU2759006C1
Код документа: RU2759006C1
Описание
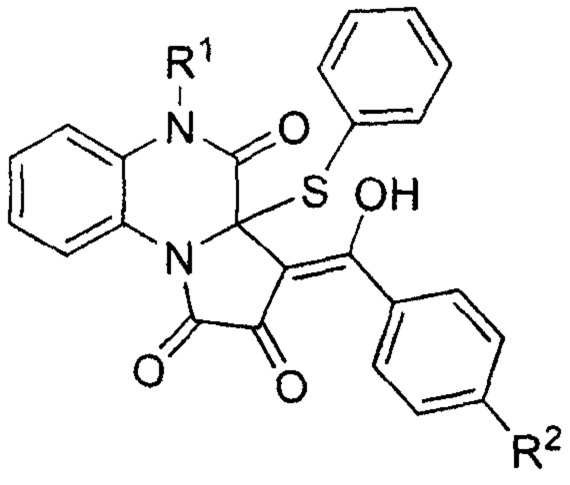
Изобретение относится к области органической химии, а именно к новым биологически активным (Z)-5-замещенным-3-(гидрокси(арил)метилен)-3а-(фенилтио)-3,3а-дигидропирроло[1,2-а]хиноксалин-1,2,4(5H)-трионам формулы:

обладающим противомикробной активностью, что позволяет предположить их использование в фармакологии и в медицине в качестве лекарственных средств с противомикробным эффектом.
Известны структурные аналоги заявленных соединений - 3-ароил-2,3а-дигидрокси-1,3а,4,5-тетрагидропирроло[1,2-a]хиноксалин-1,4-дионы (Mashevskaya I.V., Maslivets A.N., Synthesis and chemical transformations of 2,3-dihydropyrrole-2,3-diones annelated on the [a] side by azaheterocycles // Chemistry of Heterocyclic Compounds. - 2006. - T. 42. №. 1. C. 1-21).

Эталонами сравнения противомикробной эффективности выбраны антибактериальный препарат диоксидин [Падейская Е.Н. Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции // Инфекции и антимикробная терапия. - 2001. - №. 5. - С. 105-155] и противогрибковый препарат флуконазол [Shilova I.B., Gus'kova Т.А., Glushkov R.G. Modern drugs for treating dermatomycosis // Pharmaceutical Chemistry Journal. - 2004. - T. 38. - №. 4. - С. 175-180.], которые широко применяются в лечебной практике и являются аналогами по действию.
Задачей изобретения является поиск в ряду производных (Z)-5-замещенных-3-(гидрокси(арил)метилен)-3а-(фенилтио)-3,3а-дигидропирроло[1,2-а]хиноксалин-1,2,4(5H)-трионов веществ с выраженным противомикробным действием и расширение арсенала средств воздействия на живой организм.
Поставленная задача достигается получением (2)-5-замещенных-3-(гидрокси(арил)метилен)-3а-(фенилтио)-3,3а-дигидропирроло[1,2-а]хиноксалин-1,2,4(5Н)-трионов, которые обладают противомикробной активностью.
Заявляемые соединения синтезируют путем взаимодействия 5-замещенных-3-ароил-2,4-дигидро-1H-пирроло[2,1-с][1,4]хиноксалин(5H)-1,2,4-трионов (I) с тиофенолом в соотношении 1:1 в среде безводного растворителя с выделением целевых продуктов (II) по представленной схеме:
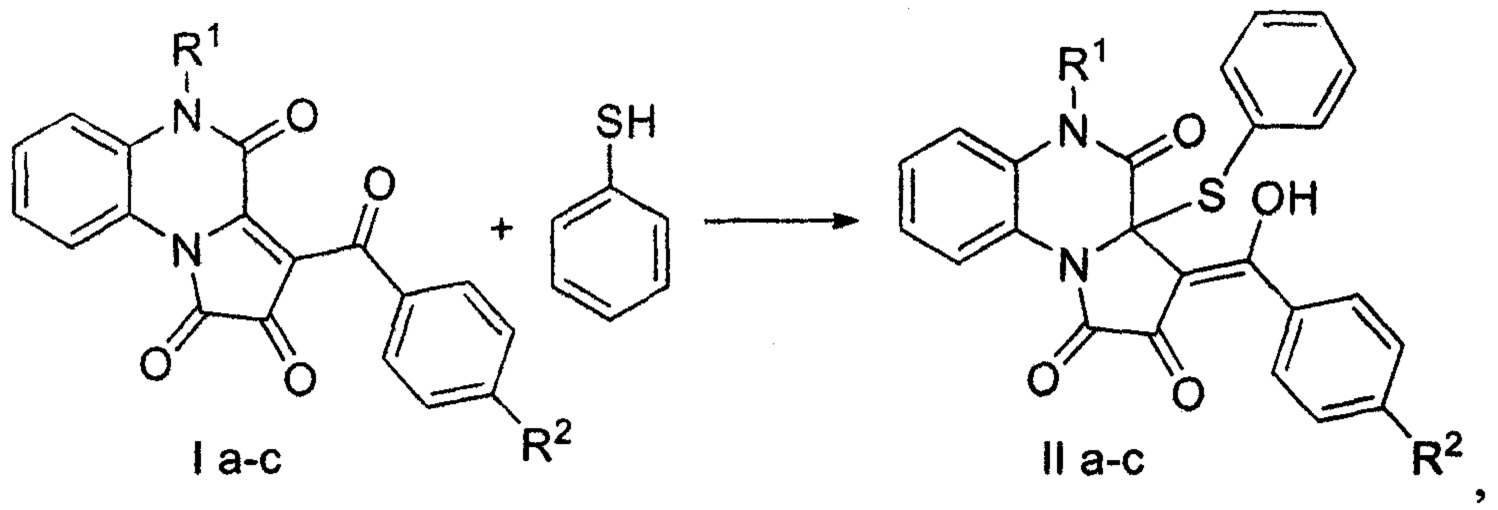
где R1=Н (a), Me (b), Bn (с); R2=Cl (a), H (b).
Процесс ведут при комнатной температуре, а в качестве растворителя используют безводный ацетонитрил или толуол.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение (2)-3-((4-хлорфенил)(гидрокси)метилен)-3a-(фенилтио)-3,3а-дигидропирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (IIa).
К раствору 1.0 ммоль 3-(4-хлорбензоил)пирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (Ia) в 2 мл безводного ацетонитрила добавляли 1.0 ммоль тиофенола. Реакционную массу перемешивали при комнатной температуре в течение 2 минут, образовавшийся осадок отфильтровывали. Выход 55%, т. пл. 185-188°С. Соединение (IIa) C24H15ClN2O4S.
Найдено, %:
Вычислено, %: С, 62.27; Н, 3.27; N, 6.05; S, 6.93
Соединение (IIa) - желтое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, в дихлорметане, хлороформе, ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIa), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний гидрокогруппы 3201 см-1, лактамной NH-группы 3086 см-1, карбонильных групп лактамного фрагмента и пиррольного цикла 1734, 1686, 1661 см-1.
Спектр ЯМР1Н (400 МГц, DMSO-d6, м.д.): 11.91 с (1H), 11.07 с (1Н), 7.87 д (J=8.5 Гц, 2Н), 7.79 дд (J=7.5, 1.9 Гц, 1H), 7.56-7.52 м (2Н), 7.46-7.41 м (1Н), 7.38-7.29 м (1Н), 7.29-7.21 м (2Н), 7.13 дд (J=7.5, 1.9 Гц, 1H).
Пример 2. Получение (Z)-3-(гидрокси(фенил)метилен)-5-метил-3а-(фенилтио)-3,3а-дигидропирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (IIb).
К раствору 1.0 ммоль 3-бензоил-5-метилпирроло[1,2-а]хиноксалин-1,2,4(5Н)-триона (Ib) в 2 мл безводного тоуола добавляли 1.0 ммоль тиофенола. Реакционную массу перемешивали при комнатной температуре в течение 10 минут, образовавшийся спустя сутки осадок отфильтровывали. Выход 72%. т. пл. 154-156°С. Соединение (IIb) C25H18N2O4S.
Найдено, %:
Вычислено, %: С 67.86; Н 4.10; N 6.33; S 7.25
Соединение (IIb) - желтое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, в дихлорметане, хлороформе, ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIb), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний гидрокогруппы 3224 см-1, карбонильных групп лактамного фрагмента и пиррольного цикла 1773, 1684, 1658 см-1.
Спектр ЯМР1Н (400 МГц, DMSO-d6, δ, м.д.): 11.41 с (1Н), 7.88-7.82 м (3Н), 7.63-7.57 м (1Н), 7.48 т (J=7.6 Гц, 2Н), 7.45-7.39 м (1Н), 7.39-7.28 м (7Н), 3.31 с (3Н).
Пример 3. Получение (Z)-5-бензил-3-(гидрокси(фенил)метилен)-3а-(фенилтио)-3,3а-дигидропирроло[1,2-a]хиноксалин-1,2,4(5H)-триона (IIc).
К раствору 1.0 ммоль 3-бензоил-5-бензилпирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (Ic) в 2 мл безводного ацетонитрила добавляли 1.0 ммоль тиофенола. Реакционную массу перемешивали при комнатной температуре в течение 2 минут, образовавшийся осадок отфильтровывали. Выход 83%, т. пл. 182-184°С. Соединение (IIc) C31H22N2O4S.
Найдено, %:
Вычислено. %: С 71.80; Н 4.28; N 5.40; S 6.18.
Соединение (IIc) - желтое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, в дихлорметане, хлороформе, ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях
В ИК спектре соединения (IIc), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний гидрокогруппы 3245 см-1, карбонильных групп лактамного фрагмента и пиррольного цикла 1732, 1712, 1698 см-1.
Спектр ЯМР1Н (400 МГц, DMSO-d6, δ, м.д.): 11.47 с (1H), 7.90-7.85 м (3Н), 7.63-7.57 м (1H), 7.53-7.43 м (3Н), 7.41-7.34 м (6Н), 7.34-7.27 м (5Н), 7.26-7.20 м (1Н), 5.37 д (J=16.5 Гц, 1Н), 4.93 д (J=16.5 Гц, 1H).
Пример 4. Фармакологическое исследование (Z)-5-замещенных-3-(гидрокси(арил)метилен)-3а-(фенилтио)-3,3а-дигидропирроло[1,2-а]хиноксалин-1,2,4(5H)-трионов (IIa-с) на наличие противомикробной активности.
Противомикробные свойства химических веществ изучали на 2-х коллекционных условно-патогенных штаммах микроорганизмов: Staphylococcus aureus (штамм 906) и Candida albicans, РКПГ Y 1353/1277.
Для исследования противомикробного действия использовали общепринятый метод двукратных серийных разведений в жидкой питательной среде микрометодом [Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М.: Изд-во Медицина, 2005. - 832 с.]. Готовили исходные разведения микроорганизмов в физиологическом растворе из суточной агаровой культуры по оптическому стандарту мутности (ОСО) на 5 ME с использованием денситометра. После ряда разведений конечная концентрация клеток в опыте составляла 2.5×105 клеток/мл. В лунках стерильного 96 луночного плоскодонного микропланшета готовили два параллельных ряда двукратных серийных разведений химических соединений в бульоне РПБ, Сабуро. В каждой лунке содержалось 150 мкл определенной концентрации испытуемого вещества и 150 мкл инокулята культуры. В последних рядах содержалась питательная среда и культура в равных объемах (контроль). Максимально испытанная концентрация соответствовала 1000.0 мкг/мл, минимальная - 1.0 мкг/мл.
Результаты оценивали с помощью программного обеспечения Gen 5 спектрофотометра для микропланшет Epoch. Последняя лунка ряда с задержкой роста и показателями ОП равной оптической плотности контрольной лунки соответствует минимальной подавляющей концентрацией соединения.
Проведенные исследования показали (см. таблицу), что соединения (IIa-с) ингибируют рост бактерий Staphylococcus aureus в концентрации 15.6 мкг/мл, что активнее препарата сравнения в 4 раза. Бактерицидным действием обладает только соединение IIb в концентрации 125.0 мкг/мл. Заявляемые соединения (IIa, с) обладают умеренным фунгистатическим действием в отношении культуры Candida albicans в концентрации 62.5 мкг/мл.

Заявляемые ранее неописанные в литературе (Z)-5-замещенные-3-(гидрокси(арил)метилен)-3а-(фенилтио)-3,3а-дигидропирроло[1,2-а]хиноксалин-1,2,4(5H)-трионы могут найти применение в фармакологии в качестве потенциальных лекарственных средств с противомикробными свойствами.
Реферат
Изобретение относится к (Z)-5-замещенным-3-(гидрокси(арил)метилен)-3а-(фенилтио)-3,3а-дигидропирроло[1,2-а]хиноксалин-1,2,4(5H)-трионам общей формулы.Технический результат: получены новые соединения, обладающие противомикробной активностью, которые могут быть использованы в фармакологии в качестве потенциальных лекарственных средств с противомикробными свойствами. 1 табл., 4 пр.
Формула

Комментарии