Производные карбапенема, применение их для изготовления фармацевтической композиции, фармацевтическая композиция на их основе и способ лечения и/или профилактики инфекционных заболеваний - RU2276154C2
Код документа: RU2276154C2
Описание
Предпосылки изобретения
Область изобретения
Настоящее изобретение относится к производным карбапенема, обладающим высокой антибиотической активностью и широким антибиотическим спектром. Более конкретно, настоящее изобретение относится к новым производным карбапенема, содержащим замещенную имидазо[5,1-b]тиазольную группу во 2-ом положении кольца карбапенема, или их солям.
Область техники, к которой относится изобретение
Производные карбапенема обладают высокой антибиотической активностью и широким антибиотическим спектром и потому интенсивно изучались в качестве высокоэффективного β-лактамного средства, а имипенем, панипенем и меропенем уже использовались клинически.
Однако в настоящее время и имипенем, и панипенем, применяются в виде смеси вследствие их нестабильности в отношении дегидропептидазы-1 почек (здесь и далее обозначаемой как DHP-1) в случае имипенема, и в целях снижения нефротоксичности в случае панипенема. С другой стороны, меропенем, благодаря наличию метильной группы в 1β-положении, обладает повышенной стабильностью в отношении DHP-1, а потому может применяться самостоятельно. Однако стабильность меропенема в отношении DHP-1 все еще является неудовлетворительной. Кроме того, антибиотическая активность как в отношении метициллин-устойчивого Staphylococcus aureus (здесь и далее обозначаемого как MRSA), создающего в настоящее время серьезные проблемы в клинике, так и в отношении пенициллин-устойчивого Streptococcus pneumoneae (здесь и далее обозначаемого как PRSP), устойчивой Pseudomonas aeruqinosa, энтерококков и вируса гриппа, также не всегда является удовлетворительной. Лекарственные средства, эффективные в отношении указанных микроорганизмов, вызывающих инфекционные заболевания, требуются в данной области техники.
Например, производные карбапенема, в которых атом углерода в имидазо[5, 1-b]тиазольной группе присоединен ко 2-ому положению кольца карбапенема, раскрыты в публикациях международных заявок WO 98/32760 и 00/06581.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что определенная группа производных карбапенема, содержащих имидазо[5,1-b]тиазольную группу, обладает высокой антибиотической активностью в отношении широкого спектра грамположительных бактерий и грамотрицательных бактерий и, в то же время, обладает высокой антибиотической активностью в отношении MRSA, PRSP, вируса гриппа и продуцирующих β-лактамазу микроорганизмов, а также высокоустойчивы в отношении DHP-1. Настоящее изобретение основано на этом наблюдении.
Соответственно, цель настоящего изобретения относится к производным карбапенема, которые обладают высокой антибиотической активностью также в отношении MRSA, PRSP, вируса гриппа и продуцирующих β-лактамазу микроорганизмов и устойчивы в отношении DHP-1. Настоящее изобретение относится к соединению, представленному формулой (I), или его фармацевтически приемлемой соли:
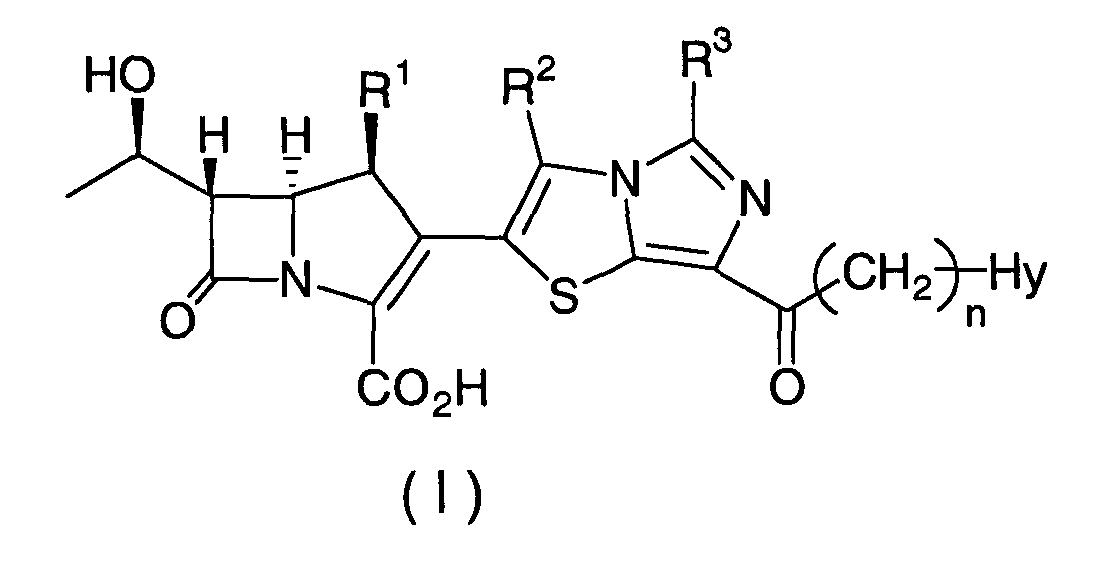
где
R1 представляет собой атом водорода или метил,
R2 и R3, которые могут быть одинаковыми или различными, каждый представляет собой
атом водорода;
атом галогена;
низший алкил, необязательно замещенный атомом галогена, цианогруппой, гидроксилом, карбамоилом, аминогруппой, формиламиногруппой, (низший алкил)карбониламиногруппой, аминосульфониламиногруппой, (низший алкил)тиогруппой, низшей алкоксигруппой, низшим циклоалкилом, N,N-ди(низший алкил)аминогруппой или N-карбамоил(низший алкил)-N,N-ди(низший алкил)аммониогруппой;
низший циклоалкил;
(низший алкил)карбонил, где алкильная часть (низший алкил)карбонила необязательно замещена атомом галогена, цианогруппой, гидроксилом, карбамоилом, аминогруппой, формиламиногруппой, (низший алкил)карбониламиногруппой, аминосульфониламиногруппой, (низший алкил)тиогруппой, низшей алкоксигруппой, низшим циклоалкилом, N,N-ди(низший алкил)аминогруппой или N-карбамоил(низший алкил)-N,N-ди(низший алкил)аммониогруппой;
карбамоил;
арил, необязательно замещенный аминогруппой, необязательно замещенной одной или двумя низшими алкильными группами;
(низший алкил)тиогруппа, где алкильная часть (низший алкил)тиогруппы необязательно замещена аминогруппой, гидроксилом, азидом, атомом галогена, цианогруппой, карбамоилом, формиламиногруппой, (низший алкил)карбониламиногруппой, аминосульфониламиногруппой или (низший алкил)тиогруппой;
морфолинил;
(низший алкил)сульфонил; или
формил;
n является целым числом от 0 до 4, и
Hy представляет собой 4-7-членную моноциклическую или 9-10-членную бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из атомов азота, кислорода и серы,
насыщенная или ненасыщенная гетероциклическая группа, представленная Hy, необязательно замещена
атомом галогена;
цианогруппой;
низшим алкилом, где один или несколько атомов водорода низшей алкильной группы необязательно замещены группами, выбранными из группы, состоящей из атома галогена; гидроксила; карбамоила; замещенного карбоксилметилом карбамоила; аминогруппы; N,N-ди(низший алкил)аминогруппы; необязательно замещенного аминогруппой арила; моноциклической или бициклической гетероциклической группы, содержащей один или несколько гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода и серы, необязательно замещенной аминосульфонилом или карбоксилом, предпочтительно 4-7-членной моноциклической или 9-10-членной бициклической насыщенной или ненасыщенной гетероциклической группы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из атомов азота, кислорода и серы, более предпочтительно пиридинила, морфолинила, пирролидинила или пиперидинила; карбоксила; иминогруппы; низшего алкоксикарбонила; (низший алкил)карбонила; аминосульфониламиногруппы; амино(низший алкил)тиогруппы; (низший алкил)сульфонила; (N,N-ди(низший алкил)амино)сульфониламиногруппы; N'-(N,N-ди(низший алкил)амино)сульфонил-N'-(низший алкил)аминогруппы; галогенированного (низший алкил)карбонила; N-аминосульфонилпиперидинила; и цианогруппы;
(низший алкил)тиогруппой, где один или несколько атомов водорода алкильной группы необязательно замещены группой, выбранной из группы, состоящей из атома галогена, гидроксила, карбамоила, аминогруппы и арила;
(низший алкил)сульфонилом, где один или несколько атомов водорода алкильной группы необязательно замещены группой, выбранной из группы, состоящей из атома галогена, гидроксила, карбамоила, аминогруппы, 1-иминоэтиламиногруппы и арила; гидроксилом;
низшей алкоксигруппой;
замещенной гидроксиаминофенилом низшей алкоксигруппой;
галогенированной низшей алкоксигруппой;
замещенной аминофенилом низшей алкоксигруппой;
формилом;
(низший алкил)карбонилом;
арилкарбонилом;
карбоксилом;
низшим алкоксикарбонилом;
карбамоилом;
N-(низший алкил)карбамоилом;
N,N-ди(низший алкил)аминокарбонилом;
аминогруппой;
N-(низший алкил)аминогруппой;
N,N-ди(низший алкил)аминогруппой;
формиламиногруппой;
(низший алкил)карбониламиногруппой;
аминосульфониламиногруппой;
(N-(низший алкил)амино)сульфониламиногруппой;
(N,N-ди(низший алкил)амино)сульфониламиногруппой;
арилом; или
моноциклической или бициклической гетероциклической группой, содержащей один или несколько гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода и серы, необязательно замещенной аминосульфонилом или карбоксилом, предпочтительно необязательно замещенной 4-7-членной моноциклической или 9-10-членной бициклической насыщенной или ненасыщенной гетероциклической группой, содержащей 1-4 гетероатома, выбранных из группы, состоящей из атомов азота, кислорода и серы.
Кроме того, настоящее изобретение относится к соединению, представленному формулой (II), или его фармацевтически приемлемой соли:
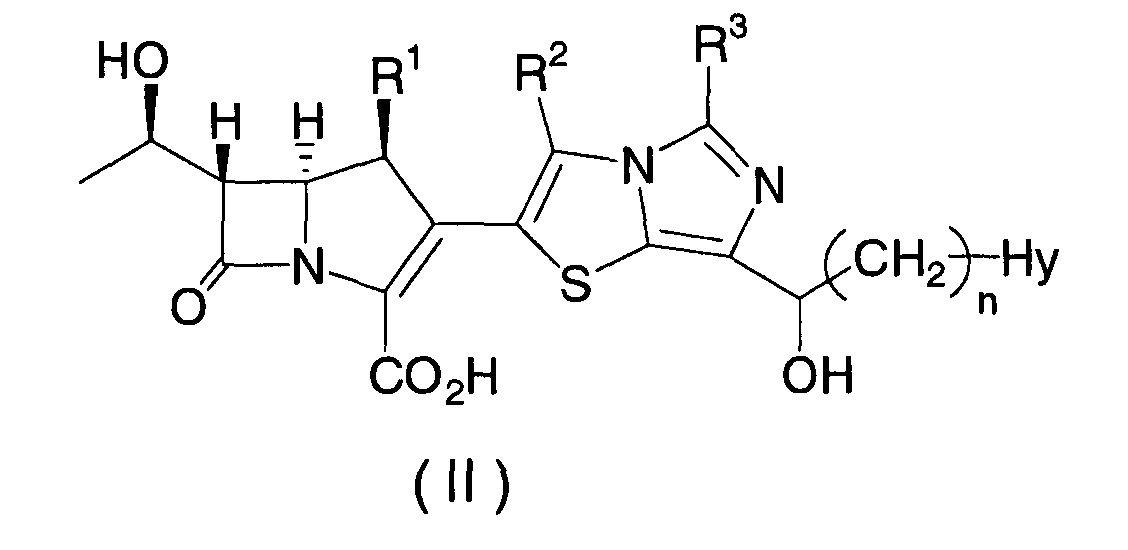
где R1, R2, R3, n и Hy имеют значения, определенные для формулы (I).
Соединения по настоящему изобретению обладают высокой антибиотической активностью в отношении широкого спектра грамположительных бактерий и грамотрицательных бактерий. В частности, соединения по настоящему изобретению обладают высокой антибиотической активностью также в отношении MRSA, PRSP, вируса гриппа и продуцирующих β-лактамазу микроорганизмов. Соответственно, соединения по настоящему изобретению применяются в качестве антибиотических препаратов.
Более того, настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению в качестве активного ингредиента. Данная фармацевтическая композиция применяется для лечения и/или профилактики инфекционных заболеваний.
Кроме того, настоящее изобретение относится к применению соединения по настоящему изобретению для изготовления фармацевтической композиции по настоящему изобретению.
Кроме того, настоящее изобретение относится к способу лечения и/или профилактики инфекционных заболеваний, включающему стадию введения терапевтически и/или профилактически эффективного количества соединения по настоящему изобретению млекопитающим, включая людей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин "низший алкил" и термин "низшая алкоксигруппа", используемый здесь для обозначения группы или части группы, соответственно, означает алкил и алкоксигруппу с неразветвленной или разветвленной цепью, содержащие 1-6, предпочтительно 1-4, атома углерода.
Примеры низшего алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил.
Примеры низшей алкоксигруппы включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу.
Термин "низший циклоалкил" означает моноциклический алкил, содержащий 3-6 атомов углерода, предпочтительно циклопропил.
Термин "атом галогена" означает атом фтора, хлора, брома или йода.
Термин "арил", используемый здесь для обозначения группы или части группы, означает 5-7-членное ароматическое моноциклическое карбоциклическое кольцо и 9-12-членное ароматическое бициклическое карбоциклическое кольцо, предпочтительно фенил или нафтил, более предпочтительно фенил.
Термин "моноциклическая или бициклическая гетероциклическая группа, содержащая один или несколько гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода или серы, предпочтительно означает 4-7-членную моноциклическую или 9-10-членную бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из атомов азота, кислорода или серы. В том случае, если гетероциклическая группа содержит несколько гетероатомов, гетероатомы могут быть одинаковыми или различными.
Предпочтительные гетероциклические группы, представленные Hy, включают гетероциклическую группу, содержащую в составе кольца один или два атома азота наряду с остальными атомами углерода, гетероциклическую группу, содержащую в составе кольца один атом азота и один атом серы наряду с остальными атомами углерода, и гетероциклическую группу, содержащую в составе кольца один атом серы наряду с остальными атомами углерода. Более предпочтительными являются пиридинил, (пиридиний)ил, тетрагидропиридинил, тиазолил, пиримидинил, тиенил, хинолинил, (хинолиний)ил, изохинолинил, дигидроизохинолинил, пиперазинил, пиперидинил, индолил, тиоморфолинил, имидазолил и пирролидинил. Наиболее предпочтительными являются пиридинил, (пиридиний)ил, тетрагидропиридинил, тиазолил, пиримидинил, тиенил, хинолинил, (хинолиний)ил и пирролидинил.
Заместителем низшей алкильной группы и низшей алкилкарбонильной группы, необязательно представленных R2 и R3, предпочтительно является гидроксил, низшая алкоксигруппа, N,N-ди(низший алкил)аминогруппа или N-карбамоил(низший алкил)-N,N-ди(низший алкил)аммониогруппа.
Заместителем арильной группы, необязательно представленной R2 и R3, предпочтительно является N,N-диалкиламиногруппа.
Заместителем (низший алкил)тиогруппы, необязательно представленной R2 и R3, предпочтительно является аминогруппа, гидроксил или азид.
Заместителем гетероциклической группы, представленной Hy, предпочтительно является низший алкил, необязательно замещенный замещенным карбоксиметилом карбамоилом, карбамоилом, фенилом, аминофенилом, N,N-ди(низший алкил)аминогруппой, аминогруппой, гидроксилом, морфолинилом, пирролидинилом, карбоксилом, иминогруппой, амино(низший алкил)тиогруппой, низшим алкоксикарбонилом, (низший алкил)карбонилом, аминосульфониламиногруппой, пиперидинилом, (низший алкил)сульфонилом, (N,N-ди(низший алкил)амино)сульфониламиногруппой, N'-(N,N-ди(низший алкил)амино)сульфонил-N'-(низший алкил)аминогруппой, галогенированным (низший алкил)карбонилом, N-аминосульфонилпиперидинилом или цианогруппой; карбамоил; пиридинил; N-аминосульфонилпирролидинил; 2-карбоксипирролидинил; фенил; гидроксил; низшая алкоксигруппа; замещенная гидроксиаминофенилом низшая алкоксигруппа; замещенная атомом галогена низшая алкоксигруппа; замещенная аминофенилом низшая алкоксигруппа; аминогруппа; карбоксил; необязательно замещенная аминогруппой (низший алкил)тиогруппа; амино(низший алкил)тиогруппа; амино(низший алкил)сульфонил; или 1-иминоэтиламино(низший алкил)сульфонил. Более предпочтительными являются низший алкил, замещенный группой, выбранной из группы, состоящей из карбамоила, карбоксила и аминосульфониламиногруппы; и замещенная аминогруппой (низший алкил)тиогруппа.
Гетероциклическая группа, представленная Hy, может быть соединена с карбонилом, -CH(-OH)- или C1-4-алкиленом в любом положении гетероциклического кольца. В том случае, если Hy представляет собой пиридинил, предпочтительным является присоединение в 3-м положении. В том случае, если Hy представляет собой пирролидинил, предпочтительным является присоединение в 2-м положении.
В том случае, если гетероциклическая группа, представленная Hy, содержит в своем кольце атом азота, атом азота может быть замещен с образованием четвертичного атома аммония.
Предпочтительные применяемые здесь заместители включают карбамоилметил, карбоксилметил и аминосульфониламиноэтил.
R1 предпочтительно представляет собой метил.
R2 и R3 предпочтительно являются атомом водорода, атомом галогена, необязательно замещенным низшим алкилом, низшим циклоалкилом, (низший алкил)карбонилом, карбамоилом, арилом, необязательно замещенной (низший алкил)тиогруппой, морфолинилом, формилом или (низший алкил)сульфонилом, более предпочтительно атомом водорода.
n предпочтительно является целым числом от 0 (нуля) до 2, более предпочтительно 0. Hy предпочтительно представляет собой необязательно замещенные (пиридин-3-ил), (пиридиний-3-ил), [1,4,5,6-тетрагидропиридин-3-ил], (пиридин-4-ил), (пиридиний-4-ил), (тиазол-5-ил), (пирролидин-2-ил), (пиримидин-5-ил), (тиофен-2-ил), (хинолин-3-ил), (хинолиний-3-ил), (изохинолин-4-ил), (1,2-дигидроизохинолин-4-ил), (пиперидин-2-ил), (пиперазин-1-ил), (пиперазиний-4-ил), (пиперидин-4-ил), (индол-3-ил), (пирролидин-1-ил), (пиперазиний-1-ил), (пирролидиний-1-ил), (пиперидин-3-ил), [1,2-дигидропиридин-3-ил], (имидазол-1-ил) или (тиоморфолин-4-ил).
Более предпочтительно, Hy представляет собой необязательно замещенный (пиридин-3-ил), необязательно замещенный (пиридиний-3-ил) или необязательно замещенный ((2S)-пирролидин-2-ил).
Группой предпочтительных соединений, представленных формулами (I) и (II), являются те из них, где
R1 представляет собой атом водорода или метил,
R2 и R3, которые могут быть одинаковыми или различными, каждый представляет собой
атом водорода;
атом галогена;
низший алкил, необязательно замещенный атомом галогена, цианогруппой, гидроксилом, карбамоилом, аминогруппой, формиламиногруппой, (низший алкил)карбониламиногруппой, аминосульфониламиногруппой или (низший алкил)тиогруппой;
(низший алкил)карбонил, где алкильная часть (низший алкил)карбонила необязательно замещена атомом галогена, цианогруппой, гидроксилом, карбамоилом, аминогруппой, формиламиногруппой, (низший алкил)карбониламиногруппой, аминосульфониламиногруппой или (низший алкил)тиогруппой;
карбамоил;
арил; или
(низший алкил)тиогруппа, где алкильная часть (низший алкил)тиогруппы необязательно замещена атомом галогена, цианогруппой, гидроксилом, карбамоилом, аминогруппой, формиламиногруппой, (низший алкил)карбониламиногруппой, аминосульфониламиногруппой или (низший алкил)тиогруппой;
n является целым числом от 0 (нуля) до 4, и
Hy представляет собой 4-7-членную моноциклическую или 9-10-членную бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из атомов азота, кислорода и серы,
насыщенная или ненасыщенная гетероциклическая группа, представленная Hy, необязательно замещена
атомом галогена;
цианогруппой;
низшим алкилом, где один или несколько атомов водорода низшей алкильной группы необязательно замещены группой, выбранной из группы, состоящей из атома галогена, гидроксила, карбамоила, аминогруппы, арила и моноциклической или бициклической гетероциклической группы, содержащей один или несколько гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода и серы, предпочтительно 4-7-членной моноциклической или 9-10-членной бициклической насыщенной или ненасыщенной гетероциклической группы, содержащей 1-4 гетероатома, выбранных из группы, состоящей из атомов азота, кислорода и серы, более предпочтительно пиридинила, морфолинила, пирролидинила или пиперидинила;
(низший алкил)тиогруппой, где один или несколько атомов водорода алкильной группы необязательно замещены группой, выбранной из группы, состоящей из атома галогена, гидроксила, карбамоила, аминогруппы и арила;
(низший алкил)сульфонилом, где один или несколько атомов водорода алкильной группы необязательно замещены группой, выбранной из группы, состоящей из атома галогена, гидроксила, карбамоила, аминогруппы и арила;
гидроксилом;
низшей алкоксигруппой;
формилом;
(низший алкил)карбонилом;
арилкарбонилом;
карбоксилом;
низшим алкоксикарбонилом;
карбамоилом;
N-(низший алкил)карбамоилом;
N,N-ди(низший алкил)аминокарбонилом;
аминогруппой;
N-(низший алкил)аминогруппой;
N,N-ди(низший алкил)аминогруппой;
формиламиногруппой;
(низший алкил)карбониламиногруппой;
аминосульфониламиногруппой; (N-(низший алкил)амино)сульфониламиногруппой;
(N,N-ди(низший алкил)амино)сульфониламиногруппой;
арилом; или
моноциклической или бициклической гетероциклической группой, содержащей один или несколько гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода и серы, предпочтительно необязательно замещенной 4-7-членной моноциклической или 9-10-членной бициклической насыщенной или ненасыщенной гетероциклической группой, содержащей 1-4 гетероатома, выбранных из группы, состоящей из атомов азота, кислорода и серы.
Другой группой предпочтительных соединений, представленных формулами (I) и (II), являются те из них, где
R1 представляет собой атом водорода или метил,
R2 и R3, которые могут быть одинаковыми или различными, каждый представляет собой
атом водорода,
атом галогена,
необязательно замещенный низший алкил,
низший циклоалкил,
низший алкилкарбонил,
карбамоил,
необязательно замещенный арил,
необязательно замещенную (низший алкил)тиогруппу,
морфолинил,
(низший алкил)сульфонил, или
формил, n является целым числом от 0 (нуля) до 2, и
Hy представляет собой группу, выбранную из группы, состоящей из необязательно замещенного пиридинила, необязательно замещенного (пиридиний)ила, необязательно замещенного тетрагидропиридинила, необязательно замещенного тиазолила, необязательно замещенного пиримидинила, необязательно замещенного тиенила, необязательно замещенного хинолинила, необязательно замещенного (хинолиний)ила, необязательно замещенного изохинолинила, необязательно замещенного дигидроизохинолинила, необязательно замещенного пиперазинила, необязательно замещенного пиперидинила, необязательно замещенного индолила, необязательно замещенного тиоморфолинила, необязательно замещенного имидазолила и необязательно замещенного пирролидинила.
Дополнительной группой предпочтительных соединений, представленных формулами (I) и (II), являются те из них, где
R1 представляет собой атом водорода или метил,
R2 и R3, которые могут быть одинаковыми или различными, каждый представляет собой
атом водорода,
атом галогена,
необязательно замещенный низший алкил,
необязательно замещенный низший алкилкарбонил,
карбамоил,
арил, или
необязательно замещенную (низший алкил)тиогруппу,
n является целым числом от 0 (нуля) до 4, и Hy представляет собой группу, выбранную из группы, состоящей из необязательно замещенного пиридинила, необязательно замещенного (пиридиний)ила, необязательно замещенного тетрагидропиридинила, необязательно замещенного тиазолила, необязательно замещенного пиримидинила, необязательно замещенного тиенила, необязательно замещенного хинолинила, необязательно замещенного (хинолиний)ила и необязательно замещенного пирролидинила.
Группой предпочтительных соединений, представленных формулой (II), являются те из них, где
R1 представляет собой метил,
R2 и R3 каждый представляет собой атом водорода,
n равно 0, и
Hy представляет собой необязательно замещенную 6-членную насыщенную гетероциклическую группу, содержащую 1-4 гетероатома.
Группой предпочтительных соединений, представленных формулами (I) и (II), являются те из них, где
R1 представляет собой атом водорода или метил,
R2 и R3 представляют собой атом водорода,
n равно 0, и
Hy представляет собой (пиридиний)ил, содержащий карбамоилметил в своем 1-ом положении.
Другой группой предпочтительных соединений, представленных формулами (I) и (II), являются те из них, где n равно 0.
Дополнительной группой предпочтительных соединений, представленных формулами (I) и (II), являются те из них, где R1 представляет собой метил, и R2 и R3 представляют собой атом водорода.
Другой группой более предпочтительных соединений, представленных формулами (I) и (II), являются те из них, где
R1 представляет собой метил,
R2 и R3 представляют собой атом водорода,
n равно 0, и
Hy представляет собой (пиридиний)ил, необязательно содержащий в своем 1-ом положении карбамоил(низший алкил), карбоксил(низший алкил) или аминосульфониламино(низший алкил), и амино(низший алкил)тиогруппу в положении, отличном от 1-ого положения.
Другой группой более предпочтительных соединений, представленных формулой (I), являются те из них, где R1 представляет собой метил, R2 и R3 представляют собой атом водорода, n равно 0, и Hy представляет собой пиридин-3-ил.
Особенно предпочтительные соединения, представленные формулами (I) и (II), включают
соединения, где R1 представляет собой метил, R2 и R3 представляют собой атом водорода, n равно 0, и Hy представляет собой 1-карбамоилметилпиридиний-3-ил,
соединения, где R1, R2 и R3 представляют собой атом водорода, n равно 0, и Hy представляет собой 1-карбамоилметилпиридиний-3-ил,
соединения, где R1 представляет собой метил, R2 и R3 представляют собой атом водорода, n равно 0, и Hy представляет собой 1-карбамоилметил-5-фенилпиридиний-3-ил,
соединения, где R1 представляет собой метил, R2 и R3 представляют собой атом водорода, n равно 0, и Hy представляет собой (2S)-пирролидин-2-ил,
соединения, где R1 представляет собой метил, R2 и R3 представляют собой атом водорода, n равно 0, и Hy представляет собой 1-карбоксиметилпиридиний-3-ил,
и соединения, где R1 представляет собой метил, R2 и R3 представляют собой атом водорода, n равно 0, и Hy представляет собой 1-(2-аминосульфониламиноэтил)пиридиний-3-ил.
Соединения по настоящему изобретению могут образовывать фармацевтически приемлемые соли. Примеры таких солей включают: неорганические соли, такие как соли лития, соли натрия, соли калия, соли кальция или соли магния; соли аммония; соли органического основания, такие как соли триэтиламина или соли диизопропилэтиламина; соли неорганических кислот, такие как соли хлористоводородной кислоты, соли серной кислоты, соли фосфорной кислоты или соли азотной кислоты; и соли органической кислоты, такие как соли уксусной кислоты, соли угольной кислоты, соли лимонной кислоты, соли яблочной кислоты, соли щавелевой кислоты или соли метансульфоновой кислоты. Предпочтительными являются внутримолекулярные соли, соли натрия, соли калия или соли хлористоводородной кислоты.
Конкретные примеры производных карбапенема, представленные формулами (I) и (II) по настоящему изобретению, включают соединения 1-175, описанные ниже в рабочих примерах.
Соединения, представленные формулой (I) по настоящему изобретению, предпочтительно получают в соответствие со схемой 1. Схема 1
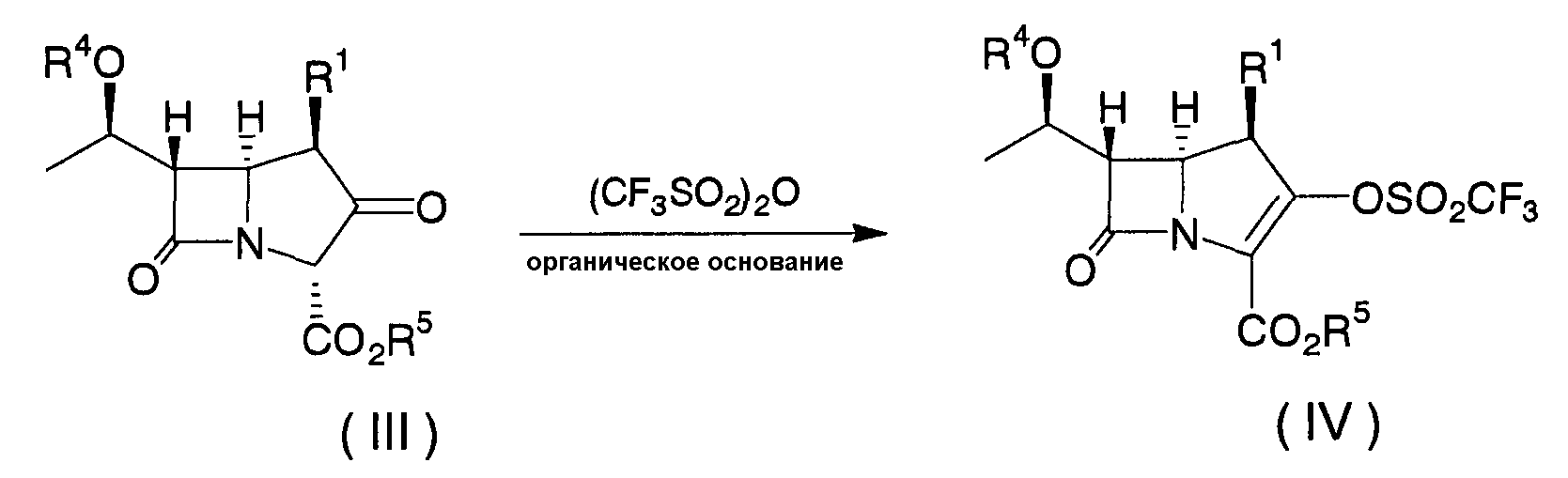
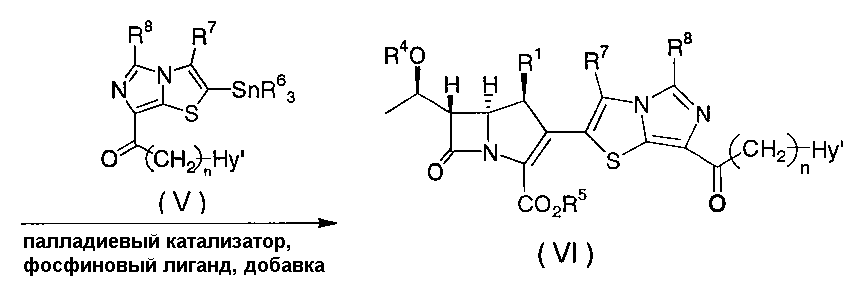
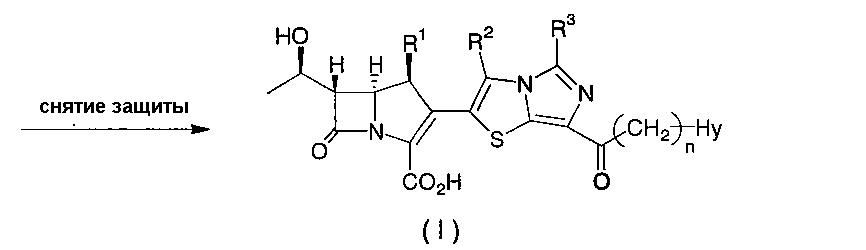
В приведенной выше схеме R1, R2, R3, n и Hy имеют значения, как определено выше для формулы (I); R4 представляет собой атом водорода или гидроксил-защитную группу, например, трет-бутилдиметилсилил, триметилсилил, триэтилсилил, 4-нитробензилоксикарбонил, 4-метоксибензилоксикарбонил или аллилоксикарбонил; R5 представляет собой карбоксил-защитную группу, например, 4-нитробензил, 4-метоксибензил, дифенилметил, трет-бутилдиметилсилил или аллил; R6 представляет собой низший алкил, предпочтительно н-бутил или метил; R7 и R8 имеют те же значения, что и R2 и R3, или представляют собой группу, образованную при защите содержащейся в R2 и R3 функциональной группы, например, гидроксила, аминогруппы или карбоксила, общепринятой защитной группой; и Hy' имеет те же значение, что и Hy, или представляет собой группу, образованную при защите содержащейся в Hy функциональной группы, например, гидроксила, аминогруппы или карбоксила, общепринятой защитной группой. Общепринятая защитная группа описана в Protective Groups in Organic Synthesis (Theodora W. Greene, Peter G. M. Wuts, published by John Wiley & Sons, Inc.).
Соединение формулы (III), указанное на первой стадии, представленной на схеме, может быть синтезировано с помощью общепринятого способа, а соединение олова формулы (V), указанное на второй стадии, показанной на схеме, может быть синтезировано в соответствии со способом, описанным в публикации международной заявки WO 98/32760.
На первой стадии соединение формулы (III) может быть преобразовано в соединение формулы (IV) следующим способом. Конкретно, соединение формулы (IV) может быть получено путем проведения взаимодействия соединения формулы (III) с одним (1) эквивалентом, или с избыточным количеством, трифторметансульфонового ангидрида в присутствии органического основания, предпочтительно диизопропилэтиламина, в одном (1) эквиваленте, или в избыточном относительно трифторметансульфонового ангидрида количестве, инертного растворителя, таком как ацетонитрил, тетрагидрофуран, дихлорметан или толуол, или в смешанном растворителе, составленном из двух или нескольких из указанных инертных растворителей, при температуре от -50°C до +50°C во временном диапазоне от 10 минут до 24 часов, подвергая затем реакционную смесь общепринятой процедуре разделения и очистки.
На второй стадии соединение формулы (IV) может быть преобразовано в соединение формулы (VI) следующим способом. Конкретно, соединение формулы (VI) может быть получено путем проведения взаимодействия соединения формулы (IV) с одним (1) эквивалентом, или с избыточным количеством, соединения формулы (V) в присутствии от 0, 001 до одного (1) эквивалента палладиевого катализатора, например, тетракис(трифенилфосфин)палладия(0), трис(дибензилиденацетон)дипалладия(0) или аддукта трис(дибензилиденацетон)дипалладия(0) с хлороформом, от 0,01 до одного (1) эквивалента фосфинового лиганда, например, трифенилфосфина, три-2-фурилфосфина, три-2-тиенилфосфина или трис(2,4,6-триметоксифенил)фосфина, и 1-10 эквивалентов добавки, например, хлорида цинка, хлорида лития или фторида цезия, по отдельности или в комбинации, в инертном растворителе, например, тетрагидрофуране, диметоксиэтане, диоксане, ацетонитриле, ацетоне, этаноле, диметилсульфоксиде, сульфолане, N,N-диметилформамиде, N,N-диметилацетамиде, N-метилпирролидиноне или гексаметилфосфорном триамиде, или в смешанном растворителе, составленном из двух или нескольких из указанных инертных растворителей, при температуре от 0°C до 100°C во временном диапазоне от 10 минут до 7 суток, и подвергая реакционную смесь общепринятой последующей обработке.
В заключение, на третьей стадии, соединение формулы (I) по настоящему изобретению может быть получено путем снятия защиты с соединения формулы (VI) в реакции снятия защиты, насчитывающей в зависимости от видов защитных групп одну или несколько стадий.
В этом случае реакции снятия защиты, которые варьируют в зависимости от видов применяемых защитных групп, могут быть осуществлены в соответствии с общепринятыми способами, традиционно применяемыми в данной области. В том случае, когда некоторые или все защитные группы могут быть удалены в кислых условиях, например, применяется неорганическая кислота, такая как хлористоводородная кислота, органическая кислота, такая как муравьиная кислота, уксусная кислота или лимонная кислота, или кислота Льюиса, такая как хлорид алюминия. В том случае, когда защитные группы удаляют в основных условиях, может применяться каталитическое восстановление с использованием различных катализаторов или металлических восстановителей, таких как цинк и железо. В том случае, когда R4 представляет собой защитную группу силильного типа, например, трет-бутилдиметилсилильную группу, триметилсилильную группу или триэтилсилильную группу, защитная группа может быть легко удалена с применением содержащего ион фтора реактива, например, тетрабутиламмонийфторида. В том случае, когда R4 представляет собой аллилоксикарбонил, и R5 представляет собой аллил, защитные группы могут быть легко удалены с применением разнообразных комплексов палладия, например, тетракис(трифенилфосфин)палладия(0).
Полученное таким образом соединение формулы (I) может быть легко выделено и очищено, например, путем кристаллизации или хроматографии с использованием неионогенной макропористой смолы, гель-фильтрации через Sephadex, и тому подобное, или колоночной хроматографии с обращенной фазой на силикагеле.
Соединения формулы (I), где Hy содержит четвертичный атом аммония, могут быть получены в соответствии со схемой 2.
Схема 2
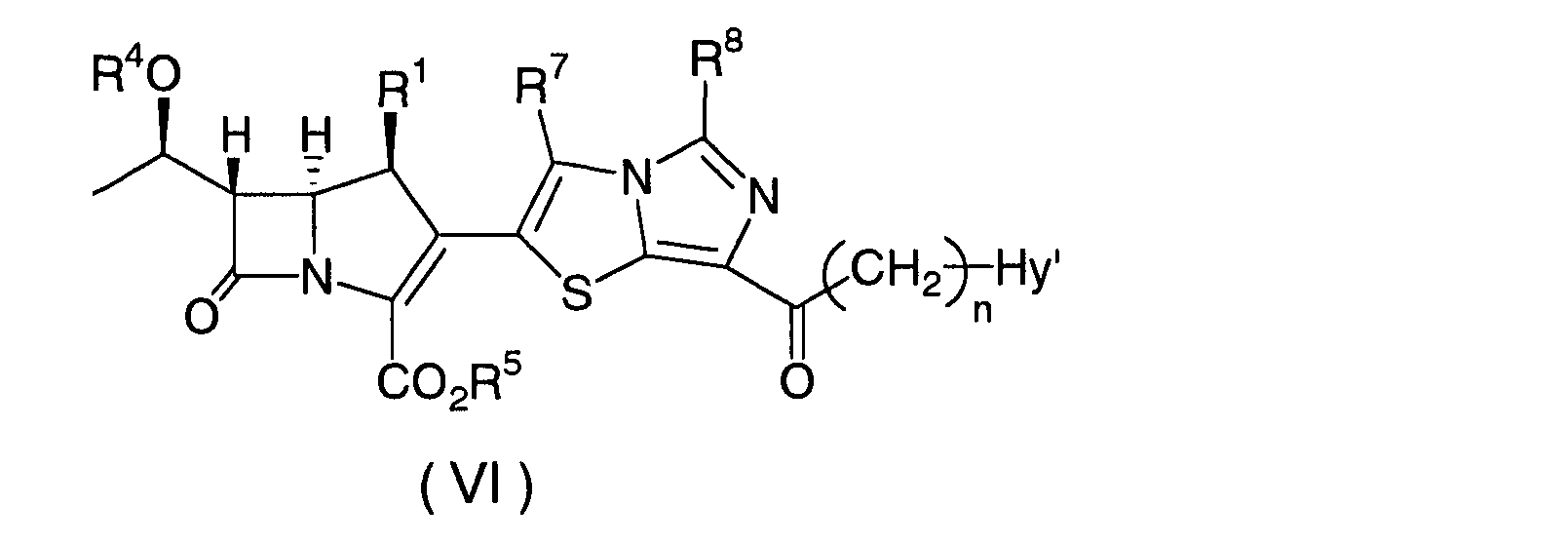
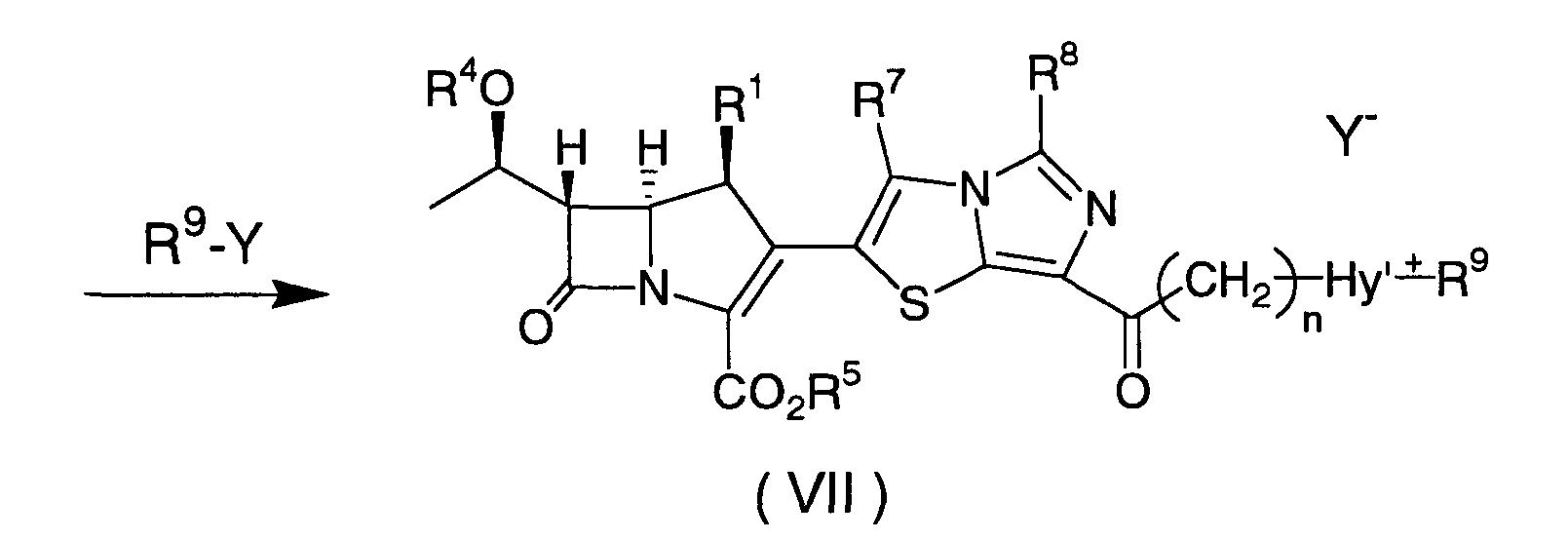
В приведенной выше схеме, R1 и n имеют значения, как определено для формулы (I); R4, R5, R7, R8 и Hy' имеют значения, как определено для схемы 1; R9 представляет собой необязательно замещенный низший алкил; и Y представляет собой подходящую уходящую группу, например, Cl, Br, I, -OSO2CF3, -OSO2CH3 или -OSO2 PhCH3.
Конкретно, соединение формулы (VII) может быть получено путем добавления одного (1) эквивалента или избыточного количества R9-Y, например, метилйодида, карбамоилметилйодида, метилтрифторметансульфоната, бензилбромида или 3-азидопропилтрифторметансульфоната, к соединению формулы (VI) в отсутствие или в присутствии инертного растворителя, например, ацетонитрила, ацетона, тетрагидрофурана, дихлорметана, толуола, N,N-диметилформамида, N,N-диметилацетамида или диметилсульфоксида, по отдельности или в смеси двух или нескольких инертных растворителей, и проводя взаимодействие при температуре от -80°C до +60°C во временном диапазоне от 15 минут до одной недели, и затем подвергая реакционную смесь общепринятой последующей обработке.
Соединение формулы (VII) может быть преобразовано в соединение формулы (I) способом, сходным с описанным для соединения формулы (VI).
Соединение формулы (II) по настоящему изобретению может быть получено в соответствие со схемой 3.
Схема 3
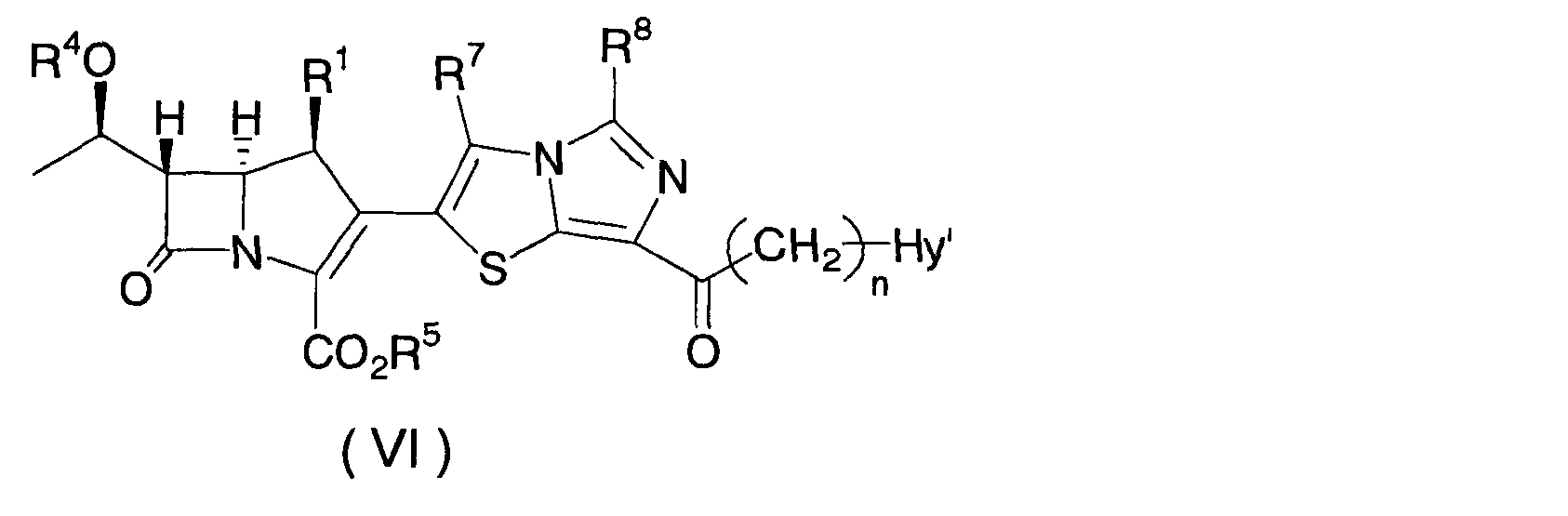
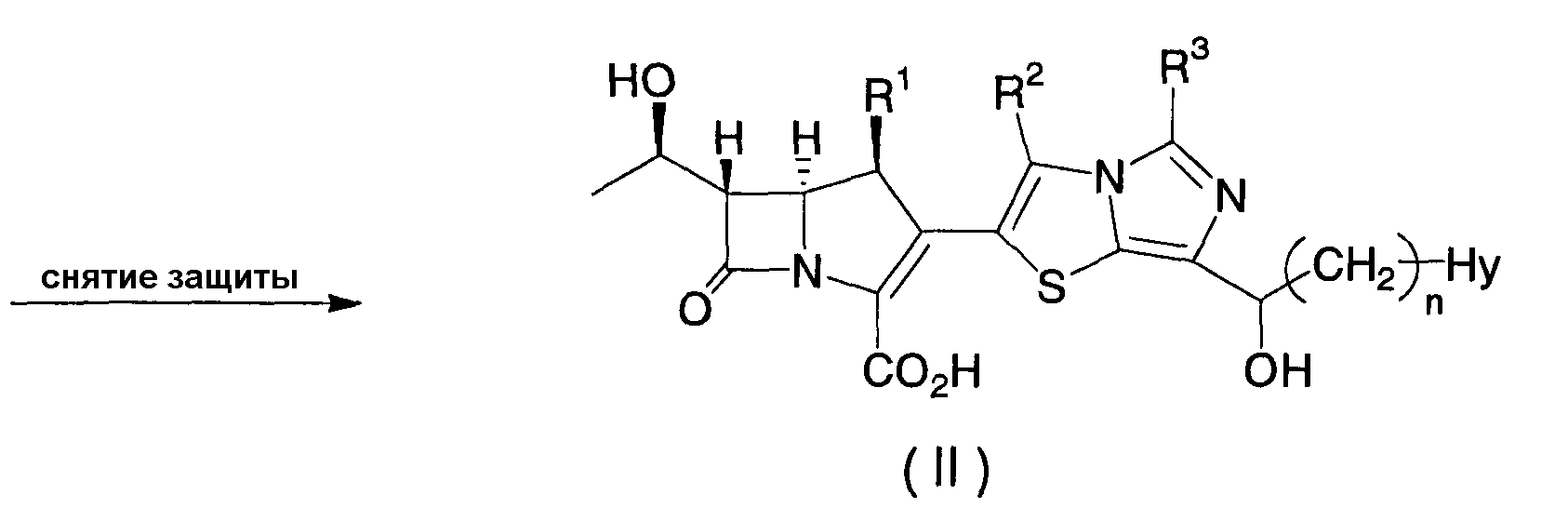
В приведенной выше схеме R1, R2, R3, n и Hy имеют значения, как определено для формулы (I); и R4, R5, R7, R8 и Hy' имеют значения, как определено в схеме 1.
Конкретно, соединение формулы (II) по настоящему изобретению может быть получено, в зависимости от типа Hy, путем снятия защиты с соединения формулы (VI) в реакции снятия защиты, насчитывающей в зависимости от видов защитных групп одну или несколько стадий, сходным с описанным выше способом.
Полученное таким образом соединение формулы (II) может быть выделено и очищено, например, путем кристаллизации или хроматографии с использованием неионогенной макропористой смолы, гель-фильтрации через Sephadex, и тому подобное, или колоночной хроматографии с обращенной фазой на силикагеле.
Соединения по настоящему изобретению обладают высокой антибиотической активностью в отношение широкого спектра грамположительных бактерий и грамотрицательных бактерий и, в то же время, обладают высокой антибиотической активностью в отношение MRSA, PRSP, вируса гриппа и продуцирующих β-лактамазу микроорганизмов. Кроме того, они обладают низкой токсичностью и устойчивы к действию DHP-1. Поэтому, соединения по настоящему изобретению могут применяться для лечения инфекционных заболеваний, обусловленных различными патогенными микроорганизмами, у животных, включая людей. Фармацевтически приемлемые композиции, содержащие в качестве активного ингредиента соединение по настоящему изобретению или его фармацевтически приемлемую соль, могут вводиться перорально или парентерально путем, например, внутривенной инъекции, внутримышечной инъекции, или подкожно, ректально или чрескожно человеку и отличным от человека животным.
Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение настоящего изобретения, может быть составлена в виде подходящих дозированных форм, в зависимости от путей введения. Конкретно, соединения по настоящему изобретению могут быть составлены в виде, например, препаратов для инъекций, таких как препаратов для внутривенных инъекций и препаратов для внутримышечных инъекций; препаратов для перорального приема, таких как капсулы, таблетки, гранулы, порошки, пилюли, мелкодисперсные порошки и пастилки; препаратов для ректального введения; и маслянистых суппозиториев.
Данные препараты могут быть получены с применением общепринятых способов с использованием традиционно применяемых для получения препаратов адъювантов, например, эксципиентов, наполнителей, связующих веществ, увлажнителей, дезинтегрантов, поверхностно-активных веществ, замасливателей, диспергаторов, буферов, консервантов, разжижающих средств, антисептиков, ароматизаторов, обезболивающих средств и стабилизаторов.
Применимые здесь нетоксические адъюванты включают, например, лактозу, фруктозу, глюкозу, крахмал, желатин, карбонат магния, синтетический силикат магния, тальк, стеарат магния, метилцеллюлозу, или их соли, гуммиарабик, полиэтиленгликоль, сироп, вазелин, глицерин, этанол, пропиленгликоль, лимонную кислоту, хлорид натрия, сульфит натрия и фосфат натрия.
Дозировка может быть определена подходящим образом, в зависимости от различных условий, например, цели лечения или профилактики, возраста, пола и степени тяжести состояния пациентов. Дозировка для лечения инфекционных заболеваний обычно составляет приблизительно от 25 до 2000 мг, предпочтительно от 50 до 1000 мг в сутки для взрослого человека. Данная дозировка может применяться в сутки однократно или может быть разделена на несколько приемов.
ПРИМЕРЫ
Настоящее изобретение дополнительно иллюстрируется следующими примерами синтеза, примерами и тестовыми примерами, которые не предназначены в качестве ограничения изобретения.
[Пример синтеза 1] 7-(Пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-[(Пиридин-3-ил)гидроксиметил]имидазо[5,1-b]тиазол
Раствор 2,50 г 7-йодимидазо[5,1-b]тиазола в 50 мл безводного ТГФ охлаждали на льду и в атмосфере аргона к охлажденному раствору добавляли 11,3 мл 0,93 M раствора метилмагнийбромида в ТГФ. Смесь перемешивали при данной температуре в течение 20 минут. Затем к ней добавляли пиридин-3-альдегид (1,04 мл), перемешивали смесь при данной температуре в течение 40 минут и затем при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду и пятикратно экстрагировали смесь дихлорметаном. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент - дихлорметан:метанол=20:1) с получением 1,925 г 7-[(пиридин-3-ил)гидроксиметил]имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 6,05 (1H, с), 6,72 (1H, д, J=4,2 Гц), 7,3-7,4 (2H, м), 7,8-7,9 (1H, м), 7,99 (1H, с), 8,55-8,65 (1H, м), 8,7-8,75 (1H, м)
b) 7-(Пиридин-3-ил)карбонилимидазо[5,1-b]тиазол
К раствору 1,02 г 7-[(пиридин-3-ил)гидроксиметил]имидазо-[5,1-b]тиазола в 40 мл дихлорметана добавляли диоксид марганца (1,0 г) и перемешивали смесь при комнатной температуре в течение 5 часов. Реакционную смесь фильтровали через целит (броунмиллерит) и затем промывали дихлорметаном. Фильтрат концентрировали при пониженном давлении с получением 1,10 г 7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 7,20 (1H, д, J=4,2 Гц), 7,4-7,5 (1H, м), 7, 63 (1H, д, J=4,2 Гц), 8,10 (1H, с), 8,75-8,85 (2H, м), 9,7-9,75 (1H, м)
c) 7-(Пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
К раствору 520 мг 7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазола в 25 мл ТГФ при -60°C в атмосфере аргона добавляли три-н-бутилстаннилхлорид (0,841 мл) и 2,95 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ, и перемешивали смесь в течение 20 минут. Температуру смеси повышали до -50°C, добавляли к ней 1,0 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ и перемешивали смесь в течение 30 минут. Температуру смеси повышали до -40°C, добавляли к ней 0,5 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ и перемешивали смесь в течение 30 минут. К реакционной смеси добавляли водный раствор хлорида аммония, экстрагировали смесь этилацетатом и затем промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния. Растворитель удаляли путем перегонки и очищали остаток методом колоночной хроматографии на силикагеле (элюент - гексан:этилацетат=2:1 → только этилацетат) с получением 712 мг указанного в заголовке соединения.
ЯМР (CDCl3) δ: 0,92 (9H, т, J=7,2 Гц), 1,2-1,3 (6H, м), 1,3-1,45 (6H, м), 1,55-1,65 (6H, м), 7,36 (1H, с), 7,4-7,45 (1H, м), 8,03 (1H, с), 8,75-8,85 (2H, м), 9,65-9,7 (1H, м)
[Пример синтеза 2] 7-(Пиридин-4-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-[(Пиридин-4-ил)гидроксиметил]имидазо[5,1-b]тиазол
7-[(Пиридин-4-ил)гидроксиметил]имидазо[5,1-b]тиазол (1,32 г) получали способом, сходным с описанным на стадии a) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 2, 50 г 7-йодимидазо[5,1-b]тиазола и 1,05 мл пиридин-4-альдегида.
ЯМР (ДМСО-d6) δ: 5,76 (1H, д, J=4,8 Гц), 6,19 (1H, д, J=4,8 Гц), 7,11 (1H, д, J=4,5 Гц), 7,35-7,45 (2H, м), 7,80 (1H, д, J=4,5 Гц), 8,11 (1H, с), 8,5-8,55 (2H, м)
b) 7-(Пиридин-4-ил)карбонилимидазо[5,1-b]тиазол
7-(Пиридин-4-ил)карбонилимидазо[5,1-b]тиазол (1,16 г) получали способом, сходным с описанным на стадии b) примера синтеза 1, за исключением того, что в качестве исходного соединения применяли 1,32 г 7-[(пиридин-4-ил)гидроксиметил]имидазо[5, 1-b]тиазола.
ЯМР (CDCl3) δ: 7,21 (1H, д, J=4,2 Гц), 7,64 (1H, д, J=4,2 Гц), 8,10 (1H, с), 8,3-8,35 (2H, м), 8,8-8,85 (2H, м)
c) 7-(Пиридин-4-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Указанное в заголовке соединение (1,78 г) получали способом, сходным с описанным на стадии c) примера синтеза 1, за исключением того, что в качестве исходного соединения применяли 1,03 г 7-(пиридин-4-ил)карбонилимидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 0,92 (9H, т, J=7,5 Гц), 1,2-1,3 (6H, м), 1,3-1,45 (6H, м), 1,55-1,65 (6H, м), 7,37 (1H, с), 8,03 (1H, с), 8,25-8,3 (2H, м), 8,8-8,85 (2H, м)
[Пример синтеза 3] 7-(4-Метилтиазол-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-(4-Метилтиазол-5-ил)карбонилимидазо[5,1-b]тиазол
Раствор 1,75 г 7-йодимидазо[5, 1-b]тиазола в 35 мл безводного ТГФ охлаждали на льду и в атмосфере аргона к охлажденному раствору добавляли 8,56 мл 0,9 M раствора метилмагнийбромида в ТГФ. Смесь перемешивали при данной температуре в течение 20 минут и затем добавляли к ней 923 мг 4-метилтиазол-5-альдегида. Смесь перемешивали при той же температуре в течение 20 минут и затем при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и пятикратно экстрагировали смесь дихлорметаном. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Для приготовления раствора остаток растворяли в 35 мл дихлорметана. К раствору добавляли диоксид марганца (2,1 г) и перемешивали смесь при комнатной температуре в течение 4 часов. Реакционную смесь фильтровали через целит и затем промывали дихлорметаном. Фильтрат концентрировали при пониженном давлении. Остаток перекристаллизовывали из дихлорметана/гексана с получением 1,50 г 7-(4-метилтиазол-5-ил)карбонилимидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 2,88 (3H, с), 7,09 (1H, д, J=4,1 Гц), 7,54 (1H, д, J=4,1 Гц), 8,00 (1H, с), 8,81 (1H, с)
b) 7-(4-Метилтиазол-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Указанное в заголовке соединение (254 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 502 мг 7-(4-метилтиазол-5-ил)карбонилимидазо[5,1-b]тиазола, 0,598 мл три-н-бутилстаннилхлорида и 4,0 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,90 (9H, т, J=7,3 Гц), 1,18 (6H, м), 1,24 (6H, м), 1,34 (6H, м), 2,93 (3H, с), 7,31 (1H, с), 7, 98 (1H, с), 8,84 (1H, с)
[Пример синтеза 4] 7-[(2S)-1-(4-Нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-[[(2S)-1-(4-Нитробензилоксикарбонил)пирролидин-2-ил]гидроксиметил]имидазо[5,1-b]тиазол
7-[[(2S)-1-(4-Нитробензилоксикарбонил)пирролидин-2-ил]гидроксиметил]имидазо[5,1-b]тиазол (2,21 г) получали способом, сходным с описанным на стадии a) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 2,50 г 7-йодимидазо[5,1-b]тиазола и 2,32 г (2S)-1-(4-нитробензилоксикарбонил)пирролидин-2-альдегида.
ЯМР (CDCl3) δ: 1,7-2,3 (4H, м), 3,4-3,6 (2H, м), 4,15-4,25 (1H, м), 4,87 (1H, д, J=8,7 Гц), 5,30 (2H, с), 6, 82 (1H, д, J=4,5 Гц), 7,37 (1H, д, J=4,5 Гц), 7,56 (2H, д, J=8,7 Гц), 7,93 (1H, с), 8,24 (2H, д, J=8,7 Гц)
b) 7-[(2S)-1-(4-Нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5, 1-b]тиазол
7-[(2S)-1-(4-Нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол (1,79 г) получали способом, сходным с описанным на стадии b) примера синтеза 1, за исключением того, что в качестве исходного соединения применяли 2,21 г 7-[[(2S)-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]гидроксиметил]имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,9-2,5 (4H, м), 3,55-3,85 (2H, м), 4,9-5,3 (2H, м), 5,45-5,55 (1H, м), 7,05-7,6 (4H, м), 7,9-8,25 (3H, м)
c) 7-[(2S)-1-(4-Нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Указанное в заголовке соединение (1,82 г) получали способом, сходным с описанным на стадии c) примера синтеза 1, за исключением того, что в качестве исходного соединения применяли 2,15 г 7-[(2S)-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5, 1-b]тиазола.
ЯМР (CDCl3) δ: 0,91 (9H, т, J=7,2 Гц), 1,2-1,3 (6H, м), 1,3-1,4 (6H, м), 1,5-1,7 (6H, м), 1,9-2,5 (4H, м), 3,55-3,85 (2H, м), 4,9-5,3 (2H, м), 5,45 -5,55 (1H, м), 7,2-7,55 (3H, м), 7,9-8,25 (3H, м)
[Пример синтеза 5] 7-(Пиримидин-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-[(Пиримидин-5-ил)гидроксиметил]имидазо[5,1-b]тиазол
Для приготовления раствора 5-бромпиримидин (1,11 г) растворяли в растворе 7 мл тетрагидрофурана и 14 мл диэтилового эфира. В атмосфере аргона к раствору по каплям добавляли 1,6 н раствор н-бутиллития в н-гексане (4,56 мл) при -78°C и перемешивали смесь в течение 30 минут. Затем в атмосфере аргона при -78°C к ней по каплям добавляли 7-формилимидазо[5,1-b]тиазол (608 мг) в тетрагидрофуране (16 мл). Смесь перемешивали при данной температуре в течение 30 минут. Затем температуру повышали до комнатной температуры и добавляли к смеси 70 мл этилацетата. Органический слой дважды промывали полунасыщенным солевым раствором и однократно насыщенным солевым раствором. Промытый органический слой сушили над безводным сульфатом магния и фильтровали. Растворитель удаляли путем перегонки при пониженном давлении и очищали остаток методом колоночной хроматографии на силикагеле (элюент - хлороформ/метанол=40/1 → 25/1 → 10/1) с получением 398 мг 7-[(пиримидин-5-ил)гидроксиметил]имидазо[5,1-b]тиазола.
ЯМР (ДМСО-d6) δ: 5,88 (1H, д, J=4,6 Гц), 6,33 (1H, д, J=4,6 Гц), 7,15 (1H, д, J=4,2 Гц), 7,81 (1H, д, J=4,2 Гц), 8,11 (1H, с), 8,79 (2H, с), 9,09 (1H, с)
b) 7-(Пиримидин-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Кетоновое соединение (217 мг) получали по существу тем же способом, что и описанный на стадии b) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 398 мг 7-[(пиримидин-5-ил)гидроксиметил]имидазо[5,1-b]тиазола и 400 мг диоксида марганца. 7-(Пиримидин-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол (68 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 46 мг кетонового соединения, 0,124 мл три-н-бутилстаннилхлорида и 0,900 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,92 (9H, т, J=7,3 Гц), 1,25 -1,33 (6H, м), 1,36-1,49 (6H, м), 1,53-1,62 (6H, м), 7,38 (1H, т, J=7,1 Гц), 8,04 (1H, с), 9,34 (1H, с), 9,78 (1H, с)
[Пример синтеза 6] 7-(Тиофен-2-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-(Тиофен-2-ил)карбонилимидазо[5, 1-b]тиазол
7-(Тиофен-2-ил)карбонилимидазо[5,1-b]тиазол (1,37 г) получали способом, сходным с описанным на стадии a) примера синтеза 3, за исключением того, что в качестве исходных соединений применяли 1,50 г 7-йодимидазо[5,1-b]тиазола и 0,561 мл тиофен-2-альдегида.
ЯМР (CDCl3) δ: 6,98 (1H, д, J=4,1 Гц), 7,05 (1H, м), 7,44 (1H, д, J=4,1 Гц), 7, 53 (1H, м), 7,90 (1H, с), 8,50 (1H, м)
b) 7-(Тиофен-2-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Указанное в заголовке соединение (923 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 550 мг 7-(тиофен-2-ил)карбонилимидазо[5,1-b]тиазола, 0,701 мл три-н-бутилстаннилхлорида и 3,6 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,85 (9H, т, J=7,3 Гц), 1,04 (6H, м), 1,11 (6H, м), 1,42 (6H, м), 7,03 (1H, м), 7,18 (1H, c), 7,48 (1H, м), 7,95 (1H, с), 8,47 (1H, с)
[Пример синтеза 7] 7-[5-(трет-Бутилдиметилсилилоксиметил)пиридин-3-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5, 1-b]тиазол
a) 7-[[5-(трет-Бутилдиметилсилилоксиметил)пиридин-3-ил]гидроксиметил]имидазо[5,1-b]тиазол
Раствор 2,49 г 5-бром-3-(трет-бутилдиметилсилилоксиметил)пиридина в 25 мл безводного диэтилового эфира охлаждали до -85°C в атмосфере аргона и к охлажденному раствору в течение 10 минут по каплям добавляли 5,56 мл 1,57 н раствора н-бутиллития в гексане. Смесь перемешивали при данной температуре в течение 30 минут, затем к ней добавляли раствор 881 мг 7-формилимидазо[5,1-b]тиазола в 20 мл безводного ТГФ, а затем перемешивали ее при той же температуре в течение 30 минут. К реакционной смеси добавляли воду. Смесь трижды экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент - этилацетат:метанол=10:1) с получением 803 мг 7-[[5-(трет-бутилдиметилсилилоксиметил)пиридин-3-ил]гидроксиметил]имидазо[5, 1-b]тиазола.
ЯМР (CDCl3) δ: 0,07 (6H, с), 0,99 (9H, с), 4,76 (2H, с), 6,02 (1H, с), 6,71 (1H, д, J=4,1 Гц), 7,32 (1H, д, J=4,1 Гц), 7,77 (1H, с), 7,95 (1H, с), 8,55 (1H, м), 8,61 (1H, м)
b) 7-[5-(трет-Бутилдиметилсилилоксиметил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол
К раствору 803 мг 7-[[5-(трет-бутилдиметилсилилоксиметил)пиридин-3-ил]гидроксиметил]имидазо[5,1-b]тиазола в 10 мл дихлорметана добавляли диоксид марганца (1,43 г) и перемешивали смесь при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через целит и затем промывали дихлорметаном. Фильтрат концентрировали при пониженном давлении с получением 712 мг 7-[5-(трет-бутилдиметилсилилоксиметил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 0,10 (6H, с), 0,94 (9H, с), 4,85 (2H, с), 7,16 (1H, д, J=4,0 Гц), 7, 58 (1H, д, J=4,0 Гц), 8,08 (1H, с), 8,72 (1H, м), 8,76 (1H, м), 9,60 (1H, м)
с) 7-[5-(трет-Бутилдиметилсилилоксиметил)пиридин-3-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5, 1-b]тиазол
Указанное в заголовке соединение (926 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 712 мг 7-[5-(трет-бутилдиметилсилилоксиметил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазола, 0,572 мл три-н-бутилстаннилхлорида и 2,9 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ. ЯМР (CDCl3) 6: 0,10 (6H, с), 0,98 (9H, т, J=7,2 Гц), 1,00 (9H, с), 1,18 (6H, м), 1,32 (6H, м), 1,54 (6H, 20 м), 4,85 (2H, с), 7,31 (1H, с), 7,98 (1H, с), 8,72 (2H, м), 9,58 (1H, м)
[Пример синтеза 8] 7-(6-Метилпиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-(6-Метилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол
7-(6-Метилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол (885 мг) получали способом, сходным с описанным на стадии a) примера синтеза 3, за исключением того, что в качестве исходных соединений применяли 1, 10 г 7-йодимидазо[5,1-b]тиазола и 532 мг 2-метилпиридин-5-альдегида.
ЯМР (CDCl3) δ: 2,51 (3H, с), 7,02 (1H, д, J=4,1 Гц), 7,18 (1H, м), 7,50 (1H, д, J=4,1 Гц), 7,97 (1H, с), 8,61 (1H, м), 9,48 (1H, м)
b) 7-(6-Метилпиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Указанное в заголовке соединение (606 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 447 мг 7-(6-метилпиридин-3-ил)карбонилимидазо[5,1-b]тиазола, 0,552 мл три-н-бутилстаннилхлорида и 3,2 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,85 (9H, т, J=7,3 Гц), 1,10 (6H, м), 1,20 (6H, м), 1, 43 (6H, м), 2,46 (3H, с), 7,16 (1H, м), 7,20 (1H, с), 7,85 (1H, с), 8,57 (1H, м), 9,40 (1H, 10 м)
[Пример синтеза 9] 7-(5-Метилтиопиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5, 1-b]тиазол
a) 7-[(5-Метилтиопиридин-3-ил)гидроксиметил]имидазо[5,1-b]тиазол
7-[(5-Метилтиопиридин-3-ил)гидроксиметил]имидазо-[5,1-b]тиазол (119 мг) получали по существу тем же способом, что и описанный на стадии a) примера синтеза 5, за исключением того, что в качестве исходных материалов применяли 204 мг 3-бром-5-метилтиопиридина, 0,656 мл 1,6 н раствора н-бутиллития в н-гексане и 102 мг 7-формилимидазо[5,1-b]тиазола.
ЯМР (ДМСО-d6) δ: 2,49 (3H, с), 5,78 (1H, д, J=4,6 Гц), 6,13 (1H, д, J=4,4 Гц), 7,11 (1H, д, J=4,4 Гц), 7,67 (1H, с), 7,80 (1H, д, J=4,2 Гц), 8,10 (1H, с), 8,36 (2H, с)
b) 7-(5-Метилтиопиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Кетоновое соединение (408 мг) получали по существу тем же способом, что и описанный на стадии b) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 430 мг 7-[(5-метилтиопиридин-3-ил)гидроксиметил]имидазо[5,1-b]тиазола и 320 мг диоксида марганца. 7-(5-Метилтиопиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол (179 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 138 мг кетонового соединения, 0,300 мл три-н-бутилстаннилхлорида и 2, 25 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,93 (9H, т, J=7,3 Гц), 1,15-1,23 (6H, м), 1,27-1,35 (6H, м), 1,56-1,64 (6H, м), 7,35 (1H, т, J=7,3 Гц), 8,02 (1H, с), 8,64 (2H, с), 9,51 (1H, с)
[Пример синтеза 10] 7-(Хинолин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-[(Хинолин-3-ил)гидроксиметил]имидазо[5,1-b]тиазол
7-[(Хинолин-3-ил)гидроксиметил]имидазо[5,1-b]тиазол (203 мг) получали по существу тем же способом, что и описанный на стадии a) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 0,25 г 7-йодимидазо[5,1-b]тиазола, 1,17 мл 0,93 M раствора метилмагнийбромида в тетрагидрофуране и 173 мг 3-хинолинкарбоксиальдегида.
ЯМР (ДМСО-d6) δ: 6,01 (1H, д, J=4,4 Гц), 6,26 (1H, д, J=4,4 Гц), 7,09 (1H, д, J=4,1 Гц), 7,58 (1H, т, J=7,8 Гц), 7,71 (1H, т, J=7,9 Гц), 7, 80 (1H, д, J=4,1 Гц), 8,00 (2H, д, J=8,0 Гц), 8,10 (1H, с), 8,90 (1H, с)
b) 7-(Хинолин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Кетоновое соединение (327 мг) получали по существу тем же способом, что и описанный на стадии b) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 577 мг 7-[(хинолин-3-ил)гидроксиметил]имидазо[5,1-b]тиазола и 421 мг диоксида марганца. 7-(Хинолин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол (73 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 64 мг кетонового соединения, 0,140 мл три-н-бутилстаннилхлорида и 1,50 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,93 (9H, т, J=7,3 Гц), 1,14-1,24 (6H, м), 1,33-1,42 (6H, м), 1,61-1,68 (6H, м), 7,38 (1H, т, J=7,3 Гц), 7,61 (1H, т, J=8,0 Гц), 7,81 (1H, м), 8,03 (1H, д, J=8,0 Гц), 8,07 (1H, с), 8,16 (1H, д, J=8,6 Гц), 9,57 (1H, с), 9,84 (1H, с)
[Пример синтеза 11] 7-([3,3']Бипиридинил-5-ил)карбонилимидазо-[5, 1-b]тиазол
a) 7-[(5-Бромпиридин-3-ил)гидроксиметил]имидазо[5,1-b]тиазол
7-[(5-Бромпиридин-3-ил)гидроксиметил]имидазо[5,1-b]тиазол (2,77 г) получали по существу тем же способом, что и описанный на стадии a) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 2,50 г 7-йодимидазо[5,1-b]тиазола, 12,2 мл 0,93 M раствора метилмагнийбромида в тетрагидрофуране и 2,05 г 3-бром-5-формилпиридина.
ЯМР (CDCl3) δ: 4,86 (1H, с), 6,04 (1H, с), 6,74 (1H, д, J=4,2 Гц), 7,35 (1H, д, J=4,4 Гц), 7, 97 (1H, c), 8,04 (1H, с), 8,62 (2H, с)
b) 7-([3,3']Бипиридинил-5-ил)карбонилимидазо[5,1-b]тиазол
Кетоновое соединение (1,96 г) получали по существу тем же способом, что и описанный на стадии b) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 2,77 г 7-[(5-бромпиридин-3-ил)гидроксиметил]имидазо[5,1-b]тиазола и 2,00 г диоксида марганца. Для приготовления раствора кетоновое соединение (616 мг) растворяли в 20 мл N,N-диметилформамида. К раствору при комнатной температуре в атмосфере аргона добавляли диэтил(3-пиридил)боран (588 мг), 232 мг тетракис(трифенилфосфин)палладия(0) и 552 мг карбоната калия. Смесь перемешивали при 90°C в течение 2,5 часов. К реакционной смеси добавляли этилацетат (200 мл) и четырежды промывали органический слой 80 мл воды и однократно насыщенным солевым раствором. Промытый органический слой сушили над безводным сульфатом магния и фильтровали. Растворитель удаляли путем перегонки при пониженном давлении и очищали остаток методом хроматографии на силикагеле (элюент - хлороформ/метанол= 20/1 → 10/1) с получением 428 мг 7-([3,3']бипиридинил-5-ил)карбонилимидазо[5, 1-b]тиазола.
ЯМР (CDCl3) δ: 7,21 (1H, д, J=3,9 Гц), 7,45 (1H, м), 7,65 (1H, д, J=4,1 Гц), 8,00 (1H, м), 8,11 (1H, с), 8,68 (1H, д, J=4,9 Гц), 8,95 (1H, с), 9,05 (1H, с), 9,08 (1H, с), 9,76 (1H, с)
[Пример синтеза 12] 7-(5-Фенилпиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-(5-Фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол
Кетоновое соединение (1,96 г) получали по существу тем же способом, что и описанный на стадии b) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 2,77 г 7-[(5-бромпиридин-3-ил)гидроксиметил]имидазо[5,1-b]тиазола и 2,00 г диоксида марганца. 7-(5-Фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол (285 мг) получали по существу тем же способом, что и описанный на стадии b) примера синтеза 11, за исключением того, что в качестве исходных соединений применяли 308 мг кетонового соединения, 240 мг фенилбороновой кислоты, 116 мг тетракис(трифенилфосфин)палладия(0) и 276 мг карбоната калия.
ЯМР (CDCl3) δ: 7,20 (1H, д, J=4,1 Гц), 7,45-7,53 (3H, м), 7,64 (1H, д, J=3,9 Гц), 7,65-7,70 (2H, м), 8,10 (1H, с), 9,01 (2H, c), 9,72 (1H, с)
b) 7-(5-Фенилпиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
7-(5-Фенилпиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол (297 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 275 мг 7-(5-фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазола, 0,330 мл три-н-бутилстаннилхлорида и 1,80 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,93 (9H, т, J=7,3 Гц), 1,15-1,22 (6H, м), 1,28-1,34 (6H, м), 1,59-1,64 (6H, м), 7,37 (1H, т, J=7,3 Гц), 7,41-7,45 (3H, м), 7,67-7,70 (2H, м), 8,03 (1H, с), 8,99 (2H, м), 9,69 (1H, с)
[Пример синтеза 13] 7-(Тиазол-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-(Тиазол-5-ил)карбонилимидазо[5,1-b]тиазол
7-(Тиазол-5-ил)карбонилимидазо[5,1-b]тиазол (187 мг) получали способом, сходным с описанным на стадии a) примера синтеза 3, за исключением того, что в качестве исходных соединений применяли 265 мг 7-йодимидазо[5,1-b]тиазола и 119 мг тиазол-5-альдегида.
ЯМР (CDCl3) δ: 7,18 (1H, д, J=4,1 Гц), 7,62 (1H, д, J=4,1 Гц), 8,10 (1H, с), 9,03 (1H, с), 9, 33 (1H, с)
b) 7-(Тиазол-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Указанное в заголовке соединение (260 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 187 мг 7-(тиазол-5-ил)карбонилимидазо[5,1-b]тиазола, 0,235 мл три-н-бутилстаннилхлорида и 1, 2 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,90 (9H, т, J=7,3 Гц), 1,22 (6H, м), 1,35 (6H, м), 1,58 (6H, м), 7,38 (1H, с), 8,02 (1H, с), 9,02 (1H, с), 9,28 (1H, с)
[Пример синтеза 14] 7-[(2S,4R)-4-трет-Бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5, 1-b]тиазол
a) 7-[[(2S,4R)-4-трет-Бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]гидроксиметил]имидазо[5,1-b]тиазол
7-[[(2S, 4R)-4-трет-Бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]гидроксиметил]имидазо[5,1-b]тиазол (4,18 г) получали способом, сходным с описанным на стадии a) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 3,39 г 7-йодимидазо[5,1-b]тиазола и 4,61 г (2S,4R)-4-трет-бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-альдегида.
ЯМР (CDCl3) δ: 0,01 (6H, с), 0,82 (9H, c), 1,7-2,3 (2H, м), 3,35-3,7 (2H, м), 4,1-4,2 (1H, м), 4,3-4,4 (1H, м), 4,85-4,95 (1H, м), 5,26 (1H, д, J=13,5 Гц), 5,37 (1H, д, J=13,5 Гц), 5,45-5,5 (1H, м), 6,82 (1H, д, J=4,2 Гц), 7,37 (1H, д, J=4,2 Гц), 7,54 10 (2H, д, J=8,1 Гц), 7,92 (1H, с), 8,24 (2H, д, J=8,1 Гц)
b) 7-[(2S, 4R)-4-трет-Бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол
7-[(2S, 4R)-4-трет-Бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол (3,89 г) получали способом, сходным с описанным на стадии b) примера синтеза 1, за исключением того, что в качестве исходного соединения применяли 4,18 г 7-[[(2S,4R)-4-трет-бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]гидроксиметил]имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 0,08 (6H, с), 0,89 (9H, с), 2,1-2,2 (1H, м), 2,3-2,5 (1H, м), 3,5-3,6 (1H, м), 3,8-3,9 (1H, м), 4,45-4,55 (1H, м), 4,85-5,35 (2H, м), 5,5-5,7 (1H, м), 7,1-7, 15 (1H, м), 7,2-7,55 (3H, м), 7,85-8,2 (3H, м)
c) 7-[(2S,4R)-4-трет-Бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5, 1-b]тиазол
Указанное в заголовке соединение (707 мг) получали способом, сходным с описанным на стадии c) примера синтеза 1, за исключением того, что в качестве исходного соединения применяли 725 мг 7-[(2S,4R)-4-трет-бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол. ЯМР (CDCl3) δ: 0,07 (6H, с), 0,8-1,0 (18H, м), 1, 1-1,4 (12H, м), 1,5-1,7 (6H, м), 2,1-2,25 (1H, м), 2,35-2,45 (1H, м), 3,45-3,6 (1H, м), 3,8-3,9 (1H, м), 4,5-4,6 (1H, м), 4,9-5,3 (2H, м), 5,5-5,7 (1H, м), 7,2-7,55 (3H, м), 7,8-8,25 (3H, м)
[Пример синтеза 15] 7-[[5-(Морфолин-4-ил)метилпиридин-3-ил]гидроксиметил]имидазо[5,1-b]тиазол
7-[[5-(Морфолин-4-ил)метилпиридин-3-ил]гидроксиметил]имидазо[5,1-b]тиазол (384 мг) получали по существу тем же способом, что и описанный на стадии a) примера синтеза 5, за исключением того, что в качестве исходных материалов применяли 1,05 г 4-(5-бромпиридин-3-ил)метилморфолина, 2,70 мл 1,59 н раствора н-бутиллития в н-гексане и 426 мг 7-формилимидазо[5,1-b]тиазола.
ЯМР (ДМСО-d6) δ: 2,46 (4H, т, J=4,6 Гц), 3,54 (2H, с), 3,69 (4H, т, J=4,6 Гц), 6,05 (1H, с), 6,71 (1H, д, J=4,2 Гц), 7,34 (1H, д, J=4,2 Гц), 7,85 (1H, с), 7,99 (1H, с), 8,54 (1H, с), 8,61 (1H, с)
[Пример синтеза 16] 7-[5-(2-Азидоэтилтио)пиридин-3-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-[5-(2-Азидоэтилтио)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол
7-[5-(2-Азидоэтилтио)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол (667 мг) получали способом, сходным с описанным на стадии a) примера синтеза 3, за исключением того, что в качестве исходных соединений применяли 650 г 7-йодимидазо[5,1-b]тиазола и 570 мг 3-(2-азидоэтилтио)пиридин-5-альдегида.
ЯМР (CDCl3) δ: 3,19 (2H, т, J=7,2 Гц), 3,56 (2H, т, J=7,2 Гц), 7,20 (1H, д, J=4,1 Гц), 7,65 (1H, д, J=4,1 Гц), 8,10 (1H, с), 8,76 (1H, м), 8,91 (1H, м), 9,56 (1H, м)
b) 7-[5-(2-Азидоэтилтио)пиридин-3-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Указанное в заголовке соединение (857 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 667 мг 7-[5-(2-азидоэтилтио)пиридин-3-ил]карбонилимидазо[5,1-b]тиазола, 0,603 мл три-н-бутилстаннилхлорида и 3,7 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,90 (9H, т, J=7,3 Гц), 1,24 (6H, м), 1,38 (6H, м), 1,58 (6H, м), 3,18 (2H, т, J=7,2 Гц), 3,57 (2H, т, J=7,2 Гц), 7,38 (1H, с), 8,04 (1H, с), 8,76 (1H, м), 8,86 (1H, м), 9, 56 (1H, м)
[Пример синтеза 17] 7-[(2S,4S)-4-Азидо-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
a) 7-[(2S, 4R)-4-Гидрокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол
7-[(2S, 4R)-4-трет-Бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол (1,15 г) растворяли в 10 мл 1,6 н раствора хлористоводородной кислоты в метаноле с получением раствора, который перемешивали с охлаждением на льду в течение 30 минут. К реакционной смеси добавляли водный раствор карбоната калия, экстрагировали смесь дихлорметаном, а затем промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и удаляли растворитель путем перегонки с получением 853 мг 7-[(2S, 4R)-4-гидрокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,90 (1H, м), 2,22 (1H, м), 2,52 (1H, м), 3,66-3,78 (1H, м), 3,88 (1H, м), 4,59 (1H, уш.с), 4,88-5,31 (2H, м), 5,66-5,72 (1H, м), 7,13 (1H, м), 7,22-7,57 (1H, м), 7,91-8,23 (1H, м)
b) 7-[(2S, 4R)-4-Метансульфонилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол
Для приготовления раствора 7-[(2S, 4R)-4-гидрокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол (850 мг) растворяли в 20 мл дихлорметана и 7 мл ДМФ при охлаждении на льду. К раствору добавляли триэтиламин (0, 425 мл) и 0,19 мл метансульфонилхлорида и перемешивали смесь в течение 30 минут. К реакционной смеси добавляли воду, экстрагировали смесь дихлорметаном, а затем дважды промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и удаляли растворитель путем перегонки с получением 734 мг неочищенного продукта 7-[(2S, 4R)-4-метансульфонилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазола.
c) 7-[(2S, 4S)-4-Азидо-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол
К раствору 552 мг 7-[(2S, 4R)-4-метансульфонилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазола в 5 мл ДМФ добавляли азид натрия (87 мг) и перемешивали смесь при 100°C в течение 13 часов. К реакционной смеси добавляли воду, экстрагировали смесь этилацетатом, а затем трижды промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и удаляли растворитель путем перегонки с получением 474 мг неочищенного продукта 7-[(2S,4S)-4-азидо-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазола.
d) 7-[(2S, 4S)-4-Азидо-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол
Указанное в заголовке соединение (321 мг) получали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 585 мг 7-[(2S, 4S)-4-азидо-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазола, 0,396 мл три-н-бутилстаннилхлорида и 2,8 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ.
ЯМР (CDCl3) δ: 0,92 (9H, т, J=7,3 Гц), 1,24 (6H, м), 1,35 (6H, м), 1,56 (6H, м), 2,31 (1H, м), 2,80 (1H, м), 3,66 (1H, м), 4,20 (1H, м), 4,95-5,31 (2H, м), 5,39-5,52 (1H, м), 7,29 (1H, м), 7,54 (1H, м), 7,88-7,98 (3H, м), 8,23 (1H, м)
[Пример 1] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 1)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
К раствору 474 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата в 13 мл безводного ацетонитрила в атмосфере аргона при -30°C по каплям добавляли N,N-диизопропилэтиламин (0,343 мл), а затем по каплям добавляли 0,218 мл безводной трифторметансульфоновой кислоты. Смесь перемешивали при данной температуре в течение 30 минут. Затем к ней добавляли этилацетат (30 мл), затем поочередно промывали полунасыщенным солевым раствором, смешанным раствором (pH=1,1), составленным из полунасыщенного солевого раствора и 1 н водного раствора хлористоводородной кислоты, смешанным раствором (pH=8,9), составленным из полунасыщенного солевого раствора и насыщенного водного раствора бикарбоната натрия, и полунасыщенным солевым раствором. Органический слой затем сушили над безводным сульфатом магния и фильтровали. Растворитель удаляли путем перегонки при пониженном давлении. Для приготовления раствора остаток растворяли в 6 мл безводного N-метилпирролидинона. К раствору добавляли три-2-фурилфосфин (37 мг), 343 мг хлорида цинка, 37 мг трис(дибензилиденацетон)дипалладия(0) и 712 мг 7-(пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола, и перемешивали смесь при 50°C в атмосфере аргона в течение 2 часов. К реакционному раствору добавляли этилацетат (30 мл) и 15 мл полунасыщенного водного раствора карбоната натрия, смесь перемешивали и удаляли нерастворимые вещества путем фильтрации. Органический слой отделяли от фильтрата, трижды промывали 20 мл полунасыщенного солевого раствора и сушили над безводным сульфатом магния. Растворитель удаляли путем перегонки при пониженном давлении и очищали остаток методом колоночной хроматографии на силикагеле (элюент - дихлорметан:метанол=20:1 → 10:1) с получением 388 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,19 (3H, д, J=6,0 Гц), 1, 24 (3H, д, J=7,5 Гц), 3,45 (1H, дд, J1=6,3 Гц, J2=3,0 Гц), 3,7-3,85 (1H, м), 4,0-4,1 (1H, м), 4,68 (1H, дд, J1=9,9 Гц, J2=3,0 Гц), 5,17 (1H, д, J=5,4 Гц), 5, 41 (1H, д, J=13,8 Гц), 5,55 (1H, д, J=13,7 Гц), 7,55-7,65 (1H, м), 7,74 (2H, д, J=9,0 Гц), 8,22 (2H, д, J=9,0 Гц), 8,47 (1H, с), 8,64 (1H, с), 8,65-8,75 (1H, м), 8,75-8,8 (1H, м), 9,55-9,6 (1H, м)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Для приготовления раствора 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (128,5 мг) растворяли в 6,7 мл ТГФ и 6,7 мл 1/15 M натрийфосфатного буферного раствора (pH 6,6) и добавляли к раствору 130 мг 10% палладия-на-углероде. В реакционном сосуде замещали воздух водородом и перемешивали содержимое реакционного сосуда при комнатной температуре в течение 2 часов. Катализатор удаляли путем фильтрации через целит и затем промывали водой. Фильтрат промывали этилацетатом и затем концентрировали при пониженном давлении до объема, равного приблизительно 2 мл. Концентрат очищали методом колоночной хроматографии на Cosmosil 40C18-PREP (элюент - 5% водный раствор метанола) с получением 40,9 мг указанного в заголовке соединения.
ЯМР (D2O) δ (HOD=4,80 м.д.): 1,15 (3H, д, J=7,2 Гц), 1,33 (3H, д, J=6,3 Гц), 3,45-3,6 (2H, м), 4,2-4,35 (2H, м), 7,35-7,45 (1H, м), 7,91 (1H, с), 8,07 (1H, с), 8,25-8,3 (1H, м), 8,5-8,55 (1H, м), 8,85-8,9 (1H, м)
Соединения №№ 33, 36, 37, 43, 45, 46, 47, 49, 50, 56, 57, 65, 66, 71, 73, 74, 88, 89, 96, 97, 98, 101, 107, 115, 118, 119, 124, 160, 165 и 172 синтезировали способом, сходным с описанным в примере 1.
[Пример 2] (1S,5R,6S)-2-[7-(1-Карбамоилметилпиридиний-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 2)
a) Йодид 4-нитробензил-(1S,5R, 6S)-2-[7-(1-карбамоилметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксила
Для приготовления суспензии 4-нитробензил-(1S, 5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (105,5 мг) суспендировали в 2 мл ацетонитрила. К суспензии добавляли 2-йодацетамид (340 мг), и перемешивали смесь при 50°C в течение 6 часов. Реакционный раствор концентрировали при пониженном давлении, к концентрату добавляли 5 мл этилацетата и собирали нерастворимые вещества путем фильтрации с получением 157 мг йодида 4-нитробензил-(1S,5R,6S)-2-[7-(1-карбамоилметилпиридиний-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,20 (3H, д, J=6,3 Гц), 1,25 (3H, д, J=7,2 Гц), 3,47 (1H, дд, J1=6,0 Гц, J2=3,3 Гц), 3,75-3,85 (1H, м), 4,0-4,1 (1H, м), 4,38 (1H, дд, J1=10,2 Гц, J2=3,3 Гц), 5,42 (1H, д, J=13,8 Гц), 5,5-5,6 (3H, м), 7,7-7,8 (3H, м), 8,08 (1H, уш.с), 8,22 (2H, д, J=8,7 Гц), 8,3-8,4 (1H, м), 8,57 (1H, с), 8,69 (1H, с), 9,15-9,2 (1H, м), 9,55-9,6 (1H, м), 9,76 (1H, с)
b) (1S,5R, 6S)-2-[7-(1-Карбамоилметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль)
Указанное в заголовке соединение (31,5 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 145 мг йодид 4-нитробензил-(1S,5R, 6S)-2-[7-(1-карбамоилметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,80 м.д.): 1,16 (3H, д, J=7,5 Гц), 1,33 (3H, д, J=6,0 Гц), 3,4-3,55 (2H, м), 4,15-4,35 (2H, м), 5,65 (2H, с), 7,89 (1H, с), 8,03 (1H, с), 8,1-8,2 (1H, м), 8,85-8,95 (1H, м), 9,15-9,2 (1H, м), 9,58 (1H, с)
Соединения №№ 38, 42, 44, 52, 75, 76, 77, 78, 84, 108, 116, 120, 122, 128, 138, 139, 140, 145, 153, 166, 167 и 168 синтезировали способом, сходным с описанным в примере 2.
[Пример 3] (1S,5R,6S)-2-[7-(1-Бензилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 3)
a) Бромид 4-нитробензил-(1S,5R,6S)-2-[7-(1-бензилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата
Для приготовления суспензии 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (78,1 мг) суспендировали в 1,5 мл ацетонитрила. К суспензии добавляли бензилбромид (0,032 мл) и перемешивали смесь при комнатной температуре в течение 10 часов. Реакционный раствор концентрировали при пониженном давлении с получением бромида 4-нитробензил-(1S,5R,6S)-2-[7-(1-бензилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6 ) δ: 1,19 (3H, д, J=6,0 Гц), 1,24 (3H, д, J=6,9 Гц), 3,45-3,5 (1H, м), 3,75-3,9 (1H, м), 4,0-4,1 (1H, м), 4,35-4,4 (1H, м), 5,15-5,2 (1H, м), 5,41 (1H, д, J=13,8 Гц), 6,01 (2H, с), 7,25-7,65 (5H, м), 7,74 (2H, д, J=8,7 Гц), 8,21 (2H, д, J=8,7 Гц), 8,3-8,4 (1H, м), 8,54 (1H, с), 8,67 (1H, с), 9,3-9,4 (1H, м), 9,45-9,55 (1H, м), 9,98 (1H, с)
b) (1S,5R, 6S)-2-[7-(1-Бензилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль)
Указанное в заголовке соединение (5,6 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения целиком применяли бромид 4-нитробензил-(1S,5R, 6S)-2-[7-(1-бензилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата, полученный на описанной непосредственно выше стадии a).
ЯМР (D2O) δ (HOD=4,80 м.д.): 1,0-1,15 (3H, м), 1,30 (3H, д, J=6,0 Гц), 3,35-3,5 (2H, м), 4,1-4,3 (2H, м), 5,86 (2H, с), 7,4-7,6 (5H, м), 7,85-8,1 (3H, м), 8,8-9,0 (2H, м), 9,6-9,7 (1H, м)
[Пример 4] (1S,5R,6S)-2-[7-[1-(3-Аминопропил)пиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид) (соединение № 4)
a) Трифторметансульфонат 4-нитробензил-(1S,5R,6S)-2-[7-[1-(3-азидопропил)пиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата
Для приготовления раствора, который затем охлаждали до -60°C, в атмосфере аргона в 3 мл дихлорметана растворяли 60 мг 3-азидо-1-пропанола. К охлажденному раствору добавляли 2,6-лутидин (0,076 мл) и 0,015 мл трифторметансульфонового ангидрида и перемешивали смесь в течение 20 минут. К реакционной смеси добавляли воду и экстрагировали смесь дихлорметаном, затем промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и удаляли нерастворимые вещества путем фильтрации. К фильтрату добавляли 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (310 мг) и перемешивали смесь при комнатной температуре в течение 3 часов. Реакционный раствор по каплям добавляли к 30 мл диэтилового эфира и собирали полученный осадок путем фильтрации с получением 452 мг трифторметансульфоната 4-нитробензил-(1S,5R,6S)-2-[7-[1-(3-азидопропил)пиридиний-3-ил]карбонилимидазо-[5,1-b]-тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ацетон-d6) δ: 1,27 (3H, д, J=6,3 Гц), 1,34 (3H, д, J=7,3 Гц), 2,52 (2H, м), 3,47 (1H, дд, J1=6,4 Гц, J2=3,0 Гц), 3,67 (2H, т, J=7,0 Гц), 3,81 (1H, м), 4,18 (1H, м), 4,27 (1H, д, J=4,9 Гц), 4,47 (1H, дд, J1=10,0 Гц, J2=3,0 Гц), 5,11 (2H, т, J=7,0 Гц), 5,37 (1H, д, J=13,7 Гц), 5,57 (1H, д, J=13,7 Гц), 7,78 (2H, д, J=9,0 Гц), 8,18 (2H, д, J=9,0 Гц), 8,47 (1H, с), 8,59 (1H, с), 9,39 (1H, м), 9,64 (1H, м), 10,15 (1H, с)
b) (1S,5R,6S)-2-[7-[1-(3-Аминопропил)пиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид)
Реакцию осуществляли способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 450 мг трифторметансульфоната 4-нитробензил-(1S,5R,6S)-2-[7-[1-(3-азидопропил)пиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата. Продукт реакции подвергали колоночной хроматографии на Cosmosil 40C18-PREP (элюент - 10% водный раствор метанола). Фракцию, элюируемую раньше, собирали и подвергали ионобменной колоночной хроматографии (элюент - вода) на Amberlyst (A-26) с получением 38 мг указанного в заголовке соединения.
ЯМР (D2О) δ (HOD=4,65 м.д.): 1,09 (3H, д, J=7,1 Гц), 1,18 (3H, д, J=6,4 Гц), 2,46 (2H, м), 3,14 (2H, м), 3,32-3,41 (2H, м), 4,06 (1H, дд, J1=9,0 Гц, J2 =2,6 Гц), 4,13 (1H, м), 7,91 (1H, с), 8,08 (1H, с), 8,14 (1H, м), 8,98 (1H, м), 9,12 (1H, м), 9,67 (1H, с)
Соединения №№ 32, 62, 64, 70, 82, 86, 87, 90, 91, 99, 103, 121, 129, 130, 131, 135, 136, 137, 141, 142, 144, 146, 147, 149, 150, 151, 152, 154, 155, 156, 157, 158, 159, 161, 162, 163, 164, 170, 171, 174 и 175 синтезировали способом, сходным с описанным в примере 4.
[Пример 5] (1S,5R,6S)-2-[7-[1-(3-Аминопропил)-1,4,5,6-тетрагидропиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (соединение № 5)
При выполнении колоночной хроматографии на Cosmosil 40C18-PREP (элюент - 10% водный раствор метанола) на стадии b) примера 4, фракцию, элюируемую позже, собирали с получением 14 мг указанного в заголовке соединения.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,13 (3H, д, J=7,3 Гц), 1,21 (3H, д, J=6,3 Гц), 1,78 (2H, м), 1,95 (2H, м), 2,23 (2H, м), 2,95 (2H, м), 3,19 (2H, м), 3,34 (2H, м), 3,38-3,50 (2H, м), 4,13-4,21 (2H, м), 7,82 (1H, с), 7,97 (1H, с), 8,25 (1H, с)
[Пример 6] (1S,5R, 6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(1-метилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 6)
a) Трифторметансульфонат 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(1-метилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата
Для приготовления суспензии 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (240 мг) суспендировали в 10 мл дихлорметана. К суспензии добавляли метилтрифторметансульфонат (0,047 мл) и перемешивали смесь при комнатной температуре в течение 20 минут. Реакционный раствор концентрировали при пониженном давлении с получением 333 мг трифторметансульфоната 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(1-метилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,19 (3H, д, J=6,4 Гц), 1,25 (3H, д, J=7,1 Гц), 3,47 (1H, дд, J1=6,0 Гц, J2=3,0 Гц), 3,79 (1H, м), 4,06 (1H, м), 4,38 (1H, дд, J1=10 Гц, J2=2,9 Гц), 4,47 (3H, с), 5,17 (1H, д, J=5,1 Гц), 5,42 (1H, д, J=13,6 Гц), 5,55 (1H, д, J=13,6 Гц), 7,76 (2H, д, J=9,1 Гц), 8,22 (2H, д, J=9,1 Гц), 8,32 (1H, м), 8,56 (1H, с), 8,67 (1H, с), 9,16 (1H, м), 9,47 (1H, м), 9,78 (1H, с)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(1-метилпиридиний-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль)
Указанное в заголовке соединение (36 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 333 мг трифторметансульфоната 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(1-метилпиридиний-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,08 (3H, д, J=7,1 Гц), 1,20 (3H, д, J=6,3 Гц), 3,33-3,41 (2H, м), 4,08 (1H, дд, J1=9,3 Гц, J2=2,7 Гц), 4,14 (1H, м), 4,40 (3H, с), 7,87 (1H, с), 8,00 (1H, с), 8,03 (1H, с), 8,83 (1H, с), 9,02 (1H, с), 9,51 (1H, с)
Соединения №№ 39, 41, 51, 59, 112 и 127 синтезировали способом, сходным с описанным в примере 6.
[Пример 7] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(пиридин-4-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 7)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-4-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-4-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (1,23 г) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 1,33 г 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 2,00 г 7-(пиридин-4-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,34 (3H, д, J=7,2 Гц), 1,41 (3H, д, J=6,3 Гц), 3,41 (1H, дд, J1=6,6 Гц, J2=3,0 Гц), 3,5-3,6 (1H, м), 4,3-4,4 (1H, м), 4,40 (1H, дд, J1=9, 6 Гц, J2=3,0 Гц), 5,29 (1H, д, J=13,5 Гц), 5,54 (1H, д, J=13,5 Гц), 7,69 (2H, д, J=8,7 Гц), 8,09 (1H, с), 8,25 (2H, д, J=8,7 Гц), 8,3-8,35 (2H, м), 8,57 (1H, с), 8,8-8,85 (2H, м)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(пиридин-4-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (74, 4 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 290 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-4-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,80 м.д.): 1,16 (3H, д, J=6,3 Гц), 1,34 (3H, д, J=6,3 Гц), 3,4-3,6 (2H, м), 4,2 -4,35 (2H, м), 7,7-7,8 (2H, м), 7,96 (1H, с), 8,11 (1H, с), 8,5-8,6 (2H, м)
[Пример 8] (1S,5R, 6S)-2-[7-(1-Карбамоилметилпиридиний-4-ил)(гидрокси)метилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (смесь диастереомеров) (соединение № 8)
a) Йодид 4-нитробензил-(1S,5R,6S)-2-[7-(1-карбамоилметилпиридиний-4-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата
Йодид 4-нитробензил-(1S,5R,6S)-2-[7-(1-карбамоилметилпиридиний-4-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата (426 мг) получали способом, сходным с описанным на стадии a) примера 2, за исключением того, что в качестве исходного соединения применяли 327 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-4-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,20 (3H, д, J=6,3 Гц), 1,25 (3H д, J=7,5 Гц), 3,4-3,5 (1H, м), 3,7-3,9 (1H, м), 4,0-4,1 (1H, м), 4,35-4,4 (1H, м), 5,42 (1H, д, J=13,5 Гц), 5,50 (2H, с), 5,55 (1H, д, J=13,5 Гц), 7,7-7,8 (3H, м), 8,08 (1H, с), 8,22 (2H, д, J=9,0 Гц), 8,54 (1H, с), 8,68 (1H, с), 8,8-8,9 (2H, м), 9,1-9,2 (2H, м)
b) (1S,5R, 6S)-2-[7-(1-Карбамоилметилпиридиний-4-ил)(гидрокси)метилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (смесь диастереомеров)
Реакцию осуществляли способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 426 мг йодида 4-нитробензил-(1S,5R, 6S)-2-[7-(1-карбамоилметилпиридиний-4-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата. Продукт реакции подвергали колоночной хроматографии на Cosmosil 40C18-PREP (элюент - 5%-20% водный раствор метанола). Фракцию, элюируемую раньше, собирали с получением 67,6 мг указанного в заголовке соединения.
ЯМР (D2 O) δ (HOD=4,80 м.д.): 1,1-1,25 (3H, м), 1,29 (3H, д, J=6,3 Гц), 3,4-3,6 (2H, м), 4,2-4,3 (2H, м), 5,51 (2H, с), 6,28 (1H, с), 7,87 (1H, с), 8,09 (1H, с), 8,1-8,2 (2H, м), 8,75-8,85 (2H, м)
[Пример 9] (1S,5R,6S)-2-[7-(1-Карбамоилметилпиридиний-4-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 9)
При выполнении колоночной хроматографии на Cosmosil 40C18-PREP (элюент - 5%-20% водный раствор метанола) на стадии b) примера 8, фракцию, элюируемую позже, собирали с получением 29,1 мг указанного в заголовке соединения.
ЯМР (ДМСО-d6) δ: 1,1-1,25 (6H, м), 3,1-3,2 (1H, м), 3,45-3,6 (1H, м), 3,9-4,0 (1H, м), 4,05-4,15 (1H, м), 5,05 (1H, д, J=5,7 Гц), 5,5-5,7 (2H, м), 7,75 (1H, с), 8,33 (1H, с), 8,38 (1H, с), 8,41 (1H, с), 8,98 (2H, д, J=6,6 Гц), 9,26 (2H, д, J=6,6 Гц)
[Пример 10] (1S,5R, 6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(4-метилтиазол-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 10)
a) 4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(4-метилтиазол-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(4-метилтиазол-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (92 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 112 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 165 мг 7-(4-метилтиазол-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (ДМСО-d6) δ: 1,18 (3H, д, J=6,3 Гц), 1,23 (3H, д, J=7,3 Гц), 2,78 (3H, с), 3,43 (1H, дд, J1=6,1 Гц, J2=2,8 Гц), 3,76 (1H, м), 4,03 (1H, м), 4,35 (1H, дд, J1=10 Гц, J2=3,0 Гц), 5,15 (1H, д, J=5,1 Гц), 5,40 (1H, д, J=13,9 Гц), 5,53 (1H, д, J=13,9 Гц), 7,73 (2H, д, J=8,8 Гц), 8,21 (2H, д, J=8,8 Гц), 8,43 (1H, с), 8,60 (1H, с), 9,22 (1H, с)
b) (1S,5R, 6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(4-метилтиазол-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (21 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 57 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(4-метилтиазол-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,05 (3H, д, J=7,3 Гц), 1,22 (3H, д, J=6,3 Гц), 2,49 (3H, с), 3,36 (1H, м), 3,42 (1H, м), 4,13-4,22 (2H, м), 7,77 (1H, с), 7,88 (1H, с), 8,71 (1H, с)
[Пример 11] (1S,5R, 6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-((2S)-пирролидин-2-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 11)
a) 4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[(2S)-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]-карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[(2S)-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (1,40 г) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 926 мг 4-нитробензил-(1R,3R,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 1,85 г 7-[(2S)-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,25-1,35 (3H, м), 1,35-1,45 (3H, м), 1,85-2,5 (4H, м), 3,35-3,8 (4H, м), 4,25-4,5 (2H, м), 4,8-5,6 (5H, м), 7,2-8,3 (9H, м), 8,50 (1H, с)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-((2S)-пирролидин-2-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (169 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 451 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[(2S)-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат.
ЯМР (D2O) δ (HOD=4,80 м.д.): 1,24 (3H, д, J=6,9 Гц), 1,35 (3H, д, J=6,3 Гц), 2,5-2,2 (3H, м), 2,6-2,75 (1H, м), 3,4-3,65 (4H, м), 4,2-4,4 (2H, м), 5,05-5,2 (1H, м), 8,05 (1H, с), 8,17 (1H, с)
[Пример 12] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(пиримидин-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 12)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиримидин-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиримидин-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (144 мг) получали по существу тем же способом, что и описанный на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 180 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 176 мг 7-(пиримидин-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,34 (3H, д, J=7,3 Гц), 1,41 (3H, д, J=6,3 Гц), 3,41 (1H, дд, J1=6,4 Гц, J2=2,9 Гц), 3,56 (1H, м), 4,34 (1H, м), 4,43 (1H, дд, J1,=9,8 Гц, J2=2,9 Гц), 5,30 (1H, д, J=13,6 Гц), 5,53 (1H, д, J=13,6 Гц), 7,69 (2H, д, J=9,0 Гц), 8,10 (1H, д), 8,20 (2H, д, J=9,0 Гц), 8,58 (1H, с), 9,37 (1H, с), 9,81 (2H, с)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(пиримидин-5-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (6,9 мг) получали по существу тем же способом, что и описанный на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 57,4 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиримидин-5-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,11 (3H, д, J=5,9 Гц), 1,13 (3H, д, J=6,6 Гц), 3,24 (1H, м), 3,56 (1H, м), 3,92 (1H, м), 4,15 (1H, дд, J1=9,8 Гц, J2=2,9 Гц), 5,02 (1H, уш.с), 8,37 (1H, с), 8,44 (1H, с), 9,31 (1H, с), 9,56 (2H, с); МС (м/z) 440 (М+H)+
[Пример 13] (1S,5R, 6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(тиофен-2-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 13)
a) 4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(тиофен-2-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(тиофен-2-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (815 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 640 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 923 мг 7-(тиофен-2-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (ДМСО-d6) δ: 1,18 (3H, д, J=6,3 Гц), 1,23 (3H, д, J=7,3 Гц), 3,43 (1H, дд, J1=6,1 Гц, J2=3 Гц), 3,75 (1H, м), 4,03 (1H, м), 4,35 (1H, дд, J1=10 Гц, J2=2,9 Гц), 5,13 (1H, д, J=5,1 Гц), 5,40 (1H, д, J=13,9 Гц), 5,53 (1H, д, J=13,9 Гц), 7,28 (1H, м), 7, 77 (2H, д, J=8,8 Гц), 8,00 (1H, м), 8,21 (2H, д, J=8,8 Гц), 8,44 (1H, с), 8,60 (1H, м)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(тиофен-2-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (95 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 170 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(тиофен-2-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,01 (3H, д, J=7,3 Гц), 1,21 (3H, д, J=6,3 Гц), 3,27-3,36 (2H, м), 4,06-4,18 (2H, м), 6,93 (1H, м), 7,60 (1H, м), 7,68 (1H, с), 7,74 (1H, с), 7, 87 (1H, м)
[Пример 14] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-2-[7-[5-(гидроксиметил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 14)
a) 4-Нитробензил-(1S,5R,6S)-2-[7-[5-(трет-бутилдиметилсилилоксиметил)пиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-2-[7-[5-(трет-бутилдиметилсилилоксиметил)пиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (707 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 509 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 926 мг 7-[5-(трет-бутилдиметилсилилоксиметил)пиридин-3-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 0,01 (6H, с), 0,81 (9H, с), 1,19 (3H, д, J=7,3 Гц), 1,27 (3H, д, J=6,1 Гц), 3,26 (1H, дд, J1=6,6 Гц, J2=2,9 Гц), 3,42 (1H, м), 4,19 (1H, м), 4,29 (1H, дд, J1=9,7 Гц, J2=2,9 Гц), 4,73 (2H, с), 5,15 (1H, д, J=13,6 Гц), 5,39 (1H, д, J=13,6 Гц), 7,55 (2H, д, J=8,8 Гц), 7,94 (1H, с), 8,11 (2H, д, J=8,8 Гц), 8,43 (1H, с), 8,61 (1H, м), 8,66 (1H, м), 9,49 (1H, м)
b) 4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-2-[7-[5-(гидроксиметил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилат
К раствору 563 мг 4-нитробензил-(1S,5R, 6S)-2-[7-[5-(трет-бутилдиметилсилилоксиметил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата в 8 мл ТГФ при охлаждении на льду добавляли 0,092 мл уксусной кислоты и 0,799 мл 1 M раствора тетра-н-бутиламмонийфторида в ТГФ, и перемешивали смесь в течение 6 часов. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом, затем промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и удаляли растворитель путем перегонки. Остаток очищали методом колоночной хроматографии (элюент - дихлорметан:метанол=1:1) на Sephadex LH-20 с получением 435 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-2-[7-[5-(гидроксиметил)пиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,18 (3H, д, J=6,3 Гц), 1,23 (3H, д, J=7,1 Гц), 3,45 (1H, м), 3,77 (1H, м), 4,03 (1H, м), 4, 36 (1H, м), 4,64 (2H, д, J=5,9 Гц), 5,15 (1H, д, J=5,1 Гц), 5,40 (1H, д, J=13,9 Гц), 5,46 (1H, т, J=5,9 Гц), 5,54 (1H, д, J=13,9 Гц), 7,73 (2H, д, J=8,8 Гц), 8,21 (2H, д, J=8,8 Гц), 8,47 (1H, с), 8,63 (1H, с), 8,66 (1H, м), 8,71 (1H, м), 9,47 (1H, м)
c) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-2-[1-[5-(гидроксиметил)пиридин-3-ил]карбонилимидазо[5, 1-b]-тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (15 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 48 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-2-[7-[5-(гидроксиметил)пиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,06 (3H, д, J=7,0 Гц), 1,20 (3H, д, J=6,3 Гц), 3,38 (1H, м), 3,47 (1H, м), 4, 13-4,21 (2H, м), 7,86 (1H, с), 8,03 (1H, с), 8,17 (1H, с), 8,42 (1H, с), 8,78 (1H, с)
[Пример 15] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(6-метилпиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 15)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(6-метилпиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(6-метилпиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (499 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 398 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 923 мг 7-(6-метилпиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (ДМСО-d6) δ: 1,18 (3H, д, J=6,4 Гц), 1,23 (3H, д, J=7,3 Гц), 2,57 (3H, с), 3,44 (1H, дд, J1=6,0 Гц, J2=2,9 Гц), 3,76 (1H, м), 4,03 (1H, м), 4,35 (1H, дд, J1=10 Гц, J2=2,7 Гц), 5,15 (1H, д, J=5,2 Гц), 5,40 (1H, д, J=13,7 Гц), 5,53 (1H, д, J=13,7 Гц), 7,44 (1H, м), 7,73 (2H, д, J=8,8 Гц), 8,20 (2H, д, J=8,8 Гц), 8,45 (1H, с), 8,61 (1H, с), 8,63 (1H, м), 9,48 (1H, м)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(6-метилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (23 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 75 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(6-метилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,04 (3H, д, J=7,1 Гц), 1,21 (3H, д, J=6,1 Гц), 2,37 (3H, с), 3,37 (1H, м), 3,45 (1H, м), 4,14-4,21 (2H, м), 7,13 (1H, м), 7,82 (1H, с), 8,00 (1H, с), 8,08 (1H, м), 8,68 (1H, с)
[Пример 16] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(5-метилтиопиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 16)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-метилтиопиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-метилтиопиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (100 мг) получали по существу тем же способом, что и описанный на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 169 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 179 мг 7-(5-метилтиопиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол.
ЯМР (CDCl3) δ: 1,15 (3H, д, J=7,3 Гц), 1,22 (3H, д, J=7,1 Гц), 2,60 (3H, с), 3,44 (1H, м), 3,76 (1H, м), 4,01 (1H, м), 4,35 (1H, дд, J1=6,9 Гц, J2=3,2 Гц), 5,15 (1H, д, J=5,2 Гц), 5,40 (1H, д, J=13,7 Гц), 5,52 (1H, д, J=13,7 Гц), 7,72 (2H, д, J=9,0 Гц), 8,20 (2H, д, J=9,0 Гц), 8,30 (1H, с), 8,47 (1H, с), 8,57 (1H, с), 8,68 (1H, с), 9,30 (1H, с)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(5-метилтиопиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (11,6 мг) получали по существу тем же способом, что и описанный на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 93 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-метилтиопиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат.
ЯМР (ДМСО-d6) δ: 1,15 (3H, д, J=7,1 Гц), 1,18 (3H, д, J=6,3 Гц), 2,60 (3H, с), 3,15 (1H, м), 3,44 (1H, м), 3,95 (1H, м), 4,07 (1H, дд, J1=6,7 Гц, J2=2,7 Гц), 5,01 (1H, д, J=5,4 Гц), 8,29 (1H, с), 8,32 (1H, с), 8,56 (1H, с), 8,65 (1H, с), 9,28 (1H, с); МС (м/z) 507 (М+Na+H)+
[Пример 17] (1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(хинолин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 17)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(хинолин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(хинолин-3-ил)карбонилимидазо[5,1-b]-тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (86 мг) получали по существу тем же способом, что и описанный на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 180 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 185 мг 7-(хинолин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,12 (3H, д, J=6,3 Гц), 1,19 (3H, д, J=7,1 Гц), 3,41 (1H, дд, J1=6,6 Гц, J2=2,9 Гц), 3,58 (1H, м), 4,35 (1H, м), 4,43 (1H, дд, J1=9,6 Гц, J2=3,0 Гц), 5,30 (1H, д, J=13,6 Гц), 5,54 (1H, д, J=13,6 Гц), 7,63 (1H, т, J=7,1 Гц), 7,70 (2H, д, J=9,0 Гц), 7,83 (1H, т, J=7,2 Гц), 8,04 (1H, д, J=7,3 Гц), 8,14 (1H, с), 8,18 (1H, д, J=8,3 Гц), 8,24 (2H, д, J=8,9 Гц), 8,61 (1H, с), 9,63 (1H, с), 9,84 (1H, с)
b) (1S,5R, 6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(хинолин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (6,5 мг) получали по существу тем же способом, что и описанный на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 84 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(хинолин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,09 (3H, д, J=7,3 Гц), 1, 11 (3H, д, J=6,4 Гц), 3,14 (1H, м), 3,47 (1H, м), 3,95 (1H, м), 4,09 (1H, дд, J1=9,8 Гц, J2=2,9 Гц), 5,02 (1H, уш.с), 7,71 (1H, т, J=6,8 Гц), 7,90 (1H, т, J=8,5 Гц), 8,11 (1H, д, J=9,0 Гц), 8,21 (1H, д, J=7,8 Гц), 8,31 (1H, с), 8,37 (1H, с), 9,47 (1H, с), 9,73 (1H, с); МС (м/z) 511 (М+Na+H)+
[Пример 18] (1S,5R, 6S)-2-[7-(1-Карбамоилметил-6-метилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 18)
a) Йодид 4-Нитробензил-(1S,5R,6S)-2-[7-(1-карбамоилметил-6-метилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата
Неочищенный продукт (119 мг) йодида 4-нитробензил-(1S,5R,6S)-2-[7-(1-карбамоилметил-6-метилпиридиний-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата получали способом, сходным с описанным на стадии a) примера 2, за исключением того, что в качестве исходных соединений применяли 112 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(6-метилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата и 495 мг 2-йодацетамида.
b) (1S,5R,6S)-2-[7-(1-Карбамоилметил-6-метилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль)
Указанное в заголовке соединение (23 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 119 мг неочищенного продукта йодида 4-нитробензил-(1S,5R,6S)-2-[7-(1-карбамоилметил-6-метилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,04 (3H, д, J=7,1 Гц), 1,21 (3H, д, J=6,1 Гц), 2,68 (3H, с), 3,23-3,35 (2H, м), 4,03 (1H, м), 4,13 (1H, м), 5,47 (2H, с), 7,69 (1H, с), 7,80-7,84 (2H, м), 8,84 (1H, м), 9,34 (1H, с)
[Пример 19] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-([3,3']бипиридинил-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 19)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-([3,3']бипиридинил-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
7-([3,3']Бипиридинил-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол синтезировали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 263 мг 7-([3,3']бипиридинил-5-ил)карбонилимидазо[5,1-b]тиазола, 0,316 мл три-н-бутилстаннилхлорида и 1,72 мл 1,0 н раствора бис(триметилсилил)амида лития в ТГФ, и, вследствие нестабильного характера соединений олова, очистку методом колоночной хроматографии на силикагеле не проводили. 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-([3, 3']бипиридинил-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (80 мг) получали по существу тем же способом, что и описанный на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 270 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 7-([3, 3']бипиридинил-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазол.
ЯМР (CDCl3) δ: 1,33 (3H, д, J=7,3 Гц), 1,37 (3H, д, J=6,3 Гц), 3,37 (1H, м), 3,64 (1H, м), 4, 24 (1H, м), 4,41 (1H, дд, J1=9,6 Гц, J2=3,0 Гц), 5,32 (1H, д, J=13,6 Гц), 5,53 (1H, д, J=13,4 Гц), 7,52 (1H, м), 7,69 (2H, т, J=8,7 Гц), 8,06 (1H, м), 8,15 (1H, с), 8,24 (2H, д, J=8,7 Гц), 8,67 (1H, м), 8,92 (1H, с), 8,99 (1H, с), 9,07 (1H, с), 9,71 (1H, с)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-([3,3']бипиридинил-5-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (16,7 мг) получали по существу тем же способом, что и описанный на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 47 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-([3,3']бипиридинил-5-ил)карбонилимидазо-[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат.
ЯМР (ДМСО-d6) δ: 1,18 (6H, д, J=7,3 Гц), 3,23 (1H, м), 3,57 (1H, м), 3,97 (1H, м), 4,15 (1H, м), 5,06 (1H, д, J=5,4 Гц), 7,46-7,57 (3H, м), 7,79 (1H, уш.с), 7,82 (1H, уш.с), 8,40 (1H, уш.с), 8,95 (1H, уш.с), 9,08 (1H, уш.с), 9,49 (1H, уш.с); МС (м/z) 538 (М+Na+H)+
[Пример 20] (1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 20)
a) 4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (47 мг) получали по существу тем же способом, что и описанный на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 270 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 293 мг 7-(5-фенилпиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,33 (3H, д, J=7,3 Гц), 1,37 (3H, д, J=6,1 Гц), 3,38 (1H, м), 3,57 (1H, м), 4,23 (1H, м), 4,41 (1H, дд, J1=9,6 Гц, J2=2,9 Гц), 5,34 (1H, д, J=13,6 Гц), 5,53 (1H, д, J=13,4 Гц), 7,45-7,55 (3H, м), 7,68-7,73 (4H, м), 8,15 (1H, с), 8,24 (2H, д, J=9,2 Гц), 8,55 (1H, с), 8,97-9,02 (2H, м), 9,65 (1H, с)
b) (1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (29,7 мг) получали по существу тем же способом, что и описанный на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 80 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-д6) δ: 1,16 (3H, д, J=6,8 Гц), 1,19 (3H, д, J=6,4 Гц), 3,14 (1H, дд, J1=6,8 Гц, J2=2,8 Гц), 3,45 (1H, м), 3,96 (1H, м), 4,15 (1H, дд, J1=9,4 Гц, J2=2,4 Гц), 5,02 (1H, д, J=5,2 Гц), 7,46-7,58 (3H, м), 7,79-7,83 (2H, м), 8,31 (1H, с), 8,34 (1H, с), 8,94 (1H, уш.с), 9,07 (1H, д, J=2,0 Гц), 9,48 (1H, д, J=2,0 Гц); МС (м/z) 537 (М+Na+H)+
[Пример 21] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(тиазол-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 21)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(тиазол-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(тиазол-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (244 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 179 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 260 мг 7-(тиазол-5-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (ДМСО-d6) δ: 1,18 (3H, д, J=6,3 Гц), 1,23 (3H, д, J=7,3 Гц), 3,43 (1H, дд, J1=6,0 Гц, J2=3,0 Гц), 3,76 (1H, м), 4,03 (1H, м), 4,35 (1H, дд, J1=10 Гц, J2=2,9 Гц), 5,15 (1H, д, J=5,1 Гц), 5,39 (1H, д, J=13,6 Гц), 5,53 (1H, д, J=13,6 Гц), 7,73 (2H, д, J=8,8 Гц), 8,20 (2H, д, J=8,8 Гц), 8,48 (1H, с), 8,62 (1H, с), 9,12 (1H, с), 9,40 (1H, с)
b) (1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(тиазол-5-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (47 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 114 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(тиазол-5-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,06 (3H, д, J=7,3 Гц), 1,22 (3H, д, J=6,3 Гц), 3,37 (1H, дд, J1=6,1 Гц, J2=2,9 Гц), 3,43 (1H, м), 4,14-4,22 (2H, м), 7, 77 (1H, с), 7,90 (1H, с), 8,45 (1H, c), 8,98 (1H, с)
[Пример 22] (1S,5R,6S)-2-[7-(1,6-Диметилпиридиний-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 22)
a) Трифторметансульфонат 4-нитробензил-(1S,5R,6S)-2-[7-(1, 6-диметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
Для приготовления раствора 92 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(6-метилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата растворяли при охлаждении на льду в 4 мл дихлорметана и добавляли к раствору 0,018 мл метилтрифторметансульфоната. Смесь перемешивали при данной температуре в течение 30 минут. Затем реакционный раствор концентрировали при пониженном давлении с получением 110 мг трифторметансульфоната 4-нитробензил-(1S,5R,6S)-2-[7-(1,6-диметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,18 (3H, д, J=6,3 Гц), 1,23 (3H, д, J=7,1 Гц), 2,86 (3H, с), 3,45 (1H, м), 3,77 (1H, м), 4,03 (1H, м), 4,34 (3H, с), 4,38 (1H, м), 5,15 (1H, д, J=5,1 Гц), 5,40 (1H, д, J=13,6 Гц), 5,53 (1H, д, J=13,6 Гц), 7,73 (2H, д, J=8,8 Гц), 8,20 (2H, д, J=8,8 Гц), 8,54 (1H, с), 8,65 (1H, с), 9,33 (1H, м), 9,76 (1H, м)
b) (1S,5R,6S)-2-[7-(1, 6-Диметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль)
Указанное в заголовке соединение (16 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 110 мг трифторметансульфоната 4-нитробензил-(1S,5R,6S)-2-[7-(1, 6-диметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2О) δ (HOD=4,65 м.д.): 1,08 (3H, д, J=7,3 Гц), 1,20 (3H, д, J=6,1 Гц), 2,73 (3H, с), 3,30-3,40 (2H, м), 4,07-4,18 (2H, м), 4,22 (3H, с), 7,78 (1H, с), 7,80 (1H, с), 7,88 (1H, с), 8,77 (1H, м), 9,40 (1H, м)
[Пример 23] (1S,5R,6S)-6-((1R)-1-гидроксиэтил)-2-[7-((2S,4R)-4-гидроксипирролидин-2-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилат (соединение № 23)
a) 4-Нитробензил-(1S,5R,6S)-2-[7-[(2S,4R)-4-трет-бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-2-[7-[(2S, 4R)-4-трет-бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (369 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 312 мг 4-нитробензил-(1R,3R,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 707 мг 7-[(2S, 4R)-4-трет-бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 0,07, 0,08 (всего 6H, с каждый), 0,88, 0,89 (всего 9H, с каждый), 1,25-1,35 (3H, м), 1,35-1,45 (3H, м), 2,1-2,2 (1H, м), 2,35-2,45 (1H, м), 3,35-3,6 (3H, м), 3,8-3,9 (1H, м), 4,25-4,6 (3H, м), 4,8-5,6 (5H, м), 7,2-8,3 (9H, м), 8,48, 8,50 (всего 1H, с каждый)
b) 4-Нитробензил-(1S,5R,6S)-2-[7-[(2S,4R)-4-гидрокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо-[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
К раствору 369 мг 4-нитробензил-(1S,5R,6S)-2-[7-[(2S, 4R)-4-трет-бутилдиметилсилилокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата в 10 мл ТГФ добавляли уксусную кислоту (0,219 мл) и 1,27 мл 1 M раствора тетра-н-бутиламмонийфторида в ТГФ, и перемешивали смесь при комнатной температуре в течение 7 часов. К реакционной смеси добавляли насыщенный солевой раствор. Смесь доводили до значения pH=8,2 добавлением насыщенного раствора гидрокарбоната натрия и затем дважды экстрагировали этилацетатом. Органические слои объединяли и промывали насыщенным солевым раствором, и сушили над безводным сульфатом магния. Растворитель удаляли путем перегонки при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент - дихлорметан:метанол=10:1) с получением 239 мг 4-нитробензил-(1S,5R,6S)-2-[7-[(2S,4R)-4-гидрокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (CDCl3) δ: 1,25-1,35 (3H, м), 1,35-1,45 (3H, м), 2,15-2,25 (1H, м), 2,45-2,55 (1H, м), 3,35-3,9 (4H, м), 4,3-4,65 (3H, м), 4,8-5,6 (5H, м), 7,2-8,3 (9H, м), 8,47, 8,50 (всего 1H, с каждый)
c) (1S,5R,6S)-6-((1R)-1-гидроксиэтил)-2-[7-((2S, 4R)-4-гидроксипирролидин-2-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилат
Указанное в заголовке соединение (76,3 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 239 мг 4-нитробензил-(1S,5R,6S)-2-[7-[(2S, 4R)-4-гидрокси-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2О) δ (HOD=4,80 м.д.): 1,24 (3H, д, J=6,9 Гц), 1,32 (3H, д, J=6,3 Гц), 2,1-2,25 (1H, м), 2,65-2,75 (1H, м), 3,4-3,6 (4H, м), 4,2-4,35 (2H, м), 4,7-4,8 (1H, м), 5,2-5,3 (1H, м), 8,00 (1H, с), 8,08 (1H, с)
[Пример 24] (1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(1-метилхинолиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 24)
Для приготовления раствора 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(хинолин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (93 мг) растворяли в смеси ацетонитрила (2,25 мл) и хлороформа (0,75 мл). К раствору при комнатной температуре добавляли метилйодид (0,063 мл) и перемешивали смесь при 40°C в течение 3 суток. Реакционный раствор вливали в диэтиловый эфир с получением порошка, который фильтровали с получением N-кватернизованного соединения. Указанное в заголовке соединение (7,7 мг) получали по существу тем же способом, что и описанный на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли данное соединение.
ЯМР (ДМСО-d6) δ: 1,16 (3H, д, J=8,3 Гц), 1,18 (3H, д, J=6,4 Гц), 3,13 (1H, м), 3,49 (1H, м), 3,94 (1H, м), 4,09 (1H, дд, J1=9,6 Гц, J2=3,0 Гц), 4,75 (3H, с), 5,02 (1H, д, J=5,2 Гц), 8,13 (1H, т, J=7,6 Гц), 8,31 (1H, с), 8,39 (1H, м), 8,45 (1H, с), 8,58 (1H, д, J=9,0 Гц), 8,71 (1H, д, J=7,6 Гц), 10,15-10,28 (2H, м); МС (м/z) 503 (М+H)+
[Пример 25] (1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-(морфолин-4-ил)метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 25)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-(морфолин-4-ил)метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
7-[5-(Морфолин-4-ил)метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол (312 мг) получали по существу тем же способом, что и описанный на стадии b) примера синтеза 1, за исключением того, что в качестве исходных соединений применяли 384 мг 7-(гидрокси)[5-(морфолин-4-ил)метилпиридин-3-ил]метилимидазо[5,1-b]тиазола и 200 мг диоксида марганца. Соответствующее соединение олова синтезировали по существу тем же способом, что и описанный на стадии c) примера синтеза 1, за исключением того, что в качестве исходных материалов применяли 407 мг данного соединения, 0,450 мл три-н-бутилстаннилхлорида и 2,46 мл 1,0 н раствор бис(триметилсилил)амида лития в ТГФ, и, вследствие нестабильного характера соединений олова, очистку методом колоночной хроматографии на силикагеле не проводили. 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-(морфолин-4-ил)метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (250 мг) получали по существу тем же способом, что и описанный на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 400 мг 4-нитробензил-(1R,3R,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и соединение олова.
ЯМР (CDCl3) δ: 1,33 (3H, д, J=7,3 Гц), 1,41 (3H, д, J=6,1 Гц), 2,50 (4H, уш.с), 3,40 (1H, дд, J=6,6 Гц, 2,9 Гц), 3,56 (1H, м), 3,63 (2H, с), 3,72 (4H, т, J=4,6 Гц), 4,33 (1H, м), 4,43 (1H, дд, J1=9,6 Гц, J2=3,0 Гц), 5,29 (1H, д, J=13,6 Гц), 5,53 (1H, д, J=13,4 Гц), 7,69 (2H, д, J=9,0 Гц), 8,09 (1H, с), 8,24 (2H, д, J=8,8 Гц), 8,71 (1H, уш.с), 8,73 (1H, уш.с), 9,65 (1H, уш.с)
b) (1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-(морфолин-4-ил)метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (40,4 мг) получали по существу тем же способом, что и описанный на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 101 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-(морфолин-4-ил)метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,15 (3H, д, J=6,8 Гц), 1,18 (3H, д, J=6,3 Гц), 2,40 (4H, уш.с), 3,14 (1H, дд, J1=7,1 Гц, J2=2,7 Гц), 3,43 (1H, м), 3,52 (4H, т, J=4,6 Гц), 3,54 (2H, с), 3,94 (1H, м), 4,08 (1H, дд, J1=9,3 Гц, J2=2,7 Гц), 5,02 (1H, д, J=5,1 Гц), 8,30 (1H, с), 8,33 (1H, с), 8,58 (1H, с), 8,67 (1H, с), 9,48 (1H, с); МС (м/z) 560 (М+Na+H)+
[Пример 26] (1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(1-метил-5-фенилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 26)
N-Кватернизованное соединение (84 мг) получали по существу тем же способом, что и описанный в примере 24, за исключением того, что в качестве исходных соединений применяли 97 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата и 0,063 мл метилйодида. Указанное в заголовке соединение (20,3 мг) получали по существу тем же способом, что и описанный на стадии c) примера 1, за исключением того, что в качестве исходного соединения применяли данное соединение.
ЯМР (ДМСО-d6) δ: 1,15 (3H, д, J=7,1 Гц), 1,18 (3H, д, J=6,3 Гц), 3,13 (1H, м), 3,43 (1H, м), 3,94 (1H, м), 4,07 (1H, м), 4,46 (3H, с), 5,03 (1H, д, J=5,1 Гц), 7,59-7,68 (3H, м), 7,94 (2H, д, J=8,0 Гц), 8,29 (1H, уш.с), 8,40 (1H, уш.с), 9,57 (1H, уш.с), 9,70 (2H, уш.с); МС (м/z) 529 (М+H)+
[Пример 27] (1S,5R, 6S)-2-[7-(1-Карбамоилметил-5-фенилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 27)
N-Кватернизованное соединение (91 мг) получали по существу тем же способом, что и описанный в примере 24, за исключением того, что в качестве исходных соединений применяли 97 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-фенилпиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата и 185 мг 2-йодацетамида. Указанное в заголовке соединение (16,7 мг) получали по существу тем же способом, что и описанный на стадии c) примера 1, за исключением того, что в качестве исходного соединения применяли данное соединение.
ЯМР (ДМСО-d6) δ: 1,15 (3H, д, J=7,6 Гц), 1,19 (3H, д, J=6,2 Гц), 3,14 (1H, дд, J1=7,2 Гц, J2=2,4 Гц), 3,37 (1H, м), 3,94 (1H, м), 4,09 (1H, дд, J1=8, 6 Гц, J2=2,7 Гц), 5,02 (1H, д, J=5,2 Гц), 5,58 (2H, с), 7,62-7,69 (3H, м), 7,92 (2H, д, J=7,6 Гц), 8,31 (1H, с), 8,40 (1H, с), 9,57 (1H, уш.с), 9,69 (1H, уш.с), 9,82 (1H, уш.с); МС (м/z) 572 (М+H)+
[Пример 28] (1S,5R,6S)-2-[7-[5-(2-аминоэтилтио)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 28)
a) 4-Нитробензил-(1S,5R,6S)-2-[7-[5-(2-азидоэтилтио)пиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-2-[7-[5-(2-азидоэтилтио)пиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (370 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 485 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 857 мг 7-[5-(2-азидоэтилтио)пиридин-3-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,34 (3H, д, J=7,3 Гц), 1,42 (3H, д, J=6,4 Гц), 3,19 (2H, т, J=7,0 Гц), 3,41 (1H, дд, J1=6,0 Гц, J2=3,0 Гц), 3,52-3,60 (3H, м), 4,33 (1H, м), 4,43 (1H, дд, J1=9,7 Гц, J2=2,9 Гц), 5,30 (1H, д, J=13,6 Гц), 5,54 (1H, д, J=13,6 Гц), 7,69 (2H, д, J=8,8 Гц), 8,09 (1H, с), 8,25 (2H, д, J=8,8 Гц), 8,56 (1H, с), 8,78 (1H, м), 8,90 (1H, м), 9,56 (1H, м)
b) (1S,5R, 6S)-2-[7-[5-(2-аминоэтилтио)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (40 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 128 мг 4-нитробензил-(1S,5R, 6S)-2-[7-[5-(2-азидоэтилтио)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,01 (3H, д, J=7,0 Гц), 1,19 (3H, д, J=6,4 Гц), 3,18 (4H, м), 3,30-3,37 (2H, м), 4,06-4,16 (2H, м), 7,67 (1H, с), 7,80 (1H, с), 8,04 (1H, с), 8,21 (1H, с), 8,50 (1H, с)
[Пример 29] (1S,5R,6S)-2-[7-((2S,4S)-4-Аминопирролидин-2-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (соединение № 29)
a) 4-Нитробензил-(1S,5R,6S)-2-[7-[(2S,4S)-4-азидо-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
Неочищенное соединение (261 мг) 4-нитробензил-(1S,5R,6S)-2-[7-[(2S,4S)-4-азидо-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата получали способом, сходным с описанным в примере, за исключением того, что в качестве исходных соединений применяли 157 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 321 мг 7-[(2S, 4S)-4-азидо-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
b) (1S,5R,6S)-2-[7-((2S,4S)-4-Аминопирролидин-2-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
Указанное в заголовке соединение (23 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 130 мг неочищенного соединения 4-нитробензил-(1S,5R,6S)-2-[7-[(2S, 4S)-4-азидо-1-(4-нитробензилоксикарбонил)пирролидин-2-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,11 (3H, д, J=7,1 Гц), 1,21 (3H, д, J=6,4 Гц), 2,13 (1H, м), 2,97 (1H, м), 3,31 (1H, м), 3,40 (2H, м), 3,60 (1H, м), 4,07 (1H, м), 4,17 (2H, м), 4,92 (1H, м), 7,89 (1H, с), 8,06 (1H, с)
[Пример 30] (1S,5R,6S)-2-[7-[5-(2-аминоэтансульфонил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 30)
a) 4-Нитробензил-(1S,5R,6S)-2-[7-[5-(2-азидоэтансульфонил)пиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
К 5 мл раствора 112 мг 4-нитробензил-(1S,5R,6S)-2-[7-[5-(2-азидоэтилтио)пиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата в дихлорметане при охлаждении на льду добавляли 123 мг мета-хлорпербензойной кислоты и перемешивали смесь в течение 4 часов. К реакционной смеси добавляли водный раствор тиосульфата натрия и экстрагировали смесь дихлорметаном, затем промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и удаляли растворитель путем перегонки. Остаток очищали методом колоночной хроматографии (элюент - дихлорметан:метанол=1:1) на Sephadex LH-20 с получением 70 мг 4-нитробензил-(1S,5R, 6S)-2-[7-[5-(2-азидоэтансульфонил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (CDCl3) δ: 1,33 (3H, д, J=7,3 Гц), 1,38 (3H, д, J=6,3 Гц), 3,56 (2H, т, J=5,5 Гц), 3,59 (1H, м), 3,81-3,89 (3H, м), 4,23 (1H, м), 4,42 (1H, дд, J1=9,7 Гц, J2=2,9 Гц), 5,32 (1H, д, J=13,6 Гц), 5, 53 (1H, д, J=13,6 Гц), 7,69 (2H, д, J=9,0), 8,14 (1H, с), 8,24 (2H, д, J=9,0 Гц), 8,52 (1H, с), 9,27 (1H, м), 9,44 (1H, м), 9,92 (1H, м)
b) (1S,5R, 6S)-2-[7-[5-(2-аминоэтансульфонил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (10 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 69 мг 4-нитробензил-(1S,5R, 6S)-2-[7-[5-(2-азидоэтансульфонил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4, 65 м.д.): 1,10 (3H, д, J=7,3 Гц), 1,21 (3H, д, J=6,3 Гц), 3,38-3,50 (4H, м), 3,83 (2H, т, J=7,0 Гц), 4,13-4,22 (2H, м), 7,88 (1H, с), 8,03 (1H, с), 8,83 (1H, м), 9,04 (1H, м), 9,26 (1H, м)
[Пример 31] (1S,5R,6S)-2-[7-[5-(2-Аминоэтилтио)-1-карбамоилметилпиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид) (соединение № 31)
a) Йодид 4-нитробензил-(1S,5R,6S)-2-[7-[5-(2-азидоэтилтио)-1-карбамоилметилпиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата
Йодид 4-нитробензил-(1S,5R,6S)-2-[7-[5-(2-азидоэтилтио)-1-карбамоилметилпиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата (140 мг) получали способом, сходным с описанным на стадии a) примера 2, за исключением того, что в качестве исходных соединений применяли 114 мг 4-нитробензил-(1S,5R,6S)-2-[7-[5-(2-азидоэтилтио)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата и 312 мг 2-йодацетамида.
ЯМР (ДМСО-d6) δ: 1,19 (3H, д, J=6,1 Гц), 1,24 (3H, д, J=7,3 Гц), 3,46 (1H, дд, J1=6,0 Гц, J2=2,9 Гц), 3,51 (2H, т, J=6,4 Гц), 3, 73 (2H, т, J=6,4 Гц), 3,78 (1H, м), 4,04 (1H, м), 4,37 (1H, дд, J1=10,0 Гц, J2=2,9 Гц), 5,16 (1H, д, J=5,1 Гц), 5,41 (1H, д, J=13,6 Гц), 5,48 (2H, с), 5,54 (1H, д, J=13,6 Гц), 7, 71-7,77 (3H, м), 8,04 (1H, уш.с), 8,21 (2H, д, J=8,8 Гц), 8,55 (1H, с), 8,68 (1H, с), 9,21 (1H, м), 9,46 (1H, м), 9,51 (1H, м)
b) (1S,5R, 6S)-2-[7-[5-(2-Аминоэтилтио)-1-карбамоилметилпиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид)
Указанное в заголовке соединение (13 мг) получали способом, сходным с описанным на стадии b) примера 4, за исключением того, что в качестве исходного соединения применяли 140 мг йодида 4-нитробензил-(1S,5R,6S)-2-[7-[5-(2-азидоэтилтио)-1-карбамоилметилпиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,08 (3H, д, J=7,1 Гц), 1,19 (3H, д, J=6,1 Гц), 3,29 (2H, д, J=6,5 Гц), 3,33-3,55 (4H, м), 4,05 (1H, м), 4,13 (1H, м), 5,49 (2H, с), 7,86 (1H, с), 7,97 (1H, с), 8,84 (1H, с), 9,11 (1H, с), 9,30 (1H, с)
[Пример 32] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-2-[7-(изохинолин-4-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 34)
4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-2-[7-(изохинолин-4-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилат синтезировали по существу тем же способом, что и описанный в примере 1, за исключением того, что в качестве исходных соединений применяли 324 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 358 мг 7-(изохинолин-4-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола. Указанное в заголовке соединение (22,3 мг) синтезировали из 72,8 мг данного соединения.
ЯМР (ДМСО-d6) δ: 1,09 (3H, д, J=7,0 Гц), 1,12 (3H, д, J=6,1 Гц), 3,07 (1H, дд, J1=6,8 Гц, J2=2,7 Гц), 3,36 (1H, м), 3,87 (1H, м), 4,01 (1H, дд, J1=9,3 Гц, J2=2,4 Гц), 4,95 (1H, д, J=5,1 Гц), 7,68 (1H, т, J=7,8 Гц), 7,76 (1H, м), 8,16-8,19 (3H, м), 8,21 (1H, с), 8,96 (1H, с), 9,39 (1H, с)
[Пример 33] (1S,5R,6S)-2-[7-(1-карбамоилметилдигидроизохинолин-4-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 35)
Указанное в заголовке соединение (19,9 мг) синтезировали по существу тем же способом, что и описанный в примере 2, за исключением того, что в качестве исходного соединения применяли 93,0 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-2-[7-(изохинолин-4-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,07 (3H, д, J=7,1 Гц), 1,11 (3H, д, J=6,1 Гц), 3,07 (1H, м), 3,31 (1H, м), 3,86 (1H, м), 4,02 (1H, м), 4,94 (1H, д, J=5,4 Гц), 5,51 (2H, с), 6,96 (1H, м), 6,98 (1H, м), 7,22 (1H, с), 7,56 (1H, с), 8,06-8,23 (3H, м), 8,51 (1H, д, J=8,3 Гц), 9,11 (1H, с)
[Пример 34] (1S,5R,6S)-2-[7-(1-Карбамоилметил-5-метилтиопиридиний-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 40)
Указанное в заголовке соединение (38,0 мг) синтезировали по существу тем же способом, что и описанный в примере 2, за исключением того, что в качестве исходного соединения применяли 155 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(5-метилтиопиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,09 (3H, д, J=7, 0), 1,11 (3H, д, J=6,1 Гц), 2,67 (3H, с), 3,08 (1H, м), 3,35 (1H, м), 3,87 (1H, м), 4,01 (1H, дд, J1=9,5 Гц, J2=2,7 Гц), 4,96 (1H, д, J=5,1 Гц), 5,43 (2H, с), 7,67 (1H, уш.с), 8, 03 (1H, уш.с), 8,23 (1H, с), 8,31 (1H, с), 8,99 (1H, уш.с), 9,30 (1H, уш.с), 9,41 (1H, уш.с)
[Пример 35] (1S,5R, 6S)-2-[7-[1-((2R)-3-Амино-2-гидроксипропил)пиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид) (соединение № 48)
a) Трифторметансульфонат 4-нитробензил-(1S,5R,6S)-2-[7-[1-((2R)-3-азидо-2-триэтилсилилоксипропил)пиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата
Неочищенное соединение (398 мг) трифторметансульфонат 4-нитробензил-(1S,5R, 6S)-2-[7-[1-((2R)-3-азидо-2-триэтилсилилоксипропил)пиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата получали способом, сходным с описанным на стадии a) примера 4, за исключением того, что в качестве исходных соединений применяли 255 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата и (2R)-3-азидо-2-триэтилсилилоксипропанол.
b) (1S,5R,6S)-2-[7-[1-((2R)-3-Амино-2-гидроксипропил)пиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид)
Для приготовления раствора неочищенное соединение (398 мг) трифторметансульфонат 4-нитробензил-(1S,5R,6S)-2-[7-[1-((2R)-3-азидо-2-триэтилсилилоксипропил)пиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата растворяли в 12 мл ТГФ и 12 мл воды. Раствор доводили до значения pH=2,2 добавлением 1 н хлористоводородной кислоты и перемешивали в течение 24 часов. Раствор доводили до значения pH=5 добавлением 5% водного раствора гидрокарбоната натрия, и проводили реакцию способом, сходным с описанным на стадии b) примера 4. Таким образом, получали 56 мг указанного в заголовке соединения.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,04 (3H, д, J=7,3 Гц), 1,18 (3H, д, J=6,4 Гц), 3,08 (1H, м), 3,23-3,39 (3H, м), 4,02 (1H, дд, J1=9,0 Гц, J2=2,4 Гц), 4,13 (1H, м), 4,43 (1H, м), 4,55 (1H, м), 4,94 (1H, м), 7,77 (1H, с), 7,90 (1H, с), 8,08 (1H, м), 8,89 (1H, м), 9,18 (1H, м), 9,58 (1H, с)
[Пример 36] (1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиперидин-4-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 53)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[1-(4-нитробензилоксикарбонил)пиперидин-4-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[1-(4-нитробензилоксикарбонил)пиперидин-4-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (1,16 г) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 938 мг 4-нитробензил-(1R,3R,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 1,91 г 7-[1-(4-нитробензилоксикарбонил)пиперидин-4-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,30 (3H, д, J=7,2 Гц), 1,40 (3H, д, J=6,3 Гц), 1,7-2,1 (4H, м), 3,0-3,2 (2H, м), 3,35-3,4 (1H, м), 3,4-3,6 (1H, м), 3,6-3,7 (1H, м), 4,2-4,4 (3H, м), 4,41 (1H, дд, J1=9,9 Гц, J2=2,7 Гц), 5,24 (2H, с), 5,27 (1H, д, J=13,5 Гц), 5,52 (1H, д, J=13,5 Гц), 7,52 (2H, д, J=8,7 Гц), 7,67 (2H, д, J=9,0 Гц), 8,01 (1H, с), 8,2-8,3 (4H, м), 8,51 (1H, с)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(пиперидин-4-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (142 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 344 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[1-(4-нитробензилоксикарбонил)пиперидин-4-ил]карбонилимидазо-[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,80 м.д.): 1,21 (3H, д, J=6,9 Гц), 1,33 (3H, д, J=6,3 Гц), 1,8-2,0 (2H, м), 2,05-2,2 (2H, м), 3,1-3,25 (2H, м), 3,25-3,6 (5H, м), 4,2-4,35 (2H, м), 7,92 (1H, с), 8,02 (1H, с)
[Пример 37] (1S,5R,6S)-2-[7-[5-(2-Аминоэтил)тио-1-карбоксилметилпиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 54)
Указанное в заголовке соединение (12 мг) получали способом, сходным с описанным на стадиях a) и b) примера 4, за исключением того, что применяемые на стадии a) примера 4 3-азидо-1-пропанол и 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат были заменены на 63 мг 4-нитробензилгидроксиацетата и 168 мг 4-нитробензил-(1S,5R,6S)-2-[7-[5-(2-азидоэтил)тиопиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата, соответственно.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,07 (3H, д, J=7,3 Гц), 1,19 (3H, д, J=6,6 Гц), 3,25-3,37 (4H, м), 3,45 (2H, м), 4,04 (1H, дд, J1=9,4 Гц, J2=2,3 Гц), 4,13 (1H, м), 5,18 (2H, м), 7,80 (1H, с), 7,85 (1H, с), 8,76 15 (1H, с), 8,97 (1H, с), 9,19 (1H, с)
[Пример 38] (5R, 6S)-6-((1R)-1-гидроксиэтил)-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 58)
a) 4-Нитробензил-(5R, 6S)-6-((1R)-1-гидроксиэтил)-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(5R, 6S)-6-((1R)-1-гидроксиэтил)-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (469 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 400 мг 4-нитробензил-(3R,5R,6S)-6-((1R)-1-гидроксиэтил)-2-оксо-1-карбапенам-3-карбоксилата и 700 мг 7-(пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,41 (3H, д, J=6,3 Гц), 3,34-3,46 (3H, м), 4,29-4,43 (2H, м), 5,34 (1H, д, J=13,6 Гц), 5,57 (1H, д, J=13,6 Гц), 7,45 (1H, м), 7,72 (2H, д, J=8,8 Гц), 8,09 (1H, с), 8,26 (2H, д, J=8,8 Гц), 8,51 (1H, с), 8,72-8,85 (2H, м), 8,75-8,85 (1H, м), 9,72 (1H, м)
b) (5R, 6S)-6-((1R)-1-гидроксиэтил)-2-[7-(пиридин-3-ил)-карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (50 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 89 мг 4-нитробензил-(5R,6S)-6-((1R)-1-гидроксиэтил)-2-[7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,16 (3H, д, J=6,3 Гц), 2,95 (2H, м), 3,24 (1H, м), 4,01 (1H, м), 4,09 (1H, м), 7,24 (1H, м), 7,54 (1H, с), 7,84 (1H, с), 8,13 (1H, м), 8,36 (1H, м), 8,77 (1H, м)
[Пример 39] (5R,6S)-2-[7-(1-Карбамоилметилпиридиний-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 60)
Указанное в заголовке соединение (32 мг) получали способом, сходным с описанным на стадиях a) и b) примера 2, за исключением того, что на стадии a) примера 2 111 мг 4-нитробензил-(5R,6S)-6-((1R)-1-гидроксиэтил)-2-[7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат применяли вместо 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,15 (3H д, J=6,4 Гц), 2,99 (2H, м), 3,28 (1H, м), 3,97 (1H, м), 4,09 (1H, м), 5,50 (2H, м), 7,58 (1H, с), 7,91 (1H, с), 8,03 (1H, м), 8,78 (1H, м), 9,06 (1H, м), 9,51 (1H, с)
[Пример 40] (1S,5R,6S)-2-[7-(1-Карбоксилметилпиридиний-3-ил)-[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 63)
Указанное в заголовке соединение (25 мг) получали способом, сходным с описанным на стадиях a) и b) примера 4, за исключением того, что в качестве исходных соединений применяли 185 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата и 95 мг 4-нитробензилгидроксиацетата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,13 (3H, д, J=7,3 Гц), 1,20 (3H, д, J=6,3 Гц), 3,40 (1H, м), 3,49 (1H, м), 4,12-4,22 (2H, м), 5,24 (2H, с), 8,00 (1H, с), 8,09 (1H, м), 8,14 (1H, с), 8,82 (1H, м), 9,10 (1H, м), 9,52 (1H, с)
[Пример 41] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(пирролидин-1-ил)ацетилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 67)
a) 4-Нитробензил-(1S,5R,6S)-2-(7-хлорацетилимидазо[5,1-b]тиазол-2-ил)-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-2-(7-хлорацетилимидазо[5,1-b]тиазол-2-ил)-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (1,01 г) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 2,85 г 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 1,66 г 7-хлорацетил-2-(три-н-бутилстаннил)имидазо[5, 1-b]тиазола.
ЯМР (ДМСО-d6) δ: 1,19 (3H, д, J=6,3 Гц), 1,23 (3H, д, J=7,2 Гц), 3,4-3,45 (1H, м), 3,7-3,8 (1H, м), 3,95-4,1 (1H, м), 4,3-4,4 (1H, м), 4,92 (2H, с), 5,39 (1H, д, J=13,8 Гц), 5,52 (1H, д, J=13,8 Гц), 7,74 (2H, д, J=9,0 Гц), 8,21 (2H, д, J=9,0 Гц), 8,38 (1H, с), 8,60 (1H, с)
b) 4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пирролидин-1-ил)ацетилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
Для приготовления раствора 4-нитробензил-(1S,5R, 6S)-2-(7-хлорацетилимидазо[5,1-b]тиазол-2-ил)-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (161 мг) растворяли в 5 мл ацетона. К раствору добавляли йодид натрия (67 мг) и перемешивали смесь при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли насыщенный солевой раствор и экстрагировали смесь этилацетатом. Экстракт сушили над безводным сульфатом магния. Растворитель удаляли путем перегонки и для приготовления раствора растворяли остаток в 5 мл N,N-диметилформамида. К растворителю добавляли пирролидин (0,03 мл) и перемешивали смесь при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный солевой раствор и экстрагировали смесь этилацетатом. Экстракт сушили над безводным сульфатом магния. Растворитель удаляли путем перегонки и промывали остаток диэтиловым эфиром с получением 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пирролидин-1-ил)ацетилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,15-1,25 (6H, м), 1,7-1,8 (4H, м), 2,6-2,75 (4H, м), 3,4-3,45 (1H, м), 3,7-3,8 (1H, м), 3,85-4,1 (2H, м), 4,3-4,4 (1H, м), 5,39 (1H, д, J=13,8 Гц), 5,52 (1H, д, J=13,8 Гц), 7,72 (2H, д, J=8,7 Гц), 8,21 (2H, д, J=8,7 Гц), 8,32 (1H, с), 8,54 (1H, с)
c) (1S,5R, 6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-(пирролидин-1-ил)ацетилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (41,7 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 200 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пирролидин-1-ил)ацетилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,80 м.д.): 1,23 (3H, д, J=6,9 Гц), 1,35 (3H, д, J=6,3 Гц), 2,1-2,2 (4H, м), 3,4-3,7 (6H, м), 4,25-4,4 (2H, м), 4,7-4,8 (2H, м), 7,93 (1H, с), 8,14 (1H, с)
Соединения №№ 55, 61, 72, 93, 95, 111 и 113 синтезировали способом, сходным с описанным в примере 41.
[Пример 42] (1S,5R,6S)-2-[7-[5-(2-Аминоэтил)тиометилпиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 68)
a) 4-Нитробензил-(1S,5R, 6S)-2-[7-[5-(2-азидоэтил)тиометилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-2-[7-[5-(2-азидоэтил)тиометилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (457 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 461 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 856 мг [7-[5-(2-азидоэтил)тиометилпиридин-3-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,34 (3H, д, J=7,3 Гц), 1,41 (3H, д, J=6,3 Гц), 2,62 (2H, т, J=6,7 Гц), 3,41 (1H, дд, J1=6,6 Гц, J2=3,0 Гц), 3,48 (2H, т, J=6,7 Гц), 3,57 (1H, м), 3,88 (2H, с), 4,34 (1H, м), 4,43 (1H, дд, J1=9,7 Гц, J2=2,9 Гц), 5, 30 (1H, д, J=13,7 Гц), 5,54 (1H, д, J=13,7 Гц), 7,69 (2H, д, J=9,0 Гц), 8,10 (1H, с), 8,25 (2H, д, J=9,0 Гц), 8,58 (1H, с), 8,74 (1H, м), 8,81 (1H, м), 9,63 (1H, м)
b) (1S,5R, 6S)-2-[7-[5-(2-Аминоэтил)тиометилпиридин-3-ил]-карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (19 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 96 мг 4-нитробензил-(1S,5R, 6S)-2-[7-[5-(2-азидоэтил)тиометилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 0,99 (3H, д, J=7,1 Гц), 1,18 (3H, д, J=6,1 Гц), 2,67 (2H, т, J=6,7 Гц), 3,10 (2H, т, J=6,7 Гц), 3,28-3,35 (2H, м), 3,62 (2H, с), 4,05-4,16 (2H, м), 7,67 (1H, с), 7,81 (1H, с), 8,03 (1H, с), 8, 22 (1H, с), 8,49 (1H, с)
[Пример 43] (1S,5R,6S)-2-[7-[5-(2-Аминоэтил)тиометил-1-карбоксиметилпиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 69)
Указанное в заголовке соединение (9 мг) получали способом, сходным с описанным на стадиях a) и b) примера 4, за исключением того, что в качестве исходных соединений применяли 105 мг 4-нитробензил-(1S,5R, 6S)-2-[7-[5-(2-азидоэтил)тиометилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата и 45 мг 4-нитробензилгидроксиацетата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,10 (3H, д, J=6,8 Гц), 1,18 (3H, д, J=6,3 Гц), 2,72 (2H, т, J=6,8 Гц), 3,09 (2H, т, J=6,8 Гц), 3,36-3,49 (2H, м), 3,99 (2H, с), 4,10-4,17 (2H, м), 5,19 (2H, с), 7,95 (1H, с), 8,08 (1H, с), 8,87 (1H, с), 9,11 (1H, с), 9,38 (1H, с)
[Пример 44] (1S,5R, 6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-[5-(пиперазин-1-ил)метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 80)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-[4-(4-нитробензилоксикарбонил)пиперазин-1-ил]метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-[4-(4-нитробензилоксикарбонил)пиперазин-1-ил]метилпиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (172 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 337 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 780 мг 7-[5-[4-(4-нитробензилоксикарбонил)пиперазин-1-ил]метилпиридин-3-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,34 (3H, д, J=7,1 Гц), 1,41 (3H, д, J=6,3 Гц), 2,45 (4H, м), 3,41 (1H, дд, J1=6,3 Гц, 5 J2=2,9 Гц), 3,54 (5H, м), 3,66 (2H, с), 4,33 (1H, м), 4,44 (1H, дд, J1=9,7 Гц, J2=2,9 Гц), 5,23 (2H, с), 5,30 (1H, д, J=13,3 Гц), 5,54 (1H, д, J=13,3 Гц), 7,50 (2H, д, J=8,8 Гц), 7,69 (2H, д, J=8,9 Гц), 8,09 (1H, с), 8,22 (2H, д, J=8,8 Гц), 8,25 (2H, д, J=8,9 Гц), 8,57 (1H, с), 8,69 (1H, дд, J1=2,1 Гц, J2=2,0 Гц), 8,74 (1H, д, J=2,1 Гц), 9,67 (1H, д, J=2,0 Гц)
b) (1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-(пиперазин-1-ил)метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (59 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 172 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-[4-(4-нитробензилоксикарбонил)пиперазин-1-ил]метилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD =4,65 м.д.): 1,03 (3H, д, J=7,1 Гц), 1,18 (3H, д, J=6,1 Гц), 2,66 (4H, м), 3,15 (4H, м), 3,33-3,43 (2H, м), 3,56 (2H, с), 4,09-4,16 (2H, м), 7,77 (1H, с), 7,89 (1H, с), 8,12 (1H, м), 8,30 (1H, м), 8,66 (1H, м)
[Пример 45] (1S,5R,6S)-2-[7-[5-(2-Аминоэтил)тиометил-1-карбамоилметилпиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид) (соединение № 81)
Указанное в заголовке соединение (9 мг) получали способом, сходным с описанным на стадиях a) and b) примера 2, за исключением того, что в качестве исходного соединения применяли 114 мг 4-нитробензил-(1S,5R, 6S)-2-[7-[5-(2-азидоэтил)тиометилпиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,10 (3H, д, J=7,3 Гц), 1,18 (3H, д, J=6,4 Гц), 2,72 (2H, т, J=6,6 Гц), 3,11 (2H, т, J=6,6 Гц), 3,37 (1H, м), 3,45 (1H, м), 4,01 (2H, с), 4,10-4,15 (2H, м), 5,51 (2H, с), 7,98 (1H, с), 8,11 (1H, с), 8,93 (1H, с), 9,19 (1H, с), 9,46 (1H, с)
[Пример 46] (1S,5R,6S)-2-[7-[3-(4-Этилпиперазин-1-ил)пропионил]имидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 83)
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[3-(тиоморфолин-4-ил)пропионил]имидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат синтезировали по существу тем же способом, что и описанный в примере 1, за исключением того, что в качестве исходных соединений применяли 2,52 г 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 2,30 г 7-[3-(тиоморфолин-4-ил)пропионил]-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола. Данное соединение обрабатывали мета-хлорпербензойной кислотой и затем этилпиперазином для синтеза 4-нитробензил-(1S,5R, 6S)-2-[7-[3-(4-этилпиперазин-1-ил)пропионил]имидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата. Указанное в заголовке соединение (33,4 мг) синтезировали из 164,9 мг данного соединения.
ЯМР (ДМСО-d6) δ: 0,99 (3H, т, J=7,0 Гц), 1,07 (3H, д, J=7,3 Гц), 1,10 (3H, д, J=6,3 Гц), 2,43-2,60 (8H, м), 2,68 (4H, уш.с), 2,96 (2H, м), 3,00 (1H, м), 3,39 (1H, м), 3,85 (1H, м), 4,02 (1H, м), 4,97 (1H, д, J=5,4 Гц), 8,08 (1H, с), 8,15 (1H, с)
Соединения №№ 46 и 85 синтезировали способом, сходным с описанным в примере 46.
[Пример 47] (1S,5R,6S)-2-[7-[5-(3-Аминопропил)тио-1-карбамоилметилпиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид) (соединение № 92)
Указанное в заголовке соединение (10 мг) получали способом, сходным с описанным на стадиях a) и b) примера 2, за исключением того, что в качестве исходного соединения применяли 141 мг 4-нитробензил-(1S,5R,6S)-2-[7-[5-(3-азидопропил)тиопиридин-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 1,09 (3H, д, J=7,3 Гц), 1,17 (3H, д, J=6,4 Гц), 2,00 (2H, м), 3,07 (2H, т, J=7,7 Гц), 3,22 (2H, т, J=7,2 Гц), 3,35-3,47 (2H, м), 4,07-4,17 (2H, м), 5,46 (2H, с), 7,94 (1H, с), 8,07 (1H, с), 8,75 (1H, с), 9,01 (1H, с), 9,28 (1H, с)
[Пример 48] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[5-фенил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 94)
4-Нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[5-фенил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат синтезировали по существу тем же способом, что и описанный в примере 1, за исключением того, что в качестве исходных соединений применяли 480 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 417 мг 5-фенил-7-(пиридин-3-ил)-карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола. Указанное в заголовке соединение (48,0 мг) синтезировали из 97,0 мг данного соединения.
ЯМР (ДМСО-d6) δ: 1,07 (3H, д, J=7,1 Гц), 1,11 (3H, д, J=6,1 Гц), 3,09 (1H, м), 3,63 (1H, м), 3,91 (1H, м), 4,03 (1H, м), 4,96 (1H, д, J=5,6 Гц), 7,45 (1H, м), 7,52-7,55 (3H, м), 7,96 (2H, д, J=8,6 Гц), 8,40 (1H, с), 8,72 (1H, с), 8,73 (1H, с), 9,59 (1H, с)
[Пример 49] (1S,5R,6S)-2-[5-Хлор-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 100)
a) 4-Нитробензил-(1S,5R,6S)-2-[5-хлор-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-2-[5-хлор-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (712 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 474 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 730 мг 5-хлор-7-(пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5, 1-b]тиазола.
ЯМР (CDCl3) δ: 1,35 (3H, д, J=7,3 Гц), 1,41 (3H, д, J=6,3 Гц), 3,42 (1H, дд, J1=6,6 Гц, J2=3,0 Гц), 3,57 (1H, м), 4,34 (1H, м), 4, 43 (1H, дд, J1=9,7 Гц, J2=2,7 Гц), 5,31 (1H, д, J=13,4 Гц), 5,56 (1H, д, J=13,4 Гц), 7,46 (1H, м), 7,69 (2H, д, J=8,7 Гц), 8,25 (2H, д, J=8,7 Гц), 8,34 (1H, с), 8,77-8,84 (2H, м), 9,68 (1H, м)
b) (1S,5R,6S)-2-[5-Хлор-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (49 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 91 мг 4-нитробензил-(1S,5R, 6S)-2-[5-хлор-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 0,97 (3H, д, J=7,1 Гц), 1,19 (3H, д, J=6,4 Гц), 3,26-3,37 (2H, м), 4,07-4,17 (2H, м), 7,20 (1H, м), 7,57 (1H, с), 8,08 (1H, м), 8,37 (1H, м), 8,73 (1H, м)
[Пример 50] (1S,5R, 6S)-2-[5-Хлор-7-(1-карбамоилметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 102)
Указанное в заголовке соединение (76 мг) получали способом, сходным с описанным на стадиях a) и b) примера 2, за исключением того, что в качестве исходного соединения применяли 185 мг 4-нитробензил-(1S,5R,6S)-2-[5-хлор-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 0,89 (3H, д, J=6,5 Гц), 1,13 (3H, д, J=6,1 Гц), 3,05-3,23 (2H, м), 3,91 (1H, м), 4,05 (1H, м), 5,39 (2H, с), 7,42 (1H, с), 7,82 (1H, м), 8,66 (1H, м), 8,91 (1H, м), 9,14 (1H, с)
[Пример 51] (1S,5R,6S)-2-[7-(1-Карбоксиметилпиридиний-3-ил)карбонил-5-фенилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 104)
Указанное в заголовке соединение (47,0 мг) синтезировали по существу тем же способом, что и описанный на стадиях a) и b) примера 4, за исключением того, что в качестве исходных соединений применяли 130 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[5-фенил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата и 4-нитробензилгидроксиацетата.
ЯМР (ДМСО-d6) δ: 1,06 (3H, д, J=7,1 Гц), 1,16 (3H, д, J=6,3 Гц), 3,11 (1H, дд, J1=6,6 Гц, J2=2,4 Гц), 3,65 (1H, м), 3,94 (1H, м), 4,00 (1H, дд, J1=9,5 Гц, J2=2,7 Гц), 5,04 (1H, д, J=5,4 Гц), 5,64 (1H, д, J=15,8 Гц), 5,81 (1H, д, J=15,8 Гц), 7,49-7,58 (3H, м), 7,77 (1H, уш.с), 8,03 (2H, д, J=8, 6 Гц), 8,30 (1H, с), 8,35 (1H, м), 8,44 (1H, уш.с), 9,14 (1H, д, J=6,1 Гц), 9,54 (1H, д, J=8,3 Гц), 9,95 (1H, с)
[Пример 52] (1S,5R, 6S)-2-[5-(4-Диметиламинофенил)-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 105)
4-Нитробензил-(1S,5R,6S)-2-[5-(4-диметиламинофенил)-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат синтезировали по существу тем же способом, что и описанный в примере 1, за исключением того, что в качестве исходных соединений применяли 486 мг 4-нитробензил-(1R,3R,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 348 мг 5-(4-диметиламинофенил)-7-(пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола. Указанное в заголовке соединение (44,0 мг) синтезировали из 104 мг данного соединения.
ЯМР (ДМСО-d6) δ: 1,07 (3H, д, J=7,0 Гц), 1,11 (3H, д, J=6,4 Гц), 2,94 (6H, с), 3,09 (1H, дд, J1=6,6 Гц, J2=2,4 Гц), 3,59 (1H, м), 3,88 (1H, м), 4,01 (1H, дд, J1=9,5 Гц, J2=2,7 Гц), 4,96 (1H, д, J=5,6 Гц), 6,80 (2H, д, J=9,0 Гц), 7,57 (1H, м), 7,75 (2H, д, J=8,8 Гц), 8,34 (1H, м), 8,70-8,72 (2H, м), 9,59 (1H, с)
[Пример 53] (1S,5R,6S)-2-[7-(1-Карбамоилметилпиридиний-3-ил)карбонил-5-(4-диметиламинофенил)имидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 106)
Указанное в заголовке соединение (35,0 мг) синтезировали по существу тем же способом, что и описанный в примере 2, за исключением того, что в качестве исходного соединения применяли 138 мг 4-нитробензил-(1S,5R, 6S)-2-[5-(4-диметиламинофенил)-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1, 05 (3H, д, J=7,0 Гц), 1,17 (3H, д, J=6,4 Гц), 3,01 (6H, с), 3,11 (1H, дд, J1=6,6 Гц, J2=2,7 Гц), 3,59 (1H, м), 3,92 (1H, м), 3,99 (1H, м), 5,02 (1H, д, J=5,4 Гц), 5,63 (1H, д, J=15,4 Гц), 5,86 (1H, д, J=15,4 Гц), 6,82 (2H, с), 7,78 (1H, уш.с), 7,81 (2H, д, J=8,8 Гц), 8,32 (1H, с), 8,53 (1H, уш.с), 9,13 (1H, д, J=6,1 Гц), 9,48 (1H, д, J=8,3 Гц), 9,98 (1H, с)
[Пример 54] (1S,5R,6S)-2-[7-[1-(3-Аминопропил)пиперидин-4-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоновая кислота (гидрохлорид) (соединение № 109)
a) 4-Нитробензил-(1S,5R,6S)-2-[7-[1-(3-азидопропил)пиперидин-4-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-2-[7-[1-(3-азидопропил)пиперидин-4-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (862 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 658 мг 4-нитробензил-(1R,3R,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 1,16 г 7-[1-(3-азидопропил)пиперидин-4-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,30 (3H, д, J=6,3 Гц), 1,40 (3H, д, J=6,4 Гц), 1,78-2,02 (6H, м), 2,14 (2H, м), 2,45 (2H, т, J=7,1 Гц), 2,99 (2H, м), 3,35 (2H, т, J=6,9 Гц), 3,37-3,56 (3H, м), 4,32 (1H, м), 4,41 (1H, дд, J1=9,8 Гц, J2=2,7 Гц), 5,27 (1H, д, J=13,6 Гц), 5,51 (1H, д, J=13,6 Гц), 7,67 (2H, д, J=8,7 Гц), 8,00 (1H, с), 8,24 (2H, д, J=8,7 Гц), 8,51 (1H, с)
b) (1S,5R,6S)-2-[7-[1-(3-Аминопропил)пиперидин-4-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоновая кислота (гидрохлорид)
Указанное в заголовке соединение (94 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 862 мг 4-нитробензил-(1S,5R, 6S)-2-[7-[1-(3-азидопропил)пиперидин-4-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,80 м.д.): 1,11 (3H, д, J=7,0 Гц), 1,19 (3H, д, J=6,3 Гц), 1,79 (2H, м), 2,06 (4H, м), 2,95-3,20 (6H, м), 3,36-3,65 (5H, м), 4,15 (1H, м), 4,20 (1H, дд, J1=9,3 Гц, J2=2,7 Гц), 7,86 (1H, с), 7,96 (1H, с)
[Пример 55] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[5-метилтио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 110)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[5-метилтио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[5-метилтио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (1,78 г) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 1,10 г 4-нитробензил-(1R,3R,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 1,88 г 5-метилтио-7-(пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,34 (3H, д, J=7,3 Гц), 1,41 (3H, д, J=6,1 Гц), 2,75 (3H, с), 3,40 (1H, дд, J1,=6,5 Гц, J2=2,8 Гц), 3,57 (1H, м), 4,33 (1H, м), 4,43 (1H, дд, J1=9,7 Гц, J2=2,8 Гц), 5,30 (1H, д, J=13,4 Гц), 5,56 (1H, д, J=13,4 Гц), 7,46 (1H, м), 7,69 (2H, д, J=8,8 Гц), 8,25 (2H, д, J=8,8 Гц), 8,33 (1H, с), 8,76-8,84 (2H, м), 9,83 (1H, м)
b) (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[5-метилтио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (37 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 108 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[5-метилтио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,65 м.д.): 0,99 (3H, д, J=7,0 Гц), 1,21 (3H, д, J=6,1 Гц), 2,42 (3H, с), 3,28-3,39 (2H, м), 4,10-4,19 (2H, м), 7,25 (1H, м), 7,56 (1H, с), 8,23 (1H, м), 8,37 (1H, м), 8,87 (1H, м)
[Пример 56] (1S,5R, 6S)-2-[7-(1-Карбамоилметилпиридиний-3-ил)карбонил-5-метилтиоимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 114)
Указанное в заголовке соединение (9 мг) получали способом, сходным с описанным на стадиях a) и b) примера 2, за исключением того, что в качестве исходного соединения применяли 162 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[5-метилтио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,13 (3H, д, J=6,8 Гц), 1,19 (3H, д, J=6,1 Гц), 2,67 (3H, с), 3,15 (1H, дд, J1=6,8 Гц, J2=2,7 Гц), 3,66 (1H, м), 3,97 (1H, м), 4,10 (1H, дд, J1=9,3 Гц, J2=2,7 Гц), 5,07 (1H, д, J=5,1 Гц), 5,60 (1H, д, J=15,7 Гц), 5,83 (1H, д, J=15,7 Гц), 7,20 (1H, с), 7,74 (1H, с), 8,34 (1H, м), 8,45 (1H, с), 9,14 (1H, м), 9,50 (1H, м), 9,87 (1H, с)
[Пример 57] (1S,5R,6S)-2-[5-Формил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 117)
a) 4-Нитробензил-(1S,5R,6S)-2-[5-формил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-2-[5-формил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (1,12 г) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 1,04 г 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 1,56 г 5-формил-7-(пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,37 (3H, д, J=7,3 Гц), 1,41 (3H, д, J=6,3 Гц), 3,42 (1H, дд, J1,=6,4 Гц, J2=3,0 Гц), 3,69 (1H, м), 4,34 (1H, м), 4,45 (1H, дд, J1=9,7 Гц, J2=2,9 Гц), 5,33 (1H, д, J=13,4 Гц), 5,57 (1H, д, J=13,4 Гц), 7,51 (1H, м), 7,69 (2H, д, J=8,8 Гц), 8,25 (2H, д, J=8,7 Гц), 8,82-8,89 (2H, м), 8,92 (1H, с), 9,83 (1H, м), 9,88 (1H, с)
b) (1S,5R,6S)-2-[5-Формил-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (54 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 209 мг 4-нитробензил-(1S,5R,6S)-2-[5-формил-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат.
ЯМР (D2О) δ (HOD=4,65 м.д.): 1,01 (3H, д, J=7,1 Гц), 1,21 (3H, д, J=6,3 Гц), 3,30-3,45 (2H, м), 4,10-4,19 (2H, м), 7,34 (1H, м), 8,12 (1H, с), 8,31 (1H, м), 8,48 (1H, м), 8,98 (1H, с), 9,40 (1H, с)
[Пример 58] (1S,5R, 6S)-2-[7-[1-(3-Аминопропил)-5-карбоксипиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид) (соединение № 123)
a) 4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-(4-нитробензилоксикарбонил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-(4-нитробензилоксикарбонил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (97,2 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 98 мг 4-нитробензил-(1R,3R,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 198 мг 7-[5-(4-нитробензилоксикарбонил)пиридин-3-ил]карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,34 (3H, д, J=7,2 Гц), 1,41 (3H, д, J=6,3 Гц), 3,41 (1H, дд, J1=6,3 Гц, J2=2,7 Гц), 3,5-3,65 (1H, м), 4,25-4,4 (1H, м), 4,44 (1H, дд, J1 =9,6 Гц, J2=2,7 Гц), 5,29 (1H, д, J=13,5 Гц), 5,54 (1H, д, J=13,5 Гц), 5,54 (2H, с), 7,6-7,75 (4H, м), 8,11 (1H, с), 8,2-8,3 (4H, м), 8,57 (1H, м), 9,4-9,5 (2H, м), 9,9-9,95 (1H, м)
b) (1S,5R,6S)-2-[7-[1-(3-Аминопропил)-5-карбоксипиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль, гидрохлорид)
Указанное в заголовке соединение (11,5 мг) получали способом, сходным с описанным на стадиях a) и b) примера 4, за исключением того, что в качестве исходных соединений применяли 97,2 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-[5-(4-нитробензилоксикарбонил)пиридин-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата и 27,0 мг 3-азидо-1-пропанола.
ЯМР (D2О) δ (HOD=4,80 м.д.): 1,07 (3H, д, J=7,5 Гц), 1,26 (3H, д, J=6,3 Гц), 2,5-2,7 (2H, м), 3,2-3,4 (4H, м), 4,0-4,3 (2H, м), 4,8-5,0 (2H, м), 7,82 (1H, с), 7,98 (1H, с), 9,15 (1H, с), 9,22 (1H, с), 9,69 (1H, с)
[Пример 59] (1S,5R,6S)-2-[5-Ацетил-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 125)
a) 4-Нитробензил-(1S,5R,6S)-2-[5-ацетил-7-(пиридин-3-ил)-карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R,6S)-2-[5-ацетил-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (112 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 269 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 437 мг 5-ацетил-7-(пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5, 1-b]тиазола.
ЯМР (ДМСО-d6) δ: 1,15-1,25 (6H, м), 2,68 (3H, с), 3,45-3,5 (1H, м), 3,8-3,95 (1H, м), 4,0-4,1 (1H, м), 4,35-4,4 (1H, м), 5,38 (1H, д, J=13,8 Гц), 5,51 (1H, д, J=13,8 Гц), 7,6-7,75 (3H, м), 8,17 (2H, д, J=8,7 Гц), 8,75-8,9 (3H, м), 9,6-9,65 (1H, м)
b) (1S,5R,6S)-2-[5-Ацетил-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (18,8 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 112 мг 4-нитробензил-(1S,5R,6S)-2-[5-ацетил-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,80 м.д.): 1,01 (3H, д, J=6,9 Гц), 1,34 (3H, д, J=6,3 Гц), 2,33 (3H, с), 3,2-3,4 (2H, м), 4,1-4,3 (2H, м), 7,25-7,35 (1H, м), 7,88 (1H, с), 8,25-8,3 (1H, м), 8,45-8,5 (1H, м), 8,98 (1H, с)
[Пример 60] (1S,5R, 6S)-2-[5-Ацетил-7-(1-карбамоилметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 126)
Указанное в заголовке соединение (1,5 мг) получали способом, сходным с описанным на стадиях a) и b) примера 2, за исключением того, что в качестве исходного соединения применяли 52,1 мг 4-нитробензил-(1S,5R,6S)-2-[5-ацетил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2О) δ (HOD=4,80 м.д.): 1,00 (3H, д, J=6,9 Гц), 1,31 (3H, д, J=6,6 Гц), 2,47 (3H, с), 3,2-3,4 (2H, м), 4,0-4,3 (2H, м), 5,66 (2H, с), 7,94 (1H, с), 8,15-8,25 (1H, м), 8,9-9,0 (1H, м), 9,3-9,4 (1H, м), 9,52 (1H, с)
[Пример 61] (1S,5R,6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[5-метилтио-7-[1-(3-сульфамоиламинопропил)пиридиний-3-ил]карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 132)
Указанное в заголовке соединение (41 мг) получали способом, сходным с описанным на стадиях a) и b) примера 4, за исключением того, что в качестве исходных соединений применяли 222 мг 4-нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[5-метилтио-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата и 166 мг 3-(4-нитробензилоксикарбониламиносульфонил)аминопропанола.
ЯМР (D2О) δ (HOD=4,65 м.д.): 1,00 (3H, д, J=7,1 Гц), 1,18 (3H, д, J=6,3 Гц), 2,14-2,27 (4H, м), 3,09 (2H, т, J=6,3 Гц), 3,23-3,35 (2H, м), 4,04 (1H, м), 4,13 (1H, м), 4,65 (2H, м), 7,49 (1H, с), 7,96 (1H, м), 8,83 (1H, м), 8,91 (1H, м), 9,51 (1H, с)
[Пример 62] (1S,5R,6S)-2-[5-Хлор-7-[1-(3-сульфамоиламинопропил)пиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 133)
Указанное в заголовке соединение (64 мг) получали способом, сходным с описанным на стадиях a) и b) примера 4, за исключением того, что в качестве исходных соединений применяли 218 мг 4-нитробензил-(1S,5R,6S)-2-[5-хлор-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата и 160 мг 3-(4-нитробензилоксикарбониламиносульфонил)аминопропанола.
ЯМР (D2О) δ (HOD=4,65 м.д.): 1,07 (3H, д, J=7,1 Гц), 1,19 (3H, д, J=6,3 Гц), 2,24 (2H, м), 3,09 (2H, т, J=6,3 Гц), 3,29-3,41 (2H, м), 4,05-4,17 (2H, м), 4,72 (2H, м), 7,71 (1H, с), 7,99 (1H, м), 8,88 (1H, м), 9,00 (1H, м), 9,41 (1H, с)
[Пример 63] (1S,5R, 6S)-2-[7-(1-Карбоксиметилпиридиний-3-ил)карбонил-5-фенилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 134)
Указанное в заголовке соединение (19,0 мг) синтезировали по существу тем же способом, что и описанный в примере 4, за исключением того, что в качестве исходных соединений применяли 115 мг нитробензил-(1S,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[5-фенил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата и 4-нитробензилгидроксиацетат.
ЯМР (ДМСО-d6) δ: 1,12 (3H, д, J=6,8 Гц), 1,17 (3H, д, J=6,1 Гц), 3,14 (1H, дд, J1=6,6 Гц, J2=2,4 Гц), 3,71 (1H, м), 3,94 (1H, м), 4,07 (1H, дд, J1=9,3 Гц, J2=2,7 Гц), 5,01 (1H, д, J=5,4 Гц), 5,05 (2H, с), 7,51-7,59 (3H, м), 8,05 (2H, д, J=6,8 Гц), 8,23 (1H, м), 8,44 (1H, с), 9,00 (1H, д, J=6,1 Гц), 9,51 (1H, д, J=8,3 Гц), 9,70 (1H, с)
[Пример 64] (1S,5R,6S)-2-[5-Карбамоил-7-(1-карбамоилметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 143)
a) 4-Нитробензил-(1S,5R,6S)-2-[5-карбамоил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат 4-Нитробензил-(1S,5R,6S)-2-[5-карбамоил-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (239 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 210 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 342 мг 5-карбамоил-7-(пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (ДМСО-d6) δ: 1,15-1,25 (6H, м), 3,45-3,5 (1H, м), 3,8-3,9 (1H, м), 4,0-4,1 (1H, м), 4,35-4,4 (1H, м), 5,16 (1H, д, J=4,8 Гц), 5,40 (1H, д, J=13,5 Гц), 5,53 (1H, д, J=13,5 Гц), 7,55-7,65 (1H, м), 7,72 (2H, д, J=9,0 Гц), 7,86 (1H, уш.с), 8,19 (2H, д, J=9,0 Гц), 8,34 (1H, уш.с), 8, 8-8,85 (1H, м), 8,95-9,0 (1H, м), 9,65-9,7 (1H, м)
b) (1S,5R,6S)-2-[5-Карбамоил-7-(1-карбамоилметилпиридиний-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-З-карбоксилат (внутримолекулярная соль)
Указанное в заголовке соединение (8,6 мг) получали способом, сходным с описанным на стадиях a) и b) примера 1, за исключением того, что в качестве исходного соединения применяли 95 мг 4-нитробензил-(1S,5R,6S)-2-[5-карбамоил-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2O) δ (HOD=4,80 м.д.): 0,9-1,1 (3H, м), 1,25-1,35 (3H, м), 3,2-3,4 (2H, м), 4, 0-4,3 (2H, м), 5,6-5,8 (2H, м), 7,7-7,8 (1H, м), 8,0-8,2 (1H, м), 8,8-9,0 (1H, м), 9,2-9,4 (2H, м), 9,4-9,5 (1H, м)
[Пример 65] (1S,5R, 6S)-6-((1R)-1-Гидроксиэтил)-1-метил-2-[7-[1-(2-сульфамоиламиноэтил)пиридиний-3-ил]карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 148)
Указанное в заголовке соединение (101 мг) получали способом, сходным с описанным на стадиях a) и b) примера 4, за исключением того, что в качестве исходного соединения применяли 572 мг 2-(4-нитробензилоксикарбониламиносульфонил)аминоэтанол вместо 3-азидо-1-пропанола на стадии a) примера 4 и 585 мг 4-нитробензил-(1S,5R, 6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-[7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-1-карбапен-2-ем-3-карбоксилата.
ЯМР (ДМСО-d6) δ: 1,14-1,21 (6H, м), 3,16 (1H, дд, J1=6,0 Гц, J2=2,6 Гц), 3,42-3,57 (3H, м), 3,95 (1H, м), 4,09 (1H, дд, J1=9,5 Гц, J2=2,7 Гц), 4,84 (2H, м), 5,07 (1H, д, J=4,2 Гц), 6,80 (2H, с), 7,29 (1H, уш.с), 8,27 (1H, с), 8,32 (1H, м), 8,35 (1H, с), 9,14 (1H, м), 9,52 (1H, с), 9,78 (1H, с)
[Пример 66] (1S,5R,6S)-2-[5-(2-Аминоэтил)тио-7-(пиридин-3-ил)карбонилимидазо[5, 1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение № 173)
a) 4-Нитробензил-(1S,5R, 6S)-2-[5-(2-азидоэтил)тио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат
4-Нитробензил-(1S,5R, 6S)-2-[5-(2-азидоэтил)тио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (853 мг) получали способом, сходным с описанным на стадии a) примера 1, за исключением того, что в качестве исходных соединений применяли 910 мг 4-нитробензил-(1R,3R,5R,6S)-6-((1R)-1-гидроксиэтил)-1-метил-2-оксо-1-карбапенам-3-карбоксилата и 1,59 г 5-(2-азидоэтил)тио-7-(пиридин-3-ил)карбонил-2-(три-н-бутилстаннил)имидазо[5,1-b]тиазола.
ЯМР (CDCl3) δ: 1,34 (3H, д, J=7,3 Гц), 1,41 (3H, д, J=6,4 Гц), 3,35 (2H, т, J=6,5 Гц), 3,41 (1H, дд, J1=6,6 Гц, J2=2,7 Гц), 3,57 (1H, м), 3,68 (2H, т, J=6,5 Гц), 4,33 (1H, м), 4,43 (1H, дд, J1=9,7 Гц, J2=2,7 Гц), 5,31 (1H, д, J=13,4 Гц), 5,56 (1H, д, J=13,4 Гц), 7,47 (1H, м), 7,69 (2H, д, J=8,8 Гц), 8,25 (2H, д, J=8,8 Гц), 8,38 (1H, с), 8,76-8,88 (2H, м), 9,78 (1H, м)
b) (1S,5R, 6S)-2-[5-(2-Аминоэтил)тио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия
Указанное в заголовке соединение (42 мг) получали способом, сходным с описанным на стадии b) примера 1, за исключением того, что в качестве исходного соединения применяли 110 мг 4-нитробензил-(1S,5R, 6S)-2-[5-(2-азидоэтил)тио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата.
ЯМР (D2О) δ (HOD=4,65 м.д.): 0,98 (3H, д, J=7,3 Гц), 1,22 (3H, д, J=6,1 Гц), 3,33-3,44 (6H, м), 4,13-4,22 (2H, м), 7,25 (1H, м), 7,70 (1H, с), 8,10 (1H, м), 8,19 (1H, м), 8,82 (1H, м)
[Пример 67] (1S,5R, 6S)-2-[5-(2-Аминоэтил)тио-7-(1-карбоксиметилпиридиний-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат (внутримолекулярная соль) (соединение № 169)
Указанное в заголовке соединение (63 мг) получали способом, сходным с описанным на стадиях a) и b) примера 4, за исключением того, что в качестве исходных соединений применяли 220 мг 4-нитробензил-(1S,5R,6S)-2-[5-(2-азидоэтил)тио-7-(пиридин-3-ил)карбонилимидазо[5,1-b]тиазол-2-ил]-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилата и 85 мг 4-нитробензилгидроксиацетата.
ЯМР (D2О) δ (HOD =4,65 м.д.): 1,06 (3H, д, J=7,3 Гц), 1,19 (3H, д, J=6,4 Гц), 3,32-3,46 (6H, м), 4,10-4,19 (2H, м), 5,24 (2H, с), 7,81 (1H, с), 8,00 (1H, м), 8,79 (1H, м), 8,98 (1H, м), 9,64 (1H, с)
Соединения №№ 1 - 175 имеют следующее химическое строение.
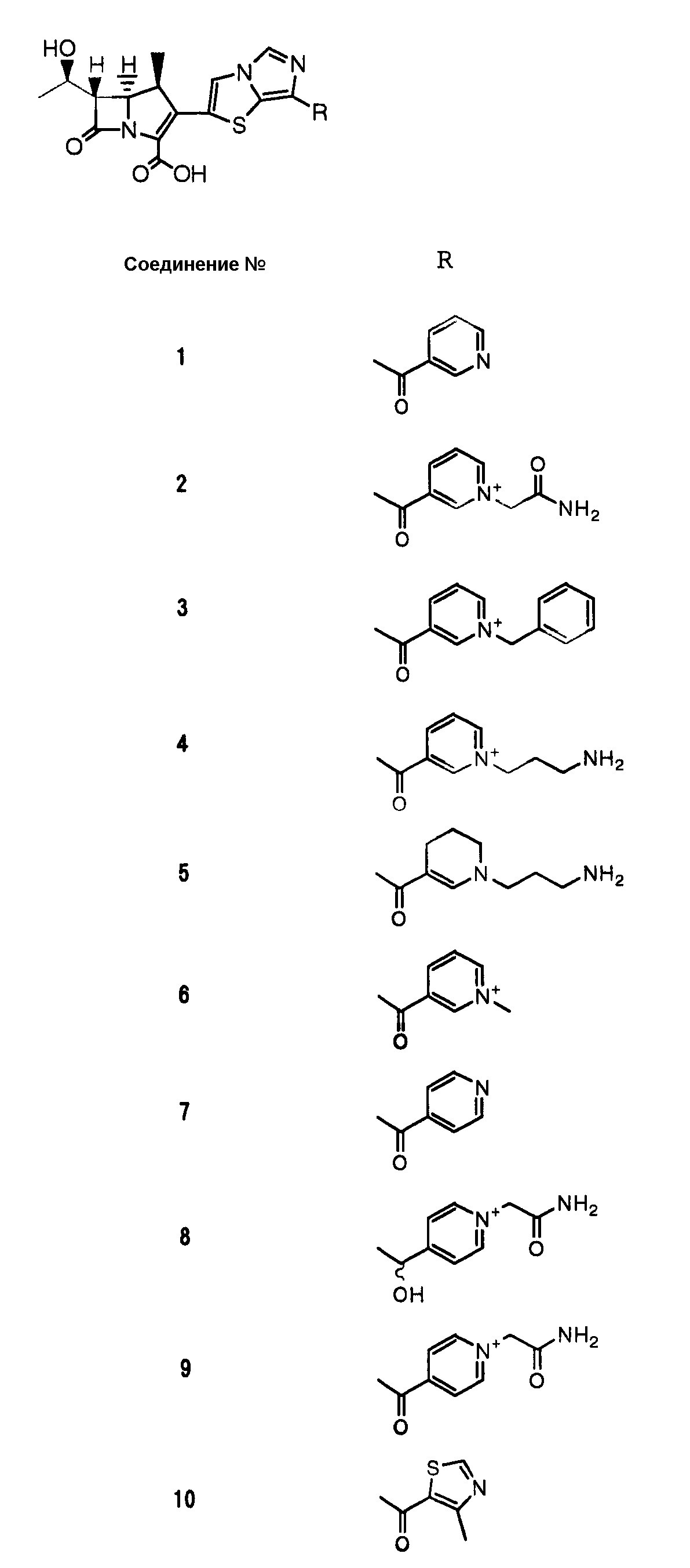
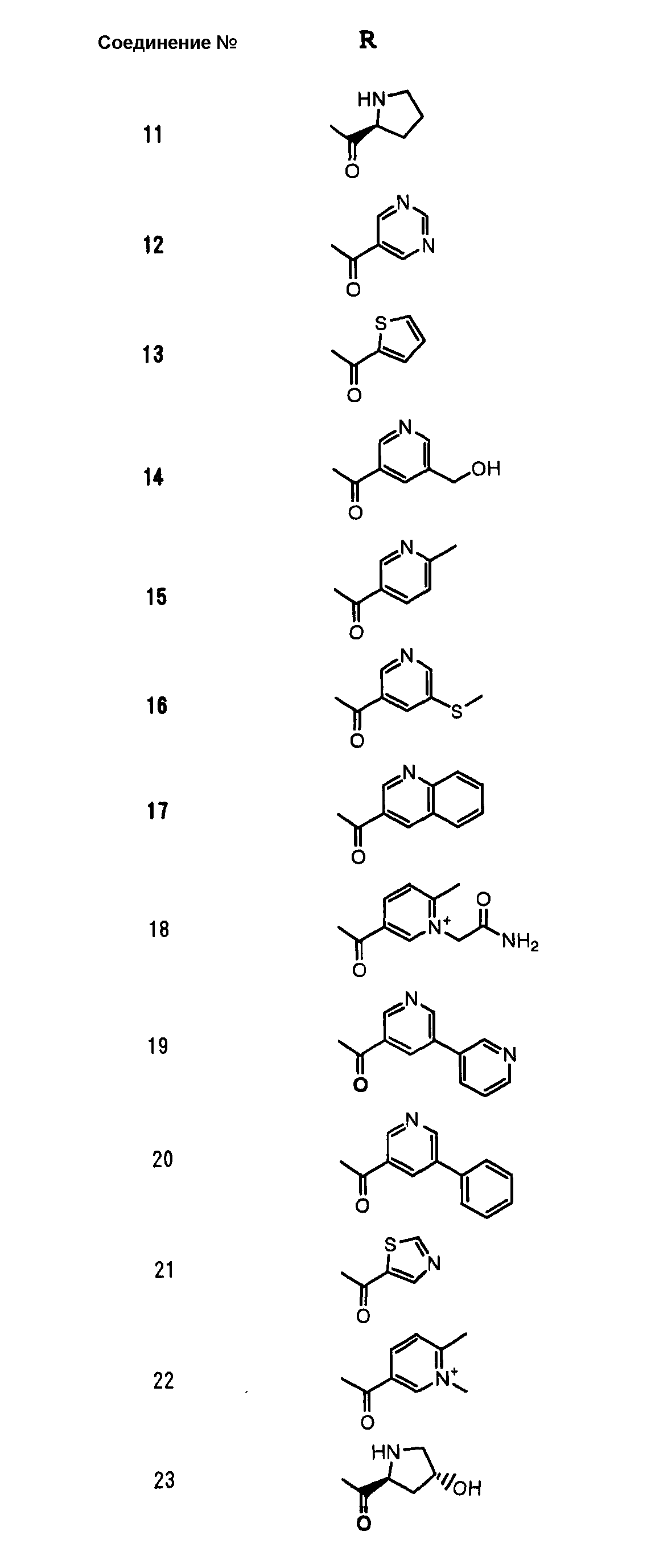
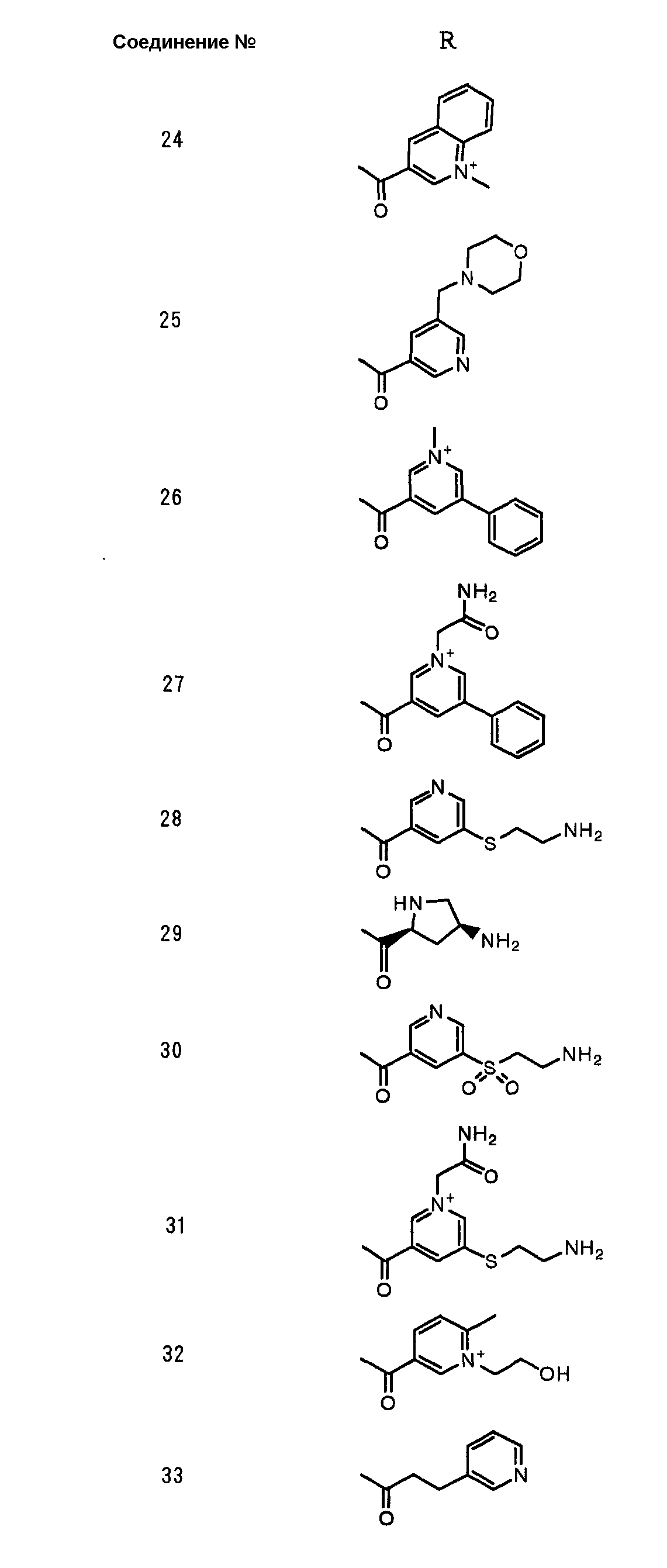
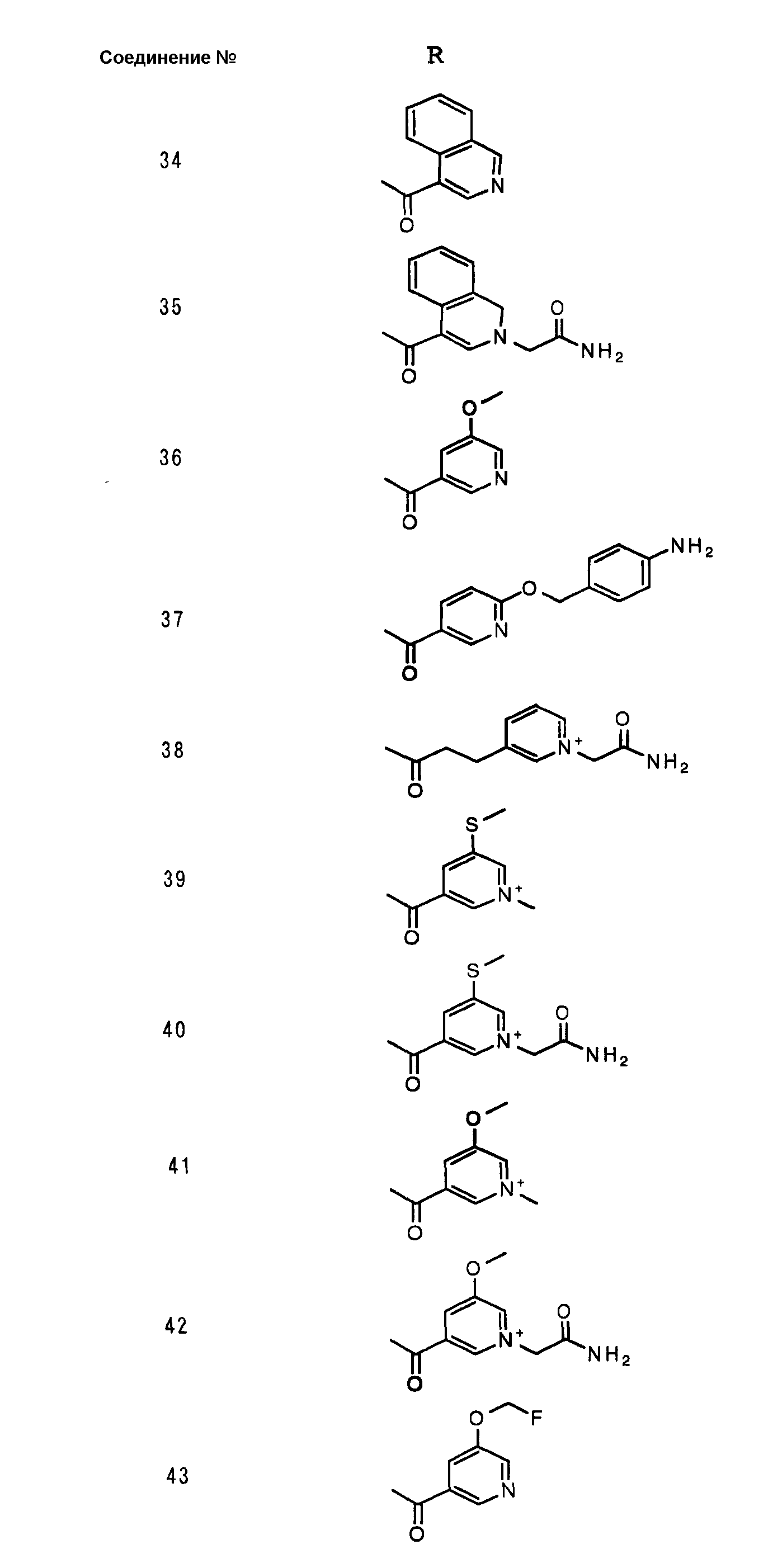
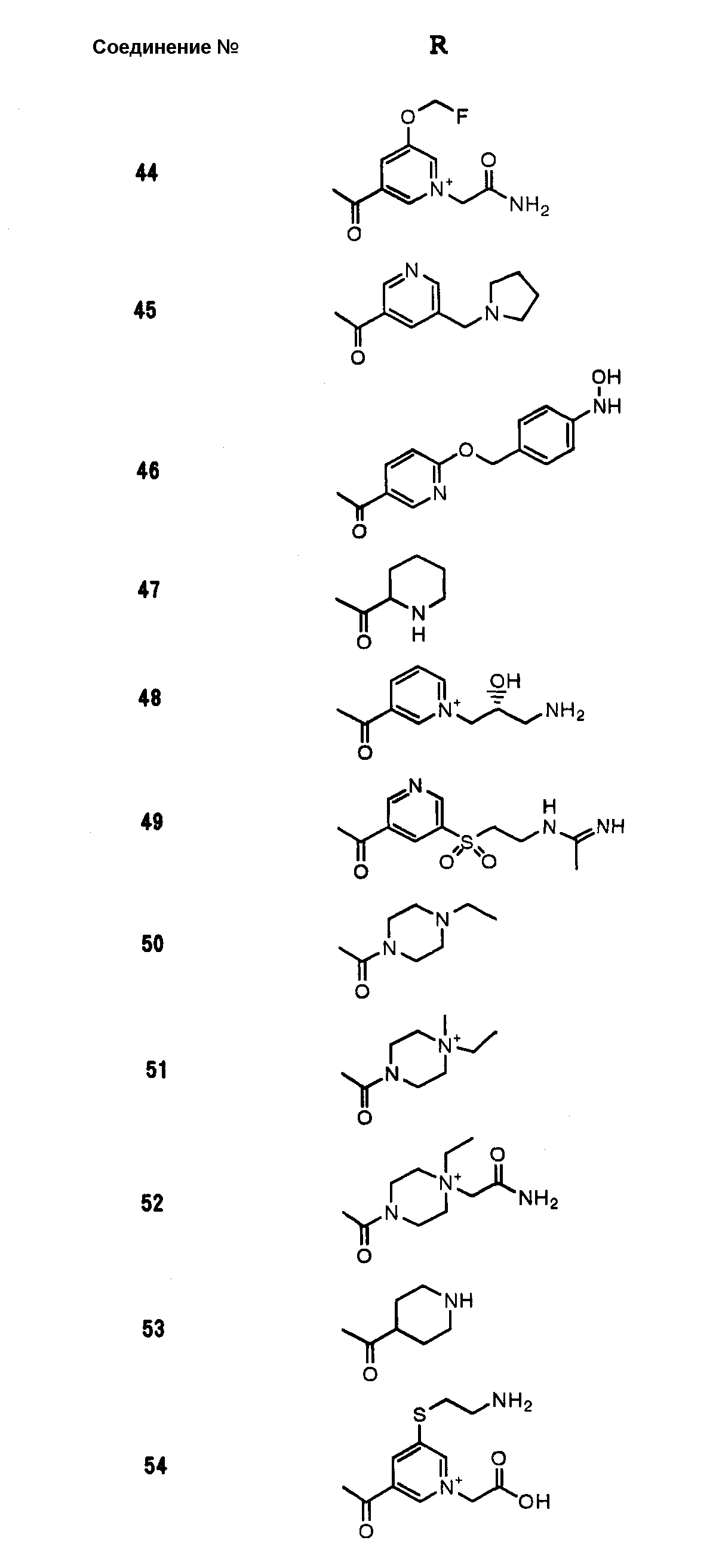
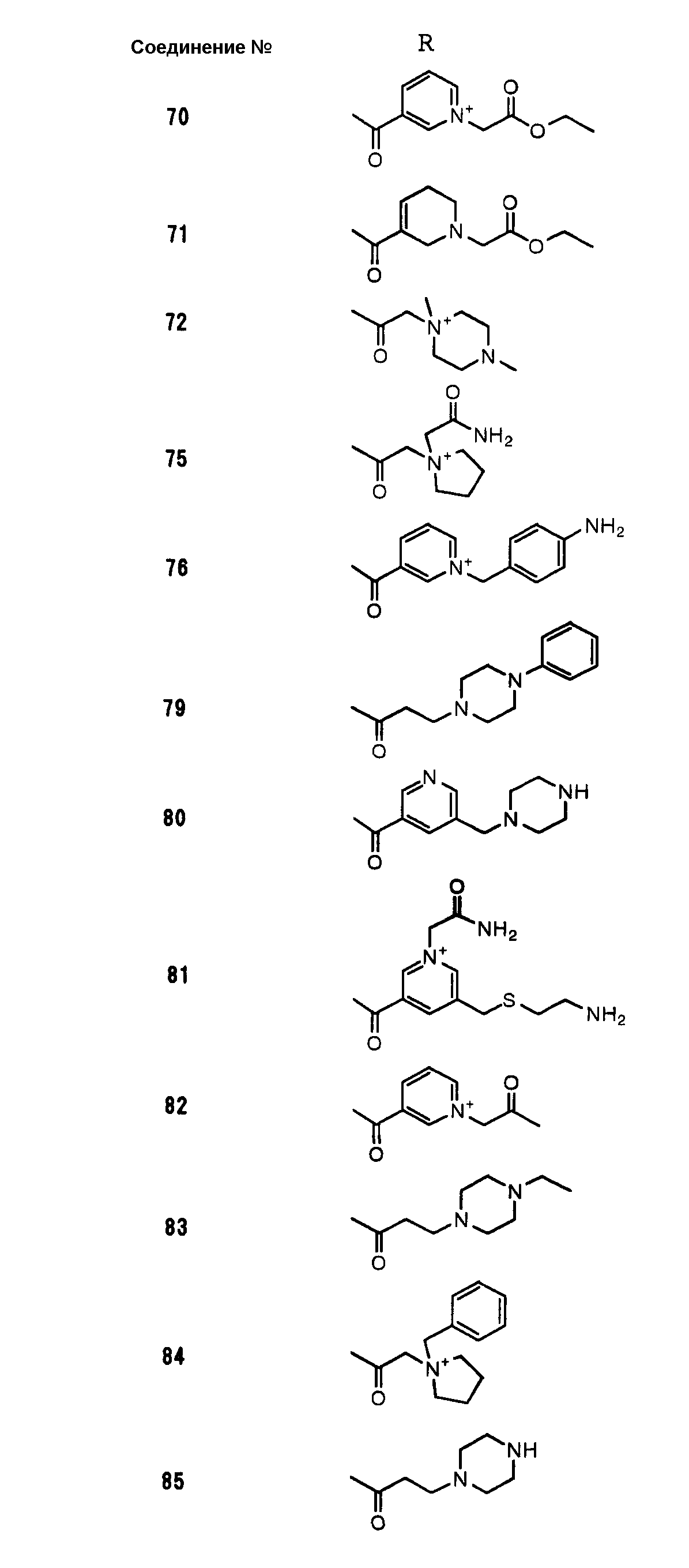
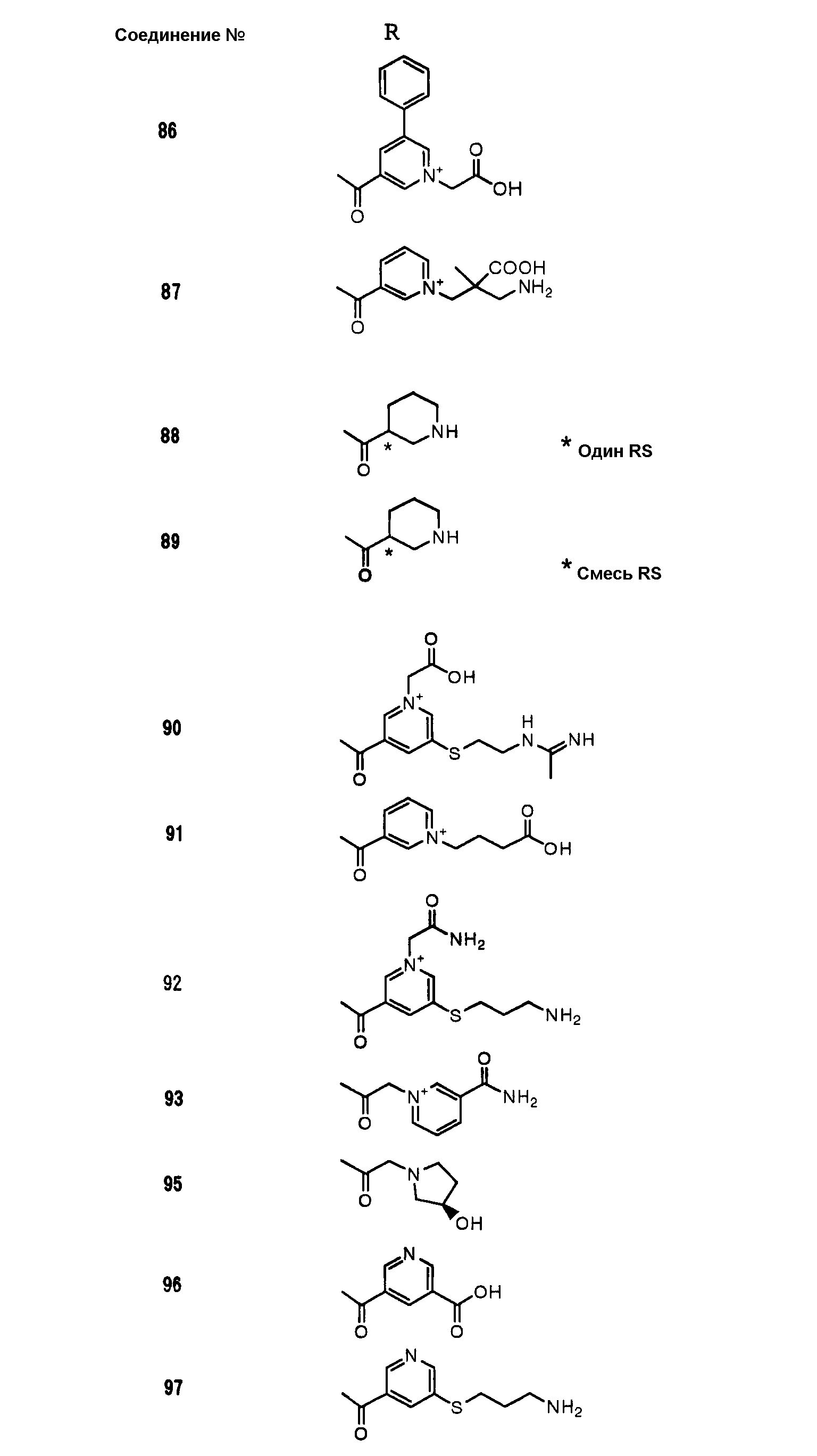
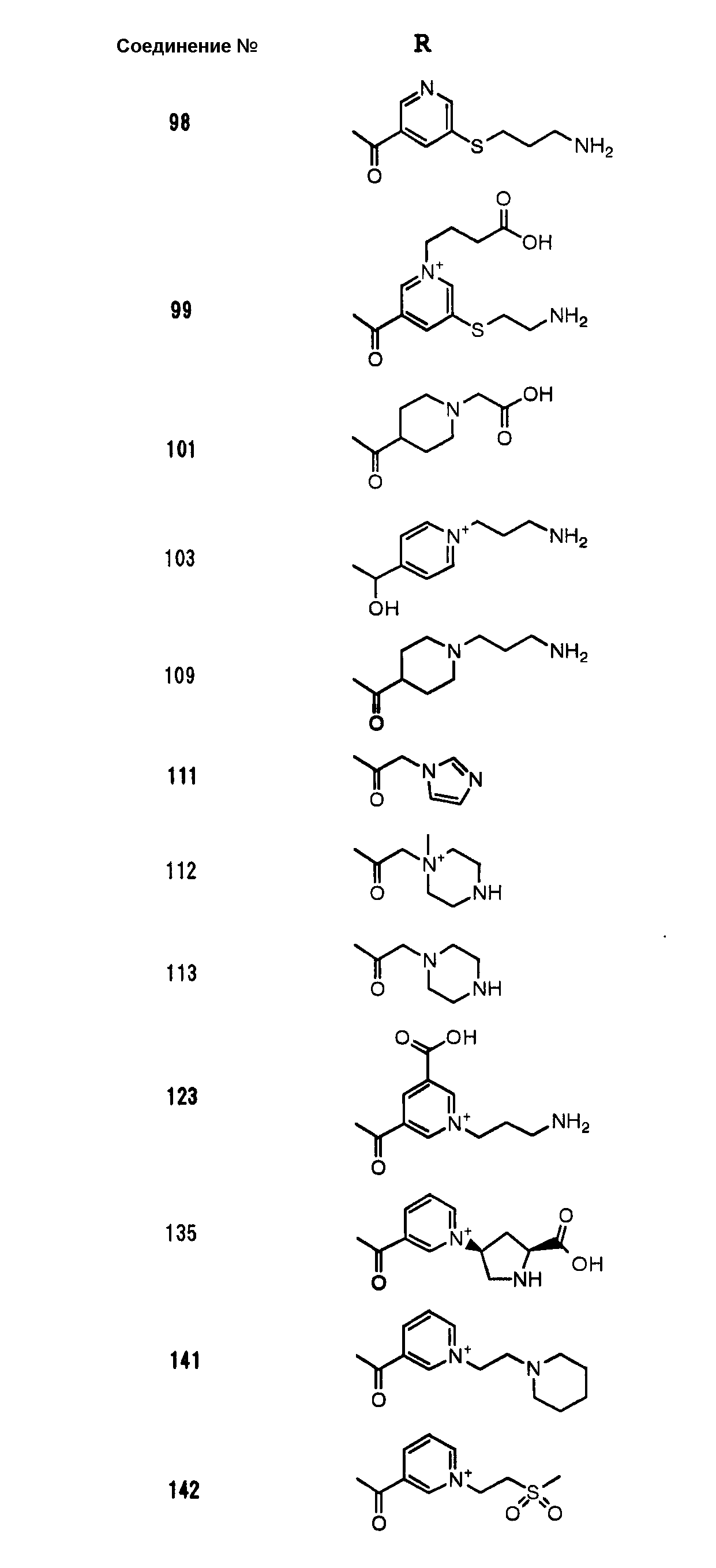
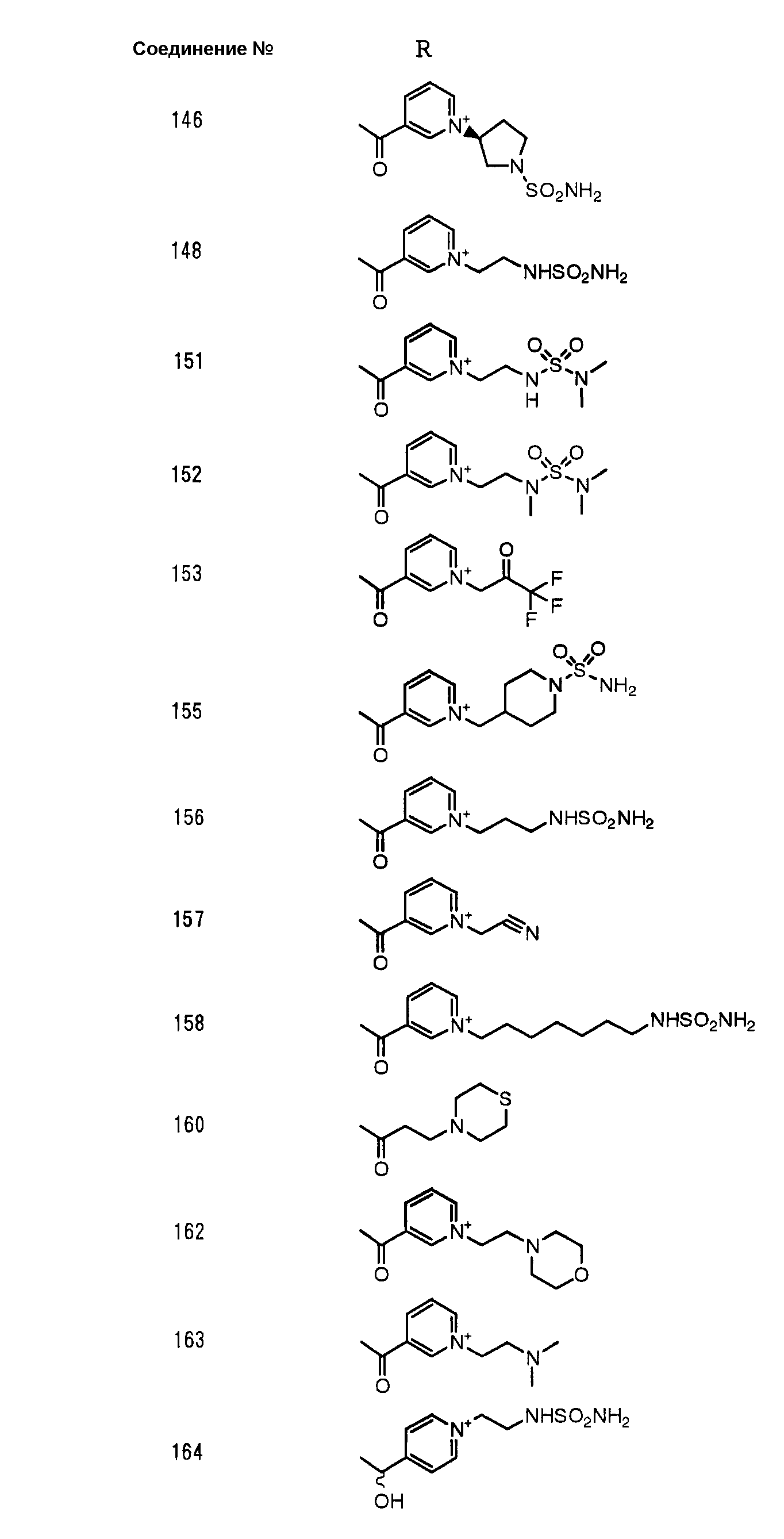
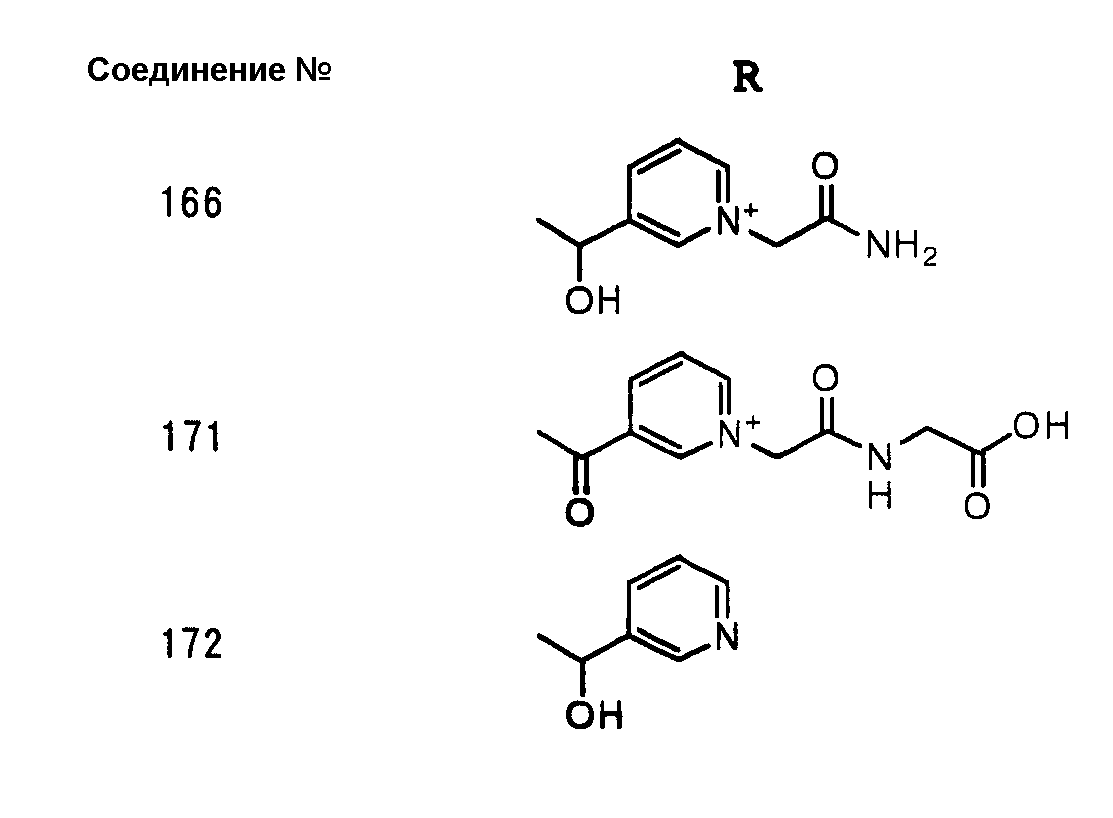
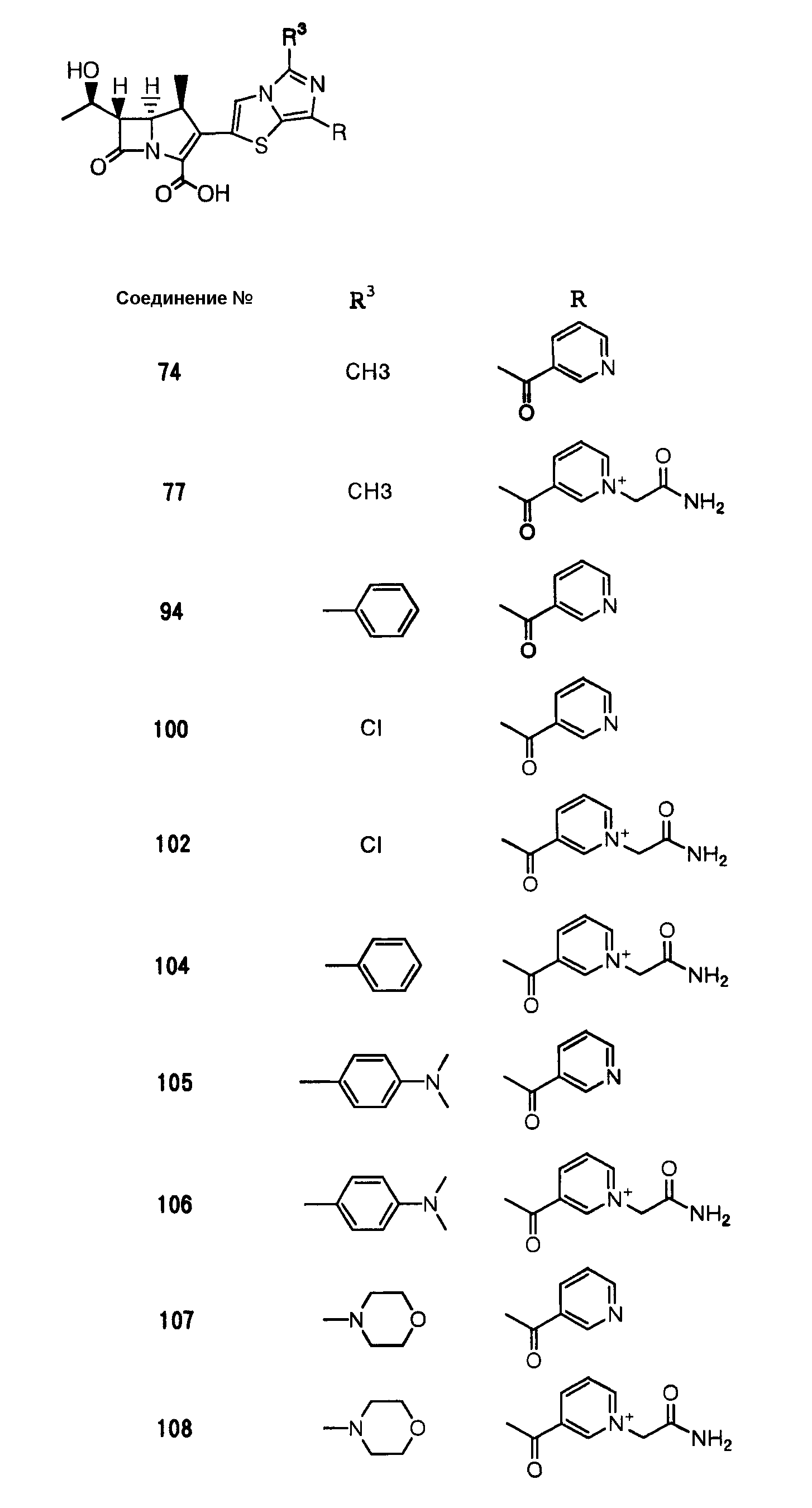
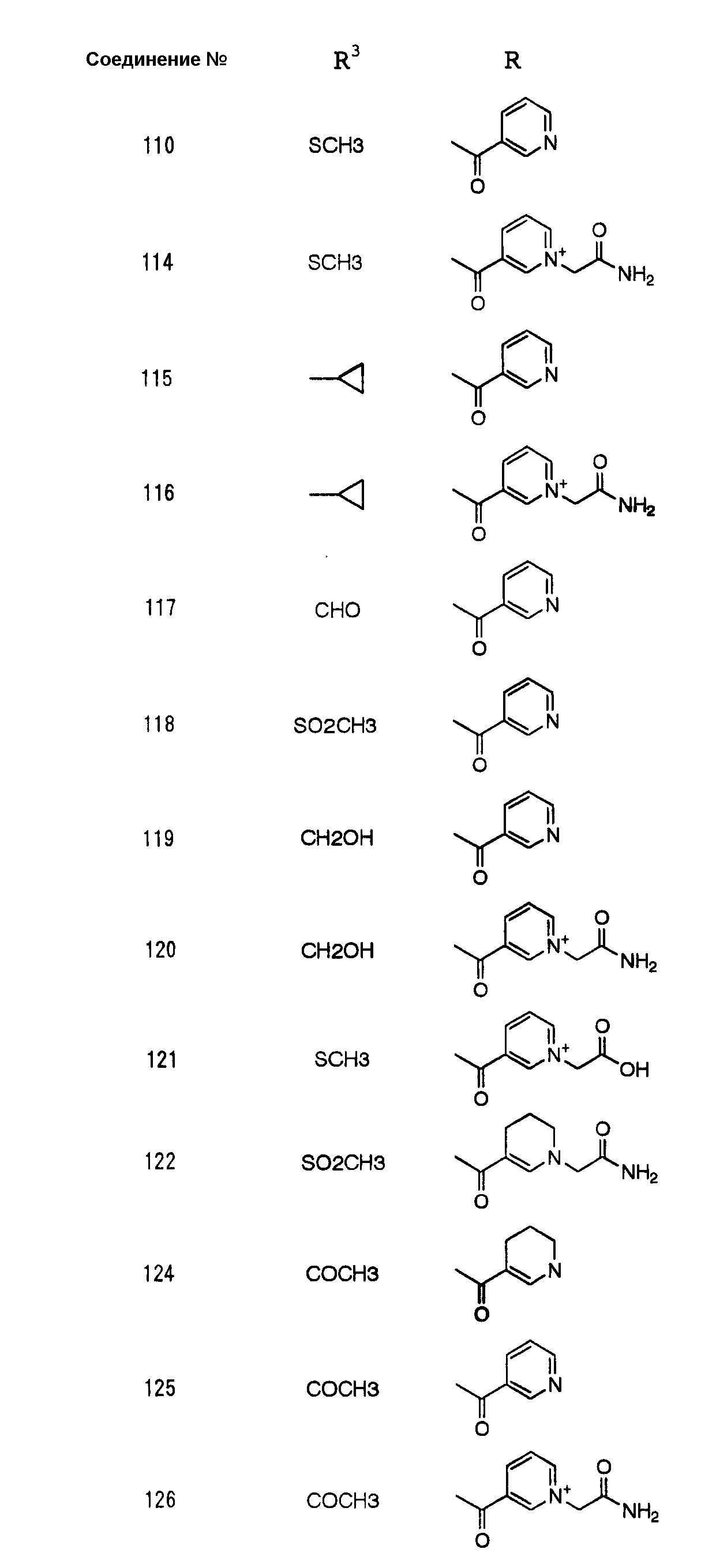
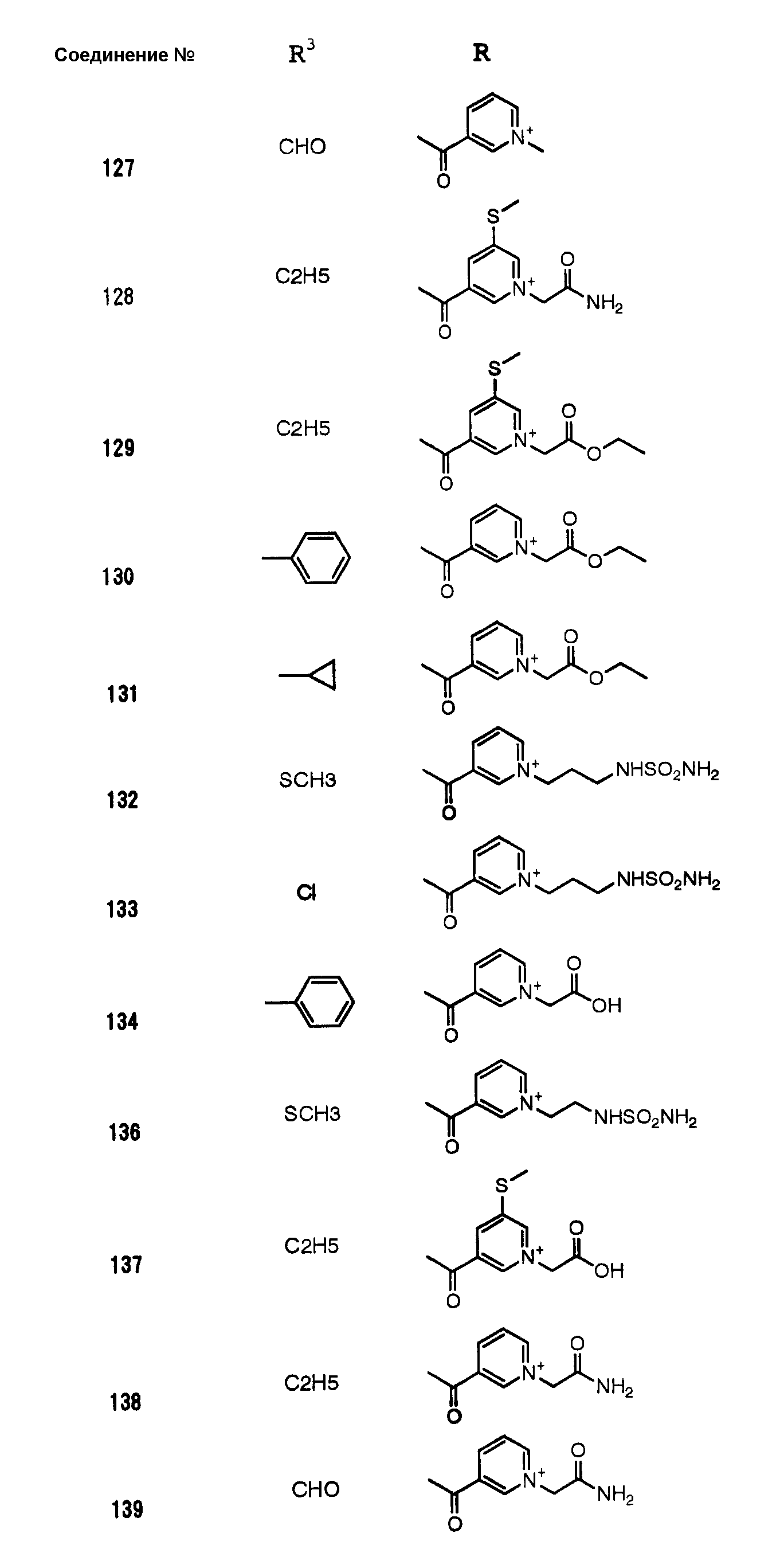
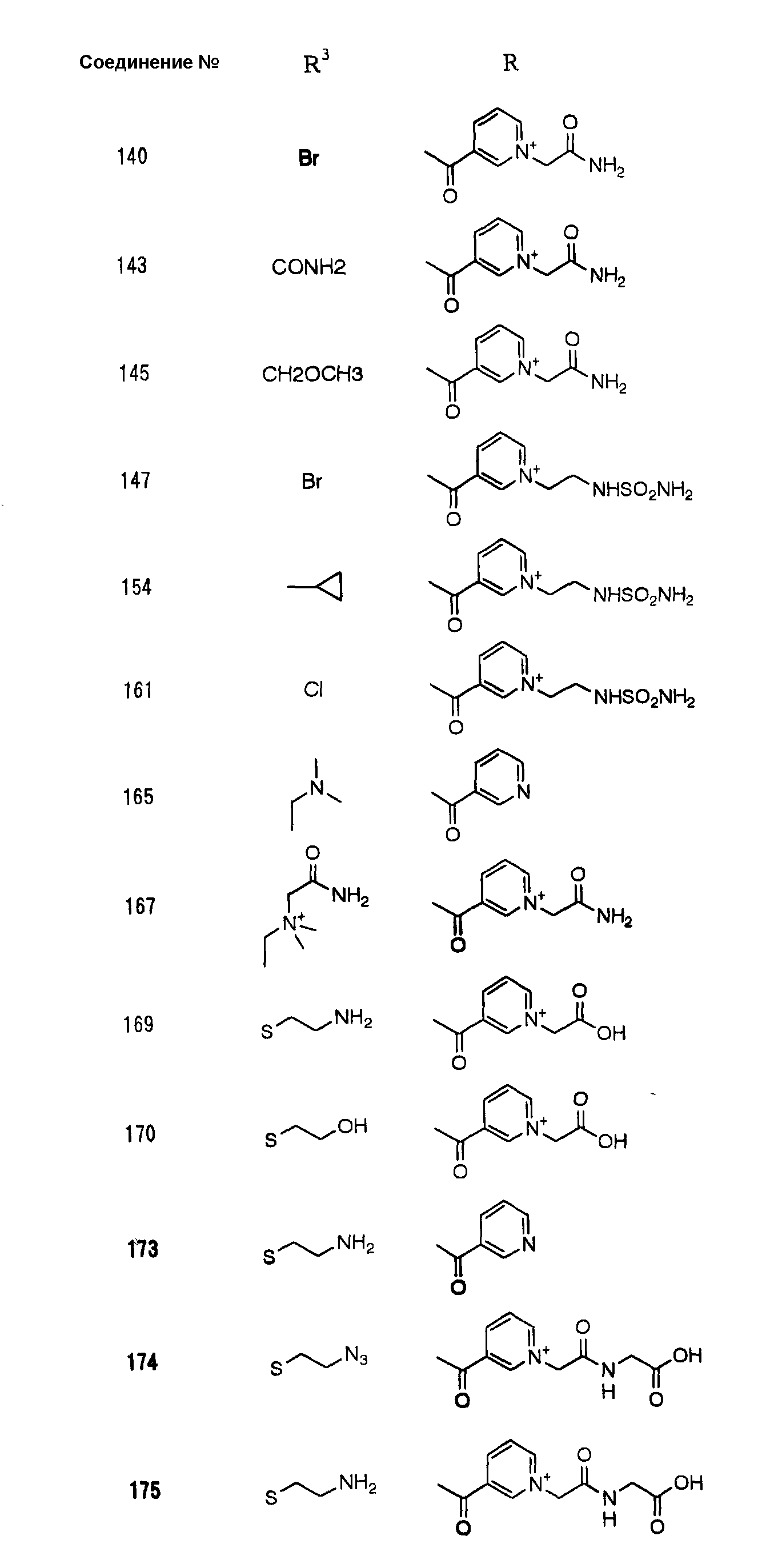
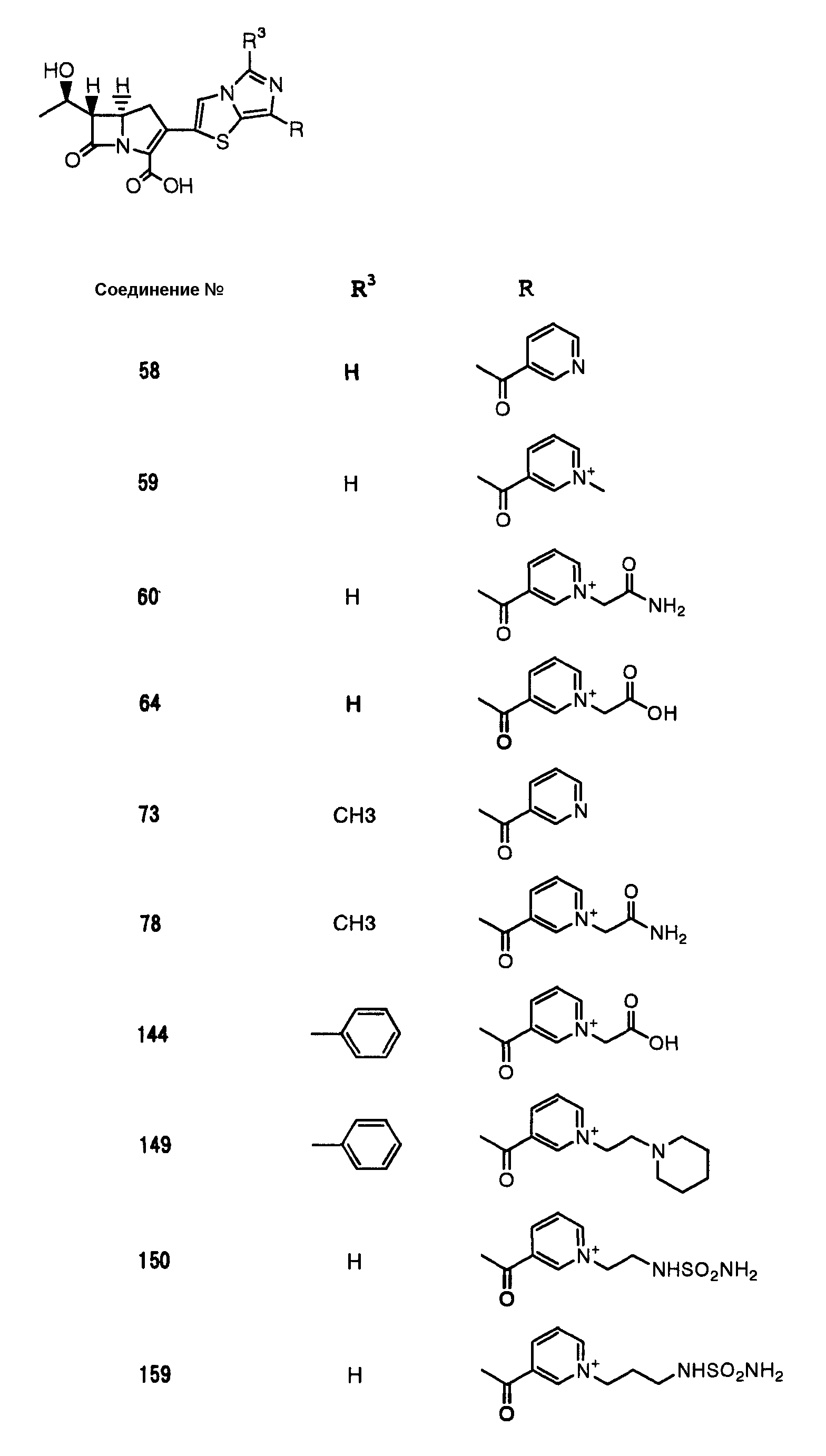
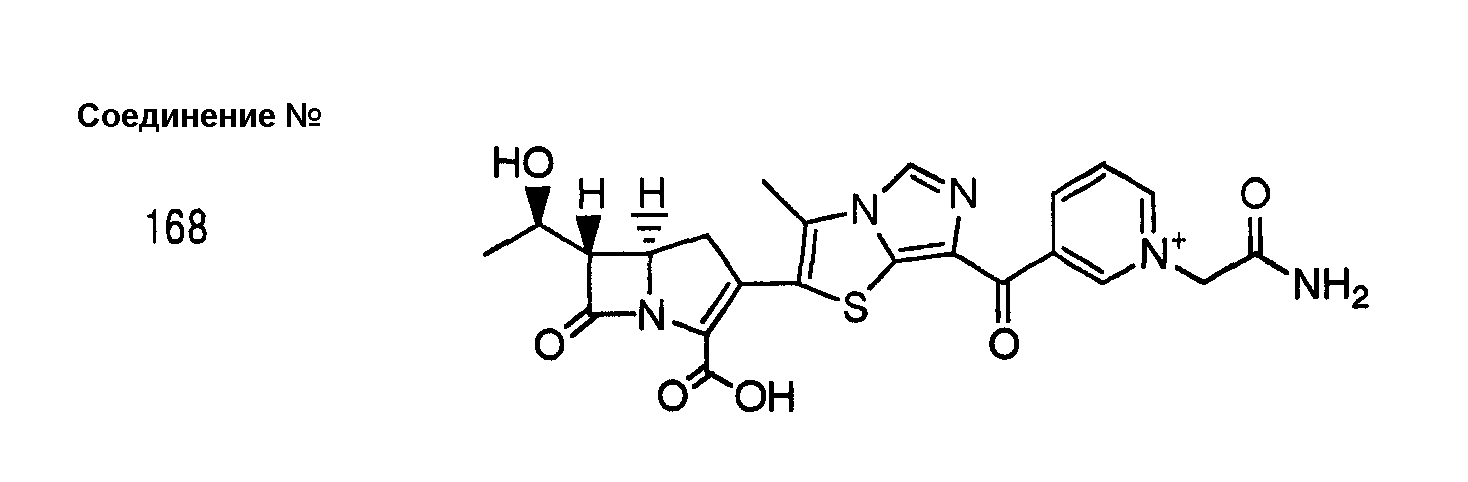
[Пример препарата 1] Препарат для инъекций
Для получения инъекционных растворов соединение примера 1 в асептических условиях распределяли по пузырькам в количестве 1000 мг (титр) на пузырек.
[Пример препарата 2] Мягкая капсула для ректального введения
Для получения мягких капсул для ректального введения соединение примера 1 в количестве 250 частей (титр) добавляли к однородной основе, состоящей из указанных выше ингредиентов, перемешивали с ней до однородного состояния и заполняли мягкие капсулы в количестве 250 мг (титр) на капсулу.
[Тестовый пример 1] Антибиотическая активность
Минимальные ингибирующие концентрации (MIC, мкг/мл) соединений, характерных среди новых производных карбапенема по настоящему изобретению, к различным патогенным микроорганизмам измеряли в соответствии со способом, описанным в CHEMOTHERAPY, vol. 16, No. 1, 99, 1968. Результаты представлены в таблице 1. Культуральной средой для измерения являлась Sensitivity Disk agar-N + 5% конской крови, а количество посевного материала составляло 106 КОЕ/мл.
Соединение A: (1S,5R,6S)-2-(7-ацетилимидазо[5, 1-b]тиазол-2-ил)-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение примера 134 в опубликованной международной заявке WO 98/32760)
Соединение B: (1S,5R, 6S)-2-(7-бензоилимидазо[5,1-b]тиазол-2-ил)-6-((1R)-1-гидроксиэтил)-1-метил-1-карбапен-2-ем-3-карбоксилат натрия (соединение примера 37 в опубликованной международной заявке WO 00/06581)
Соединение C: Имипенем
Производные карбапенема, которые являются соединениями, представленными формулами (I) и (II) по настоящему изобретению, обладают высокой антибиотической активностью в отношении различных патогенных микроорганизмов, включая MRSA, PRSP, вирус гриппа и продуцирующих β-лактамазу микроорганизмов.
Производные карбапенема, которые являются соединениями, представленными формулами (I) и (II) по настоящему изобретению, несомненно, превосходят соединения A и соединения B, которые являются предложенными в предыдущей заявке производными карбапенема, особенно, что касается антибиотической активности в отношении гиперрезистентного к действию метициллина штамма Staphylococcus aureus.
[Тестовый пример 2] Терапевтический эффект
Терапевтический эффект соединений, характерных среди новых производных карбапенема по настоящему изобретению, у инфицированных MRSA мышей, оценивали в соответствии со следующим способом, а результаты представлены в таблице 2. Конкретно, мышам (n=8) внутрибрюшинно вводили циклофосфамид (200 мг/кг), а спустя 4 суток после введения циклофосфамида мышей инфицировали MRSA путем внутрибрюшинного внесения Staphylococcus aureus MF126 (MRSA). Спустя два часа и четыре часа после инфицирования мышам подкожно вводили циластатин (1 мг/мышь) и соединение карбапенема в указанном количестве. ЭД50 рассчитывали на основе выживаемости на седьмой день после инфицирования (см. табл.2).
Производные карбапенема, которые являются соединениями, представленными формулами (I) и (II) по настоящему изобретению, обладали значительно лучшим терапевтическим эффектом in vivo по сравнению с ванкомицином, применяемым в качестве общепринятого терапевтичесткого средства в отношении MRSA.
[Тестовый пример 3] Тест на острую токсичность
Соединение примера 1 внутривенно вводили мышам (самцы линии ICR, каждая группа состояла из трех мышей) в количестве 2000 мг/кг. В результате все мыши выжили.
[Тестовый пример 4] Тест на острую токсичность
Соединение примера 2 внутривенно вводили мышам (самцы линии ICR, каждая группа состояла из трех мышей) в количестве 1000 мг/кг. В результате все мыши выжили.
Реферат
Настоящее изобретение относится к производным карбапенема, обладающих высокой антибиотической активностью в отношении метициллин-устойчивого Staphylococcus aureus (MRSA), пенициллин-устойчивого Streptococcus pneumoneae (PRSP), вируса гриппа и продуцирующих β-лактамазу микроорганизмов, и стабильных в отношении дегидропептидазы почек (DHP-1). Производные карбапенема по настоящему изобретению являются соединениями, представленными формулами (I) и (II), или их фармацевтически приемлемыми солями:
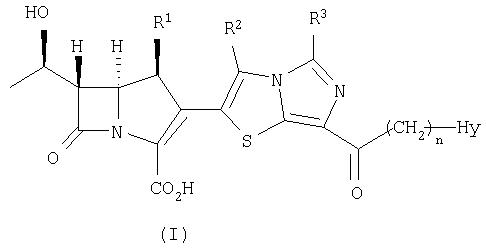
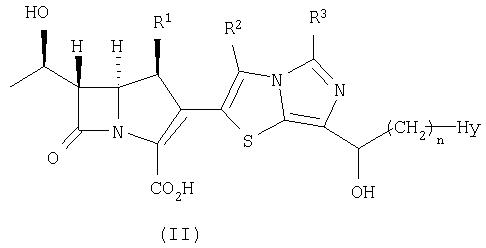
где R1 представляет собой атом водорода или метил, R2 и R3 каждый независимо представляет собой атом водорода; галоген; карбамоил; замещенный или незамещенный арил; замещенную или незамещенную алкилтиогруппу; или формил, n равно от 0 до 4, и Hy представляет собой 4-7-членную моноциклическую или 9-10-членную бициклическую насыщенную или ненасыщенную гетероциклическую группу, содержащую 1-4 гетероатома, выбранных из группы, состоящей из атомов азота и серы, причем Hy может быть необязательно замещена атомом галогена; замещенным или незамещенным низшим алкилом; (низший алкил)тиогруппой; (низший алкил)сульфонилом; карбоксилом; аминогруппой; арилом; или 6-членной моноциклической гетероциклической группой, содержащей один или несколько атомов азота. Также описан способ лечения и/или профилактики инфекционных заболеваний, обусловленных грамположительными и грамотрицательными бактериями, включающий стадию введения млекопитающим, включая людей, терапевтически и/или профилактически эффективного количества указанного производного карбапенема. 5 н. и 17 з.п. ф-лы, 2 табл.
Формула
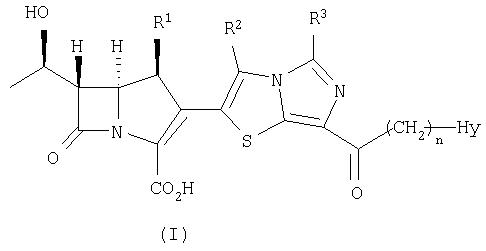
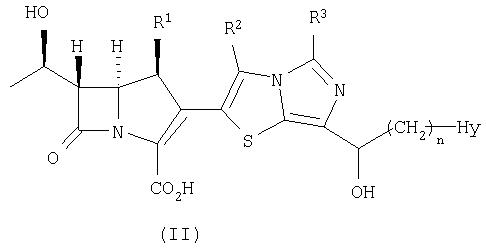

Комментарии