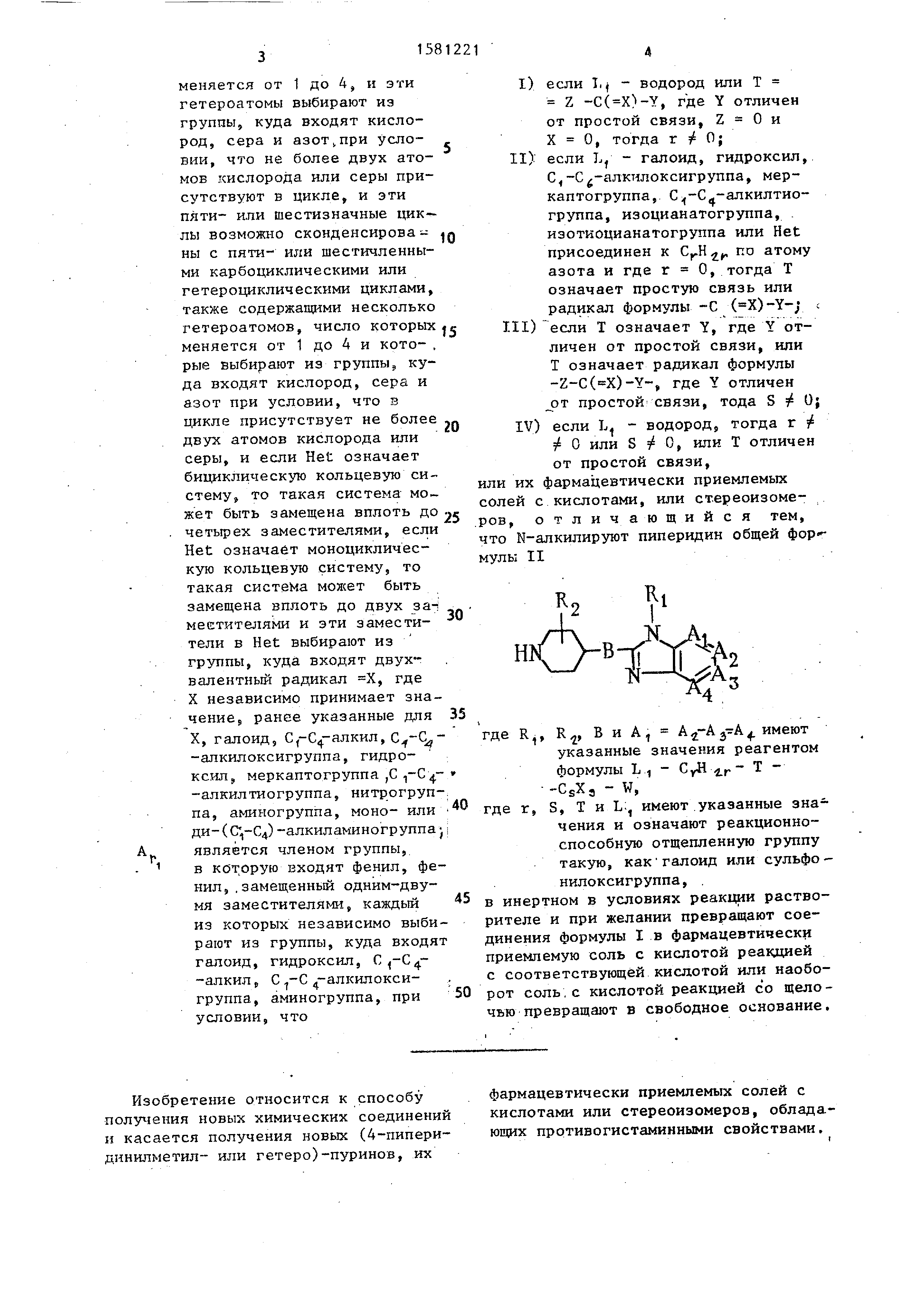
Изобретение относится к способу получения новых химических соединений
и касается получения новых (4-пипери- динилметил- или гетеро)-пуринов, их
фармацевтически приемлемых солей с кислотами или стереоизомеров, обладающих
противогистаминными свойствами.
Цель изобретения - синтез новых
пиперидинилпуринов по своим свойствам превосходящих структурный аналог, обладающий
аналогичными свойствами. (
Получение промежуточных соединений .
Пример 1. Смесь 3,7 ч. 2-пиридинметанамина, 4,1 ч. 4,6-ди«- хлорпиримидин-5-амина, 3,03 ч. N,N-
диэтилэтанамина и 150ч. воды перемешивают 8 ч при комнатной температуре.
После охлаждения смесь перемешивают в течение суток. Полученный продукт отфильтровывают, промывают водой и
высушивают в течение суток в вакууме при 80°С с получением 5,35 ч. (90,8%)
б-хлор-N - (4-фторфенил)метилJ-4,5- -пиримидиндиамин, т.пл. 244, (промежуточное
соединение 2); б-хлор-N - -(2-фуранилметил)-4,5-пиримидинди- амин, т.пл. 138,7°С (промежуточное
соединение 3); 6-хлор-Ы4-(2-тиенил- метил)-4,5-пиримидиндиамин, т.пл
10
15
20
порциями в атмосфере азота 9,86 ч. тетрагицроалюмината лития. Смесь перемешивают
6ч, после чего добавляют порциями дополнительно 10ч. тетра- гидроалюмината алюминия и перемешивание
продолжают 2 ч при комнатной температуре . Затем реакционную смесь
разлагают водой, слои разделяют, водную фазу экстрагируют тетрагидрофура-
ном, объединенные органические слои высушивают, фильтруют и испаряют. Остаток
перекристаллизовывают из ацето- нитрила. Полученный продукт отфильтровывают и высушивают с получением
18 ч. (63,5%) Nг-Г(4-фторфенил)-метил J-4 ,5-пиримидиндиамина (промежуточное соединение 12).
Применяя приведенную методику и используя эквивалентные количества
исходных соединений также получают следующее соединения: К-(4-амино-6-
-гидрокси-5-пиримидинил)-4-фторбенз- амид (промежуточное соединение 13)
165,5°С (промежуточное соединение 4); 25 и 6-амино-5-{(4-фторфенил)-метил} б-хлор-N -С(5-метил-2-фуранил)метилJ- аминоj-4-пиримидинол (промежуточное
-4,5-пиримидиндиамин (промежуточное соединение 5); б-хлор-N -(2-пирази-
нилметил)-4,5-пиримидиндиамин (промежуточное соединение 6); 6-хлор-К -
- ( 4 - тиа з ол или е тил) -4,5 -пиримидиндиамин, т.пл. 145,5°С (промежуточное соединение
7); б-хлор-N - (4-метоксифенил) метилJ-4,5-пиримидиндиамин, т.пл.
183,5°С (промежуточное соединение 8) и (Х4-фторфенил)метилJ-6-метил-
-4,5-пиримидиндиамин (промежуточное соединение 9).
Аналогичным способом получен также б-хлор-N4- С(2,4-диметилфенил)ме-
тилJ-4,5-пиримидиндиамин (промежуточное соединение 10).
Пример 2. К перемешиваемой смеси 20,2 ч, 4,5-пиримидиндиамяна, 40 ч. пиридина , и 144 ч. NjN-диме-
тилформамида прибавляют по каплям при Ю°С раствор 24,2 ч. 4-фторбензоил-
хлорида в 36 ч. К,К-диметилформамида. После окончания прикапывания перемесоединение 14).
Пример 3. Смесь 62,2 ч. 6- -хлор-N -(2-пиридинилметил)-4,5-пири30
мидиндиамина, 3 ч. 4%-ного раствора
тиофена в метаноле, 20 ч. окиси каль-
- ция и 400 ч. воды гидрируют при нормальном давлении и 50°С в присутствии
в качестве катализатора 5ч. 10% пал , ладия на угле. После поглощения paci-
считанного количества водорода, катализатор отфильтровывают, а фильтрат
испаряют с получением 63,5 ч. (100%) в остатке N -(2-пиридинилметил)-4,5дд
-пиримидиндиамина (промежуточное соединение 15).
Аналогичным способом также получают промежуточные соединения: (4-
-фторфенил) -метил J-U, 5-пиримидинди-- 45 амин в виде остатка (16); (2-фура-
нилметил)-4,5-пиримидиндиамин, т.пл. 116,4°С (17); К4--(2-тиенилметил)-4,5-
-пиримидиндиамин (18); N4- (5-метил- -2-фуранил)метил }-4,5-пиримидиндиами:;
шивание продолжают 30 мин при комнат- 50 (19); N -(2-пиразинилметил)-4,5-пири- ной температуре, после чего добавляют мидиндиамин в виде остатка (20);
(4-метоксифенил)метил -пиримидиндиамин (21) nN -(4-тиазолилметил)600 ч. воды. Образовавшийся продукт отфильтровывают и высушивают с получением 30 ч. (70%) К-(4-амино-5-пи-
римидинил)-4-фторбензамида (промежуточное соединение 11).
К перемешиваемой смеси 30 ч. N-(4- -амино-5-пиримидинил)-4-фторбензамида
и 360 ч. тетрагидрофурана добавляют
-4,5-пиримидиндиамин (22); N4-(2,4-
,, -диметилфенил)-метил }-4,5-пиримидиндиамин (промежуточное соединение 23).
Пример 4. Смесь 8,72 ч. N - - (4-фторфенил)метил }-4, 5-пиримидиндиамина , 63 ч. сероуглерода и 45 ч.
0
5
0
порциями в атмосфере азота 9,86 ч. тетрагицроалюмината лития. Смесь перемешивают
6ч, после чего добавляют порциями дополнительно 10ч. тетра- гидроалюмината алюминия и перемешивание
продолжают 2 ч при комнатной температуре . Затем реакционную смесь
разлагают водой, слои разделяют, водную фазу экстрагируют тетрагидрофура-
ном, объединенные органические слои высушивают, фильтруют и испаряют. Остаток
перекристаллизовывают из ацето- нитрила. Полученный продукт отфильтровывают и высушивают с получением
18 ч. (63,5%) Nг-Г(4-фторфенил)-метил J-4 ,5-пиримидиндиамина (промежуточное соединение 12).
Применяя приведенную методику и используя эквивалентные количества
исходных соединений также получают следующее соединения: К-(4-амино-6-
-гидрокси-5-пиримидинил)-4-фторбенз- амид (промежуточное соединение 13)
5 и 6-амино-5-{(4-фторфенил)-метил} аминоj-4-пиримидинол (промежуточное
соединение 14).
Пример 3. Смесь 62,2 ч. 6-
-хлор-N -(2-пиридинилметил)-4,5-пиримидиндиамина , 3 ч. 4%-ного раствора
тиофена в метаноле, 20 ч. окиси каль- ция и 400 ч. воды гидрируют при нормальном
давлении и 50°С в присутствии в качестве катализатора 5ч. 10% палладия
на угле. После поглощения paci- считанного количества водорода, катализатор
отфильтровывают, а фильтрат испаряют с получением 63,5 ч. (100%)
в остатке N -(2-пиридинилметил)-4,5-пиримидиндиамина (промежуточное соединение 15).
Аналогичным способом также получают промежуточные соединения: (4-
-фторфенил) -метил J-U, 5-пиримидинди-- амин в виде остатка (16); (2-фура-
нилметил)-4,5-пиримидиндиамин, т.пл. 116,4°С (17); К4--(2-тиенилметил)-4,5-
-пиримидиндиамин (18); N4- (5-метил- -2-фуранил)метил }-4,5-пиримидиндиами:;
- (4-метоксифенил)метил -пиримидиндиамин (21) nN -(4-тиазолилметил)-4
,5-пиримидиндиамин (22); N4-(2,4- -диметилфенил)-метил }-4,5-пиримидиндиамин
(промежуточное соединение 23). Пример 4. Смесь 8,72 ч. N -
- (4-фторфенил)метил }-4, 5-пиримидиндиамина , 63 ч. сероуглерода и 45 ч.
М,1Я-диметилформамида перемешивают i 3 ч при температуре кипения. После
охлаждения реакционную смесь переносят в воду. Выпавший в осадок продукт
отфильтровывают и высушивают с получением 10,1 ч. (78,9%) 9-С(4-фторфе-
нил)метил3 9Н-пурин-8-тиола (промежуточное соединение 24).
К перемешиваемой смеси 4,6 ч. гид- роокиси калия и 200 ч. воды добавляют
порциями 1,7 ч. йодметана, после чего прибавляют по каплям 3,8 ч. 9-(4-фторфенил )-метил -9и-пурин-8-тиола.
i
После завершения прикапывания смесь
перемешивают 2 ч при комнатной температуре . Выпавший осадок отфильтровывают и высушивают с получением ч.
(73,9%) 9- С(4-фторфенил) метил -8-ме- тилтио-9Н-пурина, т.пл. 167,1°С (промежуточное
соединение 25).
Пример 5. Смесь 26 ч. метилового эфира 3-метил-4-оксо-1-пипери-
динкарбоновой кислоты, 16,5 ч. бенэ- метанамина, 2 ч. 4%-ного раствора
тиофена в этаноле и 200 ч. метанола гидрируют при нормальном давлении и
комнатной температуре в присутствии в качестве катализатора Зч. 10% палладия
на угле. После поглощения рас- считанного количества водорода ката- лизатор отфильтровывают, а фильтрат
испаряют досуха с получением 40,2 ч. метилового эфира З-метил-4-(фенил-
метил) амино J-1-пиперидинкарбоновой кислоты в виде остатка (промежуточное соединение 26).
Смесь метилового эфира З-метил-4- - (фенилметил)амино -1-пиперидинкар-
боновой кислоты (40 ч.) и 160 ч. мета нола гидрируют при нормальном давлении
и комнатной температуре в присутствии в качестве катализатора 10%
палладия на угле (2 ч.). После поглощения рассчитанного количества водо-
рода катализатор отфильтровывают, фильтрат испаряют досуха. Остаток перегоняют
(т.кип. 80°С при 0,1 мм Hg). Дистиллат подвергают дальнейшей очистке с помощью газовой хроматографии
(215°С 10 фунтов/дюйм2 0,7 ати с получением 8,6 ч. метилового эфира 4-
-амино-З-метил-1-пиперидинкарбоновой кислоты (промежуточное соединение 27)
К перемешиваемой и охлаждаемой (-10°С) смеси 138,6 ч. сероуглерода,
113,8 ч. N,N -метантетраилбис (цикло- гексанамина) и 450 ч. тетрагидрофуран
прибавляют при той же температуре по
-
$
5
каплям 106 ч. метилового эфира 4-ами-
но-З-метил-1-пиперидинкарбоновой кислоты . Затем реакционную смесь доводят
до комнатной температуры, при которой перемешивают 1 ч. Смесь испаряют и
остаток перемешивают в 2,2 -оксибис- пропане. Выпавший осадок отфильтровывают
и фильтрат испаряют с получением 141,1 ч. (100%) метилового эфира цис-
-4-изотиоцианато-3-метил-1-пиперидин- карбоновой кислоты (промежуточное соединение 28) .
Применяя ту же методику и используя эквивалентные количества соответствующих
исходных продуктов получают также следующие промежуточные соединения: (цис- +транс-)-метиловый эфир
4-амино-З-метил-1-пиперидинкарбоновой кислоты, т.кип. 136 - 140°С (водоструйный
насос) (29) и метиловый эфир (цис-+ транс-)-4-изотиоцианато- -3-метил-1-пиперидинкарбоновой кислоты
(30) в виде остатка.
4 П р и м е р 6. Смесь 42,5 ч.
N -(2-фуранилметил)-4,5-пиримидинди- амина, 50,5 ч. этилового эфира 4-изо-
тиоцианато-1-пиперидинкарбоновой кислоты и 630 ч. тетрагидрофурана перемешивают
48 ч при температуре кипения смеси. После охлаждения полученный продукт отфильтровывают, промывают
тетрагидрофураном и 1,1 -оксибисэта- ном и высушивают с получением 86,4 ч.
(96,2%) этилового эфира 4-Ј((2- -фуранилметил)аминоJ-5-пиримидинил
амино)тиооксометил амино V-1-пиперидинкарбоновой кислоты (промежуточное соединение 31).
Аналогичным способом получают следующие соединения (табл. 1).
Аналогичным способом также получают следующие промежуточные соединения;
N-(4-амино-6-гидрокси-5-пиримидинил)- -N- (4-фторфенил)метил}-К -(фенил-
метил) -4 -пиперидинил иомочевина, т.пл. 192,9°С (А2); этиловый эфир 4-
(( (4-амино-6-гидрокси-5-пиримиди- нил)(4-фторфенил)метил амино гио оксо-
метил -амино)-1-пиперидинилкарбоновой кислоты (43); этиловый эфир 4-(4-
- { (2,4-диметилфенил)метил амино}-5- -пиримидинил)аминотиооксометил}амино J-
-1-пиперидинкарбоновой кислоты (44).
Пример 7. Смесь 52,4 ч.
хлоргидрата 1-(фенилметил)-4-пипери- динуксусной кислоты, 38,7 ч. (4-
-фторфенил)метил -4,5-пиримидиндиами- на и 765 ч. хлористого фосфорила пе
ремешивают 30 мин при температуре кипения смеси. Затем реакционную
смесь испаряют, а остаток разлагают ледяной водой. Полученный продукт после
обработки гидроокисью натрия экстрагируют дихлорметаном. Экстракт проминают водой, сушат, фильтруют и
испаряют. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси
трихлорметана с метанолом, насыщенной аммиаком (95:5 по объему). Чистые фракции собирают и элюент испаряют
. Остаток кристаллизуют из ацето- нитрила. Полученный продукт отфильтровывают и сушат с получением 37 ч.
(61%) N-(4-J(4-фторфенил)метилJaMH- но}-5-пиримидинил)-1-(фенилметил)-4-
-пиперидинацетамида, т.пл. 157,3°С (промежуточное соединение 45).
Пример 8. К перемешиваемой смеси 14,2 ч. изоцианатаэтана, 29,2 ч азида натрия и 135 ч. сухого тетраги
дрофурана добавляют раствор 39 ч. хлористого алюминия в 225 ч. сухого
тетрагидрофурана. Полученную смесь перемешивают в течение суток при кипячении
. Затем реакционную смесь охлаждают и подкисляют 6 н.раствором
соляной кислоты. Полученную смесь испаряют досуха и полученный продукт
экстрагируют четыре раза 2-пропано- ном. Объединенные экстракты сушат в течение суток с получением 18 ч.
(65%) 1-этил-1,4-дигидро-5Н-тетразол -5-она (промежуточное соединение 46)
К перемешиваемому раствору 109 ч. 1,2-дибромэтана и 21,2 ч. карбоната
натрия в 5 ч. воды и 18 ч. Ы,М-диме- тилформамида добавляют по каплям при
мерно при 40°С раствор 22,5 ч. 1-этил-1,4-дигидро-5Н-тетразол-5-она
в 5 ч. воды и 27 ч. NjN-диметилформ- амида. После завершения прикапывания
смесь перемешивают в течение суток при 40°С. Затем органическую фазу
отделяют, сушат и перегоняют с получением 9,8 ч. (22%) 1-(2-бромэтил)-
-4-ЭТИЛ-1,4-дигидро-5Н-тетразол-5- -она, т.кип. 110 С при 0,1 мм Hg (промежуточное соединение 47).
Пример 9. Смесь 50 ч. 2-ти азоламина, 76 ч. 3-ацетил-4,5-дигидро-2
(ЗН)-фуранона, 1,2ч. концентрированной соляной кислоты и 270 ч. ме- тилбензола перемешивают с кипячением
2 ч. ,используя ловушку для воды. Реакционную смесь охлаждают и при тем0
,
0
5
0
5
0
5
0
5
пературе между 20 и прибавляют 340 ч. хлористого фосфорила. Полученную смесь медленно нагревают до 100-
11 0°С, после чего перемешивают 2 ч при той же температуре. Реакционную
смесь испаряют, а остаток переносят в смесь размельченного льда и гидроокиси аммония. Полученный продукт
экстрагируют трихлорметаном. Экстракт сушат, фильтруют и испаряют. Остаток
очищают колоночной хроматографией на силикагеле с использованием для вымывания
смеси трихлорметана с метанолом (95:5 по объему). Чистые фракции собирают и элюент испаряют. Остаток
кристаллизуют из смеси 2-пропанола и . 1,1 -оксибисэтана с получением 36 ч.
6-(2-хлорэтил)-7-метил-5Н-тиазоло (3,2-а)-пиримидин-5-она (промежуточное соединение 48).
Пример 10. Смесь 20,65 ч. 1-(фенилметил)-4-пиперидинуксусной
кислоты в виде хлоргидрата, 19,5 ч. б-хлор-N4- С(4-фторфенил)-метил J-4,5-
-пиримидиндиамина и 510 ч. хлористого фосфорила перемешивают с кипячением
13 ч. Затем реакционную смесь испаряют , остаток переносят в ледяную воду
и обрабатывают гидроокисью натрия.
Полученный продукт экстрагируют 4-ме-
тил-2-пентаноном. Экстракт промывают водой, сушат, фильтруют и испаряют.
Остаток очищают колоночной хроматографией на силикагеле с использованием
для вымывания насыщенной аммиаком смеси трихлорметана и метанола (97:3
по объему). Собирают первую фракцию и элюент испаряют с получением
23,6 ч. (75%) 6-хлор-9-(4-фторфенил) метил J-8- 1-(фенилметил)-4-пиперид и
нил метил -9Ч-пурина в виде маслянистого остатка (промежуточное соединение 49).
Аналогичным способом также получают следующие промежуточные соединения:
6-хлор-7- (4-фторфенил)метил J-8- 0(фенилметил)-4-пиперидинил ме-
тил |-7Н-пурин (50); 9-(4-фторфенил) метил -6-метил-8- 1-(фенилметил)-4-
-пиперидинил метил -9Н-пурин в виде маслянистого остатка (51).
Пример 11. Смесь 36 ч. К- -(4- {(4-фторфенил)метил амино}-5-пи-
римидинил)-1-(фенилметил)-4-пиперидин- ацетамида и 935 ч. хлористого фосфорила
перемешивают с кипячением 8 ч. После охлаждения реакционную смесь испаряют. Остаток разлагают ледяной
водой и обрабатывают раствором гидро
окиси натрия. Полученный продукт экстрагируют 4-метил-2-пентаноном. Экстракт
сушат, фильтруют и испаряют. Остаток очищают колоночной хроматографией на силикагеле с использованием
для вымывания насыщенной аммиаком смеси трихлорметана с метанолом (97:3 по объему). Чистые фракции собирают
и элюент испаряют. Остаток перемешивают в 2,2 -оксибиспропане. Полученный продукт отфильтровывают и кри -
сталлизуют из ацетонитрила. После фильтрования и высушивания получают 10,6ч. (30,4%) 9-(4-фторфенил)метил
J- 8 - { 1 - ( фенилме тил ) -4 -пип ери д и- нил метил }-9Н-пурина, т.пл. 136,4°С
(промежуточное соединение 52).
Пример 12. Смесь 12,6 ч.
1-(фенилметил)-4-пиперидинола, 3,2 ч. 50%-ной дисперсии гидрида натрия и.
200 ч. К,М-диметилацетамида перемешивают 1 ч при комнатной температуре.
Затем порциями прибавляют 18 ч. 9- С(4-фторфенил)метил }-8-(метилтио)-
-9Н-пурина и перемешивание продолжают 4 ч при комнатной температуре. Реак-
ционную смесь переносят в воду, продукт отфильтровывают и переносят в
трихлорметан. Органический слой промывают водой и фильтруют через диато
мовую землю. Фильтрат сушат, фильтруют и испаряют. После кристаллизации
из ацетонитрила продукт фильтруют и сушат с получением 16,75 ч. (61,1%)
9-С(4-фторфенил)метил -8- 0-(фенил- метил) -4-пиперидинил JOKCH 9Н--пурина,
т.пл. 117°С (промежуточное соединение 53) .
Пример 13. К перемешиваемо
смеси 13 ч. 9-С(4-фторфенил)метилJ- -9Н-пурин-8-тиола и 300 ч. воды прибавляют
2 ч. гидроокиси натрия. Полученную реакционную смесь фильтруют через диатомовую землю. После испаре
ния остаток переносят в метилбенаол и растворитель снова испаряют (эту
операцию повторяют дважды). Остаток переносят в 27С ч. М -диметилацет-
амида, после чего прибавляют 19,3 ч. 1- (4-метилфенилсульфонил J-4-пипери-
динол в виде метансульфоната (сложный эфир). Смесь перемешивают 2 сут-
при 60°С, после чего реакционную смесь переносят в воду и продукт экстрагируют 4-метил-2-пентаноном.
Экстракт промывают водой, сушат, фильтруют и испаряют с получением 27 ч. (100%) 4-(9-1(4-фторфенил)ме
5
JQ 5 -Q .
тил -9Н-пурин-8-ил тио)-1- -метил- фенил) сульфонил гиперидина (промежуточное соединение 54),I
Пример 14. Смесь 4 ч, этилового эфира 4-({4-(2-феранилме-
тил)-амино -5-пигимидинил}амино)тио- оксометил амино}-1-пиперидинкарбоно-
вой кислоты, 6 ч. окиси ртути (II) и 80 ч. этанола перемешивают 2 ч при
температуре кипения. Полученную смесь фильтруют в горячем состоянии через
НуЈ1о®и фильтрат испаряют. Остаток кристаллизуют из смеси ацетонитрила
с этанолом. Продукт фильтруют и сушат с получением 0,8 ч. (21,5%) этилового
эфира 4- {С9-(2-фуранилметил) -9Н-пурин-8-ил амино -1 -пиперидинкар-
боновой кислоты, т.пл. 171,9°С (промежуточное соединение 55).
Применяя ту же методику и используя эквивалентные количества соответ--
ствующих исходных соединений получают также этиловый эфир 4-( 9-Ј(4-фторфенил
) метил }-9Н-пурин-8-ил -амино)-}- -пиперидинкарбоновой кислоты, т.пл.
174,5°С (промежуточное соединение 5б5 .
Пример 15. Смесь 24 ч. 4-
-(4- (фенилметил)аминоJ-5-пирими- динилj-амино )тиооксометилДамино }-1
-пиперидинкарбоновой кислоты в виде этилового эфира, 24 ч. окиси ртути
(II) и 240 ч. метанола, насыщенного аммиаком, перемешивают сутки при температуре
кипения. Затем реакционную смесь фильтруют в горячем состоянии и испаряют. Остаток переносят в смесь
трихлорметана с этанолом. После про- ; мывания водой органический слой испаряют
и остаток кристаллизуют из ацетонитрила. Продукт фильтруют и сушат с получением 20,3 ч. (92,1%)
этилового эфира (фенилметил)- -9H-nypHH-8-nriJaMHHo j-1 -пиперидинкарбоновой
кислоты, т.пл, 156,9°С (промежуточное соединение 57).
Аналогичным способом получают следующие промежуточные соединения: этиловый эфир (2-тиенилметил)-9Н-
-пурин-8-илЗ-амино J-1-пиперидинкарбоновой кислоты (58) в виде остатка;
этиловый эфир 4-ЈЈ9-(2-пиридинилме- тил)-9Н-пурин-8-ил анино -1-пиперидин-
карбоновой кислоты (59); этиловый эфир 4-(Ј9- (5-метил-2-фуранил)метил
-9Н-пурин-8-ил }амино)-1-пиперидинкарбоновой кислоты в виде остатка (6C)j
этиловый эфир (2-пираэинилме-. i тил)-9Н-пурин-8-ил }-амино }-1-пиперидинкарбоновой кислоты в виде остатка (61); этиловый эфир 4-Ј(9-метил-9Н- -пурин-8-ил)амино |-1-пиперидинкарбо-
новой кислоты, т.пл. 169,6°С (62); этиловый эфир 4-(9- С(4-метоксифенил)
метил }-9Н-пурин-8-ил}амино)- -пипе- ридинкарбоновой кислоты, т.пл. 168,1° С
(63); N- С1-(фенилметил)-4-пиперидинил -9Н-пурин-8-амин, т.пл. 276,1°С (64).
Пример 16. Смесь 15,7 ч. этилового эфира 4- ( { С4-(циклопропил- амино)-5-пиримидинш амино|тиооксоме-
тил )аминоJ-1-пиперидинкарбоновой кислоты , 20. ч. окиси ртути (II), 40 ч.
этанола и 135 ч. М,М-диметилацетамида перемешивают сутки при 80 С. Полученную
реакционную смесь фильтруют в горячем состоянии через диатомовую землю. Фильтрат переносят в воду и
продукт экстрагируют дихлорметаном. Органический слой сушат, фильтруют
и испаряют. Остаток кристаллизуют из ацетонитрила. Продукт фильтруют и сушат
с получением 2,2 ч. (14,1%) эти- левого эфира 4-(9-циклопропил-9Н-пу-
рин-8-ил)амино -1-пиперидинкарбоновой кислоты, т.пл. 177°С (промежуточное соединение 65).
Аналогичным способом получают так- же этиловый эфир 4-fЈ9-(4-тиазолилме-
тил)-9Н-пурин-8-ил}амино J-1-пиперидинкарбоновой кислоты (промежуточное соединение 66) .
Пример 17. Смесь 13 ч. метилового эфира цис-4-(Ј(4- (4-фторфе-
нил) метилЗамино)-5-пиримидинил )аминоЗ тиооксометил амино )-3-метил-1 -пиперидинкарбоновой
кислоты, 13ч. окиси ртути (II), 0,1 ч. серы и 160 ч. метанола , насыщенного аммиаком, перемешива-
юг 0,5 ч при температуре кипения. Пот лученную реакционную смесь фильтруют
в горячем состоянии через диатомовую землю и фильтрат испаряют. Остаток
переносят в воду и продукт экстраги- руют трихлорметаном. Экстракт промывают
водой, сушат, фильтруют и испаряют . Остаток осаждают 1,1 -оксибис- этаном. Продукт фильтруют и сушат
с получением 7 ч. (58,5%) метилово- го эфира цис-4-(9-С(4-фторфенил)
метил -9Н-пурин-8-ил у-амино)-3-метил- -1-пиперидинкарбоновой кислоты, т.пл.
152, (промежуточное соединение 67) .
Аналогичным способом получают также
следующие промежуточные соединения: 7- (4-фторфенил)метил J-N- 1-(фе-
нилметил)-4-пиперидинил -7Н-пурин-8-амин , т.пл-. 251, 1°С (68); метиловый
эфир (цис- + транс-)-4-(Ј-9-(4-фтор- фенил)метил }-9Н-пурин-8-ил амино)-3-
-метил-1-пиперидинкарбоновой кислоты (69); этиловый эфир 4-(f9- С(2,4-ди-
метилфенил)метил}-9Н-пурин-8-ил}-амино )- -пиперидинкарбоновой кислоты
(70); этиловый эфир 4-({9- С(4-фт6 р- фенил)метил }-9Н пурин-8-ил }метилами-
но)-1-пиперидинкарбоновой кислоты (71).
Пример 18. Смесь 88,8 ч.
этилового эфира 4-((4-амино-6-гид- рокси-5-пиримидинил)(4-фторфенил)
метллДамино}тиооксометилуамино)- -пиперидинкарбоновой кислоты, 88 ч. окиси
ртути (II), 0,1 ч. серы и 1200 ч. этанола перемешивают сутки при теп-
пературе кипения. Полученную реакционную смесь фильтруют в горячем состоянии
через диатомовую землю и фильтрат испаряют. Остаток очищают колоночной хроматографией на силикагеле
с использованием для вытеснения насыщенной аммиаком смеси трихлормета-
на с метанолом (95:5 по объему). Чистые фракции собирают и элюент испаряют
. Остаток кристаллизуют из этил- ацетата. Полученный продукт отфильтровывают
и сушат с получением 50,7 ч. (66,1%) этилового эфира 4-(7-амино-
-1- (4-фторфенил)метил J-оксазоло }5,4- - пиримидин-2(1Н) -илиден JaMHHo)-1 -пиперидинкарбоновой
кислоты, т.пл. 174,6°С (промежуточное соединение 72) .
Смесь 50,7 ч. этилового эфира 4- -(7-амино-1- (4-фторфенил)метилJOK-
сазоло 5,4-d пиримидин-2-(1Н)илиденJ- амино J-1-пиперидинкарбоновой кислоты
и 3050 ч. хлористого фосфора перемешивают 90 мин при температуре кипения
. Полученную реакционную смесь испаряют , остаток переносят в ледяную
воду. Полученную смесь обрабатывают гидроокисью аммония. Продукт экстрагируют
4-метил-2-пентаноном. Экстракт промывают водой, сушат, фильтруют и
испаряют. Остаток очищают колоночной хроматографией на силикагеле с использованием
для вымывания насыщенной аммиаком смеси трихлорметана с метанолом (95:5 по объему). Чистые фракции
собирают и элюент испаряют. Остаток кристаллизуют из ацетонитрила. Продук
фильтруют и сушат с получением 21,6ч.
(41,5%) этилового эфира 4-({б-хлор-
-7- С(4-фторфен л)метил -7Н-пурин-8- -ил )амино)-1-пиперидинкарбоновой кис
лоты, т.пл. 126,6°С (промежуточное соединение 73).
Применяя ту же методику и используя эквивалентные количества соответствующих исходных продуктов, получают
также следующие промежуточные соеди нения: 1- (4-фторфенил)метил J-2, гидро-2 С1-(фенилметил)4-пипериди-
нш имино}оксазоло 5,4-с1 }пирнмидин-4-амин , т.пл. 178, (74); 6-хлор-7-
- С(4 фтор-фенил)метилJ-N- fl -(фенилме- тил)-4-пиперидинил }-7Н-пурин-8-амин, т.пл, 248,6°С (75).
Пример 19. Смесь 16ч. 6- -хлор-7- (4-фторфенил)метилД-8-
-(фенилметил)-4-пиперидинил метил }- -7Н-пурина, 4,65 ч. этилхлорформата
и 180 ч. метилбенэола перемешивают 2 ч при температуре кипения. После
охлаждения реакционную смесь обрабатывают гидроокисью аммония и продукт
экстрагируют этил бензолом. Экстракт промывают водой, сушат, фильтруют и
испаряют с получением 18,7 ч. (100%) этилового эфира 4-f6-хлор-7- -фтор-
фенил) метил }-7Н-пурин-8-ил}-1 пип ери- динкарбоновой кислоты в виде остатка
(промежуточное соединение 76).
Аналогичным способом получают также
следующие промежуточные соединения: этиловьй эфир 4-({9- 4-фторфенил)метил}
-б-метил-ЭН-пурин-З-ил метил) -1 -пипе- ридинкарбоновой кислоты (промежуточное
соединение 77); этиловый эфир 4-(f6- -хлор-9- С(4-фторфенил)метил -9Н-пу-
рин-8-ил у-метил)-1-пиперидинкзрбоно- вой кислоты в виде остатка (промежуточное соединение 78).
Пример 20. Смесь 24,8 ч.
40
45
4-(9- (4-фторфенил) метил J-9H-nypHH
-8-ил 1 тио) -1 - Ј(4-метилфенил) сульфо- нил пиперидина и 300 ч. уксусной кислоты
, насыщенной бромистым водородом перемешивают сутки при комнатной температуре
. После испарения остаток переносят з воду. Полученную смесь обрабатывают раствором гидроокиси натрия
и экстрагируют дихлорметаном. Экстракт подкисляют соляной кислотой и экстрагируют водой. Водный слой об-
рабатывают раствором гидроокиси натрия и продукт экстрагируют дихлорметаном
. Экстракт промывают водой, сушат , фильтруют и испаряют. Остаток
очищают колоночной хроматографией на 55 силикагеле с использованием для вымывания
сначала- смеси трихлорметана с метанолом (95:5 по объему), затем
5
-
.
5
№
iv
35 „
0
40
45
55 смеси трихлорметана с метанолом, насыщенной
аммиаком (90:1 0 по объему). Чистые фракции собирают и элюент испаряют . Остаток кристаллизуют из аце-
тонитрила. Продукт отфильтровывают и сушат с получением 3 ч. (17,4%) 9-
-(4-фторфенил)метил J-8-(4-пипериди- нилтио)-9Н-пурина, т.пл. 113,5еС (промежуточное соединение 79).
Аналогичным способом получают также 9-(X4-фторфенил)метил Т-8-(4-
-пиперидинсульфонил)-9Н-пурин (промежуточное соединение 80).
Пример 21. Смесь 60,5 ч. этилового эфира (2-фуранилме- тил)9Н-пурин-8-ил амино}-1-пипери-
динкарбоновой кислоты, 90 ч. гидроокиси калия, 800 ч. 2-пропанола и
20 ч. воды перемешивают 48 ч при тем пературе кипения. Затем реакционную
смесь испаряют, остаток переносят в воду при перемешивании. Продукт отфильтровывают
и сушат с получением первой фракции 36,2 ч 9-(2-фуранил- метил)-М-(4-пиперидинил)-9Н-пурин-8-
-амина в виде полугидрата. Водную , фазу экстрагируют дихлорметаном. Органический
слой сушат, фильтруют и испаряют. Маслянистый остаток перемешивают в ацетонитрил-е и 2,2 -окси-
биспропане. Продукт отфильтровывают и сушат с получением второй фракции
в 5,6 чл 9-(2-фуранилметил)-И-(4-пи- перидинил)-9Н-пурин-8-амина. Общий
выход 41,8 ч. (86%) полугидрата 9-(2- -фуранилметил)-К-(4-пиперидинил)-9Н-
-пурин-8-амина, т.пл. 164,1°С (промежуточное соединение 81).
Применяя ту же методику и используя эквивалентные количества соответствующих
исходных продуктов также получают следующие промежуточные соединения: дкхлоргидрат 9-Ј(4-фторфенил)
метил }-К-(4-пиперидинил)-9Н-пурин-8- -амина, т.пл. 275°С (82); К-(4-пипе-
ридинил)-9-(2-тиенилметил)-9Н-пурин- -8-амин, т.пл. 189,6°С (83); N-(4-rm-
перидинил)-9-(2 пиридинилме тил)-9Н-- -пурин-8-амин, т.пл. 194,8°С (84);
9- С(5-метил-2-фуранил)метил )-Н-(4-пи- перкдинил)-9Н-пурин-8-амин, т.пл,
165,Г С (85); К-(4-пиперидинил)-9-(2- -пиразинилметил)-9Н-пурин-8-амин в
виде остатка (86); и 9- (4-метоксифе- нил)метил -N-(4-пиперидинил)-9Н-пурин-
-8-амин, т.пл. 144,1°С (87); 9-(2,4- -диметилфенил)метил -М-(4-пиперидинил
)-9Н-пурин-8-амин (88).
рин-8-амина, 1 ч. карбоната натрия и
45 ч. М,К-диметилацетамида перемешивают сутки с нагреванием при 90°С.
Затем реакционную смесь переносят в воду и полученный продукт экстрагируют трихлорметаном. Экстракт сушат,
фильтруют и испаряют. Остаток очищают колоночной хроматографией на силика-
геле с применением для вымывания насыщенной аммиаком смеси трихлорметана
с метанолом (95:5 по объему). Чистые фракции собирают и элюент испаряют.
Остаток кристаллизуют из ацетонитри- ла. Продукт отфильтровывают и высушивают с получением 0,9 ч (31,6%) 2-
-метил-3- 2-((2-пиpaзинилмeтил)- -9H-пypин-8-илJaминo}-1 -пиперидинил )
этил }-4Н-пиридо 1, 2-а }-пирамидин-4- -она, т.пл. 180,1°С (соединение 27).
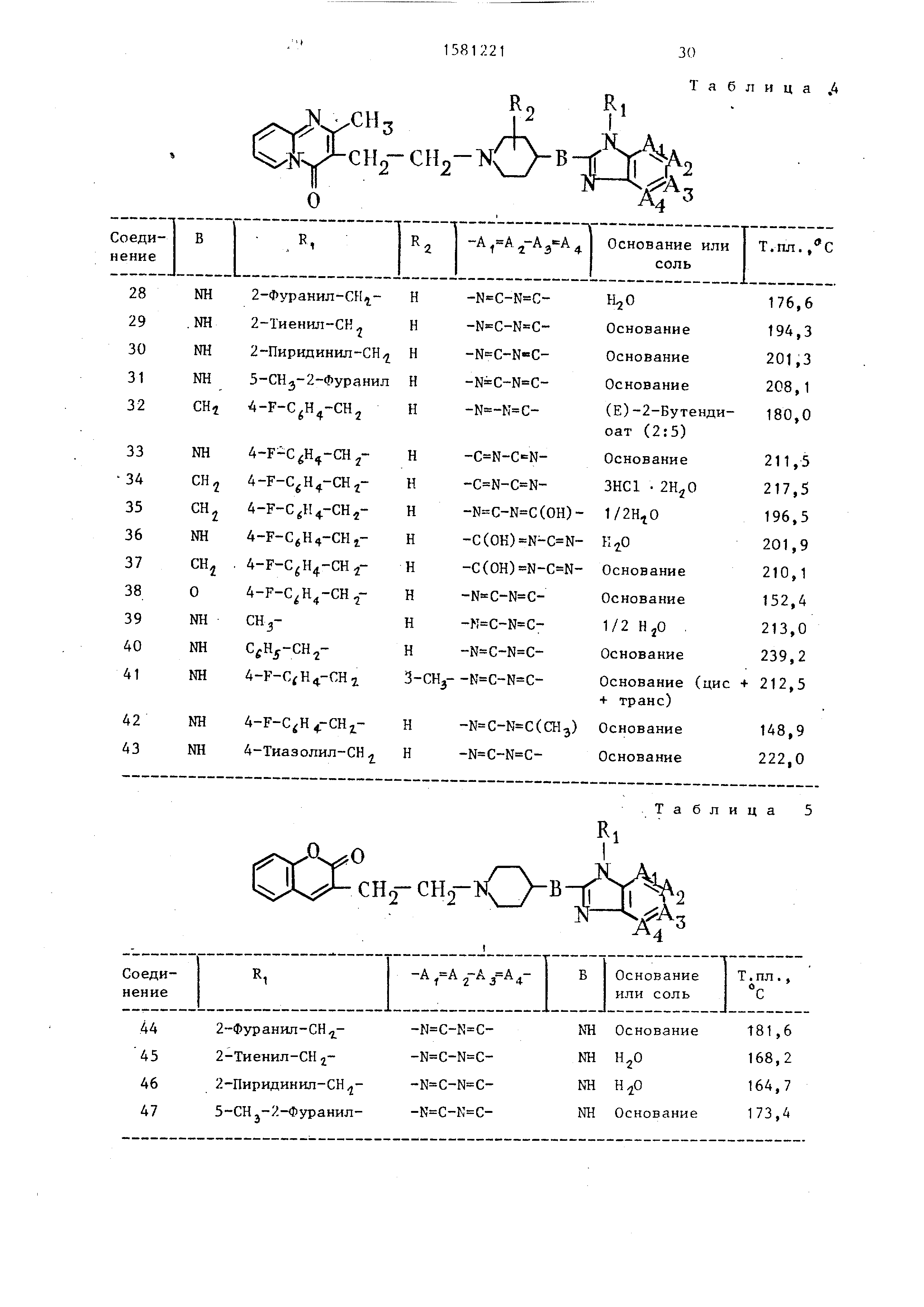
Данные по другим соединениям представлены в табл. 4.
Аналогичным способом получают также следующие соединения (табл. 5).
Аналогичным способом получают также следующие соединения: 3-f2- 4-(9- -(4-фторфенил)метил}-6тидрокси-9Н-
-пурин-8-ил -метил)-1-пиперидинил этил)-6,7,8,9-тетрагидро-2-метил-4Н-
-пиридо (1,2-аJ пиримидин-4-он, т.пл. 171,1°С (соединение 48); (f9-
- (4-фторфенил)метил}-6-метокси-9Н- -пурин-8-ил }-метил)-1-пиперидинил
пропил У-1,3-дигидро-2Н-бензимидазол- -2-она (Е)-2-бутендиоат (2:3), т.пл.
179,9°С (соединение 49); 9-(4-фтор- фенил)метил J-N-.fi- 2-(4-морфолинил)
этил -4-пиперидинил -9Н-пурин-8-амин, т.пл. 176, (соединение 50); полугидрат 7-метил-6- 2-((2-тиенил-
метил)-9Н-пурин-8-ил амино }-1-пиперидинил ) этил }-5Н-тиазоло 3,2-а пирами-
дин-5-она, т.пл. 104,5°С (соедине- ние 5); 1-этил-4-((Г9-(4-фтор-
гфенил)метил -9Н-пурин-8-ил}амино)-1- -пиперидинил этил}-1,4-дигидро-5Н-
-тетраэол-5-он, т.пл. 160,3 С (соедине ние- 52); 3-(({9-(4-фторфенил)
метил.-9Н-пурин-8-ил1-амино)-1-пиперидинил этил)-2,4-(HI, ЗН)-хиназолин-
,дион, т.пл. 241°С (соединение 53). Пример 32. Смесь 1,8 ч. 1- -(3-хлорпропил) -1,3-дигидро-2Н-бен-
зимидазол-2-она, 2,7 ч. 9- (4-фтор- фенил)метил J-8-(4-пиперидинилметил)-
-9Н-пурина, 1 ч. карбоната натрия и 45 ч. Ы,Ы-диметилформамида перемешивают
сутки при 70°С. После охлаждения реакционную смесь переносят в
0
5
0
5
0
5
0
5
0
5
воду и продукт экстрагируют трижды хлорметаном. Экстракт сушат, фильтруют
и испаряют. Остаток очищают колоночной хроматографией на силикаге-
ле с использованием для вымывания насыщенной аммиаком смеси трихлорметана
с метанолом (95:5 по объему). Чистые фракции собирают и элюент испаряют . Остаток превращают в этаноле в
соль (Е)-2-бутендионовой кислоты. Соль фильтруют и высушивают с получением
2,85 ч. (45,9%) (Е)-2-бутендио- ата (9- (4-фторфенил)метилJ-9H- -пурин-8-ил метил)-1-пиперидинилJnpo-
пил-1,3-дигидро 2Н-бензимидазол-2-она (1:2), т.пл. 186,2°С (соединение 54).
Аналогичным способом получают также следующие соединения: 1-f/:-f4-({9-
-(4-фторфенил)метил 7-9Н-пурин-8-ил}- амино)-1-пиперидинил э тил 1-1,3-дигид-
ро-2Н-бензимидамол-2-он, т.пл. 242,4° С (соединение 55); (9- - Ј(4-фторфенил)метил 6-гидрокси-9Н-
-пурин-8-ил - метил) -1 -пиперидинил про- пил }-1,3-дигидро-2Н-бензимидазол-2-
-он, т.пл. 245,8°С (соединение 56).
Пример 33. Смесь 1,2 ч.
бром-1-пропана, 3,26 ч. 9-(4-фторфенил ) метил -N-(4-пиперидинилметил)-9Н-
-пурин-8-амина, 1,5 ч. гидрокарбоната натрия и 40 ч. этанола перемешивают
при температуре кипения 1 ч. Затем реакционную смесь фильтруют в горячем состоянии через диатомовую
землю и фильтрат испаряют. Остаток переносят в воду и продукт экстрагируют
4-метил-2-пентаноном. Экстракт сушат, отфильтровывают и испаряют.
Остаток очищают колоночной хроматографией на силикагеле с использованием
для вымывания насыщенной аммиаком смеси трихлорметана с м.етанолом
(95:5 по объему). Чистые фракции собирают и элюент испаряют. Остаток
кристаллизуют из ацетонитрила. Продукт отфильтровывают и высушивают с
получением 0,8 ч. (22%) 9(4-фторфенил ) метил J-N- 1 - ( 2-пропенил) -4-пи-
перидинил -9Н-пурин-8-амина, т.пл. 144,8вС (соединение 57).
Аналогичным способом получают также (Е)-2-бутендиоат-4-({9-(4-фторфе-
нил)метил}-9Н-пурин-8-кл |амино)-N-(1- -метилэтил)-1-пиперидинпропанамида
(1:2), т.пл. 202,5°С (соединение 58).
Пример 34. Смесь 3,46 ч.
N-(дигидро-3,З-дифенил-2(ЗН)-фурани- лиден)-М-метилметанаммонийбромида,
-j15812
3,1 ч. М-(4-пиш ридинил)-9-( 2-ририди-
нилметил)-9И-пурин-8-амина, 1,5 ч. карбоната натрия и 45 ч. М,Н-диметил- ацстамида перемешивают сутки при
8(1 °С. После охлаждения реакционную смесь переносят в воду и продукт -
экстрагируют 4-метил-2-пентаноном. Экстракт сушат, фильтруют и испаряют.
Остаток очищают колоночной хроматографией на силикагеле с использованием для вымывания насыщенной аммиаком
смеси трихлорметана с метанолом. Чистые фракции собирают и элюент испаряют
. Остаток кристаллизуют из ацето- нитрила. Продукт отфильтровывают и высушивают с получением 4,1 ч. (71%)
М,К-дйметил-о/, /-дифенил-4-ц 9- (2- -пиридинилметил)-9Н-пурин-8-ил но)-1-пиперидинбутанамида, т.пл.
10
15
191,6°С (соединение 59). Данные по
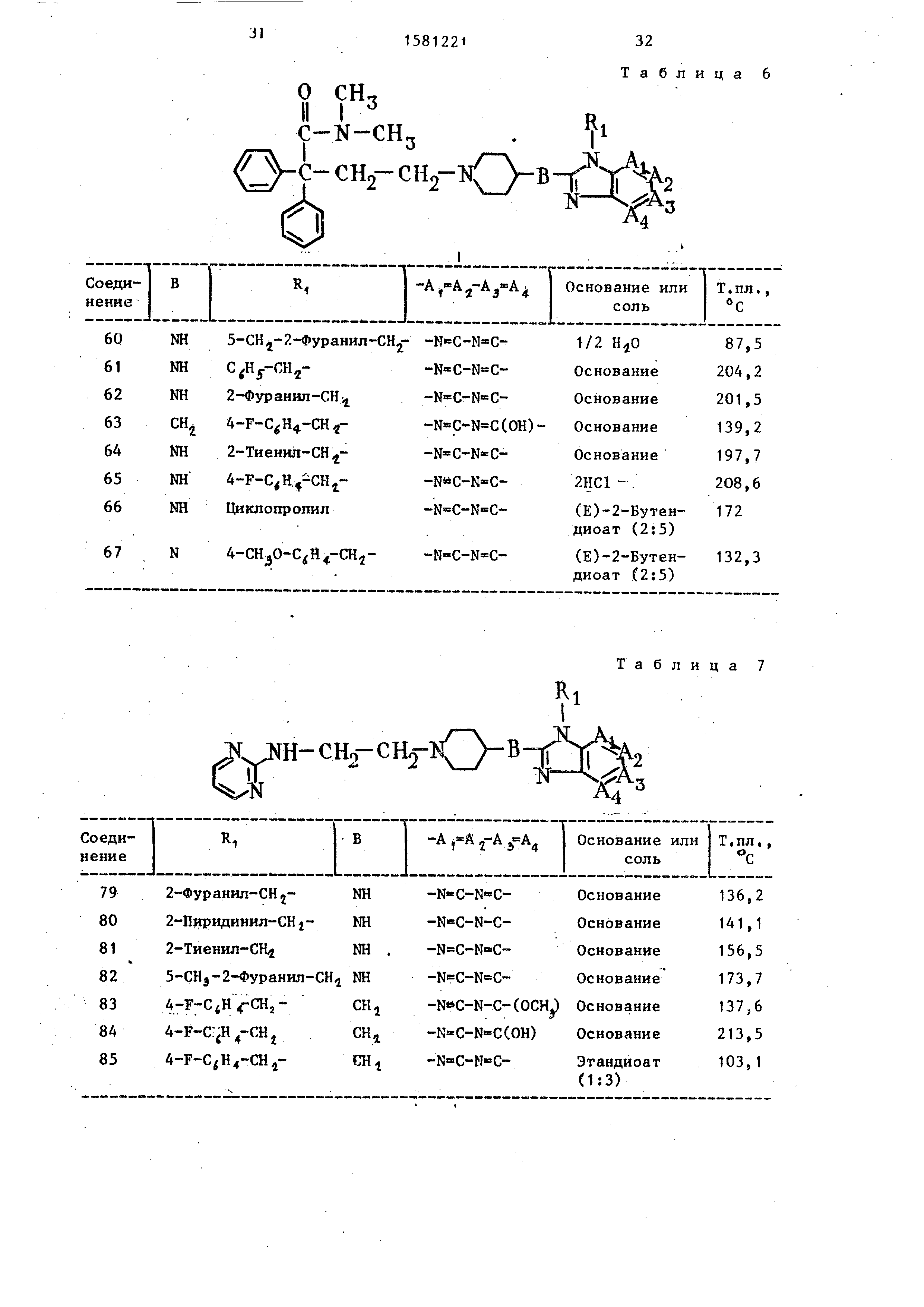
20
другим соединениям табл. 6.
приведены в
Аналогичным способом получают так- -уе же следующие соединения: N.N-r-три-
метил-V,/-дифенил-4- 9-(2-пиридинил- метил)-9Н-пурин-8-илЗамино J-1-пипери-
динбутанамид, т.пл. 143°С (соединение 68) . i
Применяя методику любого из примеров 27-33 с использованием соответствующих исходных продуктов получают
также следующие соединения: 9-(4- -фторфенил)метилJ-N- 1-( 1 -метилэтил) -
-4-пиперидинил -9Н-пурил-8-амин,
30
35
(соединение 88); (9- (4-фторфенил ) метил |-9Н-пурин-8-ил1 амино)-
-1-пип еридинил этил }-/.-тифенкарбокс- амида (Е)-2-бутендиоат (1:2) моногидрат
, т.пл. 135,2°С (соединение 89); ({9-(4-фторфенил)метилЗ 9К- -пурин-8-ил амино)-1-пиперидинил J
этилJ-2-тиазолкарбоксамида (Е)-2-бу- тендиоат (1:2), т.пл. 184,8°С (соединение
90); 2-амино-М- 2- 4-({9-С(4- -фторфенил)метил -9Н-пурил-8-ил}-ами-
но) -1 -пиперидиния)этил J бенэамида (Е) -2-бутендиоат (2:5), т.пл. 16Ь°С (соединение
91); N-((Ј9-(5-фтор- фенил)метил -9Н-пурил-8-ил}амино -1 - -пиперидинил этил)-N-метилтиомочеви184
, (соединение 69); 7-(4- на, т.пл. 204,8°С (соединение 92);
- ГлГ-У Г«л -/ ,..ч
т. пл.
-фторфенил)метил J-8- (1-метил-4-пипе- ридинил)амино 3-7Н-пурин-6-ол, т.пл.
255вС (соединение 70); 9-(4-фторфенил ) -метил}-8- (1 -метил-4-пиперидинил
) метил 3 9Н7Пурин-6-ол, т.пл. 218,5°С (соединение 71); 9- (4-фтор-
фенилметил J-N- {1 - 2- ( 2-пиридинил)
40
N- 2- 4-(9- (4-фторфенил)метил J-9H- -пурин-8-ил1метил)-1-,- 9- (4-фторфе-
нил)метил J-N-( 1-2 2- С( 1 Н-имидазо D,5-c (пиридин-2-ил) амино тил-4-пи-
перидинил }9Н-пурин-8)-амина (Е)-2-бу- тендиоат (1:3) моногидрат, т.пл.
(соединение 93); 9-(4-фторфеэтил -4-пиперидинил } 9Н-пурин-8-амин; нил)метил J-1,9-дигидро-8- 1-(фенил-
- 4-л (-„„„„ои,,0 -п . 45 метил)-4-пиперидинил метил }-бН-пурилт .пл. 173, (соединение 72); 9-(2
-фуранилметил) 2-(2-пиридинил)- -этил J4-пиперидинил у-9Н-8-пурин-8-
-амнн, т.пл. 145,3°С (соединение 73);
N-{1- 2-(2-пиридинил) этил 1-4-пипери- сл /„.nt. . ff. . r ...
i п /ч «..„50 (соединение 95): 4-ГГ4-(Г7-Г(4-(Ьтппдинил )9-(2-тиенилметил)-9Н-пурил-8-- - VL v
-амин, т.пл. (соединение 74); N-f1 (2-пиридинил)этил J-4-пипери- динил J-9-(2-пиридинилметил)-9Н-пурин-
-8-амин, т.пл. 164°С (соединение 75) ; 9- ( 5-метил-2-фуранил) метил {1 - 2-
-(2-пиридинил)этилJ-4-пиперидинил А ,
, т.пл. 196, (соединение 94); ,9- К4-фторфенил)метил J-8- ( 1 -12-(4-
-гидроксифенил)этил -4-пиперидинил j метил)9Н-пурин 6-ол, т.пл. 214,8°С
. - - --.- фенил)метил 7Н-пурин-8-ил амимо)-1т .пл. 228°С
-9Н-пурил-8-амин, т.пл. 163,2°С (соединение 76)-; 4-({9- U4-фторфенил)
пиперидинил}метил Яфенол, (соединение 96).
Фармакологические примеры.
Полезные антигистаминные свойства
соединений формулы (I), которые можно использовать как активный компонент
в фармацевтических препаратах,
24
0
5
0
метил}-9Н-пурин-8-ил} амино)-1-пипери- динэтанол, т.пл. 158, (соединение 77); 9-(4-фторфенил)-метилJ-N-
(2-пилеридиниламино) -пипетшдинил -9Н-пурил-8-амин, т.пл. 164,1°С (соединение 78), Данные по
другим соединениям приведены в табл. 7.
Аналогично получают соединения:
9-(4-фторфенил)метил J-N-(1-f2-(2-ти- азолиламино)этил}-4-пиперидил -9Н-8-
-амин, т.пл. 165°С (соединение 86); 9-(2-фуранилметил)-К-( (2-ти-
азолил) амино}пентил j-4-пиперидинш1 - -9Н-пурин-8-амин, т.пл. 188,5°С (соединение 87); ((4-фторфе-
нил)метил -9Н-пурин-8-амино -1-пиперидинил ) этил }-3-фуранкарбоксамида
(Е)-2-бутендиоат (1:2), т.пл. 133вС
е
0
35
(соединение 88); (9- (4-фторфенил
) метил |-9Н-пурин-8-ил1 амино)- -1-пип еридинил этил }-/.-тифенкарбокс-
амида (Е)-2-бутендиоат (1:2) моногидрат , т.пл. 135,2°С (соединение 89);
({9-(4-фторфенил)метилЗ 9К- -пурин-8-ил амино)-1-пиперидинил J этилJ-2-тиазолкарбоксамида (Е)-2-бу-
тендиоат (1:2), т.пл. 184,8°С (соединение 90); 2-амино-М- 2- 4-({9-С(4-
-фторфенил)метил -9Н-пурил-8-ил}-ами- но) -1 -пиперидиния)этил J бенэамида (Е)
-2-бутендиоат (2:5), т.пл. 16Ь°С (соединение 91); N-((Ј9-(5-фтор-
фенил)метил -9Н-пурил-8-ил}амино -1 - -пиперидинил этил)-N-метилтиомочевина
, т.пл. 204,8°С (соединение 92);
на, т.пл. 204,8°С (соединение 92);
- ГлГ-У Г«л -/ ,..ч
0
N- 2- 4-(9- (4-фторфенил)метил J-9H- -пурин-8-ил1метил)-1-,- 9- (4-фторфе-
нил)метил J-N-( 1-2 2- С( 1 Н-имидазо D,5-c (пиридин-2-ил) амино тил-4-пи-
перидинил }9Н-пурин-8)-амина (Е)-2-бу- тендиоат (1:3) моногидрат, т.пл. (соединение 93); 9-(4-фторфе
/„.nt. . ff. . r ...
, т.пл. 196, (соединение 94);
,9- К4-фторфенил)метил J-8- ( 1 -12-(4- -гидроксифенил)этил -4-пиперидинил j
метил)9Н-пурин 6-ол, т.пл. 214,8°С
(соединение 95): 4-ГГ4-(Г7-Г(4-(Ьтпп-
- VL v
. - - --.- фенил)метил 7Н-пурин-8-ил амимо)-1т
.пл. 228°С
пиперидинил}метил Яфенол, (соединение 96).
Фармакологические примеры.
Полезные антигистаминные свойства
соединений формулы (I), которые можно использовать как активный компонент
в фармацевтических препаратах,
что демонстрируют следующие испытания .
Пример 35. Защита крыс от
летальности, вызываемой соединением 48/80.
Соединение 48/80, представляющее
собой смесь олигомеров, образующихся при конденсации 4-метокси-Н-метилбен-
эолэтанамина с формальдегидом, явля- ется сильнодействующим агентом, вы
.деляющим гистамин (Int.Areh, Allergy Защита от коллапса, приводящего к летальному исходу, вызываемого со
.единением 48/80, является простым способом количественной оценки анти- гистаминной активности испытуемых
соединений.,В опытах использовались инбредные самцы крыс Wistar массой
240-260 г. Крысам не давали есть в течение ночи, после чего их переносили
в лабораторное помещение, в котором поддерживалась температура 21±1 С и относительная влажность 65 + 5%.
Крысам вводили подкожно или орально испытуемое соединение или растворитель (0,9%-ный раствор Nad). Через
час после этого им вводили внутривенно непосредственно перед этим раство
С НуОСОCHjOCOCHjOCOс н осоСаН/ )СОН
2-Пиразинил-СК 4-F-C H4-CH2 --N C-N C3-СН j- 4-F-C H +-СН г--N ON CН
4-CH30-CtH 4-CH2--N C-N CН 4-Тиазолил-СМ г--N C-№ Cрённое в воде соединение 48/80 в количестве 0,5 мг/кг (0,2 мл/100 г массы ) . В контрольных опытах, в которых
250 животным, обработанным растворителем , вводили стандартную дозу соединения
48/80, через 4 ч выживало не более 2,8% крыс. Поэтому за критерий защитного действия препарата принимали
выживание животных через 4 ч.
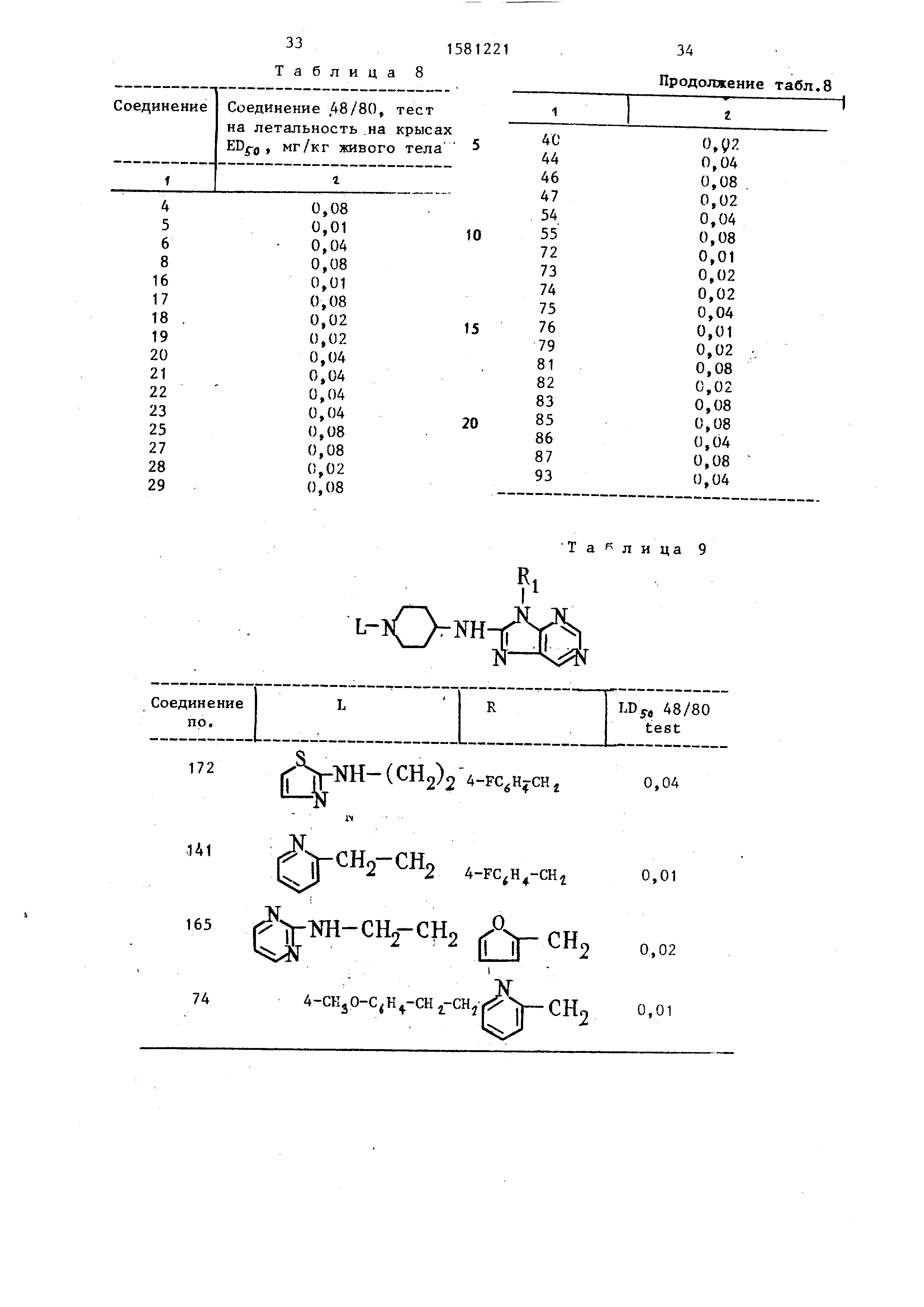
Значения для соединения формулы
(I) приведены в табл. 8. Эти значения представляют собой те количества испытуемых соединений (в мг/кг
массы), которые защищают 50% подопытных животных от летального исхода, вызываемого соединением 48/80.
Пример 36. Сравнительные данные (табл. 9).
а)предлагаемые соединения.
б)известные соединения (табл. 10).
Данные по токсичности. Испытуемые
соединения вводили крысам в различных
дозах, определяли при этом значение Д°3У в мг/кг массы,при которой
50% подопытных животных погибало (табл. 11).
Т а б л и ц а 1
R
1
Цис-
Цис + транс
27
1581221
Ri
At
fc
cHj-O-tf-iUH
x-/ HiHVk.
A:
28 Таблица 2
At
k.
A:
СН9- CH9R
R
Таблица .4
Таблица
.31
1581221
О СН.
32 Таблица
33 Таблица
Соединение по.
L
(СН2)2 4-FC HfCHj
IN
QpCH2-CH2
f Vwi-CH9-CH9 Ау-гн
UJj- 2 2 п iT CH.c
JNT
A-CKjO-C H -CH rCH4 r N- CH,
J
1581221
34 Продолжение табл.8
Т а л и ца 9
R
LD 48/80
test
0,04
0,01
0,02 0,01
- 35
I
f Н-СН2-СН2 4-F-ctH4-c
ЧГ
CH
fr
4-F-ceH4-i
Л
tf-CH2-CH2 Г lTCH2o,i6
4-CH 30-C4 H 4-CH 2
Таблица 11
Соединение Величина LDj,,, РезультатыПредельная
мг/кг теста 48/80,безопасная
величина EDконцентрация
мг/кг
75400,
172400,
141400,
115400,
7440 0,
Составитель Г. Жукова Редактор Н, Яцола Техред М.Моргентал Корректор А. Обручал)
Заказ 2026 Тираж 323Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж--35, Раушская наб., д. 4/5
Производственно-издательский комбинат Патент, г.Ужгород, ул. Гагарина,101
LD50 48/80 test
c
CH.
0,08
i
CH0 ,16
CHo
.
















Комментарии