Способ получения имидазохинолиновых соединений или их фармацевтически приемлемых солей - SU1470192A3
Код документа: SU1470192A3
Описание
1- ..,
Изобретение относится к способу получения новых имидазохинолиновьк соединений или их солей, обладакщих фармакологическими свойствами, которые позволяют использовать их в качестве ингибиторов фосфодиэстеразы, антиагрегаторов тромбоцитов крови и/или кардиотонических агентов.
1470192
Цель изобретения - синтез новых производных ряда имидазохинолинов, кторые обладают биологической активностью , превосходящей активность структурного аналога - анагрелида (6,7-дшшор-т1,5-дигидроимидазо(2,1- h)xинaзoлин-2(ЗH)-oн).
Пример 1. Получение имида- зо(4,5-Ь)хинолин-2-тионов.
А. 1,З-дигидро-6-(трифторметил)- 2Н-имидазо(4,5-Ь)хинолии-2-тион (R, 6-СРз, ).,
Стадия 1. 1,1-Диметш1этш1-J 2-C( оксо-2-тиоксо-4 имйдазолидинилиден) метил 3-5-(трифторметил)-фенил J-кар- бамат.
Смесь 1 о 1 диметилэтил- 2-формю1- 5- (трифторметкл) -фенил --карбамата (20 г, 60 ммоль) и 2-тиогидантоина (8,02 г 60 ммоль), этанола (60 мл) воды (60 мл) и морфолина (6 мл) нагревают на паровой бане. Спустя 90 мин смесь охлаждают, оставляют стоять в течение ночи, осадок от- фильтровьшают и сушат в вакууме.
Получают 1,1-диметил - 1:2-(5-окс 2-тиоксо-4-имидазолидинилидён)-мети 5-(трифторметил)-фенил J-карбамат (20,65 г, 77%), т.ил. 216 С (разл„
Вьгчислено, %: С .49,60; Н 4,16; N 10,85; S 8,27. ,
; C.H FiNgOgS
Найдено, %: С 49,56; Н 4,10; N 10,92; S 7,96.
Стадия 2. 5- 2-Амино-4-(трифтометил ) -фенил 3-метиле1 -2-тиоксо-4-и дазолидинон.
Трифторуксусную кислоту (90 мл) добавляют к смеси 1,1-диметилэтш1- 2-(5-оксо-2-тиоксо-4 имидазолидин лиден)-метил -5-(трифторметил)-фен карбамата (18 г, 46 ммоль) и анизола (36 г, 0,,3 моль). При растворен растворитель упаривается, остаток кристаллизуется из смеси этанола (65 мл) и хлороформа (135 мл).
Получают 5-l 2-aминo-4-(тpифтop мeтил)-фeнилЗ-мeтшIeнi-2-тиoкco-4- имидaзoлидинoн (9,85 г, 73%), т.пл
240° С.
N
Вычислено, %: С 45,99; Н 2,81; 14,53.
C,,H,,.F3N30S
%: С 46,00; Н 2,81;
Найдено,
N 14,54.
Стадия 3. 1,З-Дигидро-6-(трифтометил ) -2Н-имидазо (4,5-.Ъ) хиноЛин-2ТИОНо
N
J Смесь 5 Ц2-амино-4-(трифторметил ) -фенил J-метиленj-2-тиоксо-4-ими- дазолидинона (3,63 г, 12 ммоль), то- зипата пиридиния (1,8 г) и дифенкло- вого эфира (5,4 г) нагревают при 180 С в атмосфере аргона. Спустя 18 мин смесь охлаждают, добавляют хлороформ (60 мл), смесь нагревают с обратным холодильником. Спустя 30 мин твердое вещество отфильтровывают и растворяют в смеси воды (80 мл) и 10%ном растворе гидроокиси натрия (5 мл) при подогревании. При добавлении уксусной кислоты выпадает . тяжельй осадок, который отфильтровывают , промывают водой и сушат в вакууме.
Получают 1,З-дигидро-6-(трифторметил )-2Н-имидазо (4,5-Ь)ХИНОЛИН-2-ТИ- он (1,79 г, 52%), т.пл. вьше ,
Вьтислено, %: С 49,07; Н 2,25; 15,61.
N 5
0
5
0
С 48,92; Н 2,23;
N
0
5
Найдено, %: 15,58.
Б. 1,3-Дигидро-7,8-диметил-2Н-ими- дазо(4,5-Ь)хинолин-2-тион (R i R Rj 8-СНз получают аналогично А, заменив 2-амино-4-три- фторбензальдегид 2-амино-5,6-диме- тил-бензальдегидом.
Пример 2с 1,1-Диметилэтил- (2-формил-5-трифторметилфенил)гкарбамат .
А. 1,1-ДимeтшIЗTил- 5-(тpифтop- мeтил ) -фенил карбамат .
Смесь 3-аминобензотрифторида (16 г, 0,1 моль) с ди-трет-бутилди- карбонатом (32 г, 0,15 моль) и тет- рагидрофурана (ТГФ) (25 мл) перемешивают при комнатной температуре в течение 90 мин, а затем нагревают при температуре дефлегмации в течение 90 мин. Смесь разбавляют водой (10 мл), оставляют стоять в течение ночи и концентрируют в вакууме. Остаток растворяют в гексане (100 мл) при нагревании с обратным холодильником , обрабатьтают активированным углем, фильтруют и охлаждают до О С в течение 16 ч.
Получают 1,1-димeтилэтил- 5-(тpи- фтopмeтил)-фeнилJ-кapбaмaт (выход 75-80% после нескольких прогонов), т.пл. 75-76 с.
Вычислено, %: С 55,17; Н 5,40; N 5,36
С i,H ,4 iNO -j
Найдено , %:-t 55,13; Н 5,45; N 5,33.
В. 1,1-Диметилэтш1-(2-формил-5- трифторметилфенил)-карбамат-8-бутил- литий (15 мл) 1,45 М раствора в ТГФ (22 ммоль) добавляют по каплям к пе- реме1шваемому раствору 1,1-диметил- (трифторметил)-фенил3-карбаг мата (2,61 г, 10 ммоль) в сухом ТГФ (40 мл), поддерживаемому при -40°С .в атмосфере аргона. Спустя 40 мин добавляют Н,М-диметилформамид (1,15 мл, 15 ммоль) и смесь перемешивают при -40°С В течение 10 мин перед разбавлением диэтилрвым эфиром (30 мл). Смесь промывают.10%-ным раствором уксусной кислоты (30 мл) и насыщенным раствором хлористого натрия (30 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток хроматографируют на колонке из двуокиси кремния с использование гексана и этилацетата (95:5) в качестве элюента.
Получают 1,1-диметилэтил- 2-фор- мил-5-(трифторметил)фенилЗ-карбамат
выход 70-84%.
Вь числено, %: С 53,98; Н 4,87; N 4,84
Ci5Hi4F3N03
Найдено, %: С 53,67; Н 4,87; N 4,85.
Пример 2. 1,З-Дигидро-6- . (трифторметил)-2Н-имидазо(4,5-Ь)хиНОЛИН-2-ОНЫ .
А. 2-(Уетилтио)-6-(трифторметил) 1Н-имидазо(4,5-Ь)-хинолин.
40
Суспензию 1,3-дигидро-6-(трнфтор- етил)-2Н-имидазо(4,5-Ь)хинолин-2- тиона (0,53 г, 2 ммоль) в метаноле (5 мл) обрабатывают 50%-ной водной гидроокисью натрия (0,18 г). Получен- 45 ный раствор, охлаждают на ледяной бане, добавляют метилиодид (0,3 г, 0,13 мл, 2,1 ммоль). Смесь перемешивалась в течение 90 мин перед фильтрованием . Твердое вещество промьгеают метанолом и сушат на воздухе. Получают 2-(метш1тио)-6-(трифтор- метил)-1Н-имидазо(4,5-Ъ)хинолин- (0,34 г, 61%), т.пл. вьше 270 С.
Вычислено, %: С 50,88; Н 2,85; N 14,83.
C.oHoFjNi
Найдено, %: С 50,50; Н 2,83; N 15,01.
55
50
ЯМР (ДМСО-dg) сС , ч.на-млн: 2,81 (ЗН, с., -СН); 7,70 (Ш, дв.д., 8,5 Гц, 2,Гц, ароматический Н орто кСРз); 8,29 (2Н, м., ароматический , Н); 8,46 (1Н, с., ароматический Н орто к N-C-SMe); 13,70 (1Н, широкий с., NH).
Б. 1,3-Дигидpo-6-(тpифтopмeтил)- 2Н-имидазо(4,5-Ь)хинолин-2-он.
Смесь 2-(метш1Тио)-6-(трифторме- тип)-1Н-имидазо(4,5-Ь)хинапина (1,77 г, 6 ммоль), уксусной кислоты (25 мл) и 3 Н. раствора соляной кис- ЛОТЫ (25 мл) нагревают на паровой бане в течение 4 ч. Раствор разбав- ляют горячей водой (250 мл), охлаж- .дают и фильтруют. Фильтрат концентрируют , получаа еще один сбор продук- та. Твердые вещества смешивают с уксусной кислотой (25 мл) и 3 н. раствором соляной кислоты (25 мл). Смесь нагревают на паровой бане в течение ночи, разбавляют горячей водой (250 мл) и охлаждают. Твердое вещество собирают и сушат в вакууме.
Получают 1,3-днгидpo-6-( мeтил)-2H-имидaзo(4,5-b)xинoлин-2- oн (1/38 г, 83%), т.пл. выше 250 С. Вьиислено, %: С 52,18; Н 2,39;
N 16,60.
,
N
5
0
5 С iiH FjiMj
Найдено, %: С 52,04; Н 2,43; 16,64.
Аналогично примеру 1 получают соединения по примерам 3-26.
П р и м е р 3. 8-Хлор-1,3-дигид- ро-2Н-имидазо(4,5-Ь)хинолин-2-он в виде твердого вещества.
Кристаллизацией из метанола получают гидратированный 8-хлор--1,3-ди- гидpo-2H-имидaso(4,5-b)xинoлин-2-oн,
т.пл. -7360 С. .
Вычислено, %: С 52,24; Н 2,82; 18,98; С1 16,01; 0,81. С1оНьС1НзО 0,1 Найдено, %: С 54,18; Н 2,93; 18,93; С1 1.5,76; Н,0 0,75. ЯМР (ДМСО-а); f, ч.на млн: 7,44- 7,65 (2Н, м.); 7,69 (1Н, с.); 7,80 (1Н, дв. д., 3 Гц, 6 Гц); 11,18 (1Н, широкий с.); 11,70 (1Н, широкий с).
П р и м е р 4. 7-Фтор-1,3-дигид- ро-2Н-имидазо-(4,5-Ь) хинолин-2-он. 55 Добавлением дихлорметана осаждают 7-фтор-1,3- дигидро-2Н-имидазо- (4,5-Ъ)хинолйн-2-он в виде дихлор- ..метандиметилсульфоксидного сольвата гидрата, т,шт. 7360 С.
N
N
50
Вычислено, %: С 56,72; Н 3,19; N Н,,0 1,68
СбНйГЫзО.О,2 H.jO.0,05 CHjCl 0,05 CxHiOS
Найдено, %: С 57,01; Н 3,09; N 19.24: Н«0 1,66.
ЯМР (ДМСО-dg); cf, ч.на млн;2,60
О
К (ппфокий с., CHjSCH.3.); 5,75 (с.,
,У; 7,20-7,95 (4Н, м.); 11,30 (2Н, широкий с.).
Пример 5. 8-Метил-1,3-дигид- po-2H-и идaзo(4,5-b)xинoлиц-2-oн,
При добавлении простого эфира образуется остаток в ви,це гидрата 8-метил-1,3-дигидро-2Н-имидазо(4,5-Ь) хинолнн-2-она, т.пл. 350-355°С (разл.
Вьгчислено, %: С 54,60; Н 4,46; N 17,37; С1 -14,61; Н,0 2,61
C,H9N/)-HCl 0,35
Найдено, %: С 54,30; И 4,15; N 17,49; С1 14,54; 0,38
ЯМР (ДМСО-d); ч.на млн: (ЗН, с.); 7,35 (1Н, д., 8 Гц); 7,54 (1Н, д., 8 Гц),; 7,80 (1Н, с.); 7,83 (1Н, д., 8 Гц); 9,72 (1Н, широкий с. 11,70 (1Н, широкий с.).
П р и м е р 6. 7-Метил-1,3-дигид- ро-2Н-имидазо(4,5-Ь)хинолин-2-он.
Светло-коричневое твердое вещество отфильтровывают и растворяют в 10%-нон хлористом водороде в метаноле . Добавлением простого эфира осаждают 7-метил-1,3-дигидpo-2H-имидa- зo(4,5-b)xинoлин-2-oнa в виде гидра:- та гидрохлорида, т.пл,, .
Вьгчислено, %: С 54,81; Н 4,43; N 17,48; С1 14,71; HiO 2,24
С i HgNjO-HCl -0,3 HjO
Найдено, %: С 55,15; Н 4,56; N 17,16; С1 14,03; 0,69.
ЯМР (flMCO-d); с, ч. на млн.: 2,45 (ЗН, с.); 7,44 (1Н, д., 8 Гц); 7,75 (2Н, с.); 7,90 (1Н, д., 8 Гц); 11,00 (1Н, широкий с.); 11,62 (1Н, широкий с.).
Пример 7. 7-Хлор-1,3-дигид- ро-2Н-имидазо(4,5-Ь)хинолин-2-он.
Добавлением дихлорметана получают гидратированный 7-хлор-1,3-дигидро- 2Н-имидазо(4,5-Ь)хинолин-2-он, т.пл. 7360°С.
Вычислено, %: С 54,24; Н 2,82} N 18,98; С1 16,01; Н-гО 0,81,
C,,H ClNjO 0,1 Hop
Найдено, %: С 54,36; Н 2,83; N 18,88; С1 15,29; H-iO 0,52.
(AMCO-dg); сГ, чона млн: 7,46 (1Н, дв.д., 2 Гц, 9 Гц) 7,59 (1Н, синглет); 7,79 (1Н, д., 9 Гц); 7,99 (1Н, д., 2 Гц); 11,10 (1Н, широкий с.); 11,50 (1Н, широкий с.).
Пример 8. 1,3-Дигидро-6,7- диметш1-2Н-имидазо(4,5-Ь)хинолин- 2-ч)н.
Кристаллизацией из метанола получают 1,З-дигидро-6,7-диметил-2Н-ими- дазо(4,5-Ь)хинолин-2-он в виде гидрата гидрохпорида, т.пл. 360°С.
Вычислено, %: С 57,10; Н 16,65; N 16,65; НгО 1,07
HCl- 0,15 НгО Найдено, %: С 57,04; Н 5,01; N 16,57; HjO 1,02.
ЯМР (ДМСО-d); с , ч.на млн:. 2,36 (ЗН, с.); 2,39 (ЗН, с.); 7,70 (ЗН,с.).
Пример 9. 1,3-Дигидpo-7,8- димeтил-2H-имидaзo (4 ,5-Ь)хинолин-2- он.
Нерастворимое коричневое твердое вещество суспендируют в кипящем ме- о-аноле и фильтруют.
Получают 1,3-дигидpo-7,8-димeтшI- 2H-имидaзo(4,5-b)xинoлин-2-oн в виде гидрата гидрохлорида, т.пл. 360 С, Вычислено, %: С 56,90; Н 4,93;
N 16,59; 1,42
,,N30 HCl.0,2 HjO
Найдено, %; С 57,01; Н 4,89; N 16,33; 1,07.
5 ЯМР (ДМСО-dt) (СГзСО Н), с/, ч.на млн: 2,41 (ЗН, с.); 2,52 (ЗН, с.); 7,59 (2Н, АН кв., 9 Гц); 7,89 (1Н, с.); 11,50 (ЗН, широкий с.).
Б. Гидрат 1,3-дигидpo-7,8-димe- 0 тил-2Н-имидазо(4,5-Ь)хинолин-2-она.
Вещество суспендируют в кипящем метаноле (2л). Порциями добавляют йод (38,7 г, 0,15 моль) в течение 30 мин. Нагревание с обратным холодильником продолжают в течение дополнительных Ю мин, смесь концентрируют до объема приблизительно 400 мл и добавляют раствор тиосульфата натрия (60 г) и карбоната натрия (60 г) в воде (600 мл). Осадок собирают, промывают водой и метанолом и затем растворяют с водой (500 мл). Растертое твердое вещество собирают, суспендируют в кипящем 5 метаноле (200 мл), охлаждают и фильтруют .
Получают гидратированный 1,3-ди- гидро-7,8-диметил-2Н-имидазо(4,5-Ь)- ХИНОЛИН-2-ОН (88%), т.пл. .
5
0
Вычислено, %: С 66,47; Н 5,30; N 19,38, Н,0 1,66
С .гH 11ЙэО 0 2 H.,0
Найдено, %: С 66,14; Н 5,12; N 19,32; HiO 1,0;
ЯМР (JH-lCO-d), f, ч.на млн: 2,41 (ЗН, с.); 2,49 (ЗН, с.); 7,45 (2Н, АВ кв., 9 Гц); 7,62 (1Н, с.); 10,90 (1Н, с.); 11,30 (1Н, широкий с.).
Пример 10. 1,3-ДИГИДРО.-7- 5слор-6-метил-2Н-имидазо (4,5-Ь)хино- ЛИН-2-ОН, Т.Ш1. 360 С.
Вычислено, %: С 56,55; Н 3,45; N 17,98; С1 15,17.
С iHgClNjO
Найдено, %: С 56,34; Н 3,42; N 17,71; С1 14,83.
ЯМР (ЛМСО-d j) , cf , ч.на млн: (ЗН, с.); 7,55 (1Н, с.); 7,72 (1Н, с.); 7,98 (1Н, с.).
Пример 11. 1,3-Дигидро-8- метокси-2Н-имидазо(4,5-Ь)хинолин-2- он в виде гидрата (91%), т.пл. 300°С.
Вычислено, %: С 60,13; Н 4,36; N 19,13; Н-гО 2,05 С i,H5N30i-0,25
Найдено, %: С 59,85; П 4,12; N 18,78; 1,26.
ЯМР (ЛМСЬ-d), f, ч. на млн: ,3,97 (ЗН, с.); 6,88 (1Н, дв.д., 4 Гц, 5 Гц); 7,35-7,50 (2Н, м.);
ЧАи,, - ,
7,71 (1Н, с.); 10,98 (1Н, широкий с.), N 14,3S
Пример 14. 7-Метокси-1,3- дигидро-2Н-имидазо(4,5-Ь)хинолин- 2-он получают перекристаллизацией из водного диметилформамида, т.пл. .
Вычислено, %: С 61,39; Н 4,22; N 19,53,
C HgNjOj
10 Найдено, %: С 61,21; Н 4,27; N 19,53.
ЯМР (JIMCO-d(,), сС, ч. на млн: 3,79 (ЗН, с.); 7,10 (1Н, дв.д.; 3 Гц, 9 Гц); 7,28 (1Н, д., 3 Гц); 7,48 (1Н, 15 с.); 7,65 (1Н, д. 9 Гц); 10,90 (1Н, широкий с.); 11,32 (1Н, широкий с.). Пример 15. 1,3-дигидро-6,7- дкметокси-2Н-имидазо(4,5-Ъ)хинолин- 2-он в виде белого порошка, т.пл. 20 у 320°С.
Вычислено, %: С 58,77; Н 4,52; N 17,13.
С,Н,Оэ
Найдено, %: С 58,38; Н 4,55; 25 N 17,09.
ЯМР (JIMCG-d), f, ч. на млн: 3,88 (6Н, с.); 7,20 (1Н, с.); 7,30 (1Н, .. с.);- 7,49 (1Н, с.); 10,50-11,50 (2Н, широкий с.).
30 Пример 16. 7-Бром-1,3-дигид- ро-6,8-диметил-2Н-имидазо(4,5-Ь)хино- ЛИН-2-ОН, т.пл. 300°С,
Вычислено, %: С 49,34; Н 3,45;
11,45 (1Н, широкий с.).
Пример 12. 1,З-Дигидро-8- хлор-7-метил-2Н-имидазо(4,5-Ь)хино- ПИН-2-ОН в виде гидрата (55%), т.пл 7360 С.
Вычислено, %: С 55,69; И 3,57; N 17,71; 1,52.
С „HgClNaO 0,2
Найдено, %: С 54,61; Н 3,47; N 17,11; Н,0 1,43
35
Найдено, %: С 49,27; Н 3,50; N 14,42.
ЯМР (CFj,CO,H), cf, ч. на млн: 2,76 40 (ЗН, с.); 2,98 (ЗН, с.); 7,81.
Пример 17. Кислотно-аддитивные соли предлагаемых соединений могут быть получены с помощью подкисле- ния остаточного вещества в подходящем
ЯМР (ДМСО-dj, сГ, ч.на млн: 2,50 45 Растворителе. Например, обработкой
лиг . &- , ,„ „ т q Оо тртг ягипГ)О-2Н-ИМШ
(ЗН, С.); 7,57 (2Н, АБ кв., 8 Гц);
UH с ;; / / v.n, . ..., . ....8-метил-1,3,9,9а-тетрагидро-2Н-имида7 69 (1Н с ); 11,10 (1Н, широкийс.);зо(4,5-Ь)хинолин-2-она иодом и раст-.
1 60 (1Н, с.).ворением нерастворимого продукта в
пример 13. 7-Хлор-1,3-Дигид-10%-ном мет.анольном растворе хлорисро-6 ,8-диметил-2Н-имидазо(4,5-Ь)хино-50 о водорода с последующим Добавлеi w U , 1 м . о -.„.. „,,т,1т1лплтч-1 оАыпя гtnпVЧЯЮT ХЛОО
ЛИН-2-ОН, т.пл. .
Вычислено, %: С 58,19; Н 4,07; N 16,97.
С 72 loClNjOНайдено , %: С 57,92; Н 4,10; . N 17,03.
ЯМР (CFjCO H), tf, ч.на млн: 2,73 (ЗН, с.); 2,93 (ЗН, с,); 7,84 (1Н, с.); 8,90 (1Н, с.).
нием диэтилового эфира получают хлор- гидрат 8-метил-1,3-дигидpo-2H-имидa- зo,(4,5-b)xинoлин-2-oн(72%) , т.пл. ЗбО-ЗбЗ С.
55 Вычислено, %: С 56,06; Н 4,28; N 17,83,.
С НС1
Найдено, %: С 55,95; Н 4,24; N 17,65.
/ТО
470192 О
Пример 14. 7-Метокси-1,3- дигидро-2Н-имидазо(4,5-Ь)хинолин- 2-он получают перекристаллизацией из водного диметилформамида, т.пл. .
Вычислено, %: С 61,39; Н 4,22; N 19,53,
C HgNjOj
10 Найдено, %: С 61,21; Н 4,27; N 19,53.
ЯМР (JIMCO-d(,), сС, ч. на млн: 3,79 (ЗН, с.); 7,10 (1Н, дв.д.; 3 Гц, 9 Гц); 7,28 (1Н, д., 3 Гц); 7,48 (1Н, 15 с.); 7,65 (1Н, д. 9 Гц); 10,90 (1Н, широкий с.); 11,32 (1Н, широкий с.). Пример 15. 1,3-дигидро-6,7- дкметокси-2Н-имидазо(4,5-Ъ)хинолин- 2-он в виде белого порошка, т.пл. 20 у 320°С.
Вычислено, %: С 58,77; Н 4,52; N 17,13.
С,Н,Оэ
Найдено, %: С 58,38; Н 4,55; 25 N 17,09.
ЯМР (JIMCG-d), f, ч. на млн: 3,88 (6Н, с.); 7,20 (1Н, с.); 7,30 (1Н, .. с.);- 7,49 (1Н, с.); 10,50-11,50 (2Н, широкий с.).
30 Пример 16. 7-Бром-1,3-дигид- ро-6,8-диметил-2Н-имидазо(4,5-Ь)хино- ЛИН-2-ОН, т.пл. 300°С,
Вычислено, %: С 49,34; Н 3,45;
N 14,3S
Найдено, %: С 49,27; Н 3,50; N 14,42.
ЯМР (CFj,CO,H), cf, ч. на млн: 2,76 40 (ЗН, с.); 2,98 (ЗН, с.); 7,81.
Пример 17. Кислотно-аддитивные соли предлагаемых соединений могут быть получены с помощью подкисле- ния остаточного вещества в подходящем
45 Растворителе. Например, обработкой
50 о водорода с последующим Добавле- .„.. „,,т,1т1лплтч-1 оАыпя гtnпVЧЯЮT ХЛОО
нием диэтилового эфира получают хлор- гидрат 8-метил-1,3-дигидpo-2H-имидa- зo,(4,5-b)xинoлин-2-oн(72%) , т.пл. ЗбО-ЗбЗ С.
55 Вычислено, %: С 56,06; Н 4,28; N 17,83,.
С НС1
Найдено, %: С 55,95; Н 4,24; N 17,65.
11
12
1А70192
ЯМР (даСО-df), сГ , чГна млн: 2,63 Найденс , %: С 57,11; Н 4,75; (ЗН, с.); 7,33 (1Н, д., 8 Гц); 7,50 N 16,57.
((1Н, т., Гц); 7,76 (1Н, с.); 7,82 ЯМР (flMCO-d), , ч.на млн: 2,66 - -. -- зн, с., ароматический CHj); 3,41
&Vy f у .J.- г f у 7
Ч1Н, д., 8 Гц); 11,60 (1Н, с.), 11,90 (2Н, широкий с.).
Пример 18. 7-Бром-1,3-дигид- ро-2Н-имидазо(4,5-Ь)хинолин-2-он, т.пл. выше .
Вычислено, % С 45,49; Н 2,30; N 15,92., ,
CioHgBrNjO,
Найдено, %: С 45,69$ Н 2,42; N 15,85.
ЯМР (ДМСО-d), сГ, ч.на млн: 7,61 (1Н, дв.д., 9 Гц, 2 Гц, ароматический Н); 7,62 (1Н, с.); 7,71 (1Н, д., 9 Гц); 8,15 (1Н, д., 2 Гц).
П.р и м е р 19о 1,3-дигидро-7- (1-метилэтокси)-2Н имидазо(4,5-Ь)- ХИНОЛИН-2-ОН, т.пло выше 320 С.
Вычислено, %: С 64,19; Н 5,39; N 17,27..
.C,,,Hi,
Найдено, %: С 64,31,-; Н 5,40; N 17,11.
5ШР (.mCO-d () f f t ч„ на млн: 1,35
(6Н, д., 5,5 Гц, ); 4,68 (1Н,
СИ 3
м., ОСН); 7,16 (1Н, д., 9 Гц, ароматический Н орто по отношению к О- ); 7,35 (1Н, с.); 7,59 1Н, с., ароматический Н орто к NCO); 7,76 (1Н, д., 9 Гц, ароматический Н орто к -0-); 11,04 (1Н, широкий с., NH); 11,45 (1Н, широкий с., Ш).
Пример 20. 1,3-Дигидро-6,7, 8-триметокси-2Н-имидазо(4,5-Ь)хино- ЛИН-2-ОН, т.пл. выше 320 С,
Вычислено, %: С 56,73; Н 4,76; N 15,27.
С зН1эНэ04
Найдено %: С 56,90; Н 4,73; N 15,20.
ЯМР (ДМСО-d), f, ч.на млн: 3,83 (ЗН, с. ОСНз); 3,90 (ЗН, с., ОСНз); 3,95 (ЗН, с., ОСНз); 7,08 (1Н, с., ароматический Н орто к OCHj); 7,51 (1Н, с., ароматический Н орто к NCO); 10,89 (1Н, с., NH); 11,42 (1Н, с,
NH).
Пример 21. 1,З Дигидро-1,8- диметил-2Н-имидазо(4,5-Ь)хинолин- 2-он, т.пл. 340-341 0 (разл.)о
Вьиислено., %: С 57,31; Н 4,89; N 16,71,,
С.,Н „Np-HCl- 0,1 НгО
(ЗН с. N-СНз); 7,29 (1Н д., 7 Гц ароматический Н орто к СНз); 7,45 (1Н, т., ароматический Н мета к СН 7,71 (1Н, д., 7 Гц, ароматический 10 Н пара к CHj); 7,87 (1Н, с., аромат ческий Н орто к NHCO).
Пример 22. 1,3-Лигидро-1,7 диметил-2Н-имидазо(4,5-Ь)хинолин- 2-он, т.пл. вьшзе . 15 Вычислено, %: С 67,36; Н 5,22; N 19,63.
С гН uNjO 0,04 Найдено, %: С 67,04; Н 5,21; N 19,64.
20 ЯМР (7IMCO dj), rf , ч. на млн: 2,46 (ЗН, с., ароматический СНj); 3,35 (ЗН, с., N-СНз); 7,35 (1Н, д., 7 Гц, ароматический Н орто к СНэ); 7,62 (1Н, с., ароматический Н); 25 7,65 (tH, с., ароматический Н); 7,7 ( 1Н, д., 7 Гц, ароматический Н мета к CHj)o
Пример 23. 1,3-дигидро-7- метокси-1-метил-2Н-имидаз о(4,5-Ь)хи 30 НОЛИН-2-ОН, т.пл. вьш1е 31 .
Вычислено, %: С 62,77 ; Н 4,85; N 18,30; 0,157.. С i,H,,N504-0,02 Н,0 Найдено, %: С,62,43; Н 4,85; 35 N 18,14; Н,0 0,094.
ЯМР (AMCO-d), f, ч, на млн: 3,3 ( ЗН, Се, NCHj); 3,86 (ЗН, с., ОСН) 7,18 (1Н, д., 9 Гц, ароматический Н орто к ОСНэ); 7,30 (1Н, с., арома 40 тический Н орто к ОСНз); 7,66 (1Н, с., ароматический Н с. орто к ШСО) 7,71 (1Н, д., 9 Гц, ароматический Н мета к OCHj).
Пример 24. 1,3-дигидро-1,7 45 8-триметил-2Н-имидазо(4,5-Ь)хинолин 2-он, т.пл. вьш1е 300°С (кристаллизо вано из диметилацетамида).
Вычислено, %: С 68,70; Н 5,77; N 18,49.
°
Найдено, %: С 68,36; Н 5,78; N 18,46.
ЯМР (даСО-dj), Г, ч. на млн: 2,4 ,, ( ЗН, с., СНз); 2,55 (ЗН, с., СН j); 3,39 (ЗН, с., N-CH); 7,34 (1Н, д., 8,5 Гц, ароматический Н орто к CIlj) 7,57 (1Н, д., 8,5 Гц, ароматический Н мета к СН s); 7,86 (1Н, с., аромат
12
ЯМР (flMCO-d), , ч.на млн: 2,66 зн, с., ароматический CHj); 3,41
(ЗН с. N-СНз); 7,29 (1Н д., 7 Гц, ароматический Н орто к СНз); 7,45 (1Н, т., ароматический Н мета к СН); 7,71 (1Н, д., 7 Гц, ароматический Н пара к CHj); 7,87 (1Н, с., ароматический Н орто к NHCO).
Пример 22. 1,3-Лигидро-1,7- диметил-2Н-имидазо(4,5-Ь)хинолин- 2-он, т.пл. вьшзе . 5 Вычислено, %: С 67,36; Н 5,22; N 19,63.
С гН uNjO 0,04 Найдено, %: С 67,04; Н 5,21; N 19,64.
0 ЯМР (7IMCO dj), rf , ч. на млн: 2,46 (ЗН, с., ароматический СНj); 3,35 (ЗН, с., N-СНз); 7,35 (1Н, д., 7 Гц, ароматический Н орто к СНэ); 7,62 (1Н, с., ароматический Н); 5 7,65 (tH, с., ароматический Н); 7,70 (1Н, д., 7 Гц, ароматический Н мета к CHj)o
Пример 23. 1,3-дигидро-7- метокси-1-метил-2Н-имидаз о(4,5-Ь)хи- 0 НОЛИН-2-ОН, т.пл. вьш1е 31 .
Вычислено, %: С 62,77 ; Н 4,85; N 18,30; 0,157.. С i,H,,N504-0,02 Н,0 Найдено, %: С,62,43; Н 4,85; 5 N 18,14; Н,0 0,094.
ЯМР (AMCO-d), f, ч, на млн: 3,34 (ЗН, Се, NCHj); 3,86 (ЗН, с., ОСН); 7,18 (1Н, д., 9 Гц, ароматический Н орто к ОСНэ); 7,30 (1Н, с., арома- 0 тический Н орто к ОСНз); 7,66 (1Н, с., ароматический Н с. орто к ШСО); 7,71 (1Н, д., 9 Гц, ароматический Н мета к OCHj).
Пример 24. 1,3-дигидро-1,7, 45 8-триметил-2Н-имидазо(4,5-Ь)хинолин- 2-он, т.пл. вьш1е 300°С (кристаллизовано из диметилацетамида).
Вычислено, %: С 68,70; Н 5,77; N 18,49.
°
Найдено, %: С 68,36; Н 5,78; N 18,46.
ЯМР (даСО-dj), Г, ч. на млн: 2,42 ,, (ЗН, с., СНз); 2,55 (ЗН, с., СН j); 3,39 (ЗН, с., N-CH); 7,34 (1Н, д., 8,5 Гц, ароматический Н орто к CIlj); 7,57 (1Н, д., 8,5 Гц, ароматический Н мета к СН s); 7,86 (1Н, с., аромати13 . 1470192 ческий Н орто к NCO); 11,62 (1Н, с.,
NH).
Пример 25. 1,3-Дигидро-7,8- диметил-2Н-имидазо(4,5-Ь)хинолин- 2-он-получают кристаллизацией из диметилацетамида (53,4 г, 65%),т.пл.
выше .
С 67,59; Н 5,20;
14
Вычислено, N 19,71.
С,Н ,,КэО
Найдено, %: С 67,20; Н 5,20; N 19,51.
ЯМР (ДМСО-а), сГ, ч.на млн: 2,41 (ЗН, с., СНз); 2,48 (ЗН, с., СН,); 7.31 (1Н, д., 8 Гц, ароматический Н); 7,55 (1Н, д., 8 Гц, ароматический Н); 7,61 (1Н, с., ароматический Н).
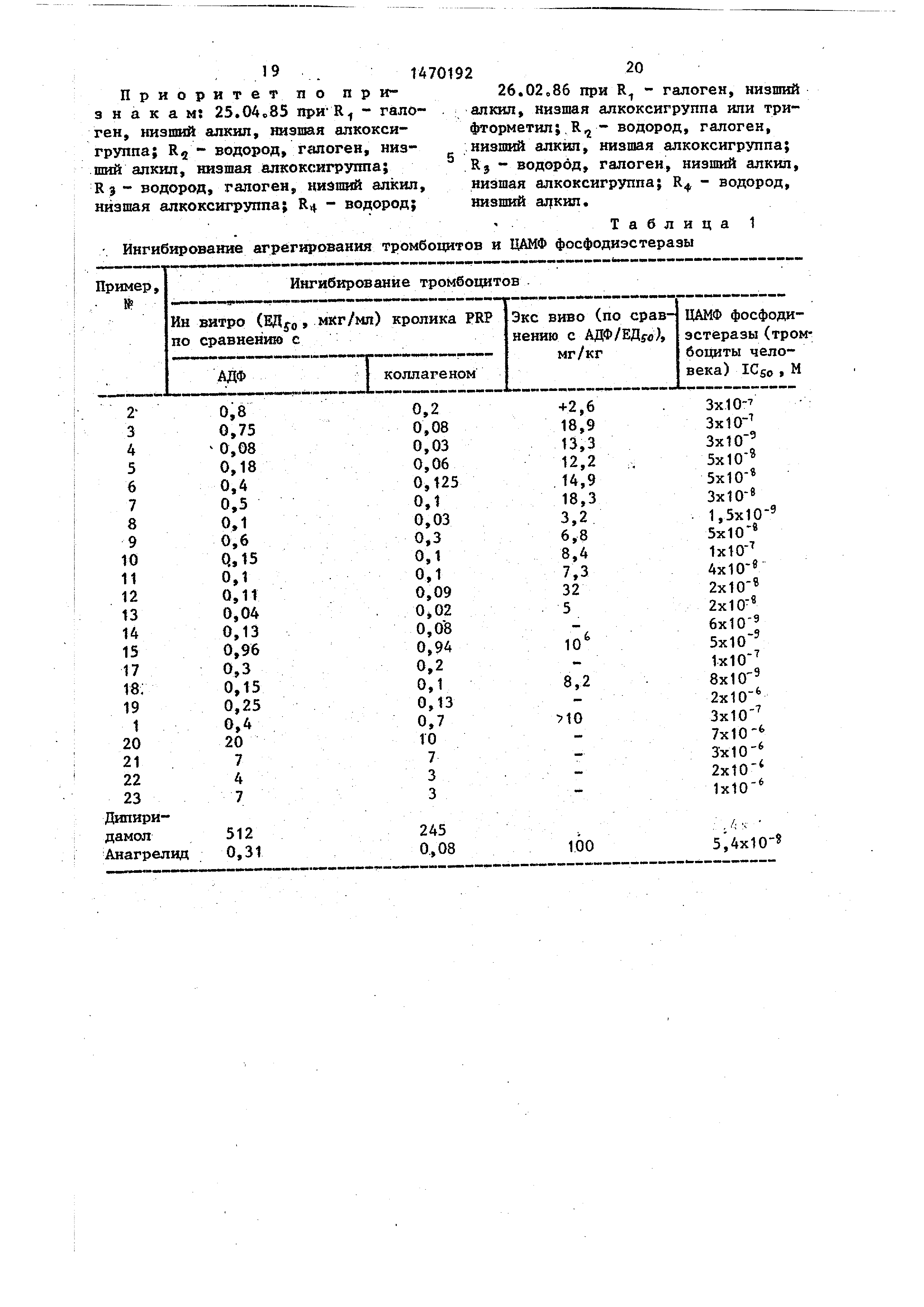
Пример 26. 1,З-дигидро-7Для оценки активности, ин витро различных соединений в отношении ин- гибирования аденозиндифосфата (АДФ) и агрегирования тромбоцитов, вызван ного коллагеном, используют известный метод измерения агрегирования.
Плазму, богатую тромбоцитами (PRP), отделяют от смеси крови кролика и
Q лимонной кислоты (3,8%). Для индуцирования используют АДФ с конечной концентрацией 0,5 мкг/мл или 0,05 мл суспензии коллагена, полученной по известной методике. Различные испыту15 емые соединения растворяют в диметил- сульфоксиде (ДМСО) так, чтобы 5 мкл, добавленных к плазме, богатой тромбоцитами , давали необходимую концентрацию . Проделывают контрольные опыты
Пример, о. I, « - - ... этокси-2Н-имидазо(4,5-Ь)хинолин-2-он, 20 с носителем и сравнивают с опытами
rt.,«Апгчиттгт оыотэaHHr rrv тч ПОРЯТО
агрегирования, вызванного в богатой тромбоцитами плазме, содержащей различные концентрации испытуемых соединений . Получают кривые ответной реак- 25 ции на дозу и вычисляют величины эффективной концентрации (ЕД5о)« В Д ном опыте величины для дипирида- мола - используемого в клиниках ан- титромбогенного агента, составляют
т.пл. вьше 320 С.
Вычислено, %: С 62,88; Н 4,84; N 18,33,
С iiN зО 7
Найдено, %: С 62,68; Н 4,92; N 18,16.
ЯМР (ДМСО-а,), , ч. на млн: 1,36 (ЗН, т., 7 Гц, ОСН.СНз); 4,04 (2Н,
Г; гГаРом ;ич;::иГн о Г; о1)Г ЗО аол;Г5Г2 мкг/. по сравнению с ЛДФ 7;08 (;н Д.. 2,6 Гц, ароматический « 245 мкг/мл по сравнению с колла- Н орто к GEt); 7,26 (1Н, с., ароматический Н орто к NCO); 7,64 (1Н, д., 9 Гц, ароматический Н мета к OEt).
Предлагаемые соединения или их 35 фармацевтически приемлемые соли обладают фармакологическими свойствами, поскольку являются ингибиторами фос- фодиастёразы, антиагрегаторами тромгеном . В табл. 1 приведены результаты для различных исследуемых соединений .
Ингибирование агрегирования тромбоцитов при оральном введении: (метод экс вино).
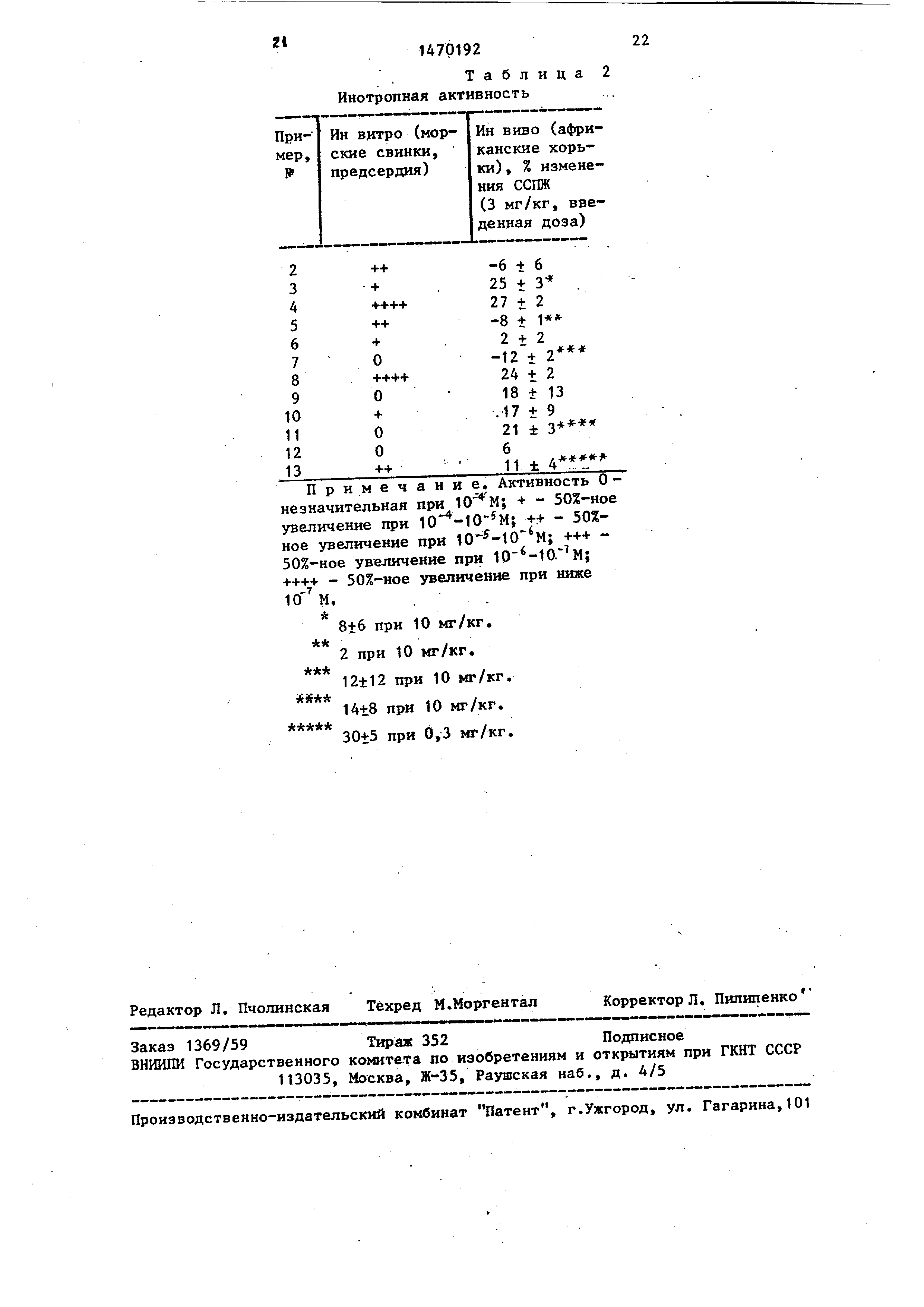
Агрегометрия проводится ин витро на пробах плазмы, богатой тромбоци;;Г„™Г-„ро™ кард„о.он™еск„- „ - ;,Гд::Пс,.Ге: IIZT.НИИ или носителя. Активность определяют через 2 ч после введения лекарства орально в различных дозах через
ми агентами, в качестве которых селективно усиливают сокращение миокарда , т.е. при лечении или профилактике сердечных состояний, таких как
кр сеопечных состоянии, лсч - - - -- „,,
.ал.„а, „едос.а;о,оо.ь, ког- « зонд J™--- - ;«„ °
да необходима положительная инотроп- ная активность), увеличивают силу сокращения, чрезмерно не увеличивая сердечный ритм. Кроме того, соединения обладают антиметастазньм потенциалом в результате способности ин- гибировать тромбо:щты.
Фармакологические свойства предлагаемых соединений показаны с помощью обычных биологических испытаний ин витро и ин виво.
Ингибирование ин витро агрегирования тромбоцитов. I
плюс несколько капель Твин-20. Активность лекарства выражается в вице
ЕД
50
(доза, необходимая для ингиби- рования вызванного агрегирования на СП 50%), вычисленной по результатам, полученным на группах из 10 животных, подвергнутых лечению различными дозами испытуемого сое лнения,в сравне- нии с отдельными контрольными грг п ..,. рами, ээ
В данном опыте величина ЕД ди- пиридамола составляет 100 мг/кг, а анагрелида 4,9,мг/кг. Результаты
14
Для оценки активности, ин витро различных соединений в отношении ин- гибирования аденозиндифосфата (АДФ) и агрегирования тромбоцитов, вызванного коллагеном, используют известный метод измерения агрегирования.
Плазму, богатую тромбоцитами (PRP), отделяют от смеси крови кролика и
лимонной кислоты (3,8%). Для индуцирования используют АДФ с конечной концентрацией 0,5 мкг/мл или 0,05 мл суспензии коллагена, полученной по известной методике. Различные испытуемые соединения растворяют в диметил- сульфоксиде (ДМСО) так, чтобы 5 мкл, добавленных к плазме, богатой тромбоцитами , давали необходимую концентрацию . Проделывают контрольные опыты
« - - ... с носителем и сравнивают с опытами
« - - ... 0 с носителем и сравнивают с опытами
.,«Апгчиттгт оыотэaHHr rrv тч ПОРЯТО
агрегирования, вызванного в богатой тромбоцитами плазме, содержащей различные концентрации испытуемых соединений . Получают кривые ответной реак- 25 ции на дозу и вычисляют величины эффективной концентрации (ЕД5о)« В Д ном опыте величины для дипирида- мола - используемого в клиниках ан- титромбогенного агента, составляют
ЗО аол;Г5Г2 мкг/. по сравнению с ЛДФ « 245 мкг/мл по сравнению с колла-
аол;Г5Г2 мкг/. по сравнению с ЛДФ « 245 мкг/мл по сравнению с колла-
геном. В табл. 1 приведены результаты для различных исследуемых соединений .
Ингибирование агрегирования тромбоцитов при оральном введении: (метод экс вино).
Агрегометрия проводится ин витро на пробах плазмы, богатой тромбоционд J™--- - ;«„ °
люс несколько капель Твин-20. Активность лекарства выражается в вице
ЕД
50
(доза, необходимая для ингиби- рования вызванного агрегирования на 50%), вычисленной по результатам, полученным на группах из 10 животных, подвергнутых лечению различными дозами испытуемого сое лнения,в сравне- нии с отдельными контрольными грг прами ,
В данном опыте величина ЕД ди- пиридамола составляет 100 мг/кг, а анагрелида 4,9,мг/кг. Результаты
для предлагаемых соединений приведены в табл. 1.
Ингибирование циклической АМФ фосфодиастеразы (ФДЕ).
Данный анализ осуществляется известным способом.
Меченный тритием циклический аде- нозин-монофосфат (ЦАМФ) инкубируется с ФДЕ - ферментом, полученным из тромбоцитов человека, который превращает часть ЦАМФ в 5 АМФ в пробирках для культуры. Данная реакция заканчивается путем погружения пробирок в кипящую водяную баню, после чего их помещают на лед и в каждую пробирку добавляют аликвоту змеиного яда. Данная реакция при еще одном инкубировании превращает 5 АМФ в аденозин, Дпя связьгоания остающегося циклического АМФ добавляют ионообменную смолу . Пробирки центрифугируют для осаждения смолы, а часть прозрачного плавающего сверху слоя (который содержит радиоактивный аденозин) просчитывают в жидкостно-сцинтшгпяционном счетчике, Актийность ингибирования ЦАМФ фосфодиастеразы испытуемого
фодиастеразы. Оценивается способность лекарств увеличивать силу сокращения предсердия. Получают кривые ответных реакций на дозы испытуемых соединений . Результаты даны в виде проце нта от контрольного значения пропанола.
При необходимости можно анализировать хронотропную ответную реакцию правого предсердия, которое бьется самопроизвольно Результаты приведены в таблице 2.
Инотропная активность ин виво.
Данное испытание проводится на африканских хорьках следукивдм об- ,разом.
Голодных анестезированных хорьков оборудуют приборами дря исследования гемодинамических параметров, а также 0 силы сокращения правого желудочка (ССШК) с использованием незамкнутой тензометрической арки. Лекарства назначают интрадуоденально в виде растворов в ДМСО (1 мл или менее). 5 Действие на силу сокращения миокарда и другие параметры контролируют в течение 60 мин после введения лекарства . Изменения силы сокращения после введения лекарства выражаются в виде
5









Реферат

Формула


Комментарии