Производные цефема или карба(детиа)цефема - RU2044738C1
Код документа: RU2044738C1
Описание
Изобретение относится к 3-(фторсульфонил)оксизамещенным цефемовым, иккарбацефемовым полупродуктам, которые используются при осуществлении указанного способа.
В патенте США N 5520022 (28.05.1985) описаны цефалоспориновые антибиотики, имеющие 1-пропениловую группу в 3-положении и описываемые
следующей формулой, в которой R1 и R2 означают Н, ОН, ОСН3 или Сl:
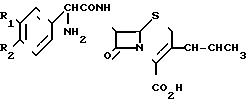
1-пропениловая группа описанных Hoshi и др. соединений предпочтительно имеет (Z)-конфигурацию, поскольку она проявляет более высокую антибактериальную активность, чем (Е)-конфигурация. Указанные соединения получают путем взаимодействия 3-галогенметилцефалоспорина с триарилфосфином с образованием в результате фосфоранилового промежуточного соединения, которое затем обрабатывают альдегидом для получения пропениловой или замещенной пропениловой группы.
При осуществлении указанного способа образуется смесь цис (Z)- и транс (Е)-изомеров. Поэтому для получения предпочтительного, обладающего более высокой антибактериальной активностью цис (Z)-изомера необходимо осуществлять дорогостоящее разделение или создавать такие условия процесса, при которых образуется целевой изомер. Общий выход целевого цис (Z)-изомера в расчете на исходный материал снижается за счет образования транс(Е)-изомера.
Сравнительно недавно в целях предупреждения образования нежелательного изомера и повышения таким образом выхода целевого было предложено путем катализируемого палладием сочетания вводить алкениловые заместители в 3-положение цефалоспоринового кольца. Аллильное сочетание 3-галогенметицефемов с винилстаннанами, инициируемое соединениями Рd(О), галоидами металлов и трис(2-фурил)-фосфином, приводит к образованию новых цефалоспоринов (S.R.Baker и др. патент США N 4847373, выданный 11 июля 1989). Способ W.J.Scott и др. J. Amar.chem.Soc. 106, 46303632 (1984), катализируемого смесью Рd(O) и LiCl сочетания цианогексенилтрифлата с винилтрибутилстаннаном был применен для получения различных 3-((Z)-1-пропенил)цеф-3-емов путем взаимодействия 3-трифлоксицеф-3-ема с (Z)-1-пропенилбутилстаннаном (S.R.Baker и др. патент США N 4870168, выданный 26.09.1989).
О других исследованиях по расширению круга реакций и оптимизации условий проведения процесса для катализируемого палладием сочетания винилтрифлатов и винилстаннанов сообщается в работах Scott и Stille, J.Amer.chem.Soc. 108, 3033-3040 (1986) и Stille и Groh, J. Amer.chem.Soc. 109 813-817 (1987).
Сочетание 3-трифлоксицеф-3-ема с трибутилстаннаном в присутствии РdCl2 (СН3СN)2 без фосфина или LiCl, необходимых в случае способа W.J.Scott и др. описано G. K. Cook и J.H.МсDonald 111 (196 th American Chemical Saciety National Meeting, Los Angeles, CA Sert. 25-30, 1988, Division of Organic chemistry. Abstract N 32).
Предметом настоящего изобретения являются новые
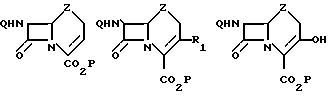
3-(фторсульфонил)оксизамещенные цефемы и карбацефемы формулы
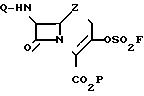
(I)
в которой Z атом серы сульфоксидная, сульфоновая или метиленовая группа; Q защищающая амин группа, обычно используемая при синтезе цефалоспорина, например феноксиацетильная или бензилоксикарбонильная аминозащитная группа, Р группа, защищающая карбокси-группу, обычно используемая при синтезе цефалоспорина, например третбутильная или бензилоксикарбонильная карбоксизащитная группа для получения соединения формулы
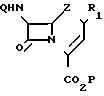
(II) где Q водород или аминозащитная группа, Р водород или карбоксизащитная группа R1 (C2-C6)алкенил.
Заявленные соединения получают взаимодействием 3-фторсульфонилоксизамещенного цефема или карбацефема формулы (1) с органостаннаном в присутствии Рd(II)- или Рd(O)-катализатора. Предлагаемый способ представляет собой усовершенствованный вариант способа, описанного в патенте США N 4870168. Усовершенствование это состоит в том, что взамен описанного в указанном патенте дорогого реагента 3-трифлоксицеф-3-ема в способе используются сравнительно дешевые реагенты.
Предпочтительными соединениями формулы (I) являются те из них, у которых Z означает атом серы. Другими предпочтительными соединениями формулы (I) являются соединения, у которых Z означает метиленовую группу.
Другими предпочтительными соединениями формулы (I), кроме того, являются те из них, у которых Q означает защищающую аминогруппу группу. Наиболее предпочтительной защитной группой является третбутоксикарбонил или бензилоксикарбонил.
Другой группой предпочтительных соединений формулы (I) являются те из них, у которых Q предпочтительно представляет собой феноксиацетильную или бензилоксикарбонильную аминозащитную группу.
Другой предпочтительной группой соединений формулы I являются соединения, у которых Р предпочтительно представляет собой третбутильную или дифенилметильную карбоксизащитную группу.
Соединения формулы (I) получают путем ацилирования соответствующего 3-оксизамещенного соединения формулы (III), 4-карбоксильная группа которого предпочтительно защищена легко отщепляющейся защитной группой, соответствующим сульфонирующим агентом, например фторсульфоновой кислотой или, что предпочтительнее, фторсульфоновым ангидридом. Типичный процесс получения соединений формулы (I) описывается следующей схемой, детальное описание которой приведено ниже.
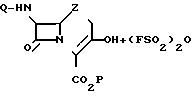
Реакцию между фторсульфоновым ангидридом и исходным соединением формулы (I) можно проводить в тех же условиях, что и при получении фенольных эфиров с использованием в качестве исходного материала ангидрида. Можно также осуществлять этот процесс и в условиях, аналогичных описанным в патенте США N 4870168 при получении энольных эфиров трифлата. Реакцию проводят, добавляя к раствору реагента формулы (III) в инертном органическом растворителе, например метиленхлориде, как минимум эквимолекулярного количества, предпочтительно избытка, например 10-100 мол. ангидрида. Основание, например стерически затрудненный третичный амин, в частности диизопропилэтиламин, берут в примерно эквимолекулярном по отношению к ангидриду количестве. Реакцию проводят при температуре 0-78оС предпочтительно в инертной атмосфере.
Отмеченное выше катализируемое палладием сочетание 3-фторсульфонилоксизамещенного цефема или карбацефема с органостаннаном при получении соединений формулы (II) предпочтительно проводить без помощи фосфинового лиганда или галоида металла. Хотя фосфиновый лиганд, например трифенилфосфин, и галоид металла, например хлорид цинка, и могут содержаться в реакционной среде, однако присутствие их не дает никакого преимущества в отношении выхода целевого продукта.
Катализирующим процесс соединением палладия может быть соединение Рd(II) или Рd(O). Примерами подходящих соединений Рd(II) являются ацетат палладия, хлорид палладия, бромид палладия, иодид палладия, дихлорид бис-(ацетонитрил) палладия, дихлорид бис-(фенилацетонитрил) палладия, нитрат палладия, ацетоацетат палладия, сульфат и оксид палладия. Примерами подходящих соединений Рd(O) являются бис (дибензилиденацетон) палладий, трис(дибензилиденацетон) палладий и тетракси (трифенилфосфин)палладий. Предпочтительными каталитическими соединениями палладия являются ацетат палладия (II) и трис (дибензилиденацетом)палладий (О).
Апротонный растворитель, использующийся при получении соединений формулы (II), может быть выбран из 1-метил-2-пирролидинона, тетрагидрофурана, ацетонитрила, диметилсульфоксида, диметилформамида, простых эфиров, таких как диглим и диоксан, гексаметилфосфарамида, ацетона, нитрометана и нитробензола, а также галогенированных углеводородов, таких как метиленхлорид. Предпочтительными растворителями являются 1-метил-2-пирролидинон, тетрагидрофуран, ацетонитрил, диметилсульфоксид, метиленхлорид и диметилформамид. Наиболее предпочтительно использовать в качестве растворителя 1-метил-2-пирролидинон или метиленхлорид. Можно использовать также и смеси растворителей.
По предпочтительному варианту осуществления способа, в качестве органостаннана -R1-трибутилстаннан, где R1 означает С2-6-алкенил, в качестве палладиевого катализатора ацетат палладия (II) или трис(дибензилиденацетон)-дипалладий (О); реакцию сочетания проводят в среде 1-метил-2-пирролидинона или метиленхлорида без добавок лигандов фосфина и галоидов металлов.
Данный способ, включающий катализируемую палладием реакцию сочетания 3-сульфонилоксицефема с органостаннаном, предпочтительно использовать для получения цефпрозила. Использующийся для синтеза цефпрозила исходный станнан, Z-1-пропенилтриалкилстаннан, может быть получен из цис-1-бромпропена. Ниже описан разработанный эффективный способ получения чистого (>99%) цис-изомера 1-бромпропена.
Получение цис-1-бромпропена.
В колбу емкостью 500 мл, снабженную мешалкой, термометром и капельной воронкой, загружали кротоновую кислоту (51,68 г, 0,6 моль, Аldrich) и 320 мл гептана. Смесь нагревали на водяной бане до температуры реакции 30оС в защитной атмосфере сухого азота, после чего добавляли в колбу по каплям в течение примерно 45 мин 34,4 мл (0,63 моль 1,05 эквивалента) брома (Ficher), поддерживая с помощью холодной водяной бани температуру 30оС. В течение 4-5 мин после окончания добавления брома происходила кристаллизация образующегося продукта, эритро-2,3-диброммасляной кислоты. Для поддерживания температуры реакции примерно 34оС колбу охлаждали на водяной бане. После этого смеси давали остыть до температуры окружающей среды, перемешивали ее в течение еще 16 ч и охлаждали на водно-ледяной бане в течение 30 мин. Бесцветные кристаллы отсасывали на фильтре, дважды промывали гептаном порциями по 75 мл и высушивали на вакууме до постоянного веса при температуре окружающей среды. В результате получали 130 г (98%) эритро-2,3-диброммаcляной кислоты с Т.плавл. 87-89оС. В двухлитровую колбу, снабженную мешалкой, термометром и обратным холодильником со смонтированным на нем барботером с минеральным маслом, загружали 517,5 мл (3,71 моль, 4,13 эквивалента) 99%-ного триэтиламина (Aldrich). При интенсивном перемешивании в колбу добавляли десятью порциями с интервалами в 5 мин 221,33 г (0,90 моль) эритро-2,3-диброммаcляной кислоты. В процессе добавления происходило выделение газа (через барботер пробулькивали пузырьки) и наблюдался разогрев смеси до 40оС. Реакционную смесь перемешивали в течение 3,4 ч при температуре окружающей среды, затем нагревали до 40оС и продолжали перемешивание при этой температуре в течение еще 3,4 ч (до прекращения выделения газа). Смесь затем охлаждали до температуры окружающей среды и добавляли к ней 321 мл воды. Твердый осадок промывали и растворяли, после чего в колбу добавляли 230 мл концентрированного раствора НСl (Fisher), поддерживая температуру реакции равной 0оС. При отделении нижней фазы в разделительной воронке получали 82,15 г (75%) сырого цис-1-бромпропена. Водную фазу сохраняли для извлечения из нее триэтиламина.
Сырой продукт промывали равным объемом насыщенного раствора NaHCO3и перегоняли при атмосферном давлении, получая в результате чистый цис-изомер 1-бромпропена в виде бесцветной жидкости. Т.кип. 59-60оС.
Кислую водную фазу охлаждали до 0-5оС и добавляли к ней при интенсивном перемешивании 750 мл 25%-ного водного раствора NaOH. После отделения в разделительной воронке верхней фазы количественно извлекали триэтиламин.
Производные цефема, у которых Q означает карбоксиацильную группу известного 7-ациламиноцефалоспоринового антибиотика, сами являются антибиотиками, которые можно использовать для лечения инфекционных заболеваний, вызываемых бактериями и другими чувствительными микроорганизмами. Однако эти антибиотики не составляют объект настоящего изобретения, предметом которого являются способ и полупродукты.
Соединения формулы (II), у которых Q означает Н или защитную группу, являются полупродуктами для получения соединений антибиотиков путем ацилирования или отщепления вначале защитной группы и затем ацилирования, осуществляемых известным образом.
Примеры иллюстрируют получение различных 3-R1-защитных цеф-2-емов формулы (II) предлагаемым способом из соответствующих упомянутых 3-фторсульфонилоксицеф-3-емов.
П р и м е р 1. Дифенилметил-7-феноксиацетамидо-3-[(фторсульфонил)окси] -3-це- фем-4-карбоксилат.
Раствор дифенилметил-7-феноксиацетамидо-3-окси-цефем-4-карбоксилата (2,0 г, 3,8 моль) в дихлорметане (20 мл) охлаждали до -78оС в инертной атмосфере и добавляли к нему по каплям в течение 2 мин N,N-диизопропилэтиламин (0,74 мл, 4,2 ммоль, 1,1-эквивалента). Образующийся в результате бледно-желтый раствор перемешивали в течение 5 мин и обрабатывали затем фторсульфоновым ангидридом (0,77 г, 4,2 ммоль, 1,1 эквивалента). Реакционную смесь перемешивали в течение 30 мин и затем прекращали реакцию путем добавления к смеси воды (10 мл). После нагревания реакционной смеси до температуры окружающей среды органическую фазу высушивали над сульфатом магния и фильтровали раствор через тонкий слой силикагеля. Силикагель промывали этилацетатом (10 мл) и объединенные органические фракции концентрировали, получая в результате бледно-желтую пенистую массу. Сырой продукт перекристаллизовывали из диэтилового эфира и в результате получали 2,2 г (96%) целевого соединения в виде белых игольчатых кристаллов. Тплавл131-132оС (с разложением).
Результаты анализа.
1Н-ЯМР (СДСl3, 360 мГц); δ 7,42-7,24 (комплексн. м. 13Н); 7,09 (видимый т, 2Н); 6,90 (д, 2Н, J=7,9 Гц); 5,97 (дв. д, 1Н, J 5,0, 9,2 Гц); 5,08 (д, 1Н, J 5,0 Гц); 4,55 (С, 2Н); 3,83 (А из АВ, 1Н, J 18,5 Гц); 3,51 (В из АВ, 1Н, J 18,5 Гц);13С ЯМР (90,5 мГц, СДСl3); δ 168,63; 164,26; 157,62; 156,73; 139,94; 138; 46; 138,28; 129,89; 128,57; 128,51; 128,44; 128,34; 127,76; 127,25; 122,55; 114,71; 80,606; 66,98; 58,23; 57,33; 25,58.
Результаты анализа из расчета на формулу С28Н23FN2O8S2:
рассчитано: С 56,17; Н 3,87; N 4,68
найдено: С 55,88; Н 3,94; N 4,56.
П р и м е р 2. Дифенилметил-7-феноксиацетамидо-3-винил-3-цефем-4-карбоксилат.
Раствор ацетата палладия (11) (3,6 мг, 0,016 ммоль 0,1 эквивалента) в 1-метил-2-пирролидиноне (2 мл) обрабатывали винилтри-нубутилстаннаном (58,4 мл, 0,2 ммоль, 1,2 эквивалента) в инертной атмосфере и перемешивали смесь в течение 3 мин. Образующуюся темную суспензию обрабатывали затем дифенилметил-7-феноксиацетамидо-3-[(фторсульфонил)окси] -3-це- фем-4-карбоксилатом (100,0 1мг, 0,16 ммоль, 1,0 эквивалент) и реакционную смесь перемешивали в течение 10 минут. Затем ее разбавляли этилацетатом и трижды промывали водой порциями по 20 мл. Органическую фракцию высушивали надсульфатом магния и концентрировали. Сырой остаток коричневого цвета подвергали очистке с помощью флеш-хроматографии на силикагеле (W.R.Grace, 951 W), используя вначале дихлорметан (50 мл) для удаления остатков станнана, а затем 1%-ный этилацетат в дихлорметане (75 мл). После концентрирования получали 74,8 мг (85%) целевого соединения в виде твердого вещества белого цвета.
Результаты анализа.
1Н ЯМР (360 мГц, СДСl3: 7,42-7,23 (комплексн, м, 12 Н); 7-04-6,92 (комплексн. м, 2Н); 6,91 (д. 1Н, J=7,82 Гц); 5,90 (дв. д, 1Н, J 4,9, 9,2 Гц); 5,42 (д. 1Н, J 17,6 Гц); 5,26 (д. 1Н, J 11,2 Гц); 5,02 (д, 1Н, J 4,9 Гц); 4,55 (с, 2Н); 3,62 (А из АВ, 1Н, J 17,7 Гц); 3,36 (В из АВ, 1Н, J 17,7 Гц).13С ЯМР (90,5 мГц, СДСl3): δ 168,66; 164,19; 161,00; 156,82; 139,28; 139,01; 131,79; 129,77; 128,51; 128,39; 128,16; 128,04; 127,72; 127,54; 127,01; 126,48; 122,32; 118,07; 114,69; 79,37; 67,01; 58,47; 57,27; 24,09.
П р и м е р 3. Дифенилметил-7-феноксиацетамидо-3-(Z-1-пропенил)-3-цефем-3-кар- боксилат.
Раствор ацетата палладия (11) (3,6 мл, 0,0116 ммоль, 0,1 эквивалента) в дихлорметане (2 мл) обрабатывали Z-1-пропенилтри-н-бутилстаннаном (66,2 мг, 0,2 ммоль, 1,2 эквивалента) в инертной атмосфере и перемешивали смесь в течение 3 мин. Образующуюся водную суспензию обрабатывали затем добавляемым в один прием дифенилметил-7-феноксиацетамидо-3-[(фторсуль- фонил)окси]-3-цефем-4-карбоксилатом (100,0 мг, 0,16 ммоль, 1,0 эквивалент) и реакционную смесь перемешивали в течение 10 мин.
Затем ее разбавляли дихлорметаном и промывали 10 мл воды. Органическую фракцию высушивали над сульфатом магния и подвергали очистке с помощью флеш-хроматографии на силикагеле (W.R.Grace, 951 W), используя вначале дихлорметан (50 мл) для удаления остатков станнана, а затем 10%-ный этилацетат в дихлорметане (50 мл). После концентрирования получали 80,4 мг (89%) целевого соединения в виде бледно-желтого твердого вещества, которое перекристаллизовывали из изопропилового спирта. В результате получали 62,3 мг (69%) белого твердого продукта. Тплавл 103-104оС.
Результаты анализа.
1Н ЯМР (360 мГц, СДСl3): δ 7,41-6,90 (комплексн, м, 17Н); 6,10 (д, 1Н, J 11,7 Гц); 5,90 (дв. д, 1Н, J 4,5, 9,8 Гц); 5,56 (м, 1Н); 5,07 (д, 1Н, J 4,5 Гц); 4,58 (с, 2Н); 3,47 (А из АВ, 1Н, J 17,5 Гц); 3,28 (В из АВ, 1Н, J17,5 Гц); 1,41 (дв. д, 3Н, J 1,7, 7,1 Гц).
13С ЯМР (90,5 мГц, СДСl3): δ 169,63; 164,28; 161,28; 156,83; 139,42; 139,10; 130,33; 129,80; 129,74; 128,45; 128,28; 128,08; 127,79; 127,81; 127,18; 125,88; 122,37; 114,74; 78,99; 67,06; 58,45; 57,55; 28,50.
П р и м е р 4. Дифенилметил-7-феноксиацетамидо-3-(Z-1-пропенил)-3-цефем-4-кар- боксилат, получаемый через трис(дибензилиденацетон)дипалладий (0).
Раствор трис (дибензилиденацетон)дипалладия (14,6 мг, 0,016 ммоль, 0,1 эквивалента) в дихлорметане (2 мл) или 1-метил-2-пирролидиноне (2 мл) обрабатывали Z-1-пропенил-три-н-бутилстаннатом (66,2 мг, 0,2 ммоль, 1,2 эквивалента) в инертной атмосфере. Полученный раствор обрабатывали затем добавляемым в один прием дифенилметил-7-феноксиацетамидо-3- [(фторсульфонил)окси]-3-цефем-4-кар- боксилатом (100,0 мг, 0,16 ммоль, 1,0 эквивалент). Протекание реакции контролировали с помощью высокопроизводительной жидкостной хроматографии. При использовании в качестве растворителя дихлорметана реакция заканчивалась через 3 ч, в случае же 1-метил-3-пирролидинона продолжительность ее составляла 8 ч. Выход целевого продукта, определенный с помощью высокопроизводительной жидкостной хроматографии, составлял более 98% Идентичность полученных при использовании обоих растворителей продуктов с целевым соединением была подтверждена с помощью ЯМР при 360 мГц.
Остаток подвергали очистке с помощью хроматографии на силикагеле. В результате получали 0,060 г (44%) целевого соединения, идентичность которого была подтверждена с помощью ЯМР.
П р и м е р 5. Третбутил-7-(бензилоксикарбониламино)-3-фторсульфонилокси-1- карба(1-детиа)-3-цефем-4-карбоксилат.
1,35 М раствор фторсульфонилового ангидрида в метиленхлориде (665 мкл, 0,906 ммоль) добавляли по каплям к перемешиваемому, охлаждаемому на бане со смесью сухого льда и ацетона раствору третбутил-7-(бензилоксикарбониламино)-2-окси-1-кар- ба(1- детиа)-3-цефем-4-карбоксилата (158 мкл, 0, 906 ммоль) в метиленхлориде (5 мл). Раствор перемешивали при -78оС в течение 0,25 ч, после чего охлаждающую баню удаляли и продолжали перемешивание при температуре окружющей среды в течение еще 0,25 ч. Раствор затем трижды промывали водой и высушивали над сульфатом натрия. После удаления растворителя в вакууме получали вязкую смолу, которую подвергали очистке с помощью хроматографии на SiO2 (20 г), используя в качестве элюента смесь метиленхлорида и этилацетата в соотношении 95:5. В результате получали 130 мг (выход 30%) целевого соединения в виде вязкой смолы, которую пререкристаллизовывали из смеси этилацетата и гексана, получая бесцветные кристаллы (56 мг) с Тплавл. 118оС (с разложением).
Результаты анализа.
1Н ЯМР (СДСl3, 300 1мГц): δ 7,35 9(с, 5Н); 5,37 (м, 1Н); 5,22 (м, 1Н); 5,11 (С, 2Н); 3,87 (м, 1Н); 2,65 (м, 2Н); 2,13 (м, 1Н); 1,68 (м, 1Н); 1,53 (с, 9Н).
Масс-спектр: (положительный ион FAB, NOBA) m/z 471 (М + 1).
Реферат
Использование: в химико-фармацевтической промышленности в качестве промежуточных продуктов для синтеза цефалоспориновых антибиотиков, в частности соединений ф-лы II, где R1-(C2-C6) алкиленил, Z S или CH2 Q H C2H5OCH2CO C6H5CH2OCO P H t-C4H9 (C2H5)2CH Сущность изобретения: производные цефема или карба (детиа)цефема ф-лы (I), где Z - определено выше, Q-C6H5OCH2CO C6H5CH2OCO,P=t=C4H9 (C6H5)2CH Реагент 1: оксизамещенные производные цефема или карби(детиа)цефема ф-лы (III), где Z, Q и P указаны выше. Реагент 2: фторсульфоновый гидрид. Условия реакции: органический растворитель, 0 78°С в присутствии основания. Структура ф-л I, II, III
Формула
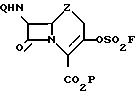
где Z сера или метиленовая группа;
Q феноксиацетильная или бензилоксикарбонильная аминозащитная группа;
P трет.бутильная или дифенилметильная карбоксизащитная группа,
в качестве промежуточных для получения цефалоспориновых антибиотиков общей формулы
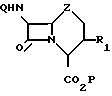
где R1 C2-C6 -алкенил;
Z имеет указанные значения;
Q водород, феноксиацетильная или бензилоксикарбонильная аминозащитная группа;
P водород, трет.бутильная или дифенилметильная карбоксизащитная группа.
21.11.89 при Z сера или метиленовая группа, Q феноксиацетильная группа, P дифенилметильная группа;
31.10.90 при Z сера или метиленовая группа, Q бензилоксикарбонильная группа, Р трет.бутильная группа.

Комментарии