Производные 1-карба-(1-детиа)-цефема - RU2107067C1
Код документа: RU2107067C1
Чертежи



Описание
Изобретение касается антибиотиков 1-карба-(1-детиа)-цефема, фармацевтических композиций, содержащих антибиотики, и методы лечения инфекционных заболеваний у человека и других животных и промежуточных продуктов для их получения.
Антибиотики 1-карба-(1-цетиа)-цефема имеют бициклическую
кольцевую систему,
представленную следующей ниже формулой, в которой нумерационная система является обычно принятой в произвольной терминологической системе цефема:
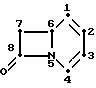
1-Карба-(1-детиа)-цефема для удобства рассматриваются здесь как 1-карба-3-цефем-4-карбоновые кислоты или некоторые из их производных.
Получение 1-карбацефалоспоринов (или 1-карба-(детиа)-3-цефемов) и их C-3-замещенных метильных производных раскрыто Christensen et al в патенте США N 422866. Hirata et al в патенте Великобритании N 2041923 описывают способ получения 3-H- и 3-гало-1-карбацефалоспоринов, тогда как Hatanaka et al. , Tetrahedron Letter 24, N 44, с. 4837 - 4838 (1983) описывают способ получения 3-окси-(±)-1-карбацефалоспоринов.
В области антибактериальной терапии необходимость в получении новых химиотерапевтических средств никогда не исчерпывается. Часто появляются мутантные штаммы микроорганизмов, устойчивые против существующих антибактериальных средств. В частности, многие штаммы Staph aureus и Staph epi (так называемые устойчивые к метициллину стафилококки) становятся в возрастающей степени устойчивы к доступным антибактериальным средствам (см., например, Philleps J and Cookson. B. Appl Bacteriology (6), 1989).
Чтобы удовлетворить эту потребность, продолжаются значительные наилучшие исследования, направленные на создание таких новых средств. Настоящее изобретение предусматривает противомикробные средства, полезные против широкого спектра грамположительных и грамотрицательных бактерий. Соединения согласно настоящему изобретению особенно полезны в борьбе против устойчивых к метициллину стафилококковых микроорганизмов.
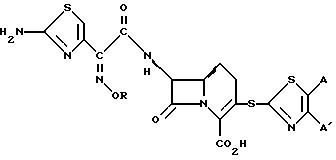
Настоящее изобретение предусматривает различные 3-тиазолотио- 1-карба-(1-детиа)-3-цефемы, полезные в качестве антибактериальных средств. В частности, настоящее изобретение предусматривает 7 β -(2-аминотиазол-4-ил)-оксимино- (или алкоксимино)-ацетиламино-1-карба-(1-детиа)-3- необязательно замещенные тиазолотио-3-цефем-4-карбоновые кислоты, полезные в качестве антибактериальных средств, в частности, при лечении устойчивых к метициллину Staphilococci.
Изобретение предусматривает также формацевтические композиции и терапевтический метод их использования в лечении антибактериальных инфекций у человека и других животных.
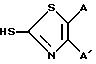
Настоящее изобретение предусматривает соединения формулы (I)
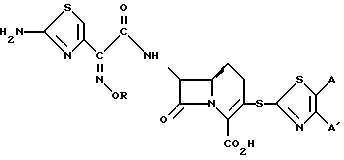
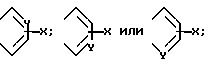
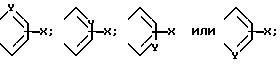
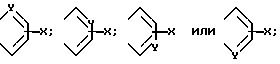
в которой R представляет собой водород, C1-C6-алкил, C2-C6-алкенил, C2 C6-алкинил, C3-C6-циклоалкил или C1-C6-галоидалкил; A и A' независимо друг от друга представляют собой водород, C1-C6 -алкил, нитро, амино, 5- или 6-членный гетероцикл, содержащий азот или серу; C1-C6-алкокси, или фенил; или A и A', вместе взятые, образуют группу формул
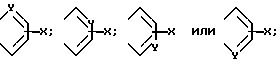
В которых X представляет собой водород, галоид, C1-C6-алкил, C1 -C6 -алкокси, C1-C6-алкоксикарбонил, амино, нитро или карбокси, и Y является азотом или углеродом, или его фармацевтически приемлемую соль.
Термин "фармацевтически приемлемая соль" включает соли, которые образуются с карбоксилатными анионами, и включает соли, образованные с органическими и неорганическими катионами, такими как противоионы, выбранные из щелочных и щелочноземельных металлов (таких как литий, натрий, калий, барий и кальций) аммонием и органическими катионами (такими как дибензиламмоний, бензиламмоний, 2-оксиэтиламмоний, бис-(2-оксиэтил)-аммоний, фенилэтилбензиламмоний, дибензилэтилендиаммоний и тому подобными катионами). Другие катионы, входящие в понятие термина, включают протонированные формы прокаина, хинина и N-метилглюкозамина и протонированные формы основных аминокислот, таких как глицин, орнитин, гистидин, фенилглицин, лизин и аргинин. Кроме того, любая цвиттерионная форма соединений, представленных формулой (I), образованная карбоновой кислотой и аминогруппой, относится к этому термину. Предпочтительным катионом для карбоксилатного аниона является катион натрия. Более того, термин включает соли, образующиеся в стандартных кислотно-основных реакциях с основными группами (такими как аминогруппы) и органическими или неорганическими кислотами. Такие кислоты включают хлористоводородную серную, фосфорную, уксусную, янтарную, лимонную, молочную, малеиновую, фумариновую, пальмитиновую, холевую, памоиновую кислоту, слизевую, Д-глутаминовую, α -камфорную, глутаровую, фталевую, винную, лауриновую, стеариновую, салициловую, метансульфоновую, бензолсульфоновую, сорбиновую, пикриновую, бензойную, коричную и тому подобные кислоты.
В приведенной формуле (I) термин "C1 -C6-алкил" означает такие радикалы, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, трет-амил, гексил и тому подобные. Предпочтительным C1-C6 -алкилом является метил.
Термин "C2-C6-алкенил" является низшим алкенилом с прямой и разветвленной цепью, например, винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил, металлил, или 1,1-диметилаллил.
Термин "C2-C6-алкинил" является низшей аклинильной группой с прямой или разветвленной цепью, например, этинил, 1-пропинил или пропаргил.
Термин "C3-C10-циклоалкил" представлен циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклогептилом, норборнилом или адамантилом.
Термин "C1-C6-галоидалкил" означает упомянутые выше C1-C6-алкильные группы, которые замещены одним галогеном, в которых "галоид" или "галоген" означает группы хлора, брома, иода и фтора. Предпочтителен фтор-C1-C6-алкил. Фторэтил является другой предпочтительной "C1-C3 -галоидалкильной группой".
Термин "C1-C6-алкокси" относится к группам, таким как метокси, этокси, бутокси и тому подобные.
Термин "галоид" включает атомы фтора, хлора, брома и иода.
Термин "C1-C6-алкоксикарбонил" относится к таким группам, как метоксикарбонил, этоксикарбонил, 3-пропоксикарбонил, 3-этоксикарбонил, 4-трет-бутоксикарбонил, 3-метоксикарбонил, 6-метоксикарбонил и тому подобные.
Термин "5-6-членный гетероцикл, содержащий азот или серу включает пиридин и тиофен, и может включать более, чем азот или серу и их сочетания. Другие примеры включают гетероциклы, описанные Fletcher, Dermer and Otis, Nomenclature of Organic Compounds с. 49-64 (1974), приведенной в библиографической ссылке к описанию.
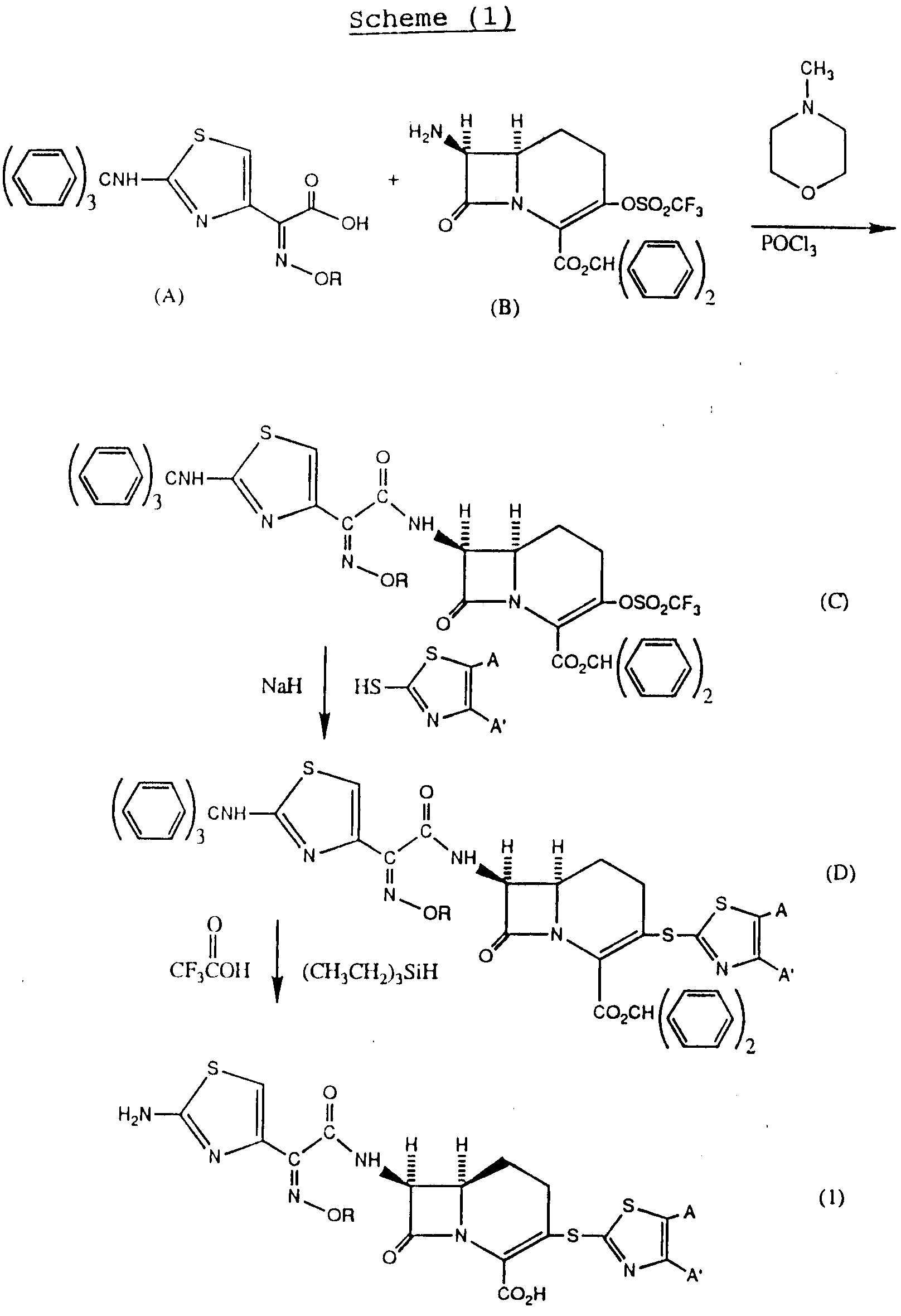
Соединения формулы (I) могут быть получены по схеме реакций приведенной в конце описания.
Исходное соединение (A), в котором R является метилом, 2-(тритил)-амино- α -(метоксиамино)-4-тиазолуксусная кислота, может быть получено из соответствующего свободного амина (поставляемого Alolrich Chemical Co, Inc., 940 West Saint Paul Avenue, Milwaukee Wisconsin (53233), используя известную в химии β -лактамов технологию.
Исходное соединение (B) или бензгидриловый эфир 7-амино-1-карба-(детиа)-/2трифторметансульфонилокси-3-цефем-4 -карбоновой кислоты может быть получен известными способами, как описывают Evans et al, в патенте США N 4673737.
На схеме
(I) реакций хлорангидрид кислоты (A) может быть получен известными методами, например, реакцией с хлористым фосфорилом и взаимодействием со свободным амином (B) с получением 7-ацил-3-трифлата (C).
Тиазолотиогруппа может быть затем введена взаимодействием трифлата (C) с соединением формулы
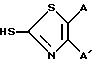
в присутствии основания, такого как гидрид натрия. Конечный продукт формулы (I) затем может быть получен удалением амино- и карбоксизащитных групп. В приведенной выше схеме смесь трифтоуксусной кислоты и (CH3CH2)3SiH использовали для удаления тритильных и бензгидрильных групп. В области химии β -лактамов будет понятно, что и другие защитные группы могут быть эффективными. Далее можно также ввести тиазолотиофункцию в 3-положение ядра цефема (B)до введения 7-ацильных функций и получить полезные промежуточные соединения, представленные в формуле (2) ниже.
Соединения формулы
где A и A1, вместе взятые, образуют группу формул
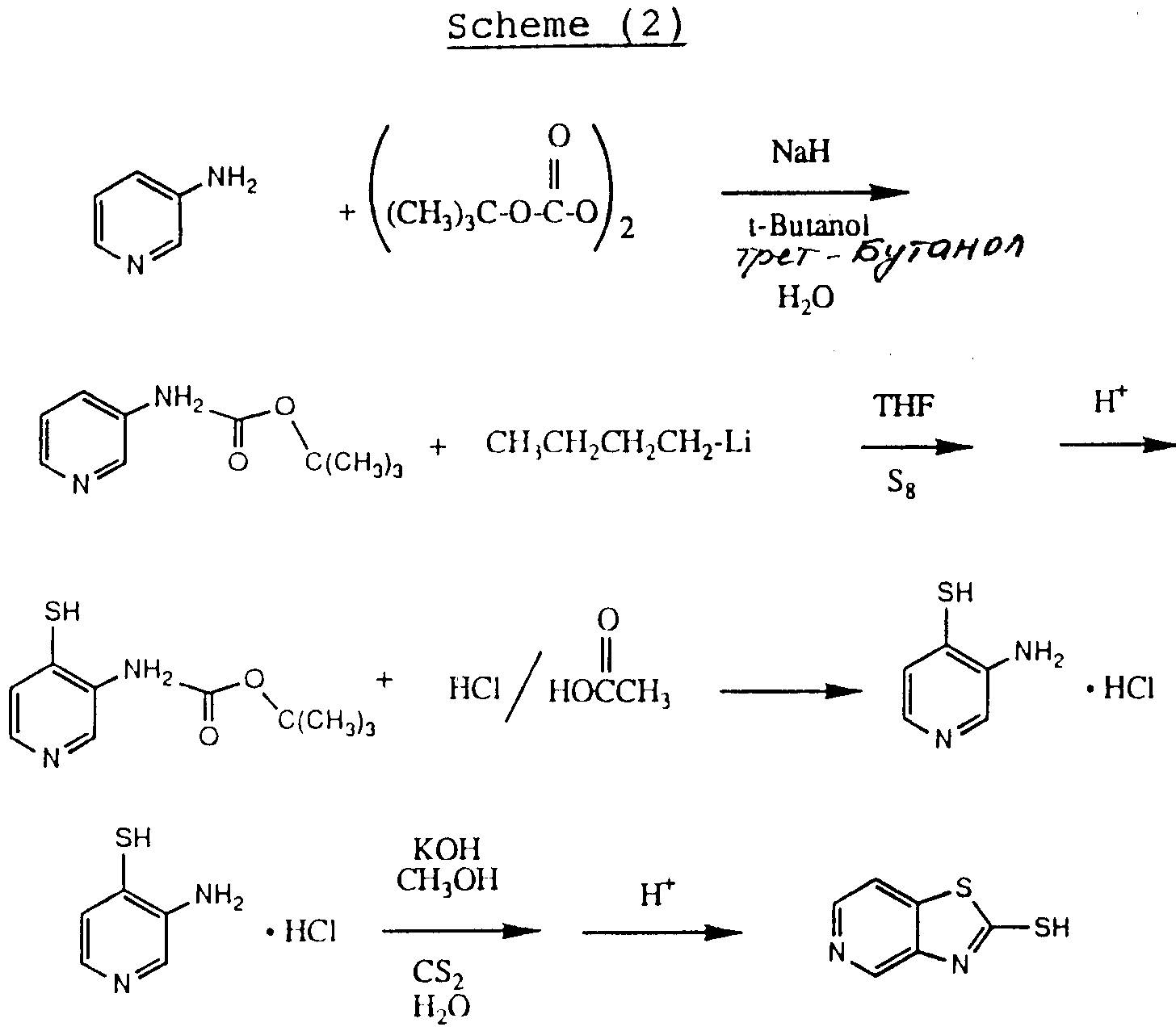
и Y является азотом, могут быть получены по схеме (2) реакций приведенной в конце описания
В схеме (2) реакций 3-аминопиридин ацилируют ди-трет-бутилбикарбонатом для введения трет-бутоксикарбонильной защитной группы. (Следует иметь в виду, что два других пиридинотиазолотиомеркаптана могут быть получены известными методами, используя другие изомеры аминопиридина), 3-аминопиридин с защищенной трет-бутоксикарбонильной группой обрабатывают затем H-бутиллитием в тетрагидрофуране с последующей обработкой элементарной серой (S8). Полученный 3-трет-бутоксикарбониламино-4-тиапиридин обрабатывают смесью уксусной кислоты и хлористоводородной кислоты, чтобы получить гидрохлорид 3-амино-4-меркаптопиридина. Желаемый 5-пиридинотиазолотиомеркаптан затем получают обработкой этого соединения сероуглеродом в щелочных условиях.
Если A и A1 взяты вместе для образования группы формулы
то желаемый тиол формулы
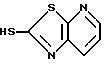
может быть получен, как указано на схеме (3) реакций
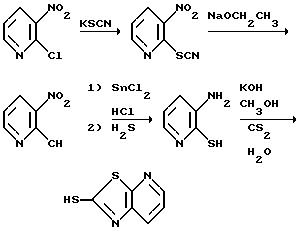
На приведенной выше схеме 2-хлор-3-нитропиридин обрабатывают изотиоцианатом калия с получением 2-изоцианато-3-нитропиридина, который в свою очередь гидролизуют для получения 2-меркапто-3-нитропиридина. Промежуточное 3-нитросоединение затем восстанавливают обработкой смесью хлористого олова (2) и хлористоводородной кислоты с получением 2-меркапто-3-аминопиридина. Желаемый пиридинотиазолотиомеркаптан получают затем основной каталитической конденсацией с сероуглеродом (смесь гидроокиси калия, метанола, сероуглерода и воды).
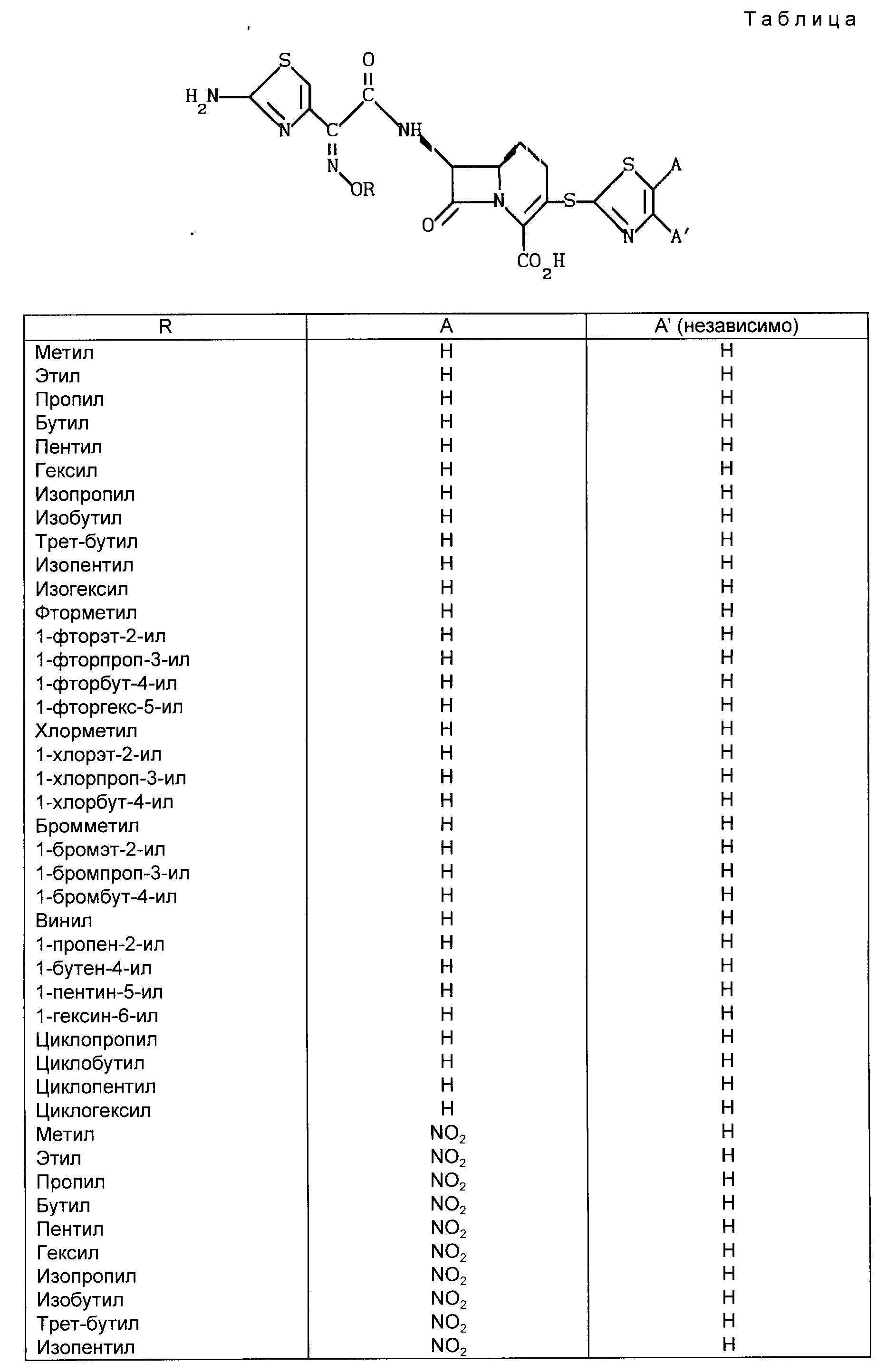
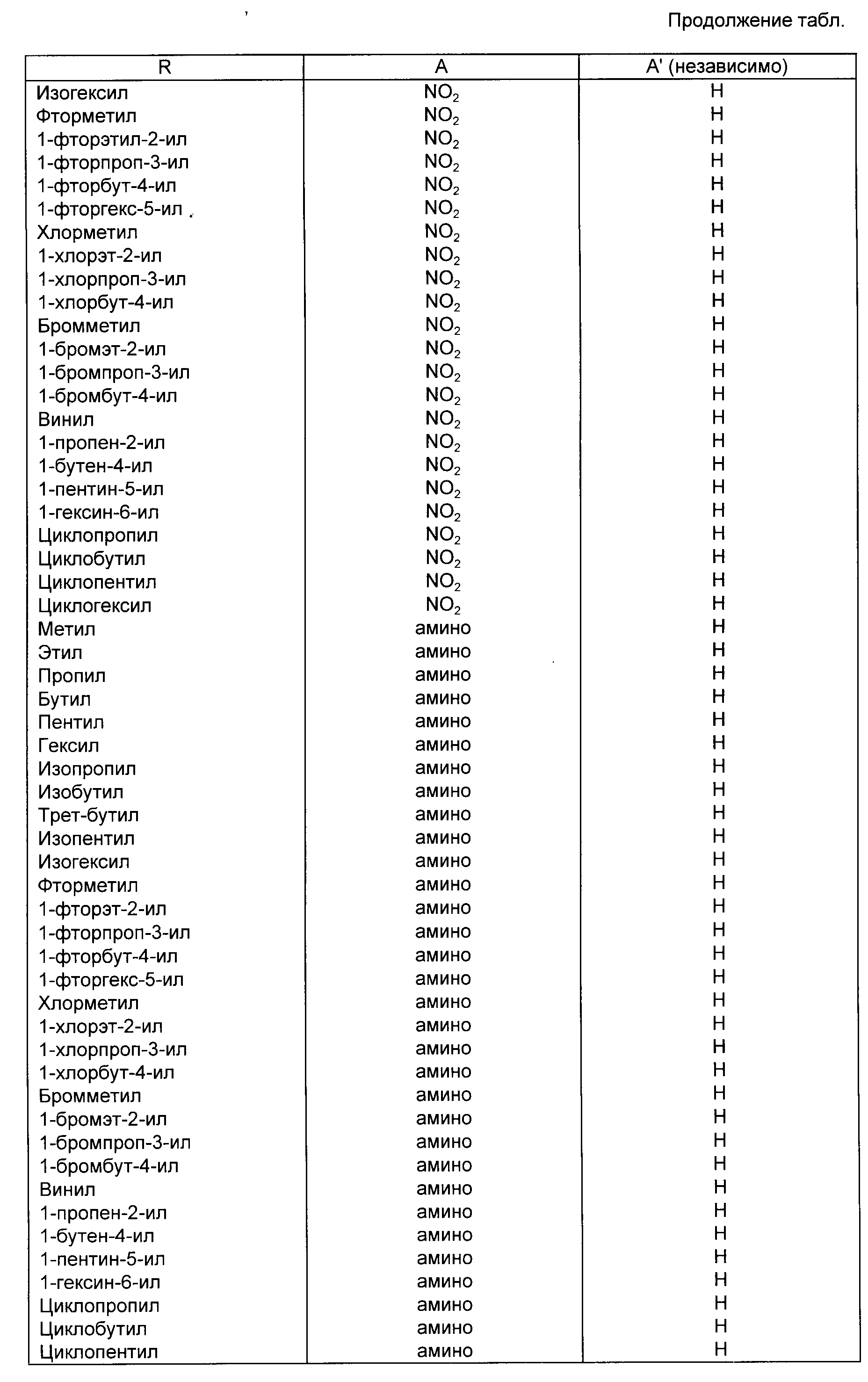
Примеры соединений, входящих в объем формулы (1), представлены в таблице.
В приведенной выше формуле (I) R предпочтительно является C1-C9-алкилом или C1-C6-галоидалкилом. Предпочтительной C1-C6-алкильной группой является метил. Предпочтительно C1-C6-галоидалкильной группой является фтор-C1-C6-алкил. Далее предпочтительной фтор-C1-C6-алкильной группой является 2-фторэт-1-ильная группа.
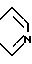
В приведенной выше формуле (I) предпочтительно, чтобы A и A' взяты вместе для образования группы формул
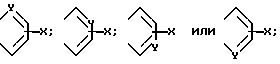
Далее предпочтительно, чтобы Y являлся азотом и A и A', вместо взятые, образуют группу формулы.
например, для получения соединения формулы
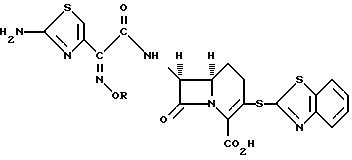
или его фармацевтически приемлемой соли. Два других предпочтительных соединения приведенной выше формулы являются соединениями, в которых R - метил или 2-фторэт-1-ил.
Это изобретение касается также способа лечения инфекционных заболеваний у человека и других животных и фармацевтических композиций, пригодных для применения в этом методе лечения. Терапевтический метод изобретению включает введение человеку или другому животному антибиотически эффективной нетоксичной дозы соединения, представленного формулой (I), или его фармацевтически приемлемой соли.
Антибиотически эффективным количеством является количество соединения от 25 мг до 2 г. Соединение, его соль или сложный эфир могут быть введены в однократной дозе или дробными многократными дозами в течение дня. Лечение может продолжаться от одной недели до 10 дней или дольше в зависимости от течения инфекции. Конкретная доза и режим лечения могут зависеть от таких факторов, как вес и возраст пациента, конкретный возбудитель инфекции, тяжесть инфекции, общее состояние здоровья больного и переносимость конкретного антибиотика.
1-Карба-(1-детиа)-цефем может быть введен парентерально, подкожно или ректально. Как и с другими β -лактамовыми антибиотиками, способ согласно изобретению может быть использован профилактически для предупреждения инфекций после контактирования или до возможного воздействия, например, предоперационно. Антибиотик может быть введен обычными методами, например, шприцем или капельницей для внутреннего вливания.
Фармацевтически приемлемые соли могут быть полезными формами антибиотиков для получения фармацевтических композиций антибиотиков.
Фармацевтическое композиции согласно изобретению содержат антибиотически эффективное нетоксичное количество соединения, представленного формулой (I), или его фармацевтически приемлемой нетоксичной соли и фармацевтически приемлемый носитель.
Лекарственные формы для парентерального применения антибактериального средства для инъекции готовят на воде для инъекции, растворе Рингера, физиологическом растворе глюкозы. Антибиотик может быть также введен в венозный кровоток капельным методом.
Для парентерального применения антибактериальное средство формулы (I) или его фармацевтически приемлемая соль могут быть приготовлены предпочтительно в форме сухого кристаллического порошка или лиофилизированного порошка и помещены в ампулы. Такие ампулы могут содержать от 100 мг до 2,0 г антибиотика на ампулу (флакон).
Предусмотрены новые промежуточные соединения формулы (2).
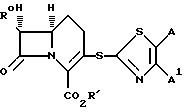
в которой R0 является амино- или замещенной аминогруппой; R' - водородом или карбоксизащитной группой, и A и A' независимо друг от друга - водородом, C1-C6-алкилом, фенилом, нитро, амино, 5-или 6-членным гетероциклом, содержащим азот или серу, или C1-C6-алкоксигруппой; или A и A', вместе взятые, образуют группу формулы
в которых X является водородом, C1-C6-алкилом, C1-C6-алкокси, C1-C6-алкоксикарбонилом, нитро или карбокси, и Y представляет собой азот или углерод.
В формуле (2) термин "карбоксизащитная группа" относится к одному из производных сложного эфира группы карбоновой кислоты, обычно применяемой для блокирования или защиты группы карбоновой кислоты при проведении взаимодействия на других функциональных группах соединения. Примеры таких защитных групп карбоновой кислоты включают 4-нитробензил, 4-метоксибензил, 3,4-диметоксибензил, 2,4-диметоксибензил, 2,4,6-триметоксибензил, 2,4,6-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрид, 4,4-диметоксибензгидрил, 2,2,4,4'-тетраметоксибензгидрил, трет-бутил, трет-амил, тритил, 4-метокситритил, 4,4'-диметокситритил, 4,4', 4''-триметокситритил, 3-фенилпроп-2-ил, триметилсилил, трет-бутилдиметилсилил, фенацил, 2,2',2''-трихлорэтил, β -(триметилсилил)-этил, (β -ди-(н-бутил)-метилдилил)-этил, пара-толуолсульфонилэтил, 4-нитробензилсульфонилэтил, аллил, циннамил, 1-(триметилсилилметил)-проп-1-ен-3-ил и тому подобные части молекулы. Вид применяемой карбоксизащитной группы не является критическим, поскольку полученная карбоновая кислота остается стабильной в условиях проведения последующих (их) реакции(ий) на других положениях молекулы, и может быть удалена (защитная группа) в нужный момент без разрушения остатка молекулы. В частности, важно не подвергать карбоксизащищенную молекулу воздействию сильными нуклеофильными основаниями или восстановительными условиями, применяя высокоактивные металлические катализаторы, такие как никель Ренея. (Таких жестких восстановительных условий следует также избегать при удалении аминозащитных групп, упоминавшихся в описании). Предпочтительная защитными группами карбоновой кислоты являются аллил, бензгидрил, и пара-нитробензильные группы. Аналогичные карбоксизащитные группы, применяемые в химии цефалоспоринов, пенициллинов и пептидов, могут быть также использованы для защиты карбокси-группы. Другие примеры этих групп находят у E. Haslam, "Protective Groups in Organic Chemistry", J.G.W. McOmie, Ed., Pleneem Press, New York, N. J. , 1973, Chapter 5, and T. W. Greene, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York, N. J., 1981, Chapter 5.
Термин "защищенная аминогруппа", использованный в связи с формулы (2), относится к аминогруппе, замещенной группой, обычно применяемой для блокирования или защиты аминофункциональности в процессе взаимодействия других функциональных групп соединения. Примеры таких аминозащитных групп включают формильную группу, тритильную группу, трет-бутоксикарбонильную группу, фталимидогруппу, феноксиацетильную, трихлорацетильную, хлорацетильную, бромацетильную и иодацетильную группу, блокирующие группы типа уретана, такие как бензилоксикарбонил, 4-фенилбензилоксикарбонил, 2-метил-бензилоксикарбонил, 4-метоксибензилоксикарбонил, 3-хлорбензилоксикарбонил, 2-хлорбензилоксикарбонил, 2,4-дихлорбензилоксикарбонил, 4-бромбензилоксикарбонил, 3-бромбензилоксикарбонил, 4-нитробензилоксикарбонил, 4-цианобензилоксикарбонил, 2-(4-бифенилин)-изопропоксикарбонил, 1,1-дифенилэтил-1-илоксикарбонил, 1,1-дифенилпроп-1-илоксикарбонил, 2-фенилпроп-2-илоксикарбонил, 2-(пара-толуол)-проп-2-илоксикарбонил, циклопентанилоксикарбонил, 1-метилциклопентанилоксикарбонил, циклогексанилоксикарбонил, 2-(4-толуилсульфонил)-этоксикарбонил, 2-(метилсульфонил)-этоксикарбонил, 2-(трифенилфосфино)-этоксикарбонил, 9-флуоренилметоксикарбонил ("FMOC"), 2-(триметилсилил)-этоксикарбонил, аллилоксикарбонил, 1-(триметилсилилметил)-проп-1-енил-оксикарбонил, 5-бензизоксалилметоксикарбонил, 4-ацетоксибензилоксикарбонил, 2,2, 2-трихлорэтоксикарбонил, 2-этинил-2-пропоксикарбонил, циклопропилметоксикарбонил, 4-(децилокси)-бензилоксикарбонил, изоборнилоксикарбонил, 1-пиперидилоксикарбонил и тому подобные: бензоилметилсульфонильная группа, группа дифенилфосфиноксида и тому подобные аминозащитные группы. Вид применяемой аминозащитной группы не является критическим постольку, поскольку получаемая производная аминогруппа является стабильной в условиях последующих реакций в других положительных молекулы и может быть удалена в подходящий момент без разрушения остаточной молекулы. Предпочтительными аминозащитными группами являются алкоксикарбонил, феноксиацетил, трет-бутоксикарбонил и тритил. Аналогичные аминозащитные группы, используемые в химии цефалоспорина, пенициллина и пептидов, включаются также в объем понятий упомянутого выше термина. Другие примеры групп, относящихся к упомянутому выше термину, описаны J.W. Barton, "Protective Groups in Organic Chemistry", J.G.W. McOmil, Ed., Plenum Press, New York, N.J., 1973, Chapter 2, and T.W.Green, "Protective Groups in Organic Synthesis", John Wiley and Sons, New York N.Y., 1981, Chapter 7.
В
формуле (2)
предпочтительны соединения, в которых A и A1, взятые вместе, образуют группы формул
Особенно предпочтительно, когда A и A1, вместе взятые, образуют группы формулы
получая при этом соединение формулы
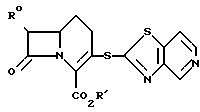
Соединения формулы (2) полезны в
качестве промежуточных соединений при получении антибактериальных средств представленной выше формулы (1). Соединения формулы (2) могут быть получены методами,
показанными на схеме (1) реакций,
замещенная 3-трифлатную часть молекулы желаемым тиолом формулы
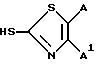
используя 7-защищенный амино-1-карба-(1-детиа)-3-трифторметансульфонилокси-3-цефем-4- (защищенный)-цикл.
Конечные продукты формулы (1) могут быть получены затем из промежуточных соединений формулы (2) снятием защиты 7-аминофункции с последующим ацилированием желаемой ацильной группой и последующим удалением амино- и карбоксизащитных групп.
В экспериментальной части представлены дальнейшие примеры на различные аспекты настоящего изобретения, которые не ограничивают объема изобретения.
Экспериментальная часть.
Получение 1. 2-(трет-бутилоксикарбонил)-аминопиридин.
76,13 г (0,81 ммоля) 3-аминопиридина растворяли в 500 мл воды вместе со 150 мл трет-бутанола и 34 г (0,85 ммоля) гидроокиси натрия, охлаждали в ледяной бане и обрабатывали 200 г (0,92 ммоля) ди-третбутилбикарбоната. Примерно через 2,5 дня добавляли еще 100 г ди-трет-бутилоксикарбоната. Затем реакционную смесь вымывали в смесь этилацетата и воды. Органическую фазу отделяли и оставшуюся водную фазу экстрагировали этилацетатом. Объединенные органические порции сушили над безводным сульфатом натрия, концентрировали в вакууме, очищали экспресс-хроматографией и получали 97 г (80%) соединения, указанного в названии примера.
Спектр ЯМР (300 МГц, CDCl3), δ: 8,43 (д., J = 1,5 Гц, 1H), 8,26 (д., J = Гц, 1H), 7,97 (широкий дублет, J= 6 Гц, 1H), 7,24-7,20 (м., 1H), 6,81 (шир. с., 1H), 1,51 (с., 9H).
ИК-спектр (KBr, см-1): 3167, 2986, 1716, 1598, 1547, 1407, 15566, 1233, 1154, 1017.
Масс-спектр: m/e 195 (M+).
УФ-спектр (этанол): λ = 281 нм ( ε = 3350)
λ = 235 нм ( ε = 15200).
Получение 2. 3-(трет-бутоксикарбонил)-амино-4-меркаптопиридин.
10 г (51,5 ммоля) 3-(трет-бутоксикарбонил)-аминопиридина растворяли в 10 мл тетрагидрофурана и охлаждали до -78oC в атмосфере азота. Затем двумя порциями добавляли 80 мл (128 ммолей) 1,6 М в гексане) н-бутиллития. Реакционную смесь помещали в ледяную баню с ацетоном и растворяли полученное твердое вещество. Примерно через два часа реакционную смесь охлаждали до -78oC и обрабатывали 2 г (7,8 ммоля) элементарной серы. Примерно через полчаса реакционную смесь нагревали до комнатной температуры и реакцию гасили насыщенным раствором хлористого аммония. Обработка и экспресс-хроматография (50%-я смесь гексан-этилацетат) давали 5,24 г (45%) целевого соединения, указанного в названии примера.
Точка плавления: 170-171oC (разлагается).
Спектр ЯМР (300 МГц, DMCO-d6), δ : 12,88 (шир.синглет, 1H), 8,95 (с., 1H), 8,45 (широкий синглет, 1H), 7,62 (шир.дублет, J= 3 Гц, 1H), 7,44 (д., J= 3 Гц, 1H), 1,49 (с., 9H).
ИК-спектр (KBr, см-1): 3239, 2978, 2885, 2741, 1721, 1608, 1530, 1492, 1436, 1384, 1213, 1161, 1085.
Масс-спектр: FDMS m/e 227 (M+).
УФ-спектр (этанол): - λ = 345 нм ( ε = 19600) - λ = 259 нм ( ε = 10200) - λ - 224 нм ( ε = 17200).
Получение 3. 3-амино-4-меркаптопиридин, гидрохлорид
13,78 г (0,06 ммоля) 3-(трет-бутоксикарбонил)-амино-4-меркаптопиридина растворяли в уксусной
кислоте
(250 мл) и добавляли к охлажденному льдом раствору примерно 3 н. хлористоводородной кислоты в уксусной кислоте, который получали пропусканием газообразного водорода через ледяную уксусную
кислоту (100
мл). Через четыре часа полученное твердое вещество отфильтровывали, промывали диэтиловым эфиром, сушили в вакууме и получали 10,4 г (около 100%) целевого соединения, указанного в
названии примера.
Точка плавления: выше 200oC.
Спектр ЯМР (300 МГц, DMCO-d6), δ : 8,17 (с., 1H), 7,99 (д., J= 3 Гц, 1H), 7,81 (д., J= 3 Гц, 1H), 5,60-4,00 (ш., 4H).
ИК-спектр (KBr, см-1): 3184, 3054, 2848, 1639, 1586, 1482, 1442, 1134, 1123.
Масс-спектр: FDMS m/e 126 (М-36).
УФ-спектр (этанол): - λ = 355 нм ( ε = 13900) - λ = 264 нм ( ε = 6830) - λ = 223 нм ( ε = 13100).
Получение 4. 2-меркапто-5-пиридинотиазол
13 г (0,198
ммоля) гидроокиси калия растворяли в 32 мл воды и 154 мл метаноле. Этот раствор обрабатывали затем 3,8 мл (0,063 ммоля) сероуглерода, затем 10,4 г )0,06 ммоля) гидрохлорида
3-амино-4-меркаптопиридина.
После оставления на ночь при перемешивании и нагревании с обратным холодильником реакционную смесь обрабатывали активированным углем и фильтровали через Hyflo Super
CelTM. Фильтрат
подкисляли уксусной кислотой, что вызывало образование твердого вещества. Полученное твердое вещество сушили в вакууме при 50oC примерно три часа и при комнатной
температуре 2,5 дня и
получали 8,19 г (81%) целевого соединения.
Точка плавления: выше 310oC (разлагается).
Спектр ЯМР (300 МГц, DMCO-d6), δ: 14,03 (шир.синглет, 1H), 8,46 (с., 1H), 8,33 (д., J= 6 Гц, 1H), 7,75 (д., J= 6 Гц, 1H).
ИК-спектр (KBr, см-1): 3440 (шир. ), 2650 (шир.), 2510 (шир.), 1528, 1457, 1305, 1294, 1265, 1256, 1039, 1024, 815.
Масс-спектр: EIMS m/e 168 (M+).
Получение 2. Бензгидриловый эфир 7 β - феноксиацетиламино-1-карба-(1-детиа)-3-трифторметансульфонилокси-3- цефем-4-карбоновой кислоты.
Целевое соединение получали по методу Эванса и соавторов, описанному в патенте США N 4637737, приведенному в библиографической справке. Реакция обмена упомянутых выше амино- и карбоксизащитных групп или использование альтернатив могут быть выполнены известными в химии β -лактамов способами. См., например, Protective Groups in Organic Synthesis, Theodora W. Greene, New Jork Johu Wiley and Sons, 1981.
Пример 1. 7 β -/(2-аминотиазол-4-ил)-(Z)-метоксиминоацетил/- амино-1-карба-(1-детиа)-3-/2-(5-пиридиноатиазолотио)/-цефем-4- карбоновая кислота.
A. Бензгидрил-7 β -амино-1-карба-(1-детиа)-3-трифторметан- сульфонилокси-3-цефем-4-карбоксилат.
50 г (79 ммолей) бензгидрилового эфира 7 β -феноксиацетиламино-1-карба-(детиа)-3-трифторметансульфонилокси-3- цефем-4-карбоновой кислоты растворяли в 500 мл дихлорметана, охлаждали в ледяной бане с водой и обрабатывали 7,7 (95 ммолей) пиридина, с последующей обработкой 18,2 (87 ммолей) пятихлористого фосфора. Через четыре часа добавляли дополнительно 7,7 мл пиридина и 18,2 г пятихлористого фосфора. Реакционную смесь переносили канюлей в раствор 80 мл изобутилового спирта и 1000 мл дихлорметана, охлажденного в водяной бане со льдом. После перемешивания при комнатной температуре в течение 20 мин реакционную смесь разбавляли водой. Водную фазу отделяли и экстрагировали дихлорметаном. Объединенные органические части промывали насыщенным раствором бикарбоната натрия, рассолом и сушили над безводным сульфатом магния. Полученную органическую фазу концентрировали до 500 мл и использовали в части B ниже.
B. Бензиловый эфир 7 β -/2-(трифенилметил)-аминотиазол-4-ил)- (Z)-метоксиминоацетил/-амино-1-карба-(1-детиа)-3-трифторметансульфонилокси- 3-цефем-4-карбоновой кислоты.
35 г (79 ммолей) 20(трифенилметил)-аминотиазол-4-ил (Z)-метоксиминоуксусной кислоты растворяли в 1 л дихлорметана, охлаждали в ледяной бане с ацетоном и обрабатывали 8,1 (74 ммоля) N-ьетилморфолина и затем 6,9 (74 ммоля) хлорокиси фосфора. Через 20 мин добавляли материал, полученный в части A выше, с последующим добавлением N-метиофорфолина. Реакционную смесь нагревали до комнатной температуры и затем разбавляли рассолом. Водную фазу отделяли, экстрагировали дихлорметаном и объединенные органические экстракты промывали рассолом, сушили, очищали колоночной хроматографией и получали 12,65 г целевого соединения, указанного в названии примера 1, части (B) выше.
C/ Бензиловый эфир 7 β -/2-(трифенилметил)-аминотиазол-4-ил)- (Z)-метоксиминоацетил/-амино-1-карба-(1-детиа)-3-/2-(5- пиридинотиазолотио)/-3-цефем-4-карбоновой кислоты.
12 мг (0,5 ммоля) гидрида натрия (20 мг, 60 % суспензия) промывали гексаном, суспендировали в 5 мл тетрагидрофурана и обрабатывали 84 мг (0,5 ммоля) 2-меркапто-5-пиридинотиазола. Полученную смесь нагревали, чтобы вызвать растворение, и затем переносили тремя частями в раствор 461 мл (0,5 ммоля) продукта, полученного в части B, выше растворенного в 5 мл тетрагидрофурана. Реакционную смесь затем нагревали с обратным холодильником, охлаждали, разбавляли этилацетатом и последовательно промывали 1 н. хлористоводородной кислотой (один раз), насыщенным раствором бикарбоната натрия (один раз) и рассолом. После осушивания над сульфатом магния неочищенный продукт очищали колоночной хроматографией (75 % смесь этилацетата и гексана в качестве элюента) и получали 350 мг (74%) целевого соединения, указанного в названии части C выше.
Спектр ЯМР (300 МГц, DMCO-d6), δ: 9,30 (д., J = 10 Гц, 1H), 9,11 (с., 1H), 8,78 (с., 1H), 8,47 (д., J = 6 Гц, 1H), 8,07 (д., J = 7 Гц, 1H), 7,40 - 7,07 (м. , 25H), 6,86 (с., 1H), 6,70 (с., 1H), 5,59 - 5,49 (м., 1H), 4,03 - 3,93 (м., 1H), 3,78 (с., 3H), 2,73 - 2,45 (шир. мултиплет, 2H), 1,96 - 1,66 (широкий мультиплет, 2H).
D. Снятие защиты
для получения целевого соединения
350 мг (0,37 ммоля) соединения, полученного в части (C) выше, растворяли в смеси 5 мл трифторуксусной кислоты и 2 мл триэтилсилана и перемешивали около 10
мин. Затем реакционную смесь разбавляли 40 мл толуола и смесь концентрировали в вакууме. Обращеннофазовой колоночной хроматографией (17 % смесь цианистого метила в воде) получали 33,3 мг соединения,
указанного в названии примера 1.
Спектр ЯМР (300 МГц, DMCO-d6), δ : 9,39 (д., J = 4 Гц, 1H), 9,20 - 9,06 (шир. , 1H), 8,56 - 8,34 (широкий, 1H), 8,15 - 8,07 (шир., 1H), 7,21 (с., 2H), 6,86 (с., 1H), 5,55 (дд., J = 3 Гц, 1H), 5,04 - 3,95 (м., 1H), 3,84 (с. , 3H), 2,82 - 2,63 (шир., 1H), 2,60 - 2,34 (шир., 3H), 2,02 - 1,90 (шир., 1H), 1,88 - 1,76 (шир., 1H).
ИК-спектр (KBr, см-1): 3350 (шир.), 1762, 1679, 1435, 1206, 1137.
Масс-спектр: FAB MS m/e 532 (M+).
УФ-спектр (этанол) - λ = 287 нм ( ε = 15300) - λ = 231 нм ( ε = 20700).
Получение 6. 2-изотиоцианато-3-нитропиридин.
10 г 2-хлор-3-нитропиридина, 8 г изотиоцианата калия и 75 мл уксусной кислоты смешивали и нагревали с обратным холодильником два часа. Затем реакционную смесь охлаждали и выливали в 400 мл воды со льдом. Полученное твердое вещество промывали водой, снова растворяли в этилацетате и 4 раза промывали водой. Затем этилацетатный раствор обрабатывали активированным углем, сушили над безводным сульфатом натрия, фильтровали, выпаривали досуха и получали 3,72 г соединения, указанного в названии примера.
Точка плавления: 115 - 118oC.
Спектр ЯМР (300 МГц, CDCl3), δ : 8,62 (м., 1H), 7,22 (д., J = 6 Гц, 1H), 7,46 (м., 1H).
Получение 7. 2-меркапто-3-нитропиридин.
50 мл этанола обрабатывали 612 мг натрия при пониженной температуре (ледяная баня) и в значительной степени в безводных условиях. Затем реакционную смесь обрабатывали 3,6 г (0,02 ммоля) порциями целевого соединения, полученного в примере получения 6. Реакционную смесь перемешивали два часа, разбавляли 250 мл воды и выпаривали в вакууме. Полученное твердое вещество отфильтровывали и удаляли. Раствор подкисляли уксусной кислотой до pH 4,5 и образовывались желтовато-красные кристаллы. Целевое соединение отфильтровывали, промывали водой, сушили в вакууме над сиккативом и получали 1,1 г.
Точка плавления: 185 - 187oC (разлагается).
Спектр ЯМР (300 МГц, CDCl3), δ : 8,09 (д., J = 7 Гц, 1H), 7,89 (д., J = 7 Гц, 1H), 6,84 (дд., J = 6 и 3 Гц, 1H).
ИК-спектр (KBr, см-1): 3110, 2872, 1611, 1577, 1527, 1349, 1330, 1240, 1141.
Масс-спектр: EI MS m/e 126 (M+).
Получение 8. 2-меркапто-3-аминопиридин.
100 мл Концентрированной хлористоводородной кислоты (жидкость) охлаждали в ледяной бане и обрабатывали хлористым оловом (2). Затем реакционную смесь обрабатывали 14 г (0,11 ммоля) соединения, полученного в примере получения 7, по частям и перемешивали три часа. Затем реакционную смесь выпаривали до получения твердого остатка, растворяли в 1 л воды и обрабатывали газообразным серовоодородом в течение 30 мин при нагревании на паровой бане. Полученное твердое вещество отфильтровывали, промывали горячей водой и удаляли. Объединенные водные фракции выпаривали для получения твердого вещества. Полученное твердое вещество два раза варили с горячей гидроокисью аммония. Полученное твердое вещество фильтровали и выбрасывали, а раствор гидроокиси аммония выпаривали и получали влажное твердое вещество, которое, в свою очередь, переводили в воду. Полученное желто-зеленое целевое соединение фильтровали, промывали водой и сушили в вакууме при 40oC над осушителем.
Выход составил 4,20 (30 %).
Точка плавления: 127 - 128oC.
Спектр ЯМР (300 МГц, CDCl3, DMCO-d6) δ: 6,91 (м., 1H), 6,65 (д., J = 5 Гц, 1H), 6,46 (м., 1H), 5,03 (с., 2H).
Получение 9. 2-меркапто-7-пиридинотиазол.
2,8 г (85 %) гидроокиси калия растворяли в 16 мл воды и 50 мл метанола. Затем добавляли 2,6 г сероуглерода и промывали 30 мл метанола. Добавляли 4 г (23,8 ммоля) 2-меркапто-3-аминопиридина и реакционную смесь оставляли на ночь при нагревании с обратным холодильником. После охлаждения реакционную смесь обрабатывали активированным углем и фильтровали через Super CelTM, промывая остаток на фильтре небольшим количеством метанола. Затем раствор подкисляли до pH 5,5 уксусной кислотой. Целевое соединение выпадало в осадок из этого раствора в виде желтоватого твердого вещества, которое сушили при 60oC над сиккативом.
Выход составил: 3,29 г.
Точка плавления: 285-287oC (разлагается).
Спектр ЯМР (300 Мгц, DMCO-d6) δ : 8,38 (дд., J=3 гц и 1,5 Гц, 1H), 7,61 (дд. , J=4 и 1,5 Гц, 1H), 7,43 (дд., J=5 и 3 Гц, 1H), 3,33 (широкий синглет, 1H).
ИК-спектр (KBr), см-1): 3040, 2700, 2540, 1597, 1523, 1399, 1311, 1302, 1274, 1132, 876.
Масс-спектр: EI MS m/e 169 (M ± 1).
Получение 10. Этил-/2-(трифенилметил)-аминотиазол-4-ил/-2- бромэтил-1-ил-оксиминоапетат.
9,88 г (0,02 ммоля) этил/2-(трифенилметил)-аминотиазол- 4-ил/-оксимиоацетата растворителя в 20 мл N,N-диметилформамиде и обрабатывали 8,28 г (0,06 ммоля) порошкообразного карбоната калия; После 30-минутного перемешивания добавляли 17,3 мл 1,2-дибромэтана и реакционную смесь оставляли на ночь при перемешивании в атмосфере аргона.
Затем реакционную смесь выливали в смесь 100 мл дихлорметана и 200 мл воды. Водный слой снова эксрагировали дихлорметаном. Объединенные фазы дихлорметана промывали водой, рассолом, сушили над безводным сульфатом магния. Фильтровали, выпаривали в вакууме и получали масло. После жидкостной хроматографии (25% смесь гексана и дихлорметана) получали 7,16 г (63,4 %) соединения, указанного в названии примера.
Точка плавления: 55oC.
Спектр ЯМР (300 МГц, CDCl3), δ: 7,32 (с., 15H), 6,52 (с., 1H), 4,55-4,46 (м., 2H), 3,38 (кв., J=4 Гц, 3H), 3,63-3,53 (м., 2H), 1,37 (т., J=4 Гц, 3H).
Элементарный анализ.
Вычислено: C 59,58; H 4,64; N 7,44.
Найдено: C 59,36; H 4,61; N 7,18.
Получение 11. Этил-/2-(трифенилметил)-аминотиазол-4-ил/-2- фторэт-1-ил-оксиминоацетат.
Указанное в названии примера соединение получали способом, аналогичным описанному в примере получения 10, используя 1-бром- 2-фторэтан в качестве алкилирующего агента.
Выход: 3,3 г.
Спектр ЯМР (300 МГц, DMCO-d6), δ: 8,77 (с., 1H), 7,39-7,12 (м., 15H), 6, 92 (с. , 1H), 4,60 (т., J=3 Гц, 1H), 4,44 (т., J=3 Гц, 1H), 4,26 (т., J=3 Гц, 1H), 4,16 (т., J=3 Гц, 1H), 3,90 (кв., J=4 Гц, 2H), 1,06 (т., J=4 Гц, 3H).
Получение 12. /2-(трифенилметил)-аминотиазол-4-ил/-2-фторэт- 1-ил0оксимино-уксусная кислота.
2,5 г (5 ммолей) соединения, полученного в примере получения 11, растворяли в 20 мл этанола и 5 мл 910 ммолей) 2 н. гидроокиси натрия. После перемешивания в течение двух часов при 50oC кристаллизовали натриевая соль кислоты. Твердое вещество суспендировали в смеси вода-хлороформ и подкисляли 1 н. хлористоводородной кислотой. Водный слой снова экстрагировали хлороформом и объединенные хлорформные фазы промывали водой, рассолом и сушили над безводным сульфатом натрия. Затем хлороформную фазу выпаривали в вакууме и получали 1,52 г (63,9 %) целевого соединения в виде пены.
Точка плавления: 125,33oC (разлагается).
Спектр ЯМР (300 МГц, CDCl3), δ : 9,70 (широкий синглет, 1H), 7,30-7,22 (м., 15H), 6,52 (с., 1H), 4,65 (т., J=3 Гц, 1H), 4,27 (т., J=3 Гц, 1H).
ИК-спектр (CDCl3 см-1 ): 3000, 1735, 1592, 1449, 1186, 1070, 1035.
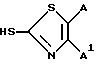
Примеры 2-8. Следующие ниже примеры 2-8- получения соединений согласно изобретению выполняли, в основном, аналогично
описанному в примере
1, используя различные меркаптаны формулы:
Пример 2. Натриевая соль 7 β -/(2-ол-4-ил)-2-фторэт-1-ил-оксиминоацетил/-амино-1-карба-(1-дитиа)-3-(4,5-диметил-тиазол-2-ил)-тио-3-цефем-4-карбоновая кислоты.
Точка плавления: 241-242oC (разлагается).
Масс-спектр: M (FAB) m/e 541 (M-22).
ЯМР-спектр на1H (300 МГц. DMCO-d6), δ : 9,30 (д., J=6 Гц, 1H), 7,18 (с. , 2H), 6,73 (с. , 1H), 5,42 (дд., J=6 и 4 Гц, 1H), 4,63 (т., J=3 Гц, 1H), 4,47 (т., J=3 Гц, 1H), 4,27 (т., J=3 Гц, 1H), 4,17 (т., J=3 гц, 1H), 3,87-3,80 (м., 1H), 2,34-2,04 (шир.м., 2H), 2,30 (с., 3H), 2,32 (с., 3H), 1,89-1,79 (м., 1H), 1,64-1,46 (м., 1H).
Элементарный анализ.
Вычислено: C 42,70; H 3,58; N 14,94.
Найдено: C 42,93; H 3,82; N 14,83.
Пример 3. Натриевая соль 7 β -/(2-аминотиазол-4-ил)-2-фторэт-1-ил-оксиминоацетил/- амино-1-карба-(1-детиа)-3-(5-амино-тиазол-2-ил)-тио-3-цефем-карбоновой кислоты
Масс-спектр: (FAB) m/e 550 (M+), 528 (M+1-23),
УФ/спектр (этанол): - 307 нм ( ε =169000) - 229 нм ( ε =179000).
ИК-спектр (KBr, см-1): 1747, 3194, 1600, 1533, 1522, 1395, 1357.
ЯМР-спектр на1H (300 МГц, DMCO-d6): δ : 9,23 (д., J=6 Гц, 1H), 7,19 (c. , 2H), 6,72 (c., 1H), 6,68 (c., 1H), 5,86 (c., 2H), 5,22 (дд., J=6 Гц, и 4 Гц, 1H), 4,63 (т. , J=3 Гц, 1H), 4,48 (т., J=3 Гц, 1H), 4,28 (т., J=3 Гц, 1H), 3,98 (т., J=3 Гц, 1H), 3,64-3,57 (м., 1H), 2,12-1,93 (м., 2H), 1,80-1,67 (шир., 1H), 1,58-1,40 (шир., 1H).
Пример 4. Натриевая соль 7 β
-/(2-аминотиазол-4-ил)-2-фторэт-1-ил-оксиминоацетил/-амино-1-карба- (1-детиа)-3-(натрий-4-карбоксилаттиазол)-тио-3-цефем-4-4-карбоновой
кислоты
Масс-спектр: М (FAB) m/e 623 (М+23), 601 (М+),
578 (М+1-23).
Спектр УФ (этанол): - 285 нм ( ε =129000) - 207 нм ( ε =20300).
ИК-спектр (KBr, см-1); 3261, 1751, 1653, 1604, 1525, 1412, 1379, 1357, 1278, 1034.
Спектр ЯМР на1H (300 МГц, DMCO-d6) δ : 9,34 (д., J=6 Гц, 1H), 7,65 (c., 1H), 7,18 (c., 2H), 6,70 (c., 1H), 5,25 (дд., J =6 Гц, и 4 Гц, 1H), 4,63 (т. , J= 3 Гц, 1H), 4,46 (т., J=3 Гц, 1H), 4,25 (т., J=3 Гц, 1H), 4,17 (т., J=4 Гц, 1H), 3,76-3,66 (м., 1H), 2,32-2,03 (шир., 2H), 1,81-1,57 (шир., 2H).
Пример 5.
Натриевая соль 7 β
-/(2-аминотиазол-4-ил)-2-фторэт-1-ил-оксиминоацетил/-амино-1-карба- (1-детиа)-3-(5-нитротиазол-2-ил)-тио-3-пефем-карбоновой кислоты
Масс-спектр: (FAB) m/e 580 (М+),
558 (М+1-23).
УФ-спектр (этанол): - 365 нм (ε=8800) - 235 нм (ε=20700).
ЯМР-спектр на1H (300 МГц, DMCO-d6) δ: 9,40-9,20 (м., 1H), 8,14 (с., 1H), 7,19 (с. , 2H), 6,72 (с., 1H), 5,50-5,28 (м., 1H), 4,66 (т., J=3 Гц, 1H), 4,52 (т. , J=3 Гц, 1H), 4,32 (т., J=3 Гц, 1H), 4,20 (т., J=3 Гц, 1H), 3,92-3,79 (м., 1H), 2,78-2,2 (шир. м., 2H), 2,00-1, 44 (шир. м., 2H).
ИК-спектр (KBr, см-1): 3205, 1759, 1670, 1619, 1530, 1352, 1329, 1291.
Элементарный анализ.
Вычислено: C 37,31; H 2,61;
N 16,92,
Найдено: C 37,01; H 2,56; N 16,73.
Пример 6. Натриевая соль 7 β -/(2-аминотиазол-4-ил)-2-фторэт-1-ил-оксиминоапетил/-амино-1-карба-(1- детиа)-3-(4-этоксикарбонилтиазол-2-ил)-тио-3-цефем-4-карбоновой кислоты.
Масс-спектр: MS (FAB) m/e 607 (М+), 585 (М+1-23).
УФ-спектр (этанол): - 283 нм (ε=19600); - 265 нм (ε= 19600). - 219 нм (ε=2500).
ИК-спектр (KBr, см-1): 2980, 1756, 1722, 1657, 1611, 1536, 1401, 1353, 1230, 1015 см-1.
Спектр ЯМР на1H (300 МГц, DMCO-d6), δ: 9,32 (д., J = 8 Гц, 1H), 8,40 (с. , 1H), 7,98 (с., 2H), 6,73 (с., 1H), 5,30 (дд., J=6 Гц и 4 Гц, 1H), 4,65 (т. , J=3 Гц, 1H), 4,48 (т., J=3 Гц, 1H), 4,28 (т., J=3 Гц, 1H), 4,23 (кв., J= 6 Гц, 2H), 4,18 (т., J=3 Гц, 1H), 3,80-3,75 (м., 1H), 2,42-2,25 (м., 1H), 2,18-2,08 (м. , 1H), 1,85-1,76 (м., 1H), 1,75-1,57 (м., 1H), 1,26 (т., J=4 Гц, 3H).
Пример 7. 7 β
-/(2-аминотиазол-4-ил)-2-фторэт-1-илоксиминоацетил/-амино-1-карба-(1-детил)- 3-(тиазол-2-ил)-тио-3-цефем-4-карбоновая кислота
Пример 8. Натриевая соль 7 β
-/(2-аминотиазол-4-ил)-2-фторэт-1-ил-оксиминоацетил/-амино-1-карба-(1-детиа)- 3-(тиазол-2-ил)-тио-3-цефем-карбоновой кислоты
Масс-спектр: MS (FAB) m/e 589 (М+1-23).
Спектр ЯМР (300 МГц, DMCO-d6): δ : 9,32 (д., J=8,7 Гц, 1H), 8,02 (с., 1H), 7,90-7,81 (м., 2H), 7,45-7,09 (м., 5H), 6,72 (с., 1H), 5,30 (дд., J=8,4 и 5,3 Гц, 1H), 4,64 (т., J =3,6 Гц, 1H), 4, 48 (т., J=3,6 Гц, 1H), 4,28 (т., J= 3,6 Гц, 1H), 4,18 (т., J=3,6 Гц, 1H), 3,7 1H), 3,79-3,75 (м., 1H), 2,55-2,35 (м., 1H), 2,30-2,97 (м., 1H), 1,90-1,50 (м., 2H).
Реферат
Предоставляются различные 3-замещенные
1-карба-(1-детиа)-цефемы формулы
I, полезные в качестве антибактериальных средств, в которой R - (C1 - C6) алкил или (C1 - C6) галоидалкил; A и A1 независимо означают атом
водорода, (C1 - C6) алкил, нитро, амино, пиридил или фенил, или A и A1 вместе образуют группы, в которых X - водород, галоген, (C1 - C6) алкокси,
амино, нитрогруппы, а Y - атом азота или угдерода. Раскрыты фармацевтические приемлемые соли соединения I. 7 з.п. ф-лы,
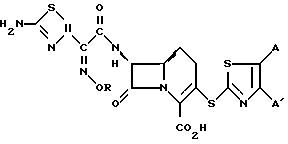
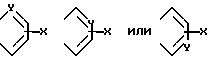
A и A1 вместе
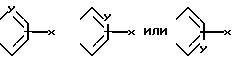
Формула
где R - С1 - С6 - алкил или С1 - С6 - галоидалкил;
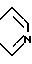
А и А' - независимо друг от друга атом водорода, С1 - С6 - алкил, нитрогрупп, аминогрупп, пиридинил или фенил, или А и А', взятые вместе, образуют группу формулы
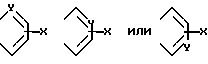
где X - атом водорода, атом галогена, С1 - С6 - алкоксигруппа, аминогруппа, нитрогруппа;
Y - атом азота или углерод,
и их фармацевтически приемлемые соли.
6. Соединения по п.5, в которых Y является атомом азота.
8. Соединения по п.7, в которых R - метил и 2-фторэтил.

Комментарии