Способ ферментативного получения эпотилонов, кристаллическая форма эпотилона b и ее использование - RU2268306C2
Код документа: RU2268306C2
Описание
Настоящее изобретение относится к новому биотехнологическому способу получения, который может применяться в промышленном масштабе для получения эпотилонов, прежде всего к способу концентрирования этих соединений в культуральной среде, а также к новому штамму, предназначенному для получения этих соединений ферментативным путем. Изобретение также относится к новым кристаллическим формам эпотилонов, прежде всего эпотилона В, которые могут быть получены с помощью предлагаемого способа, к их применению для приготовления фармацевтических композиций, к новым фармацевтическим композициям, включающим эти новые кристаллические формы, и/или к применению этих соединений для лечения пролиферативных заболеваний, таких как опухоли, или для приготовления фармацевтических композиций, которые могут применяться для такого лечения.
Предпосылки создания изобретения
Среди известных цитотоксических действующих веществ, предназначенных для лечения опухолей, важную роль играет стабилизирующий микротрубки агент Taxol® (Paclitaxel; фирма Bristol-Myers Squibb), который пользуется большим спросом на рынке. Однако таксолу присущ целый ряд недостатков. В частности, одна из проблем связана с его плохой растворимостью в воде. В результате этого Taxol® необходимо вводить в композиции вместе с Cremophor® EL (полиэтоксилированное касторовое масло; фирма BASF, Людвигсхафен, Германия). Cremophor® EL обладает серьезными побочными действиями; например, он вызывает аллергические реакции, что по крайней мере в одном случае даже привело к смерти пациента.
Хотя относящиеся к классу таксана стабилизирующие микротрубки противораковые агенты охарактеризованы как "вносящие, вероятно, наиболее важный вклад в арсенал фармацевтических средств борьбы с раком в последнем десятилетии" (см. Rowinsky E.K., Ann. rev. Med. 48, 353-374 (1997)), тем не менее несмотря на коммерческий успех Taxol® эти соединения реально пока еще не считаются крупным достижением в химиотерапии рака. Лечение с помощью Taxol® связано с целым рядом серьезных побочных действий, а несколько классов первичных твердых опухолей, а именно, опухоли ободочной кишки и опухоли предстательной железы, чувствительны к этому соединению лишь в незначительной степени (Rowinsky E.K, см. выше). Кроме того, на эффективность таксола могут влиять и даже полностью ее нейтрализовать механизмы приобретенной устойчивости, базирующиеся прежде всего на сверхэкспрессии фосфопротеинов, которые действуют в качестве так называемых "откачивающих насосов" для действующих веществ, а также устойчивость ко множеству лекарств, являющая следствием сверхэкспрессии транспортного гликопротеина для многих лекарств, т.е. "Р-гликопротеина".
Эпотилоны А и В представляют собой новый класс стабилизирующих микротрубки цитотоксических действующих веществ (см. Gerth К. и др., J.Antibiot. 49, 560-563 (1966)) формулы I

где R означает атом водорода (эпотилон А) или метил (эпотилон В).
Эти соединения обладают следующими преимуществами по сравнению с Taxol®:
а) они обладают лучшей растворимостью в воде, что в результате упрощает приготовление композиции на их основе,
б) имеются данные о том, что в экспериментах на культуре клеток они также проявляют активность в отношении пролиферации клеток, у которых в результате активности связанного с Р-гликопротеином "откачивающего насоса" развилась устойчивость ко множеству лекарств, чем обусловлена устойчивость к лечению другими химиотерапевтическими агентами, включая Taxol® (см. Bolag D.M. и др., "Epothilones, a new class of mirotubule-stabililizing agents with Taxollike mechanism of action", Cancer Research 55, 2325-2333 (1995)), и
в) было установлено, что они проявляют очень высокую эффективность in vitro в отношении устойчивой к Taxol® линии клеток карциномы яичника с модифицированным β-тубулином (см. Kowalski R.J. и др., J.Biol. Chem. 272(4), 2543-2541 (1997)).
Эпотилоны можно применять в фармацевтике, например, для лечения опухолей, аналогично тому, как это описано для таксола (см. например, US 5641803, US 5496804, US 5565478).
Однако для того, чтобы эпотилоны можно было применять в фармацевтических целях в широких масштабах, эти соединения необходимо получать в соответствующих количествах.
К настоящему времени в литературе описана экстракция природных веществ, прежде всего эпотилонов, из миксобактерий, главным образом из клеток штамма Sorangium cellulosum Soce90 (который депонирован под номером 6773 в Немецкой коллекции микроорганизмов и клеточных культур, см. WO 93/10121). Для получения удовлетворительной концентрации природных веществ в культуральной среде, прежде всего эпотилонов, и последующей их экстракции ранее всегда добавляли в качестве адсорбата смолу на основе полистирола, например Amberlite XAD-1180 (фирма Rohm&Haas, Франкфурт, Германия).
Однако недостаток этого процесса состоит в том, что при его применении в крупномасштабном производстве возникает множество проблем. Так, например, происходит повреждение клапанов шариками смолы, существует возможность закупорки трубок, а сам аппарат может подвергаться высокому износу из-за механического трения. Шарики смолы являются пористыми и вследствие этого имеют большую площадь внутренней поверхности (примерно 825 м2/г смолы). Еще одна проблема связана со стерилизацией, поскольку заключенный в смоле воздух не автоклавирован. Таким образом, добавление смолы практически исключает крупномасштабное применение этого процесса. С другой стороны, без добавления шариков смолы в культуральной среде не может быть достигнута удовлетворительная концентрация эпотилонов.
При создании изобретения неожиданно был найден путь решения этой дилеммы, позволяющий достичь удовлетворительной концентрации природных веществ с помощью микроорганизмов, прежде всего миксобактерий, которые продуцируют эпотилоны, такие как эпотилон А или В, в частности достичь удовлетворительной концентрации эпотилонов А и В в культуральной среде без добавления смол, что тем самым позволяет устранить вышеуказанные технические недостатки, связанные с получением этих соединений, прежде всего эпотилонов, в промышленном масштабе.
Подробное описание изобретения
Одним из объектов настоящего изобретения является способ концентрирования эпотилонов, прежде всего эпотилона А и/или В, в частности эпотилона В, в культуральной среде с целью получения этих соединений в биотехнологическом масштабе, при этом при осуществлении способа используются микроорганизмы, продуцирующие эти соединения, прежде всего миксобактерий (как продуценты природных веществ), причем в среду добавляют комплексообразующий компонент, который растворим в культуральной среде.
Еще одним объектом изобретения является культуральная среда с соответствующим комплексообразующим компонентом и микроорганизмами, прежде всего миксобактериями, в частности рода Sorangium, которые могут применяться для продуцирования эпотилонов, прежде всего эпотилона А и/или В.
Еще одним объектом изобретения является способ получения эпотилонов, прежде всего эпотилона А и/или В, главным образом двух чистых соединений, в частности эпотилона В, который отличается тем, что эпотилоны получают за счет приготовления культуральной среды для биотехнологического получения этих соединений, которая предназначена для выращивания микроорганизмов в качестве продуцентов природных веществ, прежде всего миксобактерий, которые продуцируют эти соединения, и в которую добавлен комплексообразующий компонент, растворимый в культуральной среде, с последующими очисткой и при необходимости разделением эпотилонов, например эпотилона А и эпотилона В.
Следующим объектом изобретения является способ разделения эпотилонов, прежде всего эпотилонов А и В, отличающийся применением колоночной хроматографии с обращенной фазой и элюента, включающего (низш.) алкилцианид.
Еще одним объектом изобретения является полученный в результате мутагенеза штамм Sorangium cellulosum, который в идентичных в остальном условиях продуцирует большее количество эпотилонов, чем штамм Sorangium cellulosum Soce90.
Объектом изобретения являются также новые кристаллические формы эпотилона В.
Общие понятия, которые используются выше и ниже в описании, имеют следующие значения.
Если выше и ниже в описании даются ссылки на литературные источники, то они включены в описании в той мере, в какой это необходимо.
Приставка "(низш.)" всегда означает, что соответствующий радикал содержит максимум до 7 атомов углерода, в частности до 4 атомов углерода, и он может быть разветвленным или неразветвленным. (Низш.)алкил может быть, например, неразветвленным или одно- либо многократно разветвленным и означает, например, метил, этил, пропил, такой как изопропил или н-пропил, бутил, такой как изобутил, втор-бутил, трет-бутил или н-бутил, или также пентил, такой как амил или н-пентил.
Культуральная среда для биотехнологического получения эпотилонов с продуцирующими эти соединения микроорганизмами в качестве продуцентов природных веществ, прежде всего с миксобактериями, представляет собой главным образом среду, которая предназначена для выращивания соответствующих (встречающихся в естественных условиях или же полученных путем культивирования либо, в частности, путем генетической модификации) микроорганизмов, прежде всего штаммов миксобактерий, которые могут продуцировать эти соединения, в частности миксобактерий рода Sorangium, предпочтительно (в частности для производства эпотилона) микроорганизма типа Sorangium cellulosum Soce90 (см. WO 93/10121), или полученного из него или из частей миксобактерий биоматериала (например, с помощью мутагенеза или технологии рекомбинантного гена), прежде всего соответствующим образом полученного штамма, в частности штамма, обозначенного как ВСЕ33/10, или его мутантов, и которая помимо воды предпочтительно содержит другие общепринятые и пригодные компоненты культуральных сред, такие как биополимеры, сахара, аминокислоты, соли, нуклеиновые кислоты, витамины, антибиотики, полусинтетические химические вещества, факторы роста, экстракты из биологических материалов, такие как дрожжи или экстракты других клеток, соевая мука, крахмал, такой как картофельный крахмал и/или микроэлементы, например ионы железа в форме комплекса, или приемлемые комбинации всех или некоторых из этих компонентов и/или также аналогичные добавки. Соответствующие культуральные среды известны специалистам в данной области или могут быть приготовлены по известным методам (см., например, составы культуральных сред, приведенные в качестве примеров в настоящем описании или представленные в WO 93/10121). Предпочтительным штаммом миксобактерии является штамм, полученный с помощью УФ-мутагенеза и отобранный по признаку повышенного образования эпотилона А и/или В по сравнению со штаммом Sorangium cellulosum Soce90, который депонирован в DSM по номером 6773, прежде всего мутант ВСЕ33/10, который был депонирован под номером DSM 11999 9 февраля 1998 г. в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zeilkulturen GmbH (DSMZ), Mascheroder Weg 1b, D-38124, Braunschweig, Германия).
Культивирование штамма ВСЕ33/10 и морфологическое описание штамма
Штамм может расти на целлюлозе в качестве единственного источника углерода и энергии с добавлением нитрата калия в качестве единственного источника азота, например на фильтровальной бумаге, покрывающей агар ST21 с минеральными солями (0,1% KNO3, 0,1% MgSO4 •7H2O, 0,1% CaCl2•2Н2О, 0,1% К2HPO4, 0,01% MnSO4•7H2O, 0,02% FeCl3, 0,002% дрожжевого экстракта, стандартный раствор микроэлементов, 1% агара). На этой среде формируются плодовые тела от темного красновато-коричневого до черновато-коричневого цвета. Они состоят из небольших спорангиолей (диаметром примерно 15-30 мкм) и присутствуют в виде плотных образований и групп различного размера.
Вегетативные палочки имеют форму, типичную для Sorangium (относительно компактные, при исследовании с помощью фазово-контрастного микроскопа представляют собой темные, цилиндрические палочки с широкими округлыми концами, имеющие в среднем длину 3-6 мкм и ширину 1 мкм).
Эпотилоны представляют собой прежде всего эпотилон А и/или В, но также и другие эпотилоны, например эпотилоны С и D, описанные в заявках WO 97/19086 и WO 98/22461, эпотилоны Е и F, описанные в WO 98/22461, и другие эпотилоны, которые могут быть получены с помощью соответствующих микроорганизмов.
Водорастворимый комплексообразующий компонент представляет собой прежде всего водорастоворимое олиго- или полипептидное производное или, в частности, олиго- или полисахаридное производное циклического или спиралевидного строения, которое образует внутримолекулярную полость, и вследствие своих в достаточной степени гидрофобных свойств обладает способностью связываться с эпотилонами, прежде всего с эпотилоном А и/или эпотилоном В. Особенно предпочтительный водорастворимый комплексообразующий компонент выбирают из группы, включающей циклодекстрины или (в частности) циклодекстриновые производные и их смеси.
Циклодекстрины представляют собой циклические (α-1,4)-связанные олигосахариды α-D-глюкопиранозы с относительно гидрофобной центральной полостью и гидрофильной областью внешней поверхности.
Следует отметить, в частности, следующие соединения (цифрами в скобках обозначено количество остатков глюкозы на молекулу): α-циклодекстрин (6), β-циклодекстрин (7), γ-циклодекстрин (8), δ -циклодекстрин (9), ε-циклодекстрин (10), ζ-циклодекстрин (11), η-циклодекстрин (12) и θ-циклодекстрин (13). Наиболее предпочтительными являются δ-циклодекстрин и особенно α-циклодекстрин, β-циклодекстрин или γ-циклодекстрин либо их смеси.
Циклодекстриновые производные прежде всего представляют собой производные вышеперечисленных циклодекстринов, особенно α-циклодекстрин, β-циклодекстрин или γ-циклодекстрин, в частности циклодекстрины, в которых одна или большее количество вплоть до всех гидроксигрупп (3 на радикал глюкозы) преобразованы с образованием простого или сложного эфира. Простые эфиры прежде всего представляют собой простые алкиловые эфиры, предпочтительно (низш.)алкиловые эфиры, такие как метиловый или этиловый эфир, а также пропиловый или бутиловый эфир, арилгидроксиалкиловые эфиры, такие как фенилгидрокси(низш.)алкиловый, предпочтительно фенилгидроксиэтиловый эфир, гидроксиалкиловые эфиры, в частности гидрокси(низш.)алкиловые эфиры, предпочтительно 2-гидроксиэтиловый эфир, гидроксипропиловый эфир, такой как 2-гидроксипропиловый эфир, или гидроксибутиловый эфир, такой как 2-гидроксибутиловый эфир, карбоксиалкиловые эфиры, в частности карбокси(низш.) алкиловые эфиры, предпочтительно карбоксиметиловый или карбоксиэтиловый эфир, дериватизированные карбоксиалкиловые эфиры, в частности дериватизированный карбокси(низш.)алкиловый эфир, в котором дериватизированная карбоксигруппа является этерифицированной или амидированной карбоксигруппой (прежде всего аминокарбонилом, моно- или ди(низш.)алкиламинокарбонилом, морфолино-, пиперидино-, пирролидино- или пиперазинокарбонилом, или алкоксикарбонилом), в частности (низш.)алкоксикарбонил-(низш)алкиловые эфиры, например метилоксикарбонилпропиловый эфир или этилоксикарбонилпропиловый эфир, сульфоалкиловые эфиры, в частности сульфо(низш.)алкиловые эфиры, предпочтительно сульфобутиловыи эфир, циклодекстрины, в которых одна или большее количество ОН-групп этерифицировано с помощью радикала формулы
-O-[Alk-O]n-H
где Alk означает алкил, предпочтительно (низш.)алкил, а n обозначает целое число от 2 до 12, предпочтительно 2-5, в частности 2 или 3, циклодекстрины, в которых одна или большее количество ОН-групп этерифизировано с помощью радикала формулы

где R' обозначает атом водорода, гидрокси, -O-(Alk-O)z-H, -O-(Alk(-R)-O)p-Н или -O-(Alk(-R)-O)q-Alk-CO-Y, при этом Alk во всех случаях обозначает алкил, предпочтительно (низш.)алкил, m, n, p, q и z обозначают целое число от 1 до 12, предпочтительно 1-5, в частности 1-3, a Y означает OR1 или NR2R3, где R1, R2 и R3 независимо друг от друга обозначают атом водорода или (низш.)алкил либо R2 и R3 вместе с присоединенным атом азота обозначают морфолино, пиперидино, пирролидино или пиперазино, или разветвленные циклодекстрины, в которых присутствуют эфирные группы или ацетали, образованные с другими молекулами сахаров, предпочтительно глюкозил-, диглюкозил(G2-β-циклодекстрин), мальтозил- или димальтозилциклодекстрин или N-ацетилглюкозаминил-, глюкозаминил-, N-ацетилгалактозаминил- или галактозаминилциклодекстрин.
Сложные эфиры прежде всего представляют собой алканоиловые эфиры, в частности (низш.) алканоиловые эфиры, такие как ацетиловые эфиры циклодекстринов.
Также возможно использовать циклодекстрины, в которых два или большее количество указанных различных групп простых эфиров и групп сложных эфиров присутствует одновременно.
Также могут применяться смеси из двух или большего количества этих циклодекстринов и/или циклодекстриновых производных.
Предпочтение отдается, в частности, α-, β- или γ-циклодекстринам или их простым (низш.)алкиловым эфирам, таким как метил-β -циклодекстрин или особенно предпочтительно 2,6-ди-О-метил-β-циклодекстрин, или предпочтительно их простым гидрокси(низш.)алкиловым эфирам, таким как 2-гидроксипропил-α-, 2-гидроксипропил-β- или 2-гидроксипропил-γ-циклодекстрин.
Циклодекстрины или циклодекстриновые производные добавляют в культуральную среду предпочтительно в концентрации 0, 02-10, более предпочтительно 0,05-5, особенно предпочтительно 0,1-4, например 0,1-2% (мас./об.).
Циклодекстрины или циклодекстриновые производные являются известными или могут быть получены с помощью известных методов (см., например, US 3459731, US 4383992, US 4535152, US 4659696, ЕР 0094157, ЕР 0149197, ЕР 0197571, ЕР 0300526, ЕР 0320032, ЕР 0499322, ЕР 0503710, ЕР 0818469, WO 90/12035, WO 91/11200, WO 93/19061, WO 95/08993, WO 96/14090, GB 2189245, DE 3118218, DE 3317064 и указанные в этих публикациях ссылки, которые также относятся к синтезу циклодекстринов или циклодекстриновых производных, или см. также Т.Loftsson и М.Е.Brewster, Pharmaceutical Applications of Cyclodextrins: Drug Solubilization and Stabilisation, Journal of Pharmaceutical Science 85 (10): 1017-1025 (1996); R.A.Rajewski и V.J.Stella, Pharmaceutical Applications of Cyclodextrins: In vivo Drug Delivery, Journal of Pharmaceutical Science 85 (II): 1142-1168 (1996)).
В приведенном ниже описании процесса обработки и очистки под понятием "эпотилон" подразумевают эпотилон, который может быть получен из соответствующего микроорганизма, предпочтительно эпотилон С, D, Е, F или особенно предпочтительно эпотилон А, наиболее предпочтительно эпотилон В. Если не указано иное, то при использовании понятия "эпотилон" подразумевают это понятие в широком смысле, включающем индивидуальные эпотилоны или их смеси.
Процесс обработки эпотилонов осуществляют общепринятыми методами, прежде всего разделением культуры на жидкую фазу (центрифугат) и твердую фазу (клетки) с помощью фильтрации или центрифугирования (лабораторная центрифуга или сепаратор). Часть (основную) эпотилонов, находящуюся в центрифугате или в фильтрате, затем непосредственно смешивают с синтетической смолой, например со смолой, основой которой является полистирол в качестве матрицы (далее в настоящем описании также обозначена просто как полистирол), такой как Amberlite XAD-16 [фирма Rohm & Haas GmbH, Франкфурт, Германия] или Diaion HP-20 [Resindion S.R.L., Mitsubishi Chemical Co., Милан] (предпочтительно в объемном соотношении центрифугат:смола примерно от 10:1 до 100:1, более предпочтительно примерно 50:1). После контактирования со смолой, длящегося предпочтительно от 0,25 до 50 ч, особенно предпочтительно от 0,8 до 22 ч, смолу отделяют, например фильтрацией или центрифугированием. При необходимости после адсорбции смолу промывают высокополярным растворителем, предпочтительно водой. Затем осуществляют десорбцию эпотилона с помощью соответствующего растворителя, предпочтительно спирта, в частности изопропанола. Фазу растворителя, предпочтительно изопропанольную фазу, затем удаляют из растворителя, предпочтительно путем предварительного, одновременного или последующего добавления воды, в частности в испарителе с циркуляцией, осуществляя таким образом при необходимости концентрирование, и образовавшуюся водную фазу экстрагируют растворителем, пригодным для образования второй фазы, таким как сложный эфир, например (низш.)алканол(низш.)алканоат, как правило, этилацетат или изопропилацетат. Таким путем эпотилоны переносят в органическую фазу. Затем органическую фазу концентрируют до требуемой степени, предпочтительно досуха, например с помощью роторного испарителя.
Затем осуществляют дополнительную обработку с использованием следующих стадий, где стадия очистки с помощью хроматографии с обращенной фазой с элюированием нитрилом представляет собой предлагаемую в изобретении стадию и вследствие этого является обязательной, в то время как другие стадии являются необязательными:
- молекулярную фильтрацию (гель-хроматография), например на колонке из такого материала, как Sephadex LH-20 (фирма Pharmacia, Уппсала, Швеция), с использованием спирта, такого как метанол, в качестве элюента;
- отделение эпотилонов с помощью хроматографии с обращенной фазой после их растворения в пригодном растворителе и элюирование смесью нитрил/вода (обязательно), предпочтительно отличающееся тем, что хроматографию проводят на колонке из такого материла, как преимущественно материал RP-18, который несет углеводородные цепи, такие как углеводородные цепи, содержащие 18 атомов углерода, а элюент включает нитрил, предпочтительно (низш.)алкилнитрил, в частности ацетонитрил, прежде всего применяют смесь нитрил/вода, предпочтительно смесь ацетонитрил/вода, предпочтительно в соотношении нитрила и воды примерно от 1:99 до 99:1, прежде всего от 1:9 до 9:1, например от 2:8 до 7:3, в частности 3:7 или 4:6;
- однократную или многократную экстракцию остатка (предпочтительно после упаривания) в двухфазной системе, включающей воду и несмешивающийся с водой растворитель, предпочтительно сложный эфир, в частности (низш.)алкил(низш.)алканоат, такой как этилацетат или изопропилацетат;
- адсорбционную хроматографию, в частности с использованием колонки из силикагеля и элюирования соответствующим растворителем или смесью растворителей, предпочтительно смесью сложный эфир/углеводород, например (низш.)алкил(низш.)алканоат/С4-С10алкан, предпочтительно этил- или изопропилацетат/н-гексан, причем соотношение сложного эфира и углеводорода предпочтительно составляет от 99:1 до 1:99, более предпочтительно от 10:1 до 1:10, например 4:1;
- растворение остатка, который может быть получен после концентрирования в соответствующем растворителе, таком как спирт, например метанол;
- смешение с активированным углем и его удаление;
- перекристаллизацию, например из соответствующих растворителей или смесей растворителей, содержащих, например сложные эфиры, смеси сложный эфир/углеводород или спирты, предпочтительно этил- или изопропилацетат:толуол, в соотношении от 1:10 до 10:1, предпочтительно 2:3 (эпотилон А) или метанол или этилацетат (эпотилон В);
при этом между стадиями образовавшиеся растворы или суспензии при необходимости концентрируют и/или жидкие и твердые компоненты отделяют друг от друга, в частности фильтрацией или центрифугированием растворов/суспензий. Приведенные ниже более точные характеристики могут предпочтительно применяться на вышеуказанных отдельных стадиях.
Переработку и очистку предпочтительно проводят следующим образом.
После сбора культуру разделяют на жидкую фазу (центрифугат) и твердую фазу (клетки) с помощью центрифугирования (лабораторная центрифуга или сепаратор). Основную часть эпотилонов, находящуюся в центрифугате, затем непосредственно смешивают с полистиролом, таким как Amberlite XAD-16 [фирма Rohm & Haas GmbH, Франкфурт, Германия] или Diaion HP-20 [Resindion S.R.L., Mitsubishi Chemical Co., Милан] (предпочтительно в объемном соотношении центрифугат:смола примерно от 10:1 до 100:1, более предпочтительно примерно 50:1), и перемешивают в смесителе. На этой стадии эпотилоны переносят из циклодекстрина на смолу. После контактирования со смолой, длящегося примерно 1 ч, смолу отделяют центрифугированием или фильтрацией. Адсорбцию эпотилонов на смолу также можно осуществлять на хроматографической колонке, внося смолу на колонку и разгоняя центрифугат на смоле. После адсорбции смолу промывают водой. Десорбцию эпотилонов из смолы проводят с помощью изопропанола. Затем от изопропанольной фазы отделяют изопропанол предпочтительно путем добавления воды, в частности в испарителе с циркуляцией, и образовавшуюся водную фазу экстрагируют этилацетатом. Эпотилоны переносят из водной фазы в этилацетатную фазу. Затем этилацетатный экстракт концентрируют досуха с помощью роторного испарителя. Первоначальное концентрирование эпотилонов затем осуществляют с помощью молекулярной фильтрации (используя, например, Sephadex LH-20 [фирма Pharmacia, Уппсала, Швеция] и метанол в качестве элюента). Полученные после молекулярной фильтрации фракции, которым соответствуют наиболее высокие пики (пиковые фракции), содержат эпотилон А и В, ив них общее содержание эпотилонов превышает 10%. Затем проводят разделение этих пиковых фракций, которые содержат эпотилон А и B в смеси, на индивидуальные компоненты с помощью хроматографии с обращенной фазой, например RP-18-фазой (фаза, модифицированная алкильными радикалами, содержащими 18 атомов углерода на цепь), с использованием соответствующего элюента, предпочтительно содержащего нитрил, такой как ацетонитрил (что позволяет достичь более эффективного разделения, чем при использовании, например, спиртов, таких как метанол). Эпотилон А элюируется раньше, чем эпотилон В. Содержащие эпотилон В пиковые фракции еще могут включать небольшие количества эпотилона А, который может быть удален дополнительным разделением на RP-18. В завершение фракцию, включающую эпотилон А, кристаллизуют непосредственно из смеси этилацетат:толуол (2:3), а фракцию, включающую эпотилон В, - из метанола или этилацетата.
Предпочтительные варианты осуществления изобретения
Изобретение предпочтительно относится к способу концентрирования эпотилонов, предпочтительно эпотилона А и/или В, в частности эпотилона В, в культуральной среде, которая предназначена для биотехнологического получения этого(-их) соединения (-ий) с использованием микроорганизма, пригодного для такого получения, предпочтительно штамма Sorangium, особенно предпочтительно штамма типа Sorangium cellulosum Soce90, или его мутанта, в частности штамма, обозначенного как ВСЕ33/10, и которая содержит воду и другие обычно необходимые ингредиенты культуральных сред, причем в среду добавляют циклодекстрин или циклодекстриновое производное либо смесь двух или большего количества этих соединений, предпочтительно одно или более, более предпочтительно один, два или более циклодекстринов, выбранных из группы, включающей α-циклодекстрин (6), β -циклодекстрин (7), γ-циклодекстрин (8), δ-циклодекстрин (9), ε-циклодекстрин (10), ζ-циклодекстрин (11), η- циклодекстрин (12) и θ-циклодекстрин (13), особенно предпочтительно α-циклодекстрин, β-циклодекстрин или γ-циклодекстрин, или прежде всего циклодекстриновое производное или смесь циклодекстриновых производных, выбранных из производных циклодекстрина, в которых одна или большее количество вплоть до всех гидроксигрупп преобразованы с образованием простого алкилового эфира, предпочтительно (низш.)алкилового эфира, такого как метиловый или этиловый эфир, а также пропиловый или бутиловый эфир, арилгидроксиалкилового эфира, такого как фенилгидрокси(низш.)алкиловый, предпочтительно фенилгидроксиэтиловый эфир, гидроксиалкилового эфира, в частности гидрокси(низш.)алкилового эфира, предпочтительно 2-гидроксиэтилового эфира, гидроксипропилового эфира, такого как 2-гидроксипропиловый эфир, или гидроксибутилового эфира, такого как 2-гидроксибутиловый эфир, карбоксиалкилового эфира, в частности карбокси(низш.)алкилового эфира, предпочтительно карбоксиметилового или карбоксиэтилового эфира, дериватизированного карбоксиалкилового эфира, в частности дериватизированного карбокси(низш.)алкилового эфира, в котором дериватизированная карбоксигруппа представляет собой аминокарбонил, моно- или ди-(низш.)алкиламинокарбонил, морфолино-, пиперидино-, пирролидино- или пиперазинокарбонил либо алкоксикарбонил, в частности (низш.)алкоксикарбонил, такой как предпочтительно (низш.) алкоксикарбонил -(низш.)алкиловый эфир, например метилоксикарбонилпропиловый эфир или этилоксикарбонилпропиловый эфир, сульфоалкилового эфира, в частности сульфо(низш.)алкилового эфира, предпочтительно сульфобутилового эфира, циклодекстрина, в котором одна или большее количество ОН-групп этерифицировано с помощью радикала формулы
-O-[Alk-O]n-Н
где Alk обозначает алкил, предпочтительно (низш.)алкил, а n обозначает целое число от 2 до 12, предпочтительно 2-5, в частности 2 или 3, циклодекстрина, в котором одна или большее количество ОН-групп этерифицировано с помощью радикала формулы

где R' обозначает атом водорода, гидрокси, -O-(Alk-O)z-H, -O-(Alk(-R)-O)p-Н или -O-(Alk(-R)-O)q-Alk-CO-Y, при этом Alk во всех случаях обозначает алкил, предпочтительно (низш.) алкил, m, n, p, q и z обозначают целое число от 1 до 12, предпочтительно 1-5, в частности 1-3, a Y обозначает OR1 или NR2R3, где R1, R2 и R3 независимо друг от друга обозначают атом водорода или (низш.)алкил либо R2 и R3 вместе с присоединенным атом азота обозначают морфолино, пиперидино, пирролидино или пиперазино, или разветвленного циклодекстрина, в котором присутствуют эфирные группы или ацетали, образованные с другими молекулами сахаров, предпочтительно глюкозил-, диглюкозил(G2-β-циклодекстрин), мальтозил- или димальтозилциклодекстрин или N-ацетилглюкозаминил- глюкозаминил-, N-ацетилгалактозаминил- или галактозаминилциклодекстрин, или (низш)алканоила, такого как сложный ацетиловый эфир циклодекстрина.
Особенно предпочтительным является способ, в котором циклодекстрин и/или циклодекстриновое производное добавляют в культуральную среду в концентрации 0,02-10, предпочтительно 0,05-10, более предпочтительно 0,05-5, особенно предпочтительно 0,1-4, например 0,1-2% (мас./об.).
Особенно предпочтительным является способ по любому из двух предыдущих параграфов, согласно которому циклодекстриновое производное выбирают из циклодекстрина, предпочтительно β-циклодекстрина, и гидрокси(низш.)алкилциклодекстрина, предпочтительно 2-гидроксипропил-α-, -β- или -γ-циклодекстрина, либо их смеси, включающей один или несколько этих циклодекстринов, причем наиболее предпочтительным является 2-гидроксипропил-β-циклодекстрин.
Изобретение также относится, в частности, к культуральной среде, которая включает циклодекстрин, циклодекстриновое производное или смесь из двух или большего количества комплексообразующих компонентов, выбранных из группы, включающей циклодекстрины и циклодекстриновые производные, особенно предпочтительно циклодекстрин или циклодекстриновое производное, указанные в третьем из предыдущих параграфе, в частности указанные во втором из предыдущих параграфе, или смеси, включающие одно или несколько из этих соединений, и которая служит для выращивания микроорганизма, который может продуцировать эпотилоны, предпочтительно эпотилон А и/или эпотилон В, предпочтительно штамма рода Sorangium, предпочтительно штамма Sorangium cellulosum, например штамма Soce90 или полученного из него мутанта, в частности штамма ВСЕ33/10.
Еще одним объектом изобретения является способ получения эпотилона А и/или В, предпочтительно в виде двух чистых соединений, в частности эпотилона В, который отличается тем, что эпотилоны разделяют, например, центрифугированием, на твердую и жидкую фазы (центрифугат), при этом приготавливают культуральную среду с целью биотехнологического получения этих соединений, как описано выше, в среду добавляют комлексообразующий компонент, который растворим в культуральной среде, в частности циклодекстрин, циклодекстриновое производное или смесь из двух либо большего количества циклодекстринов и/или циклодекстриновых производных, центрифугат смешивают со смолой, предпочтительно с полистиролом, или прогоняют через колонку, заполненную такой смолой, смолу при необходимости промывают водой, эпотилон(-ы) десорбируют из смолы с помощью полярного растворителя, предпочтительно спирта, прежде всего (низш.)алканола, такого как изопропанол, при необходимости концентрируют путем предварительного, одновременного или последующего добавления воды, добавляют органический растворитель, который не смешивается с водой, например сложный эфир, такой как этилацетат, и эпотилон(-ы) переносят в органическую фазу, например перемешиванием или смешением, органическую фазу при необходимости концентрируют, эпотилоны, полученные из органического растворителя, концентрируют с помощью молекулярного сита для соединений с низкой молекулярной массой, а затем фракции, содержащие эпотилоны, предпочтительно эпотилон А и/или В, подвергают разделению с помощью колонки с обращенной фазой, предпочтительно элюированием элюентом, содержащим нитрил, такой как ацетонитрил (или в другом варианте элюентом, содержащим спирт, такой как метанол), при этом эпотилоны А и В экстрагируются по отдельности, и при необходимости они могут быть дополнительно концентрированы с помощью перекристаллизации.
Еще одним предпочтительным объектом изобретения является способ разделения эпотилонов, прежде всего эпотилонов А и В, который отличается тем, что используют хроматографию на колонке с обращенной фазой с элюентом, содержащим (низш.)алкилцианид, причем хроматографию проводят на таком материале колонки, прежде всего на материале RP-18, который несет углеводородные цепи, такие как углеводородные цепи, содержащие 18 атомов углерода, и применяют включающий нитрил элюент, который предпочтительно представляет собой (низш.)алкилнитрил, в частности ацетонитрил, прежде всего смесь нитрил/вода, предпочтительно смесь ацетонитрил/вода, предпочтительно в соотношении нитрила и воды примерно от 1:99 до 99:1, прежде всего от 1:9 до 9:1, например от 2:8 до 7:3, в частности 3:7 или 4:6. Это разделение можно осуществлять после фильтрации через молекулярное сито или предпочтительно непосредственно с использованием остатка после адсорбции эпотилонов из культуральной среды, содержащей комплексообразующий компонент на смоле. Преимуществом разделения с помощью элюента, содержащего (низш.)алкилцианид по сравнению с использованием спиртов, таких как метанол, является более эффективное разделение эпотилонов А и В.
Изобретение предпочтительно относится к способу получения эпотилонов, который предусматривает:
а) концентрирование эпотилонов, прежде всего эпотилона А и/или В, в частности эпотилона В, в культуральной среде для биотехнологического получения этого(-их) соединений(-я), на которой выращивают микроорганизм, пригодный для такого получения, прежде всего штамм Sorangium, особенно предпочтительно штамм типа Sorangium cellulosum Soce90, или его мутант, в частности штамм, обозначенный как ВСЕ33/10, и которая содержит воду и другие обычно необходимые ингредиенты культуральных сред, причем в среду добавляют циклодекстрин или циклодекстриновое производное либо смесь из двух или большего количества этих соединений, предпочтительно один или более, более предпочтительно один, два или более циклодекстринов, выбранных из группы, включающей α-циклодекстрин (6), β -циклодекстрин (7), γ-циклодекстрин (8), δ-циклодекстрин (9), ε-циклодекстрин (10), ζ-циклодекстрин (11), η-циклодекстрин (12) и θ-циклодекстрин (13), особенно предпочтительно α-циклодекстрин, β-циклодекстрин или γ-циклодекстрин, или прежде всего циклодекстриновое производное или смесь циклодекстриновых производных, выбранных из производных циклодекстрина, в которых одна или большее количество вплоть до всех гидроксигрупп преобразованы с образованием простого алкилового эфира, предпочтительно (низш.)алкилового, такого как метиловый или этиловый эфир, а также пропиловый или бутиловый эфир, арилгидроксиалкилового эфира, такого как фенилгидрокси(низш.)алкиловый, предпочтительно фенилгидроксиэтиловый эфир, гидроксиалкилового эфира, в частности гидрокси(низш,)алкилового эфира, предпочтительно 2-гидроксиэтилового эфира, гидроксипропилового эфира, такого как 2-гидроксипропиловый эфир, или гидроксибутилового эфира, такого как 2-гидроксибутиловый эфир, карбоксиалкилового эфира, в частности карбокси(низш.)алкилового эфира, предпочтительно карбоксиметилового или карбоксиэтилового эфира, дериватизированного карбоксиалкилового эфира, в частности дериватизированного карбокси(низш.)алкилового эфира, в котором дериватизированная карбоксигруппа представляет собой аминокарбонил, моно- или ди-(низш.)алкиламинокарбонил, морфолино-, пиперидино-, пирролидино- или пиперазинокарбонил либо алкоксикарбонил, в частности (низш.)алкоксикарбонил, такой как предпочтительно (низш.)алкоксикарбонил-(низш)алкиловый эфир, например метилоксикарбонилпропиловый эфир или этилоксикарбонилпропиловый эфир, сульфоалкилового эфира, в частности сульфо(низш.)алкилового эфира, предпочтительно сульфобутилового эфира, циклодекстрина, в котором одна или большее количество ОН-групп этерифицировано с помощью радикала формулы
-O-[Alk-O]n-Н
где Alk обозначает алкил, предпочтительно (низш.)алкил, а n обозначает целое число от 2 до 12, предпочтительно 2-5, в частности 2 или 3, циклодекстрина, в котором одна или большее количество ОН-групп этерифицировано с помощью радикала формулы

где R' обозначает атом водорода, гидрокси, -O-(Alk-O)z-H, -O-(Alk(-R)-O)p-Н или -O-(Alk(-R)-O)q-Alk-CO-Y, при этом Alk во всех случаях обозначает алкил, предпочтительно (низш.)алкил, m, n, p, q и z обозначают целое число от 1 до 12, предпочтительно 1-5, в частности 1-3, a Y обозначает OR1 или NR2R3, где R1, R2 и R3 независимо друг от друга обозначают атом водорода или (низш.)алкил либо R2 и R3 вместе с присоединенным атом азота обозначают морфолино, пиперидино, пирролидино или пиперазино, или разветвленного циклодекстрина, в котором присутствуют эфирные группы или ацетали, образованные с другими молекулами сахаров, предпочтительно глюкозил-, диглюкозил(G2-β-циклодекстрин), мальтозил- или димальтозилциклодекстрин или N-ацетилглюкозаминил-, глюкозаминил-, N-ацетилгалактозаминил- или галактозаминилциклодекстрин, или (низш)алканоила, такого как сложный ацетиловый эфир циклодекстрина, и
б) разделение эпотилонов, прежде всего эпотилонов А и В, которое отличается тем, что используют хроматографию на колонке с обращенной фазой с элюентом, содержащим (низш.)алкилцианид, причем хроматографию проводят на таком материале колонки, прежде всего на материале RP-18, который несет углеводородные цепи, такие как углеводородные цепи, содержащие 18 атомов углерода, и применяют включающий нитрил элюент, предпочтительно (низш.)алкилнитрил, в частности ацетонитрил, прежде всего смесь алкилнитрил/вода, предпочтительно смесь ацетонитрил/вода, предпочтительно в соотношении нитрила и воды примерно от 1:99 до 99:1, прежде всего от 1:9 до 9:1, например от 2:8 до 7:3, в частности 3:7 или 4:6, после чего при необходимости используют дополнительные стадии для перебработки и очистки.
Изобретение также относится, в частности, к мутанту, полученному из штамма Sorangium cellulosum Soce90, прежде всего штамму Sorangium cellulosum, который может быть получен с помощью мутагенеза, предпочтительно с помощью одной или большего количества стадий УФ-индуцированного мутагенеза (в частности с помощью УФ-облучения в диапазоне длин волн от 200 до 400, прежде всего от 250 до 300 нм) с последующим отбором после каждой стадии мутантов, обладающих повышенной способностью продуцировать эпотилоны (в частности, с помощью которых повышается концентрация эпотилонов в культуральной среде), причем этот штамм в идентичных в остальном условиях продуцирует большее количество эпотилонов, прежде всего эпотилона А и/или В, чем штамм Sorangium cellulosum Soce90, прежде всего представляет собой штамм Sorangium cellulosum ВСЕ33/10.
Изобретение предпочтительно относится к отдельным стадиям процесса, описанным в примерах, или к их любому сочетанию, к культуральной среде, приведенной в настоящем описании, к кристаллическим формам и к описанному штамму.
Изобретение также относится к новым кристаллическим формам эпотилона В, прежде всего к кристаллической форме эпотилона В, описанной как модификация В, и, в частности, к форме, описанной как модификация А.
Кристаллические формы прежде всего можно различать на основе их рентгенограмм. Для определения характеристик твердых органических соединений предпочтительно используют рентгенограммы, полученные с помощью дифрактометра и Cu-Кα1 в качестве источника облучения. Рентгенограммы являются особенно предпочтительными для определения кристаллической модификации вещества. С целью охарактеризовать полученную кристаллическую модификацию А и кристаллическую модификацию В эпотилона В измерения проводят в интервале значений угла (29) от 2° до 35° при использовании образцов вещества, которые выдерживают при комнатной температуре.
Данные полученной таким образом рентгенограммы (углы отражения и интенсивности наиболее важных линий) для кристаллической модификации А (модификация А) эпотилона В приведены в следующей таблице 1A:
Изобретение также относится, в частности, к новой кристаллической форме эпотилона В, которая отличается тем, что ее температура плавления составляет более 120°С, прежде всего от 120 и 128°С, в частности 124-125°С. Неожиданно было установлено, что это значение существенно выше значений, ранее известных из литературы. Изобретение предпочтительно относится к кристаллической форме эпотилона В, которая отличается наличием рентгенограммы, характерной для кристаллической формы А, и температурой плавления выше 120° С, прежде всего 120-128°С, в частности 124-125°С.
Данные полученной таким образом рентгенограммы (углы отражения и интенсивности наиболее важных линий) кристаллической модификации В (модификация В) эпотилона В приведены в следующей таблице 1B:
Новые кристаллические формы являются особенно стабильными, в частности кристаллическая форма А является более термодинамически стабильной, и они в результате этого пригодны в качестве действующих веществ для твердых форм введения, для хранения в виде твердой формы или для хранения в виде промежуточных продуктов (которые отличаются особенно высокой стабильностью), предназначенных для получения твердых или жидких форм введения.
Изобретение также относится к применению новых кристаллических форм, предпочтительно кристаллической формы В, прежде всего кристаллической формы А (все они обозначены далее как действующее вещество), при приготовлении фармацевтических композиций, новых фармацевтических композиций, которые содержат эти новые кристаллические формы, и/или к их применению для лечения пролиферативных заболеваний, таких как опухоли. Далее в контексте настоящего описания, если упоминаются фармацевтические препараты или композиции, которые содержат или включают действующее вещество, в случае жидких композиций или композиций, которые уже не содержат кристаллическую форму как таковую, всегда подразумеваются и фармацевтические препараты, полученные с использованием кристаллических форм (например, растворы для инфузии, полученные с использованием кристаллических форм А или В эпотилона В), даже если они уже не содержат соответствующую кристаллическую форму (например, с связи с тем, что они находятся в растворе).
Изобретение также предпочтительно относится к применению новой кристаллической формы эпотилона В, предпочтительно кристаллической формы В, прежде всего кристаллической формы А, при приготовлении фармацевтических композиций, отличающемуся смешением новой кристаллической формы эпотилона В с одним или несколькими носителями.
Изобретение также относится к способу лечения теплокровных животных, страдающих от пролиферативного заболевания, отличающемуся введением эпотилона B в дозе, эффективной в отношении лечения этого заболевания, в виде одной из новых кристаллических форм теплокровному животному, которому необходимо такое лечение, и включающему, в частности, лечение с помощью таких композиций, которые приготовлены с использованием одной из новых кристаллических форм, и/или к применению новой кристаллической формы эпотилона В для такого лечения.
Для приготовления фармацевтических композиций действующее вещество может использоваться, например, таким образом, чтобы фармацевтические композиции содержали эффективное количество действующего вещества в сочетании или в смеси с достаточным количеством одного или нескольких органических или неорганических жидких или твердых фармацевтически приемлемых носителей.
Изобретение также относится к фармацевтической композиции, пригодной для введения теплокровному животному, прежде всего человеку, для лечения пролиферативного заболевания, такого как опухоль, при этом такая композиция содержит действующее вещество в количестве, необходимом для лечения болезни, в сочетании с фармацевтически приемлемым носителем.
Фармацевтические композиции по изобретению представляют собой композиции, пригодные для энтерального, прежде всего назального, ректального или орального, предпочтительно парентерального, прежде всего внутримышечного или внутривенного введения, теплокровным животным, прежде всего людям, и они содержат эффективную дозу действующего вещества индивидуально или в сочетании с достаточным количеством фармацевтически приемлемого носителя. Доза действующего вещества зависит от типа теплокровного животного, веса тела, возраста и индивидуального состояния, конкретных фармакокинетических особенностей, подлежащей лечению болезни и пути введения.
Фармацевтические композиции содержат от примерно 0,0001% до примерно 95%, предпочтительно от 0,001% до 10% или 20%, либо до примерно 90% действующего вещества. Фармацевтические композиции по изобретению могут присутствовать, например, в виде стандартных дозируемых форм, например в форме ампул, пузырьков, суппозиториев, драже, таблеток или капсул.
Фармацевтические композиции по настоящему изобретению приготавливают по известным методам, например путем обычного растворения, лиофилизации, смешения, гранулирования или других процессов.
Растворы действующего вещества, а также суспензии, в частности водные растворы или суспензии, когда это возможно, например в случае лиофилизированных композиций, которые содержат действующее вещество как таковое или в сочетании с фармацевтически приемлемым носителем, например маннитом, предпочтительно применяют в виде растворов или суспензий, приготовленных непосредственно перед введением. Фармацевтические композиции могут быть стерильными и/или содержать эксципиенты, такие как консерванты, стабилизаторы, смачивающие или эмульгирующие агенты, вещества, усиливающие растворимость, соли для регулирования осмотического давления и/или буферы, и они могут быть приготовлены по известным методам, например путем обычных процессов растворения или лиофилизации. Указанные растворы или суспензии могут содержать вещества, повышающие вязкость, такие как карбоксиметилцеллюлоза натрия, карбоксиметилцеллюлоза, декстран, поливинилпирролидон или желатин.
Суспензии в масле содержат в качестве масляного компонента растительные, синтетические или полусинтетические масла, которые обычно применяют для инъекций. Наиболее предпочтительными примерами являются, в частности, жидкие эфиры жирных кислот, которые содержат в качестве кислотного компонента жирную кислоту с длинной цепью, состоящей из 8-22, предпочтительно 12-22 атомов углерода, например лауриновую кислоту, тридециловую кислоту, миристиновую кислоту, пентадециловую кислоту, пальмитиновую кислоту, маргариновую кислоту, стеариновую кислоту, арахидоновую кислоту, бегеновую кислоту, или соответствующие ненасыщенные кислоты, например олеиновую кислоту, элаидиновую кислоту, эруковую кислоту, брассиловую кислоту или линолевую кислоту, и при необходимости добавки в виде консервантов, например витамин Е, β-каротин или 3,5-ди-трет-бутил-4-гидрокситолуол. Спиртовой компонент этих эфиров жирных кислот предпочтительно имеет максимум 6 атомов углерода и представляет собой моно- или полигироксиспирт, например моно-, ди- или тригидроксиспирт, например метанол, этанол, пропанол, бутанол или пентанол, или его изомер, но предпочтительно гликоль и глицерин. В частности, в качестве примеров можно упомянуть следующие эфиры жирных кислот: пропилмиристат, изопропилпальмитат, "Labrafil M 2375" (полиоксиэтиленглицеринтриолеат, Gattefosse, Париж), "Miglyol 812" (триглицерид насыщенных жирных кислот с длиной цепи 8-12 атомов углерода, Hills AG, Германия), но прежде всего растительные масла, такие как хлопковое масло, миндальное масло, оливковое масло, касторовое масло, кунжутное масло, соевое масло и особенно арахисовое масло.
Препараты для инъекции или инфузии приготавливают по обычным методам в стерильных условиях; это же относится к заполнению композициями ампул или пузырьков и укупориванию емкостей.
Предпочтение отдается раствору для инфузии, который содержит действующее вещество и фармацевтически приемлемый органический растворитель.
Фармацевтически приемлемые органические растворители, которые могут применяться в композиции по изобретению, могут быть выбраны из всех таких растворителей, которые известны специалистам в данной области. Растворитель предпочтительно выбирают из спирта, например абсолютного этанола, смесей этанола с водой, предпочтительно 70%-ного этанола, полиэтиленгликоля 300, полиэтиленгликоля 400, полипропиленгликоля и N-метилпирролидона, предпочтительно полипропиленгликоля или 70%-ного этанола.
Действующее вещество присутствует в композиции в концентрации от 0,001 до 100 мг/мл, предпочтительно примерно от 0,05 до 5 мг/л или от 5 до 50 мг/мл.
Композиции этого типа легко хранить в пузырьках или ампулах. Как правило, пузырьки или ампулы изготавливают из стекла, например из боросиликатного стекла. Пузырьки или ампулы могут иметь любой объем, который обычно используется в данной области. Они предпочтительно имеют размер, достаточный для заполнения композицией объемом 0,5-5 мл.
Перед введением действующего вещества пациенту композиции необходимо разбавить водной средой, пригодной для внутривенного введения.
Предпочтительно раствор для инфузии имеет такое же или практически такое же осмотическое давление, что и у общей воды организма. Таким образом, водная среда предпочтительно содержит агент для поддержания изотоничности, который придает раствору для инфузии такое же или практически такое же осмотическое давление, что и у общей воды организма.
Агент для поддержания изотоничности может быть выбран из любого из известных в данной области веществ, например может представлять собой маннит, декстрозу, глюкозу или хлорид натрия. Предпочтительно агент для поддержания изотоничности представляет собой глюкозу или хлорид натрия. Агенты для поддержания изотоничности могут применяться в количествах, которые придают раствору для инфузии такое же или практически такое же осмотическое давление, что и у общей воды организма. Точные необходимые количества могут быть определены с помощью обычных экспериментов, и они могут зависеть от состава раствора для инфузии и от типа агента для поддержания изотоничности.
Концентрация агента для поддержания изотоничности в водной среде зависит от типа каждого из используемых агентов. Когда применяют глюкозу, то ее концентрация предпочтительно составляет от 1 до 5% мас./об., более предпочтительно 5% мас./об. Когда агент для поддержания изотоничности представляет собой хлорид натрия, то его предпочтительно применяют в количествах до 1% мас./об, предпочтительно примерно 0,9% мас./об.
Раствор для инфузии может быть разбавлен водной средой. Применяемое количество водной среды выбирают в зависимости от требуемой концентрации действующего вещества в растворе для инфузии. Раствор для инфузии предпочтительно получают смешением содержимого пузырька или ампулы, представляющего собой концентрат для инфузии (см. выше), с водной средой, доводя с помощью водной среды объем до 200-1000 мл. Растворы для инфузии могут содержать другие добавки, которые обычно используют в композициях для внутривенного введения. К этим добавкам также относятся антиоксиданты.
Антиоксиданты могут применяться для защиты действующего вещества от окислительного разложения. Антиоксиданты могут быть выбраны из антиоксидантов, известных специалистам в данной области и пригодных для внутривенных композиций. Количество антиоксиданта может быть определено с помощью обычных экспериментов. В качестве альтернативы антиоксидантам или в дополнение к ним антиокислительное действие может быть достигнуто за счет предотвращения контакта кислорода (воздуха) с раствором для инфузии. Как правило, для этой цели емкость, содержащую раствор для инфузии, можно обработать инертным газом, например азотом, что является простой операцией.
Растворы для инфузии могут быть получены смешением содержимого пузырька или ампулы с водной средой, например 5%-ным раствором глюкозы в воде для инъекций (ВДИ) в соответствующей емкости, например в баллоне или сосуде для инфузии.
Емкости для растворов для инфузии могут быть выбраны из любых обычных емкостей, материалы которых не вступают в реакцию с указанным раствором для инфузии. При этом могут применяться, в частности, стеклянные емкости, предпочтительно изготовленные из боросиликатного стекла, хотя предпочтительно использовать пластиковые емкости, например пластиковые баллоны для инфузии.
Пластиковые емкости прежде всего могут представлять собой емкости из термопластичных полимеров. Пластмассы могут дополнительно включать такие добавки, как, например, пластификаторы, наполнители, антиоксиданты, антистатики и другие добавки, известные в данной области.
Пластики, пригодные согласно настоящему изобретению, также должны быть стойкими к действию повышенных температур, необходимых для стерилизации. Предпочтительными пластиковыми баллонами для инфузии являются баллоны, выполненные из таких известных специалистам в данной области пластмасс, как ПВХ.
Могут применяться емкости, размеры которых варьируются в широких пределах. При выборе размера емкости прежде всего следует учитывать растворимость эпотилонов в водой среде, простоту обращения с ней и при необходимости способность емкости к хранению. Предпочтительно использовать емкости, вместимость которых может составлять примерно 200-1000 мл раствора для инфузии.
С учетом их предпочтительных для включения в композиции свойств, новые кристаллические формы эпотилона В по изобретению являются наиболее пригодными для простого и воспроизводимого приготовления указанных растворов для инфузии. Однако новые кристаллические формы особенно пригодны для приготовления фармацевтических композиций, которые содержат действующее вещество в твердой форме, например композиций для орального введения.
Фармацевтические композиции для орального введения могут быть получены объединением действующего вещества с твердыми носителями, при необходимости гранулированием образовавшейся смеси и последующей обработкой смеси, при необходимости после добавления приемлемых адъювантов, с получением таблеток, ядер драже или капсул. Также возможно наносить на них покрытие из пластиковых субстратов, которые дают возможность действующему веществу диффундировать или высвобождаться в заданных количествах.
Пригодными фармацевтически приемлемыми носителями являются прежде всего наполнители, такие как лактоза, сахароза, маннит или сорбит, препараты на основе целлюлозы и/или фосфаты кальция, например трикальций фосфат или бикарбонат кальция, и связующие вещества, такие как крахмалы, например кукурузный, пшеничный, рисовый или картофельный крахмал, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза натрия и/или поливинилпирролидон, и/или при необходимости разрыхлители, такие как указанные выше крахмалы, сшитые винилпирролидоны, агар, альгиновая кислота или ее соли, такие как альгинат натрия. Адъюванты прежде всего представляют собой улучшающие текучесть агенты и замасливатели, такие как силикаты, тальк, стеариновая кислота или ее соли, такие как стеарат магния или кальция, и/или полиэтиленгликоль. На ядра драже при необходимости наносят соответствующие устойчивые к действию желудочных соков покрытия с использованием, среди прочего, концентрированных растворов сахаров, гумммиарабика, талька, поливинилпирролидона, полиэтиленгликоля и/или диоксида титана или с использованием растворов для покрытия в приемлемых органических растворителях либо - с целью получения устойчивых к действию желудочных соков покрытий - растворов приемлемых препаратов целлюлозы, таких как фталат этилцеллюлозы или фталат гидроксипропилметилцеллюлозы. Капсулы представляют собой сухие капсулы, состоящие из желатина или пектина и при необходимости мягчителя, такого как глицерин или сорбит. Сухие капсулы могут содержать действующее вещество в форме гранул, например с наполнителями, такими как лактоза, связующими веществами, такими как крахмалы, и/или с замасливателями, такими как тальк или стеарат магния, и при необходимости стабилизаторами. В капсулах с мягким покрытием действующее вещество может присутствовать в растворенной или диспергируемой форме, к которой добавлены маслянистые адъюванты, такие как жирные масла, парафин или жидкие пропиленгликоли, при этом также могут быть добавлены стабилизаторы и/или антибактериальные добавки. В таблетки или в покрытия драже могут быть добавлены красители или пигменты, например с целью идентификации или различения различных доз действующего вещества.
Применение для лечения пролиферативного заболевания одной из кристаллических форм В и прежде всего формы А предпочтительно осуществляют путем введения кристаллической формы (предпочтительно так же, как и для вышеописанного применения в виде раствора для инфузии) теплокровному животному, прежде всего человеку, в дозе, которая может быть определена на уровне от 20 до 133%, предпочтительно от 25 до 100% от максимальной переносимой дозы (МПД), с помощью стандартных методов, например с помощью модифицированных рядов Фибоначчи, в которых последовательное увеличение доз составляет 100%, 67%, 50% и 40%, а затем для всех последующих доз 33%, и при необходимости вводится еще одна и несколько дополнительных доз в диапазоне, превышающем первую дозу, при этом каждая доза вводится по истечении такого периода времени, который позволяет пациенту, подвергающемуся лечению, восстановиться после предыдущей обработки, в частности через 1 неделю или более после первой обработки, предпочтительно через 2-10 недель, особенно предпочтительно через 3-6 недель после кажой предыдущей обработки. В целом, эта схема лечения, согласно которой высокую дозу вводят один, два или несколько раз с достаточно длительными интервалами между отдельными введениями, позволяющими произойти восстановлению, обладает преимуществом по сравнению с более частыми обработками более низкими дозами, поскольку позволяет проводить более редкую и более кратковременную госпитализацию, а также позволяет надеяться на более высокое противораковое действие. Рекомендованная для людей доза эпотилона В предпочтительно составляет от 0,1 до 50 мг/м2, - более предпочтительно от 0,2 до 10 мг/м2.
Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем.
Меры предосторожности: При работе с эпотилонами вследствие их высокой токсичности при необходимости следует использовать средства защиты.
Применяемый в описании 750-литровый ферментер представляет собой ферментер из очищенной стали, полученный от компании Alpha AG, Нидау, Щвейцария.
Пример 1: Получение штамма ВСЕ33/10 посредством получения мутации и отбора
Используемый штамм представляет собой мутантный штамм ВСЕЗЗ/10 (который депонирован под номером DSM 11999 в Немецкой коллекции микроорганизмов и клеточных культур 9 февраля 1998 г.), полученный из штамма Sorangium cellulosum Soce90 в результате получения мутации и отбора, как описано ниже. В жидкой среде мутант ВСЕ33/10 формирует типичные для рода Sorangium палочки с закругленными концами длиной 3-6 мкм и шириной примерно 1 мкм. Штамм Sorangium cellulosum Soce90 был получен из Немецкой коллекции микроорганизмов и клеточных культур под номером DSM 6773.
Получение мутанта ВСЕ33/10 включает 3 стадии мутации с помощью УФ-облучения и отбор отдельных колоний. Эта процедура предусматривает следующие стадии.
Культивирование из ампулы
Клетки DSM6773 из ампул переносят в 10 мл среды G52 в колбу Эрленмейера объемом 50 мл и инкубируют в течение 6 дней в мешалке при скорости вращения 180 об/мин и при 30°С. 5 мл этой культуры переносят в 50 мл среды G52 (в колбу Эрленмейера объемом 200 мл) и инкубируют в течение 3 дней в мешалке при скорости вращения 180 об/мин и при 30°С.
Первая стадия получения мутации с помощью УФ и отбора
Аликвоты по 0, 1 мл указанной выше культуры высевают в несколько чашек Петри, содержащих агаровую среду S42. Затем каждую чашку обрабатывают УФ-лучами (максимальная длина волны облучения составляет 250-300 нм) в течение 90 или 120 с при 500 мкВт/см2. Затем чашки инкубируют в течение 7-9 дней при 30°С до получения отдельных колоний диаметром 1-2 мм. Затем с помощью пластиковой петли клетки из каждой из 100-150 колоний высевают по отдельности в секторы чашки Петри, содержащие агар S42 (4 сектора на чашку) и инкубируют в течение 7 дней при 30°С. Клетки, которые выросли на площади примерно 1 см2 агара, переносят с помощью пластиковой петли в 10 мл среды G52 в колбу Эрленмейера объемом 50 мл и инкубируют в течение 7 дней в мешалке при скорости вращения 180 об/мин и при 30°С. 5 мл этой культуры переносят в 50 мл среды G52 (в колбу Эрленмейера объемом 200 мл) и инкубируют в течение 3 дней в мешалке при скорости вращения 180 об/мин и при 30°С. 10 мл этой культуры переносят в 50 мл среды 23ВЗ и инкубируют в течение 7 дней в мешалке при скорости вращения 180 об/мин и при 30°С.
С целью определения в этой культуре количеств эпотилона А и эпотилона В используют следующий процесс. 50 мл раствора культуры фильтруют через найлоновое сито (размер пор 150 мкм), сохранившийся на сите полистирол Amberlite XAD16 промывают небольшим количеством воды и затем помещают вместе с фильтром в центрифужную пробирку объемом 50 мл (фирма Falcon Labware, Becton Dickinson AG, Immengasse 7, 4056 Базель). В пробирку с фильтром добавляют 10 мл изопоропанола (>99%). После этого плотно закрытую пробирку встряхивают в течение 1 ч при 180 об/мин для растворения эпотилона А и В, которые связаны со смолой (с полистиролом), в изопропаноле. Затем 1,5 мл жидкости центрифугируют и примерно 0,8 мл супернатанта добавляют с помощью пипетки в колонку для ЖХВР. ЖХВР-анализ этих образцов проводят по методике, описанной ниже в разделе, относящемуся к анализу продукта с помощью ЖХВР. С помощью ЖХВР-анализа определяют, какая из культур имеет наиболее высокое содержание эпотилона В. Из указанного выше сектора чашки, соответствующего этой колонии (чашки в это время хранят при 4°С), клетки из области агара площадью примерно 1 см2переносят с помощью пластиковой петли в 10 мл среды G52 в колбу Эрленмейера объемом 50 мл и инкубируют в течение 7 дней в мешалке при скорости вращения 180 об/мин и при 30°С. 5 мл этой культуры переносят в 50 мл среды G52 (в колбу Эрленмейера объемом 200 мл) и инкубируют в течение 3 дней в мешалке при скорости вращения 180 об/мин и при 30°С.
Вторая и третья стадии получения мутации с помощью УФ и отбора
Эта процедура точно соответствует описанной выше для первой стадии получения мутации с помощью УФ, однако для второго мутагенеза используют лучшую из колоний, отобранную на первой стадии УФ-мутагенеза. Для третьей стадии мутагенеза соответственно используют лучшую из колоний, отобранную на второй стадии УФ-мутагенеза. Лучшая из колоний после третьего цикла стадий получения мутаций с помощью УФ после отбора полученных штаммов в отношении повышенного продуцирования эпотилона В соответствует мутанту ВСЕ33/10.
Хранение штамма
10 мл 3-дневной культуры в среде G52 (50 мл среды в колбе Эрленмейера объемом 200 мл, 30°С и 180 об/мин) переносят в 50 мл среды 23В3 (в колбу Эрленмейера объемом 200 мл) и инкубируют в течение 3 дней в мешалке при скорости вращения 180 об/мин и при 30°С. Аликвоту этой культуры объемом 1 мл выделяют по возможности в наиболее гомогенной форме (перед каждым выделением культуру встряхивают вручную в колбе Эрленмейера) вместе с полистиролом Amberlite XAD16 (адсорбирующий полистирол, фирма Rohm & Haas, Франкфурт, Германия), а затем вносят в криопробирки объемом 1 мл типа Nunc (A/S Nunc, DK 4000, Розильде, Дания) и хранят при -70°С или в жидком азоте.
Культивирование штаммов из этих ампул осуществляют путем их нагревания на воздухе при комнатной температуре и последующего переноса всего содержимого криопробирки в 10 мл среды G52 в колбу Эрленмейера объемом 50 мл и инкубирования в течение 5-7 дней в мешалке при скорости вращения 180 об/мин и при 30°С.
Среды
Среда G52:
Стерилизация: 20 мин при 120°С
Агаровая среда S42
Соответствует среде, описанной у S.Jaoua и др., Plasmid 28, 157-165 (1992).
Среда 23В3
деонизированная вода
значение рН 7,8 скорректировано с помощью NaOH
Стерилизация: 20 мин при 120°С
(HEPES обозначает 4-(2-гидроксиэтил)пиперазин-1-этансульфоновую кислоту)
Пример 2: Культивирование с целью получения эпотилонов
Штамм: Sorangium cellulosum Soce90 ВСЕ33/10 (пример 1).
Хранение штамма: в жидком N2, как описано в примере 1.
Среды
Предварительные культуры и промежуточные культуры: среда G52
Основная культура: среда 1В12.
Среда G52
значение рН 7,4 скорректировано с помощью КОН
Стерилизация: 20 мин при 120°С.
Среда 1В12
значение рН 7,8 скорректировано с помощью КОН
Стерилизация: 20 мин при 120°С.
Добавление циклодекстринов и диклодекстриновых производных
Различные концентрации циклодекстринов (фирма Fluka, Букс, Щвейцария, или Wacker Chemie, Мюнхен, Германия) стерилизуют отдельно и добавляют в среду 1В12 до посева культуры.
Культивирование
1 мл суспензии супернатанта штамма Sorangium cellulosum Soce90 ВСЕ33/10 из ампулы с жидким N2 переносят в 10 мл среды G52 (в колбе Эрленмейера объемом 50 мл) и инкубируют в течение 3 дней в мешалке со смещением 25 мм при скорости вращения 180 об/мин и при 30°С. 5 мл этой культуры переносят в 45 мл среды G52 (в колбе Эрленмейера объемом 200 мл) и инкубируют в течение 3 дней в мешалке со смещением 25 мм при скорости вращения 180 об/мин и при 30°С. 50 мл этой культуры затем добавляют к 450 мл среды G52 (в колбе Эрленмейера объемом 2 л) и инкубируют в течение 3 дней в мешалке со смещением 50 мм при скорости вращения 180 об/мин и при 30°С.
Поддержание культуры
Культуры пересевают каждые 3-4 дня, добавляя 50 мл культуры к 450 мл среды G52 (в колбе Эрленмейера объемом 2 л). Все эксперименты и процессы ферментации проводят, используя в качестве исходной эту поддерживаемую культуру.
Опыты в колбе
(I) Предварительная культура во встряхиваемой колбе
Используя в качестве исходной 500 мл поддерживаемой культуры, 1×450 мл среды G52 засевают с помощью 50 мл поддерживаемой культуры и инкубируют в течение 4 дней в мешалке со смещением 50 мм при скорости вращения 180 об/мин и при 30°С.
(II) Основная культура во встряхиваемой колбе
40 мл среды 1В12 плюс 5 г/л порошка 4-морфолинпропансульфоновой кислоты (МОПС) (в колбе Эрленмейера объемом 200 мл) смешивают с 5 мл 10-кратного концентрированного раствора циклодекстрина, высевают 10 мл предварительной культуры и инкубируют в течение 5 дней в мешалке со смещением 50 мм при скорости вращения 180 об/мин и при 30°С.
Ферментация
Процессы ферментации осуществляют в объемах 10 л, 100 л и 500 л. Ферментации в 20 л и в 100 л служат в качестве промежуточной стадии культивирования. В то время как предварительные культуры и промежуточные культуры высевают в виде поддерживаемой культуры в концентрация 10 об.%, основную культуру засевают с помощью 20 об. %-ной промежуточной культуры. Важно отметить, что в отличие от перемешиваемых культур ингредиенты сред для ферментации рассчитывают в пересчете на конечный объем культуры, включая инокулят. Например, если объединяют 18 л среды + 2 л инокулята, то вещества взвешивают из расчета 20 л, однако смешивают только с 18 л.
Предварительная культура во встряхиваемой колбе
Используя в качестве исходной 500 мл поддерживаемой культуры, 4×450 мл среды G52 (в колбе Эрленмейера объемом 2 л) засевают с помощью 50 мл этой культуры и инкубируют в течение 4 дней в мешалке со смещением 50 мм при скорости вращения 180 об/мин и при 30°С.
Промежуточная культура: 20-литровая или 100-литровая
20-литровая культура: 18 л среды G52 в ферментере, имеющем общий объем 30 л, засевают с помощью 2 л предварительной культуры. Культивирование продолжают в течение 3-4 дней в следующих условиях: 30°С, 250 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, без контроля рН.
100-литровая культура: 90 л среды G52 в ферментере, имеющем общий объем 150 л, засевают с помощью 10 л 20-литровой предварительной культуры. Культивирование продолжают в течение 3-4 дней в следующих условиях: 30°С, 150 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, без контроля рН.
Основная культура: 10-, 100- или 500-литровая
10-литровая культура: Ингредиенты для получения 10 л среды 1В12 стерилизуют в 7 л воды, затем добавляют 1 л стерильного 10%-ного раствора 2-(гидроксипропил)-β-циклодекстрина (ГП-β-ЦД) и засевают с помощью 2 л 20-литровой промежуточной культуры. Продолжительность культивирования основной культуры составляет 6-7 дней в следующих условиях: 30°С, 250 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, контроль рН с помощью Н2SO4/КОН до рН 7,6±0,5 (т.е. без контроля при значении рН от 7,1 до 8,1).
100-литровая культура: Ингредиенты для получения 100 л среды 1В12 стерилизуют в 70 л воды, затем добавляют 10 л стерильного 10%-ного раствора 2-(гидроксипропил)-β-циклодекстрина и засевают с помощью 20 л 20-литровой промежуточной культуры. Продолжительность культивирования основной культуры составляет 6-7 дней в следующих условиях: 30°С, 200 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, контроль рН с помощью H2SO4/KOH до рН 7,6±0,5. Последовательность посевов для 100-литрового ферментера схематично приведена ниже:
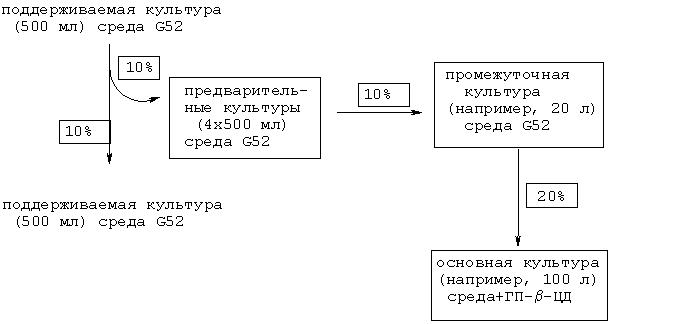
500-литровая культура: Ингредиенты для получения 500 л среды 1В12 стерилизуют в 350 л воды, затем добавляют 50 л стерильного 10%-ного раствора 2-(гидроксипропил)-β-циклодекстрина и засевают с помощью 100 л 100-литровой промежуточной культуры. Продолжительность культивирования основной культуры составляет 6-7 дней в следующих условиях: 30°С, 120 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, контроль рН с помощью Н2SO4/КОН до рН 7,6±0,5.
Анализ продуктов
Приготовление образца
50 мл образцов смешивают с 2 мл полистирола Amberiite XAD16 (фирма Rohm и Haas, Франкфурт, Германия) и встряхивают при 180 об/мин в течение 1 ч при 30°С. Полистирол затем фильтруют, используя найлоновое сито с размером пор 150 мкм, промывают небольшим количеством воды и затем смешивают с фильтром в пробирке типа Nunc объемом 15 мл.
Элюирование продукта из полистирола
В пробирку с фильтром и полистиролом добавляют 10 мл изопропанола (>99%). После этого закрытую пробирку встряхивают в течение 30 мин при комнатной температуре на роторном смесителе типа Rota-Mixer (фирма Labinco BV, Нидерланды). Затем 2 мл жидкости удаляют центрифугированием и добавляют супернатант с помощью пипетки в колонки для ЖХВР.
Пример 2А: Воздействие добавления циклодекстрина и диклодекстриновых производных на концентрации полученных эпотилонов
Все исследованные циклодекстриновые производные получены от компании Fluka, Букс, Швейцария. Опыты проводят во встряхиваемых колбах объемом 200 мл, содержащих 50 мл культуры. В качестве контролей используют колбы со смолой (полистиролом) Amberlite XAD16 (фирма Rohm & Haas, Франкфурт, Германия) в качестве адсорбента и без добавления абсорбента. После инкубации в течение 5 дней с помощью ХЖВР могут быть определены следующие титры эпотилонов.
1)За исключением Amberlite (об.%), все проценты представляют собой % мас./об.
Некоторые из исследованных циклодекстринов (2, 6-ди-орто-метил-β-циклодекстрин, метил-β-циклодекстрин) в исследованных концентрациях не обладают никаким действием или оказывают отрицательное действие на продуцирование эпотилона. Как видно из примеров, добавление 1-2% 2-гидроксипропил-β-циклодекстрина повышает продуцирование в 6-8 раз по сравнению с продуцированием без использования циклодекстринов.
Пример 2Б: Ферментация 10-литровой культуры с добавлением 1% 2-гидроксипропил-β-циклодекстрина
Ферментацию проводят в 15-литровом стеклянном ферментере. Среда содержит 10 г/л 2-(гидроксипропил)-β-циклодекстрина, полученного от фирмы Wacker Chemie, Мюнхен, Германия. Изменение выхода продукта в процессе ферментации представлено в таблице 2. Ферментацию заканчивают через 6 дней и продукт перерабатывают.
Пример 2В: Ферментация 100-литровой культуры с добавлением 1% 2-гидроксипропил-β-циклодекстрина
Ферментацию проводят в 150-литровом ферментере. Среда содержит 10 г/л 2-(гидроксипропил)-β-циклодекстрина. Изменение выхода продукта в процессе ферментации представлено в таблице 3. Ферментацию заканчивают через 7 дней и производят обработку продукта.
Пример 2Г: Ферментация 500-литровой культуры с добавлением 1% 2-гидроксипропил-β-циклодекстрина
Ферментацию проводят в 750-литровом ферментере. Среда содержит 10 г/л 2-(гидроксипропил)-β-циклодекстрина. Изменение выхода продукта в процессе ферментации представлено в таблице 4. Полученный в результате ферментации продукт собирают через 7 дней и производят его обработку.
Пример 2Е: Сравнительный пример ферментации 10-литровой культуры без добавления адсорбента
Ферментацию проводят в 15-литровом стеклянном ферментере. Среда не содержит никакого циклодекстрина или другого адсорбента. Изменение выхода продукта в процессе ферментации представлено в таблице 5. Полученный в результате ферментации продукт не собирают и не обрабатывают.
Пример 3: Переработка эпотилонов: выделение из 500-литровой основной культуры
Выход 500-литровой основной культуры, описанной в примере 2Г, составляет 450 л, ее разделяют с помощью очищающего сепаратора Westfalia типа SA-20-06 (скорость вращения 6500 об/мин) на жидкую фазу (центрифугат+промывочная вода=650 л) и твердую фазу (клетки примерно 15 кг). Основная часть эпотилонов обнаружена в центрифугате. Полученная после центрифугирования клеточная масса содержит менее 15% от установленного количества эпотилонов, и ее далее не перерабатывают. Центрифугат объемом 650 л затем помещают в резервуар с мешалкой объемом 4000 л, смешивают с 10 л Amberlite XAD16 (объемное соотношение центрифугат: смола (полистирол) 65:1) и перемешивают. После контактирования со смолой в течение примерно 2 ч ее удаляют центрифугированием с помощью центрифуги со сливом типа Heine (вместимость корзины 40 л, скорость вращения 2800 об/мин). Смолу удаляют из центрифуги и промывают 10-15 л деионизированной воды. Десорбцию осуществляют двукратным перемешиванием смолы в стеклянных резервуарах с мешалкой объемом 30 л по 30 мин, каждый раз используя по 30 л изопропанола. Отделение изопропанольной фазы от смолы проводят с помощью вакуум-фильтра. Затем изопропанол удаляют из объединенных изопропанольных фаз, добавляя 15-20 л воды в вакуумном испарителе с циркуляцией (фирма Schmid-Verdampfer), и полученную водную фазу объемом примерно 10 л экстрагируют трижды, используя каждый раз по 10 л этилацетата. Экстракцию проводят в стеклянных сосудах объемом 30 л при перемешивании. Этилацетатный экстракт концентрируют до объема 3-5 л в вакуумном испарителе с циркуляцией (фирма Schmid-Verdampfer) и после этого концентрируют досуха на роторном испарителе (типа Büchi). В результате получают 50,2 г этилацетатного экстракта. Этилацетатный экстракт растворяют в 500 мл метанола, нерастворимые фракции отфильтровывают с помощью складчатого фильтра и раствор вносят в 10-килограммовую колонку Sephadex LH 20 (Pharmacia, Уппсала, Швеция) (диаметр колонки 20 см, уровень заполнения примерно 1,2 м). Элюирование осуществляют, используя в качестве элюента метанол. Эпотилоны А и B в основном присутствуют во фракциях 21-23 (при размере фракции 1 л). Эти фракции концентрируют досуха в вакууме на роторном испарителе (общая масса 9,0 г). Затем эти сефадексные фракции с максимальным содержанием эпотилонов (9,0 г) растворяют в 92 мл смеси ацетонитрил:вода:метиленхлорид (50:40:2), раствор фильтруют через складчатый фильтр и вносят в RP-колонку (устройство типа Prepbar 200, фирма Merck; 2,0 кг LiChrospher RP-18, Merck, размер гранул 12 мкм, диаметр колонки 10 см, уровень заполнения 42 см; фирма Merck, Дармштадт, Германия). Элюирование осуществляют смесью ацетонитрил:вода (3:7) (скорость потока 500 мл/мин; время удерживания эпотилона А примерно 51-59 мин; время удерживания эпотилона В примерно 60-69 мин). Фракционирование контролируют с помощью УФ-детектора при длине волны 250 нм. Фракции концентрируют досуха в вакууме с помощью роторного испарителя типа Büchi. Масса эпотилона А в пиковой фракции составляет 700 мг, что согласно полученным с помощью ЖХВР данным (с внешним стандартом) соответствует 75,1%. Масса эпотилона B в пиковой фракции составляет 1980 мг, что согласно полученным с помощью ЖХВР данным (с внешним стандартом) соответствует 86,6%. В завершение фракцию эпотилона А (700 мг) кристаллизуют из 5 мл смеси этилацетат:толуол (2:3) с получением 170 мг эпотилона А в виде чистого кристаллизата [содержание по данным ЖХВР (площадь, %) составляет 94,3%]. Кристаллизацию эпотилона В (1980 мг) осуществляют с помощью 18 мл метанола, получая 1440 мг эпотилона B в виде чистого кристаллизата [содержание по данным ЖХВР (площадь, %) составляет 99,2%], tпл (эпотилон В), например, 124-125°С.
Ниже в таблице приведены данные1Н-ЯМР-анализа для эпотилона В:
ЯМР при 500 МГц; растворитель: ДМСО-d6; химический сдвиг δ в част./млн относительно ТМС (s обозначает синглет, d обозначает дублет, m обозначает мультиплет):
Согласно этому примеру (пример 3) эпотилон В получают в виде кристаллической модификации А, для которой характерна рентгенограмма модификации А (см. общую часть настоящего описания).
Пример 4: Кристаллическая модификация В эпотилона В
50 мг эпотилона В (полученного, например, согласно описанному выше способу) суспендируют в 1 мл изопропанола и встряхивают в течение 24 ч при 25°С. Продукт фильтруют и сушат. После сушки в глубоком вакууме получают эпотилон B в форме кристаллов белого цвета. Для кристаллической модификации продукта характерна рентгенограмма модификации В (см. общую часть настоящего описания).
Следующие конкретные варианты осуществления составляют часть изобретения:
а) способ разделения эпотилонов, прежде всего эпотилонов А и В, который отличается тем, что его осуществляют хроматографией на колонке с обращенной фазой с помощью элюента, содержащего (низш.)алкилцианид;
б) способ по п. а), отличающийся тем, что используемый материал колонки несет углеводородные цепи, содержащие 18 атомов углерода, а элюент представляет собой смесь воды и ацетонитрила;
в) штамм Sorangium cellulosum, полученный с помощью мутагенеза, который в идентичных в остальном условиях продуцирует большее количество эпотилонов, чем штамм Sorangium cellulosum Soce90;
г) штамм по п. в), обозначенный как ВСЕ33/10;
д) кристаллическая форма эпотилона В, обозначенная как модификация А, отличающаяся наличием ренгенограммы, полученной с помощью дифрактометра с Cu-Кα1 в качетсве источника облучения, которая представлена в виде следующей таблицы:
е) кристаллическая форма эпотилона В, обозначенная как модификация В, отличающаяся наличием ренгенограммы, полученной с помощью дифрактометра с Cu-Кα1 в качетсве источника облучения, которая представлена в виде следующей таблицы:
ж) фармацевтическая композиция, которая содержит действующее вещество по п. д) или е) в сочетании с фармацевтически приемлемым носителем;
з) способ лечения теплокровного животного, страдающего от пролиферативного заболевания, путем введения эпотилона В по п. д) или е) в дозе, эффективной для лечения этой болезни, теплокровному животному, которое нуждается в таком лечении;
и) применение кристаллической формы по п. д) или е) для лечения пролиферативного заболевания;
к) применение новой кристаллической формы эпотилона В по п. д) или е) при приготовлении фармацевтических композиций, где кристаллическую форму этого типа смешивают с одним или несколькими носителями.
Реферат
Изобретение относится к биотехнологии и касается получения, концентрирования цитотоксических веществ, в частности эпотилонов, и их использования для приготовления фармацевтических композиций, пригодных для лечения пролиферативных заболеваний. Способ концентрирования эпотилонов предусматривает добавление в водную культуральную среду для выращивания продуцента Sorangium cellulosum комплексообразующего компонента, выбранного из группы циклодекстринов. Описаны также культуральная среда для выращивания S.cellulosum, которая содержит вышеупомянутый комплексообразующий компонент и способ получения эпотилонов с использованием этой среды. Представлен способ разделения полученных эпотилонов, прежде всего эпотилонов А и В с использованием колоночной хроматографии с обращенной фазой и элюента, включающего (низш.)алкилцианид. Описана кристаллическая форма эпотилона В и его использование в фармацевтической композиции для лечения пролиферативной болезни и способ лечения данного заболевания. Использование изобретения позволит получать эпотилоны в промышленном масштабе. 8 н. и 8 з.п. ф-лы, 6 табл.
Формула


Комментарии