Сульфонамидное производное изоксазола или его фармацевтически приемлемая соль - RU2116301C1
Код документа: RU2116301C1
Описание
Настоящая заявка является частично продолжающей патентной заявкой США серия N 840,496, поданная 24 февраля 1992 г.
Изобретение относится к антагонистам эндотелина, используемым inter alia, для лечения гипертензии.
Соединения формулы
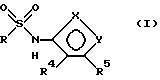
и их фармацевтически приемлемые соли являются антагонистами рецептора эндотелина, используемыми inter alia, в качестве гипотензивных средств. В данном описании вышеприведенные символы определяются следующим образом:
один из X и Y есть N, а другой - O;
R - нафтил или нафтил, замещенный R1, R2 и R3;
каждый из R1, R2 и R3 независимо друг от друга
(a) водород;
(b) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен Z1, Z2 и Z3;
(c) гало;
(d) гидроксил;
(e) циано;
(f) нитро
(g) -C(O)H или -C(O)R6;
(h) -CO2H или CO2R6;
(i) -SH, -S(O)n R6, -S(O)m-OH, -S(O)m-OR6, -O-S(O)m-R6, -O-S(O)mOH, или -O-S(O)m-OR6;
(j) -Z4 -NR7 R8; или
(k) -Z4-N(R11)-Z5-NR9R10;
R4 и R5 независимо друг от друга
(a) водород;
(b) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил или аралкил, любой из которых может быть замещен Z1, Z2 и Z3;
(c) галоген;
(d) гидроксил;
(e) циано;
(f) нитро;
(g) -C(O)H или -C(O)R6;
(h) -CO2H или CO2R6;
(i) -SH, -S(O)nR6, -S(O)m-OH, -S(O)m-OR6, -O-S(O)m-R6, -O-S(O)mOH, или -O-S(O)m-OR6;
(j) -Z4-NR7R8;
(k) -Z4-N(R11)-Z5-NR9R10; или
R4 и R5 вместе являются алкиленом или алкениленом (каждый из которых может быть замещен Z1, Z2 и Z3), завершая 4-8-членное насыщенное, ненасыщенное или ароматическое кольцо вместе с атомами углерода, к которым они примыкают;
R6 - алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен Z1, Z2 и Z3;
R7 - это:
(a) водород;
(b) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен Z1, Z2 и Z3;
(c) циано;
(d) гидроксил;
(e) -C(O)H или -C(O)R6;
(f) -CO2H или CO2R6;
(g) -SH, -S(O)nR6, -S(O)m-OH, -S(O)m-OR6, -O-S(O)m-R6, -O-S(O)mOH, или -O-S(O)m-OR6, за исключением того, когда Z4 является -S(O)n-;
R8 - это:
(a) водород;
(b) -C(O)H или C(O)R6, за исключением того, когда Z4 - это -C(O)- и R7 - -C(O)H, -C(O)R6, -CO2H, или -CO2 R6;
(c) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен Z1, Z2 и Z3; или
R7 и R8 вместе являются алкиленом или алкениленом (каждый из которых может быть замещен Z1, Z2 и Z3), завершая 3-8-членное насыщенное, ненасыщенное или ароматическое кольцо вместе с атомом азота, к которому они примыкают;
R9 - это:
(a) водород;
(b) гидроксил;
(c) -C(O)H или C(O)R6;
(d) -CO2H или -CO2R6;
(e) -SH, -S(O)nR6, -S(O)m-OH, -S(O)m-OR6, -O-S(O)m-R6, -O-S(O)mOH, или -O-S(O)m-OR6;
(f) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен Z1, Z2 и Z3;
R10 - это:
(a) водород;
(b) -C(O)H или -C(O)R6, за исключением когда Z5 - это -C(O)- и R9 - -C(O)H, -C(O)R6, -CO2H, или -CO2R6;
(c) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен Z1, Z2 и Z3;
R11 - это:
(a) водород;
(b) гидроксил, CO2R6 или CO2H, за исключением того, когда один из R9 и R10 - гидроксил, CO2R6 или CO2H;
(c) -C(O)H или -C(O)R6; или
(d) алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен Z1, Z2 и Z3; или любые два из R9, R10 и R11 вместе являются алкиленом или алкениленом (любой из которых может быть замещен Z1, Z2 и Z3), завершая 3-8-членное насыщенное, ненасыщенное или ароматическое кольцо вместе с атомами, к которым они примыкают;
Z1, Z2 и Z3 - независимо друг от друга:
(a) водород;
(b) гало;
(c) гидрокси;
(d) алкокси;
(e) -SH, -S(O)n-Z6, -S(O)m-OH, -S(O)m-OZ6, -O-S(O)m-Z6, -O-S(O)mOH, или -O-S(O)m-OZ6;
(f) оксо;
(g) нитро;
(h) циано;
(i) -C(O)H или -C(O)Z6;
(j) -CO2H или -CO2Z6; или
(k) -NZ7Z8, -C(O)NZ7Z8, или -S(O)nZ7Z8;
Z4 и Z5 независимо друг от друга:
(a) одинарная связь;
(b) -S(O)n-;
(c) -C(O)-;
(d) -C(S)-; или
(e) алкил, алкенил, алкинил, циклоалкил; циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, любой из которых может быть замещен Z1, Z2 и Z3;
Z6, Z7 и Z8 независимо друг от друга - водород, алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, арил, или аралкил, или Z7 и Z8 вместе являются алкиленом или алкениленом, завершая 3-8-членное насыщенное, ненасыщенное или ароматическое кольцо вместе с атомом азота, к которому они примыкают;
m - 1 или 2;
n - 0, 1 или 2.
Для соединения 1
предпочтительно, чтобы R -
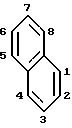
с сульфонамидом, примыкающим в положении 1 или 2 и одним из R1, R2 и R3, примыкающим в положении 5 или 6;
один из R1, R2 и R3 - NR7R8;
R4 и R5 являются алкилом;
R7 и R8 независимо друг от друга - водород, алкил, или -C(O)R6, где R6 - алкил.
Наиболее предпочтительными являются соединения, в которых один из R1, R2 и R3 - NR7R8, а два других - водород, -NR7R8 примыкает в положении 5, и сульфонамид примыкает в положении I, R4 и R5 - метил, R7 и R8 - водород, метил, метилэтил, или ацетил.
Ниже перечисляются определения терминов, используемых в этом описании. Эти определения применяются к терминам, используемым как во всем этом описании, индивидуально или как часть другой группы, если только не ограничиваются в конкретных примерах.
Термины "алкил" и "алкокси" относятся к углеводородным группам в виде прямой или разветвленной цепи, имеющим 1 - 10 атомов углерода. Термины "низший алкил" и "низший алкокси" относятся к группам из 1 - 4 атомов углерода, которые являются предпочтительными.
Термин "арил" или "ар-" относится к фенилу, нафтилу и бифенилу.
Термин "алкенил" относится к углеводородным группам в виде прямой или разветвленной цепи из 2 - 10 атомов углерода, имеющим по крайней мере одну двойную связь. Группы из двух - четырех атомов углерода являются предпочтительными.
Термин "алкинил" относится к группам в виде прямой или разветвленной цепи из 2 - 10 атомов углерода, имеющим по крайней мере одну тройную связь. Группы из двух - четырех атомов углерода являются предпочтительными.
Термин "алкенилен" относится к мостику из прямой цепи из 1 - 5 атомов углерода, имеющих одну или две двойных связи, которые соединены одинарными связями (например, -CH= CH2-CH=CH-, -CH2-CH=CH-, -CH2-CH=CH-CH2-), которые могут быть замещены 1 - 3 низшими алкильными группами.
Термин "алкилен" относится к мостику в виде прямой цепи из 1 - 5 атомов углерода, соединенных одинарными связями (например, -(CH2)m-, где m равно 1 - 5), которые могут быть замещены 1 - 3 низшими алкильными группами.
Термины "циклоалкил" и "циклоалкенил" относятся к циклическим углеводородным группам из 3 - 8 атомов углерода.
Термины "галоген" и "гало" относятся к фтору, хлору, брому и иоду.
Соединения формулы I образуют соли, которые также подпадают под объем этого изобретения. Предпочтительными являются фармацевтически приемлемые (т. е., нетоксичные, физиологически приемлемые) соли, хотя и другие соли являются используемыми, например, в изолировании или очистке соединений этого изобретения.
Соединения формулы I могут образовывать соли с такими щелочными металлами, как натрий, калий и литий, с такими щелочно-земельными металлами, как кальций и магний, с такими органическими основаниями, как дициклогексиламин, бензатин, N-метил-D-глюкамид и гидрабамин, и с такими аминокислотами, как аргинин, лизин и т.п. Эти соли можно получить взаимодействием соединения I с желаемым ионом в среде, в которой осаждается соль или в водной среде с последующей лиофилизацией.
Когда заместители R1 - R5 составляют основную составляющую, такую как амино или замещенный амино, соединение I может образовывать соли со множеством органических и неорганических кислот. Такие соли включают соли, образуемые с соляной кислотой, бромидом водорода, метансульфоновой кислотой, серной кислотой, уксусной кислотой, малеиновой кислотой, бензолсульфонатом, толуолсульфонатом, и различными другими сульфонатами, нитратами, фосфатами, боратами, ацетатами, тартратами, малеатами, цитратами, сукцинатами, бензоатами, аскорбатами, салицилатами, и т.п. Такие соли могут быть образованы взаимодействием соединения I в эквивалентном количестве кислоты в среде, в которой осаждается соль или в водной среде с последующей лиофилизацией.
В добавление, когда заместители R1 - R5 представляют основную составляющую, такую как амино, могут быть образованы цвиттерионы ("внутренние соли").
Некоторые из заместителей R1 - R5 соединения I могут содержать асимметричные атомы углерода. Такие соединения формулы I могут существовать, следовательно, в энантиомерной и диастереомерной формах, и в их рацемических смесях. Все они подпадают под объем изобретения.
Соединения формулы I являются антагонистами ЕТ-1, ЕТ-2, и/или ЕТ-3 и используемы в лечении всех зависимых от эндотелина нарушениях. Таким образом, они являются используемыми в качестве антигипертензивных средств. Путем назначения композиции, имеющей одно или комбинацию соединений этого изобретения давление крови гипертензивного млекопитающего (например, человека) реципиента понижается.
Соединения по изобретению также используют в лечении нарушений, относящихся к функции клетки почечного эпителия, гломерулярной и мезангиальной клеток, включая хроническую почечную недостаточность, гломерулярное повреждение, почечное поражение, вторичное к пожилому возрасту, нефросклероз (особенно гипертензивный нефросклероз), нефротоксичность (включая нефротоксичность, относящуюся к воображаемым и контрастным средствам), и т.п. Соединения этого изобретения можно также использовать в лечении нарушений, относящихся к паракринной и эндокринной функциям.
Соединения по изобретению также могут использоваться в лечении эндотоксемии (наличии в крови эндотоксинов) или эндотоксинного шока, а также в качестве антиишемических средств для лечения, например, сердечной, почечной и церебральной ишемии и т.п.
Соединения этого изобретения могут быть также использованы в качестве антиаритмических средств; антиангинозных средств; антифибриляторных средств; антиастматических средств; терапии для инфаркта миокарда; терапии для нарушений периферийных сосудов (например, болезни Рейно); антиатеросклеротических средств; лечения кардиальной гипертрофии (например, гипертрофированной кардиомиопатии); лечения легочной гипертензии, добавок к кардиоплегическим растворам для искусственного кровообращения; вспомогательных средств к тромболитической терапии; лечения сосудистых нарушений центральной нервной системы, например, в качестве антиприпадочных средств, антимигреневых средств, и терапии для субарахноидального кровотечения; лечения бихевиоральных нарушений центральной нервной системы, включая средства против поноса; регулирование роста клетки; лечение гепатоксичности и скоропостижной смерти.
Соединения этого изобретения могут также быть в композиции в комбинации с ингибитором фермента, преобразующего эндотелин (ECE), таким как фосфорамидон; антагонистами активирующего фактора тромбоцитов (PAF); ингибиторами рецептора ангиотензина II(AII); ингибиторами ренина; ингибиторами фермента, преобразующего ангиотензин (ACE), такими как каптоприл, зофеноприл, фозиноприл, церанаприл, алацеприл, аналаприл, делаприл, пентоприл, квинаприл, рамиприл, лизиноприл, и соли подобных соединений; ингибиторами нейтральной эндопептидазы (NEP); блокаторами канала кальция; активаторами канала калия; бетаадренергическими средствами; антиаритмическими средствами; мочегонными средствами, такими как хлортиазид, гидрохлортиазид, флюметиазид, гидрофлюметиазид, бендрофлюметиазид, метилхлортиазид, трихлорметиазид, политиазид или бензотиазид, а также этакриновая кислота, трикринафен, хлорталидон, фуросемид, музолимин, буметанид, триамтерен, амилорид и спиронолактон, и соли таких соединений; тромболитическими средствами, такими как активатор плазминогена ткани (tPA), рекомбинантный tPA, стрептокиназа, урокиназа, проурокиназа, и анизоилированный комплекс активатора плазминогена стрептокиназы (APSAC, Eminase, Beecham Laboratories).
При составлении в качестве фиксированной дозы такие продукты комбинации используют соединения этого изобретения в диапазоне доз, описанном ниже, а другие фармацевтически активные средства - в их одобренном диапазоне доз. Соединения этого изобретения могут быть также в композиции или использоваться вместе с противогрибковыми и иммунодепрессантными средствами, такими как амфотерицин B, циклоспорины и т.п., чтобы противостоять гломерулярному сокращению и нефротоксичности, побочной к таким соединениям. Соединения этого изобретения могут также использоваться в связи с гемодиализом.
Соединения этого изобретения могут назначаться перорально или парентерально различным млекопитающим, которые подвержены таким болезням, например человеку, в эффективном количестве в диапазоне доз примерно 0,1 - 100 мг/кг, предпочтительно примерно 0,2 - 50 мг/кг, и более предпочтительно примерно 0,5 - 25 мг/кг (или примерно 1 - 2500 мг, предпочтительно от примерно 5 до примерно 2000 мг) в единой или разделенной на 2 - 4 раза ежедневной дозе.
Активное вещество может использоваться в такой композиции, как таблетка, капсула, раствор или суспензия, содержащей примерно 5 - 500 мг на стандартную дозу соединения или смеси соединений формулы I, или в локальной форме для лечения раны (0,01 - 5 мас.% соединения формулы I, 1 - 5 обработок в день). Они могут быть соединены обычным образом с физиологически приемлемым носителем или наполнителем, разбавителем, связующим веществом, консервантом, стабилизатором, корригентом и т. д., или с локальным носителем, таким как Пластибейз (минеральное масло, загущенное с полиэтиленом) как называется в принятой фармацевтической практике.
Соединения этого изобретения могут также назначаться локально для обработки периферийных сосудистых болезней и, таким образом, могут быть составлены как крем или мазь.
Соединения формулы I могут также составляться в таких композициях, как стерильные растворы суспензий для парентерального назначения. Примерно 0,1 - 500 мг соединения формулы I соединяется с физиологически приемлемым наполнителем, носителем, разбавителем, связующим веществом, консервантом, стабилизатором, и т.д., в форме унифицированной дозы, как предусматривается принятой фармацевтической практикой. Количество активного вещества в этих композициях или препаратах таково, чтобы получить подходящую дозу в указанном диапазоне.
Соединения по изобретению могут быть получены следующим образом.
Сульфонил галогенид
R - SO2 гало (II)
подвергают взаимодействию с изоксазоламином
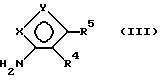
в безводном органическом растворителе (например, пиридине) с целью образования соединения I.
Для соединений, в которых каждый из R1 - R5 включает реакционноспособные функциональные группы, реагенты могут быть обработаны до взаимодействия с защитными агентами. Подходящие защитные агенты и процедуры для их использования широко известны. Примером защитных групп являются бензил, галокарбобензилокси, тозил и подобное гидроксилу; карбобензилокси, галокарбобензилокси, ацетил, бензоил и подобное амино. Такие группы могут быть затем удалены из результирующего защищенного аналога соединения I обработкой одним или более дезащитными средствами. Подходящие дезащитные средства и процедуры для их использования широко известны.
Для образования соединения I, где один или более из
R1 - R3 - это -NR7
R8 и R7 и/или R8 - это ацил, связанную нонацил сульфоновую кислоту
R -SO3H (IV)
обрабатывают водой и гидроксидом щелочного металла,
например, гидроксидом натрия для образования соли сульфоновой кислоты
R-SOM+
(V)
где
M+ - литий, натрий или ион калия. Соль V обрабатывают ацилирующим средством (например, уксусным ангидридом)
при примерно 90 - 110oC либо в ацилирующем
средстве как растворителе, либо в безводном органическом растворителе (например, пиридине) для образования соли сульфоновой кислоты формулы V, где
один или более R1, R2 и R3 - это - -NR7R8 и по крайней мере один из R7 и R8 - ацил. Соль сульфоновой кислоты V затем
обрабатывают раствором галосульфоновой кислоты (например,
хлорсульфоновой кислоты) или другим хлорирующим агентом (например, пентахлоридом фосфора, тионилхлоридом) при примерно 0 - 80oC для
образования ацилсульфонового галогенида формулы II,
который подвергают взаимодействию с изоксазоламином III для образования соединения I, где по крайней мере один из R1, R2 и
R3 - это NR7R8 и по
крайней мере один из R7 и R8 - ацил.
Замещенные амины формулы I (например, соединения, имеющие -NR7 R8, где по крайней мере один из R7 и R8 отличен от водорода) могут быть получены из ассоциированного свободного амина (где R7 и R8 - водород). Свободный амин обрабатывают (1) кетоном или альдегидом (например, ацетоном), (2) восстановителем (например, цианоборогидридом натрия) или водородом в виде газа (H2) и катализатором (например, палладием на углероде), (3) кислотой (например, уксусной, соляной) в органическом растворителе (например, метаноле) для образования ассоциированного моноамина соединения I (например, примеры 18, 25).
Может оказаться необходимым защитить атом азота сульфонамидного ядра в течение этого процесса (см., например, пример 38). Подходящие защитные группы широко известны. Защитная группа может быть добавлена обработкой свободного амина галогенидом защитной группы при примерно 0oC в присутствии основания (например, триэтиламина). После добавления группы R7 или R8 (как описано выше) защитная группа может быть удалена обработкой кислотой (например, трифторуксусной кислотой) в органическом растворителе (например, метиленхлориде) примерно при 0oC.
Альтернативно замещенный амин можно получить из ассоциированного соединения ацила (полученного как описано выше) обработкой таким восстановителем, как боран.
Соединения формулы I,
имеющие циклизованные заместители амина (например, соединения, где R7 и R8 вместе являются алкиленом или алкениленом) можно получить следующим
образом. Ассоциированный свободный
амин подвергают гидроаминированию обработкой альдегидом или кетон галогенидом (например, 4-хлорбутаналом) в органическом растворителе (например, метиленхлориде)
примерно при 20 - 30oC для
образования соединения формулы
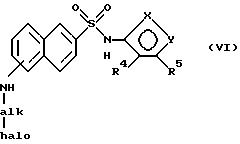
где
"алк" - алкилен или алкенилен и "гало" - галоген. Когда алк-группу замещают оксогруппой на углероде, примыкающем к аминогруппе, используют галогенангидрид (например, 4-бромбутирил хлорид) вместо альдегида в присутствии основания (например, пиридина). Соединение VI затем подвергают циклизации обработкой основанием (например, карбонатом цезия) в органическом растворителе (например, диметилформамиде) при примерно 55 - 65oC для образования соединения I, где R7 и R8 вместе являются алкиленом или алкениленом.
Соединения формулы I, имеющие циклизованные заместители амина, можно также получить посредством следующего альтернативного процесса. Ассоциированный свободный амин подвергают гидроаминированию обработкой дикетоном или диальдегидом (например, глутарическим диальдегидом) в присутствии органической кислоты (например, уксусной кислоты) в органическом растворителе (например, диоксане), а затем восстановителем (например, цианоборгидрид натрия) для образования циклированного амина, где R7 и R8 вместе являются алкиленом или алкениленом.
Ассоциированный свободный амин (имеющий - NR7R8,
где R7 и R8 оба являются водородом) можно также сконденсировать с соединением формулы
R9N=C=O (VIIa)
или с соединением формулы
R9
N=C=
(VIIb)
где
R9 в соединениях VIIa и VIIb выбирают из подпараграфа (f) в предшествующем определении (например, где соединение VIIb - фенилизотиоцианат). Реакцию можно
проводить в присутствии основания (например, триэтиламина) и катализатора (например, диметиламинопиридина) в органическом растворителе (например, ацетоне) при примерно 60 - 70oC для
образования соединения I, где один из R1 - R5 - это -Z4-N(R11)-Z5 - NR9R10.
Для образования соединения I, где один или более из R1 - R3 - алкокси, ассоциированную гидрокси сульфоновую кислоту IV можно обработать алкилирующим агентом (например, диметилсульфатом) и гидроксидом щелочного металла (например, гидроксидом натрия) в смеси водного/органического растворителя (например, вода/этанол), а затем кислотой (например, соляной кислотой). Полученную соль алкокси сульфоновой кислоты V можно использовать, как описано выше, для образования соединения I.
Для соединений, где один из R1 - R5 включает кислотную составляющую, получают ассоциированный сложный эфир (например, где R1 - -CO2R6 или алкил, замещенный -CO2Z6) взаимодействием соединений II и III, как описано выше, с последующим деэстерифицированием, например, гидроксидом натрия, в таком спирте, как метанол примерно при 20 - 30oC.
Соединения, где один из R1 - R5 включает гидроксильную составляющую (например, где R1 - гидроксил, или алкил, замещенный гидроксилом), можно получить восстановлением ассоциированной карбоновой кислоты; например, обработкой бораном в органическом растворителе (например, тетрагидрофуране) примерно при 0 - 30oC. Альтернативно ассоциированный сложный эфир можно обрабатывать органометаллическим реагентом (например, бромидом метил магния) в органическом растворителе (например, тетрагидрофуране) при нагревании в колбе с обратным холодильником для образования гидроксильного соединения. Далее защищенный гидроксил, образованный взаимодействием соединений II и III, можно обычным образом дезащитить, как описано выше.
Соединения, где один из R1 - R5 включает алкенильную составляющую, можно получить удалением воды из ассоциированного гидроксильного соединения, например, обработкой кислотой (например, трифторуксусной кислотой) в органическом растворителе (например, метиленхлориде) при нагревании в колбе с обратным холодильником.
Соединения, где один из R1 - R5 включает кето или альдегидную составляющую, можно получить из ассоциированного спирта обработкой окислителем (например, хлорхроматом пиридиния) в органическом растворителе (например, метиленхлориде) примерно при 20 - 30o C.
Подобные альдегиды можно гидроаминировать для образования дизамещенных аминов соединения I. Например, альдегид обрабатывают кислотой (например, уксусной), дизамещенным амином (например, диметиламином) и восстановителем (например, триацетоксиборгидридом) в органическом растворителе (например, тетрагидрофуране) для образования дизамещенного амина формулы I.
Далее изобретение будет описано рабочими примерами, которые являются его предпочтительными вариантами исполнения изобретения. В дальнейших структурах "Ac" означает ацетил, "Me" - метил. Эти примеры являются аллюстративными, а не ограничивающими.
Пример 1. 5-(Диметиламино)-N-(3,4-диметил-5-изоксазолил)-1-
нафталинсульфонамид
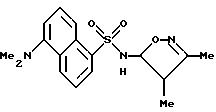
Раствор дансил хлорида (2,00 г, 7,67 ммоль) в пиридине (10 мл) добавляли по каплям к раствору 3,4-диметил-5-изоксазоламина (1,65 г, 14, 7 ммоль) в пиридине (5 мл). Реакционную смесь нагревали при 60oC всю ночь. После охлаждения до комнатной температуры реакционную смесь добавляли по каплям к воде (100 мл) и суспензию перемешивали в течение ночи, образуя желтовато-коричневую смолу. Воду сливали, и смолу растворяли в эфире (50 мл) и экстрагировали добавлением воды (50 мл). Слой эфира выпаривали до получения пушистого желтого твердого тела, которое высушивали под вакуумом с выходом 1,41 г (55%). Продукт пропускали через столб кремнезема, используя 15%-ный этилацетат/метиленхлорид в качестве растворителя. Фракции, содержащие продукт, комбинировали и выпаривали с выходом 0,84 г вещества по примеру 1 аморфного желтого твердого тела. Точка плавления: 126,2 - 129,8oC.
Пример 2.
N-[5-[[(3,4-Диметил-5-изоксазолил)амино]сульфонил]-1- нафталинил]ацетамид
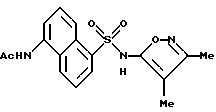
A. 5-Амино-1-нафталинсульфоновая кислота, соль натрия.
К суспензии 5-амино-1-нафталинсульфоновой кислоты (12 г, 54 ммоль) в воде (130 мл) добавляли 5 N гидроксида натрия (11 мл). После 5 мин воду удаляли in vacuo, и осадок промывали толуолом (20 мл) с выходом 13,0 г (98%) соединения A.
B. 5-(Ацетиламино)-1-нафталинсульфоновая кислота, соль натрия.
Уксусный ангидрид (50 мл) добавляли к соединению A (13,0 г, 53,0 ммоль), и суспензию нагревали при 100oC в течение 1,5 ч. После охлаждения до комнатной температуры продукт отфильтровывали в вакууме, промывали этанолом (100 мл) и высушивали под вакуумом с выходом 14,8 г (97%) соединения B, которое затем далее высушивали в вакуумной печи (40oC).
C. N-5-(Хлорсульфонил)-1-нафталинил-ацетамид.
Раствор соединения B (2,67 г, 9,29 ммоль) в хлорсульфоновой кислоте (12 мл) перемешивали при комнатной температуре в течение 2,5 ч. Реакционную смесь добавляли по каплям очень медленно в разломанный лед (150 мл), и суспензию перемешивали до тех пор, пока плавился лед, получая мелкодисперсный осадок, который отфильтровывали в вакууме и высушивали с выходом 2,63 г (100%) соединения C.
D. N-[5-[[(3,4-Диметил-5-изоксазолил)-амино] -сульфонил]-1- нафталинил] ацетамид.
К раствору 3, 4-диметил-5-изоксазоламина (1,21 г, 10,8 ммоль) в пиридине (7 мл) добавляли раствор соединения C (1,51 г, 5,32 ммоль) в пиридине (13 мл), по каплям в течение 10-минутного периода. Реакционную смесь нагревали при 70oC в течение 2 ч. После охлаждения до комнатной температуры большую часть пиридина удаляли in vacuo, и остаток разбавляли до 50 мл водой. При подкислении до pH 3 6 N соляной кислотой образовывался осадок, который отфильтровывали под вакуумом и высушивали с выходом 0,36 г (19%) соединения примера 2. Перекристаллизация 0,19 г из этанола/воды дала 0,12 г коричневых кристаллов.
Точка плавления: 216,3 - 222,0oC.
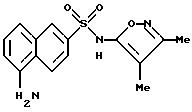
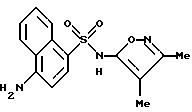
Пример 3. 5-Амино-N-(3,4-диметил-5-изоксазолил)-1-нафталин- сульфонамид
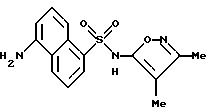
Раствор примера 2 (0,188 г, 0,523 ммол) в 5 N гидроксида натрия (2 мл) и метанола (1 мл) нагревали при 70oC всю ночь. После охлаждения до комнатной температуры реакционную смесь подкисляли до pH 3 1N соляной кислотой, образуя осадок, который отфильтровывали и высушивали in vacuo с выходом 0,14 г (84%). Перекристаллизация из этанола/воды дала темно-оранжевые кристаллы (0,084 г, 51%).
Точка плавления: 121,5 - 127,0oC.
Пример 4. N-[6-[[(3,
4-диметил-5-изоксазолил)амино]сульфонил]-1- нафталинил]ацетамид
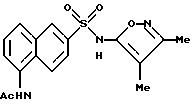
A. 5-Амино-2-нафталинсульфонат натрия.
К суспензии 5-амино-2-нафталин сульфоновой кислоты (25 г, 0,11 ммоль) в воде (300 мл) добавляли 5 N гидроксида натрия (23 мл). После перемешивания раствора в течение 5 мин воду удаляли in vacuo, и остаток промывали толуолом (50 мл) и высушивали под вакуумом с выходом 27,9 г (100%) соединения A.
B. 5-Ацетиламино-2-нафталинсульфонат натрия.
Суспензию соединения A (14,6 г, 59,6 ммоль) в уксусном ангидриде (80 мл) нагревали при 100oC в течение 3 ч. После охлаждения до комнатной температуры смесь отфильтровывали под вакуумом, и твердое тело промывали этанолом. Твердое тело перемешивали в этаноле (100 мл) в течение 5 мин, перефильтровывали и высушивали с выходом 15, 7 г (92%) соединения B.
C. 5-Ацетиламино-2-нафталинсульфонил хлорид
В большой ступке измельчали соединение B (7,00 г, 24,4 ммоль) и пентахлорид фосфора (10,1 г, 48,7 ммоль)
до
образования густой, коричневой барботирующей (кипящей) жидкости. Смесь выдерживали в течение 15 мин, и затем измельчали с колотым льдом (400 г). После плавления льда полученный тонкодисперсный
осадок
отфильтровывали под вакуумом и экстрагировали в Soxhlet экстракторе с этилацетатом в течение 3 ч. Выпаривание раствора этилацетата дало 6,39 г (92%) соединения C.
D. N-[6-[[(3, 4-диметил-5-изоксазолил)-амино] сульфонил] -1- нафталинил] ацетамид.
К раствору 3,4-диметил-5-изоксазоламина (1,74 г, 15,5 ммоль) в пиридине (8 мл) добавляли соединение C (4,02 г, 14, 2 ммоль) все сразу при перемешивании. Реакционная смесь становилась коричневой, и ее оставляли перемешивать на ночь при комнатной температуре и затем при 75oC в течение 1 ч. Продукт осаждали подгонкой реакционной смеси до pH 3 6N соляной кислоты и собирали фильтрацией под вакуумом с выходом 2,36 г (47%) названного соединения в неочищенной форме. Этот материал перекристаллизовывали из этанол/хлороформа с выходом 0,263 г (5%) соединения примера 4 в виде розового порошка.
Температура плавления: 210,5 - 212,0oC.
Анализ для C17H17N3O4S • 0,31H2O
Вычислено: C 55,95; H 4,87; N 11,51; S 8,78.
Обнаружено: C 55,95; H 4,68; N 11, 41; S 8,71.
Пример 5. 5-Амино-N-(3,4-диметил-5-изоксазолил)-2-нафталинсульфонамид
Перемешиваемый раствор примера 4 (1,36 г, 3,78 ммоль), гидроксид натрия (5 N, 4,5 мл), воду (1,5 мл) и метанол (1 мл) нагревали при 60oC всю ночь. После охлаждения до комнатной температуры реакционную смесь разбавляли до 40 мл водой и подкисляли до pH 3 6N соляной кислотой для получения коричневого осадка. При перемешивании твердое тело становилось порошком, который затем отфильтровывали под вакуумом и высушивали. Перекристаллизация из толуола дала 0,113 г (9%) чистого соединения примера 5 в виде желтого порошка.
Точка плавления: 152,5 - 153,8oC.
Анализ для C15H15N3O3S.
Вычислено: C 56,77; H 4,76; N 13,24; S 10,10.
Обнаружено: C 56,93; H 4,75; N 13,12; S 10,18.
Пример 6. N-[4-[[(3,4-Диметил-5-изоксазолил)амино]сульфонил]-1- нафталинил]ацетамид
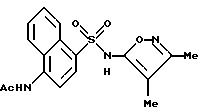
A. 4-Ацетиламино-1-нафталинсульфонил хлорид.
В большой ступке измельчали 4-ацетиламино-1-нафталинсульфонат натрия (3,00 г, 10,4 ммоль) с пентахлоридом фосфора (3,80 г, 18,2 ммоль) до образования барботирующей пасты, которая вскоре стала сухой. После выстаивания в течение 1 ч при комнатной температуре смесь добавляли к колотому льду (150 мл). После измельчения ледяной смеси в ступке ее перемешивали до тех пор, пока лед не расплавился, образуя розовый порошкообразный осадок, который отфильтровывали под вакуумом и высушивали с выходом 1,07 г (36%) соединения A.
B. N-[4-[[(3,4-Диметил-5-изоксазолил)амино]-сульфонил]-1- нафталинил]ацетамид.
К раствору 3,4-диметил-5-изоксазоламина (0,217 г, 1,94 ммоль) в пиридине (2 мл) добавляли соединение A (0,503 г, 1,77 ммоль). Реакционная смесь становилась коричневой и слегка нагревалась. После перемешивания в течение 4,5 ч смесь по каплям добавляли к воде (30 мл) для образования белого осадка, который удаляли фильтрацией под вакуумом. Фильтрат подкисляли до pH 3 6N соляной кислотой, и осадок собирали и высушивали (0,216 г, 33%). Перекристаллизация твердого тела из этанола/воды дала 0,12 г (18%) соединения примера 6 в виде темно-красных кристаллов.
Точка плавления: 199,3 - 205,5oC.
Анализ для C17H17N3
O4S • 0,2H2O
Вычислено: C 56,24; H 4,83; N 11,57; S 8,83.
Обнаружено: C 56,42; H 4,60; N 11, 39; S 8,96.
Пример 7. N-[6-[[(3,
4-Диметил-5-изоксазолил)амино]-сульфонил]-2- нафталинил]ацетамид
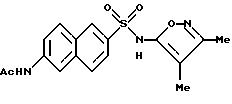
A. 6-Амино-2-нафталинсульфонат натрия.
К перемешиваемой суспензии 6-амино-2-нафталинсульфоновой кислоты (3,01 г, 13,5 ммоль) в метаноле (100 мл) добавляли 5 N гидроксида натрия (2,7 мл). Реакционную смесь перемешивали в течение 5 мин, метанол удаляли in vacuo и остаток высушивали с выходом 2,44 г (74%) соединения A.
B. 6-Ацетиламино-2-нафталинсульфонат натрия.
Суспензию соединения A (2,44 г, 9,95 ммоль) в уксусном ангидриде (15 мл) нагревали при 100oC в течение 1 ч. Продукт отфильтровывали под вакуумом, промывали этанолом (100 мл) и высушивали с выходом соединения B (2,52 г, 88%).
C. 6-Ацетиламино-2-нафталинсульфонил хлорид.
Хлорсульфоновую кислоту (7 мл) добавляли к соединению B (2,41 г, 8,39 ммоль), и темно-коричневый раствор выдерживали при комнатной температуре в течение 2,5 ч. Реакционную смесь добавляли по каплям к колотому льду (100 мл) и перемешивали до плавления льда. Осадок отфильтровывали в вакууме, промывали водой и высушивали с выходом 2,38 г (100%) соединения C.
D. N-[6-[[(3,4-Диметил-5-изоксазолил)-амино] -сульфонил]-2- нафталинил] ацетамид.
Раствор соединения C (2,36 г, 8,32 ммоль) в пиридине (20 мл) добавляли по каплям к перемешиваемому раствору 3,4-диметил-5-изоксазоламина (1,91 г, 17,0 ммоль) в пиридине (5 мл), и реакционную смесь нагревали при 70oC в течение 4 ч. После охлаждения до комнатной температуры смесь добавляли по каплям к воде (100 мл), и водный раствор подкисляли до pH 3 6N соляной кислотой, образуя песочно-коричневый осадок, который отфильтровывали под вакуумом и высушивали. Перекристаллизация из метанола/воды дала чистое соединение примера 7 в виде мелких рыжевато-коричневых кристаллов (0,342 г, 11%).
Точка плавления: 206,2 - 207,0oC.
Анализ для C17H17N3O4S • 0,15H2O.
Вычислено: C 56,39; H 4,82; N 11,60; S 8,85.
Обнаружено: C 56,67; H 4,60; N 11,42; S 9,04.
Пример 8. 6-Амино-N-(3,
4-диметил-5-изоксазолил)-2-нафталинсульфонамид
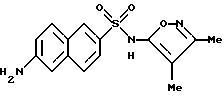
Перемешиваемый раствор примера 7 (0,216 г, 0, 601 ммоль) в 5 N гидроксида натрия (1,4 мл) и метаноле (1 мл) нагревали при 70oC всю ночь. После охлаждения реакционной смеси до комнатной температуры pH довели до примерно 2 - 3 соляной кислотой (1 N). Бледно-розовый осадок, который образовывался, отфильтровывали и высушивали in vacuo с выходом 0,174 г (91%). Перекристаллизация из этанола/воды дала 0,145 г (71%) соединения примера 8 в виде маленьких кристаллов.
Точка плавления: 174,5 - 176,0oC.
Анализ для C15H15N3O3S • 0,17H2
O
Вычислено: C 56,22; H 4,83; N 13,11;
S 10,01.
Обнаружено: C 56,32; H 4,65; N 13,02; S 9,88.
Пример 9. 4-Амино-N-(3,
4-диметил-5-изоксазолил)-1-нафталинсульфонамид
Смесь примера 6 (200 мг, 0,557 ммоль) и 5 N гидроксида натрия (1 мл) нагревали при 70oC в течение 2 ч. После охлаждения реакцию подкисляли 6N соляной кислотой до pH 2. Осадок собирали фильтрацией, промывали водой (2 х 2 мл) и высушивали.
Неочищенный материал суспендировали в толуоле (примерно 10 мл) и доводили до кипения. К кипящей смеси добавляли этанол для воздействия на растворение. Результатом продолжавшегося кипения стало образование небольшого количества багряного осадка. Осадок удаляли горячим фильтрованием, и фильтрат немедленно охлаждали во льду. Твердый продукт, который образовывался, собирали фильтрованием, промывали толуолом и высушивали. Этот материал тритуратировали эфиром (5 мл) и промывали эфиром (2 х 2 мл) и высушивали с выходом чистого соединения примера 9 (52 мг, 29%) в виде рыжевато-коричневого порошка.
Точка плавления: 152,0 - 154,0oC.
Анализ для C15H15N3O3S • 0,20H2O.
Вычислено: C 56,13; H 4,84; N 13,09.
Обнаружено: C 56,15; H 4,53; N 12,85.
Пример 10. 5-Диметиламино-N-(4,
5-диметил-3-изоксазолил)-1- нафталинсульфонамид
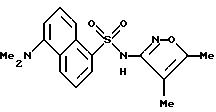
К раствору 4,5-диметил-3-изоксазоламина (135 мг, 1,20 ммоль) в пиридине (2 мл) добавляли 5-диметиламино-1-нафталинсульфонил хлорид (270 мг, 1,00 ммоль) в одну порцию. После перемешивания в течение 2 ч реакцию добавляли к воде (20 мл) по каплям. Смесь доводили до pH 8,5 2N гидроксида натрия. Смесь отфильтровывали через Celite® и фильтрат доводили до pH 4. Полученную смолу перемешивали в течение 1 ч, и осадок собирали фильтрацией, промывали водой (3 х 10 мл) и высушивали in vacuo. Желтоватый порошок (252,9 мг) перекристаллизовывали из 95%-ного этанола (примерно 2 мл) после стадии горячей фильтрации. Кристаллический материал собирали, прополаскивали холодным этанолом (1 мл) и высушивали с выходом 250 мг (72%) соединения примера 10 в виде светло-зеленых кристаллов.
Точка плавления: 190,5 - 192,0oC.
Анализ для C17H19N3O3S.
Вычислено: C 59,11; H 5,54; N 12,17; S 9,28.
Обнаружено: C 59,15; H 5,50; N 12,08; S 9,38.
Пример 11. N-[5-[[(5,
5-диметил-3-изоксазолил)амино]-сульфонил]- 1-нафталинил]ацетамид
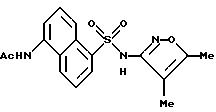
К раствору 4, 5-диметил-3-изоксазоламина (123 мг, 1,10 ммоль) в пиридине (1 мл) добавляли 5-ацетиламино-1-нафталинсульфонилхлорид (284 мг, 1,00 ммоль) в одну порцию. Реакцию перемешивали в течение 1 ч и затем добавляли по каплям к воде (20 мл). pH раствора подгоняли до 7,5 2N гидроксида натрия. Небольшое количество осадка удаляли фильтрацией. Фильтрат доводили до pH 2,5 6N соляной кислоты. Коричневый осадок собирали фильтрацией, промывали водой (2 х 10 мл) и высушивали. Этот материал (239 мг) перекристаллизовывали из этанола/воды с выходом соединения примера 11 (139 мг, 39%) в виде коричневых кристаллов.
Точка плавления: 225,0 - 226,0oC.
Вычислено: C 56,81; H 4,77; N 11,69; S 8,92.
Обнаружено: C 56,63; H 4,61; N 11,50; S 9, 14.
Пример 12. N-[5-[[(3,
4-диметил-5-изоксазолил)амино]-сульфонил]- 2-нафталинил]ацетамид
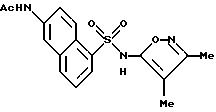
A. Соль 6-амино-1-нафталинсульфоновой кислоты и натрия
К суспензии 6-амино-1-нафталин-сульфоновой кислоты (10,0 г, 44,8 ммоль) в воде (10 мл) добавляли 5N гидроксида натрия (9 мл, 45 ммоль). Смесь подогревали до полного растворения, и затем растворитель удаляли in vacuo для получения соединения A в виде белого твердого тела (11,3 г).
B. Соль 6-ацетиламино-1-нафталинсульфоновой кислоты и натрия.
Соединение A (10,0 г, 40,8 ммоль) суспендировали в уксусном ангидриде (100 мл). Смесь нагревали при 95oC в течение 4 ч, охлаждали до комнатной температуры и выпаривали in vacuo с выходом 11,2 г соединения B в виде белого порошка.
C. 6-Ацетиламино-1-нафталинсульфонил хлорид
Раствор соединения
B (1,00 г, 3,48 ммоль)
в хлорсульфоновой кислоте (5,0 мл, 75,2 ммоль) перемешивали при комнатной температуре в присутствии аргона в течение 2,5 ч. Реакцию затем добавляли по каплям к примерно 400 мл
колотого льда, и смесь
перемешивали до тех пор, пока весь лед не расплавился. Тонкодисперсный осадок, который образовывался, отфильтровывали под вакуумом, промывали обильными количествами воды (400
мл) и высушивали с
выходом соединения C (0,850 г, 86%).
D. N-[5-[[(3,4-диметил-5-изоксазолил)амино] -сульфонил] -2- нафталинил] ацетамид.
Раствор соединения C (0,700 г, 2,47 ммоль) в пиридине (3 мл) добавляли по каплям к раствору 3,4-диметил-5-изоксазоламина (0,358 г, 3,19 ммоль) и диметиламинопиридина (0,057 г, 0,467 ммоль) в пиридине (3 мл). Реакцию нагревали при 70o C в течение 6 ч, затем охлаждали до комнатной температуры. Раствор добавляли по каплям к воде (100 мл) и при подкислении до pH 3 6 N соляной кислотой осаждалось белое твердое тело, которое собирали фильтрацией и высушивали до твердого состояния (0,713 г, 80%). Перекристаллизация 0,200 г твердого тела из метанола/воды дала соединение примера 12 в виде светло-коричневых кристаллов (0,140 г, 56%).
Точка плавления: 232,2 - 235,5oC (разл.).
Анализ для C17H17N3O4S • 0,01H2
O:
Вычислено: C 56,79; H 4,77; N 11,69; S 8,92.
Обнаружено: C 56,77; H 4,65; N 11,71; S 9,05.
Пример 13. N-[8-[[(3,
4-диметил-5-изоксазолил)амино]-сульфонил]-2-нафталинил] ацетамид
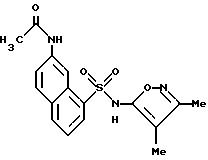
A. 7-Амино-1-нафталинсульфонат натрия.
К суспензии 7-амино-1-нафталинсульфоновой кислоты (10,0 г, 44,8 ммоль) в воде (10 мл) добавляли гидроксид натрия (5 N, 9 мл, 45 ммоль). Полученный раствор выпаривали in vacuo с выходом соединения A в виде твердого тела (11,0 г).
B. 7-Ацетамино-1-нафталинсульфонат натрия.
Порцию соединения A (10,0 г, 40,8 ммоль) суспендировали в уксусном ангидриде (125 мл). Эту смесь нагревали при 95oC в течение 6 ч, охлаждали и выпаривали in vacuo для получения соединения B в виде рыжевато-коричневого порошка (11, 8 г, 100%).
C. 7-Ацетиламино-1-нафталинсульфонил хлорид.
Соединение B (1,00 г, 3,48 ммоль) добавляли порциями к хлорсульфоновой кислоте (3 мл) при 0oC. Смесь доводили до комнатной температуры и перемешивали в течение 1 ч. Реакцию осторожно добавляли к колотому льду (30 г). Смесь перемешивали до тех пор, пока лед не расплавился, и затем осадок собирали фильтрацией, промывали водой (4 х 15 мл) и высушивали in vacuo с выходом 893 мг (90%) соединения C.
D. N-[8-[[(3,4-диметил-5-изоксазолил амино]-сульфонил]-2- нафталинил]ацетамид.
К раствору 3,4-диметил-5-изоксазоламина (206 мг, 1,83 ммоль) и 4-диметиламинопиридина (35 мг) в пиридине (2 мл) добавляли соединение C (400 мг, 1,41 ммоль). Смесь нагревали до 75oC в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры, вливали в воду (30 мл) и доводили до pH 1,5 6 N соляной кислотой. Клейкую смесь перемешивали в течение 2 дней. Полученный осадок собирали фильтрацией, промывали водой (3 х 10 мл) и высушивали in vacuo. Перекристаллизация этого материала из этанола/воды дала соединение примера 13 (319 мг, 63% выход) в виде рыжевато-коричневых кристаллов.
Точка плавления: 140,0 - 143,0oC.
Пример 14. N-[7-[[(3,
4-диметил-5-изоксазолил)амино]-сульфонил]- 2-нафталинил]ацетамид
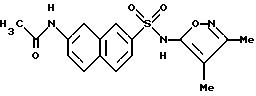
A. 7-Ацетиламино-2-нафталинсульфонат натрия.
7-Амино-2-нафталинсульфонат натрия (13,2 г, содержащий 24% хлорида натрия и 10% воды, 40,8 ммоль) суспендировали в уксусном ангидриде (100 мл). Эту смесь нагревали при 95oC в течение 4 ч, охлаждали и выпаривали in vacuo для получения соединения A в виде рыжевато-коричневого порошка (13,4 г, 90%).
B. 7-Ацетиламино-2-нафталинсульфонил хлорид.
Соединение A (1,33 г, содержит 25% хлорида натрия, 3,48 ммоль) добавляли порциями к хлорсульфоновой кислоте (3 мл) при 0oC. Смесь доводили до комнатной температуры и перемешивали в течение 4 ч. Реакцию осторожно добавляли к колотому льду (30 г). Смесь перемешивали до тех пор, пока лед не расплавился, и затем осадок собирали фильтрацией, промывали водой (4 х 15 мл) и высушивали in vacuo с выходом 651 мг (66%) соединения B.
C. N-[7-[[(3,4-диметил-5-изоксазолил)амино] -сульфонил] -2- нафталинил] ацетамид.
К раствору 3,4-диметил-5-изоксазоламина (206 мг, 1,83 ммоль) и 4-диметиламинопиридина (35 мг) в пиридине (2 мл) добавляли соединение B (400 мг, 1,41 ммоль). Смесь нагревали до 75oC в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры, вливали в воду (30 мл) и доводили до pH 1,5 6 N соляной кислотой. Клейкую смесь перемешивали в течение 17 ч. Полученный осадок собирали фильтрацией, промывали водой (3 х 10 мл) и высушивали in vacuo. Перекристаллизация этого материала из этанола/воды дала соединение по примеру 14 (324 мг, 64% выход) в виде рыжевато-коричневых кристаллов.
Точка плавления: 191,5 - 193,5oC (разл.).
Пример 15. N-[7-[[(3,
4-диметил-5-изоксазолил)амино]сульфонил]-1- нафталинил]ацетамид
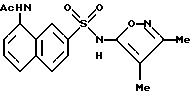
A. 8-Ацетиламино-2-нафталинсульфонат натрия
К суспензии 8-амино-2-нафталин-сульфоновой кислоты (10,0 г, 44,8 ммоль) в воде (250 мл) добавляли гидроксид натрия (5 N, 9 мл, 45 ммоль). Полученный раствор выпаривали in vacuo. Часть этого материала (10 г, 40,8 ммоль) затем суспендировали в уксусном ангидриде (100 мл) и затем нагревали при 95oC в течение 6 ч, охлаждали и выпаривали in vacuo до получения твердого тела. Это твердое тело помещали в воду (100 мл) и нагревали при 55oC в течение 2 дней и затем при 85oC в течение 2 ч. Раствор затем выпаривали in vacuo с выходом соединения A в виде твердого тела (12,0 г).
B. 8-Ацетиламино-2-нафталинсульфонил хлорид
Соединение A (4,00 г, 13,9 ммоль) добавляли порциями к
хлорсульфоновой
кислоте (12 мл) при 0oC. Смесь доводили до комнатной температуры и перемешивали в течение 5 ч. Реакцию осторожно добавляли к колотому льду (150 г). Смесь перемешивали до
тех пор, пока лед
не расплавился, и затем осадок собирали фильтрацией, промывали водой (3 х 20 мл) и высушивали in vacuo с выходом 2,91 г (74%) соединения B.
C. N-[7-[[(3,
4-диметил-5-изоксазолил)амино]-сульфонил]-1- нафталинил]ацетамид
К раствору 3,4-диметил-5-изоксазоламина (408 мг, 1,83 ммоль) и 4-диметиламинопиридина (68 мг) в пиридине (5 мл) добавляли
соединение B (800 мг, 2,80 ммоль). Смесь нагревали до 75oC в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры, вливали в воду (30 мл) и доводили до pH 1,5 6 N соляной
кислотой. Клейкую смесь перемешивали в течение 17 ч. Полученный осадок собирали фильтрацией, промывали водой (3 х 10 мл) и высушивали in vacuo. Перекристаллизация этого материала из этанола/воды дала
соединение примера 15 (847 мг, выход 84%).
Точка плавления: 133,0 - 134,0oC.
Пример 16. N-(3,4-Диметил-5-изоксазолил)-5-метокси-1- нафталинсульфонамид
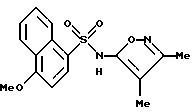
A. 5-Метокси-1-нафталинсульфоновой кислоты и натрия соль.
Раствор соли натрия 5-гидрокси-1-нафталинсульфоновой кислоты (10 г, 40,6 ммоль), диметилсульфата (3,7 мл, 40,6 ммоль) и 4 N гидроксида натрия (10,0 мл, 40,6 ммоль) в 20 мл 1:1 воды : этанола нагревали в колбе с обратным холодильником в течение ночи, охлаждали, подкисляли концентрированной соляной кислотой и выпаривали. Серое металлическое твердое тело промывали эфиром до получения 12,4 г (больше чем 100%) соединения A с примесью в виде серого твердого тела.
B. 5-Метокси-1-нафталинсульфонил хлорид.
Смесь неочищенного соединения A (4,2 г, 16,1 ммоль) и пентахлорида фосфора (6,73 г, 32,3 ммоль) нагревали при 70oC при перемешивании в течение 2 ч, в течение этого времени твердые тела разжижались до серо-зеленой смолы. В смесь добавляли ледяную воду, и серо-зеленое твердое тело отфильтровывали, промывали водой и помещали в дихлорметан, и раствор высушивали (сульфатом магния) и выпаривали для получения соединения B в виде серо-зеленой смолы, которая кристаллизовалась при выстаивании.
C. N-(3,4-Диметил-5-изоксазолил)-5-метокси-1- нафталинсульфонамид.
Раствор соединения B (1,4 г, 5,5 ммоль), 3, 4-диметил-5-изоксазоламина (0,74 г, 6,59 ммоль) и диметиламинопиридина (0,17 г, 1,37 ммоль) в 5 мл пиридина нагревали при 75oC в течение 2 ч и наливали на лед. Раствор подкисляли концентрированной соляной кислотой, и полученное коричневое твердое тело отфильтровывали, прополаскивали водой и растворяли в насыщенном бикарбонате натрия (150 мл). Добавляли Celite® , суспензию отфильтровывали, и фильтрат подкисляли концентрированной соляной кислотой. Полученное рыжевато-коричневое твердое тело отфильтровывали, ополаскивали водой и высушивали под вакуумом для получения 1,10 г рыжевато-коричневого твердого тела. Хроматография на кремнеземе с 3% метанол/метилен хлоридом дала 0,29 г соединения по примеру 16 (16%) в виде рыжевато-коричневого твердого тела.
Точка плавления: 72 - 75oC.
13C ЯМР (CDCl3) 6,38, 10,73, 55,75, 105,10, 107,62, 116,02, 123,37, 126,57, 129,10, 129,30, 129,42, 130,51, 133,82, 154,40, 155,94, 16179 м.д.
Пример 17. N-(3,4-Диметил-5-изоксазолил)-1-нафталинсульфонамид
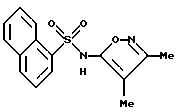
При 0oC к раствору 3,4-диметил-5-изоксазоламина (1,19 г, 10,6 ммоль) в пиридине (5 мл) добавляли 1-нафталинсульфонил хлорид (2,00 г, 8,82 ммоль) в одну порцию. Реакцию доводили до комнатной температуры. Вскоре образовывался осадок. Реакцию перемешивали в течение 2 ч, и затем добавляли по каплям в воду (50 мл), pH подгоняли до 8 2 N гидроксида натрия, и смесь перемешивали в течение 30 мин. Получили клейкую смолу. Раствор сливали со смолы. Смолу ополаскивали водой, и собранные декантаты доводили до pH 2 6N соляной кислотой и перемешивали всю ночь, получая прозрачное, стеклообразное твердое тело. После сливания растворителя стеклообразное твердое тело высушивали in vacuo. Вышеозначенную смолу перемешивали с метанолом (примерно 4 мл), вызывая образование твердого тела. Смесь разбавляли водой (75 мл), доводили до pH 2 6N соляной кислотой и перемешивали всю ночь, осаждая твердое тело, которое собирали, промывали водой (2 х 20 мл) и сходным образом высушивали. Это твердое тело и высушенное стеклообразное тело соединяли с 1 N гидроксида натрия (20 мл). После перемешивания смеси в течение 40 мин осадок удаляли фильтрацией, и фильтрат доводили до pH 2. Бледно-красный осадок собирали фильтрацией, ополаскивали водой (2 х 5 мл) и высушивали с выходом твердого тела. Хроматография (тонкослойная, кремнезем, 25 мм диа, 30% этилацетат/метилен хлорид) дала соединение по примеру 17 в виде белой пены (700 мг, 26%).
Точка плавления: 54,0 - 57,5oC.
Анализ для C15H14N2O3S • 0,02H2O.
Вычислено: C 59,52; H 4,67; N 9,25; S 10,59.
Обнаружено: C 59,64; H 4,91; N 9,13; S 10,27.
Пример 18. 5-[(1-Метилэтил)амино]-N-(3,4-диметил-5-изоксазолил) -1-нафталинсульфонамид
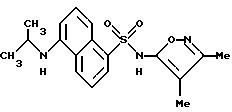
К раствору по примеру 3 (0,150 г, 0,473 ммоль) в 10 мл метанола добавляли ацетон (0,035 г, 0,473 ммоль). Полученный прозрачный желтый раствор перемешивали в течение 45 мин. Добавляли цианоборгидрид натрия (0,058 г, 0,95 ммоль) и уксусную кислоту (0,172 г, 2,85 ммоль), и смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь выпаривали in vacuo, помещали в 20 мл воды и экстрагировали этилацетатом (3 х 30 мл). Комбинированные органические слои промывали рассолом (1 х 35 мл), высушивали (сульфатом магния) и выпаривали in vacuo с выходом 0,21 г желтого твердого тела. Этот материал хроматографировали, используя этилацетат : гексаны (1 : 1) в качестве элюента с выходом 0,101 г (60%) примера 18 в виде желтого твердого тела.
Точка плавления: 156 - 159oC.
Пример 19. N-[5-[[(3,4-Диметил-5-изоксазолил)амино]сульфонил]-1- нафталинил]-2-метилпропанамид
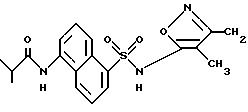
Изобутирил хлорид (0,144 мл, 1,38 ммоль) добавляли по каплям к раствору примера 3 (0,350 г, 1,10 ммоль) в пиридине (1 мл) и ацетоне (7 мл). Смесь перемешивали в течение 2,5 ч, и ацетон удаляли под вакуумом до получения густого коричневого остатка, который добавляли по каплям к полунасыщенному карбонату натрия водорода (30 мл). pH полученной смеси подгоняли до 8 - 8,5 насыщенным карбонатом натрия водорода. Неочищенный продукт осаждали подкислением раствора до pH 1,5 6N соляной кислотой, отфильтровывали и высушивали. Перекристаллизация из метанола/воды дала 51% твердого тела.
Точка плавления: 177,1 - 180,2oC.
Анализ для C19H21N3O4S.
Вычислено: C 58, 90; H 5,46; N 10,85; S 8,27.
Обнаружено: C 58,97; H 5,24; N 10,83; S 8,10.
Пример 20. 5-Хлор-N-(3,
4-диметил-5-изоксазолил)-1-нафталинсульфонамид
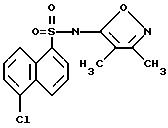
К суспензии 5-хлорнафталин сульфонилхлорида (0, 5 г, 1,9 ммоль) в 10 мл безводного пиридина при продувке аргоном добавляли 5-амино-3,4-диметилизоксазол (0,256 г, 2,28 ммоль) и диметиламинопиридин (50 мг, 10 мас.%). Раствор перемешивали всю ночь и нагревали при 60oC в течение 6 ч. После охлаждения до комнатной температуры смесь вливали в 30 мл воды, подкисляли 6N соляной кислотой до pH 2 - 3 и экстрагировали этилацетатом (3 х 50 мл). Собранные органические экстракты промывали рассолом, высушивали (сульфатом магния) и выпаривали под вакуумом с получением 0,61 г коричневой смолы. Тонкослойная хроматография (силикагель), с 2 : 1 ацетат : гексаны дала 0,27 г (81%) соединения по примеру 20 в виде белого твердого тела.
Точка плавления: 155 - 158oC.
Анализ для C15H13ClN2O3.
Вычислено: C 53,49; H 3,89; N 8,32; S 9,52; Cl 10,53.
Обнаружено: C 53,92; H 3,76; N 8,18; S 9,11; Cl 10,37.
Пример 21. N-(3,
4-Диметил-5-изоксазолил)-5-(фенилметил)-амино-1- нафталинсульфонамид
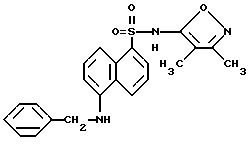
К раствору примера 3 (0, 26 г, 0,84 ммоль) в 10 мл метанола добавляли бензальдегид (0,13 г, 1,25 ммоль) и цианоборгидрид натрия (0,10 г, 1,67 ммоль). Раствор перемешивали в течение 15 мин, добавляли уксусную кислоту (0,29 мл, 5,00 ммоль), и раствор перемешивали всю ночь. Добавляли дополнительные порции бензальдегида (0,026 г), цианоборгидрида натрия (0,021 г) и уксусной кислоты (0,06 мл), и смесь перемешивали в течение 4 ч. Смесь выпаривали, суспендировали в 30 мл воды и экстрагировали 3 х 40 мл этилацетата. Собранные органические фазы промывали 50 мл рассола, высушивали (сульфатом магния) и выпаривали до коричневого твердого тела. Тонкослойная хроматография (силикагель) этилацетат : гексаны (1 : 1) и вторая хроматография метилен хлорид : метанол (96 : 4) дала 180 мг желтого твердого тела, которое при тритурации эфир : гексаны (30 : 70) дала 150 мг (44%) соединения по примеру 21 в виде желтого твердого тела.
Вычислено: C 64,85; H 5,19; N 10,31; S 7, 87.
Обнаружено: C 64,82; H 5,13; N 10,12; S 7,86.
Пример 22. N-(3,4-Диметил-5-изоксазолил)-5-гидрокси-1- нафталинсульфонамид
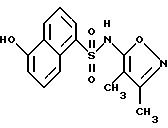
A. 5-[[(4-Метилфенил)сульфонил] окси] -1-нафталинсульфоновой кислоты и натрия соль.
Раствор соли натрия 5-гидрокси-1-нафталинсульфоновой кислоты (21,3 г, 86,5 ммоль) и толуолсульфонил хлорида (16,5 г, 86,5 ммоль) в смеси 20 мл воды, 20 мл этанола и 20 мл 5 N гидроксида натрия нагревали при 100oC в течение 3 ч и охлаждали. Рыжевато-коричневое твердое тело отфильтровывали, промывали 3 раза водой и высушивали всю ночь под вакуумом при 50oC для получения 16,0 г соединения A.Собранный фильтрат и осажденное дополнительное рыжевато-коричневое твердое тело из промывочной воды, которое отфильтровывали, промывали водой и высушивали под вакуумом для получения дополнительных 5,9 г соединения A (63% полного).
B. 5-[[(4-Метилфенил)сульфонил]окси]-1-нафталинсульфонил хлорид.
Соединение B получали из соединения A, следуя процедурам части B примера 16 (100%-ный выход серо-зеленой смолы, которую кристаллизовали при выстаивании).
C. N-(3,4-диметил-5-изоксазолил)-5-[[(4-метилфенил)сульфонил] окси]-1-нафталинсульфонамид.
Соединение C получали из соединения B, следуя процедурам части C примера 16. После вливания реакции на ледяную разбавленную соляную кислоту полученное рыжевато-коричневое твердое тело отфильтровывали, ополаскивали водой и растворяли в этилацетате. Раствор высушивали (сульфатом магния) и выпаривали до получения рыжевато-коричневого пенистого твердого тела, которое подвергали тонкослойной хроматографии на кремнеземе (75% этилацетат/гексаны) для получения соединения C в виде светлого желтого пенистого твердого тела.
D. N-(3,
4-Диметил-5-изоксазолил)-5-гидрокси-1-нафталинсульфонамид
Раствор соединения C (0,36 г, 0,78 ммоль) и 4 N гидроксида натрия (0,98 мл, 3,92 ммоль) в 5 мл метанола нагревали при 65oC
в течение 21,5 ч, охлаждали и подкисляли 10%-ной соляной
кислотой. Метанол выпаривали, и остаток экстрагировали дважды 10%-ным изопропанол/метилен хлоридом. Собранные органические фазы высушивали
(сульфатом магния) и выпаривали до получения 0,39 г
красно-коричневой смолы с некоторым кристаллическим материалом. Перекристаллизация из водного этанола дала 0,149 г розового твердого тела. Этот
материал подвергали препаративной TLC на кремнеземе с
этилацетатом, и продукт экстрагировали 10%-ным изопропанол/метилен хлоридом. Выпаривание органического раствора дало 0,122 г (49%) соединения по
примеру 22 в виде светло-розового твердого тела.
Точка плавления: 201 - 203oC.
Анализ для C15H14N2O4S.
Вычислено: C 56,59; H 4,43; N 8,80; S 10, 07.
Обнаружено: C 56,44; H 4,33; N 8,60; S 9,80.
Пример 23. 7-(Диметиламино)-N-(3,
4-диметил-5-изоксазолил)-1- нафталинсульфонамид
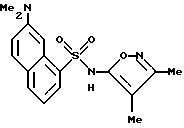
Раствор по примеру 48 (100 мг, 0,315 ммоль) и цианоборгидрид натрия (139 мг, 2,21 ммоль) в тетрагидрофуране (2 мл) добавляли по каплям при 0oC к раствору формальдегида (37%, 13,3 М, 0,14 мл, 1,9 ммоль) и 3 М серной кислоты (0,1 мл) в тетрагидрофуране (2 мл). Реакцию перемешивали при 0oC в течение 1,5 ч, и затем делали основной 2 N гидроксида натрия (2 мл). Тетрагидрофуран удаляли под вакуумом, и раствор доводили до pH 3,5 1 N соляной кислотой. Смесь перемешивали в течение 1 ч, и осадок собирали фильтрацией, промывали водой (2 х 2 мл), высушивали, хроматографировали (кремнезем, 2% метанол/метилен хлорид) и перекристаллизовывали из этанола/воды для получения соединения по примеру 23 (45%).
Точка плавления: 222 - 223oC.
Анализ для C17H19 N3O3S • 0,07H2O.
Вычислено: C 58, 90; H 5,57; N 12,12; S 9,25.
Обнаружено: C 58,54; H 5,42; N 12,10; S 9,68.
Пример 24. N-(3,
4-Диметил-5-изоксазолил)-5-[метил(1-метилэтил)-амино]-1- нафталинсульфонамид
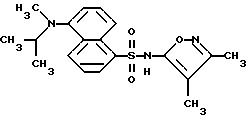
К раствору по примеру 18 (0,25 г, 0,70 ммоль) в 5 мл метанола добавляли 37% водного формальдегида (170 мл, 2,08 ммоль), и раствор перемешивали в течение 5 мин. Добавляли ледяную уксусную кислоту (0,2 мл), и затем добавляли цианоборгидрид натрия (0,13 г, 2,08 ммоль) в одну порцию, и смесь перемешивали всю ночь. Раствор выпаривали и разбавляли 25 мл воды, и полученное таким образом желтое твердое тело отфильтровывали и высушивали. Перекристаллизация из гексанов/этилацетата дала 0,21 г (81%) соединения по примеру 24 в две порции.
Точка плавления: 132 - 133oC.
Анализ для C19H23N3O3S - 1,19 H2O.
Вычислено: C 57,78; H 6,48; N 10,64; S 8,12.
Обнаружено: C 57,74; H 6,04; N 10,68; S 8,34.
Пример 25. 2-[[5-[[(3,4-Диметил-5-изоксазолил)амино]сульфонил]- 1-нафталинил]амино]пропановой кислоты этиловый эфир
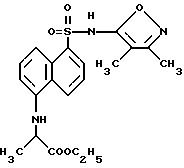
Соединение по примеру 25 получили в виде желтого твердого тела из примера 3 и этил пируват, как описано для примера 21.
Точка плавления: 62 - 65oC.
Анализ для C20H23N3O5S - 0,12 H2O.
Вычислено: C 58,03; H 5,90; N 9,71; S 7,41.
Обнаружено: C 58,03; H 5,78; N 9,32; S 7,37.
Пример 26. N-(3,4-Диметил-5-изоксазолил)-5-(2-оксо-1- пирролидинил)-1-нафталинсульфонамид
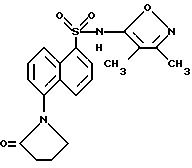
A. N-(3,4-Диметил-5-изоксазолил)-5-[1-(4-бром-1-оксобутил)амино] -1-нафталинсульфонамид
К раствору примера 3 (300 мг, 0,95 ммоль) и пиридина (0,11 мл, 1,41 ммоль) в дихлорметане (15 мл) добавляли 4-бромбутирил хлорид (0,12 мл, 1,04 ммоль). Смесь перемешивали при комнатной температуре в течение 90 мин и экстрагировали 10%-ным водным бикарбонатом натрия (три раза). Собранные водные экстракты подкисляли до pH 3 6N соляной кислотой и экстрагировали дихлорметаном (три раза). Собранные органические фазы промывали рассолом, высушивали (сульфатом магния) и выпаривали до получения 263 г (47%) соединения A в виде рыжевато-коричневого твердого тела.
B. N-(3,
4-Диметил-5-изоксазолил)-5-(2-оксо-1-пирролидинил)-1- нафталинсульфонамид
К суспензии карбоната цезия (290 мг, 0,90 ммоль) в безводном диметилформамиде (5 мл) при 60oC добавляли
раствор соединения A (210 мг, 0,45 ммоль) в 5 мл безводного диметилформамида по каплям в течение 30 мин. Смесь перемешивали в течение 90 мин, выпаривали и остаток разделяли между этилацетатом и
водой.
Водный слой экстрагировали этилацетатом (дважды), подкисляли до pH 3 6N соляной кислотой и экстрагировали дихлорметаном (три раза). Собранные фазы дихлорметана промывали рассолом, высушивали
(сульфатом магния) и выпаривали. Остаток кристаллизовали из этилацетата/гексанов, и кристаллическое твердое тело тритуратировали гексанами с получением 124 мг (73%) соединения примера 26 в виде
рыжевато-коричневого твердого тела.
Точка плавления: 183 - 187oC.
Анализ для C19H19N3SO4 : 0,79 H2
O
Вычислено: C 57,11; H 5,19; N 10,51; S 8,02.
Обнаружено: C 57,25; H 5,03; N 10,37; S 8,36.
Пример 27. N-(3,
4-Диметил-5-изоксазолил)-5-(2-оксо-1- пиперидинил)-1-нафталинсульфонамид
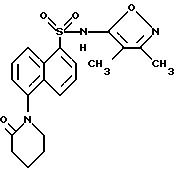
A. N-(3, 4-Диметил-5-изоксазолил)-5-[1-(5-бром-1-оксопентил) амино]-1-нафталинсульфонамид.
Соединение A получили в виде рыжевато-коричневого твердого тела из примера 3 и 5-бромвалерилхлорид, как описано для соединения A примера 26.
B. N-(3,4-Диметил-5-изоксазолил)-5-(2-оксо-1-пиперидинил)-1- нафталинсульфонамид.
Соединение примера 27 получали из соединения A в виде коричневого твердого тела, как описано в примере 26.
Точка плавления: 203 - 208oC.
Анализ для C20H21N3 SO4 : 0,06 H2O.
Вычислено: C 59,97; H 5,31; N 10,49; S 8,00.
Обнаружено: C 59,66; H 5,45; N 10,80; S 8,06.
Пример 28 N-(3,
4-Диметил-5-изоксазолил)-5-[[(фениламино)- тиоксометил] амино]-1-нафталинсульфонамид
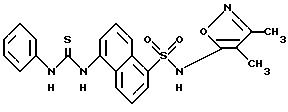
Фенилизотиоцианат (0,62 мл, 5,2 ммоль) добавляли по каплям к раствору примера 3 (1,26 г, 3,97 ммоль), триэтиламина (1,3 мл, 9,3 ммоль) и диметиламинопиридина (0,100 г, 0,819 ммоль) в ацетоне (45 мл). Смесь нагревали в колбе с обратным холодильником при 65oC. После 48 ч добавляли другие 0,3 эквивалента (0,1 мл) фенилизотиоцианата, и смесь нагревали в колбе с обратным холодильником дополнительно 120 ч. Ацетон выпаривали и добавляли полунасыщенный карбонат натрия водорода (75 мл) к коричневому остатку. Смесь перемешивали всю ночь и отфильтровывали для собирания коричневого твердого тела. Оставшуюся черную смолу оставляли в колбе перемешиваться с другими 50 мл полунасыщенного карбоната натрия водорода в течение 1 часа и отфильтровывали. Собранные осадки на фильтре высушивали, хроматографировали (кремнезем, 2% с последующими 10% метанола/метилен хлорида) и рехроматографировали на НР-20 колонке, элюируя 25%, 30%, затем 35% метанола/воды растворами, содержащими 0, 2% гидркосида аммония с выходом соединения примера 28 в виде бледно-желтого твердого тела (87 мг, 6%).
Точка плавления: 137 - 138oC.
Анализ для C22H20N4O3S2 - 1,90 H2O - 0,75 NH3.
Вычислено: C 52,90; H 5,26; N 13,32; S 12,84.
Обнаружено: C 52,67; H 4,92; N 13,22; S 13,25.
Пример 29. N-(3,4-Диметил-5-изоксазолил)-5-(1-пирролидинил)-1- нафталинсульфонамид
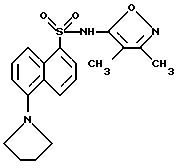
A. N-(3,4-Диметил-5-изоксазолил)-5-(4-хлорбутиламино)-1- нафталинсульфонамид
Раствор 2-(3-хлорпропил)1,3-диоксолана (1,25 мл, 9,45 ммоль) в 5%-ной водной соляной кислоте (3 мл) и диоксане (3 мл) перемешивали всю ночь. Суспензию примера 3 (3,0 г, 9,45 ммоль) в ледяной уксусной кислоте (50 мл) добавляли, и смесь перемешивали при 0oC в течение 1 ч. Добавляли цианоборгидрид натрия (4,66 г, 64,6 ммоль) порциями в течение 3 ч, и смесь перемешивали всю ночь при комнатной температуре и выпаривали. Остаток разделяли между дихлорметаном и водой, и водный слой подкисляли до pH 3 6N соляной кислотой и экстрагировали дихлорметаном (три раза). Собранные органические фазы промывали рассолом, высушивали (сульфатом магния) и выпаривали до получения 2,13 г (55,4%) соединения A в виде желтого твердого тела.
B. N-(3,4-Диметил-5-изоксазолил)-5-(1-пирролидинил)-1- нафталинсульфонамид
Раствор соединения A (2,13 г, 5,
23 ммоль) и N-метилморфолина (4 мл) в диметилформамиде (25 мл) нагревали до 75oC в течение 4 ч. Растворитель удаляли под вакуумом, и остаток растворяли в
воде. Водный раствор подкисляли до
pH 3 6N соляной кислотой, экстрагировали этилацетатом (три раза), и собранные органические фазы промывали рассолом, высушивали (сульфатом магния) и выпаривали.
Остаток хроматографировали на кремнеземе
этилацетатом : гексанами (1 : 1) для получения 320 мг желтого полутвердого тела, которое перекристаллизовывали из водного этанола для получения 159 мг (7%)
соединения примера 29 в виде зеленого
твердого тела.
Точка плавления: 172 - 173oC.
Анализ для C19H21N3SO3 : 0, 51 H2O.
Вычислено: C 59,96; H 5,83; N 11,04; S 8,42.
Обнаружено: C 59,98; H 5,53; N 11,02; S 8,34.
Пример 30. 5-[[(3,
4-Диметил-5-изоксазолил)амино] сульфонил]
-1- нафталинкарбоновая кислота
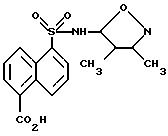
Раствор примера 32 (6 г, 16,7 ммоль) в 4 N гидроксида натрия (20 мл) и метанола (100 мл) перемешивали при комнатной температуре в течение 2,5 ч. Органический растворитель выпаривали, и водный остаток подкисляли до pH 3 6N соляной кислотой. Полученное рыжевато-коричневое твердое тело собирали фильтрацией, ополаскивали водой и высушивали до получения 4,2 г примера 30 (72%) в виде рыжевато-коричневого твердого тела. Фильтрат экстрагировали дихлорметаном, органическую фазу промывали насыщенным хлоридом натрия, высушивали (сульфатом магния), отфильтровывали и выпаривали до получения 1,0 г соединения примера 30.
Точка плавления: 202 - 204oC.
Анализ для C16H14N2SO5 : 0,32 H2O.
Вычислено: C 54,58; H 4,19; N 7,96; S 9, 11.
Обнаружено: C 54,55; H 4,18; N 7,99; S 9,05.
Пример 31. 5-[[[5-(Диметиламино)-1-нафталинил] сульфонил]амино]- 3-метил-4-изоксазолкарбоновой
кислоты этиловый
эфир
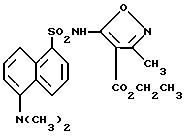
A. Этилбромпропиолят.
К раствору этилпропиолята (15,2 мл, 150 ммоль) в ацетоне (250 мл) добавляли нитрат серебра (2,51 г, 15 ммоль), а затем N-бромсукцинимид (1,34 мл, 9,60 ммоль). Раствор перемешивали в течение 1 ч, и летучие компоненты удаляли из серого гетерогенного раствора под вакуумом и собирали в ловушку при -78oC. Полутвердый остаток разделяли между эфиром и водой, эфирный слой промывали рассолом, высушивали (сульфатом магния) и выпаривали при низком давлении для удаления эфира. Масляный остаток соединяли с уловленными летучими компонентами раствора, и полученный раствор перегоняли сначала при атмосферном давлении для удаления большей части ацетона и затем при 7 мм с получением соединения A, дистиллированного при 52 - 58oC в виде прозрачного масла, которое становилось светло-коричневым при выстаивании (22,1 г, 83%).
B. 3-метил-5-бром-4-этоксикарбонилизоксазол.
К раствору соединения A (15,4 г, 87 ммоль) и ацетальдоксимина (7,94 мл, 130 ммоль) в метиленхлориде (50 мл) добавляли клорокс (277 мл, примерно 208 ммоль) по каплям в течение 2,5 ч. Сине-зеленый раствор перемешивали 30 мин, разделяли, водную фазу промывали метиленхлоридом и собранные органические фазы высушивали (сульфатом магния) и выпаривали до получения 22,2 г оранжевого масла. Тонкослойная хроматография на кремнеземе с 10% эфира/гексанов дала 7,44 г (36%) 2 : 1 смеси соединения B и 3-метил-4-бром-5-этоксикарбонилизоксазола в виде прозрачного масла.
C. 5-[[[5-(Диметиламино)-нафталинил] -сульфонил]амино]-3-метил-4- изоксазолкарбоновой кислоты, этиловый эфир.
Раствор соединения B (2,03 г, 2 : 1 смеси региоизомеров, 8,67 ммоль), дансил-амида (2,17 г, 8,67 ммоль) и карбоната цезия (5,64 г, 17,3 ммоль) нагревали при 77oC в диметилформамиде (10 мл) в течение 3 ч, и фазу растворителя удаляли под вакуумом при нагревании. Остаток разделяли между метиленхлоридом и 5%-ным водным сульфатом калия водорода, водную фазу промывали метиленхлоридом, и собранные органические фазы высушивали (сульфатом магния) и выпаривали с получением 7,8 г коричневого масла. Масло растворяли в 200 мл эфира и отфильтровывали небольшое количество коричневого твердого тела. Фильтрат выпаривали и нагревали под высоким вакуумом для удаления дополнительного диметилформамида, получая 4,26 г светло-коричневого масла. Масло пропускали через прокладку кремнезема с этилацетатом для получения 3,30 г желтого твердого тела, которое растворяли в эфире и отфильтровывали. Фильтрат выпаривали и подвергали тонкослойной хроматографии на кремнеземе с этилацетатом до получения 0,24 г чистого соединения примера 31 в виде светло-желтой пены и 2,2 г примесного соединения примера 31 в виде желтой пены. Примесное вещество растворяли в эфире и охлаждали для получения 0,54 г (15%) соединения примера 31 в виде желтых кубов, которые становились аморфным твердым телом при мягком нагревании под вакуумом.
Точка плавления: 146 - 148oC.
Анализ для C19H21N3O5S.
Вычислено: C 56,56; H 5,25; N 10,42; S 7,95.
Обнаружено: C 56,63; H 5, 31; N 10,22; S 7,82.
Пример 32. 5-[[(3,4-Диметил-5-изоксазолил)амино] сульфонил] -1- нафталинкарбоновой кислоты метиловый эфир
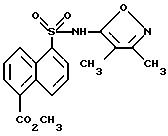
Раствор 5-хлорсульфонил-1-нафталинкарбоновой кислоты метилового эфира (15 г, 52,7 ммоль), диметиламинопиридина (500 мг, 4,09 ммоль) и 5-амино-3,4-диметилизоксазола (6,02 г, 55,3 ммоль) в пиридине (150 мл) нагревали при 70oC всю ночь. Смесь выпаривали до половины объема, вливали в ледяную 10%-ную водную соляную кислоту и экстрагировали с этилацетатом (три раза). Собранные органические фазы экстрагировали с 10%-ным водным карбонатом натрия водорода. Водный раствор подкисляли до pH 3 6N соляной кислотой и экстрагировали с этилацетатом (три раза). Собранные органические фазы промывали насыщенным хлоридом натрия, высушивали (сульфатом магния), отфильтровывали и выпаривали до получения 11,1 г (59%) соединения примера 32 в виде рыжевато-коричневого твердого тела.
Точка плавления: 173 - 178oC.
Анализ для C17H16N2SO5 : 0,18 H2O.
Вычислено: C 56,16; H 4,53; N 7,71; S 8,82.
Обнаружено: C 55,85; H 4,43; N 8,02; S 8,41.
Пример 33.
5-(Диметиламино)-N-(3-метил-5-изоксазолил)-1- нафталинсульфонамид
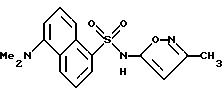
К раствору примера 31 (325 мг, 0,80 ммоль) в 95%-ном этаноле (9 мл) добавляли 1N гидроксид натрия (4 мл, 4 ммоль). Раствор нагревали в колбе с обратным холодильником в течение 3 ч, этанол выпаривали и добавляли водный 5%-ный сульфат калия водорода к остатку. Смесь экстрагировали дважды 10%-ным изопропанол/метилен хлоридом, и собранные органические фазы высушивали (сульфатом магния) и выпаривали до получения 0,37 г зеленого пенистого твердого тела. После соединения с приблизительно 70 мг продукта из предыдущей реакции твердое тело перекристаллизовывали из этилацетата/гексанов для получения 111 мг (35%) соединения примера 33 в виде зеленых кристаллов.
Точка плавления: 183 - 187oC.
Анализ для C16H17N3O3S - 0,53 H2O.
Вычислено: C 56,35; H 5,34; N 12,32; S 9,40.
Обнаружено: C 55,96; H 4,91; N 12,09; S 9,50.
Пример 34. 5-[(Диметиламино)метил]-N-(3,
4-диметил-5-изоксазолил)- 1-нафталинсульфонамид, трифторацетата (1 : 1) соль
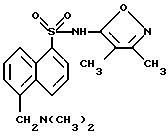
A. 5-[Гидроксиметил] -N-(3,4-диметил-5-изоксазолил)-1- нафталинсульфонамид.
К раствору примера 30 (1,5 г, 4,32 ммоль) в безводном тетрагидрофуране (60 мл) при 0oC добавляли 1 М раствор борана : тетрагидрофурана (15 мл, 15,0 ммоль) по каплям в течение 1 ч. Смесь перемешивали при 0oC в течение 1 ч и при комнатной температуре в течение 4 ч и вливали в 150 мл 3N соляной кислоты. Раствор экстрагировали с этилацетатом (три раза), и собранные органические фазы промывали рассолом, высушивали (сульфатом магния) и выпаривали. Остаток растворяли в эфире, и раствор промывали водой и рассолом, высушивали (сульфатом магния) и впаривали до получения 1,5 г (100%) соединения A в виде рыжевато-коричневого твердого тела.
B. 5-[[(3,
4-Диметил-5-изоксазолил)амино]сульфонил] -1-нафтальдегид
К смеси соединения A (1,5 г, 4,51 ммоль) в дихлорметане (150 мл) добавляли хлорхромат пиридиния (1,33 г, 6,9 ммоль). Смесь
перемешивали при комнатной температуре в течение 30 мин, пропускали через прокладку флюорисила и элюировали 600 мл 10% метанол/дихлорметана. Элюент выпаривали до 200 мл, промывали рассолом,
высушивали
(сульфатом магния) и выпаривали до получения 1,22 г (82%) соединения B в виде коричневого твердого тела.
C. 5-[(Диметиламино)метил] -N-(3,
4-диметил-5-изоксазолил)-1- нафталинсульфонамид, трифторацетата (1 : 1) соль
К раствору соединения B (800 мг, 2,42 ммоль), уксусной кислоты (0,138 мл, 2,42 ммоль) и диметиламина (1,82 М в
безводном тетрагидрофуране, 1,73 мл, 3,15 ммоль) в сухом тетрагидрофуране (50 мл) добавляли триацетоксиборгидрид натрия (710 мг, 3,38 ммоль). Смесь перемешивали при комнатной температуре в течение 48
ч, добавляли дополнительно уксусную кислоту (0,069 мл, 1,21 ммоль), диметиламин (0,86 мл, 1,58 ммоль) и триацетоксиборгидрид натрия (355 мг, 1,69 ммоль), и смесь перемешивали в течение 24 ч и
выпаривали. Остаток разделяли между дихлорметаном и 4 N водной соляной кислотой, и водный слой лиофилизовали с получением 245 мг белого лиофилизата. Лиофилизат растворяли в 20 мл 80%-ного водного
ацетонитрила, содержащего 0,1% трифторуксусной кислоты, и раствор подвергали градиентной препаративной HPLC (85 - 40% водного ацетонитрила, содержащего 0,1% трифторуксусной кислоты). Фракции,
содержащие чистый продукт, собирали и лиофилизировали, и остаток тритуратировали эфиром для получения 144 мг (17%) соединения примера 34 в виде рыжевато-коричневого твердого тела.
Анализ для C18H21N3O3S - 1,66 H2O - 1,2 CF3CO2H.
Вычислено: C 46,56; H 4,84; N 7,98; S 6,09.
Обнаружено: C 46,56; H 4,45; N 7,85; S 5,92.
13С ЯМР: (CDCl3/CD3OD) 4,93; 9,17; 42,18; 57,2; 125,75; 127,00; 127,32; 129,25; 129,4; 130,43; 132,02; 133,0; 136,1; 163,15 м.д.
Пример 35. N-(3,4-Диметил-5-изоксазолил)-5-(1-гидрокси-1- метилэтил)-1-нафталинсульфонамид
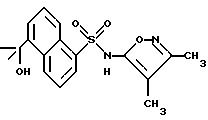
К раствору примера 32 (0,99 г, 2,75 ммоль) в безводном тетрагидрофуране (50 мл) добавляли бромид метил магния (4,58 мл 3 М раствора в эфире, 13,7 ммоль). Раствор нагревали в колбе с обратным холодильником в течение 75 мин, быстро охлаждали 5%-ным водным сульфатом калия водорода и экстрагировали этилацетатом, и органическую фазу промывали рассолом, высушивали (сульфатом магния) и выпаривали. Остаток соединяли с продуктом предыдущей реакции (0,55 ммоль шкала) для получения 1,26 г небелого пенообразного твердого тела. Хроматография на кремнеземе (тонкослойная; 75% этилацетат/гексаны) дала 0,28 г (24%) соединения примера 35 в виде белого пенообразного твердого тела (точка плавления 97 - 101oC), а также 0,40 г немного менее чистого вещества.
Анализ для C18H20N2O4S.
Вычислено: C 59,98; H 5,59; N 7,77; S 8,90.
Обнаружено: C 59,74; H 5,81; N 7,76; S 8,55.
Пример 36. N-(3,4-Диметил-5-изоксазолил)-5-(1-метилэтил)-1- нафталинсульфонамид
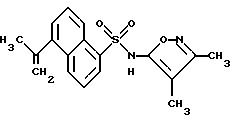
Раствор примера 35 (0,40 г, 1,11 ммоль) и трифторуксусной кислоты (0,17 мл, 2,21 ммоль) в метиленхлориде (5 мл) нагревали в колбе с обратным холодильником в течение 5 ч. Добавляли дополнительно метиленхлорид, и раствор промывали водой, высушивали (сульфатом магния) и выпаривали до получения 0,31 г небелого пенообразного твердого тела. Хроматография на кремнеземе (тонкослойная: 60% этилацетат/гексаны) дала 0,27 г (71%) соединения примера 36 в виде небелого пенообразного твердого тела.
Точка плавления: 65 - 70oC.
Анализ C18H18N2O3S.
Вычислено: C 63,14; H 5,30; N 8,18; S 9,36.
Обнаружено: C 62,97; H 5,45; N 8,16; S 9,03.
Пример 37. N-(3,4-Диметил-5-изоксазолил)-5-(1-пиперидинил)-1- нафталинсульфонамид, трифторацетата (2 : 1) соль
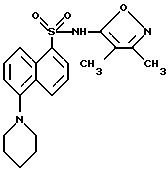
К смеси примера 3 (1,5 г, 4,71 ммоль) в ледяной уксусной кислоте (40 мл) и диоксане (20 мл) при 0oC добавляли 50%-ный раствор глутарового диальдегида (0,85 г, 4,71 ммоль). Смесь перемешивали при 0oC в течение 1 ч, добавляли цианоборгидрид натрия (1,5 г, 23,9 ммоль) порциями в течение 1 ч, и смесь перемешивали в течение ночи и выпаривали. Остаток разделяли между водой и этилацетатом, и водный слой подкисляли до pH 3 6N соляной кислотой и экстрагировали этилацетатом (три раза). Собранные органические фазы промывали рассолом, высушивали (сульфатом магния) и выпаривали. Остаток хроматографировали на кремнеземе этилацетатом : гексанами (1 : 1). Фракции, содержащие продукт, собирали и выпаривали. Остаток растворяли в 80%-ном водном ацетонитриле, содержащем 0,1% трифторуксусной кислоты, и подвергали градиентной препаративной HPLC (70 - 45% водного ацетонитрила, содержащего 0,1% трифторуксусной кислоты). Фракции, содержащие чистый продукт, собирали и лиофилизовали из воды с получением 48 мг (3%) соединения примера 37 в виде пушистого коричневого лиофилизата.
Точка плавления 89 - 93o C.
Анализ для C20H23N3O3S - 1,26 H2O - 0,5 CF3CO2H.
Вычислено: C 54,22; H 5,63; N 9,00; S 6,89.
Обнаружено: C 54,22; H 5,27; N 8,71; S 6,87.
Пример 38. N-(3,4-Диметил-5-изоксазолил)-5-(метиламино)-1- нафталинсульфонамид
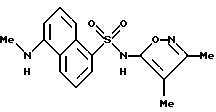
A. N-(3,4-Диметил-5-изоксазолил)-N-((2-триметил-силил)этокси) метил)-5-амино-1-нафталинсульфонамид.
Триэтиламин (0,048 мл, 0, 35 ммоль) добавляли к перемешиваемой суспензии примера 3 (100 мг, 0,32 ммоль) в метиленхлориде (3 мл). Однородную смесь охлаждали до 0oC, в течение этого времени образовывался осадок. Триметилсилилэтоксиметил хлорид (0,061 мл, 0,35 ммоль) добавляли по каплям и после 1 ч при 0oC добавляли последовательно дополнительные 0,5 эквиваленты каждого из триэтиламина и триметилсилилэтоксиметил хлорида. После дополнительного 1 ч реакцию загружали на колонку кремнезема, которую элюировали 25%, а затем 30% этилацетатом/гексанами для получения соединения A в виде масла (78,1 мг, 55%).
B. N-(3,4-Диметил-5-изоксазолил)-N-((2-(триметилсилил)этокси) метил)-5-(метиламино)-1-нафталинсульфонамид
Суспензию 10% палладия на угле (250
мг) в метаноле
(1 мл) добавляли к раствору соединения A (528 мг, 1,18 ммоль), формальдегида (13 М, 37%, 0,18 мл, 2,4 ммоль), и уксусной кислоты (0,67 мл, 1,2 ммоль) в метаноле (10 мл) в присутствии
аргона. Аргон
заменяли водородом 4 циклами перекачки/продувки. Реакцию перемешивали при комнатной температуре в течение 2,5 ч, водород заменяли аргоном, и смесь отфильтровывали через Celite® AFA и
выпаривали под вакуумом. Тонкослойная хроматография (кремнезем, 35% этилацетат/гексаны) дала 340 мг (62%) соединения B в виде масла.
C. N-(3, 4-Диметил-5-изоксазолил)-5-(метиламино)-1- нафталинсульфонамид.
При 0oC к раствору соединения B (224 мг, 0,48 ммоль) в метиленхлориде (2 мл) добавляли трифторуксусную кислоту (4 мл). Реакцию перемешивали в течение 2,5 ч и выпаривали под вакуумом. Тонкослойная хроматография (кремнезем, 5% метанол/метиленхлорид) и вторая тонкослойная хроматография (кремнезем, 60% этилацетат/гексаны) дали масло. Это вещество растворяли в 5%-ном карбонате натрия водорода (10 мл), раствор отфильтровывали через Celite® AFA, и фильтрат доводили до pH 4 6N соляной кислотой. Зеленовато-желтое твердое тело собирали фильтрацией, промывали водой (2 х 5) мл и высушивали для получения 147 мг (91%) соединения примера 38.
Точка плавления 92 - 105oC.
Анализ для C16H17N3O3S - 0,65 H2O.
Вычислено: C 55,86; H 5,39; N 12,22; S 9,32.
Обнаружено: C 56,01; H 5,38; N 12,25; S 9,34.
Пример 39. N-(3,4-Диметил-5-изоксазолил)-5-(этиламино)-1- нафталинсульфонамид
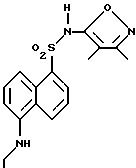
Соединение по примеру 2 (0,244 г, 0,62 ммоль) добавляли к раствору борана (1,0 М в тетрагидрофуране, 1,9 мл, 1,9 ммоль) в тетрагидрофуране (13 мл), перемешивая при 0oC. После перемешивания при 0oC в течение 15 мин при температуре окружающей среды в течение 1,25 ч и при нагревании в колбе с обратным холодильником в течение 2 ч реакционную смесь выпаривали под вакуумом. К остатку медленно добавляли воду и смесь подкисляли до pH 4,5 1 N соляной кислотой и экстрагировали метиленхлоридом (2 х 75 мл). Собранные органические фазы высушивали (сульфатом магния) и выпаривали до получения 0,22 г неочищенного продукта. Тонкослойная хроматография (кремнезем, 15 мм диа., 20% этилацетат/метиленхлорид) дала 0,12 г (58%) соединения примера 39.
Точка плавления 75,0 - 85,0oC, разлагается.
Анализ для C17H19N3O3S - 0,25 C4H8O2.
Вычислено: C 58,84; H 5,76; N 11,44.
Обнаружено: C 59,01; H 5,82; N 11,29.
Пример 40.
N-(3-Метил-5-фенилметил-5-изоксазолил)-5-[диметиламино] -1- нафталинсульфонамид
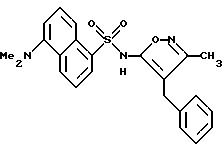
Получали в 38%-ном выходе в виде желтого пенообразного твердого тела из дансил хлорида и 3-метил-4-фенилметил-5-изоксазоламина, как описано в примере 20. Реакцию нагревали при 85oC в течение 75 мин. Тонкослойную хроматографию проводили на кремнеземе с 25%, затем 40%, затем 60% этилацетата/гексаны.
Точка плавления: 59 - 65oC.
Анализ для C23 H23N3O3S - 0,11 H2O.
Вычислено: C 65,23; H 5,53; N 9,92; S 7,57.
Обнаружено: C 65,23; H 5,70; N 9,72; S 7,20.
Пример 41. N-(3-Метил-4-фенил-5-изоксазолил)-5- (диметиламино)-1-нафталинсульфонамид
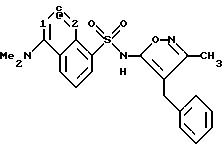
Получали в 10%-ном выходе в виде желтого пенообразного твердого тела из дансил хлорида и смеси 3-метил-4-фенил-5-изоксазоламина и 5-метил-4-фенил-3-изоксазоламина как описано в примере 20. Реакцию нагревали при 85oC в течение 75 мин. Тонкослойную хроматографию проводили на кремнеземе с 50%, затем 100% этилацетата/гексаны.
Точка плавления: 78 - 88o C.
Анализ для C22H21N3O3S - 0,37 H2O.
Вычислено: C 63,81; H 5,29; N 10,15; S 7,74.
Обнаружено: C 64,24; H 5,39; N 10,22; S 7,34.
Пример 42. N-(3-Этил-4-метил-5-изоксазолил)-5-(диметиламино)-1- нафталинсульфонамид
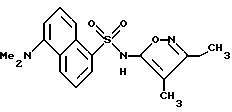
Соединение примера 42 получали в 20%-ном выходе в виде желтого твердого тела из дансил хлорида и 3-этил-4-метил-5-изоксазоламина как описано в примере 20. Реакцию нагревали при 75oC в течение 3,5 ч. Тонкослойную хроматографию проводили на кремнеземе с 40% этилацетата/гексаны. Аналитический образец получили растворением в водном карбонате натрия водорода, фильтрацией через Celite® , подкислением фильтрата твердым сульфатом калия водорода и фильтрацией и высушиванием полученного желтого твердого тела.
Точка плавления: 51 - 68oC.
Анализ для C18H21N3O3S - 0,52 H2O.
Вычислено: C 58,62; H 6,02; N 11,39; S 8,69.
Обнаружено: C 58,62; H 5,73; N 11,69; S 8,68.
Пример 43. 5-(Дибутиламино)-N-(3,4-диметил-5-изоксазолил)-1- нафталинсульфонамид, мононатрия соль
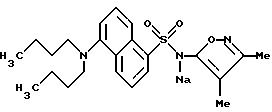
Раствор 5-дибутиламино-1-нафталинсульфонил хлорида (906 мг, 2,56 ммоль), 3, 4-диметил-5-изоксазоламина (373 мг, 3,33 ммоль) и 4-диметиламинопиридина (63 мг, 0,51 ммоль) в безводном пиридине (5 мл) нагревали при 70oC в течение 3 ч. Реакцию охлаждали до комнатной температуры и вливали в 50 мл воды. Смесь доводили до pH 4,5 6N соляной кислотой, воду сцеживали с полученной смолы и добавляли эфир (100 мл) к остатку. Оставшийся осадок удаляли фильтрацией и соединяли с веществом из предыдущей 0,565 - ммоль масштаба реакции, и все хроматографировали (тонкослойная, кремнезем, 30% этилацетат/гексаны) для получения 618 мг желто-зеленого стекла.
Это вещество суспендировали в полунасыщенном карбонате натрия водорода (20 мл), раствор нагревали для способствования растворению и добавляли 1 N гидроксида натрия для доведения pH до 10. Добавляли метанол (1 мл), чтобы способствовать полному раствору. Раствор загружали на активированный метанолом, в равновесии с водой Sep-Pak Cartridge (Waters, 10 г t C18 упаковки). Колонку промывали водой (50 мл) и 10% метанолом/водой (20 мл). Продукт элюировали метанолом (30 мл). Этот элюат выпаривали под вакуумом, и стеклообразный остаток тритуратировали эфиром 10 мл для получения после фильтрации и высушивания 524 мг (45%) названного соединения.
Точка плавления: 130,0 - 135,0oC.
Анализ для C23H30N3O3SNa - 0,63 H2O.
Вычислено: C 59,68; H 6,81; N 9,08.
Обнаружено: C 59,61; H 6,74; N 9,00.
Пример 44. 4-[1-[[(3,
4-Диметил-5-изоксазолил)амино]сульфонил]нафталин-5-ил] амино]бутановая кислота
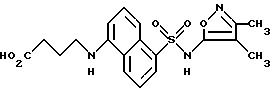
Раствор примера 26 (200 мг, 0,52 ммоль) в метаноле (5 мл) и водный 4 N гидроксид натрия (15 мл) нагревали при 70oC в течение 52 ч. Раствор охлаждали до комнатной температуры, подкисляли до pH 3 6N водной соляной кислотой, и полученный желтый осадок собирали фильтрацией, ополаскивали водой и высушивали под вакуумом. Твердое тело хроматографировали (силикагель, 10% метанол/дихлорметан) для получения 60 мг (29%) соединения примера 44 в виде желтого твердого тела.
Точка плавления: 129 - 132oC.
Анализ для C19H21N3 SO5 : 1,18 H2O : 1,0 CH2Cl2.
Вычислено: C 47,12; H 5,01; N 8,24; S 6,28.
Обнаружено: C 47,12; H 4,87; N 8,42; S 5, 98.
Примеры 45 - 48. Следующие примеры получали аналогично примеру 3 за исключением того, что pH подгоняли до 4 - 4,5 для осаждения продукта из раствора. Другие различия перечисляются: исходное вещество; мл 5 N гидроксида натрия/ммоль исходного вещества; мл метанола/ммоль исходного вещества; время реакции; температура реакции; растворитель для перекристаллизации; выход.
Пример 45. 6-Амино-N-(3,4-диметил-5-изоксазолил)-1- нафталинсульфонамид
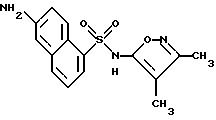
Пример 4: 2 мл; 0,4 мл; 17 ч; 70oC; водный метанол; 27%.
Точка плавления: 179 - 180oC.
Анализ для C15H15N3O3 S.
Вычислено: C 56,44; H 4,80; N 13,16; S 10,04.
Обнаружено: C 56,55; H 4,56; N 13,05; S 9,92.
Пример 46. 7-Амино-N-(3,
4-диметил-5-изоксазолил)-2- нафталинсульфонамид
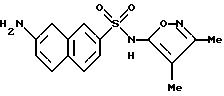
Пример 14: 2 мл; 0,7 мл; 3 ч; 80o C; водный этанол; 75%.
Точка плавления: 193 - 194oC.
Анализ для C15H15N3O3S - 0,07 H2O.
Вычислено: C 56,54; H 4,79; N 13,19; S 10,06.
Обнаружено: C 56,78; H 4,68; N 13,09; S 9,73.
Пример 47. 8-Амино-N-(3,
4-диметил-5-изоксазолил)-2- нафталинсульфонамид
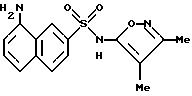
Пример 13: 2 мл; 0,4 мл; 3 ч; 80o C; водный этанол; 70%.
Точка плавления: 198 - 202oC.
Анализ для C15H15N3O3S.
Вычислено: C 56, 77; H 4,76; N 13,24; S 10,10.
Обнаружено: C 56,76; H 4,38; N 13,12; S 9,73.
Пример 48. 7-Амино-N-(3,4-диметил-5-изоксазолил)-1- нафталинсульфонамид
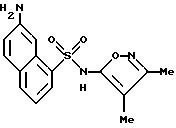
Пример 15: 2,8 мл; 1,8 мл; 22 ч; 75oC; водный этанол; 72%.
Точка плавления: 182 - 183oC.
Анализ для C15H15N3O3S - 0,46 H2O.
Вычислено: C 55,32; H 4,93; N 12,90; S 9,84.
Обнаружено: C 55,34; H 4,84; N 12,78; S 9,83.
Примеры 49 - 51. Следующие примеры получали аналогично примеру 23 с перечисленными различиями: исходное вещество; эквиваленты формальдегида; эквиваленты 3 N серной кислоты; эквиваленты цианоборгидрида натрия; время реакции; способ очистки; выход.
Пример 49. 7-(Диметиламино)-N-(3,
4-диметил-5-изоксазолил)-2- нафталинсульфонамид
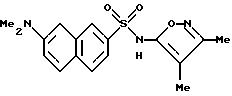
Пример 46. 5 эквивалентов; 1 эквивалент; 6 эквивалентов; 6 ч; тонкослойная хроматография на кремнеземе с метанол/метиленхлоридом с последующей перекристаллизацией из бензола/гексанов; 36%.
Точка плавления: 131 - 132o C.
Анализ для C17H19N3O3S - 0,4 H2O; 0,4 C6H6.
Вычислено: C 60,70; H 5,83; N 10, 95; S 8, 35.
Обнаружено: C 60,58; H 5,52; N 10,84; S 8,61.
Пример 50. 8-(Диметиламино)-N-(3,4-диметил-5-изоксазолил)-2- нафталинсульфонамид
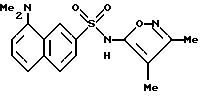
Пример 47. 5 эквивалентов; 1 эквивалент; 6 эквивалентов; 4 ч; тонкослойная хроматография на кремнеземе с метанол/метиленхлоридом с последующей перекристаллизацией из водного этанола; 49%.
Точка плавления: 155 - 156oC.
Анализ для C17H19 N3O3S - 0,13 H2O.
Вычислено: C 58,72; H 5,58; N 12,08; S 9,22.
Обнаружено: C 58,76; H 5,41; N 12,04; S 9,45.
Пример
51. 6-(Диметиламино)-N-(3,4-диметил-5-изоксазолил)-1- нафталинсульфонамид
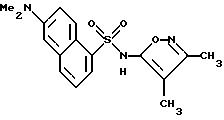
Пример 45. 6 эквивалентов; 1 эквивалент; 7 эквивалентов; 5 ч; тонкослойная хроматография на кремнеземе с метанол/метиленхлоридом с последующей перекристаллизацией из водного этанола; 15%.
Точка плавления: 182 - 183oC.
Анализ для C17H19N3O3S.
Вычислено: C 59,11; H 5,54; N 12,17; S 9,28.
Обнаружено: C 59,20; H 5,37; N 12,05; S 9,30.
Примеры 52 - 55. Следующие примеры получали аналогично примеру 1 с перечисленными различиями: способ соединения реагента; время реакции; температура реакции; способ очистки; выход.
Пример 52. 5-(Диметиламино)-N-(3-метил-4-нитро-5-изоксазолил)-1- нафталинсульфонамид
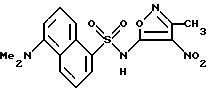
По каплям; 65 ч; комнатная температура; осаждение из 5%-ного водного карбоната натрия водорода; 32%.
Точка плавления: 220 - 228oC.
Анализ для C16H16N4O5S.
Вычислено: C 50,07; H 4,42; N 14,60; S 8,35.
Обнаружено: C 50, 45; H 4,04; N 14,22; S 8,14.
Пример 53. 5-(Диметиламино)-N-(4,5,6,7-тетрагидро-2,1- бензизоксазол-3-ил)-1-нафталинсульфонамид
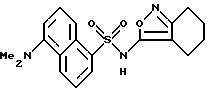
По каплям; 5 ч; 75oC; растворяли в эфире, фильтровали, фильтрат выпаривали; 18%.
Точка плавления: 69 - 80oC.
Анализ для C19H21N3O3S - 0,8 H2O.
Вычислено: C 59,14; H 5,90; N 10,89; S 8,31.
Обнаружено: C 59,29; H 5,74; N 10,74; S 8,59.
Пример 54. 5-(Диметиламино)-N-(4-этил-3-метил-5-изоксазолил)-1- нафталинсульфонамид
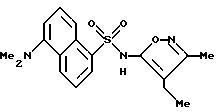
Периодическими порциями; 1 ч; 100oC; тонкослойная хроматография на кремнеземе с этилацетат/гексанами с последующим осаждением из 5%-ного водного карбоната натрия водорода; 43%.
Точка плавления: 55 - 85oC.
Анализ для C18H21N3O3S - 0,04 H2O.
Вычислено: C 60,03; H 5,90; N 11,67; S 8,90.
Обнаружено: C 59,99; H 6,02; N 11,71; S 8,81.
Пример 55.
5-(Диметиламино)-N-(4-метил-5-изоксазолил)-1- нафталинсульфонамид
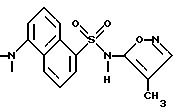
Периодическими порциями; 18 ч; комнатная температура; тонкослойная хроматография на кремнеземе с этилацетатом с последующим осаждением из 5%-ного водного карбоната натрия водорода; 17%.
Точка плавления: 57 - 67oC.
Анализ для C16H17N3O3S - 0,41 H2O.
Вычислено: C 56,73; H 5,30; N 12,40; S 9,46.
Обнаружено: C 56,51; H 5,04; N 12,62; S 9,34.
Пример 56. N-(3,4-диметил-5-изоксазолил)-5-(пентиламино)-1- нафталинсульфонамид
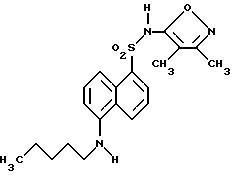
A. N-5-[[(3,4-диметил-5-изоксазолил)амино] сульфонил] -1- нафталинил] пентанамид.
Валерилхлорид (0,32 мл, 2,7 ммоль) по капле добавили в раствор по примеру 3 (0,68 г, 2,1 ммоль) и пиридин (2,0 мл) в ацетоне (14 мл) в атмосфере аргона, и раствор перемешивали в течение 2,5 ч. Ацетон выпаривали, к остатку добавили полунасыщенный гидрокарбонат натрия (60 мл), pH довели до 8 - 8,5 с помощью насыщенного гидроксикарбоната натрия. Смесь перемешивали в течение 1 ч, подкислили 6N соляной кислотой до pH 1,0, и перемешивали в течение ночи. Твердые частицы собирали фильтрацией, промывали водой и высушивали. После рекристаллизации из смеси метанола с водой получали 0,72 г (84%) соединения A, температура плавления 171 - 172oC.
B. N-(3,4-диметил-5-изоксазолил)амино] сульфонил-1-нафталинил] пентанамид.
Соединение A (0,71 г, 1,8 ммоль) добавили в раствор борана (1,0М в тетрагидрофуране, 5,3 мл, 5,3 ммоль) в тетрагидрофуране (37 мл) при 0oC. Раствор перемешивали при 0oC в течение 20 мин, при температуре окружающей среды еще 1 ч, а затем перегоняли в течение 2 ч. Смесь выпаривали, воду медленно добавляли к остатку, затем смесь разделяли между водой и метиленхлоридом. Водную фазу дважды экстрагировали метиленхлоридом, и объединенные органические фазы высушивали (сульфатом магния) и выпаривали. После флэш-хроматографии (силикагель, 3% метанол/метиленхлорид) получали 0,31 г твердого вещества, которое рекристаллизовали из смеси метанола с водой, получая 0,23 г (33%) целевого вещества по примеру 56 в виде светло-желтого кристаллического твердого вещества, температура плавления 143 - 145oC.
Анализ по C20H25N3O3S.
Рассчетн.: C 61,99; H 6,50; N 10,84; S 8,27.
Обнаруж.: C 62,05; H 6,54; N 10,84; S 7,94.
Пример 57. N-[5-[[(3,4-диметил-5-изоксазолил)амино]сульфонил]-1- нафталинил]-5-бензолпентанамид.
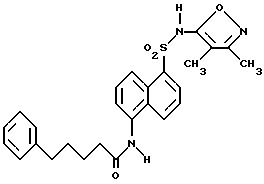
Вещество по примеру 57 получали из 5-фенилвалероилхлорида и вещества по примеру 3 способом, который соответствует способу получения вещества A по примеру 56. В результате рекристаллизации из смеси метанола с водой получали вещество по примеру 57 (85% выход) в виде белого кристаллического твердого вещества, температура плавления 168 - 171oC.
Анализ по C26H27N3O4S.
Рассчетн.: C 65,39; H 5,70; N 8,80; S 6,71.
Обнаруж.: C 65,53; H 5,76; N 8,91; S 6, 55.
Пример 58. N-[5-[[(3,4-диметил-5-изоксазолил)амино] сульфонил]-1- нафталинил]- β -фенилбензолпропанамид.
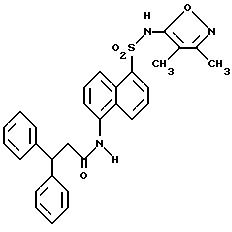
Вещество по примеру 58 получали из 3,4-дифенилпропаноилхлорида и вещества по примеру 3 способом, который соответствует способу получения вещества A по примеру 56. В результате рекристаллизации из смеси метанола с водой получали вещество по примеру 58 (72% выход) в виде белого кристаллического твердого вещества, температура плавления 200 - 204oC.
Анализ по C30H27N3O4S • 0,19 H2O.
Рассчетн.: C 68,10; H 5,22; N 7,94; S 6, 06.
Обнаруж.: C 68,26; H 5,11; N 7,78; S 5,96.
Пример 59. N-[5-[[(3,4-диметил-5-изоксазолил)амино] сульфонил]-1- нафталинил]- α -фенилбензолацетамид.
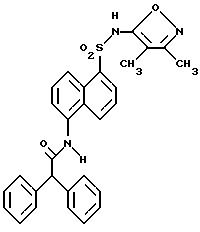
Вещество по примеру 59 получали из 3,3-дифенилацетилхлорида и вещества по примеру 3 способом, который соответствует способу получения вещества A по примеру 56. В результате рекристаллизации из смеси метанола с водой получали вещество по примеру 59 (65% выход) в виде желтовато-коричневого кристаллического твердого вещества, температура плавления 218 - 222oC.
Анализ по C29H25N3O4S • 12 H2O.
Рассчетн.: C 67,79; H 4,95; N 8,18; S 6,24.
Обнаруж.: C 67,88; H 5,11; N 8,09; S 6,29.
Пример 60. N-(3, 4-диметил-5-изоксазолил)-5-[(дифенилметил)амино] -1- нафталинсульфонамид.
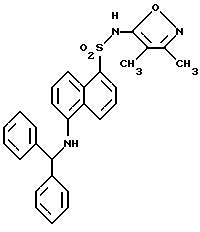
A. N-(3, 4-диметил-5-изоксазолил)-5-[(дифенилметилен)амино] -1- нафталинсульфонамид.
Концентрированную соляную кислоту (0,36 мл, 4,4 ммоль) добавили в раствор вещества по примеру 3 (1,4 г, 4, 4 ммоль) в метиленхлориде (20 мл) и метанол (8 мл). Растворитель удаляли и добавляли метиленхлорид (16 мл) и бензофенонимин (0,83 г, 4,4 ммоль). Раствор перемешивали в течение 3 дней при отсутствии влаги, а полученное желтое твердое вещество отфильтровывали и промывали метиленхлоридом и водой. Органическую фазу отделяли от фильтрата, высушивали (сульфатом магния) и выпаривали. Остаток рекристаллизовывали из метанола, кристаллическое твердое вещество соединяли с желтым твердым веществом и подвергали рекристаллизации из метанола до получения 1,30 г (66%) соединения A в виде желтого кристаллического вещества, температура плавления: 220 - 225oC.
B. N-(3,4-диметил-5-изоксазолил)-5-[(дифенилметил)амино] -1- нафталинсульфонамид.
Вещество по примеру 60 было получено из соединения A тем же способом, которым получали соединение B по примеру 56. В результате флэш-хроматографии с последующей рекристаллизацией из смеси метанол/вода получали вещество по примеру 60 в виде желтого кристаллического твердого вещества, температура плавления 152 - 158oC.
Анализ по C28H25N3 O3S • 0,18 H2O.
Рассчетн.: C 69,09; H 5,25; N 8,63; S 6,59.
Обнаруж.: C 69,12; H 5,14; N 8,60; S 6,60.
Пример 61. N-(3,
4-диметил-5-изоксазолил)-5-[(2,2-дифенилэтил)
амино]-1-нафталинсульфонамид
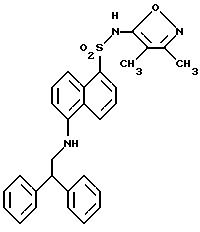
Вещество по примеру 61 было получено из вещества по примеру 59 способом, которым получали соединение B из примера 56. В результате флэш-хроматографии (силикагель, 5% метанол/метиленхлорид) с последующей рекристаллизацией из смеси этанол/вода поулчали вещество по примеру 61 в виде желтого кристаллического твердого вещества, температура плавления 206 - 211oC.
Анализ по C29H27N3O3S • 0,31 H2O.
Рассчетн.: C 69,23; H 5,53; N 8,35; S 6,37.
Обнаруж.: C 69,25; H 5,49; N 8,33;
S 6,24
Пример 62. N-(3,4-диметил-5-изоксазолил)-5-[(3,
3-дифенилпропил) амино] -1-нафталинсульфонамид
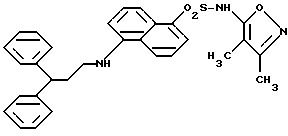
Вещество по примеру 62 было получено из вещества по примеру 58 способом, которым получали соединение B из примера 56. В результате флэш-хроматографии (силикагель, 5% метанол/метиленхлорид) с последующей рекристаллизацией из смеси этанол/вода получали вещество по примеру 62 в виде желтого кристаллического твердого вещества, температура плавления 171 - 177oC.
Анализ по C30H29 N3O3S • 0,75 H2O.
Рассчетн.: C 68,61; H 5,85; N 8,00; S 6, 20.
Обнаруж.: C 68,77; H 5,66; N 7,84; S 6,10.
Пример 63. N-(3,4-диметил-5-изоксазолил)-5-[(фенилпентил)амино] - 1-нафталинсульфонамид, натриевая соль.
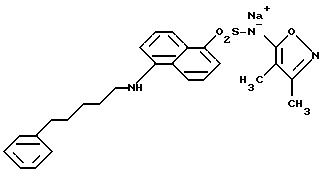
Вещество по примеру 63 было получено из вещества по примеру 48 способом, которым получали соединение B из примера 57. После флэш-хроматографии (силикагель, 5% метанол/метиленхлорид) материал растворяли в 5%-ном гидрокарбонате натрия и добавляли в 5 г картридж "Waters SepPaktC18", который уравновешивали метанолом, а затем - водой. Колонку элюировали водой, смесью 25% метанол/вода, 50% метанол/вода и метанолом. После выпаривания фракции 50% метанола/воды с последующим высушиванием в высоком вакууме получали вещество по примеру 63 в виде желто-зеленого стекла с температурой плавления 120 - 123oC.
Анализ по C26H28N3O3SNa • 0,72 H2O.
Рассчетн.: C 62,65; H 5,95; N 8,43; S 6,43.
Обнаруж.: C 62,74; H 5,96; N 8,34; S 6,37.
Пример 64. N-(3,
4-диметил-5-изоксазолил)-5-(метиламино)-1- нафталинсульфонамид
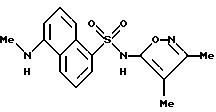
A. N-[5-[[(3, 4-диметил-5-изоксазолил)амино] сульфонил] -1- нафталинил] формамид.
Муравьиную кислоту (95%, 1,90 мл, 50,4 ммоль) по капле добавили в уксусный ангидрид (3,90 мл, 41,0 ммоль) при 0oC. Смесь нагревали до 55oC в течение 2 ч, охлаждали до комнатной температуры и разбавляли тетрагидрофураном (9 мл). Затем по капле добавили раствор вещества по примеру 3 (5,00 г, 15,8 ммоль) в тетрагидрофуране (10 мл), и смесь перемешивали при комнатной температуре в течение 30 мин, после чего концентрировали. Остаток разбавляли водой (200 мл) и метанолом (100 мл), и добавляли 5Н раствор гидроксида натрия, добавку производили порциями по 2 мл, чтобы сохранять pH раствора в пределах от 9 до 11. После того, как твердые вещества растворились, а pH остался равным 11, смесь перемешивали в течение 10 мин, после чего pH довели до 8 с помощью водной соляной кислоты. Метанол выпарили, к остатку добавили воду (200 мл) и довели pH до 3 с помощью 6Н раствора соляной кислоты. Смесь энергично перемешивали, чтобы разбить комки, после чего твердое вещество собрали на фильтре, промыли водой (3 х 20 мл) и высушили, получив 5,05 г соединения A в виде бело-розового порошка (93%).
B. N-(3, 4-диметил-5-изоксазолил)-5-(метиламино)-1- нафталинсульфонамид.
При 0oC в раствор соединения A (5,00 г, 14,5 ммоль) в тетрагидрофуране (100 мл) по капле добавили боранметилсульфид (5,8 мл, 57,9 ммоль). Смесь перемешивали при 0oC в течение 10 мин, а затем перегоняли в течение 3 ч, охлаждали до 0o C и добавляли метанол. После того, как выделение водорода замедлялось, смесь доводили до комнатной температуры, перемешивали в течение 40 мин и добавили концентрированную соляную кислоту до pH 2 - 2, 5. Смесь перегоняли в течение 40 мин, растворитель выпаривали, остаток заливали водой (200 мл) и доводили pH раствора до 3 с помощью водной соляной кислоты. Получившийся осадок собирали на фильтре, высушивали и подвергали хроматографии (силикагель, 50% этилацетат/гексан). Продукт растворяли в 5%-ном бикарбонате натрия (100 мл), раствор фильтровали через "Celite", фильтрат разбавляли водой (200 мл) и доводили pH фильтрата до 3 с помощью 6Н соляной кислоты. Полученный осадок собирали на фильтре, промывали водой (2 х 50 мл) и высушивали до получения вещества по примеру 64 в виде желтого твердого вещества (3,30 г, 69%), температура плавления 188 - 191oC.
Анализ по C16H17N3O3S • 0,62 H2O.
Рассчетн.: C 56,09; H 5, 37; N 12,26; S 9,36.
Обнаруж.: C 56,23; H 5,34; N 12,12; S 9,27.
Реферат
Использование: в химии гетероциклических соединений, обладающих антагонистической активностью к эндотелину. Раскрыты сульфонамидные производные формулы I, где один из X или Y - это N, а другой - кислород, R - нафтил или замещенный нафтил, R4 и R5 - радикалы, представленные на с.81-86 описания, а также их фармацевтически приемлемые соли. 14 з.п. ф-лы.
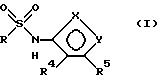
Формула
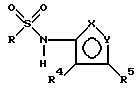
где один из X или Y - азот, а другой - кислород;
R - нафтил или нафтил, замещенный R1, R2 и R3, где R1, R2, R3 независимо друг от друга - водород, низший алкил, низший алкенил, низший алкокси, каждый из которых может быть замещен Z1, Z2, Z3; гало; гидроксил; -CO2H или CO2R6; -Z4 -NR7R8 или -Z4-N(R11)-Z5-NR9R10;
R4 и R5 независимо друг от друга - водород, низший алкил, фенил, или фенил(низший)алкил, каждый из которых может быть замещен Z1, Z2, Z3; нитро; -CO2R6 или R4 и R5 вместе являются алкиленом, образуя с атомами углерода, с которыми они связаны, 4 - 8-членное насыщенное кольцо;
R6 - низший алкил;
R7 - водород; - С1 - С5 -алкил или С1 - С5-алкил, замещенный одной или двумя фенильными группами, каждая из которых может быть замещена Z1, Z2, Z3; -C(O)R6; -CO2H или CO2R6;
R8 - водород; низший алкил, фенил(низший)алкил, каждый из которых может быть замещен Z1, Z2 и Z3; или R7 и R8 вместе являются алкиленом, возможно замещенным оксогруппой, образуя вместе с атомом азота, с которым они связаны, 3 - 8-членное насыщенное кольцо;
R9 - водород;
R10 - фенил;
R11 - водород;
Z1, Z2, Z3 независимо друг от друга - гидрокси; оксо; -CO2H или CO2 Z6; -NZ7Z8;
Z4 и Z5 независимо друг от друга - одинарная связь; -C(S);
Z6, Z7, Z8 независимо друг от друга - водород, низший алкил,
или его фармацевтически приемлемая соль.
с сульфоанамидом, примыкающим в положении 1 или 2, и один из R1, R2, R3 примыкает в положении 5 или 6.
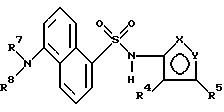
9. Соединение по п.8, где R7 и R8 независимо друг от друга - водород, низший алкил, или С(О) - низший алкил.

Комментарии