Производные оксадиазола - RU2182905C2
Код документа: RU2182905C2
Чертежи
Описание
Изобретение относится к новым азотсодержащим гетероциклическим соединениям с биологической активностью, в частности к производным оксадиазола.
Известны производные оксадиазола, обладающие активностью, нейрозащитным действием (см. заявку ЕР-А-504574).
Задачей данного изобретения является расширение арсенала производных оксадиазола, обладающих нейропротективным действием.
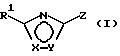
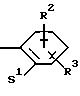
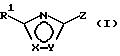
Поставленная задача решается предлагаемыми производными оксадиазола общей формулы (I)
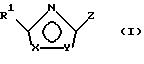
в которой Х и Y означают кислород или азот, причем Х и Y не могут быть одновременно кислородом или азотом;
Z означает радикал формулы
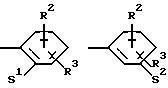
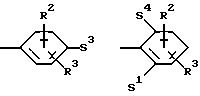
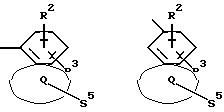
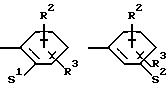
в которых S1 и S2 означают радикалы формулы
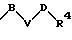
в которых V означает кислород, серу; В и D означают одинаковые или различные C1-С10 -алкиленовые мостики, которые, соответственно, могут быть однократно или многократно замещены такими заместителями, как =0, 1,3-диоксолан или 1,3-диоксан.
S1 и S2
означают радикалы формулы
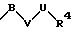
в которой V и В имеют вышеприведенные значения, a U означает С3-С6-циклоалкильную группу или С6-С10-арильную группу, которые, соответственно, могут быть однократно или многократно замещены С1-С4 -алкилом, -NR5R6;
S1 и S2 означают радикалы формулы
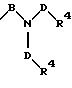
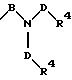
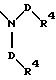
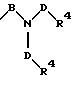
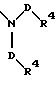
в которой В и D имеют вышеприведенные значения и обе группы D и оба радикала R4 могут быть одинаковыми или различными;
S1 и S2 означают радикалы формулы
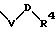
причем V и D имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
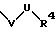
причем V и U имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
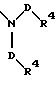
причем D имеет вышеприведенные значения и обе группы D и оба радикала R4 могут быть одинаковыми или различными;
S1 и S2 означают радикалы формулы
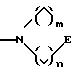
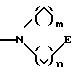
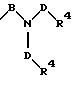
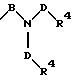
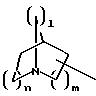
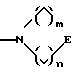
в которых Е означает NR7 (n, m=2 или 3 и n+m>2);
S1 и S2 означают радикалы формулы
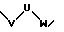
в которой V и D имеют вышеприведенные значения и W означает радикал формулы
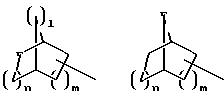
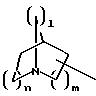
при необходимости замещенный С1-С4-алкилом, в которых Е означает NR7, a n, m, l=0,1 или 2, или W означает подсоединенный через атом углерода 5, 6-членный гетероцикл, содержащий один или несколько гетероатомов из ряда азот, кислород, который при необходимости может быть замещен бензилом или С1-С4-алкилом;
S1 и S2 означают радикалы формулы
-V-W
в которой V и W имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
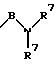
в которой В имеет вышеприведенные значения и оба заместителя R7 могут быть одинаковыми или различными;
S1 и S2 означают радикалы формулы
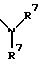
в которой оба заместителя R7 могут быть одинаковыми или различными;
S3 и S4 означают радикалы формулы
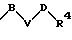
в которой В, V и D имеют вышеприведенные значения;
S3 и S4 означают радикалы формулы
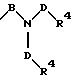
в которой В и D имеют вышеприведенные значения и обе группы D и оба заместителя R4 могут быть как одинаковыми, так и различными;
S3 и S4 означают радикалы формулы
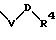
в которой V и D имеют вышеприведенные значения;
S3 и S4 означают радикалы формулы
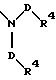
в которой D имеет вышеприведенные значения, и обе группы D и оба заместителя R4 могут быть как одинаковыми, так и различными;
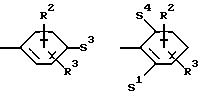
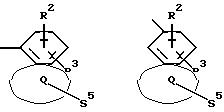
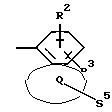
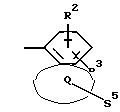
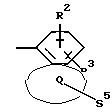
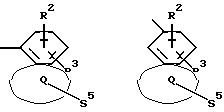
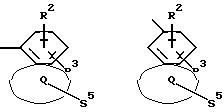
Q означает конденсированный, однократно ненасыщенный 5-членный цикл, который может содержать один или несколько гетероатомов из ряда кислород;
S5 означает радикал формулы
-D-R4
в которой D имеет вышеприведенные значения;
R1 означает фенильный радикал, который при необходимости замещен напрямую или через алкиленовые мостики с числом атомов углерода от 1 до 4 однократно, двухкратно или трехкратно одним или несколькими заместителями из ряда галоген, С1-С4-алкил, -CF3, -NR5R6, -NO2, -OR7,
или заместителем формулы
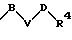
в которой В, V или D имеют вышеприведенные значения;
R1 означает фенил, который замещен заместителем формулы
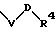
в которой V и D имеют вышеприведенные значения;
R1 означает фенил-С1-С6-алкил, предпочтительно фенил-С1-С4-алкил, фенил-С2 -С6-алкенил;
R1 означает радикал формулы М-, причем М - это 5, 6-членный гетероцикл, присоединенный через С- или N-атом, который содержит один гетероатом из ряда азот, кислород или сера;
R1 означает С3-С7-циклоалкильный радикал;
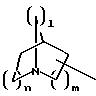
R1 означает, при необходимости замещенный С1-С4 -алкилом, предпочтительно метилом, норборнановый, норборненовый радикалы, предпочтительно адамантан или норадамантан радикалы;
R1 означает при необходимости замещенный радикал формулы
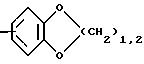
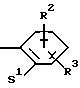
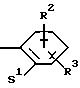
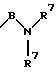
R2 и R3 означают одинаковые или различные радикалы такие, как водород, галоген, -OR7, C1-С10-алкил;
R4 означает амин формулы -NR5R6;
R4 означает N-оксид формулы
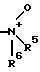
R5 означает водород, С1-С10-алкил;
R6 означает водород, C1-С10-алкил;
R6 означает С6-С10-арил, предпочтительно фенил;
R7 означает водород, С1 -С4-алкил;
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров или их смесей, а также, при необходимости, их фармакологически безопасных солей с кислотами.
Предпочтительны соединения общей формулы (I)
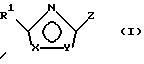
в которой Х и Y означают кислород или азот, причем Х и Y не могут быть оба одновременно кислородом или азотом,
Z означает радикал формулы в которой
S1 и S2 означают радикалы формулы
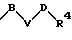
в которой V означает кислород, серу, В и D означают одинаковые или, различные С1-С4-алкиленовые мостики, которые могут быть замещены такими заместителями, как =0;
S1 и S2 означают радикалы формулы
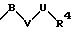
в которой V и В имеют вышеприведенное значение, a U означает С3-С6-циклоалкильную или С6-С10-арильную группы, которые могут быть замещены такими заместителями, как С1 -С4 -алкил, -NR5R6;
S1 и S2 означают радикалы формулы
в которой В и D имеют вышеприведенные значения и обе группы D, а также оба радикала R4 могут быть как одинаковыми, так и различными;
S1 и S2 означают радикалы формулы
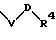
в которой V и D имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
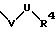
в которой V и U имеют вышеприведенные значения
S1 и S2 означают радикалы формулы
в которой D имеет вышеприведенное значение и обе группы D, а также оба радикала R4 могут быть как одинаковыми, так и различными;
S1 и S2 означают радикалы формулы
в которой Е означает NR7 (n, m=2 или 3 и n+m>2);
S1 и S2 означают радикалы формулы
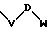
в которой V и D имеют вышеприведенные значения, a W означает радикал формулы
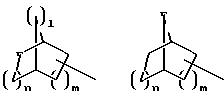
при необходимости С1-С4-алкилом, в котором Е означает NR7, n, m, l=0, 1 или 2, или W означает присоединенный через атом углерода 5, 6-членный гетероцикл, содержащий один или несколько гетероатомов из ряда азот, кислород, который, при необходимости, может быть замещен бензилом или С1 -С4-алкилом;
S1 и S2 означают радикалы формулы
-V-W
в которых V и W имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
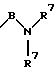
в которой В имеет вышеприведенные значения и заместители R7 могут быть как одинаковыми, так и различными;
S1 и S2 означают радикалы формулы
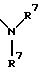
в которой заместители R7 могут быть как одинаковыми, так и различными;
S3 и S4 означают радикалы формулы
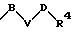
в которой В, V и D имеют вышеприведенные значения;
S3 и S4 означают радикалы формулы
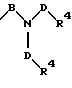
в которой В и D имеют вышеприведенные значения и обе группы D, а также оба заместителя R4 могут быть как одинаковыми, так и различными;
S3 и S4 означают радикалы формулы
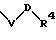
в которой V и D имеют вышеприведенные значения;
S3 и S4 означают радикалы формулы
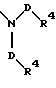
в которой D имеет вышеприведенные значения и обе группы D, а также оба заместителя R4 могут быть одинаковыми или различными;
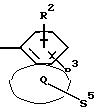
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, содержащий один или несколько гетероатомов из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает фенильный радикал, который при необходимости однократно или многократно замещен одним или несколькими заместителями такими, как галоген, предпочтительно фтор, хлор или бром, С1-С4-алкильный радикал, -СF3, -NR5R6, -NO2, -OR7 или одним радикалом формулы
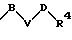
в которой В, V и D имеют вышеприведенные значения;
R1 означает фенильный радикал, который может быть замещен заместителем формулы
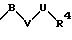
в которой В, V и U имеют вышеприведенные значения;
R1 означает фенильный радикал, который замещен заместителем формулы
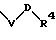
в которой V и D имеют вышеприведенные значения;
R1 означает фенил-С1-С4-алкил, предпочтительно бензил, фенил-С2-С4-алкенил;
R1 означает радикал формулы М-, причем М - это 5 или 6-членный гетероцикл, присоединенный через С- или N-атом, который содержит один гетероатом из ряда азот, кислород или сера;
R1 означает С3-С7-циклоалкил, предпочтительно циклопропил или циклопентил;
R1 означает, при необходимости замещенный С1-С4-алкилом предпочтительно метилом, норборнан-, норборнен-радикалы, предпочтительно адамантан- или норадамантан-радикалы;
R1 означает, при необходимости однократно или многократно замещенный галогеном, гидроксигруппой или метоксигруппой радикал формулы
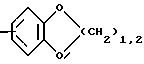
R2 и R3 означают одинаковые или различные радикалы такие, как водород, гидроксигруппа, галоген, предпочтительно фтор, хлор или бром, С1-С4-алкилоксигруппа, предпочтительно метилоксигруппа, С1-С4-алкил;
R4 означает -NR5R6,
R4 означает N-оксид с формулой
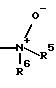
R5 означает водород, C1-C4-алкил,
R6 означает водород, С1-С4-алкил;
R6 означает фенильный радикал,
R7 означает водород, С1-С4-алкил;
при необходимости в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, а также, при необходимости, их фармакологически безопасных солей с кислотами.
Особенно предпочтительны производные оксадиазола общей формулы (I)
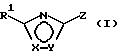
в которой Х и Y означают кислород или азот, причем Х и Y не могут быть одновременно кислородом или азотом,
Z означает радикал формулы
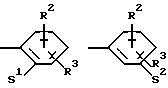
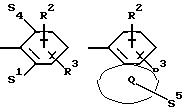
в которой S1 означает радикал формулы
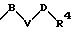
в которой V означает кислород, серу и В и D означают одинаковые или различные С1-С4 -алкиленовые, мостики, которые могут быть замещены такими заместителями, как =0;
S1 означает радикал формулы
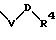
в которой V и D имеют вышеприведенные значения;
S1 означает радикал формулы
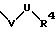
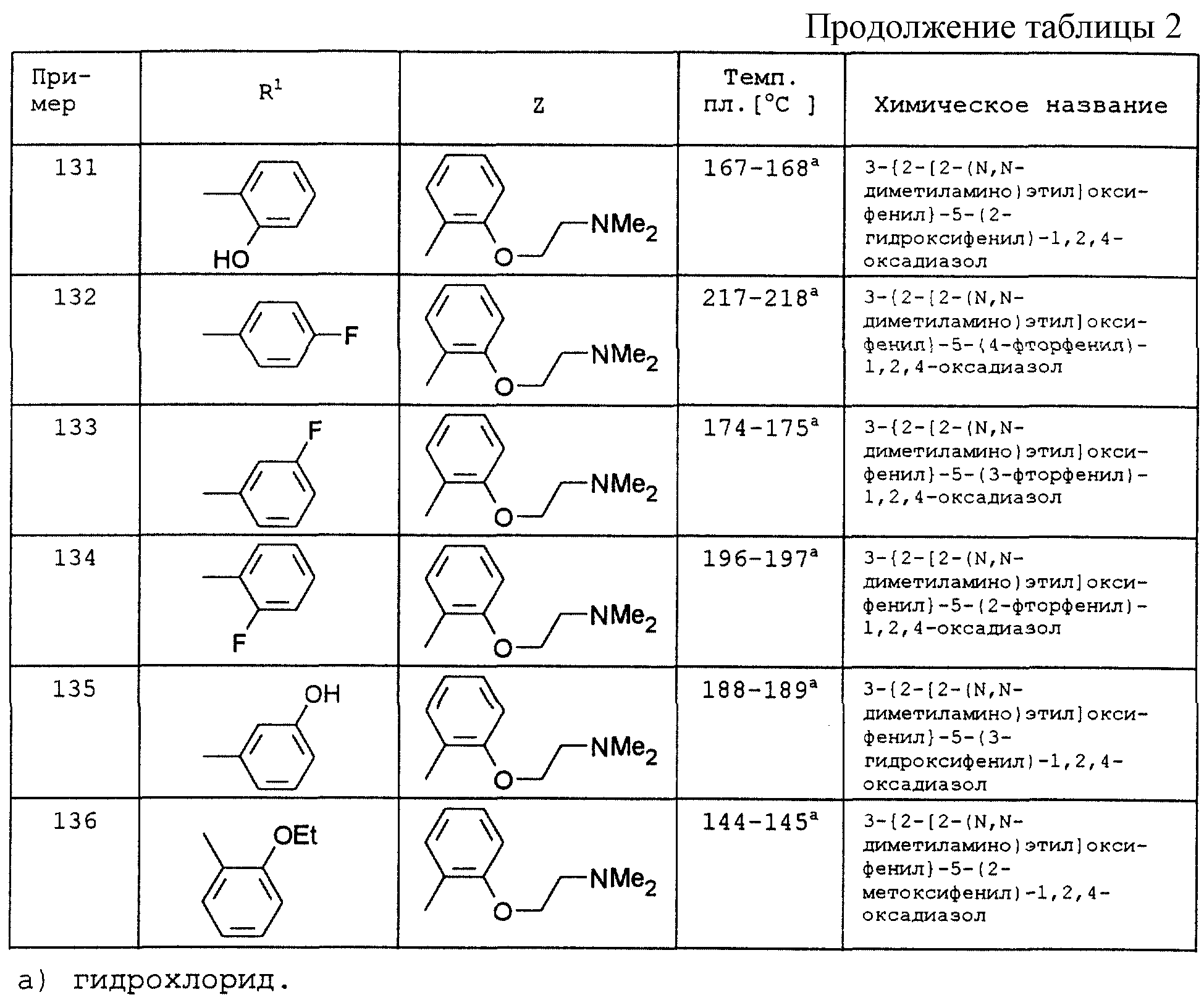
в которой V имеет вышеприведенные значения и U означает С3 -С6-циклоалкильную или фенильную группы, которые могут быть замещены С1-С4-алкилом;
S1 означает радикал формулы
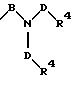
в которой В и D имеют вышеприведенные значения и обе группы D, а также оба заместителя R4 одинаковы или различны;
S1 означает радикал формулы
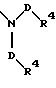
в которой D имеет вышеприведенные значения и обе группы D, а также оба заместителя R4 одинаковы или различны;
S1 означает радикал формулы
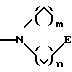
в которой Е означает NR7 (с n, m=2 или 3 и n+m>2);
S1 означает радикал формулы
в которой V и D имеют вышеприведенные значения, a W означает радикал формулы
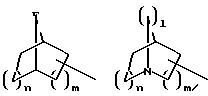
при необходимости замещенный С1-С4-алкилом, в которой Е означает NR7, n, m, l=0, 1 или 2,
или W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, который содержит один или несколько гетероатомов из ряда азот, кислород и который при необходимости замещен бензилом или С1-С4-алкилом;
S1 означает радикал формулы
-V-W
в которой V и W имеют вышеприведенные значения;
S2 означает радикал формулы
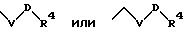
в которой V и D имеют вышеприведенные значения;
S4 означает радикал формулы
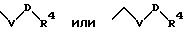
в которой V и D имеют вышеприведенные значения;
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, содержащий один или несколько гетероатомов из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает бензильный или фенильный радикал, причем последний может быть однократно или многократно замещен одним или несколькими заместителями такими, как фтор, хлор или бром, -С1-С4-алкил, -CF3, -NMe2,-NEt2, -NO2 или -OR7;
R1 означает фенильный радикал, замещенный радикалом формулы
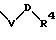
в которой V означает кислород и D означает С1-С4-алкильный мостик;
R1 означает 5- или 6-членный гетероцикл, присоединенный через атом углерода или азота, который содержит один гетероатом из ряда азот, кислород или сера;
R1 означает циклопропил, цикпопентил или циклогексил;
R1 означает норборнан, норборнен, адамантан или норадамантан, при необходимости замещенные метальной группой;
R1 означает радикал формулы
R1 означает -СН=СН-фенил;
R2 означает водород, фтор, хлор, бром, C1-C4-алкилоксигруппу, С1-С4-алкил или гидроксигруппу;
R3 означает водород;
R4 означает -NR5R6;
R4 означает N-оксид формулы
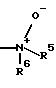
R5 означает водород, C1-С3-алкил;
R6 означает водород, C1-С3-алкил, бензил или фенил;
R7 означает водород, С1 -С4-алкил, бензил;
при необходимости, в форме их рацематов, их энантиомеров, в форме стереомеров или их смесей, а также при необходимости, их фармакологически безопасных солей с кислотами.
Особый интерес представляют соединения общей формулы (I)
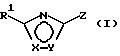
в которой Х и Y означают кислород или азот, причем Х и Y не могут быть оба одновременно кислородом или азотом;
Z означает радикал формулы
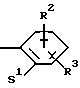
в которой S1 означает радикал формулы
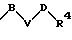
в которой V означает кислород, серу, В означает -CH2- и D означает одну из групп -СН2 -, -СН2-СН2-, -СН2-СН2-СН2-, -СН2-С(СН3)Н-, -СН2-СО-, -СН2-СН2-СО-;
S1 означает радикал формулы
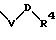
в которой V и D имеют вышеприведенные значения;
S1 означает радикалы пиперазин-1-ил, 4-метилпиперазин-1-ил;
S1 означает радикал формулы
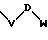
в которой V и D имеют вышеприведенные значения, а
W означает радикал формулы
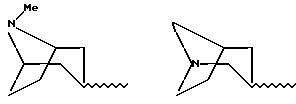
при необходимости замещенный С1-С4-алкильной группой или
W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, содержащий азот, который при необходимости замещен бензилом или C1-C4-алкилом;
R1 означает радикал формулы
-V-W,
в которой V и W имеют вышеприведенные значения
S2 означает радикал формулы
-(CH2)0, 1-O-(CH2)2,3-R4,
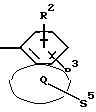
Q означает конденсированный, однократно ненасыщенный 5-членный цикл, который может содержать один гетероатом из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает радикалы циклопропил, циклопентил, бензил или фенил, причем последний может быть однократно или многократно замещен одним или несколькими заместителями, такими как фтор, хлор, бром, С1-С4-алкил, -CF3, -NMe2, -NO2 или -OR7;
R1 означает фенил, замещенный радикалом формулы
-O-(CH2)2,3-R4,
R1 означает фуран, тиофен, пиридин или пиррол;
R1 означает норборнан, норборнен, адамантан или норадамантан;
R1 означает -СН=СН-фенил;
R2 означает водород, фтор, хлор, бром, С1-С4-алкилоксигруппу, С1-С4-алкил или гидроксигруппу;
R3 означает водород;
R4 означает -NR5R6 или N-оксид формулы
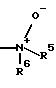
R5 означает водород, C1-С3-алкил;
R6 означает водород, С1-С3-алкил, бензил или фенил;
R7 означает водород, метил, этил, пропил, изопропил, бутил, трет-бутил;
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, а также, при необходимости, их фармакологически безопасных солей с кислотами.
Особый интерес представляют далее
соединения общей формулы (I) в которой
Х и Y означают азот или кислород, причем Х и Y не могут быть одновременно кислородом или азотом,
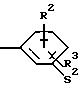
Z означает радикал формулы
в которой S1 означает радикал формулы
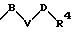
в которой V означает кислород, серу, В означает -СН2- и D означает одну изгрупп-CH2,-CH2-CH2 -,-СН2-СН2-СН2-,-СН2-С(СН3)Н-,-СН2-СО-,-СН2-СН2-СО-;
S1 означает радикал формулы
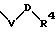
в которой V и D имеют вышеприведенные значения;
S1 означает радикалы пиперазин-1-ил, 4-метилпиперазин-1-ил;
S1 означает радикал формулы
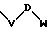
в которой V и D имеют вышеприведенные значения и W означает радикал с формулой
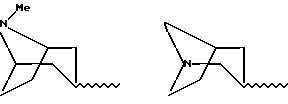
при необходимости замещенный С1-С4-алкильной группой, или W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, содержащий азот, который может быть, при необходимости, замещен бензилом или С1-С4-алкилом;
S1 означает радикал формулы
-V-W,
в которой V и W имеют вышеприведенные значения;
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, который содержит один гетероатом из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает радикалы циклопропил, циклопентил или фенил, причем фенильный цикл может быть однократно или многократно замещен одним или несколькими заместителями, такими как фтор, хлор, бром, С1-С4-алкильный радикал, -СF3, -NMe2, -NO2 или -OR7;
R1 означает фуран, тиофен, пиридин или пиррол;
R1 означает норборнан, норборнен, адамантан или норадамантан;
R1 означает -СН=СН-фенил;
R2 означает водород, фтор, хлор, бром, С1-С4-алкилоксигруппу, С1-С4-алкил или гидроксигруппу;
R3 означает водород;
R4 означает, -NR5R6 или N-оксид формулы
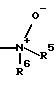
в которой R5 означает водород, С1-С3-алкил;
R6 означает водород, С1-С3-алкил, бензил или фенил;
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, а также, при необходимости, их фармакологически безопасных солей с кислотами.
Далее
представляют большой интерес
соединения общей формулы (I)
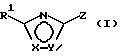
в которой Х и Y означает кислород или азот, причем Х и Y не могут быть оба одновременно кислородом или азотом;
Z означает радикал формулы
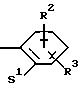
в которой S1 означает радикал формулы
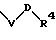
в которой V означает кислород, серу и D означает одну из групп -CH2-, -СН2-СН2-, -СН2-СН2-СН2-, -СН2-С(СН3)Н-,-СН2-СО-, -СН2-СН2-СО-;
S1 означает радикалы пиперазин-1-ил, 4-метилпиперазин-1-ил;
S1 означает радикал формулы
в которой V и D имеют вышеприведенные значения и W означает радикал формулы
или W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, содержащий азот, который при необходимости, замещен метильной группой;
S1 означает радикал формулы
-V-W,
в которой V и W имеют вышеприведенные значения;
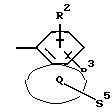
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, который содержит один гетероатом из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает фенильный радикал, который при необходимости, однократно или многократно замещен одним или несколькими заместителями такими, как фтор, хлор, бром, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, -CF3 или -OR7;
R1 означает фуран, тиофен или пиридин;
R2 означает водород, фтор, хлор, бром, метил, метилоксигруппу или гидроксигруппу;
R3 означает водород;
R4 означает -NR5R6 или N-оксид с формулой
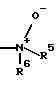
R5 означает водород, метил, этил, н-пропил, изопропил;
R6 означает водород, метил, этил, н-пропил, изопропил, бензил или фенил;
R7 означает водород, метил или этил;
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, при необходимости, их фармакологически безопасных солей с кислотами.
Особое
значение имеют далее соединения общей формулы (I)
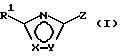
в которой Х и Y означают кислород или азот, причем Х и Y не могут быть одновременно кислородом или азотом;
Z означает радикал формулы,
в которой S1 означает радикал формулы
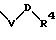
в которой V означает кислород и D означает одну из групп -CH2-, -CH2-CH2-, -СН2 -С(СН3)Н-,-СН2-СН2-СО-;
S1 означает радикалы N-пиперазинил;
S1 означает радикал формул
в которой V и D имеют вышеприведенные значения, a W означает радикал формулы
или W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, содержащий азот, при необходимости замещенный метильной группой;
S1 означает радикал формулы
-V-W,
в которой V и W имеют вышеприведенные значения;
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, содержащий в качестве гетероатома кислород;
S5 означает радикал формулы
-D-R4,
в котором D имеет вышеприведенные значения;
R1 означает фенильный радикал, который может быть однократно или многократно замещен одним или несколькими заместителями такими, как фтор, хлор, бром, метильный радикал, -СF3, гидроксигруппа, метилоксигруппа или этилоксигруппа;
R1 означает фуран, тиофен или пиридин;
R2 означает водород, фтор, хлор или метил;
R3 означает водород;
R4 означает -NR5R6;
R5 означает водород, метил, этил, н-пропил, изопропил;
R6 означает водород, метил, этил, н-пропил, изопропил, бензил или фенил;
при необходимости в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, при необходимости, их фармакологически безопасных солей с кислотами.
Особенно предпочтительны согласно изобретению соединения общей формулы (I)
в которой
Х и Y означают кислород или азот, причем Х и Y не могут быть одновременно кислородом или азотом;
Z означает радикал формулы
в которой S1 означает один из радикалов -O-CH2-CH2-R4, -O-СН2-С(СН3)Н-R4, -O-С(СН3)Н-CH2-R4 или -CH2-CH2-CO-R4;
S1 означает один из радикалов -O-CH2-W или -O-W, в которых W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, включающий атом азота, который, при необходимости, замещен метильной группой;
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, содержащий в качестве гетероатома кислород;
S5 означает радикал формулы -CH-R4;
R1 означает фенильный радикал, который может быть однократно или многократно замещен одним или несколькими заместителями такими, как фтор, хлор, бром, метил, -СF3, гидроксигруппа, метилоксигруппа или этилоксигруппа;
R1 означает тиофен;
R2 означает водород, фтор, хлор или метил;
R3 означает водород;
R4 означает -NR5R6;
R5 означает водород, метил, этил, изопропил;
R6 означает водород, метил, этил, изопропил, бензил или фенил;
при необходимости в форме их рацематов, их энантиомеров, в форме их диастереомеров или их смесей; при необходимости, их фармакологически безопасных солей с кислотами.
Под алкильными группами или алкилами (и в том случае, когда они являются составными частями других заместителей, например алкиленовых мостиков) понимают, если иначе не оговорено, разветвленные или неразветвленные алкильные группы с числом атомов углерода от 1 до 10, предпочтительно с числом атомов углерода от 1 до 4, в качестве примера можно назвать метил, этил, н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил, гептил и октил. Для обозначения метильной, этильной, бутильной или трет-бутильной групп используются и сокращения Me, Et, Bu и tBu.
Замещенные алкильные группы, если иначе не оговорено (и в том случае, когда они являются составными частями других заместителей) могут иметь, например, один или несколько заместителей из следующего ряда галоген, гидрокси-, меркапто-, C1-C6-алкилокси-, амино-, алкиламино-, диалкиламино-, циано-, нитро-группа, =О, -СНО, СООН, -COO-C1-C6-алкил, -S-C1-C6-алкил.
Под алкенильными группами (и в том случае, когда они являются составными частями других заместителей) понимают разветвленные или неразветвленные алкенильные группы с числом атомов углерода от 2 до 10, предпочтительно, с числом атомов углерода от 2 до 3, содержащие, как минимум, одну двойную связь, например, и вышеназванные алкильные группы, если они содержат, как минимум, одну двойную связь, как, например, винил (при условии, что не образуются неустойчивые енамины или энолэфиры), пропенил, изо-пропенил, бутенил, пентенил, гексенил.
Замещенные алкенильные группы, если это иначе не оговорено (и в том случае, если они являются составными частями других заместителей) могут иметь один или несколько заместителей из следующего ряда галоген, гидрокси-, меркапто-, C1-С6-алкилокси-, амино-, алкиламино-, диалкиламино-, циано-, нитро-группа, =О, -СНО, -СООН, -СОО-С1-С6-алкил и -S-C1-С6-алкил.
Под алкинильными группами (и, в том случае, когда они являются составными частями других заместителей) понимают алкинильные группы с числом атомов углерода от 2 до 10, которые содержат, как минимум, одну тройную связь, например, этинил, пропаргил, бутинил, пентинил, гексинил.
Замещенные алкинильные группы, если это иначе не оговорено, (и в том случае, когда они являются составными частями других заместителей) могут иметь один или несколько заместителей из ряда галоген, гидрокси-, меркапто-, С1-С6-алкилокси-, амино-, алкиламино-, диалкиламино-, циано-, нитро-группа, =O, -СНО, -СООН, -COO-C1-С6-алкил, -S-C1-С6-алкил.
Под циклоалкильными радикалами с числом атомов углерода от 3 до 6 понимают циклопропил, циклобутил, циклопентил или циклогексил, которые могут быть замещены разветвленной или неразветвленной алкильной группой с числом атомов углерода от 1 до 4, гидроксигруппой и/или галогеном или как уточнено выше. Под галогеном понимают фтор, хлор, бром или йод.
Под арилом понимают ароматическую циклическую систему, содержащую от 6 до 10 атомов углерода, которая, если это не уточнено иначе, может иметь заместители из ряда C1-С6-алкил, С1-С6-алкоксигруппа, галоген, гидрокси-, меркапто-, амино-, алкиламино-, диалкиламино-группа, СF3-, циано-, нитро-группа, -СНО, -СООН, -COO-C1-С6-алкил, -S-C1-C6-алкил. Предпочтительным арильным радикалом является фенил.
В качестве примера присоединенных через атом углерода 5- или 6-членных гетероциклов, которые содержат такие гетероатомы, как азот, кислород или серу, можно назвать фуран, тетрагидрофуран, 2-метилтетрагидрофуран, 2-гидроксиметилфуран, тетрагидрофуранон, γ-бутилролактон, α-пиран, γ-пиран, диоксалан, тетрагидропиран, диоксан, тиофен, дигидротиофен, тиолан, дитиолан, пиррол, пирролин, пирролидин, пиразол, пиразолин, имидазол, имидазолин, имидазолидин, триазол, тетразол, пиридин, пиперидин, пиридазин, пиримидин, пиразин, пиперазин, триазин, тетразин, морфолин, тиоморфолин, оксазол, изоксазол, оксазин, тиазол, изотиазол, тиадиазол, оксадиазол, пиразолидин, причем гетероцикл может быть замещен, как указано в уточнениях.
"=О" означает атом кислорода присоединенный через двойную связь.
В данном изобретении описаны соединения, которые неожиданно обнаружили высокое сродство к следующим типам рецепторов: "Na+ канал site 2" место связывания, гистамин H1 рецептор, 5-гидрокситриптамин 1А рецептор, 5-гидрокситриптамин 2А рецептор, сигма рецептор. Кроме того, эти соединения обнаруживают антагонистическую активность на АМРА-рецепторе.
Нейропротективное действие соединений согласно изобретению было подтверждено на животных. Исходя из этих результатов, соединения согласно изобретению могут быть использованы при невродегенеративных заболеваниях, а также при ишемии мозга различного происхождения.
Соединения согласно изобретению могут быть получены при применении известных способов, среди прочих и так как описано ниже.
На первой стадии нитрил общей формулы (I), опираясь на способы, известные из литературы (L.F.Tietze, T.Eicher, "Reaktionen und Sinthesen im Organisch-chemischen Praktikum und Forschungslaboratorium", 2 изд. 1991, Georg Thieme Verlag Stuttgart, New York, стр. 340), при реакции с гидроксиламином превращают в амидоксим общей формулы (2) (схема 1). При реакции этого амидоксима (2) при щелочных условиях реакции с производными бензойной кислоты, замещенной нуклеофильными группами, общей формулы (3) получают оксадиазолы общей формулы (4). Производные бензойной кислоты (3), которые имеют боковые цепи с функциональными группами, можно использовать при применении соответствующих защитных групп.
В качестве оснований подходят алкоголяты щелочных или щелочноземельных металлов, например, метанола, этанола, изопропанола, н-, втор- и трет-бутильного спирта. Подходящими щелочными и щелочноземельными металлами являются литий, натрий, калий, магний, кальций. Метилат натрия, этилат натрия, изопропилат натрия, трет-бутилат калия и метилат калия особенно предпочтительны в качестве оснований. Кроме того, согласно изобретению пригодны такие основания, как гидриды щелочных и щелочноземельных металлов.
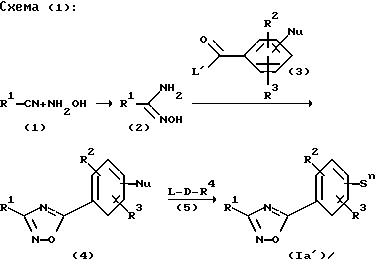
в которой L' = отщепляемая групп, например хлор, бром или алкоксигруппа;
L = отщепляемая группа, например, хлор, бром, иод, метансульфонил;
Nu = -ОН, -SH, -NH2 =VH, согласно вышеприведенным уточнениям, или
Nu = -B-OH, -B-SH, -B-NH2 =B-VH согласно вышеприведенным уточнениям,
Sn = S1, S2, S3, S4 или S5 согласно вышеприведенным уточнениям.
Модификация боковой цепи при образовании производных оксадиазола общей формулы (Ia') происходит согласно схеме 1 при завершающей реакции соединения (4) с электрофильными соединениями общей формулы (5). Для этого к оксадиазолам (4) после добавления одного основания в инертном растворителе при комнатной температуре добавляют электрофильное соединение (5) и через промежуток времени до 1 часа, предпочтительно, через от 15 до 30 минут, нагревают при обратной перегонке в течение времени от 4 до 12 часов, предпочтительно от 6 до 8 часов. После охлаждения до комнатной температуры большую часть растворителя отгоняют в вакууме, а продукт после промывки и сушки очищают кристаллизацией или хроматографически. Согласно изобретению используют в качестве оснований гидриды щелочных и щелочноземельных металлов. Предпочтительны гидриды натрия, лития, калия, а также магния, кальция. Подходящими инертными растворителями являются диметилформамид, метиленхлорид, а также циклические эфиры такие, как тетрагидрофуран или, предпочтительно, диоксан. Наряду с этим, в качестве оснований используют алкоголяты щелочных и щелочноземельных металлов, например метанола, этанола, изопропанола, н-, втор-, трет-бутанола. Пригодны такие щелочные и щелочноземельные металлы, как литий, натрий, калий, магний и кальций. Применяют метилат натрия, этилат натрия, изопропилат натрия, трет-бутилат калия и метилат калия. Согласно изобретению также применяют гидроокиси щелочных и щелочноземельных металлов лития, натрия, калия, а также магния и кальция, однако предпочтительны гидроокись натрия, гидроокись калия, гидроокись лития и гидроокись кальция в спиртовом или водном растворе.
Оксадиазолы общей формулы (Ia), которые вместо фенильного цикла, содержащегося в формуле (Ia1), содержат гетероароматический цикл, получают аналогичным способом.
Реакция ароматических нитридов общей формулы (6) с электрофилами общей формулы (5) дает согласно схеме 2 ароматические цианиды, замещенные боковой цепью Sn (n=1, 2, 3, 4), общей формулы (7). При этом нитрилы (6) после добавления основания в инертном растворителе при комнатной температуре или при нагреве предпочтительно от 40 до 80o депротонируются и в заключение добавляют электрофилы (5). Полученный раствор в течение времени от 0,25 до 2 часов нагревают от 40 до 80o и после охлаждения до комнатной температуры отгоняют растворитель в вакууме. Этот продукт после промывки и сушки без дальнейшей очистки напрямую вводят в следующую стадий. Согласно изобретению в качестве основания используют гидриды щелочных и щелочноземельных металлов, предпочтительно гидриды натрия, лития, калия, а также магния и кальция. Подходящими инертными растворителями являются диметилформамид, метиленхлорид, а также циклические эфиры такие, как тетрагидрофуран, предпочтительно диоксан.
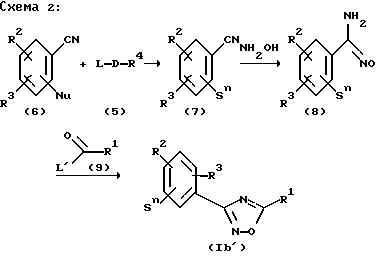
в которой L' = отщепляемая группа, например хлор, бром, алкоксигруппа;
L = отщепляемая группа, например хлор, бром, иод, метансульфонил;
Nu = ОН, SH, NH2 =VH согласно вышеприведенным уточнениям, или
Nu = -B-OH, -B-SH, -B-NH2 =B-VH согласно вышеприведенным уточнениям;
Sn=S1, S2, S3, S4 или S5 согласно вышеприведенным уточнениям.
Эти нитрилы превращают известным способом (L. F. Tietze, T.Eicher, "Реакции и синтезы в органическо-химическом практикуме и в исследовательской лаборатории", Georg Thieme Verlag, Stuttgart, 2 изд., 1991, стр. 340) в ароматические амидоксимы общей формулы (8). В щелочной среде эти амидоксимы при реакции с производными карбоновых кислот (9) образуют оксадиазолы формулы (Ib'). Для этого растворяют амидоксимы (8) с производными карбоновых кислот (9) в инертном растворителе, предпочтительно в спирте, особо предпочтительно в этаноле, и при воздействии основания нагревают. После охлаждения до комнатной температуры большую часть растворителя отгоняют в вакууме и продукт после промывания и сушки чистят кристаллизацией или хроматографически. В качестве оснований подходят алкоголяты щелочных или щелочноземельных металлов метанола, этанола, изопропанола, н-, втор- и трет-бутильного спирта. Подходящими щелочными и щелочноземельными металлами являются: литий, натрий, калий, магний, кальций. В качестве оснований особенно предпочтительны метилат натрия, этилат натрия, изопропилат натрия, трет-бутилат калия и этилат калия.
Оксадиазолы общей формулы (Ib), которые вместо фенильного цикла, содержащегося в формуле (Ib'), содержат гетероароматический цикл, получают аналогичным способом. Оксадиазолы общей формулы (Ib), имеющие функциональные группы в боковой цепи, получают при применении подходящих защитных групп.
Производные оксадиазола общей формулы (10), которые имеют у ароматического цикла боковую цепь, замещенную отщепляемой группой, превращают согласно изобретению при реакции с нуклеофилами общей формулы (11) в соединения общей формулы (I') (см. схему 3).
Схема 3:
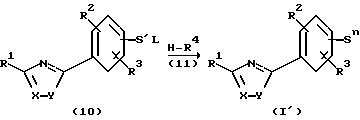
в которой L = отщепляемая группа, например хлор, бром, иод, метансульфонил,
S' = -B-V-D, -V-D, причем В, V и D приведены выше в уточнениях,
Sn = S1, S2, S3, S4 или S5 имеют вышеуточненные значения.
Для этого соединения (10) растворяют в инертном растворителе и после добавления нуклеофила (11) нагревают в течение от 0,5 до 2 часов, предпочтительно от 1 до 1,5 часов, при температуре от 50 до 120oС. После охлаждения до комнатной температуры большую часть растворителя отгоняют в вакууме, и продукт после промывки и сушки очищают кристаллизацией или хроматографически.
Подходящими инертными растворителями являются диметилформамид, метиленхлорид, а также циклические эфиры, такие как тетрагидрофуран или предпочтительно диоксан.
Оксадиазолы общей формулы (I), которые вместо фенильного цикла, содержащегося в формуле (I'), содержат гетероароматический цикл, получают аналогичным путем и образом. Синтез оксадиазолов общей формулы I, имеющих функциональные группы в боковых цепях, осуществляют при применении подходящих защитных групп.
Ниже приведены несколько подробных описаний синтеза, иллюстрирующих данное изобретение, однако предмет изобретения не ограничивается ими.
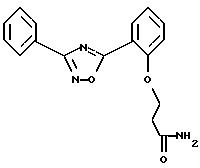
Пример 1: 5-{ 2-[2-(N, N-диметиламино)этил]оксиметил-фенил}-3-фенил-1,2,4-оксадиазол
а) Получение амидоксима бензойной кислоты:
14 г гидрохлорида гидроксиламина растворяют в 50 мл воды и при перемешивании и охлаждении льдом добавляют 16, 8 г гидрогенкарбоната натрия. К этой смеси добавляют раствор 10,3 г нитрила бензойной кислоты в 100 мл этанола и 3 часа нагревают при обратной перегонке. В заключение этанол отгоняют в вакууме и остаток 2 раза экстрагируют диэтиловым эфиром. Объединенные эфирные фазы сушат над сульфатом натрия и отгоняют растворитель. Остаток (13,4 г = 98,5% от теор.) без дальнейшей очистки вводят в реакцию циклизации.
б) Получение 5-(2-гидроксиметил-фенил)-3-фенил-1,2,4-оксадиазола:
1,36 г амидоксима бензойной кислоты добавляют к свежеприготовленному
раствору 0,46 г натрия в 50
мл безводного этанола и перемешивают 15 минут. В заключение добавляют 2,68 г фталида при перемешивании и нагревают 15 часов при обратной перегонке. Темно-красный раствор
высушивают в вакууме и остаток
растворяют в воде. Его нейтрализуют 2Н соляной кислотой и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия, отгоняют растворитель и
хроматографируют на силикагеле с
дихлорметан/метанолом (98: 2).
Выход 1,2 г (48% от теор.).
в) Получение 5-{2-[2-(N,N-диметиламино)этил]оксиметил-фенил}-3-фенил-1,2,
4-оксадиазола:
1 г
5-(2-гидроксиметил-фенил)-3-фенил-1,2,4-оксадиазола растворяют в 20 мл диметилформамида (ДМФ) и добавляют 0,2 г гидрида натрия (60% в масле). Затем перемешивают 30 минут
при 20-23oС и
добавляют предварительно перемешанную в течение 30 минут смесь из 2-N,N-диметиламиноэтилхлорида и 0,22 г гидрида натрия (60% в масле) в 20 мл ДМФ. Эту смесь нагревают на
100oС в течение 5
часов, затем растворитель отгоняют в вакууме. Остаток растворяют в воде, подкисляют 2Н соляной кислотой и экстрагируют эфиром уксусной кислоты. Водную фазу подщелачивают
с помощью раствора едкого
натра и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия, отгоняют растворитель в вакууме и хроматографируют на силикагеле (метанол). Продукт
переводят в гидрохлорид в эфирном
растворе НС1 и перекристаллизовывают из этанола/эфира. Выход 0,07 г (5% от теор.). Температура плавления: 107oС (разл.)
Пример 2: 5-{2-[2-(N,
N-диметиламино)этил]окси-фенил}-3-фенил-1,2,4-оксадиазол
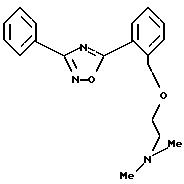
а) Получение 5-(2-гидроксифенил)-3-фенил-1,2,4-оксадиазола:
6,8 г амидоксима бензойнов кислоты и 15,2 г метилового эфира салициловой кислоты растворяют в 150 мл безводного этанола, добавляют 2,3 г натрия и 3 раза нагревают по 25 минут (с 5-минутными перерывами) в микроволновой печи мощностью 400 ватт. Реакционную смесь уменьшают доl/3 объема в вакууме и к остатку добавляют воду. При охлаждении добавлением 2Н соляной кислоты устанавливают рН 8-9, образующийся осадок отсасывают и промывают водой. Для полного удаления воды его растворяют в дихлорметане и сушат над сульфатом натрия и отгоняют растворитель. Выход: 12,9 г (92% от теор. в пересчете на амидоксим бензойной кислоты). Температура плавления: 156-158oС.
б) Получение 5-{2-[2-(N,
N-диметиламино)этил]окси-фенил}-3-фенил-1,2,4-оксадиазола:
2,38 г 5-(2-гидроксифенил)-3-фенил-1,2,4-оксадиазола растворяют в 100 мл безводного диоксана и добавляют 0,3 г 80% суспензии
гидрида
натрия в масле и 15 минут при температуре 25-30oС перемешивают. К этому раствору добавляют 60 мл безводного диоксана, к которому добавлено 2,88 г гидрохлорида 2-(N,
N-диметиламино)этилхлорида и 0,6 г 80%-ной суспензии гидрида натрия в масле. Этот раствор также перемешивают 15 минут при температуре 25-30oС. Объединенные растворы нагревают 8 часов при
обратной перегонке, оставляют на ночь и упаривают в вакууме. К остатку добавляют воду и 20 мл 1 N едкого натра и проводят
экстракцию уксусным эфиром. Органическую фазу сушат над сульфатом
натрия, растворитель выпаривают в вакууме, а остаток хроматографируют на силикагеле с уксусным эфиром/изопропанолом (70: 30, к которым добавлено 2,5% 25%-ного раствора аммиака). Полученное таким
образом основание растворяют в безводном этаноле, подкисляют раствором НС1 в эфире и высаживают диэтиловым эфиром. Осадок перекристаллизовывают из безводного этанола и диэтилового эфира. Выход: 2,2 г
(64% от теор.), температура плавления: 186-187oС.
Пример 3: 3-{2-[2-(N,N-диметиламино)этил]окси-фенил}-5-фенил-1,2,4-оксадиазол:
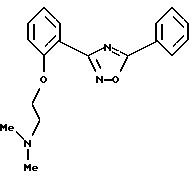
а) Получение 2-[2-(N, N-диметиламино)этилокси]-(нитрила бензойной кислоты):
23,8 г 2-гидрокси (нитрила бензойной кислоты) перемешивают с 6,0 г 80%-ной суспензии гидрида натрия в масле и с 200 мл диоксана в течение 30 минут при 60oС. К этому раствору добавляют 100 мл безводного диоксана, к которому добавлено 28, 8 г гидрохлорида 2-(N,N-диметиламино)этилхлорида и 6,0 г 80%-ной суспензии гидрида натрия в масле. Этот раствор также перемешивают 30 минут при 60oС. Объединенные растворы нагревают 4 раза по 8 минут в микроволновой печи при мощности 400 ватт и затем растворитель выпаривают в вакууме. К остатку добавляют воду и 1Н едкий натр и экстрагируют диэтиловым эфиром. Органическую фазу высушивают над сульфатом натрия, а растворитель выпаривают в вакууме. Выход: 19,6 г (52% от теор.).
б) Получение 2-[2-(N,N-диметиламино)этилокси](амидоксима бензойной кислоты):
14 г
гидрохлорида гидроксиламина растворяют в 100 мл воды и порционно при перемешиваний добавляют 16,8 г гидрогенкарбоната натрия. К этой смеси добавляют раствор 19,0 г 2-(N,
N-диметиламино)этилокси-(нитрила бензойной кислоты) в 150 мл этанола и 5 часов нагревают с обратной перегонкой. После этого этанол выпаривают в вакууме и остаток 2 раза экстрагируют диэтиловым
эфиром.
Объединенные эфирные фазы сушат над сульфатом натрия и растворитель испаряют. Остаток (16 г равный 72% теор.) используют в реакции циклизации без дальнейшей очистки.
в)
Получение
3-{2-[2-(N,N-диметиламино)этил]окси-фенил}-5-фенил-1,2,4-оксадиазола:
4,46 г 2-(N, N-диметиламино)этилокси-(амидоксима бензойной кислоты) и 5,44 г метилового эфира бензойной
кислоты
растворяют в 150 мл абсолютного этанола, добавляют 2,3 г натрия и нагревают 2 раза по 11 минут (с перерывом в 5 минут) в микроволновой печи мощностью 300 ватт. Реакционную смесь выпаривют в
вакууме, к
остатку добавляют воду и экстрагируют уксусным эфиром. Органическую фазу высушивают над сульфатом натрия, растворитель выпаривают в вакууме, а остаток хроматографируют на силикагеле с
уксусным
эфиром/изопропанолом (70: 30, при добавлении 2,5% 25%-ного раствора аммиака). Полученное таким образом основание растворяют в безводном этаноле, подкисляют раствором НС1 в эфире и высаживают
диэтиловым эфиром. Остаток перекристаллизовывают из безводного этанола и диэтилового эфира. Выход: 2,5 г (36% от теор.). Температура плавления: 174-175oС.
Пример 4:
5-{2-[2-(морфолино)этил]окси-фенил}-3-фенил-1,2,4-оксадиазол
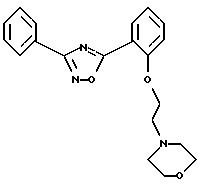
2,38 г 5-(2-гидроксифенил)-3-фенил-1,2,4-оксадиазола растворяют в 100 мл безводного диоксана и перемешивают с 0,3 г 80%-ной суспензии гидрида натрия в масле в течение 15 минут при 25-30oС. К этому раствору добавляют 75 мл абсолютного диоксана, к которому добавлено 3,72 г гидрохлорида 2-(морфолино)этиленхлорида и 0,6 г 80%-ной суспензии гидрида натрия в масле. Этот раствор также перемешивают 15 минут при 25-30oС. Эти объединенные растворы нагревают 6 часов при 100oС и в заключение растворитель испаряют в вакууме. К остатку добавляют воду и 20 мл 1N едкого натра и экстрагируют уксусным эфиром. Органическую фазу сушат над сульфатом натрия, растворитель отгоняют под вакуумом и остаток хроматографируют на силикагеле с уксусным эфиром/изопропанолом (70:30, к которым добавлено 1,5% 25%-ного раствора аммиака). Основание, полученное таким образом, растворяют в безводном этаноле, подкисляют эфирным раствором НС1 и высаживают диэтиловым эфиром. Остаток перекристаллизовывают из безводного этанола и диэтилового эфира. Выход: 1,9 г (49% от теор.). Температура плавления 194-195oС.
Пример 5: 5-{
2-[2-(4-метилпиперазин-1-ил)этил] окси-фенил}-3-фенил-1,2,4-оксадиазол
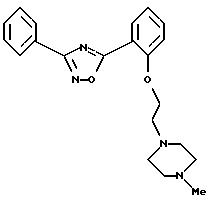
а) Получение 5-[2-(2-бромэтил)окси-фенил]-3-фенил-1,2,4-оксадиазола:
1,85 г 5-(2-гидроксифенил)-3-фенил-1,2,4-оксадиазола растворяют в 80 мл метилэтилкетона и добавляют 5 мл 1,2-дибромметана, 6 г карбоната калия и 0,1 г йодида калия. Смесь нагревают 12 часов при обратной перегонке и после охлаждения отфильтровывают осадок. Органическую фазу отделяют от растворителя в вакууме и хроматографируют на силикагеле вначале с толуолом, а затем дихлорметаном в качестве элюента. Выход: 2,3 г (86% от теор.).
б) Получение
5-{2-[2-(4-метилпиперазин-1-ил)этил]окси-фенил}-3-фенил-1,2,4-оксадиазола:
1,72 г 5-[2-(2-бромэтил)окси-фенил]-3-фенил-1,2,4-оксадиазола растворяют в 50 мл безводного диоксана и добавляют 2
г
N-метилпиперазина. Раствор нагревают 1 час при обратной перегонке и затем отгоняют растворитель в вакууме. Остаток хроматографируют на силикагеле с дихлорметаном/метанолом (90:10). Основание,
полученное таким образом, растворяют в безводном этаноле, подкисляют раствором HC1 в эфире и высаживают диэтиловым эфиром. Остаток перекристаллизовывают из безводного этанола и диэтилового эфира.
Выход; 1,7 г (78% от теор.). Температура плавления: 251-253oС.
Пример 6: 5-фенил-3-[2-(4-метилпиперазин-1-ил)-фенил]-1,2,4-оксадиазол.
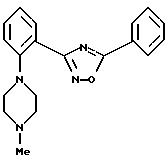
а) Получение 1-(2-цианофенил)пиперазина:
(по аналогии с G. Е.Martin, R.J.Elgin, J.R.Mathiasen, С.В.Davis, J.M. Kesslick, J. Med. Chem. 32 (1989), 1052-1056)
б) Получение 1-(2-цианофенил)-4-метилпиперазина:
7,48 г 1-(2-цианофенил)пиперазина растворяют в 30 мл формальдегида и 30 мл муравьиной кислоты, нагревают 1 час при обратной перегонке. Растворитель выпаривают в вакууме и остаток растворяют в эфире и добавляют воду. Подщелачивают 20%-ным раствором едкого натра, насыщают карбонатом калия и экстрагируют эфиром. Органическую фазу высушивают над сульфатом натрия и в вакууме отгоняют растворитель. Для очистки хроматографируют на силикагеле с уксусным эфиром/изопропанолом (70:30, при добавлении 1% 25%-ного раствора аммиака). Выход: 6,7 г (83% от теор.).
в) Получение амидоксимов осуществляют по способу, описанному в примере 3б.
г) Получение 1,2,4-оксадиазолов осуществляют по способу, описанному в примере 3в.
Пример 7: 3-фенил-5-[2-(пиперазин-1-ил)-фенил]-1,2,4-оксадиазол
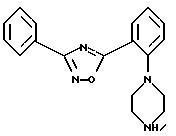
а) Получение 2-(пиперазин-1-ил)-(метилового эфира бензойной кислоты):
(по аналогии с G.S.Poindexter, M.A.Bruce, К.L.LeBoulluec, I.Monkovic, Tetrahedron Lett. 35 (1994), 7331-7334)
б) Получение 5-[2-(пиперазин-1-ил)-фенил]-3-фенил-1,2,4-оксадиазола:
К 1,36 г амидоксима бензойной кислоты и 2,34 г малеината 2-(пиперазин-1-ил)-(этилового эфира бензойной кислоты) добавляют 0,92 г натрия в 100 мл безводного этанола и 6 раз по 30 минут (с перерывами по 5 минут) нагревают в микроволновой печи с мощностью 350 ватт. После охлаждения растворитель отгоняют в вакууме. Остаток экстрагируют дихлорметаном из воды. Органическую фазу сушат над сульфатом натрия и отгоняют растворитель в вакууме. Остаток хроматографируют на силикагеле с уксусным эфиром/изопропанолом (70:30 при добавлении 5% 25%-ного раствора аммиака). Выход: 90 мг (3% от теор.). Температура плавления: 254-255oС.
Пример 8: 5-{2-[2-(N,N-диметиламино)этил]окси-фенил}-3-(4-гидроксифенил)-1,2,4-оксадиазол
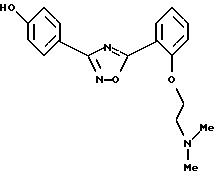
а) Получение 2-[2-(N, N-диметхламино)этил] окси-(метилового эфира бензойной кислоты):
15,2 г метилового эфира салициловой кислоты растворяют в 200 мл безводного ацетонитрила, добавляют 4,4 г 60%-ной суспензии гидрида натрия в масле и перемешивают 60 минут при комнатной температуре. К этому раствору добавляют 200 мл абсолютного ацетонитрила, в который добавлено 17,4 г гидрохлорида 2-(N,N-диметиламино)этилхлорида и 5,2 г 60%-ной суспензии гидрида натрия в масле. Этот раствор также перемешивают 60 минут при комнатной температуре. Объединенные растворы нагревают 1 час при обратной перегонке и затем отгоняют растворитель в вакууме. К остатку добавляют воду и экстрагируют уксусным эфиром. Органическую фазу сушат над сульфатом натрия, растворитель отгоняют в вакууме, а остаток хроматографируют на силикагеле с уксусным эфиром/метанолом (1:1). Получают 14,6 г желтого масла (65% от теор. ).
б)
Получение 2-[2-(N,N-диметиламино)этил]окси-(бензойной
кислоты):
4,4 г 2-[2-(N,N-диметиламино)этил]окси-(метилового эфира бензойной кислоты) нагревают с 30 мл 5Н соляной кислоты в течение 15
минут в микроволновой печи с мощностью 300 ватт. После
этого экстрагируют уксусным эфиром, водную фазу испаряют и перекристаллизовывают из ацетонитрила/эфира. Выход: 4,2 г (86% от теор.)
в)
Получение 5-{2-[2-(N,
N-диметиламино)этил]окси-фенил}-3-(4-гидроксифенил)-1,2,4-оксадиазола;
2,45 г 2-[2-(N, N-диметиламино)этил] окси-(бензойной кислоты), 1,91 г гидрохлорида
N-этил-(N-диметиламинопропил)карбодиимида и каталитического количества гидроксибензотриазола растворяют в 50 мл ДМФ. Через 15 минут добавляют 1,52 г 4-гидрокси(амидоксима бензойной кислоты) и
нагревают 15 минут в микроволновой печи при мощности 700 ватт. Растворитель отгоняют, остаток растворяют в уксусном эфире, промывают водой, сушат над сульфатом натрия и растворитель отгоняют в
вакууме. Остаток фильтруют на силикагеле этанолом и переводят в соль, как описано выше. Выход: 1,1 г (29% от теор.). Температура плавления 170oС (разл.).
Пример 9:
5-{2-[(карбоксамидо)метил]окси-фенил}-3-фенил-1,2,4-оксадиазол
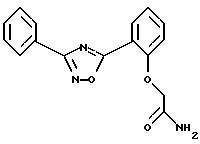
3,57 г 5-(2-гидроксифенил)-3-фенил-1,2,4-оксадиазола растворяют в 70 мл безводного ДМФ и перемешивают с 0,6 г 60%-ной суспензии гидрида натрия в масле в течение 30 минут при температуре 25-30oС. К этому раствору добавляют 1,4 г амида 2-хлоруксусной кислоты и перемешивают 2 часа при 100oС. После этого отгоняют растворитель в вакууме. К остатку добавляют воду и отсасывают. Осадок вываривают последовательно в метаноле и в этиловом эфире уксусной кислоты. Выход: 3/3 г (75% от теор.). Температура плавления: 249-251oС.
Пример 10:
5-{2-[2-(карбоксамидо)этил]окси-фенил}-3-фенил-1,2,4-оксадиазол
а) Получение 5-{2-[2-[1, 3-диоксан-2-ил)этил]окси-фенил}-3-фенил-1,2,4-оксадиазола:
4,1 г 5-(2-гидроксифенил)-3-фенил-1,2,4-оксадиазола растворяют в 60 мл безводного ДМФ и добавляют 0,688 г 60%-ной суспензии гидрида натрия в масле. К этой смеси добавляют 3,15 г 2-(2-бромэтил)-1,3-диоксана и перемешивают 4 часа при 100oС. После охлаждения растворитель отгоняют в вакууме и к остатку добавляют воду. Его экстрагируют уксусным эфиром, органическую фазу высушивают над сульфатом натрия и в вакууме отгоняют растворитель. Остающийся раствор хроматографируют на силикагеле с этиловым эфиром уксусной кислоты. Выход: 2,5 г (41% от теор.).
б) Получение 5-{2-[2-(карбоксил)этил]окси-фенил}-3-фенил-1,2,4-оксадиазола:
2,5 г 5-{2-[2-(1,3-диоксан-2-ил)этил]окси-фенил}-3-фенил-1,2,
4-оксадиазола растворяют в 50 мл ацетона и при 0oС добавляют каплями раствор окиси хрома (VI) в 30%-ной серной кислоте. Затем в течение 20 часов перемешивают при 20-23oС и
добавляют при охлаждении при 5oС 25 мл изопропанола. Смесь вводят в суспензию 100 мл дихлорметана и 100 мл воды и отделяют органическую фазу. Водную фазу еще раз экстрагируют дихлорметаном
и объединенные органические растворы еще раз водой. Высушивают над сульфатом натрия, отгоняют растворитель в вакууме и хроматографируют на силикагеле с дихлорметан/этиловым эфиром уксусной кислоты
(97:3). Продукт перекристаллизовывают из этилового эфира уксусной кислоты. Выход: 0,23 г (11% от теор.). Температура плавления: 170-171oС.
в) Получение 5-{
2-[2-(карбоксамидо)этил]окси-фенил}-3-фенил-1,2,4-оксадиазола:
0,8 г 5-{2-[2-(карбоксил)этил]окси-фенил}-3-фенил-1,2,4-оксадиазола растворяют в 40 мл безводного дихлорметана и охлаждают до
0oС. К этому раствору добавляют 2 мл оксалилхлорида, растворенного в 5 мл безводного дихлорметана и перемешивают 1,5 часа при 20oС. Растворитель отгоняют в вакууме и добавляют
30
мл безводного дихлорметана. При охлаждении добавляют аммиачный раствор дихлорметана до тех пор, пока реакционный объем не станет щелочным. Оставляют на 14 часов, добавляют воду, отделяют
образующийся
осадок и дихлорметановую фазу и высушивают органическую фазу над сульфатом натрия. После отгонки растворителя получают остаток в 0,7 г. Этот остаток хроматографируют на силикагеле с
дихлорметан/метанолом (98:2) и продукт перекристаллизовывают из уксусного эфира. Выход: 0,24 г (33% от теор.). Температура плавления: 137-138oС.
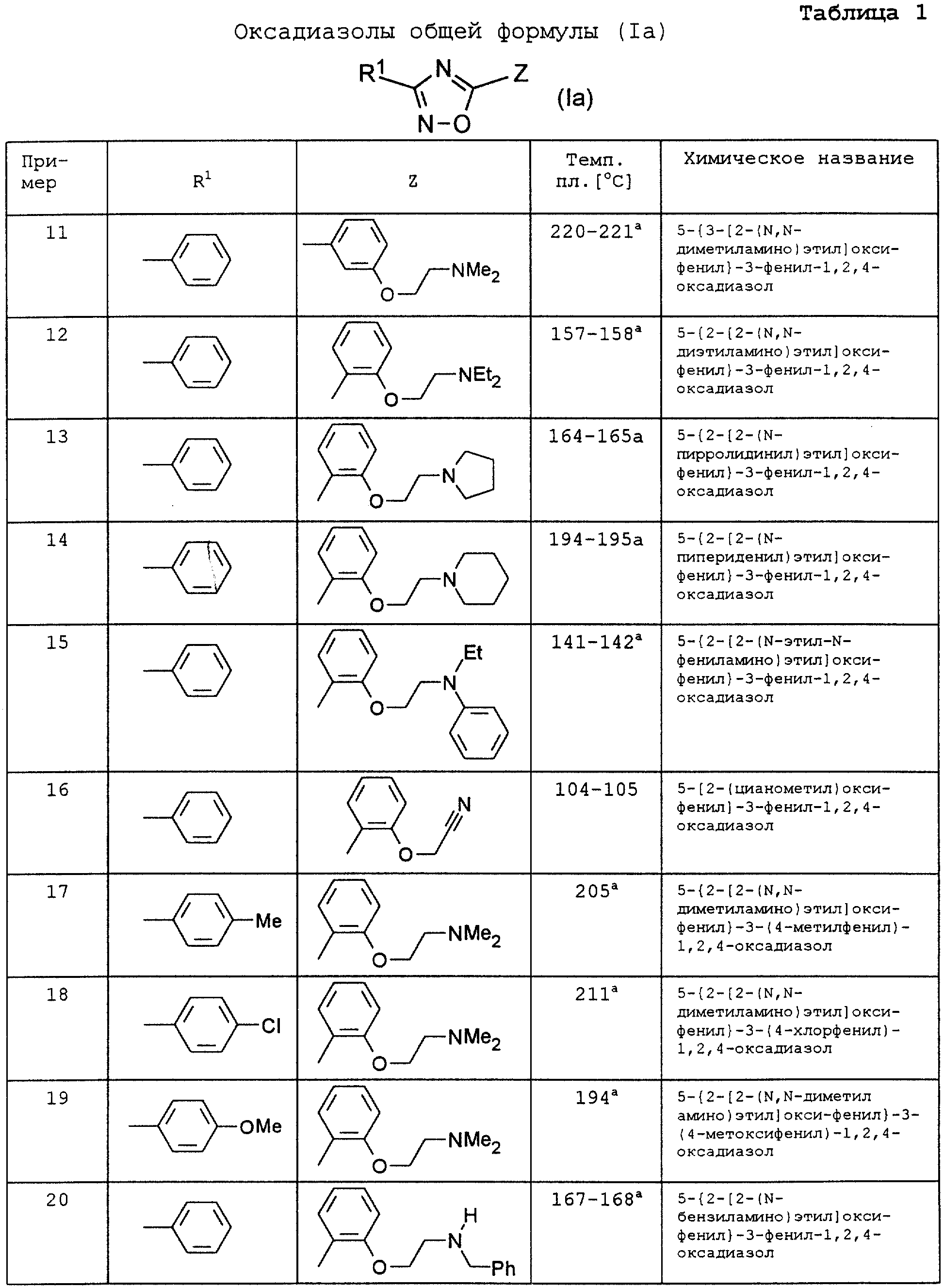
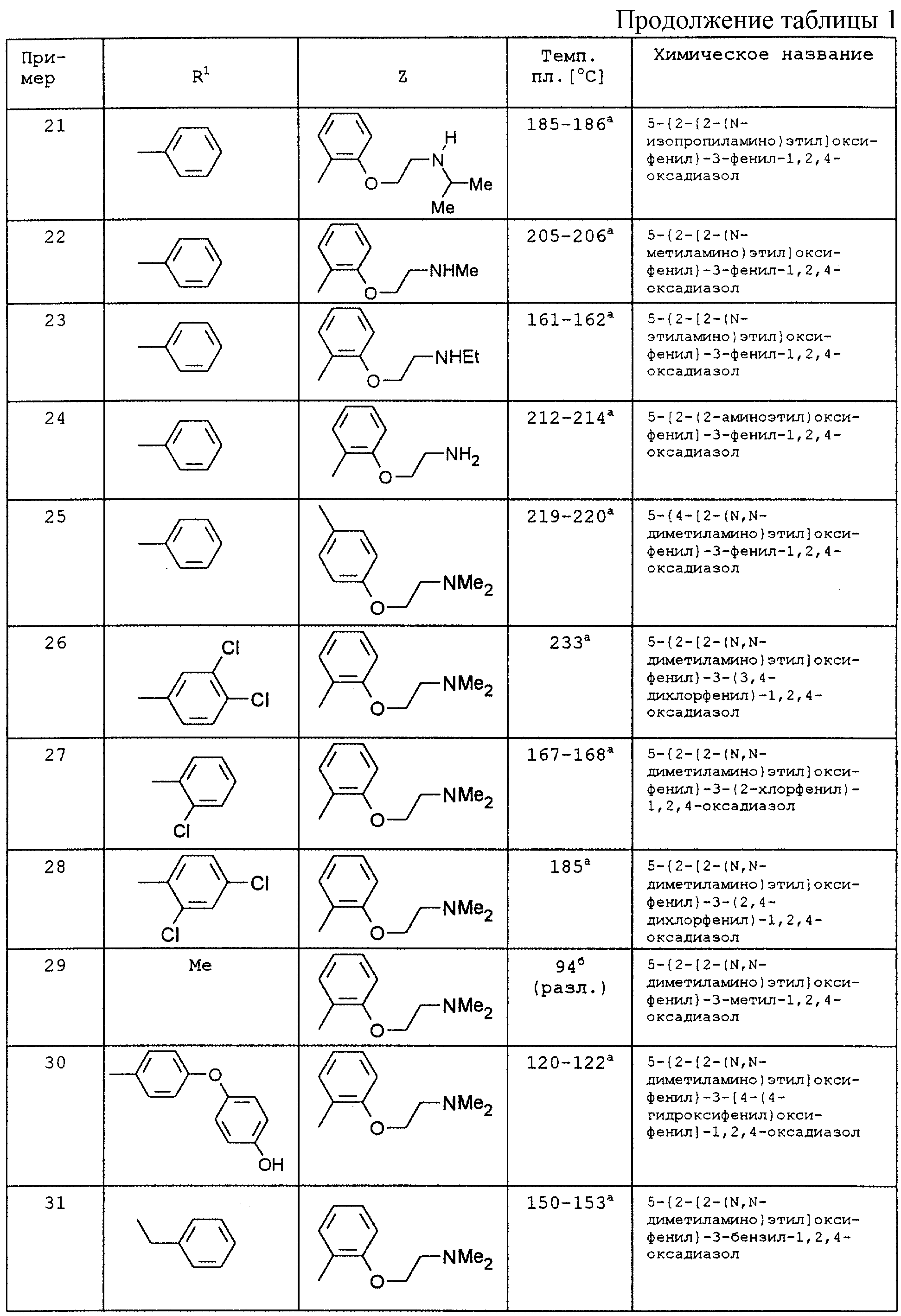
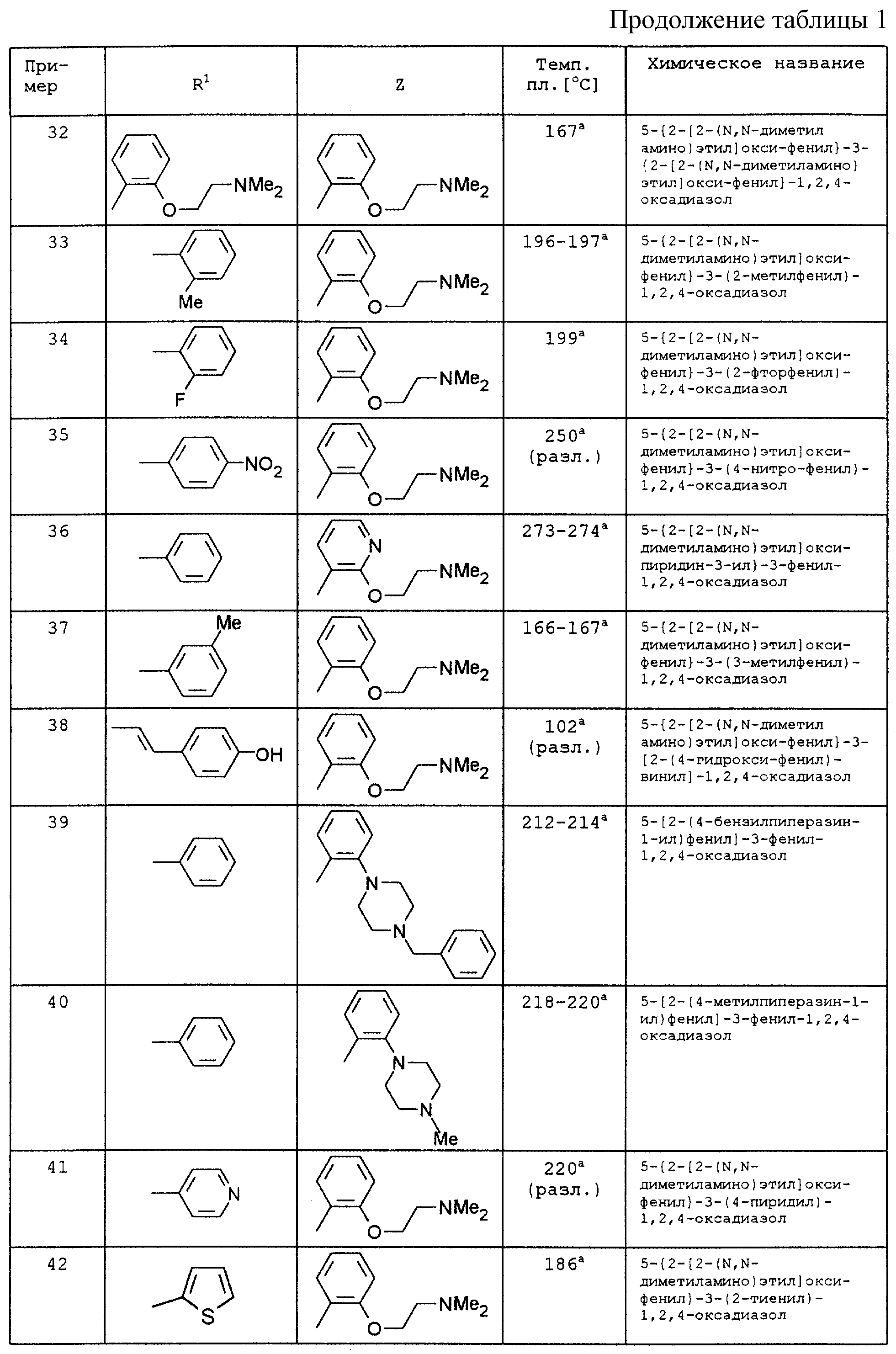
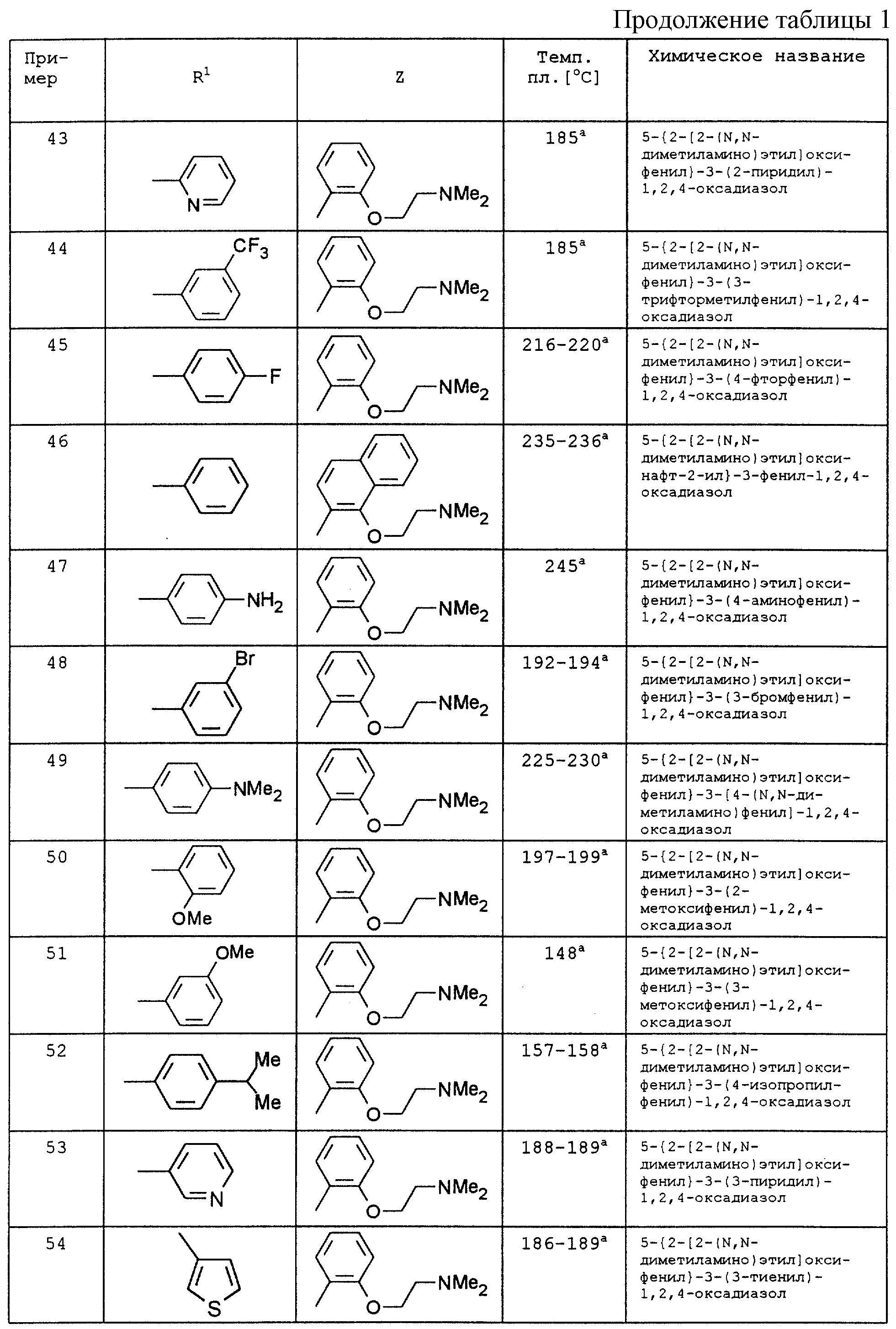
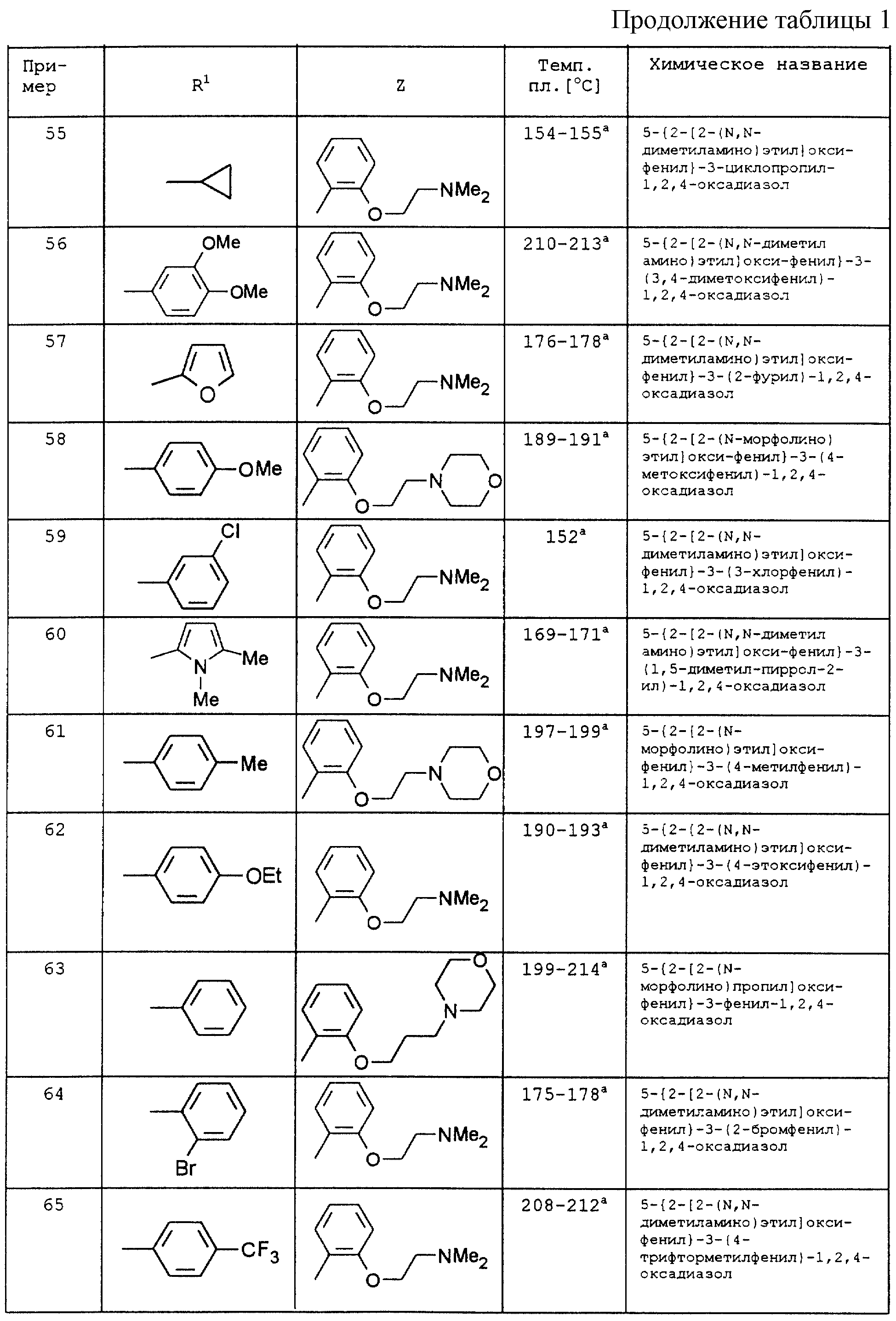
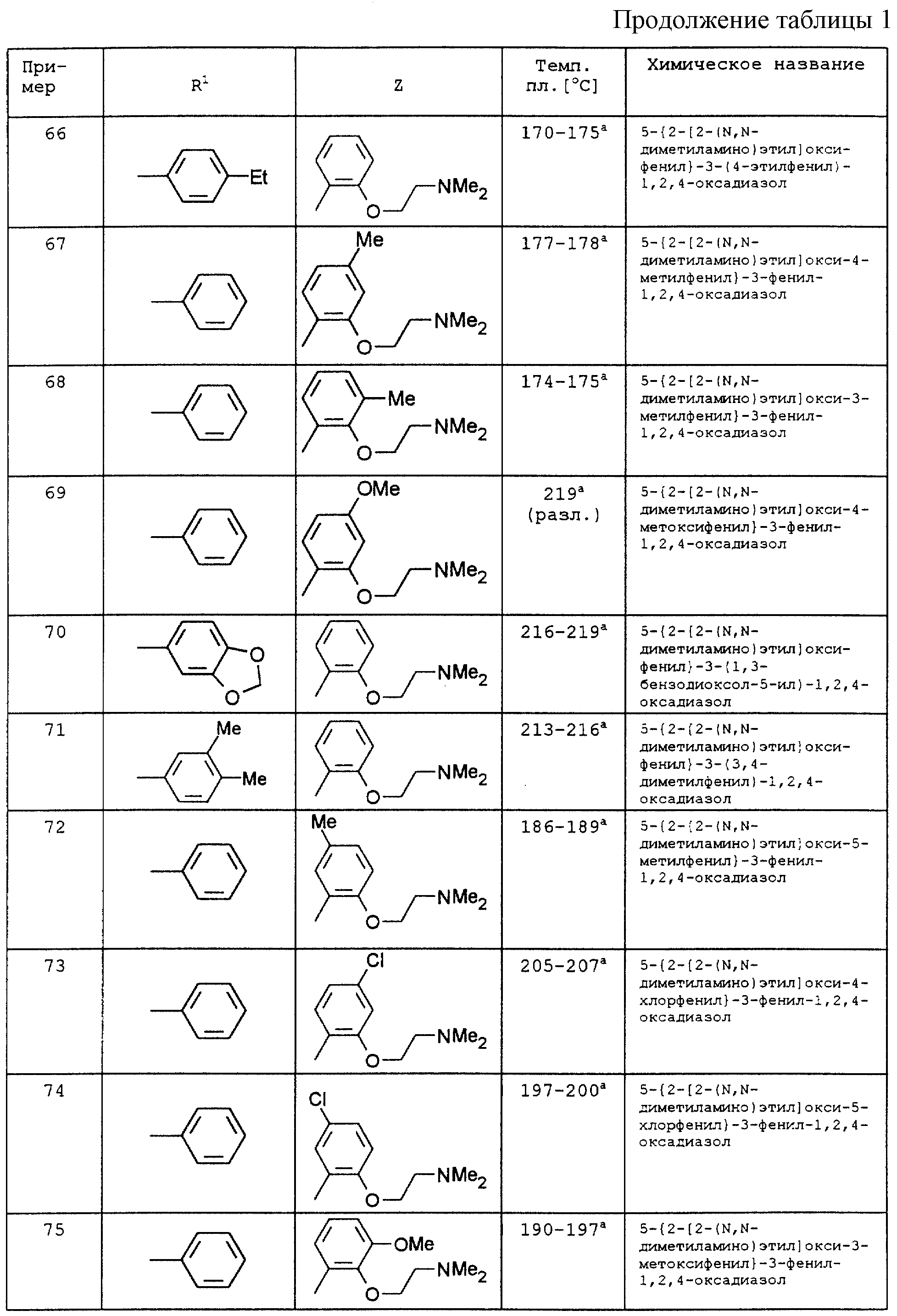
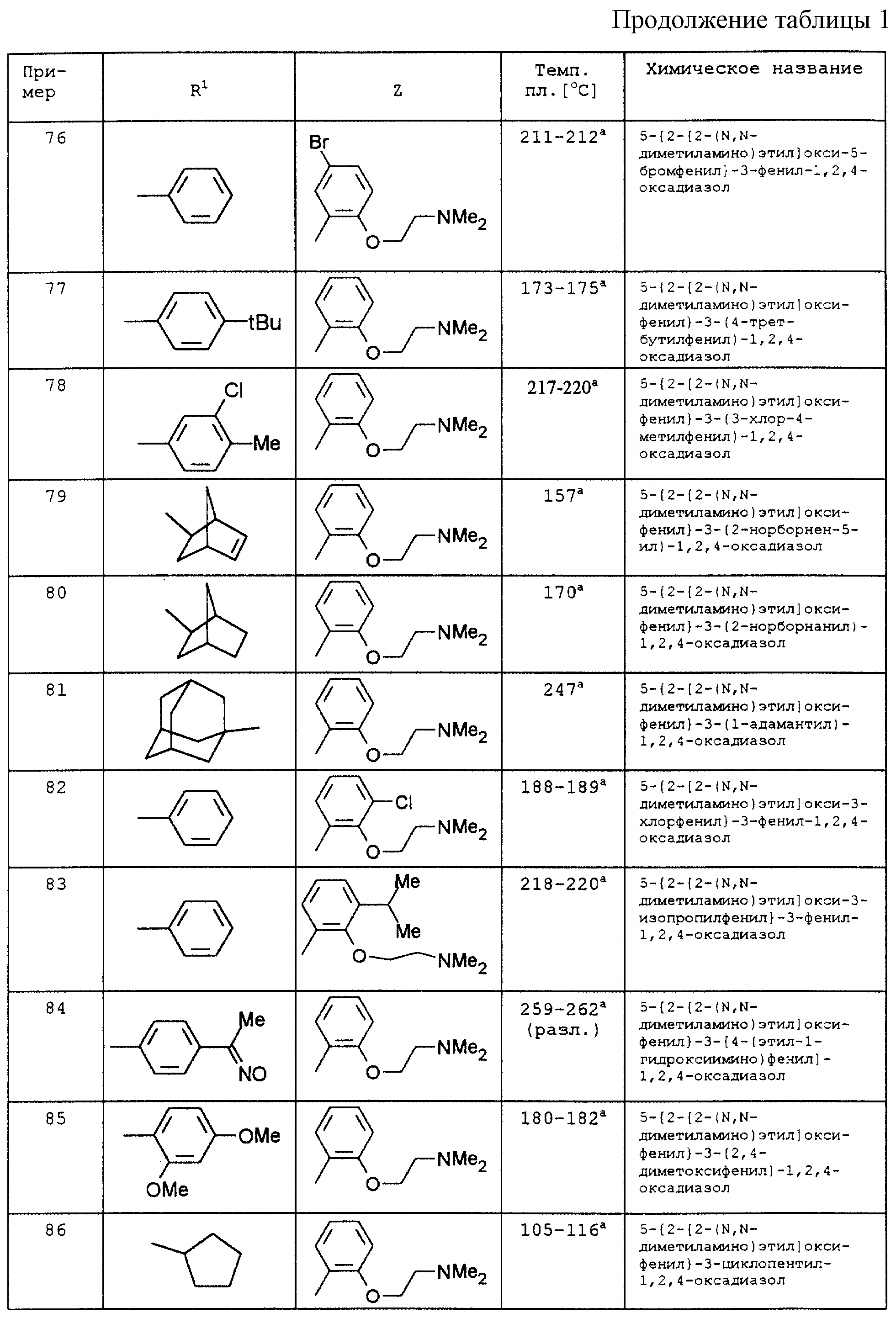
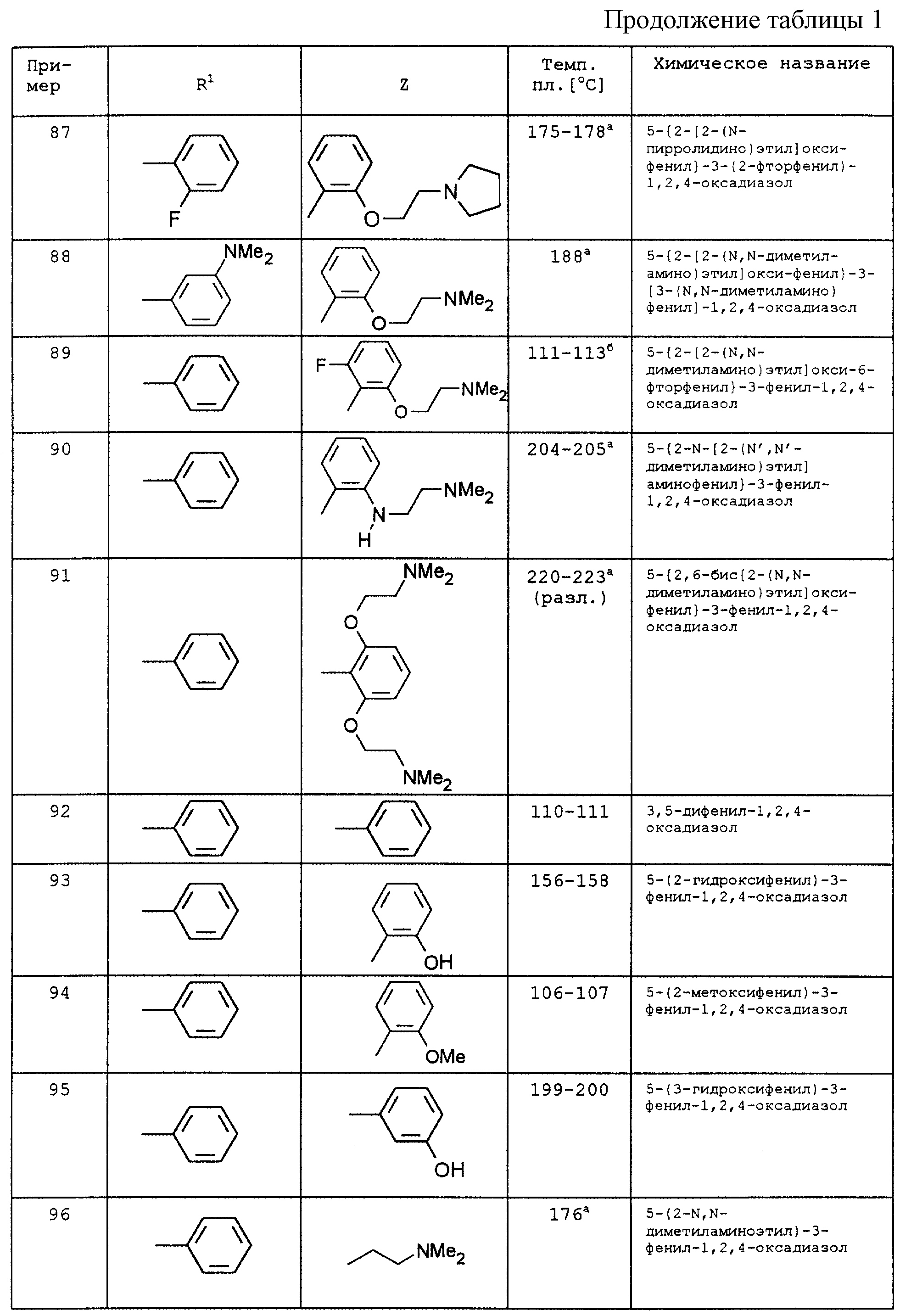
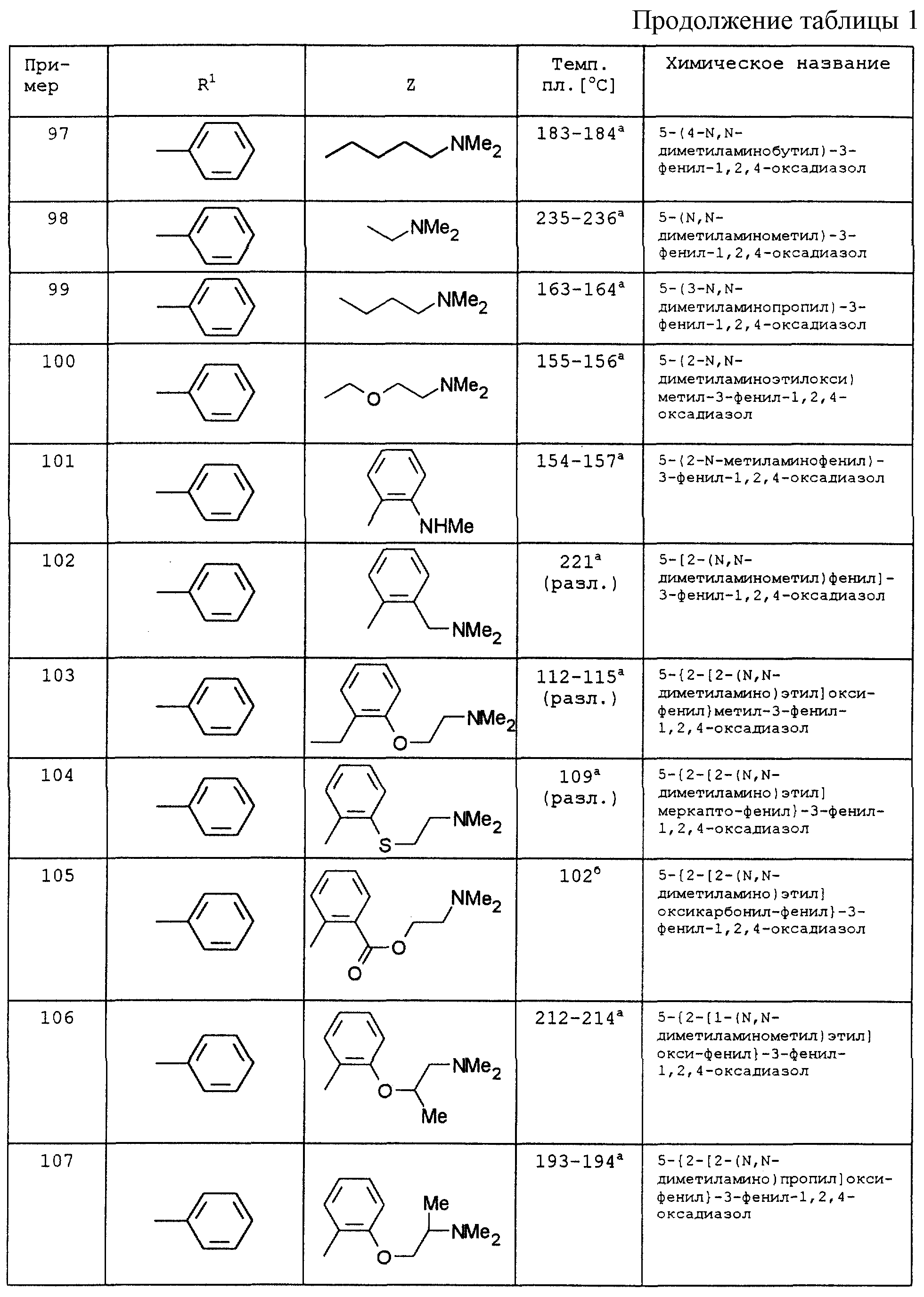
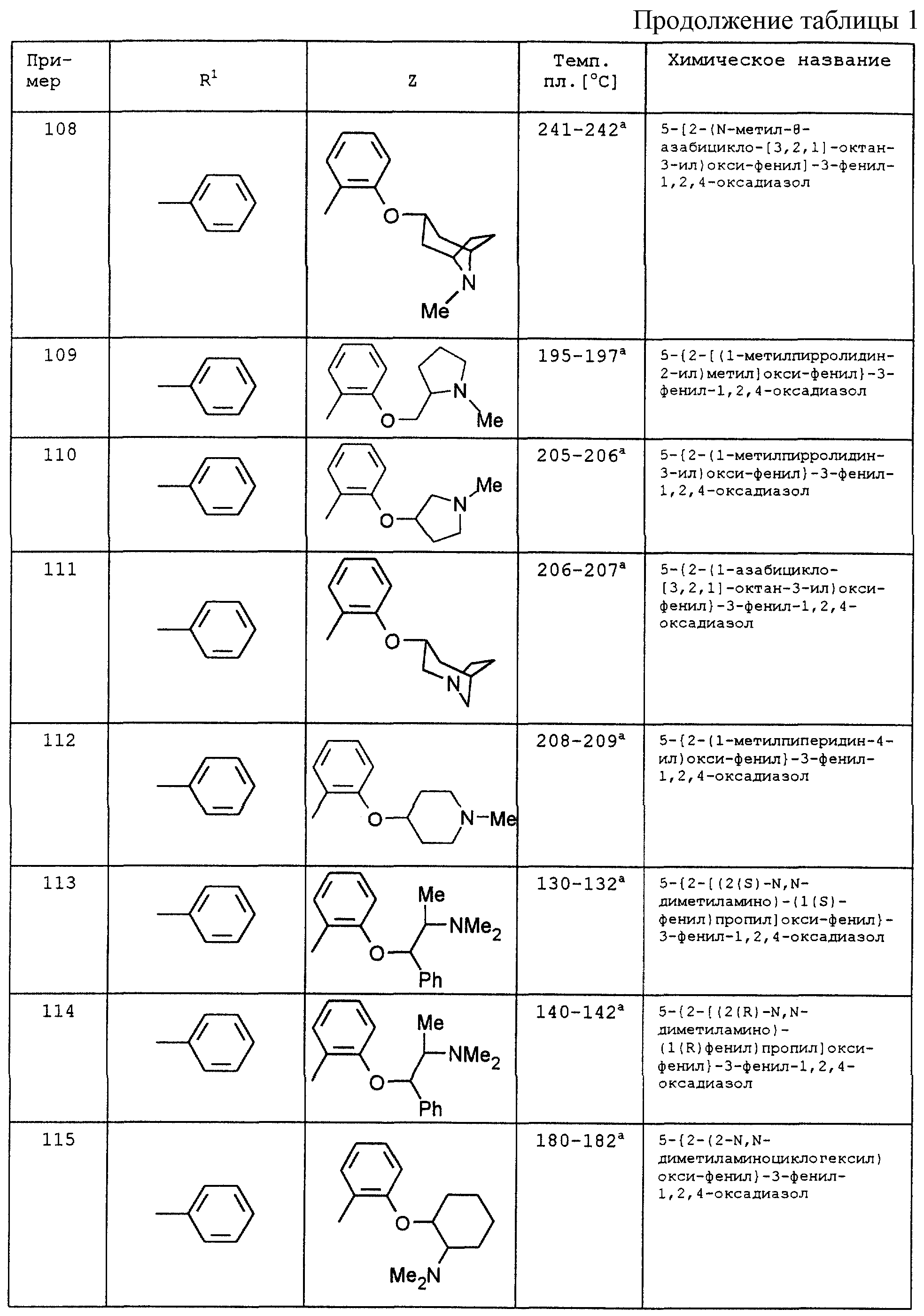
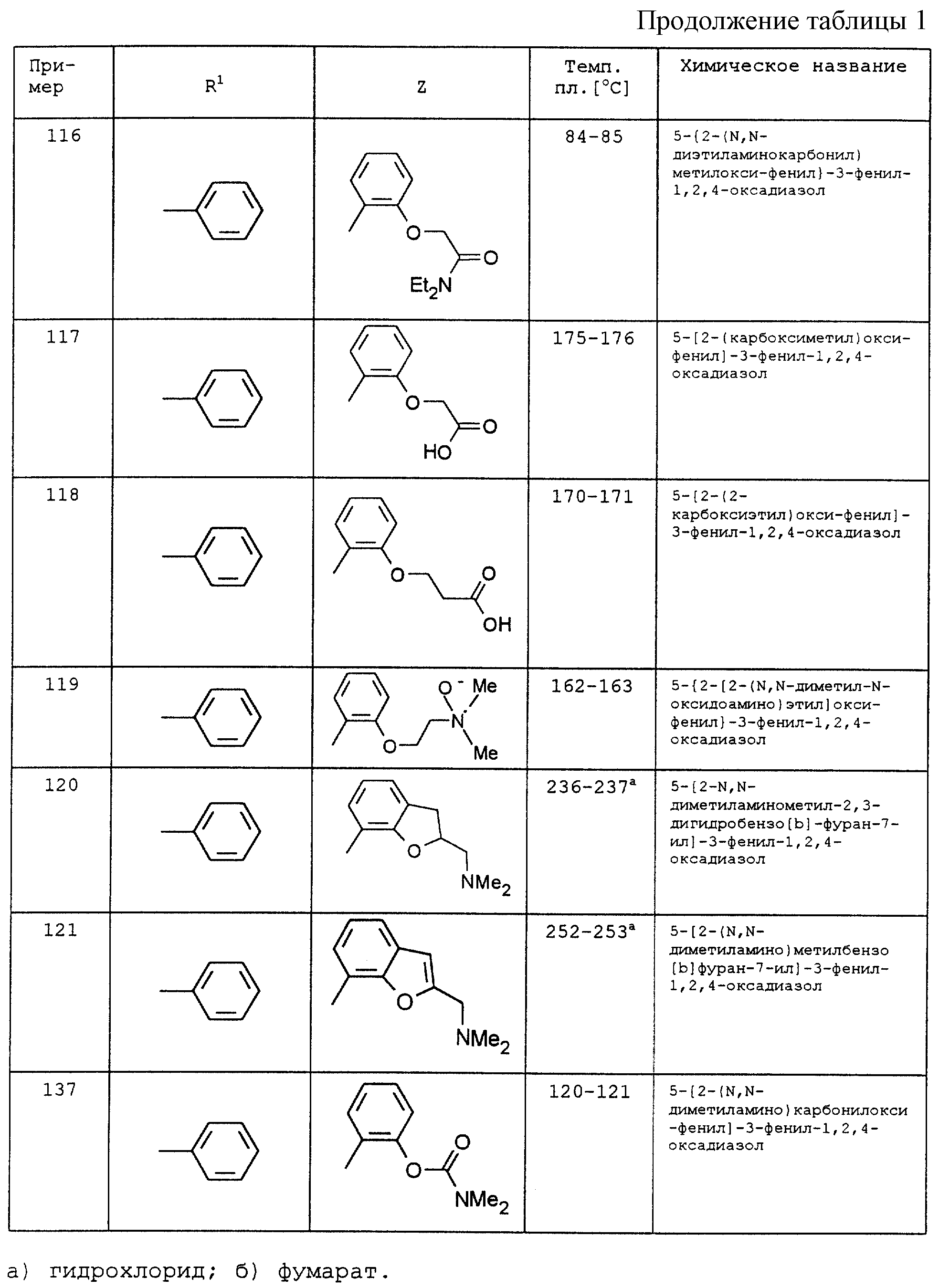
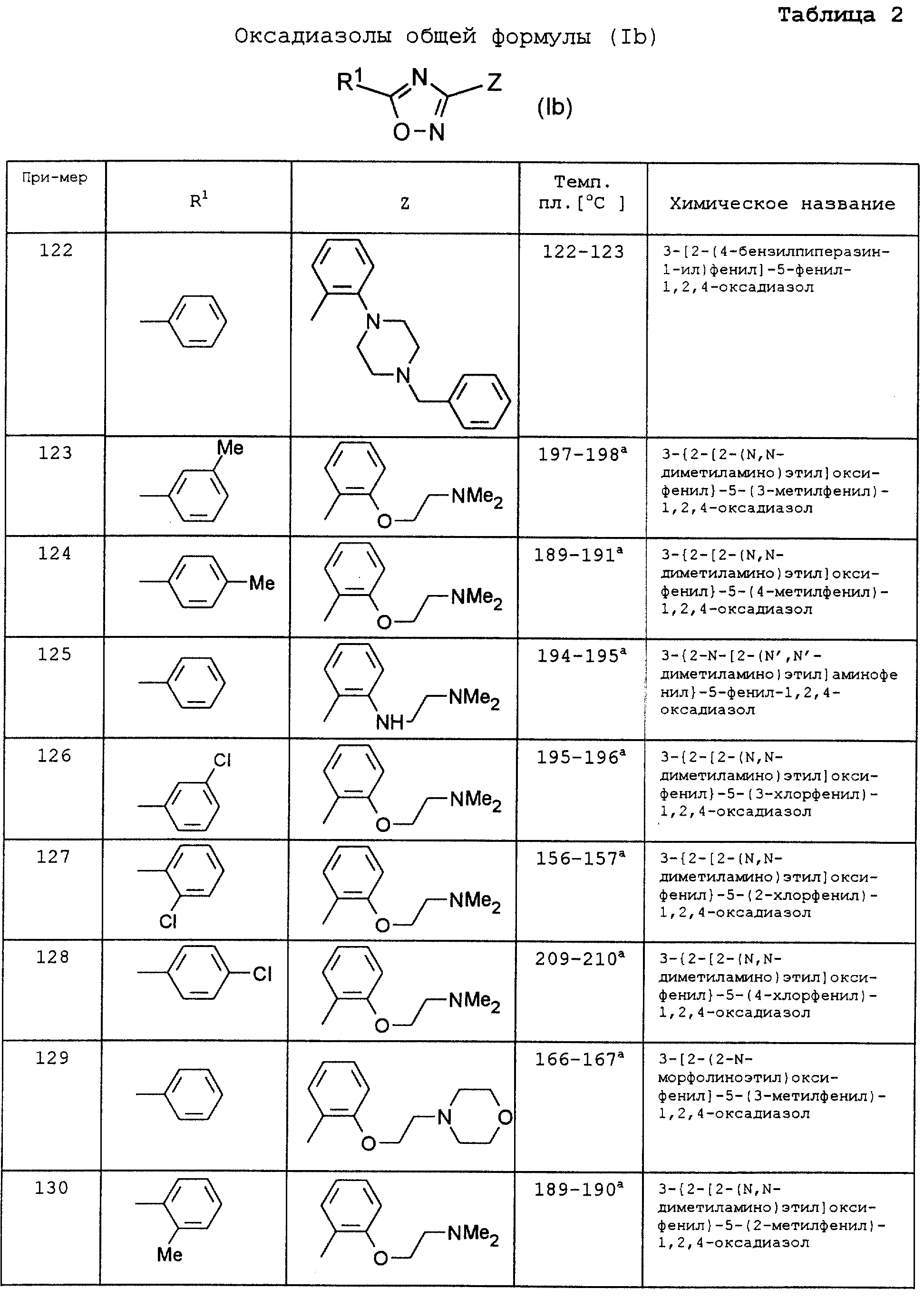
По аналогии с вышеописанными способами и примерами синтезов были получены в том числе и следующие соединения (см.табл.1 и 2).
Неожиданно было обнаружено, что соединения, соответствующие изобретению, проявляют сродство к различным рецепторам или активность на различных типах рецепторов и проявляют нейропротективное действие.
Опыты in vivo и in vitrо показали, что повреждение клеток и прекращение их функционирования, происходящие в мозгу в результате гипогликемии, гипоксии, аноксии, глобальной или фокальной ишемии, черепно-мозговой травмы, отека мозга и повышенного внутричерепного давления частично связаны с повышенной синаптической активностью и усиленным в связи с этим высвобождением трансмиттеров. Наряду с глутаматом, гистамин и серотонин являются особенно важными нейротрансмиттерами. Кроме того, происходит изменение концентрации ионов, особенно ионов кальция и натрия.
Известно, что после систематического приема глутамата происходит разрушение нейронов в мозгу мышей (S.M.Rothman, T.W.Olney, Trends in Neurosciences, 10 (1987) 299). Этот результат позволяет сделать вывод, что глутамат играет роль при невродегенеративных заболеваниях (R.Schwarcz, B.Meldrum, The Zancet 11 (1985) 140). Кроме того, известно, что такие вещества, как квискваловая кислота, каиновая кислота, иботеновая кислота, глутаминовая кислота, N-метил-D-аспарагиновая кислота (NMDA) и α-амино-3-гидрокси-5-метил-4-изооксазолпропионовая кислота (АМРА) являются экзогенными, соответственно, эндогенными нейротоксинами. Поражения мозга, которые могут быть индуцированы такими веществами, сравнимы с поражениями, которые возникают в связи с эпилепсией и другими невродегенеративными заболеваниями такими, как болезнь Хантингтона или болезнь Альцгеймера. Вещества и ионы, которые тормозят активность глутамат-рецепторов и связанного с этим рецептором ионного канала, как, например, конкурирующие и неконкурирующие антагонисты возбуждающих аминокислот, защищают клетки мозга от гипоксических и ишемических повреждений. Эти результаты показывают, что глутамат-рецепторы играют важную роль при передаче ишемических повреждений.
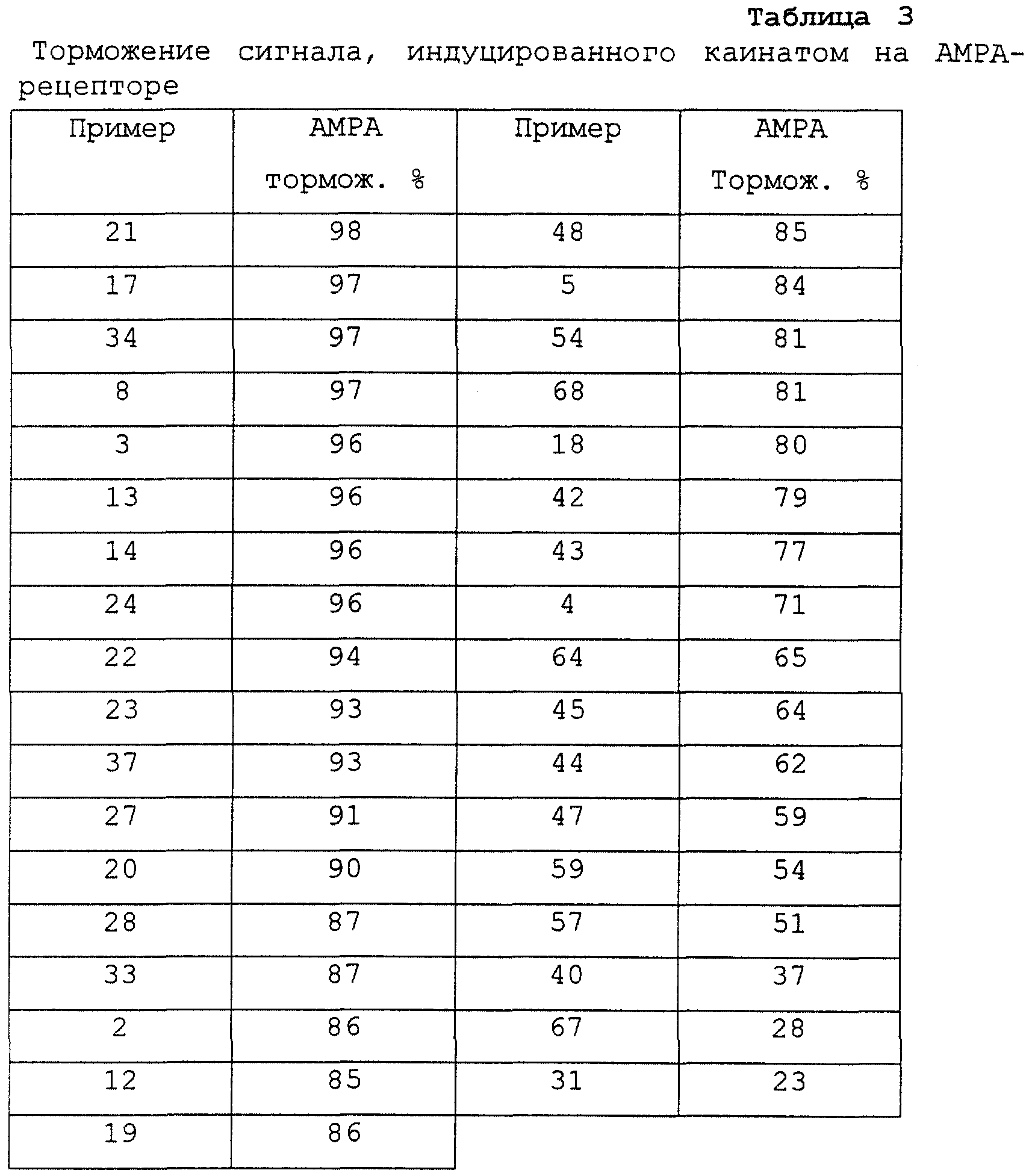
Доказательство воздействия на АМРА-рецептор получено с помощью электрофизиологии на нейронных клетках (patch-clamp метод) (M. L. Mayer, L. Vyklicky, G.L.Westbrook, J. Physiol. 415 (1989) 329-350). Тестирование проводилось при концентрации тестового вещества 100 мкM (см.табл.3).
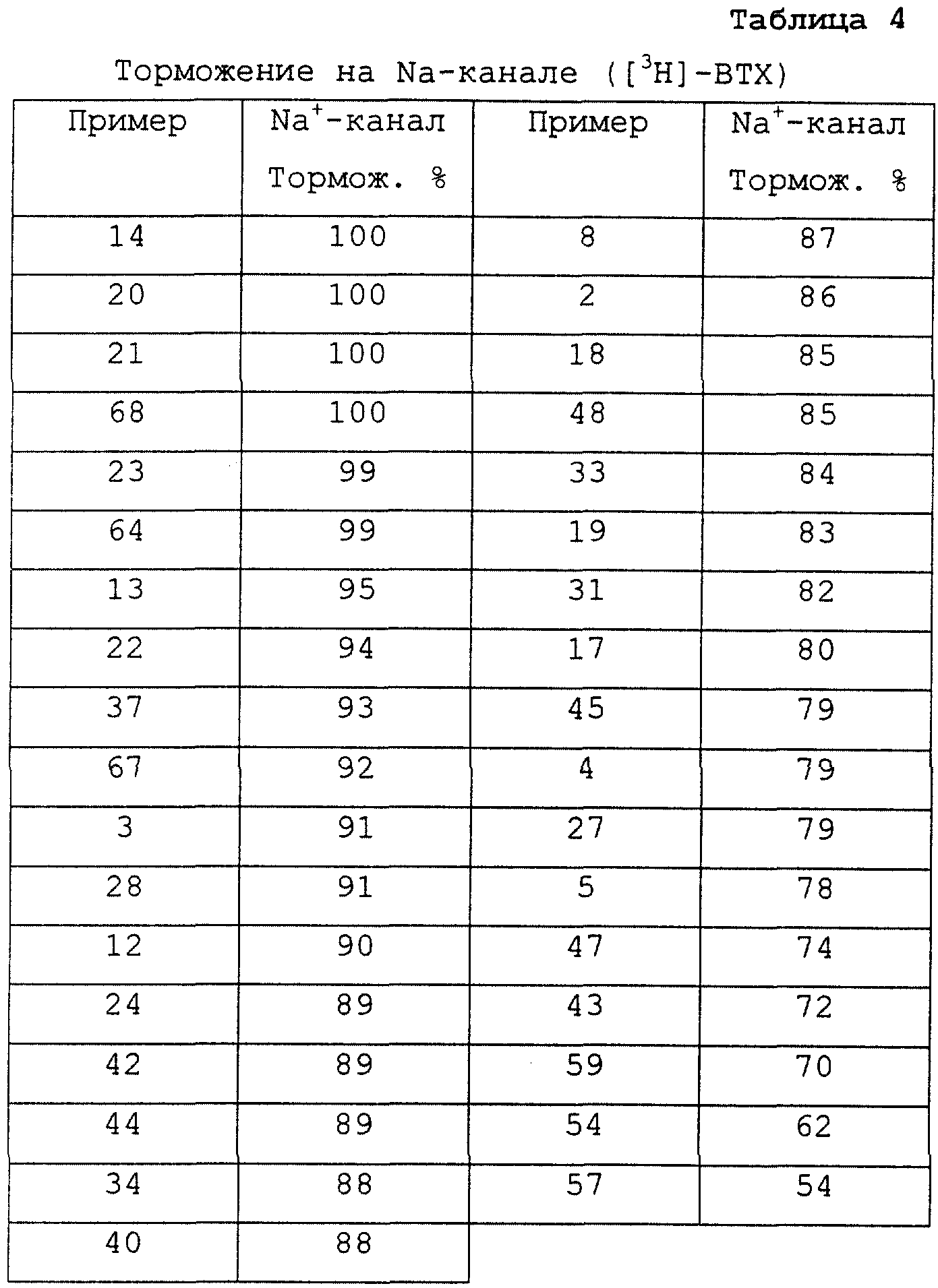
Доказательства сродства к месту присоединения "Na+ канал site" были получены таким путем, как описано G.W.Brown (J.Newrosci. 6 (1986) 2064).
Тестирование проводилось типичным способом, при концентрации тестового вещества 10 мкМ (см.табл.4).
Повреждения клеток при гипогликемии, гипоксии, аноксии и ишемии ведут в результате недостаточного снабжения к пониженному предложению энергоносителей, как, например, глюкозы в нейронах.
Влияние антагонистов гистаминных рецепторов на нарушение поглощения 2-деоксиглюкозы, индуцированное гипоксией и гипогликемией было исследовано на крысиных "Hippocampus Slice" препаратах (S.Shibata, S.Watanase, Neuroscience Letters 151 (1993) 138). Добавление гистамина еще более усугубляет уменьшение поглощения 2-деоксиглюкозы, индуцированное ишемией. Было показано, что антагонисты гистамин H1 рецептора улучшают поглощение 2-деоксиглюкозы, понижение которого индуцировано ишемией, в то время как антагонисты гистамин Н2 рецептора не оказывают на него влияния. Защитный эффект антагонистов гистамин Н1 рецептора можно устранить с помощью гистамина. Это исследование показало, что гистаминные рецепторы играют важную роль в уменьшении метаболизма глюкозы, индуцированном ишемией.
Чрезмерная нейронная активность в сочетании с массивным возрастанием нейротрансмиттеров может приводить к нейронной дегеренерации в животных моделях с неустановившейся церебральной ишемией (A.Benveniste, H.Drejer, A.Schousboe, N.H.Diemer, J.Neurochem. 43 (1984) 1369). Нейронная активность может ингибироваться веществами, которые связывают нейротрансмиттеры с рецепторами такими, как 5-гидрокситриптамин (серотонин) (R.Andrade, R.A.Nicoll, Soc. Neurosci. Abstr. 11 (1985) 297). Кроме того, было показано что управление 5-гидрокситриптамин агонистами на животных моделях с окклюзией средней церебральной артерии ведет к уменьшению инфарктного пространства (J.H.M.Pren, C. Backhauss, C.Karkoutly, J.Nuglisch, B.Peruche, C.Rossberg, J.Krieglstein, Eur. J. Pharmacol. 203 (1991) 213).
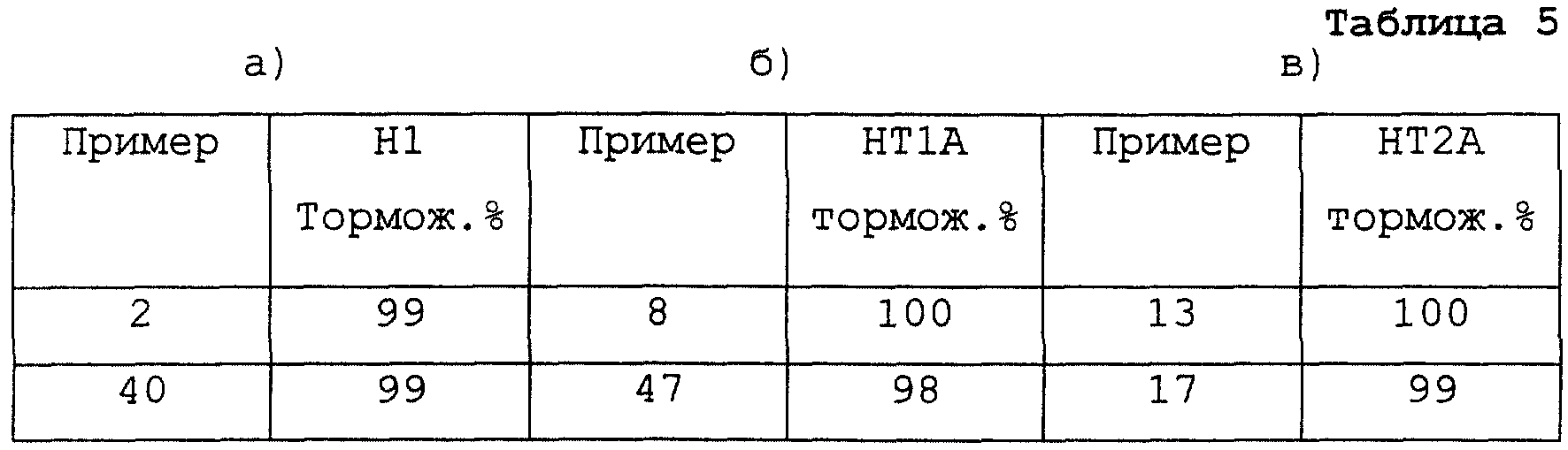
В качестве тестовых систем для доказательства сродства к следующим рецепторам были проведены исследования по связыванию рецепторов, опирающиеся на следующие работы: гистамин H1 (H1) рецептор (S.Dini и сотр. Agents and Actions 33 (1991) 181); 5-гидрокситриптамин 1А (HT1A) рецептор (M.D.Hall и сотр., J. Neurochem. 44 (1985) 1685); 5-гидрокситриптамин 2А (НТ2А) рецептор (J.H.Leysen и сотр., Mol. Pharmacol. 21 (1982) 301). Тестирование проводилось типичным образом при концентрации тестового вещества 10 μМ.
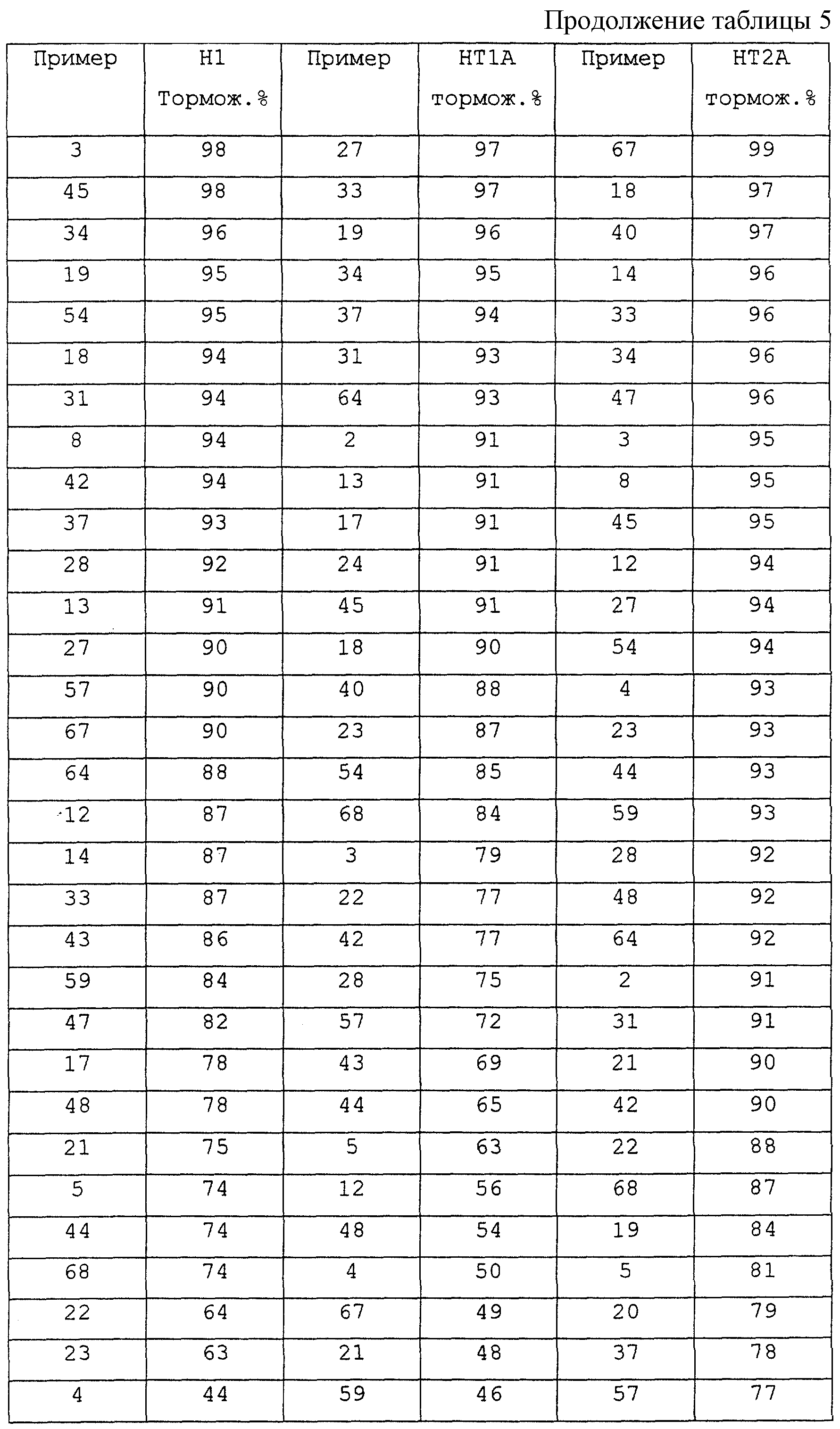
В таблице 5 приведены величины торможения на вышеназванных рецепторах.
Согласно H. Takahashi и сотр. (Stroke 26 (1995) 1676) сигма- рецепторы вовлечены в механизм острых повреждений после неустановившейся фокальной ишемии. Takahashi и сотр. удалось, например, доказать при исследовании потенциального лиганда сигма-рецептора в модели неустановившейся фокальной ишемии уменьшение инфарктного пространства.
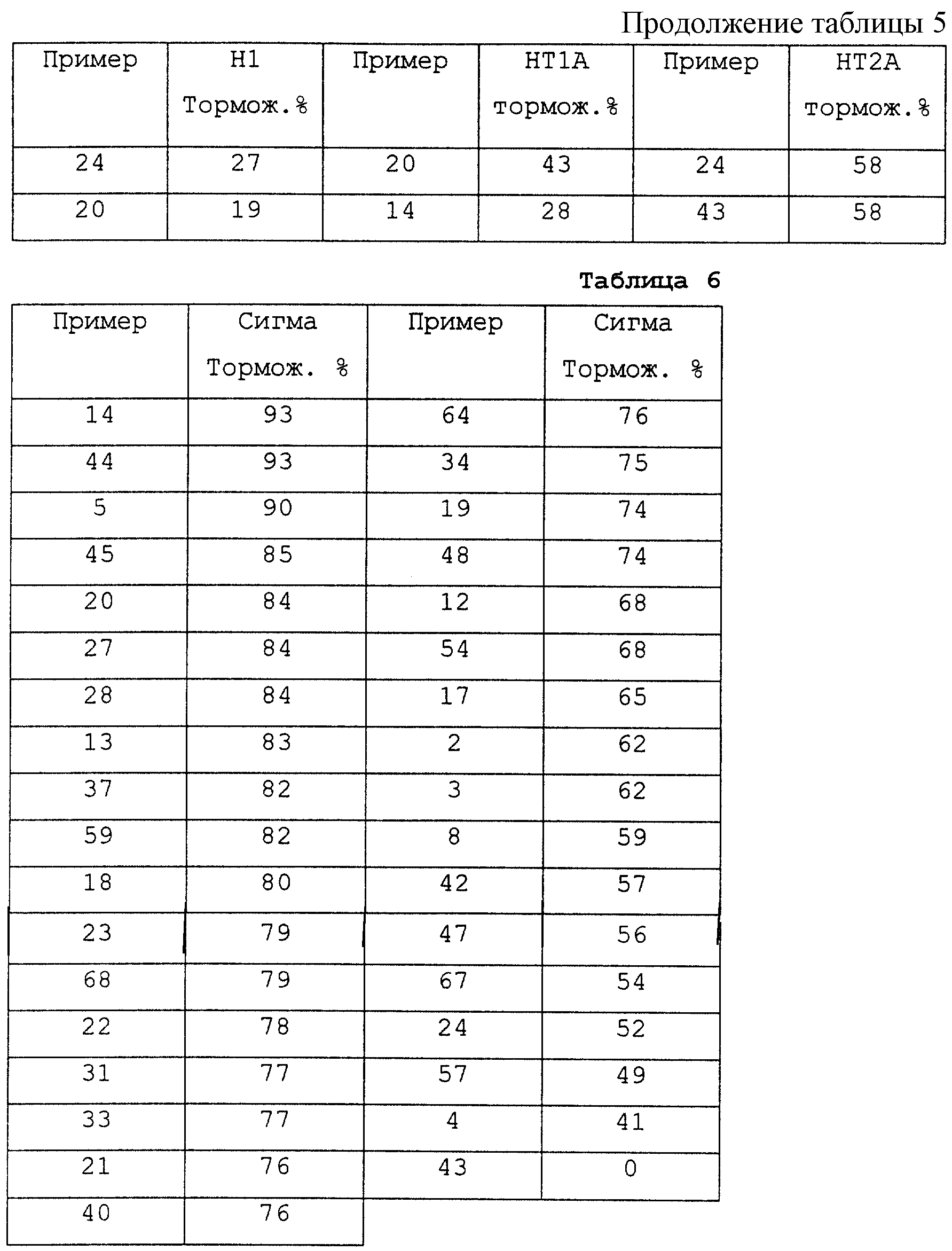
В качестве тестовой системы для доказательства сродства соединений, соответствующих изобретению, к сигма-рецептору были проведены исследования связывания рецептора, согласно (E.W.Karbon, K.Naper, M.J.Pontecorvо Eur. J. Pharmacol. 193 (1991) 21). Тестирование проводилось типичным способом при концентрации тестового вещества 10 μМ. Величины торможения приведены в таблице 6.
Доказательство нейропротективного действия in vivo получены на модели апоплексического удара у крыс. Для этого индуцируют перманентную фокальную церебральную ишемию в результате операционной окклюзии Arteria cerebri media (MCAO) (опираясь на работу A.Tamura, D.I.Graham, J.McCulloch и G.M.Teasdale, J. Cereb. Blood Metab. 1 (1981) 53-60). С помощью 5-{2-[2-(N,N-диметиламино)этил]окси-фенил}-3-фенил-1,2,4-оксадиазола (пример 2) удалось отчетливо и значительно уменьшить область поражения.
Вышеописанные результаты доказывают, что производные оксадиазола общей формулы I могут быть использованы при невродегенеративных заболеваниях и ишемии мозга различного происхождения. К ним относятся, например, эпилепсия, гипоклемия, гипоксия, аноксия, травма мозга, отек мозга, амиотропный латеральный склероз, болезнь Хантингтона, болезнь Альцгеймера, гипотония, инфаркт сердца, повышенное внутричерепное давление, ишемический и связанный с кровоизлиянием паралич, глобальная церебральная ишемия при остановке сердца, диабетическая полиневропатия, тинитус, перинатальная асфиксия, психозы, шизофрения, депрессия и болезнь Паркинсона.
Соединения общей формулы (I) используют по отдельности или в комбинации с другими соединениями, соответствующими изобретению, при необходимости и в комбинации с другими фармакологичкски активными веществами. Подходящими формами для применения являются, например, таблетки, капсулы, свечи и растворы, особенно растворы для инъекции (s.c., i.v., i.m.) и инфузии-сиропы, эмульсии или дисперсные порошки. Причем доля фармацевтически действующего вещества составляет от 0,1 до 90 вес.%, предпочтительно от 0,5 до 50 вес.% от общего состава, то есть в количествах, которые достаточны для достижения интервалов дозировки, приведенных ниже. Соответствующие таблетки получают, например, при смешивании одного или нескольких действующих веществ с известными вспомогательными веществами, например, инертными разбавителями такими, как карбонат кальция, фосфат кальция или молочный сахар, распылительными средствами такими, как кукурузный крахмал или альгиновая кислота, связующими веществами такими, как крахмал и желатина, смазывающими средствами такими, как стеарат магния или тальк и/или средствами для достижения эффекта пролонгирования такими, как карбоксиметилцеллюлоза, ацетатфталат целлюлозы или поливинилацетат. Таблетки могут также состоять из многих слоев.
Соответственно можно получать драже при покрытии ядер, полученных аналогично таблеткам, веществами, которые обычно используют для покрытия драже таких, как коллидон или шеллак, гуммиарабик, тальк, диоксид титана или сахар. Для достижения эффекта пролонгирования или для избежания несовместимости ядро может состоять и из нескольких слоев. Аналогично, для эффекта пролонгирования может служить и оболочка драже, состоящая из нескольких слоев, причем используют те же вспомогательные вещества, которые упомянуты выше и используют для таблеток.
Сиропы действующих соединений, при необходимости комбинации действующих веществ, соответствующих изобретению, могут содержать подслащивающие вещества такие, как сахарин, цикламат, глицерин или сахар, а также средства, улучшающие вкус, например ароматизирующие вещества такие, как ванилин или экстракт апельсина. Кроме этого, они могут содержать вспомогательные вещества для образования суспензий, сгущающие средства, такие как натрийкарбоксиметилцеллюлоза, сшивающие средства, например продукты конденсации жирных спиртов с этиленоксидом, или защитные вещества такие, как п-гидроксибензоат.
Инъекционные и инфузионные растворы получают обычным путем, например при добавлении изотонантов, консервирующих средств таких, как п-гидроксибензоаты, или стабилизаторов таких, как соли щелочных металлов с этилендиаминтетрауксусной кислотой, при необходимости используя эмульгирующие средства и/или диспергирующие средства, причем при использовании воды в качестве разбавителя, при необходимости, органические растворители могут быть использованы в качестве посредников при растворении или вспомогательных растворителей, и заполняют инъекционные бутылки или ампулы, или инфузионные бутылки.
Можно изготовлять капсула, содержащие одно или несколько действующих веществ, при необходимости, комбинации действующих веществ, при этом действующие вещества смешивают с инертными носителями такими, как молочный сахар или сорбит, и заделывают в желатиновые капсулы.
Подходящие свечи можно, например, изготовить при смешивании с предусмотренными для этого носителями такими, как нейтральные жиры или полиэтиленгликоли, при необходимости, их производные. В качестве вспомогательных веществ можно упомянуть, например, воду, формацевтически безопасные органические растворители такие, как парафины (например, фракции нефтей), масла растительного происхождения (например, арахисовое масло, кунжутовое масло), моно- или полифункциональные спирты (например, этанол, глицерин), вещества-носители такие, как помол горных пород (например, каолин, глинозем, тальк, мел), помолы синтетических неорганических материалов (высокодисперсные кремниевая кислота и силикаты), сахар (тростниковый, молочный или виноградный сахар), эмульгирующие средства (например, лигнин, отработанный сульфитный щелок, метилцеллюлоза, крахмал и поливинилпирролидон) и добавки для улучшения переработки (например, стеарат магния, тальк, стеариновая кислота и натрийлауратсульфат).
Применение осуществляется обычным путем, предпочтительно парентеральным путем, особенно внутривенной инфузией.
В случае орального применения таблетки могут, само собой разумеется, содержать, наряду с названными веществами-носителями, добавки такие, как цитрат натрия, карбонат кальция и дикальцийфосфат вместе с другими веществами-наполнителями такими, как крахмал, предпочтительно картофельный крахмал, желатина и тому подобное. Кроме того, могут совместно использоваться средства для улучшения переработки при таблетировании такие, как стеарат магния, натрийлауросульфат и тальк. В случае водных суспензий к действующим веществам, кроме вышеназванных вспомогательных веществ можно добавлять улучшители вкуса или красящие вещества.
В случае парентерального применения используют растворы действующих веществ с подходящими жидкими материалами-носителями.
Дозировка при внутривенном применении составляет от 1 до 1000 мг в час, предпочтительно от 5 до 500 мг в час. Однако при необходимости возможно отклонение от указанных количеств в зависимости от веса тела, соответственно, от формы применения, индивидуальной восприимчивости к лекарству, вида лекарственной формы и времени, соответственно, от интервала между приемами. Так, в некоторых случаях оказывается достаточным применение в меньшем количестве, чем составляет минимальное количество, в то время как в других случаях приходится превышать верхнюю границу. В случае применения больших количеств рекомендуется их осуществлять при большем количестве приемов в день.
Кроме того, соединения с общей формулой (I), соответственно, их соли с кислотами, можно комбинировать с действующими веществами другого ряда.
Примеры, приведенные ниже, иллюстрируют данное изобретение, однако оно не ограничивается ими:
Примеры фармацевтических форм
А)
Таблетки - на таблетку
Действующее вещество - 100 мг
Молочный сахар - 140 мг
Кукурузный крахмал - 240 мг
Поливинилпирролидон - 15 мг
Стеарат магния - 5 мг
- 500 мг
Тонкоразмолотые действующее вещество, молочный сахар и часть кукурузного крахмала смешивают между собой. Смесь просеивают, после чего ее увлажняют раствором пирролидона в воде,
месят,
гранулируют во влажном виде и высушивают. Гранулят, остаток кукурузного крахмала и стеарат магния просеивают и смешивают между собой. Из смеси прессуют таблетки подходящего веса и формы.
Б) Таблетки - на таблетку
Действующее вещество - 80 мг
Молочный сахар - 55 мг
Кукурузный крахмал - 190 мг
Микрокристаллическая целлюлоза - 35 мг
Поливинилпирролидон - 15 мг
Натрий карбоксиметил крахмал - 23 мг
Стеарат марния - 2 мг - 400 мг
Тонкоразмолотые действующее вещество, часть кукурузного крахмала, молочный
сахар, микрокристаллическую целлюлозу и поливинилпирролидон перемешивают между собой, смесь просеивают и с остатками крахмала и водой перерабатывают в гранулят, который высушивают и просеивают. К
этому добавляют натрийкарбоксиметильный крахмал и стеарат магния, пеpемешивают и из этой смеси прессуют таблетки подходящей величины.
В) Ампульные растворы
Действующее
вещество - 50 мг
Хлорид натрия - 50 мг
Aqua на инъекцию - 5 ml
Действующее вещество растворяют при собственном рН или, при необходимости, при рН 5,5 до 6,5, в воде и
добавляют хлорид натрия в качестве изотонанта, полученный раствор фильтруют в отсутствии пирогенов и фильтрат при асептических условиях заливают в ампулы, которые затем стерилизуют и заплавляют.
Ампулы содержат 5 мг, 25 мг и 50 мг действующего вещества.
Реферат
Изобретение относится к новым производным оксадиазола общей формулы I, в которой Х и Y означают кислород или азот, причем Х и Y не могут быть одновременно кислородом или азотом; Z означает радикал формулы II, R1 означает фенильный радикал, который при необходимости замещен напрямую или через алкиленовые мостики с числом атомов углерода от 1 до 4 однократно, двухкратно или трехкратно одним или несколькими заместителями из ряда галоген, С1-С4-алкил, СF3, -NR5R6, NO2, -OR7. Производные оксадиазола общей формулы I могут быть использованы в качестве лекарств при невродегенеративных заболеваниях и ишемии мозга различного происхождения. К ним относятся, например, эпилепсия, гипоклемия, гипоксия, аноксия, травма мозга, отек мозга, амиотропный латеральный склероз, болезнь Хантингтона, болезнь Альцгеймера. 7 з.п. ф-лы, 6 табл.
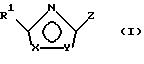
Формула
в которой X и Y означают кислород или азот, причем X и Y не могут быть одновременно кислородом или азотом;
Z означает радикал формулы
в которых S1 и S2 означают радикалы формулы
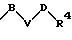
в которой V означает кислород, серу;
В и D означают одинаковые или различные C1-С10-алкиленовые мостики, которые могут быть однократно или многократно замещены такими заместителями, как = О, 1,3-диоксолан или 1,3-диоксан;
S1 и S2 означают радикалы формулы
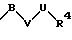
в которой V и В имеют вышеприведенные значения;
а U означает С3-С6-циклоалкильную группу или С6-С10-арильную группу, которые соответственно могут быть однократно или многократно замещены С1-С4-алкилом, -NR5R6;
S1 и S2 означают радикалы формулы
в которой В и D имеют вышеприведенные значения и обе группы D и оба радикала R4 могут быть одинаковыми или различными;
S1 и S2 означают радикалы формулы
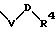
причем V и D имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
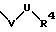
причем V и U имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
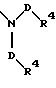
причем D имеет вышеприведенные значения и обе группы D и оба радикала R4 могут быть одинаковыми или различными;
S1 и S2 означают радикалы формулы
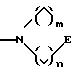
в которой E означает NR7 (n, m= 2 или 3 и n+m>2);
S1 и S2 означают радикалы формулы
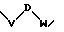
в которой V и D имеют вышеприведенные значения и W означает радикал формулы
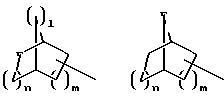
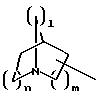
при необходимости, замещенный С1-С4-алкилом, в которых E означает NR7, а n, m, l= 0, 1 или 2, или W означает подсоединенный через атом углерода 5, 6-членный гетероцикл, содержащий один или несколько гетероатомов из ряда азот, кислород, который при необходимости может быть замещен бензилом или С1-С4-алкилом;
S1 и S2 означают радикалы формулы
-V-W,
в которой V и W имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
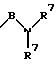
в которой В имеет вышеприведенные значения и оба заместителя R7 могут быть одинаковыми или различными;
S1 и S2 означают радикалы формулы
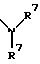
в которой оба заместителя R7 могут быть одинаковыми или различными;
S3 и S4 означают радикалы формулы
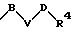
в которой В, V и D имеют вышеприведенные значения;
S3 и S4 означают радикалы формулы
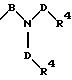
в которой В и D имеют вышеприведенные значения и обе группы D и оба заместителя R4 могут быть как одинаковыми, так и различными;
S3 и S4 означают радикалы формулы
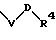
в которой V и D имеют вышеприведенные значения;
S3 и S4 означают радикалы формулы
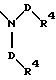
в которой D имеет вышеприведенные значения и обе группы D и оба заместителя R4 могут быть как одинаковыми, так и различными;
Q означает конденсированный, однократно ненасыщенный 5-членный цикл, который может содержать один или несколько гетероатомов из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает фенильный радикал, который, при необходимости, замещен напрямую или через алкиленовые мостики с числом атомов углерода от 1 до 4 однократно, двухкратно или трехкратно одним или несколькими заместителями из ряда галоген, С1-С4-алкил, -CF3, -NR5R6, -NO2, -OR7 или заместителем формулы
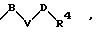
в которой В, V или D имеют вышеприведенные значения;
R1 означает фенил, который замещен заместителем формулы
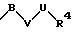
в которой В, V, U имеют вышеприведенные значения;
R1 означает фенил, который замещен заместителем формулы
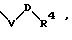
в которой V и D имеют вышеприведенные значения;
R1 означает фенил-С1-С6-алкил, предпочтительно, фенил-С1-С4-алкил, фенил-С2-С6-алкенил;
R1 означает радикал формулы М-, причем М - это 5,6-членный гетероцикл, присоединенный через С- или N-атом, который содержит один гетероатом из ряда азот, кислород или сера;
R1 означает С3-С7-циклоалкильный радикал,
R1 означает, при необходимости замещенный С1-С4 -алкилом, предпочтительно метилом, норборнановый, норборненовый радикалы, предпочтительно адамантан или норадамантан радикалы;
R1 означает при необходимости замещенный радикал формулы
R2 и R3 означают одинаковые или различные радикалы такие, как водород, галоген, -OR7, С1-С10-алкил;
R4 означает амин формулы -NR5R6;
R4 означает N-оксид формулы
R5 означает водород, С1-С10-алкил;
R6 означает водород, C1-С10-алкил;
R6 означает С6-С10-арил, предпочтительно фенил;
R7 означает водород, С1 -С4-алкил,
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров или их смесей, а также, при необходимости, их фармакологически безопасных солей с кислотами.
Z означает радикал формулы
в которой S1 и S2 означают радикалы формулы
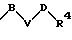
в которой V означает кислород, серу, В и D означают одинаковые или различные С1-С4-алкиленовые мостики, которые могут быть замещены такими заместителями, как = O;
S1 и S2 означают радикалы формулы
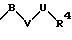
в которой V и В имеют вышеприведенное значение, a U означает С3-С6-циклоалкильную или С6-С10-арильную группы, которые могут быть замещены такими заместителями, как С1-С4-алкил, -NR5R6;
S1 и S2 означают радикалы формулы
в которой В и D имеют вышеприведенные значения и обе группы D, а также оба радикала R4 могут быть как одинаковыми, так и различными;
S1 и S2 означают радикалы формулы
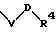
в которой V и D имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
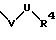
в которой V и U имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
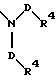
в которой D имеет вышеприведенное значение и обе группы D, а также оба радикала R4 могут быть как одинаковыми, так и различными;
S1 и S2 означают радикалы формулы
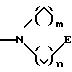
в которой E означает NR7 (n, m= 2 или 3 и n+m>2);
S1 и S2 означают радикалы формулы
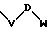
в которой V и D имеют вышеприведенные значения, a W означает радикал формулы
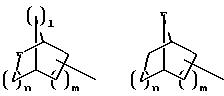
при необходимости, замещенный, С1-С4-алкилом, в котором E означает NR7, n, m, l= 0, 1 или 2, или W означает присоединенный через атом углерода 5,6-членный гетероцикл, содержащий один или несколько гетероатомов из ряда азот, кислород, который, при необходимости, может быть замещен бензилом или С1-С4-алкилом;
S1 и S2 означают радикалы формулы
-V-W,
в которых V и W имеют вышеприведенные значения;
S1 и S2 означают радикалы формулы
в которой В имеет вышеприведенные значения и заместители R7 могут быть как одинаковыми, так и различными;
S1 и S2 означают радикалы формулы
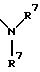
в которой заместители R7 могут быть как одинаковыми, так и различными;
S3 и S4 означают радикалы формулы
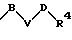
в которой В, V и D имеют вышеприведенные значения;
S3 и S4 означают радикалы формулы
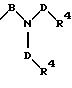
в которой В и D имеют вышеприведенные значения и обе группы D, а также оба заместителя R4 могут быть как одинаковыми, так и различными;
S3 и S4 означают радикалы формулы
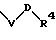
в которой V и D имеют вышеприведенные значения;
S3 и S4 означают радикалы формулы
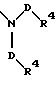
в которой D имеет вышеприведенные значения и обе группы D, а также оба заместителя R4 могут быть одинаковыми или различными;
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, содержащий один или несколько гетероатомов из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает фенильный радикал, который, при необходимости, однократно или многократно замещен одним или несколькими заместителями, такими, как галоген, предпочтительно фтор, хлор или бром, С1-С4-алкильный радикал, -CF3, -NR5R6, -NO2, -OR7, или одним радикалом формулы
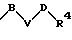
в которой В, V и D имеют вышеприведенные значения;
R1 означает фенильный радикал, который может быть замещен заместителем формулы
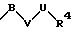
в которой В, V и U имеют вышеприведенные значения;
R1 означает фенильный радикал, который замещен заместителем формулы
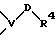
в которой V и D имеют вышеприведенные значения;
R1 означает фенил-С1-С4-алкил, предпочтительно бензил, фенил-С2-С4-алкенил;
R1 означает радикал формулы М-, причем М - это 5 или 6-членный гетероцикл, присоединенный через С- или N-атом, который содержит один гетероатом из ряда азот, кислород или сера;
R1 означает С3-С7-циклоалкил, предпочтительно циклопропил или циклопентил;
R1 означает, при необходимости, замещенный С1-С4-алкилом, предпочтительно метилом, норборнан-, норборнен-радикалы, предпочтительно адамантан- или норадамантан-радикалы;
R1 означает, при необходимости, однократно или многократно замещенный галогеном, гидроксигруппой или метоксигруппой радикал формулы
R2 и R3 означают одинаковые или различные радикалы, такие, как водород, гидроксигруппа, галоген, предпочтительно фтор, хлор или бром, C1-C4-алкилоксигруппа, предпочтительно метилоксигруппа, С1-С4-алкил;
R4 означает -NR5R6,
R4 означает N-оксид с формулой,
R5 означает водород, С1-С4 -алкил;
R6 означает водород, С1-С4-алкил;
R6 означает фенильный радикал;
R7 означает водород, С1-С4-алкил,
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, а также, при необходимости, их фармакологически безопасных солей с кислотами.
в которой S1 означает радикал формулы
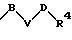
в которой V означает кислород, серу и В и D означают одинаковые или различные С1-С4 -алкиленовые мостики, которые могут быть замещены такими заместителями, как = O;
S1 означает радикал формулы
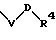
в которой V и D имеют вышеприведенные значения;
S1 означает радикал формулы
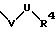
в которой V имеет вышеприведенные значения и U означает С3-С6-циклоалкильную или фенильную группы, которые могут быть замещены С1-С4-алкилом;
S1 означает радикал формулы
в которой В и D имеют вышеприведенные значения и обе группы D, а также оба заместителя R4 одинаковы или различны;
S1 означает радикал формулы
в которой D имеет вышеприведенные значения и обе группы D, а также оба заместителя R4 одинаковы или различны;
S1 означает радикал формулы
в которой E означает NR7 (n, m= 2 или 3 и n+m>2);
S1 означает радикал формулы
в которой V и D имеют вышеприведенные значения, а W означает радикал формулы
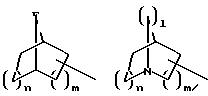
при необходимости замещенный С1-С4-алкилом, в котором E означает NR7, n, m, l= 0, 1 или 2, или W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, который содержит один или несколько гетероатомов из ряда азот, кислород и который, при необходимости, замещен бензилом или C1-C4-алкилом;
S1 означает радикал формулы
-V-W,
в которой V и W имеют вышеприведенные значения;
S2 означает радикал формулы
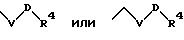
в которой V и D имеют вышеприведенные значения;
S4 означает радикал формулы
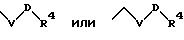
в которой V и D имеют вышеприведенные значения;
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, содержащий один или несколько гетероатомов из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает бензильный или фенильный радикал, причем последний может быть однократно или многократно замещен одним или несколькими заместителями, такими, как фтор, хлор или бром, -С1-С4-алкил, -CF3, -NMe2, -NЕt2, -NO2 или -ОR7;
R1 означает фенильный радикал, замещенный радикалом формулы
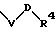
в которой V означает кислород и D означает С1-С4-алкильный мостик;
R1 означает 5- или 6-членный гетероцикл, присоединенный через атом углерода или азота, который содержит один гетероатом из ряда азот, кислород или сера;
R1 означает циклопропил, циклопентил или циклогексил;
R1 означает норборнан, норборнен, адамантан или норадамантан, при необходимости, замещенные метильной группой;
R1 означает радикал формулы
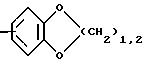
R1 означает -СН= СН-фенил;
R2 означает водород, фтор, хлор, бром, С1-С4-алкилоксигруппу, С1-С4-алкил или гидроксигруппу;
R3 означает водород;
R4 означает -NR5R6;
R4 означает N-оксид формулы
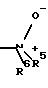
R5 означает водород, С1-С3-алкил;
R6 означает водород, C1-С3-алкил, бензил или фенил;
R7 означает водород, С1-С4-алкил,
при необходимости, в форме их рацематов, их энантиомеров, в форме стереомеров или их смесей, а также, при необходимости, их фармакологически безопасных солей с кислотами.
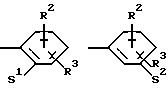
в которой S1 означает радикал формулы
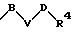
в которой V означает кислород, серу, В означает -СН2- и D означает одну из групп -СН2-, -СН2-СН2-, -СН2-СН2-СН2-, -СН2-С(СН3)Н-, -СН2-СО-, -СН2-СН2-СО-;
S1 означает радикал формулы
в которой V и D имеют вышеприведенные значения;
S1 означает радикалы пиперазин-1-ил, 4-метилпиперазин-1-ил;
S1 означает радикал формулы
в которой V и D имеют вышеприведенные значения, a W означает радикал формулы
при необходимости, замещенный С1-С4-алкильной группой или
W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, содержащий азот, который, при необходимости, замещен бензилом или С1-С4-алкилом;
S1 означает радикал формулы
-V-W,
в которой V и W имеют вышеприведенные значения;
S2 означает радикал формулы
-(CH2)0,1-O-(CH2)2,3-R4,
Q означает конденсированный, однократно ненасыщенный 5-членный цикл, который может содержать один гетероатом из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает радикалы, циклопропил, циклопентил, бензил или фенил, причем последний может быть однократно или многократно замещен одним или несколькими заместителями, такими, как фтор, хлор, бром, С1-С4-алкил, -CF3, -NMe2, -NO2 или -OR7;
R1 означает фенил, замещенный радикалом формулы
-O-(CH2 )2,3-R4,
R1 означает фуран, тиофен, пиридин или пиррол;
R1 означает норборнан, норборнен, адамантан или норадамантан;
R1 означает -СН= СН-фенил;
R2 означает водород, фтор, хлор, бром, С1-С4-алкилоксигруппу, С1-С4-алкил или гидроксигруппу;
R3 означает водород;
R4 означает -NR5R6 или N-оксид формулы
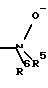
R5 означает водород, С1-С3-алкил;
R6 означает водород, С1-С3-алкил, бензил или фенил;
R7 означает водород, метил, этил, пропил, изопропил, бутил, трет-бутил,
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, а также, при необходимости, их фармакологически безопасных солей с кислотами.
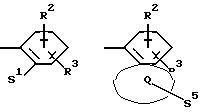
в которой S1 означает радикал формулы
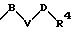
в которой V означает кислород, серу, В означает -СН2- и D означает одну из групп -СН2-, -СН2-СН2-, -СН2-СН2-СН2-, -СН2-С(СН3)Н-, -СН2-СО-, -СН2-СН2-СО-;
S1 означает радикал формулы
в которой V и D имеют вышеприведенные значения;
S1 означает радикалы пиперазин-1-ил, 4-метилпиперазин-1-ил;
S1 означает радикал формулы
в которой V и D имеют вышеприведенные значения и W означает радикал с формулой
при необходимости, замещенный С1-С4-алкильной группой, или W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, содержащий азот, который может быть, при необходимости, замещен бензилом или С1-С4-алкилом;
S1 означает радикал формулы
-V-W,
в которой V и W имеют вышеприведенные значения;
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, который содержит один гетероатом из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает радикалы циклопропил, циклопентил или фенил, причем фенильный цикл может быть однократно или многократно замещен одним или несколькими заместителями, такими, как фтор, хлор, бром, С1-С4-алкильный радикал, -CF3, -NMe2, -NO2 или -OR7;
R1 означает фуран, тиофен, пиридин или пиррол;
R1 означает норборнан, норборнен, адамантан или норадамантан;
R1 означает -СН= СН-фенил;
R2 означает водород, фтор, хлор, бром, С1-С4-алкилоксигруппу, С1-С4-алкил или гидроксигруппу;
R3 означает водород;
R4 означает -NR5R6 или N-оксид формулы
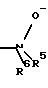
R5 означает водород, C1-С3-алкил;
R6 означает водород, C1-С3-алкил, бензил или фенил;
R7 означает водород, метил, этил, пропил, изопропил, бутил, трет-бутил,
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, а также, при необходимости, их фармакологически безопасных солей с кислотами.
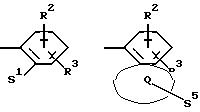
в которой S1 означает радикал формулы
в которой V означает кислород, серу и D означает одну из групп -СН2-, -СН2-СН2-, -СН2-СН2-СН2-, -СН2-С(СН3)Н-, -СН2-СО-, -СН2 -СН2-СО-;
S1 означает радикалы пиперазин-1-ил, 4-метилпиперазин-1-ил;
S1 означает радикал формулы
в которой V и D имеют вышеприведенные значения и W означает радикал формулы
или W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, содержащий азот, который при необходимости, замещен метильной группой;
S1 означает радикал формулы
-V-W,
в которой V и W имеют вышеприведенные значения;
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, который содержит один гетероатом из ряда кислород;
S5 означает радикал формулы
-D-R4,
в которой D имеет вышеприведенные значения;
R1 означает фенильный радикал, который при необходимости, однократно или многократно замещен одним или несколькими заместителями такими, как фтор, хлор, бром, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, -СF3 или -OR7;
R1 означает фуран, тиофен или пиридин;
R2 означает водород, фтор, хлор, бром, метил, метилоксигруппу или гидроксигруппу;
R3 означает водород;
R4 означает -NR5R6 или N-оксид с формулой
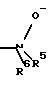
R5 означает водород, метил, этил, н-пропил, изопропил;
R6 означает водород, метил, этил, н-пропил, изопропил, бензил или фенил;
R7 означает водород, метил или этил,
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, при необходимости, их фармакологически безопасных солей с кислотами.
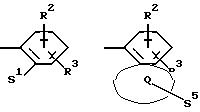
в которой S1 означает радикал формулы
в которой V означает кислород и D означает одну из групп -СН2-, -СН2-СН2-, -СН2-С(СН3)Н-, -СН2-СН2-СО-;
S1 означает радикалы N-пиперазинил;
S1 означает радикал формулы
в которой V и D имеют вышеприведенные значения, a W означает радикал формулы
или W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, содержащий азот, при необходимости замещенный метильной группой;
S1 означает радикал формулы
-V-W,
в которой V и W имеют вышеприведенные значения;
Q означает конденсированный, однократно ненасыщенный 5-членный гетероцикл, содержащий в качестве гетероатома кислород;
S5 означает радикал формулы
-D-R4,
в котором D имеет вышеприведенные значения;
R1 означает фенильный радикал, который может быть однократно или многократно замещен одним или несколькими заместителями, такими, как фтор, хлор, бром, метильный радикал, -CF3, гидроксигруппа, метилоксигруппа или этилоксигруппа;
R1 означает фуран, тиофен или пиридин;
R2 означает водород, фтор, хлор или метил;
R3 означает водород;
R4 означает -NR5R6;
R5 означает водород, метил, этил, н-пропил, изопропил;
R6 означает водород, метил, этил, н-пропил, изопропил, бензил или фенил,
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров и их смесей, при необходимости, их фармакологически безопасных солей с кислотами.
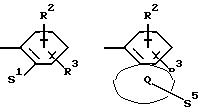
в которой S1 означает один из радикалов -O-CH2-CH2-R4, -O-CH2-C(CH3 )H-R4, -O-C(CH3)H-CH2-R4 или -CH2-CH2-CO-R4;
S1 означает один из радикалов -O-CH2-W или -O-W, в которых W означает присоединенный через атом углерода 5- или 6-членный гетероцикл, включающий атом азота, который, при необходимости, замещен метильной группой;
Q означает конденсированный, однократно 5-членный гетероцикл, содержащий в качестве гетероатома кислород;
S5 означает радикал формулы -CH-R4;
R1 означает фенильный радикал, который может быть однократно или многократно замещен одним или несколькими заместителями, такими, как фтор, хлор, бром, метил, -CF3, гидроксигруппа, метилоксигруппа или этилоксигруппа;
R1 означает тиофен;
R2 означает водород, фтор, хлор или метил;
R3 означает водород;
R4 означает -NR5R6 ;
R5 означает водород, метил, этил, изопропил;
R6 означает водород, метил, этил, изопропил, бензил или фенил,
при необходимости, в форме их рацематов, их энантиомеров, в форме их диастереомеров или их смесей, при необходимости, их фармакологически безопасных солей с кислотами.

Комментарии