Новые физиологически активные вещества - RU2338741C2
Код документа: RU2338741C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к 12-членному циклическому макролидному соединению, полезному в качестве лекарственного средства, способу его получения и его применению.
Предпосылки создания изобретения
Соединения, обладающие цитотоксичностью, уже используют в качестве противоопухолевых средств, и проводится много исследований методом скрининга с использованием цитотоксичности в качестве показателя. Результаты показывают, что, поскольку большинство уже существующих противоопухолевых средств оказывает влияние на опухолевые клетки и одновременно на нормальные ткани с активной пролиферацией клеток, например, на костный мозг и кишечный эпителий, улучшение QOL пациентов еще в достаточной мере не обеспечено.
Кроме того, при существующих обстоятельствах бывает, что противоопухолевые средства оказывают достаточно полезный эффект при лечении лейкоза, но совсем не обязательно, что они эффективны для лечения солидной злокачественной опухоли. Поэтому существует большая потребность в противоопухолевых средствах, эффективных по отношению к солидной опухоли и в высокой степени безопасных.
Уже проводились исследования методом скрининга продуктов ферментации микроорганизмов в основном с использованием цитотоксичности in vitro в качестве показателя, с тем, чтобы использовать их в качестве противоопухолевых средств. В результате было найдено много цитотоксических соединений. Однако, как оказалось, большинство из указанных соединений проявляет цитотоксическую активность только in vitro, и было найдено немного соединений, проявляющих противоопухолевую активность in vivo. Кроме того, совсем немного соединений проявляют эффективность в отношении солидных злокачественных опухолей.
Раскрытие сущности изобретения
Целью настоящего изобретения является создание соединений, проявляющих противоопухолевую активность не только in vitro, но и in vivo и обладающих противоопухолевой активностью по отношению к солидным злокачественным опухолям, из продуктов ферментации микроорганизма или их производных.
Считается, что онкогенез нормальных клеток вызывают мутации гена в клетке, в результате чего экспрессируется анормальный ген. В данной ситуации авторами настоящего изобретения были проведены обширные исследования на основе предположения, что изменение экспрессии гена в опухолевых клетках может вызвать ингибирование пролиферации опухолевых клеток, то есть пролиферацию опухолевых клеток можно ингибировать, например, изменяя ген онкогена или гена-супрессора опухоли или изменяя экспрессию гена, участвующего в клеточном цикле. Авторы изобретения провели скрининг ферментационных продуктов различных микроорганизмов и их производных с использованием в качестве показателя продукции VEGF (сосудистый эндотелиальный фактор роста) клетками U251 в условиях гипоксической стимуляции, ожидая, что соединения, изменяющие экспрессию гена, в частности соединения, которые ингибируют продукцию VEGF в условиях слабой гипоксии, будут подавлять вызываемый опухолями ангиогенез и, кроме того, проявлять противоопухолевую активность по отношению к солидным злокачественным опухолям. В результате авторы настоящего изобретения открыли новые физиологически активные вещества, 12-членное циклическое макролидное соединение под названием 11107 и его аналоги, которые ингибируют продукцию VEGF в условиях слабой гипоксии in vitro и, кроме того, ингибируют пролиферацию клеток солидных опухолевых in vivo.
В результате дальнейших обширных исследований авторы настоящего изобретения обнаружили, что среди аналогов 11107 соединение 6-дезокси 11107D, в котором гидроксильная группа соединения 11107D в положении 6 заменена водородом, и соединения, полученные химической модификацией 6-дезокси 11107D (далее их называют как «производные 6-дезокси 11107D»), устойчивы в водном растворе и что указанные производные не только наследуют характеристики стабильности от 11107D, но и сильнее ингибируют пролиферацию клеток солидных опухолей в экспериментах in vivo. На основе указанных находок и было создано настоящее изобретение.
В качестве родственного известного соединения, наиболее структурно подобного соединению по настоящему изобретению, является FD-895, которое представляет собой 12-членное циклическое макролидное соединение (JP-A-04-352783), представленное формулой (XIV):

В указанной выше публикации раскрыто, что FD-895 обладает цитотоксической активностью in vitro против клеток Р388 мышиного лейкоза, клеток L-1210 мышиного лейкоза и клеток HL-60 человеческого лейкоза в питательной среде RPM-1640 (колонка № 6, таблица 2 указанной публикации). Однако есть сообщение, что FD-895 не проявляет противоопухолевой активности в эксперименте in vivo с использованием клеток Р388 мышиного лейкоза (Seki-Asano M. et al., J. Antibiotics, 47, 1395-1401, 1994).
Кроме того, как описано позднее, поскольку FD-895 неустойчиво в водном растворе, ожидается, что оно непригодно для смешивания с инфузионным раствором при введении. Таким образом, FD-895 не обладает достаточными для противоопухолевого средства свойствами.
Поэтому в соответствии с настоящим изобретением предлагаются:
1. Соединение, представленное формулой (I):

где W представляет собой

и R3, R7, R16, R17, R20, R21 и R21', одинаковые или различные, независимо представляют собой
1) атом водорода,
2) гидроксильную группу или оксогруппу, при условии, что оксогруппа ограничена оксогруппой, образованной R3 или R7 вместе с атомом углерода, к которому присоединена группа R3 или R7, и оксогруппой, образованной группами R21 и R21' вместе с атомом углерода, к которому присоединены R21 и R21',
3) С1-С22алкоксигруппу, которая может иметь заместитель,
4) ненасыщенную С2-22алкоксигруппу, которая может иметь заместитель,
5) С7-С22аралкилоксигруппу, которая может иметь заместитель,
6) 5-14-членную гетероаралкилоксигруппу, которая может иметь заместитель,
7) RC(=Y)-O-, где Y представляет собой атом кислорода или атом серы и R представляет собой
а) атом водорода,
b) С1-С22алкильную группу, которая может иметь заместитель,
с) ненасыщенную С2-С22алкильную группу, которая может иметь заместитель,
d) С6-С14арильную группу, которая может иметь заместитель,
е) 5-14-членную гетероарильную группу, которая может иметь заместитель,
f) С7-С22аралкильную группу, которая может иметь заместитель,
g) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
h) С1-С22алкоксигруппу, которая может иметь заместитель,
i) ненасыщенную С2-С22алкоксигруппу, которая может иметь заместитель,
j) С6-С14арилоксигруппу, которая может иметь заместитель,
k) С3-С14циклоалкильную группу, которая может иметь заместитель,
l) 3-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель, или
m) 5-14-членную гетероарилоксигруппу, которая может иметь заместитель,
8) RS1RS2RS3SiO-, где RS1, RS2 и RS3, одинаковые или различные, независимо представляют собой
а) С1-С6алкильную группу или
b) С6-С14арильную группу,
9) атом галогена,
10) RN1RN2N-RМ-, где RМ представляет собой
а) одинарную связь,
b) -СО-О-,
с) -SO2-O-,
d) -CS-O- или
е) -СО-NRN3-, где RN3 представляет собой атом водорода или С1-С6алкильную группу, которая может иметь заместитель, при условии, что крайняя левая связь в b)-e) присоединена к атому азота,
RN1 и RN2, одинаковые или различные, независимо представляют собой
а) атом водорода,
b) С1-С22алкильную группу, которая может иметь заместитель,
с) ненасыщенную С2-С22алкильную группу, которая может иметь заместитель,
d) алифатическую С2-С22ацильную группу, которая может иметь заместитель,
е) ароматическую С7-С15ацильную группу, которая может иметь заместитель,
f) С6-С14арильную группу, которая может иметь заместитель,
g) 5-14-членную гетероарильную группу, которая может иметь заместитель,
h) С7-С22аралкильную группу, которая может иметь заместитель,
i) С1-С22алкилсульфонильную группу, которая может иметь заместитель,
j) С6-С14арилсульфонильную группу, которая может иметь заместитель,
k) 3-14-членную неароматическую гетероциклическую группу, образованную RN1 и RN2 вместе с атомом азота, к которому присоединены RN1 и RN2, причем 3-14-членная неароматическая гетероциклическая группа может иметь заместитель,
l) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
m) С3-С14циклоалкильную группу, которая может иметь заместитель, или
n) 3-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
11) RN4SO2-O-, где RN4 представляет собой
а) С1-С22алкильную группу, которая может иметь заместитель,
b) С6-С14арильную группу, которая может иметь заместитель,
с) С1-С22алкоксигруппу, которая может иметь заместитель,
d) ненасыщенную С2-С22алкоксигруппу, которая может иметь заместитель,
е) С6-С14арилоксигруппу, которая может иметь заместитель,
f) 5-14-членную гетероарилоксигруппу, которая может иметь заместитель,
g) С7-С22аралкилоксигруппу, которая может иметь заместитель, или
h) 5-14-членную гетероаралкилоксигруппу, которая может иметь заместитель,
12) (RN5О)2РО-О-, где RN5 представляет собой
а) С1-С22алкильную группу, которая может иметь заместитель,
b) ненасыщенную С2-С22алкильную группу, которая может иметь заместитель,
с) С6-С14арильную группу, которая может иметь заместитель,
d) 5-14-членную гетероарильную группу, которая может иметь заместитель,
е) С7-С22аралкильную группу, которая может иметь заместитель, или
f) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
13) (RN1RN2N)2РО-О-, где RN1 и RN2 являются такими же, как определено выше, или
14) (RN1RN2N)(RN5О)РО-О-, где RN1, RN2 и RN5 являются такими же, как определено выше,
его фармакологически приемлемая соль или их гидрат;
2. Соединение, в соответствии с 1, представленное формулой (I-а):

где W является таким, как определено выше, и R3а, R7а, R16а, R17а, R20а, R21а и R21а', одинаковые или различные, независимо представляют собой
1) атом водорода,
2) гидроксильную группу или оксогруппу, при условии, что оксогруппа ограничена оксогруппой, образованной R3а или R7а вместе с атомом углерода, к которому присоединена группа R3а или R7а, и оксогруппой, образованной группами R21а и R21а' вместе с атомом углерода, к которому присоединены R21а и R21а',
3) С1-С22алкоксигруппу, которая может иметь заместитель,
4) RаC(=Yа)-O-, где Yа представляет собой атом кислорода или атом серы и Rа представляет собой
а) атом водорода,
b) С1-С22алкильную группу, которая может иметь заместитель,
с) ненасыщенную С2-С22алкильную группу, которая может иметь заместитель,
d) С6-С14арильную группу, которая может иметь заместитель,
е) 5-14-членную гетероарильную группу, которая может иметь заместитель,
f) С7-С22аралкильную группу, которая может иметь заместитель,
g) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
h) С1-С22алкоксигруппу, которая может иметь заместитель,
i) ненасыщенную С2-С22алкоксигруппу, которая может иметь заместитель,
j) С6-С14арилоксигруппу, которая может иметь заместитель,
k) С3-С14циклоалкильную группу, которая может иметь заместитель,
l) 3-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель, или
m) 5-14-членную гетероарилоксигруппу, которая может иметь заместитель,
5) RaS1RaS2RaS3SiO-, где RaS1, RaS2 и RaS3, одинаковые или различные, независимо представляют собой
а) С1-С6алкильную группу или
b) С6-С14арильную группу, или
6) RaN1RaN2N-RaM-, где RaM представляет собой
а) -СО-О- или
b) -CS-O-, при условии, что крайняя левая связь в а) или b) присоединена к атому азота, и
RaN1 и RaN2, одинаковые или различные, независимо представляют собой
а) атом водорода,
b) С1-С22алкильную группу, которая может иметь заместитель,
с) ненасыщенную С2-С22алкильную группу, которая может иметь заместитель,
d) алифатическую С2-С22ацильную группу, которая может иметь заместитель,
е) ароматическую С7-С15ацильную группу, которая может иметь заместитель,
f) С6-С14арильную группу, которая может иметь заместитель,
g) 5-14-членную гетероарильную группу, которая может иметь заместитель,
h) С7-С22аралкильную группу, которая может иметь заместитель,
i) С1-С22алкилсульфонильную группу, которая может иметь заместитель,
j) С6-С14арилсульфонильную группу, которая может иметь заместитель,
k) 3-14-членную неароматическую гетероциклическую группу, образованную RaN1 и RaN2 вместе с атомом азота, к которому присоединены RaN1 и RaN2, причем 3-14-членная неароматическая гетероциклическая группа может иметь заместитель,
l) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
m) С3-С14циклоалкильную группу, которая может иметь заместитель, или
n) 3-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
3. Соединение в соответствии с 1, представленное формулой (I-b):

где W является таким, как определено выше, и R3b, R7b, R16b, R17b, R20b, R21b и R21'b, одинаковые или различные, независимо представляют собой
1) атом водорода,
2) гидроксильную группу или оксогруппу, при условии, что оксогруппа ограничена оксогруппой, образованной R3b или R7b вместе с атомом углерода, к которому присоединена группа R3b или R7b, и оксогруппой, образованной группами R21b и R21b' вместе с атомом углерода, к которому присоединены R21а и R21b',
3) С1-С22алкоксигруппу, которая может иметь заместитель,
4) RbC(=O)-O-, где Rb представляет собой
а) С1-С22алкильную группу, которая может иметь заместитель,
b) ненасыщенную С2-С22алкильную группу, которая может иметь заместитель,
c) С7-С22аралкильную группу, которая может иметь заместитель,
d) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
e) С6-С14арилоксигруппу, которая может иметь заместитель,
f) С3-С14циклоалкильную группу, которая может иметь заместитель,
g) 3-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
5) RbS1RbS2RbS3SiO-, где RbS1, RbS2 и RbS3, одинаковые или различные, независимо представляют собой
а) С1-С6алкильную группу или
b) С6-С14арильную группу, или
6) RbN1RbN2N-RbM-, где RbM представляет собой
а) -СО-О- или
b) -CS-O-, при условии, что крайняя левая связь в а) или b) присоединена к атому азота, и
RbN1 и RbN2, одинаковые или различные, независимо представляют собой
а) атом водорода,
b) С1-С22алкильную группу, которая может иметь заместитель,
с) 3-14-членную неароматическую гетероциклическую группу, образованную RbN1 и RbN2 вместе с атомом азота, к которому присоединены RbN1 и RbN2, причем 3-14-членная неароматическая гетероциклическая группа может иметь заместитель,
d) С3-С14циклоалкильную группу, которая может иметь заместитель, или
e) 3-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
4. Соединение в соответствии с 1, представленное формулой (I-c):

где W является таким, как определено выше, и R3с, R7с, R16с, R17с, R20с, R21с и R21'с, одинаковые или различные, независимо представляют собой
1) атом водорода,
2) гидроксильную группу или оксогруппу, при условии, что оксогруппа ограничена оксогруппой, образованной R3с или R7с вместе с атомом углерода, к которому присоединена группа R3с или R7с, и оксогруппой, образованной группами R21с и R21с' вместе с атомом углерода, к которому присоединены R21с и R21с',
3) RсC(=O)-O-, где Rс представляет собой С1-С22алкильную группу, которая может иметь заместитель,
4) RсS1RсS2RсS3SiO-, где RсS1, RсS2 и RсS3, одинаковые или различные, независимо представляют собой
а) С1-С6алкильную группу или
b) С6-С14арильную группу, или
5) RсN1RсN2N-RcM-, где RcM представляет собой -СО-О-, при условии, что крайняя левая связь присоединена к атому азота, и
RсN1 и RсN2, одинаковые или различные, независимо представляют собой
а) атом водорода,
b) С1-С22алкильную группу, которая может иметь заместитель,
с) 3-14-членную неароматическую гетероциклическую группу, образованную RсN1 и RсN2 вместе с атомом азота, к которому присоединены RсN1 и RсN2, причем 3-14-членная неароматическая гетероциклическая группа может иметь заместитель,
d) С3-С14циклоалкильную группу, которая может иметь заместитель, или
e) 3-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
5. Соединение в соответствии с 1, представленное формулой (I-d):

где R3d и R16d независимо представляют собой
1) гидроксильную группу,
2) С1-С22алкоксигруппу, которая может иметь заместитель,
3) ненасыщенную С2-С22алкоксигруппу, которая может иметь заместитель,
4) С7-С22аралкилоксигруппу, которая может иметь заместитель,
5) RdC(=O)-O-, где Rd представляет собой
а) атом водорода,
b) С1-С22алкильную группу, которая может иметь заместитель,
с) ненасыщенную С2-С22алкильную группу, которая может иметь заместитель,
d) С6-С14арильную группу, которая может иметь заместитель,
е) 5-14-членную гетероарильную группу, которая может иметь заместитель,
f) С7-С22аралкильную группу, которая может иметь заместитель,
g) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
h) С1-С22алкоксигруппу, которая может иметь заместитель,
i) ненасыщенную С2-С22алкоксигруппу, которая может иметь заместитель,
j) С6-С14арилоксигруппу, которая может иметь заместитель, или
k) 5-14-членную гетероарилоксигруппу, которая может иметь заместитель, или
6) RdN1RdN2N-CO-О-, где RdN1 и RdN2, одинаковые или различные, независимо представляют собой
а) атом водорода,
b) С1-С22алкильную группу, которая может иметь заместитель,
с) ненасыщенную С2-С22алкильную группу, которая может иметь заместитель,
d) С6-С14арильную группу, которая может иметь заместитель,
е) 5-14-членную гетероарильную группу, которая может иметь заместитель,
f) С7-С22аралкильную группу, которая может иметь заместитель,
g) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
h) С3-С14циклоалкильную группу, которая может иметь заместитель,
i) 3-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель, или
j) 3-14-членную неароматическую гетероциклическую группу, образованную RdN1 и RdN2 вместе с атомом азота, к которому присоединены RdN1 и RdN2, причем 3-14-членная неароматическая гетероциклическая группа может иметь заместитель, и
R7d и R21d, одинаковые или различные, независимо представляют собой
1) гидроксильную группу,
2) С1-С22алкоксигруппу, которая может иметь заместитель,
3) ненасыщенную С2-С22алкоксигруппу, которая может иметь заместитель,
4) С7-С22аралкилоксигруппу, которая может иметь заместитель,
5) RdC(=O)-O-, где Rd является таким, как определено выше,
6) RdN1RdN2N-CO-О-, где RdN1 и RdN2 такие, как определено выше,
7) RdN1RdN2N-SO2-О-, где RdN1 и RdN2 такие, как определено выше,
8) RdN1RdN2N-CS-О-, где RdN1 и RdN2 такие, как определено выше,
9) RdN4-SO2-О-, где RdN4 представляет собой
a) С1-С22алкильную группу, которая может иметь заместитель,
b) С6-С14арильную группу, которая может иметь заместитель,
с) С1-С22алкоксигруппу, которая может иметь заместитель,
d) ненасыщенную С2-С22алкоксигруппу, которая может иметь заместитель,
е) С6-С14арилоксигруппу, которая может иметь заместитель,
f) 5-14-членную гетероарилоксигруппу, которая может иметь заместитель,
g) С7-С22аралкилоксигруппу, которая может иметь заместитель, или
h) 5-14-членную гетероаралкилоксигруппу, которая может иметь заместитель,
10) (RdN5О)2РО-О-, где RdN5 представляет собой
а) С1-С22алкильную группу, которая может иметь заместитель,
b) ненасыщенную С2-С22алкильную группу, которая может иметь заместитель,
с) С6-С14арильную группу, которая может иметь заместитель,
d) 5-14-членную гетероарильную группу, которая может иметь заместитель,
е) С7-С22аралкильную группу, которая может иметь заместитель, или
f) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
11) (RdN1RdN2N)2РО-О-, где RdN1 и RdN2 такие, как определено выше, или
12) (RdN1RdN2N)(RdN5О)РО-О-, где RdN1, RdN2 и RdN5 такие, как определено выше,
его фармакологически приемлемая соль или их гидрат;
6. Соединение в соответствии с 1, где R7 и/или R6 независимо представляют собой RC(=Y)-O-, где Y и R, такие как определено выше, или RN1RN2N-RM'-, где RM' представляет собой
а) -СО-О- или
b) -CS-O-, при условии, что крайняя левая связь в a) или b) присоединена к атому азота, и
RN1 и RN2 такие, как определено выше,
его фармакологически приемлемая соль или их гидрат;
7. Соединение в соответствии с 1, представленное формулой (I-е):

где R3е, R16е и R21е, одинаковые или различные, независимо представляют собой
1) гидроксильную группу,
2) С1-С22алкоксигруппу, которая может иметь заместитель,
3) ненасыщенную С2-С22алкоксигруппу, которая может иметь заместитель,
4) С7-С22аралкилоксигруппу, которая может иметь заместитель,
5) алифатическую С2-С6ацильную группу, которая может иметь заместитель, или
6) ReN1ReN2N-CO-O-, где ReN1 и ReN2 независимо представляют собой
а) атом водорода или
b) С1-С6алкильную группу, которая может иметь заместитель, и
R7е представляет собой ReC(=Yе)-O-, где Yе представляет собой атом кислорода или атом серы и Re представляет собой
а) атом водорода,
b) С1-С22алкильную группу, которая может иметь заместитель,
с) С6-С14арильную группу, которая может иметь заместитель,
d) 5-14-членную гетероарильную группу, которая может иметь заместитель,
е) С7-С10аралкильную группу, которая может иметь заместитель,
f) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
g) 3-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
h) группу формулы (III):

где А) n представляет собой целое число от 0 до 4,
Хе представляет собой
i) -CHReN4-,
ii) -NReN5-,
iii) -O-,
iv) -S-,
v) -SO- или
vi) -SO2-,
RеN1 представляет собой
i) атом водорода или
ii) С1-С6алкильную группу, которая может иметь заместитель,
RеN2 представляет собой
i) атом водорода или
ii) С1-С6алкильную группу, которая может иметь заместитель,
RеN3 и ReN4, одинаковые или различные, независимо представляют собой
i) атом водорода,
ii) С1-С6алкильную группу, которая может иметь заместитель,
iii) ненасыщенную С2-С10алкильную группу, которая может иметь заместитель,
iv) С6-С14арильную группу, которая может иметь заместитель,
v) 5-14-членную гетероарильную группу, которая может иметь заместитель,
vi) С7-С10аралкильную группу, которая может иметь заместитель,
vii) С3-С8циклоалкильную группу, которая может иметь заместитель,
viii) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
ix) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
x) 5-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
xi) -NReN6ReN7, где ReN6 и ReN7, одинаковые или различные, независимо представляют собой атом водорода или С1-С6алкильную группу, которая может иметь заместитель, или
xii) 5-14-членную неароматическую гетероциклическую группу, образованную ReN3 и ReN4 вместе с атомом азота, к которому присоединены ReN3 и ReN4, причем 5-14-членная неароматическая гетероциклическая группа может иметь заместитель, и
RеN5 представляет собой
i) атом водорода,
ii) С1-С6алкильную группу, которая может иметь заместитель,
iii) ненасыщенную С2-С10алкильную группу, которая может иметь заместитель,
iv) С6-С14арильную группу, которая может иметь заместитель,
v) 5-14-членную гетероарильную группу, которая может иметь заместитель,
vi) С7-С10аралкильную группу, которая может иметь заместитель,
vii) С3-С8циклоалкильную группу, которая может иметь заместитель,
viii) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
ix) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
x) 5-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель, или
xi) 5-14-членную неароматическую гетероциклическую группу, образованную ReN3 и ReN5 вместе с атомом азота, к которому присоединены ReN3 и ReN5, причем 5-14-членная неароматическая гетероциклическая группа может иметь заместитель,
В) Хе, n, ReN3, ReN4 и ReN5 независимо представляют группу, определенную выше, и ReN1 и ReN2 независимо представляют собой 5-14-членную неароматическую гетероциклическую группу, совместно образованную группами ReN1 и ReN2, причем 5-14-членная неароматическая гетероциклическая группа может иметь заместитель,
С) Хе, n, ReN2, ReN4 и ReN5 независимо представляют собой группу, определенную выше, и ReN1 и ReN3 независимо представляют собой 5-14-членную неароматическую гетероциклическую группу, совместно образованную группами ReN1 и ReN3, причем 5-14-членная неароматическая гетероциклическая группа может иметь заместитель, или
D) Хе, n, ReN1, ReN4 и ReN5 независимо представляют собой группу, определенную выше, и ReN2 и ReN3 независимо представляют собой 5-14-членную неароматическую гетероциклическую группу, совместно образованную группами ReN2 и ReN3, причем 5-14-членная неароматическая гетероциклическая группа может иметь заместитель, или
i) группу формулы (IV):

где RеN8 и ReN9, одинаковые или различные, независимо представляют собой
i) атом водорода,
ii) С1-С6алкильную группу, которая может иметь заместитель,
iii) С6-С14арильную группу, которая может иметь заместитель,
iv) 5-14-членную гетероарильную группу, которая может иметь заместитель,
v) С7-С10аралкильную группу, которая может иметь заместитель, или
vi) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
8. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе1C(=Yе1)-O-, где Yе1 представляет собой атом кислорода или атом серы и Rе1 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) С6-С10арильную группу, которая может иметь заместитель,
4) 5-14-членную гетероарильную группу, которая может иметь заместитель,
5) С7-С10аралкильную группу, которая может иметь заместитель, или
6) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
9. Соединение в соответствии с 7, где R7е и/или R21е представляют собой Rе2C(=Yе2)-O-, где Yе2 представляет собой атом кислорода или атом серы и Rе2 представляет собой группу формулы (III'):

где А) n представляет собой целое число от 0 до 4,
Х1 представляет собой
1) -CHReN13-,
2) -NReN14-,
3) -O-,
4) -S-,
5) -SO- или
6) -SO2-,
RеN10 и RеN11, одинаковые или различные, независимо представляют собой
1) атом водорода или
2) С1-С6алкильную группу, которая может иметь заместитель,
RеN12 и ReN13, одинаковые или различные, независимо представляют собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) ненасыщенную С2-С10алкильную группу, которая может иметь заместитель,
4) С6-С14арильную группу, которая может иметь заместитель,
5) 5-14-членную гетероарильную группу, которая может иметь заместитель,
6) С7-С10аралкильную группу, которая может иметь заместитель,
7) С3-С8циклоалкильную группу, которая может иметь заместитель,
8) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
9) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
10) 5-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
11) -NReN15ReN16, где ReN15 и ReN16, одинаковые или различные, независимо представляют собой атом водорода или С1-С6алкильную группу, которая может иметь заместитель, или
12) 5-14-членную неароматическую гетероциклическую группу, совместно образованную группами ReN12 и ReN13, причем 5-14-членная неароматическая гетероциклическая группа может иметь заместитель, и
RеN14 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) ненасыщенную С2-С10алкильную группу, которая может иметь заместитель,
4) С6-С14арильную группу, которая может иметь заместитель,
5) 5-14-членную гетероарильную группу, которая может иметь заместитель,
6) С7-С10аралкильную группу, которая может иметь заместитель,
7) С3-С8циклоалкильную группу, которая может иметь заместитель,
8) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
9) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
10) 5-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
11) 5-14-членную неароматическую гетероциклическую группу, образованную вместе с атомом азота, к которому присоединена группа ReN14, и одним заместителем, выбранным из группы, состоящей из ReN10, ReN11 и ReN12, причем 5-14-членная неароматическая гетероциклическая группа может иметь заместитель, или
12) 5-14-членную неароматическую гетероциклическую группу, образованную вместе с атомом азота, к которому присоединена группа ReN14, и двумя заместителями, выбранными из группы, состоящей из ReN10, ReN11 и ReN12, причем 5-14-членная неароматическая гетероциклическая группа может иметь заместитель, или
В) n, Х1, ReN11, ReN13 и ReN14 являются такими, как определено выше, и ReN10 и ReN12 совместно образуют 5-14-членную неароматическую гетероциклическую группу, причем 5-14-членная неароматическая гетероциклическая группа может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
10. Соединение в соответствии с 9, где Х1 представляет собой -NRdN14-, где NRdN14 является таким, как определено выше, его фармакологически приемлемая соль или их гидрат;
11. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе3C(=Yе3)-O-, где Yе3 представляет собой атом кислорода или атом серы и Rе3 представляет собой группу формулы (V):

где n1 представляет собой целое число от 0 до 6,
RеN17 представляет собой
1) атом водорода или
2) С1-С6алкильную группу, которая может иметь заместитель, и
RеN18 представляет собой
1) атом водорода,
2) аминогруппу, которая может иметь заместитель,
3) пиридильную группу, которая может иметь заместитель,
4) пирролидин-1-ильную группу, которая может иметь заместитель,
5) пиперидин-1-ильную группу, которая может иметь заместитель,
6) морфолин-4-ильную группу, которая может иметь заместитель, или
7) пиперазин-1-ильную группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
12. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе4CO-O-, где Rе4 представляет собой группу формулы (VI):

где n2 и n3, одинаковые или различные, независимо представляют собой целое число от 0 до 4,
Х2 представляет собой
1) -CHRеN21-,
2) -NRеN22-,
3) -O-,
4) -S-,
5) -SO- или
6) -SO2-,
RеN19 представляет собой
1) атом водорода или
2) С1-С6алкильную группу, которая может иметь заместитель,
RеN20 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) С6-С14арильную группу, которая может иметь заместитель, или
4) С7-С10аралкильную группу, которая может иметь заместитель,
RеN21 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) ненасыщенную С2-С10алкильную группу, которая может иметь заместитель,
4) С6-С14арильную группу, которая может иметь заместитель,
5) 5-14-членную гетероарильную группу, которая может иметь заместитель,
6) С7-С10аралкильную группу, которая может иметь заместитель,
7) С3-С8циклоалкильную группу, которая может иметь заместитель,
8) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
9) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
10) -NRеN23RеN24, где RеN23 и RеN24, одинаковые или различные, независимо представляют собой атом водорода или С1-С6алкильную группу, которая может иметь заместитель, или
11) 5-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель, и
RеN22 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) ненасыщенную С2-С10алкильную группу, которая может иметь заместитель,
4) С6-С14арильную группу, которая может иметь заместитель,
5) 5-14-членную гетероарильную группу, которая может иметь заместитель,
6) С7-С10аралкильную группу, которая может иметь заместитель,
7) С3-С8циклоалкильную группу, которая может иметь заместитель,
8) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
9) 5-14-членную гетероаралкильную группу, которая может иметь заместитель, или
10) 5-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
13. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе5CO-O-, где Rе5 представляет собой группу формулы (VII):
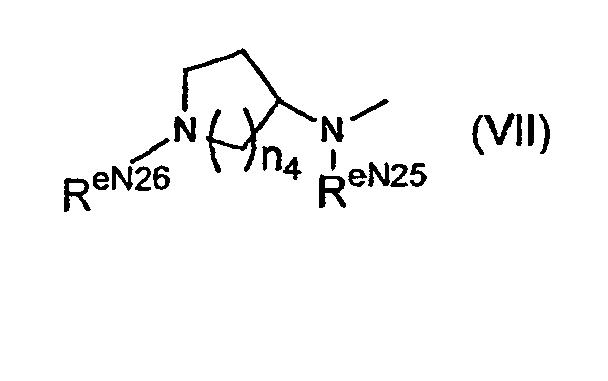
где n4 представляет собой 1 или 2,
RеN25 представляет собой
1) атом водорода или
2) С1-С6алкильную группу, которая может иметь заместитель, и
RеN26 представляет собой
1) атом водорода или
2) С1-С6алкильную группу, которая может иметь заместитель его фармакологически приемлемая соль или их гидрат;
14. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе6CO-O-, где Rе6 представляет собой группу формулы (VIII):

где n2 и n3, одинаковые или различные, независимо представляют собой целое число от 0 до 4,
Х3 представляет собой
1) -CHRеN29-,
2) -NRеN30-,
3) -O-,
4) -S-,
5) -SO- или
6) -SO2-,
RеN27 представляет собой
1) атом водорода или
2) С1-С6алкильную группу, которая может иметь заместитель,
RеN28 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) С6-С14арильную группу, которая может иметь заместитель, или
4) С7-С10аралкильную группу, которая может иметь заместитель,
RеN29 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) ненасыщенную С2-С10алкильную группу, которая может иметь заместитель,
4) С1-С6алкоксигруппу, которая может иметь заместитель,
5) С6-С14арильную группу, которая может иметь заместитель,
6) 5-14-членную гетероарильную группу, которая может иметь заместитель,
7) С7-С10аралкильную группу, которая может иметь заместитель,
8) С3-С8циклоалкильную группу, которая может иметь заместитель,
9) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
10) 5-14-членную гетероаралкильную группу, которая может иметь заместитель,
11) -NRеN31RеN32, где RеN31 и RеN32, одинаковые или различные, независимо представляют собой атом водорода или С1-С6алкильную группу, которая может иметь заместитель, или образуют 5-14-членную неароматическую гетероциклическую группу вместе с атомом азота, к которому RеN31 и RеN32 присоединены, или
12) 5-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель, и
RеN30 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) ненасыщенную С2-С10алкильную группу, которая может иметь заместитель,
4) С6-С14арильную группу, которая может иметь заместитель,
5) 5-14-членную гетероарильную группу, которая может иметь заместитель,
6) С7-С10аралкильную группу, которая может иметь заместитель,
7) С3-С8циклоалкильную группу, которая может иметь заместитель,
8) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
9) 5-14-членную гетероаралкильную группу, которая может иметь заместитель, или
10) 5-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
15. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе7CO-O-, где Rе7 представляет собой группу формулы (IX):

где n5 представляет собой целое число от 1 до 3, и
RеN33 представляет собой
1) аминогруппу,
2) аминогруппу, которая может иметь заместитель,
3) пирролидин-1-ильную группу, которая может иметь заместитель,
4) пиперидин-1-ильную группу, которая может иметь заместитель, или
5) морфолин-4-ильную группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
16. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе8CO-O-, где Rе8 представляет собой группу формулы (Х):

где n5 представляет собой целое число от 1 до 3,
RеN34 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) С6-С14арильную группу, которая может иметь заместитель, или
4) С7-С10аралкильную группу, которая может иметь заместитель,
RеN35 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) С3-С8циклоалкильную группу, которая может иметь заместитель,
4) 3-8-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
5) С6-С14арильную группу, которая может иметь заместитель,
6) 5-14-членную гетероарильную группу, которая может иметь заместитель,
7) С7-С10аралкильную группу, которая может иметь заместитель,
8) 5-14-членную гетероаралкильную группу, которая может иметь заместитель, или
9) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
17. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе9CO-O-, где Rе9 представляет собой группу формулы (XI):

где n5 представляет собой целое число от 1 до 3, и
RеN36 представляет собой
1) атом водорода,
2) С1-С8алкильную группу, которая может иметь заместитель,
3) С3-С6циклоалкильную группу, которая может иметь заместитель,
4) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
5) С7-С10аралкильную группу, которая может иметь заместитель,
6) пиридильную группу, которая может иметь заместитель, или
7) тетрагидропиранильную группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
18. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе10CO-O-, где Rе10 представляет собой группу формулы (XII):

где m1, m2, m3 и m4, одинаковые или различные, независимо представляют собой 0 или 1,
n5 представляет собой целое число от 1 до 3 и
RdN37 представляет собой
1) атом водорода,
2) С1-С6алкильную группу, которая может иметь заместитель,
3) ненасыщенную С2-С10алкильную группу, которая может иметь заместитель,
4) С6-С14арильную группу, которая может иметь заместитель,
5) 5-14-членную гетероарильную группу, которая может иметь заместитель,
6) С7-С10аралкильную группу, которая может иметь заместитель,
7) С3-С8циклоалкильную группу, которая может иметь заместитель,
8) С4-С9циклоалкилалкильную группу, которая может иметь заместитель,
9) 5-14-членную гетероаралкильную группу, которая может иметь заместитель, или
10) 5-14-членную неароматическую гетероциклическую группу, которая может иметь заместитель,
его фармакологически приемлемая соль или их гидрат;
19. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе11CO-O-, где Rе11 представляет собой группу формулы (XIII):

где m5 представляет собой целое число от 1 до 3, и n5 представляет собой 2 или 3,
его фармакологически приемлемая соль или их гидрат;
20. Соединение в соответствии с 7, где R7е и/или R21е независимо представляют собой Rе12CO-O-, где Rе12 представляет собой группу, выбранную из группы, состоящей из:

или группу, выбранную из группы, состоящей из:

причем у обеих групп в кольце может быть заместитель,
его фармакологически приемлемая соль или их гидрат;
21. Соединение в соответствии с 1, где R16 представляет собой гидроксильную группу;
его фармакологически приемлемая соль или их гидрат;
22. Соединение в соответствии с 1, где
[1] W представляет собой

R3 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R16, R17, R20 и R21' представляют собой атом водорода,
[2] W представляет собой

R3 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R16, R17, R20 и R21' представляют собой атом водорода,
[3] W представляет собой

R3, R16 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17, R20 и R21' представляют собой атом водорода,
[4] W представляет собой

R21 и R21' образуют оксогруппу вместе с атомом углерода, к которому R21 и R21' присоединены, R3, R16 и R20 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17 представляет собой атом водорода,
[5] W представляет собой

R3, R16, R20 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17 и R21' представляют собой атом водорода,
[6] W представляет собой

R3, R7, R16 и R21 представляют собой гидроксильную группу, и R17, R20 и R21' представляют собой атом водорода,
[7] W представляет собой

R3, R17, R16 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R20 и R21' представляют собой атом водорода, или
[8] W представляет собой

R21 и R21' образуют оксогруппу вместе с атомом углерода, к которому R21 и R21' присоединены, R3 и R16 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17 и R20 представляет собой атом водорода,
его фармакологически приемлемая соль или их гидрат;
23. Соединение в соответствии с 1, которое представляет собой:
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 18),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 19),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(пиперидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 21),
(8Е,12Е,14Е)-7-((4-этилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 24),
(8Е,12Е,14Е)-7-(N-(3-(N',N'-диметиламино)пропил)-N-метилкарбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 27),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 28),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(1-метилпиперидин-4-ил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 29),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-изопропилгомопиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 39),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-(4-гидроксипеперидин-1-ил)пиперидин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 40),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(морфолин-4-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 42),
(8Е,12Е,14Е)-7-((4-этилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 43),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 44),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-(((1S,4S)-5-изопропил-2,5-диаззабицикло[2.2.1]гептан-2-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 49),
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диметиламино)этил)-N-метилкарбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 50),
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диметиламино)этил)карбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 51) или
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(((1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 55);
24. Соединение в соответствии с п.1, которое представляет собой:
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(1-метилпиперидин-4-ил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 29),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-изопропилгомопиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 39),
(8Е,12Е,14Е)-7-((4-этилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 43),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 44) или
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(((1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 55);
25. Лекарственное средство, содержащее соединение в соответствии с любым из 1-24, его фармакологически приемлемую соль или их гидрат в качестве активного компонента;
26. Фармацевтическая композиция, содержащая соединение в соответствии с любым из 1-24, его фармакологически приемлемую соль или их гидрат в качестве активного компонента;
27. Лекарственное средство в соответствии с 25 в качестве агента для профилактики или лечения заболевания, против которого эффективна регуляция экспрессии гена;
28. Лекарственное средство в соответствии с 25 в качестве агента для профилактики или лечения заболевания, против которого эффективно ингибирование продукции VEGF;
29. Лекарственное средство в соответствии с 25 в качестве агента для профилактики или лечения заболевания, против которого эффективен антиангиогенный эффект;
30. Лекарственное средство в соответствии с 25 в качестве ингибитора ангиогенеза;
31. Лекарственное средство в соответствии с 25 в качестве противоопухолевого агента;
32. Лекарственное средство в соответствии с 25 в качестве терапевтического агента для лечения гемангиомы;
33. Лекарственное средство в соответствии с 25 в качестве ингибитора метастаз рака;
34. Лекарственное средство в соответствии с 25 в качестве терапевтического агента для лечения ретинальной реваскуляризации или диабетической ретинопатии;
35. Лекарственное средство в соответствии с 25 в качестве терапевтического агента для лечения воспалительного заболевания;
36. Лекарственное средство в соответствии с 25 в качестве терапевтического агента для лечения воспалительных заболеваний, состоящих из деформирующего артрита, ревматоидного артрита, псориаза и гиперчувствительности замедленного типа;
37. Лекарственное средство в соответствии с 25 в качестве терапевтического агента для лечения атеросклероза;
38. Лекарственное средство в соответствии с 25 в качестве терапевтического агента для лечения солидной злокачественной опухоли;
39. Лекарственное средство в соответствии с 38, где солидной злокачественной опухолью является рак легкого, опухоль головного мозга, рак молочной железы, рак предстательной железы, рак яичника, рак ободочной кишки или меланома;
40. Лекарственное средство в соответствии с 25 в качестве терапевтического агента для лечения лейкоза;
41. Лекарственное средство в соответствии с 25 в качестве противоопухолевого агента, основанного на регуляции экспрессии гена;
42. Лекарственное средство в соответствии с 25 в качестве противоопухолевого агента, основанного на угнетении продукции VEGF;
43. Лекарственное средство в соответствии с 25 в качестве противоопухолевого агента, основанного на эффекте ингибирования ангиогенеза;
44. Способ профилактики или лечения заболевания, против которого эффективна регуляция экспрессии гена, включающий введение пациенту фармакологически эффективной дозы лекарственного средства в соответствии с 25;
45. Способ профилактики или лечения заболевания, против которого эффективно ингибирование продукции VEGF, включающий введение пациенту фармакологически эффективной дозы лекарственного средства в соответствии с 25;
46. Способ профилактики или лечения заболевания, против которого эффективно ингибирование ангиогенеза, включающий введение пациенту фармакологически эффективной дозы лекарственного средства в соответствии с 25;
47. Применение соединения в соответствии с любым из 1-24, его фармакологически приемлемой соли или их гидрата для изготовления агента для профилактики или лечения заболевания, против которого эффективна регуляция экспрессии гена;
48. Применение соединения в соответствии с любым из 1-24, его фармакологически приемлемой соли или их гидрата для изготовления агента для профилактики или лечения заболевания, против которого эффективно ингибирование продукции VEGF;
49. Применение соединения в соответствии с любым из 1-24, его фармакологически приемлемой соли или их гидрата для изготовления агента для профилактики или лечения заболевания, против которого эффективно ингибирование ангиогенеза;
50. Применение соединения в соответствии с любым из 1-24, его фармакологически приемлемой соли или их гидрата для изготовления агента для профилактики или лечения солидной злокачественной опухоли;
51. Способ получения соединения 6-дезокси 11107, отличающийся тем, что содержит культивирование микроорганизма, принадлежащего к роду Streptomyces, который способен продуцировать соединение формулы (I):

где [1] W представляет собой

R3 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R16, R17, R20 и R21' представляют собой атом водорода, или
[2] W представляет собой

R3 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R16, R17, R20 и R21' представляют собой атом водорода, и
сбор из культуры соединения, определенного в [1] или [2] (далее называемого как «соединение 6-дезокси 11107»);
52. Штамм Streptomyces sp. А-1543 (FERM BP-8442), который способен продуцировать соединение 6-дезокси 11107 в соответствии с 51;
53. Способ получения 6-дезоксисоединения биологическим превращением соединения формулы (I):

где [1] W представляет собой

R3 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R16, R17, R20 и R21' представляют собой атом водорода,
(далее называемого как «6-дезокси 11107В») в соединение формулы (I), где
[3] W представляет собой

R3, R16 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17, R20 и R21' представляют собой атом водорода,
[4] W представляет собой

R21 и R21' образуют оксогруппу вместе с атомом углерода, к которому R21 и R21' присоединены, R3, R16 и R20 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17 представляет собой атом водорода,
[5] W представляет собой

R3, R16, R20 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17 и R21' представляют собой атом водорода,
[6] W представляет собой

R3, R7, R16 и R21 представляют собой гидроксильную группу, и R17, R20 и R21' представляют собой атом водорода,
[7] W представляет собой

R3, R17, R16 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R20 и R21' представляют собой атом водорода, или
[8] W представляет собой

R21 и R21' образуют оксогруппу вместе с атомом углерода, к которому R21 и R21' присоединены, R3 и R16 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17 и R20 представляет собой атом водорода (указанные соединения называют далее как «6-дезоксисоединения»), содержащий
1) стадию, на которой можно проводить биологическое превращение, стадию инкубирования 6-дезокси 11107В в присутствии культурального раствора штамма, выбранного из микроорганизмов, относящихся к бактериям, или продукта, полученного из культуральных клеток штамма, и
2) сбор 6-дезоксисоединения из инкубированного раствора;
54. Способ в соответствии с 53, где микроорганизмом, относящимся к бактериям, является штамм А-1544 (FERM BP-8446) или штамм А-1545 (FERM BP-8447); и
55. Штамм А-1544 (FERM BP-8446) или штамм А-1545 (FERM BP-8447), который способен превращать 6-дезокси 11107В в 6-дезоксисоединение.
Наилучший способ осуществления изобретения
Ниже описаны различные термины, символы и тому подобное, используемые в данном описании.
В данном описании химическая формула соединения по настоящему изобретению показана для удобства в виде планиметрической формулы. Однако настоящее изобретение может включать заданные изомеры, производные от данной химической формулы. Настоящее изобретение может охватывать все изомеры и их смеси, такие как геометрические изомеры, порожденные конфигурацией соединения, оптические изомеры на основе асимметрического углеродного атома, ротамеры, стереоизомеры и таутомеры и смеси указанных изомеров. Настоящее изобретение не ограничивается подходящим для данного случая описанием химической формулы и может охватывать любые изомеры или их смеси. Таким образом, когда соединение по настоящему изобретению содержит в молекуле асимметрический углеродный атом и существует в виде оптически активного вещества или рацемата, то изобретение охватывает как оптически активное вещество, так и рацемат. Хотя могут существовать кристаллические полиморфы соединения, соединение не ограничивается одной кристаллической формой и может существовать в одной единственной кристаллической форме или в виде смеси множественных кристаллических форм. Соединение формулы (I) в соответствии с настоящим изобретением или его соль может представлять собой ангидрат или гидрат. Как ангидрат, так и гидрат включены в настоящее изобретение. Метаболиты, образующиеся in vivo в результате разложения соединения формулы (I) по настоящему изобретению, и пролекарство соединения формулы (I) по настоящему изобретению или его соль также включены в настоящее изобретение.
Термин «атом галогена», используемый в описании к данной заявке, относится к атому фтора, атому хлора, атому брома и атому иода. Среди них предпочтительными являются, например, атом фтора, атом хлора и атом брома. Из них обычно предпочтительными являются атом фтора и атом хлора.
«С1-С22алкильная группа» при использовании в описании к данной заявке относится к неразветвленной или разветвленной алкильной группе, содержащей 1-22 углеродных атома. Примеры включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, 1,1-диметилпропильную группу, 1,2-диметилпропильную группу, 2,2-диметилпропильную группу, 1-этилпропильную группу, н-гексильную группу, 1-этил-2-метилпропильную группу, 1,1,2-триметилпропильную группу, 1-пропилпропильную группу, 1-метилбутильную группу, 2-метилбутильную группу, 1,1-диметилбутильную группу, 1,2-диметилбутильную группу, 2,2-диметилбутильную группу, 1,3-диметилбутильную группу, 2,3-диметилбутильную группу, 2-этилбутильную группу, 2-метилпентильную группу, 3-метилпентильную группу, н-гептильную группу, н-октильную группу, н-нонильную группу и н-децильную группу. Предпочтительно, «С1-С22алкильная группа» относится к неразветвленной или разветвленной алкильной группе, содержащей 1-6 углеродных атомов. Примеры включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу и н-пентильную группу. Из них предпочтительными являются, например, метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа и трет-бутильная группа.
«Ненасыщенная С2-С22алкильная группа» при использовании в описании к данной заявке относится к неразветвленной или разветвленной алкенильной группе, содержащей 2-22 углеродных атома, или неразветвленной или разветвленной алкинильной группе, содержащей 2-22 углеродных атома. Примеры включают винильную группу, аллильную группу, 1-пропенильную группу, изопропенильную группу, 2-метил-1-пропенильную группу, 2-метил-2-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, 1-пентенильную группу, 1-гексенильную группу, 1,3-гександиенильную группу, 1,5-гександиенильную группу, этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу, 3-бутинильную группу, 1-этинил-2-пропинильную группу, 2-метил-3-бутинильную группу, 1-пентинильную группу, 1-гексинильную группу, 1,3-гександиинильную группу и 1,5-гександиинильную группу. Предпочтительно, «ненасыщенная С2-С22алкильная группа» относится к неразветвленной или разветвленной алкенильной группе, содержащей 2-10 углеродных атомов, или неразветвленной или разветвленной алкинильной группе, содержащей 2-10 углеродных атомов. Предпочтительные примеры включают винильную группу, аллильную группу, 1-пропенильную группу, изопропенильную группу, 3-метил-2-бутенильную группу, 3,7-диметил-2,6-октадиенильную группу, этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу, 3-бутинильную группу и 3-метил-1-пропинильную группу.
«С6-С14арильная группа» при использовании в описании к данной заявке относится к ароматической циклической углеводородной группе, содержащей 6-14 углеродных атомов, и включает моноциклическую группу и конденсированное кольцо, такое как бициклическая группа или трициклическая группа. Примерами являются фенильная группа, инденильная группа, 1-нафтильная группа, 2-нафтильная группа, азуленильная группа, гепталенильная группа, индаценильная группа, аценафтильная группа, флуоренильная группа, феналенильная группа, фенантренильная группа и антраценильная группа. Предпочтительными являются, например, фенильная группа, 1-нафтильная группа и 2-нафтильная группа.
«5-14-Членная гетероарильная группа» в описании к данной заявке относится к моноциклической, бициклической или трициклической 5-14-членной ароматической гетероциклической группе, содержащей один или несколько гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Предпочтительные примеры включают азотсодержащую ароматическую гетероциклическую группу, такую как пирролильная группа, пиридинильная группа, пиридазинильная группа, пиримидинильная группа, пиразинильная группа, триазолильная группа, тетразолильная группа, бензотриазолильная группа, пиразолильная группа, имидазолильная группа, бензимидазолильная группа, индолильная группа, изоиндолильная группа, индолизинильная группа, пуринильная группа, индазолильная группа, хинолинильная группа, изохинолинильная группа, хинолизинильная группа, фталазинильная группа, нафтиридинильная группа, хиноксалинильная группа, хиназолинильная группа, циннолинильная группа, птеридинильная группа, имидазотриазинильная группа, пиразинопиридазинильная группа, акридинильная группа, фенантридинильная группа, карбазолильная группа, карбазолинильная группа, перимидинильная группа, фенантролинильная группа, феназинильная группа, имидазопиридинильная группа, имидазопиримидинильная группа, пиразолопиридинильная группа и пиразолопиридинильная группа; серосодержащую ароматическую гетероциклическую группу, такую как тиенильная группа и бензотиенильная группа; кислородсодержащую ароматическую гетероциклическую группу, такую как фурильная группа, пиранильная группа, циклопентапиранильная группа, бензофурильная группа и изобензофурильная группа; и ароматические гетероциклические группы, содержащие два или более различных гетероатомов, такие как тиазолильная группа, изотиазолильная группа, бензотиазолильная группа, бензотиадиазолильная группа, фенотиазинильная группа, изоксазолильная группа, фуразанильная группа, феноксазинильная группа, оксазолильная группа, изоксазолильная группа, бензоксазолильная группа, оксадиазолильная группа, пиразолооксазолильная группа, имидазотиазолильная группа, тиенофуранильная группа, фуропирролильная группа и пиридооксазинильная группа. Предпочтительными являются, например, тиенильная группа, фурильная группа, пиридинильная группа, пиридазинильная группа, пиримидинильная группа и пиразинильная группа.
«3-14-Членная неароматическая гетероциклическая группа» при использовании в описании к данной заявке относится к моноциклической, бициклической или трициклической 3-14-членной неароматической гетероциклической группе, которая может содержать один или несколько гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Предпочтительными примерами являются азиридинильная группа, азетидинильная группа, пирролидинильная группа, пирролильная группа, пиперидинильная группа, пиперазинильная группа, гомопиперидинильная группа, гомопиперазинильная группа, имидазолильная группа, пиразолидинильная группа, имидазолидинильная группа, морфолинильная группа, тиоморфолинильная группа, имидазолинильная группа, оксазолинильная группа, 2,5-диазабицикло[2.2.1]гептильная группа, 2,5-диазабицикло[2.2.2]октильная группа, 3,8-диазабицикло[3.2.1]октильная группа, 1,4-диазабицикло[4.3.0]нонильная группа, хинуклидинильная группа, тетрагидрофуранильная группа и тетрагидротиофенильная группа. Указанные выше неароматические гетероциклические группы включают группу, производную от пиридонового кольца и неароматического конденсированного кольца (например, группу, производную от фталимидного кольца, сукцинимидного кольца или тому подобное).
«С7-С22аралкильная группа» при использовании в описании к данной заявке относится к группе, соответствующей определенной выше «С2-С22алкильной группе», замещаемая часть которой замещена определенной выше «С6-С14арильной группой». Конкретными примерами являются бензильная группа, фенетильная группа, 3-фенилпропильная группа, 4-фенилбутильная группа, 1-нафтилметильная группа и 2-нафтилметильная группа. Предпочтительной является аралкильная группа, содержащая 7-10 углеродных атомов, например, бензильная группа или фенетильная группа.
«5-14-Членная гетероаралкильная группа» при использовании в описании к данной заявке относится к группе, соответствующей определенной выше «С1-С22алкильной группе», содержащей определенную выше «5-14-членную гетероарильную группу» в качестве заместителя. Конкретными примерами являются тиенилметильная группа, фурилметильная группа, пиридинилметильная группа, пиридазинилметильная группа, пиримидинилметильная группа и пиразинилметильная группа. Предпочтительными являются, например, тиенилметильная группа, фурилметильная группа и пиридинилметильная группа.
«С3-С14циклоалкильная группа» при использовании в описании к данной заявке означает циклоалкильную группу, содержащую 3-14 углеродных атомов. Подходящими примерами являются циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа и циклооктильная группа. Предпочтительными являются, например, циклопентильная группа, циклогексильная группа, циклогептильная группа и циклооктильная группа.
«С4-С9циклоалкилалкильная группа» при использовании в описании к данной заявке, означает группу, соответствующую определенной выше «С1-С22алкильной группе», содержащей определенную выше «С3-С14циклоалкильную группу» в качестве заместителя. Конкретными примерами являются циклопропилметильная группа, циклобутилметильная группа, циклопентилметильная группа, циклогексилметильная группа, циклогептилметильная группа и циклооктилметильная группа. Предпочтительными являются, например, циклопропилметильная группа, циклобутилметильная группа и циклопентилметильная группа.
«С1-С22алкоксигруппа» при использовании в описании к данной заявке, означает группу, полученную присоединением атома кислорода к концу определенной выше «С1-С22алкильной группы». Примерами подходящей группы являются метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа,
н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа,
трет-бутоксигруппа, н-пентилоксигруппа, изопентилоксигруппа,
втор-пентилоксигруппа, н-гексилоксигруппа, изогексилоксигруппа,
1,1-диметилпропоксигруппа, 1,2-диметилпропоксигруппа,
2,2-диметилпропилоксигруппа, 1-этил-2-метилпропоксигруппа,
1,1,2-триметилпропоксигруппа, 1,2,2-триметилпропоксигруппа,
1,1-диметилбутоксигруппа, 1,2-диметилбутоксигруппа,
2,2-диметилбутоксигруппа, 2,3-диметилбутилоксигруппа,
1,3-диметилбутоксигруппа, 2-этилбутоксигруппа,
2-метилпентоксигруппа, 3-метилпентоксигруппа и гексилоксигруппа.
Предпочтительными являются метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, изобутоксигруппа и 2,2-диметилпропилоксигруппа.
«Ненасыщенная С2-С22алкоксигруппа» при использовании в описании к данной заявке означает группу, полученную присоединением атома кислорода к концу определенной выше «ненасыщенной С2-С22алкильной группы». Примерами подходящей группы являются винилоксигруппа, аллилоксигруппа,
1-пропенилоксигруппа, изопропенилоксигруппа,
2-метил-1-пропенилоксигруппа, 2-метил-2-пропенилоксигруппа,
1-бутенилоксигруппа, 2-бутенилоксигруппа, 3-бутенилоксигруппа,
1-пентенилоксигруппа, 1-гексенилоксигруппа,
1,3-гександиенилоксигруппа, 1,5-гександиенилоксигруппа,
пропаргилоксигруппа и 2-бутинилоксигруппа. Предпочтительными являются, например, аллилоксигруппа, пропаргилоксигруппа и 2-бутинилоксигруппа.
«С6-С14арилоксигруппа» при использовании в описании к данной заявке означает группу, полученную присоединением атома кислорола к концу определенной выше «С6-С14арильной группы». Конкретными примерами являются фенилоксигруппа, инденилоксигруппа, 1-нафтилоксигруппа, 2-нафтилоксигруппа, азуленилоксигруппа, гепталенилоксигруппа, индаценилоксигруппа, аценафтилоксигруппа, флуоренилоксигруппа, феналенилоксигруппа, фенантренилоксигруппа и антраценилоксигруппа. Предпочтительными являются, например, фенилоксигруппа, 1-нафтилоксигруппа и 2-нафтилоксигруппа.
«С7-С22аралкилоксигруппа» при использовании в описании к данной заявке означает группу, полученную присоединением атома кислорода к концу определенной выше «С7-С22аралкильной группы». Конкретными примерами являются бензилоксигруппа,
фенетилоксигруппа, 3-фенилпропилоксигруппа,
4-фенилбутилоксигруппа, 1-нафтилметилоксигруппа и
2-нафтилметилоксигруппа. Предпочтительной является, например, бензилоксигруппа.
«5-14-Членная гетероаралкилоксигруппа» при использовании в описании к данной заявке означает группу, полученную присоединением атома кислорода к концу определенной выше «5-14-членной гетероаралкильной группы». Конкретными примерами являются тиенилметилоксигруппа, фурилметилоксигруппа,
пиридинилметилоксигруппа, пиридазинилметилоксигруппа,
пиримидинилметилоксигруппа и пиразинилметилоксигруппа.
Предпочтительными соединениями являются, например, тиенилметилоксигруппа, фурилметилоксигруппа и пиридинилметилоксигруппа.
«5-14-Членная гетероарилоксигруппа» при использовании в описании к данной заявке, означает группу, полученную присоединением атома кислорода к концу определенной выше «5-14-членной гетероарильной группы». Конкретными примерами являются пирролилоксигруппа, пиридинилоксигруппа, пиридазинилоксигруппа,
пиримидинилоксигруппа, пиразинилоксигруппа, триазолилоксигруппа,
тетразолилоксигруппа, бензотриазолилоксигруппа,
пиразолилоксигруппа, имидазолилоксигруппа,
бензимидазолилоксигруппа, индолилоксигруппа,
изоиндолилоксигруппа, индолизинилоксигруппа, пуринилоксигруппа,
индазолилоксигруппа, хинолинилоксигруппа,
изохинолинилоксигруппа, хинолизинилоксигруппа,
фталазинилоксигруппа, нафтиридинилоксигруппа,
хиноксалинилоксигруппа, хиназолинилоксигруппа,
циннолинилоксигруппа, птеридинилоксигруппа,
имидазотриазинилоксигруппа, пиразинопиридазинилоксигруппа,
акридинилоксигруппа, фенантридинилоксигруппа,
карбазолилоксигруппа, карбазолинилоксигруппа,
перимидинилоксигруппа, фенантролинилоксигруппа,
феназинилоксигруппа, имидазопиридинилоксигруппа,
имидазопиримидинилоксигруппа, пиразолопиридинилоксигруппа,
пиразолопиридинилоксигруппа, тиенилоксигруппа,
бензотиенилгруппа, фурилоксигруппа, пиранилоксигруппа,
циклопентапиранилоксигруппа, бензофурилоксигруппа,
изобензофурилоксигруппа, тиазолилоксигруппа,
изотиазолилоксигруппа, бензотиазолилоксигруппа,
бензотиадиазолилоксигруппа, фенотиазинилоксигруппа,
изоксазолилоксигруппа, фуразанилоксигруппа,
феноксазинилоксигруппа, оксазолилоксигруппа,
изоксазолилоксигруппа, бензоксазолилоксигруппа,
оксадиазолилоксигруппа, пиразолооксазолилоксигруппа,
имидазотиазолилоксигруппа, тиенофуранилоксигруппа,
фуропирролилоксигруппа и пиридооксазинилоксигруппа.
Предпочтительными являются, например, тиенилоксигруппа, пиридинилоксигруппа, пиримидинилоксигруппа или пиразинилоксигруппа.
«Алифатическая С2-С22ацильная группа» при использовании в описании к данной заявке означает группу, полученную присоединением карбонильной группы к концу определенной выше «С1-С22алкильной группы» или «ненасыщенной С2-С22алкильной группы». Примерами являются ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, изовалерильная группа, пивалоильная группа, капроильная группа, деканоильная группа, лауроильная группа, миристоильная группа, пальмитоильная группа, стеароильная группа, арахидоильная группа, акрилоильная группа, пропиолоильная группа, кротоноильная группа, изокротоноильная группа, олеоильная группа и линоленоильная группа. Предпочтительными являются алифатические ацильные группы, содержащие 2-6 углеродных атомов, например ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа и акрилоильная группа.
«Ароматическая С7-С15ацильная группа» при использовании в описании к данной заявке означает группу, полученную присоединением карбонильной группы к концу определенной выше «С6-С14арильной группы» или «5-14-членной гетероарильной группы». Примерами являются бензоильная группа, 1-нафтоильная группа, 2-нафтоильная группа, пиколиноильная группа, никотиноильная группа, изоникотиноильная группа, фуроильная группа и тиофенкарбонильная группа. Предпочтительными являются, например, бензоильная группа, пиколиноильная группа, никотиноильная группа и изоникотиноильная группа.
«С1-С22алкилсульфонильная группа» при использовании в описании к данной заявке означает сульфонильную группу, к которой присоединена определенная выше «С1-С22алкильная группа». Конкретными примерами являются метансульфонильная группа, этансульфонильная группа, н-пропансульфонильная группа и изопропансульфонильная группа. Предпочтительной является, например, метансульфонильная группа.
«С6-С14арилсульфонильная группа» при использовании в описании к данной заявке означает сульфонильную группу, к которой присоединена определенная выше «С6-С14арильная группа». Конкретными примерами являются бензолсульфонильная группа, 1-нафталинсульфонильная группа и 2-нафталинсульфонильная группа. Предпочтительной является, например, бензолсульфонильная группа.
«Алифатическая С2-С22ацилоксигруппа» при использовании в описании к данной заявке означает группу, полученную присоединением атома кислорода к концу определенной выше «алифатической С2-С22ацильной группы». Примерами являются ацетоксигруппа, пропионилоксигруппа и акрилоксигруппа. Предпочтительными являются, например, ацетоксигруппа и пропионилоксигруппа.
«С2-С22алкоксикарбонильная группа» при использовании в описании к данной заявке означает группу, полученную присоединением карбонильной группы к концу определенной выше «С1-С22алкоксигруппы». Примерами являются метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа, изопропоксикарбонильная группа, н-бутоксикарбонильная группа, изобутоксикарбонильная группа, втор-бутоксикарбонильная группа и трет-бутоксикарбонильная группа. Предпочтительными являются, например, этоксикарбонильная группа, изопропоксикарбонильная группа и трет-бутоксикарбонильная группа.
«Ненасыщенная С3-С22алкоксикарбонильная группа» при использовании в описании к данной заявке означает группу, полученную присоединением карбонильной группы к концу определенной выше «ненасыщенной С2-С22алкоксигруппы». Примерами являются винилоксикарбонильная группа, аллилоксикарбонильная группа, 1-пропенилоксикарбонильная группа, изопропенилоксикарбонильная группа, пропаргилоксикарбонильная группа и 2-бутинилоксикарбонильная группа. Предпочтительной является, например, аллилоксикарбонильная группа.
«С1-С22алкилтиогруппа» при использовании в описании к данной заявке означает группу, полученную присоединением атома серы к концу определенной выше «С1-С22алкильной группы». Примерами являются метилтиогруппа, этилтиогруппа, н-пропилтиогруппа и изопропилтиогруппа. Предпочтительными являются, например, метилтиогруппа и этилтиогруппа.
«С1-С22алкилсульфинильная группа» при использовании в описании к данной заявке означает группу, полученную присоединением сульфинильной группы к концу определенной выше «С1-С22алкильной группы». Примерами являются метансульфинильная группа, этансульфинильная группа, н-пропансульфинильная группа и изопропансульфинильная группа. Предпочтительными являются, например, метансульфинильная группа или этансульфинильная группа.
«С1-С22алкилсульфонилоксигруппа» при использовании в данном описании означает группу, полученную присоединением атома кислорода к концу определенной выше «С1-С22алкилсульфонильной группы». Примерами являются метансульфонилоксигруппа, этансульфонилоксигруппа, н-пропансульфонилоксигруппа и изопропансульфонилоксигруппа. Предпочтительной является, например, метансульфонилоксигруппа.
В качестве заместителя в группе, «которая может иметь заместитель», при использовании в описании к данной заявке, является одна или более групп, выбранных из:
(1) атома галогена,
(2) гидроксильной группы,
(3) тиольной группы,
(4) нитрогруппы,
(5) нитрозогруппы,
(6) цианогруппы,
(7) карбоксильной группы,
(8) сульфонилоксигруппы,
(9) аминогруппы,
(10) С1-С22алкильной группы (например, метильной группы, этильной группы, н-пропильной группы, изопропильной группы, н-бутильной группы, изобутильной группы, втор-бутильной группы или трет-бутильной группы),
(11) ненасыщенной С2-С22алкильной группы (например, винильной группы, аллильной группы, 1-пропенильной группы, изопропенильной группы, этинильной группы, 1-пропинильной группы, 2-пропинильной группы, 1-бутинильной группы, 2-бутинильной группы или 3-бутинильной группы),
(12) С6-С14арильной группы (например, фенильной группы, 1-нафтильной группы или 2-нафтильной группы),
(13) 5-14-членной гетероарильной группы (например, тиенильной группы, фурильной группы, пиридинильной группы, пиридазинильной группы, пиримидинильной группы или пиразинильной группы),
(14) 3-14-членной неароматической гетероциклической группы (например, азиридинильной группы, азетидинильной группы, пирролидинильной группы, пирролильной группы, пиперидинильной группы, пиперазинильной группы, гомопиперидинильной группы, гомопиперазинильной группы, имидазолильной группы, пиразолидинильной группы, имидазолидинильной группы, морфолинильной группы, тиоморфолинильной группы, имидазолинильной группы, оксазолинильной группы или хинуклидинильной группы),
(15) С3-С14циклоалкильной группы (например, циклопропильной группы, циклобутильной группы, циклопентильной группы, циклогексильной группы, циклогептильной группы или циклооктильной группы),
(16) С1-С22алкоксигруппы (например, метоксигруппы, этоксигруппы, н-пропоксигруппы, изопропоксигруппы,
втор-пропоксигруппы, н-бутоксигруппы, изобутоксигруппы,
втор-бутоксигруппы или трет-бутоксигруппы),
(17) ненасыщенной С2-С22алкоксигруппы (например, винилоксигруппы, аллилоксигруппы, 1-пропенилоксигруппы,
изопропенилоксигруппы, этинилоксигруппы, 1-пропинилоксигруппы,
2-пропинилоксигруппы, 1-бутинилоксигруппы или
2-бутинилоксигруппы),
(18) С6-С14арилоксигруппы (например, фенилоксигруппы, 1-нафтилоксигруппы или 2-нафтилоксигруппы),
(19) С7-С22аралкилоксигруппы (например, бензилоксигруппы,
фенетилоксигруппы, 3-фенилпропилоксигруппы,
4-фенилбутилоксигруппы, 1-нафтилметилоксигруппы или
2-нафтилметилоксигруппы),
(20) 5-14-членной гетероаралкилоксигруппы (например, тиенилметилоксигруппы, фурилметилоксигруппы,
пиридинилметилоксигруппы, пиридазинилметилоксигруппы,
пиримидинилметилоксигруппы или пиразинилметилоксигруппы),
(21) 5-14-членной гетероарилоксигруппы (например, тиенилоксигруппы, фурилоксигруппы, пиридинилоксигруппы, пиридазинилоксигруппы, пиримидинилоксигруппы или пиразинилоксигруппы),
(22) алифатической С2-С22ацильной группы (например, ацетильной группы, пропионильной группы, бутирильной группы, изобутирильной группы, валерильной группы, изовалерильной группы, пивалоильной группы, капроильной группы, деканоильной группы, лауроильной группы, миристоильной группы, пальмитоильной группы, стеароильной группы, арахидоильной группы, акрилоильной группы, пропиолоильной группы, кротоноильной группы, изокротоноильной группы, олеоильной группы или линоленоильной группы),
(23) ароматической С7-С15ацильной группы (например, бензоильной группы, 1-нафтоилььной группы или 2-нафтоильной группы),
(24) алифатической С2-С22ацилоксигруппы (например, ацетоксигруппы, пропионилоксигруппы или акрилоксигруппы),
(25) С2-С22алкоксикарбонильной группы (например, метоксикарбонильной группы, этоксикарбонильной группы, н-пропоксикарбонильной группы, изопропоксикарбонильной группы, н-бутоксикарбонильной группы, изобутоксикарбонильной группы, втор-бутоксикарбонильной группы или трет-бутоксикарбонильной группы),
(26) ненасыщенной С3-С22алкоксикарбонильной группы (например, винилоксикарбонильной группы,
аллилоксикарбонильной группы, 1-пропенилоксикарбонильной группы,
изопропенилоксикарбонильной группы,
пропаргилоксикарбонильной группы или
2-бутинилоксикарбонильной группы),
(27) С1-С22алкилтиогруппы (например, метилтиогруппы, этилтиогруппы, н-пропилтиогруппы или изопропилтиогруппы),
(28) С1-С22алкилсульфинильной группы (например, метансульфинильной группы, этансульфинильной группы, н-пропансульфинильной группы или изопропансульфинильной группы),
(29) С1-С22алкилсульфонильной группы (например, метансульфонильной группы, этансульфонильной группы, н-пропансульфонильной группы или изопропансульфонильной группы),
(30) С6-С14арилсульфонильной группы (например, бензолсульфонильной группы, 1-нафталинсульфонильной группы или 2-нафталинсульфонильной группы),
(31) С1-С22алкилсульфонилоксигруппы (например, метансульфонилоксигруппы, этансульфонилоксигруппы,
н-пропансульфонилоксигруппы или изопропансульфонилоксигруппы),
(32) карбамоильной группы,
(33) формильной группы и тому подобное. Предпочтительными являются, например, аминогруппа, С1-С22алкильная группа, ненасыщенная С2-С22алкильная группа, С6-С14арильная группа, 5-14-членная гетероарильная группа, 3-14-членная неароматическая гетероциклическая группа и С3-С14циклоалкильная группа. В частности, указанный заместитель, предпочтительно, представляет собой один или два заместителя, таких как, например, аминогруппа, С1-С22алкильная группа, 3-14-членная неароматическая гетероциклическая группа и С3-С14циклоалкильная группа. Кроме того, указанные выше аминогруппа (9) и карбамоильная группа (31), данные в качестве заместителя в описанной выше группе «которая может иметь заместитель», каждая может быть дополнительно замещена одной или двумя С1-С22алкильными группами, ненасыщенными С2-С22алкильными группами или С6-С14арильными группами.
Далее дается пояснение соединений формулы (I) по настоящему изобретению.
Соединение формулы (I) ингибирует продукцию VEGF в гипоксических условиях, обладает ингибирующей активностью по отношению к пролиферации клеток солидной опухоли in vivo и проявляет активность in vivo при дозе, не вызывающей существенного снижения массы тела. Среди таких соединений предпочтительным является соединение формулы (I-а), более предпочтительным соединение формулы (I-b) и особенно предпочтительным соединение формулы (I-с). Кроме того, соединение формулы (I), где R16 представляет собой гидроксильную группу, является соединением, проявляющим очень высокую стабильность в водном растворе.
Поскольку соединение формулы (I) получают с использованием известной реакции химического превращения для функциональных групп (например, гидроксильной группы), находящихся в положении 3, положении 7, положении 16 и положении 21, причем в положение 3, положение 7, положение 16 и положение 21 могут быть введены одинаковые заместители. Так как структурной особенностью является боковая цепь в положении 7 и/или боковая цепь в положении 21, группу более предпочтительных соединений можно определить как соединения формулы (I-d). Кроме того, соединения формулы (I), в которой R21 образует оксофрагмент вместе с атомом углерода, к которому присоединен R21, как и соединения формулы (I-d), относятся к группе соединений, обладающих хорошей активностью. В качестве примеров конкретных вариантов более предпочтительных соединений среди соединений формулы (I-d) можно указать соединения, описанные выше как варианты «7»-«20» настоящего изобретения.
Предпочтительные примеры соединений формулы (I) описаны ниже. Представителем группы предпочтительных соединений, включая соединения, описанные далее в примерах, является, например:
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 18),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 19),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(пиперазин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 21),
(8Е,12Е,14Е)-7-((4-этилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 24),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-(3-(N',N'-диметиламино)пропил)-N-метилкарбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 27),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 28),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(1-метилпиперидин-4-ил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 29),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-изопропилгомопиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 39),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-(4-гидроксипеперидин-1-ил)пиперидин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 40),
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(морфолин-4-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 42),
(8Е,12Е,14Е)-7-((4-этилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 43),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 44),
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-(((1S,4S)-5-изопропил-2,5-диаззабицикло[2.2.1]гептан-2-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 49),
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диметиламино)этил)-N-метилкарбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 50),
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диметиламино)этил)карбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 51) или
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(((1S,4S)-5-метил-2,5-диаззабицикло[2.2.1]гептан-2-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 55). Из них более предпочтительными являются, например, соединение 29, соединение 39, соединение 43, соединение 44 и соединение 55.
Далее описан способ получение соединения формулы (I) по настоящему изобретению.
Соединение формулы (I) может быть получено химической модификацией типового соединения, такого как соединение 6-дезокси 11107 или 6-дезоксисоединение, используя традиционный способ следующим образом. Соединение 6-дезокси 11107 получают культивированием в аэробных условиях штамма, относящегося к роду Streptomyces, который способен продуцировать соединение 6-дезокси 11107 как физиологически активное вещество формулы (I), где [1] W представляет собой

R3 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R16, R17, R20 и R21' представляют собой атом водорода (6-дезокси 11107В),
[3] W представляет собой

R3, R16 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17, R20 и R21' представляют собой атом водорода (6-дезокси 11107D),
[7] W представляет собой

R3, R17, R16 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R20 и R21' представляют собой атом водорода, и сбором соединения с клеток и культурального раствора; и 6-дезоксисоединение получают биологическим превращением соединения формулы (I), где
[1] W представляет собой

R3 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R16, R17, R20 и R21' представляют собой атом водорода (далее называемое как «6-дезокси 11107В»), в соединение формулы (I), где
[2] W представляет собой

R3 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R16, R17, R20 и R21' представляют собой атом водорода,
[4] W представляет собой

R21 и R21' образуют оксогруппу вместе с атомом углерода, к которому R21 и R21' присоединены, R3, R16 и R20 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17 представляет собой атом водорода,
[5] W представляет собой

R3, R16, R20 и R21 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17 и R21' представляют собой атом водорода,
[6] W представляет собой

R3, R7, R16 и R21 представляют собой гидроксильную группу, и R17, R20 и R21' представляют собой атом водорода, или
[8] W представляет собой

R21 и R21' образуют оксогруппу вместе с атомом углерода, к которому R21 и R21' присоединены, R3 и R16 представляют собой гидроксильную группу, R7 представляет собой ацетоксигруппу, и R17 и R20 представляет собой атом водорода, и химическим модифицированием типового соединения с использованием подходящим образом традиционного способа.
Настоящее изобретение подробно описано ниже в отношении получения соединения 6-дезокси 11107 ферментацией, получения 6-дезоксисоединения с использованием реакции биопревращения и модификации активного вещества методом органического синтеза.
Сначала описан способ получения соединения 6-дезокси 11107.
Соединение 6-дезокси 11107 (в частности, 6-дезокси 11107В), которое может быть превращено в соединение 6-дезокси 11107D (биологически активное вещество) по настоящему изобретению может быть получено микробной ферментацией.
В качестве микроорганизма для получения соединения 6-дезокси 11107 можно использовать любой микроорганизм, лишь бы он представлял собой штамм, способный продуцировать соединение 6-дезокси 11107. Например, штамм для продуцирования 6-дезокси 11107В может быть получен из штамма, выделенного из почвы, или известного штамма, способного продуцировать аналог 11107В, типичной мутационной обработкой с использованием, например, ультрафиолетовых лучей или мутагенного агента, такого как N-метил-N'-нитро-N-нитрозогуанидин (NTG) в качестве мутагена, или таким методом, как генное расщепление с гомологичной рекомбинацией.
В качестве примера микроорганизма для продуцирования соединения 6-дезокси 11107 можно назвать следующий депозитный штамм микроорганизма. Указанный штамм был сдан на международное хранение в International Patent Organism Depositary (IPOD), National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan. В частности, Streptomyces sp. Mer-11107 был депонирован 19 декабря 2000 г. как FERM P-18144 в the National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology in 1-1-3 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan и был передан International Patent Organism Depositary (IPOD), National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan под международным депозитарным номером FERM BP-7812 27 ноября 2001 г.
Нет особого ограничения на штаммы для продукции соединения 6-дезокси 11107, включая мутанты указанных штаммов, лишь бы они относились к роду Streptomyces и обладали способностью продуцировать соединение 6-дезокси 11107. В дополнение к описанному выше штамму можно привести в качестве примера штамм Streptomyces sp. A-1543. Указанный штамм был депонирован в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan, как FERM P-18942 23 июля 2002 г. и был передан International Patent Organism Depositary (IPOD), National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan под международным депозитарным номером FERM BP-8442 28 июля 2003 г.
Ниже приводится подробное описание получения соединения 6-дезокси 11107 в отношении 1. характеристик выделенного штамма-продуцента, 2. метода культивирования штамма-продуцента и 3. метода очистки активного вещества.
1. Характеристики выделенного штамма-продуцента
Предполагается, что в качестве штамма для применения в настоящем изобретении может быть использован любой штамм, принадлежащий к роду Streptomyces и обладающий способностью продуцировать соединение 6-дезокси 11107. В качестве типичных штаммов авторы настоящего изобретения предлагают штамм под номером Mer-11107 и мутант данного штамма А-1543. Микробиологические характеристики указанных штаммов даны ниже.
(1). Морфология
В указанном штамме от вегетативных гиф отходят спиральные воздушные гифы. На конце зрелых воздушных гиф образована цепь спор, состоящая примерно из 10-20 столбчатых спор. Каждая спора имеет размер примерно 0,7 мкм×1,0 мкм и имеет гладкую поверхность. Атипичных органов, таких как спорангий, склероций и жгутик не наблюдается.
(2). Условия роста на различных культуральных средах
Ниже показаны культуральные характеристики штамма после культивирования при 28°С в течение двух недель на различных культуральных средах. Цветовые тона описаны в соответствии с цветовыми дисками Треснера и обозначены названием цвета и символом, показанным в круглых скобках.
1) Агаровая среда с дрожжевым и солодовым экстрактами
Штамм растет хорошо. Воздушные гифы культивируемого штамма на поверхности разветвляются, делятся и образуют светло-серые споры (светло-серый; d). Противоположная сторона имеет светло-желтый цвет дыни. (3еа). Растворимый пигмент не наблюдается.
2) Агаровая среда с овсяной мукой
Штамм растет умеренно. Воздушные гифы культивируемого штамма на поверхности слегка разветвляются, делятся и образуют серые споры (серый; g). Противоположная сторона имеет телесный рыжевато-коричневый цвет, (4gс) или цвет замазки (11/2 ес). Растворимый пигмент не наблюдается.
3) Агаровая среда с неорганическими солями и крахмалом
Штамм растет хорошо. Воздушные гифы культивируемого штамма на поверхности разветвляются, делятся и образуют серые споры (серый; е). Противоположная сторона имеет цвет желтовато-коричневый (4ig) или серый (g). Вырабатывание растворимого пигмента не наблюдается.
4) Агаровая среда с глицерином и аспарагином
Штамм растет хорошо. Воздушные гифы культивируемого штамма на поверхности разветвляются, делятся и образуют белые споры (белый; a). Противоположная сторона имеет цвет перламутровый розовый (3са). Растворимый пигмент не наблюдается.
5) Агаровая среда с пептоном, дрожжевым экстрактом и железом
Штамм растет плохо. Воздушные гифы культивируемого штамма на поверхности не разветвляются. Противоположная сторона имеет светло-желтый цвет дыни (3еа). Растворимый пигмент не наблюдается.
6) Тирозиновая агаровая среда
Штамм растет хорошо. Воздушные гифы культивируемого штамма на поверхности разветвляются, делятся и образуют белые споры (белый; а). Противоположная сторона имеет цвет перламутровый розовый (3са). Растворимый пигмент не наблюдается.
(3). Использование различных источников углерода
Ниже показано состояние роста штамма после культивирования в среде при 28°С в течение двух недель при добавлении различных источников углерода в агаровую культуральную среду Придхама-Готтлиба.
1) L-арабиноза ±
2) D-ксилоза ±
3) D-глюкоза +
4) D-фруктоза +
5) Сахароза +
6) Инозит +
7) L-рамноза -
8) D-маннит +
9) Рафиноза +
(Символ «+» означает «положительный», символ «±» означает «слабо положительный» и символ «-» означает «отрицательный»).
(4). Физиологические свойства
Физиологические свойства штамма являются такими, как показано ниже.
(а) Интервал температуры культивирования (агаровая среда с дрожжевым и солодовым экстрактами, культивирование в течение двух недель): 12°С-37°С
(b) Интервал оптимальной температуры культивирования (агаровая среда с дрожжевым и солодовым экстрактами, культивирование в течение двух недель): 21°С-33°С
(с) Разжижение желатина (агаровая среда с глюкозой, пептоном и желатином): отрицательное
(d) Свертывание молока (агаровая среда с сепарированным молоком): отрицательное
(е) Пептонизация молока (агаровая среда с сепарированным молоком): отрицательная
(f) Гидролиз крахмала (агаровая среда с неорганической солью и крахмалом): положительный
(g) Образование меланоидного пигмента (агаровая среда с пептоном, дрожжевым экстрактом и железом): отрицательное,
(тирозиновая агаровая среда): отрицательное
(h) Образование сероводорода (агаровая среда с пептоном, дрожжевым экстрактом и железом): отрицательное
(i) Снижение содержания нитрата (бульон, содержащий 0,1% нитрат калия): отрицательное
(j) Толерантность к NaCl (агаровая среда с дрожжевым и солодовым экстрактами, культивирование в течение двух недель): растет при концентрации NaCl 4% или ниже
(5). Клеточный компонент
Была обнаружена LL-диаминопимеловая кислота из оболочек клеток штамма.
2. Метод культивирования штамма-продуцента
Соединение 6-дезокси 11107 по настоящему изобретению может быть получено инокуляцией описанного выше штамма на питательную среду и аэробным культивированием штамма. В качестве штамма для продуцирования соединения 6-дезокси 11107 в настоящем изобретении, не ограничиваясь описанным выше штаммом, можно использовать любой штамм, относящийся к роду Streptomyces и обладающий способностью продуцировать соединение 6-дезокси 11107.
Метод культивирования указанного выше микроорганизма в принципе соответствует обычному методу культивирования микроорганизма, но обычно, предпочтительно, осуществлять его в аэробных условиях, таких как жидкостное культивирование в колбе со встряхиванием, культивирование в танке или тому подобное. Для культивирования может быть использована любая культуральная среда, лишь бы она содержала источник питания, который может быть использован микроорганизмом, относящимся к роду Streptomyces. Может быть использована любая из различных культуральных сред, синтетических, полусинтетических или натуральных. В качестве источников углерода в составе среды могут быть использованы, например, глюкоза, сахароза, фруктоза, глицерин, декстрин, крахмал, меласса и соевое масло, отдельно или в сочетании из двух или более источников. В качестве источников азота могут быть использованы органические источники азота, такие, например, как фармацевтические среды, пептон, мясной экстракт, соевый порошок, казеин, аминокислота, дрожжевой экстракт и мочевина, и неорганические источники азота, такие, например, как нитрат натрия и сульфат аммония, отдельно или в сочетании из двух или более источников. Кроме того, например, могут быть добавлены соли, такие как хлорид натрия, хлорид калия, карбонат кальция, сульфат магния, фосфат натрия, фосфат калия и хлорид кобальта, соли тяжелых металлов и витамины, такие как витамин В и биотин, если их использование необходимо. В случае, когда во время культивирования происходит вспенивание культуральной среды, в среду могут быть добавлены подходящим образом различные пеногасители. При добавлении пеногасителя концентрацию необходимо довести до такой, которая не будет оказывать вредного влияния на продуцирование целевого вещества. Предпочтительно, используют концентрацию, например, 0,05% или ниже.
Условия культивирования могут быть подобраны так, чтобы описанный выше штамм хорошо рос и мог продуцировать указанное выше вещество, соответственно. Предпочтительно, например, доводить рН среды до примерно 5-9 и обычно близко к нейтральному. Температуру культивирования обычно поддерживают в интервале 20°С-40°С, предпочтительно, 23°С-35°С. Время культивирования составляет примерно двое-восемь суток, обычно примерно трое-пять суток. Указанные условия культивирования могут быть, конечно, изменены в соответствии с видом и свойствами используемого микроорганизма, внешними условиями и тому подобное, причем могут быть подобраны оптимальные условия. Соединение 6-дезокси 11107 по настоящему изобретению, накопившееся в культуральном растворе, может быть собрано обычными методами разделения с использованием его характеристик, например, методом экстракции растворителем или методом абсорбции смолой.
3. Метод очистки активного вещества
Для сбора 6-дезокси 11107 из культурального раствора после культивирования обычно могут быть использованы методы разделения и очистки, используемые для выделения микробного метаболита из культурального раствора. Например, для этого годятся все соответствующие методы, такие как экстракция органическим растворителем с использованием метанола, этанола, бутанола, этилацетата, хлороформа или тому подобное, различные виды ионообменной хроматографии, гель-фильтрационная хроматография с использованием Сефадекса LH-20 или тому подобное, активированный уголь, обработка методом адсорбция/десорбция с помощью абсорбционной хроматографии или тонкослойной хроматографии с использованием силикагеля или тому подобное и высокоэффективная жидкостная хроматография с использованием колонки с обращенной фазой, применимой для данного метода. Методы очистки особо не ограничиваются методами, указанными в данном описании.
Соединение 6-дезокси 11107 может быть выделено и очищено, используя указанные методы в отдельности или в сочетании двух или более методов в произвольном порядке или многократно.
Далее описан второй способ получения соединения 6-дезокси 11107.
1. Микроорганизм, который продуцирует 6-дезоксисоединение биопревращением
6-Дезоксисоединение по настоящему изобретению может быть получено гидроксилированием атома водорода в положении 16 соединения 6-дезокси 11107, полученного описанным выше способом (в частности, 6-дезокси 11107В), с использованием биопревращения.
В качестве микроорганизма для получения соединения 6-дезокси 11107 можно использовать любой микроорганизм, лишь бы он представлял собой штамм, способный гидроксилировать атом водорода в положении 16 соединения 6-дезокси 11107 (в частности, 6-дезокси 11107В), с превращением соединения в соединение 6-дезокси 11107D по настоящему изобретению. В качестве репрезентативных примеров такого микроорганизма можно назвать штамм А-1544 и штамм А-1545, выделенные из почвы авторами настоящего изобретения. Указанные штаммы были сданы на международное хранение в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan 23 июля 2002 г, как FERM P-18943 и FERM P-18944, соответственно, и были переданы International Patent Organism Depositary (IPOD), National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan 30 июля 2003 г. под международными депозитарными номерами FERM BP-8446 и FERM BP-8447, соответственно.
2. Получение 6-дезоксисоединения с использованием реакции биопревращения
6-Дезоксисоединение получают, заставляя соединение 6-дезокси 11107 (в частности, 6-дезокси 11107В) входить в контакт с клетками или клеточным препаратом описанного выше штамма или его мутанта. Обычно 6-дезоксисоединение получают добавлением соединения 6-дезокси 11107 (в частности, 6-дезокси 11107В) в качестве предшественника в культуральный раствор, полученный инокулированием описанного выше штамма в культуральную среду, содержащую источник питания, и аэробным культивированием штамма, или в суспензию промытых клеток описанного выше штамма в подходящем буферном растворе. Когда соединение получают в культуральном растворе, соединение 6-дезокси 11107 (в частности, 6-дезокси 11107В) может быть добавлено в культуральный раствор в любое время до культивирования или в заданный период времени после начала культивирования. Хотя можно культивировать указанный штамм для приготовления культурального раствора или промытых клеток или указанный штамм с предшествующим соединением обычным методом культивирования микроорганизма, обычно является предпочтительным проводить культивирование в аэробных условиях, таких как жидкостное культивирование в колбе со встряхиванием, культивирование в танке или тому подобное.
Для культивирования может быть использована любая культуральная среда, лишь бы она содержала источник питания, который может быть использован микроорганизмом. Может быть использована любая из различных культуральных сред, синтетических, полусинтетических или натуральных.
В качестве источников углерода в составе среды могут быть использованы, например, глюкоза, галактоза, сахароза, мальтоза, фруктоза, глицерин, декстрин, крахмал, меласса и соевое масло, отдельно или в сочетании из двух или более источников. В качестве источников азота могут быть использованы органические источники азота, такие, например, как фармацевтические среды, пептон, мясной экстракт, соевая мука, рыбная мука, мука из клейковины, казеин, сухие дрожжи, аминокислота, дрожжевой экстракт и мочевина, и неорганические источники азота, такие, например, как нитрат натрия и сульфат аммония, отдельно или в сочетании из двух или более источников. Кроме того, например, при необходимости могут быть добавлены соли, такие как хлорид натрия, хлорид калия, карбонат кальция, сульфат магния, фосфат натрия, фосфат калия, сульфат меди, сульфат железа, хлорид марганца и хлорид кобальта, соли тяжелых металлов, витамины, такие как витамин В и биотин, и клатратообразующее средство, такое как циклодекстрины. В случае, когда во время культивирования происходит вспенивание культуральной среды, в среду могут быть добавлены подходящим образом различные пеногасители. При добавлении пеногасителя концентрацию необходимо довести до такой, которая не будет оказывать вредного влияния на продуцирование целевого вещества.
Условия культивирования могут быть подобраны так, чтобы описанный выше штамм хорошо развивался, обеспечивая возможность превращения соединения 6-дезокси 11107 (в частности, 6-дезокси 11107В) в 6-дезоксисоединение, соответственно. Предпочтительно, например, доводить рН среды примерно до 5-9 и обычно близко к нейтральному. Температуру культивирования поддерживают обычно в интервале 20-40°С, предпочтительно, 24-30°С. Время культивирования составляет примерно от одних до восьми суток, обычно двое-пять суток.
Указанные выше различные условия культивирования могут быть, конечно, изменены в соответствии с видом и свойствами используемого микроорганизма, внешними условиями и тому подобное, причем могут быть подобраны оптимальные условия. 6-Дезоксисоединение, накопившееся в культуральном растворе, может быть извлечено обычными методами разделения с использованием его характеристик, например, методом экстракции растворителем или методом абсорбции смолой.
3. Метод очистки 6-дезоксисоединения
Для сбора 6-дезоксисоединения из культурального раствора после культивирования обычно могут быть использованы методы разделения и очистки, применяемые для выделения микробного метаболита из культурального раствора, соответствующие методу очистки соединения 6-дезокси 11107 (в частности, 6-дезокси 11107В), описанному выше. 6-Дезоксисоединение может быть выделено и очищено, используя указанные методы в отдельности или в сочетании двух или более методов в произвольном порядке или многократно.
Далее описан способ получение соединения формулы (I), отличного от соединения 6-дезокси 11107 и 6-дезоксисоединения.
Различные соединения формулы (I) могут быть синтезированы преобразованием гидроксильной группы и/или ацетоксигруппы в выделенном и очищенном соединении 6-дезокси 11107 или 6-дезоксисоединении в качестве исходного вещества по общим методикам органического синтеза. Типичными примерами способов синтеза являются: А. способ получения производного уретана, В. способ получения производного тиоуретана, С. способ получения производного простого эфира, D. способ получения производного сложного эфира, Е. способ получения производного сложного эфира фосфорной кислоты или производного сложного эфира амидофосфорной кислоты, F. способ получения производного сложного эфира серной кислоты или сложного эфира амидосерной кислоты, G. способ получения галогенсодержащего производного, Н. способ получения производного сложного эфира сульфоновой кислоты, I. способ получения производного амина и J. способ получения оксопроизводного окислением гидроксильной группы. Введение и удаление защитной группы для гидроксильной группы можно осуществлять в соответствии с описанным в литературе методом (см. T.W. Green, Protective Groups in Organic Synthesis, John Wiley & Sons Inc., 3rd Edition) или аналогичным методом в зависимости от типа защитной группы и устойчивости соединения, используемого для конкретном получении. Соединение формулы (I) может быть получено путем использования реакций введения и удаления защитной группы для гидроксильной группы и описанного выше получения в подходящем сочетании. В частности, соединение формулы (I), где R3, R7, R16, R17, R20 и R21 представляют собой заместители, указанные в описанном выше классе 10), может быть получено по способам получения производного уретана, производного тиоуретана, производного сложного эфира амидосерной кислоты и производного амина или тому подобное; соединение формулы (I), где R3, R7, R16, R17, R20 и R21 представляют собой заместители, указанные в описанных выше в классах 3)-6), может быть получено по способу получения производного простого эфира; соединение формулы (I), где R3, R7, R16, R17, R20 и R21 представляют собой заместители, указанные в описанном выше классе 7), может быть получено по способу получения производного сложного эфира; соединение формулы (I), где R3, R7, R16, R17, R20 и R21 представляют собой заместители, указанные в описанном выше классе 12) или 13), может быть получено по способу получения производного сложного эфира фосфорной кислоты или производного сложного эфира амидофосфорной кислоты; соединение формулы (I), где R3, R7, R16, R17, R20 и R21 представляют собой заместители, указанные в описанном выше классе 11), может быть получено по способу получения производного сложного эфира серной кислоты или производного сложного эфира сульфоновой кислоты; соединение формулы (I), где R3, R7, R16, R17, R20 и R21 представляют собой заместители, указанные в описанном выше классе 9), может быть получено по способу получения галогенсодержащего производного; соединение формулы (I), где R3, R7, R16, R17, R20 и R21 представляют собой заместители, указанные в описанном выше классе 8), могут быть получены, используя реакции введения и удаления защитной группы для гидроксильной группы; и оксопроизводное соединения формулы (I), где R3, R7, R16, R17, R20 и R21 представляют собой заместители, указанные в описанном выше классе 1), может быть получено по способу получения оксопроизводного окислением гидроксильной группы.
Далее описаны способы синтеза, используемые для получения соединений формулы (I).
А. Способ получения производного уретана

В формулах R3х, R16х и R21х независимо представляют собой атом водорода или защитную группу, при условии, что R3х, R16х и R21х не представляют собой одновременно атом водорода; R3y, R16y и R21y независимо представляют собой атом водорода, защитную группу или группу, представленную формулой RfО-СО-, где Rf представляет собой С6-С14арильную группу, которая может иметь (а) заместитель(и), при условии, что R3y, R16y и R21y не представляют собой одновременно атом водорода; и R3с, R16с и R21с независимо представляют собой атом водорода, защитную группу или группу, представленную формулой RN1RN2N-СО-, где RN1 и RN2 являются такими, как определено выше, при условии, что R3с, R16с и R21с не представляют собой одновременно атом водорода.
Стадия А1 является стадией получения соединения формулы (IA). Данную стадию проводят, защищая гидроксильную группу(ы) соединения 6-дезокси 11107D (описанное выше соединение, определенное в [3]).
Реакцию защиты гидроксильной группы или групп, изменяемую в зависимости от типа защитной группы, осуществляют по методике, хорошо известной в химии органического синтеза.
Примерами защитной группы являются 1-этоксиэтил,
тетрагидропиранил, 1-метил-l-метоксиэтил, 1-(2-хлорэтокси)этил,
1-метоксициклогексил, 4-метокситетрагидропиранил,
4-метокситетрагидротиопиранил, S,S-диоксид
4-метокситетрагидротиопиранила, метоксиметил, метилтиометил,
метоксиэтоксиметил, трихлорэтоксиметил, триметилсилилэтил,
триметилсилилэтоксиметил, трет-бутилдиметилсилил, триэтилсилил,
диэтилизопропилсилил, триметилсилил, триизопропилсилил,
метил-ди-трет-бутилсилил, дифенилметилсилил, бензил,
п-метоксибензил, п-метилбензил, п-нитробензил, п-хлорбензил и
трифенилметил. Все или часть гидроксильных групп могут быть подходящим образом защищены указанными защитными группами.
Например, каждое производное, в котором гидроксильная группа защищена 1-этоксиэтилом, тетрагидропиранилом, 1-метоксициклогексилом, 4-метокситетрагидропиранилом, 4-метокситетрагидротиопиранилом или S,S-диоксидом 4-метокситетрагидротиопиранила, может быть синтезировано обработкой соединения 6-дезокси 11107D соответствующим простым виниловым эфиром, таким как этилвиниловый эфир или дигидропиран, в присутствии кислоты. В качестве кислоты используют обычные органические кислоты, такие, например, как п-толуолсульфонат пиридиния (PPTS), п-толуолсульфоновая кислота, камфорсульфоновая кислота, уксусная кислота, трифторуксусная кислота или метансульфоновая кислота, и обычные неорганические кислоты, такие, например, как хлористый водород, азотная кислота, хлористоводородная кислота и серная кислота. Предпочтительно, используют, например, п-толуолсульфонат пиридиния (PPTS), п-толуолсульфоновую кислоту и камфорсульфоновую кислоту. Растворитель, используемый в реакции, особо не ограничивают, но желателен инертный растворитель, который не может легко взаимодействовать с исходным веществом. Примерами таких растворителей являются простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, диоксан и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; углеводороды, такие как гексан, бензол и толуол; кетоны, такие как ацетон и метилэтилкетон; нитрилы, такие как ацетонитрил; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пиридон и гексаметилфосфорамид, и сульфоксиды, такие как диметилсульфоксид. Предпочтительно, используют, например, дихлорметан, хлороформ и тетрагидрофуран. Время реакции составляет от 10 минут до пяти суток, предпочтительно, одни-двое суток. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, равна комнатной температуре. Количество винилового эфира и кислоты, используемых в реакции, составляет по отношению к соединению 6-дезокси 11107D 1-200 эквивалентов и 0,05-2 эквивалента, соответственно, и, предпочтительно, 30-50 эквивалентов и 0,1-0,3 эквивалента, соответственно.
Примеры других защитных групп включают метоксиметил, метилтиометил, метоксиэтоксиметил, трихлорэтоксиметил, триметилсилилэтил, триметилсилилэтоксиметил, трет-бутилдиметилсилил, триэтилсилил, триметилсилил, диэтилизопропилсилил, триизопропилсилил, трет-бутилдиметилсилил, дифенилметилсилил, бензил, п-метоксибензил, п-метилбензил, п-нитробензил, п-хлорбензил и трифенилметил. Производное, в котором гидроксильная группа защищена указанными защитными группами, может быть синтезировано путем взаимодействия исходного вещества с хлоридом, бромидом или трифторметансульфонатом соответственной защитной группы в присутствии основания. В качестве основания используют обычное органическое основание или неорганическое основание. Примерами органического основания являются ароматические основания, такие как имидазол, 4-(N,N-диметиламино)пиридин (который является синонимом 4-диметиламинопиридина, N,N-диметиламинопиридина и диметиламинопиридина), пиридин, 2,6-лутидин и коллидин; третичные амины, такие как N-метилпиперидин, N-метилпирролидин, триэтиламин, триметиламин, диизопропилэтиламин, циклогексилдиметиламин, N-метилморфолин и 1,8-бис(диметиламино)нафталин; вторичные амины, такие как диизобутиламин и дициклогексиламин; алкиллитий, такой как метиллитий и бутиллитий; и алкоксиды металлов, такие как метоксид натрия и этоксид натрия. Примерами неорганического основания являются гидриды щелочных металлов, такие как гидрид натрия и гидрид калия; гидриды щелочноземельных металлов, такие как гидрид кальция; гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и карбонат цезия, и гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия. Примерами предпочтительного основания для защиты гидроксильной группы силильной защитной группой являются ароматические основания, такие как имидазол и 4-диметиламинопиридин, и третичные амины, такие как триэтиламин. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами таких растворителей являются описанные выше инертные растворители, из которых предпочтительными примерами являются тетрагидрофуран, дихлорметан и N,N-диметилформамид. Время реакции составляет от 10 минут до трех суток, предпочтительно, одни-двое суток. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 50°С. Количество хлорида, бромида или трифторметансульфата и основания, используемых в реакции, составляет по отношению к соединению 6-дезокси 11107D 1-20 эквивалентов и 0,5-30 эквивалентов, предпочтительно, 1-15 эквивалентов и 0,5-20 эквивалентов, соответственно.
Гидроксильная(ые) группа(ы) соединения 6-дезокси 11107D может(гут) быть избирательно защищена(ы) путем выбора реагента и его эквивалентности, используемых для защиты гидроксильной(ых) группы или групп. Например, соединение, в котором избирательно защищают гидроксильные группы в положении 3 и положении 21, может быть получено проведением реакции при комнатной температуре с использованием хлортриэтилсилана, триэтиламина и 4-диметиламинопиридина в дихлорметане или трет-бутилхлордиметилсилана и имидазола в N,N-диметилформамиде. По этой методике, например, гидроксильная группа в положении 3 может быть избирательно защищена ограничением эквивалентности хлортриэтилсилана или трет-бутилхлордиметилсилана. Кроме того, после защиты двух или трех из четырех гидроксильных групп силильной группой остальные две или одну гидроксильную группу можно защитить указанными выше этоксиэтильными группами или тому подобное.
Стадия А2 является стадией получения соединения формулы (IIA). Эту стадию осуществляют превращением ацетоксигруппы соединения формулы (IA) в гидроксильную группу обработкой основания в инертном растворителе.
Примерами основания являются неорганические основания, включающие гидриды щелочных металлов, такие как гидрид натрия и гидрид калия; гидриды щелочноземельных металлов, такие как гидрид кальция; гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, и алкоксиды металлов, такие как метоксид лития, метоксид натрия, этоксид натрия и трет-бутоксид калия, а также такие основания, как гуанидин и аммиак. Предпочтительными примерами основания являются карбонат калия и гуанидин.
Примеры инертного растворителя, используемого в реакции, включают, кроме указанных выше инертных растворителей, спиртовые растворители, такие как метанол, этанол, изопропанол и трет-бутанол, и воду. Указанные растворители могут быть использованы в смеси двух или более растворителей. Предпочтительным примером растворителя является спиртовой растворитель или смесь спирта и галогенсодержащего растворителя. Время реакции составляет от 10 минут до пяти суток, предпочтительно, от 30 минут до одних суток. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, равна комнатной температуре. Количество основания, используемого в реакции, по отношению к соединению формулы (IA) составляет 1-10 эквивалентов и, предпочтительно, 2-5 эквивалентов.
Стадия А3 является стадией получения соединения формулы (IIIA). Данную стадию осуществляют обработкой гидроксильной группы соединения формулы (IIA) производным хлорформиата или карбонилдиимидазолом в присутствии основания. Примерами производного хлорформиата являются 4-нитрофенилхлорформиат, фенилхлорформиат, 4-хлорфенилхлорформиат, 4-бромфенилхлорформиат и 2,4-динитрофенилхлорформиат. Примерами основания являются указанные выше органические основания и неорганические основания. Предпочтительно, используют, например, диизопропилэтиламин, 4-диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами таких растворителей являются описанные выше инертные растворители, из которых, предпочтительно, используют, например, тетрагидрофуран, дихлорметан и N,N-диметилформамид. Количество производного хлорформиата и основания, используемых в реакции, по отношению к соединению формулы (IIA) составляет 1-10 эквивалентов и 1-20 эквивалентов, соответственно, предпочтительно, 1-5 эквивалентов и 1-10 эквивалентов, соответственно. Время реакции составляет от 10 минут до 30 часов, предпочтительно, один-четыре часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 50°С.
Что касается гидроксильного соединения (IA), в котором одна-три из групп OR3А, OR6А, OR16А и OR21А не были защищены на стадии А1, то гидроксильная группа может быть превращена в карбонатную группу на стадии А3. В частности, гидроксильные группы соединения (IA), отличные от гидроксильной группы в положении 7 соединения (IA), могут быть превращены в карбонатные группы так же, как в случае гидроксильной группы в положении 7, обработкой соединения основанием и производным хлорформиата в эквивалентах, соответствующих числу гидроксильных групп, превращаемых в карбонатные.
Стадия А4 является стадией получения соединения формулы (IVA). Данную стадию осуществляют обработкой карбоната в соединении формулы (IIIA) амином (RN1RN2H), которая может образовать требуемое соединение формулы (I), в инертном растворителе в присутствии основания или одним только амином.
Примерами амина, используемого на данной стадии, являются метиламин, этиламин, пропиламин, бутиламин, октиламин,
дециламин, циклопропиламин, циклопентиламин, циклогексиламин,
диметиламин, диэтиламин, этилметиламин, этилендиамин,
1,3-пропандиамин, 1,4-бутандиамин, N,N-диметилэтилендиамин,
N,N-диметил-1,3-пропандиамин, N,N-диметил-1,4-бутандиамин,
N,N-диэтилэтилендиамин, N,N-диэтил-1,3-пропандиамин,
N,N-диэтил-1,4-бутандиамин, N,N,N'-триметилэтилендиамин,
N,N,N'-триметил-1, 3-пропандиамин,
N,N,N'-триметил-1,4-бутандиамин,
N-этил-N',N'-диметилэтилендиамин,
N-этил-N',N'-диметил-1,3-пропандиамин,
N-этил-N',N'-диметил-1,4-бутандиамин,
N,N,N'-триэтилэтилендиамин, N,N,N'-триэтил-1,3-пропандиамин,
N,N,N'-триэтил-1,4-бутандиамин, N,N-диэтил-N'-метилэтилендиамин,
N,N-диэтил-N'-метил-1,3-пропандиамин,
N,N-диэтил-N'-метил-1,4-бутандиамин,
N,N'-диметил-N-фенилэтилендиамин,
N,N'-диметил-N-фенил-1,3-пропандиамин,
N-бензил-N,N'-диметилэтилендиамин,
N-бензил-N,N'-диметил-1,3-пропандиамин, морфолин, тиоморфолин,
тиоморфолин-S-оксид, тиоморфолин-S,S-диоксид, пирролидин,
пиперидин, пиперазин, гомопиперазин, 4-гидроксипиперидин,
4-метоксипиперидин, 1-метилпиперазин, 1-этилпиперазин,
1-пропилпиперазин, 1-бутилпиперазин, 1-изопропилпиперазин,
1-циклобутилпиперазин, 1-циклопентилпиперазин,
1-циклогексилпиперазин, 1-циклогептилпиперазин,
1-циклооктилпиперазин, 1-(циклопропилметил)пиперазин,
1-бензилпиперазин, 1-метилгомопиперазин, 1-этилгомопиперазин,
1-(2-аминоэтил)пирролидин, 1-(2-(N-метиламино)этил)пирролидин),
1-(3-аминопропил)пирролидин,
1-(3-(N-метиламино)пропил)пирролидин), 1-(2-аминоэтил)пиперидин,
1-(2-(N-метиламино)этил)пиперидин), 1-(3-аминопропил)пиперидин,
1-(3-(N-метиламино)пропил)пиперидин), 4-(2-аминоэтил)морфолин,
4-(2-(метиламино)этил)морфолин), 4-(3-аминопропил)морфолин,
4-(3-(N-метиламино)пропил)морфолин),
1-(2-аминоэтил)-4-метилпиперазин,
1-(3-аминопропил)-4-метилпиперазин,
1-(3-(N-метиламино)пропил)-4-метилпиперазин,
1-амино-4-метилпиперидин, 1-метиламино-4-метилпиперидин,
1-этил-4-(N-метиламино)пиперидин,
1-метиламино-4-пропилпиперидин,
1-бутил-4-(N-метиламино)пиперидин,
1-(N,N-диметиламино)пиперидин, 1-(N,N-диэтиламино)пиперидин,
4-(пирролидин-1-ил)пиперидин, 4-(пиперидин-1-ил)пиперидин,
3-аминохинуклидин, 3-(N-метиламино)хинуклидин, анилин,
N-метиланилин, N,N-диметил-п-фенилендиамин,
N,N-диметил-м-фенилендиамин, N,N,N'-триметил-п-фенилендиамин,
N,N,N'-триметил-м-фенилендиамин, 1-нафтиламин, 2-нафтиламин,
бензиламин, N-метилбензиламин, фенетиламин, N-метилфенетиламин,
2-пиколиламин, 3-пиколиламин, 4-пиколиламин,
N-метил-2-пиколиламин, N-метил-3-пиколиламин,
N-метил-4-пиколиламин, 2,5-диазабицикло[2.2.1]гептан,
2-метил-2,5-диазабицикло[2.2.1]гептан,
3,8-диазабицикло[3.2.1]октан и 1,4-диазабицикло[4.3.0]нонан.
Примерами основания являются указанные выше органические основания и неорганические основания, из которых, предпочтительно, используют, например, диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами таких растворителей являются описанные выше инертные растворители, из которых, предпочтительно, используют, например, тетрагидрофуран, дихлорметан и N,N-диметилформамид. Количество амина и основания, используемых в реакции, по отношению к соединению формулы (IIIA) составляет 1-10 эквивалентов и 2-20 эквивалентов, соответственно, предпочтительно, 1,5-5 эквивалентов и 2-10 эквивалентов, соответственно. Время реакции составляет от 10 минут до 30 часов, предпочтительно, один-два часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 50°С.
Соединение формулы (IVA) может быть также получено обработкой соединения формулы (IIA) изоцианатом в инертном растворителе в присутствии основания и/или хлорида меди(1). Изоцианат особо не ограничивают и он может представлять собой, например, этилизоцианат, метилизоцианат или фенилизоцианат. Примерами основания являются указанные выше органические основания и неорганические основания, из которых, предпочтительно, используют, например, диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами таких растворителей являются описанные выше инертные растворители, из которых, предпочтительно, используют, например, тетрагидрофуран, дихлорметан и N,N-диметилформамид. Количество основания и изоцианата, используемых в реакции, по отношению к соединению формулы (IIIA) составляет 3-100 эквивалентов и 1-20 эквивалентов, соответственно, предпочтительно, 5-20 эквивалентов и 3-10 эквивалентов, соответственно. В случае использования хлорида меди(1) его количество составляет 1-10 эквивалентов, предпочтительно, 2-6 эквивалентов. Время реакции составляет от 10 минут до 30 часов, предпочтительно, один-два часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 50°С.
Далее, соединение с гидроксильной группой, в котором одна или две из групп OR3х, OR16х и OR21х не были защищены на стадии А1, может быть превращено в производное, содержащее несколько уретановых структур, превращением гидроксильной группы в карбонатную группу на стадии А3 и затем превращением карбонатной группы в карбамоилоксигруппу на стадии А4.
Стадия А5 является стадией получения соединения формулы (VA). Данную стадию осуществляют, подвергая производное уретана формулы (IVA) обработке для снятия защиты в инертном растворителе так, как описано ниже. Реакцию удаления защитной группы гидроксильной группы, которую изменяют в зависимости от типа защитной группы, осуществляют методом, хорошо известным в химии органического синтеза.
Реакция снятия защиты для соответственных гидроксильных групп, защищенных, например, 1-этоксиэтилом, тетрагидропиранилом, 1-метоксициклогексилом, 4-метокситетрагидропиранилом, 4-метокситетрагидротиопиранилом или S,S-диоксидом 4-метокситетрагидротиопиранила, может быть легко осуществлена обработкой кислотой в инертном растворителе. В качестве кислоты используют указанные выше органические и неорганические кислоты и тому подобное. Предпочтительными примерами является п-толуолсульфонат пиридиния, п-толуолсульфоновая кислота и камфорсульфоновая кислота. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с предшественником. Предпочтительными являются, например, спиртовые растворители, такие как метанол, этанол, изопропанол и трет-бутанол. Указанные растворители могут быть использованы в смеси с описанными выше инертными растворителями. Количество кислоты, используемой в реакции, по отношению к соединению формулы (IVA) составляет 0,5-5 эквивалентов и, предпочтительно, 1-3 эквивалента. Время реакции составляет от 10 минут до десяти суток, предпочтительно, одни-четверо суток. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 50°С.
Далее, в случае, когда гидроксильная группа защищена другой защитной группой, например, трет-бутилдиметилсилилом, триэтилсилилом, диэтилизопропилсилилом, триметилсилилом, триизопропилсилилом, ди-трет-бутилметилсилилом или дифенилметилсилилом, защитная группа может быть удалена, например, обработкой фтор-анионом или кислотой. В качестве фтор-аниона используют, например, тетрабутиламмонийфторид, фтористый водород, фторид калия и хлористый водород-пиридин. В качестве кислоты используют указанные выше органические и неорганические кислоты и тому подобное. Предпочтительными примерами являются уксусная кислота, муравьиная кислота, трифторуксусная кислота, п-толуолсульфонат пиридиния и камфорсульфоновая кислота. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами являются указанные выше инертные растворители, из которых, предпочтительно, используют, например, тетрагидрофуран, диэтиловый эфир и воду. Количество фтор-аниона и кислоты, используемых в реакции, по отношению к соединению формулы (IVA) составляет 1-5 эквивалентов и 0,5-5 эквивалентов, соответственно, предпочтительно, 1-4 эквивалента и 0,5-3 эквивалента, соответственно. Время реакции составляет от 10 минут до 30 часов, предпочтительно, один-два часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 50°С.
Сочетанием различных способов защиты гидроксильных групп, описанных на первой стадии, и различных способов защиты, описанных на пятой стадии, каждая из гидроксильных групп в положении 3 и положении 21 может быть избирательно подвергнута реакции образования производного с получением производного уретана.
Кроме того, метод избирательной модификации гидроксильной группы в положении 3 или положении 21, осуществляемый с использованием различных сочетаний методов защиты и снятия защиты, может быть также применен к другим методам модификации, описанным ниже.
В. Способ получения производного тиоуретана

В формулах R3х, R16х и R21х являются такими, как определено выше; R3с, R16с и R21с независимо представляют собой атом водорода, защитную группу или группу, представленную формулой RN1RN2N-CS-, где RN1 и RN2 являются такими, как определено выше, при условии, что R3с, R16с и R21с не представляют собой одновременно атом водорода; и R3d, R16d и R21d независимо представляют собой атом водорода или группу, представленную формулой RN1RN2N-CS-, где RN1 и RN2 являются такими, как определено выше.
Стадия В1 является стадией синтеза соединения формулы (IB) с использованием изотиоцианата или тиокарбамоилхлорида вместо изоцианата. Данную стадию осуществляют обработкой соединения формулы (IIA) изотиоцианатом или тиокарбамоилхлоридом в инертном растворителе в присутствии основания или оксида бис(трибутилолова). Изотиоцианат, используемый в данной реакции, особо не ограничивают, и он может представлять собой, например, этилизотиоцианат, метилизотиоцианат, фенилизотиоцианат,
бензилизотиоцианат, аллилизотиоцианат,
2-(N,N-диметиламино)этилизотиоцианат,
2-(N,N-диэтиламино)этилизотиоцианат,
3-(N,N-диметиламино)пропилизотиоцианат,
3-(N,N-диэтиламино)пропилизотиоцианат,
2-(морфолин-4-ил)этилизотиоцианат,
2-(пиперидин-1-ил)этилизотиоцианат и
2-(пирролидин-1-ил)этилизотиоцианат. Тиокарбамоилхлорид, используемый в данной реакции, особо не ограничивают, и он может представлять собой, например, N,N-диметилтиокарбамоилхлорид, N-фенил-N-метилтиокарбамоилхлорид, (морфолин-4-ил)тиокарбамоилхлорид, (4-метилпиперазин-1-ил)тиокарбамоилхлорид и (4-метилгомопиперазин-1-ил)тиокарбамоилхлорид. Примерами основания являются указанные выше органические основания и неорганические основания, из которых, предпочтительно, используют, например, диизопропилэтиламин, 4-диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами растворителя являются описанные выше инертные растворители, из которых, предпочтительно, используют, например, тетрагидрофуран, дихлорметан, N,N-диметилформамид и толуол. Количество основания или оксида бис(трибутилолова) и изотиоцианата или тиокарбамоилхлорида по отношению к соединению формулы (IIA) составляет 1-5 эквивалентов и 1-10 эквивалентов, соответственно, предпочтительно, 1-3 эквивалента и 2-5 эквивалентов, соответственно. Время реакции составляет от 10 минут до 72 часов, предпочтительно, 1-24 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 70°С.
Кроме того, превращением гидроксильной группы в соединении формулы (IIA), где один или два из OR3х, OR16х и OR21х не были защищены, в тиокарбамоилоксигруппу на стадии В1 может быть также синтезировано соединение формулы (IB), содержащее несколько тиокарбамоильных групп.
Затем удалением защитной(ых) группы или групп гидроксильной группы в соответствии со стадией А5 может быть синтезировано производное тиоуретана формулы (IIB).
С. Способ получения производного простого эфира

В формулах R3е, R16е и R21е независимо представляют собой атом водорода или защитную группу, при условии, что R3е, R16е и R21е не представляют собой одновременно атом водорода и, по крайней мере, один из R3е, R16е и R21е представляет собой атом водорода; R3f, R16f и R21f независимо представляют собой защитную группу или С1-С22алкильную группу, которая может иметь заместитель; R3g, R16g и R21g независимо представляют собой атом водорода, алкильную группу или карбамоильную группу; и R7g представляет собой ацетильную группу или карбамоильную группу.
Стадия С1 является стадией синтеза соединения формулы (IC). Данную стадию осуществляют таким же образом, как реакцию стадии А1 метода А. Но число защищенных гидроксильных групп равно единице или двум.
Альтернативно, соединение, в котором один из заместителей в положении 3 и положении 21 представляет собой гидроксильную группу, а другой - защищенную гидроксильную группу, может быть синтезировано сочетанием различных способов защиты гидроксильной группы, соответствующих стадии А1 способа А, и различных методов снятия защиты с защищенной гидроксильной группы, соответствующих стадии А5.
Стадия С2 является стадией синтеза соединения формулы (IIC). Данную стадию осуществляют алкилированием незащищенной гидроксильной группы или групп в соединении (IC).
Алкилирование может быть осуществлено обработкой алкилирующим агентом формулы Rm-Х в присутствии основания. Заместитель Rm представляет собой С1-С22алкильную группу, которая может иметь заместитель и включает, например, метильную группу, этильную группу и бензильную группу. Х представляет собой уходящую группу. Примерами уходящей группы являются хлор, бром, иод и трифторметансульфонильная группа. Примерами основания являются указанные выше органические и неорганические основания, из которых предпочтительными примерами являются гидрид натрия, бис(триметилсилил)амид лития, диизопропиламид лития, дициклогексиламид лития, карбонат калия, карбонат цезия и 1,8-бис(N,N-диметиламино)нафталин. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами являются описанные выше инертные растворители, из которых, предпочтительно, используют, например, диэтиловый эфир, тетрагидрофуран, диметоксиэтан и толуол. Количество алкилирующего агента и основания, используемых в реакции, по отношению к соединению формулы (IC) составляет 3-20 эквивалентов и 5-30 эквивалентов, соответственно, предпочтительно, 3-5 эквивалентов и 5-10 эквивалентов, соответственно. Время реакции составляет от 10 минут до 48 часов, предпочтительно, 1-24 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 70°С.
Стадия С3 является стадией синтеза соединения формулы (IIIC). На данной стадии осуществлением стадии А2, стадии А3, стадии А4 и стадии А5, когда требуется, может быть получено соединение, модифицированное как карбамоильной группой, так и алкильной группой. Кроме того, осуществлением только стадии А5 может быть получено соединение, подвергнутое только лишь алкилированию. Стадия С3 может быть осуществлена с использованием условий реакций стадии А2, стадии А3, стадии А4 и стадии А5.

В формулах R3х, R16х и R21х - такие же, как определенные ранее, и R3f', R7f', R16f' и R21f' независимо представляют собой атом водорода или алкильную группу.
Производное простого эфира, представленное формулой (IIC'), где гидроксильная группа в положении 7 алкилирована, может быть получено, подвергая соединение формулы (IIA) реакции стадии С2 и затем реакции стадии А5 способом, подобно описанному выше.
Кроме того, в данном случае производное, в котором тиокарбамоильная группа введена в гидроксильную группу в положении 7 и алкильная группа введена в одну или две гидроксильные группы в положении 3 и положении 21, может быть получено, подвергая соединение формулы (IIIC) реакции стадии В1 и затем реакции стадии А5.
Далее, использованием ненасыщенного алкилирующего агента, аралкилирующего агента или гетероаралкилирующего агента, способного дать требуемое соединение формулы (I), вместо алкилирующего агента, описанного выше, может быть получено соответствующее производное простого эфира.
D. Способ получения производного сложного эфира

В формулах R3е, R16е и R21е независимо представляют собой атом водорода или защитную группу, при условии, что R3е, R16е и R21е не представляют собой одновременно атом водорода и, по крайней мере, один из R3е, R16е и R21е представляет собой атом водорода; и R3h, R16h и R21h независимо представляют собой атом водорода или группу, представленную формулой RСОСО-, где RСО представляет собой атом водорода, С1-С22алкильную группу, которая может иметь заместитель, ненасыщенную С2-С22алкильную группу, которая может иметь заместитель, С6-С14арильную группу, которая может иметь заместитель, 5-14-членную гетероарильную группу, которая может иметь заместитель, С7-С22аралкильную группу, которая может иметь заместитель, или 5-14-членную гетероаралкильную группу, которая может иметь заместитель, при условии, что R3h, R16h и R21h не представляют собой одновременно атом водорода.
Стадия D1 является стадией превращения гидроксильной группы, которая не была защищена, в сложноэфирную группу с использованием соединения формулы (IC), синтезированного на стадии С1, в качестве исходного вещества.
Этерификацию осуществляют, например, используя ангидрид кислоты в сочетании с основанием, галогенангидирид кислоты в сочетании с основанием, карбоновую кислоту в сочетании с конденсирующим агентом или реакцию Мицунобу. В качестве ангидрида кислоты используют различные ангидриды карбоновых кислот. Примеры включают смешанный ангидрид, содержащий, например, уксусную кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту или бензойную кислоту; симметричный ангидирид; циклический ангидрид, такой как янтарный ангидрид, глутаровый ангидрид или адипиновый ангидрид. Предпочтительными являются уксусный ангидрид, пропионовый ангидрид, масляный ангидрид, бензойный ангидрид и тому подобное. В качестве галогенангидрида используют, например, различные хлорангидриды и бромангидриды, из которых предпочтительным примером является ацетилхлорид, пропионилхлорид, бензоилхлорид и бензоилбромид. Примерами основания являются указанные выше органические и неорганические основания, из которых предпочтительными примерами являются имидазол, 4-диметиламинопиридин, пиридин и гидрид натрия. В качестве карбоновой кислоты используют различные карбоновые кислоты, из которых предпочтительными являются, например, уксусная кислота и пропионовая кислота. В качестве конденсирующего агента предпочтительными являются, например, дициклогексилкарбодиимид, трифторуксусный ангидрид, карбонилдиимидазол, N,N-диизопропилкарбодиимид и 1-этил-3-(3-диметиламинопропил)карбодиимид. В реакции Мицунобу гидроксильная группа может быть замещена различными карбоновыми кислотами в присутствии трифенилфосфина и диэтилазодикарбоксилата или диизопропилазодикарбоксилата. Растворитель, используемый в каждой из реакций, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами являются описанные выше инертные растворители, из которых, предпочтительно, используют, например, дихлорметан, хлороформ и тетрагидрофуран. Количество используемых в реакции ангидрида кислоты вместе с основанием, галогенангидирида вместе с основанием и карбоновой кислоты вместе с конденсирующим агентом по отношению к соединению формулы (IC) составляет 1-10 эквивалентов с 3-20 эквивалентами, 1-10 эквивалентов с 3-20 эквивалентами и 1-20 эквивалентов с 1-20 эквивалентами, соответственно, предпочтительно, 1-5 эквивалентов с 2-10 эквивалентами, 1-5 эквивалентов с 2-10 эквивалентами и 1-5 эквивалентов с 1-5 эквивалентами, соответственно. Кроме того, реакция может быть, когда необходимо, ускорена добавлением 0,2-2 эквивалентов 4-диметиламинопиридина. Время реакции составляет от 10 минут до 30 часов, предпочтительно, один-два часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 50°С.
Затем удалением защитной группы для гидроксильной группы синтезированного таким образом сложноэфирного производного по методике, подобно описанной для стадии А5, может быть получено соединение формулы (ID).
Кроме того, проводя реакцию этерификации, подобную реакции на стадии D1, с использованием соединения 6-дезокси 11107D в качестве исходного вещества, можно также этерифицировать одну-три гидроксильные группы.

В формулах R3х, R16х и R21х являются такими, как определено выше, и R3h', R7h', R16h' и R21h' независимо представляют собой атом водорода или группу, представленную формулой RСОСО-, где RСО представляет собой такую же группу, как определено выше.
Производное, представленное формулой (ID'), где гидроксильная группа в положении 7 этерифицирована, можно получить, подвергая соединение формулы (IIA) стадии D1 по методике, описанной выше, и затем подвергая продукт стадии А5.
Е. Способ получения производного сложного эфира фосфорной кислоты или производного сложного эфира амидофосфорной кислоты

В формулах R3х, R16х и R21х являются такими, как определено выше, и R3i, R7i, R16i и R21i независимо представляют собой атом водорода, группу, представленную формулой (RN3О)2PO-, (RN1RN2N)2PO- или (RN1RN2N)(RN3О)PO-, где RN1, RN2 и RN3 имеют такие же значения, как определено выше.
Стадия Е1 является стадией превращения гидроксильной группы соединения формулы (IIA) как исходного вещества в сложный эфир фосфорной кислоты или сложный эфир амидофосфорной кислоты.
Образование сложного эфира фосфорной кислоты осуществляют, например, используя фосфорилгалогенид и основание. В качестве фосфорилгалогенида в настоящем изобретении можно использовать различные его типы, примерами которых являются диалкоксифосфорилхлорид, дифенилоксифосфорилхлорид, алкокси(N,N-дизамещенный амино)фосфорилхлорид, аллилокси(N,N-дизамещенный амино)фосфорилхлорид, алкокси(N-замещенный амино)фосфорилхлорид и аллилокси(N-замещенный амино)фосфорилхлорид. Примерами основания являются указанные выше органические и неорганические основания, из которых предпочтительными примерами являются пиридин, 4-диметиламинопиридин, триэтиламин, этилдиизопропиламин, гидрид натрия, н-бутиллитий, карбонат калия и карбонат натрия. Растворитель, используемый в каждой из реакций, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами являются описанные выше инертные растворители, из которых, предпочтительно, используют, например, дихлорметан, хлороформ, тетрагидрофуран и N,N-диметилформамид. Время реакции составляет от 10 минут до 72 часов, предпочтительно, 1-24 часа. Количество фосфорилгалогенида и основания, используемых в реакции, по отношению к соединению формулы (IIA) составляет 1-10 эквивалентов и 2-20 эквивалентов, соответственно, предпочтительно, 1-5 эквивалентов и 2-10 эквивалентов, соответственно. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 50°С.
Затем удалением защитной группы для гидроксильной группы синтезированного таким образом производного сложного эфира фосфорной кислоты по аналогичной методике, проводимой на стадии А5, может быть получено соединение формулы (IE).
Кроме того, осуществляя образование сложного эфира фосфорной кислоты способом, подобно стадии Е1, с использованием соединения 6-дезокси 11107D в качестве исходного вещества, можно также преобразовать в сложные эфиры фосфорной кислоты одну-четыре гидроксильные группы.
F. Способ получения производного сложного эфира серной кислоты или производного сложного эфира сульфаминовой кислоты

В формулах R3х, R16х и R21х являются такими, как определено выше, и R3j, R7j, R16j и R21j независимо представляют собой атом водорода или группу, представленную формулой RN1RN2N-SO2- или RN4О-SO2-, где RN1, RN2 и RN4 независимо представляют собой такую же группу, как определено выше.
Стадия F1 является стадией превращения гидроксильной группы соединения формулы (IIA) как исходного вещества в сложный эфир серной кислоты.
Образование сложного эфира серной кислоты осуществляют, используя галогенангидрид серной кислоты и основание или тому подобное. В качестве галогенангидрида серной кислоты можно использовать различные его типы. Примеры включают алкоксисульфонилхлорид и N,N-дизамещенный сульфамоилхлорид. В качестве основания можно использовать указанные выше органические и неорганические основания и тому подобное. Предпочтительными являются, например, пиридин, 4-диметиламинопиридин, триэтиламин, этилдиизопропиламин, гидрид натрия, н-бутиллитий, карбонат калия и карбонат натрия. Растворитель, используемый в каждой из реакций, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с предшественником. Могут быть использованы описанные выше инертные растворители. Предпочтительно, используют, например, дихлорметан, хлороформ, тетрагидрофуран и N,N-диметилформамид. Количество галогенангидрида серной кислоты и основания, используемых в реакции, по отношению к соединению формулы (IIA) составляет 1-10 эквивалентов и 2-20 эквивалентов, соответственно, предпочтительно, 1-5 эквивалентов и 2-10 эквивалентов, соответственно. Время реакции составляет от 10 минут до 72 часов, предпочтительно, 1-24 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и, предпочтительно, от -10°С до 50°С.
Затем удалением защитной группы для гидроксильной группы синтезированного таким образом производного сложного эфира серной кислоты по аналогичной методике стадии А5, может быть синтезировано соединение формулы (IF).
Кроме того, осуществляя образование сложного эфира серной кислоты способом, подобно стадии F1, с использованием соединения 6-дезокси 11107D в качестве исходного вещества, можно также преобразовать в сложные эфиры серной кислоты одну-четыре гидроксильные группы.
G. Способ получения галогенсодержащего производного

В формулах R3х, R16х и R21х являются такими, как определено выше, и R3k, R16k и R21k независимо представляют собой гидроксильную группу или атом галогена.
Стадия G1 является стадией превращения гидроксильной группы в галоген с использованием соединения формулы (IA) в качестве исходного вещества.
Данная реакция галогенирования может быть осуществлена, обработкой диэтиламиносератрифторида (DAST) или трифенилфосфина, например, тетрабромидом углерода, бромом, трибромидом фосфора, иодом или тетрахлоридом углерода в присутствии основания. В качестве основания могут быть использованы обычные органические и неорганические основания, например диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с предшественником. Примерами являются тетрагидрофуран, дихлорметан и N,N-диметилформамид. В частности, предпочтительной является реакция фторирования с использованием диэтиламиносератрифторида. Количество диэтиламиносератрифторида (DAST), используемого в реакции, по отношению к соединению формулы (IA) составляет 1-5 эквивалентов и, предпочтительно, 1-3 эквивалентам. Время реакции составляет от 10 минут до 10 часов. Температура реакции находится в интервале от -78°С до комнатной температуры.
Затем удалением защитной группы для гидроксильной группы в группах синтезированного таким образом галогенсодержащего производного по методике стадии А5, может быть синтезировано соединение формулы (IG).
Н. Способ получения производного сложного эфира сульфоновой кислоты

В формулах R3х, R16х и R21х являются такими, как определено выше, и R3l, R7l, R16l и R21l независимо представляют собой атом водорода или группу, представленную формулой RN5SO2-, где RN5 представляет собой такую же группу, как определено выше.
Стадия Н1 является стадией сульфонилирования гидроксильной группы с использованием соединения формулы (IIA) в качестве исходного вещества.
Сульфонилирование может быть осуществлено обработкой сульфонилхлоридом, таким, например, как п-толуолсульфонилхлорид, метансульфонилхлорид и бензолсульфонилхлорид, в присутствии основания. В качестве основания можно использовать обычные органические и неорганические основания, например диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами являются тетрагидрофуран, дихлорметан и N,N-диметилформамид. Количество сульфонилхлорида и основания, используемых в реакции, по отношению к соединению формулы (IIA) составляет 1-5 эквивалентов и 2-10 эквивалентов, соответственно, предпочтительно, 1-3 эквивалента и 2-6 эквивалентов, соответственно. Время реакции составляет от 10 минут до 30 часов. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником.
Затем удалением защитной группы для гидроксильной группы в синтезированном таким образом галогенсодержащем производном по методике стадии А5, может быть синтезировано производное, представленное формулой (IH), в котором гидроксильная группа сульфонилирована в положении 7.
Кроме того, осуществляя этерификацию способом, подобно стадии Н1, с использованием соединения 6-дезокси 11107D в качестве исходного вещества, можно также сульфонилировать одну-четыре гидроксильные группы.
I. Способ получения производного амина

В формулах R3х, R16х и R21х являются такими, как определено выше, и R3m, R7m, R16m и R21m независимо представляют собой гидроксильную группу или группу формулы RN1RN2N-, где RN1 и RN2 независимо представляют собой такую же группу, как определено выше.
Стадия I1 является стадией превращения гидроксильной группы непосредственно в амин или стадию превращения гидроксильной группы в удобную уходящую группу, затем превращения уходящей группы в азид и последующего превращения азида в амин восстановлением, используя соединение формулы (IIA) в качестве исходного вещества.
В случае, когда гидроксильную группу превращают в азид, можно использовать, например, 1) дифенилфосфорилазид (DPPA), диэтилазодикарбоксилат и трифенилфосфин, 2) DPPA и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), 3) азид водорода, диэтилазодикарбоксилат и трифенилфосфин, 4) DPPA, тетраметилазодикарбоксамид (TMAD) и трибутилфосфин или 5) азид натрия в присутствии основания. В качестве основания можно использовать указанные выше органические и неорганические основания. Предпочтительно, используют, например, диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Кроме того, гидроксильную группу можно также превращать в азид обработкой азидом натрия в присутствии палладиевого катализатора. Примером палладиевого катализатора является Pd(PPh3)4. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами являются тетрагидрофуран, дихлорметан, N,N-диметилформамид, толуол и бензол. Время реакции составляет от 10 минут до 30 часов. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником.
Восстановление азида до амина может быть осуществлено, используя, например, трифенилфосфин или литийалюминийгидрид. Кроме того, восстановление до амина может быть осуществлено с использованием катализатора, такого как палладий на углероде или катализатор Линдлара, в атмосфере водорода. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами являются тетрагидрофуран, диэтиловый эфир и этанол. Время реакции составляет от 10 минут до 30 часов. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником.
Гидроксильная группа может быть превращена в подходящую уходящую группу по методике, подобно описанной для стадии G1 (галогенирование) или для стадии Н1 (сульфонилирование). Примерами подходящей уходящей группы являются хлор, бром, иод, ментансульфонильная группа и п-толуолсульфонильная группа.
Затем обработкой указанного соединения, в котором гидроксильная группа превращена в уходящую группу, амином в инертном растворителе в присутствии основания можно синтезировать соединение, в котором гидроксильная группа превращена в аминогруппу или в аминогруппу, имеющую заместитель.
Примерами используемого амина являются метиламин, этиламин, диметиламин и диэтиламин. В качестве основания можно использовать указанные выше органические и неорганические основания и тому подобное. Предпочтительно, используют, например, диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Могут быть использованы указанные выше инертные растворители. Предпочтительно, используют, например, тетрагидрофуран, дихлорметан и N,N-диметилформамид. Время реакции составляет от 10 минут до 30 часов, предпочтительно, один-два часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником, предпочтительно, от -10°С до 50°С.
Затем удалением защитной группы для гидроксильной группы в синтезированном таким образом производном амина по аналогичной методике стадии А5, может быть получено соединение формулы (II). Кроме того, осуществляя аминирование по аналогичной методике стадии I1 с использованием 6-дезокси 11107D в качестве исходного вещества, можно также аминировать одну или две гидроксильные группы.
Кроме того, алкилированием, ацилированием, карбамоилированием или сульфонилированием аминогруппы, соответственно, соединения формулы (II) методом, хорошо известным в химии органического синтеза, или методам, описанным выше, может быть получено соединение формулы (I).
J. Способ получения кетосоединения (окисление гидроксильной группы)

В формулах любой один из R3Ja и R3Jb представляет собой гидроксильную группу, а другой представляет собой атом водорода, или R3Ja и R3Jb вместе с атомом углерода, к которому R3Ja и R3Jb присоединены, представляют собой оксогруппу; и один из R21Ja и R21Jb представляет собой гидроксильную группу, а другой представляет собой атом водорода, или R21Ja и R21Jb вместе с атомом углерода, к которому R21Ja и R21Jb присоединены, представляют собой оксогруппу.
Стадия J1 является стадией синтеза оксосоединения, представленного формулой (IIJ), окислением гидроксильной группы соединения 6-дезокси 11107D как исходного вещества.
Окислителем, используемым на данной стадии, является, например, диоксид марганца, хлорхромат пиридиния, дихромат пиридиния, реактив Десса-Мартина или реактивы, используемые в окислении по Сверну. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным веществом. Примерами являются тетрагидрофуран, дихлорметан, хлороформ и толуол. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником. Время реакции составляет от 10 минут до 78 часов. Среди указанных реакций предпочтительной является, например, реакция с использованием реактива Десса-Мартина, диоксида марганца или реактивов, используемых в окислении по Сверну. Особо предпочтительной является реакция с использованием реактива Десса-Мартина. В качестве растворителя для окисления с использованием реактива Десса-Мартина особо предпочтительными являются дихлорметан и хлороформ. Количество окислителя, используемого в реакции, относительно указанного соединения (6-дезокси 11107D) соответствует 1-20 эквивалентам, предпочтительно, 1-5 эквивалентам. Температура реакции находится в интервале от 0°С до комнатной температуры. Время реакции составляет от 30 минут до 24 часов, предпочтительно, один-восемь часов.
Далее, на стадии J1, используя соединение, полученное в результате предварительного образования производного способом, описанным выше для уретанового производного, тиоуретанового производного, сложноэфирного производного, алкилпроизводного или тому подобное, вместо 6-дезокси 11107D, может быть синтезировано соединение, в котором гидроксильная группа в положении 3 или положении 21 указанных производных превращена в оксофрагмент. Кроме того, окислением гидроксильной группы в положении 7 соединения, представленного формулой (IIA), также может быть получено 7-оксосоединение.
И еще, комбинируя различным образом методы защиты и снятия защиты на описанных выше стадиях А1 и А5 со стадией J1, гидроксильные группы в положении 3, положении 7 и/или положении 21 можно избирательно превратить в оксофрагмент. Кроме того, проводя реакцию образования, соответственно, уретанового производного, тиоуретанового производного, сложноэфирного производного или алкилпроизводного соединения, гидроксильная группа которого предварительно была превращена в оксофрагмент, в соответствии с описанным выше методом, можно синтезировать соединение, модифицированное как соответствующей модификацией, так и образованием оксопроизводного, соответственно.
Подходящей комбинацией реакций А-J и методов защиты и снятия защиты гидроксильной группы, описанных выше, может быть синтезировано соединение, представленное формулой (I).
По окончании реакции целевой продукт каждой реакции выделяют из реакционной смеси по традиционной методике. Например, целевое соединение может быть получено удалением нерастворимого вещества фильтрованием и удалением растворителя выпариванием подходящим способом, если нерастворимое вещество присутствует, или разбавлением реакционной смеси органическим растворителем, таким как этилацетат, промывкой смеси водой, сушкой органического слоя над безводным сульфатом магния и затем выпариванием растворителя. Целевой продукт при необходимости может быть затем очищен традиционным методом, например колоночной хроматографией, тонкослойной хроматографией или высокоэффективной жидкостной хроматографией.
Соединение формулы (I) может быть синтезировано из выделенного и очищенного 6-дезокси 11107D и соединения 6-дезокси 11107D с использованием обычных методов органического синтеза. Репрезентативные А. производные уретана, В. производные тиоуретана, С. производные простого эфира, D. производные сложного эфира, Е. производные сложного эфира фосфорной кислоты или производные сложного эфира моноамидофосфорной кислоты, F. производные сложного эфира серной кислоты и производные сложного эфира сульфаминовой кислоты, G. галогенсодержащие производные, Н. производные сложного эфира сульфоновой кислоты, I. производные амина и J. кетосоединения могут быть получены описанными выше способами путем изменения условий стадии 1А защиты гидроксильной группы.
Далее, для доказательства полезности настоящего изобретения определяли ингибирующее действие на транскрипцию VEGF, ингибирующее действие на пролиферацию клеток WiDr рака ободочной кишки человека, ингибирующее действие на пролиферацию солидной злокачественной опухоли, снижение массы тела (острая токсичность) и устойчивость в водном растворе соединений, как типичных представителей соединений формулы (I) по настоящему изобретению.
Пример 1 испытаний
Конструирование репортерной системы для скрининга соединения, ингибирующего транскрипцию VEGF
Чтобы получить репортерную систему, отражающую транскрипцию от VEGF промотора, клонировали последовательность VEGF промотора и вставляли ее в вектор плацентарной щелочной фосфатазы (PLAR) для конструирования репортерного вектора.
Для получения промоторной области человеческого VEGF клонировали VEGF геном из библиотеки фагов. На основе кДНК VEGF (GenBank accession number: Х62568) определяли ПЦР-праймер в последовательности, описанной как SEQ ID NO:1 или SEQ ID NO:2, для проведения ПЦР с получением фрагмента примерно из 340 п.о. Библиотеку геномных фагов человека (human genomic library, Clontech) скринировали с использованием указанного фрагмента в качестве зонда для получения pUC18-VEGFA, содержащего VEGF 5'-фланкирующую область примерно из 5,4 т.п.о. Используя Kpn I/Nhe I расщепляли pUC18-VEGFA с получением VEGF промоторной области примерно из 2,3 т.п.о. и вставляли ее в мультиклонирующий сайт Kpn I/Nhe I репортерного вектора плацентарной щелочной фосфатазы (PLAP) (Goto et al, Mol. Pharmacol., 49, 860-873, 1996), чтобы сконструировать вектор VEGF-PLAP.
Полученный вектор VEGF-PLAP вводили в клетки U251, культивированной в модифицированной Дульбекко среде Игла, содержащей 10% сыворотку плода коровы (DMEM; фирма-изготовитель SIGMA Co.), и клетки культивировали в присутствии 1 мг/мл G418 (Merck & Co., Inc.), чтобы создать устойчивый к G418 стабильный клон (клетки U251/1-8).
Как было подтверждено в сообщении Minchenko et al. (Cell. Mol. Biol. Res. 40, 35-39, 1994), клетки U251/1-8 являются репортерной системой, которая секретирует PLAP в культуральную среду в гипоксических условиях (инкубатор с 2% О2) и в которой отражается транскрипция от VEGF промотора. Используя полученный клон, осуществляли скрининг соединения, угнетающего продукцию VEGF, вызываемую гипоксической стимуляцией.
Пример 2 испытаний
Ингибирующая активность по отношению к транскрипции VEGF производного 6-дезокси 11107D
Чтобы исключить влияние щелочной фосфатазы в сыворотке, клетки U251/1-8 промывали два раза достаточным количеством PBS (забуференный фосфатом солевой раствор) и обрабатывали при 65°С в течение 20 мин, чтобы инактивировать щелочную фосфатазу в сыворотке. Клетки разбавляли в культуральной среде DMEM, содержавшей 10% указанной сыворотки, и высевали на 96-луночные планшеты по 4×104клеток/180 мкл на лунку.
Клетки культивирования в СО2 инкубаторе (5% СО2) при 37°С в течение ночи и добавляли 20 мкл описанного выше культурального раствора, содержавшего испытуемое соединение при 3-кратных серийных разведениях. Затем клетки культивировали в гипоксическом (2% СО2) инкубаторе в течение 18 часов. Для измерения PLAP активности в культуральном супернатанте к 50 мкл 0,28М Na2CO3-NaHCO3 буферного раствора (рН 10,0, 8,0 мМ MgSO4) добавляли 10 мкл культурального супернатанта и затем 50 мкл щелочного фосфатазного субстрата (Lumistain, Genome Science Laboratories Co., Ltd.). После осуществления взаимодействия в течение одного часа, определяли химическую люминесценцию с помощью микропланшетридера (Perkin Elmer) для измерения PLAP активности в виде активности щелочной фосфатазны. PLAP активность в условиях нормоксии устанавливали как 0%, PLAP активность клеток, обработанных в условиях гипоксии, устанавливали как 100% и концентрацию, угнетающую PLAP активность на 50%, устанавливали как IC50-значение PLAP. Определяли значения IC50 производных 6-дезокси 11107D, показанных в примерах (n=2-3). Значения IC50 репрезентативных соединений показаны в таблице 1.
Соединение формулы (I) показало высокую ингибирующую активность по отношению к транскрипции VEGF.
Пример 3 испытаний
Ингибирующая активность по отношению к пролиферации человеческих клеток WiDr рака ободочной кишки
Человеческие клетки WiDr рака ободочной кишки, культивированные в модифицированной Дульбекко среде Игла, содержавшей 10% сыворотку плода коровы, пенициллин (100 единиц/мл) и стрептомицин (100 мкг/мл) (DMEM, фирма-изготовитель Sigma Co.), высевали на 96-луночные планшеты по 2×303 клеток/лунка. Клетки культивировали в течение ночи в СО2 инкубаторе и добавляли 20 мкл описанного выше культурального раствора, содержавшего испытуемое соединение при 3-кратных серийных разведениях, для культивирования клеток. Через три дня добавляли 50 мкл раствора 3,3 мг/мл МТТ и затем клетки культивировали в течение одного часа. Затем формазан, образованный восстановлением с помощью живых клеток, экстрагировали 100 мкл ДМСО для определения оптической плотности (А540/А660), которую использовали в качестве показателя числа живых клеток.
Определяли концентрацию соединения формулы (I) для 50% ингибирования пролиферации клеток WiDr рака ободочной кишки человека на (n=2-3). Значения IC50 для репрезентативных соединений показаны в таблице 2.
Соединения формулы (I) показали высокую ингибирующую активность по отношению к пролиферации клеток WiDr рака ободочной кишки человека.
Пример 4 испытаний
Ингибирующая активность по отношению к росту солидной опухоли
Чтобы исследовать ингибирующую активность по отношению к росту солидной опухоли соединения формулы (I) in vivo, подкожно имплантировали человеческие клетки WiDr рака ободочной кишки в тело каждой голой мыши. Когда объем опухоли каждой мыши достигал примерно 100 мм3, мышей разделяли на группы так, чтобы обе группы имели одинаковый средний объем опухолей. Контрольная группа состояла из десяти мышей, а группа с введенными производными 6-дезокси 11107D - из пяти мышей. Производное вводили каждой мыши в группе, предназначенной для введения производного, внутривенной инъекцией в количестве 0,625 мг/кг/сутки, 1,25 мг/кг/сутки, 2,5 мг/кг/сутки, 5 мг/кг/сутки или 10 мг/кг/сутки, а каждой мыши из контрольной группы вводили носитель.
Измеряли объемы опухолей на день 15, чтобы определить относительный коэффициент объема опухоли (Т/С%), взяв объем опухоли контрольной группы за 100%. Каждый Т/С% для репрезентативных соединений формулы (I) показан в таблице 3. Измеряли массу тела на день начала введения, день 5, день 8, день 12 и день 15 (или 16), чтобы проверить относительные изменения массы тела в случае введения репрезентативных соединений, взяв массу тела на день начала введения за 100%. Минимальные относительные коэффициенты массы тела, которыми являются относительные коэффициенты массы тела на день, когда массы тела были наименьшими, показаны в таблице 3.
Соединение формулы (I) показало ингибирующую активность по отношению к росту WiDr опухоли ободочной кишки человека даже in vivo при дозе, не вызывающей существенного снижения массы тела.
Пример 5 испытания
Устойчивость в водном растворе
Соединение формулы (I) растворяли в ДМСО в концентрации 10-20 мМ и полученный раствор разбавляли примерно 500-кратно буферным раствором Бриттона-Робинсона с рН 7. Полученный раствор использовали в качестве раствора-образца и инкубировали при 25°С в течение 24 часов.
Раствор-образец до и после инкубации анализировали высокоэффективной жидкостной хроматографией с получением хроматограмм. Процентное содержание соединения, оставшегося в растворе-образце после инкубации, определяли из площади пика хроматограммы. Результаты для репрезентативных соединений показаны в таблице 4.
Хотя содержание FD895 уменьшилось до 83% через 24 часа, оставшееся процентное содержание соединений 18, 19, 20, 22, 39, 43, 44 и 45 как репрезентативных соединений формулы (I) составляло 95-96%. Данные результаты показывают, что производное 6-дезокси 11107D как соединение формулы (I) устойчиво в водных растворах.
Как видно из описанных выше примеров фармакологических испытаний, соединение формулы (I) по настоящему изобретению изменяет экспрессию генов и поэтому, в частности, ингибирует продукцию VEGF. Следовательно, как ожидается, соединение может быть использовано в качестве противоопухолевого средства, в частности, лекарственного средства для лечения солидной злокачественной опухоли, ингибитора метастаза рака, средства для лечения диабетической ретинопатии, средства для лечения ревматоидного артрита и средства для лечения экхимомы. Кроме того, как можно видеть из примера 4 испытания на токсичность, поскольку ингибирующее действие на рост опухоли WiDr ободочной кишки человека проявляется при дозе, не вызывающей существенного снижения массы тела тестируемой мыши, то соединение формулы (I) является высоко безопасным соединением. Следовательно, соединение эффективно для профилактики или лечения заболевания, против которого эффективно регулирование экспрессии генов, заболевания, против которого эффективна ингибирующая активность по отношению к продукции VEGF, и заболевания, против которого эффективна ингибирующая ангиогенез активность. «Профилактика или лечение» означает профилактику, лечение или и то, и другое. В частности, соединение формулы (I) по настоящему изобретению эффективно в качестве противоопухолевого средства или ингибитора метастазов опухоли, действующего против солидной злокачественной опухоли. Примеры солидной злокачественной опухоли включают рак поджелудочной железы, рак желудка, рак ободочной кишки, рак молочной железы, рак предстательной железы, рак легкого, рак почки, опухоль головного мозга, рак головы и шеи, рак пищевода, рак кожи, рак печени, рак матки, рак шейки матки, рак мочевого пузыря, рак щитовидной железы, рак яичка, ворсинчатую карциному, остеосаркому, саркому мягких тканей и рак яичника. Особенно предпочтительно использовать соединение против рака, такого как рак ободочной кишки, рак молочной железы, рак предстательной железы, рак легкого, рак головы и шеи или рак яичника. Кроме того, соединение эффективно также в качестве противоопухолевого средства для лечения лейкоза. Кроме того, соединение эффективно также в качестве средства для лечения гемангиомы. И более того, соединение эффективно в качестве средства для лечения диабетической ретинопатии, средства для лечения ревматоидного артрита или средства для лечения гемангиомы, основанного на ингибирующем действии на продукцию VEGF. В соответствии с другим вариантом, соединение эффективно также как средство для лечения воспалительных заболеваний, включающих остеоартрит, псориаз, аллергическую реакцию замедленного типа и атеросклероз.
Когда описанное выше соединение должно быть приготовлено в виде инъекционного раствора, к активному компоненту добавляют, когда это необходимо, регулятор рН, буфер, стабилизатор, солюбилизатор или тому подобное с получением инъекционного раствора для подкожного, внутримышечного, внутрисуставного или внутривенного введения.
Когда описанное выше соединение должно быть введено как средство для лечения или профилактики различных заболеваний, его можно вводить перорально в виде таблеток, порошка, гранул, капсул, сиропа или тому подобное или парентерально в виде аэрозоля, суппозитория, инъекционного раствора, средства для наружного применения или капель. Доза заметно меняется в зависимости от тяжести симптома, возраста, типа болезни печени и тому подобное и составляет для взрослого обычно приблизительно от 1 мг до 100 мг в сутки в виде одноразовой дозы или в виде раздельных доз, вводимых за несколько раз.
Лекарственное средство изготавливают с использованием обычных компонентов и обычных методов. В частности, когда изготавливают твердую лекарственную форму для перорального применения, к активному компоненту добавляют носитель и, если необходимо, связующее вещество, разрыхлитель, смазывающее вещество, краситель, корригирующее вещество, вещество, маскирующее запах, или тому подобное и затем из полученной смеси изготавливают таблетки, таблетки с покрытием, гранулы, порошок, капсулы или тому подобное. Разумеется, таблетки или гранулы могут быть подходящим образом покрыты сахаром, желатином или другими покрытиями.
В соответствии с настоящим изобретением соединение формулы (I) по настоящему изобретению ингибирует, в частности, продукцию VEGF и ангиогенез изменением экспрессии генов, проявляет высокий противоопухолевый эффект на модели in vivo солидной опухоли и обладает также устойчивостью в водном растворе. Следовательно, настоящее изобретение может дать, например, средство для лечения рака, в частности, средство для лечения солидного рака, ингибитор метастаза рака, средство для лечения диабетической ретинопатии, средство для лечения ревматоидного артрита или средство для лечения экхимомы.
Примеры
Настоящее изобретение описано далее более подробно на примерах, касающихся способов получения 6-дезокси 11107В (примеры 1-4), реакций биопревращения из 6-дезокси 11107В в 6-дезокси 11107D (примеры 5-11), аналогов 6-дезокси 11107D (примеры 12-17) и производных 6-дезокси 11107D (примеры 18-60), и ссылочных примерах. Однако не следует считать, что указанные примеры ограничивают настоящее изобретение.
Ниже показаны значения сокращений, используемых в химических формулах в примерах:
DEIPS: диэтилизопропилсилильная группа
ЕЕ: 1-этоксиэтильная группа
TES: триэтилсилильная группа.
Пример 1
Получение мутанта Mer-11107
В настоящем изобретении Streptomyces sp. Mer-11107 (депозитарный номер: FERM BP-7812) заставляли мутировать с помощью N-метил-N'-нитрозо-N-нитрозогуанидина в трис-малеатном буферном растворе (рН 6,0) (100 мкг/мл, 28°С, один час) и распределяли штамм по агаровой культуральной среде с дрожжевым и солодовым экстрактом для образования спор. Полученные споры собирали, часть спор разводили и распределяли по агаровой культуральной среде с дрожжевым и солодовым экстрактами для образования колоний. Каждую клетку, взятую в качестве образца из колоний, вносили в пробирку объемом 15 мл, содержавшую 2 мл культуральной среды для посева (глюкоза: 2%, 2% соевая мука (Esusan-meat, производитель Ajinomoto Co., Inc.): 1%, дрожжевой экстракт (производитель Oriental Yeast Co., Ltd.): 0,5%, хлорид натрия: 0,25% и карбонат кальция: 0,32%, рН 6,8), и культивировали на шейкере при 25°С в течение двух суток. Затем 0,5 мл посевного культурального раствора вносили в пробирку объемом 15 мл, содержавшую 2 мл продуцирующей культуральной среды (растворимый крахмал: 7%, мука из клейковины: 0,8%, фармацевтическая среда: 0,8% и карбонат кальция: 0,1%; рН 7,5), и клетки культивировали на шейкере при 25°С в течение четырех суток. Культуральный раствор экстрагировали этилацетатом и анализировали с помощью ТСХ (Merck 5715, ацетон:толуол=1:1, окрашена фосфомолибденовой кислотой), чтобы отобрать штамм А-1543, штамм, в котором появилось пятно, отличное от 11107В (Rf: около 0,5). Полученный штамм был депонирован в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan как FERM P-18942 23 июля 2002 г. и был передан International Patent Organism Depositary (IPOD), National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan под международным депозитарным номером FERM BP-8442 28 июля 2003 г.
Пример 2
Культивирование А-1543
Замороженную посевную культуру А-1543 сначала размораживали. 0,2 мл размороженной культуры вносили в коническую колбу объемом 250 мл, содержавшую 20 мл культуральной среды для посева (глюкоза: 2%, 2% соевая мука (Esusan-meat, производитель Ajinomoto Co., Inc.): 1%, дрожжевой экстракт (производитель Oriental Yeast Co., Ltd.): 0,5%, хлорид натрия: 0,25% и карбонат кальция: 0,32%, рН 6,8), и клетки культивировали на шейкере при 25°С в течение трех суток. Затем 0,6 мл посевного культурального раствора вносили в 60 мл продуцирующей культуральной среды (растворимый крахмал: 5%, мука из клейковины: 1%, фармацевтическая среда: 2% и карбонат кальция: 0,1%; рН 7,5), и посевную смесь культивировали на шейкере при 25°С в течение пяти суток.
Пример 3
Очистка 6-дезокси 11107В и 6-дезокси 11107BI
Культуральный раствор, полученный способом примера 2 (1,2 л), разделяли на фильтрат и клетки с помощью центрифуги. Супернатант экстрагировали этилацетатом (1,2 л). Клетки экстрагировали ацетоном (500 мл) и экстракт фильтровали с получением ацетонового экстракта. Ацетон из ацетонового экстракта удаляли отгонкой при пониженном давлении и затем отогнанный продукт экстрагировали этилацетатом (1 л). Соответственный этилацетатный слой промывали водой и затем сушили, обезвоживая безводным сульфатом натрия. Далее указанные слои концентрировали вместе при пониженном давлении с получением 531 мг неочищенной активной фракции. Полученную неочищенную активную фракцию подвергали колоночной хроматографии на силикагеле (Kiesel gel 60, 25 г), промывали толуолом (50 мл) и элюировали смешанным раствором толуола с этилацетатом (3:1; об./об.) (300 мл) с получением 161 мг неочищенной активной фракции, содержавшей 6-дезокси 11107В, и 34 мг неочищенной активной фракции, содержавшей 6-дезокси 11107BI. Полученную неочищенную активную фракцию, содержавшую 6-дезокси 11107В, подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) в препаративных условиях (А1), описанных ниже, с получением элюированной фракции 6-дезокси 11107В. Затем удаляли отгонкой растворитель с получением 118,8 мг 6-дезокси 11107В. Аналогичным образом фракционировали неочищенную активную фракцию, содержавшую 6-дезокси 11107ВI, с использованием ВЭЖХ в препаративных условиях (А2), описанных ниже, и затем удаляли отгонкой растворитель с получением 11,0 мг 6-дезокси 11107ВI.
Условия (А1) препаративной ВЭЖХ:
Колонка: CAPCELL PACK С18 UG120, диаметр: 30 мм, длина: 250 мм (фирма-изготовитель Shiseido Co., Ltd.)
Объемный расход: 20 мл/мин
Детектирование: 240 нм
Элюат: ацетонитрил/вода (60:40, об./об.), изократический
Условия (А2) препаративной ВЭЖХ:
Колонка: CAPCELL PACK С18 UG120, диаметр: 30 мм, длина: 250 мм (фирма-изготовитель Shiseido Co., Ltd.)
Объемный расход: 20 мл/мин
Детектирование: 240 нм
Элюат: ацетонитрил/вода (65:35, об./об.), изократический
Время удерживания описанных выше соединений в следующих условиях ВЭЖХ-анализа показано ниже. Условия (а) ВЭЖХ-анализа:
Колонка: CAPCELL PACK С18 SG120, диаметр: 4,6 мм, длина: 250 мм (фирма-изготовитель Shiseido Co., Ltd.)
Температура: 40°С
Объемный расход: 1 мл/мин
Детектирование: 240 нм
Элюат: ацетонитрил/вода (60:40, об./об.), изократический
Время удерживания:
6-дезокси 11107В: 12,0 минут
6-дезокси 11107ВI: 26,4 минуты
Пример 4
Физико-химические свойства 6-дезокси 11107В
Физико-химические свойства 6-дезокси 11107В показаны ниже. Определяли структуру 6-дезокси 11107В, которая представлена формулой (XVI").
1. Характеристики: бесцветный порошок
2. Молекулярная масса: 520, ESI-MC 543 (М+Na)+, ESI-МС 519 (M-H)-
3. Растворимость: растворимо в диметилсульфоксиде, пиридине, метаноле и ацетоне, плохо растворимо в воде
4. Цветная реакция: положительная для иода, серной кислоты и фосфомолибденовой кислоты
5. Ультрафиолетовый спектр поглощения (метанол, максимальное значение) нм: 240 (ε 33500)
6. Инфракрасный спектр поглощения (KBr)см-1: 3449, 2965, 1734, 1714, 1456, 1372, 1242, 1170
7.1Н-ЯМР (CD3OD, 400 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,87 (3H, д, J=7,0 Гц), 0,90 (3H, д, J=7,0 Гц), 0,94 (3H, д, J=7,3 Гц), 0,97 (3H, д, J=7,0 Гц), 1,08 (3H, д, J=7,0 Гц), 1,17-1,21 (1H, м), 1,24-1,36 (2H, м), 1,42-1,52 (3H, м), 1,61-1,66 (3H, м), 1,74 (3H, д, J=1,1 Гц), 1,89-1,96 (1H, м), 2,00 (3H, с), 2,41-2,47 (1H, м), 2,43 (1H, дд, J=5,5, 13,9 Гц), 2,51-2,58 (1H, м), 2,56 (1H, дд, J=3,7, 13,9 Гц), 2,65 (1H, дд, J=2,2, 8,1 Гц), 2,72 (1H, дт, J=2,2, 5,9 Гц), 3,51 (1H, дт, J=4,4, 8,4 Гц), 3,75-3,80 (1H, м), 4,91 (1H, дд, J=8,8, 10,6 Гц), 5,00 (1H, д, J=10,6 Гц), 5,42 (1H, дд, J=9,2, 15,0 Гц), 5,49 (1H, дд, J=9,2, 15,0 Гц), 5,65 (1H, дд, J=8,4, 15,0 Гц), 6,08 (1H, д, J=10,6 Гц), 6,32 (1H, дд, J=10,6, 15,0 Гц).

Пример 5
Физико-химические свойства 6-дезокси 11107ВI
Физико-химические свойства 6-дезокси 11107ВI показаны ниже. Определяли структуру 6-дезокси 11107ВI, которая представлена следующей ниже формулой.
1. Молекулярная масса: 504, ESI-MC 527 (М+Na)+, ESI-МС 503 (M-H)-
2.1Н-ЯМР (CD3OD, 400 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,86 (3H, д, J=6,6 Гц), 0,92 (3H, т, J=7,3 Гц), 0,97 (3H, д, J=6,6 Гц), 0,98 (3H, д, J=6,6 Гц), 1,01 (3H, д, J=7,0 Гц), 1,25-1,35 (3H, м), 1,53-1,61 (3H, м), 1,72 (3H, д, J=0,7 Гц), 1,89-1,95 (1H, м), 2,00 (3H, с), 2,02-2,05 (2H, м), 2,10 (1Н, дд, J=7,0, 14,3 Гц), 2,27-2,31 (1H, м), 2,43 (1H, дд, J=5,1, 13,9 Гц), 2,50-2,56 (1H, м), 2,56 (1H, дд, J=3,3), 13,9 Гц), 3,18 (1H, дт, J=3,3, 8,8 Гц), 3,75-3,80 (1H, м), 4,91 (1H, перекрытый Н2О), 5,00 (1H, д, J=10,6 Гц), 5,32 (1H, дд, J=7,3, 15,4 Гц), 5,38 (1H, дд, J=6,2, 15,4 Гц), 5,41 (1H, дд, J=9,2, 15,0 Гц), 5,49 (1H, дд, J=9,2, 15,4 Гц), 5,64 (1H, дд, J=7,7, 15,0 Гц), 6,06 (1H, д, J=11,0 Гц), 6,21 (1H, дд, J=9,9, 15,0 Гц).

Пример 6
Получение штамма для превращения 6-дезокси 11107В в 6-дезокси 11107D
Часть скошенной культуральной среды (агаровая культуральная среда с дрожжевым и солодовым экстрактами) штамма, выделенного из почвы, вносили в коническую колбу объемом 250 мл, содержавшую 20 мл посевной культуральной среды [растворимый крахмал: 2,4%, глюкоза: 0,1%, соевая мука (Esusan meat, фирма-изготовитель Ajinomoto Co., Inc.): 0,5%, говяжьего экстракта (фирма-изготовитель Difco Со.): 0,3%, дрожжевого экстракта (фирма-изготовитель Difco Со.): 0,5%, триптон-пептон (фирма-изготовитель Difco Со.): 0,5% и карбонат кальция: 0,4%], и клетки культивировали на шейкере при 28°C в течение трех суток с получением посевного культурального раствора. Затем 0,6 мл посевного культурального раствора вносили в коническую колбу объемом 500 мл, содержавшую 60 мл продукционной культуральной среды [картофельный крахмал: 2%, глюкоза: 2%, соевая мука (Esusan meat, фирма-изготовитель Ajinomoto Co., Inc.): 2%, дрожжевой экстракт: 0,5%, хлорид натрия: 0,25%, карбонат кальция: 0,32, сульфат меди: 0,0005%, хлорид марганца: 0,0005% и сульфат цинка: 0,0005%; рН 7,4], и клетки культивировали на шейкере при 28°С в течение четырех суток. Каждые 2 мл полученного культурального раствора вносили в пробирку объемом 15 мл и центрифугировали при 3000 об/мин в течение 5 минут, чтобы собрать клетки. Клетки суспендировали в 2 мл 50 мМ фосфатного буферного раствора (рН 6,0). Затем приготавливали в качестве субстрата 6-дезокси 11107В в виде 5 мг/мл раствора в диметилсульфоксиде и добавляли по 0,04 мл раствора к суспензии. После добавления смесь встряхивали при 28°С в течение 23 часов для осуществления реакции гидроксилирования. По окончании реакции проводили анализ методом ВЭЖХ, отобрав два штамма, в которых появился пик 6-дезокси 11107D: штамм А-1544 и штамм А-1545. Указанные штаммы были депонированы в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan 23 июля 2002 г. как FERM P-18943 и FERM P-18944, соответственно, и были переданы International Patent Organism Depositary (IPOD), National Institute of Advanced Industrial Science and Technology in Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki 305-8566, Japan 30 июля 2003 г. под международными депозитарными номерами FERM BP-8446 и FERM BP-8447, соответственно.
Время удерживания описанных выше соединений в следующих условиях анализа методом ВЭЖХ показано ниже.
Условия (b) анализа методом ВЭЖХ:
Колонка: CAPCELL PACK C18 SG120 диаметр: 4,6 мм, длина: 250 мм (фирма-изготовитель Shiseido Со., Ltd.)
Температура: 40°С
Объемный расход: 1 мл/мин
Детектирование: 240 нм
Элюат: ацетонитрил/вода (50:50, об./об.), изократический
Время удерживания:
6-дезокси 11107В: 27,2 мин
6-дезокси 11107D: 8,2 мин.
Пример 7
Культивирование А-1544
Часть скошенной культуральной среды (агаровая культуральная среда с дрожжевым и солодовым экстрактами) штамма А-1544 вносили в коническую колбу объемом 250 мл, содержавшую 25 мл посевной культуральной среды (картофельный крахмал: 2%, глюкоза: 2%, соевая мука (Esusan meat, фирма-изготовитель Ajinomoto Co., Inc.): 2%, дрожжевой экстракт: 0,5%, хлорид натрия: 0,25%, карбонат кальция: 0,32, сульфат меди: 0,0005%, хлорид марганца: 0,0005% и сульфат цинка: 0,0005%; рН 7,4), и клетки культивировали на шейкере при 28°C в течение трех суток с получением посевного культурального раствора. Затем каждые 0,75 мл полученного посевного культурального раствора вносили в пробирки объемом 2 мл с сывороткой (фирма-изготовитель Sumitomo Bakelite Co., Ltd.) и добавляли равное количество 40% водного раствора глицерина. Смесь перемешивали и затем замораживали при -70°С с получением замороженной посевной культуры. Полученную замороженную посевную культуру оттаивали. 0,25 мл культуры вносили в коническую колбу объемом 250 мл, содержавшую 25 мл среды для посева (картофельный крахмал: 2%, глюкоза: 2%, соевая мука (Esusan meat, фирма-изготовитель Ajinomoto Co., Inc.): 2%, дрожжевой экстракт: 0,5%, хлорид натрия: 0,25%, карбонат кальция: 0,32, сульфат меди: 0,0005%, хлорид марганца: 0,0005% и сульфат цинка: 0,0005%; рН 7,4), и культивировали на шейкере при 28°С в течение двух суток с получением посевного культурального раствора. Затем 0,25 мл посевного культурального раствора вносили в коническую колбу объемом 250 мл, содержавшую 25 мл продукционной культуральной среды (картофельный крахмал: 2%, глюкоза: 2%, соевая мука (S-San meat, фирма-изготовитель Ajinomoto Co., Inc.): 2%, дрожжевой экстракт: 0,5%, хлорид натрия: 0,25%, карбонат кальция: 0,32, сульфат меди: 0,0005%, хлорид марганца: 0,0005% и сульфат цинка: 0,0005%; рН 7,4) и клетки культивировали на шейкере при 25°С в течение четырех суток.
Пример 8
Получение 6-дезокси 11107D реакцией биопревращения
Каждый из культуральных растворов штамма А-1544, полученных способом примера 7 (30 конических колб объемом 25 мл/250 мл каждая), подвергали центрифугированию при 3000 об/мин в течение 10 минут, чтобы собрать клетки. Клетки суспендировали в 25 мл 50 мМ фосфатного буферного раствора (рН 6,0). Затем приготавливали в качестве субстрата 6-дезокси 11107В в виде 50 мг/мл раствора в диметилсульфоксиде и добавляли по 0,25 мл раствора к суспензии. После добавления смесь встряхивали при 28°С в течение 22 часов для осуществления реакции гидроксилирования. По окончании реакции продукт реакции центрифугировали при 5000 об/мин в течение 20 минут для разделения продукта на фильтрат и клетки. Супернатант экстрагировали этилацетатом (750 мл). Клетки экстрагировали ацетоном (500 мл) и экстракт фильтровали с получением ацетонового экстракта. Ацетон из ацетонового экстракта удаляли отгонкой при пониженном давлении и затем отогнанный продукт экстрагировали этилацетатом (750 мл). Соответственный этилацетатный слой промывали водой и затем сушили, обезвоживая над безводным сульфатом натрия. Далее указанные слои концентрировали вместе при пониженном давлении с получением 365 мг неочищенной активной фракции. Полученную неочищенную активную фракцию подвергали колоночной хроматографии на силикагеле (Kiesel gel 60, 35 г), промывали толуолом (70 мл) и элюировали смешанным раствором толуола с этилацетатом (4:1; об./об.) (500 мл) и смешанным раствором толуола с ацетоном (2:1; об./об.) (300 мл) с получением 139 мг неочищенной активной фракции, содержавшей 6-дезокси 11107D и 6-дезокси 11107ВР, 78 мг неочищенной активной фракции, содержавшей 6-дезокси 11107AV, и 78 мг неочищенной активной фракции, содержавшей 6-дезокси 11107D 20-ОН и 6-дезокси 11107F. Полученную неочищенную активную фракцию, содержавшую 6-дезокси 11107D и 6-дезокси 11107ВР, подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) в препаративных условиях (В1), описанных ниже, с получением элюированных фракции 6-дезокси 11107D и фракции 6-дезокси 11107ВР. Затем удаляли отгонкой растворитель с получением 6-дезокси 11107D (67,0 мг) и 6-дезокси 11107ВР (8,1 мг). Аналогичным образом, фракционировали неочищенную активную фракцию, содержавшую 6-дезокси 11107AV и неочищенную активную фракцию, содержавшую 6-дезокси 11107D 20-ОН и 6-дезокси 11107F, с использованием ВЭЖХ в препаративных условиях (А1), описанных выше, и препаративных условиях (В2), описанных ниже, соответственно. Затем удаляли отгонкой растворители с получением 6-дезокси 11107AV, (9,3 мг), 6-дезокси 11107D 20-ОН (19,9 мг) и 6-дезокси 11107F (22,1 мг).
Пример 9
Культивирование А-1545
Часть скошенной культуральной среды (агаровая культуральная среда с дрожжевым и солодовым экстрактами) штамма А-1545 вносили в коническую колбу объемом 250 мл, содержавшую 25 мл посевной культуральной среды (картофельный крахмал: 2%, глюкоза: 2%, соевая мука (Esusan meat, фирма-изготовитель Ajinomoto Co., Inc.): 2%, дрожжевой экстракт: 0,5%, хлорид натрия: 0,25%, карбонат кальция: 0,32, сульфат меди: 0,0005%, хлорид марганца: 0,0005% и сульфат цинка: 0,0005%; рН 7,4), и клетки культивировали на шейкере при 28°C в течение трех суток с получением посевного культурального раствора. Затем каждые 0,75 мл полученного посевного культурального раствора вносили в пробирку объемом 2 мл с сывороткой (фирма-изготовитель Sumitomo Bakelite Co., Ltd.) и добавляли равное количество 40% водного раствора глицерина. Смесь перемешивали и затем замораживали при -70°С с получением замороженной посевной культуры. Полученную замороженную посевную культуру оттаивали. 0,25 мл культуры вносили в коническую колбу объемом 250 мл, содержавшую 25 мл культуральной среды для посева (картофельный крахмал: 2%, глюкоза: 2%, соевая мука (Esusan meat, фирма-изготовитель Ajinomoto Co., Inc.): 2%, дрожжевой экстракт: 0,5%, хлорид натрия: 0,25%, карбонат кальция: 0,32, сульфат меди: 0,0005%, хлорид марганца: 0,0005% и сульфат цинка: 0,0005%; рН 7,4), и клетки культивировали на шейкере при 28°С в течение двух суток с получением посевного культурального раствора. Затем 0,25 мл посевного культурального раствора вносили в коническую колбу объемом 250 мл, содержавшую 25 мл продукционной культуральной среды (картофельный крахмал: 2%, глюкоза: 2%, соевая мука (Esusan meat, фирма-изготовитель Ajinomoto Co., Inc.): 2%, дрожжевой экстракт: 0,5%, хлорид натрия: 0,25%, карбонат кальция: 0,32, сульфат меди: 0,0005%, хлорид марганца: 0,0005% и сульфат цинка: 0,0005%; рН 7,4), и клетки культивировали на шейкере при 25°С в течение четырех суток.
Пример 10
Получение 6-дезокси 11107D реакцией биопревращения
Каждый из культуральных растворов штамма А-1545, полученных способом примера 9 (40 конических колб объемом 25 мл/250 мл каждая), подвергали центрифугированию при 3000 об/мин в течение 10 минут, чтобы собрать клетки. Клетки суспендировали в 25 мл 50 мМ фосфатного буферного раствора (рН 6,0). Затем приготавливали в качестве субстрата 6-дезокси 11107В в виде 50 мг/мл раствора в диметилсульфоксиде и добавляли по 0,25 мл раствора к суспензии. После добавления смесь встряхивали при 28°С в течение 22 часов для осуществления реакции гидроксилирования. По окончании реакции продукт реакции центрифугировали при 5000 об/мин в течение 20 минут для разделения продукта на фильтрат и клетки. Супернатант экстрагировали этилацетатом (1 л). Клетки экстрагировали ацетоном (500 мл) и экстракт фильтровали с получением ацетонового экстракта. Ацетон из ацетонового экстракта удаляли отгонкой при пониженном давлении и затем отогнанный продукт экстрагировали этилацетатом (1 л). Соответственный этилацетатный слой промывали водой и затем сушили, обезвоживая над безводным сульфатом натрия. Далее указанные слои концентрировали вместе при пониженном давлении с получением 537 мг неочищенной активной фракции. Полученную неочищенную активную фракцию подвергали колоночной хроматографии на силикагеле (Kiesel gel 60, 50 г), промывали толуолом (100 мл) и элюировали смешанным раствором толуола с этилацетатом (4:1; об./об.) (600 мл) и смешанным раствором толуола с ацетоном (2:1; об./об.) (600 мл) с получением 112 мг неочищенной активной фракции, содержавшей 6-дезокси 11107D, и 47 мг неочищенной активной фракции, содержавшей 6-дезокси 11107D 20-ОН, 6-дезокси 11107D 17-ОН и 6-дезокси 11107D 17-OH (эпимер по положению 17). Полученную неочищенную активную фракцию, содержавшую 6-дезокси 11107D, подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) в препаративных условиях (В1), описанных ниже, с получением элюированной фракции 6-дезокси 11107D. Затем удаляли отгонкой растворитель с получением 6-дезокси 11107D (67,2 мг). Аналогичным образом, фракционировали неочищенную активную фракцию, содержавшую 6-дезокси 11107AV, и неочищенную активную фракцию, содержавшую 6-дезокси 11107D 20-ОН, 6-дезокси 11107D 17-ОН и 6-дезокси 11107D 17-OH (эпимер по положению 17), с использованием ВЭЖХ в препаративных условиях (А1), описанных выше, и препаративных условиях (В2), описанных ниже, соответственно. Затем удаляли отгонкой растворители с получением 6-дезокси 11107AV (5,7 мг), 6-дезокси 11107D 20-ОН (9,0 мг), 6-дезокси 11107D 17-ОН (5,9 мг) и 6-дезокси 11107D 17-OH (эпимер по положению 17) (6,4 мг).
Условия (В1) препаративной ВЭЖХ:
Колонка: CAPCELL PACK C18 UG120, диаметр: 30 мм, длина: 250 мм (фирма-изготовитель Shiseido Co., Ltd.)
Объемный расход: 20 мл/мин
Детектирование: 240 нм
Элюат: ацетонитрил/вода (40:60, об./об.), изократический
Условия (В2) препаративной ВЭЖХ:
Колонка: CAPCELL PACK C18 UG120, диаметр: 30 мм, длина: 250 мм (фирма-изготовитель Shiseido Co., Ltd.)
Объемный расход: 20 мл/мин
Детектирование: 240 нм
Элюат: ацетонитрил/вода (35:65, об./об.), изократический
Время удерживания описанных выше соединений в следующих условиях анализа методом ВЭЖХ показано ниже.
Условия (с) анализа методом ВЭЖХ:
Колонка: CAPCELL PACK C18 SG120 диаметр: 4,6 мм, длина: 250 мм (фирма-изготовитель Shiseido Со., Ltd.)
Температура: 40°С
Объемный расход: 1 мл/мин
Детектирование: 240 нм
Элюат: ацетонитрил/вода (45:55, об./об.), изократический
Время удерживания:
6-дезокси 11107D: 12,5 минуты
Аналог 1 (6-дезокси 11107ВР): 11,4 минуты
Аналог 2 (6-дезокси 11107D 20-ОН): 7,3 минуты
Аналог 3 (6-дезокси 11107F): 4,6 минуты
Аналог 4 (6-дезокси 11107D 17-ОН): 7,8 минуты
Аналог 5 (6-дезокси 11107D 17-ОН): 8,3 минуты
Аналог 6 (6-дезокси 11107AV): 17,8 минуты.
Пример 11
Физико-химические свойства 6-дезокси 11107D
Физико-химические свойства 6-дезокси 11107D показаны ниже. Как было определено, 6-дезокси 11107D имеет структуру, представленную формулой (XVII').
1. Молекулярная масса: 536, ESI-MC 559 (М+Na)+, ESI-МС 535 (M-H)-
2.1Н-ЯМР (CD3OD, 400 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,87 (3H, д, J=7,0 Гц), 0,90 (3H, д, J=7,0 Гц), 0,94 (3H, т, J=7,3 Гц), 0,97 (3H, д, J=6,6 Гц), 1,21-1,26 (1H, м), 1,29-1,37 (3H, м), 1,34 (3H, с), 1,44-1,52 (2H, м), 1,60-1,64 (1H, м), 1,65 (1H, дд, J=6,2, 13,9 Гц), 1,77 (3H, д, J=1,1 Гц), 1,86 (1H, дд, J=5,4, 13,9 Гц), 1,89-1,94 (1H, м), 2,00 (3H, с), 2,43 (1H, дд, J=5,5, 13,9 Гц), 2,50-2,60 (1H, м), 2,56 (1H, дд, J=3,3, 13,9 Гц), 2,66 (1H, дд, J=2,2, 7,7 Гц), 2,89 (1H, дт, J=2,2, 6,2 Гц), 3,52 (1H, дт, J=4,8, 8,4 Гц), 3,75-3,80 (1H, м), 4,90 (1H, перекрытый Н2О), 5,01 (1H, д, J=10,6 Гц), 5,42 (1H, дд, J=9,2, 15,0 Гц), 5,50 (1H, дд, J=9,2, 15,0 Гц), 5,86 (1H, д, J=15,0 Гц), 6,13 (1H, д, J=10,6 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц).

Пример 12
Физико-химические свойства аналога 1 (6-дезокси 11107ВР)
Физико-химические свойства аналога 1 показаны ниже. Как было определено, аналог 1 имеет структуру, представленную следующей ниже формулой.
1. Молекулярная масса: 550, ESI-MC 573 (М+Na)+, ESI-МС 549 (M-H)-
2.1Н-ЯМР (CD3OD, 400 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,86 (3H, д, J=7,0 Гц), 0,97 (3H, д, J=6,6 Гц), 1,01 (3H, т, J=7,0 Гц), 1,25 (3H, с), 1,29-1,35 (2H, м), 1,34 (3H, с), 1,58-1,65 (2H, м), 1,68 (1H, дд, J=6,2, 13,9 Гц), 1,77 (3H, д, J=1,1 Гц), 1,86 (1H, дд, J=5,5, 13,9 Гц), 1,88-1,93 (1H, м), 2,00 (3H, с), 2,42 (1H, дд, J=5,1, 14,3 Гц), 2,52-2,58 (1H, м), 2,56 (1H, дд, J=3,3, 14,3 Гц), 2,61-2,76 (2H, м), 3,00 (1Н, д, J=2,2 Гц), 3,17 (1H, дт, J=2,2, 5,9 Гц), 3,75-3,80 (1H, м), 4,91 (1H, дд, J=9,2, 10,3 Гц), 5,01 (1H, д, J=10,6 Гц), 5,42 (1H, дд, J=9,2, 15,0 Гц), 5,50 (1H, дд, J=9,2, 15,0 Гц), 5,87 (1H, д, J=15,4 Гц), 6,14 (1H, д, J=11,0 Гц), 6,53 (1H, дд, J=11,0, 15,4 Гц).

Пример 13
Физико-химические свойства аналога 2 (6-дезокси 11107D 20-ОН)
Физико-химические свойства аналога 2 показаны ниже. Как было определено, аналог 2 имеет структуру, представленную следующей ниже формулой.
1. Молекулярная масса: 552, ESI-MC 575 (М+Na)+, ESI-МС 551 (M-H)-
2.1Н-ЯМР (CD3OD, 400 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,87 (3H, д, J=7,0 Гц), 0,97 (3H, д, J=7,0 Гц), 1,01 (3H, т, J=7,3 Гц), 1,04 (3H, с), 1,25-1,35 (3H, м), 1,35 (3H, с), 1,55-1,65 (2H, м), 1,69 (1H, дд, J=5,9, 13,9 Гц), 1,72-1,77 (1H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,9, 13,9 Гц), 1,88-1,95 (1H, м), 2,00 (3H, с), 2,43 (дд, J=5,4, 13,9 Гц), 2,50-2,60 (1H, м), 2,56 (1H, дд, J=3,3, 13,9 Гц), 2,90 (1H, д, J=2,2 Гц), 3,10 (1H, дт, J=2,2, 5,9 Гц), 3,30 (1H, дд, J=2,0, 10,7 Гц), 3,75-3,81 (1H, м), 4,71 (1H, дд, J=9,2, 10,3 Гц), 5,01 (1H, д, J=10,6 Гц), 5,42 (1H, дд, J=8,8, 15,0 Гц), 5,50 (1H, дд, J=8,9, 15,0 Гц), 5,87 (1H, д, J=15,4 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц).

Пример 14
Физико-химические свойства аналога 3 (6-дезокси 11107F)
Физико-химические свойства аналога 3 показаны ниже. Как было определено, аналог 3 имеет структуру, представленную следующей ниже формулой.
1. Молекулярная масса: 494, ESI-MC 517 (М+Na)+, ESI-МС 493 (M-H)-
2.1Н-ЯМР (CD3OD, 400 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,90 (6H, д, J=7,0 Гц), 0,94 (3H, т, J=7,3 Гц), 1,07 (3H, д, J=6,6 Гц), 1,21-1,26 (2H, м), 1,27-1,30 (1H, м), 1,34 (3H, с), 1,43-1,54 (2H, м), 1,57-1,68 (3H, м), 1,78 (3H, с), 1,87 (1H, дд, J=5,1, 13,9 Гц), 2,42 (1H, дд, J=5,5, 14,3 Гц), 2,52-2,58 (1H, м), 2,57 (1H, дд, J=3,3, 14,3 Гц), 2,67 (1H, дд, J=2,2, 8,1 Гц), 2,89 (1H, дт, J=2,2, 5,9 Гц), 3,52 (1H, дт, J=4,8, 9,2 Гц), 3,57 (1H, дд, J=9,5, 9,9 Гц), 3,73-3,79 (1H, м), 5,02 (1H, д, J=10,6 Гц), 5,31 (1H, дд, J=9,5, 15,0 Гц), 5,47 (1H, дд, J=9,2, 15,0 Гц), 5,86 (1H, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,53 (1H, дд, J=11,0, 15,0 Гц).

Пример 15
Физико-химические свойства аналога 4 (6-дезокси 11107D 17-ОН)
Физико-химические свойства аналога 4 показаны ниже. Как было определено, аналог 4 имеет структуру, представленную следующей ниже формулой.
1. Молекулярная масса: 552, ESI-MC 575 (М+Na)+, ESI-МС 551 (M-H)-
2.1Н-ЯМР (CD3OD, 400 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,87 (3H, д, J=6,2 Гц), 0,88 (3H, д, J=7,0 Гц), 0,94 (3H, т, J=7,3 Гц), 0,97 (3H, д, J=7,0 Гц), 1,25-1,25 (3H, м), 1,32 (3H, с), 1,44-1,55 (2H, м), 1,57-1,67 (2H, м), 1,77 (3Н, с), 1,88-1,95 (1H, м), 2,00 (3H, с), 2,43 (1H, дд, J=5,5, 13,9 Гц), 2,57 (1H, дд, J=3,3, 13,9 Гц), 2,51-2,61 (1H, м), 2,84 (1H, дд, J=2,2, 7,7 Гц), 2,92 (1H, дд, J=2,2, 6,6 Гц), 3,12 (1H, д, J=6,6 Гц), 3,54 (1H, дт, J=4,8, 7,7 Гц), 3,74-3,81 (1H, м), 4,91 (1H, дд, J=9,1, 10,3 Гц), 5,01 (1H, д, J=10,6 Гц), 5,42 (1H, дд, J=9,1, 14,7 Гц), 5,50 (1H, дд, J=8,8, 14,7 Гц), 5,92 (1H, д, J=15,0 Гц), 6,14 (1H, д, J=11,0 Гц), 6,58 (1H, дд, J=11,0, 15,0 Гц).

Пример 16
Физико-химические свойства аналога 5 (6-дезокси 11107D 17-ОН)
Физико-химические свойства аналога 5 показаны ниже. Как было определено, аналог 5 имеет структуру, представленную следующей ниже формулой. Данное соединение является стереоизомером гидроксильной группы в положении 17 аналога 4.
1. Молекулярная масса: 552, ESI-MC 575 (М+Na)+, ESI-МС 551 (M-H)-
2.1Н-ЯМР (CD3OD, 400 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,87 (3H, д, J=6,6 Гц), 0,89 (3H, д, J=7,0 Гц), 0,94 (3H, т, J=7,3 Гц), 0,97 (3H, д, J=7,0 Гц), 1,20-1,40 (3H, м), 1,34 (3H, с), 1,43-1,67 (4H, м), 1,77 (3H, с), 1,87-1,96 (1H, м), 2,00 (3H, с), 2,43 (1H, дд, J=5,1, 13,9 Гц), 2,57 (1H, дд, J=3,3, 13,9 Гц), 2,54-2,55 (1H, м), 2,93-2,96 (2H, м), 3,44 (1H, д, J=3,3 Гц), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,74-3,81 (1H, м), 4,91 (1H, перекрытый H2O), 5,01 (1H, д, J=10,6 Гц), 5,42 (1H, дд, J=8,8, 15,0 Гц), 5,50 (1H, дд, J=9,2, 15,0 Гц), 5,93 (1H, д, J=15,4 Гц), 6,13 (1H, д, J=11,0 Гц), 6,59 (1H, дд, J=11,0, 15,9 Гц).

Пример 17
Физико-химические свойства аналога 6 (6-дезокси 11107AV)
Физико-химические свойства аналога 6 показаны ниже. Как было определено, аналог 6 имеет структуру, представленную следующей ниже формулой.
1. Молекулярная масса: 534, ESI-MC 557 (М+Na)+, ESI-МС 533 (M-H)-
2.1Н-ЯМР (CD3OD, 400 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,87 (3H, д, J=6,6 Гц), 0,97 (3H, д, J=7,7 Гц), 0,98 (3H, т, J=7,3 Гц), 1,07 (3H, д, J=7,0 Гц), 1,28-1,32 (2H, м), 1,33 (3H, с), 1,58-1,64 (2H, м), 1,63 (1H, дд, J=6,6, 14,3 Гц), 1,77 (3H, д, J=1,1 Гц), 1,88-1,94 (1H, м), 1,89 (1H, дд, J=5,1, 14,3 Гц), 2,28-2,35 (1H, м), 2,42 (1H, дд, J=5,5, 14,3 Гц), 2,52-2,63 (4H, м), 2,75 (1H, дд, J=2,2, 8,4 Гц), 2,91 (1H, дт, J=2,2, 6,6 Гц), 3,75-3,80 (1H, м), 4,91 (1H, дд, J=8,8, 10,3 Гц), 5,01 (1H, д, J=10,6 Гц), 5,42 (1H, дд, J=8,8, 15,0 Гц), 5,50 (1H, дд, J=9,2, 15,0 Гц), 5,86 (1H, д, J=15,4 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц).
Пример 18
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 18)

Пример 18-1 стадия
(1) (8Е,12Е,14Е)-7-ацетокси-3,16,21-трис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид

(8Е,12Е,14Е)-7-Ацетокси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (6-дезокси 11107D) (129 мг, 240 мкмоль) растворяли в метиленхлориде (2 мл). Этилвиниловый эфир (1,4 мл, 14,4 ммоль) и п-толуолсульфонат пиридиния (19,9 мг, 79,2 мкмоль) добавляли к реакционной смеси при комнатной температуре и реакционную смесь перемешивали при той же температуре в течение 4,5 часов. Данную реакционную смесь разбавляли этилацетатом (30 мл) и органический слой промывали очищенной водой (10 мл) и насыщенным раствором соли (10 мл). Полученный органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта (188 мг).
ESI-MC m/z 775 (М+Na)+.
Пример 18-2 стадия
(2) (8Е,12Е,14Е)-3,16,21-трис(1-этоксиэтокси)-7-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид

(8Е,12Е,14Е)-7-Ацетокси-3,6,16,21-трис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (186 мг) в виде неочищенного продукта растворяли в метаноле (2 мл). К реакционной смеси добавляли карбонат калия (75,0 мг, 543 мкмоль) и реакционную смесь перемешивали при комнатной температуре трех часов. Полученный реакционный раствор разбавляли этилацетатом (50 мл) и органический слой промывали насыщенным раствором соли (10 мл) два раза. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученный концентрат очищали колоночной хроматографией на силикагеле (Merck Silica gel 60, 63-200 мкм; гексан:этилацетат=3:1→2:1) с получением указанного в заголовке соединения (131 мг, 185 мкмоль, 78,6%, 2 стадии) в виде бесцветного масла.
ESI-MC m/z 733 (М+Na)+.
Пример 18-3 стадия
(3) (8Е,12Е,14Е)-3,16,21-трис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-18,19-эпокситрикоза-8,12,14-триен-11-олид

(8Е,12Е,14Е)-3,16,21-трис(1-Этоксиэтокси)-7-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (129 мг, 182 мкмоль) растворяли в метиленхлориде (1 мл). К реакционной смеси добавляли триэтиламин (127 мкл, 911 мкмоль) и 4-диметиламинопиридин (67,0 мг, 548 мкмоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. К полученной реакционной смеси добавляли по каплям раствор 4-нитрофенилхлорформиата (112 мг, 556 мкмоль) в метиленхлориде (1 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3,5 часов. Реакционную смесь разбавляли этилацетатом (30 мл) и органический слой промывали насыщенным водным раствором гидрокарбоната натрия (10 мл) и очищенной водой (10 мл) два раза и насыщенным раствором соли (10 мл). Полученный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученный концентрат очищали колоночной хроматографией на силикагеле (Merck Silica gel 60, 63-200 мкм; гексан:этилацетат=5:1→4:1) с получением указанного в заголовке соединения (137 мг, 156 мкмоль, 85,8%) в виде бесцветного масла.
ESI-MC m/z 898 (М+Na)+.
Пример 18-4 стадия
(4) (8Е,12Е,14Е)-3,16,21-трис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид

(8Е,12Е,14Е)-3,16,21-трис(1-Этоксиэтокси)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-18,19-эпокситрикоза-8,12,14-триен-11-олид (26,6 мг, 30,4 мкмоль) растворяли в тетрагидрофуране (0,5 мл). К реакционной смеси добавляли раствор 1-метилпиперазина (4,4 мкл, 49 мкмоль) в тетрагидрофуране (0,5 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов. Полученный реакционный раствор концентрировали и концентрат очищали колоночной хроматографией на силикагеле (Fuji Silysia NH Silica gel, 100 мкм; гексан:этилацетат=1:1) с получением указанного в заголовке соединения (25,1 мг, 30,0 мкмоль, 98,7%) в виде бесцветного масла.
ESI-MC m/z 837 (М+H)+.
Пример 18-5 стадия
(5) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 18)

(8Е,12Е,14Е)-3,16,21-трис(1-Этоксиэтокси)-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (25,1 мг, 30,0 мкмоль) растворяли в смешанном растворе (1:1) тетрагидрофурана и 2-метил-1-пропанола (1 мл). К реакционной смеси при комнатной температуре добавляли п-толуолсульфонат пиридиния (23,7 мг, 94,3 мкмоль). Реакционную смесь перемешивали при той же температуре в течение 24,5 часов и затем еще добавляли п-толуолсульфонат пиридиния (8,7 мг, 34,6 мкмоль). Реакционную смесь перемешивали в течение 4,5 часов. Реакционную смесь разбавляли этилацетатом (30 мл) и органический слой промывали насыщенным водным раствором гидрокарбоната натрия (6 мл) и очищенной водой (6 мл) два раза и насыщенным раствором соли (6 мл). Полученный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученный концентрат очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel plate, хлороформ:метанол=40:1) с получением указанного в заголовке соединения (12,2 мг, 19,6 мкмоль, 65,3%) в виде бесцветного масла.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=6,6 Гц), 0,93 (3H, т, J=7,3 Гц), 0,99 (3H, д, J=6,6 Гц), 1,19-1,37 (3H, м), 1,33 (3H, с), 1,40-1,65 (4H, м), 1,65 (1H, дд, J=5,5, 14,3 Гц), 1,77 (3H, д, J=0,7 Гц), 1,86 (1H, дд, J=5,5, 14,3 Гц), 1,89-1,97 (1H, м), 2,29 (3H, с), 2,35-2,45 (5H, м), 2,53-2,60 (1H, м), 2,56 (1H, дд, J=3,7, 13,9 Гц), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,88 (1H, дт, J=2,2, 5,5 Гц), 3,42-3,54 (5H, м), 3,74-3,81 (1H, м), 4,79 (1H, дд, J=9,2, 9,2 Гц), 5,01 (1H, д, J=10,6 Гц), 5,44 (1H, дд, J=8,8, 15,0 Гц), 5,50 (1H, дд, J=9,2, 15,0 Гц), 5,86 (1H, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц). ESI-МС m/z 621 (M+H)+.
Пример 19
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 19)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 0,98-1,03 (3H, м), 1,20-1,68 (8Н, м), 1,33 (3H, с), 1,77 (3H, с), 1,83-1,98 (4H, м), 2,34 (3Н, с), 2,42 (1H, дд, J=5,5, 13,9 Гц), 2,50-2,66 (6H, м), 2,66 (1H, дд, J=2,2, 7,7 Гц), 2,89 (1H, дд, J=2,2, 6,2 Гц), 3,44-3,59 (5H, м), 3,74-3,80 (1H, м), 4,80 (1H, дд, J=9,2, 9,2 Гц), 5,02 (1H, д, J=10,6 Гц), 5,44 (1H, дд, J=9,2, 15,0 Гц), 5,50 (1H, дд, J=9,2, 15,0 Гц), 5,86 (1H, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц). ESI-МС m/z 635 (M+H)+.
Пример 20
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диэтиламино)этил-N-метил)карбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 20)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=8,1 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 0,98-1,11 (9H, м), 1,19-1,68 (8H, м), 1,33 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,5, 14,3 Гц), 1,88-1,98 (1H, м), 2,42 (1H, дд, J=5,5, 14,3 Гц), 2,51-2,63 (8H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,87-2,95 (4H, м), 3,30-3,39 (2H, м), 3,52 (1Н, дт, J=4,4, 8,8 Гц), 3,74-3,82 (1H, м), 4,80 (1H, дд, J=9,2, 9,2 Гц), 5,01 (1H, д, J=10,6 Гц), 5,44 (1H, дд, J=9,2, 15,0 Гц), 5,50 (1H, дд, J=9,2, 15,0 Гц), 5,86 (1H, д, J=15,4 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 651 (M+H)+.
Пример 21
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(пиперидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 21)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 0,99 (3H, д, J=6,6 Гц), 1,19-1,67 (16H, м), 1,33 (3H, с), 1,77 (3H, с), 1,82-1,97 (4H, м), 2,42 (1H, дд, J=5,5, 14,3 Гц), 2,42-2,61 (7H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,69-2,86 (2H, м), 2,88 (1H, дт, J=2,2, 5,9 Гц), 3,52 (1H, дт, J=4,8, 8,4 Гц), 3,73-3,81 (1H, м), 4,12-4,22 (2H, м), 4,77 (1H, дд, J=9,2, 9,2 Гц), 5,01 (1H, д, J=10,6 Гц), 5,43 (1H, дд, J=9,2, 15,0 Гц), 5,49 (1H, дд, J=9,2, 15,0 Гц), 5,86 (1H, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 689 (М+H)+.
Пример 22
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диэтиламино)этил)карбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 22)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,3 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 0,99 (3H, д, J=7,0 Гц), 1,05 (6H, т, J=7,0 Гц), 1,19-1,65 (7H, м), 1,33 (3H, с), 1,65 (1H, дд, J=5,5, 13,9 Гц), 1,76 (3H, с), 1,80-1,90 (1H, м), 1,86 (1H, дд, J=5,5, 13,9 Гц), 2,42 (1H, дд, J=5,1, 13,9 Гц), 2,51-2,59 (4H, м), 2,58 (4Н, кв, J=7,0 Гц), 2,66 (1H, дд, J=2,2, 7,7 Гц), 2,89 (1H, дт, J=2,2, 5,5 Гц), 3,15-3,20 (2H, м), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,72-3,80 (1H, м), 4,74 (1H, дд, J=9,5, 9,5 Гц), 5,01 (1H, д, J=10,6 Гц), 5,41 (1H, дд, J=9,2, 15,0 Гц), 5,48 (1H, дд, J=9,5, 15,0 Гц), 5,86 (1H, д, J=15,4 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 637 (М+H)+.
Пример 23
(8Е,12Е,14Е)-7-((4-(2,2-диметилпропил)пиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 23)

Пример 23-1 стадия
(1) (8Е,12Е,14Е)-7-ацетокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид

Раствор (8Е,12Е,14Е)-7-ацетокси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (54 мг, 0,1 ммоль), 4-диметиламинопиридин (124 мг, 1 ммоль) и триэтиламин (102 мг, 1 ммоль) в метиленхлориде (2,5 мл) охлаждали до 5°С. К реакционной смеси добавляли по каплям раствор триэтилсилилхлорида (152 мг, 1 ммоль) в метиленхлориде (0,5 мл) и затем реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водой. Полученный органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат:гексан=1:19→1:14) с получением указанного в заголовке соединения (77,1 мг, 88%) в виде бесцветного масла.
ESI-MC m/z 901 (М+Na)+.
Пример 23-2 стадия
(2) (8Е,12Е,14Е)-7-гидрокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид

(8Е,12Е,14Е)-7-Ацетокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (77 мг, 0,0875 ммоль) растворяли в метаноле (2 мл). К полученному метанольному раствору добавляли карбонат калия (36,5 мг, 0,262 ммоль) и метанол (1 мл) и реакционную смесь перемешивали при комнатной температуре в течение четырех часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат:гексан=1:9→1:6→1:4→1:3) с получением указанного в заголовке соединения (38,6 мг, 50%) в виде бесцветного масла.
ESI-MC m/z 859 (М+Na)+.
Пример 23-3 стадия
(3) (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-((4-нитрофенокси)карбокси)-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид

Раствор (8Е,12Е,14Е)-7-гидрокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (38,6 мг, 0,046 ммоль), 4-диметиламинопиридина (26 мг, 0,207 ммоль) и триэтиламина (28 мг, 0,276 ммоль) в метиленхлориде (2 мл) охлаждали до 5°С. К реакционной смеси добавляли раствор 4-нитрофенилхлорформиата (29 мг, 0,138 ммоль) в метиленхлориде (1 мл) и реакционную смесь перемешивали при 5°С в течение одного часа. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором гидрокарбоната натрия. Затем органический слой промывали последовательно водным раствором хлорида аммония, водным раствором гидрокарбоната натрия и водой, сушили над безводным сульфатом магния и фильтровали. Затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат:гексан=1:14) с получением указанного в заголовке соединения (46,1 мг, 100%) в виде бледно-желтого масла.
ESI-MC m/z 1024 (М+Na)+.
Пример 23-4 стадия
(4) (8Е,12Е,14Е)-7-((4-(2,2-диметилпропил)пиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид

Раствор 1-(2,2-диметилпропил)пиперазиндитрифторацетата (12 мг, 20 мкмоль) и триэтиламина (10 мг, 0,1 ммоль) в тетрагидрофуране (0,7 мл) добавляли по каплям к раствору (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (10 мг, 10 мкмоль) в тетрагидрофуране (0,5 мл) и реакционную смесь перемешивали при комнатной температуре в течение трех часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали тонкослойной хроматографией (Merck, Art 1,05628; этилацетат-гексан, 1:6) с получением указанного в заголовке соединения (9,7 мг, 95%) в виде бесцветного масла.
ESI-MC m/z 1019 (М+Н)+.
Пример 23-5 стадия
(5) (8Е,12Е,14Е)-7-((4-(2,2-диметилпропил)пиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 23)

Раствор (8Е,12Е,14Е)-7-((4-(2,2-диметилпропил)пиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (9,7 мг, 9,5 мкмоль) в тетрагидрофуране (1 мл) охлаждали до 5°С. К реакционной смеси добавляли по каплям тетрабутиламмонийфторид (1,0М раствор в тетрагидрофуране, 31 мкл, 31 мкмоль) и реакционную смесь перемешивали при комнатной температуре в течение двух часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel plate, метанол-метиленхлорид, 1:49) с получением указанного в заголовке соединения (6,3 мг, 98%) в виде бесцветного масла.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,85-0,92 (15H, м), 0,94 (3H, т, J=7,6 Гц), 0,99 (3H, д, J=6,8 Гц), 1,19-1,69 (11H, м), 1,77 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 1,87-1,97 (1H, м), 2,09 (2H, с), 2,38-2,61 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,34-3,52 (4H, м), 3,52 (1H, тд, J=4,4, 7,6 Гц), 3,74-3,81 (1H, м), 4,75-4,82 (1H, м), 5,01 (1H, д, J=10,8 Гц), 5,43 (1H, дд, J=8,8, 14,8 Гц), 5,50 (1H, дд, J=9,2, 14,8 Гц), 5,86 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 677 (М+H)+.
Пример 24
(8Е,12Е,14Е)-7-((4-этилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 24)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,00 (3H, д, J=6,8 Гц), 1,11 (3H, т, J=7,2 Гц), 1,19-1,70 (11H, м), 1,77 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,6, 14,0 Гц), 1,88-1,99 (1H, м), 2,38-2,49 (7H, м), 2,51-2,61 (2H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,40-3,57 (5H, м), 3,74-3,82 (1H, м), 4,76-4,83 (1H, м), 5,01 (1H, д, J=10,8 Гц), 5,44 (1H, дд, J=8,8, 15,2 Гц), 5,51 (1H, дд, J=9,2, 14,8 Гц), 5,87(1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 635 (М+H)+.
Пример 25
(8Е,12Е,14Е)-7-((4-(N,N-диметиламино)пиперидин-1-ил)карбонил)окси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 25)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,00 (3H, д, J=6,8 Гц), 1,19-1,70 (13H, м), 1,77 (3H, д, J=0,8 Гц), 1,82-1,99 (4H, м), 2,28 (6H, с), 2,32-2,46 (2H, м), 2,50-2,62 (2H, м), 2,67 (1H, дд, J=2,4, 7,6 Гц), 2,68-2,88 (2H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,52 (1H, тд, J=4,4, 8,0 Гц), 3,74-3,82 (1H, м), 4,11-4,21 (2H, м), 4,75-4,82 (1H, м), 5,02 (1H, д, J=10,8 Гц), 5,44 (1H, дд, J=8,8, 15,2 Гц), 5,50 (1H, дд, J=9,2, 14,8 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 649 (М+H)+.
Пример 26
(8Е,12Е,14Е)-7-(N-(3-(N',N'-диметиламино)пропил)карбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 26)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,4 Гц), 1,00 (3H, д, J=6,4 Гц), 1,19-1,71 (10H, м), 1,34 (3H, с), 1,77 (3H, с), 1,82-1,90 (2H, м), 2,24 (6H, с), 2,34 (2H, т, J=7,6 Гц), 2,42 (1H, дд, J=5,4, 14,2 Гц), 2,50-2,60 (2H, м), 2,66 (1H, дд, J=2,2, 7,8 Гц), 2,89 (1H, дт, J=2,2, 5,6 Гц), 3,10 (2H, т, J=6,8 Гц), 3,48-3,55 (1H, м), 3,72-3,82 (1H, м), 4,74 (1H, дд, J=9,4, 9,4 Гц), 5,02 (1H, д, J=10,8 Гц), 5,37-5,53 (2H, м), 5,86 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 623 (М+H)+.
Пример 27
(8Е,12Е,14Е)-7-(N-(3-(N',N'-диметиламино)пропил)-N-метилкарбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 27)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=7,2 Гц), 0,89 (3Н, д, J=7,2 Гц), 0,94 (3Н, т, J=7,4 Гц), 1,01 (3H, д, J=6,4 Гц), 1,19-1,79 (10H, м), 1,34 (3H, с), 1,77 (3H, с), 1,82-1,98 (2H, м), 2,26 (6H, с), 2,28-2,37 (2H, м), 2,42 (1H, дд, J=5,2, 14,0 Гц), 2,51-2,59 (2H, м), 2,66 (1H, дд, J=2,2, 7,8 Гц), 2,83-2,94 (4H, м), 3,22-3,37 (2H, перекрытый CD3OD), 3,48-3,55 (1H, м), 3,74-3,82 (1H, м), 4,70-4,96 (1H, перекрытый Н2О), 5,02 (1Н, д, J=10,8 Гц), 5,40-5,55 (2H, м), 5,86 (1H, д, J=15,6 Гц), 6,12 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 637 (М+H)+.
Пример 28
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 28)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=6,6 Гц), 0,93 (3H, т, J=7,3 Гц), 0,99 (3H, д, J=7,2 Гц), 1,19-1,37 (3H, м), 1,33 (3H, с), 1,40-1,54 (2H, м), 1,54-1,68 (3H, м), 1,75 (3H, с), 1,82-1,98 (2H, м), 2,35-2,46 (1Н, м), 2,48-2,60 (2H, м), 2,62-2,68 (1H, м), 2,68-2,80 (4H, м), 2,82-2,92 (1H, м), 3,34-3,54 (5H, м), 3,72-3,82 (1H, м), 4,74-4,92 (1H, перекрытый Н2О), 5,01 (1H, д, J=10,4 Гц), 5,34-5,54 (2H, м), 5,86 (1H, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 607 (М+H)+.
Пример 29
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(1-метилпиперидин-4-ил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 29)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,89 (3H, д, J=7,2 Гц), 0,93 (3H, т, J=7,6 Гц), 0,99 (3H, д, J=6,8 Гц), 1,00-1,04 (1H, м), 1,19-1,68 (11H, м), 1,33 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, (14,0 Гц), 1,90-1,98 (1H, м), 2,04-2,16 (2H, м), 2,28 (3H, с), 2,42-2,60 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,79 (3H, с), 2,84-2,98 (3H, м), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,72-3,80 (1H, м), 3,82-3,98 (1H, м), 4,76-4,92 (1H, перекрытый Н2О), 5,01 (1H, д, J=10,4 Гц), 5,44 (1H, дд, J=9,2, 15,2 Гц), 5,50 (1H, дд, J=9,2, 15,2 Гц), 5,86 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 649 (М+H)+.
Пример 30
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(1-метилпиперидин-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 30)

Пример 30-1 стадия
(1) (8Е,12Е,14Е)-7-ацетокси-3,21-бис(диэтилизопропилсилокси)-16-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид

Раствор (8Е,12Е,14Е)-7-ацетокси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (177 мг, 0,33 ммоль) и имидазола (450 мг, 6,61 ммоль) в метиленхлориде (6 мл) охлаждали до 5°С. К реакционной смеси добавляли по каплям раствор диэтилизопропилсилилхлорида (272 мг, 1,65 ммоль) в метиленхлориде (1,5 мл) и реакционную смесь перемешивали при комнатной температуре в течение двух часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водой. Полученный органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=1:19→1:9→1:6→1:4) с получением указанного в заголовке соединения (242,9 мг, 93%) в виде бесцветного масла.
ESI-MC m/z 815(М+Na)+.
Пример 30-2 стадия
(2) (8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-7,16-дигидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид

0,2М Раствор гуанидин/нитрат гуанидина (смесь метанол-метиленхлорид, 9:1) (3,9 мл, 0,78 ммоль) добавляли к (8Е,12Е,14Е)-7-ацетокси-3,21-бис(диэтилизопропилсилокси)-16-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олиду (307 мг, 0,3868 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 13 часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором хлорида аммония. Полученный органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат-гексан, 1:4) с получением указанного в заголовке соединения (271,5 мг, 93%) в виде бесцветного масла.
ESI-MC m/z 773 (М+Na)+.
Пример 30-3 стадия
(3) (8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-16-гидрокси-6,10,12,16,20-пентаметил-7-((4-нитрофенокси)карбокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид

Раствор (8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-7,16-дигидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (271 мг, 0,3605 ммоль), 4-диметиламинопиридина (22 мг, 0,18 ммоль) и триэтиламина (369 мг, 3,61 ммоль) в метиленхлориде (5 мл) охлаждали до 5°С. К раствору добавляли по каплям раствор 4-нитрофенилхлорформиата (374 мг, 1,8 ммоль) в метиленхлориде (3 мл) и реакционную смесь перемешивали при 5-10°С в течение одного часа. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором гидрокарбоната натрия. Полученный органический слой промывали водой, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат-гексан, 1:9→1:7→1:6) с получением указанного в заголовке соединения (319,6 мг, 97%) в виде бледно-желтого масла.
ESI-MC m/z 938 (М+Na)+.
Пример 30-4 стадия
(4) (8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-16-гидрокси-6,10,12,16,20-пентаметил-7-((4-(1-метилпиперидин-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид

Раствор 1-(4-метилпиперидин-1-ил)пиперазина (11,7 мг, 63,3 мкмоль) в тетрагидрофуране (1 мл) и триэтиламин (13 мг, 0,127 ммоль) добавляли по каплям к раствору (8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-16-гидрокси-6,10,12,16,20-пентаметил-7-((4-нитрофенокси)карбокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (29 мг, 31,6 мкмоль) в тетрагидрофуране (2 мл) и реакционную смесь перемешивали при комнатной температуре в течение двух часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором гидрокарбоната натрия. Полученный органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel plate; этилацетат-гексан, 9:1) с получением указанного в заголовке соединения (18,5 мг, 61%) в виде бесцветного масла.
Пример 30-5 стадия
(5) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(1-метилпиперидин-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 30)

Раствор (8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-16-гидрокси-6,10,12,16,20-пентаметил-7-((4-(1-метилпиперидин-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (18,5 мг, 19,2 мкмоль) в тетрагидрофуране (2 мл) охлаждали до 5°С. К раствору добавляли по каплям тетрабутиламмонийфторид (1,0М раствор в тетрагидрофуране, 42,3 мкл, 42,3 мкмоль) и реакционную смесь перемешивали при комнатной температуре в течение четырех часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором гидрокарбоната натрия. Полученный органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel plate; метанол-дихлорметан, 1:24) с получением указанного в заголовке соединения (7,6 мг, 56%) в виде бесцветного масла.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,00 (3H, д, J=6,8 Гц), 1,19-1,69 (13H, м), 1,77 (3H, с), 1,82-1,97 (4H, м), 1,98-2,06 (2H, м), 2,25 (3H, с), 2,24-2,32 (1H, м), 2,42 (1H, дд, J=5,2, 14,0 Гц), 2,48-2,60 (6H, м), 2,66 (1Н, дд, J=2,4, 8,0 Гц), 2,87-2,95 (3H, м), 3,38-3,55 (5H, м), 3,74-3,81 (1Н, м), 4,75-4,82 (1H, м), 5,01 (1H, д, J=10,4 Гц), 5,44 (1H, дд, J=8,8, 14,8 Гц), 5,50 (1H, дд, J=9,2, 14,8 Гц), 5,86 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 704 (М+H)+.
Пример 31
(8Е,12Е,14Е)-7-((4-(2-цианоэтил)пиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 31)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,00 (3H, д, J=6,8 Гц), 1,19-1,69 (11H, м), 1,77 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 1,88-1,98 (1H, м), 2,38-2,51 (5H, м), 2,52-2,60 (2Н, м), 2,61-2,70 (5Н, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,40-3,56 (5H, м), 3,74-3,81 (1H, м), 4,76-4,82 (1H, м), 5,01 (1H, д, J=10,4 Гц), J=5,44 (1H, дд, J=8,8, 14,8 Гц), 5,50 (1H, дд, J=9,2, 14,8 Гц), 5,86 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 660 (М+H)+, 682 (М+Na)+.
Пример 32
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(((2S)-2-((пирролидин-1-ил)метил)пирролидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 32)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 30.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 0,97-1,07 (3H, м), 1,19-2,03 (25H, м), 2,38-2,69 (10Н, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,30-3,40 (1H, перекрытый CD3OD), 3,52 (1H, тд, J=4,4, 8,4 Гц), 3,73-3,81 (1H, м), 3,89-3,99 (1H, м), 4,74-4,86 (1H, перекрытый H2O), 5,02 (1H, д, J=10,8 Гц), 5,40-5,55 (2H, м), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 675 (М+H)+.
Пример 33
(8Е,12Е,14Е)-7-((4-(2-(N,N-диметиламино)этил)пиперазин-1-ил)карбонил)окси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 33)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 30.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,00 (3H, д, J=6,8 Гц), 1,19-1,69 (11H, м), 1,77 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 1,88-1,98 (1H, м), 2,28 (6H, с), 2,39-2,49 (5H, м), 2,49-2,61 (6H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,40-3,56 (5H, м), 3,75-3,81 (1H, м), 4,75-4,83 (1H, м), 5,02 (1H, д, J=10,8 Гц), 5,44 (1H, дд, J=8,8, 14,8 Гц), 5,50 (1H, дд, J=9,2, 14,8 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 678 (М+H)+.
Пример 34
(8Е,12Е,14Е)-7-((4-бензилпиперазин-1-ил)карбонил)окси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 34)
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 0,99 (3H, д, J=7,2 Гц), 1,14-1,32 (3H, м), 1,34 (3H, с), 1,36-1,70 (5H, м), 1,77 (3H, д, J=1,2 Гц), 1,78-1,96 (2H, м), 2,36-2,48 (5H, м), 2,52-2,60 (2H, м), 2,67 (1H, дд, J=2,4, 10,4 Гц), 2,89 (1H, дт, J=1,6, 5,2 Гц), 3,41-3,58 (7H, м), 3,74-3,82 (1H, м), 4,78 (1H, дд, J=9,0, 9,0 Гц), 5,01 (1H, д, J=10,4 Гц), 5,44-5,54 (2H, м), 5,87 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц), 7,22-7,38 (5H, м); ESI-МС m/z 697 (М+H)+.
Пример 35
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-(1-метилпиперидин-4-ил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 35)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=7,2 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 0,99 (3H, д, J=6,8 Гц), 1,20-1,32 (3H, м), 1,34 (3H, с), 1,36-1,72 (5H, м), 1,77 (3H, д, J=1,2 Гц), 1,80-1,90 (6H, м), 2,04-2,18 (2H, м), 2,26 (3H, с), 2,42 (1H, дд, J=5,6, 14,8 Гц), 2,51-2,59 (2H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,78-2,86 (2H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,35-3,40 (1H, м), 3,48-3,54 (1H, м), 3,74-3,80 (1H, м), 4,70-4,79 (1H, м), 5,01 (1H, д, J=10,8 Гц), 5,38-5,42 (2H, м), 5,86 (1H, д, J=15,6 Гц), 6,12 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 635 (М+H)+.
Пример 36
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(пиридин-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 36)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,89 (3H, д, J=7,2 Гц), 0,93 (3H, т, J=7,2 Гц), 1,01 (3H, д, J=6,8 Гц), 1,20-1,32 (3H, м), 1,34 (3H, с), 1,35-1,70 (5Н, м), 1,77 (3H, с), 1,82-2,01 (2H, м), 2,43 (1H, дд, J=5,2, 14,0 Гц), 2,51-2,62 (2H, м), 2,66 (1H, дд, J=2,0, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,38-3,48 (4H, м), 3,49-3,55 (1H, м), 3,56-3,66 (4H, м), 3,74-3,82 (1H, м), 4,80-4,92 (1H, перекрытый Н2О), 5,02 (1H, J=10,8 Гц), 5,40-5,56 (2H, м), 5,87 (1H, д, J=14,8 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц), 6,86 (2H, д, J=6,4 Гц), 8,12 (2H, д, J=6,4 Гц); ESI-МС m/z 684 (М+H)+.
Пример 37
(8Е,12Е,14Е)-7-((4-циклогексилпиперазин-1-ил)карбонил)окси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 37)
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,89 (3Н, д, J=7,2 Гц), 0,94 (3Н, т, J=7,4 Гц), 1,00 (3Н, д, J=6,4 Гц), 1,08-1,41 (8Н, м), 1,34 (3Н, с), 1,41-1,70 (6H, м), 1,70-1,98 (6H, м), 1,77 (3H, с), 2,25-2,35 (1H, м), 2,42 (1H, дд, J=5,4, 14,2 Гц), 2,50-2,63 (6H, м), 2,66 (1H, дд, J=2,2, 7,8 Гц), 2,89 (1H, дт, J=2,2, 5,6 Гц), 3,37-3,55 (5H, м), 3,74-3,82 (1H, м), 4,75-4,82 (1H, м), 5,02 (1H, д, J=10,8 Гц), 5,40-5,54 (2H, м), 5,86 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 689 (М+H)+.
Пример 38
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(тетрагидропиран-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 38)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,4 Гц), 1,00 (3H, д, J=6,4 Гц), 1,20-1,98 (14H, м), 1,34 (3H, с), 1,77 (3H, с), 2,38-2,62 (8H, м), 2,66 (1H, дд, J=2,2, 7,8 Гц), 2,89 (1H, дт, J=2,2, 5,6 Гц), 3,37-3,56 (7H, м), 3,74-3,82 (1H, м), 3,94-4,02 (2H, м), 4,76-4,82 (1H, м), 5,02 (1H, д, J=10,4 Гц), 5,40-5,54 (2H, м), 5,86 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=10,0 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 691 (М+H)+.
Пример 39
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-изопропилгомопиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 39)

(8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-16-гидрокси-6,10,12,16,20-пентаметил-7-((4-нитрофенокси)карбокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (31 мг, 0,034 ммоль), полученный в примере 30-3 стадия, растворяли в тетрагидрофуране (2 мл). Затем к смеси добавляли 1-изопропилгомопиперазин (9,7 мг, 0,068 ммоль) и триэтиламин (10,3 мг, 0,10 ммоль) и реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение двух часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором гидрокарбоната натрия и насыщенным раствором соли. Полученный органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia NH Silica gel; этилацетат-гексан, 20:80 →25:75) с получением (8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-16-гидрокси-7-((4-изопропилгомопиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (26 мг, 0,028 ммоль). ESI-MC m/z 919(М+Н)+.
Полученный продукт (25 мг, 0,027 ммоль) растворяли в тетрагидрофуране (1 мл) и к смеси добавляли по каплям тетрабутиламмонийфторид (1,0М раствор в тетрагидрофуране, 0,081 мл, 0,081 ммоль). Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение двух часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором гидрокарбоната натрия и насыщенным раствором соли. Полученный органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia NH Silica gel; метиленхлорид-метанол, 100:0,5→100:2) с получением указанного в заголовке соединения (14,6 мг) в виде бесцветного масла.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,4 Гц), 0,99-1,05 (9H, м), 1,16-2,00 (12H, м), 1,34 (3H, с), 1,77 (3H, с), 2,42 (1H, дд, J=5,2, 14,0 Гц), 2,48-2,76 (7H, м), 2,84-2,98 (2H, м), 3,38-3,58 (5H, м), 3,74-3,82 (1Н, м), 4,76-4,91 (1H, м), 5,02 (1H, д, J=10,8 Гц), 5,40-5,56 (2H, м), 5,86 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=10,0 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 663 (М+H)+.
Пример 40
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-(1-(4-(4-гидроксипеперидин-1-ил)пиперидин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 40)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 30.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=6,8 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,4 Гц), 0,99 (3H, д, J=6,4 Гц), 1,20-1,70 (12H, м), 1,34 (3H, с), 1,77 (3H, с), 1,82-1,98 (6H, м), 2,29-2,38 (2H, м), 2,38-2,60 (4H, м), 2,66 (1H, дд, J=7,6, 2,0 Гц), 2,70-2,91 (5H, м), 3,49-3,55 (1H, м), 3,55-3,64 (1Н, м), 3,74-3,81 (1H, м), 4,11-4,20 (2H, м), 4,75-4,81 (1H, м), 5,02 (1H, д, J=10,8 Гц), 5,40-5,54 (2H, м), 5,86 (1H, д, J=15,2 Гц), 6,12 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=11,2, 15,6 Гц); ESI-МС m/z 705 (М+H)+.
Пример 41
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-(2-гидроксиэтил)пиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 41)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=6,0 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,3 Гц), 0,99 (3H, д, J=6,8 Гц), 1,18-1,69 (11H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 1,88-1,98 (1H, м), 2,35-2,61 (9H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,82-2,92 (1H, м), 3,38-3,55 (5H, м), 3,60-3,80 (3H, м), 4,70-4,86 (1H, перекрытый H2О), 5,01 (1H, д, J=10,8 Гц), 5,34-5,54 (2H, м), 5,86 (1Н, д, J=15,2 Гц), 6,12 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 651 (М+H)+.
Пример 42
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(морфолин-4-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 42)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 18.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,2 Гц), 0,89 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 0,99 (3H, д, J=7,2 Гц), 1,20-1,69 (13H, м), 1,77 (3H, с), 1,82-1,98 (4H, м), 2,33-2,46 (3H, м), 2,50-2,60 (4H, м), 2,66 (1H, дд, J=2,0, 8,0 Гц), 2,72-2,86 (1H, м), 2,89 (1H, дт, J=2,0, 6,4 Гц), 3,52 (1H, дт, J=4,0, 8,0 Гц), 3,68 (4H, дд, J=4,8, 4,8 Гц), 3,73-3,82 (1H, м), 4,09-4,21 (4H, м), 4,70-4,85 (1H, м), 5,01 (1H, д, J=10,8 Гц), 5,40-5,55 (2H, м), 5,86 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,6 Гц); ESI-МС m/z 691 (М+H)+.
Пример 43
(8Е,12Е,14Е)-7-((4-этилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 43)

(8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-16-гидрокси-6,10,12,16,20-пентаметил-7-((4-нитрофенокси)карбокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (40 мг, 0,044 ммоль), полученный в примере 30-3 стадия, растворяли в тетрагидрофуране (2 мл). Затем к смеси добавляли 1-этилгомопиперазин (11 мг, 0,088 ммоль) и триэтиламин (0,061 мг, 0,44 ммоль) и реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водой и насыщенным раствором соли. Полученный органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto Silica gel 60N, 40-50 мкм; этилацетат-гексан, 1:1 →метиленхлорид-метанол, 1:9) с получением (8Е,12Е,14Е)-3,21-бис(диэтилизопропилсилокси)-7-((4-этилгомопиперазин-1-ил)карбонил)окси-16-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (34 мг, 0,038 ммоль) в виде бесцветного масла.
Полученный продукт (34 мг, 0,038 ммоль) растворяли в тетрагидрофуране (1 мл) и к смеси добавляли по каплям тетрабутиламмонийфторид (1,0М раствор в тетрагидрофуране, 0,187 мл, 0,187 ммоль). Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 17 часов. Реакционную смесь разбавляли этилацетатом и затем органический слой промывали водным раствором гидрокарбоната натрия и насыщенным раствором соли. Полученный органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; метиленхлорид-метанол, 100:1,5→метиленхлорид-метанол-28% водный раствор гидроксида аммония, 100:5:1) с получением указанного в заголовке соединения (23,3 мг) в виде бесцветного масла.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=7,2 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,01 (3H, д, J=6,8 Гц), 1,09 (3H, т, J=7,2 Гц), 1,20-1,69 (11H, м), 1,77 (3H, с), 1,82-1,90 (3H, м), 1,90-1,98 (1H, м), 2,42 (1Н, дд, J=5,2, 14,0 Гц), 2,52-2,72 (9H, м), 2,89 (1H, дт, J=2,4, 6,4 Гц), 3,42-3,60 (5H, м), 3,75-3,82 (1H, м), 4,70-4,90 (1H, перекрытый Н2О), 5,02 (1H, д, J=10,8 Гц), 5,40-5,55 (2H, м), 5,87 (1Н, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 649 (М+H)+.
Пример 44
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 44)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 30.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,00 (3H, д, J=6,8 Гц), 1,07 (6H, д, J=6,4 Гц), 1,20-1,69 (11H, м), 1,77 (3H, шир.с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 1,89-1,98 (1Н, м), 2,42 (1H, дд, J=5,2, 14,0 Гц), 2,48-2,60 (6H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,67-2,78 (1H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,40-3,57 (5H, м), 3,74-3,82 (1Н, м), 4,77-4,91 (1Н, перекрытый Н2О), 5,01 (1H, д, J=10,4 Гц), 5,40-5,55 (2H, м), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-MC m/z 649 (М+H)+.
Пример 45
(8Е,12Е,14Е)-7-((4-циклопропилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 45)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 30.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,32-0,54 (4H, м), 0,87 (3H, д, J=8,0 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,00 (3H, д, J=6,0 Гц), 1,14-2,00 (19H, м), 2,42 (1H, дд, J=5,6, 14,0 Гц), 2,42-2,62 (2H, м), 2,66 (1Н, дд, J=2,0, 8,0 Гц), 2,70-2,92 (5H, м), 3,37-3,58 (5Н, м), 3,68-3,82 (1Н, м), 4,77-4,91 (1Н, перекрытый Н2О), 5,0 (1H, д, J=10,8 Гц), 5,44-5,55 (2H, м), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 661 (М+H)+.
Пример 46
(8Е,12Е,14Е)-7-((4-циклопропилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 46)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 30.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,40-0,52 (4H, м), 0,87 (3H, д, J=5,6 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 0,98 (3H, д, J=6,0 Гц), 1,20-1,70 (12H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 1,89-1,98 (1H, м), 2,42 (1H, дд, J=5,6, 14,0 Гц), 2,50-2,63 (6H, м), 2,66 (1Н, дд, J=2,0, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,36-3,49 (4H, м), 3,52 (1H, дт, J=4,8, 7,6 Гц), 3,74-3,82 (1H, м), 4,77-4,90 (1H, перекрытый Н2О), 5,01 (1H, д, J=10,4 Гц), 5,44-5,55 (2H, м), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 647 (М+H)+, 670 (М+Na)+.
Пример 47
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-((N-(4-гидрокси-1-метилпиперидин-4-ил)метил-N-метил)карбамоилокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 47)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 30.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,86 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,01 (3H, д, J=6,8 Гц), 1,20-1,70 (15H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 1,89-1,98 (1H, м), 2,27 (1,5H, с), 2,28 (1,5H, с), 2,34-2,46 (3H, м), 2,50-2,64 (6H, м), 2,66 (1H, дд, J=2,0, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,4 Гц), 3,0 (1,5H, с), 3,02 (1,5H, с), 3,52 (1H, 10 дт, J=4,8, 8,0 Гц), 3,74-3,82 (1H, м), 4,74-4,92 (1H, перекрытый Н2О), 5,01 (1Н, д, J=10,4 Гц), 5,40-5,55 (2Н, м), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 48
(8Е,12Е,14Е)-7-(((1S,4S)-5-этил-2,5-диаззабицикло[2.2.1]гептан-2-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 48)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 30.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,92 (3H, д, J=6,8 Гц), 0,94 (3H, д, J=7,2 Гц), 0,98 (3H, т, J=7,2 Гц), 1,03 (1,5H, д, J=6,8 Гц), 1,06 (1,5H, д, J=6,8 Гц), 1,10-1,22 (3H, м), 1,22-1,75 (8H, м), 1,38 (3H, с), 1,76-2,03 (4H, м), 1,82 (3H, с), 2,47 (1H, дд, J=5,6, 14,4 Гц), 2,54-2,77 (6H, м), 2,83-2,99 (2H, м), 3,22-3,33 (1H, м), 3,53-3,63 (2H, м), 3,65 (1H, шир.с), 3,79-3,88 (1H, м), 4,36 (0,5H, с), 4,39 (0,5H, с), 4,77-4,91 (1H, м), 5,06 (1H, д, J=10,4 Гц), 5,45-5,63 (2H, м), 5,91 (1H, д, J=15,2 Гц), 6,18 (1H, д, J=10,8 Гц), 6,57 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 647 (М+H)+.
Пример 49
(8Е,12Е,14Е)-3,16,21-тригидрокси-7-(((1S,4S)-5-изопропил-2,5-диаззабицикло[2.2.1]гептан-2-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 49)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 30.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,92 (3Н, д, J=7,6 Гц), 0,94 (3Н, д, J=7,2 Гц), 0,98 (3Н, т, J=7,6 Гц), 1,03 (1,5Н, д, J=7,2 Гц), 1,09-1,16 (6Н, м), 1,21-1,75 (8Н, м), 1,38 (3Н, с), 1,77-2,03 (4Н, м), 1,82 (3Н, с), 2,47 (1Н, дд, J=5,6, 14,4 Гц), 2,52-2,75 (5Н, м), 2,94 (1Н, дт, J=2,0, 6,0 Гц), 3,05-3,16 (1Н, м), 3,21-3,34 (1Н, м), 3,51-3,65 (2Н, м), 3,77-3,89 (2Н, шир.c), 4,35 (0,5Н, с), 4,38 (0,5Н, с), 4,79-4,91 (1Н, м), 5,06 (1Н, д, J=10,8 Гц), 5,45-5,61 (2Н, м), 5,91 (1Н, д, J=15,6 Гц), 6,17 (1Н, д, J=10,8 Гц), 6,57 (1Н, дд, J=10,8, 15,2 Гц); ESI-MC m/z 661 (M+H)+.
Пример 50
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диметиламино)этил)-N-метилкарбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 50)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 1,01 (3H, шир.д, J=6,2 Гц), 1,19-1,68 (7H, м), 1,33 (3H, с), 1,65 (1H, дд, J=6,2, 13,9 Гц), 1,77 (3H, д, J=1,1 Гц), 1,86 (1H, дд, J=6,2, 13,9 Гц), 1,89-1,98 (1H, м), 2,27 (6H, с), 2,42 (1H, дд, J=5,5, 13,9 Гц), 2,45-2,60 (4H, м), 2,66 (1H, дд, J=2,2, 7,7 Гц), 2,87-2,92 (4H, м), 3,37-3,42 (2H, м), 3,52 (1H, дт, J=4,8, 8,4 Гц), 3,74-3,81 (1H, м), 4,74-4,82 (1H, м), 5,01 (1H, д, J=10,6 Гц), 5,40-5,53 (2H, м), 5,86 (1H, д, J=15,4 Гц), 6,12 (1H, дд, J=1,1, 11,0 Гц), 6,52 (1H, д, J=11,0, 15,4 Гц); ESI-МС m/z 623 (М+H)+.
Пример 51
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диметиламино)этил)карбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 51)
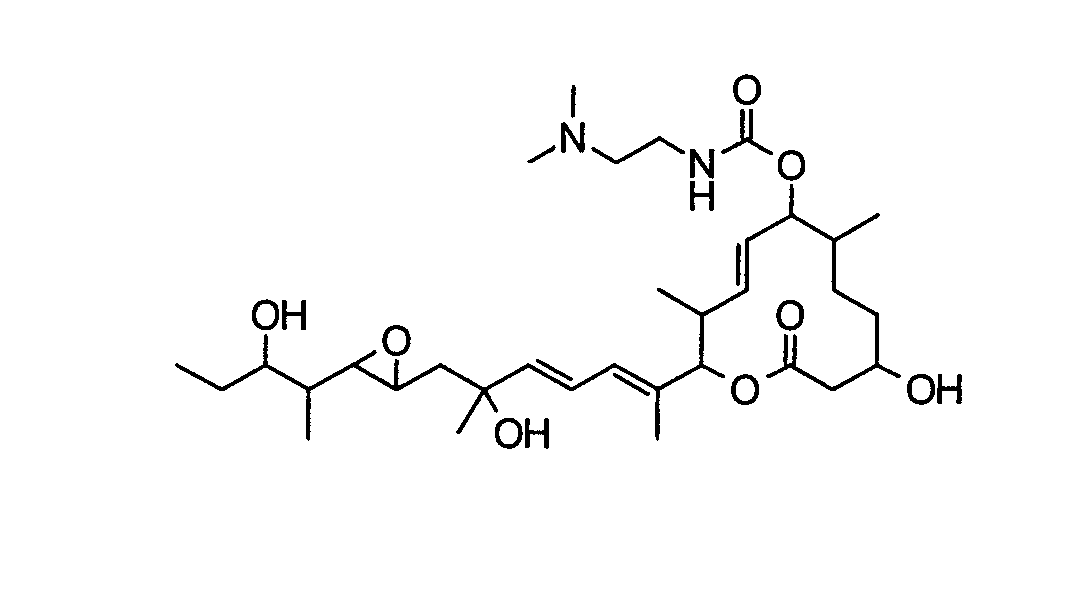
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,3 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 0,99 (3H, д, J=6,6 Гц), 1,20-1,68 (7H, м), 1,33 (3H, с), 1,65 (1H, дд, J=6,2, 13,9 Гц), 1,77 (3H, с), 1,83-1,91 (1H, м), 1,86 (1H, дд, J=6,2, 13,9 Гц), 2,25 (6H, с), 2,39-2,46 (1H, м), 2,43 (2H, т, J=7,0 Гц), 2,52-2,60 (2H, м), 2,66 (1Н, дд, J=2,2, 8,1 Гц), 2,89 (1H, дт, J=2,2, 6,2 Гц), 3,21 (2H, т, J=7,0 Гц), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,73-3,81 (1H, м), 4,74 (1H, дд, J=9,5, 9,5 Гц), 5,01 (1H, д, J=10,6 Гц), 5,38-5,52 (2H, м), 5,86 (1H, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, д, J=11,0, 15,0 Гц); ESI-МС m/z 609 (М+H)+.
Пример 52
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(морфолин-4-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 52)

(1) (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(морфолин-4-ил)этил)карбамоилокси)-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 52-1)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,625 (6H, кв, J=8,1 Гц), 0,634 (6H, кв, J=8,1 Гц), 0,65 (6H, кв, J=8,1 Гц), 0,83 (3H, т, J=7,3 Гц), 0,85 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93-1,01 (30Н, м), 1,15-1,32 (2H, м), 1,39-1,63 (6H, м), 1,42 (3H, с), 1,75 (3H, с), 1,83-1,92 (1H, м), 1,93 (1H, дд, J=4,8, 13,9 Гц), 2,33 (1H, дд, J=6,2, 13,6 Гц), 2,44-2,60 (8H, м), 2,61 (1H, дд, J=2,2, 8,1 Гц), 2,85-2,90 (1H, т), 2,92 (3H, с), 3,38-3,49 (2H, т), 3,61-3,72 (4H, м), 3,74 (1H, дт, J=3,7, 6,6 H), 3,90-3,98 (1H, т), 4,72-4,81 (1Н, т), 4,93 (1Н, д, J=10,6 Гц), 5,41-5,52 (2Н, м), 5,82 (1H, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,50 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 1008 (М+H)+.
(2) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(морфолин-4-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 52)

Удаляли защитные группы для гидроксильных групп в соединении 52-1 способом, подобно описанному в примере 23, с получением указанного в заголовке соединения (бесцветное масло).
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,01 (3H, д, J=7,0 Гц), 1,19-1,65 (7H, м), 1,33 (3H, с), 1,65 (1H, дд, J=5,5, 14,3 Гц), 1,77 (3H, д, J=1,1 Гц), 1,86 (1H, дд, J=5,5, 14,3 Гц), 1,89-1,98 (1H, м), 2,42 (1H, дд, J=5,5, 13,9 Гц), 2,42-2,61 (8H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,86-2,94 (1H, м), 2,91 (3H, с), 3,34-3,48 (2H, м), 3,52 (1H, дт, J=4,8, 8,4 Гц), 3,63-3,71 (4H, м), 3,74-3,81 (1H, м), 4,74-4,83 (1H, м), 5,01 (1H, д, J=10,6 Гц), 5,41-5,54 (2H, м), 5,86 (1Н, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 665 (М+H)+.
Пример 53
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(пиперидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 53)

(1) (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(пиперидин-1-ил)этил)карбамоилокси)-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 53-1)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,59-0,68 (18H, м), 0,82 (3H, т, J=7,3 Гц), 0,85 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,0 Гц), 0,95-1,02 (30Н, м), 1,15-1,63 (14H, м), 1,42 (3H, с), 1,75 (3Н, с), 1,83-1,92 (1Н, м), 1,93 (1H, дд, J=4,8, 13,9 Гц), 2,32 (1H, дд, J=6,2, 13,6 Гц), 2,41-2,59 (8H, м), 2,61 (1H, дд, J=2,2, 8,1 Гц), 2,85-2,92 (4H, м), 3,38-3,44 (2H, м), 3,74 (1Н, дт, J=3,3, 7,0 Гц), 3,91-3,98 (1H, м), 4,71-4,80 (1Н, м), 4,93 (1H, д, J=10,6 Гц), 5,40-5,52 (2H, м), 5,82 (1H, д, J=15,4 Гц), 6,11 (1H, д, J=11,0 Гц), 6,50 (1H, дд, J=11,0, 15,4 Гц). ESI-МС m/z 1006 (М+H)+.
(2) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(пиперидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 53)

Удаляли защитные группы для гидроксильных групп в соединении 53-1 способом, подобно описанному в примере 23, с получением указанного в заголовке соединения (бесцветное масло).
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,7 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 1,01 (3H, шир.д, J=6,2 Гц), 1,19-1,68 (14H, м), 1,33 (3H, с), 1,77 (3H, д, J=1,1 Гц), 1,86 (1H, дд, J=5,5, 14,3 Гц), 1,89-1,97 (1H, м), 2,39-2,60 (9H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,86-2,93 (1H, м), 2,90 (3H, с), 3,36-3,46 (2H, м), 3,52 (1H, дт, J=4,8, 8,4 Гц), 3,74-3,81 (1H, м), 4,74-4,82 (1H, м), 5,01 (1Н, д, J=10,6 Гц), 5,41-5,53 (2H, м), 5,86 (1H, д, J=15,4 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 663 (M+H)+.
Пример 54
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(пирролидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 54)

(1) (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(пирролидин-1-ил)этил)карбамоилокси)-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 54-1)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,59-0,68 (18H, м), 0,82 (3H, т, J=7,3 Гц), 0,85 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,0 Гц), 0,95-1,02 (30Н, м), 1,15-1,31 (2H, м), 1,42 (3H, с), 1,39-1,63 (6Н, м), 1,75 (3H, д, J=0,7 Гц), 1,75-1,93 (5H, м), 1,93 (1Н, дд, J=4,8, 13,9 Гц), 2,32 (1H, дд, J=6,2, 13,6 Гц), 2,50-2,69 (9H, м), 2,85-2,93 (4H, м), 3,39-3,46 (2H, м), 3,74 (1H, дт, J=3,3, 6,6 Гц), 3,90-3,98 (1H, м), 4,71-4,80 (1H, м), 4,93 (1H, д, J=10,6 Гц), 5,40-5,52 (2H, м), 5,82 (1H, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,50 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 992 (М+H)+.
(2) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(пирролидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 54)

Удаляли защитные группы для гидроксильных групп в соединении 54-1 способом, подобно описанному в примере 23, с получением указанного в заголовке соединения (бесцветное масло).
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 1,01 (3H, шир.д, J=6,6 Гц), 1,19-1,65 (7H, м), 1,33 (3H, с), 1,65 (1H, дд, J=5,5, 13,9 Гц), 1,77 (3H, д, J=1,1 Гц), 1,77-1,84 (4H, м), 1,86 (1H, дд, J=5,5, 13,9 Гц), 1,89-1,98 (1H, м), 2,42 (1H, дд, J=5,1, 14,3 Гц), 2,50-2,67 (8H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,86-2,93 (1H, м), 2,90 (3H, с), 3,39-3,45 (2H, м), 3,52 (1H, дт, J=4,8, 8,1 Гц), 3,74-3,82 (1H, м), 4,74-4,83 (1H, м), 5,01 (1H, д, J=10,6 Гц), 5,41-5,53 (2H, м), 5,86 (1H, д, J=15,4 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 649 (М+Н)+.
Пример 55
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(((1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 55)

(1) (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(((1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 55-1)
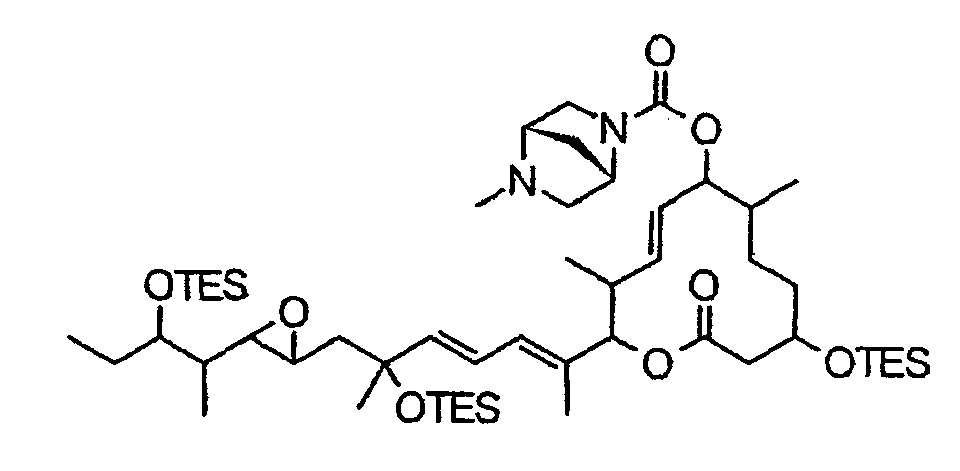
Раствор (1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептана (0,3М раствор в смеси N,N-диметилформамид-хлороформ (1:9), 80 мкл, 24 мкмоль) в тетрагидрофуране (0,5 мл) добавляли по каплям к раствору (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-3,6,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (12,7 мг, 12,7 мкмоль), полученного в примере 23-3 стадия, в тетрагидрофуране (0,5 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение пяти часов и затем удаляли растворитель выпариванием. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia NH Silica gel; этилацетат:гексан=1:2) с получением указанного в заголовке соединения (12,2 мг) в виде бесцветного масла.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,59-0,68 (18H, м), 0,82 (3H, т, J=7,7 Гц), 0,85 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,0 Гц), 0,95-1,02 (30H, м), 1,18-1,33 (2H, м), 1,39-1,63 (6H, м), 1,42 (3H, с), 1,72-1,98 (4H, м), 1,75 (3H, д, J=1,1 Гц), 2,32 (1H, дд, J=6,2, 13,6 Гц), 2,38 (1,5H, с), 2,40 (1,5Н, с), 2,52-2,90 (6H, т), 3,19-3,28 (1H, т), 13,44-3,52 (2H, т), 3,74 (1Н, дт, J=3,3, 6,6 Гц), 3,90-3,97 (1H, м), 4,31 (0,5Н, с), 4,35 (0,5H, с), 4,71-4,79 (1H, м), 4,93 (1H, д, J=10,6 Гц), 5,41-5,52 (2H, м), 5,82 (1Н, д, J=15,4 Гц), 6,11 (1H, д, J=11,0 Гц), 6,50 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 976 (М+H)+.
(2) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(((1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 55)

(8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(((1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид, полученный в примере 55-1 стадия (12,2 мг, 12,5 мкмоль) растворяли в тетрагидрофуране (0,5 мл). К смеси добавляли по каплям при перемешивании при комнатной температуре тетрабутиламмонийфторид (1,0М раствор в тетрагидрофуране, 0,050 мл, 0,050 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение двух часов и затем к реакционной смеси еще добавляли по каплям тетрабутиламмонийфторид (1,0М раствор в тетрагидрофуране, 0,012 мл, 0,012 ммоль). Реакционную смесь дополнительно перемешивали еще 30 минут и затем добавляли метанол (50 мкл). Полученную реакционную смесь очищали тонкослойной хроматографией (Fuji Silysia NH Silica gel plate; хлороформ-метанол, 40:1) с получением указанного в заголовке соединения (7,3 мг) в виде бесцветного масла.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=6,6 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 0,98 (1,5H, д, J=7,0 Гц), 1,01 (1,5H, д, J=7,0 Гц), 1,19-1,80 (9H, м), 1,33 (3H, с), 1,77 (3H, д, J=1,1 Гц), 1,83-1,97 (3H, м), 2,38-2,40 (1H, м), 2,38 (1,5H, с), 2,40 (1,5H, с), 2,50-2,61 (1H, м), 2,56 (1H, дд, J=3,7, 14,3 Гц), 2,62-2,71 (1H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,75 (0,5H, дд, J=1,8, 10,3 Гц), 2,81 (0,5H, дд, J=1,8, 10,3 Гц), 2,89 (1H, дт, J=2,2, 5,9 Гц), 3,20 (0,5H, дд, J=1,8, 10,3 Гц), 3,25 (0,5H, дд, J=1,8, 10,3 Гц), 3,44-3,55 (3H, м), 3,74-3,81 (1H, м), 4,31 (0,5H, с), 4,34 (0,5H, с), 4,74-4,82 (1H, м), 5,01 (1H, д, J=10,6 Гц), 5,42-5,53 (2H, м), 5,86 (1H, д, J=15,4 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц). ESI-МС m/z 633 (М+H)+.
Пример 56
(8Е,12Е,14Е)-7-(N-(1-азабицикло[2.2.2]октан-3-ил)карбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 56)

(1) (8Е,12Е,14Е)-7-(N-(1-азабицикло[2.2.2]октан-3-ил)карбамоилокси)-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 56-1)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,59 (18H, м), 0,82 (3H, т, J=7,3 Гц), 0,85(3H, д, J=7,0 Гц), 0,88 (3H, д, J=7,0 Гц), 0,95-1,01 (30H, м), 1,18-1,89 (14H, м), 1,42 (3H, с), 1,74 (3H, с), 1,93 (1H, дд, J=4,8, 13,9 Гц), 2,32 (1H, дд, J=6,2, 13,2 Гц), 2,50-2,61 (3H, м), 2,61 (1Н, дд, J=2,2, 8,4 Гц), 2,72-2,91 (5H, м), 3,19-3,28 (1Н, м), 3,66-3,78 (2H, м), 3,90-3,97 (1Н, м), 4,68-4,75 (1Н, м), 4,93 (1H, д, J=10,6 Гц), 5,38-5,50 (2H, м), 5,82 (1H, д, J=15,4 Гц), 6,11 (1H, д, J=11,0 Гц), 6,49 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 990 (М+H)+.
(2) (8Е,12Е,14Е)-7-(N-(1-азабицикло[2.2.2]октан-3-ил)карбамоилокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 56)

Удаляли защитные группы для гидроксильных групп в соединении 56-1 способом, подобно описанному в примере 23, с получением указанного в заголовке соединения (бесцветное масло).
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 1,01 (3H, д, J=6,6 Гц), 1,18-1,94 (15H, м), 1,33 (3H, с), 1,76 (3H, д, J=0,7 Гц), 2,42 (1H, дд, J=5,5, 14,3 Гц), 2,49-2,60 (3H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,69-2,92 (5H, м), 3,17-3,25 (1H, м), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,64-3,70 (1H, м), 3,73-3,81 (1H, м), 4,70-4,79 (1H, м), 5,01 (1H, д, J=10,6 Гц), 5,39-5,51 (2H, м), 5,86 (1Н, д, J=15,4 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 647 (М+H)+.
Пример 57
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(N'-метиламино)циклогексил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 57)

(1) (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(N'-метиламино)циклогексил)карбамоилокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 57-1)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,59-0,69 (18H, м), 0,82 (3H, т, J=7,3 Гц), 0,85 (3H, д, J=7,0 Гц), 0,85-0,91 (3H, м), 0,95-1,03 (30H, м), 1,07-1,68 (13H, м), 1,42 (3H, с), 1,71-1,82 (2H, м), 1,75 (3Н, с), 1,83-1,94 (1H, м), 1,94 (1H, дд, J=4,8, 13,9 Гц), 2,08-2,16 (1H, м), 2,29-2,36 (1H, м), 2,33 (3H, с), 2,47-2,61 (3H, м), 2,61 (1Н, дд, J=2,2, 8,1 Гц), 2,78 (3H, с), 2,85-2,90 (1H, м), 3,72-3,86 (2H, м), 3,91-3,97 (1H, м), 4,78 (1H, дд, J=9,2, 9,2 Гц), 4,93 (1H, д, J=10,6 Гц), 5,41-5,52 (2H, м), 5,82 (1H, д, J=15,0 Гц), 6,11 (1H, д, J=11,0 Гц), 6,50 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 1006 (М+H)+.
(2) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(N'-метиламино)циклогексил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 57)

Удаляли защитные группы для гидроксильных групп в соединении 57-1 способом, подобно описанному в примере 23, с получением указанного в заголовке соединения (бесцветное масло).
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,86 (3H, шир.д, J=5,9 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 0,97-1,68 (16H, м), 1,33 (3H, с), 1,71-1,82 (2H, м), 1,76 (3Н, д, J=0,7 Гц), 1,86 (1H, дд, J=5,5, 13,9 Гц), 1,90-1,99 (1H, м), 2,07-2,16 (1H, м), 2,32 (3H, с), 2,42 (1H, дд, J=5,5, 13,9 Гц), 2,47-2,63 (3H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,78 (3H, с), 2,88 (1H, дт, J=2,2, 6,2 Гц), 3,52 (1H, дт, J=4,8, 8,1 Гц), 3,74-3,82 (2H, м), 4,81 (1Н, дд, J=9,9, 9,9 Гц), 5,01 (1H, д, J=10,6 Гц), 5,42-5,53 (2Н, м), 5,86 (1H, д, J=15,4 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 663 (М+H)+.
Пример 58
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-(2-(морфолин-4-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 58)
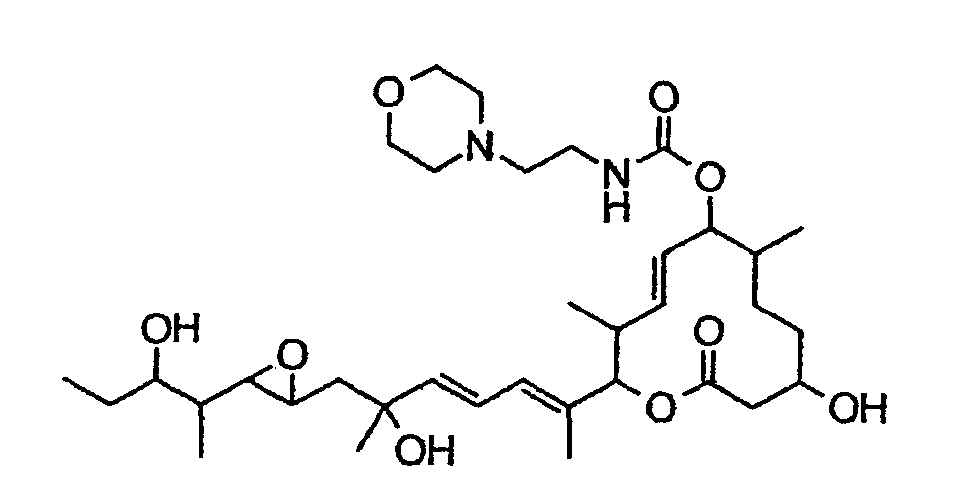
(1) (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(N-(2-(морфолин-4-ил)этил)карбамоилокси)-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 58-1)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H-ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,59-0,68 (18H, м) 0,82 (3H, т, J=7,7 Гц), 0,85 (3H, д, J=6,6 Гц), 0,89 (3H, д, J=7,0 Гц), 0,95-1,02 (30Н, м), 1,16-1,32 (2H, м), 1,39-1,62 (6H, м), 1,42 (3H, с), 1,75 (3H, с), 1,75-1,87 (1H, 5 м), 1,93 (1H, дд, J=4,8, 13,9 Гц), 2,32 (1H, дд, J=6,2, 13,6 Гц), 2,42-2,61 (8H, м), 2,61 (1H, дд, J=2,2, 8,4 Гц), 2,85-2,90 (1H, м), 3,32 (2H, т, J=6,6 Гц), 3,67 (4H, т, J=4,8 Гц), 3,74 (1H, дт, J=3,3, 6,6 Гц), 3,90-3,98 (1H, м), 4,71 (1H, дд, J=8,8, 8,8 Гц), 4,93 (1H, д, J=10,6 Гц), 5,37-5,50 (2H, м), 5,82 (1H, д, J=15,0 Гц), 6,11 (1H, д, J=11,0 Гц), 6,49 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 994 (М+H)+.
(2) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-(2-(морфолин-4-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 58)

Удаляли защитные группы для гидроксильных групп в соединении 58-1 способом, подобно описанному в примере 23, с получением указанного в заголовке соединения (бесцветное масло).
1H ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,00 (3H, д, J=7,0 Гц), 1,19-1,64 (7H, м), 1,33 (3H, с), 1,65 (1H, дд, J=5,5, 13,9 Гц), 1,76 (3H, д, J=0,7 Гц), 1,83-1,90 (1H, м), 1,86 (1H, дд, J=5,5, 13,9 Гц), 2,38-2,60 (9H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,88 (1H, дт, J=2,2, 5,5 Гц), 3,23 (2H, дт, J=1,1, 7,0 Гц), 3,52 (1H, дт, J=4,8, 8,1 Гц), 3,67 (4H, т, J=4,8 Гц), 3,73-3,80 (1H, м), 4,74 (1H, дд, J=9,9, 9,9 Гц), 5,01 (1H, д, J=10,6 Гц), 5,38-5,51 (2H, м), 5,86 (1H, д, J=15,0 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 651 (М+H)+.
Пример 59
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-(2-(пиперидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 59)

(1) (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(N-(2-(пиперидин-1-ил)этил)карбамоилокси)-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 59-1)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,59-0,68 (18H, м), 0,82 (3H, т, J=7,7 Гц), 0,85 (3H, д, J=7,3 Гц), 0,89 (3H, д, J=6,6 Гц), 0,95-1,02 (30Н, м), 1,16-1,32 (2H, м), 1,39-1,62 (12H, м), 1,42 (3H, с), 1,74 (3H, с), 1,76-1,85 (1H, м), 1,93 (1H, дд, J=4,8, 13,9 Гц), 2,32 (1H, дд, J=6,6, 13,6 Гц), 2,41-2,61 (8H, м), 2,61 (1H, дд, J=2,2, 8,4 Гц), 2,84-2,90 (1H, м), 3,23 (2H, т, J=7,0 Гц), 3,74(1H, дт, J=3,7, 7,0 Гц), 3,90-3,97 (1H, м), 4,70 (1H, дд, J=9,2, 9,2 Гц), 4,93 (1H, д, J=10,6 Гц), 5,37-5,50 (2H, м), 5,82 (1H, д, J=15,4 Гц), 6,11 (1H, д, J=11,0 Гц), 6,49 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 992 (М+H)+.
(2) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-(2-(пиперидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 59)

Удаляли защитные группы для гидроксильных групп в соединении 59-1 способом, подобно описанному в примере 23, с получением указанного в заголовке соединения (бесцветное масло).
1H ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,3 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 0,99 (3H, д, J=7,0 Гц), 1,19-1,68 (14H, м), 1,33 (3H, с), 1,76 (3H, д, J=1,1 Гц), 1,83-1,90 (1H, м), 1,86 (1H, дд, J=5,5, 13,9 Гц), 2,38-2,60 (9H, м), 2,66 (1H, дд, J=2,6, 8,1 Гц), 2,89 (1H, дт, J=2,6, 5,5 Гц), 3,23 (2H, дд, J=6,2, 7,7 Гц), 3,52 (1H, дт, J=4,8, 8,4 Гц), 3,73-3,80 (1H, м), 4,74 (1H, дд, J=9,9, 9,9 Гц), 5,01 (1H, д, J=10,6 Гц), 5,38-5,51 (2H, м), 5,86 (1H, д, J=15,4 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 649 (М+H)+.
Пример 60
(8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-(2-(пирролидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 60)

(1) (8Е,12Е,14Е)-6,10,12,16,20-пентаметил-7-(N-(2-(пирролидин-1-ил)этил)карбамоилокси)-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 60-1)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобно описанному в примере 23.
1H ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,59-0,68 (18H, м), 0,82 (3H, т, J=7,7 Гц), 0,85 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=6,6 Гц), 0,95-1,02 (30Н, м), 1,15-1,30 (2H, м), 1,39-1,61 (6H, м), 1,42 (3H, с), 1,75 (3H, д, J=0,7 Гц), 1,75-1,85 (5H, м), 1,93 (1H, дд, J=4,8, 13,9 Гц), 2,32 (1H, дд, J=6,6, 13,6 Гц), 2,50-2,62 (9H, м), 2,85-2,90 (1H, м), 3,24 (2H, т, J=7,0 Гц), 3,74 (1H, дт, J=3,3, 7,0 Гц), 3,90-3,97 (1H, м), 4,71 (1H, дд, J=9,5, 9,5 Гц), 4,93 (1H, д, J=10,6 Гц), 5,37-5,50 (2H, м), 5,82 (1H, д, J=15,4 Гц), 6,11 (1H, д, J=11,0 Гц), 6,49 (1H, дд, J=11,0, 15,4 Гц); ESI-MC m/z 978 (M+H)+.
(2) (8Е,12Е,14Е)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-(N-(2-(пирролидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 60)

Удаляли защитные группы для гидроксильных групп в соединении 60-1 способом, подобно описанному в примере 23, с получением указанного в заголовке соединения (бесцветное масло).
1H ЯМР (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=7,7 Гц), 0,89 (3H, д, J=7,3 Гц), 0,93 (3H, т, J=7,3 Гц), 1,00 (3H, д, J=6,6 Гц), 1,20-1,65 (7H, м), 1,33 (3H, с), 1,65 (1H, дд, J=5,5, 13,9 Гц), 1,76 (3H, д, J=1,1 Гц), 1,76-1,90 (5H, м), 1,86 (1H, дд, J=5,5, 13,9 Гц), 2,42 (1H, дд, J=5,1, 13,9 Гц), 2,49-2,63 (8H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,89 (1H, дт, J=2,2, 5,5 Гц), 3,24 (2H, т, J=7,3 Гц), 3,52 (1H, дт, J=4,8, 8,1 Гц), 3,74-3,81 (1H, м), 4,74 (1H, дд, J=9,9, 9,9 Гц), 5,01 (1H, д, J=10,6 Гц), 5,38-5,51 (2H, м), 5,86 (1H, д, J=15,4 Гц), 6,12 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 635 (М+H)+.
Реферат
Изобретение относится к новым соединения, представленным общей

формулой (I)
их фармакологически приемлемым солям и гидраам тех и других, где W представляет собой

и R3, R7, R16, R17, R20, R21 и R21′ являются одинаковыми или различными и каждый из них представляет собой атом водорода идругие значения, указанные в формуле изобретения. Благодаря ингибированию ангиогенеза и ингибированию продукции VEGF, в частности в гипоксических условиях, соединения (I) полезны в качестве лекарственных средств для лечения солидной злокачественной опухоли. Изобретения также относится к фармацевтической композиции и лекарственному средству на основе этих соединений, микробиологическим способам получения этих соединений, штаммам, используемым для их получения, способам ингибирования и лечения и применению. 14 н. и 39 з.п. ф-лы, 4 табл.
Формула











































Комментарии