Производные бензопирана, замещенные вторичными аминами, включающими в себя тетразол, способ их получения и содержащие их фармацевтические композиции - RU2283312C2
Код документа: RU2283312C2
Описание
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Настоящее изобретение относится к производным бензопирана, замещенным вторичными аминами, включающими в себя тетразол, и представленным нижеследующей формулой 1, способу их получения и содержащей их фармацевтической композиции.
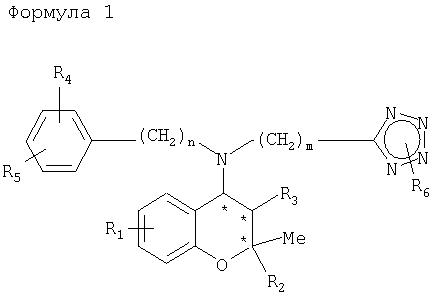
где R1, R2, R3, R4, R5, R6, n, m и * имеют значения, указанные в описании.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Нейроны в ЦНС (центральной нервной системе) млекопитающих являются очень чувствительными к доступности кислорода. Хорошо известно, что временное критическое снижение уровня кислорода в здоровом головном мозге запускает различные патологические процессы и, в конце концов, приводит к летальному повреждению головного мозга [К.Nieber, Pharmacol. Ther. 1999, 82, 71]. Кислород может стать недоступным для головного мозга из-за потери кровотока (ишемии) после остановки сердца или окклюзии внутричерепных сосудов вследствие тромбоза и эмболии или из-за недостаточной концентрации кислорода в крови (гипоксии).
Ишемическое повреждение клеток может являться результатом биохимических каскадов сложных взаимодействий, которые включают в себя нарушения в электрофизиологическом, гемодинамическом и энергетическом метаболизме [W. Paschen and B. Djuricic, J. Neurochem. 1995, 65, 1692] и модификации в синаптической трансмиссии [H. J. Luhmann, Prog. Neurobiol. 1996, 48, 131]. Нарушенный ионный гомеостаз, характеризующийся повышенным клеточным истечением К+ и поступлением Na+ и Са2+, сопровождается существенным внеклеточным ацидозом, образованием свободных радикалов, набуханием клеток и ингибированием синтеза белков, которые связаны с рецептором возбуждающих аминокислот, Са-зависимым или АТФ-зависимым К-каналом и т.д. Как объяснялось выше, ишемическое повреждение клеток возникает вследствие каскада биохимических событий, а не отдельного события. Так, для разработки нейрозащитных агентов предложено несколько стратегий и предполагается также, что эффективное вмешательство в несколько ключевых стадий во время ишемического каскада является необходимым для эффективного терапевтического агента для ишемии головного мозга [De Keyser et al. Trends Neurosci., 1999, 22, 535; Dirnagl et al. Trends Neurosci., 1999, 22, 391; Gladstont et al. Stroke, 2002, 33, 2123].
Даже после того, как кровоток восстанавливается, кислород может также усилить биохимические реакции, которые генерируют свободные радикалы, которые могут привести к возможности того, что будет иметь место «реперфузионное повреждение». Известно, что, как острое, так и хроническое повреждение тканей и органов вызывается ишемией-реперфузией или эндотоксинами вследствие бактериальной инфекции. Для того чтобы предотвратить повреждение головного мозга, вызванного ишемией-реперфузией, головной мозг должен быть защищен во время ишемического периода, чтобы избежать дополнительного повреждения, а патологические прогрессирующие клеточные изменения нужно минимизировать.
Для этой цели проводится разработка нескольких нейрозащитных средств, таких как антагонисты возбуждающих аминокислот, антиокислители, агонисты аденозина и открыватели КАТР-каналов.
Известно, что повреждение или гибель нейронов является основной причиной различных неврологических нарушений, таких как удар, травма головы, болезнь Альцгеймера, болезнь Паркинсона, асфиксия младенцев, глаукома и диабетическая невропатия и т.д. [G. J. Zoppo et al., Drugs 1997, 54, 9: I. Sziraki et al., Neurosci, 1998, 85, 1101].
Нейроны повреждаются различными факторами, включающими повышения в концентрации железа, реакционноспособные кислородные разновидности и перокислители в нейронах [M. P. Mattson et al., Methods Cell Biol. 1995, 46, 187; Y. Goodman et al., Brain Res. 1996, 706, 328].
Свободные радикалы генерируются в клетках окислительным стрессом. Избыток кислородных свободных радикалов способствует липидному перокислению, так что перокислители аккумулируются в нейронах и это также вызывает изменение в синтезе белка и ДНК. Известно, что реакционноспособные свободные радикалы, аккумулированные в клетках, являются ответственными за различные заболевания [J. M. McCord, Am J. Med. 2000, 108, 652], включая воспалительные заболевания, такие как артрит; атеросклероз; инфаркт сердечной мышцы и нейродегенеративное заболевание, такое как деменция, аллергия, рак, а также острое и хроническое повреждение тканей и органов.
Поэтому были продолжены терапевтические подходы для минимизации повреждения или гибели нейронов, включающие ингибирование липидного перокисления, образования NO и реакционноспособных кислородных частиц, индуцированных эндотоксинами. На сегодняшний день известно, что антиокислители снижают повреждение и гибель нейронов, вызванные повышением концентрации железа в нейронах. Много усилий прилагали для разработки фармацевтических лекарственных средств, которые способны предотвратить повреждение нейронов окислительным стрессом (Y. Zhang et al., J. Cereb. Blood Flow Metab. 1993, 13, 378).
Имеются сообщения о том, что открытие КАТР-канала связано с индуцированием антиокислительных ферментов [S. Okubo et al., Mol. and cell Biochem., 1999, 196, 3] и снижением высвобождения возбуждающей аминокислоты [J-L Moreau, G. Huber, Brain Res., 1999, 31, 65].
Было описано, что диазоксид, открыватель КАТР-каналов, обратимо окисляет флавопротеины в митохондрии, что приводит к ингибированию образования кислородных свободных радикалов, такое ингибирование может защитить клетки от повреждения окислительным стрессом [A. A. Starkov, Biosci, Rep. 1997, 17, 273; V. P. Skulachev, Q. Rev. Biophus. 1996, 29, 169].
Описано, что асфиксия младенцев (IA), обусловленная временным недостатком снабжения кислородом во время родов, вызывается снижением продуцирования энергии, повреждением клеточной мембраны из-за кислородных свободных радикалов, высвобождением возбуждающих нейротрансмиттеров, изменением внутриклеточных концентраций ионов, в том числе кальция, цинка и т.д. IA является основной проблемой во всем мире, поскольку, если IA является тяжелой, случаи смертности являются высокими (приблизительно 1/3 общей смертности младенцев). Кроме того, она может вызвать длительные последствия, такие как нарушения движений, потери способности к обучению, эпилепсия, дистония, умственная отсталость и мышечная спастичность [C. F. Loid et al. Physiology and Behavior, 2000, 68, 263-269].
Антиокислительные ферменты, аллопуринол, витамины С и Е, поглотители свободных радикалов, ингибиторы возбуждающих нейротрансмиттеров, блокаторы кальциевых каналов, такие как нимодипин и флунаризин, ингибиторы образования NO, гипергликемическая и гипотермическая терапия могут быть полезными для защиты головного мозга от повреждения, но их клиническое применения является все же ограниченным.
Глаукому, одну из основных причин слепоты, определяют как глазную невропатию, связанную с характерными изменениями в зрительном нерве. У людей зрительный нерв состоит из 1 миллиона оксонов нейронов, перикарионы которых находятся в основном в слое ганглиозных клеток и в меньшей степени во внутренней части внутреннего ядерного слоя. Считается, что рассеченный внешний вид диска зрительного нерва при глаукоме вызывается гибелью и затем потерей ганглиозных клеток и их аксонов [N.N. Osborne, et al., Survey of Ophthalmology, 43; suppl. 1999, S102-128].
Нейрозащитные агенты при глаукоме могут защитить от гибели ретинальные нейроны, в частности ганглиозные клетки, либо непосредственным, либо косвенным образом. Для защиты от гибели ретинальных нейронов, вызванной ишемией, и защиты от повреждения зрительных нервов могут быть использованы различные агенты, такие как антагонист рецептора NMDA (N-метил-D-аспартата), α-блокаторы, антагонисты кальция и антиокислители.
Хотя патогенез диабетической невропатии не был четко установлен, были предложены две основные гипотезы для этого. Одной из них является метаболические нарушения и другой является недостатки кровотока в периферических нервах [K. Naka et al. Diabetes Research and Clinical Practice, 1995, 30, 153-162]. В клинических исследованиях применяют ацетил-L-карнитин (ALC), действующий посредством стимуляции метаболизма липидов и исправления ослабленных ноцицепторных реакций нейронов, и просаптид, действующий посредством высвобождения нейротрофических факторов. Кроме того, проводят клиническое исследование с немантином, оказывающим хорошее действие на васкулярную деменцию посредством регуляции рецептора NMDA. Затем для лечения диабетической невропатии могут быть разработаны нейрозащитные агенты, имеющие различные механизмы действия.
Ишемические заболевания сердца обычно вызываются миокардиальной ишемией, когда подача кислорода значительно снижается по сравнению с потребностью в кислороде вследствие нарушения равновесия между ними [G. J. Grover, Can. J. Physiol., 1997, 75, 309; G. D. Lopaschuk et al. Science and Medicine, 1997, 42]. Миокардиальная ишемия вызывает различные патофизиологические изменения прогрессирующим образом, что в конечном счете приведет к необратимому миокардиальному повреждению, гибели клеток и некрозу ткани. На стадии, где повреждение клеток является обратимым, этот процесс может быть предотвращен ранней реперфузией миокарда. Однако существует возможность того, что будет иметь место «повреждение при реперфузии» [D. J. Hearse, Medicographia, 1996, 18, 22].
Для замедления ишемического каскада и минимизации повреждения при реперфузии исследовали использование агонистов аденозина, ингибиторов Na+-K+-антипорта, поглотителей кислородных свободных радикалов и открывателей КАТР (АТР-чувствительного калиевого канала), а также ингибиторов АСЕ (фермента, превращающего ангиотензин) и антагонистов кальция. Кроме того, общая ишемия имеет место во время хирургии сердца или во время хранения сердца перед трансплантацией. В недавних исследованиях описано, что добавление открывателей КАТР к гиперкалемическому, кардиоплегическому раствору способствует восстановлению послеишемической сократительной функции после нормотермической ишемии или коротких периодов гипотермической ишемии [D. J. Chamders, D. J. Hearse, Ann. Thoar. Surg., 1999, 68, 1960]. Проводятся исследования по использованию этих соединений в качестве защитных средств или лечебных средств для органов, связанных с «повреждением вследствие ишемии при реперфузии», таких как сетчатка и скелетные мышцы, помимо сердца и головного мозга.
Как указано выше, так как ишемические каскады развиваются посредством комплексных взаимодействий, этот факт может быть полезной стратегией для разработки соединения, действующего у более чем одного целевого сайта в ишемическом каскаде.
КАТР обнаружен в различных тканях, в том числе в сердечной мышце, гладкой мышце, скелетной мышце, почке, панкреатических β-клетках, головном мозге и центральной нервной системе, которые делают его перспективным в качестве целевого лекарственного средства. Однако такое многообразие обуславливает трудность нахождения селективных для тканей агентов.
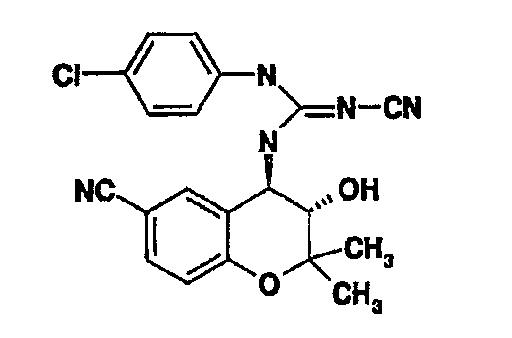
Было описано, что в отличие от общепринятых открывателей калиевых каналов, производное бензопиранилцианогуанидина (BMS-180448), представленное нижеследующей формулой 4, и производное бензопиранилимидазола (BMS-191095), представленное нижеследующей формулой 5, проявляют умеренную антиишемическую активность с превосходной сердечной селективностью. Хотя соединение, представленное формулой 5, имело все желательные свойства для того, чтобы служить в качестве основного соединения, оно все же сохраняет некоторую степень сосудорасширяющей и гипотензивной активности [K. S. Atwal et al., J. Med. Chem., 1995, 38, 3236; K. S. Atwal et al., J. Med. Chem., 1996, 40, 24; K. S. Atwal et al., Current Pharmaceutical Design, 1996, 2, 585]. Поэтому более кардиоселективные соединения, которые обладают кардиозащитной активностью без значительного снижения кровяного давления, все же дают надежду на разработку нового кардиозащитного средства.
ФОРМУЛА 4
ФОРМУЛА 5

Доля рака среди заболеваний человека постепенно возрастает. Ангиогенез, образование новых кровеносных сосудов, признают в качестве основного процесса для роста и метастазирования солидных опухолей (Folkma, J. et al., J. Biol. Chem. 1992, 267, 10931-10934). Ангиогенез регулируется индукторами и ингибиторами ангиогенеза. Когда баланс между ними нарушается, то есть когда индукторы ангиогенеза превалируют над ингибиторами ангиогенеза, образуется большое количество новых кровеносных сосудов. Ангиогенез тесно связан с различными физиологическими феноменами, такими как эмбриональное развитие, заживление раны, хроническое воспаление, гемангиомы, диабетическая ретинопатия, ревматоидный артрит, псориаз, осложнения при СПИДЕ и рост и метастаз злокачественных опухолей (Forkman, J., Klagsbrun, M. Science, 1987, 235, 442-447). Ангиогенез включает в себя ряд процессов, таких как миграция, пролиферация и дифференциация эндотелиальных клеток, и является важной предпосылкой для роста и метастаза раковых опухолей. Подробно, поскольку рост опухолевых клеток требует образования кровеносных сосудов из клеток хозяина, стимуляторы ангиогенеза, образованные из опухолей, стимулируют индуцирование ангиогенеза в опухолевую массу. Впоследствии кровеносные сосуды, образованные вокруг злокачественных опухолей, способствуют метастазированию опухолевых клеток в других местах. Поэтому ингибирование ангиогенеза приводит к предотвращению роста и метастаз раковых опухолей. В качестве одной из важных областей исследования для разработки противораковых лекарственных средств, основное внимание уделяют нахождению индукторов ангиогенеза и ингибиторов ангиогенеза и установлению механизмов их действия.
К настоящему времени установлено, что белки, такие как простамин и некротические факторы опухолей, полученные из тканей хрящей, и названные кортизонами ангиостатические стероиды и различные производные стероидов, способны играть роль в качестве ингибиторов ангиогенеза. В частности, гидрокортизон проявляет антиангиогенную активность при совместном лечении с гепарином (Lee, A. et al., Science, 1983, 221, 1185-1187; Crum, R. et al., Science, 1985, 230, 1375-1378). Однако применение этих соединений для эффективного лечений раковых заболеваний может создать проблему из-за их токсичности.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к производным бензопирана, замещенным вторичным амином, включающим в себя тетразол, их стереоизомерам или их фармацевтически приемлемым солям.
Настоящее изобретение относится далее к способу их получения.
Настоящее изобретение относится далее к фармацевтической композиции, содержащей производные бензопирана, замещенные вторичным амином, включающим в себя тетразол, их стереоизомеры или их фармацевтически приемлемые соли в качестве эффективного ингредиента.
Чтобы достичь вышеуказанную цель, настоящее изобретение предлагает производные бензопирана, замещенные вторичным амином, включающим в себя тетразол, и представленные нижеследующей формулой 1, их стереоизомеры или их фармацевтически приемлемые соли.

где R1 представляет собой Н, F, Cl, Br, CF3, NO2, CN, -ORa,
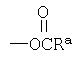
R2 представляет собой CH2ORa,


R3 представляет собой ОН, F, Cl, Br, ONO2 или

R4 и R5 представляют собой, независимо, Н, F, Cl, Br, неразветвленный или разветвленный С1-С3алкил, ORa, CF3, OCF3, NO2,

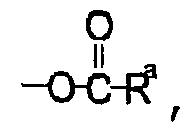
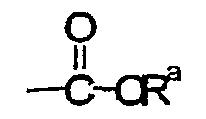
R6 представляет собой Н, неразветвленный или разветвленный С1-С3алкил,
n и m равны, независимо, целому числу 0-2;
* представляет собой хиральный атом углерода.
Предпочтительно, в соединении формулы 1 R1 представляет собой NO2, CN или NH2;
R2 представляет собой
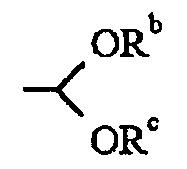

R3 представляет собой ОН или

R4 и R5 представляют собой, независимо, Н, F, Cl, неразветвленный или разветвленный С1-С3алкил, ORa, CF3, OCF3 или NO2, при условии, что Rа представляет собой неразветвленный или разветвленный С1-С3алкил;
R6 представляет собой неразветвленный или разветвленный С1-С3алкил;
n и m равны целому числу 0-1.
Настоящее изобретение включает в себя кроме производных бензопирана формулы 1 и их фармацевтически приемлемых солей все сольваты и гидраты, которые могут быть получены из производных бензопирана, замещенных вторичными аминами, включающими в себя тетразол.
Кроме того, настоящее изобретение включает в себя кроме рацемических смесей или диастереомерных смесей производных бензопирана формулы 1 все индивидуальные стереохимические изомеры, т.е. диастереомерно чистые или энантиомерно чистые соединения, которые имеют один или несколько хиральных центров в 2-, 3- и 4-положениях.
Предпочтительно, соединения формулы 1 содержат:
1) (2S,3S,4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
2) (2S,3R,4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
3) (2S,3S, 4R)-6-нитро-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
4) (2S,3R, 4S)-6-нитро-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
5) (2S,3S, 4R)-6-нитро-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
6) (2S,3R, 4S)-6-нитро-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
7) (2S,3S, 4R)-6-нитро-4-[N-бензил-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
8) (2S,3R, 4S)-6-нитро-4-[N-бензил-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
9) (2S,3S, 4R)-6-нитро-4-[N-(4-нитрофенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
10) (2S,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
11) (2S,3R, 4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
12) (2S,3S, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
13) (2S,3S, 4R)-6-нитро-4-[N-(1-метил-1Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
14) (2S,3S, 4R)-6-нитро-4-[N-(4-фторфенил)-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
15) (2S,3S, 4R)-6-нитро-4-[N-бензил-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
16) (2S,3R, 4S)-6-нитро-4-[N-бензил-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
17) (2S,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
18) (2S,3S, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
19) (2S,3S, 4R)-6-нитро-4-[N-(1Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
20) (2S,3S, 4R)-6-нитро-4-[N-бензил-N-(1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
21) (2S,3S, 4R)-6-нитро-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
22) (2S,3S, 4R)-6-амино-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
23) (2S,3S, 4R)-6-нитро-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
24) (2S,3S, 4R)-6-амино-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
25) (2S,3R, 4S)-6-нитро-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
26) (2S,3R, 4S)-6-амино-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
27) (2S,3R, 4S)-6-нитро-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
28) (2S,3R, 4S)-6-амино-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
29) (2S,3R, 4S)-6-нитро-4-[N-(2-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
30) (2S,3R, 4S)-6-амино-4-[N-(2-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
31) (2S,3R, 4S)-6-нитро-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
32) (2S,3R, 4S)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
33) (2S,3R, 4S)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
34) (2S,3R, 4S)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
35) (2S,3R, 4S)-6-нитро-4-[N-(3-ацетилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
36) (2S,3R, 4S)-6-амино-4-[N-[3-(1-гидроксиэтил)фенил]-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
37) (2S,3R, 4S)-6-нитро-4-[N-(2-метил-4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
38) (2S,3R, 4S)-6-амино-4-[N-(2-метил-4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
39) (2S,3R, 4S)-6-нитро-4-[N-(4-метоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
40) (2S,3R, 4S)-6-амино-4-[N-(4-метоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
41) (2S,3R, 4S)-6-нитро-4-[N-(2-метил-4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
42) (2S,3R, 4S)-6-амино-4-[N-(2-метил-4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
43) (2S,3R, 4S)-6-нитро-4-[N-(2-метокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
44) (2S,3R, 4S)-6-амино-4-[N-(2-метокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
45) (2S,3R,4S)-6-нитро-4-[N-(2, 4-диметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
46) (2S,3R,4S)-6-амино-4-[N-(2, 4-диметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
47) (2S,3R,4S)-6-нитро-4-[N-(2, 6-диметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
48) (2S,3R,4S)-6-амино-4-[N-(2, 6-диметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
49) (2S,3R,4S)-6-нитро-4-[N-(2, 3-диметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
50) (2S,3R,4S)-6-амино-4-[N-(2, 3-диметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
51) (2S,3R, 4S)-6-нитро-4-[N-(2-изопропилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
52) (2S,3R, 4S)-6-амино-4-[N-(2-изопропилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
53) (2S,3R, 4S)-6-нитро-4-[N-(4-этоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
54) (2S,3R, 4S)-6-амино-4-[N-(4-этоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
55) (2S,3R, 4S)-6-амино-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
56) (2S,3R, 4S)-6-амино-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
57) (2S,3R, 4S)-6-амино-4-[N-бензил-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
58) (2S,3R, 4S)-6-нитро-4-[N-[(3-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
59) (2S,3R, 4S)-6-амино-4-[N-[(3-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-метоксиметил-3,4-дигидро-2Н-1-бензопиран,
60) (2S,3R, 4S)-6-нитро-4-[N-(2-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
61) (2S,3R, 4S)-6-амино-4-[N-(2-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
62) (2S,3R, 4S)-6-нитро-4-[N-[(2-метокси-4-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
63) (2S,3R, 4S)-6-амино-4-[N-[(2-метокси-4-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
64) (2S,3R, 4S)-6-нитро-4-[N-[(2-метил-4-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
65) (2S,3R, 4S)-6-амино-4-[N-[(2-метил-4-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
66) (2S,3R, 4S)-6-нитро-4-[N-(2-этилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
67) (2S,3R, 4S)-6-амино-4-[N-(2-этилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
68) (2S,3R, 4S)-6-нитро-4-[N-(2-метил-5-(метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
69) (2S,3R, 4S)-6-амино-4-[N-(2-метил-5-(метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
70) (2S,3R, 4S)-6-нитро-4-[N-(2-гидрокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
71) (2S,3R, 4S)-6-амино-4-[N-(2-гидрокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
72) (2S,3R,4S)-6-нитро-4-[N-(2,4, 6-триметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
73) (2S,3R,4S)-6-амино-4-[N-(2,4, 6-триметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
74) (2S,3S, 4R)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
75) (2S,3S, 4R)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
76) (2R,3S, 4R)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
77) (2R,3S, 4R)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
78) (2R,3R, 4S)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
79) (2R,3R, 4S)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
80) (2S,3S, 4R)-6-нитро-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
81) (2S,3S, 4R)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
82) (2R,3R, 4S)-6-нитро-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
83) (2R,3R, 4S)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
84) (2R,3S, 4R)-6-нитро-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
85) (2R,3S, 4R)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
86) (2S,3S, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-ацетокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
87) (2S,3S, 4R)-6-ацетамино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-ацетокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
88) (2S,3S, 4R)-6-ацетамино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
89) (2S,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-ацетокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
90) (2S,3R, 4S)-6-бром-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
91) (2R,3R, 4S)-6-бром-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
92) (2S,3R, 4S)-6-бром-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
93) (2R,3R, 4S)-6-бром-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
94) (2R,3R, 4S)-6-бром-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
95) (2R,3R, 4S)-6-метансульфонилокси-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
96) (2S,3S, 4R)-6-метансульфонилокси-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
97) (2S,3S, 4R)-6-гидрокси-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
98) (2S,3S, 4R)-6-нитро-5-метил-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
99) (2S,3S, 4R)-6-нитро-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
100) (3R, 4S)-6-циано-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2,2-диметил-3,4-дигидро-2Н-1-бензопиран,
101) (3R, 4S)-6-циано-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2,2-диметил-3,4-дигидро-2Н-1-бензопиран,
102) (2S,3S, 4R)-6-гидрокси-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
103) (2S,3S, 4R)-8-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
104) (2S,3S, 4R)-8-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
105) (2R,3S, 4R)-8-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
106) (2R,3S, 4R)-8-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
107) (2R,3R, 4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
108) (2R,3R, 4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
109) (2R,3S, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
110) (2R,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
111) (2S,3R, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
112) (2S,3R, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
113) (2S,3S, 4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
114) (2S,3S, 4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
115) (2R,3R, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
116) (2R,3R, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
117) (2R,3S, 4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
118) (2R,3S, 4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран.
Более предпочтительно соединения формулы 1 содержат:
1) (2S,3S,4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
10) (2S,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
11) (2S,3R, 4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
17) (2S,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
22) (2S,3S, 4R)-6-амино-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
24) (2S,3S, 4R)-6-амино-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
26) (2S,3R, 4S)-6-амино-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
28) (2S,3R, 4S)-6-амино-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
30) (2S,3R, 4S)-6-амино-4-[N-(2-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
32) (2S,3R, 4S)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
34) (2S,3R, 4S)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
42) (2S,3R, 4S)-6-амино-4-[N-(2-метил-4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
52) (2S,3R, 4S)-6-амино-4-[N-(2-изопропилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
54) (2S,3R, 4S)-6-амино-4-[N-(4-этоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
55) (2S,3R, 4S)-6-амино-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
56) (2S,3R, 4S)-6-амино-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
57) (2S,3R, 4S)-6-амино-4-[N-бензил-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
59) (2S,3R, 4S)-6-амино-4-[N-[(3-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-метоксиметил-3,4-дигидро-2Н-1-бензопиран,
60) (2S,3R, 4S)-6-нитро-4-[N-(2-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
61) (2S,3R, 4S)-6-амино-4-[N-(2-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
70) (2S,3R, 4S)-6-нитро-4-[N-(2-гидрокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
75) (2S,3R, 4S)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
77) (2R,3S, 4R)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
79) (2R,3R, 4S)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
81) (2S,3S, 4R)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
83) (2R,3R, 4S)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
85) (2R,3S, 4R)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
89) (2S,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-ацетокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
107) (2R,3R, 4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
108) (2R,3R, 4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
109) (2R,3S, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
110) (2R,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
111) (2S,3R, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
112) (2S,3R, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
113) (2S,3S, 4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
114) (2S,3S, 4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
115) (2R,3R, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
116) (2R,3R, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
117) (2R,3S, 4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран,
118) (2R,3S, 4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран.
Что касается фармацевтически приемлемой соли, такая соль, предпочтительно, представляет собой кислотно-аддитивную соль, полученную с использованием фармацевтически приемлемой свободной кислоты. Свободная кислота может быть использована, если она является фармацевтически приемлемой, независимо от того, является ли она неорганической или органической. Примеры неорганической свободной кислоты включают хлористо-водородную кислоту, бромистоводородную кислоту, серную кислоту и фосфорную кислоту. Примерами пригодных органических свободных кислот являются лимонная кислота, уксусная кислота, молочная кислота, винная кислота, яблочная кислота, фумаровая кислота, муравьиная кислота, пропионовая кислота, щавелевая кислота, трифторуксусная кислота, бензойная кислота, глюконовая кислота, метансульфоновая кислота, гликолевая кислота, янтарная кислота, 4-толуолсульфоновая кислота, галактуроновая кислота, эмбоновая кислота, глутаминовая кислота и аспарагиновая кислота.
Соли с кислотами соединений по настоящему изобретению могут быть получены обычным способом, например растворением соединения формулы 1 в избытке водной кислоты и осаждением соли смешиваемым с водой органическим растворителем, таким как метанол, этанол, ацетон или ацетонитрил. Ее можно также получить нагреванием эквивалентных количеств соединения формулы 1 и кислоты в воде или спирте, таком как монометиловый эфир гликоля, и затем упариванием смеси досуха или вакуум-фильтрацией осажденной соли.
Кроме того, соединения формулы 1 могут быть в форме фармацевтически приемлемых солей щелочных металлов или щелочно-земельных металлов. Соли соединений формулы 1 щелочных металлов или щелочно-земельных металлов могут быть получены, например, растворением соединения формулы 1 в растворе избытка гидроксида щелочного металла или щелочноземельного металла, фильтрованием нерастворившихся веществ и упариванием фильтрата досуха.
Соли натрия, калия или кальция являются фармацевтически приемлемыми. Соответствующие соли серебра получают взаимодействием соли щелочного металла или щелочно-земельного металла с подходящей солью серебра, такой как нитрат серебра.
В соответствии с другим аспектом настоящего изобретения, предложен способ получения замещенного тетразолом производного бензопирана формулы 1, как показано на нижеследующей химической схеме 1.
Более конкретно, настоящее изобретение предлагает способ, содержащий стадию взаимодействия эпоксидного соединения формулы 2 со вторичными аминными соединениями, включающими в себя гетероцикл формулы 3, в присутствии соли металла с получением соединения формулы 1а, у которого R3 представляет собой ОН-группу. Кроме того, настоящее изобретение предлагает следующий способ, содержащий стадию взаимодействия соединения формулы 1а по химической схеме 2 с получением соединения формулы 1, причем данный способ применяют с различными заместителями у R3.


где R1, R2, R3, R4, R5, R6, n, m и * имеют значения, указанные выше.
В химической схеме 1 соль металла выбрана из группы, состоящей из Mg(ClO4)2, CoCl2, LiClO4, NaClO4, CaCl2, ZnCl2, LiBF4и Zn(Tf)2.
Растворитель выбран из группы, состоящей из ацетонитрила, тетрагидрофурана и диметилформамида, предпочтительным является ацетонитрил.
Условия реакции могут быть модифицированы в соответствии с разными значениями заместителей R1, R2, R3, R4, R5 и R6, способом получения и реагентом для реакции. Температура реакции может быть в диапазоне от комнатной температуры до температуры кипения используемого растворителя.
Кроме того, заместители R1, R2, R3, R4, R5 и R6 могут быть модифицированы по химической схеме 2, и стереохимия атома углерода в 3-положении может быть определена по реакции, представленной химической схемой 1.
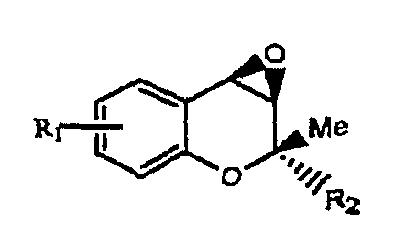
Эпоксидные соединения формулы 2 могут быть получены способом получения, описанным в патенте США №5236935 и патенте Республики Корея №094546, которые были получены авторами настоящего изобретения (химическая схема 3).

где R1 и R2 имеют значения, указанные выше, (OZ) представляет собой уходящую группу, Hal представляет собой атом галогена.
Кроме того, олефиновое соединение формулы 2 может быть получено способом, описанным в патенте Республики Корея № 0192083, согласно авторам настоящего изобретения, и стереоизомер может быть выделен обычной хиральной колоночной хроматографией или перекристаллизацией.
Эпоксидные соединения формул 2а-2d могут быть отделены от соответствующего стереоизомера, все из выделенных эпоксидных соединений или их смеси могут быть использованы в следующей стадии.
В случае использования рацемической смеси соединения формулы 2 в качестве синтетического промежуточного продукта соединения формулы 1 получают в виде рацемической или диастереомерной смеси, которая может быть разделена с выделением каждого стереоизомера.
Более конкретно, соединения формулы 1, которые имеют первоначальные свойства стереохимии исходных материалов, могут быть получены из каждого стереоизомера эпоксидного соединения, представленного от формулы 2а до формулы 2d.
ФОРМУЛА 2a

ФОРМУЛА 2b
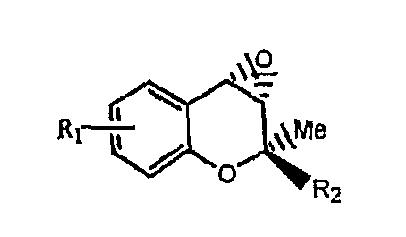
ФОРМУЛА 2c
ФОРМУЛА 2d

где R1 и R2 имеют значения, указанные выше.
Можно также получить стереоизомеры эпоксидных соединений формулы 2, соответственно, из олефиновых соединений с использованием (salen) Mn (III) в качестве катализатора эпоксидирования [E. N. Jacobsen et al., Tetrahedron Lett. 1991, 38, 5055].
Вторичные аминные соединения, включающие в себя тетразол, описанные в химической схеме 1 в качестве другого исходного соединения, могут быть получены способом химической схемы 4.
Химическая схема 4
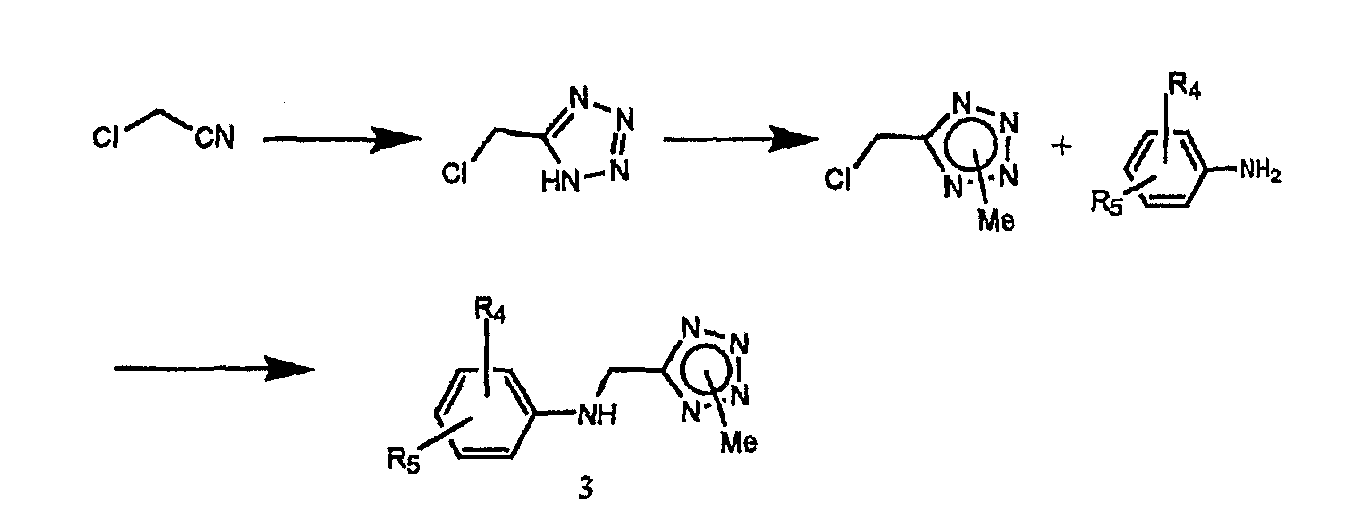
где n равно 0, m равно 1, R6 представляет собой метил, R4 и R5 имеют значения, указанные выше.
В стадии 1 соединение типа азида металла выбрано из группы, состоящей из азида натрия, азида аммония, азида триалкиламмония, триалкилсилилазида и азида триалкилолова, предпочтительно, азида натрия, азида аммония.
Растворитель для реакции выбран из группы, состоящей из тетрагидрофурана, диметилформамида, толуола и диметоксиэтана. Температура реакции может изменяться от комнатной температуры до температуры кипения используемого растворителя.
В стадии 3 основание выбрано из группы, состоящей из карбоната калия, карбоната натрия, гидрида натрия и метоксида натрия, и растворитель выбран из группы, состоящей из растворителя типа простого эфира, такого как тетрагидрофуран или диоксан; растворителя типа кетона, такого как ацетон, и диметилформамида. Температура реакции может варьироваться от комнатной температуры до точки кипения используемого растворителя.
Несколько способов получения соединений формулы 1 в зависимости от значения заместителей R1, R2, R3, R4, R5 и R6 описаны подробно ниже. Однако не следует считать, что описание способов, реагентов и условий реакции ограничивает настоящее изобретение.
(1) Введение ацетокси при R3
Как описано в химической схеме 5, соединение формулы 1b с введенной ацетоксигруппой по положению R3 может быть получено из соединения формулы 1а, полученного по химической схеме 1, в присутствии подходящего растворителя и основания.
ХИМИЧЕСКАЯ СХЕМА 5

где R1, R2, R4, R5, R6, n, m и * имеют значения, указанные выше.
В химической схеме 5 ацетильная группа может быть введена с использованием уксусного ангидрида (Ас2О) или ацетилхлорида (AcCl), и все органические и неорганические основания могут быть использованы в качестве оснований. Предпочтительное органическое основание выбрано из группы, состоящей из триэтиламина, пиридина и N,N-диизопропилэтиламина, и предпочтительное неорганическое основание выбрано из группы, состоящей из карбоната натрия, гидроксида натрия и карбоната кальция. В то же время предпочтительным количеством основания является 1-3 эквивалента относительно количества соединения формулы 1a.
Предпочтительным катализатором является 4-(диметиламино)пиридин и предпочтительным количеством катализатора является 0,05-0,5 эквивалента относительно количества соединения формулы 1а.
Растворитель выбран из группы, состоящей из метиленхлорида, хлороформа, тетрагидрофурана, ацетонитрила. В то же время температура реакции может изменяться от 0°С до 40°С.
(2) Введение NH2 в качестве R1
Соединение (1d) формулы 1, у которого R1 представляет собой NH2, может быть получено восстановлением соединения (1с), у которого R1 представляет собой NO2, как показано на приведенной ниже схеме 6.
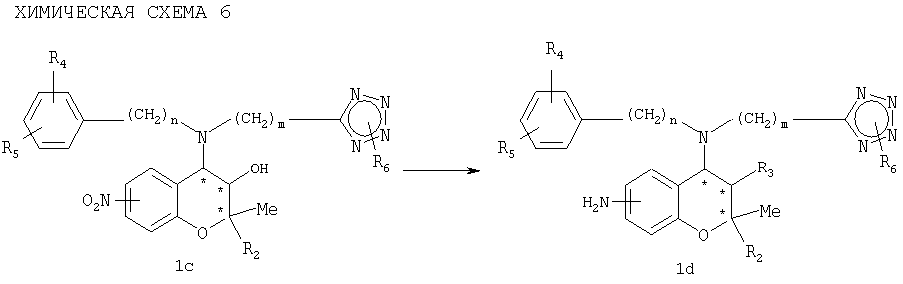
где R2, R3, R4, R5, R6, n, m и * имеют значения, указанные выше.
Группа NO2 может быть восстановлена в группу NH2гидрированием с использованием металлических катализаторов, таких как платина, палладий на угле (Pd/C), никель Ренея и т.д., в подходящем растворителе. Реакцию восстановления проводят с использованием общепринятых восстановителей. Растворителями являются спирты, такие как метанол, этанол и т.д., и этилацетат.
Кроме того, восстановление группы NO2 в группу NH2 может быть проведено с использованием восстанавливающего агента, такого как NaBH4, в присутствии CuSO4, Cu(OAc)2, CoCl2, SnCl2 или NiCl2. В то же время растворителем является смесь воды и метанола, и предпочтительной температурой реакции является комнатная температура.
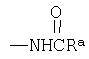
(3) Введение

Соединение формулы 1е, у которого R1 представляет собой NHC(O)Ra, может быть получено взаимодействием соединения формулы 1d, полученного по химической схеме 6, с ацилхлоридом или ангидридом кислоты в присутствии растворителя и основания.
Основание выбрано из группы, состоящей из триэтиламина, N,N-диизопропилэтиламина, пиридина и 4-(диметиламино)пиридинам.
Растворитель выбран из группы, состоящей из метиленхлорида, хлороформа, диметилсульфоксида, диметилформамида, тетрагидрофурана и диоксана.
(4) Введение -NHS(O)l Ra в качестве R1
Соединение формулы 1f, у которого R1 представляет собой -NHS(O)mRa, может быть получено взаимодействием соединения формулы 1d, полученного по химической схеме 6, с алкилсульфонилхлоридом или арилсульфонилхлоридом в присутствии растворителя и основания.
В то же время основание выбрано из группы, состоящей из триэтиламина, N,N-диизопропилэтиламина, пиридина и 4-(диметиламино)пиридина. Растворитель выбран из группы, состоящей из метиленхлорида, хлороформа, диметилсульфоксида, диметилформамида, тетрагидрофурана и диоксана.
В соответствии со следующим аспектом настоящего изобретения, предложена фармацевтическая композиция, содержащая производные бензопирана, замещенные вторичными аминами, включающими в себя тетразол, формулы 1, их стереоизомеры или их фармацевтически приемлемые соли в качестве эффективного ингредиента.
Более конкретно, настоящее изобретение предлагает фармацевтическую композицию, содержащую производные бензопирана, замещенные вторичными аминами, включающими в себя тетразол, их стереоизомеры или их фармацевтически приемлемые соли, для защиты от повреждения нервных клеток, головного мозга, сердца, ретинальных ганглиозных клеток и органов во время их хранения или во время хирургической операции на сердечно-сосудистой системе, для антиокислительного действия, ингибирования генерации NO или подавления ангиогенеза.
Настоящее изобретение предлагает фармацевтические композиции, содержащие производные бензопирана, замещенные вторичными аминами, включающими в себя тетразол, их стереоизомеры или их фармацевтически приемлемые соли, для защиты нервных клеток.
Соединения (фармацевтические композиции) настоящего изобретения обнаруживают нейрозащитное действие, направленное на защиту от индуцированной окислительным стрессом гибели клеток под воздействием железа или пероксида водорода.
Кроме того, соединения настоящего изобретения защищают от ишемического-гипоксического и гипоксического повреждения головной мозг у новорожденных крыс, которых чаще всего используют для изучения асфиксии младенцев, поскольку зрелость головного мозга их является сходной со зрелостью младенцев человека и легко получить достаточное число животных, требуемых для определения действий соединений по снижению отношения липид/NAA (N-ацетиласпартат) и липид/Cr (креатин) в протонной МРС (спектроскопии магнитного резонанса), причем такие отношения являются важным индексом для апоптоза, а также улучшения показателей морфологических оценок и смертности. Кроме того, соединения настоящего изобретения защищают аксотомизированные ретинальные ганглиозные клетки и оказывают нейрозащитные действия за счет улучшения состояния таких поврежденных клеток.
Кроме того, соединения настоящего изобретения оказывают нейрозащитные действия за счет повышения скорости проводимости поврежденного нерва на модели животного с диабетической невропатией. Таким образом, соединения настоящего изобретения могут быть использованы в качестве нейрозащитных средств и могут также быть использованы для профилактики и лечения асфиксии младенцев, глаукомы, диабетической невропатии и травмы головы, вызванной повреждением или гибелью нервных клеток.
Кроме того, соединения настоящего изобретения ингибируют перокисление липидов, индуцированное железом или медью, и подавляют действие внутриклеточных реакционноспособных кислородных разновидностей в А7r5 (клеточной линии гладких мышц грудной аорты, АТСС), индуцированных Н2О2. Поэтому соединения настоящего изобретения могут быть использованы в качестве антиокислителя и могут быть эффективно использованы для лекарственного лечения нейродегенеративных нарушений, вызванных перокислением липидов и аккумулированием разновидностей свободных радикалов в нейронах, таких как старение и сенильная деменция.
Кроме того, соединения настоящего изобретения ингибируют образование NO (оксид азота), индуцированное эндотоксинами, такими как липополисахариды (LPS), доза-зависимым образом. Поэтому соединения настоящего изобретения могут быть использованы в качестве ингибиторов образования NO и могут быть эффективно использованы для лечения воспалительных заболеваний, таких как артрит, инфаркт сердечной мышцы, артериослероз и деменция, которые вызываются повреждением ткани или органов в результате апоптозной или некротической гибели клеток вследствие аккумуляции NO в клетках.
Кроме того, соединения настоящего изобретения эффективно защищают головной мозг от повреждения при ишемии-реперфузии. Ишемические заболевания имеют место в результате комплексного взаимодействия между различными типами нейротрансмиттеров, ионных каналов, ферментов и т.д. Затем предполагается, что соединения настоящего изобретения, которые обладают различными фармакологическими действиями, такими как регуляция ионных каналов, защита от нейротоксичности, являющейся результатом действия железа, пероксида водорода и т.д., ингибирование перокисления липидов и защита головного мозга от повреждения и т.д., предотвращают или лечат удар, вызванный ишемией головного мозга.
На модели изъятого ишемизированного сердца крысы с использованием аппарата Ландендорфа соединения настоящего изобретения значительно пролонгируют время до контрактуры (ТТС, время до контрактуры), усиливают восстановление послеишемической сократительной функции [LVDP х HR (левое вентрикулярное развиваемое давление) х (частота сердечных сокращений)] и снижают высвобождение лактатдегидрогеназы (LDH), которая является маркером-ферментом для повреждения клеток, затем проявляют кардиозащитное действие, сходное с кардиозащитным действием BMS-180448. Кроме того, соединения настоящего изобретения проявляли антиишемическую активность, сходную с антиишемической активностью BMS-180448, на моделях ишемического повреждения миокарда анестезированных крыс. Кроме того, в противоположность BMS-180448, соединения настоящего изобретения обладают заметно низкой сосудорасширяющей активностью и, таким образом, они превосходят общепринятые лекарственные средства в качестве сердечных селективных кардиозащитных средств.
Как описано выше, соединения настоящего изобретения обладают превосходной антиишемической активностью как in vivo, так и in vitro, в то же время обнаруживают низкую сосудорасширяющую активность, так что они могут быть использованы в качестве кардиозащитных средств для профилактики и лечения инфаркта миокарда, застойной сердечной недостаточности и стенокардии.
Кроме того, соединения настоящего изобретения подавляют ангиогенез доза-зависимым образом в васкулярных эндотелиальных клетках, так что они могут быть использованы для подавления ангиогенеза и профилактики и лечения ревматического артрита, псориаза, осложнения при СПИДЕ, рака или диабетической ретинопатии, вызванной ангиогенезом.
Настоящее изобретение включает в себя фармацевтические композиции, которые содержат, кроме нетоксичных, инертных фармацевтически приемлемых добавок, один или больше, чем один, активный ингредиент по настоящему изобретению, а также способ получения этих препаратов.
Нетоксичные инертные фармацевтически приемлемые, подходящие носители включают твердые, полутвердые или жидкие разбавители, наполнители и добавки препаратов всех типов.
Предпочтительными фармацевтическими препаратами являются таблетки, таблетки с покрытиями, капсулы, пилюли, гранулы, суппозитории, растворы, суспензии и эмульсии, пасты, мази, гели, кремы, лосьоны, присыпки и спреи.
Таблетки, таблетки с покрытием, капсулы, пилюли и гранулы могут содержать более чем одну добавку, кроме активного ингредиента или ингредиентов, такую как (а) наполнители и разбавители, например крахмалы, лактозу, сахарозу, глюкозу, маннит и кремниевую кислоту, (b) связующие вещества, например карбоксиметилцеллюлозу, альгинаты, желатин и поливинилпирролидон, (с) увлажнители, например глицерин, (d) дезинтегрирующие агенты, например агар-агар, карбонат кальция и карбонат натрия, (е) замедлители растворения, например парафин, и (f) замедлители абсорбции, например четвертичные аммониевые соединения, (g) смачивающие агенты, например цетиловый спирт и моностеарат глицерина, (h) адсорбенты, например каолин и бентонит, и (i) смазывающие вещества, например тальк, стеарат кальция, стеарат магния и твердые полиэтиленгликоли, или смеси веществ, перечисленных по пунктам от (а) до (i).
Таблетки, таблетки с покрытием, капсулы, пилюли и гранулы могут быть представлены с обычными покрытиями и оболочками, необязательно содержащими агенты, придающие препарату непрозрачность, и могут быть такой композицией, которая высвобождает активный ингредиент или ингредиенты только или преимущественно в определенной части кишечника, при необходимости, замедленным образом, причем примерами композиций, которые могут быть использованы, являются полимерные вещества и воски.
При необходимости активный ингредиент или ингредиенты могут также присутствовать в микрокапсулированной форме с одним или несколькими указанными выше эксципиентами.
Суппозитории могут содержать, помимо активного ингредиента или ингредиентов, обычные водорастворимые или водонерастворимые эксципиенты, например полиэтиленгликоли, жиры, например какао-масло, и высшие сложные эфиры (например, эфиры С14-спирта и С18-жирной кислоты) или смеси этих веществ.
Мази, пасты, кремы и гели могут содержать, помимо активного ингредиента или ингредиентов, обычные эксципиенты, например животные и растительные жиры, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка или смеси этих веществ.
Присыпки и дусты могут содержать, помимо активного ингредиента или ингредиентов, обычные эксципиенты, например лактозу, тальк, кремниевую кислоту, гидроксид алюминия, силикат кальция и полиамидный порошок или смеси этих веществ. Спреи могут дополнительно содержать обычные пропелленты, например хлорфторуглеводороды.
Растворы и эмульсии могут содержать, помимо активного ингредиента или ингредиентов, обычные эксципиенты, такие как растворители, солюбилизирующие агенты и эмульгаторы, например, воду этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла, в частности хлопковое масло, арахисовое масло, масло зародышей кукурузы, оливковое масло, касторовое масло и кунжутное масло, глицерин, формаль глицерина, тетрагидрофурфуриловый спирт, полиэтиленгликоли и эфиры жирных кислот и сорбитана или смеси этих веществ.
Для парентерального введения растворы и эмульсии могут также быть в стерильной форме, которая является изотоничной с кровью.
Суспензии могут содержать, помимо активного ингредиента или ингредиентов, обычные эксципиенты, такие как жидкие разбавители, например воду, этиловый спирт и пропиленгликоль, и суспендирующие агенты, например этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант, или смеси этих веществ.
Указанные формы препаратов могут содержать также красящие агенты, консерванты и добавки, которые улучшают запах и вкус, например мятное масло и эвкалиптовое масло, и подслащивающие агенты, например сахарин.
Терапевтически активные ингредиенты должны, предпочтительно, присутствовать в указанных выше фармацевтических препаратах в концентрации приблизительно 0,1-99,5, предпочтительно, приблизительно 0,5-95 мас.% общей смеси.
Указанные выше фармацевтические препараты могут содержать помимо соединений по настоящему изобретении также другие фармацевтически активные соединения.
Указанные выше фармацевтические препараты получают обычным образом известными способами, например смешиванием активного ингредиента или ингредиентов с наполнителями.
Указанные выше препараты могут быть использованы для введения людям и животным либо пероральным, ректальным, парентеральным (внутривенным, внутримышечным или подкожным), внутриполостным, интравагинальным, внутрибрюшинным либо местным путем (присыпка, мазь, капли) и для терапии инфекционных заболеваний в полых местах и полостях тела. Возможными подходящими препаратами являются растворы для инъекций, растворы и суспензии для пероральной терапии и гели, препараты для инфузии, эмульсии, мази или капли, для местной терапии могут быть использованы эмульсии, мази или капли, офтальмологические и дерматологические препараты, соли серебра и другие соли, глазные капли, глазные мази, присыпки или растворы. В случае животных введение может быть осуществлено также в подходящих препаратах посредством кормов и питьевой воды.
Для людей и животных, кроме того, могут быть использованы гели, порошки, присыпки, таблетки, таблетки пролонгированного действия, премиксы, концентраты, гранулы, пилюли, капсулы, аэрозоли, спреи и лекарственные формы для ингаляции. Соединения по настоящему изобретению, кроме того, могут быть включены в другие материалы-носители, такие, как например, пластыри (ряд пластырей для местной терапии), коллаген или костный цемент.
В общем, доказано, что подходящим для терапии людей является введение активного ингредиента или ингредиентов по настоящему изобретению в общих количествах приблизительно от 0,1 до приблизительно 20 мг/кг, предпочтительно, 0,5-10 мг/кг массы тела каждые 8 часов, при необходимости, в форме нескольких индивидуальных доз, до достижения требуемых результатов. Однако может быть необходимо отклонение от указанных доз и, в частности, может быть необходимо сделать их функцией природы и массы тела подвергаемого лечению субъекта, природы и тяжести заболевания, природы препарата и пути введения лекарственного средства и периода или интервала, с которым проводят введение.
В результате испытания на острую пероральную токсичность на крысах показано, что производные бензопирана, замещенные вторичными аминами, включающими в себя тетразол, их стереоизомеры или их фармацевтически приемлемые соли не обнаруживают токсичность для крыс при дозе до 2000 мг/кг. Таким образом, соединения настоящего изобретения могут быть безопасно введены in vivo.
Настоящее изобретение будет объяснено более подробно со ссылкой на нижеследующие примеры. Однако нижеследующие примеры представлены только для иллюстрации настоящего изобретения, и настоящее изобретение не ограничивается ими. Структуры соединений по настоящему изобретению определяют инфракрасной спектроскопией, спектроскопией ядерного магнитного резонанса, масс-спектроскопией, жидкостной хроматографией, рентгеновской кристаллографией, рентгеноструктурным методом вращающегося кристалла, сравнением аналитических вычисленных данных с найденными величинами соединения.
<ПРИМЕР 1> Получение (2S,3S, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Стадия 1: Получение (2S,3S, 4R)-6-нитро-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана
0,05 М водный раствор Na2HPO4 (16,6 мл) добавляют к 0,55 М водному раствору NaOCl (41,5 мл, 22,8 ммоль) при 0°С. К водному раствору медленно добавляют раствор (2S)-6-нитро-2-метил-2-диметоксиметил-2Н-1-бензопиран (1,5 г, 5,7 ммоль) и катализатор, (S,S)-Mn (III) (salen) (155 мг, 0,28 ммоль) для энантиоселективного эпоксидирования, разработанного Jacobsen, в дихлорметане (8,5 мл). Раствор перемешивают при комнатной температуре в течение 12 часов. После завершения реакции реакционную смесь фильтруют для удаления катализатора и фильтрат экстрагируют дихлорметаном (200 мл). Слой дихлорметана промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют для удаления дихлорметана. Неочищенный продукт очищают хроматографией (проявляющий раствор - н-гексан:этилацетат, 4:1), получая при этом (2S,3S,4R)-6-нитро-2-метил-2-диметоксиметил-3, 4-эпокси-3,4-дигидро-2Н-1-бензопиран, соединение формулы 2 (1,4 г, выход: 88%).
1Н ЯМР (CDCl3, 200 МГц): δ 1,53 (с, 3Н), 3,25 (с, 3Н), 3,49 (с, 3Н), 3,79 (д, 1Н), 3,96 (д, 1Н), 4,19 (с, 1Н), 6,82 (д, 1Н), 8,09 (дд, 1Н), 8,24 (д, 1Н).
Стадия 2: Получение N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина
а. Получение 5-хлорметил-1Н-тетразола
Азид натрия (1,72 г, 26,4 ммоль) добавляют в ТГФ (30 мл), к смеси добавляют хлорид алюминия (0,88 г, 6,6 ммоль) и хлорацетонитрил (0,42 мл, 6,6 ммоль) при 0°С. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 48 часов. После завершения реакции реакционную смесь подкисляют до рН 3 н раствором HCl при 0°С и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния. Растворитель удаляют и образовавшееся белое твердое вещество промывают смесью этилацетата и н-гексана (1:4), получая при этом 5-хлорметил-1Н-тетразол (1,7 г, выход: 89%).
1Н ЯМР (CDCl3, 200 МГц): δ 4,86 (с, 2Н), 5,10 (ушир. с, 1Н).
b. Получение 5-хлорметил-1-метил-1Н-тетразола и 5-хлорметил-2-метил-2Н-тетразола
5-Хлорметил-1Н-тетразол (300 мг, 2,53 ммоль), полученный выше, растворяют в ДМФ (10 мл), к раствору добавляют К2СО3 (455 мг, 3,29 ммоль). После этого к смеси медленно по каплям в течение 4 часов при комнатной температуре добавляют MeI (0,16 мл, 2,53 ммоль), реакционную смесь перемешивают при комнатной температуре. После завершения указанной реакции к реакционной смеси добавляют воду (30 мл). Реакционную смесь экстрагируют эфиром (50 мл), после этого органический слой промывают насыщенным раствором соли, сушат над безводным MgSO4 и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 4:1), получая при этом 5-хлорметил-1-метил-1Н-тетразол (88,1 мг, 26%) и 5-хлорметил-2-метил-2Н-тетразол (184,2 мг, выход: 55%).
5-Хлорметил-2-метил-2Н-тетразол:1Н ЯМР (CDCl3, 200 МГц): δ 4,37 (с, 3Н), 4,51 (с, 2Н),
5-хлорметил-1-метил-1Н-тетразол:1Н ЯМР (CDCl3 , 200 МГц): δ 4,05 (с, 3Н), 4,52 (с, 2Н).
с. Получение N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина
п-Хлоранилин (14 г, 13,2 ммоль) растворяют в ДМФА (120 мл), в раствор добавляют К2СО3 (9,49 г, 68,6 ммоль) и 5-хлорметил-2-метил-2Н-тетразол (7 г, 34,4 ммоль), полученный в указанной выше стадии 2, к смеси добавляют NaI (4,9 г, 34,3 ммоль). Реакционную смесь перемешивают в течение 4 часов при 80°С. После завершения реакции к смеси добавляют воду (60 мл). Реакционную смесь экстрагируют эфиром (20 мл) и органический слой промывают насыщенным раствором соли, сушат над безводным MgSO4 и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 4:1), получая при этом N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амин, соединение формулы 3 (3,9 г, выход: 61%).
1Н ЯМР (CDCl3, 200 МГц): δ 4,30 (с, 3Н), 4,47 (ушир. с, 1Н), 4,56 (с, 2Н), 6,64 (д, 2Н), 7,11 (д, 2Н).
Стадия 3: Получение (2S,3S, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Соединение, полученное в стадии 1 (450 мг, 1, 6 ммоль), растворяют в ацетонитриле (0,5 мл). К раствору добавляют вторичное аминное соединение, содержащее тетразол и полученное в указанной выше стадии 2 (363 мг, 1,6 ммоль), и перхлорат магния ((MgClO4)2) (357 мг, 1,6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 10 часов, к ней добавляют водный раствор NaHCO3 (20 мл). Реакционную смесь экстрагируют этилацетатом (30 мл). Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (435 мг, выход: 54%).
1H ЯМР (CDCl3 , 200 МГц): δ 1,62 (с, 3H), 3,49 (с, 3H), 3,59 (с, 3H), 3,95 (дд, 1H), 4,32 (д, 1H), 4,48 (с, 3H), 4,72 (с, 1H), 4,83 (д, 1Н), 5,60 (д, 1H), 6,82 (д, 2H), 6,95 (д, 1H), 7,16 (д, 2H), 7,99 (д, 1H), 8,06 (дд, 1H).
<ПРИМЕР 2> Получение (2S,3R,4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Стадия 1: получение (2S,3R,4R)-6-нитро-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 1 примера 1, за исключением использования (2S)-6-нитро-2-метил-2-диметоксиметил-2Н-1-бензопирана (2,5 г, 9,4 ммоль) и (R,R)-Mn (III) (salen). Сырой продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 4:1), получая при этом требуемое соединение (2,1 г, выход: 80%).
1Н ЯМР (CDCl3, 200 МГц): δ 1,28 (с, 3Н), 3,60 (с, 3Н), 3,68 (с, 3Н), 3,80 (д, 1Н), 3,97 (д, 1Н), 4,47 (с, 1Н), 6,95 (д, 1Н), 8,16 (дд, 1Н), 8,31 (д, 1Н).
Стадия 2: получение (2S,3R,4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (250 мг, 0,9 ммоль), полученного в приведенной выше стадии 1. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (359 мг, выход: 87%).
1H ЯМР (CDCl3 , 200 МГц): δ 1,48 (с, 3H), 3,58 (с, 3H), 3,64 (с, 3H), 4,29 (с, 3H), 4,42 (дд, 1H), 4,52 (д, 1H), 4,61 (с, 1H), 4,82 (д, 1H), 5,13 (д, 1Н), 5,18 (д, 1H), 6,84 (д, 2H), 7,05 (д, 1H), 7,15 (д, 2H), 8,08 (дд, 1H), 8,10 (д, 1H).
<ПРИМЕР 3> Получение (2S,3S,4R)-6-нитро-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (450 мг, 1,6 ммоль), полученного в приведенной выше стадии 1 примера 1, и N-(2-метил-2Н-тетразол-5-илметил)фениламина (302 мг, 1,6 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (484 мг, выход: 64%).
1H ЯМР (CDCl3, 200 МГц): δ 1,49 (с, 3H), 3,57 (с, 3H), 3,64 (с, 3H), 4,31 (с, 3H), 4,32 (дд, 1H), 4,39 (д, 1H), 4,82 (д, 1H), 5,21 (д, 1H), 4,63 (с, 1H), 5,27 (д, 1H), 6,79-6,92 (м, 3H), 7,05 (д, 1H), 7,16-7,25 (м, 2H), 8,07 (дд, 1H), 8,09 (с, 1H).
<ПРИМЕР 4> Получение (2S,3R,4S)-6-нитро-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (225 мг, 0,8 ммоль), полученного в приведенной выше стадии 1 примера 2, и N-(2-метил-2Н-тетразол-5-илметил)фениламина (151 мг, 0,8 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (134 мг, выход: 56%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 3,51 (с, 3H), 3,55 (с, 3H), 3,91 (дд, 1H), 4,29 (д, 1H), 4,33 (с, 3H), 4,75 (с, 1H), 4,88 (д, 1H), 5,45 (д, 1H), 5,69 (д, 1H), 6,80-6,97 (м, 4Н), 7,20 (д, 2H), 8,01 (д, 1H), 8,07 (дд, 1H).
<ПРИМЕР 5> Получение (2S,3S, 4R)-6-нитро-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (450 мг, 1,6 ммоль), полученного в стадии 1 примера 1, и N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)фениламина (332 мг, 1,6 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (661 мг, выход: 86%).
1H ЯМР (CDCl3, 200 МГц): δ 1,62 (с, 3Н), 3,48 (с, 3Н), 3,53 (с, 3Н), 3,91 (дд, 1H), 4,33 (с, 3H), 4,35 (д, 1Н), 4,71 (с, 1H), 4,82 (д, 1H), 5,38 (д, 1H), 5,50 (д, 1H), 6,85-6,96 (м, 5H), 8,03 (с, 1H), 8,05 (дд, 1H).
<ПРИМЕР 6> Получение (2S,3R, 4S)-6-нитро-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (450 мг, 1,6 ммоль), полученного в стадии 1 примера 2, и N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (332 мг, 1,6 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (528 мг, выход: 69%).
1H ЯМР (CDCl3, 200 МГц): δ 1,46 (с, 3H), 3,57 (с, 3H), 3,63 (с, 3H), 4,31 (с, 3H), 4,32 (д, 1H), 4,39 (дд, 1H), 4,60 (с, 1H), 4,80 (д, 1H), 5,10 (д, 1H), 5,19 (д, 1H), 6,87 (д, 2H), 6,90 (д, 2H), 7,03 (д, 1H), 8,08 (дд, 1H), 8,14 (д, 1H).
<ПРИМЕР 7> Получение (2S,3S, 4R)-6-нитро-4-[N-бензил-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,07 ммоль), полученного в стадии 1 примера 1, и N-бензил-N-(2-метил-2Н-тетразол-5-илметил)амина (217 мг, 1,07 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (282 мг, выход: 55%).
1H ЯМР (CDCl3, 200 МГц): δ 1,24 (с, 3H), 3,61 (с, 3H), 3,63 (с, 3H), 3,94-4,30 (м, 5H), 4,30 (с, 3H), 4,32 (д, 1H), 4,45 (с, 1H), 4,50 (д, 1H), 6,84 (д, 1H), 7,20-7,33 (м, 3H), 7,43 (д, 2H), 7,99 (дд, 1H), 8,74 (д, 1H).
<ПРИМЕР 8> Получение (2S,3R, 4S)-6-нитро-4-[N-бензил-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (200 мг, 0,71 ммоль), полученного в стадии 1 примера 2, и N-бензил-N-(2-метил-2Н-тетразол-5-илметил)фениламина (145 мг, 0,71 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (165 мг, выход: 48%).
1H ЯМР (CDCl3, 200 МГц): δ 1,58 (с, 3H), 3,30 (с, 3H), 3,34 (с, 3H), 3,89-4,12 (м, 6H), 4,27-4,33 (м, 5H), 6,83 (д, 1Н), 7,23-7,38 (м, 3H), 7,45 (д, 2H), 8,01 (дд, 1H), 8,73 (д, 1H).
<ПРИМЕР 9> Получение (2S,3S,4R)-6-нитро-4-[N-(4-нитрофенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (200 мг, 0,71 ммоль), полученного в стадии 1 примера 1, и N-(4-нитрофенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (167 мг, 0,71 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (162 мг, выход: 45%).
1H ЯМР (CDCl3, 200 МГц): δ 1,59 (с, 3H), 3,65-3,49 (м, 7H), 4,32-4, 40 (м, 4H), 4,62 (с, 1H), 4,86 (д, 1H), 5,14 (д, 1H), 5,45 (д, 1H), 6,98 (д, 2H), 7,07 (д, 1H), 7,99-8,15 (м, 4H).
<ПРИМЕР 10> Получение (2S,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
(2S,3S, 4R)-6-Нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран, полученный в примере 1 (100 мг, 0,2 ммоль), растворяют в метаноле (2 мл), к раствору добавляют водный раствор Cu(OAc)2 (0,38 мл, 0,4 М водный раствор, 0,15 ммоль). К раствору в течение 30 мин при комнатной температуре медленно добавляют борогидрид натрия (NaBH4) (113 мг, 3,0 ммоль), реакционную смесь перемешивают в течение 1 часа, после чего к реакционной смеси добавляют этилацетат (5 мл). Образовавшуюся смесь фильтруют для удаления осажденного черного твердого вещества. К фильтрату добавляют насыщенный водный раствор NaHCO3 (5 мл) и экстрагируют этилацетатом (30 мл). Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель - н-гексан:этилацетат, 1:3), получая при этом требуемое соединение, у которого R1 представляет собой аминогруппу (62 мг, выход: 67%).
1H ЯМР (CDCl3, 200 МГц): δ 1,34 (с, 3H), 3,51 (с, 3H), 3, 61 (с, 3H), 4,02 (с, 3H), 4,10 (дд, 1Н), 4,33 (д, 1H), 4,47 (с, 1H), 4,68 (д, 1H), 4,80-4,97 (м, 2H), 6,35 (д, 1H), 6,54 (дд, 1H), 6,74 (д, 1H), 6,81 (д, 2H), 7,14 (д, 2H).
< ПРИМЕР 11> Получение (2S,3R,4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (150 мг, 0,3 ммоль), полученного в примере 2. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:3), получая при этом требуемое соединение (74 мг, выход: 52%).
1H ЯМР (CDCl3, 200 МГц): δ 1,54 (с, 3H), 3,49 (с, 3H), 3,52 (с, 3H), 3,95 (дд, 1H), 4,30 (д, 1H), 4,32 (с, 3H), 4,41-4,70 (м, 3H), 5,33 (д, 1H), 6,45 (с, 1H), 6,55 (дд, 1H), 6,68 (д, 1H), 6,82 (д, 2H), 7,13 (д, 2H).
<ПРИМЕР 12> Получение (2S,3S,4R)-6-нитро-4-[N-(4-хлорфенил)-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Стадия 1: получение N-(4-хлорфенил)-N-(1-метил-1Н-тетразол-5-илметил)амина
Выполняют такую же методику, как в стадии 2 примера 1, за исключением использования п-хлоранилина (5,8 г, 45,3 ммоль) и 5-хлорметил-1-метил-1Н-тетразола (6 г, 45,3 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (3,68 г, выход: 36%).
Стадия 2: получение (2S,3S, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (150 мг, 0,53 ммоль), полученного в стадии 1 примера 1, и N-(4-хлорфенил)-N-(1-метил-1Н-тетразол-5-илметил)амина (121 мг, 0,53 ммоль), полученного в указанной выше стадии 1. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (194 мг, выход: 72%).
1H ЯМР (CDCl3, 200 МГц): δ 1,44 (с, 3H), 3,52 (с, 3H), 3,63 (с, 3H), 4,08 (с, 3H), 4,20 (дд, 1H), 4,35 (д, 1H), 4,58 (с, 1H), 4,84 (д, 1H), 5,08 (д, 1H), 5,58 (д, 1H), 6,81 (д, 2H), 7,17 (д, 2H), 7,03 (д, 1H), 8,02 (д, 1H), 8,04 (дд, 1H).
<ПРИМЕР 13> Получение (2S,3S, 4R)-6-нитро-4-[N-(1-метил-1Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (150 мг, 0,53 ммоль), полученного в стадии 1 примера 1, и N-(1-метил-1Н-тетразол-5-илметил)амина (101 мг, 0,53 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (203 мг, выход: 81%).
1H ЯМР (CDCl3, 200 МГц): δ 1,47 (с, 3H), 3,54 (с, 3H), 3,64 (с, 3H), 4,08 (с, 3H), 4,18 (дд, 1H), 4,37 (д, 1H), 4,61 (с, 1H), 4,84 (д, 1Н), 5,18 (д, 1H), 5,66 (д, 1H), 6,86-7,08 (м, 4H), 7, 24 (д, 2H), 8,05 (с, 1H), 8,10 (дд, 1H).
<ПРИМЕР 14> Получение (2S,3S, 4R)-6-нитро-4-[N-(4-фторфенил)-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (150 мг, 0,53 ммоль), полученного в стадии 1 примера 1, и N-(4-фторфенил)-N-(1-метил-1Н-тетразол-5-илметил)амина (111 мг, 0,53 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (198 мг, выход: 76%).
1H ЯМР (CDCl3, 200 МГц): δ 1,43 (с, 3H), 3,56 (с, 3H), 3,64 (с, 3H), 4,08 (с, 3H), 4,19 (дд, 1H), 4,37 (д, 1H), 4,57 (с, 1H), 4,84 (д, 1H), 4,99 (д, 1H), 5,47 (д, 1H), 7,03 (д, 1H), 7,94 (дд, 4H), 8,06 (дд, 1H), 8,09 (с, 1H).
<ПРИМЕР 15> Получение (2S,3S, 4R)-6-нитро-4-[N-бензил-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (200 мг, 0,71 ммоль), полученного в стадии 1 примера 1, и N-бензил-N-(1-метил-1Н-тетразол-5-илметил)амина (145 мг, 0,71 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (192 мг, выход: 56%).
1H ЯМР (CDCl3, 200 МГц): δ 1,30 (с, 3H), 3,63 (с, 3H), 3,65 (с, 3H), 3,67 (с, 3H), 3,80-4,10 (м, 4H), 4,37-4,62 (м, 4H), 6,89 (д, 1H), 7,26-7,35 (м, 5H), 8,00 (дд, 1H), 8,57 (д, 1H).
<ПРИМЕР 16> Получение (2S,3R,4S)-6-нитро-4-[N-бензил-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (200 мг, 0,71 ммоль), полученного в стадии 1 примера 2, и N-бензил-N-(2-метил-2Н-тетразол-5-илметил)амина (145 мг, 0,71 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (70 мг, выход: 20%).
1H ЯМР (CDCl3, 200 МГц): δ 1,60 (с, 3H), 3,39 (с, 3H), 3,41 (с, 3H), 3,56 (дд, 1H), 3,74-3,97 (м, 4H), 4,02-4,33 (м, 6H), 6,84 (д, 1H), 7,24-7,38 (м, 5H), 8,03 (дд, 1H), 8,52 (д, 1H).
<ПРИМЕР 17> Получение (2S,3S, 4R)-6-амино-4-[N-(4-хлорфенил)-N-(1-метил-1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования эпоксидного соединения (100 мг, 0,2 ммоль), полученного в примере 12. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (62 мг, выход: 67%).
1H ЯМР (CDCl3, 200 МГц): δ 1,34 (с, 3H), 3,51 (с, 3H), 3,61 (с, 3H), 4,02 (с, 3H), 4,10 (дд, 1H), 4,33 (д, 1H), 4,47 (с, 1Н), 4,68 (д, 1H), 4,80-4,97 (м, 2H), 6,35 (д, 1H), 6,54 (дд, 1H), 6,74 (д, 1H), 6,81 (д, 2H), 7,14 (д, 2H).
< ПРИМЕР 18> Получение (2S,3S,4R)-6-нитро-4-[N-(4-хлорфенил)-N-(1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Стадия 1: получение (2S,3S,4R)-6-нитро-4-[N-(4-хлорфенил)-N-[2-(1-этоксиэтил)-2Н-тетразол-5-илметил]амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (900 мг, 3,2 ммоль), полученного в стадии 1 примера 1, и N-(4-хлорфенил)-N-[2-(1-этоксиэтил)-2Н-тетразол-5-илметил)амина (900 мг, 3,2 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (566 мг, выход: 31%).
1H ЯМР (CDCl3, 200 МГц): δ 1,12 (м, 3H), 1,48 (с, 3H), 1,82 (д, 3H), 3,26-3,34 (м, 1H), 3,49-3,59 (м, 1H), 3,57 (с, 3H), 3,64 (с, 3H), 4,43-4,10 (м, 2H), 4,62 (с, 1H), 4,86 (д, 1H), 5,15 (д, 1H), 5,20 (д, 1H), 6,00 (кв., 1H), 6,85 (д, 2H), 7,05 (д, 1H), 7,13 (д, 2H), 8, 06 (дд, 1H), 8,10 (д, 1H).
Стадия 2: получение (2S,3S,4R)-6-нитро-4-[N-(4-хлорфенил)-N-(1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Соединение, полученное в указанной выше стадии 1 (300 мг, 0,53 ммоль), растворяют в метаноле (2 мл), к раствору добавляют 3% водный раствор HCl (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение 12 часов. К реакционной смеси добавляют воду (20 мл). Реакционную смесь экстрагируют этилацетатом (30 мл). Органический слой сушат над безводным сульфатом магния и концентрируют. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (160 мг, выход: 61%).
1H ЯМР (CDCl3, 200 МГц): δ 1,49 (с, 3H), 3,63 (с, 6H), 4,60-4,40 (м, 3H), 5,20-4,95 (м, 3H), 6,78-6,50 (м, 3H), 7,00 (д, 1H), 7,10 (д, 2H), 7,99 (д, 1H), 8,10 (дд, 1H).
<ПРИМЕР 19> Получение (2S,3S, 4R)-6-нитро-4-[N-(1Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 1 примера 18, за исключением использования N-[2-(1-этоксиэтил)-2Н-тетразол-5-илметил]фениламина, получая при этом соединение, тетразольная группа которого защищена. С использованием этого соединения (272 мг, 0,52 ммоль) выполняют такую же методику, как в стадии 2 примера 18. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (119 мг, выход: 50%).
1H ЯМР (CDCl3, 200 МГц): δ 1,49 (с, 3H), 3,62 (с, 6H), 4,75-4,43 (м, 3H), 5,21-4,97 (м, 3H), 6,84-6,73 (м, 3H), 6,99 (д, 1H), 7,20-7,12 (м, 2H), 8,03 (д, 1H), 8,11 (дд, 1H).
<ПРИМЕР 20> Получение (2S,3S, 4R)-6-нитро-4-[N-бензил-N-(1Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 1 примера 18, за исключением использования эпоксидного соединения, полученного в стадии 1 примера 1, и N-бензил-N-[2-(1-этоксиэтил)-2Н-тетразол-5-илметил]амина, получая при этом указанное в заголовке соединение (254 мг, 0,47 ммоль). После этого выполняют такую же процедуру, как в стадии 2 примера 18. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (107 мг, выход: 48%).
1H ЯМР (CDCl3, 200 МГц): δ 1,25 (с, 3H), 3,64 (с, 6H), 3,85 (м, 2H), 4,16 (д, 1H), 4,52-4,41 (м, 4H), 6,90 (д, 1H), 7,25-7,17 (м, 5H), 8,05 (дд, 1H), 8,41 (д, 1H).
<ПРИМЕР 21> Получение (2S,3S, 4R)-6-нитро-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (150 мг, 0,53 ммоль), полученного в стадии 1 примера 1, и N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (249 мг, выход: 9,3%).
1H ЯМР (CDCl3, 200 МГц): δ 1,50 (с, 3H), 4,10 (с, 3H), 4,41-4,34 (м, 4H), 4,62 (с, 1H), 4,81 (д, 1H), 5,20 (д, 2H), 6,80 (дд, 2H), 6,89 (с, 1H), 7,07 (м, 2H), 8,08 (м, 2H).
<ПРИМЕР 22> Получение (2S,3S,4R)-6-амино-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (148 мг, 0,3 ммоль), полученного в примере 21. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (106 мг, выход: 74%).
1H ЯМР (CDCl3, 200 МГц): δ 1,41 (с, 3H), 3,55 (с, 3H), 3,61 (с, 3H), 4,20-4,40 (м, 6H), 4,57 (с, 1H), 4,68 (д, 1H), 5,09 (д, 1H), 6,40 (д, 1H), 6,54 (дд, 1H), 6,70-6,80 (м, 3H), 6,87 (с, 1H), 7,08 (т, 1H).
<ПРИМЕР 23> Получение (2S,3S,4R)-6-нитро-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,1 ммоль), полученного в стадии 1 примера 1, и N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (463 мг, выход: 69%).
1H ЯМР (CDCl3, 200 МГц): δ 1,48 (с, 3H), 2,02 (с, 3H), 3,57 (с, 3H), 3,64 (с, 3H), 4,38-4,31 (м, 5H), 4,62 (с, 1H), 4,84 (д, 1H), 5,16 (с, 1H), 5,21 (с, 1H), 6,82 (д, 2H), 6,99-7,06 (м, 3H), 8,06 (дд, 1H), 8,12 (с, 1H).
<ПРИМЕР 24> Получение (2S,3S, 4R)-6-амино-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования эпоксидного соединения (263 мг, 0,54 ммоль), полученного в примере 23. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (176 мг, выход: 72%).
1H ЯМР (CDCl3, 200 МГц): δ 1,41 (с, 3H), 2,23 (с, 3H), 3,55 (с, 3H), 3,61 (с, 3H), 4,30 (с, 3H), 4,42 (с, 1H), 4,59 (с, 1H), 4,70 (с, 1H), 4,93 (с, 1H), 5,11 (д, 1Н), 6,44 (д, 1H), 6,53 (дд, 1H), 6,79 (дд, 3H), 7,00 (д, 2H).
<ПРИМЕР 25> Получение (2S,3R,4S)-6-нитро-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (150 мг, 0,53 ммоль), полученного в стадии 1 примера 2, и N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (124 мг, выход: 46%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 3,52 (с, 3H), 3,55 (с, 3H), 3,95 (кв., 1H), 4,36 (м, 4H), 4,75 (с, 1H), 4,85 (д, 1H), 5,47 (с, 1H), 5,70 (д, 2H), 6,78 (дд, 1H), 6,90 (с, 1H), 6,95 (д, 1H), 7,12 (т, 1H), 7,96 (с, 1H), 8,08 (дд, 1H).
<ПРИМЕР 26> Получение (2S,3R, 4S)-6-амино-4-[N-(3-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (180 мг, 0,37 ммоль), полученного в примере 25. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (95 мг, выход: 54%).
1H ЯМР (CDCl3, 200 МГц): δ 1,54 (с, 3H), 3,40 (с, 1H), 3,50 (с, 3H), 3,53 (с, 3H), 3,92 (кв., 1H), 4,32-4,50 (м, 4H), 4,64 (с, 1H), 4,63-4,73 (м, 2H), 5,41 (д, 1H), 6,42 (с, 1H), 6,56 (дд, 1H), 6,68-6,78 (м, 3H), 6,91 (с, 1H), 7,05 (т, 1H).
< ПРИМЕР 27> Получение (2S,3R,4S)-6-нитро-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как на стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,1 ммоль), полученного в стадии 1 примера 2, и N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (388 мг, выход: 75%).
1H ЯМР (CDCl3, 200 МГц): δ 1,62 (с, 3H), 2,24 (с, 3H), 3,49 (с, 3H), 3,55 (с, 3H), 3,92 (кв., 1H), 4,26 (м, 4H), 4,74 (с, 1H), 4,86 (д, 1H), 5,40 (д, 1H), 5,55 (д, 1H), 6,81 (д, 2H), 7,04-6,91 (м, 3H), 8,02 (с, 3H), 8,06 (д, 1H).
<ПРИМЕР 28> Получение (2S,3R, 4S)-6-амино-4-[N-(4-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (238 мг, 0,49 ммоль), полученного в примере 27. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (168 мг, выход: 69%).
1H ЯМР (CDCl3, 200 МГц): δ 1,53 (с, 3H), 2,23 (с, 3H), 3,48 (с, 3H), 3,52 (с, 3H), 3,92 (д, 1H), 4,30 (с, 3H), 4,39 (д, 1H), 4,64 (с, 1H), 4,65-4,74 (м, 2H), 5,35 (д, 1H), 6,48 (д, 1H), 6,52 (д, 1H), 6,69 (д, 1H), 6,82 (д, 2H), 7,00 (д, 2H).
< ПРИМЕР 29> Получение (2S,3R,4S)-6-нитро-4-[N-(2-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как на стадии 3 примера 1, за исключением использования эпоксидного соединения (450 мг, 1,6 ммоль), полученного в стадии 1 примера 2, и N-(2-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (118 мг, выход: 15%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 3,42 (с, 3H), 3,53 (м, 3H), 4,13 (д, 1H), 4,22 (с, 3H), 4,45 (д, 1H), 4,54 (с, 1H), 4,63 (д, 1H), 5,12 (д, 1H), 6,88-6,93 (м, 2H), 7,16 (т, 1H), 7,34 (дд, 1H), 7,67 (дд, 1H), 8,08 (дд, 1H), 9,12 (дд, 1H).
<ПРИМЕР 30> Получение (2S, 3R,4S)-6-амино-4-[N-(2-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (108 мг, 0,21 ммоль), полученного в примере 29. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (78 мг, выход: 78%).
1H ЯМР (CDCl3, 200 МГц): δ 1,49 (с, 3H), 3,16 (ушир. с, 1H), 3,35 (с, 3H), 3,48 (с, 3H), 4,19 (с, 3H), 4,30 (д, 1H), 4,50 (с, 1H), 4,82 (д, 1H), 4,94 (д, 1H), 6,58 (дд, 1H), 6,67 (д, 1H), 6,85 (т, 1H), 7,10 (т, 1H), 7,28 (д, 1H), 7,45 (д, 1H), 7,74 (д, 1H).
<ПРИМЕР 31> Получение (2S,3R,4S)-6-нитро-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как на стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,07 ммоль), полученного в стадии 1 примера 2, и N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (248 мг, выход: 42%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 3,50 (с, 3H), 3,55 (с, 3H), 3,92 (кв., 1H), 4, 30 (ушир. с, 1H), 4,35 (с, 3H), 4,73 (с, 3H), 4,85 (д, 1H), 5,47 (с, 1H), 5,62 (д, 2H), 6,86 (д, 2H), 6,96 (д, 1H), 7,07 (д, 2H), 7,99 (с, 1H), 8,07 (дд, 1H).
<ПРИМЕР 32> Получение (2S,3R,4S)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (165 мг, 0,30 ммоль), полученного в примере 31. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (117 мг, выход: 75%).
1H ЯМР (CDCl3, 200 МГц): δ 1,54 (с, 3H), 3,48 (с, 3H), 3,52 (с, 3H), 3,95 (кв., 1H), 4,32 (с, 1H), 4,41 (д, 1H), 4,66-4,74 (м, 3H), 5,36 (д, 1H), 6,46 (с, 1H), 6,54 (дд, 1H), 6,70 (д, 1H), 6,86 (д, 2H), 7,03 (д, 2H).
<ПРИМЕР 33> Получение (2S,3R,4S)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,07 ммоль), полученного в стадии 1 примера 2, и N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-ил)метил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (92 мг, выход: 16%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 3,51 (с, 3H), 3,54 (с, 3H), 3,98 (ушир. с, 1H), 4, 35 (м, 4H), 4,74 (с, 1H), 4,92 (д, 1H), 5,80 (с, 1H), 6,72 (д, 1H), 6,96 (д, 2H), 7,40-7,47 (м, 2H), 7,95 (м, 1H), 8,06 (дд, 1H).
<ПРИМЕР 34> Получение (2S,3R, 4S)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (92 мг, 0,17 ммоль), полученного в примере 33. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (26 мг, выход: 30%).
1H ЯМР (CDCl3, 200 МГц): δ 1,55 (с, 3H), 3,50 (с, 3H), 3,53 (с, 3H), 3,99 (ушир. с, 1H), 4,32-4,40 (м, 4H), 4,64-4,80 (м, 3H), 5,56 (с, 1H), 6,40 (с, 1H), 6,55 (дд, 1H), 6,71 (д, 1H), 6,95 (д, 2H), 7,42 (д, 2H).
<ПРИМЕР 35> Получение (2S,3R,4S)-6-нитро-4-[N-(3-ацетилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,07 ммоль), полученного в стадии 1 примера 2, и N-(3-ацетилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (232 мг, выход: 42%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 2,54 (с, 3H), 3,56 (с, 6H), 3,97 (с, 1H), 4,33 (м, 4H), 4,76 (с, 1H), 4,92 (д, 1H), 5,43 (с, 1H), 5,80 (с, 1H), 6,96 (д, 1H), 7,04 (д, 1H), 7,24-7,38 (м, 2H), 7,60 (д, 1H), 7,96 (д, 1H).
<ПРИМЕР 36> Получение (2S,3R, 4S)-6-амино-4-[N-[3-(1-гидроксиэтил)фенил]-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (151 мг, 0,29 ммоль), полученного в примере 35. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (90 мг, выход: 64%).
1H ЯМР (CDCl3, 200 МГц): δ 1,43 (дд, 3H), 1,54 (с, 3H), 3,51 (с,3 H), 3,54 (с, 3H), 3,97 (д, 1H), 4,30-4,45 (м, 4H), 4,65-4,78 (м, 3H), 5,47 (д, 1H), 6,47-6,56 (м, 2H), 6,68-6,77 (м, 3H), 6,99 (д, 1H), 7,16 (т, 1H)
<ПРИМЕР 37> Получение (2S,3R,4S)-6-нитро-4-[N-(2-метил-4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (450 мг, 1,6 ммоль), полученного в стадии 1 примера 2, и N-[(2-метил-4-фтор)фенил]-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (323 мг, выход: 40%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 2,47 (с, 3H), 3,38 (с, 3H), 3,40 (с, 3H), 3,99 (д, 1H), 4,12 (д, 1H), 4,23 (с, 1H), 4,33 (д, 1H), 4,47 (с, 1H), 4,67 (д, 1H), 4,78 (д, 1H), 6,75-6,85 (м, 2H), 7,55 (дд, 1H), 8,06 (дд, 1H), 9,02 (д, 1H).
<ПРИМЕР 38> Получение (2S,3R,4S)-6-амино-4-[N-(2-метил-4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (205 мг, 0,41 ммоль), полученного в примере 37. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (143 мг, выход: 74%).
1H ЯМР (CDCl3, 200 МГц): δ 1,49 (с, 3H), 2,43 (с, 3H), 2,98 (д, 1H), 9,31 (с, 3H), 3,46 (с, 3H), 4,19 (с, 3H), 4,23 (д, 1H), 4,37 (д, 1H), 4,43 (с, 3H), 4,81 (д, 1H), 6,58 (дд, 1H), 6,65-6,80 (м, 3H), 7,40 (дд, 1H), 7,68 (д, 1H).
<ПРИМЕР 39> Получение (2S,3R,4S)-6-нитро-4-[N-(4-метоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,07 ммоль), полученного в стадии 1 примера 2, и N-(4-метоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (417 мг, выход: 78%).
1H ЯМР (CDCl3, 200 МГц): δ 1,62 (с, 3H), 3,48 (с, 3H), 3,54 (с, 3H), 3,74 (с, 3H), 3,93 (дд, 1H), 4,32 (м, 4H), 4,72 (с, 1H), 4,83 (д, 1H), 5,34 (д, 1H), 5,46 (д, 2H), 6,76-6,95 (м, 3H), 8,03 (д, 1H), 8,08 (дд, 1H).
<ПРИМЕР 40> Получение (2S,3R, 4S)-6-амино-4-[N-(4-метокси-фенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (300 мг, 0,6 ммоль), полученного в примере 39. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (270 мг, выход: 96%).
1H ЯМР (CDCl3, 200 МГц): δ 1,53 (с, 3H), 3,39 (с, 2H), 3,48 (с, 3H), 3,51 (с, 3H), 3,73 (с, 3H), 3,93 (дд, 1H), 4,30 (с, 3H), 4,44 (д, 1H), 4,61 (м, 1H), 4,67 (д, 1H), 5,17 (д, 1H), 6,54 (м, 1H), 6,69 (д, 1H), 6,77 (д, 2H), 6,89 (д, 2H)
< ПРИМЕР 41> Получение (2S,3R,4S)-6-нитро-4-[N-(2-метил-4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (450 мг, 1,6 ммоль), полученного в стадии 1 примера 2, и N-[(2-метил-4-хлорфенил)]-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (235 мг, выход: 28%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 2,46 (с, 3H), 3,38 (с, 3H), 3,41 (с, 3H), 3,99-4,18 (м, 2H), 4,23 (с, 3H), 4,33 (д, 1H), 4,48 (6, 1H), 4,67 (д, 1H), 4,87 (с, 1H), 6,90 (д, 1H), 7,01-7,09 (м, 2H), 7,50 (д, 1H), 8,07 (дд, 1H), 8,99 (д, 1H).
<ПРИМЕР 42> Получение (2S,3R,4S)-6-амино-4-[N-(2-метил-4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (164 мг, 0,31 ммоль), полученного в примере 41. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (86 мг, выход: 57%).
1H ЯМР (CDCl3, 200 МГц): δ 1,50 (с, 3H), 2,42 (с, 3H), 2,99 (д, 1H), 3,32 (с, 3H), 3,46 (с, 3H), 4,03-4,23 (м, 4H), 4,19 (с, 3H), 4,43 (с, 1H), 4,48 (д, 1H), 4,81 (д, 1H), 6,58 (дд, 1H), 6,68 (д, 1H), 6,96-7,04 (м, 2H), 7,34 (д, 1H), 7,65 (д, 1H).
<ПРИМЕР 43> Получение (2S,3R,4S)-6-нитро-4-[N-(2-метокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (400 мг, 1,4 ммоль), полученного в стадии 1 примера 2, и N-[(2-метокси-5-метил)фенил]-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (615 мг, выход: 85%).
1H ЯМР (CDCl3, 200 МГц): δ 1,64 (с, 3H), 3,37 (с, 3H), 3,50 (с, 3H), 3,93 (с, 3H), 4,13 (д, 1H), 4,23 (с, 1H), 4,75 (с, 1H), 4,85 (д, 1H), 4,68 (с, 1H), 4,99 (д, 1H), 5,76 (д, 1H), 5,79 (д, 1H), 6,80 (с, 2H), 6,87 (д, 1H), 7,35 (с, 1H), 8,02 (дд, 1H), 8,83 (д, 1H).
<ПРИМЕР 44> Получение (2S,3R,4S)-6-амино-4-[N-(2-метокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (414 мг, 0,8 ммоль), полученного в примере 43. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (285 мг, выход: 74%).
1H ЯМР (CDCl3, 200 МГц): δ 1,53 (с, 3H), 2,21 (с, 3H), 3,41 (с, 3H), 3,44 (с, 3H), 3,83 (с, 3H), 4,00-4,11 (м, 2H), 4,20 (с, 3H), 4,49 (д, 1H), 4,53 (с, 1H), 4,61 (д, 1H), 4,98 (д, 1H), 6,54 (дд, 1H), 6,64-6,76 (м, 3H), 7,18 (с, 1H), 7,25 (с, 1H).
<ПРИМЕР 45> Получение (2S,3R,4S)-6-нитро-4-[N-(2, 4-диметил-фенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (250 мг, 0,89 ммоль), полученного в стадии 1 примера 2, и N-(2,4-диметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (256 мг, выход: 57%).
1H ЯМР (CDCl3, 200 МГц): δ 1,62 (с, 3H), 2,23 (с, 3H), 2,46 (с, 3H), 3,39 (с, 3H), 3,40 (с, 3H), 4,12-4,16 (м, 2H), 4,22 (с, 3H), 4,40 (д, 1H), 4,51 (с, 1H), 4,64 (д, 1H), 4,89 (д, 1H), 6, 87-6,94 (м, 3H), 7,48 (д, 1H), 8,05 (дд, 1H), 8,99 (дд, 1H).
<ПРИМЕР 46> Получение (2S,3R,4S)-6-амино-4-[N-(2, 4-диметил-фенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (180 мг, 0,36 ммоль), полученного в примере 45. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (155 мг, выход: 92%).
1H ЯМР (CDCl3, 200 МГц): δ 1,49 (с, 3H), 2,20 (с, 3H), 2,42 (с, 3H), 3,10 (ушир.с, 3H), 3,32 (с, 3H), 3,45 (с, 3H), 4,12 (д, 1H), 4,16 (с, 3H), 4,20 (д, 1H), 4,45 (с, 1H), 4,49 (д, 1H), 4,82 (д, 1H), 6,56 (дд, 1H), 6,67 (д, 1H), 6,83 (с, 1H), 6,88 (с, 1H), 7,33 (д, 1H), 7,67 (д, 1H).
<ПРИМЕР 47> Получение (2S,3R,4S)-6-нитро-4-[N-(2,6-диметил-фенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,1 ммоль), полученного в стадии 1 примера 2, и N-(2,6-диметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (153 мг, выход: 29%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 2,55 (ушир. с, 6H), 3,13 (д, 1H), 3,30 (с, 3H), 3,40 (с, 3H), 3,62 (д, 1H), 4,15 (д, 1H), 4,22 (с, 3H), 4,37 (с, 1H), 4,62 (д, 1H), 4,93 (д, 1H), 6,89-6,94 (м, 4H), 8,05 (дд, 1H), 9,17 (д, 1H).
<ПРИМЕР 48> Получение (2S,3R,4S)-6-амино-4-[N-(2,6-диметил-фенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (107 мг, 0,21 ммоль), полученного в примере 47. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (78 мг, выход: 80%).
1H ЯМР (CDCl3, 200 МГц): δ 1,51 (с, 3H), 2,53 (с, 6H), 2,91 (д, 1H), 3,28 (с, 3H), 3,45 (с, 3H), 3,54 (с, 1H), 3,60 (д, 1H), 3,98-4,13 (м, 1H), 4,15 (с, 3H), 4,29 (д, 1H), 4,46 (с, 1H), 4,87 (д, 1H), 6,59 (д, 1H), 6,64 (д, 1H), 6,68-6,86 (м, 3H), 7,84 (с, 1H).
<ПРИМЕР 49> Получение (2S,3R,4S)-6-нитро-4-[N-(2,3-диметил-фенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,07 ммоль), полученного в стадии 1 примера 2, и N-(2,3-диметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (253 мг, выход: 47%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 2,26 (с, 3H), 2,40 (с, 3H), 3,38 (с, 3H), 3,39 (с, 3H), 4,04 (д, 1H), 4,13 (д, 1H), 4,21 (с, 3H), 4,40 (д, 1H), 4,49 (с, 1H), 4,67 (д, 1H), 4,89 (д, 1H), 6,85 (д, 1H), 6,89 (д, 1H), 7,02 (т, 1H), 7,47 (д, 1H), 8,06 (дд, 1H), 9,00 (д, 1H).
<ПРИМЕР 50> Получение (2S,3R,4S)-6-амино-4-[N-2,3-диметил-фенил]-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (177 мг, 0,35 ммоль), полученного в примере 49. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (131 мг, выход: 80%).
1H ЯМР (CDCl3 , 200 МГц): δ 1,48 (с, 3H), 2,23 (с, 3H), 2,35 (с, 3H), 2,90 (с, 1H), 3,30 (с, 3H), 3,45 (с, 3H), 4,07-4,25 (м, 2H), 4,18 (с, 3H), 4,44 (с, 1H), 4,51 (д, 1H), 4,83 (д, 1H), 6,58 (дд, 1H), 6,68 (д, 1H), 6,78 (д, 1H), 6,96 (т, 1H), 7,31 (д, 1H), 7,71 (д, 1H).
<ПРИМЕР 51> Получение (2S,3R, 4S)-6-нитро-4-[N-(2-изопропилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (300 мг, 1,07 ммоль), полученного в стадии 1 примера 2, и N-(2-изопропилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (192 мг, выход: 35%).
1H ЯМР (CDCl3, 200 МГц): δ 1,27 (д, 3H), 1,63 (с, 3H), 3,38 (с, 3H), 3,36 (с, 3H), 4,15 (д, 1H), 4,20 (с, 3H), 4,31 (д, 1H), 4,45 (с, 1H), 4,75 (д, 1H), 4,82 (д, 1H), 6,90 (д, 1H), 7,02-7,12 (м, 2H), 7,23 (д, 1H), 7,60 (дд, 1H), 8,07 (дд, 1H), 9,02 (дд, 1H).
<ПРИМЕР 52> Получение (2S,3R, 4S)-6-амино-4-[N-(2-изопропилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (140 мг, 0,27 ммоль), полученного в примере 51. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (83 мг, выход: 64%).
1H ЯМР (CDCl3, 200 МГц): δ 1,23 (д, 3H), 1,27 (д, 3H), 1,49 (с, 3H), 2,90 (ушир. с, 1H), 3,27 (с, 3H), 3,44 (с, 3H), 3,61 (м, 1H), 4,10-4,20 (м, 4H), 4,41 (с, 1H), 4,44 (д, 1H), 4,88 (д, 1H), 6,59 (дд, 1H), 6,68 (д, 1Н), 6,95-7,06 (м, 2H), 7,19 (дд, 1H), 7,48 (дд, 1H), 7,65 (д, 1H).
<ПРИМЕР 53> Получение (2S,3R, 4S)-6-нитро-4-[N-(4-этоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (400 мг, 1,42 ммоль), полученного на стадии 1 примера 2, и N-[(2-этоксикарбонил)фенил]-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (161 мг, выход: 33%).
1H ЯМР (CDCl3, 200 МГц): δ 1,35 (т, 3H), 1,63 (с, 3H), 3,52 (с, 3H), 3,55 (с, 3H), 3,92 (с, 1H), 4,33 (м, 6H), 4,51-4,75 (м, 2H), 4,91 (д, 1H), 5,49 (с, 1H), 5, 81 (д, 1H), 6,89- 6,99 (м, 3H), 7,87-8,10 (м, 4H).
<ПРИМЕР 54> Получение (2S,3R, 4S)-6-амино-4-[N-(4-этоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (118 мг, 0,22 ммоль), полученного в примере 53. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (49 мг, выход: 44%).
1H ЯМР (CDCl3, 200 МГц): δ 1,33 (т, 3H), 1,54 (с, 3H), 3,25 (с, 1H), 3,49 (с, 3H), 3,52 (с, 3H), 3,99 (с, 1H), 4,24-4,42 (м, 5H), 4,64-4,81 (м, 3H), 5,58 (с, 1H), 6,53 (дд, 1H), 6,70 (д, 1H), 6,89 (д, 2H), 7,87 (д, 2H).
<ПРИМЕР 55> Получение (2S,3R,4S)-6-амино-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (217 мг, 0,46 ммоль), полученного в примере 4. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (157 мг, выход: 77%).
1H ЯМР (CDCl3, 200 МГц): δ 1,54 (с, 3H), 3,30 (с, 1H), 3,49 (с, 3H), 3,52 (с, 3H), 3,96 (д, 1H), 4,30 (с, 3H), 4,45 (д, 1H), 4,64 (с, 1H), 4,71 (д, 1H), 5,43 (д, 1H), 6,46 (с, 1H), 6,52 (дд, 1H), 6,69 (д, 1H), 6,76 (д, 1H), 6,90 (д, 1H), 7,25 (т, 2H).
<ПРИМЕР 56> Получение (2S,3R,4S)-6-амино-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (104 мг, 0,21 ммоль), полученного в примере 6. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (85 мг, выход: 88%).
1H ЯМР (CDCl3, 200 МГц): δ 1,53 (с, 3H), 3,48 (с, 3H), 3,51 (с, 3H), 3,96 (д, 1H), 4,29 (с, 3H), 4,44 (д, 1H), 4,61 (с, 1H), 4,67 (д, 1H), 5,26 (д, 1H), 6,53 (д, 2H), 6,69 (д, 1H), 6,85 (д, 2H), 6,88 (д, 2H).
<ПРИМЕР 57> Получение (2S,3R,4S)-6-амино-4-[N-бензил-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (75 мг, 0,15 ммоль), полученного в примере 8. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (57 мг, выход: 87%).
1H ЯМР (CDCl3, 200 МГц): δ 1,51 (с, 3H), 3,22 (с, 3H), 3,39 (с, 3H), 3,61 (д, 1H), 3,83 (д, 1H), 3,92 (д, 1H), 4,02 (д, 1H), 4,12-4,27 (м, 3H), 4,31 (с, 3H), 6,52 (дд, 1H), 6,59 (д, 1H), 7,22-7,37 (м, 4H), 7,48 (д, 2H).
<ПРИМЕР 58> Получение (2S,3R,4S)-6-нитро-4-[N-(3-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (460 мг, 1,65 ммоль), полученного в стадии 1 примера 2, и N-[(3-метоксикарбонил)фенил]-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (360 мг, выход: 40%).
1H ЯМР (CDCl3, 200 МГц): δ 1,22 (с, 3H), 3,57 (с, 3H), 3,89 (с, 3H), 4,13 (м, 2H), 4,30 (с, 3H), 4,88 (с, 1H), 6,98 (м, 2H), 7,27 (д, 1H), 7,30 (д, 1H), 7,69 (1H), 7,96 (м, 1H), 8,07 (дд, 1H).
<ПРИМЕР 59> Получение (2S,3R, 4S)-6-амино-4-[N-(3-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (520 мг, 0,57 ммоль), полученного в примере 58. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (360 мг, выход: 40%).
1H ЯМР (CDCl3, 200 МГц): δ 1,53 (с, 3H), 3,59 (д, 6H), 3,84 (с, 3H), 3,98 (м, 2H), 4,12 (с, 3H), 4,15 (м, 1H), 4,78 (с, 1H), 5,55 (м, 1H), 6,66 (м, 2H), 6,71 (д, 1H), 7,01 (м, 1H), 7,17 (т, 1H), 7,38 (м, 1H), 7,68 (м, 1H).
<ПРИМЕР 60> Получение (2S,3R,4S)-6-нитро-4-[N-(2-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (370 мг, 1,32 ммоль), полученного в стадии 1 примера 2, и N-(2-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (140 мг, выход: 21%).
1H ЯМР (CDCl3, 200 МГц): δ 1,66 (с, 3H), 3,44 (д, 6Н), 4,13 (м, 2H), 4,33 (с, 3H), 4,81 (с, 1H), 4,91 (м, 1H), 4,99 (м, 1H), 6,99 (м, 1H), 7,55 (м, 1H), 8,02 (дд, 1H), 8,54 (дд, 1H).
<ПРИМЕР 61> Получение (2S,3R, 4S)-6-амино-4-[N-(2-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (210 мг, 0,42 ммоль), полученного в примере 60. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (71 мг, выход: 37%).
1H ЯМР (CDCl3, 200 МГц): δ 1,57 (с, 3H), 3,55 (д, 6H), 4,15 (м, 2H), 4,33 (с, 3H), 4,44 (8, 1H), 4,75 (м, 1H), 4,84 (м, 1H), 6,86 (м, 6H), 7,49 (м, 1H).
<ПРИМЕР 62> Получение (2S,3R, 4S)-6-нитро-4-[N-(2-метокси-4-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (380 мг, 1,36 ммоль), полученного в стадии 1 примера 2, и N-[(2-метокси-4-метоксикарбонил)фенил]-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:3), получая при этом требуемое соединение (250 мг, выход: 48%).
1H ЯМР (CDCl3, 200 МГц): δ 1,64 (с, 3Н), 3,48 (д, 6H), 3,90 (с, 3Н), 4,01 (с, 3Н), 4,33 (м, 2Н), 4,66 (с, 1H), 4,99 (м, 1H), 5,19 (м, 1H), 6,92 (д, 1H), 7,55 (м, 3H), 8,02 (дд, 1H), 8,74 (м, 1H).
<ПРИМЕР 63> Получение (2S,3R, 4S)-6-амино-4-[N-(2-метокси-4-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (200 мг, 0,37 ммоль), полученного в примере 62. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (90 мг, выход: 45%).
1H ЯМР (CDCl3, 200 МГц): δ 1,52 (с, 3H), 3,42 (д, 6H), 3,58 (м, 1H), 3,75 (с, 3H), 3,77 (с, 3H), 3,98 (м, 1H), 4,49 (с, 1H), 4,57 (м, 1H), 4,68 (м, 1H), 5,26 (д, 1H), 6,57 (м, 1H), 7,27 (м, 2H), 7,55 (м, 2H).
<ПРИМЕР 64> Получение (2S,3R,4S)-6-нитро-4-[N-(2-метил-4-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (350 мг, 1,26 ммоль), полученного в стадии 1 примера 2, и N-[(2-метил-4-гидрокси)фенил]-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (190 мг, выход: 30%).
1H ЯМР (CDCl3, 200 МГц): δ 1,61 (с, 3H), 2,43 (с, 6H), 3,39 (д, 6H,) 3,64 (м, 1H), 3,96 (м, 1H), 4,16 (с, 1H), 4,46 (с, 1H), 4,68 (м, 1H), 4,72 (м, 1H), 5,81 (ушир. с, 1H), 6,59 (дд, 1H), 6,61 (м, 1H), 6,91 (д, 1H), 7,27 (д, 1H), 8,04 (дд, 1H), 9,05 (м, 1H).
<ПРИМЕР 65> Получение (2S,3R,4S)-6-амино-4-[N-(2-метил-4-гидроксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (140 мг, 0,29 ммоль), полученного в примере 64. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (70 мг, выход: 53%).
1H ЯМР (CDCl3, 200 МГц): δ 1,48 (с, 3H), 2,32 (с, 3H), 3,31 (д, 6H,) 3,63 (м, 1H), 3,78 (м, 1H), 4,10 (с, 3H), 4,23 (м, 1H), 4,33 (с, 1H), 4,82 (м, 1H), 6,34 (дд, 1H), 6,59 (м, 3H), 7,26 (м, 1H), 7,71 (м, 1H).
<ПРИМЕР 66> Получение (2S,3R,4S)-6-нитро-4-[N-(2-этилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (270 мг, 0,98 ммоль), полученного на стадии 1 примера 2, и N-(2-этилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (100 мг, выход: 22%).
1H ЯМР (CDCl3, 200 МГц): δ 1,27 (т, 3H), 1,62 (с, 3H), 2,89 (т, 2H,) 3,36 (д, 6H), 3,82 (д, 1H), 4,10 (д, 1H), 4,18 (с, 3H), 4,28 (д, 1H), 4,35 (с, 1H), 4,84 (д, 1H), 7,10 (м, 4H), 7,59 (дд, 1H), 8,08 (дд, 1H), 9,02 (м, 1H).
<ПРИМЕР 67> Получение (2S,3R, 4S)-6-амино-4-[N-(2-этилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (190 мг, 0,39 ммоль), полученного в примере 66. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (30 мг, выход: 14%).
1H ЯМР (CDCl3, 200 МГц): δ 1,24 (т, 3H), 1,49 (с, 3H), 2,65 (м, 1H), 2,91 (м, 1H), 3,27 (д, 6H), 4,09 (м, 2H), 4,14 (с, 3H), 4,42 (с, 1H), 4,45 (м, 1H), 4,92 (м, 1H), 6,70 (м, 2H), 7,05 (м, 3H), 7,45 (д, 1H), 7,67 (м, 1Н).
<ПРИМЕР 68> Получение (2S,3R,4S)-6-нитро-4-[N-(2-метил-5-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (420 мг, 1,48 ммоль), полученного в стадии 1 примера 2, и N-(2-метил-5-(метоксикарбонил)фенил]-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (520 мг, выход: 51%).
1H ЯМР (CDCl3, 200 МГц): δ 1,64 (с, 1H), 2,56 (с, 3H), 3,41 (д, 6H,) 3,87 (с, 3H), 4,07 (м, 2H), 4,10 (с, 3H), 4,48 (с, 1H), 4,80 (д, 1H), 4,93 (д, 1H), 6,93 (д, 1H), 7,17 (д, 1H), 7,61 (м, 1H), 8,07 (дд, 1H), 8,25 (м, 1H), 8,97 (м, 1H).
<ПРИМЕР 69> Получение (2S,3R,4S)-6-амино-4-[N-(2-метил-5-метоксикарбонилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (220 мг, 0,40 ммоль), полученного в примере 68. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (90 мг, выход: 44%).
1H ЯМР (CDCl3, 200 МГц): δ 1,48 (с, 3H), 2,49 (с, 3H), 3,44 (д, 6H), 3,72 (м, 1H), 3,83 (м, 1H), 4,05 (с, 3H), 4,49 (с, 1H), 4,54 (д, 1H), 4,96 (д, 1H), 6,68 (м, 2H), 7,25 (д, 1H), 7,49 (м, 2H), 8,05 (м, 1H).
<ПРИМЕР 70> Получение (2S,3R,4S)-6-нитро-4-[N-(2-гидрокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (400 мг, 1,43 ммоль), полученного в стадии 1 примера 2, и N-(3-гидрокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (280 мг, выход: 39%).
1H ЯМР (CDCl3, 200 МГц): δ 1,67 (с, 3H), 2,33 (с, 3H), 3,46 (д, 6H), 4,07 (м, 2H), 4,25 (с, 3H), 4,87 (с, 1H), 4,86 (д, 1H), 4,93 (д, 1H), 6,80 (с, 1H), 6,94 (д, 1H), 7,39 (м, 1H), 8,07 (дд, 1H), 8,33 (м, 1H), 8,53 (м, 1H).
<ПРИМЕР 71> Получение (2S,3R,4S)-6-амино-4-[N-(2-гидрокси-5-метилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (140 мг, 0,29 ммоль), полученного в примере 70. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (70 мг, выход: 53%).
1H ЯМР (CDCl3, 200 МГц): δ 1,62 (с, 3H), 2,33 (с, 3H), 3,30 (д, 6H,) 3,62 (м, 1H), 3,74 (м, 1H), 3,78 (с, 3H), 4,17 (м, 1H), 4,33 (с, 1Н), 4,82 (д, 1H), 6,35 (м, 1H), 6,59 (м, 3H), 7,22 (м, 1H), 7,71 (м, 1H).
<ПРИМЕР 72> Получение (2S,3R,4S)-6-нитро-4-[N-(2,4,6-триметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (400 мг, 1,43 ммоль), полученного в стадии 1 примера 2, и N-(2,4, 6-триметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (260 мг, выход: 35%).
1H ЯМР (CDCl3, 200 МГц): δ 1,62 (с, 3H), 2,20 (с, 3H), 2,49 (м, 6H), 3,30 (д, 6H), 3,68 (м, 2H), 4,10 (м, 1H), 4,17 (с, 3H), 4,20 (с, 1H), 4,68 (м, 1H), 4,93 (м, 1H), 6,88 (м, 2H), 6,93 (д, 1H), 8,07 (дд, 1H), 9,14 (м, 1H).
<ПРИМЕР 73> Получение (2S,3R,4S)-6-амино-4-[N-(2, 4,6-триметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (190 мг, 0,37 ммоль), полученного в примере 73. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (90 мг, выход: 52%).
1H ЯМР (CDCl3, 200 МГц): δ 1,64 (с, 3H), 2,17 (с, 3H), 2,52 (м, 6H), 3,31 (д, 6H), 3,65 (м, 2H), 4,07 (с, 3H), 4,30 (м, 1H), 4,47 (с, 1H), 4,89 (м, 1H), 6,56 (м, 1H), 6,73 (м, 3H), 7,84 (м, 1H).
<ПРИМЕР 74> Получение (2S,3S, 4R)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (340 мг, 1,21 ммоль), полученного в стадии 1 примера 1, и N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (522 мг, выход: 82%).
1H ЯМР (CDCl3, 200 МГц): δ 1,50 (с, 3H), 3,59 (с, 3H), 3,63 (с, 3H,) 4,38 (с, 5H), 4,60 (с, 1H), 4,90 (м, 1H), 5,30 (м, 2H), 7,00 (м, 3H), 7,43 (м, 2H), 8,10 (м, 2H).
<ПРИМЕР 75> Получение (2S,3S,4R)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (200 мг, 0,37 ммоль), полученного в примере 74. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (155 мг, выход: 81%).
1H ЯМР (CDCl3, 200 МГц): δ 1,50 (с, 3H), 3,63 (с, 3H), 3,68 (с, 3H), 4,40 (с, 5Н), 4,63 (с, 1H), 4,80 (м, 1H), 4,98 (м, 1H), 5,20 (м, 1H), 6,50 (м, 1H), 6,63 (м, 1H), 6,90 (д, 1H), 7,00 (м, 2H), 7,50 (м, 2H).
<ПРИМЕР 76> Получение (2R,3S, 4R)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Стадия 1: получение (2R,3S,4S)-6-нитро-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 1 примера 1, за исключением использования (2R)-6-нитро-2-метил-2-диметоксиметил-2Н-1-бензопирана (1,5 г, 5,7 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 4:1), получая при этом требуемое соединение (1,3 г, выход: 82%).
1H ЯМР (CDCl3, 200 МГц): δ 1,28 (с, 3H), 3,60 (с, 3H), 3,61 (с, 3H), 3,80 (д, 1H), 3,97 (д, 1H), 4,47 (с, 1H), 6,94 (д, 1H), 8,15 (дд, 1H), 8,30 (д, 1H).
Стадия 2: получение (2R,3R, 4R)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (426 мг, 1,51 ммоль), полученного в указанной выше стадии 1, и N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (391 мг, 1,51 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (111 мг, выход: 14%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 3,50 (с, 3H), 3,55 (с, 3H,) 3,92 (кв., 1H), 4,30 (ушир. с, 1H), 4,35 (с, 3H), 4,73 (с, 1H), 4,85 (д, 1H), 5,47 (с, 1H), 5,62 (д, 2H), 6,86 (д, 2H), 6,96 (д, 1H), 7,07 (д, 2H), 7,99 (с, 1H), 8,07 (дд, 1H).
<ПРИМЕР 77> Получение (2R,3S, 4R)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (93 мг, 0,17 ммоль), полученного в примере 76. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (73 мг, выход: 84%).
1H ЯМР (CDCl3, 200 МГц): δ 1,54 (с, 3H), 3,48 (с, 3H), 3,52 (с, 3H,) 3,95 (кв., 1H), 4,32 (с, 1H), 4,41 (д, 1H), 4,66-4,74 (м, 3H), 5,36 (д, 1H), 6,46 (с, 1H), 6,54 (дд, 1H), 6,70 (с, 1H), 6,86 (д, 2H), 7,03 (д, 2H).
<ПРИМЕР 78> Получение (2R,3R,4S)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Стадия 1: получение (2R,3R,4R)-6-нитро-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 1 примера 1, за исключением использования (2R)-6-нитро-2-метил-2-диметоксиметил-2Н-1-бензопирана (2,5 г, 9,4 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 4:1), получая при этом требуемое соединение (2,3 г, выход: 87%).
1H ЯМР (CDCl3, 200 МГц): δ 1,56 (с, 3Н), 3,28 (с, 3Н), 3,49 (с, 3Н), 3,82 (д, 1H), 3,99 (д, 1H), 4,21 (с, 1H), 6,85 (д, 1H), 8,13 (дд, 1H), 8,28 (д, 1H).
Стадия 2: получение (2R,3R, 4S)-6-нитро-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (604 мг, 2,15 ммоль), полученного в указанной выше стадии 1, и N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (555 мг, 2,15 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (700 мг, выход: 60%).
1H ЯМР (CDCl3, 200 МГц): δ 1,50 (с, 3H), 3,58 (с, 3H), 3,65 (с, 3H,) 4,38 (м, 5H), 4,60 (с, 1H), 4,90 (м, 1H), 5,30 (м, 2H), 7,05 (д, 1H), 7, 01 (м, 1H), 7,43 (д, 2H), 8,10 (дд, 1H).
<ПРИМЕР 79> Получение (2R,3R, 4S)-6-амино-4-[N-(4-трифторметилфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (376 мг, 0,70 ммоль), полученного в примере 78. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:3), получая при этом требуемое соединение (284 мг, выход: 80%).
1H ЯМР (CDCl3, 200 МГц): δ 1,42 (с, 3H), 3,56 (с, 3H), 3,62 (с, 3H), 4,40 (с, 5H), 4,63 (с, 1H), 4,80 (м, 1H), 4,98 (м, 1H), 5,20 (м, 1Н), 6,50 (м, 1H), 6,63 (м, 1H), 6,90 (д, 1H), 7,00 (м, 2H), 7,50 (м, 2H).
<ПРИМЕР 80> Получение (2S,3S,4R)-6-нитро-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (293 мг, 1,04 ммоль), полученного в стадии 1 примера 1, и N-(4-трифторметоксифенил)-N-(2-метил-1Н-тетразол-5-илметил)амина (285 мг, 1,04 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (433 мг, выход: 75%).
1H ЯМР (CDCl3, 200 МГц): δ 1,45 (с, 3H), 3,59 (с, 3H), 3,63 (с, 3H), 4,34 (с, 3H), 4,40 (м, 2H), 4,63 (с, 1H), 4,83 (д, 1H), 5,19 (м, 2H), 6,87 (м, 2H), 7,04 (м, 3H), 8,08 (м, 2H).
<ПРИМЕР 81> Получение (2S,3S, 4R)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (240 мг, 0,43 ммоль), полученного в примере 80. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (189 мг, выход: 83%).
1H ЯМР (CDCl3, 200 МГц): δ 1,43 (с, 3H), 3,60 (с, 3H), 3,63 (с, 3H), 4,39 (с, 3H), 4,40 (м, 2H), 4,60 (с, 1H), 4,76 (д, 2H), 4,90 (с, 1H), 5,16 (м, 1H), 6,43 (с, 1H), 6,59 (м, 1H), 6,88 (м, 3H), 7,18 (м, 2H).
<ПРИМЕР 82> Получение (2R,3R,4S)-6-нитро-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (260 мг, 0,92 ммоль), полученного в указанной выше стадии 1 примера 78, и N-(4-трифторметоксифенил)-N-(2-метил-1Н-тетразол-5-илметил)амина (253 мг, 0,92 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (406 мг, выход: 80%).
1H ЯМР (CDCl3, 200 МГц): δ 1,45 (с, 3H), 3,59 (с, 3H), 3,63 (с, 3H), 4,34 (д, 3H), 4,40 (м, 2H), 4,63 (с, 1H), 4,83 (д, 1H), 5,19 (м, 2H), 6,87 (м, 2H), 7,04 (м, 3H), 8,08 (м, 2H).
<ПРИМЕР 83> Получение (2R,3R, 4S)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (240 мг, 0,43 ммоль), полученного в примере 82. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (176 мг, выход: 78%).
1H ЯМР (CDCl3, 200 МГц): δ 1,40 (с, 3H), 3,56 (с, 3H), 3,61 (с, 3H), 4,37 (с, 3H), 4,40 (м, 2H), 4,60 (с, 1H), 4,76 (д, 2H), 4,90 (с, 1H), 5,16 (м, 1H), 6,43 (с, 1H), 6,59 (м, 1H), 6,88 (м, 3H), 7,18 (м, 2H).
<ПРИМЕР 84> Получение (2R,3S,4R)-6-нитро-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (504 мг, 1,79 ммоль), полученного в указанной выше стадии 1 примера 76, и N-(4-трифторметоксифенил)-N-(2-метил-1Н-тетразол-5-илметил)амина (490 мг, 1,79 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (645 мг, выход: 65%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 3,50 (с, 3H), 3,55 (с, 3H), 3,92 (кв., 1H), 4,30 (ушир. с, 1H), 4,35 (с, 3H), 4,73 (с, 1H), 4,85 (д, 1H), 5,47 (с, 1H), 5,62 (д, 2H), 6,86 (д, 2H), 6,96 (д, 1Н), 7,07 (д, 2H), 7,99 (с, 1H), 8,09 (дд, 1H).
<ПРИМЕР 85> Получение (2R,3S,4R)-6-амино-4-[N-(4-трифторметоксифенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (295 мг, 0,53 ммоль), полученного в примере 84. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:3), получая при этом требуемое соединение (225 мг, выход: 81%).
1H ЯМР (CDCl3, 200 МГц): δ 1,54 (с, 3H), 3,48 (с, 3H), 3,52 (с, 3H), 3,95 (кв., 1H), 4,32 (с, 1Н), 4,41 (д, 1H), 4,66-4,74 (м, 3H), 5,36 (д, 1H), 6,46 (с, 1Н), 6,54 (дд, 1H), 6,70 (д, 1H), 6,86 (д, 2H), 7,03 (д, 2H).
<ПРИМЕР 86> Получение (2S,3S,4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Соединение (700 мг, 1,43 ммоль), полученное в указанном выше примере 21, растворяют в дихлорметане (5 мл), к раствору добавляют триэтиламин (0,3 мл) и уксусный ангидрид (160 мкл). К реакционной смеси добавляют 4-диметиламинопиридин (50 мг). Реакционную смесь перемешивают при комнатной температуре в течение 5 часов. К реакционной смеси добавляют воду (30 мл). Реакционную смесь экстрагируют этилацетатом (30 мл) и органический слой промывают насыщенным раствором соли (20 мл), сушат над безводным сульфатом магния и концентрируют. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (652 мг, 83%).
1H ЯМР (CDCl3, 200 МГц): δ 1,41 (с, 3H), 1,65 (д, 3H), 3,52 (с, 3H), 3,57 (с, 3H), 4,25 (с, 5H), 4,76 (д, 1H), 5,24 (д, 1H), 5,71 (д, 1H), 6,90 (д, 2H), 7,00 (д, 1H), 7,15 (д, 2H), 8,08 (дд, 1H), 8, 71 (д, 1H).
<ПРИМЕР 87> Получение (2S,3S,4R)-6-ацетамидо-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-ацетокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Соединение (150 мг, 0,32 ммоль), полученное в указанном выше примере 10, растворяют в дихлорметане (3 мл), к раствору добавляют триэтиламин (0,11 мл) и уксусный ангидрид (65 мкл). К реакционной смеси добавляют 4-диметиламинопиридин (11 мг). Реакционную смесь перемешивают при комнатной температуре в течение 12 часов. К реакционной смеси добавляют воду (20 мл). Реакционную смесь экстрагируют этилацетатом (20 мл) и органический слой промывают насыщенным раствором соли (20 мл), сушат над безводным сульфатом магния и концентрируют. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (158 мг, 88%).
1H ЯМР (CDCl3, 200 МГц): δ 1,32 (с, 3H), 1,65 (с, 3H), 2,08 (с, 3H), 3,47 (с, 3H), 3,56 (с, 3H), 4,33-4,21 (ушир. с, 5H), 4,68 (д, 1H), 5,13 (д, 1H), 5,62 (д, 1H), 6,86 (д, 3H), 7,11 (д, 2H), 7,39 (ушир. с, 1H), 7,49 (с, 1H), 7,63 (д, 1H).
<ПРИМЕР 88> Получение (2S,3S, 4R)-6-ацетамино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 86, за исключением использования соединения (359 мг, 0,76 ммоль), полученного в примере 10. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:4), получая при этом требуемое соединение (376 мг, выход: 96%).
1H ЯМР (CDCl3, 200 МГц): δ 1,41 (с, 3H), 2,07 (с, 3H), 3,56 (с, 3Н), 3,61 (с, 3H), 4,31 (ушир. с, 4H), 4,57 (с, 1H), 4,72 (д, 1H), 4,94 (ушир. с, 1H), 5,06 (д, 1H), 6,83 (ушир. с, 1H), 6,90 (д, 2H), 7,10 (д, 3H), 7,20 (ушир. с, 1H), 7,38 (дд, 1Н).
<ПРИМЕР 89> Получение (2S,3S,4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-ацетокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (150 мг, 0,28 ммоль), полученного в примере 86. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:3), получая при этом требуемое соединение (102 мг, выход: 77%).
1H ЯМР (CDCl3 , 200 МГц): δ 1,30 (с, 3Н), 1,62 (с, 3H), 3,45 (с, 3H), 3,56 (с, 3H), 4,18 (с, 1H), 4,23 (с, 1H), 4,31 (д, 1H), 4,68 (д, 1H), 5,12 (д, 1H), 5,58 (д, 1H), 6,57 (дд, 1H), 6,72 (д, 1H), 6,87 (д, 2H), 7,03 (д, 1H), 7,11 (д, 2H).
<ПРИМЕР 90> Получение (2S,3R, 4S)-6-бром-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (2S,3R,4R)-6-бром-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (192 мг, 0,61 ммоль) и N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (136 мг, 0,60 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (55 мг, выход: 17%).
1H ЯМР (CDCl3, 200 МГц): δ 1,26-1,31 (м, 3H), 1,57 (с, 3H), 3,48 (с, 3H), 3,52 (с, 3H), 3,96-3,91 (м, 1H), 4,32 (с, 3H), 4,68 (д, 1H), 4,78 (д, 1H), 5,05 (ушир. с, 1H), 5,49 (д, 1H), 6,88-6,74 (м, 3H), 7,27-7,12 (м, 5H).
<ПРИМЕР 91> Получение (2R,3R, 4S)-6-бром-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (2R,3R,4R)-6-бром-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (232 мг, 0,74 ммоль) и N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (164 мг, 0,74 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 3:1), получая при этом требуемое соединение (165 мг, выход: 41%).
1H ЯМР (CDCl3, 200 МГц): δ 1,28-1,25 (т, 3Н), 1,42 (с, 3H), 3,55 (с, 3H), 3,61 (с, 3H), 4,33-4,30 (ушир. с, 5H), 4,58 (с, 1H), 4,75 (д, 1H), 5, 14-5,05 (ушир. с, 1H), 6,87-6,82 (м, 3Н), 7,12 (д, 2H), 7,28-7,23 (м, 2H).
<ПРИМЕР 92> Получение (2S,3R, 4S)-6-бром-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как на стадии 3 примере 1, за исключением использования (2S,3R,4R)-6-бром-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (209 мг, 0,66 ммоль) и N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (138 мг, 0,66 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 6:1), получая при этом требуемое соединение (165 мг, выход: 51%).
1H ЯМР (CDCl3, 200 МГц): δ 1,28-1,21 (м, 3Н), 1,56 (с, 3H), 3,47 (д, 3Н), 3,51 (с, 3Н), 4,92 (д, 1H), 4,30 (д, 3H), 4,40 (с, 1H), 4,66 (д, 1H), 4,76 (д, 1H), 5,00 (ушир. с, 1H), 5,41 (д, 1H), 6,94-6,72 (м, 5H), 7,21-7,26 (м, 2H).
<ПРИМЕР 93> Получение (2R,3R, 4S)-6-бром-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (2R,3R,4R)-6-бром-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (198 мг, 0,63 ммоль) и N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (130 мг, 0,63 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 4:1), получая при этом требуемое соединение (175 мг, выход: 53%).
1H ЯМР (CDCl3, 200 МГц): δ 1,20-1,27 (м, 3H), 1,40 (с, 3H), 2,03 (д, 3H), 3,55 (с, 3Н), 3,60 (с, 3Н), 4,28-4,33 (м, 5Н), 4,56 (с, 1Н), 4,73 (д, 1H), 5,02 (д, 1H), 6,80-6,88 (м, 5H), 7,22-7,26 (м, 2H).
<ПРИМЕР 94> Получение (2R,3R, 4S)-6-бром-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (2R,3R,4R)-6-бром-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (204 мг, 0,65 ммоль) и N-(2-метил-2Н-тетразол-5-илметил)фениламина (123 мг, 0,65 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 3:1), получая при этом требуемое соединение (196 мг, выход: 60%).
1H ЯМР (CDCl3, 200 МГц): δ 1,27-1,39 (м, 3H), 1,60 (с, 3H), 3,50 (д, 3H), 3,53 (с, 3H), 3,91 (д, 1H), 4,30-4,50 (ушир. с, 3H), 4,77 (д, 1H), 4,80 (д, 1H), 5,02 (ушир. с, 1H), 5,40 (д, 1H), 6,62-6,89 (м, 5H), 7,10-7,40 (м, 5H).
<ПРИМЕР 95> Получение (2R,3S, 4R)-6-метансульфонилокси-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (2R,3S,4S)-6-метансульфонилокси-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (231 мг, 0,70 ммоль) и N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (187 мг, 0,84 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (104 мг, выход: 27%).
1H ЯМР (CDCl3, 200 МГц): δ 1,58 (с, 3H), 3,06 (с, 3H), 3,52 (д, 6H), 4,07 (м, 2H), 4,32 (с, 3H), 4,67 (с, 1H), 5,10 (с, 1H), 5,50 (д, 1H), 6,78-7,15 (м, 7H).
<ПРИМЕР 96> получение (2S,3S, 4S)-6-метансульфонилокси-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 95. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (64 мг, выход: 17%).
1Н ЯМР (CDCl3, 200 МГц): δ 1,44 (с, 3Н), 3,04 (с, 3Н), 3,59 (д, 6Н), 4,32 (с, 3Н), 4,57 (с, 1Н), 4,78 (д, 1Н), 5,10 (д, 1Н), 6,94-7,14 (м, 7Н).
<ПРИМЕР 97> Получение (2S,3S,4R)-6-гидрокси-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Соединение (50 мг, 0,09 ммоль), полученное в примере 96, растворяют в этиловом спирте (2 мл), к раствору добавляют 6 н. КОН (1 мл). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 1 часа, к смеси добавляют 1 н. HCl (10 мл). Реакционную смесь экстрагируют этилацетатом (20 мл). Органический слой сушат над безводным сульфатом магния и концентрируют, получая при этом неочищенный продукт. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (40 мг, выход: 93%).
1Н ЯМР (CDCl3, 200 МГц): δ 1,38 (с, 3Н), 3,56 (д, 3Н), 4,28 (с, 3Н), 4,55 (с, 1Н), 4,90 (с, 1Н), 5,10 (д, 1Н), 6,75-7,10 (м, 7Н).
<ПРИМЕР 98> Получение (2S,3S,4R)-6-нитро-5-метил-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (2S,3S,4S)-6-нитро-5-метил-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана (100 мл, 0,34 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (80 мг, выход: 45%).
1Н ЯМР (CDCl3, 200 МГц): δ 1,30 (с, 3Н), 2,12 (с, 3Н), 3,60 (д, 6Н), 4,10 (с, 3Н), 4,23 (с, 3Н), 4,30 (с, 2Н), 4, 62 (д, 1Н), 5,08 (д, 1Н), 6,80-7,80 (м, 6Н).
<ПРИМЕР 99> Получение (2S,3S, 4R)-6-нитро-4-[N-(4-фторфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-метоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (2S,3S,4S)-6-нитро-2-метил-2-метоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (100 мл, 0,40 ммоль) и аминного соединения (116 мг, 0,52 ммоль), полученного в стадии 2 примера 1. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (110 мг, выход: 58%).
1Н ЯМР (CDCl3, 200 МГц): δ 1,40 (с, 3Н), 3,43 (с, 3Н), 3,70 (дд, 2Н), 4,28 (с, 2Н), 4,90 (д, 1Н), 5,12 (д, 1Н), 6,80-7,20 (м, 5Н), 8,05 (м, 2Н).
<ПРИМЕР 100> Получение (3R,4S))-6-циано-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2,2-диметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (3R,4R)-6-циано-2,2-диметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (300 мг, 1,49 ммоль) и аминного соединения (270 мг, 1,19 ммоль), полученного в стадии 2 примера 1. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (109 мг, выход: 22%).
1H ЯМР (CDCl3, 200 МГц): δ 1,42 (с, 3H), 1,58 (с, 3H), 3,85 (д, 1H), 4,13 (с, 3H), 4,22 (дд, 1H), 4,77 (д, 1H), 5,10 (д, 1H), 5,20 (д, 1H), 6,81-6,93 (м, 3H), 7,15 (д, 1H), 7,36 (с, 1H), 7,46 (дд, 1H).
<ПРИМЕР 101> Получение (3R, 4S))-6-циано-4-[N-(2-метил-2Н-тетразол-5-илметил)фениламино]-3-гидрокси-2,2-диметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (3R,4R)-6-циано-2,2-диметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (200 мг, 0,99 ммоль) и N-(2-метил-2Н-тетразол-5-илметил)фениламина (188 мг, 0,99 ммоль). Неочищенный продукт очищают, получая при этом требуемое соединение (229 мг, выход: 77%).
1H ЯМР (CDCl3, 200 МГц): δ 1,43 (с, 3H), 1,59 (с, 3H), 3,88 (д, 1H), 4,32 (дд, 1H), 4,33 (с, 3H), 4,80 (д, 1H), 5,19 (д, 1H), 5,39 (д, 1H), 6,92-6,70 (м, 4H), 7,20 (д, 2H), 7,40 (с, 1H), 7,45 (дд, 1H).
<ПРИМЕР 102> Получение (2S,3S, 4R))-6-гидрокси-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-3-метил-2,2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Соединение (64 мг, 0,1 ммоль), полученное в примере 96, растворяют в этиловом спирте (2 мл), к раствору добавляют 6 н. КОН (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь нейтрализуют 1 н. HCl и экстрагируют этилацетатом (20 мл). Органический слой сушат над безводным сульфатом магния и концентрируют. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (45 мг, выход: 82%).
1Н ЯМР (CDCl3, 200 МГц): δ 1,38 (с, 3Н), 3,53 (с, 3Н), 3,56 (с, 3Н), 4,28 (с, 3Н), 4,55 (с, 1Н), 4,90 (с, 1Н), 5,10 (д, 1Н), 6,75-7,10 (м, 7Н).
<ПРИМЕР 103> Получение (2S,3S, 4R)-8-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (2S,3S,4S)-8-нитро-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (751 мг, 0,67 ммоль) и N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (597 мг, 2,67 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (691 мг, выход: 51%).
1H ЯМР (CDCl3, 200 МГц): δ 1,41 (с, 3H), 3,49 (с, 3H), 3,53 (с, 3H), 4,24 (с, 3H), 4,46-4, 72 (м, 4H), 5,06 (д, 1H), 6,79 (д, 1H), 6,91 (т, 1H), 7,04 (д, 2H), 7,45 (д, 1H), 7,67 (д, 1H).
<ПРИМЕР 104> Получение (2S,3S,4R)) 8-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (170 мг, 0,34 ммоль), полученного в примере 103. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (128 мг, выход: 80%).
1H ЯМР (CDCl3, 200 МГц): δ 1,43 (с, 3H), 3,55 (с, 3H), 3,60 (с, 3H), 4,29 (с, 3H), 4,35 (д, 1H), 4,62 (с, 2H), 4,89 (ушир. с, 1H), 5,12 (д, 1H), 6,45 (д, 1H), 6,60-6,72 (м, 2H), 6,82 (д, 2H), 7,10 (д, 2H).
<ПРИМЕР 105> Получение (2R,3S, 4R)-8-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования (2R,3S,4S)-8-нитро-2-метил-2-диметоксиметил-3,4-эпокси-3,4-дигидро-2Н-1-бензопирана (75 мг, 2,67 ммоль) и N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амина (597 мг, 2,67 ммоль). Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (200 мг, выход: 15%).
1H ЯМР (CDCl3, 200 МГц): δ 1,63 (с, 3H), 3,46 (с, 6H), 4,00 (д, 1H), 4,31 (с, 3H), 4,76 (с, 2H), 5,30 (ушир. с, 1H), 5,59 (д, 1H), 6,78-6,94 (м, 3H), 7,13 (д, 2H), 7,23 (д, 1H), 7,66 (д, 1H).
<ПРИМЕР 106> Получение (2R,3S, 4R))-8-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 10, за исключением использования соединения (100 мг, 0,20 ммоль), полученного в примере 105. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:1), получая при этом требуемое соединение (70 мг, выход: 74%).
1H ЯМР (CDCl3, 200 МГц): δ 1,60 (с, 3H), 3,48 (с, 3H), 3,53 (с, 3H), 4,00 (д, 1H), 4,30 (с, 3H), 4,42 (ушир. с, 1H), 4,63 (с, 2H), 5,40 (д, 1H), 6,45 (д, 1H), 6,61-6,70 (м, 2H), 6,83 (д, 2H), 7,11 (д, 2H).
<ПРИМЕР 107> Получение (2R,3R, 4S))-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в стадии 3 примера 1, за исключением использования эпоксидного соединения (250 мг, 0,9 ммоль), полученного в стадии 1 примера 2. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (340 мг, выход: 82%).
1H ЯМР (CDCl3, 200 МГц): δ 1,67 (с, 3H), 3,49 (с, 3H), 3,59 (с, 3H), 3,95 (дд, 1H), 4,32 (д, 1H), 4,48 (с, 3H), 4,83 (д, 1H), 4,72 (с, 1H), 5,60 (д, 1H), 6,82 (д, 2H), 6,95 (д, 1H), 7,16 (д, 2H), 7,99 (д, 1H), 8,06 (дд, 1H).
<ПРИМЕР 108> Получение (2R,3R,4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
(2R,3R,4S)-6-Нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран (100 мг, 0,2 ммоль), полученный в примере 107, растворяют в метаноле (2 мл), к раствору добавляют водный раствор Cu(OAc)2 (0,38 мл, 0,4 М водный раствор, 0,15 ммоль). К раствору медленно добавляют при комнатной температуре в течение 30 мин борогидрид натрия (NaBH4, 113 мг, 3,0 ммоль). Реакционную смесь перемешивают в течение 1 часа, к смеси добавляют этилацетат (5 мл). Реакционную смесь фильтруют для удаления черного осадка. К образовавшемуся фильтрату добавляют водный раствор NaHCO3 (5 мл). Фильтрат экстрагируют этилацетатом (30 мл). Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:3), получая при этом требуемое соединение (60 мг, выход: 63%).
1H ЯМР (CDCl3, 200 МГц): δ 1,34 (с, 3H), 3,51 (с, 3H), 3,61 (с, 3H), 4,02 (с, 3H), 4,10 (дд, 1H), 4,33 (д, 1H), 4,47 (с, 1H), 4,68 (д, 1H), 4,80-4,97 (м, 2H), 6,35 (д, 1H), 6,54 (дд, 1H), 6,74 (д, 2H), 6,81 (д, 2H), 7,14 (д, 2H).
<ПРИМЕР 109> Получение (2R,3S, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Эпоксидное соединение (450 мг, 1,6 ммоль), полученное в стадии 1 примера 1, растворяют в ацетонитриле (0,5 мл). К раствору добавляют вторичный амин (363 мг, 1,6 ммоль), содержащий тетразольную группу, полученный в стадии 2 примера 1, с перхлоратом магния (Mg(ClO4)2, 357 мг, 1,6 ммоль). Реакционную смесь перемешивают в течение 10 часов, к смеси добавляют водный раствор NaHCO3 (20 мл). Реакционную смесь экстрагируют этилацетатом (30 мл). Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и концентрируют. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 2:1), получая при этом требуемое соединение (480 мг, выход: 60%).
1H ЯМР (CDCl3, 200 МГц): δ 1,48 (с, 3H), 3,58 (с, 3H), 4,29 (с, 3H), 4,42 (дд, 1H), 4,61 (с, 1H), 4,82 (д, 1H), 5,13 (д, 1H), 5,18 (д, 1H), 6,84 (д, 1H), 7,05 (д, 1H), 7,15 (д, 2H), 8,08 (дд, 1H), 8,10 (д, 1H).
<ПРИМЕР 110> Получение (2R,3S,4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
(2R,3S,4R)-6-Нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран (100 мг, 0,2 ммоль), полученный в примере 109, растворяют в метаноле (2 мл), к раствору добавляют водный раствор Cu(OAc)2 (0,38 мл, 0,4 М водный раствор, 0,15 ммоль). К раствору медленно добавляют при комнатной температуре в течение 30 мин борогидрид натрия (NaBH4, 113 мг, 3,0 ммоль). Реакционную смесь перемешивают в течение 1 часа, к смеси добавляют этилацетат (5 мл). Реакционную смесь фильтруют для удаления черного осадка. К образовавшемуся фильтрату добавляют водный раствор NaHCO3 (5 мл). Фильтрат экстрагируют этилацетатом (30 мл). Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:3), получая при этом требуемое соединение (58 мг, выход: 62%).
1H ЯМР (CDCl3, 200 МГц): δ 1,54 (с, 3H), 3,49 (с, 3H), 3,52 (с, 3H), 4,30 (д, 1H), 4,32 (с, 3H), 4,41-4,70 (м, 3H), 5,33 (д, 1Н), 6,45 (с, 1H), 6,55 (дд, 1H), 6,68 (д, 1H), 6,82 (д, 2H), 7,13 (д, 2H).
<ПРИМЕР 111> Получение (2S,3R, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
(2S,3S, 4R)-6-Нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопиран (100 мг, 0,20 ммоль) растворяют в смешанном растворителе (3,8 мл, толуол/тетрагидрофуран, 1/1). К раствору при 0°С добавляют трифенилфосфин (268 мг, 0,99 ммоль) и 4-нитробензойную кислоту (149 мг, 0,87 ммоль). После этого к реакционной смеси через шприц медленно добавляют диэтилазокарбоксилат (156 мкл, 0,99 ммоль). Реакционную смесь перемешивают в течение 3 дней при комнатной температуре. Растворитель удаляют при пониженном давлении, получая при этом неочищенный продукт. Неочищенный продукт очищают хроматографией на короткой колонке с силикагелем, получая при этом полупродукт. Дополнительную очистку не проводят. Неочищенный продукт растворяют в дихлорметане. К раствору при -20°С по каплям медленно добавляют DiBAL-H (1М раствор в гексане, 1,36 ммоль). Реакционную смесь перемешивают в течение 20 мин. Для окончания реакции к реакционной смеси добавляют насыщенный раствор соли. Органический слой отделяют. Растворитель удаляют при пониженном давлении, получая при этом неочищенный продукт. Неочищенный продукт очищают колоночной хроматографией на силикагеле (проявляющий растворитель - смесь н-гексан:этилацетат, 1:2), получая при этом требуемое соединение (18 мг, выход: 19%).
1H ЯМР (CDCl3, 200 МГц): δ 1,52 (с, 3H), 3,63 (с, 3H), 3,69 (с, 3H), 4,32 (с, 3H), 4,48 (д, 1H), 4,53 (м, 2H), 4,74 (с, 1H), 5,32 (д, 1H), 5,45 (д, 1H), 6,85 (д, 2H), 7,03 (д, 1H), 7,16 (д, 2H), 8,11 (дд, 1H).
<ПРИМЕР 112> Получение (2S,3R,4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 110, за исключением использования (2S,3R, 4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана (100 мг, 0,2 ммоль), полученного в примере 111. Получают требуемое соединение (62 мг, выход: 67%).
1H ЯМР (CDCl3, 200 МГц): δ 1,48 (с, 3H), 3,52 (с, 3H), 3,56 (с, 3H), 4,01 (с, 3H), 4,13 (м, 1H), 4,48 (д, 1H), 4, 75 (м, 1H), 4,90 (м, 3H), 6,42 (д, 1H), 6,62 (дд, 1H), 6,82 (д, 2H), 6,94 (д, 2H), 7,18 (д, 2H).
<ПРИМЕР 113> Получение (2S,3S, 4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 111, за исключением использования (2S,3R,4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана (100 мг, 0,20 ммоль), полученного в примере 2. Получают требуемое соединение (14 мг, выход: 14%).
1H ЯМР (CDCl3, 200 МГц): δ 1,57 (с, 3H), 3,53 (с, 3H), 3,62 (с, 3H), 4,34 (с, 3H), 4,52 (д, 1H), 4,67 (м, 2H), 4,82 (м, 1H), 5,41 (д, 1H), 5,47 (д, 1H), 6,86 (д, 2H), 7,12 (д, 1H), 7,18 (д, 2H), 8,12 (д, 1H), 8,14 (дд, 1H).
<ПРИМЕР 114> Получение (2S,3S,4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 110, за исключением использования (2S,3S,4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана (100 мг, 0,20 ммоль), полученного в примере 113. Получают требуемое соединение (55 мг, выход: 57%).
1H ЯМР (CDCl3, 200 МГц): δ 1,48 (с, 3H), 3,53 (с, 3H), 3,58 (с, 3H), 4,02 (дд, 3H), 4,35 (м, 1H), 4,38 (д, 1H), 4,92 (м, 2H), 5,35 (м, 2H), 6,42 (д, 1H), 6,59 (д, 1H), 6,73 (д, 1H), 6,92 (д, 2H), 7,19 (д, 2H).
<ПРИМЕР 115> Получение (2R,3R,4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 111, за исключением использования (2R,3S,4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана (100 мг, 0,20 ммоль), полученного в примере 2. Получают требуемое соединение (11 мг, выход: 11%).
1H ЯМР (CDCl3, 200 МГц): δ 1,57 (с, 3H), 3,53 (с, 3H), 3,62 (с, 3H), 4,34 (с, 3H), 4,52 (д, 1H), 4,67 (м, 2H), 4,82 (м, 1H), 5,41 (д, 1H), 5,47 (д, 1H), 6,86 (д, 2H), 7,12 (д, 1H), 7,18 (д, 2H), 8,12 (д, 1H), 8,14 (дд, 1H).
<ПРИМЕР 116> Получение (2R,3R,4R)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 110, за исключением использования (2R,3R,4R)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана (100 мг, 0,20 ммоль), полученного в примере 115. Получают требуемое соединение (51 мг, выход: 55%).
1H ЯМР (CDCl3, 200 МГц): δ 1, 48 (с, 3H), 3,53 (с, 3H), 3,58 (с, 3H), 4,02 (дд, 3H), 4,35 (м, 1H), 4,38 (д, 1H), 4,92 (м, 2H), 5,35 (м, 2H), 6,42 (д, 1H), 6,59 (дд, 1H), 6,73 (д, 1H), 6,92 (д, 2H), 7,19 (д, 2H).
<ПРИМЕР 117> Получение (2R,3S,4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 111, за исключением использования (2R,3R,4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3, 4-дигидро-2Н-1-бензопирана (100 мг, 0,20 ммоль), полученного в примере 107. Получают требуемое соединение (13 мг, выход: 13%).
1H ЯМР (CDCl3, 200 МГц): δ 1, 52 (с, 3H), 3,63 (с, 3H), 3,69 (с, 3H), 4,32 (с, 3H), 4,48 (д, 1H), 4,53 (м, 2H), 4,74 (м, 1H), 5,32 (д, 1H), 5,45 (д, 1H), 6,85 (д, 2H), 7,03 (д, 1H), 7,16 (д, 2H), 8,09 (д, 1H), 8,11 (дд, 1H).
<ПРИМЕР 118> Получение (2R,3S,4S)-6-амино-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана
Выполняют такую же методику, как в примере 110, за исключением использования (2R,3S, 4S)-6-нитро-4-[N-(4-хлорфенил)-N-(2-метил-2Н-тетразол-5-илметил)амино]-3-гидрокси-2-метил-2-диметоксиметил-3,4-дигидро-2Н-1-бензопирана (100 мг, 0,20 ммоль), полученного в примере 117. Получают требуемое соединение (55 мг, выход: 59%).
1H ЯМР (CDCl3, 200 МГц): δ 1,48 (с, 3H), 3,52 (с, 3H), 3,56 (с, 3H), 4,01 (с, 3H), 4,13 (м, 1H), 4,48 (д, 1H), 4, 75 (м, 1H), 4,90 (м, 3H), 6,42 (д, 1H), 6,62 (дд, 1H), 6,82 (д, 1H), 6,94 (д, 2H), 7,18 (д, 2H).
Соединения настоящего изобретения, полученные в указанных выше примерах, показаны в таблице 1.
ТАБЛИЦА 1а

ТАБЛИЦА 1b
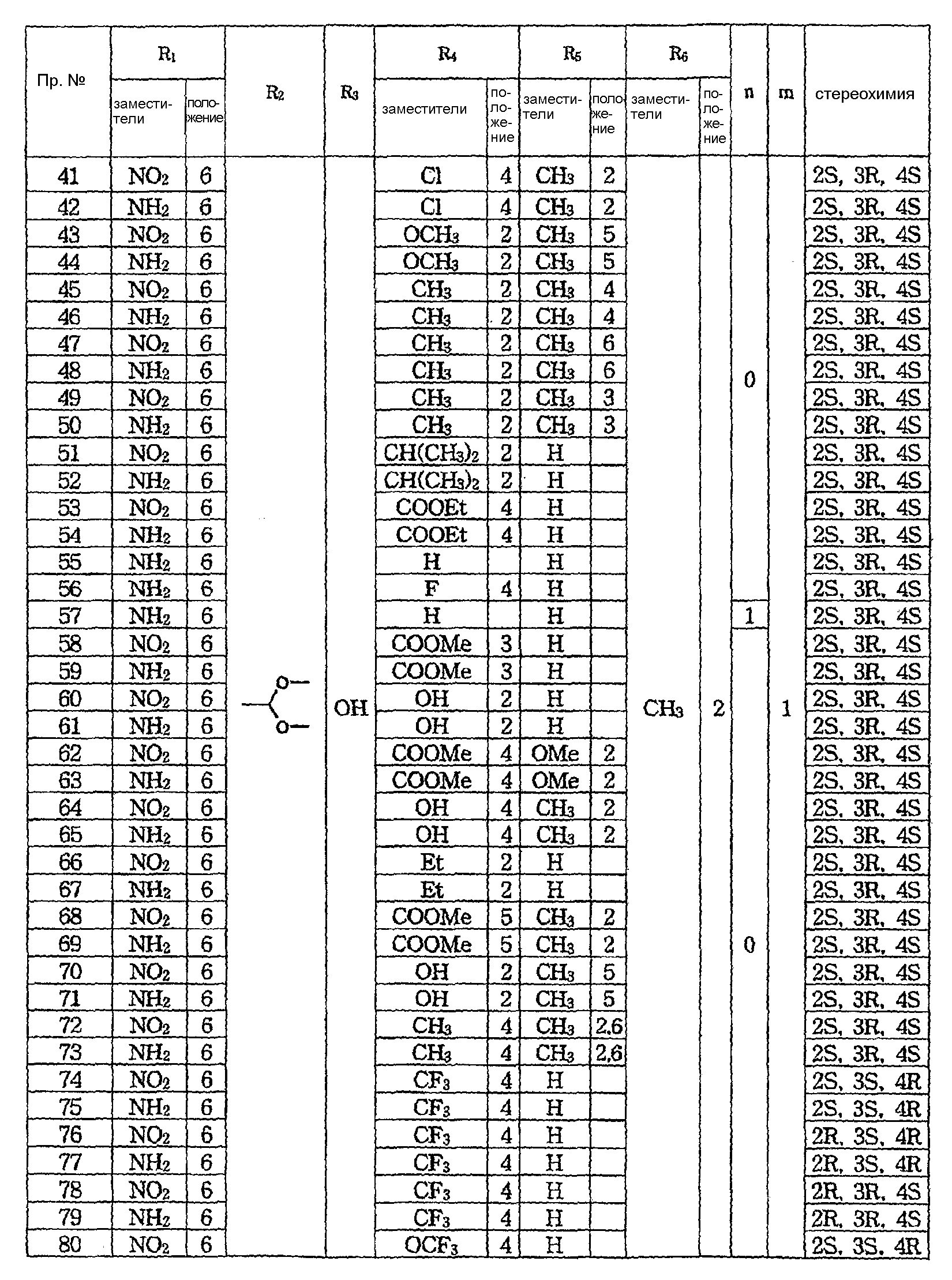
ТАБЛИЦА 1с

Эксперимент, подтверждающий фармакологическое действие соединений формулы 1 по настоящему изобретению, выполняли, как описано ниже.
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 1> Сосудорасширяющее действие на кровеносный сосуд, иссеченный у крыс
Эксперимент, подтверждающий, обладают ли соединения формулы 1 по настоящему изобретению сосудорасширяющим действием на кровеносный сосуд, выполняли, как описано ниже.
Крыс (350 ˜ 450 г, получены от the Experimental Animal Team of The Korea Research Institute of Chemical Technology) доводили до бессознательного состояния ударом в затылочную область, умерщвляли смещением позвонков и подвергали торактомии. После быстрого извлечения грудную аорту лишали жировой ткани и нарезали на аортные кольца шириной 3 мм. Аорту слегка вытирали ватным тампоном, смоченным в модифицированном буфере Krebs Henseleit (физиологический раствор) для удаления из нее внутреннего эпителиального слоя. При подвешивании в ванне для органов, содержащей физиологический буфер, васкулярной гладкой мышце давали возможность уравновешиваться при натяжении в состоянии покоя 2 г и затем выдерживали ее в течение 1 часа при 37°С для стабилизации, подавая карбоген, состоящий из 95% О2 и ˜ 5% СО2.
После этого васкулярную гладкую мышцу сокращали 10-5М фенилэфрином и промывали несколько раз физиологическим раствором. Указанную процедуру повторяли снова, чтобы обеспечить стабильную реакцию васкулярной гладкой мышцы к периодически повторяющемуся циклу сокращение/релаксация.
После этого применяли 3 х 10-6 М метоксамин для индуцирования интенсивного сокращения в васкулярной гладкой мышце. Когда вазоконстрикция, индуцированная метоксамином, достигала максимума и сохранялась на таком уровне, испытуемые соединения и контрольный материал кумулятивно добавляли к ванне для органа при концентрации 1, 3, 10 и 30 мкМ, соответственно, чтобы изучить сосудорасширяющее действие. Кромакалим, BMS-180448 (соединение формулы 4) и BMS-191095 (соединение формулы 5), известные как первые открыватели генерации КАТР с сильной сосудорасширяющей активностью, использовали в качестве контрольных материалов.
Изменение скорости сокращения добавлением лекарственных средств по сравнению с максимальным сокращением, индуцируемым метоксамином, вычисляют для нанесения на график для построения кривой зависимости концентрация-сокращение. При помощи метода наименьших квадратов линейного регрессионного анализа для каждого лекарственного средства была получена величина IC50, которая является концентрацией лекарственного средства, при которой васкулярная ткань сокращается до 50% степени максимального сокращения.
Как показано в приведенной выше таблице 2, кромакалим обнаруживал сильное сосудорасширяющее действие, имея IC50 0,067 мкМ, на извлеченной аорте крысы, сжатой метоксамином (3 мкМ), тогда как IC50 BMS-180448 и BMS-191095 были 1,38 мкМ и 2,14 мкМ, соответственно, что в двадцать и тридцать раз является более слабым действием по расширению сосудов, чем у кромакалина. С другой стороны, значения IC50 соединений настоящего изобретения варьировали от 5,59 мкМ до больше, чем 30 мкМ, так что их сосудорасширяющие действия были значительно слабее, чем действия контролей, кромакралина, BMS-180448 и BMS-191095.
Оказывая действия на КАТР, присутствующего в сердце, соединения по настоящему изобретению играют роль в защите сердца. С другой стороны, открыватели КАТР, действующие на КАТР, присутствующий в периферической васкулярной гладкой мышце, расширяют кровеносные сосуды, снижая кровяное давление. Гипотензия может маскировать любые кардиозащитные действия вследствие снижения давления при перфузии коронарной артерии и может ограничить пригодность при лечении ишемии миокарда. Таким образом, соединения настоящего изобретения могут быть более оптимальными в качестве кардиозащитных средств благодаря их слабой сосудорасширяющей активности.
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 2> Защитное действие, оказываемое против индуцированного железом повреждения нервных клеток
Эксперимент, подтверждающий, подавляют ли соединения формулы 1 по настоящему изобретению индуцированное железом повреждение нервных клеток, выполняли, как описано ниже.
Из головного мозга 17˜18-дневных эмбрионов выделяли кортикальные нервные клетки и затем их культивировали при 37°С в течение 7˜ 9 дней в инкубаторе с 5% СО2. Культуры указанных кортикальных клеток промывали дважды МЕМ (минимальной поддерживающей средой) для снижения уровня сыворотки до 0,2%. Испытуемые соединения серийно разводили четыре раза для получения конечной концентрации 30, 7,5, 1,875 и 0,469 мкМ, соответственно. Затем соединение с такой концентрацией предварительно обрабатывали в течение 30 мин, соответственно. Для эксперимента испытуемое соединение растворяли в ДМСО и разводили в среде. В это время конечная концентрация ДМСО не должна превышать 0,1%. Для контрольной группы применяли только наполнитель.
После указанной предварительной обработки к среде добавляли FeSO4, чтобы конечная концентрация была 50 мкМ. Среду культивировали в инкубаторе с СО2 в течение 24 часов. Во время инкубации под действием железа высвобождалась лактатдегидрогеназа (LDH). Уровень в сыворотке лактатдегидрогеназы, высвобождаемой в среду, измеряли для оценки некроза нервных клеток под действием окислительной токсичности железа. Защитное действие на нервные клетки испытуемых соединений оценивали вычислением степени снижения содержания LDH в группе обработки по сравнению со степенью снижения содержания LDH контрольной группы. Строили кривую зависимости концентрация-защитное действие и величину IC50, концентрацию лекарственного средства, соответствующую 50% максимального действия, вычисляли при помощи метода наименьших квадратов линейного регрессионного анализа. Результаты показаны ниже в таблице 3.
Как показано в таблице 3, соединения настоящего изобретения обладают защитным действием для индуцированного железом повреждения нервных клеток. Предпочтительно, IC50 соединений, полученных в примерах 11, 17, 31, 32, 54, 59, 61, 70, 75, 77, 79, 81, 82 и 85, были ниже 2 мкМ. Более предпочтительно, IC50 соединений, полученных в примерах 60 и 71, были ниже 1 мкМ. Таким образом, соединения настоящего изобретения обладают сильным защитным действием для индуцированного железом повреждения нервных клеток.
Поскольку производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, по настоящему изобретению обладают сильным защитным действием против индуцированной железом токсичности нервных клеток, они могут быть использованы в качестве агентов для профилактики или лечения неврологических нарушений, вызванных нейронным повреждением, таким как церебральный удар и деменция, а также воспалительного заболевания, такого как артрит, инфаркт сердечной мышцы и острое/хроническое повреждение ткани (S. Miranda et al., The role of oxidative stress in the toxicity induced by amyloid-peptide in Alzheimer's disease Progress in Neurobiology, 2000, 62, 633-648; S.A. Cook, P.H. Sugden, A. Clerk, Regulation of Bcl-2 Family Proteins During Development and in Response to Oxidative Stress in Cardiac Myocytes Association with Changes in Mitochondrial Membrane Potential Circulation Research, 1999, 85, 940-949; J.M. McCord, The Evolution of Free Radicals and Oxidative Stress. Am J Med, 2000, 108, 652-659).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 3> Защитное действие, оказываемое против повреждения нервных клеток, вызванного пероксидом водорода
Эксперимент, подтверждающий подавляют ли соединения формулы 1 по настоящему изобретению индуцированное пероксидом водорода повреждение нервных клеток, был выполнен, как описано ниже.
Выполняли такую же процедуру, как в примере 2, за исключением того, что концентрация добавленного испытуемого соединения была 30 мкМ, и конечная концентрация пероксида водорода была 30 мкМ. Результаты показаны в таблице 4.
Как показано выше, ссылочное соединение формулы 5 (BMS-191095) проявляло защитное действие (27%) при концентрации 30 мкМ. Однако соединение формулы 11 по настоящему изобретению имело высокую степень ингибирования (96%). Таким образом, производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, по настоящему изобретению имели защитное действие, сходное с действием обычных антиокислителей, таких как пропилгаллат и прометазин. Кроме того, соединения настоящего изобретения обладают сильным защитным действием против токсичности нервных клеток, индуцированной пероксидом водорода, они могут быть использованы в качестве терапевтического агента для профилактики или лечения неврологических нарушений, вызванных гибелью нейронов, индуцированной окислительным стрессом, индуцированного пероксидом водорода повреждения или некроза нейронов, таких как церебральный удар и деменция, а также воспалительного заболевания, такого как артрит, инфаркт сердечной мышцы и острое/хроническое повреждение ткани (S. Miranda et al., The role of oxidative stress in the toxicity induced by amyloid-peptide in Alzheimer's disease Progress in Neurobiology, 2000, 62, 633-648; S.A. Cook, P.H. Sugden, A. Clerk, Regulation of Bcl-2 Family Proteins During Development and in Response to Oxidative Stress in Cardiac Myocytes Association with Changes in Mitochondrial Membrane Potential Circulation Research, 1999, 85, 940-949; J.M. McCord, The Evolution of Free Radicals and Oxidative Stress. Am J Med, 2000, 108, 652-659).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 4> Ингибирующее действие, оказываемое против перокисления липидов, вызванного железом
Эксперимент, подтверждающий, подавляют ли соединения формулы 1 по настоящему изобретению индуцированное железом перокисление липидов, был выполнен, как описано ниже.
Головной мозг крысы гомогенизировали в буфере Кребса (15 мМ HEPES, 10 мМ глюкоза, 140 мМ NaCl, 3,6 мМ KCl, 1,5 мМ CaCl2, 1,4 мМ КН2РО4, 0,7 мМ MgCl2, рН 7,4), и супернатант, отделенный центрифугированием при 12000 об/мин в течение 10 мин, использовали для дальнейших экспериментов. Добавляли FeCl2 для достижения конечной концентрации 400 мкМ. Затем гомогенат головного мозга выдерживали при 37°С в течение 30 мин для содействия окислению. Каждое испытуемое соединение добавляли при концентрации 100 мкМ. Для контрольной группы использовали только наполнитель.
Железо способствует окислению указанного гомогената головного мозга с образованием малонового альдегида (MDA), продукта перокисления липидов. Таким образом, перокисление липидов определяли количественно при помощи MDA. Ингибирующее действие испытуемого соединения против перокисления липидов оценивали вычислением степени снижения содержания MDA, вызванного испытуемыми соединениями, по сравнению со степенью снижения содержания MDA контрольной группы.
Обычно количественное определение MDA достигали взаимодействием образцов с 2-тиобарбитуровой кислотой (ТВА) и измерением поглощения при 530 нм. Однако этот способ является непригодным для обработки образцов в большом масштабе вследствие стадии кипячения. Поэтому в этом эксперименте вместо ТВА использовали N-метил-2-фенилиндол. В этом случае одна молекула MDA взаимодействует с двумя молекулами N-метил-2-фенилиндола с образованием хромагена, который обнаруживает максимальное поглощение при 586 нм и не требует стадий кипячения. Набор BioxytechR LPO-586 использовали для количественного определения MDA. Результаты показаны ниже в таблице 5.
Как показано выше, соединения, полученные в примерах 10, 11, 22, 24, 26, 34, 57, 70, 71, 83, 85 и 108, обладали очень сильным ингибирующим действием против индуцированного железом перокисления липидов с более чем 90% ингибирующим действием. Кроме того, соединения, полученные в примерах 11, 17, 32, 54, 59, 60, 70, 71, 81 и 85, обладали одновременно ингибирующим действием против перокисления липидов, а также защитным действием против индуцированного окислительным стрессом повреждения нервным клеток под действием железа или меди (таблицы 3 и 4). Таким образом, соединения настоящего изобретения могут быть использованы в качестве терапевтического агента для профилактики или лечения неврологических нарушений, вызванных аккумуляцией продукта окисления с содействием перокислению липидов, таких как церебральный удар и деменция, а также воспалительное заболевание, такое как артрит, инфаркт сердечной мышцы и острое/хроническое повреждение ткани (Chul Lee, Antioxidant ability of caffein and its metabolites based on the study of oxygen radical absorbing capacity and inhibition of LDL peroxidation, Clinica Chimica Acta, 2000, 295, 141-154; P-E. Chabrier et al FBN 80933, a dual inhibitor of neuronal nitric oxide synthase and lipid peroxidationL A promising neuroprotective strategy. Pro. Natl. Acad Sci USA, 1999, 96, 10824-10829).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 5> Ингибирующее действие, оказываемое против перокисления липидов, индуцированного медью
Эксперимент, подтверждающий, подавляют ли соединения формулы 1 по настоящему изобретению индуцированное медью окисление липопротеинов низкой плотности (LDL), был выполнен, как описано ниже.
Липопротеин низкой плотности человека (LDL человека, sigma) растворяли в воде до конечной концентрации 1 мг/мл. Для удаления EDTA (этилендиаминтетрауксусной кислоты) водный раствор диализовали в фосфатном буфере при 4°С в течение 18 часов. В этом диализе фосфатный буфер заменяли три раза. Фосфатный буфер добавляли к LDL (100 мкг белка LDL/мл), из водного раствора которого была удалена EDTA, дополнительно к раствору добавляли 10 мкМ CuSO4 в качестве окислителя. Таким образом, конечная концентрация токоферола для испытуемых соединений и контрольного материала была 10-9, 10-7 и 10-5 М, соответственно. Группу, к которой CuSO4 не добавляли, использовали в качестве слепого опыта. Группу, к которой наполнитель добавляли вместо испытуемых соединений, использовали в качестве контрольного опыта. Смесь инкубировали при 37°С в течение 18 часов. 200 мкМ EDTA добавляли к смеси для прерывания реакции окисления.
Как показано в примере 4, Cu2+ способствует реакции окисления с образованием малонового альдегида (MDA), продукта перокисления липидов. Количественное образование MDA достигается взаимодействием образцов с 2-тиобарбитуровой кислотой (ТВА) и измерением поглощения у 530 нм. Кроме того, 1,1,3,3-тетраметоксипропан, приобретенный у sigma, использовали в качестве стандартного материала. Ингибирующее действие испытуемых соединений против липидного перокисления измеряли по количеству NMA (нмоль) на белок (мг). Вычисляли снижение MDA относительно снижения MDA контрольной группы. Результат показан в приведенной ниже таблице 6.
Как показано в таблице 6, соединение примера 11 настоящего изобретения обладало значительным ингибирующим действием против липидного перокисления, индуцированного медью, в зависимости от концентрации такого соединения. Кроме того, соединение настоящего изобретения обладало ингибирующим действием, в два раза превышающим ингибирующее действие токоферола (ссылочное соединение) при концентрации 10-5 М. Кроме того, соединение настоящего изобретения обладает ингибирующим действием, сходным с ингибирующим действием пробукола.
Поскольку производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, по настоящему изобретению обладают очень сильным ингибирующим действием против индуцированного медью липидного перокисления, они могут быть использованы в качестве агента для профилактики или лечения неврологических нарушений, вызванных аккумуляцией продукта окисления со способствованием липидному перокислению, таких как церебральный удар и деменция, а также воспалительное заболевание, такое как артрит, инфаркт сердечной мышцы и острое/хроническое повреждение ткани (Chul Lee, Antioxidant ability of caffein and its metabolites based on the study of oxygen radical absorbing capacity and inhibition of LDL peroxidation. Clinica Chimica Acta, 2000, 295, 141-154; P-E, Chabrier et al FBN 80933, a dual inhibitor of neuronal nitric oxide synthase and lipid peroxidation, A promising neuroprotective strategy. Pro. Natl. Acad Sci USA, 1999, 96, 10824-10829).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 6> Ингибирующее действие, оказываемое против аккумуляции реакционноспособных кислородных разновидностей, индуцируемой пероксидом водорода
Эксперимент, подтверждающий, подавляют ли соединения формулы 1 по настоящему изобретению индуцированные пероксидом водорода реакционноспособные кислородные разновидности, был выполнен, как описано ниже.
Для измерения содержания реакционноспособных кислородных разновидностей использовали H2DCFDA (диацетат 2',7'-дихлордигидрофлуоресцеина, Molecular Probes, Eugene, OR, USA). Если H2DCFDA, неполярный материал, переносится через клеточную мембрану, он превращается в H2DCF (2',7'-дихлордигидрофлуоресцеин), материал, непроницаемый для мембраны благодаря внутриклеточной эстеразе. Н2DCF превращается в весьма флуоресцентный DCF (2',7'-дихлорфлуоресцеин) посредством имеющего низкую флуоресценцию перокисленного кислорода или гидроксильного радикала. Раствор H2DCFDA (10 мМ), полученный растворением в ДМСО, использовали перед экспериментом. A7r5 (клеточная линия гладкой мышцы грудной аорты крысы, АТСС) в виде клеток гладкой мышцы инкубировали в DMEM (модифицированная по способу Дульбекко среда Игла), содержащей 10% FBS (фетальной бычьей сыворотки). После этого клетки инкубировали в 48-луночном планшете в течение двух дней, затем инкубировали в DMEM без сыворотки в течение 24 часов для использования для эксперимента. Буфер Krebs-linger (Krebs-Ringer (K-R), 99,01 мМ NaCl, 4,69 мМ KCl, 1,87 мМ CaCl2, 1,2 мМ MgSO4, 1,03 мМ К2НРО4, 25 мМ NaHCO3, 20 мМ Hepes, 11,1 мМ D-глюкоза, рН 7,4) использовали для промывания и процессинга клеточных монослоев. После удаления среды из клеточных монослоев каждое из испытуемых соединений (0,2 мл) предварительно обрабатывали средой, затем инкубировали при 37°С в течение 15 мин. Конечная концентрация была 50 мкМ, добавляли пероксид водорода. Среду выдерживали в течение 30 мин. Затем указанный раствор из среды удаляли. Среду промывали один раз. К среде добавляли 20 мкМ Н2DCFDA. Среду выдерживали в течение 30 мин. Среду промывали два раза. После этого окисление Н2DCFDA измеряли флуоресцентным планшет-ридером (FL600, Biotech Instruments, возбуждение у 485 нм, эмиссия у 530). Результаты показаны в таблице 7.
Если к клеткам A7r5 добавляли пероксид водорода, повреждение клеток индуцировалось реакционноспособными кислородными разновидностями, что приводило к повышению флуоресценции DCF. Однако повышение в флуоресценции DCF, индуцированное пероксидом водорода, ингибировали обработкой соединением формулы 11 настоящего изобретения доза-зависимым образом. Наиболее предпочтительно, флуоресценцию DCF полностью ингибировали обработкой 30 мкМ соединением формулы 11. Поскольку соединение формулы 11 настоящего изобретения обладало сильным ингибирующим действием против аккумулирования реакционноспособных кислородных разновидностей, индуцированного пероксидом водорода, они могут быть использованы в качестве терапевтического агента для профилактики или лечения неврологических нарушений, вызванных аккумуляцией продукта окисления с содействием липидному перокислению, таких как церебральный удар и деменция, а также воспалительное заболевание, такое как артрит, инфаркт сердечной мышцы и острое/хроническое повреждение ткани (G. J. Gross, J. R. Kersten, D.C. Warltier Mechanism of post ischemic contractile dysfunction Ann Thoar Sur, 1999, 68, 1898-1904; S. Okubo, Myocardial preconditioning: Basic concepts and potential mechanisms. Molecular and Cellular Biochemistry, 1999, 196, 3-12; I Cantuti-Castelvetri, B. Shukitt-HAle, J.A.Joseph, Neurobehavioral aspects of antioxidants in aging Int. J. Neuroscience, 2000, 18, 267-381).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 7> Защитное действие, оказываемое против повреждения головного мозга, индуцируемого процессом ишемия-реперфузия головного мозга
Эксперимент, подтверждающий, оказывают ли соединения формулы 1 по настоящему изобретению защитное действие против повреждения головного мозга, индуцируемого процессом ишемия-реперфузия, был выполнен, как описано ниже.
Самца крысы (крыса Sprague-Dawley, 350 ± 50 г, Samyook) анестезировали введением 40 мг/кг пентобарбитал натрия. Трубку РЕ-19 вставляли в бедренную вену и артерию, левую сонную артерию обнажали. Перед операцией в брюшинную полость инъецировали 20 мкг гепаринсульфата. Устройство для измерения кровяного давления вставляли в бедренную артерию для непрерывного измерения артериального давления. Кровь (10 мл) собирали из бедренной вены для снижения кровяного давления до 30 мм Hg. Если кровяное давление не снижалось до 100 мм Hg посредством сбора крови (7 мл), это означало, что симпатический тон является очень высоким. Указанный случай исключали из эксперимента, так как смертность крыс является высокой при кровяном давление 30 мм Hg или даже после успеха в снижении кровяного давления, эти крысы обнаруживали высокую смертность после операции.
При кровяном давлении, поддерживаемом при 30 мм Hg, левую сонную артерию закрывали зажимом для аневризмы на 20 мин для индуцирования ишемии. Реперфузию выполняли собранной кровью и 0,84% бикарбонатным физиологическим раствором (5 мл). Температуру тела крыс во время ишемии поддерживали постоянной в пределах 37 ± 0,5°С посредством применения термического покрытия и электрических осветительных ламп. После операции в период восстановления температуру тела поддерживали постоянной в течение более чем 2 часов. Если крысы восстанавливались полностью, их переносили в лабораторию для животных. Условия в лаборатории для животных, такие как температура, влажность и световой цикл, поддерживали постоянными на уровне 27°С, 60% и 12-21 часов, соответственно.
Через 24 часа после операции крыс умерщвляли. Затем в пределах 3 мин у крыс энуклеировали головной мозг. Энуклеированный головной мозг иссекали на льду на секции с интервалом 2 мм с использованием матрикса головного мозга для получения шести венечных срезов. Указанные венечные срезы окрашивали в 2 % растворе хлорида 2,3,5-трифенилтетразолия при 37°С в течение 30 мин. Указанную окрашенную венечную секцию проявляли и помечали номерами. После этого отношение площади некроза к площади головного мозга измеряли с использованием анализатора изображения.
В противном случае испытуемые соединения вводили четыре раза в брюшную полость при дозе 30 мг/кг. В частности, испытуемые соединения вводили за 30 мин до операции, а также через 2, 4 и 16 часов после закрытия сонной артерии. Для контрольной группы вместо испытуемых соединений вводили только наполнитель. В сравнительной группе крысам вводили гидромалеат (5R,10S)-(+)-5-метил-10,11-дигидро-5Н-дибензо[a,d]циклогептен-5,10-имина (МК 801) в качестве неконкурирующего NMDA (N-метил-D-аспартата).
Защитное действие, оказываемое против повреждения головного мозга, индуцируемого процессом ишемия-реперфузия головного мозга, оценивали вычислением уменьшения площади некроза относительно площади некроза головного мозга контрольной группы. Результаты показаны в таблице 8.
Как показано в таблице 8, объем инфаркта сравнительной группы, которой вводили МК 801 при дозе 30 мг/кг, был 29,8%, что составляло снижение объема инфаркта на 24,8% относительно объема инфаркта контрольной группы.
В другом случае объем инфаркта испытуемой группы, которой вводили соединение формулы 11 при дозе 30 мг/кг, был 21,5%, что составляло снижение объема инфаркта на 46,3% относительно объема инфаркта контрольной группы. Таким образом, соединение настоящего изобретения имело защитное действие против повреждения головного мозга, индуцированного процессом ишемия-реперфузия головного мозга, в два раза выше, чем имело ссылочное соединение МК 801.
Кроме того, в группе, обработанной МК 801, в качестве сравнительной группы наблюдали побочное действие, такое как снижение подвижности у крыс. Однако в группе, которой вводили соединение формулы 11, побочные действия, включающие изменения в подвижности, не наблюдали. Как показано в таблице 2, вследствие слабого сосудорасширяющего действия (IC50 > 30 мкМ) соединения настоящего изобретения побочное действие, индуцированное снижением перфузии в ишемический головной мозг, значительно снижалось.
Поскольку производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, обладают превосходным защитным действием против повреждения головного мозга, индуцируемого процессом ишемия-реперфузия головного мозга, они могут быть использованы в качестве агентов для профилактики или лечения заболевания, вызванного повреждением головного мозга, такого как церебральный удар и деменция (E.V. Golanov, J.D. Christensen, D.J. Reis, Role of Potassium Channels in the central neurogenic neuroprotection elicited by cerebellar stimulation in rat. Brain Research, 1999, 842, 496-500).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 8> Защитное действие, оказываемое против ишемического-гипоксического повреждения головного мозга
Эксперимент, подтверждающий, оказывают ли соединение формулы 1 настоящего изобретения защитное действие против ишемического-гипоксического повреждения головного мозга, был выполнен, как описано ниже, с использованием СМР (спектра магнитного резонанса).
Описано, что в ишемической-гипоксической модели крыс результат гистологического испытания в значительной степени коррелировал с изменением спектра магнитного резонанса. С использованием указанного описания было исследовано защитное действие, оказываемое против повреждения головного мозга, индуцированного гипоксией in vitro. [Van der A. Toorn et al. Magnetic Resonance in Medicine, 1996, 36, 914-9220]. Описано, что пик липида увеличивался в СМР из-за повреждения ишемических нервных клеток вследствие деструкции клеточной мембраны, включая гематоэнцефалический барьер. Кроме того, описано, что повышение концентрации липидов коррелировало с апоптозом. [A. Bizzi et al., Magnetic Resonance Imaging, 1996, 14, 581-592]. Таким образом, было описано, что отношение липид/NAA и липид/Cr, полученное сравнением липида с N-ацетиласпартатом (NAA) и креатином (Cr) в качестве маркера нервной клетки, коррелировало с морфологическими изменениями и тяжестью апоптоза при гипоксическом повреждении головного мозга.
У новорожденных крыс (возраст 7 дней, 10 ˜ 15 г) левую сонную артерию перекрывали на 3 часа для индуцирования гипоксии. Испытуемые соединения инъецировали внутрибрюшинным способом за 1 час до гипоксии. Левый глаз, сонную артерию которого перекрывали, использовали в качестве ишемической-гипоксической модели, правый глаз, сонную артерию которого не перекрывали, использовали в качестве гипоксической модели. Спектр магнитного резонанса получали от двух моделей после гистологического испытания, выполняемого через один день после повреждения. Из указанного результата вычисляли отношение липид/NAA или липид/Cr. Кроме того, вычисляли жизнеспособность и морфологический показатель макроскопическим обследованием объема инфаркта. Результаты показаны в таблице 9.
Как показано в таблице 9, соединение формулы 11 настоящего изобретения снижает отношение Лип./NAA и Лип./Cr, полученное из спектра магнитного резонанса на ишемической-гипоксической или гипоксической модели новорожденной крысы, не менее чем в два раза или три раза относительно отношения контрольной группы, соответственно. Таким образом, соединение настоящего изобретения обладает защитным действием, оказываемым против повреждения головного мозга. Кроме того, сравнение жизнеспособности показало, что соединение формулы 11 значимо повышало жизнеспособность, более чем до 79% жизнеспособности контрольной группы (50%). Соединение формулы 11 снижало морфологическую оценку, полученную из макроскопического обследования объема инфаркта, в два раза в сравнении с морфологической оценкой контрольной группы.
Так как производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, по настоящему изобретению обладают защитным действием, оказываемым против повреждения головного мозга, индуцируемого ишемией-гипоксией или гипоксией, следовательно, соединение настоящего изобретения может быть использовано в качестве агента для профилактики или лечения гипоксии новорожденных (С. C Huang et al Measurement of the urinary laktate:creatinine ratio for the early identification of newborn infants at risk for hypoxic-ischemic encephalopathy. New England J. Of Medicine, 1999, 341 (5), 328-335).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 9> Защитное действие, оказываемое против повреждения нервных клеток аксотомией зрительного нерва
Эксперимент, подтверждающий, оказывает ли соединение формулы 1 по настоящему изобретению защитное действие, оказываемое против повреждения нервных клеток, индуцируемого аксотомией глазного нерва, был выполнен, как описано ниже.
Испытуемые соединения растворяли в ДМСО для получения исходного раствора (100 мМ), который разводили физиологическим раствором до 20 мкМ. 10 мкл исходного раствора инъецируют в стеклянное тело.
Взрослых крыс анестезировали хлоральгидратом (400 мг/кг), затем глазной нерв обнажали конъюнктивой глазного яблока. После этого делали надрез нерва на расстоянии, соответствующем 0,5 мм или 3 мм от глазного яблока, соответственно. Или через верхнее веко выполняли ампутацию кожи, затем удаляли часть слезной железы. На глазном яблоке переднюю прямую мышцу иссекали в глазных мышцах для обнажения глазного нерва. Глазной нерв иссекали приблизительно на расстоянии 5 мм за глазным яблоком. Кровеносные сосуды сетчатки глаза, снабжающие кровью сетчатку, не повреждали. Состояние кровеносных сосудов сетчатки контролировали офтальмоскопом. Фторозолото (Fluorochrome Inc., 5% раствор в PBS (растворе с фосфатным буфером)) вводили половине крыс испытуемой группы при движении назад после аксотомии зрительного нерва. Для исследования выживания клеток ганглий после аксотомии глаза у крыс удаляли, затем сетчатку выделяли через 3 дня, 1 неделю, 2 недели, 4 недели, 2 месяца, 4 месяца и 6 месяцев. Выделенную сетчатку изучали трансмиссионным электронным микроскопом. Для количественного анализа в то же самое время получали ткань сетчатки. Полученную ткань исследовали иммунохимическим окрашиванием или флуоресцентным микроскопом, к которому смонтирован 530 ˜ 560 нм фильтр. Результаты показаны в таблице 10.
Как показано в таблице 10, после аксотомии зрительного нерва степень выживания ганглиозных клеток сетчатки относительно контрольной группы была 22%. Однако степень выживания ганглиозных клеток сетчатки из группы испытания, которой соединение формулы 11 вводили при концентрации 20 мкМ, было 43%. Таким образом, соединение формулы 1 значительно повышало степень выживания.
Поскольку производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, обладают защитным действием, направленным против гибели ганглиозных клеток сетчатки из-за повреждения, индуцированного аксотомией зрительного нерва, они могут быть использованы в качестве агента для профилактики или лечения глаукомы, индуцированной повреждением ганглиозных клеток (Р. Hardy et al. Oxidant, nitric oxid and prostanoids in the developing ocular Vasculature: a basis for ischemic retinopathy Car diovascular Research, 2000, 47, 489-509).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 10> Влияние на скорость проводимости двигательного нерва у диабетических крыс
Эксперимент, подтверждающий, улучшают ли соединения формулы 1 скорость проводимости ослабленного двигательного нерва у диабетических крыс, был выполнен, как описано ниже.
Диабет индуцировали инъекцией крысам стрептозотоцина (65 мг/кг), затем перорально вводили один раз в день испытуемое соединение, растворенное в 2 мл среды (смесь физиологический раствор: этанол: твин 80, 1:1:1). Крыс анестезировали пентоталом, затем седалищный нерв обнажали для измерения скорости проводимости двигательного нерва. Нерв стимулировали в двух точках. Первый стимулирующий электрод вставляли у проксимального конца и второй стимулирующий электрод вставляли у дистального надреза. Коаксиальный игольчатый электрод вставляли в межпальцевую мышцу, затем потенциал действия мышцы индуцировали стимуляцией в двух точках. Скорость проводимости вычисляли делением расстояния между двумя точками стимула на различия в латентном состоянии. Липоевую кислоту (100 мг/кг) использовали для сравнения с соединением настоящего изобретения в восстановлении нарушенной скорости проводимости двигательного нерва (MNCV) у диабетических крыс. Восстановление (%) проводимости двигательного нерва вычисляли по следующей математической формуле 1. Результаты показаны в таблице 11.
МАТЕМАТИЧЕСКАЯ ФОРМУЛА 1

Как показано в таблице 11, MNCV диабетических крыс были значительно пониженными по сравнению с MNCV группы нормальных контрольных крыс. Введение соединения формулы 11 при дозе 50 мг/кг значительно повышало MNCV у диабетических крыс.
Поскольку производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, по настоящему изобретению повышают MNCV у диабетических крыс, они могут быть использованы в качестве агента для профилактики или лечения диабетической невропатии или диабетического нарушения периферических нервов (K. Naka et al. Effects of stazol on development of experimental diabetic neuropathy: functional and structural studies, and Na+-K+ -ATPase acidity in peripheral nerve in rats with streptozocin-induced diabetes. Diabetes Res. and Clinical Practice, 1995, 30, 153-162).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 11> Ингибирующее действие на продуцирование NO
Эксперимент, подтверждающий, обладают ли соединения формулы 1 ингибирующим действием на образование NO (оксид азота), был выполнен, как описано ниже.
С использованием среды RPMI1640, дополненной 10% фетальной бычьей сывороткой (FBS), клетки RAW 264.7 (получены от American Type Culture Collection), клеточную линию мышиных макрофагов, культивировали при 37°С в инкубаторе с 5% СО2. Клетки RAW 264,7 собирали и плотность клеток регулировали до 5 х 105 клеток/мл средой RPMI1640, дополненной 0,5% FBS, и высевали при плотности 5х104 клеток/лунку в 96-луночном планшете, клетки затем культивировали в течение 20 часов в СО2-инкубаторе. После удаления среды клетки предварительно обрабатывали в течение 1 часа свежей средой, содержащей 30 мкМ. Испытуемые соединения растворяли в ДМСО и разводили до соответствующей концентрации в среде. Чтобы минимизировать влияние ДМСО на образование оксида азота клетками RAW 264.7, в лунках делали так, чтобы среда содержала ДМСО при концентрации 0,1% или ниже.
После завершения одночасовой предварительной обработки для активации клеток добавляли липополисахарид (E. coli, серотип 055:В5) при конечной концентрации 1 мкг/мл, клетки выдерживали в течение 24 часов в СО2 -инкубаторе. В результате активации клеток RAW 264.7 при помощи LPS происходило образование NO. Высвобождение NO в среду происходило в форме нитрита (NO2-) и количественное измерение NO проводили с использованием реагента Griess. Контрольную группу обрабатывали только наполнителем вместо испытуемых соединений. При использовании нитритного стандарта было показано, что испытуемые лекарственные средства сами не препятствуют количественному определению NO.
Ингибирующее действие испытуемых соединений против образования NO определяли как снижение количества NO по сравнению с количеством NO контрольной группы. Результаты показаны в таблице 12.
Как показано в таблице 12, производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, по настоящему изобретению обладают ингибирующим действием, проявляемым против образования NO, индуцируемого эндотоксином, таким как LBS. Предпочтительно, соединения, полученные в примерах 29, 45, 58, 60 и 70, обладают ингибирующим действием, составляющим более чем 75% при концентрации 30 мкМ. Наиболее предпочтительно, соединения, полученные в примерах 51 и 53, обладают ингибирующим действием, составляющим более, чем 90% при такой же концентрации.
Поскольку производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, по настоящему изобретению обладают ингибирующим действием, проявляемым против образования NO, они могут быть использовано в качестве агента для профилактики или лечения неврологических нарушений, вызванных избыточным образованием NO, таких как церебральный удар и деменция, а также воспалительного заболевания, такого как артрит, инфаркт сердечной мышцы и острое/хроническое повреждение ткани (J.F. Kerwin Jr. Nitric Oxide: A New Paradigm for second Messengers J. Med. Chem, 1995, 38, 4343-4362).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 12> Кардиозащитное действие на моделях ишемического сердца крыс
Эксперимент, подтверждающий, обладают ли соединения формулы 1 защитным действием (антиишемическим действием) на ишемическое сердце, был выполнен, как описано ниже.
Самцов крыс (300 ˜ 450 г, получены из experimental animal team of the Korea Research Institute of Chemical Technology) анестезировали внутрибрюшинной инъекцией натрийпентабарбитала при дозе 100 мг/кг. Гепарин (1000 Е/кг) инъецировали в хвостовую вену и затем сердце энуклеировали. Конкретно, в этот орган вставляли канюлю (РЕ 240). Крыс подвергали искусственной вентиляции легких с помощью автоматического дыхательного аппарата для крыс, in situ в их аорты вставляли канюлю для аорты. При обратной реперфузии сердце у них энуклеировали, затем сразу помещали на аппарат Ландендорфа. Ткань, присоединенную к сердцу, удаляли. Через сердце перфузировали насыщенный кислородом, модифицированный бикарбонатный буфер Krebs-Henseleit (состав в мМ/л: 116 NaCl, 4,7 KCl, 1,1 MgSO4, 1,17 KH2PO4, 24,9 NaHCO3, 2,52 CaCl2, 8,32 глюкоза, 2,0 пируват) при постоянном давлении перфузии (85 мм Hg). Металлическую канюлю, присоединенную к латексному баллону, заполненному растворителем (этанол:вода, 1:1 (об./об.)), водили в левый желудочек через легочную вену и соединяли с изоволюметрическим датчиком давления (H.S.E., Germany) для измерения левого вентрикулярного давления (LVP). Сердцу давали возможность уравновеситься в течение 15 мин, и в это время левое вентрикулярное конечное диастолическое давление (EDP) регулировали до 5 мм Hg и этот объем баллона сохраняли на протяжении всего эксперимента.
Измеряли базовую сердечную сократительную функцию, частоту сердечных сокращений (HR) и коронарный кровоток (CF). Сердечную сократительную функцию вычисляли вычитанием LVSP (левого вентрикулярного пикового систологического давления) из LVEDP (левого вентрикулярного конечного диастолического давления), получая при этом LVDP (левое вентрикулярное развиваемое давление). Двойное произведение RPP (произведение частота-давление) (DP), другой важный параметр для косвенного определения сердечной активности в сердце Ландердорфа, непригодный для измерения минутного сердечного выброса, вычисляли умножением HR на LVDP.
На протяжении всего эксперимента общий коронарный кровоток измеряли посредством использования зонда коронарного кровотока (диаметр: 1,0 мм), установленного в аортной канюле с электромагнитным измерителем скорости кровотока. Температуру сердца поддерживали постоянной погружением сердца в физиологический раствор с температурой 37°С, к которому постоянно подавали газообразную смесь 95% О2/5% СО2. После стабилизации в течение 15 мин сердце предварительно обрабатывали в течение 10 мин наполнителем (0,04% ДМСО) или смесью, содержащей соединение настоящего изобретения или контрольный материал. После этого повторно измеряли сердечную сократительную функцию, HR и CF. Общую ишемию индуцировали полным выключением перфузата в течение 30 мин. Тяжесть ишемии определяли как время до контрактуры (ТТС, мин) во время общей ишемии, где наблюдали первое 5 мм Hg повышение в EDP. Затем сердце подвергали реперфузии и спустя 30 мин повторно измеряли сократительные функции (LVDP, HR и CF). После выполнения реперфузии в течение 30 мин уровень LDH (лактатдегидрогеназы) измеряли как коэффициент чувствительности на потерю жизнеспособности клеток с использованием набора. Результаты показаны в таблице 13.
В группе, обработанной наполнителем, DP реперфузии (LVDP X HR), индекс для функции сократительности, снижался до 23,0% DP перед предварительной обработки, а EDP увеличивался от 5 мм Hg до 43,3 мм Hg и ТТС было 20,3 мин, и высвобождение LDH при реперфузии было 29,9 мкг/г, как показано выше.
У группы, обработанной BMS-180448, функция реперфузионной сократительности (DP, LVDP x HR) была 67,6% от DP предварительной обработки, которая значительно повышалась по сравнению с группой, обработанной наполнителем. EDP было 16,5 мм Hg, значительно ниже, чем контрольное, и ТТС было 27,8 мин, пролонгированное по сравнению с контрольным, и высвобождение LDH при реперфузии было 17,2 Е/г, т.е. более высокое, чем контрольное. В таком случае все параметры группы, обработанной BMS-180448, обнаруживали значительное защитное действие на ишемическое сердце.
При сравнении только антиишемического действия среди этих параметров, сердечной сократительной функции, EDP, TTC и высвобождения LDH, соединения настоящего изобретения были сходными с BMS-180448 или превосходили его. Однако, поскольку соединения настоящего изобретения обладают исключительно низким сосудорасширяющим действием, чем доза BMS-180448, они значительно превосходят такое общепринятое лекарственное средство в кардиоселективной антиишемической активности. Соединение примера 30 обнаруживало особенно хорошее кардиозащитное действием при том, что сократительная функция (LVDP x HR) повышалась до 64, 7% индекса перед обработкой и EDP был 17,0 мм Hg и ТТС было 27,9 мин, а уровень высвобождения LDH при реперфузии был 17,7 Г/г, при очень низкой сосудорасширяющей активности. Таким образом, это соединение обнаруживает лучшую кардиоселективность при слабом сосудорасширяющем действии, чем BMS-180448. Следовательно, соединения настоящего изобретения могут быть использованы для лечения ишемического заболевания сердца благодаря их превосходной селективности и защитной активности против ишемического сердечно-сосудистого заболевания. Кроме того, соединения, полученные в примерах 1, 11 и 32 настоящего изобретения, обладали превосходным защитным действием, проявляемым против повреждения клеток, вызываемого реперфузией после ишемии посредством снижения высвобождения LDH при реперфузии.
Поскольку производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, по настоящему изобретению обладают защитным действием на сердце при ишемии, похожим на такое действие BMS-180448 или превосходящим его, кроме того, они обладают, что более предпочтительно, более низким сосудорасширяющим действием по сравнению с BMS-180448, они могут быть использованы в качестве агента для профилактики или лечения инфаркта сердечной мышцы, сердечной недостаточности или стенокардии благодаря их превосходной селективности и защитной активности (T. Miura etal. Roles of Mitochondrial ATP-sensitive К Channels and PKC in Anti-lnfarct Tolerance afforded by Adenosine Al receptor Activation. J Am Coll Cardiol, 1999, 35, 238-45; D. J. Chambers, D. J. Hearse Developments in Cardioprotection: "Polarized" Arrest as an Alternative to "Depolarized" Arrest Ann. Thorc. Surg, 1999, 68, 1960-6).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 13> Ингибирующее действие, проявляемое против образования трубочек HUVEC
Эксперимент, подтверждающий, обладают ли соединения формулы 1 ингибирующим действием, проявляемым против образования трубочек HUVEC, был выполнен, как описано ниже.
HUVEC (эндотелиальные клетки пупочной вены человека) культивировали и «тубулогенез» (образование трубочек) в васкулярных эндотелиальных клетках индуцировали помещением их на поверхность матригеля на несколько часов. Влияние испытуемых соединений на образование трубочек сравнивали с обработанной наполнителем контрольной группой, затем их антиангиогенное действие подтверждали непосредственно in vitro. Результаты показаны в таблице 14.
Как показано в таблице 14, происходило ингибирование образование трубочек HUVEC концентрация-зависимым образом при концентрации 10 мкМ и сильное ингибирование происходило при концентрации 100 мкМ в случае соединения, полученного в примере 2. Кроме того, соединение, полученное в примере 28, обладало ингибирующим действием, проявляемым против образования трубочек, при этом подавляя ангиогенез.
Поскольку производные бензопирана, замещенные вторичным амином, содержащим тетразольную группу, по настоящему изобретению обладают сильным ингибирующим действием против ангиогенеза, они могут быть использованы для лекарственного лечения различных заболеваний, относящихся к ангиогенезу, таких как ревматоидный артрит, псориаз, осложнение при СПИДЕ, раковые заболевания, диабетическая ретинопатия и т.п. (P. A. Burke, S.J. DeNardo Antiangiogenic agents and their promising potential in combined therapy. Critical Reviews in Oncology/Hematology, 2001, 39, 155-171).
<ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 14> Испытание на крысах на острую пероральную токсичность
Эксперимент, подтверждающий, обладает ли соединение формулы 1 настоящего изобретения острой пероральной токсичностью, был выполнен, как описано ниже.
В этом испытании шестинедельных крыс SPF SD использовали с распределением по группам. Каждая группа состояла из двух крыс. Соединения, полученные в примерах 1, 7, 11, 17, 22, 24, 26, 28, 30, 32, 34, 42, 52, 54, 55, 56, 57, 59, 60, 61, 70, 75, 77, 79, 81, 83, 85 и 89, суспендировали в 0,5% метилцеллюлозе, соответственно. Затем суспензии вводили перорально при разовой дозе 1 г/кг/15 мл. После введения животных обследовали на клинические симптомы токсичности или смертность и измеряли изменение массы тела. Кроме того, выполняли гематологическое испытание и биохимический анализ. После умерщвления животных проводили аутопсию для макроскопического обследования органов и тканей. В результате этого не наблюдали значительных изменений в клинических симптомах, массе тела и смертности. Кроме того, не наблюдали изменений в гематологии, химических параметрах сыворотки, макроскопическом обследовании и изменений, связанных с лекарственным средством. В результате все подвергнутые испытанию соединения не проявляли токсичность на крысах при дозе до 2 г/кг, и было определено, что летальная доза (LD50) для перорального введения составляет свыше 2 г/кг.
Реферат
Изобретение относится к новым производным бензопирана, замещенным вторичными аминами, включающими в себя тетразол, их стереоизомерам или их фармацевтически приемлемым солям
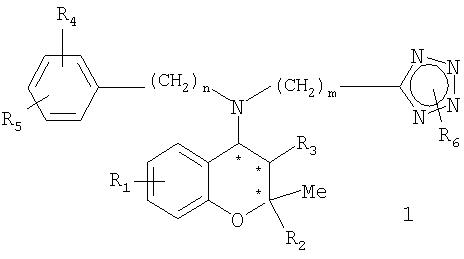


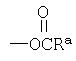


Формула



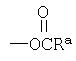



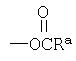

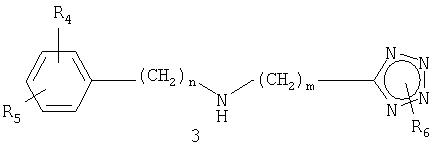



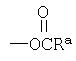



Комментарии