Производные n-(4-пиперидинил)(дигидробензофуран или дигидро-2н-бензопиран)-карбоксиамида или их соли, или их стереоизомеры, способы их получения, промежуточные соединения для них, фармацевтическая композиция на основе производных n-(4-пиперидинил)(дигидр - RU2070884C1
Код документа: RU2070884C1
Чертежи

Описание
Изобретение касается новых производных N-(4-пиперидинил) (дигидробензофуран или дигидро-2Н-бензопиран) карбоксиамида, обладающих способностью стимулировать гастрокишечную систему, также изобретение касается способа получения указанных соединений, фармацевтических композиций на их основе и промежуточных соединений для получения указанных производных.
Известен ряд производных замещенного /3-гидрокси-4-пиперидинил/бензамида, используемых в качестве стимуляторов активности гастрокишечных систем ЕР-А-0, 076, 530, ЕР-А-0,299, 566 и ЕР-А-0,309, 043, В ЕР-А-0,307, 172, ЕР-А-0,124, 783, ДЕ-3,702,005, ЕР-А-0,147,044 ЕР-А-0,234,872 и US-4,772,459.
Известны производные бензофурана, бензопирана и бензоксипина, в которых атом азота может быть замещенным алкиламино-группой или моно- или бициклическим гетерокольцом в алкильной цепочке (ЕР-А-0,234,872, US-4772459). Эти соединения могут быть использованы в качестве антирвотных, антипсихических или нейролептических веществ.
Задачей изобретения является создание новых производных N-(4-пиперидинил)(дигидробензофуран или дигидро-2Н-бензопиран)-карбоксиамида, способных активно стимулировать гастрокишечную систему, а также новых промежуточных соединений для получения указанных выше производных, а кроме того, создание новой фармацевтической композиции, используемой для лечения нарушений гастрокишечной системы.
Задача достигается новыми производными N-(4-пиперидинил)(дигидробензофуран или дигидро-2Н-бензопиран)-карбоксиамида общей формулы I.
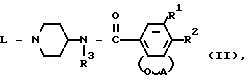
где А радикал формулы:
-CH2-CH2 (a-1),
-CH2-CH2-CH2- (a-2) или
-CH2-CH2-CH2-CH2 (a-3),
в которых один или два атома водорода могут быть замещены С1-6 алкилом;
R1 атом водорода или галогена;
R2 атом водорода, амино- или моно (С1-6алкил) аминогруппы;
R^ атом водорода или C1-6 алкил;
L C3-6 циклоалкил, C3-6 алкенил, в случае необходимости замещенный арилом, или L радикал формулы:
Alk R4 (b-1)
Alk-X-R5 (b-2) или
Alk-Y-C(=O)-R7 (b-3),
в которых каждый Alk является С1-6 алкандиил; и
R4 атом водорода, циан, С3-6 циклоалкил, арил, ди(арил)-метил или Het;
R5 атом водорода, С1-6 алкил, гидрокси С1-6 алкил, С3-6 циклоалкил, арил или Het;
Х является О или NH;
R7 атом водорода, С1-6 алкил, арил, С1-6 алкилокси- или гидроксигруппа;
Y является NR8 или прямая связь, указанный R8 атом водорода или арил; каждый арил незамещенный фенил или фенил, замещенный 1-3 заместителями каждый, независимо выбранный из атома галогена или С1-6 алкилоксигруппы и каждый Het тетрагидрофуранил, 1,3-диоксоланил, замещенный С1-4 алкилом; 3,4-дигидро-1(2Н)-бензопиранил; пиперидинил; пиридинил, в случае необходимости замещенный группой NC; пиразинил, замещенный С1-4 алкилом; индолил; 2,3-дигидро-2-оксо-1Н-бензимидазолил, при необходимости замещенный С1-4 алкилом; 2-оксо-1-имидазолидинил, замещенный С1-4 алкилом; 3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-ил, замещенный тремя С1-4 алкилоксигруппами; 1-оксо-2(1Н)-фталазинил; 2,3-дигидро-5-оксо-5Н-тиазол-[3, 2-a]пиримидин-6-ил, замещенный С1-4 алкилом; 5-оксо-5Н-тиазол-[3,2-a]пиримидин-6-ил, замещенный С1-7 алкилом; 1,6-дигидро-6-оксо-1-пиридазинил, замещенный С1-4 алкилом или атомом галогена; или 1,2,3,4-тетрагидро-2,4-диоксо-3-хиназолинил или их солями или их стереоизомерами.
Данные соединения получают путем N-алкилирования соединения формулы II
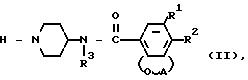
где R1, R2, R3 и А имеют вышеуказанные значения, соединением формулы L W (III),
где L имеет вышеуказанные значения, а W атом галогена или сульфонилоксигруппа в среде инертного растворителя, в случае необходимости, в присутствии основания и/или соли йода, и выделяют целевой продукт в свободном виде или в виде терапевтически активной нетоксичной соли обработкой основания соответствующей кислотой или обратно превращают соль в свободное основание обработкой щелочью, и/или соединение формулы I, содержащие функциональную гидроксигруппу, может быть О-алкилировано действием соответствующего алкилирующего агента в присутствии основания и растворителя, или соединение формулы I, несущее защитное диоксалановое кольцо, может быть деацетилировано до соответствующих оксо-соединений действием кислой водной среды, или соединение формулы I, содержащее в качестве заместителей CN группу, может быть превращено в соответствующий амин действием водорода в присутствии соответствующего катализатора, при необходимости, в присутствии основания, или соединение формулы I, содержащее аминогруппу, может быть алкилировано действием соответствующего алкилирующего агента, или соединение формулы I, содержащее аминогруппы, может быть получено путем обработки карбамата основанием, или соединение формулы I, содержащее эфирные группы, может быть превращено в соответствующую карбоксильную кислоту обработкой водной щелочью или водным кислотным раствором.
N-алкилирование проводят в инертных растворителях, таких как вода, ароматические углеводороды, бензол, метилбензол, диметилбензол, хлорбензол, метоксибензол, и др. а также спирты, например метанол, этанол, 1-бутанол и др. галогенпроизводные углеводородов, например дихлорметан, трихлорметан и др. сложные эфиры, этилацетат, γ-бутиролактон и др. кетоны: 2-пропанон, 4-метил-2-пентанон и др. пpостые эфиры: 1,4-диоксан, 1,1'-оксибисэтан, тетрагидрофуран и др. полярные растворители: N,N-диметилформамид, N,N-диметилацетамид, диметил-сульфоксид, гексаметилфосфорный триамид, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон, 1,3-диметил-2-имидазолидинон, 1,1,3,3-тетраметилмочевина, нитробензол, 1-метил-2-пирролидинон и др. а также смеси этих растворителей.
Введение соответствующих оснований, таких как щелочи, карбонаты щелочноземельных металлов, гидрокарбонаты, карбоксилаты, амиды, оксиды, гидроксиды или алкоксиды, например карбонат натрия, гидрокарбонат натрия, карбонат калия, окись кальция, ацетат натрия, амид натрия, гидроксид натрия, метоксид натрия и др. или органических оснований, например амины, N,N-диметил-4-пиридинамин, N, N-диэтилэтанамин, N-(1-метилэтил)-2-пропанамин, 1,4-диазобицикло (2,2,2) октан, 4-этилморфолин и др. нейтрализуют кислоты в процессе реакции. В некоторых случаях используют соли иодидов, преимущественно иодиды щелочных металлов или эфиров. Перемешивание и незначительное повышение температуры может увеличить скорость реакции. Дополнительно можно провести N-алкилирование в инертной атмосфере (кислород-аргон или азот). Альтернативно N-алкилирование проводят при перемешивании реагентов в присутствии оснований, в соответствующей инертной атмосфере и в присутствии катализатора, например триалкилфенилметиламмония, тетралкиламмония, тетраалкилфосфония, тетраарилфосфоний-галоида, гидроксида, гидросульфата и др.
Продукты реакции выделяют из реакционной смеси и, если необходимо, в дальнейшем очищают путем экстракции, дистилляции, растирания и хроматографии.
Соединения формулы (I) могут быть превращены в соединения с другими функциональными группами известными приемами.
Так, например, соединения формулы (I), содержащие гидроксигруппы, могут быть О-алкилированы, например, перемешиванием в присутствии соответствующих алкилирующих агентов и, при необходимости, в присутствии оснований и растворителей.
Соединения формулы (I), содержащие блокирующее диоксалановое кольцо, могут быть деацетилированы, чтобы получить оксосоединения. Указанное деацетилирование может быть проведено известными методами, например взаимодействием исходных материалов в водно-кислой среде.
Соединения формулы (I), содержащие цианозаместители, могут быть превращены в соответствующие заместители аминов посредством перемешивания или, при необходимости, нагревом исходных цианосоединений в водородной среде в присутствии катализатора, например платины на угле, никеля Ренея, и в присутствии либо оснований, например, амин, т.е. N,N-диэтилэтанамин и подобные, или гидроксидов (гидроксид натрия и др.). Подходящими растворителями являются также спирты (метанол, этанол и др.), эфиры (тетрагидрофуран и др.) или смеси таких растворителей.
Соединения формулы (I), содержащие аминогруппы, могут быть приготовлены обработкой карбаматов основаниями, например гидроксидами (гидроксид калия, гидроксид натрия и др. ). Подходящими растворителями являются спирты (метанол, 2-пропанол и др.), эфиры (тетрагидрофуран и др.).
Аминогруппы могут быть алкилированы в соответствии с известными способами, например, N-алкилированием, восстановительным N-алкилированием и др. методами, описанными выше.
Соединения формулы (I), содержащие эфирные группы, могут быть превращены в карбоновые кислоты в соответствии с известными методами омыления, например, обработкой исходных соединений водными растворами кислот или щелочей.
Соединения формулы (I), где R1-гало, могут быть превращены в соединения с R1-водород в соответствии с известными методами гидролиза, например перемешиванием или, при необходимости, нагревом исходных соединений в инертных растворителях в присутствии водорода и катализатора (палладий на угле и др. ).
Cоединения формулы (I) могут быть превращены в соединения с N-оксидными группами путем перехода 3-х валентного азота в N-оксид. Реакция N-окисления может быть проведена при взаимодействии исходных соединений формулы (I) соответствующими органическими или неорганическими перекисями (перекиси натрия, калия, бария, перекись бензокарбоновой кислоты, перекись 3-хлорбензокарбоновой кислоты, перекись уксусной кислоты, гидроперекись бутила и др.).
N-окисление может проводиться в соответствующих растворителях: воде, низших спиртах (метанол, этанол, бутанол, пропанол и др.), углеводородах (бензол, метилбензол, диметилбензол и др.), кетонах -(2-пропано, 2-бутанол и др. ), галогенированных углеводородах (дихлорметан, трихлорметан и др.) или смесях таких растворителей. Для увеличения скорости реакции можно использовать нагрев реакционной смеси.
Некоторые из указанных выше промежуточных продуктов или исходных материалов являются уже известными, а некоторые новыми. Они могут быть приготовлены в соответствии с известными методами (ЕР-А-0,389,037). Способы получения некоторых промежуточных продуктов будут описаны ниже.
Промежуточные продукты формулы (II) могут быть получены из замещенного пиперидина формулы (XVII) при взаимодействии с реагентом формулы (V) или функциональными производными с последующей амидизацией и последующим удалением группы P' из продукта (XVIII), например, проведением гидролиза в кислой или щелочной среде или каталитического гидрирования, в зависимости от природы Р'.
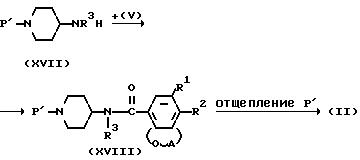
В реакции (XVII) c (V) и в последующих схемах реакций группа P' удаляется при гидрировании или гидролизе. Предпочтительнее гидролизованные группы, например, метилфенил, С1-4 алкилоксикарбонил, этоксикарбонил, бензилоксикарбонил и др.
Промежуточные продукты формулы (II), где R3 водород, представленной формулой (II-a), могут быть альтернативно получены взаимодействием изоцианата формулы (ХIX) с промежуточным продуктом формулы (XVIII). Продукт представлен формулой (XVIII-a). В формуле (ХХ) W5 щелочной метил (литий, натрий и др.) или галоген магния (хлорид или бромид магния). Реакция может быть проведена в инертных растворителях (тетрагидрофуран, 1,1'-оксибисэтан, 1,2-диметоксиэтан, пентан, гексан и др.). Взаимодействие может быть проведено известным способом (Tetrahedron Zetters. 270 1971 (1986) или Org.Chem. 32, 1273 (1967)).
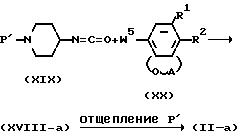
Полученный таким образом промежуточный продукт (XVIII-a) может быть получен аналогично продукту формулы (II-a), как описано выше.
Интерес представляют соединения общей формулы (I), в которой R1 является водородом или галогеном: и/или R2 является водородом, амино или С1-2 алкиламино, и/или R3 является водородом.
Представляют интерес также соединения формулы (I), где R1 является водородом или галогеном, и/или R2 является водородом, амино или С1-6 алкиламино, и/или R3 является С1-4 алкилом.
Не менее интересными
соединениями являются те, где L является С3-6 циклоалкилом или С3-6 алкенилом, избирательно замещенным арилом, или L является радикалом формулы (b-1), где R4 является
водородом, циано, С3-6 циклоалкилом, арилом, ди(арил)метилом или Het или
L является радикалом формулы (b-2), где Х является O, или NH и R5 является водородом, С1-4 алкилом, С3-6 циклоалкилом, арилом или Het или
L является радикалом формулы (b-3), где Y является NR8 или прямой связью, R8 является водородом или
арилом и R7 является водородом, С1-4 алкилом, арилом, С1-4 алкилокси или гидрокси.
Наиболее интересными соединениями являются те, где А является радикалом формулы (а-1) или (а-2), где атом углерода примыкает к атому кислорода и является избирательно замещенным одним или двумя С1-4 алкильными заместителями.
Наиболее
предпочтительными из указанных выше соединений являются те, где L представляет собой С5-6 циклоалкил или С3-6 алкенил, избирательно замещенный арилом, или
L является
радикалом формулы (b-1), где Alk является С1-4 алкандиилом и R4 является циано, С3-6 циклоалкилом, диарилметилом или Het,
или L является радикалом формулы
(b-2), где Alk является С1-4 алкандиилом, Х является О или NH и
R5 является водородом, С1-4 алкилом, С3-6 циклоалкилом, арилом или Het,
или L является радикалом формулы (b-2), где Alk является С1-4 алкандиилом, Y является NH или прямой связью и R7 является С1-4 алкилом, арилом, С1-4
алкилокси или гидрокси.
Предпочтительными являются также те соединения, где Het является пиперидинилом, пиридинилом, избирательно замещенного или циано, пиразинилом, избирательно замещенного С1-6 алкилом, бензимидазолилом, избирательно замещенного С1-6 алкилом, или индолилом.
Особенно предпочтительными являются те соединения, где Het является тетрагидрофуранилом, 1,3-диоксаланилом, избирательно замещенного С1-4 алкилом, 3,4-дигидро-1(2Н)-бензопиранилом, пиперидинилом, пиридинилом, избирательно замещенного циано, пиразинилом, избирательно замещенного С1-4 алкилом, бензимидазолилом, индолилом, 2,3-дигидро-2-оксо-1Н-бензимидазолилом, избирательно замещенного С1-4 алкилом, 2-оксо-1-имидазолидинилом, избирательно замещенного С1-4 алкилом, 3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-илом, избирательно замещенного тремя С1-4 алкилоксигруппами, 1-оксо-2-(1Н)-фталазинилом, 2,3-дигидро-5-оксо-5Н-тиазоло-(3,2-а)пиримидин-6-илом, избирательно замещенного С1-4 алкилом, 5-оксо-5Н-тиазод-(3,2-а)пиримидин-6-илом, избирательно замещенного С1-4 алкилом, 1,6-дигидро-6-оксо-1-пиридазинилом, избирательно замещенного С1-4 алкилом или галогеном, и 1,2,3,4-тетрагидро-2,4-диоксо-3-хиназолинилом.
Наиболее
предпочтительными являются соединения, где R1 является водородом или хлором, и/или R2 является водородом, амино- или (1-метилэтил)амино, и/или R3 является водородом,
и/или L является радикалом формулы (b-1), где R4 является циано, циклопентилом, тетрагидрофуранилом, пиперидинилом, 7-метил-5-оксо-5Н-тиазол (3,2-а)пиримидин-6-илом, 3-этил-2,
3-дигидро-2-оксо-1Н-бензамидазолилом, 1,6-дигидро-3-метил-6-оксо-1-пиридазинилом, или
L радикал формулы (b-2), где Х является О или NH и R5 является водородом или 4-фторфенилом,
или
L радикал формулы (b-3), где Y является NH или прямой связью и R7 является метилом, этокси или 3,4,5-триметоксифенилом.
Самыми предпочтительными являются
соединения:
5-амино-6-хлор-3,4-дигидро-N-/1-/(тетрагидро-2-фуранил)метил/4- пиперидинил/-2Н-1-бензопиран-8-карбоксиамид,
/-/-/R/-5-амино-6-хлор-3,4-дигидро-

4-амино-5-хлор-2,3-дигидро-

/-/-/R/-4-амино-5-хлор-2, 3-дигидро-

/-/-/R/-4-амино-5-хлор-2,3-дигидро-

/+/-/S/метил/-4-пиперидинил/-7-бензофуранкарбосиамид, этил /2-/4-//(5-амино-6-хлор-3,4-дигидро-
5-амино-6-хлор-

этил 4-//(5-амино-6-хлор-3,4-дигидро-

5-амино-6-хлор-3,4-дигидро-
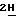
4-амино-5-хлор-2,3-дигидро-2,2-диметил-

стереизомеры и фармацевтически подходящие кислые соли.
Соединения формулы (I) могут иметь асимметричные углеродные атомы, их точное положение может быть указано стереохимическим расположением R и S.
Стереоизомерные структуры промежуточных продуктов описаны выше в схемах реакций и в соединениях формулы (I) и могут быть получены известными методами. Например, диастереизомеры могут быть выделены физическими методами: дистилляцией, кристаллизацией, хроматографически (распределение методом противотока, жидкостная хроматография) и др. Чистые энантиомеры могут быть получены кристаллизацией их диастереомерных солей с активными агентами, хроматографическими методами разделения диастереомерных производных или неподвижных хиральных фаз и др. Альтернативно энантиомерные чистые структуры могут быть получены из энантиомерных чистых изомерных структур исходных материалов при условии, что процесс реакции протекает стереоспецифически.
Соединения формулы (I) и промежуточные продукты формулы (II), N-оксидные структуры и фармацевтически проходящие соли стимулируют активность гастрокишечной системы, в особенности, толстых кишок. Эти свойства подтверждены результатами испытаний (Colon ascendens induced contractions), описанных ниже.
Стимулирующий эффект соединений формулы (I) и (II) подтвержден различными методами испытаний (The Iournal of Pharmacology and Experimental Therapeutics, 234, 775-783 (1985) и "Drug Development Research", 8,243-250 (1986)).
Кроме того, соединения формулы (I) и (II), N-оксидные структуры, фармацевтически подходящие кислые примеси солей и некоторые стереоизомерные структуры обладают закрепляющими свойствами. Некоторые группы соединений изобретения, особенно то, где радикал А не замещен С1-6 алкилом, имеют слабую 5НТ3 антагонистическую активность.
Для большинства соединений данного изобретения не отмечается рецепторно-связующего родства с серотонергиком 5НТ1 и серотонергиком 5НТ2 и характерна малая или отсутствие допаминэнергетической антагонистической активности.
Полезные свойства соединений, оказывающих активное воздействие на гастрокишечную систему, могут иметь несколько вариантов для лечебных целей.
Для получения фармацевтических соединений изобретения активные ингредиенты (основания, кислые примеси солей) вводятся в смеси с соответствующим носителем. Полученные фармацевтические композиции представляют собой единичные дозы для приема оральным, ректальным или другим родственным способом.
Например, для орального способа могут быть использованы жидкие носители (вода, гликоли, масла, спирты) при изготовлении жидких препаратов типа суспензий, сиропов, их эликсиров или растворов.
В качестве твердых носителей могут быть использованы сахар, крахмал, каолин, смазки, связующие, дезинтегрирующие агенты для приготовления порошков, пилюль, капсул и таблеток. Для лучшего растворения могут быть добавлены другие ингредиенты. В растворы могут быть введены, например, соляные растворы или растворы глюкозы или их смесь. В композициях, предназначенных для подкожного введения, носитель может включать добавки, активизирующие проникновения, и/или смачивающие агенты. Эти добавки не должны оказывать вредного влияния на кожу. Композиции могут быть применены в виде наложенных повязок, смазок и др. Кислые добавки солей (I) благодаря их водной растворимости наиболее пригодны для изготовления водных растворов композиций. Рассмотренные здесь дозы, рассчитанные как единичные, предназначены для обеспечения терапевтического эффекта в сочетании с нужным фармацевтическим носителем. Дозы приведены в табл. 1 3.
Соединения изобретения обладают возможностью стимулировать активность толстой кишки, нормализовать и улучшать работу гастрокишечной системы и перистальтику желудка и/или малых и/или больших кишок.
Соединения предназначены также для лечения теплокровных животных, страдающих от нарушений гастрокишечной системы, например, гастропаралича, вспученности, язвы, псевдонепроходимости и особенно при нарушении кишечной проходимости. Для лечения указанных нарушений наиболее подходящими являются соединения формулы (I), N-оксиды, фармацевтически подходящие кислые примеси солей или стереоизомерные структуры. Особенностью соединений изобретения является также терапевтическое воздействие на активность верхнего отдела кишечника и пищевода при нарушении их работы.
Эффективность действия соединений зависит от вводимых доз, которые определены в результате испытаний и составляют 0,001 10 мг/кг, наиболее предпочтительно 0,01 1 мг/кг веса тела.
Экспериментальная часть
А. Получение промежуточных
продуктов.
Пример 1.
а) В раствор из 310 ч. метил 4-(ацетиламино)-2-гидроксибензоата в 2820 ч. N,N-диметилформамида добавляют небольшими порциями 71 ч. дисперсии гидрата натрия в минеральном масле (50) и после перемешивания в течение 1 ч при комнатной температуре добавляют один кристалл иодида калия к 172 ч. 3-хлор-3-метил-1-бутина в атмосфере азота. Полученную смесь перемешивают в течение 24 ч при 90oC, а затем выливают в 10-ный водный раствор NaOH. Полученный продукт экстрагируют в дихлорметане. Экстракт высушивают, фильтруют и выпаривают. Полученный осадок перемешивают в петролейном эфире и растворяют в дихлорэтане. Этот раствор промывают водой, 10-ным раствором NaOH снова водой, а затем высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель, СН2Cl2). Очищенную фракцию выпаривают. Из двух фракций получена 41 ч. (10,1) метил 4-(ацетиламино)-2-(1, 1-диметил-2-пропинилокси) бензоата (промежут. прод. 1).
б) Смесь из 36 ч. (промежуточного продукта 1) и 188 ч. N,N-диметилацетамида перемешивают в течение 24 ч при температуре кипения. Реакционную смесь выпаривают, а осадок растворяют в дихлорметане. Раствор промывают водой, 5-ным раствором NaOH и снова водой, а затем высушивают, фильтруют и выпаривают. Полученный осадок очищают в хроматографических колонках (силикагель: CH2Cl2/CH3OH 99: 1). Очищенную фракцию выпаривают. Получено 23,7 ч. (66,2) метил 5-(ацетиламино)-2, 2-диметил-2Н-1-бензопиран-8-карбоксилата (промежут. прод. 2).
с) Смесь из 23,7 ч. промежуточного продукта 2 и 148 ч. метанола сразу же гидрогенизируют при нормальном давлении и комнатной температуре в присутствии палладий-угольного катализатора (10). Далее вычисленное количество водорода удаляют, а катализатор отфильтровывают и выпаривают. Получают 21,2 ч. (88,9) метил 5-(ацетиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-8 -карбоксилата (промежут.прод.3).
д) Смесь из 21,2 ч. промежуточного продукта 3, 10,3 ч. хлорсукцинимида и 158 ч. ацетонитрила перемешивают в течение 2 ч при температуре кипения. Реакционную смесь далее выпаривают и осадок растворяют в дихлорметане. Этот раствор промывают водой, высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель: СН2Cl2/CH3OH 99:1). Очищенную фракцию выпаривают. Получают 23 ч. (95,8) метил 5-(ацетиламино)-6-хлор-3, 4-дигидро-2,2-диметил-2Н-1-бензопиран-8- карбоксилата (промежут. прод.4).
е) Смесь из 20 ч. промежуточного продукта 4, 36 ч. гидроксида калия и 250 ч. воды перемешивают в течение 16 ч при температуре кипения.
После охлаждения раствор декантируют и осадок промывают дихлорметаном дважды. Водный остаток подкисляют 69,9 ч. НСl (концентр.). Осадок фильтруют, промывают водой и высушивают в вакууме при 70oC. Получают 13 ч. (79,4) 5-амино-6-хлор-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-8 -карбоксильной кислоты. Т. пл. 165oC (пром.прод.5).
Пример 2.
а) Смесь из 58 ч. метил 4-(ацетиламино)-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксилата, 123 ч. гидроксида калия и 1100 ч. воды перемешивают в течение 3 ч при температуре кипения. После охлаждения реакционную смесь подкисляют до рН 1 соляной кислотой. Осадок фильтруют и высушивают в вакууме при 80oC. Получают 36 ч. (79,0) 4-амино-2,3-дигидро-2, 2-диметил-7-бензофуранкарбоксильной кислоты (пром.прод.6).
б) Смесь из 36 ч. промежуточного продукта 6, 66,2 ч. сульфокислоты и 142 ч. метанола перемешивают в течение 30 мин при температуре кипения. После охлаждения реакционную смесь подщелачивают метанолом насыщенным аммиаком, а затем смесь выпаривают. Осадок растворяют в дихлорметане и воде. Органическую часть отделяют, промывают водой, высушивают, фильтруют и выпаривают. Другую часть осадка выкристаллизовывают из ацетонитрила при 0oC. Продукт отфильтровывают и высушивают в вакууме при 40oC. Получено 20 ч. (53,2) метил-4-амино-2,3-дигидро-2,2-диметил-7-бензофуранкарбоксилата (пром.прод.7).
в) Смесь из 15,3 ч. промежуточного продукта 7, 23,3 ч. 2-иодпропана, 9,13 ч. N, N-диэтилэтанамина и 72,1 ч. гексаметилфосфорного триамида перемешивают в течение 28 ч при 130oC. После охлаждения реакционную смесь выливают в воду. Продукт экстрагируют дихлорметаном и экстракт промывают водой, высушивают и выпаривают. Осадок очищают в хроматографических колонках (силикагель: CH2Cl2/CH3OH 99:1).
Очищенную фракцию выпаривают, а осадок выкристаллизовывают из 2,2-оксибиспропана при 0oC. Продукт фильтруют и высушивают в вакууме при 40oC. Получают 10 ч. (54,2) метил-2,3-дигидро-2, 2-диметил-4-/(1-метилэтил)амино/-7-бензофуранкарбоксилата (пром.прод.8).
д) Смесь из 9 ч. промежуточного продукта 8, 3,2 ч. гидроксида натрия и 60 ч. воды перемешивают в течение 1 ч при температуре кипения. После охлаждения реакционную смесь подкисляют до рН 6 НСl (конц.). Осадок промывают водой и высушивают в вакууме при 60oC. Получают 7,2 ч. (76,9) 2,3-дигидро-2, 2-диметил-4-/(1-метилэтил)амино/-7-бензофуранкарбоксильной кислоты (пром. прод.9).
Пример 3.
а) В суспензию из 17 ч. 4-амино-5-хлор-2, 3-дигидро-7-бензофуранкарбоксильной кислоты (приготовленной в соответствии с ЕР-А-0,389,037) в 435 ч. трихлорметана добавляют последовательно 9,13 ч. N,N-диметилэтанамина и 8,68 ч. этилхлорформиата. Хранят суспензию при температуре ниже 5oC. После перемешивания в течение 2 ч с одновременным охлаждением на льду всю суспензию добавляют к раствору из 14,5 ч. этил-4-амино-1-пиперидинокарбоксилата в 218 ч. трихлорметана при температуре ниже 5oC. Перемешивание продолжают при комнатной температуре. Реакционную смесь промывают 5-ным раствором NaOH (дважды) и водой (дважды), а затем высушивают, отфильтровывают и выпаривают. Осадок последовательно в 3 приема перетирают с 2,2'-оксибиспропаном, а затем выкристаллизовывают из ацетонитрила. Продукт отфильтровывают, промывают ацетонитрилом и высушивают. Получают 19,7 ч. (66,9) продукта. Дополнительное количество продукта 1,2 ч. (4,1) получают из слоев 2,2'-оксибиспропана. Всего получено: 20,9 ч. (71) этил 4-//(4-амино-5-хлор-2,3-дигидро-7-бензофуранил)карбонил/амино/-1- пиперидин-карбоксилата; т. пл. 158,6oC (пром.прод. 10).
в) Раствор из 18,4 ч. промежуточного продукта 10 и 28 ч. гидроксида натрия в 125 ч. 2-пропанола перемешивают в течение 4 ч при температуре кипения. Затем растворитель выпаривают и добавляют 100 ч. воды. Смесь выпаривают снова, а остаток перемешивают в 100 ч. воды в течение 15 мин с одновременным подогревом на водяной бане. После охлаждения твердый состав отфильтровывают, промывают водой и растворяют в кипящем 2-пропаноле. К раствору добавляют 40 ч. воды. Продукт выкристаллизованный при охлаждении, отфильтровывают, промывают водой и высушивают. Получают 12,35 ч. (83,5) 4-амино-5-хлор-2, 3-дигидро-N-(4-пиперидинил)-7-бензофуранкарбоксиамида; т. пл. 190,3oC (пром.прод.11).
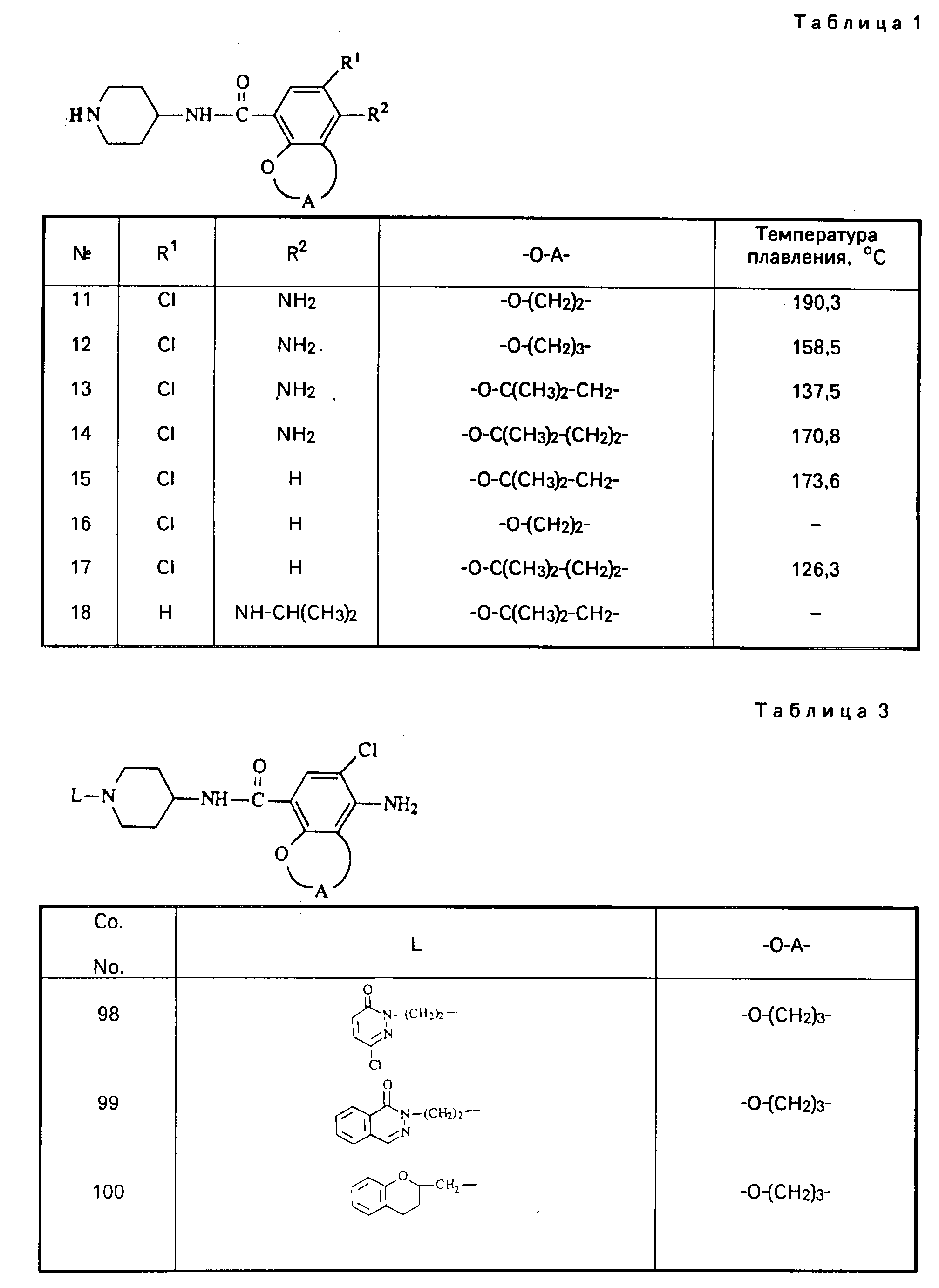
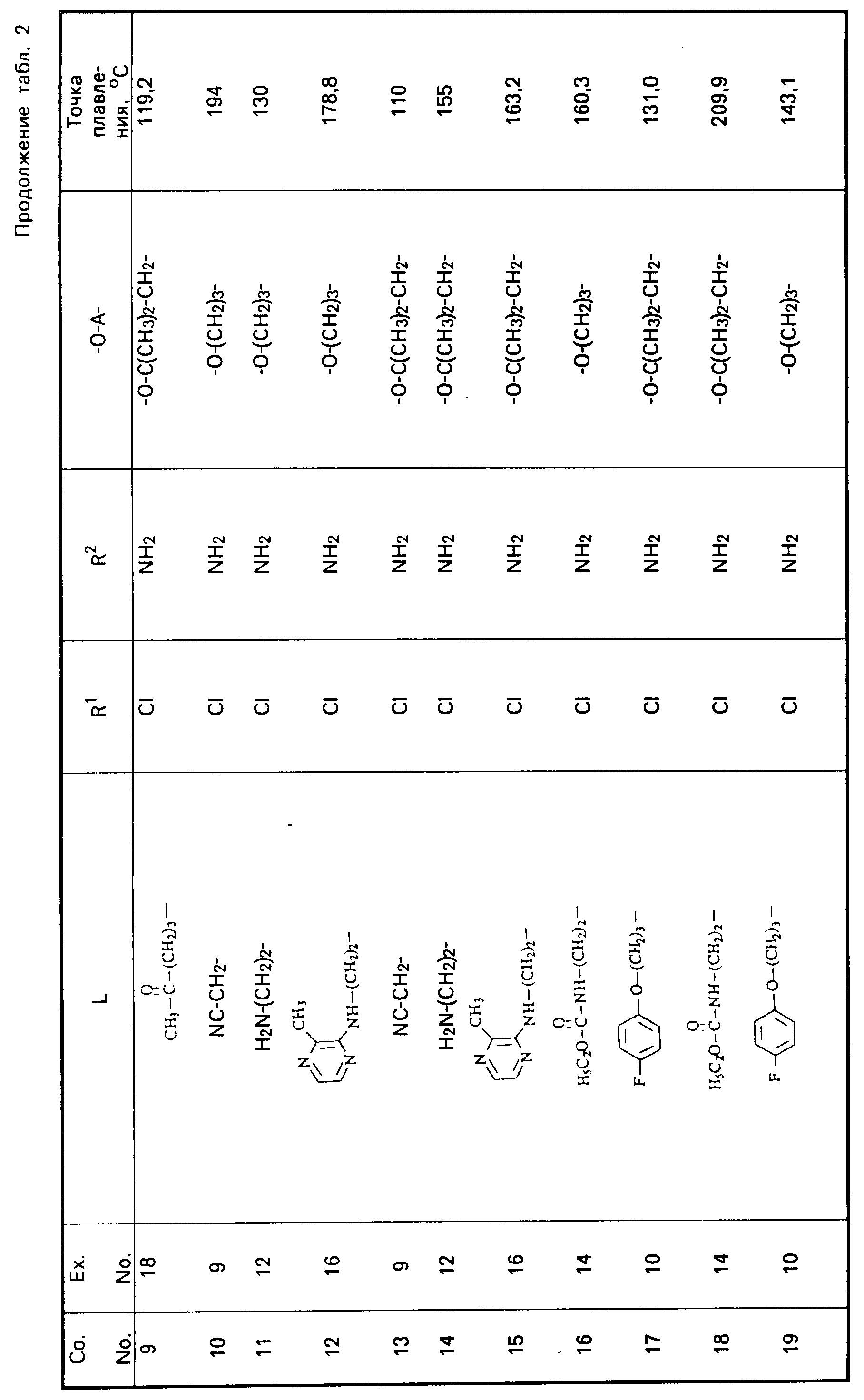
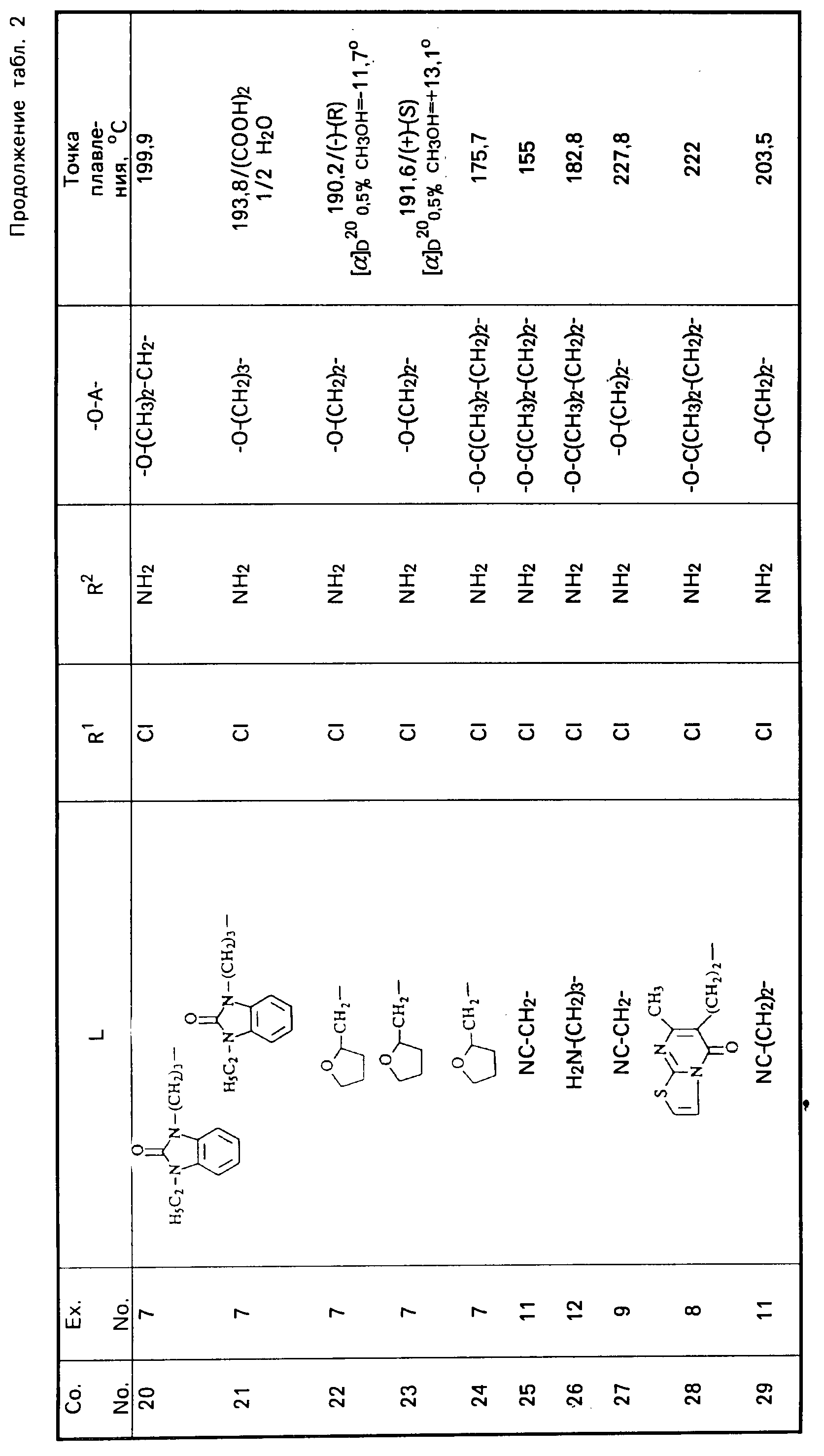
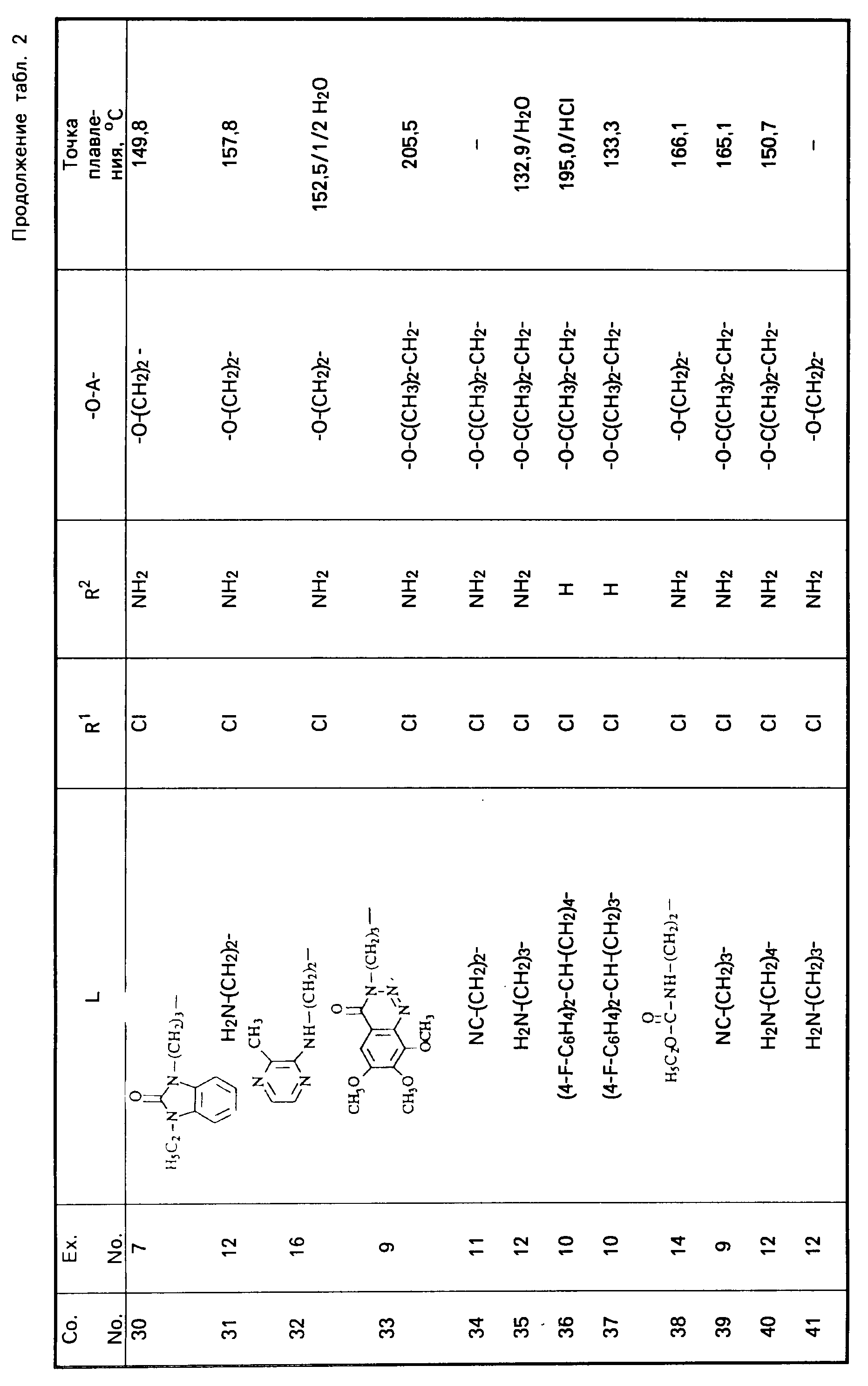
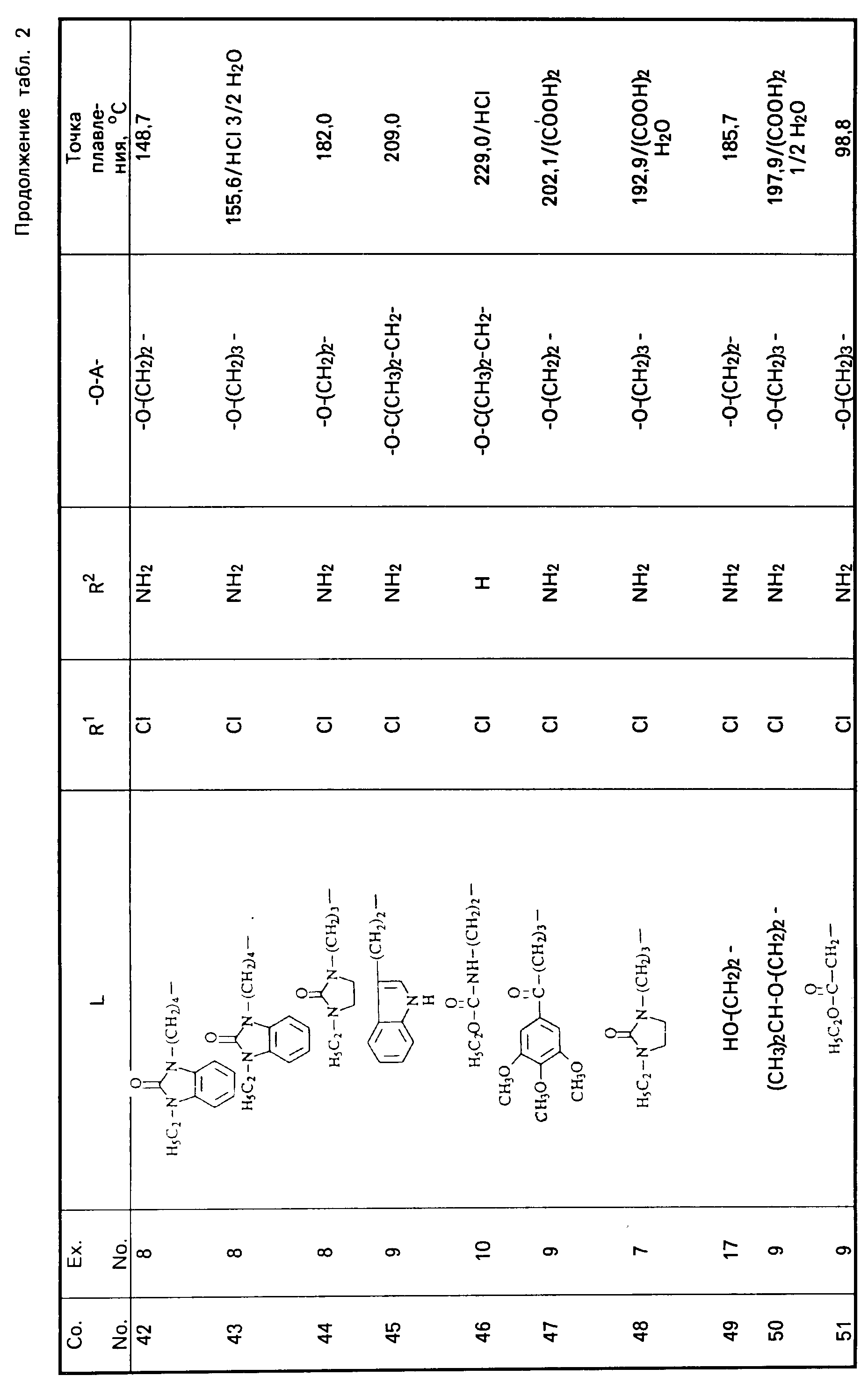
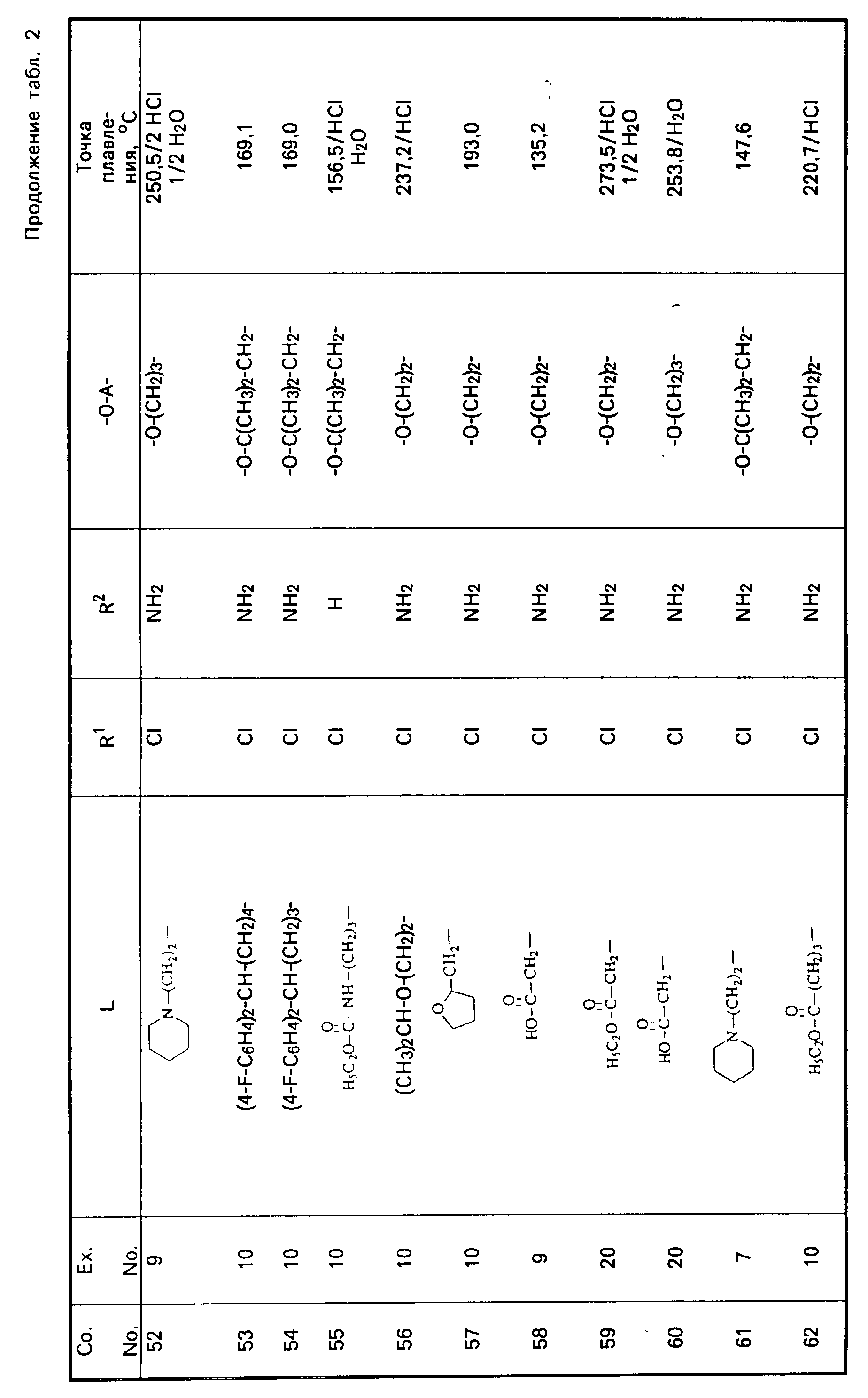
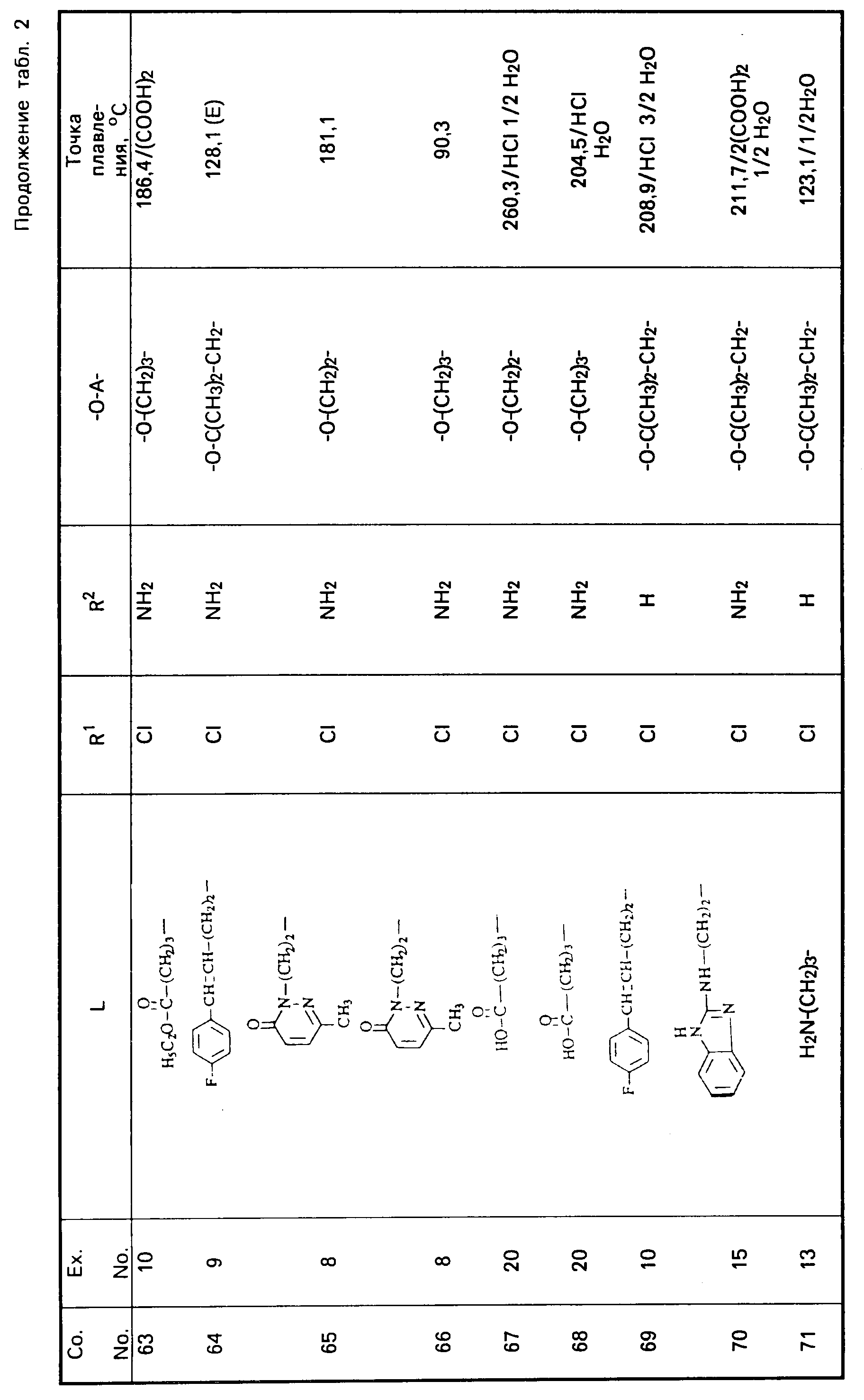
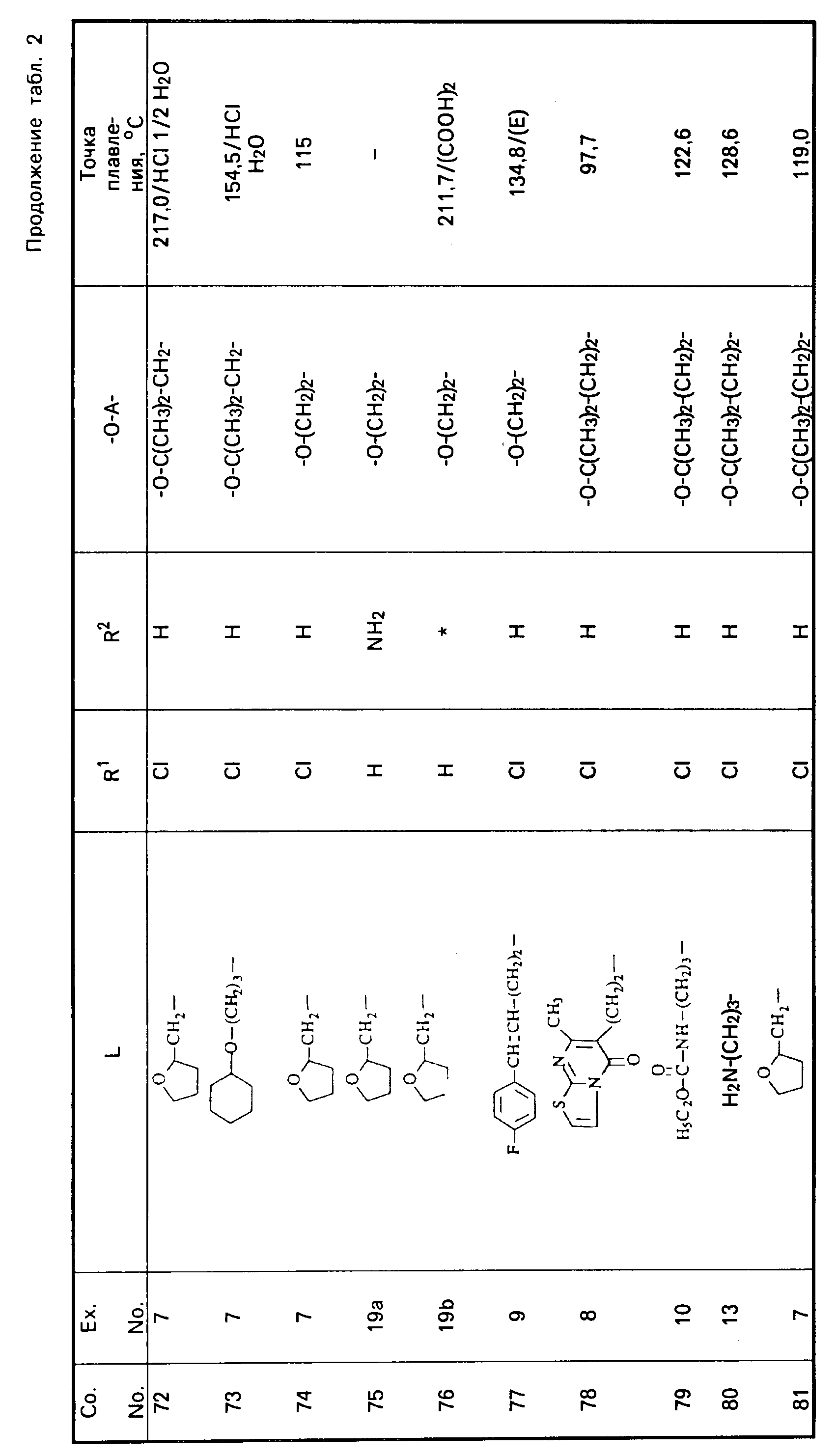
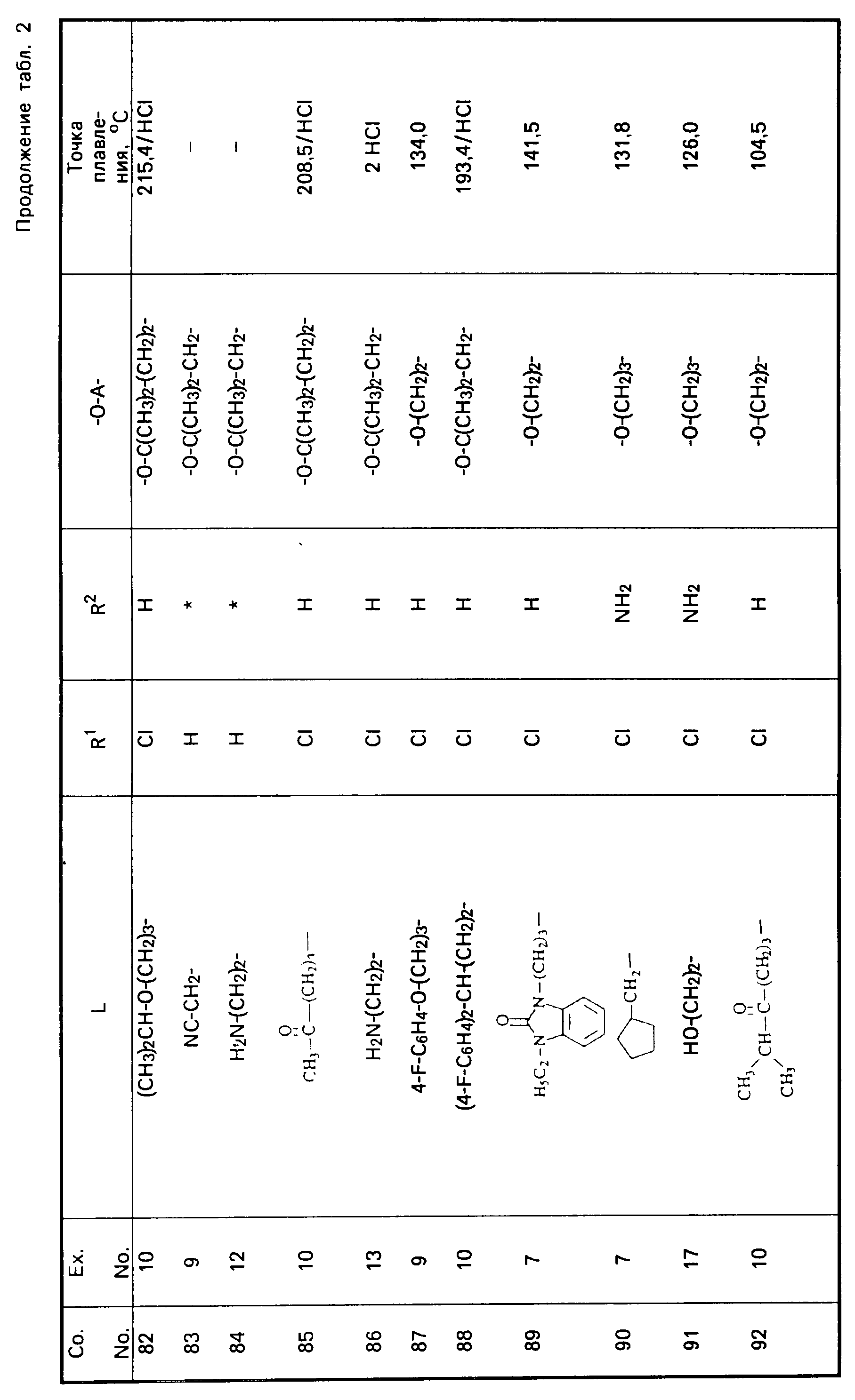
Все промежуточные продукты, приведенные в табл. 1, приготовлены аналогичным образом.
Пример 4.
К перемешанной и охлажденной (в ледяной бане) смеси из 20 ч. (-)-(R)-тетрагидро-2-фуранметанола и 39,2 ч. пиридина добавляют по капле 24,7 ч. хлорида метансульфохлорида. Перемешивание проводят при комнатной температуре в течение 16 ч. К реакционной смеси добавляют дихлорметан и смесь промывают раствором 1N HCl высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель: CH2Cl2OH 99,5: 0,5). Очищенную фракцию выпаривают. Получают 26,7 ч. (75,6) (-)-(R)-тетрагидро-2-фуранметанол метансульфоната (эфир); [α] -15078 (конц. 1) в СН2Cl2) (пром.прод. 19).
Аналогичным образом приготовлен (+)-(S)-тетрагидро-2-фуранметанол метансульфонат (эфир); [α]
Пример 5.
К раствору из 10 ч. 3-(циклогексилокси)-1-пропанол в 160 ч. дихлорметана добавляют 11,2 ч. N,N-диэтилэтанамин и по каплям 8,14 ч. хлорида метансульфонила. Всю смесь перемешивают в течение 9 ч при комнатной температуре. Реакционную смесь промывают Na2CO3 (водный) и водой, затем высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель: CH2Cl2/CH3OH 99:1). Очищенную фракцию выпаривают, а осадок был выпарен вместе с метилбензолом. Продукт отфильтровывают и сушат. Получают 8,6 ч. (57,8) 3-(циклогексилокси)-1-пропанол-метансульфоната (эфир) (пром. прод.21).
Пример 6.
Раствор из 5,5 ч. 3,3-бис(4-фторфенил)-1-пропанола и 2,92 ч. тионилхлорида в 39,9 ч. дихлорметана перемешивают при 60oC в течение 4 ч. Реакционную смесь выпаривают, а затем смешивают с метилбензолом и еще раз выпаривают. Осадок растворяют в этилацетате и этот раствор промывают Na2CO3 (водн.) водой и NaCl (насыщ.), а затем высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель, (С2H5)2 O/H-гексан 2: 98). Очищенную фракцию выпаривают, получают 4,5 ч. (76,7) 1-/3-хлор-1-(4-фторфенил)пропил/-4-фторбензола (пром.прод.22).
Б. Получение целевых соединений.
Пример 7.
Раствор из 2,96 ч. промежуточного прод. 11, 3,2 ч. раствора карбоната натрия и 160 ч. 4-метил-2-пентанона перемешивают в течение 30 мин при температуре кипения в присутствии водопоглотителя. В этот раствор добавляют 3,6 ч. тетрагидро-2-фуранметилового сложного эфира метансульфоновой кислоты и все это перемешивают при температуре кипения в течение 48 ч. Реакционную смесь смешивают с дихлорметаном и полученный раствор промывают водой, высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель, CH2Cl2/CH3OH 95:5). Очищенную фракцию выпаривают, а осадок выкристаллизовывают из ацетонитрила. Продукт отфильтровывают и высушивают. Получают 1,63 ч. (42,9 ) 4-амино-5-хлор-2,3-дигидро-N-/1-/(тетрагидро-2-фуранил)метил-4 -пиперидинил/-7/бензофуранкарбоксиамида; т. пл. 175,4oC (соед.3).
Пример 8.
Смесь из 3,09 ч. промежуточного продукта 12, 13,28 ч. карбоната натрия и 160 ч. 4-метил-2-пентанона перемешивают при температуре кипения в присутствии водопоглотителя. Затем добавляют 2,74 ч. 6-(2-хлорэтил)-7-метил-5Н-тиазол(3,2-а-)-пиримидин-5-пиримидина и 0,1 ч. иодида калия и все это перемешивают при температуре кипения в течение 36 ч. Реакционную смесь выпаривают, а осадок растворяют в трихлорметане и воде. Органическую часть осадка отделяют, промывают водой, высушивают, отфильтровывают и выпаривают. Другую часть осадка очищают в хроматографических колонках (силикагель: СН2Cl2/CH3OH 90: 10). Очищенную фракцию выпаривают, а осадок кипятят в ацетонитриле. После охлаждения продукт отфильтровывают и высушивают. Получают 2,7 ч. (53,8 ) 5-амино-6-хлор-3,4-дигидро-N-/1-/2-(7-метил-5-окси-5Н-тиазол-/3,2 -a/пиримидин-6-ил)этил/-4-пиперидин/-2Н-1-бензопиран-8-карбоксиамида; т. пл. 211,8oC (соед.2).
Пример 9.
Смесь из 21,7 частей промежуточного продукта 12, 5, 7 ч. хлорацетонитрила, 9,2 ч. N,N-диэтиламина и 430 ч. N,N-диметилформамида перемешивают сразу же после приготовления при 60oC. Реакционную смесь выпаривают и к осадку добавляют Na2CO3 (водн.). Продукт экстрагируют дихлорметаном (трижды). Полученные экстракты высушивают, отфильтровывают и выпаривают. Из осадка готовят суспензию в ацетонитриле. Первую фракцию продукта отфильтровывают, а фильтрат выпаривают. Осадок очищают в хроматографических колонках (силикагель: CH2Cl2/CH3OH (NH3 97:3). Очищенную фракцию выпаривают, а осадок смешивают с ацетонитрилом и получают вторую фракцию, а затем обе фракции высушивают в вакууме. Получают 22,1 ч. (90,5% ) 5-амино-6-хлор-N-(1-(цианометил)-4-пиперидинил)-3, 4-дигидро-2Н-1- бензопиран-8-карбоксиамида, т. пл. 194oC (соед.10).
Пример 10.
Смесь из 4,3 ч. 2-(3-хлорпропил)-2-метил-1,3-диоксолана: 7,4 ч. промежуточного продукта 13, 4, 7 ч. N,N-диэтилэтанамина, необходимого количества катализатора иодида калия и 106 ч. N,N-диметилформамида перемешивают при 70oC в течение 17 ч. Реакционную смесь выпаривают и к осадку добавляют Na2CO3 (водн. ). Продукт экстрагируют дихлорметаном, а экстракт высушивают, отфильтровывают и выпаривают, а затем очищают в хроматографических колонках (силикагель: СН2Cl2/CH3OH(NH3) 97:3). Очищенную фракцию выпаривают и осадок растирают с 2,2'-оксибиспропаном. Продукт отфильтровывают и высушивают. Получают 2,1 ч. (20,2) 4-амино-5-хлор-2,3-дигидро-2,2-диметил-N-/1-/3-(2-метил-1,3-диоксан -2-ил)пропил/-4-пиперидинил/-7-бензофуранкарбоксиамида. Т. пл. 136,5oC (соед.8).
Пример 11. Смесь из 6 ч. промежуточного продукта 14, 1,13 ч. пропенитрила и 78 ч. 2-пропанола перемешивают в течение 4 ч при температуре кипения. Реакционную смесь выпаривают, а осадок суспендируют в 2, 2'-оксобиспропане. Полученный осадок отфильтровывают и высушивают в вакууме при 60oC. Получают 608 ч. (96,6) 5-амино-6-хлор-N-/1-(2-цианоэтил)-4-пиперидинил)-3,4-дихлор-2, 2- диметил-2Н-1-бензопиран-8-карбоксиамида (соед.25).
Пример 12.
Смесь из 22 ч. соединения 10 в 356 ч. тетрагидрофурана и 79 ч. метанола обрабатывают при нормальном давлении и комнатной температуре 6 ч. катализатора Raney никеля. После окончания реакций катализатор фильтруют, а фильтрат выпаривают. Полученный осадок очищают в хроматографических колонках (силикагель: CH2Cl2/CH3OH(NH3) 93:7). Очищенную фракцию выпаривают, а осадок растирают в 2,2'-оксибиспропане, а затем перемешивают в небольшом количестве ацетонитрила. Продукт отфильтровывают и высушивают. Получают 14 ч. (63,0) 5-амино-N-/1-(2-аминоэтил)-4-пиперидинил)-6-хлор-3,4-дигидро-2Н-1- бензопиран-8-карбоксиамида; т. пл. 130oC (соед.11).
Пример 13.
Смесь из 16,7 ч. соединения 55, 19 ч. гидроксида калия и 92 ч. 2-пропанола перемешивают в течение 3 ч при температуре кипения. Реакционную смесь выпаривают и осадок повторно выпаривают с водой (дважды) и затем растворяют в дихлорметане, метаноле и воде, водную часть осадка отделяют и экстрагируют в дихлорметане. Оставшиеся 2 органические части осадка высушивают и отфильтровывают. Получают 8,3 ч. (65,1) N-/1-(3-аминопропил)-4-пиперидинил/-5-хлор-2,3/дигидро-2,2- диметил-7-бензофуранкарбоксиамида полугидрата; т. пл. 123,1oC (соед.71).
Пример 14.
К охлажденной (баня со льдом) смеси из 2,3 ч. соединение 11 и 74 ч. трихлорметана добавляют 0,86 ч. N,N-диэтилэтанамина и по капле раствор из 0,77 ч. этилхлороформиата в 40 ч. трихлорметана при температуре ниже 10oC. После перемешивания в течение 30 мин при комнатной температуре, реакционную смесь промывают водой, высушивают, отфильтровывают и выпаривают. Осадок очищают в хроматографических колонках (силикагель: СH2Cl2/CH3OH (NH3 95:5). Очищенную фракцию выпаривают, а осадок кристаллизуют из ацетонитрила. Продукт фильтруют и высушивают. Получают 1,4 ч. (50,7) этил/2-/4-//(5-амино-6-хлор-3,4-дигидро-2Н-1-бензопиран-8-ил)карбонил /амино/-1-пиперидинил/-этил/карбамата; т. пл. 160,3oC (cоед.16).
Пример 15.
Смесь из 3,67 ч. соединения 14, 1,85 ч. 2-хлор-1Н-бензимидазола; 4,7 ч. N, N-диметилацетамида, необходимого количества катализатора иодида калия и 2,10 ч. карбоната натрия перемешивают в течение 3 ч при 120oC. После охлаждения реакционную смесь разбавляют водой, высушивают, фильтруют и выпаривают. Осадок очищают в хроматографических колонках (силикагель: CH2Cl2/CH3OH(NH3) 95:5. Очищенную фракцию выпаривают, а осадок превращают в раствор соли этандиоата (1:2) в этаноле. Продукт отфильтровывают и высушивают. Получают 0,56 ч. (8,3 ) 4-амино-N-/1-/2-(1H-бензимидазол-2-иламино)/этил/- 4-пиперидинил/-5-хлор-2,3-дигидро-2,2-диметил-7-бензофуран-карбоксиамид этандиоата (1:2) полугидрата. Т. пл. 211,7oC (соед. 70).
Пример 16.
Смесь из 3,1 ч. 2-хлор-3-метилпиразина, 4,4 ч. соединения 14 и 0,79 ч. окиси кальция перемешивают в течение 24 ч при 120oC. После охлаждения реакционную смесь растворяют в дихлорметане и NH4OH (разб.). Водную часть осадка отделяют и повторно экстрагируют в дихлорметане. Обе органические части осадка высушивают, отфильтровывают и выпаривают, фильтруют и выпаривают. Осадок очищают в хроматографических колонках (силикагель: CH2Cl2 /CH3OH(NH3) 98: 2). Очищенную фракцию выпаривают, а осадок растворяют в 2,2'-оксибиспропане. Продукт отфильтровывают и высушивают. Получают 3,3 ч. (59,9) 4-амино-4-хлор-2, 3-дигидро-2,2-диметил-N-/1-/2//(3-метил-2-пиразинил) амино/этил/-4-пиперидинил/-7-бензофуранкарбоксиамида: температура плавления 163,2oC (соед. 15).
Пример 17.
Через раствор из 3,5 ч. промежуточного продукта 11 в 19,8 ч. этанола и 25 ч. воды барботируют оксиран в течение 1 ч при комнатной температуре. Реакционную смесь выпаривают, а осадок очищают в хроматографических колонках (силикагель: СH2Cl2/CH3OH (NH3) 95:5). Очищенную фракцию выпаривают, а осадок выкристаллизовывают из ацетонитрила. Продукт фильтруют и высушивают в вакууме при 70oC. Получают 1,64 ч. (40,2) 4-амино-5-хлор-2,3-дигидро-N-/1-(2- гидрокси-этил)-4-пиперидинил)-7-бензофуранкарбоксиамида; т. пл. 185,7oC (соед.49).
Пример 18.
К смеси из 12,2 ч. соединения 8 и 83 ч. воды добавляют 1,53 ч. сульфокислоты. После перемешивания в течение 4,5 ч при комнатной температуре реакционную смесь выливают в смесь из NH4OH (разб.) и льда. Затем продукт экстрагируют дихлорметаном, а экстракт высушивают, фильтруют и выпаривают. Осадок очищают в хроматографических колонках (силикагель, СH2Cl2/CH3OH (NH3 97: 3). Очищенную фракцию выпаривают, а осадок растирают в 2,2-оксибиспропане. Затем продукт отфильтровывают и высушивают. Получают 2,3 ч. (40,3) 4-амино-5-хлор-2,3-дигидро-2,2-диметил-N-/1-(4-оксопентил)-4 -пиперидинил)-7-бензофуранкарбоксиамида; т. пл. 119,2oC (сосед.9).
Пример 19.
а) Смесь из 7,6 ч. соединения, 3,5 ч. уксуснокислого калия и 158 ч. метанола гидрогенизируют при нормальном давлении и температуре 50oC с 2 ч. палладий-угольного катализатора 10 После определения количества атомов водорода, катализатор отфильтровывают, а фильтрат выпаривают. Получают 6,91 ч. (100 ) 4-амино-2,3-дигидро-N-/1-/тетрагидро-2-фуранил)метил/-4 -пипеpидинил/-7-бензофуранкарбоксиамида (соед. 75).
б) Смесь из 8 ч. соединения 75,5 ч. 2-иодпропана, 3,1 ч. N,N-диэтилэтанамина и 25,8 ч. гексаметилфосфорного триамида перемешивают в течение 20 ч при 130oC. После охлаждения реакционную смесь выливают в воду. После экстрагирования в дихлорметане экстракт промывают водой, высушивают, отфильтровывают и выпаривают. Осадок обрабатывают в 2,2'-оксибиспропане. После фильтрации этот раствор выпаривают, а полученный осадок обрабатывают в 2-пропаноле. 2,2'-оксибиспропан добавляют для повышения степени кристаллизации. Осадок отфильтровывают и растворяют в дихлорметане. Этот раствор промывают водой, высушивают, отфильтровывают и выпаривают. Полученный осадок очищают в хроматографических колонках (силикагель: CH2 Cl2(CH3OH (NH3 97:3). Очищенную фракцию выпаривают, а осадок превращают в соль этандиоата (1:1). Продукт отфильтровывают и высушивают в вакууме при 60oC. Получают 0,3 ч. (2,7) 2,3-дигидро-4-/(1-метилэтил)-амино/-N-/1-/(тетрагидро-2-фуранил) -метил/-4-пиперидинил/-бензофуранкарбоксиамид этандиоата (1: 1), т. пл. 211,7oC (соед.76).
Пример 20.
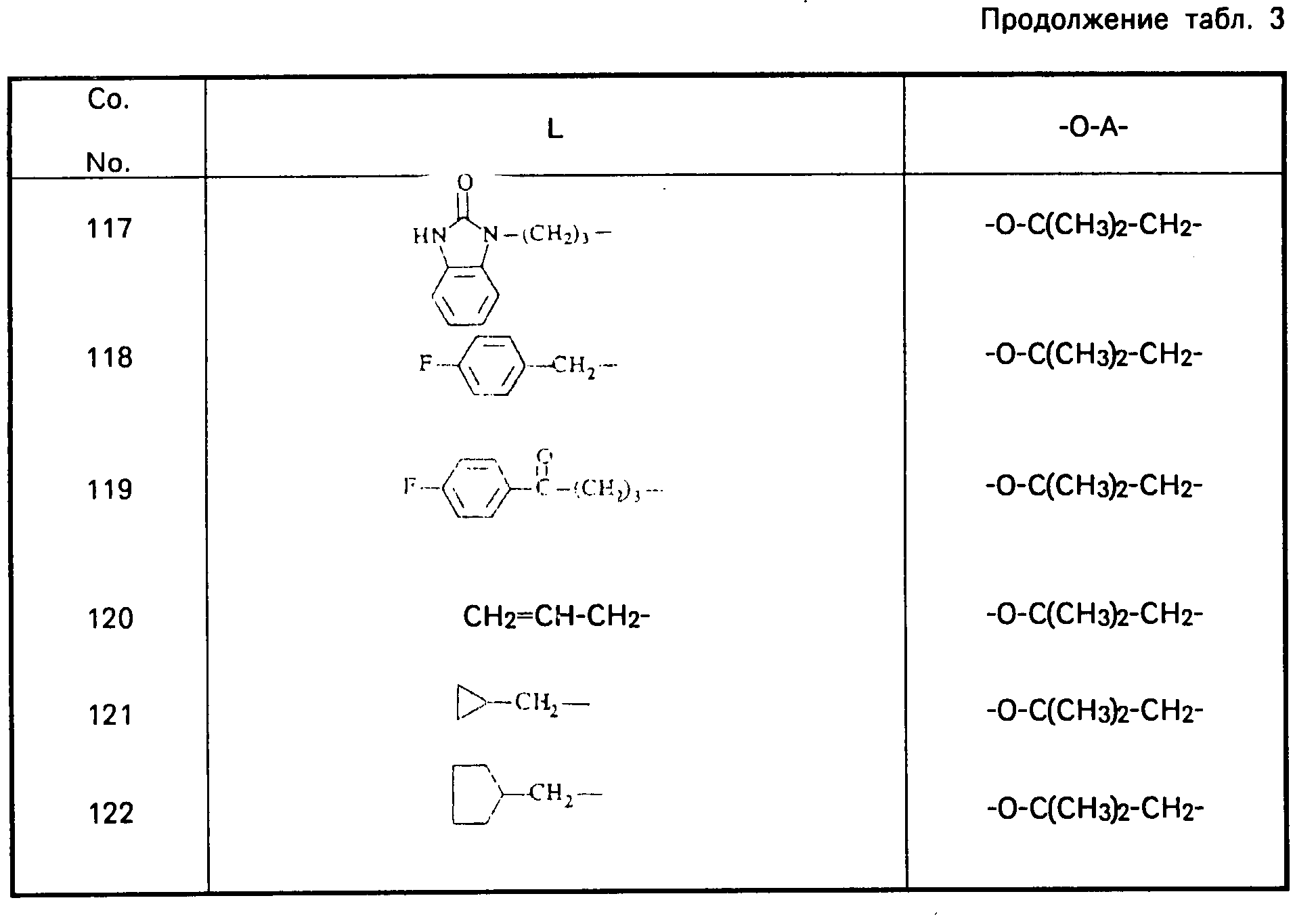
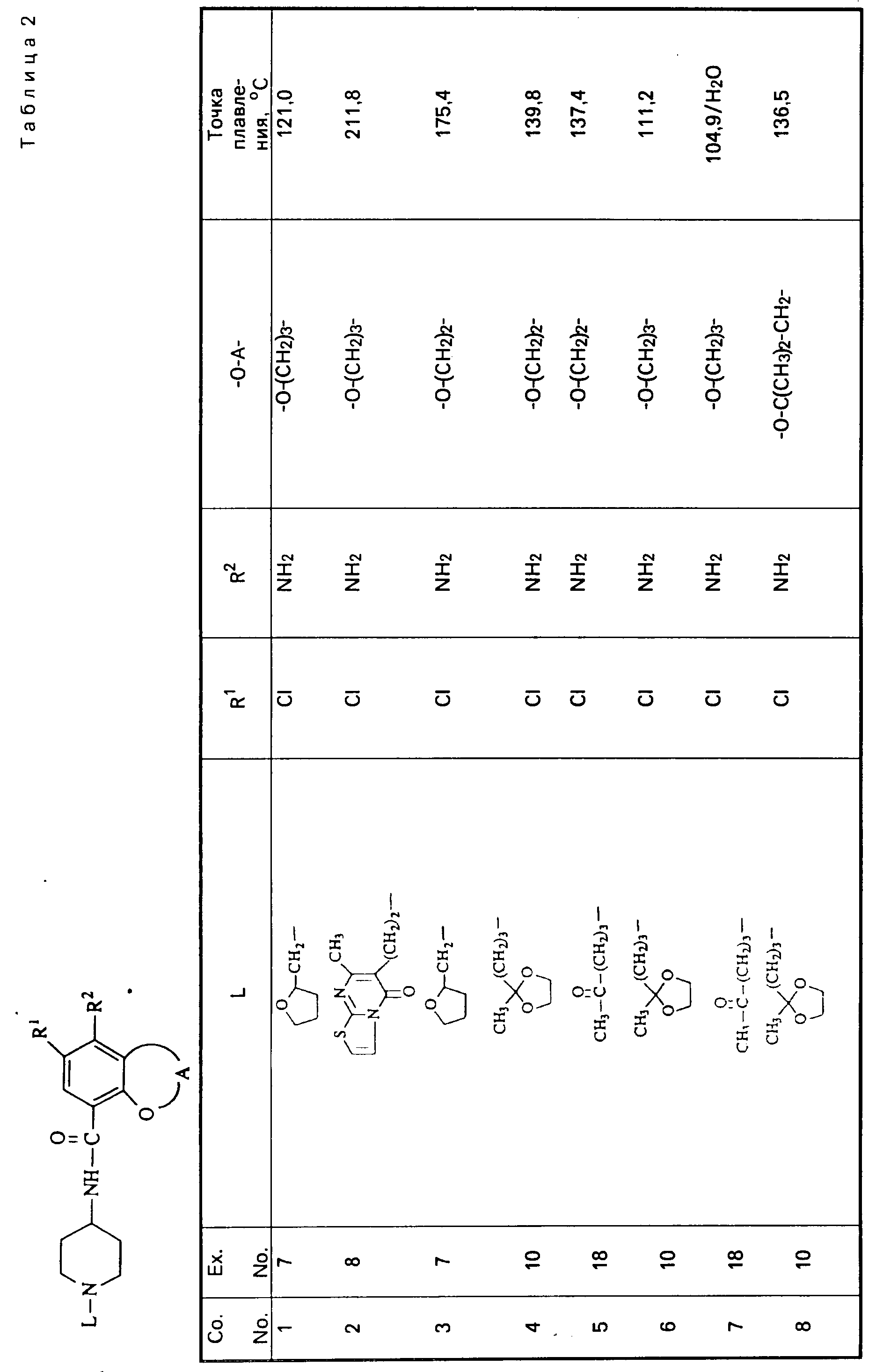
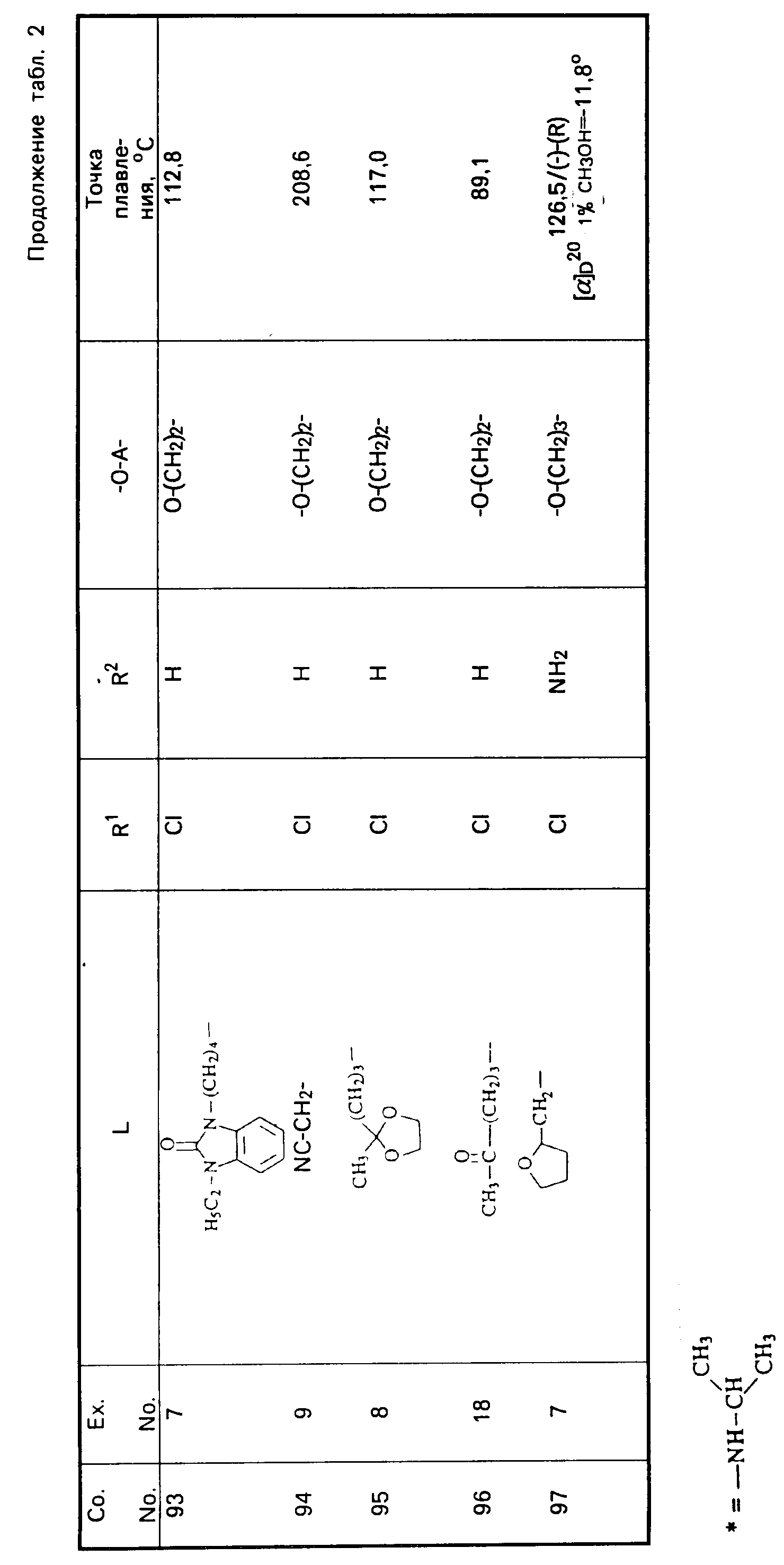
Cмесь из 5 ч. соединения 63 и 230 мл НСl (3N) перемешивают в течение 1 ч при температуре кипения. После охлаждения реакционную смесь выпаривают. Осадок перемешивают в 5 ч. воды. Затем продукт отфильтровывают, промывают небольшим количеством воды и высушивают в вакууме при 70oC. Получают 107 ч. (31,5. ) 4-//(5-амино-6-хлор-3, 4-дигидро-2Н-1-бензопиран-8-ил)карбонил/- амино/-1-пиперидинбутановая кислота моногидрохлорида моногидрата; т. пл. 204,5oC (соед. 68). Все соединения, указанные в табл. 2 и 3, получают теми же способами, которые описаны в примерах 7 20.
Пример 21.
Влияние на сокращаемость толстой кишки.
Эксперимент проведен в соответствии с методикой, описанной в "The Journal of Pharmacology and Experimental Therapeutics", 234, 776-783, 1985. Сегмент толстой кишки длиной 4,5 см вертикально подвешивают с нагрузкой 2 г в 100 мл сосуда De Zalon с раствором (KCl 5,6 мм, СаСl2•2H2O 0,54 мм, NaHCO3 5,9 мм, NaCl 154,1 мм, глюкоза 2,8 мм) при 37,5oC, наполненного смесью газов из 95 О2 и 5 СО2. Сокращения замещены в соответствии с методикой НР 7 ДСДТ-1000, IS IД Displacement Trausducer Control Unit.
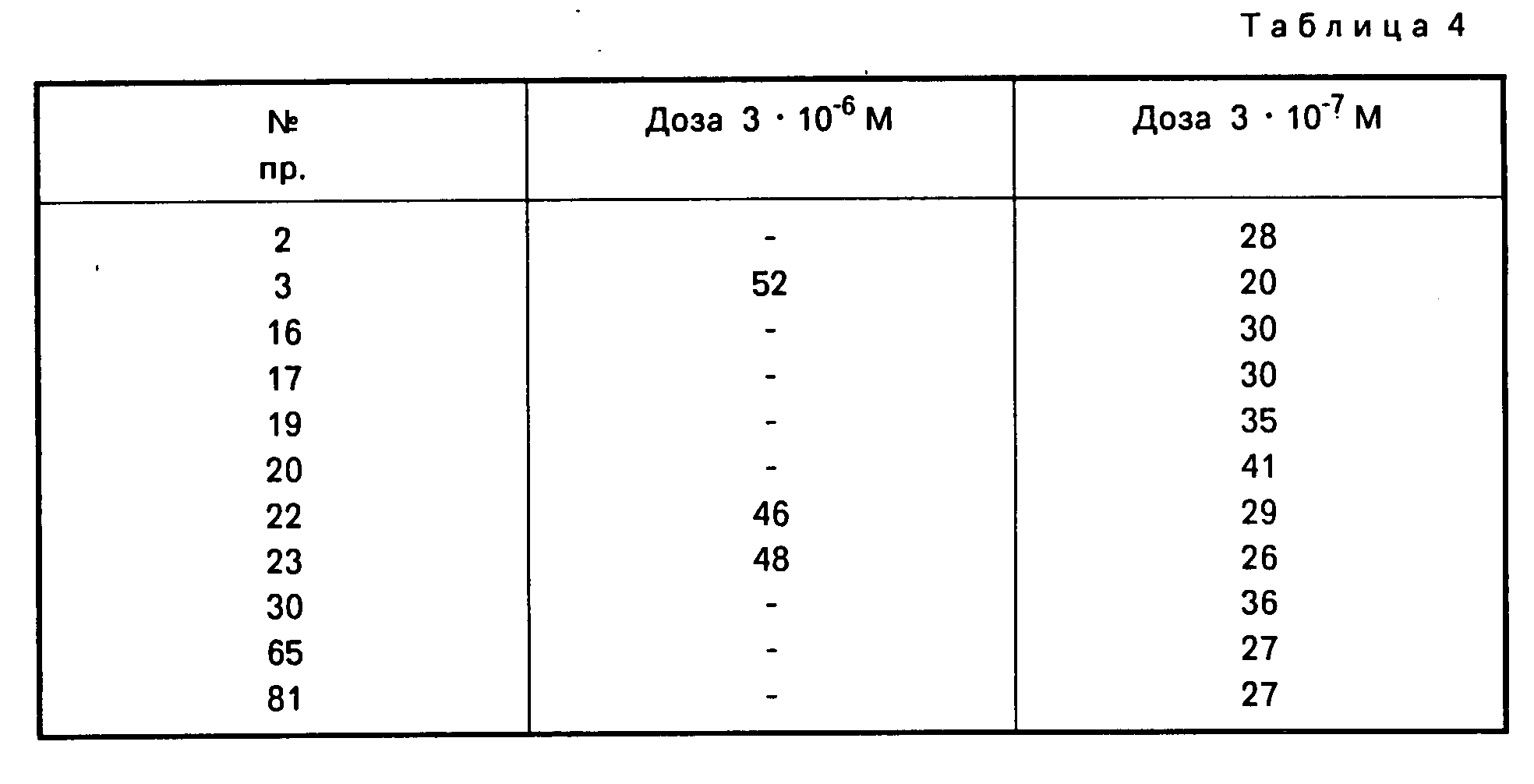
После стабилизации в течение 20 мин 3,4 х 106 М метахолина вводят в течение 15 мин. Когда сокращения сегмента кишки воспроизведены, испытания продолжают в растворе в течение 10 мин с максимальной концентрацией метахолина 3,4 x 10-6 М. Процент воспроизводимости результатов испытаний представлен в табл. 4 для конкретного номера соединения формулы (I).
Д. Примеры соединения.
Фармацевтические соединения в соответствии с настоящим изобретением предназначены для дозированного систематического или временного применения для теплокровных животных.
Активные ингредиенты (АИ), используемые в примерах (фармацевтически пригодные кислота, примесь соли и стереоизомеры), относятся к соединениям формулы (I).
Пример 22.
Растворы для орального применения.
9 г метил 4-гидроксибензоата и 1 г пропил 4-гидроксибензоата растворяют в 4 л кипящей очищенной воде. В 3 л этого раствора растворяют сначала 10 г 2, 3-дигидроксибутадиеновой кислоты, а затем 20 г АИ. Затем в этот раствор добавляют оставшийся 1 л раствора и уже в этот общий раствор добавляют 12 л 1,2,3-пропантриола и 3 л 70-ного сорбитола, 40 г сахарина натрия растворяют в 0,5 л воды, а затем добавляют по 2 мл малиновой и крыжовниковой эссенции. Полученный раствор смешивают с предыдущим раствором и разводят водой до объема 20 л. Данный оральный раствор содержит 5 мг АИ. Раствор хранится в соответствующих контейнерах.
Пример 23.
Капсулы.
20 г АИ, 6 г сульфата лаурила натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидной двуокиси кремния и 1,2 г стеарата магния энергично перемешивают вместе. Полученной смесью наполняют 1000 капсул из твердого желатина. Каждая капсула содержит 20 мг АИ.
Пример 24.
Таблетки с пленкой.
Приготовление таблеток: смесь из 100 г АИ, 570 г, лактозы и 200 г крахмала тщательно перемешивают и увлажняют раствором из 5 г додецил сульфата натрия и 10 г поливинилпирролидона (Kollidon- K90®) в 200 мл воды. Порошковую смесь пропускают через сито, высушивают и снова пропускают через сито. Затем добавляют 100 г микрокристаллической целлюлозы (Avicel®) и 15 г гидрогенизированного растительного масла (Sterofex®). Полученную смесь перемешивают и таблетируют. Количество полученных таблеток 1000. Каждая таблетка содержит 10 мг АИ.
Покрытие.
К раствору из 10 г метилцеллюлозы (Methocel 60HG®) в 75 мл денатурата этанола добавляют 5 г этилцеллюлозы (Ethocel 22 cps®) в 150 мл дихлорметана. В полученный раствор добавляют 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. 10 г полиэтиленгликоля размягчают и растворяют в 75 мл дихлорметана. Эту смесь добавляют к предыдущему раствору и вводят 2,5 г октадецената магния, 5 г поливинилпирролидона и 30 мл концентрированной цветной суспензии (Opaspray K-1-2109®) и всю смесь гомогенизируют. Полученной смесью покрывают таблетки в специальных аппаратах.
Реферат
Использование: в медицине в
качестве веществ, стимулирующих активность гастрокишечной системы. Сущность изобретения: производные N-(4-пиперидинил)(дигидробензофуран или дигидро-2Н-бензопиран) ф-лы I:
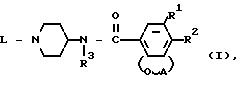
где А является радикалом формулы:
-CH2-CH2- - (a-1)
-CH2 -CH2-CH2- - (a-2)
или
-CH2-CH2-CH2-CH2- - (a-3),
где один или два атом водорода в радикалах от (а-1) до (а-3) могут быть замещены С1-6 алкилрадикалом; R1 - атом водорода или галогена, R2 - атом водорода, амино-, моно- или ди(С1-6 алкил) амино-группа или С1-6 алкилкарбониламиногруппа, R3 - атом водорода, или С1-6 алкил, L -С3-6 циклоалкил, С5-6 циклоалканон, С3-6 алкенил, избирательно замещенный арилом, или L - радикал формулы:
Alk - R4 - (b-1)
Alk - X - R5 - (b-2)
Alk - Y-C(=O)-R7 - (b-3)
R4 - атом водорода, цианогруппа, С3-6 циклоалкил, арил, ди(арилметил) или Het, R5 - атом водорода, С1-6 алкил, гидрокси-С1-6 алкил, С3-6 циклоалкил, арил или Het; X является О или NH; R7 - атом водорода, С1-6 алкил, арил, С1-6 алкилокси- или гидроксигруппа; Y является NR8 или прямая связь, указанный R8 - атом водорода или арил; каждый арил - незамещенный фенил или фенил, замещенный 1-3 заместителями каждый, независимо выбранный из атома галогена или С1-6 алкилоксигруппы, и каждый Het - тетрагидрофуранил, 1,3-диоксоланил, замещенный С1-4 алкилом; 3,4-дигидро-1(2Н)-бензопиранил; пиперидинил; пиридинил, в случае СN; пиразинил, замещенный С1-4алкилом; индолил; 2,3-дигидро-2-оксо-1Н-бензимидазолил, при необходимости замещенный С1-4 алкил; 2-оксо-1-имидазолидинил, замещенный С1-4 алкилом; 3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-ил, замещенный тремя С1-4 алкилоксигруппами; 1-оксо-2(1Н)-фталазинил; 2,3-дигидро-5-оксо-5Н-тиазол-[3,2-a]пиримидин-6-ил, замещенный С1-4 алкилом; (5-оксо-5Н-тиазол-[3, 2-a]пиримидин-6 замещенный С1-4 алкилом); 1,6-дигидро-6-оксо-1-пиридазинил, замещенный С1-4 алкилом или атомом галогена; или 1,2,3,4-тетрагидро-2,4-диоксо-3-хиназолинил, или их соли, или их стереоизомеры, обладающие свойствами, стимулирующими активность гастрокишечной системы, способ их получения, промежуточное соединение и фармацевтическая композиция на их основе. 4 с. и 8 з.п., 3 табл.
Формула
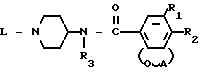
где А радикал формулы -СН2-СН2- (а-1), -СН2-СН2-СН2- (а-2) или -СН2-СН2-СН2-СН2- (а-3), в которых один или два атома водорода могут быть замещены С1 С6-алкилом;
R1 водород или галоген;
R2 водород, амино- или моно (C1 C6 -алкил) аминогруппы;
R3 водород или С1 C6-алкил;
L С3 C6-циклоалкил, С3 C6-алкенил, в случае необходимости замещенный арилом, или L радикал формулы -Alk R4 (b-1), -Alk-X-R5 (b-2) или -Alk-Y-С(= О)-R7 (b-3), в которых каждый Alk С1 С6 -алкандиил;
R4 водород, цианогруппа, С3 С6-циклоалкил, арил, диарилметил или Het;
R5 водород, С1 С6-алкил, гидрокси-С1 - С6- алкил, С3 С6-циклоалкил, арил или Het;
X кислород или NH;
R7 водород, С1 С6-алкил, арил, С1 - С6-алкилокси- или гидроксигруппа;
Y NR8 или прямая связь, где R8 водород или арил; каждый арил незамещенный фенил или фенил, замещенный 1 3 заместителями каждый, независимо выбранный из атома галогена или С1 С6-алкилоксигруппы и каждый Het тетрагидрофуранил, 1,3-диоксоланил, замещенный С1 - С4 -алкилом; 3,4-дигидро-1(2Н)-бензопиранил; пиперидинил; пиридинил, в случае необходимости замещенный цианогруппой; пиразинил, замещенный С1 - С4-алкилом; индолил; 2, 3-дигидро-2-оксо-1Н-бензимидазолил, при необходимости замещенный С1 С4-алкилом; 2-оксо-1-имидазолидинил, замещенный С1 С4-алкилом; 3,4-дигидро-4-оксо-1,2, 3-бензотриа-зин-3-ил, замещенный тремя С1 - С4-алкилоксигруппами; 1-оксо-2(1Н)-фталазинил; 2,3-дигидро-5-оксо-5Н-тиазол-[3,2-а]-пиримидин-6-ил, замещенный С1 - С4-алкилом; 5-оксо-5Н-тиазол [3,2-а]-пиримидин-6-ил, замещенный С1 С4-алкилом; 1,6-дигидро-6-оксо-1-пиридазинил, замещенный С1 - С4-алкилом или галогеном; или 1,2,3,4-тетрагидро-2,4-диоксо-3-хиназолинил,
или их солей, или их стереоизомеров, отличающийся тем, что соединение общей формулы II
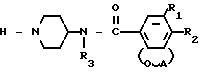
где R1, R2, R3 и А имеют указанные значения,
подвергают N-алкилированию действием соединения общей формулы III L-W, где L имеет указанные значения, W галоген или сульфонилоксигруппа, в среде инертного растворителя, в случае необходимости в присутствии основания и/или соли йода, и выделяют целевой продукт в свободном виде или в виде терапевтически активной нетоксичной соли обработкой основания соответствующей кислотой или обратно превращают соль в свободное основание обработкой щелочью, и/или соединение формулы I, содержащее функциональную гидроксигруппу, может быть О-алкилировано действием соответствующего алкилирующего агента в присутствии основания и растворителя, или соединение формулы I, несущее защитное диоксалановое кольцо, может быть деацетилировано до соответствующих оксосоединений действием кислой водной среды, или соединение формулы I, содержащее в качестве заместителей -CN-группу, может быть превращено в соответствующий амин действием водорода в присутствии соответствующего катализатора, при необходимости в присутствии основания, или соединение формулы I, содержащее аминогруппу, может быть алкилировано действием соответствующего алкилирующего агента, или соединение формулы I, содержащее аминогруппы, может быть получено путем обработки карбамата основанием, или соединение формулы I, содержащее эфирные группы, может быть превращено в соответствующую карбоксильную кислоту обработкой водной щелочью или водным кислотным раствором.
или их соли или их стереоизомеры.
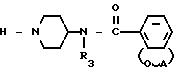
где R1, R2, R3 и А имеют значения, указанные в п. 1,
в качестве промежуточного продукта для синтеза производных N-/4-пиперидинил/-дигидробензофуран или дигидро-2Н-бензопиран-карбоксиамида, обладающих действием, стимулирующим гастрокишечную систему.

Комментарии