Производные хроменона и хроманона в качестве ингибиторов интегринов - RU2234505C2
Код документа: RU2234505C2
Описание
Настоящее изобретение относится к соединениям формулы I

в которой
R1 обозначает CH2OR10, COOR10, CONHR10 или CONCR12)2,
R2 обозначает R10, CO-R10, CO-R6, COOR6, COOR10, SO2R6, SO2R10, CONHR6, CON(R6)2, CONHR10 или CON(R12)2,
R3 обозначает H, Hal, NHR10, N(R12)2, -NH-ацил, -O-ацил, CN, NO2, OR10, SR10, SO2R10, SО3Р10, COOR10, CONHR6 , CON(R6)2, CONHR10 или СОN(R12)2,
R4 обозначает Н, А, Аr или аралкилен с 7-14 С-атомами,
R5 обозначает NH2, H2N-C(=NH) или Н2N-(С=МН)-NН, при этом первичные аминогруппы могут быть защищены также обычными аминозащитными группами, или могут быть одно-, дву- либо тризамещенными заместителями R10, CO-R10, COOR10 или SO2R10, или обозначает R6-NH-,
R6 обозначает одно- либо двухъядерный гетероцикл с 1-4 N-, О- и/или S-атомами, который может быть незамещенным либо одно-, дву- или тризамещенным заместителями Hal, А, -СО-А, ОН, CN, СООН, СООА, CONH2, NO2, =NH или =O,
R7, R8 каждый независимо друг от друга отсутствует или обозначает Н, R7 и R8 вместе образуют также связь,
Z отсутствует или обозначает О, S, NH, NR1, С(=O), CONH, NHCO, C(=S)NH, NHC(=S), C(=S), SO2NH, NHSO2 или СА=СА',
R9 обозначает Н, Hal, OR11, NH2, NHR12, N(R12)2 NНацил, Оацил, CN, NO2, SR11, SOR12, SO2R12 или SO3Н,
R10 обозначает Н, А, Аr или аралкилен с 7-14 С-атомами,
R11 обозначает Н или алкил с 1-6 С-атомами,
R12 обозначает алкил с 1-6 С-атомами,
А обозначает Н или незамещенный либо одно-, дву- или тризамещенный заместителем R9 алкил с 1-15 С-атомами или циклоалкил с 3-15 С-атомами и где одна, две либо три метиленовые группы могут быть заменены на N, О и/или S,
Аr обозначает незамещенную либо одно-, дву- или тризамещенную заместителями А и/или R9 одно- либо двухъядерную ароматическую циклическую систему с 0, 1, 2, 3 или 4 N-, О- и/или S-атомами, Hal обозначает F, Cl, Вr или I и
m, n каждый независимо друг от друга обозначает 0, 1, 2, 3 или 4, а также к их физиологически приемлемым солям и сольватам.
Аналогичные соединения известны, например, из заявок WO 94/29273, WO 96/00730 и WO 96/18602.
В основу настоящего изобретения была положена задача получить новые соединения с ценными свойствами, прежде всего такие соединения, которые могли бы применяться для изготовления соответствующих лекарственных средств.
Было установлено, что соединения формулы I и их соли и сольваты наряду с хорошей совместимостью обладают очень ценными фармакологическими свойствами. В первую очередь они эффективны в качестве ингибиторов интегринов, причем прежде всего они подавляют взаимодействие рецепторов αv-интегрина с лигандами. Особую эффективность соединения проявляют в случае интегринов αvβ3 и αvβ5. Наиболее эффективны указанные соединения в качестве антагонистов адгезионных рецепторов по отношению к рецептору витронектина αvβ3. Эффективность этого действия может быть подтверждена с помощью метода, описанного у J.W.Smith и др. в Journ. Biol. Chem. 265, стр. 11008-11013 и 12267-12271 (1990).
В. Felding-Habermann и D.A. Cheresh описывают в Curr. Opin. Cell. Biol. 5, стр. 864 (1993) значение интегринов в качестве адгезионных рецепторов для самых разных феноменов и клинических проявлений, в частности по отношению к рецептору витронектина αvβ3.
Зависимость возникновения ангиогенеза от взаимодействия между васкулярными интегринами и внеклеточными матриксными белками описана у Р.С.Brooks, R.A.Clark и D.A.Cheresh в Science 264. стр. 569-571 (1994).
Возможность подавления этого взаимодействия и тем самым возможность для начала апоптоза (запрограммированная гибель клеток) ангиогенных васкулярных клеток с помощью циклического пептида описана у Р.С.Brooks, A.M.Montgomery, M.Rosenfeld, R.A.Reisfeld, T.-Hu, G.Klier и D.A.Cheresh в Cell 79, стр. 1157-1164 (1994).
Подтверждение того факта, что и соединения по изобретению препятствуют прикреплению живых клеток на соответствующих матриксных белках и соответственно также прикреплению к ним раковых клеток, может быть получено экспериментальным путем в тесте на адгезию клеток, проводимом аналогично методу F.Mitjans и др., описанному в Journ. Cell Science 108, стр. 2825-2838 (1995).
Р.С.Brooks и др. описывают в Journ. Clin. Invest. 96, стр. 1815-1822 (1995) αvβ3-антагонисты для борьбы с раком и для лечения обусловленных опухолями ангиогенных заболеваний. С учетом этого предлагаемые в изобретении соединения формулы I могут применяться в качестве биологически активных веществ в лекарственных средствах, предназначенных прежде всего для лечения опухолевых заболеваний, остеопорозов, остеолитических заболеваний, а также для подавления ангиогенеза.
Соединения формулы I, блокирующие взаимодействие рецепторов интегрина с лигандами, например, связывание фибриногена с фибриногенным рецептором (гликопротеин IIb/IIIa), препятствуют в качестве гпIIb/IIIа-антагонистов метастазу раковых клеток. Это подтверждают следующие наблюдения.
Распространение раковых клеток от местной опухоли в сосудистую систему происходит за счет образования микроагрегатов (микротромбов). Раковые клетки блокированы благодаря защите в микроагрегате и не распознаются клетками иммунной системы. Микроагрегаты могут прикрепляться к стенкам сосудов, что облегчает дальнейшее проникновение раковых клеток в ткань. Благодаря тому, что образование микротромбов происходит опосредованно за счет связывания фибриногена с фибриногенными рецепторами на активированных тромбоцитах, гпIIa/IIIb - антагонисты могут рассматриваться как эффективные ингибиторы метастаз.
Наряду с ингибированием связывания фибриногена, фибронектина и фактора Виллебранда с фибриногенным рецептором тромбоцитов соединения формулы I подавляют также связывание других адгезионных протеинов, таких как витронектин, коллаген и ламинин, с соответствующими рецепторами на поверхности клеток различных типов. Прежде всего они препятствуют образованию тромбоцитарных ("бляшечных") тромбов и могут поэтому применяться для лечения тромбозов, апоплексии, инфаркта миокарда, воспалений и артериосклероза.
Эффективность свойств соединений по изобретению может быть подтверждена также с помощью методов, описанных в ЕР 0462960 А1. Подавление связывания фибриногена с фибриногенным рецептором может быть подтверждено с помощью метода, описанного в ЕР 0381033 А1.
Действие, подавляющее агрегацию тромбоцитов, может быть подтверждено in vitro по методу Борна (Born, Nature 4832, стр. 927-929, 1962).
Объектом настоящего изобретения в соответствии с этим являются соединения формулы I согласно пункту 1 и их физиологически приемлемые соли и сольваты в качестве гпIIb/IIIa-антагонистов для борьбы с тромбозами, инфарктом миокарда, ишемической болезнью сердца и артериосклерозом.
Объектом изобретения являются далее соединения формулы I согласно пункту 1 и их физиологически приемлемые соли и сольваты для получения соответствующего лекарственного средства, предназначенного для применения в качестве ингибиторов интегринов.
Объектом изобретения являются прежде всего соединения формулы I согласно пункту 1 и их физиологически приемлемые соли и сольваты для получения соответствующего лекарственного средства, предназначенного для борьбы с обусловленными патологическими факторами ангиогенными заболеваниями, опухолями, остеопорозом, воспалениями и инфекциями.
Соединения формулы I могут применяться в качестве активных веществ в лекарственных средствах, предназначенных для использования в медицине и ветеринарии, прежде всего для профилактики и/или терапии тромбоза, инфаркта миокарда, артериосклероза, воспалений, апоплексии, стенокардии, раковых заболеваний, остеолитических заболеваний, таких как остеопороз, патологических ангиогенных заболеваний, таких, например, как воспаления, офтальмологических заболеваний, диабетической ретинопатии, макулярной дегенерации, миопии, глазного гистоплазмоза, ревматоидного артрита, остеоартрита, рубеотической глаукомы, язвенного колита, болезни Крона, атеросклероза, псориаза, рестеноза после ангиопластики, вирусной инфекции, бактериальной инфекции, грибковой инфекции, при острой почечной недостаточности и при залечивании ран в качестве средств, способствующих ускорению процесса заживления.
Соединения формулы I могут применяться в качестве обладающих антимикробным действием субстанций при операциях, где используются биоматериалы, имплантаты, катетеры или водители ритма сердца. При этом они проявляют антисептический эффект. Эффект антимикробной активности может быть подтвержден с помощью метода, описанного у Р. Valentin-Weigund и др. в Infection and Immunity, стр. 2851-2855 (1988).
Еще одним объектом настоящего изобретения является способ получения соединений формулы I согласно пункту 1 и их солей и сольватов, который отличается тем, что
а) соединение формулы I путем обработки агентом сольволиза или гидрогенолиза высвобождают из одного из его функциональных производных или
б) один остаток R1, R2 и/или R5 превращают в другой остаток R1, R2 и/или R5, например, следующим образом:
1) аминогруппу взаимодействием с амидинирующим агентом превращают в гуанидиновую группу,
2) омыляют сложный эфир,
3) карбоновую кислоту восстанавливают до спирта,
4) гидроксиамидин путем гидрирования переводят в амидин, и/или основание либо кислоту формулы I переводят в одну из их солей.
Соединения формулы I имеют по меньшей мере один хиральный центр и поэтому могут быть представлены в нескольких стереоизомерных формах. Все эти формы (например D- и L-формы), равно как и их смеси (например DL-формы) включены в формулу I.
Предлагаемые согласно изобретению соединения включают также так называемые пролекарственные производные, то есть дериватизированные с помощью, например, алкильных или ацильных групп, Сахаров или олигопептидов соединения формулы I, которые в организме быстро расщепляются до эффективных соединений по изобретению.
Соединения по изобретению включают также сольваты этих соединений. Под этим понятием имеются в виду аддукты, образующиеся при взаимодействии, например с водой (гидраты) или спиртами, такими как метанол или этанол.
Принятые далее сокращения обозначают:
Ас ацетил
БОК трет-бутоксикарбонил
БзОК бензилоксикарбонил
ДЦК дициклогексилкарбодиимид
ДМФ диметилформамид
ДОФА (3,4-дигидроксифенил)анилин
ДПФН нитрат 3,5-диметилпиразол-1-формамидиния
ДМАП диметиламинопиридин
ЭДК N-этил-N,N'-(диметиламинопропил)карбодиимид
Et этил
Fmoc 9-флуоренилметоксикарбонил
ГОБТ 1-гидроксибензотриазол
Me метил
МТБЭ метил-трет-бутиловый эфир
Мтр 4 метокси-2,3, 6-триметилфенилсульфонил
N-МП N-метилпирролидон
N-ГОСу N-гидроксисукцинимид
Нп неопентил
Овn бензиловый эфир
OBut трет-бутиловый эфир
Okt октаноил
ОMе метиловый эфир
OEt этиловый эфир
Орн орнитин
Пбф 2,2,4,6, 7-пентаметилдигидробензофуран-5-сульфонил
ФОА феноксиацетил
ТБТУ тетрафтороборат O-(бензотриазол-1-ил)-N,N,N',N'-тeтpaметилурония
ТФК трифторуксусная кислота
пТСК-соль соль пара-толуолсульфокислоты
Трт тритил (трифенилметил)
Для изобретения в целом справедливо, что все остатки, неоднократно присутствующие в соединениях, могут быть идентичными или разными, иными словами, их значения не зависят друг от друга.
В вышеприведенных формулах алкил представляет собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил либо трет-бутил, а также пентил, 1-, 2- либо 3-метилбутил, 1,1-, 1,2- либо 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- либо 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3-либо 3,3-диметилбутил, 1- либо 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2- либо 1,2,2-триметилпропил, гептил, октил, нонил или децил.
Циклоалкил обозначает предпочтительно циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил или 3-ментил. Прежде всего циклоалкил представляет собой остаток бициклического терпена и наиболее предпочтительно камфор-10-ильный остаток.
Алкилен обозначает предпочтительно метилен, этилен, пропилен, бутилен, пентилен, а также гексилен, гептилен, октилен, нонилен или децилен. Аралкилен обозначает предпочтительно алкиленфенил и представляет собой, например, предпочтительно бензил или фенетил.
Циклоалкилен обозначает предпочтительно циклопропилен, 1, 2- либо 1,3-циклобутилен, 1,2- либо 1,3-циклопентилен, 1,2-, 1,3- либо 1,4-циклогексилен, а также 1,2-, 1,3- либо 1,4-циклогептилен.
СО-А представляет собой алканоил или циклоалканоил и обозначает предпочтительно формил, ацетил, пропионил, бутирил, пентаноил, гексаноил, гептаноил, октаноил, нонаноил, деканоил, ундеканоил, додеканоил, тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, гептадеканоил или октадеканоил.
Ацил представляет собой С1-С7ацил и имеет 1, 2, 3, 4, 5, 6 или 7 С-атомов и обозначает предпочтительно, например, формил, ацетил, пропионил, бутирил, трифторацетил или бензоил.
Предпочтительными заместителями R9 для алкила, алкилена, циклоалкила, циклоалкилена, алканоила, циклоалканоила и арила являются, например, Hal, OR11, NHR12, N(R12)2 CN, NO2, SR11, SOR12, SO2R12 и/или SO3H, прежде всего, например, F, Cl, гидрокси-, метокси-, этокси-, амино-, диметиламино-, метилтиогруппы, метилсульфинил, метилсульфонил или фенилсульфонил.
В алкильных, алкиленовых, циклоалкильных, циклоалкиленовых, алканоильных и циклоалканоильных группах соответственно одна, две либо три метиленовых группы могут быть заменены на N, О и/или S.
Аr-СО представляет собой ароил и обозначает предпочтительно бензоил или нафтоил.
Аr представляет собой незамещенный или предпочтительно, как указано выше, однозамещенный фенил, конкретно предпочтительно фенил, о-, м- либо п-толил, о-, м- либо п-этилфенил, о-, м- либо п-пропилфенил, о-, м- либо п-изопропилфенил, о-, м- либо п-трет-бутилфенил, о-, м- либо п-цианфенил, о-, м- либо п-метоксифенил, о-, м- либо п-этоксифенил, о-, м- либо п-фторфенил, о-, м- либо п-бромфенил, о-, м- либо п-хлорфенил, o-, м- либо п-метилтиофенил, о-, м- либо п-метилсульфинилфенил, о-, м- либо п-метилсульфонилфенил, о-, м- либо п-аминофенил, о-, м- либо п-метиламинофенил, о-, м- либо п-диметиламинофенил, о-, м- либо п-нитрофенил, а также предпочтительно 2,3-, 2,4-, 2,5-, 2,6-, 3,4- либо 3, 5-дифторфенил, 2,3-, 2,4-, 2, 5-, 2,6-, 3,4- либо 3,5-дихлорфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- либо 3,5-дибромфенил, 2-хлор-3-метил-, 2-хлор-4-метил-, 2-хлор-5-метил-, 2-хлор-6-метил-, 2-метил-3-хлор-, 2-метил-4-хлор-, 2-метил-5-хлор-, 2-метил-б-хлор-, 3-хлор-4-метил-, 3-хлор-5-метил- либо 3-метил-4-хлорфенил, 2-бром-3-метил-, 2-бром-4-метил-, 2-бром-5-метил-, 2-бром-6-метил-, 2-метил-3-бром-, 2-метил-4-бром-, 2-метил-5-бром-, 2-метил-6-бром-, 3-бром-4-метил-, 3-бром-5-метил- либо 3-метил-4-бромфенил, 2,4- либо 2,5-динитрофенил, 2,5- либо 3,4-диметоксифенил, 2,3,4-, 2,3, 5-, 2,3,6- либо 3,4,5-трихлорфенил, 2, 4,6-три-трет-бутилфенил, 2,5-диметилфенил, п-иодфенил, 4-фтор-3-хлорфенил, 4-фтор-3,5-диметилфенил, 2-фтор-4-бромфенил, 2,5-дифтор-4-бромфенил, 2, 4-дихлор-5-метилфенил, 3-бром-6-метоксифенил, 3-хлор-6-метоксифенил, 2-метокси-5-метилфенил, 2,4,6-триизопропилфенил, нафтил, 1,3-бензодиоксол-5-ил, 1,4-бензодиоксан-6-ил, бензотиадиазол-5-ил либо бензоксадиазол-5-ил.
Кроме того, Аr обозначает предпочтительно 2- либо 3-фурил, 2- либо 3-тиенил, 1-, 2- либо 3-пирролил, 1-, 2-, 4- либо 5-имидазолил, 1-, 3-, 4- либо 5-пиразолил, 2-, 4- либо 5-оксазолил, 3-, 4- либо 5-изоксазолил, 2-, 4- либо 5-тиазолил, 3-, 4- либо 5-изотиазолил, 2-, 3- либо 4-пиридил, 2-, 4-, 5- либо 6-пиримидинил, а также предпочтительно 1,2,3-триазол-1-, -4- либо -5-ил, 1,2,4-триазол-1-, -3- либо -5-ил, 1- либо 5-тетразолил, 1,2,3-оксадиазол-4-либо -5-ил, 1,2,4-оксадиазол-3- либо -5-ил, 1,3,4-тиадиазол-2- либо -5-ил, 1,2,4-тиадиазол-3- либо -5-ил, 1, 2,3-тиадиазол-4- либо -5-ил, 2-, 3-, 4-, 5-либо 6-2Н-тиопиранил, 2-, 3- либо 4-4Н-тиопиранил, 3- либо 4-пиридазинил, пиразинил, 2-, 3-, 4-, 5-, 6- либо 7-бензофурил, 2-, 3-, 4-, 5-, 6- либо 7-бензотиенил, 1-, 2-, 3-, 4-, 5-, 6- либо 7-индолил, 1-, 2-, 4- либо 5-бензимидазолил, 1-, 3-, 4-, 5-, 6- либо 7-бензопиразолил, 2-, 4-, 5-, 6- либо 7-бензоксазолил, 3-, 4-, 5-, 6- либо 7-бензизоксазолил, 2-, 4-, 5-, 6- либо 7-бензтиазолил, 2-, 4-, 5-, 6- либо 7-бензизотиазолил, 4-, 5-, 6- либо 7-бенз-2,1,3-оксадиазолил, 2-, 3-, 4-, 5-, 6-, 7- либо 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7- либо 8-изохинолил, 3-, 4-, 5-, 6-, 7- либо 8-циннолинил, 2-, 4-, 5-, 6-, 7-либо 8-хиназолинил.
Арилен имеет те же значения, что и указанные для Аr, при условии, что присутствует еще одна связь между ароматической системой и ближайшим партнером по связи.
Гетероциклоалкилен представляет собой предпочтительно 1,2-, 2,3- либо 1,3-пирролидинил, 1,2-, 2,4-, 4,5- либо 1, 5-имидазолидинил, 1,2-, 2,3- либо 1,3-пиразолидинил, 2,3-, 3,4-, 4, 5- либо 2,5-оксазолидинил, 1,2-, 2,3-, 3,4-либо 1,4-изоксазолидинил, 2,3-, 3,4-, 4,5- либо 2,5-тиазолидинил, 2,3-, 3,4-, 4,5- либо 2, 5-изотиазолидинил, 1,2-, 2,3-, 3,4- либо 1,4-пиперидинил, 1,4-либо 1,2-пиперазинил, кроме того, предпочтительно 1,2,3-тетрагидротриазол-1,2- либо -1,4-ил, 1,2,4-тетрагидротриазол-1,2- либо -3,5-ил, 1, 2- либо 2,5-тетрагидротетразолил, 1,2,3-тетрагидрооксадиазол-2,3-, -3,4-, -4,5- либо -1,5-ил, 1,2,4-тетрагидрооксадиазол-2,3-, -3,4- либо -4,5-ил, 1,3,4-тетрагидротиа-диазол-2,3-, -3,4-, -4,5- либо -1,5-ил, 1,2,4-тетрагидротиадиазол-2,3-, -3,4-, -4,5- либо -1,5-ил, 1, 2,3-тиадиазол-2,3-, -3,4-, -4,5- либо –1,5-ил, 2,3- либо 3,4-морфолинил, 2,3-, 3,4- либо 2,4-тиоморфолинил.
R6 представляет одно- либо двухъядерный гетероцикл, предпочтительно 2-либо 3-фурил, 2- либо 3-тиенил, 1-, 2- либо 3-пирролил, 1-, 2-, 4- либо 5-имидазолил, 1-, 3-, 4- либо 5-пиразолил, 2-, 4- либо 5-оксазолил, 3-, 4- либо 5-изоксазолил, 2-, 4- либо 5-тиазолил, 3-, 4- либо 5-изотиазолил, 2-, 3- либо 4-пиридил, 2-, 4-, 5- либо 6-пиримидинил, кроме того, предпочтительно 1,2,3-триазол-1-, -4- либо -5-ил, 1,2,4-триазол-1-, -3- либо -5-ил, 1- либо 5-тетразолил, 1,2,3-оксадиазол-4- либо -5-ил, 1,2,4-оксадиазол-3- либо -5-ил, 1,3,4-тиадиазол-2- либо -5-ил, 1,2,4-тиадиазол-3- либо -5-ил, 1, 2,3-тиадиазол-4- либо -5-ил, 2-, 3-, 4-, 5- либо 6-2Н-тиопиранил, 2-, 3- либо 4-4Н-тиопиранил, 3- либо 4-пиридазинил, пиразинил, 2-, 3-, 4-, 5-, 6- либо 7-бензофурил, 2-, 3-, 4-, 5-, 6- либо 7-бензотиенил, 1-, 2-, 3-, 4-, 5-, 6- либо 7-индолил, 1-, 2-, 4- либо 5-бензимидазолил, 1-,3-, 4-, 5-, 6- либо 7-бензопиразолил, 2-,4-, 5-, 6- либо 7-бензоксазолил, 3-, 4-, 5-, 6- либо 7-бензизоксазолил, 2-, 4-, 5-, 6- либо 7-бензтиазолил, 2-, 4-, 5-, 6- либо 7-бензизотиазолил, 4-, 5-, 6- либо 7-бенз-2,1,3-оксадиазолил, 2-, 3-, 4-, 5-, 6-, 7- либо 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7- либо 8-изохинолил, 3-, 4-, 5-, 6-, 7-либо 8-циннолинил, 2-, 4-, 5-, 6-, 7- либо 8-хиназолинил.
Гетероциклические остатки могут быть также частично либо полностью гидрированы.
R6 может, следовательно, обозначать, например, также 2,3-дигидро-2-, -3-, -4- либо -5-фурил, 2,5-дигидро-2-, -3-, -4- либо 5-фурил, тетрагидро-2- либо 3-фурил, 1,3-диоксолан-4-ил, тетрагидро-2- либо -3-тиенил, 2,3-дигидро-1-, -2-, -3-, -4- либо -5-пирролил, 2,5-дигидро-1-, -2-, -3-, -4-либо -5-пирролил, 1-, 2- либо 3-пирролидинил, тетрагидро-1-, -2- либо -4-имидазолил, 2, 3-дигидро-1-, -2-, -3-, -4- либо -5-пиразолил, тетрагидро-1-, -3- либо -4-пиразолил, 1,4-дигидро-1-, -2-, -3- либо -4-пиридил, 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5- либо -6-пиридил, 1-, 2-, 3- либо 4-пиперидинил, 2-, 3- либо 4-морфолинил, тетрагидро-2-, -3- либо -4-пиранил, 1,4-диоксанил, 1,3-диоксан-2-, -4- либо -5-ил, гексагидро-1-, -3- либо -4-пиридазинил, гексагидро-1-, -2-, -4- либо -5-пиримидинил, 1-, 2- либо 3-пиперазинил, 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5-, -6-, -7- либо -8-хинолил, 1,2,3,4-тетрагидро-1-, -2-, -3~, -4-, -5-, -6-, -7- либо -8-изохинолил.
Вышеназванные гетероциклические кольца могут быть также одно-, дву-либо тризамещенными заместителями Hal, А, -СО-А, ОН, CN, СООН, СООА, CONH2, NO2, =NH или =O.
Наиболее предпочтительными значениями R6 являются 1H-имидазол-2-ил, тиазол-2-ил, 1Н-бензимидазол-2-ил, 2Н-пиразол-2-ил, 1Н-тетразол-5-ил, 2-иминоимидаз олидин -4-он-5-ил, 1-алкил-1,5-дигидроимидазол-4-он-2-ил, пиридин-2-ил, пиримидин-2-ил или 1,4,5, 6-тетрагидропиримидин-2-ил.
R1 обозначает прежде всего, например, гидроксиметил, карбокси, метоксикарбонил, этоксикарбонил, CONH2, CONHMe, CONHEt, CONMe2 или CONEt2 Наиболее предпочтительно R1 обозначает карбокси или этоксикарбонил.
R2 обозначает прежде всего, например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, трет-бутилоксикарбонил, изобутилоксикарбонил, 2,2-диметилпропоксикарбонил, метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил, изобутилсульфонил, 2, 2-диметилпропилсульфонил, фенилсульфонил или бензилсульфонил. Наболее предпочтительными значениями R2 являются 2, 2-диметилпропоксикарбонил, 2,2-диметилпропилсульфонил, бутилсульфонил, фенилсульфонил или бензилсульфонил.
R3 обозначает предпочтительно, например, Н, F, Cl, Вr, амино, метиламино, этиламино, диметиламино, диэтиламино, ацетамидо, ацетокси, циан, нитро, метокси, этокси, метилсульфонил, фенилсульфонил, п-толилсульфонил, карбокси, метоксикарбонил, этоксикарбонил, CONH2, CONHMe или CONMe2. Наиболее предпочтительно R3 обозначает Н.
R4 обозначает предпочтительно, например, Н, метил, этил, пропил, изопропил или бутил. Наиболее предпочтительным значением R является Н.
R9 обозначает предпочтительно, например, Н, F, Cl, Вr, метокси, этокси, пропокси, амино, метиламино, диметиламино, этиламино, диэтиламино, ацетамидо, ацетокси, циан, нитро, метилсульфонил, фенилсульфонил, п-толилсульфонил или SO3Н. Наиболее предпочтительным значением R9 является Н.
R обозначает Н или алкил с 1-6 С-атомами, но предпочтительно Н.
В соответствии с этим объектом изобретения являются прежде всего такие соединения формулы I, в которых по меньшей мере один из названных остатков имеет одно из вышеуказанных предпочтительных значений. Некоторые предпочтительные группы могут быть представлены подпадающими под формулу I следующими субформулами Ia-In, где не расшифрованные более подробно остатки имеют значения, указанные в формуле I, однако есть и определенные отличия, а именно:
в Iа R3 обозначает Н;
в Ib R3 обозначает Н, а R2 обозначает COOR10 или SO2R10,
в Iс R3 обозначает Н, R2 обозначает COOR10 или SO2R10 и R10 обозначает Н, А, Аr или аралкилен с 7-14 С-атомами;
в Id m обозначает 0;
в Ie m обозначает 0, a R3 обозначает Н;
в If R3 обозначает Н, R2 обозначает COOR10 или SO2R10 и m обозначает 0;
в Ig R3 обозначает Н, R2 обозначает COOR10 или SO2R10, R10 обозначает Н, А, Аr или аралкилен с 7-14 С-атомами и m обозначает 0;
в Ih R3 обозначает Н, R2 обозначает COOR10 или SO2R10,
R10 обозначает Н, А, Аr или аралкилен с 7-14 С-атомами, А обозначает Н или незамещенный алкил с 1-15 С-атомами или циклоалкил с 3-15 С-атомами, Аr обозначает фенил или нафтил и m обозначает 0;
в Ii R6 представляет собой одно- либо двухъядерный гетероцикл с 1-4 N-атомами, который может быть незамещенным либо одно-, дву- или тризамещенным заместителями Hal, А, -СО-А, ОН, CN. СООН, СООА, CONH2, NO2, =NH или =O;
в Ij R3 обозначает Н, R2 обозначает COOR10 или SO2R10, R10 обозначает Н, А, Аr или аралкилен с 7-14 С-атомами, m обозначает 0, R6 представляет собой одно- либо двухъядерный гетероцикл с 1-4 N-атомами, который может быть незамещенным либо одно-, дву- или тризамещенным заместителями Hal, А, -СО-А, ОН, CN. СООН, СООА, CONH2, NO2, =NH или =O;
в Ik Z отсутствует;
в Il Z отсутствует и R3 обозначает Н;
в Im Z отсутствует, R3 обозначает Н и R2 обозначает COOR10 или SO2R10;
в In Z отсутствует, R3 обозначает Н, R4 обозначает Н, R2 обозначает COOR10 или SO2R10, R10 обозначает Н, А, Аr или аралкилен с 7-14 С-атомами, R6 представляет собой одно- либо двухъядерный гетероцикл с 1-4 N-атомами, который может быть незамещенным либо одно-, дву- или тризамещенным заместителями Hal, А, -СО-А, ОН, CN, СООН, СООА, СОNН2, NO2, =NH или =O,
А обозначает Н или незамещенный алкил с 1-6 С-атомами,
Аr обозначает фенил или нафтил и
m обозначает 0.
Особенно предпочтительны группы представленных ниже соединений согласно приведенной формуле I соответственно:
а)

в которой
R1 обозначает CH2OR10, COOR10, CONHR10 или CON(R12)2,
R2 обозначает COOR10 или SO2R10,
R5 обозначает NH2, H2N-C(=NH) либо H2N-(C=NH)-NH или R6NH-,
R6 обозначает 1Н-имидазолил-2-ил, 1Н-бензимидазол-2-ил, пиримидин-2-ил или пиридин-2-ил,
R7, R8 каждый независимо друг от друга отсутствует или обозначает Н, или
R7 и R8 вместе образуют также связь,
Z отсутствует,
R10 обозначает Н, А, Аr или бензил,
R11 обозначает Н,
R12 обозначает алкил с 1-6 С-атомами,
А обозначает Н или незамещенный алкил с 1-15 С-атомами либо циклоалкил с 3-15 С-атомами,
Аr обозначает фенил или нафтил,
m обозначает 0,
n обозначает 2, 3 или 4,
а также их физиологически приемлемые соли и сольваты;
б)

в которой
R1 обозначает CH2OR10, COOR10, CONHR10 или СОN(R12)2,
R2 обозначает R10, CO-R10, COOR10 или SO2R10 .
R4 обозначает Н или R12.
R5 обозначает NH2, H2N-C(=NH) или H2N-(C=NH)-NH, при этом первичные аминогруппы могут быть также защищены обычными аминозащитными группами, или могут быть одно-, дву- либо тризамещенными заместителями R10, CO-R10, COOR10 или SO2R10, или обозначает R6-NH-,
R6 обозначает 1Н-имидазол-2-ил, 1Н-бензимидазол-2-ил, 2Н-пиразол-2-ил, 1H-тетразол-5-ил, 2-иминоимидазолидин-4-он-5-ил, 1-алкил-1,5-дигидроимидазол-4-он-2-ил, пиридин-2-ил, пиримидин-2-ил или 1,4,5, 6-тетрагидропиримидин-2-ил,
R7, R8 каждый независимо друг от друга отсутствует или обозначает Н, или
R7 и R8 вместе образуют также связь,
Z отсутствует,
R10 обозначает Н, А, Аr или аралкилен с 7-14 С-атомами,
R11 обозначает Н,
R12 обозначает алкил с 1-6 С-атомами,
А обозначает Н или незамещенный алкил с 1-6 С-атомами,
Аr обозначает фенил или нафтил,
Hal обозначает F, Cl, Вr либо I и
m обозначает 0,
n обозначает 2, 3 или 4,
а также их физиологически приемлемые соли и сольваты;
в)

в которой
R1 обозначает CH2OR10, COOR10, CONHR10 или СОN(R12)2,
R2 обозначает R10, CO-R10, COOR10 или SО2R10,
R4 обозначает Н или R12,
R5 обозначает NH2, H2N-C(=NH) или H2N-(C=NH)-NH, при этом первичные аминогруппы могут быть также защищены обычными аминозащитными группами, или могут быть одно-, дву- либо тризамещенными заместителями R10, CO-R10, COOR10 или SO2R10, или обозначает R6-NH-,
R6 обозначает 1Н-имидазол-2-ил, 1Н-бензимидазол-2-ил, 2Н-пиразол-2-ил, 1Н-тетразол-5-ил, 2-иминоимидазолидин-4-он-5-ил, 1-алкил-1,5-дигидроимидазол-4-он-2-ил, пиридин-2-ил, пиримидин-2-ил или 1,4,5, 6-тетрагидропиримидин - 2-ил,
R7, R8 каждый независимо друг от друга отсутствует или обозначает Н, или
R7 и R8 вместе образуют также связь,
Z отсутствует или обозначает О, С(=O) или СН=СН,
R9 обозначает Н, Hal, OR11, NH2, NHR12, N(R12)2, NНаций, Оацил, CN, NO2, SR11, SOR12, SО2R12 или SO3Н,
R10 обозначает Н, А, Аr или аралкилен с 7-14 С-атомами,
R11 обозначает Н,
R12 обозначает алкил с 1-6 С-атомами,
А обозначает Н или незамещенный алкил с 1-6 С-атомами,
Аr обозначает незамещенный либо одно-, дву- или тризамещенный заместителями А и/или R9 фенил или нафтил,
Hal обозначает F, Cl, Br либо I и
m обозначает 0,
n обозначает 2, 3 или 4,
а также их физиологически приемлемые соли и сольваты;
г)

в которой
R1 обозначает CH2OR10, COOR10, CONHR10 или СОN(R12)2,
R2 обозначает R10, CO-R10, COOR10 или SО2R10,
R4 обозначает Н или R12.
R5 обозначает NH2, H2N-C(=NH) или H2N-(C=NH)-NH, при этом первичные аминогруппы могут быть также защищены обычными аминозащитными группами, или могут быть одно-, дву- либо тризамещенными заместителями R10, CO-R10, COOR10 или SO2R10, или обозначает R6-NH-,
R6 обозначает 1Н-имидазол-2-ил, 1H-бензимидазол-2-ил, 2Н-пиразол-2-ил, 1Н-тетразол-5-ил, 2-иминоимидазолидин-4-он-5-ил, 1-алкил-1, 5-дигидроимидазол-4-он-2-ил, пиридин-2-ил, пиримидин-2-ил или 1,4,5,6-тетрагидропиримидин - 2-ил,
R7, R8 каждый независимо друг от друга отсутствует или обозначает Н, или
R7 и R вместе образуют также связь,
Z отсутствует,
R9 обозначает Н, Hal, OR11, NH2, NHR12, N(R12)2, NНацил, Оацил, CN, NO2, SR11, SOR12, SC2 R12 или SО3Н,
R10 обозначает Н, A, Ar или аралкилен с 7-14 С-атомами,
R11 обозначает Н или алкил с 1-6 С-атомами,
R12 обозначает алкил с 1-6 С-атомами,
А обозначает Н или незамещенный алкил с 1-6 С-атомами,
Ar обозначает незамещенный либо одно-, дву- или тризамещенный заместителями А и/или R9 фенил или нафтил,
Hal обозначает F, Сl, Вr либо I и
m обозначает 0,
n обозначает 1, 2, 3 или 4,
а также их физиологически приемлемые соли и сольваты.
Соединения формулы I, равно как и исходные вещества для их получения в остальном получают по известным методам, описанным в литературе (например, в таких основополагающих публикациях, как Houben-Weyl, Methoden der organischen Chemie, изд-во Georg-Thieme-Verlag, Штутгарт), а именно, при соблюдении условий, известных и пригодных для осуществления указанных реакций. При этом могут использоваться также известные, не поясняемые в данном описании более подробно варианты.
Исходные вещества при необходимости могут быть также образованы in situ, что исключает их обязательное выделение из реакционной смеси и обеспечивает возможность их последующего превращения в соединения формулы I.
Соединения формулы I можно получать предпочтительно, высвобождая их из одного из их функциональных производных путем обработки агентом сольволиза или гидрогенолиза.
Предпочтительными исходными веществами для сольволиза, соответственно гидрогенолиза являются такие, которые вместо одной или нескольких свободных амино- и/или гидроксигрупп содержат соответствующие защищенные амино-и/или гидроксигруппы, предпочтительно такие, которые вместо Н-атома, связанного с N-атомом, несут аминозащитную группу, прежде всего такие, которые вместо HN-группы содержат R'-N-группу, где R' обозначает аминозащитную группу, и/или такие, которые вместо Н-атома гидроксигруппы несут гидроксизащитную группу, например такие, которые подпадают под формулу I, однако вместо группы -СООН несут группу -COOR", где R" обозначает гидроксизащитную группу.
Возможно также наличие в молекуле исходного вещества нескольких - идентичных либо различных - защищенных амино- и/или гидроксигрупп. При наличии отличающихся друг от друга защитных групп последние во многих случаях можно селективным путем отщеплять.
Понятие "аминозащитная группа" общеизвестно и относится к группам, которые способны защищать (блокировать) аминогруппу от химических превращений, но которые можно легко удалять по завершении требуемой химической реакции в других местах молекулы. Типичными представителями таких групп являются прежде всего незамещенные либо замещенные ацильные, арильные, аралкоксиметильные или аралкильные группы. Поскольку аминозащитные группы по завершении требуемой реакции (или соответствующей стадии) удаляют, их тип и величина в остальном не играют существенной роли, предпочтительны, однако, группы с 1-20, прежде всего с 1-8 С-атомами.
Понятие "ацильная группа" применительно к предлагаемому способу используется в самом широком смысле. Оно включает ацильные группы, являющиеся производными алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот либо сульфокислот, а также прежде всего алкоксикарбонильные, арилоксикарбонильные и в первую очередь аралкоксикарбонильные группы. В качестве примеров таких ацильных групп можно назвать алканоил, такой как ацетил, пропионил, бутирил, аралканоил, такой как фенилацетил, ароил, такой как бензоил или толуил, арилоксиалканоил, такой как ФОА, алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, 2,2, 2-трихлорэтоксикарбонил, БОК, 2-иодэтоксикарбонил, аралкилоксикарбонил, такой как БзОК, 4-метоксибензилоксикарбонил, Fmoc, арилсульфонил, такой как Мтр. Предпочтительными аминозащитными группами являются БОК и Мтр, а также БзОК, Fmoc, бензил и ацетил.
Отщеплять аминозащитную группу - в зависимости от используемой защитной группы - целесообразно, например, с помощью сильных кислот, предпочтительно ТФК или перхлорной кислоты, а также с помощью других сильных неорганических кислот, таких как соляная кислота или серная кислота, сильных органических карбоновых кислот, таких как трихлоруксусная кислота, или сульфокислот, таких как бензол - или п-толуолсульфокислота. Присутствие дополнительного инертного растворителя возможно, но не всегда обязательно. В качестве инертных растворителей пригодны предпочтительно органические растворители, например, карбоновые кислоты, такие как уксусная кислота, простые эфиры, такие как тетрагидрофуран или диоксан, амиды, такие как ДМФ, галогенированные углеводороды, такие как дихлорметан, кроме того, спирты, такие как метанол, этанол или изопропанол, а также вода. Могут использоваться и смеси названных растворителей. ТФК используют предпочтительно в избытке без добавления другого растворителя. Перхлорную кислоту используют в виде смеси из уксусной кислоты и 70%-ной перхлорной кислоты в соотношении 9:1. Температура, необходимая для отщепления, находится предпочтительно в интервале от приблизительно 0 до приблизительно 50° С, целесообразно работать в интервале от 15 до 30° С (комнатная температура).
Отщепление групп БОК, О But и Мтр можно осуществлять, например, предпочтительно с помощью ТФК в дихлорметане или с помощью приблизительно
3-5 н. НС1 в диоксане при 15-30° С, Fmoc-группу можно отщеплять с помощью приблизительно 5-50%-ного раствора диметиламина, диэтиламина или пиперидина в ДМФ при 15-30° С.
Удаляемые гидрогенолитическим путем защитные группы (например БзОК или бензил) могут отщепляться, например, за счет обработки водородом в присутствии катализатора (например катализатора на основе благородного металла, такого как палладий, предпочтительно на носителе, таком как уголь). В качестве растворителей при этом можно использовать таковые, из числа указанных выше, прежде всего, например, спирты, такие как метанол или этанол либо амиды, такие как ДМФ. Гидрогенолиз осуществляют, как правило, при температурах в интервале от приблизительно 0 до 100° С и давлении в пределах от порядка 1 до 200 бар, предпочтительно при 20-30° С и 1-10 бар. Гидрогенолиз БзОК-группы целесообразно проводить, например, в присутствии 5-10%-ного Pd/C в метаноле или с помощью формиата аммония (вместо водорода) в присутствии Pd/C в метаноле/ДМФ при 20-30° С.
Соединения формулы I, в которых R5 обозначает R6-NH-, можно получать предпочтительно, например, аналогично схемам 1-3.
В качестве инертных растворителей пригодны среди прочих углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол, хлорированные углеводороды, такие как трихлорэтилен, 1,2-дихлорэтан, тетрахлорметан, хлороформ или дихлорметан, спирты, такие как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан, простые гликолевые эфиры, такие как монометиловый либо моноэтиловый эфир этиленгликоля (метилгликоль либо этилгликоль), метиловые эфиры этиленгликоля (диглимы), кетоны, такие как ацетон или бутанон, амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФ), нитрилы, такие как ацетонитрил, сульфоксиды, такие как диметилсульфоксид (ДМСО), сероуглерод, карбоновые кислоты, такие как муравьиная кислота или уксусная кислота, нитросоединения, такие как нитрометан или нитробензол, сложные эфиры, такие как этилацетат, вода или же смеси указанных растворителей.
Можно далее один из остатков R1, R2 и/или R5 превращать соответственно в другой остаток R1, R2 и/или R5. Прежде всего можно эфир карбоновой кислоты превращать в карбоновую кислоту. Так, в частности, можно омылять сложный эфир формулы I. Эту операцию целесообразно осуществлять, как указано выше, путем сольволиза или гидрогенолиза, например, с помощью NaOH либо КОН в смеси диоксана и воды при температурах в интервале от 0 до 60° С, предпочтительно от 10 до 40° С.
Превращение цианогруппы в амидиновую группу осуществляют взаимодействием, например, с гидроксиламином и последующим восстановлением N-гидроксиамидина с помощью водорода в присутствии катализатора, такого как Pd/C.
Еще одна возможность заключается в том, что обычную аминозащитную группу заменяют на водород, отщепляя при этом защитную группу, как указано выше, путем сольволиза либо гидрогенолиза или же высвобождая защищенную обычной защитной группой аминогруппу тем же путем сольволиза либо гидрогенолиза.
Для получения соединений формулы I, в которых R5 обозначает H2 N-C(=NH)-NH-, соответствующее аминосоединение можно обрабатывать амидинирующим агентом. В качестве такого амидинирующего агента предпочтителен 1-амидино-3,5-диметилпиразол (ДПФН), который применяют прежде всего в форме его нитрата. При этом целесообразно работать, добавляя основание, такое как триэтиламин или этилдиизопропиламин, в инертном растворителе либо в смеси растворителей, например, воды и диоксана, при температурах в интервале от 0 до 120° С, предпочтительно от 60 до 120° С.
Для получения амидина формулы I (R5 обозначает -C(=NH)-NH2) к нитрилу формулы I (R5 обозначает CN) можно присоединять аммиак. Это присоединение предпочтительно проводить в несколько стадий, а именно, известным образом а) превращать нитрил взаимодействием с H2S в тиоамид, который с помощью алкилирующего агента, например CH3I, переводят в соответствующий S-алкиловый имидотиоэфир, реагирующий в свою очередь с NН3 с образованием амидина, б) превращать нитрил взаимодействием со спиртом, например этанолом, в присутствии НС1 в соответствующий имидоэфир и этот последний обрабатывать аммиаком, или в) подвергать нитрил взаимодействию с бис(триметилсилил)амидом лития, после чего гидролизовать полученный продукт.
Далее, свободные аминогруппы можно по известной технологии ацилиро-вать хлорангидридом или ангидридом кислоты либо алкилировать незамещенным или замещенным алкилгалогенидом, предпочтительно в инертном растворителе, таком как дихлорметан либо ТГФ и/или в присутствии основания, такого как триэтиламин либо пиридин, при температурах в интервале от -60 до +30° С.
Основание формулы I может переводиться с помощью кислоты в соответствующую кислотно-аддитивную соль, например, взаимодействием эквивалентных количеств основания и кислоты в инертном растворителе, таком как этанол, и последующим упариванием. Для такой реакции пригодны прежде всего кислоты, которые образуют физиологически приемлемые соли. Так, в частности, можно использовать такие неорганические кислоты, как серная кислота, азотная кислота, галогеноводородные кислоты, такие как хлористоводородная кислота либо бромистоводородная кислота, фосфорные кислоты, такие как ортофосфорная кислота, сульфаминокислота, а также органические кислоты, прежде всего алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- либо многоосновные карбоновые, сульфоновые или серные кислоты, такие, например, как муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- или этансульфокислота, этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталинмоно- и -дисульфокислоты, лаурилсерная кислота. Касательно солей физиологически неприемлемых кислот, например пикратов, следует отметить, что они могут использоваться для выделения и/или очистки соединений формулы I.
С другой стороны, кислоту формулы I взаимодействием с основанием можно переводить в одну из ее физиологически приемлемых металлических или аммониевых солей. В качестве таких солей могут рассматриваться прежде всего соли натрия, калия, магния, кальция и аммония, а также замещенные аммониевые соли, например соли диметил-, диэтил- или диизопропиламмония, соли моноэтанол-, диэтанол- или диизопропиламмония, соли циклогексил-, дициклогексиламмония, соли дибензилэтилендиаммония, кроме того, например, соли аргинина или лизина.
Как указывалось выше, соединения формулы I содержат один или несколько хиральных центров и могут быть поэтому представлены в рацемической или оптически активной форме. Полученные рацематы можно по известным методам механическим или химическим путем разделять на энантиомеры. Предпочтительно из рацемической смеси взаимодействием с оптически активным разделяющим агентом образуют диастереомеры. В качестве разделяющих агентов можно использовать, например, оптически активные кислоты, как например D- и L-формы винной кислоты, диацетилвинной кислоты, дибензоилвинной кислоты, миндальной кислоты, яблочной кислоты, молочной кислоты или различные оптически активные камфарные сульфокислоты, такие как β -камфарная сульфокислота. Предпочтительно также проводить разделение на энантиомеры с помощью колонки, заполненной оптически активным разделяющим агентом (например динитробензоилфенилглицином); в качестве элюента пригодна, например, смесь гексан/изопропанол/ацетонитрил, например, в объемном соотношении 82:15:3.
Оптически активные соединения формулы I можно, как очевидно, получать также по описанным выше методам за счет применения исходных материалов, являющихся уже оптически активными.
Еще одним объектом изобретения является применение соединений формулы I и/или их физиологически приемлемых солей для получения фармацевтических композиций, прежде всего нехимическим путем. При этом их можно использовать совместно с по меньшей мере твердым, жидким и/или полужидким носителем либо вспомогательным веществом и при необходимости в сочетании с одним или несколькими другими активными веществами для изготовления соответствующих дозированных форм.
Объектом изобретения являются далее фармацевтические композиции, содержащие по меньшей мере одно соединение формулы I и/или одну из его физиологически приемлемых солей. Эти композиции могут применяться в качестве лекарственных средств в медицине и ветеринарии. В качестве носителей для этих композиций могут рассматриваться органические или неорганические вещества, пригодные для энтерального (например, орального), парентерального, местного введения или же для применения в форме ингаляционного спрея и не реагирующие с новыми соединениями, например вода, масла растительного происхождения, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, триацетат глицерина, желатин, углеводы, такие как лактоза или крахмал, стеарат магния, тальк, вазелины. Для орального назначения служат прежде всего таблетки, пилюли, драже, капсулы, порошки, грануляты, сиропы, микстуры или капли, для ректального применения - суппозитории, для парентерального применения - растворы, предпочтительно масляные либо водные растворы, кроме того, суспензии, эмульсии или имплантаты, для местного применения пригодны мази, кремы или пудра. Новые соединения можно также подвергать лиофилизации и полученные лиофилизаты использовать, например, для приготовления инъекционных препаратов. Указанные композиции можно стерилизовать и/или они могут содержать в своем составе вспомогательные вещества, такие как замасливатели, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для регулирования осмотического давления, буферные субстанции, красители, вкусовые добавки и/или одно либо несколько других активных веществ, например, один или несколько витаминов.
В качестве спрея для ингаляции могут применяться спреи, которые содержат активное вещество в растворенной или суспендированной форме в одном пропелленте либо в пропелленте из смеси (например, в СО2 или во фторхлоруглеводородах). Целесообразно при этом применять активное вещество в микронизированном виде, причем можно добавлять один или несколько дополнительных физиологически приемлемых растворителей, например этанол. Ингаляцию растворами можно проводить с помощью обычных ингаляторов.
Объектом настоящего изобретения является также применение соединений формулы I в качестве терапевтических активных веществ.
Соединения формулы I и их физиологически приемлемые соли могут применяться в качестве ингибиторов интегринов в первую очередь при борьбе с такими болезнями, как обусловленные патологическими факторами ангиогенные заболевания, тромбозы, инфаркт миокарда, ишемическая болезнь сердца, артериосклероз, опухоли, воспаления и инфекции.
Предлагаемые согласно изобретению субстанции, как правило, могут вводиться при этом аналогично другим известным, коммерчески доступным пептидам, но прежде всего аналогично соединениям, описанным в патенте US 4472305, предпочтительно в дозировках от порядка 0,05 до 500 мг, прежде всего от 0,5 до 100 мг на одну унифицированную дозу. Суточная доза составляет предпочтительно от порядка 0,01 до 2 мг/кг веса тела пациента. Однако при назначении конкретно тому или иному пациенту специальной дозы последняя зависит от самых разных факторов, например, от эффективности применяемого соединения, от возраста и веса тела пациента, общего состояния его здоровья, пола, особенностей питания, от времени и метода введения препарата, скорости выделения, комбинации лекарственных средств и степени тяжести соответствующего заболевания, которое требует данной терапии. Предпочтительно парентеральное применение.
Выше и в последующем все температуры указаны в градусах Цельсия. Под используемым в нижеследующих примерах понятием "обычная переработка" имеется в виду следующее: при необходимости добавляют воду, в зависимости от структурных особенностей конечного продукта устанавливают при необходимости на рН-значения от 2 до 10, экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу сушат над сульфатом натрия, упаривают и очищают посредством хроматографии на силикагеле и/или путем кристаллизации.
Масс-спектрометрия (МC):EI (ионизация пучком электронов) M+, FAB (бомбардировка ускоренными атомами) (M+Н)+ .
Пример 1
(2S)-3-{2-[3-(1Н-имидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2,2-диметилпропоксикарбоксамидо)пропионовая кислота
Синтез указанного в заголовке соединения осуществляют, например, согласно схеме 1.
80 г (0,31 моля) 3-ацетил-L-тирозина суспендируют в 1 л безводного этанола и при 80° в течение 12 часов кипятят с обратным холодильником в присутствии 70 г (0,37 моля) толуол-4-сульфокислоты. После охлаждения до комнатной температуры добавляют 500 мл МТБЭ, выпавшие в осадок кристаллы отфильтровывают вакуум-фильтрацией, промывают МТБЭ и сушат.
Выход: 99,4 г этилового эфира 3-ацетил-L-тирозина (соединение АВ) в виде пТСК-соли.
20 г (47,2 моля) соединения АВ суспендируют в 320 мл воды и 160 мл ТГФ и при перемешивании порциями примешивают 8 г (94 ммоля) NаНСО3. Затем по каплям добавляют раствор из 8,6 г (56 ммолей) неопентилового эфира хлормуравьиной кислоты в 160 мл ТГФ и перемешивают в течение 30 минут при комнатной температуре, после чего проводят обычную переработку. Остаток перекристаллизовывают из МТБЭ.
Выход: 16,1 г (93%) этилового эфира N-(2, 2-диметилпропилоксикар-бонил)-3-ацетил-L-тирозина (соединение АС).
5 г (14,2 ммоля) соединения АС и 3,3 г (17 ммолей) 4-бензилоксимасляной кислоты растворяют в 100 мл ДМФ и при комнатной температуре смешивают с 3,1 мл (28,4 ммоля) N-метилморфолина и 4,08 г (21,3 ммоля) ЭДК. По истечении 5 часов реакционный раствор сливают на 700 мл воды и проводят обычную переработку.
Выход: 7,4 г 2-ацетил-4-(2-карбоксиэтил-2-(2,2-диметилпро-пил)оксикарбониламиноэтил)фенилового эфира 4-бензилоксимасляной кислоты (соединение AD).
6,2 г (11,4 ммоля) соединения AD растворяют в 100 мл безводного ТГФ и при комнатной температуре перемешивают вместе с 342 мг (11,4 ммоля) гидрида натрия (80%-ного в минеральном масле). По истечении 30 минут раствор нейтрализуют кислым ионитом и концентрируют.
Выход: 6,2 г этилового эфира (2S)-3-(2-гидрокси-2-(3-бензилок-сипропил)-4-оксохроман-6-ил)-2-(2, 2-диметилпропил)оксикарбониламино-пропионовой кислоты (соединение АЕ).
К раствору из 6,2 г (11,4 ммоля) соединения АЕ в 180 мл дихлорметана добавляют 18 мл трифторуксусной кислоты и перемешивают при комнатной температуре в течение ночи. Затем раствор концентрируют, повторно еще трижды концентрируют с использованием каждый раз 50 мл толуола и хрома -тографируют на силикагеле толуолом/метанолом (в соотношении 20:1) в качестве элюента.
Выход: 4,2 г этилового эфира (2S)-3-(2-(3-бензилоксипропил)-4-оксо-4Н-хромен-6-ил)-2-(2, 2-иметилпропил)оксикарбониламинопропионовой кислоты (соединение AF), FAB 534.
3,5 г (6,7 ммоля) соединения AF гидрируют в 50 мл этанола в присутствии 350 мг палладия (10%-ного на активированном угле) в течение 1 часа при комнатной температуре и нормальном давлении. После отфильтровывания катализатора и концентрирования раствора продукт получают в виде бесцветной аморфной массы.
Выход: 2,6 г этилового эфира (2S)-3-(2-(3-гидроксипропил)-4-оксо-4Н-хромен-6-ил)-2-(2,2-диметилпропил)оксикарбониламинопропионовой кислоты (соединение AG), FAB 434.
К раствору из 500 мг (1,15 ммоля) соединения AG и 357 мг (1,38 ммоля) 2-(2,2,2-трихлорэтоксикарбонил)амино-1Н-имидазола в 20 мл безводного ТГФ добавляют 0,267 мл (1,72 ммоля) ДЭАД (диэтилазадикарбоксилат, диэтиловый эфир азодикарбоновой кислоты) и 450 мг (172 ммоля) трифенилфосфина и перемешивают в течение ночи при 60° С. Затем раствор концентрируют и остаток хроматографируют на силикагельной колонке с обращенной фазой RP-8 метанолом/водой в соотношении 2:1.
Выход: 560 мг этилового эфира (2S)-3-(2-(3-((1Н-имидазол-2-ил)-(2,2, 2-трихлорэтоксикарбонил)амино)пропил)-4-оксо-4Н-хромен-6-ил)-2-(2,2-диметилпропил)оксикарбониламинопропионовой кислоты (соединение АН) в виде бесцветного масла, FAB 675.
К раствору из 280 мг (4,15 ммоля) соединения АН в 5 мл ТГФ с 0,5 мл уксусной кислоты и 0,5 мл воды примешивают 500 мг (7,7 ммоля) цинковой пыли и в течение 1 часа перемешивают при комнатной температуре. Затем отфильтровывают, раствор концентрируют и остаток сушат.
Выход: 210 мг этилового эфира (2S)-3-{2-[3-(1Н-имидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2, 2-диметилпропокси-карбоксамидо)пропионовой кислоты (соединение AI), FAB 499.
200 мг (0,4 ммоля) соединения AI растворяют в 4 мл диоксана и перемешивают с 2 мл 1 н. НС1 в течение 12 часов при 75° . Затем раствор концентрируют и остаток очищают посредством препаративной ЖХВР на силикагельной колонке с обращенной фазой RP-18 с использованием градиента элюента (вода/ацетонитрил с изменением соотношения за 60 минут от 1:99 до 99:1). После сушки вымораживанием ЖХВР-фракций продукт получают в виде белого аморфного порошка.
Выход: 103 мг (2S)-3-{2-[3-(1Н-имидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил] -2- (2,2-диметилпропоксикарбоксамидо)пропионовой кислоты (соединение АК), tпл 105-110° , FAB 471.
Схема 1

Пример 2
(2S)-3-{2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2,2-диметилпропоксикарбоксамидо)пропионовая кислота
Синтез указанного в заголовке соединения осуществляют, например, согласно схеме 2.
К раствору из 0,5 г (1,37 ммоля) соединения АС и 630 мг (1.77 ммоля) 4-(пиридин-2-ил-(2,2,2-трихлорэтоксикарбонил)амино)масляной кислоты в 10 мл дихлорметана при комнатной температуре примешивают 420 мг (2,04 ммоля) ДЦК и 20 мг ДМАП и перемешивают в течение 15 часов. Затем отфильтровывают от выпавшей в осадок дициклогексилмочевины, остаток промывают дихлорметаном и раствор концентрируют. Остаток хроматографируют на силикагеле толуолом/ацетоном в соотношении 20:1.
Выход: 130 мг 2-ацетил-4-(2-карбоксиэтил-2-(2, 2-диметилпро-пил)оксокарбониламиноэтил)фениловый эфир 4-(пиридин-2-ил-(2,2,2-трихлорэтоксикарбонил) амино) масляной кислоты (соединение ВВ), FAB 704.
130 мг (0,185 ммоля) соединения ВВ подвергают взаимодействию с 5,4 мг (0,18 ммоля) гидрида натрия (80%-ного в минеральном масле) в 5 мл ТГФ при комнатной температуре. По истечении 45 минут нейтрализуют уксусной кислотой и концентрируют до образования соответствующего остатка.
Выход: 130 мг этилового эфира (2S)-3-(2-гидрокси-2-(3-(пиридин-2-ил-(2,2, 2-трихлорэтоксикарбонил)амино)пропил)-4-оксохроман-6-ил)-2-(2, 2-диметилпропил)оксикарбониламинопропионовой кислоты (соединение ВС).
130 мг (0,18 ммоля) соединения ВС перемешивают при комнатной температуре в течение 15 часов в 5 мл дихлорметана и 0,5 мл трифторуксусной кислоты. Затем раствор концентрируют и остаток хроматографируют на силикагеле.
Выход: 55 мг этилового эфира (2S)-3-(2-(3-((пиридин-2-ил)-(2,2, 2-трихлорэтоксикарбонил)амино)пропил)-4-оксо-4Н-хромен-6-ил)-2-(2,2-диметилпропил)оксикарбониламинопропионовой кислоты (соединение BD), FAB 686.
Отщепление ТРОК-группы от соединения BD осуществляют аналогично описанному для соединения AI, получая после обычной переработки 40 мг этилового эфира (2S)-3-{2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2, 2-диметилпропоксикарбоксамидо)пропионовой кислоты (соединение BE).
40 мг (78 мкмолей) соединения BE в 2 мл диоксана перемешивают в течение 60 часов при 70° с 1 мл 1 н. НС1. После концентрирования остаток очищают посредством препаративной ЖХВР на силикагельной колонке с обращенной фазой RP-18.
Выход: 20 мг (2S)-3-{2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2,2-диметилпропоксикарбоксамидо)пропионовой кислоты (соединение BF) в виде белого аморфного порошка, полученного после сушки вымерзанием, tпл 80-85° , FAB 482.
Схема 2

Пример 3
(2S)-3-{2-[3-(1Н-бензимидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2,2-диметилпропоксикарбоксамидо)пропионовая кислота
Синтез указанного в заголовке соединения осуществляют, например, согласно схеме 3.
6,5 г (17,8 ммолей) соединения AD подвергают аналогично примеру 1 взаимодействию с 5,2 г (35,6 ммоля) 4-ацетоксимасляной кислоты в присутствии 7,5 г (39,1 ммоля) ЭДК и 5,9 мл (53,6 ммоля) N-МП в 100 мл ДМФ. Полученный продукт очищают посредством хроматографии на силикагеле толуолом/ацетоном (в соотношении 6:1) в качестве элюента.
Выход: 7,7 г 2-ацетил-4-(2-карбоксиэтил-2-(2,2-диметилпро-пил)оксикарбониламиноэтил)фенилового эфира 4-ацетоксимасляной кислоты (соединение СА) в виде бесцветного масла, FAB 494.
Аналогично примеру 1 7,7 г (15,7 ммоля) соединения СА подвергают взаимодействию с 489 мг (16,3 ммоля) NaH (80%-ного в минеральном масле) в 200 мл ТГФ в течение 16 часов при комнатной температуре и затем перерабатывают.
Выход: 7,2 г этилового эфира (2S)-3-(2-гидрокси-2-(3-ацетоксипропил)-4-оксо-хроман-6-ил)-2-(2,2-диметилпропил)оксикарбониламинопропионовой кислоты (соединение СВ) в виде сырого продукта, который без очистки используют в последующей реакции.
Аналогично примеру 1 в течение 48 часов при комнатной температуре осуществляют дегидратацию 7,2 г (15,7 ммоля) соединения СВ с помощью 18 мл трифторуксусной кислоты в 180 мл дихлорметана. Полученный после концентрирования реакционного раствора продукт сушат и непосредственно используют в последующей реакции.
Выход: 7,0 г этилового эфира (2S)-3-(2-(3-ацетоксипропил)-4-оксо-4Н-хромен-6-ил)-2-(2,2-диметилпропил)оксикарбониламинопропионовой кислоты (соединение СC в виде бесцветного масла.
7,0 г (14,7 ммоля) соединения СС в 200 мл безводного этанола перемешивают в течение 1 часа при комнатной температуре с 1,9 г (28 ммолей) этилата натрия. Затем нейтрализуют кислым ионитом, раствор концентрируют до образования соответствующего остатка и хроматографируют на силикагеле толуолом/ацетоном в соотношении 2:1.
Выход: 2,4 г этилового эфира (2S)-3-(2-(3-гидроксипропил)-4-оксо-4Н-хромен-6-ил)-2-(2, 2-диметилпропил)оксикарбониламинопропионовой кислоты (соединение CD), FAB 434.
500 мг (1,15 ммоля) соединения CD растворяют в 20 мл дихлорметана и в течение 1,5 часов при комнатной температуре окисляют 370 мг (1,73 ммоля) хлорохромата пиридиния. Затем реакционный раствор фильтруют, пропуская его через 30 г силикагеля, осадок на фильтре промывают этилацетатом и раствор концентрируют. Сырой продукт без дальнейшей очистки используют в последующей реакции.
Выход: 392 мг этилового эфира (2S)-3-(2-(3-оксопропил)-4-оксо-4Н-хромен-6-ил)-2-(2, 2-диметилпропил)оксикарбониламинопропионовой кислоты (соединение СЕ).
Сырой продукт СЕ (100 мг, 0,23 ммоля) растворяют в 10 мл пиридина и в присутствии 0,13 мл (0,93 ммоля) триэтиламина подвергают взаимодействию с 33 мг (0,25 ммоля) 2-аминобензимидазола. По завершении реакции (по истечении 3 часов при комнатной температуре) добавляют 18 мг (0,46 ммоля) борогидрида натрия и перемешивают еще в течение 3 часов при комнатной температуре. Затем нейтрализуют разбавленной уксусной кислотой, раствор концентрируют и остаток очищают посредством препаративной ЖХВР на колонке с обращенной фазой RP-18.
Выход: 64 мг этилового эфира (2S)-3-{2-[3-(1Н-бензимидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2, 2-диметилпропокси-карбоксамидо)пропионовой кислоты (соединение CF) в виде бесцветного аморфного порошка, полученного после сушки вымерзанием, FAB 549.
50 мг (0,09 ммоля) соединения CF в 2 мл диоксана перемешивают с 1 мл 1 н. НС1 в течение 12 часов при 80° и затем концентрируют.
Выход: 45 мг (2S)-3-{2-[3-(1Н-бензимидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил]-2-(2, 2-диметилпропоксикарбоксамидо)пропионовой кислоты (соединение CG), FAB 521.
Схема 3

Пример 4
Процесс получения хроменонов и хроманонов формулы I, где R обозначает амид, можно осуществлять, например, согласно схеме 4.
Схема 4

Пример 5
Процесс получения хроменонов формулы I, где R1 обозначает СН2ОН, можно осуществлять, например, согласно схеме 5.
Схема 5

Пример 6
Процесс получения хроменонов формулы I, где R5 обозначает гуанидиновую группу, можно осуществлять, например, согласно схеме 6.
Схема 6
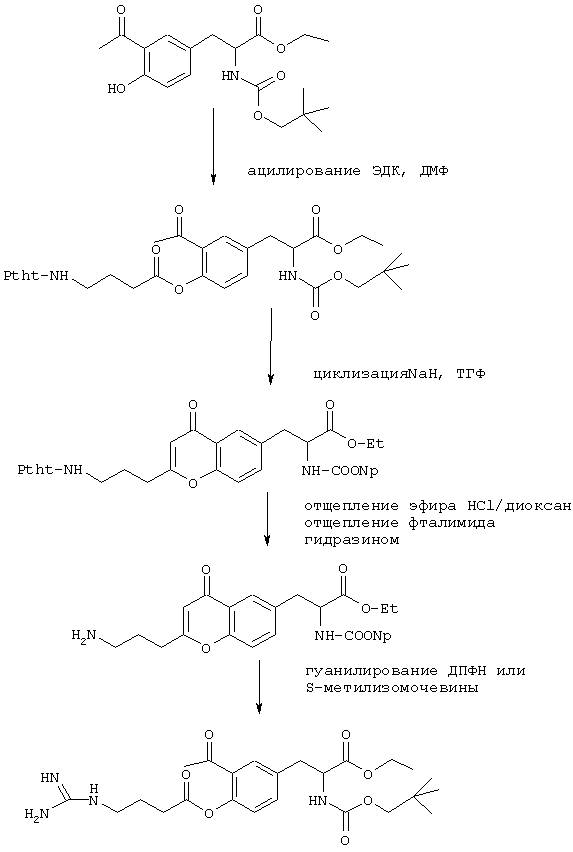
Пример 7
Процесс получения хроменонов формулы I, где R5 обозначает амидиновую группу, можно осуществлять, например, согласно схеме 7.
Схема 7

Пример 8
Аналогично примерам 1, 2 и 3 получают следующие сульфамидные производные:
(2S)-3-[2-[3-(1Н-имидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2,2-диметилпропилсульфамидо)пропионовую кислоту,
(2S)-3-[2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил]-2-(2,2-диметилпропилсульфамидо)пропионовую кислоту,
(2S)-3-[2-[3-(1Н-бензимидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2,2-диметилпропилсульфамидо)пропионовую кислоту.
(2S)-3-[2-[3-(1Н-имидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-бутилсульфамидопропионовую кислоту,
(2S)-3-[2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-бутилсульфамидопропионовую кислоту,
(2S)-3-[2-[3-(1Н-бензимидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил]-2-бутилсульфамидопропионовую кислоту,
(2S)-3-[2-[3-(1Н-имидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-фенилсульфамидопропионовую кислоту,
(2S)-3-{2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-фенилсульфамидопропионовую кислоту,
(2S)-3-{2-[3-(1Н-бензимидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил]-2-фенилсульфамидопропионовую кислоту,
(2S)-3-{2-[3-(1Н-имидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-бензилсульфамидопропионовую кислоту,
(2S)-3-{2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-бензилсульфамидопропионовую кислоту,
(2S)-3-[1-[3-(1Н-бензимидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил]-2-бензилсульфамидопропионовую кислоту.
В нижеследующих примерах представлены фармацевтические композиции и технология их приготовления в соответствующих дозированных формах.
Пример А: Склянки для инъекционных растворов
Раствор из 100 г активного вещества формулы I и 5 г гидрофосфата динатрия в 3 л дважды дистиллированной воды с помощью 2 н. соляной кислоты устанавливают на рН 6,5, стерильно фильтруют, заполняют склянки, лиофилизуют в стерильных условиях и стерильно укупоривают. В каждой склянке содержится 5 мг активного вещества.
Пример Б: Суппозитории
Вначале приготавливают смесь из 20 г активного вещества формулы I, 100 г соевого лецитина и 1400 г масла какао, затем расплавляют, разливают в формы и дают застыть. Каждый суппозиторий содержит 20 мг активного вещества.
Пример В: Раствор
Приготавливают раствор из 1 г активного вещества формулы I, 9,38 г NaH2PO4·2H2O, 28,48 г Na2HPO4·12H2O и 0,1 г хлорида бензалкония в 940 мл дважды дистиллированной воды. Затем устанавливают на рН 6,8, доводят до объема 1 л и стерилизуют облучением. Этот раствор может применяться в виде глазных капель.
Пример Г: Мазь
При соблюдении асептических условий приготавливают смесь из 500 мг активного вещества формулы I и 99,5 г вазелина.
Пример Д: Таблетки
Приготавливают смесь из 1 кг активного вещества формулы I, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния, которую затем таблетируют по обычной технологии таким образом, что каждая таблетка содержит 10 мг активного вещества.
Пример Е: Драже
Аналогично примеру Д прессуют таблетки, которые затем по обычной технологии покрывают оболочкой из сахарозы, картофельного крахмала, талька, траганта и красителя.
Пример Ж: Капсулы
Из 2 кг активного вещества формулы 1 по обычной технологии изготавливают капсулы с твердохелатиновым покрытием таким образом, что каждая капсула содержит 20 мг активного вещества.
Пример 3: Ампулы
Раствор из 1 кг активного вещества формулы I в 60 л дважды дистиллированной воды стерильно фильтруют, разливают в ампулы, в стерильных условиях лиофилизуют и стерильно укупоривают. В каждой ампуле содержится 10 мг активного вещества.
Пример И: Ингаляционный спрей
14 г активного вещества формулы I растворяют в 10 л изотонического NaCl-раствора и затем этот раствор разливают в обычные, коммерчески доступные баллончики, снабженные насосным приспособлением. Раствор может применяться для ингаляции полости рта и носа. Выдаваемая из баллончика за одно нажатие порция (примерно 0,1 мл) соответствует дозе приблизительно 0,14 мг.
Фармакологические испытания
Исследования по ингибированию рецептора
Очищенные человеческие αvβ3 интегрины из плаценты были адсорбированы в микротитрованные лунки и были подвергнуты контрольному заражению биотинилированным комплементарным лигандом-витронектин (VN) к αv β3 в присутствии увеличенных количеств испытываемых соединений.
Метод: 1 мкг мл-1 был инкубирован 1 мкг мл-1 покрытым рецептором в присутствии серийно разведенных пептидов. Через 3 часа при 30° С связанный лиганд был измерен путем определения антибиотин-щелочной фосфатазы.
Литература: Charo, I.F., Nannizzi, L., Smith, J.W. and Cheresh D.A., J.Cell.Biol. 111, 2795-2800 (1990).
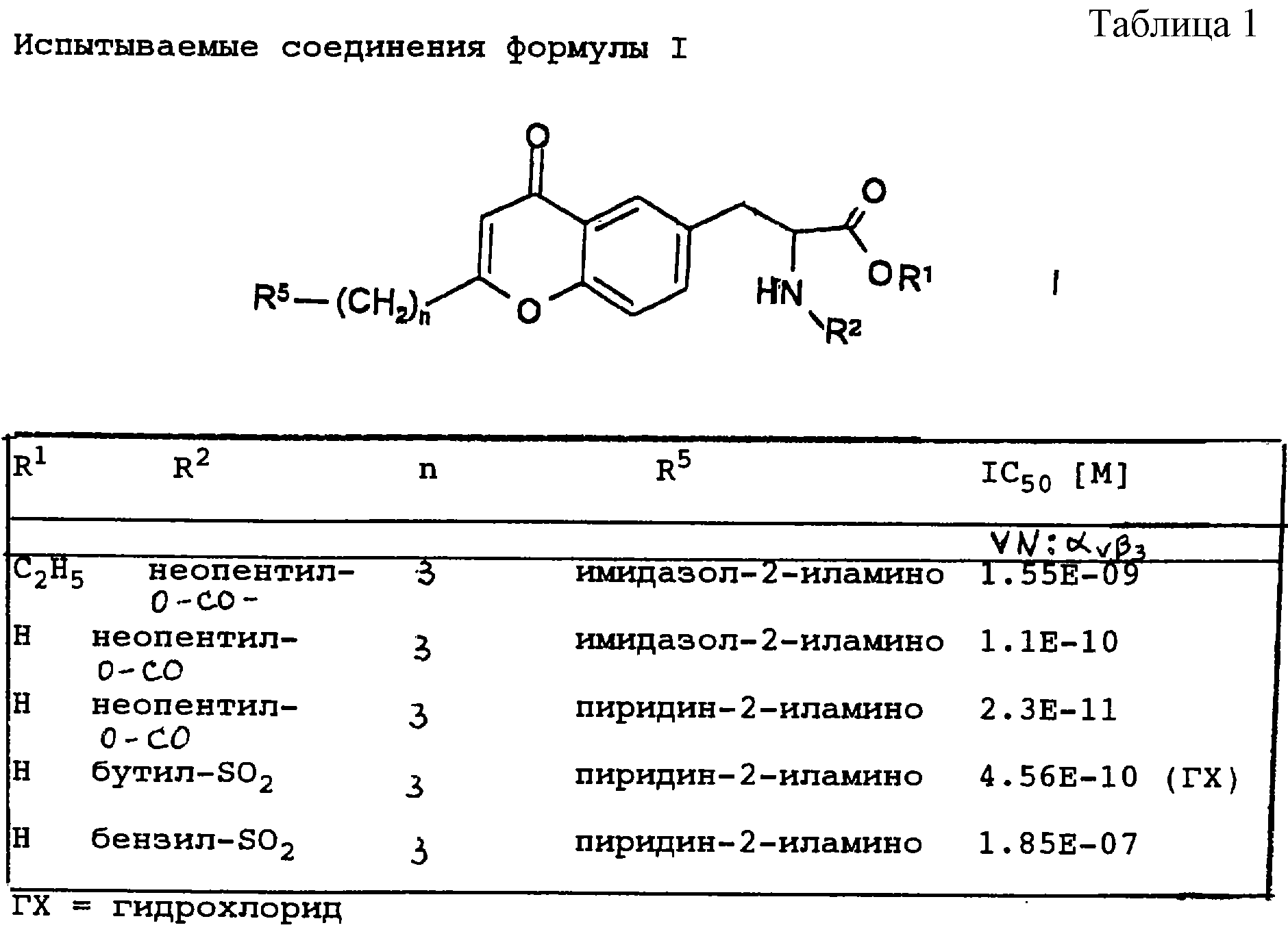
Таблица I
Значения IC50 для связывания биотинилированных лигандов с человеческими плацентальными αvβ3 приведены в табл.1.
Представленные в табл. 2 данные по токсичности получены по стандартной методике на крысах и показывают, что соединения имеют низкий уровень токсичности (см. табл.2).

Реферат
Изобретение относится к новым производные хроменона и хроманона, выбранных из группы, включающей: этиловый эфир (2S)-3-{2-[3-(1Н-мидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил]-2-(2,2-диметилпропоксикарбоксамидо)пропионовой кислоты, (2S)-3-[2-[3-(1Н-имидазол-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2,2-диметилпропоксикарбоксамидо)пропионовую кислоту, (2S)-3-[2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-(2, 2-диметилпропоксикарбоксамидо)пропионовую кислоту, (2S)-3-{2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-бутилсульфонамидопропионовая кислота, (2S)-3-{2-[3-(пиридин-2-иламино)пропил]-4-оксо-4Н-хромен-6-ил}-2-бензилсульфонамидопропионовая кислота, а также их физиологически приемлемые соли, энантиомеры или диастереомеры. Эти соединения являются ингибиторами интегринов αvβ3, используемые для борьбы с обусловленными патологическими факторами антигиогенными заболеваниями, тромбозами, инфарктом миокарда, ишемической болезнью сердца, атериосклерозом, опухолями, остеопорозом и ревматическим артритом. Изобретение относится также к фармацевтической композиции на основе этих соединений и способу ее получения. 3 с. и 2 з.п. ф-лы, 2 табл.
Формула
Документы, цитированные в отчёте о поиске
Способ получения производных флавоноида

Комментарии