Тиенил- или фурилпирроловые соединения, способы борьбы с насекомыми и клещами, композиции для борьбы с насекомыми и клещами - RU2130455C1
Код документа: RU2130455C1
Чертежи









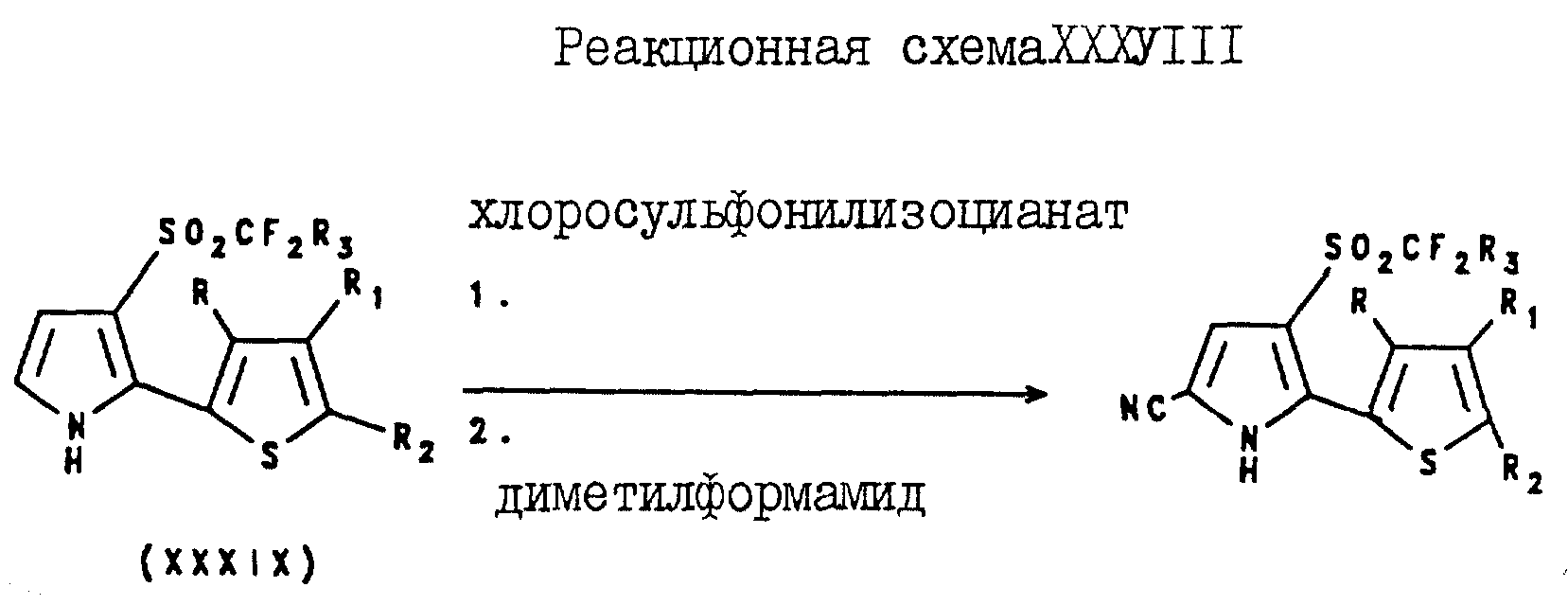




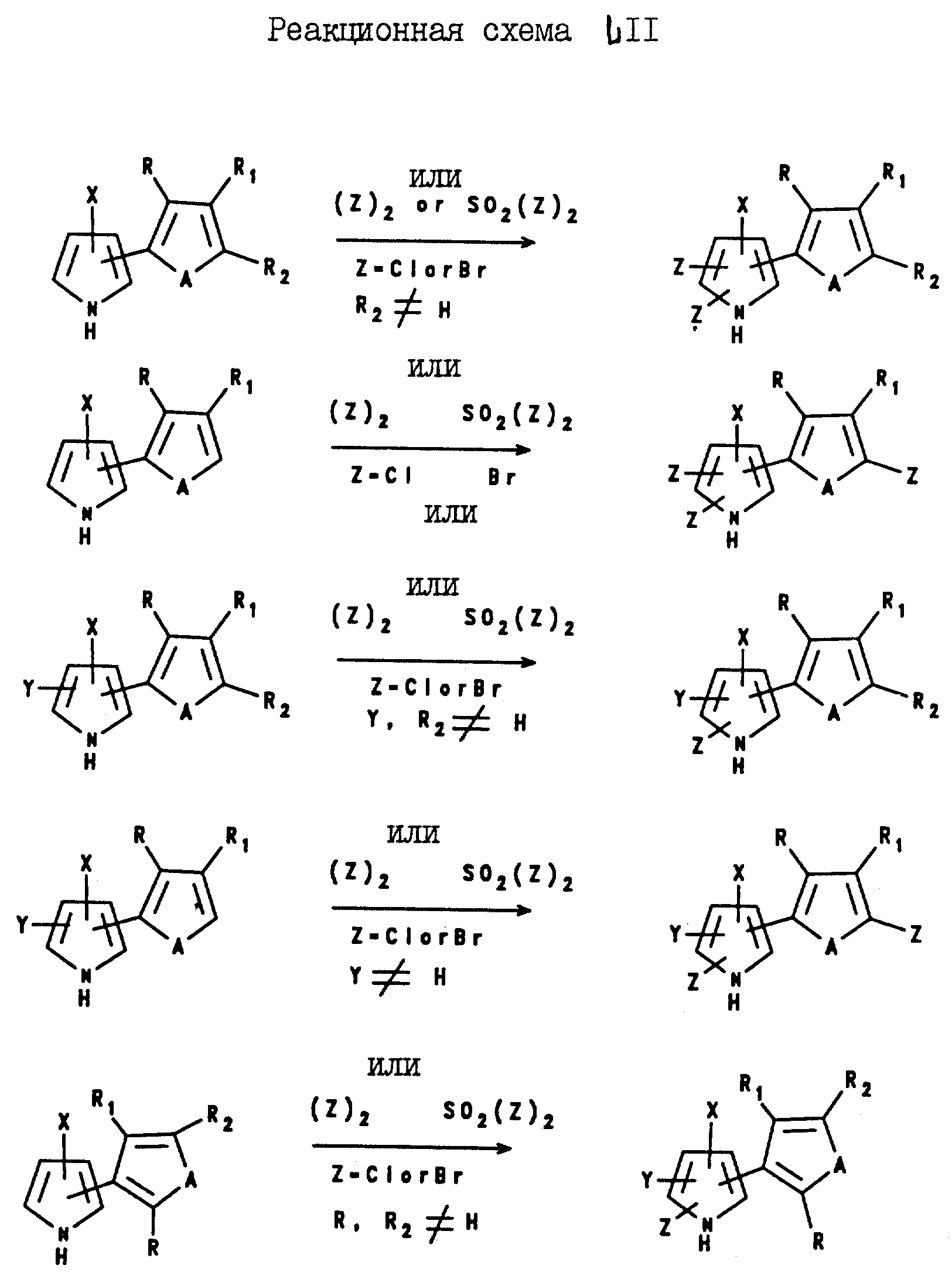


Описание
Насекомые и клещи способны уничтожать как собранный урожай, так и урожай на корню. Лишь в Соединенных Штатах сельскохозяйственные культуры поражаются тысячами видов различных насекомых и клещей. Наиболее ощутимый вред урожаю сельскохозяйственных культур наносят, в частности, совки, капустные совки и двупятнистые паутинные клещи.
Особенно серьезные экономические потери причиняют совки. В частности, совки буквально уничтожают урожаи хлопчатника, поедая зеленые семенные коробочки. Борьба с совками представляет значительные трудности вследствие того, что эти насекомые обладают резистентностью ко многим известным инсектицидам, включая органофосфаты, карбаматы и пиретроиды. Кроме того, использование имеющихся в настоящее время инсектицидов против личинок совки почти не имеет никакого эффекта после того, как они достигают третьей возрастной стадии.
Двупятнистый паутинный клещ поражает многие виды растений, например малину, путем отсасывания сока из листьев растений. При значительном поражении растений малины, их стебли и листья становятся чахлыми. При очень серьезном поражении, повреждаются плодоносящие побеги, что приводит к снижению урожая и качества плодов.
Несмотря на использование имеющихся коммерческих инсектицидных и акарицидных препаратов, истребление насекомыми и клещами как урожаев на корню, так и собранных урожаев все еще продолжается. А поэтому и продолжаются исследования по разработке новых и более эффективных инсектицидов и акарицидов.
Известно, что некоторые пирроловые соединения обладают акарицидной, фунгицидной, инсектицидной и/или противовоспалительной активностью (см., например, патент США 4267184; 5010098; 5102904; 5157047; 5162308; 5306827; 5286741; 5286742 и 5286743; заявку на патент Японии JP-85-40874, поданную 1 марта 1985 г.; заявку на Европатент EP-111452-A1, поданную 20 июня 1984 г.; и работу N. Ono и др., Journal of Heterocyclic Chemistry, 28, стр. 2053 - 2055 (1991). Однако ни одно из пирроловых соединений, раскрытых в указанных патентах, патентных заявках и публикации, не входит в объем настоящего изобретения.
Поэтому целью настоящего изобретения является получение соединений, которые были бы высокоэффективными в борьбе против насекомых и клещей.
Кроме того, целью настоящего изобретения является разработка способа борьбы против насекомых и клещей.
Еще одной целью настоящего изобретения является разработка способа защиты возделываемых растений от поражений насекомыми и клещами.
Эти и другие цели настоящего изобретения будут более понятны из нижеследующего детального описания изобретения.
Краткое описание
изобретения
Настоящее изобретение относится к тиенил- и фурилпирроловым соединениям, которые могут быть использованы в качестве инсектицидных и акарицидных средств для борьбы против насекомых
и клещей, и для защиты растений от поражения насекомыми и клещами.
Тиенил- и фурилпирроловые соединения настоящего изобретения имеют следующую структурную формулу I
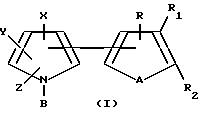
где: R, R1 и R2 независимо представляют собой водород, галоген, HO2 или CHO; либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут образовывать кольцо, в котором, R1R2 представлены структурой
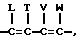
где L, T, V и W независимо представляют собой водород, галоген, CN или NO2;
A представляет собой O или S;
X представляет собой CN; NO2, C1-C6-галогеноалкил, S(O)m CF2R3, или C(S)NR4R5; где R3 представляет собой водород, F, Cl
Y представляет собой водород; галоген; C1-C6-галогеноалкил; S(O)m CF2R3; CN или фенил, необязательно замещенный одним или несколькими атомами галогена, NO2-группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена, или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
Z представляет собой водород; галоген; или C1-C6-галогеноалкил;
B представляет собой R6, OR6 или CN;
R6 представляет собой водород; C(O)R7; CHR8 HC(O)R9; CH2SO; CHR10OC(O)(CR11R12) Q1; C1-C6-алкил, необязательно замещенный одним-тремя атомами галогена; одним три(C1-C4-алкил)силилом, одной гидроксигруппой, одной цианогруппой, одной или двумя C1-C4-алкоксигруппами, необязательно замещенными 1 - 3 атомами галогена, одной C1-C4-алкилтиогруппой; одним фенилом, необязательно замещенным 1 - 3 атомами галогена, 1 - 3 C1-C4 -алкильными группами, или 1 - 3 C1-C4-алкоксигруппами; одной феноксигруппой, необязательно замещенной 1 - 3 атомами галогена, 1 - 3 C1-C4-алкильными группами, или 1 - 3 C1-C4-алкоксигруппами; одной бензилоксигруппой, необязательно замещенной на фенильном кольце 1 - 3 атомами галогена, 1 - 3 C1-C4 -алкильными группами, или 1 - 3 C1-C4-алкоксигруппами; одной C1-C6-алкилкарбонилоксигруппой, необязательно замещенной 1 - 3 атомами галогена; одной C2-C6-алкенилкарбонилоксигруппой, необязательно замещенной 1 - 3 атомами галогена; одной фенилкарбонилоксигруппой, необязательно замещенной 1 - 3 атомами галогена, 1 - 3 C1 -C4-алкильными группами, или 1 - 3 C1-C4-алкоксигруппами; C1-C6-алкоксикарбонильной группой, необязательно замещенной 1 - 3 атомами галогена, или 1 - 3 C1-C4-алкоксигруппами; или одной бензилкарбонилоксигруппой, необязательно замещенной на фенильном кольце 1 - 3 атомами галогена, 1 - 3 C1-C4 -алкильными группами, или 1 - 3 C1-C4-алкоксигруппами; C3-C6-алкенил, необязательно замещенный 1 - 3 атомами галогена, или одной фенильной группой; или C3-C6-алкинил, необязательно замещенный 1 - 3 атомами галогена или одной фенильной группой;
R7 представляет собой C1-C6-алкил или C3-C6-циклоалкил, каждый из которых является необязательно замещенным: 1 - 3 атомами галогена; одной гидроксигруппой; одной цианогруппой; одной или двумя C1-C4 -алкоксигруппой, необязательно замещенными 1 - 3 атомами галогена; одной C1-C4-алкилтиогруппой; одной фенильной группой, необязательно замещенной 1 - 3 атомами галогена, 1 - 3 C1-C4-алкильными группами, или 1 - 3 C1-C4-алкоксигруппами; одной феноксигруппой, необязательно замещенной 1 - 3 атомами галогена, 1 - 3 C1-C4-алкильными группами, или 1 - 3 C1-C4-алкоксигруппами; одной бензилоксигруппой, необязательно замещеноq на фенильном кольце одним-тремя атомами галогенf, одной-тремя C1-C4-алкильными группами, или одной-тремя C1-C4-алкоксигруппами; одной C1-C6-алкилкарбонилоксигруппой, необязательно замещенной 1 - 3 атомами галогена; одной C2-C6-алкенилкарбонилоксигруппой, необязательно замещенной 1 - 3 атомами галогена; одной фенилкарбонилоксигруппой, необязательно замещенной 1 - 3 атомами галогена, 1 - 3 C1-C4-алкильными группами, или 1- 3 C1-C4-алкоксигруппами; одной C1-C6--алкоксикарбонильной группой, необязательно замещенной 1 - 3 атомами галогена, или 1 - 3 C1-C4-алкоксигруппами; или бензилоксикарбонильной группой, необязательно замещенной на фенильном кольце 1 - 3 атомами галогена, 1 - 3 C1-C4-алкильными группами, или 1 - 3 C1-C4-алкоксигруппами; C2-C6-алкенил, необязательно замещенный 1 - 3 атомами галогена, или одной фенильной группой; C3-C6-алкинил, необязательно замещенный 1 - 3 атомами галогена или одной фенильной группой; фенил, необязательно замещенный одним или несколькими атомами галогена, C1-C4-алкильными группами, C1-C4-алкоксигруппами, феноксигруппами, C1-C4-алкилтиогруппами, три(C1-C4 -алкил)силильными группами, C1-C4-алкилсульфинильными группами, C1-C4-алкилсульфонильными группами, CN-группами, NO2-группами, или CF3 -группами, феноксигруппу, необязательно замещенную одним или несколькими атомами галогена, C1-C4-алкильными группами, C1-C4-алкоксигруппами, C1 -C4- алкилтиогруппами, три(C1-C4-алкил)силильными группами, C1-C4-алкилсульфонильными группами, C1-C4-алкилсульфонильными группами, CN-группами, NO2-группами, или CF3-группами; 1- или 2-нафтил; 2-, 3-, или 4-пиридил, необязательно замещенный - 1 - 3 атомами галогена; C1-C6 -алкоксигруппами, необязательно замещенными 1 - 3 атомами галогена, или C2-C6-алкенилоксигруппами, необязательно замещенными 1 - 3 атомами галогена;
R8 представляет собой водород, или C1-C4-алкил;
R9 представляет собой C1-C6-алкил, необязательно замещенный 1 - 3 атомами галогена; фенил, необязательно замещенный 1 - 3 атомами галогена; CN-группами, NO2-группами, C1-C4-алкильными группами, C1-C4-алкоксигруппами, или CF3 -группами; 2- или 3-тиенил; или 2- или 3-фурил;
Q представляет собой
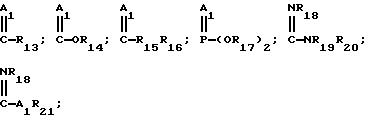
CN; C1-C6-алкил, необязательно замещенный одним или несколькими атомами галогена, CN-группами, или фенильными группами; или фенил, необязательно замещенный одним или несколькими атомами галогена, C1-C4-алкильными группами, C1-C4 -алкоксигруппами, CN-группами, NO2-группами, CF3-группами, или NP24R25-группами; где A1 представляет собой O или S;
R13 представляет собой C1-C6-алкил или фенил;
R14 представляет собой C1-C6-алкил;
R15 и R16, каждый, независимо представляет собой водород, C1-C6-алкил; либо взятые вместе с атомом, с которым они связаны, образуют 5 - 7-членное кольцо;
R17 представляет собой C1-C4-алкил;
R18 представляет собой водород, C1-C4-алкил; либо R18, взятый вместе с R19 или R21 и с атомами, с которыми они связаны, образует 5-7-членное кольцо, необязательно замещенное одной или двумя C1-C4-алкильными группами;
R19 и R20 независимо представляют собой водород или C1-C4-алкил;
R21 представляет собой C1-C4-алкил; либо взятый вместе R18 и атомами, с которыми они связаны, он может образовывать 5-7-членное кольцо, необязательно замещенное одним или двумя C1-C4-алкильными группами;
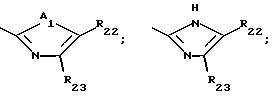
R22 и R23 независимо представляют собой водород; или C1-C4-алкил; либо взятые вместе, они могут образовывать кольцо, где R22R23 означают -CH=CH-CH= CH-;
R24 и R25 независимо представляют собой водород или C1-C4-алкил;
R10 представляет собой водород или C1-C4-алкил;
R11 и R12 представляют собой независимо: водород, C1-C6-необязательно замещенный одним или несколькими атомами галогена; C1-C6-алкоксигруппу, необязательно замещенную одним или несколькими атомами галогена; C1-C6-алкилтиогруппу, необязательно замещенную одним или несколькими атомами галогена; или фенил, необязательно замещенный одним или несколькими атомами галогена; NO2-группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена; либо R11 и R12, взятые вместе с атомом, с которым они связаны, могут образовывать C3-C6-циклоалкильную группу, необязательно замещенную одной, двумя или тремя C1-C4-алкильными группами, C2-C6-алкенильными группами, или фенильными группами; либо R11 и R12, взятые вместе с R26 и атомами, с которыми они связаны, образуют 4-7-членное гетероциклическое кольцо;
n является целым числом 0, 1, 2, 3 или 4;
Q представляет собой A2R26,

A2 представляет собой O или S(O)p;
p представляет собой целое число 0, 1 или 2;
R26 представляет собой водород; C1C6-алкил; C2-C6-алкенил; C2-C6-алкинил; фенил, необязательно замещенный одним или несколькими атомами галогена, NO2-группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена; C(O)R33 при условии, что p = 0; C(O)R34 при условии, что p=0; (CH2CH2O)qR33, или

либо R26, взятый вместе с R11 или R12 и с атомами, с которыми они связаны, может образовывать 4-7-членное гетероциклическое кольцо;
A3 представляет собой O или S;
R33 представляет собой C1-C6-алкил; C2-C6-алкенил; C2-C6-алкинил; или фенил, необязательно замещенный одним или несколькими: атомами галогена; NO2-группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
q представляет собой целое число 1, 2 или 3;
R34 представляет собой OR37 или NR33 R39;
R37 представляет собой C1-C6-алкил; или фенил, необязательно замещенный одним или несколькими: атомами галогена; NO2-группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
R38 и R39 независимо представляет собой водород или C1-C4-алкил;
R35 и R36 независимо представляет собой водород или C1-C4-алкил; либо взятые вместе, они могут образовывать кольцо, где R35R36 представляет собой -CH=CH-CH=CH-;
R27 представляет собой C1-C4-алкил;
R28 представляет собой водород; C1-C6-алкил; C2-C6-алкенил, C2-C6-алкинил; или фенил, необязательно замещенный одним или несколькими атомами галогена, NO2 - группами; CN - группами; C1-C4 -алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена; либо R28, взятый вместе с R11 и R12 и с атомами, с которыми они связаны, могут образовывать 4 - 7-членное гетероциклическое кольцо;
R29 представляет собой водород; C1-C6-алкил; C2-C6-алкенил; C2-C6-алкинил; фенил, необязательно замещенный одним или несколькими атомами галогена, NO2-группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4 -алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена; C(A)R40; CN; SO2R41; или C(O)CHR42NHR43;
A4 представляет собой O или S;
R40 представляет собой OR44, CO2R44; NR45R46; C1-C6-алкил, необязательно замещенный одним-тремя атомами галогена; C2-C6-алкенил; C2-C6-алкинил; или фенил, необязательно замененный одним или несколькими атомами галогена; NO2-группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4 -алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
R44 представляет собой C1-C6-алкил, необязательно замещенный одной фенильной группой; или фенил, необязательно замещенный одним или несколькими; атомами галогена; NO2 - группами; CN - группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
R45 и R46 независимо представляют собой водород, или C1-C6-алкил;
R41 представляет собой NR47R48; C1-C6-алкил; C2-C6-алкенил; C2-C6-алкинил; или фенил, необязательно замещенный одним или несколькими : атомами галогена; NO2-группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
R47 и R48 независимо представляют собой водород или C1-C4-алкил;
R42 представляет собой водород; C1-C4-алкил; необязательно замещенный одной гидроксигруппой; одной SR49-группой; одной C(O)NH2-группой; одной NH2-группой; одной NHC(=NH)NH2-группой; одной CO2H-группой; одной фенильной группой, необязательно замещенной одной гидроксигруппой; одной 3-индолильной группой или одной 4-имидазолильной группой;
R49 представляет собой водород или C1-C4-алкил;
R43 представляет собой C(A4)R50;
R50 представляет собой C1-C6-алкил, необязательно замещенный одним или несколькими атомами галогена; C1-C6-алкоксиалкил; C1-C6-алкилтио; фенил, необязательно замещенный одним или несколькими атомами галогена; NO2-группами, CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена, или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена; OR44; CO2R44; или NR45R46;
R30 и R31 независимо представляют собой водород; C1-C6-алкил, необязательно замещенный одним или несколькими атомами галогена; C1-C6-алкоксигруппу, необязательно замещенную одним или несколькими атомами галогена; фенил, необязательно замещенный одним или несколькими атомами галогена, CN-группами, NO2 -группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена; либо R30 и R31, взятые вместе с атомом, с которым они связаны могут образовывать C3-C6-циклоалкильную группу, необязательно замещенную 1 - 3 C1-C4-алкильными группами, C2-C6-алкенильными группами или фенильными группами;
R32 представляет собой OR51, NR47R48, C1-C4-алкил или фенил, необязательно замещенный одним или несколькими атомами галогена; CN-группами; NO2-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена, или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
R51 представляет собой C1-C4-алкил или фенил, необязательно замещенный одним или несколькими атомами галогена; CN - группами, NO2 - группами, C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
при условии, что если A является S, X является S(O)mCF2R3, а Z является водородом, то Y является водородом, галогеном, C1-C6-галогеноалкилом, S(O)mCF2R3 или CN; и кроме того, если пиррольное кольцо замещено водородом у каждого из атомов углерода пиррола, смежных с атомом азота на кольце, то X не может быть CN или NO2.
Настоящее изобретение также относится к композициям, содержащим вышеуказанные соединения, а также к способам использования этих соединений и композиций. Было обнаружено, что тиенил- и фурилпирроловые соединения настоящего изобретения, а также композиции, содержащие эти соединения, являются эффективными инсекцидными и акарицидными средствами и могут быть с успехом использованы для борьбы с насекомыми и клещами, и для защиты растений от поражений, вызываемых насекомыми и клещами. Соединения настоящего изобретения являются особенно эффективными против совок (Spodoptera eridania u Heliothis virescens).
Подробное описание изобретения
Настоящее изобретение относится, преимущественно, к способу борьбы с насекомыми и клещами путем обработки этих насекомых и клещей, а также почвы, в которой они обитают, или пищи, которую они
употребляют или в которой они обитают, инсектицидно или акарицидно эффективным количеством тиенил- или фурилпирролового соединения формулы I.
Настоящее изобретение также относится к способу защиты растений от поражения насекомыми и клещами, заключающемуся в том, что листья указанных растений либо почву или воду, в которой эти растения произрастают, обрабатывают инсектицидно или акарицидно эффективным количеством тиенил- или фурилпирроловым соединением формулы I.
Тиенил- и фурилпирроловые соединения настоящего изобретения имеют следующую структурную формулы
I
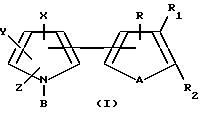
где R, R1, R2, A, X, Y, Z являются такими, как они были определены выше для формулы I.
Предпочтительными соединениями настоящего изобретения являются тиенил- фурилпирроловые соединения формулы I, где R, R1 и R2 независимо
представляют собой водород, галоген, или NO2, либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут образовывать кольцо, в котором R1
R2 представлены структурой
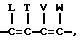
где L, T, V и W независимо представляют собой водород, галоген, CN или NO2;
A представляет собой O или S;
X представляет собой CN, NO2, C1-C6-галогеноалкил, S(O)mCF2R3 или C(S)NR4R5;
R3 представляет собой водород, F, Cl, Br, CF2H, CCl2H, CClFH; CF3, или CCl3;
m является целым числом 0, 1 или 2;
R4 и R5 независимо представляют собой водород; C1-C4-алкил, необязательно замещенный одним или несколькими атомами галогена; или фенил, необязательно замещенный одним или несколькими: атомами галогена; NO2-группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
Y представляет собой водород; галоген; C1-C4-галогеноалкил, S(O)mCF2R3; CN; или фенил, необязательно замещенный одним или несколькими атомами галогена, NO2 -группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
Z представляет собой водород, галоген; или C1-C6-галогеноалкил;
B - представляет собой R6 или CN;
R6 представляет собой водород; C(O)P7; или C1-C6-алкил, необязательно замещенный 1-3 атомами галогена, одной цианогруппой: одной C1-C4-алкоксигруппой, одной C1-C6-алкилкарбонилоксигруппой, одной фенилкарбонилоксигруппой или одной бензилкарбонилоксигруппой;
R7 представляет собой фенил, необязательно замещенный одним или несколькими атомами галогена, C1-C4-алкильными группами, C1-C4-алкоксигруппами, CN-группами, NO2-группами или CF3-группами.
Другой группой предпочтительных инсектицидных и акарицидных соединений настоящего изобретения являются соединения формулы I, где R,
R1 и R2 независимо представляют собой водород, галоген; или NO2; либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут
образовывать кольцо, в котором R1R2 представлены структурой
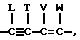
где L, T, V и W независимо представляют собой водород, галоген, CN или NO2;
A представляет собой O или S;
X представляет собой CN, NO2 или C1-C6 -галогеноалкил;
Y представляет собой водород; галоген; C1-C6-галогеноалкил или фенил, необязательно замещенный одним или несколькими: атомами галогена, NO2 -группами, CN-группами, C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена, или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
Z представляет собой водород; галоген или C1-C6-галогеноалкил;
B представляет собой R6 или CN;
R6 представляет собой водород; C(O)R7; или C1-C6-алкил, необязательно замещенный одним, двумя или тремя атомами галогена; одной цианогруппой, одной C1-C4-алкоксигруппой, одной C1-C6-алкилкарбонилоксигруппой, одной фенилкарбонилоксигруппой или одной бензилкарбонилоксигруппой;
R7 представляет собой фенил, необязательно замещенный одним или несколькими атомами галогена, C1-C4-алкильными группами, C1-C4-алкоксигруппами, CN - группами, или CF3 - группами.
Более предпочтительными соединениями настоящего изобретения являются тиенил- и фурилпирроловые соединения формулы I, где R, R1
и R2 независимо представляют собой водород; галоген; или NO2; либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны: могут образовывать
кольцо, где R1R2 представлены структурой:
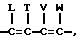
где L, T, V и W независимо представляют собой водород, галоген; CN или NO2;
A представляет собой O или S;
X представляет собой CN, NO2 или C1-C6-галогеноалкил;
Y представляет собой водород; галоген; C1-C6-галогеноалкил, или фенил, необязательно замещенный одним или несколькими атомами галогена, NO2-группами, CN - группами, C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена, или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
Z представляет собой галоген; или C1-C6-галогеноалкил;
B представляет собой R6 или CN;
R6 представляет собой водород; C(O)R7; или C1-C6-алкил, необязательно замещенный одним, двумя или тремя атомами галогена, одной цианогруппой, одной C1-C4-алкоксигруппой, одной C1-C6-алкилкарбонилоксигруппой, одной фенилкарбонилоксигруппой или одной бензилкарбонилоксигруппой;
R7 представляет собой фенил, необязательно замещенный одним или несколькими атомами галогена, C1-C4-алкильными группами, C1-C4-алкоксигруппами, CN-группами, NO2-группами, или CF3-группами.
Другой группой более предпочтительных соединений настоящего изобретения, представляющих собой эффективные инсектицидные и акарицидные средства, являются тиенил- и фурилпирроловые соединения формулы I, где R, R1 и R2 независимо представляют собой водород; галоген; или NO2, либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут образовывать кольцо, где R1R2 представлены структурой: -CH=CH-CH=CH-; A представляет собой O или S; X представляет собой CN или NO2; Y представляет собой галоген; CF3; или фенил, необязательно замещенный одним или несколькими: атомами галогена; NO2 -группами; CN-группами; C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена; Z представляет собой галоген или CF3 и B представляет собой водород; или C1-C6-алкил, замещенный одной C1-C4-алкоксигруппой.
Наиболее предпочтительными инсектицидными и акарицидными соединениями настоящего изобретения являются соединения формулы I, где R, R1 и R2 независимо представляют собой водород, галоген; или NO2; A представляет собой O или S; X представляет собой CN или NO2; Y представляет собой галоген; CF3; или фенил, необязательно замещенный одним или несколькими: атомами галогена, NO2-группами, CN-группами, C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена; или C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена; Z представляет собой CF3; и B представляет собой водород, или C1-C6-алкил, замещенный одной C1-C4-алкоксигруппой.
Примерами вышеуказанного галогена являются фтор, хлор, бром и йод. Термин "C1-C6-галогеноалкил" означает C1-C6-алкильную группу, замещенную одним или несколькими атомами галогена.
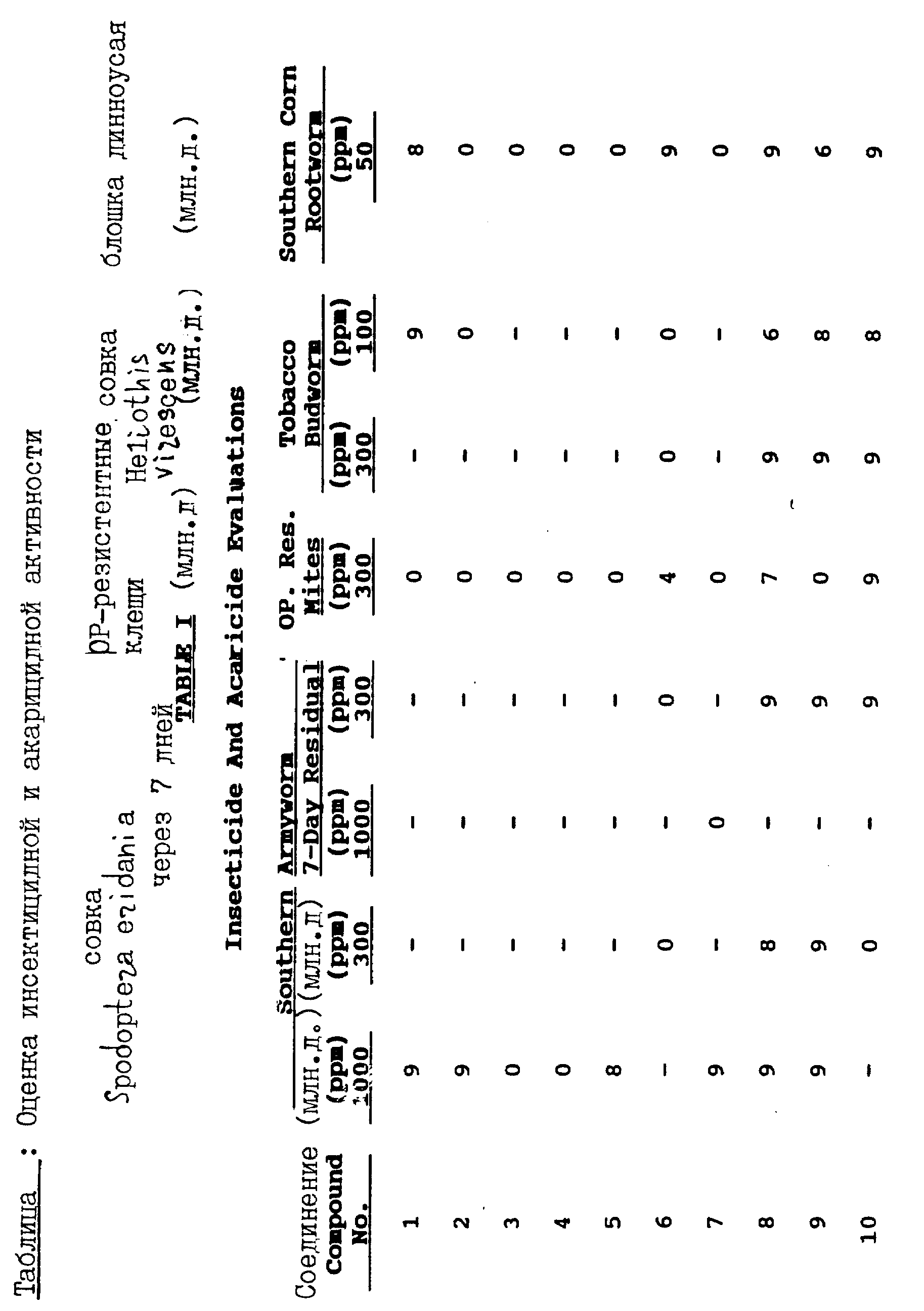
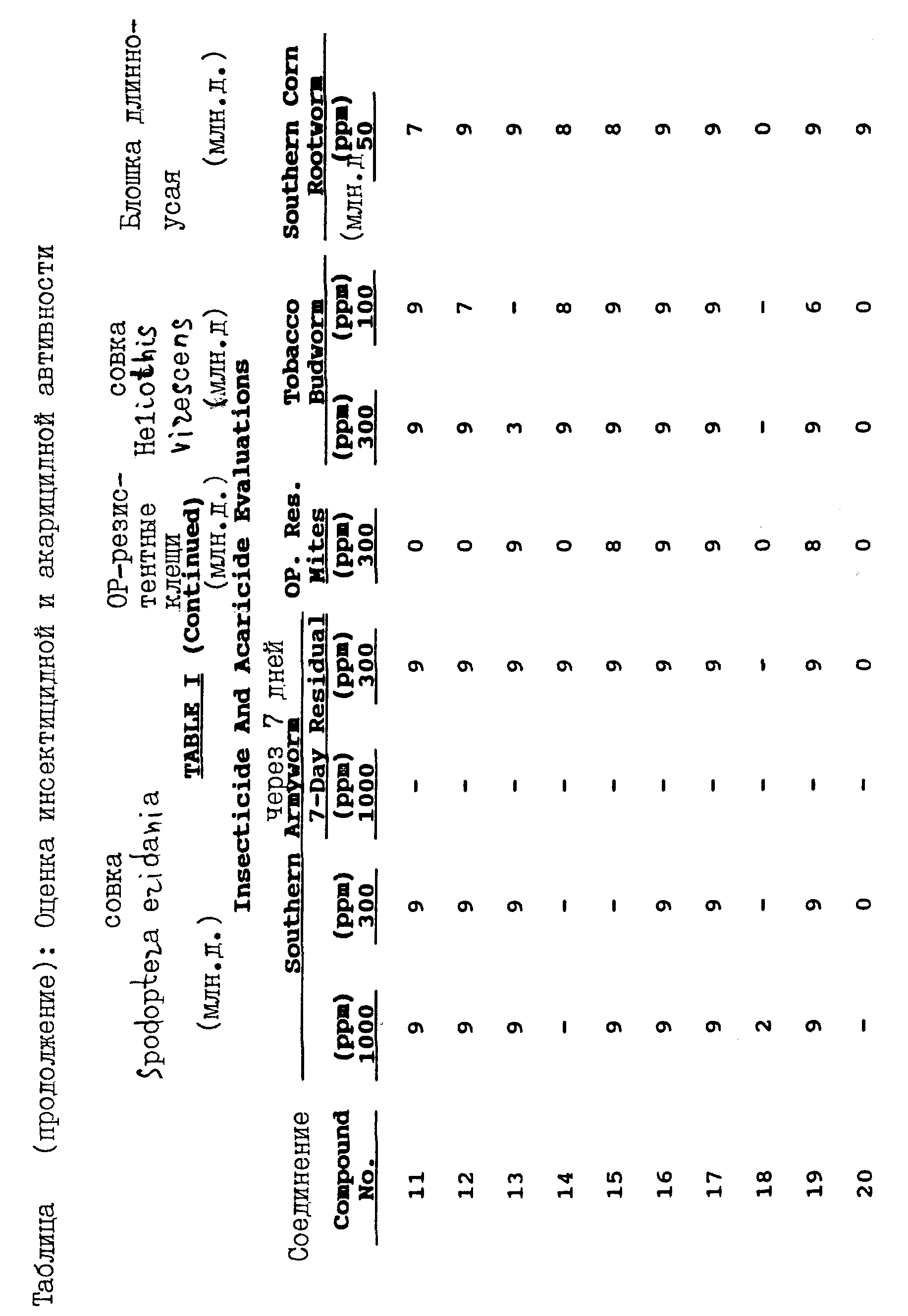
Было обнаружено, что соединения настоящего изобретения, имеющие формулу I, могут быть с успехом использованы для борьбы против совок Spodoptera eridania, Heliothis virescens и двупятнистого паутинного клеща.
Тиенил- и фурилпирроловые соединения формулы I, где X является CN, а Y и Z и B являются водородом, могут быть получены с помощью реакции N-формил(тиенил- или фурил)глицина формулы II с 2-хлоракрилонитрилом и уксусным ангидридом, как показано на реакционной схеме 1 ( см. в конце описания).
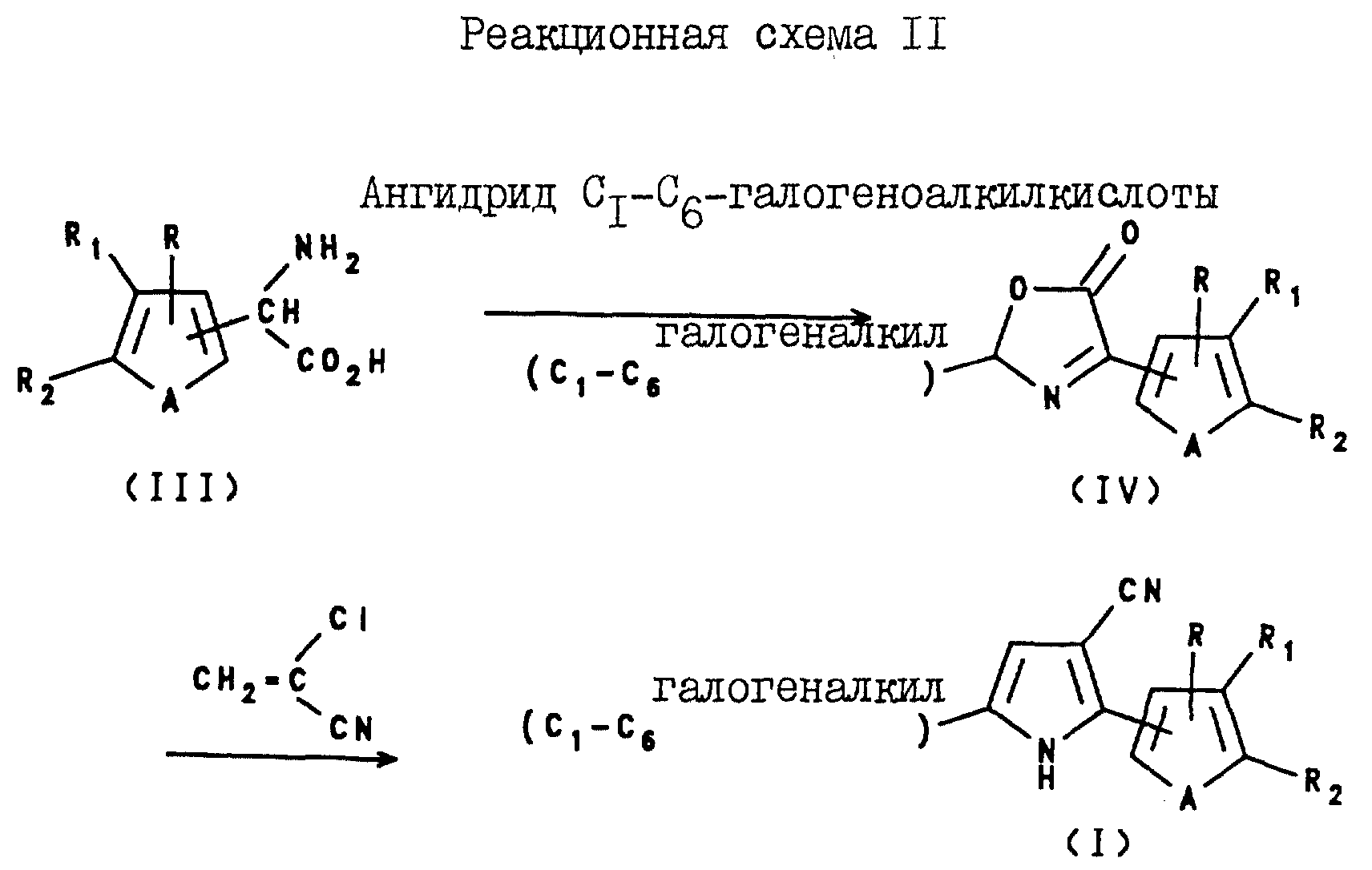
Некоторые соединения формулы I, где X является CN, Y является C1-C6-галогеноалкилом, а Z и B являются водородом, могут быть получены с помощью реакции соответствующим образом замещенного тиенил- или фурилглицина формулы III с ангидридом C1-C6-галогеноалкилкислоты с образованием оксазолина формулы IV в качестве промежуточного соединения; и последующей реакции указанного промежуточного соединения формулы IV с 2-хлороакрилонитрилом, как показано на реакционной схеме II.
Соединения формулы I, где X и Y являются C1-C6-галогеноалкилом, а Z и B являются водородом, могут быть получены с помощью реакции оксазолинона формулы IV с бромоалкеном формулы V, как показано на реакционной схеме III.
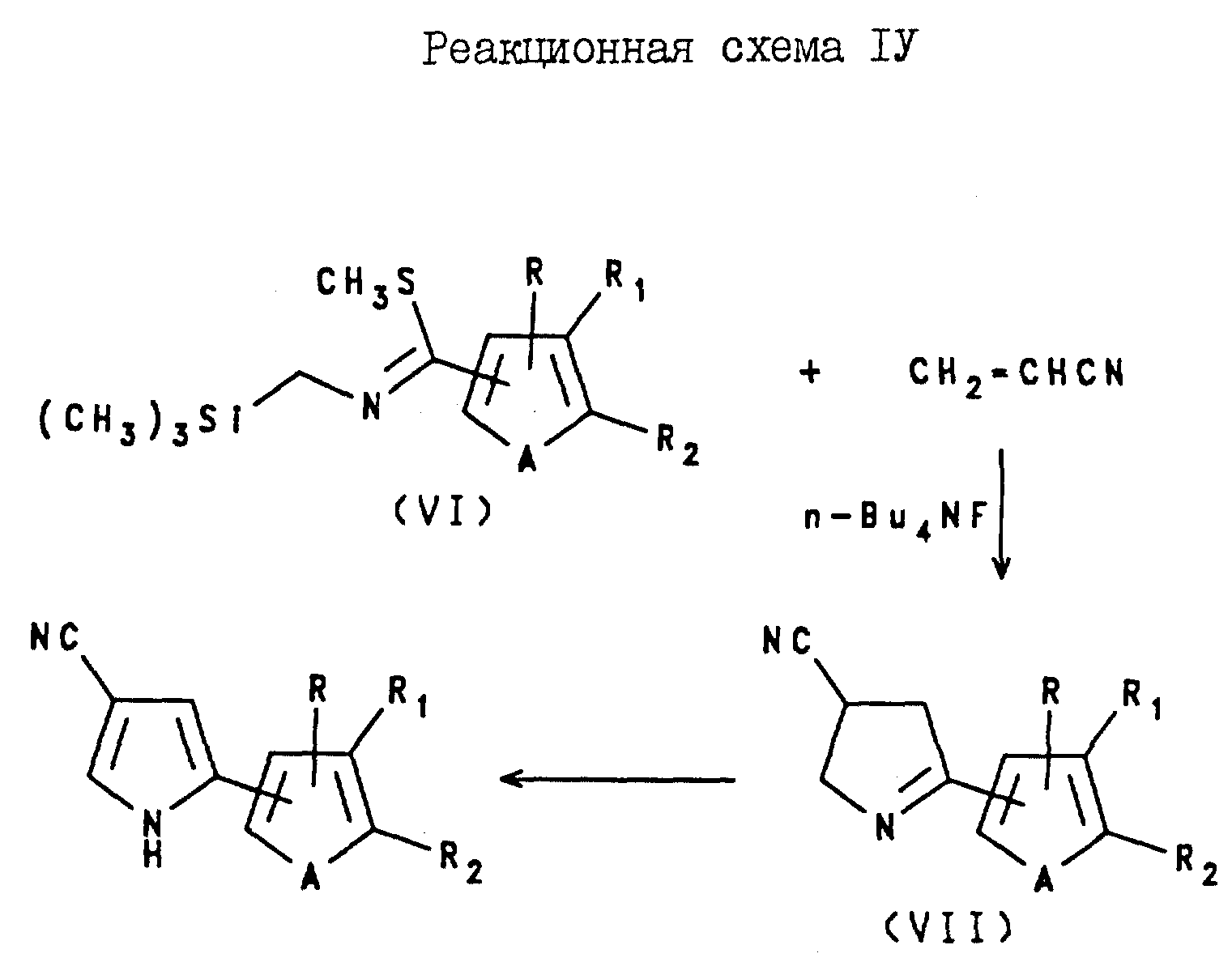
4-Циано-2-(тиенил- или фурил)пирроловые соединения могут быть получены с помощью реакции акрилонитрила с N-(триметилсилил)метил-5-метил-(тиенил- или фурил)тиоимидатом формулы VI в присутствии фторида тетрабутиламмония, в результате чего образуется 2-(тиенил- или фурил)-1-пирролин-4-карбонитрил формулы VII в качестве промежуточного соединения, которое затем подвергают реакции с 2,3-дихлоро-5,6-дициано-1,4-бензохиноном и пиридином, как показано в реакционной схеме IV.
3-Циано или нитро-2-тиенилпирроловые соединения могут быть получены, как показано в реакционной схеме V, где R, R1 и R2 независимо представляют собой
водород; галоген; или NO2, либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут образовывать кольцо, где
R1R2
представлены структурой:

где L, T, V, и W независимо представляют собой водород, галоген, CN или NO2;
X представляет собой CN или NO2; и
R52 представляет собой C1-C4-алкил.
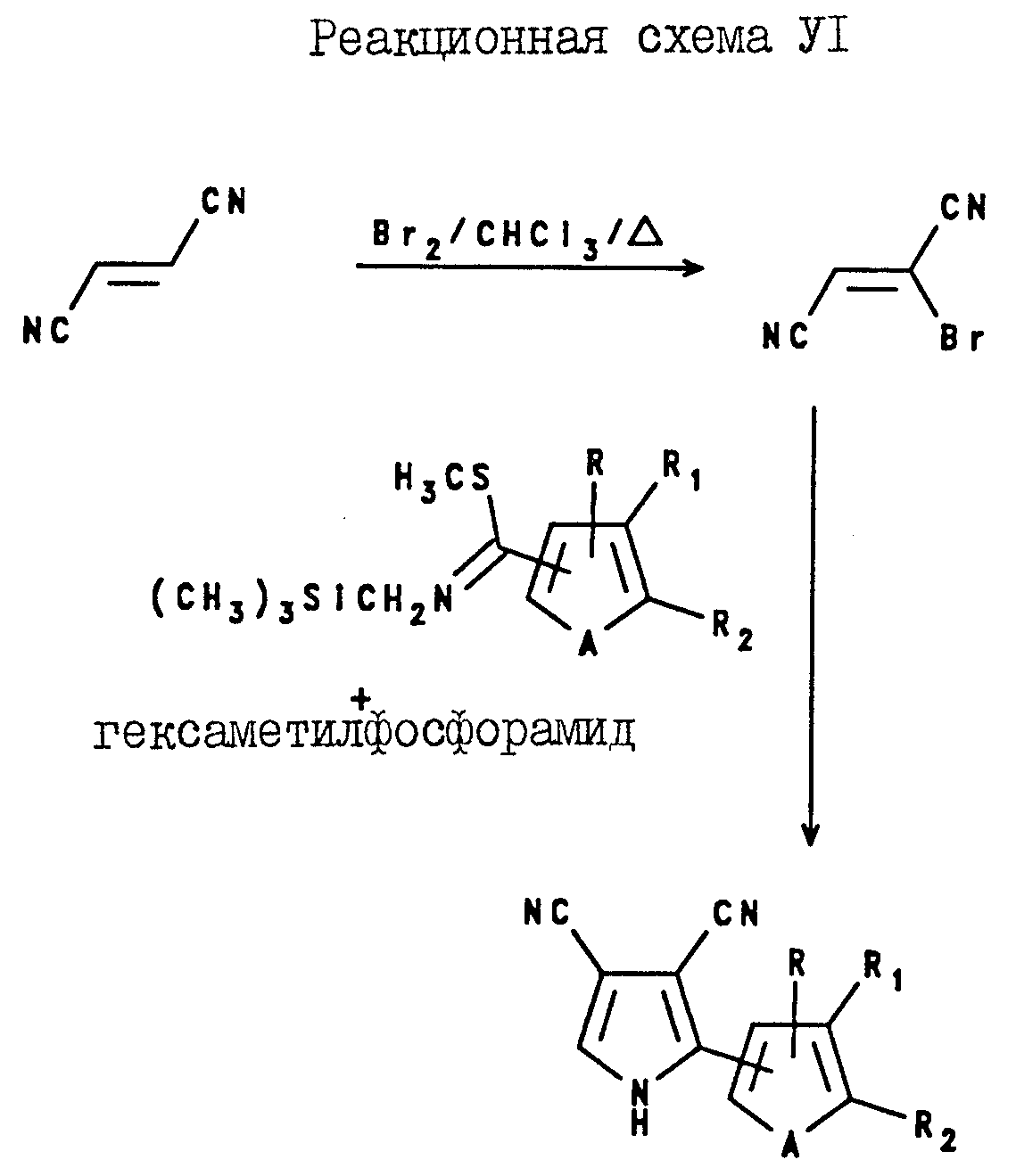
2-(Тиенил- или фурил)пиррол-3, 4-дикарбонитриловые соединения могут быть получены, как показано в реакционной схеме VI.
Соединения формулы I, где X представляет собой C(S)NH2 могут быть получены с помощью
реакции соответствующим образом замещенного (тиенил- или фурил)пиррол-карбонитрила формулы VIII с избыточным количеством перекиси водорода и гидроксида натрия, в результате которой образуется
соответствующим образом замещенный (тиенил- или фурил)пирролкарбоксамид формулы IX, и с помощью последующей реакции указанного карбоксамида формулы IX с реагентом, способным вводить тиоксогруппу,
такую, как 2,4-бис(4-мет-оксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид, как показано в реакционной схеме VII, где A, B, Y и Z являются такими, как они были определены выше для формулы I;
R, R2 и R2 независимо представляют собой водород, галоген или NO2, либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут
образовывать кольцо, где R1R6 представлены структурой

где L, T, V и W независимо представляют собой водород, галоген, CN или NO2.
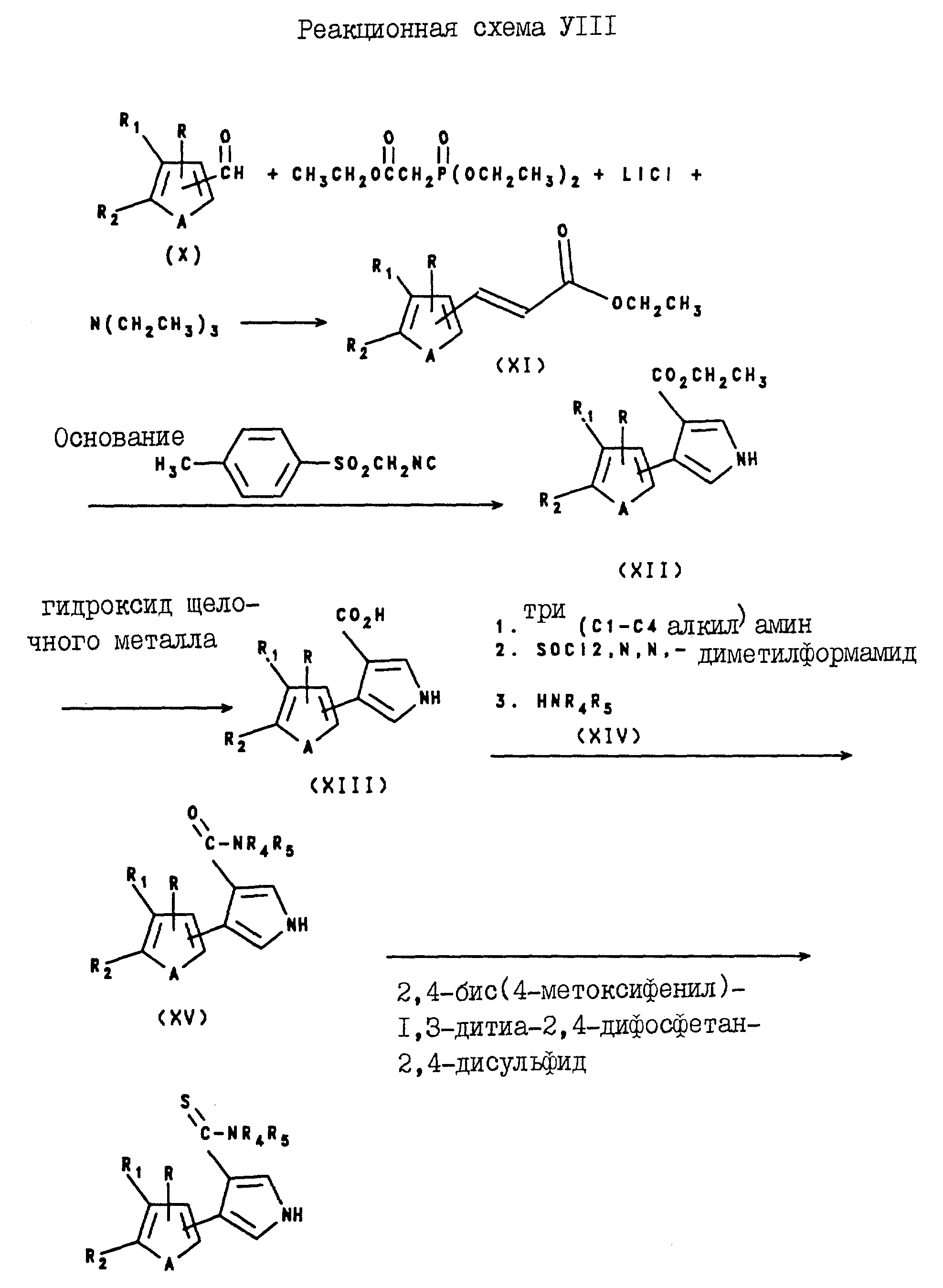
4-(Тиенил- или фурил)пиррол-3-тиокарбоксамидные соединения могут быть получены с помощью реакции соответствующим
образом замещенного альдегида формулы X с триэтилфосфоноацетатом, литийхлоридом и триэтиламином с образованием сложного эфира формулы XI. Затем полученный сложный эфир формулы XI подвергают реакции с
сильным основанием, таким, как гидрид натрия, с толилметилизоцианидом, в результате чего получают этил 4-(тиенил- или фурил)пиррол-3-карбоксилат формулы XII, который затем подвергают гидролизу в
присутствии гидроксида щелочного металла, такого, как гидроксид калия, с получением 4-(тиенил- или фурил)пиррол-3-карбоновой кислоты формулы XIII. Указанную карбоновую кислоту формулы XIII подвергают
реакции с три(C1-C4)-алкилом)амином, в результате которой получают первую смесь. Эту первую смесь подвергают реакции с тионилхлоридом и N,N-диметилформамидом и получают вторую
смесь. Полученную вторую смесь подвергают реакции с аминовым соединением формулы XIY, в результате чего получают 4-(тиенил- или фурил)пиррол-3-карбоксамид формулы XV, который затем подвергают реакции
с реагентом, способным вводить тиоксо-группу, такую, как 2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид, в результате чего получают целевой 4-(тиенил- или
фурил)пиррол-3-тиокарбоксамид. Описанные выше реакции показаны в реакционной схеме VIII, где A, R4 и R5 являются такими, как они были определены для формулы I;
R, R1 и R2 независимо представляют собой водород, галоген, или NO2, либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут
образовывать кольцо, где R1R2 представлены структурой
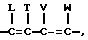
где I, T, V и W независимо представляют собой водород, галоген, CN или NO2.
2-(Тиенил- и фурил)-1-гидроксипиррол-3-карбонитриловые соединения могут быть получены с помощью реакции сложного
эфира формулы XVI с ацеталем цианопропиональдегида в присутствии гидрида натрия с образованием ацеталя формулы XVII и последующей реакции указанного ацеталя формулы XVI с гидрохлоридом гидроксиламина,
как показано ниже в реакционной схеме IX
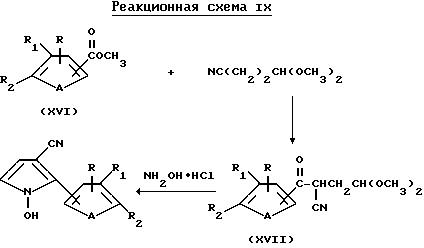
где A представляет собой O или S;
R, R1 и R2 независимо представляют собой водород, галоген, или NO2, либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут образовывать кольцо, где R1R2 представлены структурой
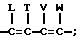
где L, T, V и W независимо представляют собой водород, галоген, CN или NO2.
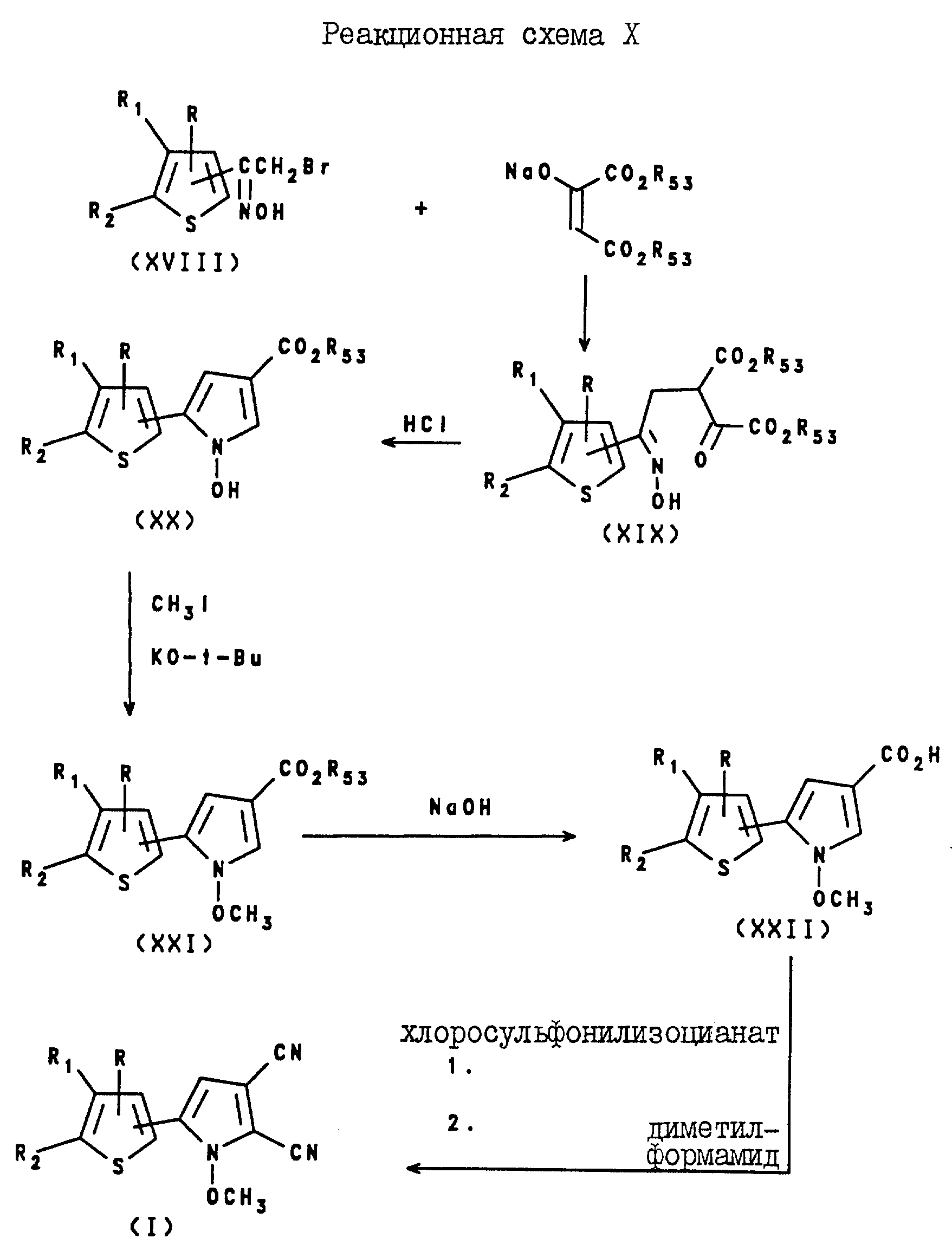
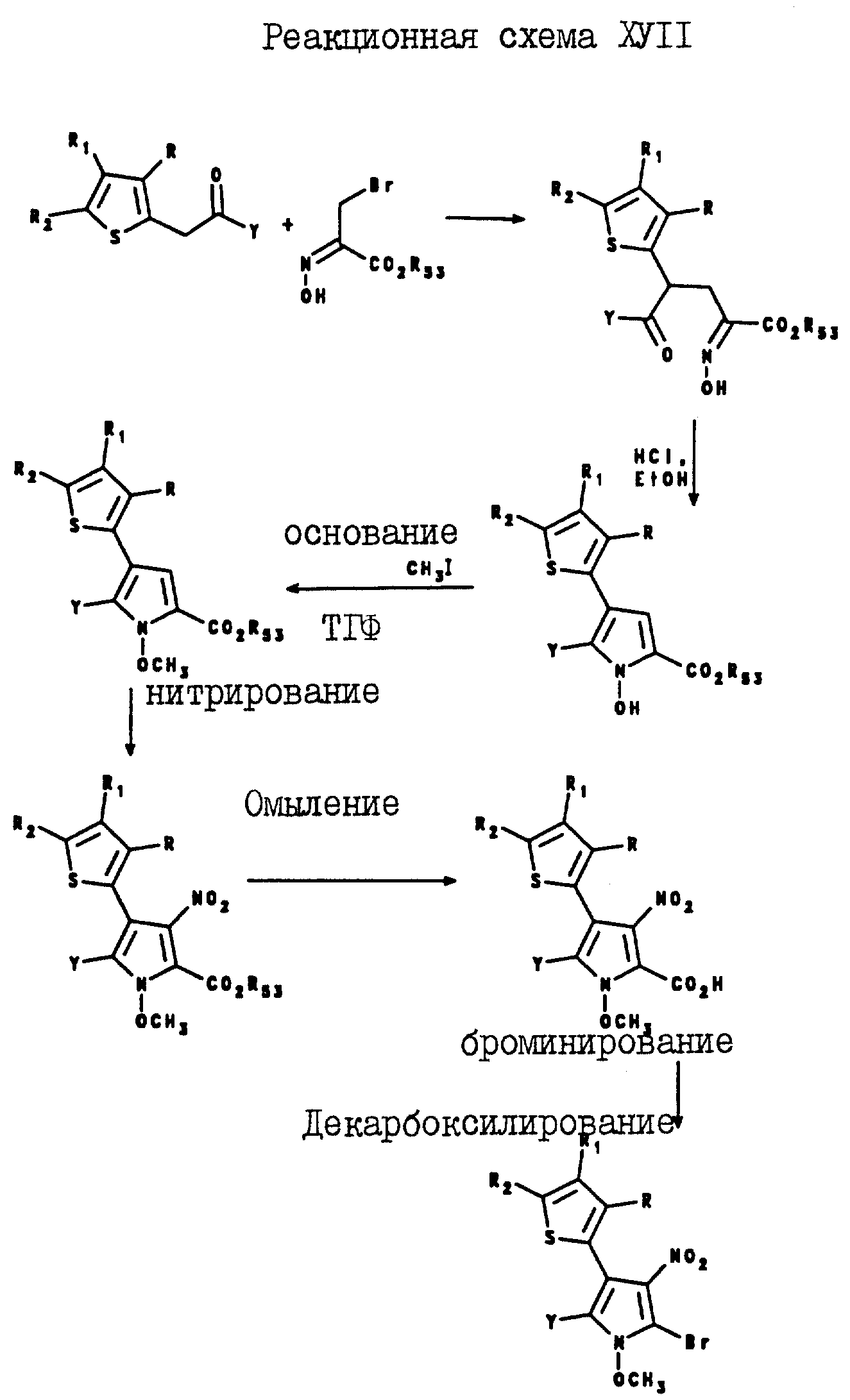
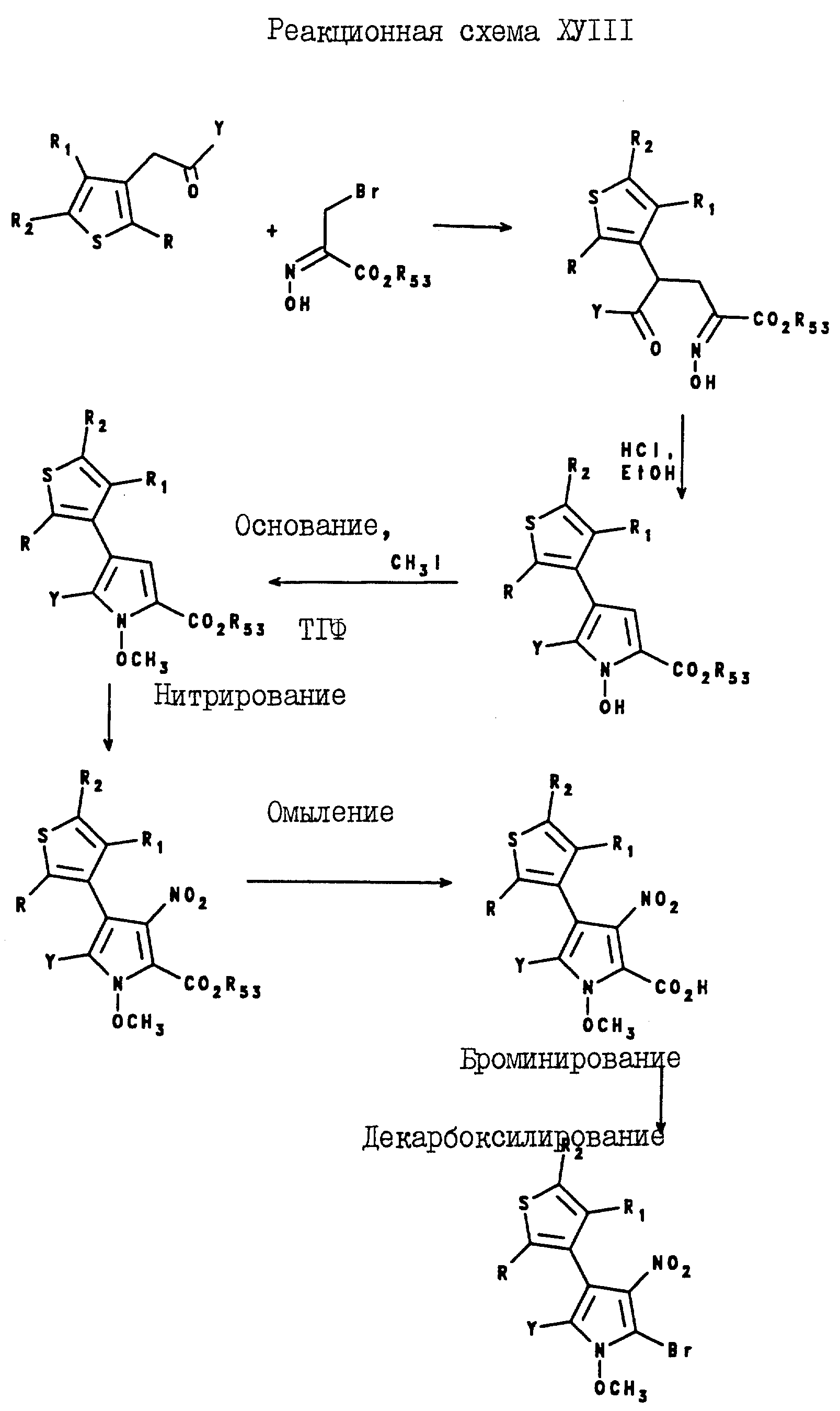
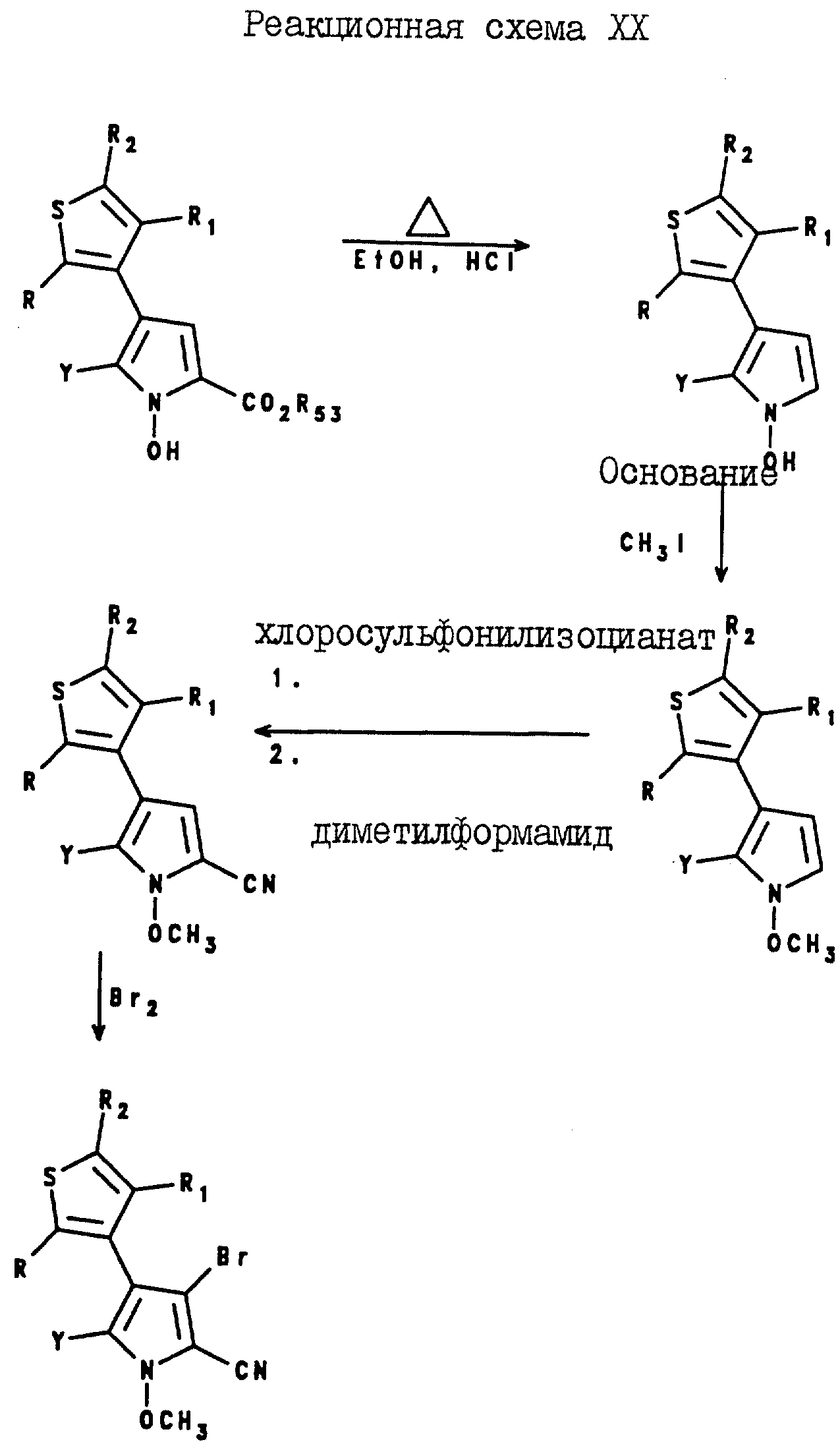
5-Тиенилпиррол-2,3-дикарбонитриловые соединения формулы I могут быть получены посредством реакции оксима формулы XVIII с оксалацетатом натрия, в результате которой образуется промежуточное соединение формулы XIX, а после реакции этого промежуточного соединения с соляной кислотой в присутствии спирта образуется 5-тиенил-1-гидроксипиррол-3-карбоксилат формулы XX.
Карбоксилат формулы XX подвергают реакции с метилиодидом и т-бутоксидом калия, в результате чего получают
5-тиенил-1-метоксипиррол-3-карбоксилат. После реакции омыления карбоксилата формулы XXI получают 5-тиенил-1-метоксипиррол-3-карбоновую кислоту формулы XXII, которую затем подвергают реакции с
хлоросульфонилизоцианатом и с N,N-диметилформамидом, в результате чего получают 5-тиенилпиррол-2,3-дикарбонитрил формулы I. Описанная реакция показана на реакционной схеме X (см. в конце описания),
где R, R1 и R2 независимо представляют собой водород, галоген, или NO2, либо R1 и R2, взятые вместе с атомами углерода, с которыми они
связаны, могут образовывать кольцо, где R1R2 представлено структурой:
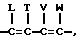
где L, T, V и W независимо представляют собой водород, галоген, CN или NO2;
R53 представляет собой C1-C6-алкил или C3-C6 -циклоалкил.
2,4-Дибромо-5-(2-тиенил)-1-метоксипиррол-3-карбонитриловые соединения настоящего изобретения могут быть получены посредством реакции
5-(2-тиенил)-1-метоксипиррол-3-карбоксилата формулы XXIII с бромом, в результате которой образуется 2,4-дибромо-5-(2-тиенил)-1-метоксипиррол-3-карбоксилат формулы XXIV. После реакции омыления
карбоксилата формулы XXIV получают кислоту формулы XXV, которую подвергают реакции с хлоросульфонилизоцианатом и диметилформамидом, в результате чего получают нужный 2,
4-дибромо-5-(2-тиенил)-1-метоксипиррол-3-карбонитрил. Реакции, описанные выше, показаны в реакционной схеме XI
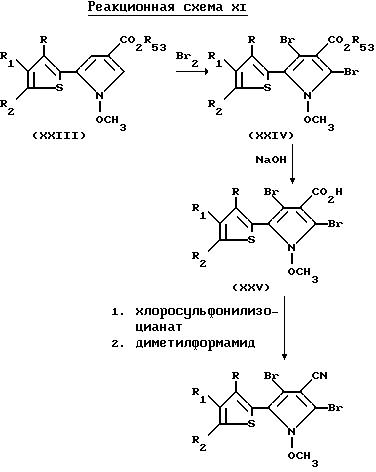
где R и R1 независимо представляют собой водород, галоген, или NO2, либо R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут образовывать кольцо, где R1R2 представлены структурой
R2 является галогеном, либо взятые вместе с R1 и с атомами углерода, с которыми они связаны, они могут образовывать кольцо, где R1R2 представлены структурой:

где L, T, V и W независимо представляют собой водород, галоген, CN или NO2;
R53 представляет собой C1-C6-алкил или C3-C6-циклоалкил.
Аналогично, 2,
4-дибромо-5-(3-тиенил)-1-метоксипиррол-3-карбонитриловые соединения могут быть получены в соответствии с реакционной схемой XII
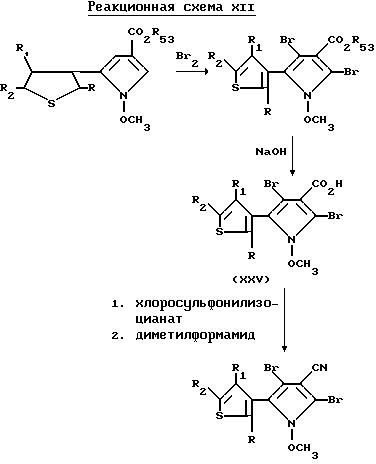
где R1 представляет собой водород, галоген, или NO2, либо взятый вместе с R2 и с атомами углерода, с которыми они связаны, образует кольцо, где R1R2 представляют собой структуру
R и R2 независимо представляют собой галоген, либо R2 и R1, взятые вместе с атомами углерода, с которыми они связаны, могут образовывать кольцо, где R1R2 представлены структурой

где L, T, V и W независимо представляют собой водород, галоген, CN или NO2;
R53 представляет собой C1-C6-алкил или C3-C6-циклоалкил.
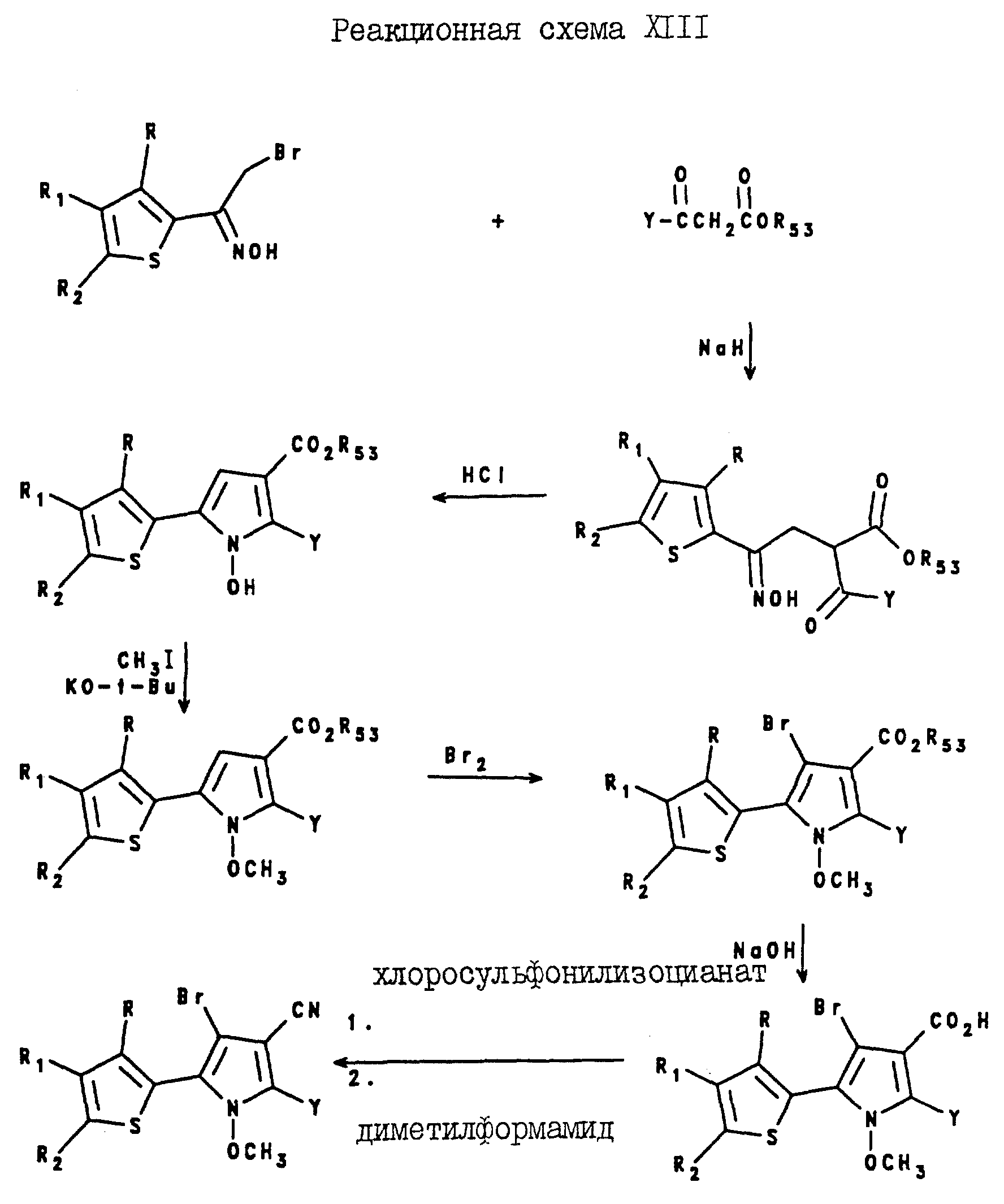
4-Бромо-2-(C1-C6 -галогеноалкил)-5-(2-тиенил)-1- метоксипиррол-3-карбонитриловые соединения настоящего изобретения могут быть получены, как показано в реакционной схеме XIII (см. в конце описания), где Y представляет собой C1-C6-галогеноалкил, а R, R1 и R53 являются такими, как они были определены для реакционной схемы XI.
Аналогично, 4-бромо-2-(C1-C6-галогеноалкил)-5-(3-тиенил)-1- метоксипиррол-3-карбонитриловые соединения могут быть получены как показано в реакционной схеме XIV, где Y представляет собой C1-C6-галогеноалкил, а R, R1, R2 и R53 являются такими, как они были определены для реакционной схемы XII.
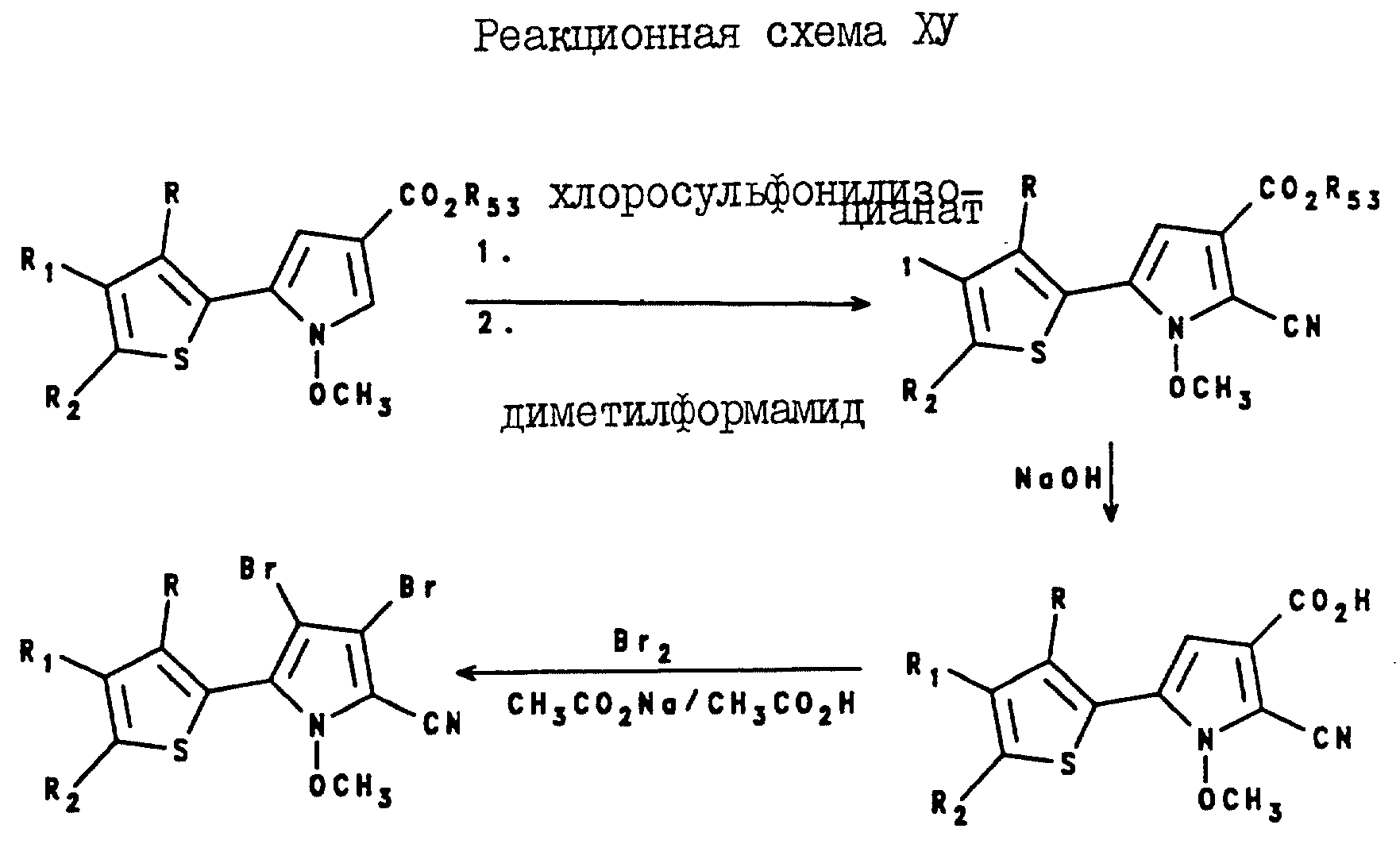
3, 4-Дибромо-5-(2-тиенил)-1-метоксипиррол-2-карбонитриловые соединения могут быть получены с помощью реакции 5-(2-тиенил)-1-метоксипиррол-3- карбоксилата с хлорсульфонилизоцианатом и диметилформамидом, в результате которой образуется 2-циано-5-(2-тиенил)-1-метоксипиррол-3-карбоксилат. После реакций омыления и бромирования 2 циано-5-(2-тиенил)-1-метоксипиррол-3-карбоксилата получают целевой 3, 4-дибромо-5-(2-тиенил)-1-метоксипиррол-2-карбонитрил, как показано в реакционной схеме XV, где R, R1, R2 и R53 являются такими, как они были определены для реакционной схемы XI.
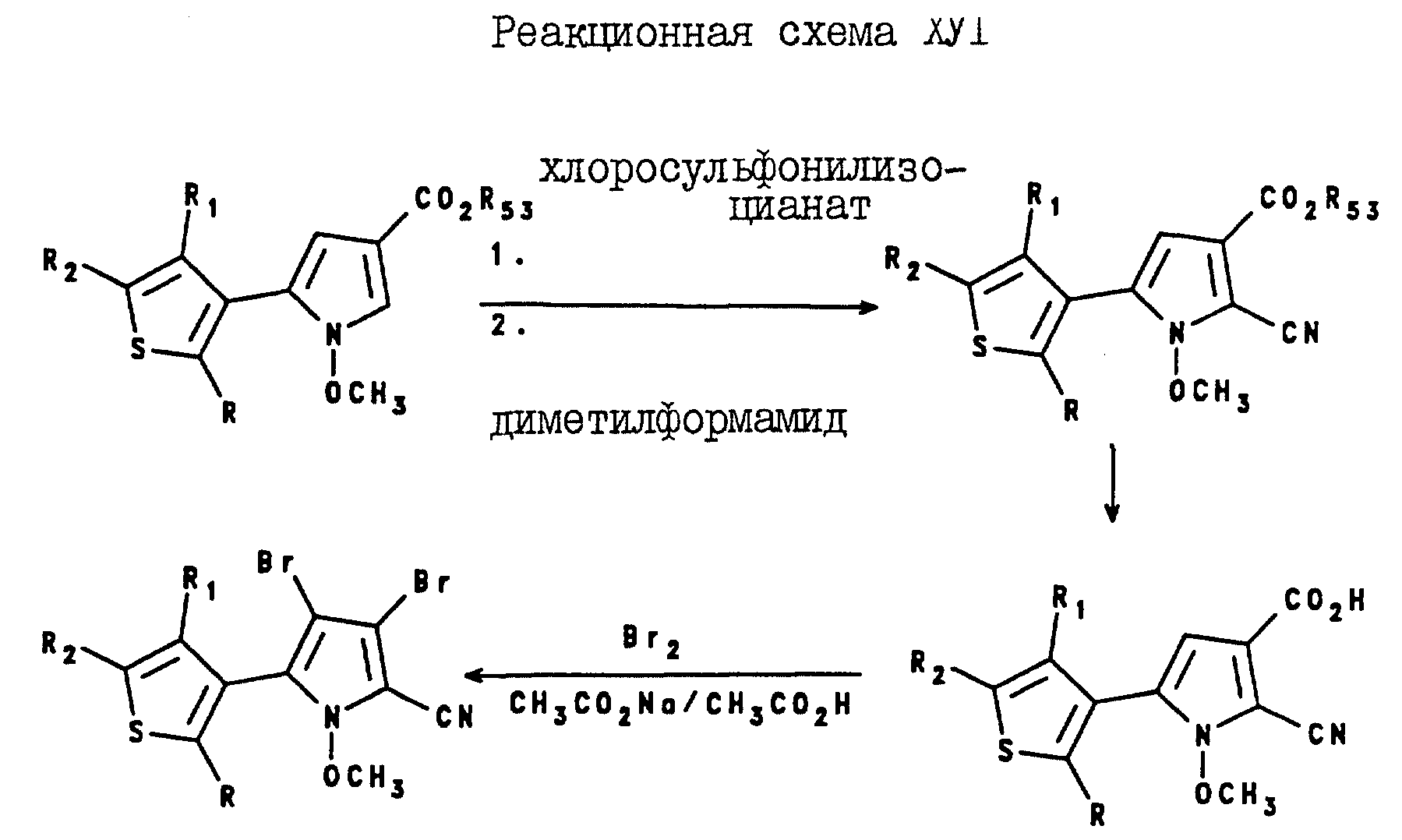
Аналогично, 3,4-дибромо-5-(3-тиенил)-1-метоксипиррол-2-карбонитриловые соединения могут быть получены в соответствии с реакционной схемой XVI, где R, R1, R2 и R53 являются такими, как они были определены выше для реакционной схемы XII.
2-Бромо-3-нитро-5-(C1-C6 -галогеноалкил)-4- (2-тинил)-1-метоксипирроловые соединения формулы I могут быть получены в соответствии с реакционной схемой XVII, где Y представляет собой C1-C6-галогеноалкил и R, R1 и R53 являются такими, как они были определены для реакционной схемы XI.
Аналогично, 2-бромо-3-нитро-5-(C1-C6
-галогеноалкил)-4-(3-тиенил)-1- метоксипирроловые соединения могут быть получены в соответствии с реакционной схемой XVIII,
где Y представляет собой C1-C6-галогеноалкил,
а R, R1, R2 и R53 являются такими, как они были определены для реакционной схемы XII.
3-Бромо-5-(C1-C6 -галогеноалкил)-4-(2-тиенил)-1- метоксипиррол-2-карбонитриловые соединения могут быть получены в соответствии с реакционной схемой XIX, где Y представляет собой C1-C6 -галогеноалкил, а R, R1, R2 и R53 являются такими, как они были определены для реакционной схемы XI.
Аналогично 3-бромо-5-(C1-C6 -галогеноалкил)-4-(3-тиенил)-1- метоксипиррол-2-карбонитриловые соединения могут быть получены в соответствии с реакционной схемой XX, где Y представляют собой C1-C6 -галогеноалкил, а R, R1, R2 и R53 являются такими, как они были определены для реакционной схемы XII.
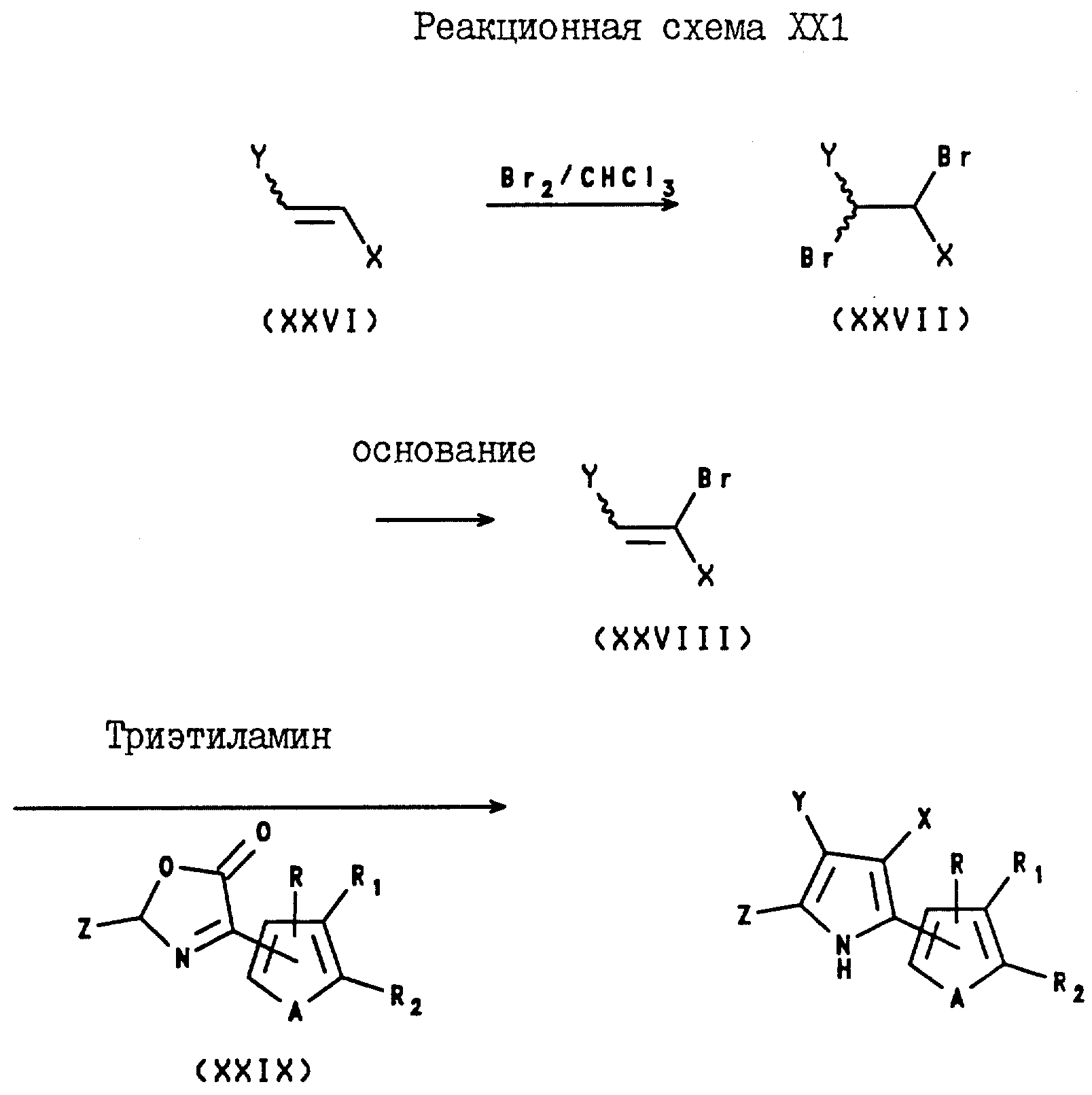
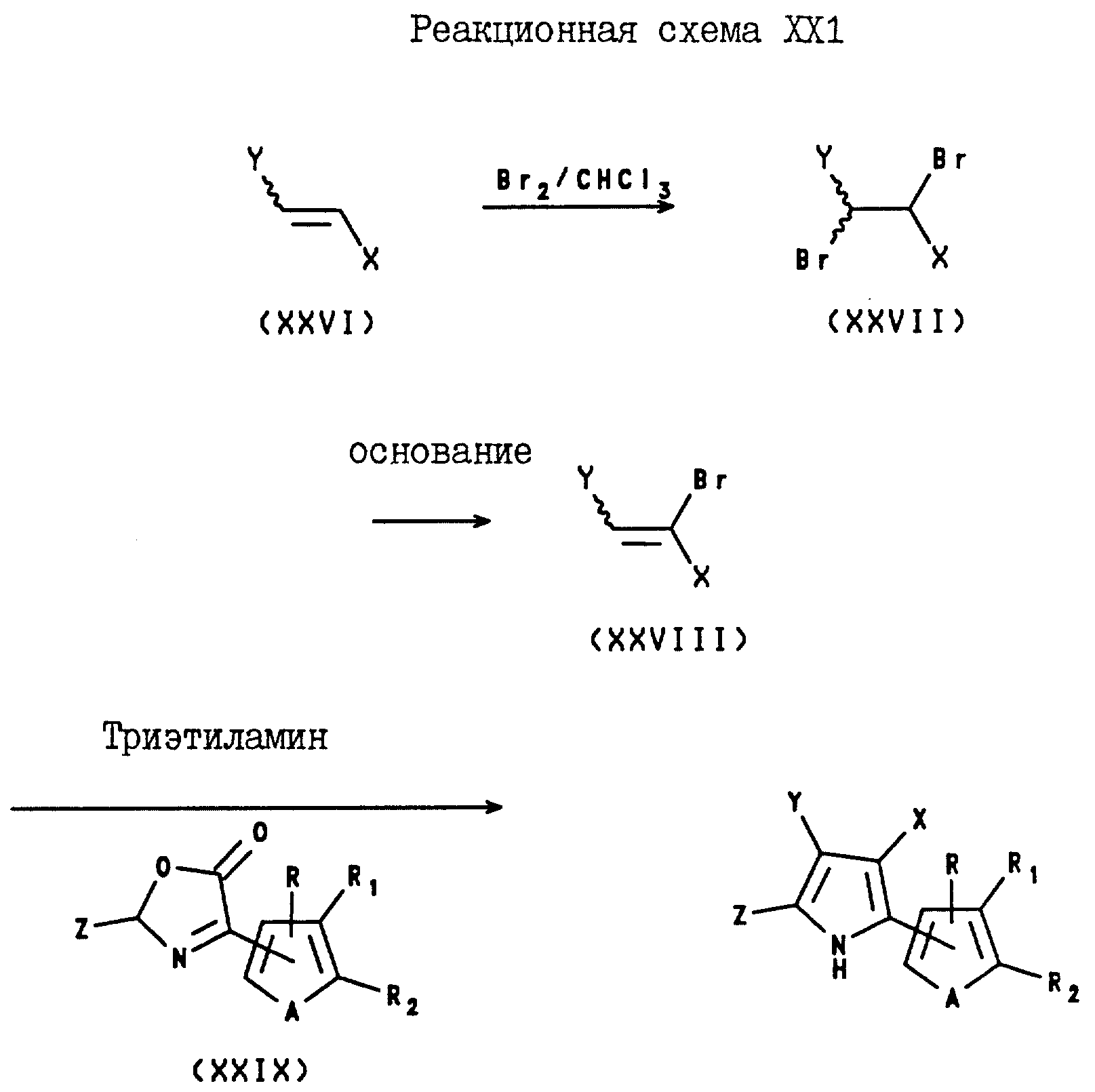
4-Арил-3-(нитро- и циано)-5-(C1-C6-галогеноалкил)- 2-(2- и 3-тиенил и фурил)пирроловые соединения могут быть получены с помощью реакции замещенного или незамещенного бета-(нитро- или циано)стирола формулы XXVI с бромом, в
результате чего образуется (замещенный или незамещенный фенил)-1,2-дибромо-2-(нитро- или циано) этан формулы XXVII, который затем подвергают реакции дегалогенирования с использованием основания,
такого, как пиридин, и в результате этой реакции получают замещенный или незамещенный (нитро- или циано)бромостирол формулы XXVIII. После этого, указанный бромостирол подвергают реакции с оксазолином
формулы XXIX в присутствии трис(C1-C4-алкил)амина, в результате чего получают целевой 4-арил-3-(нитро или циано)-5-(C1-C6-галогеноалкил)-2-(2- или 3-тиенил
или -фурил)пиррол. Вышеуказанные реакции проводят в соответствии с реакционной схемой XXI, где X представляет собой CN или NO2;
Y представляет собой фенил, необязательно замещенный
одним или несколькими атомами галогена, NO2-группами, CN-группами, C1-C4-алкильными группами, необязательно замещенными одним или несколькими атомами галогена, или
C1-C4-алкоксигруппами, необязательно замещенными одним или несколькими атомами галогена;
Z представляет собой C1-C6-галогеноалкил;
A
представляет собой O или S;
R, R1 и R2 независимо представляют собой водород, галоген, или NO2 , либо R1 и R2, взятые вместе с атомами
углерода, с которыми они связаны, могут образовывать кольцо, где R1R2 представлены структурой
где L, T, V и W независимо представляют собой водород, галоген, CN или NO2.
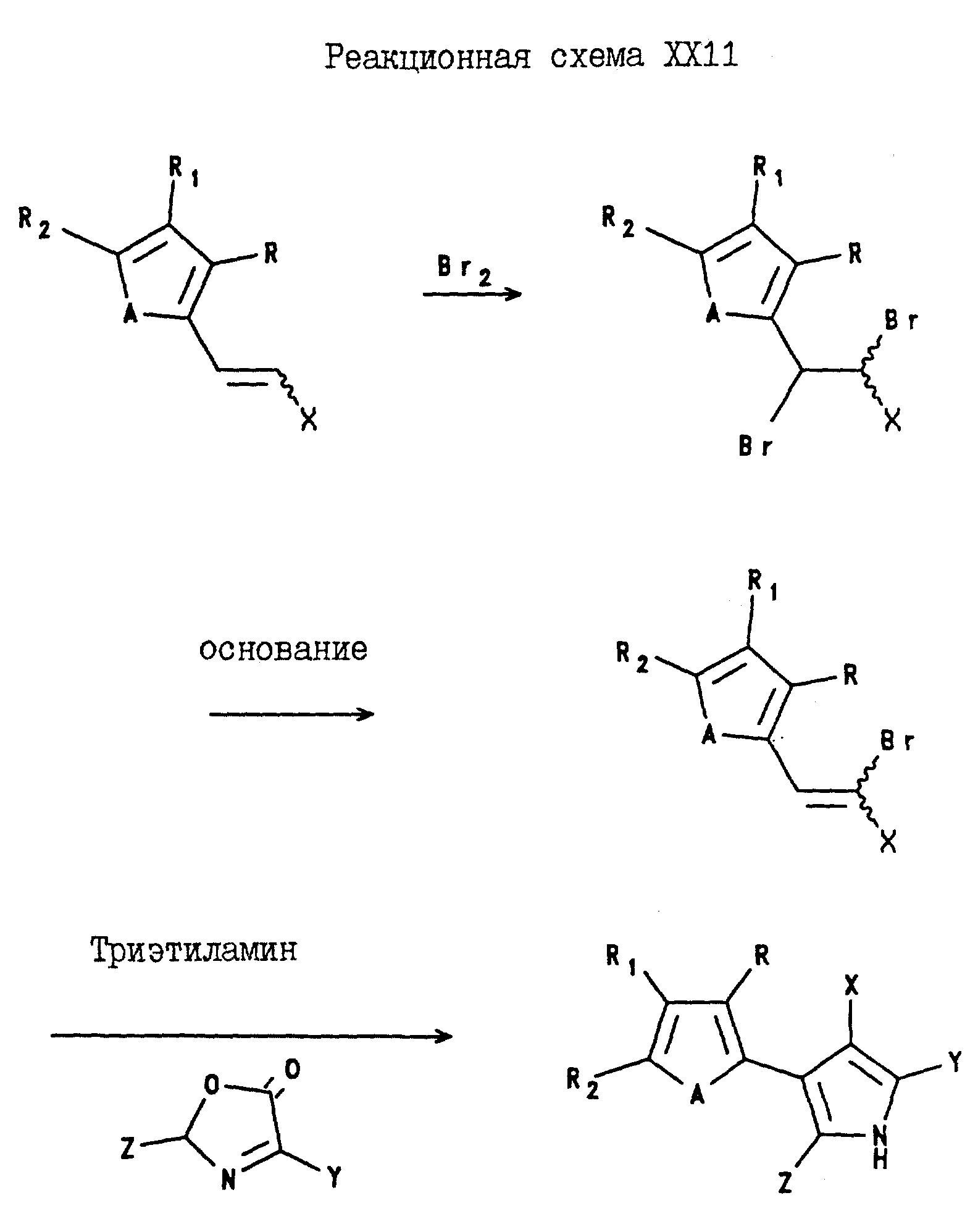
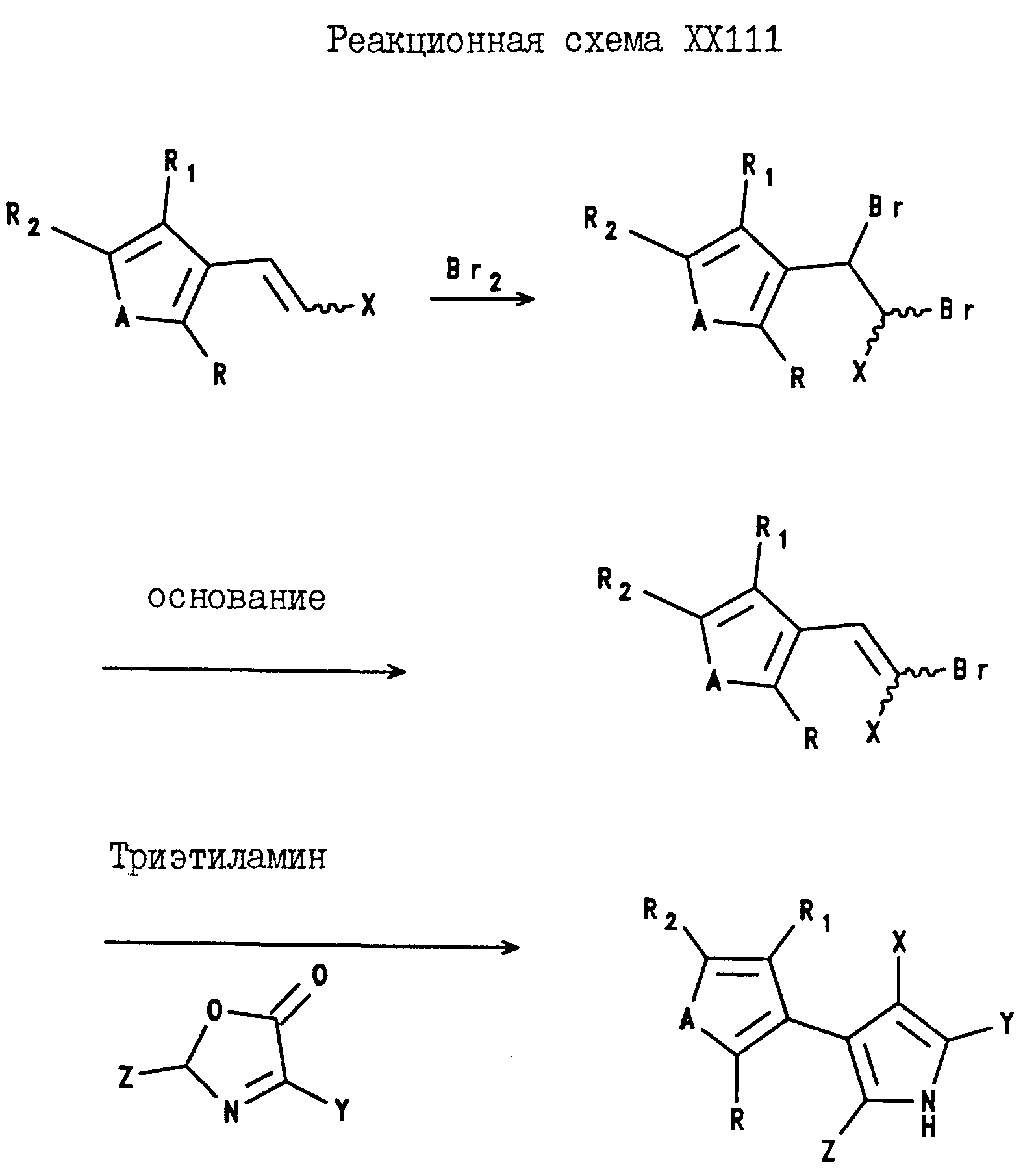
Аналогично, 4-(2-тиенил и -фурил)-3-(нитро и циано)-5-(C1-C6-галогеноалкил)-2-арилпирроловые соединения могут быть получены в соответствии с Реакционной схемой XXII; а 4-(3-тиенил и -фурил)-3-нитро и циано)-5-C1 -C6-галогеноалкил)-2-арилпирроловые соединения могут быть получены в соответствии с реакционной схемой XXIII, где A, X, Y и Z являются такими, как они были определены для реакционной схемы XXI, а R, R1 и R2 являются такими, как они были определены для реакционной схемы XI, где A, X, Y и Z определены в описании Реакционной схемы XXI, а R, R1 и R2 определены в описании реакционной схемы XII.
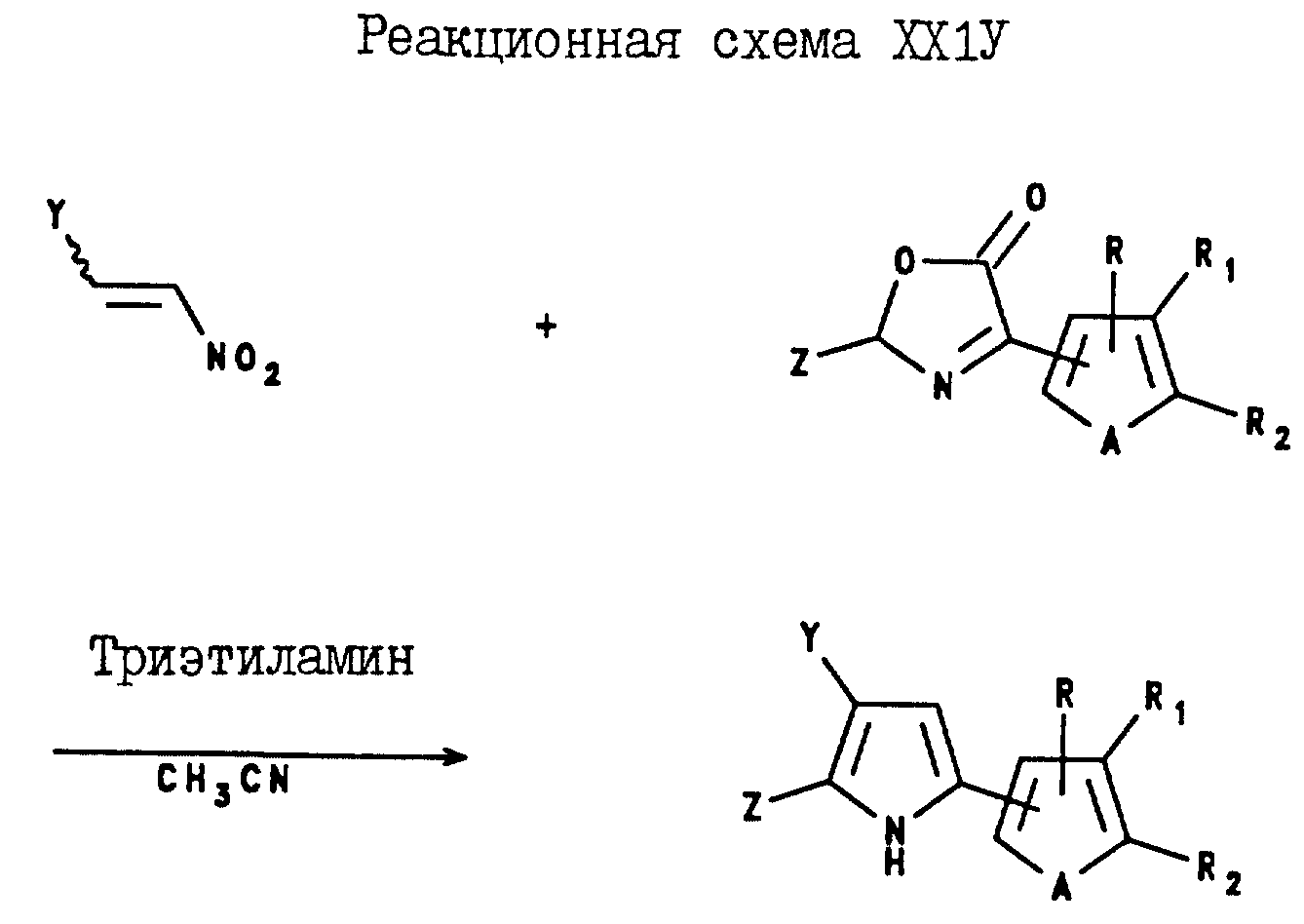
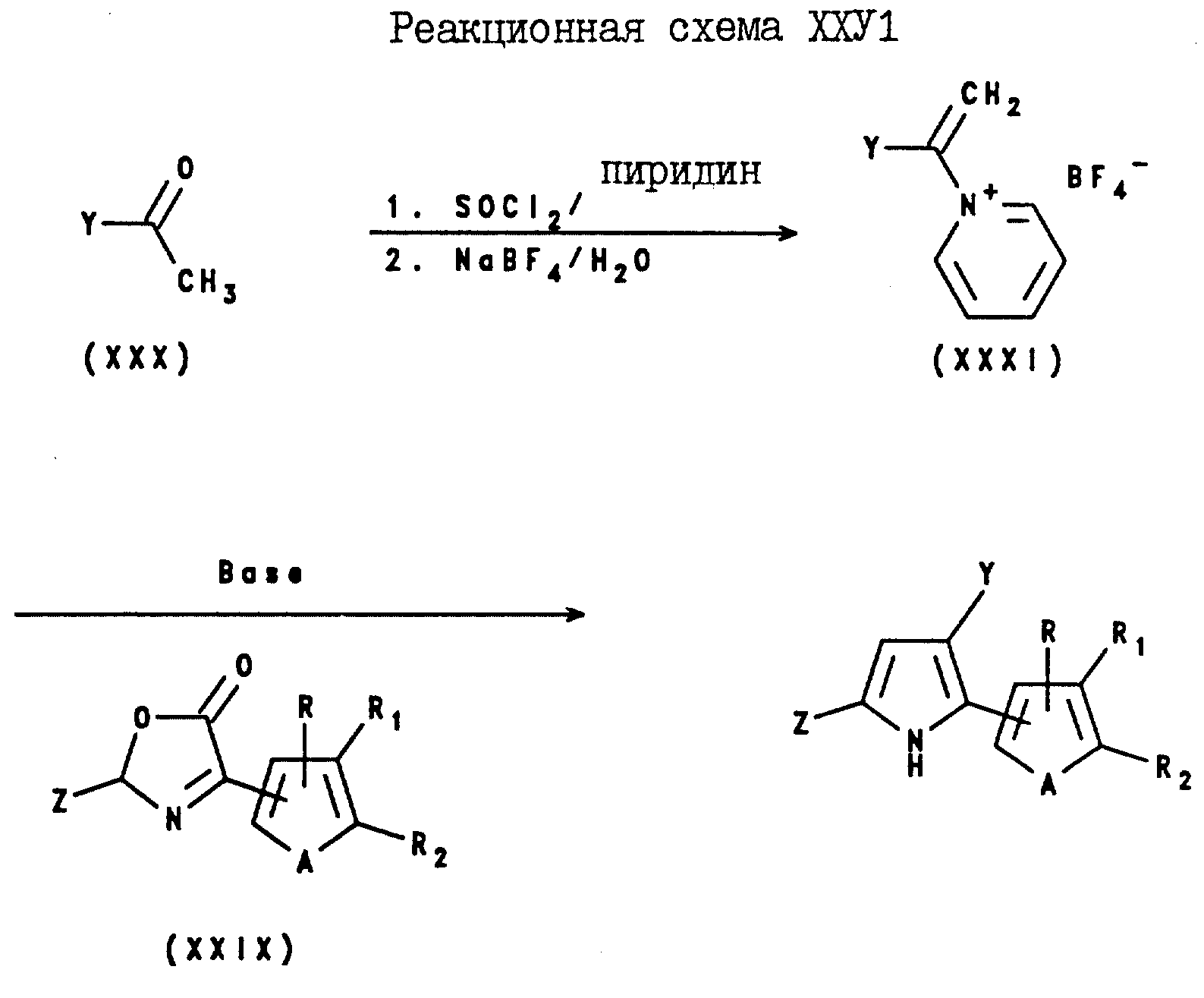
3-Арил-2-(C1-C6-галогеноалкил)-5-(2- и 3-тиенил и -фурил)пирроловые соединения могут быть получены в соответствии с реакционной схемой XXIV, где Y, Z, A, R, R1 и R2 являются такими, как они были определены в реакционной схеме XXI.
Аналогично, 3-(2- и 3-тиенил и -фурил)-2-(C1-C6-галогеноалкил)-5-арилпирроловые соединения могут быть получены в соответствии с реакционной схемой XXV, где Y, Z, A, R, R1 и R2 являются такими, как они были определены в реакционной схеме XXI.
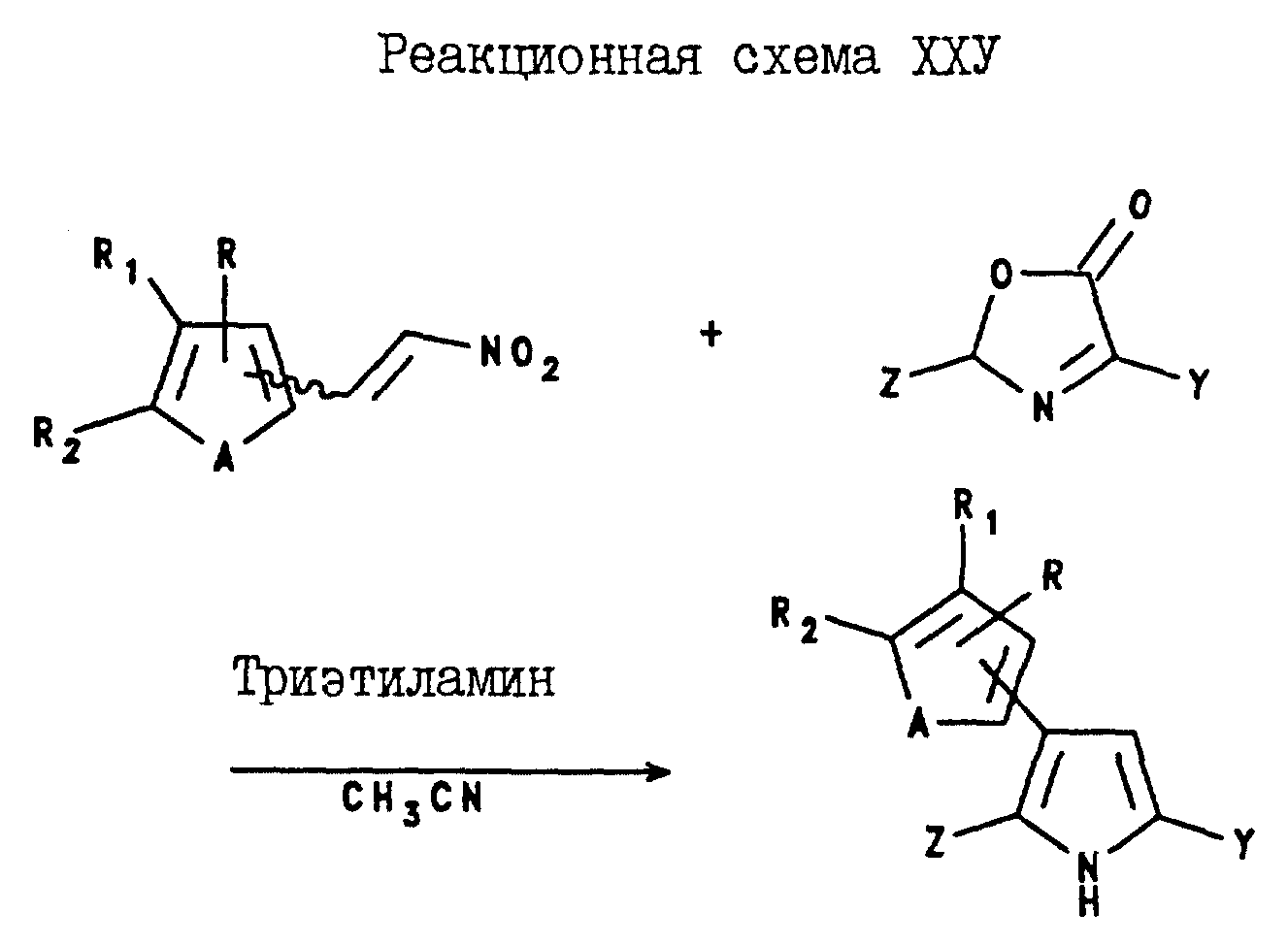
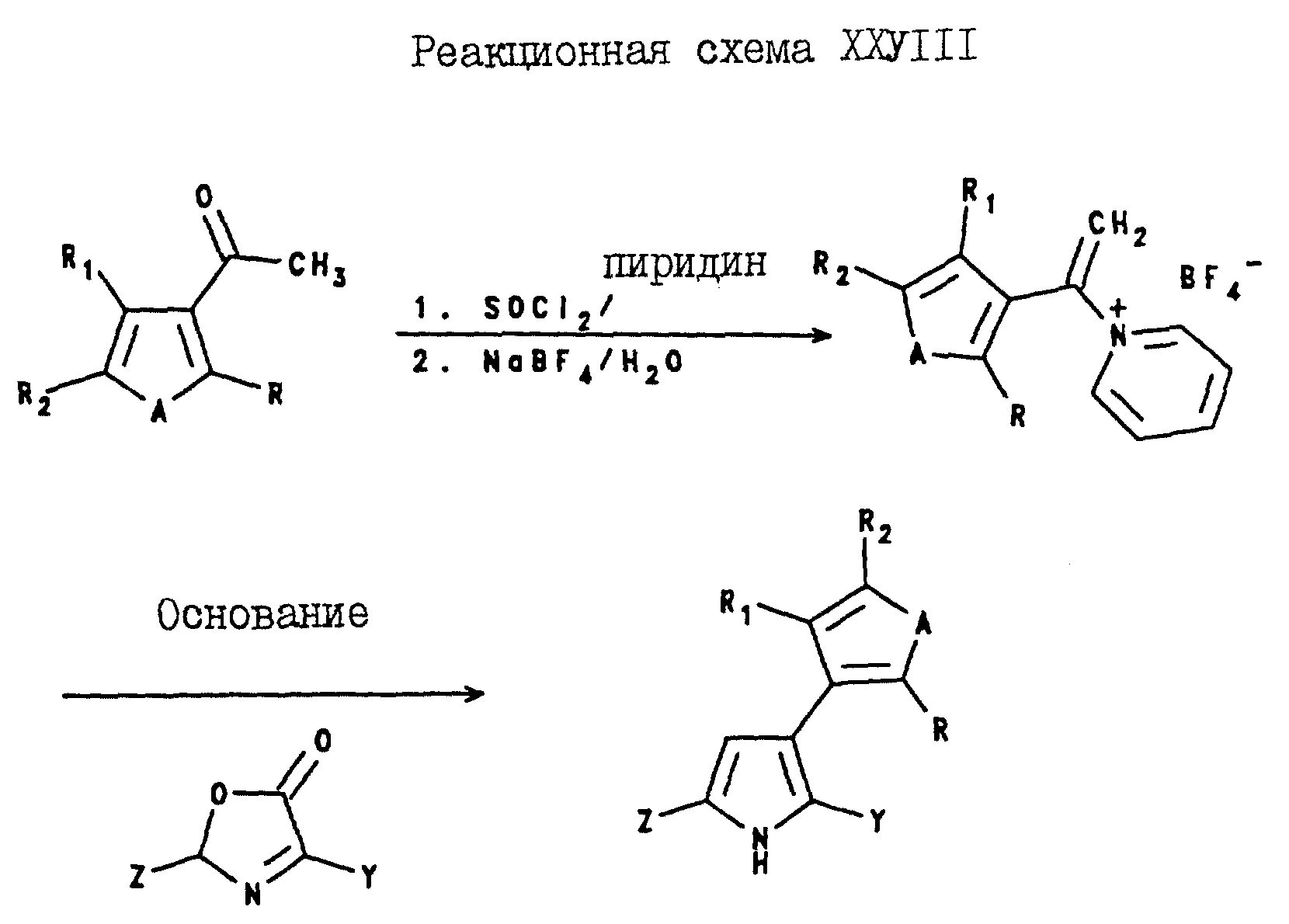
5-(C1-C6-галогеноалкил)-3-арил-2-(2- и 3-тиенил и-фурил) пирроловые соединения могут быть получены путем реакции замещенного или незамещенного ацетофенона формулы XXX с тионилгалидом в присутствии органического основания такого, как пиридин. После этого, реакционную смесь обрабатывают водным тетрагидроборатом натрия, в результате чего получают N - α - (замещенный или незамещенный) стирилпиридинийтетрафтороборат формулы XXXI. Затем указанный стирилпиридинийтетрафтороборат формулы XXXI подвергают реакции с оксазолином формулы XXIX в присутствии основания, такого, как пиридин, в результате чего получают целевое 5-(C1-C6-галогеноалкил)-3-арил-2-(2- или 3-тиенил или -фурил)пирроловое соединение. Эти реакции проиллюстрированы реакционной схемой XXVI, где Y, Z, A, R, R1 и R2 являются такими, как они были определены для реакционной схемы XXI.
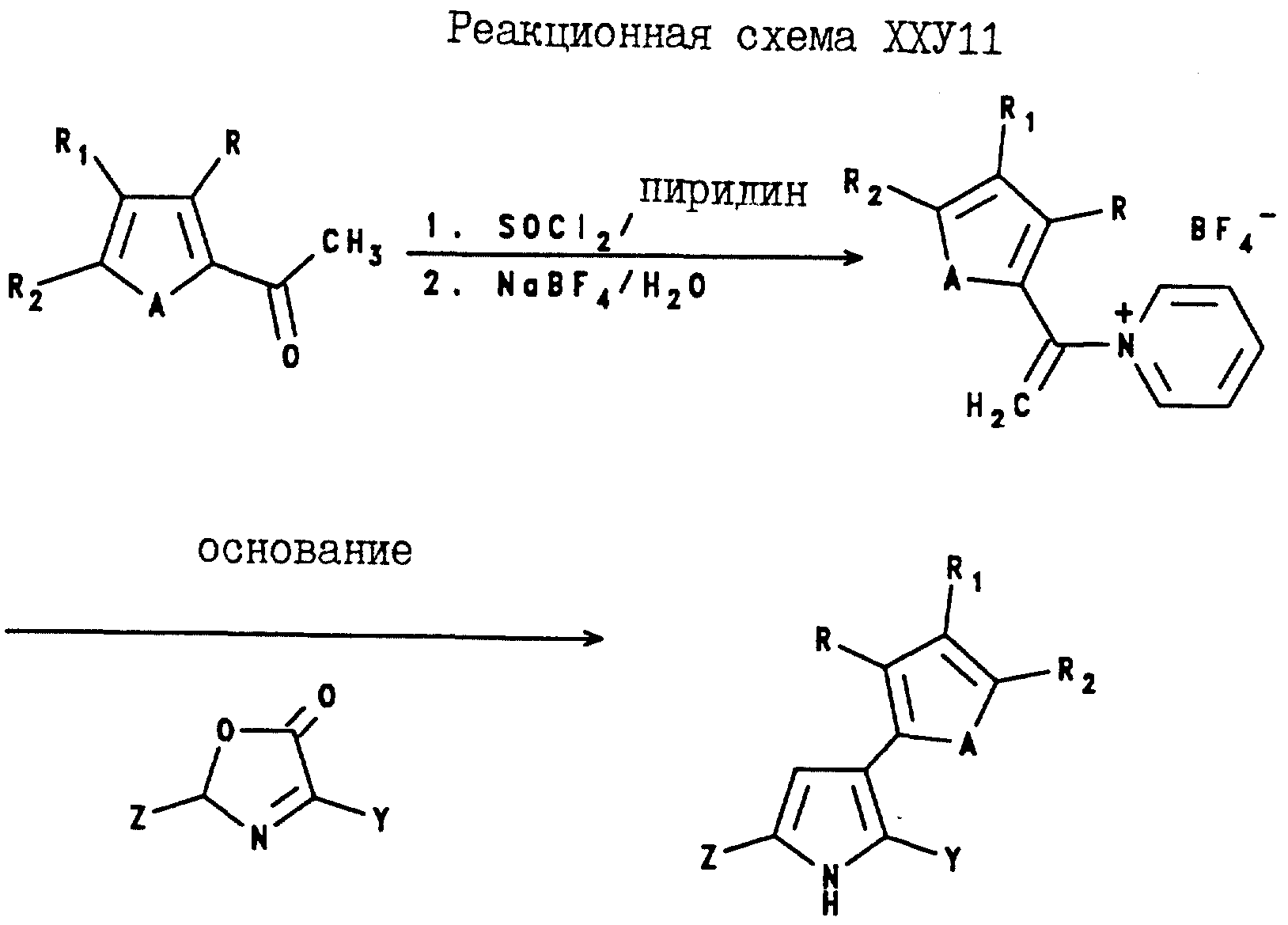
Аналогично, 5-(C1-C6-галогеноалкил)-2-арил-3-(2-тиенил и -фурил)пирроловые соединения могут быть получены в соответствии с Реакционной схемой XXVII, а 5(С1-С6- галогеноалкил)-2-арил-3-(3-тиенил и -фурил)пирроловые соединения могут быть получены в соответствии с реакционной схемой XXVIII, где A, Z и Y являются такими, как они были определены для реакционной схемы XXI, а R, R1 и R2 являются такими, как они были определены для реакционной схемы XI, где A, Z и Y являются такими, как они были определены в реакционной схеме XXI, R, R1 и R2 являются такими, как они были определены в реакционной схеме XII.
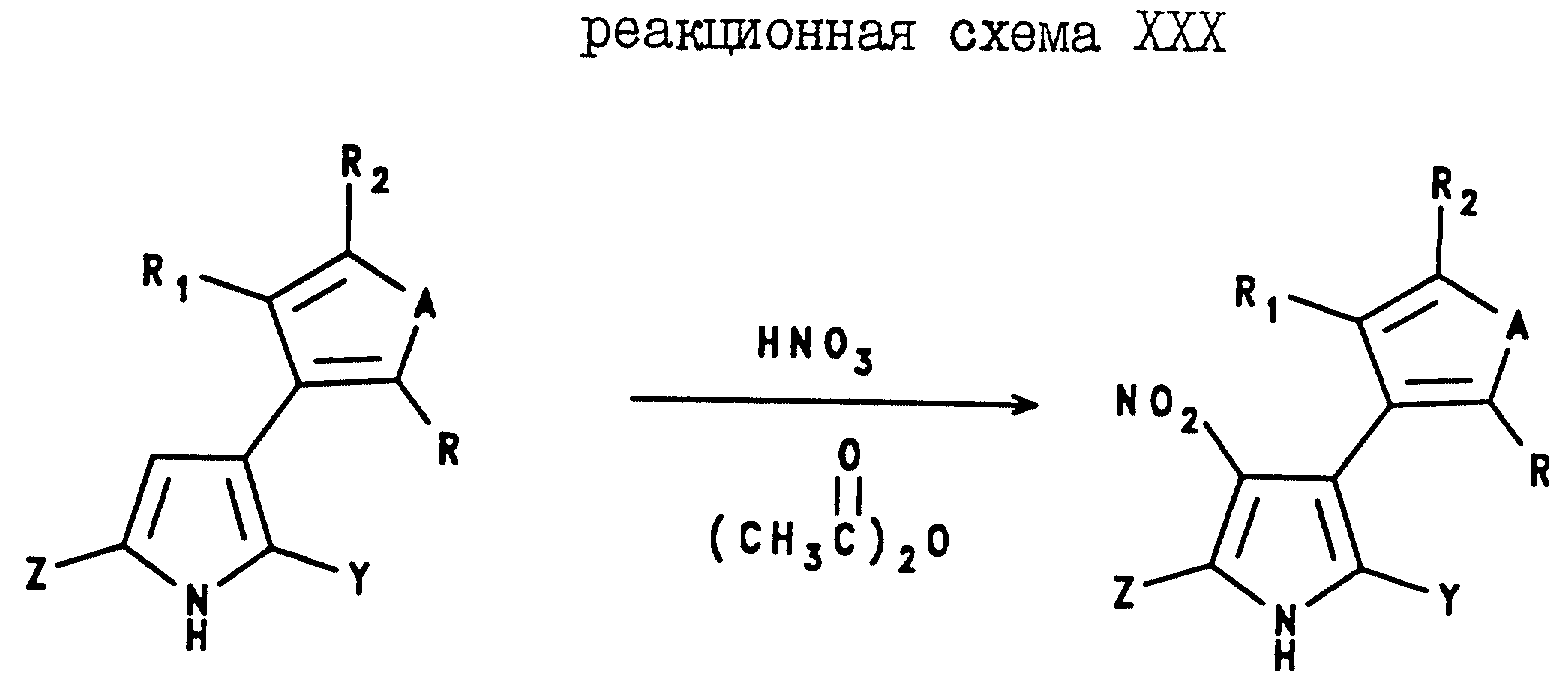
5-(C1-C6-галогеноалкил)-2 арил-4-нитро-3-(2-тиенил)пирроловые соединения могут быть получены с помощью реакции 5-(C1-C6-галогеноалкил)-2-арил-3-(2-тиенил)пиррола с азотной кислотой и уксусным ангидридом, как показано в реакционной схеме XXIX, где A, Z и Y являются такими, как они были определены для реакционной схемы XXI, а R, R1 и R2 являются такими, как они были определены для реакционной схемы XI.
Аналогично, 5-(C1-C6-галогеноалкил)-2-арил-4-нитро-3-(3-тиенил)пирроловые соединения могут быть получены в соответствии с реакционной схемой XXX, где A, Z и Y являются такими, как они были определены в реакционной схеме XXI, а R, R1 и R2 являются такими, как они были определены в реакционной схеме XII.
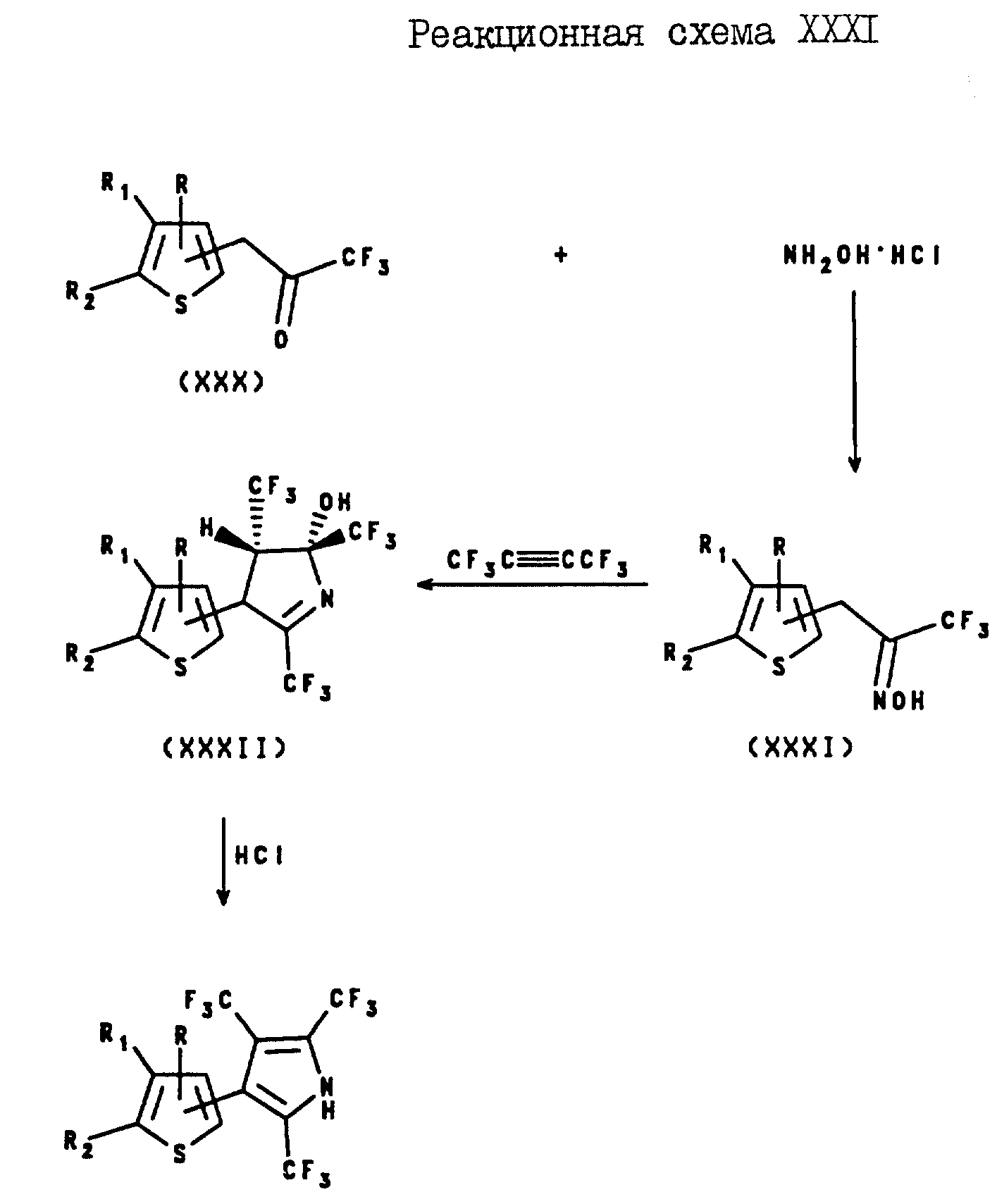
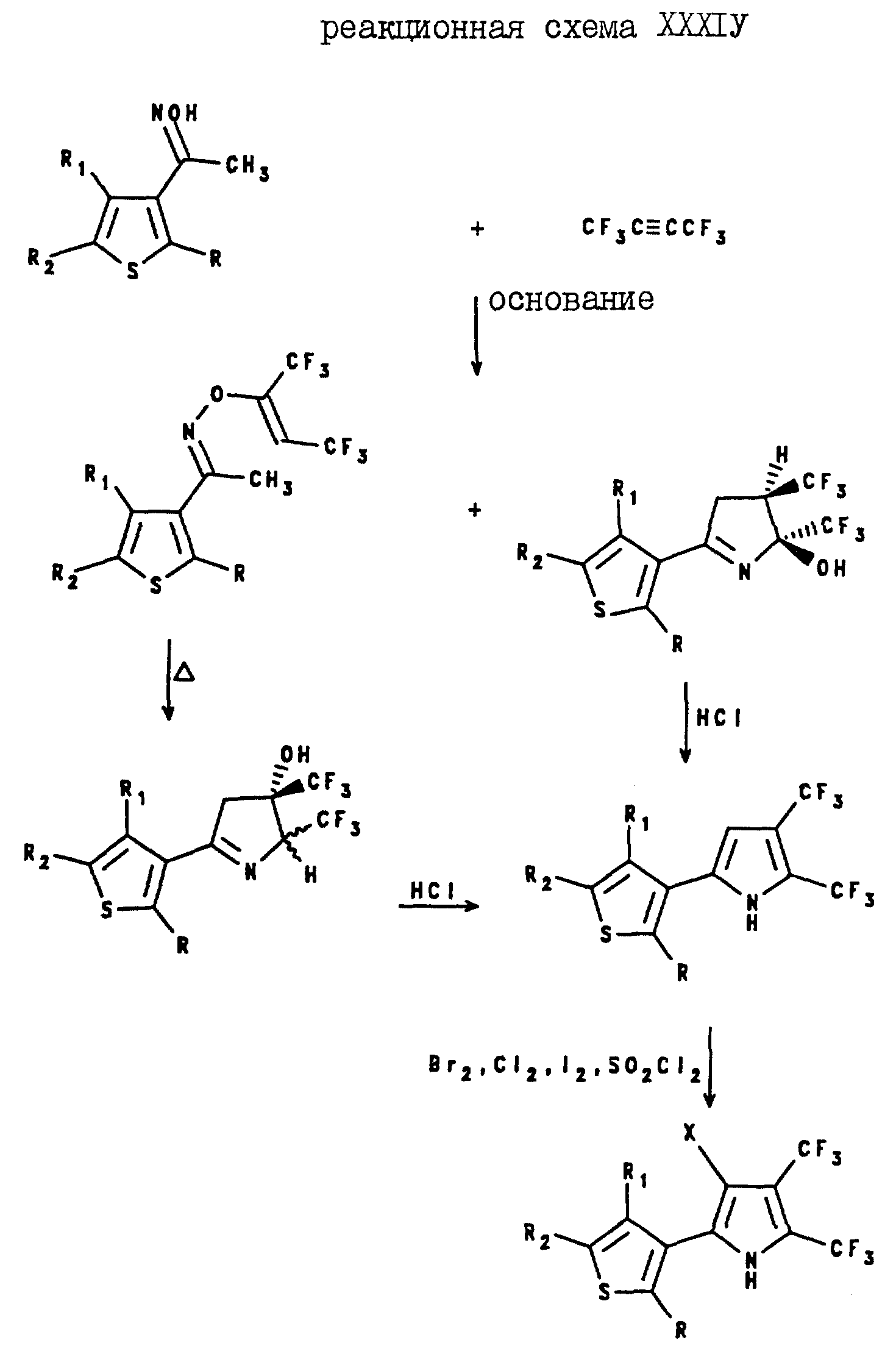
2,3,5-Трис(трифторометил)-4-(2- и 3-тиенил)пирроловые соединения настоящего изобретения могут быть получены с помощью реакции 3-(2- или 3-тиенил-1,1,1-трифторо-2-пропанона формулы XXX с гидрохлоридом гидроксиламина, в результате которой образуется оксим формулы XXXI. Затем этот оксим формулы XXXI подвергают реакции с жидким гексафторо-2-бутеном в сосуде высокого давления в присутствии, по крайней мере, 10 М% основания, такого, как алкоксид щелочного металла, в растворителе, и при повышенной температуре, в результате чего получают 3-(2- или 3-тиенил)-5а-гидрокси-2,4-а, 5b - трис(трифторметил)-1- пирролин формулы XXXII. Затем пирролин формулы XXXII подвергают реакции с соляной кислотой в спирте, в результате чего получают целевой 2,3-5-трис(трифторометил)-4-(2- или 3-тиенил)пиррол. Эти реакции проиллюстрированы в реакционной схеме XXXI.
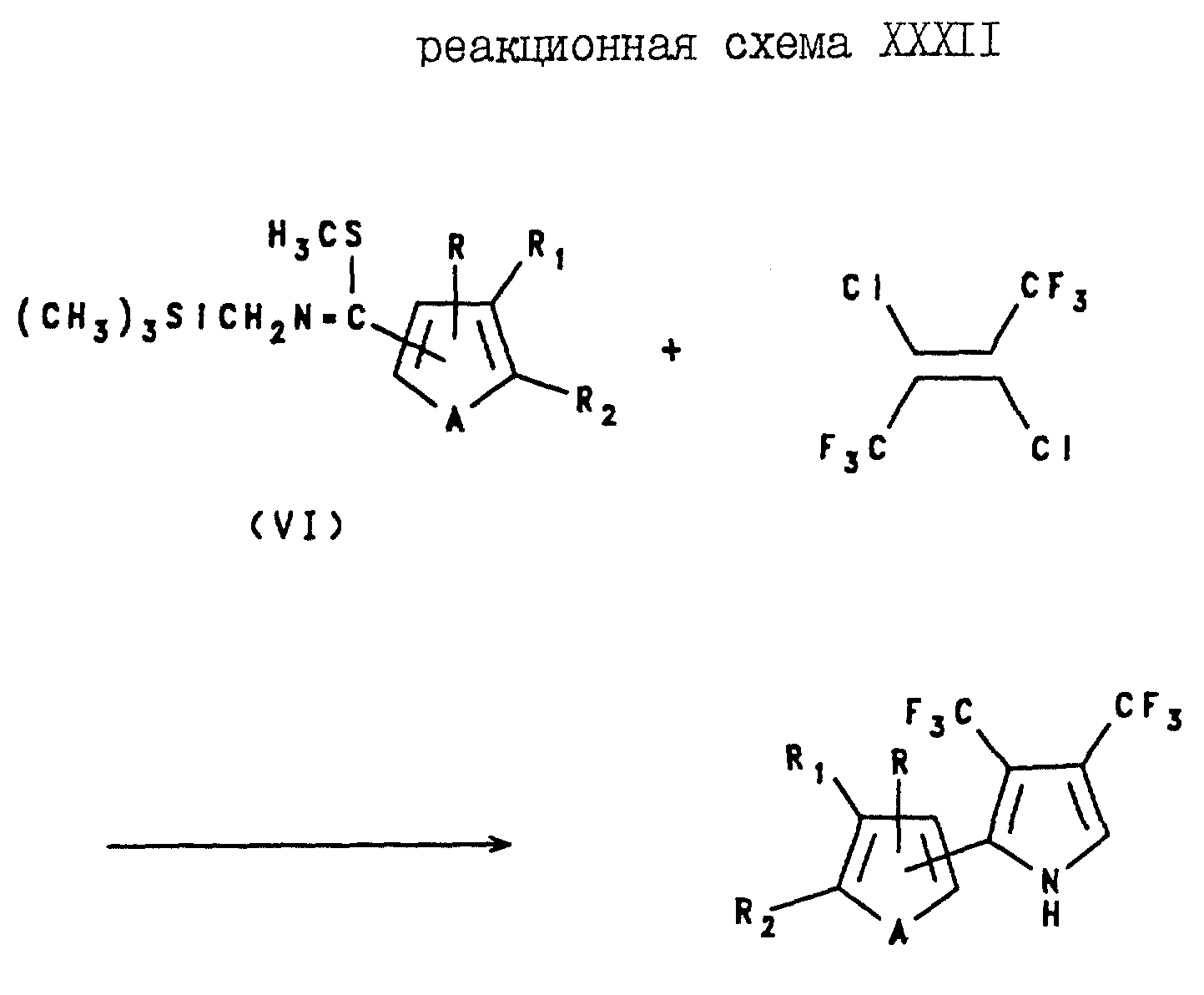
3,4-Бис(трифторметил)-2-(2- и 3-тиенил и -фурил) пирроловые соединения могут быть получены с помощью реакции N- (триметилсилил)метил-5-метил(тиенил- или фурил)тиомидата формулы VI с 2,3-дихлорогексафторобутеном, как показано на реакционной схеме XXXII.
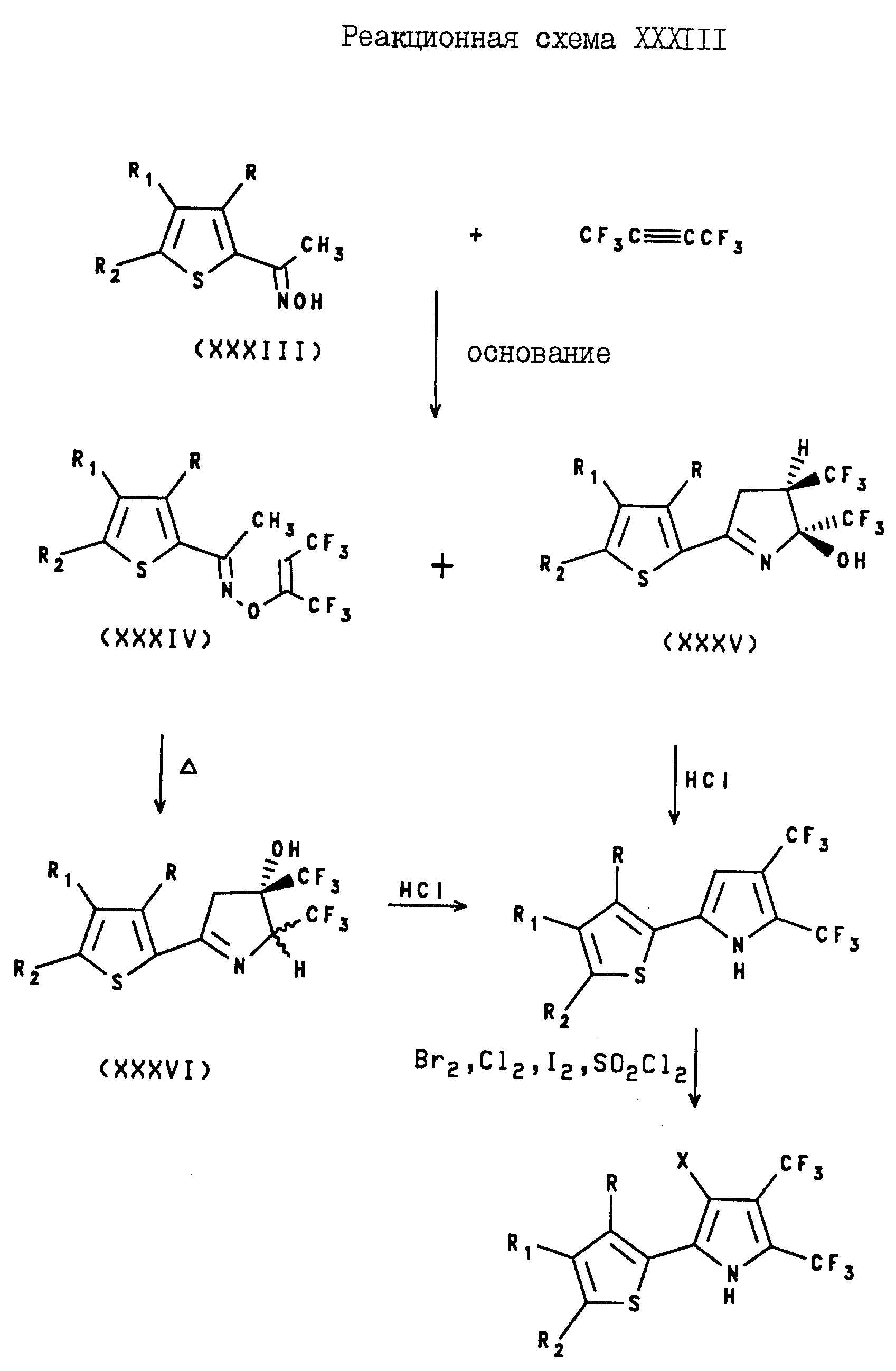
2, 3-Бис(трифторометил)-4-галогено-5-(2-тиенил)пирроловые соединения могут быть получены с помощью реакции оксима формулы XXXIII с гексафторо-2-бутеном в присутствии основания, такого, как алкоксил щелочного металла, с образованием винилоксима формулы XXXIV и 2-(2-тиенил)-4,5-транс-бис(трифторметил)-1-пирролин-5-ола формулы XXXV. Затем винилокси формулы XXXIV нагревают и получают 2-(2-тиенил-4, 5-бис(трифторметил)-1-пирролин-4-ол формулы XXXVI. После этого, пирролин-5-ол формулы XXXV или пирролин-4-ол формулы XXXVI подвергают реакции с поляной кислотой в спирте, в результате чего получают 5-(2-тиенил)-2,3-бис(трифторометил)пиррол. Полученный 5-(2-тиенил)-2,3-бис(трифторметил)пиррол подвергают реакции с галогенирующим агентом и получают целевой 2, 3-бис(трифторометил)-4-галогена-5-(2-тиенил)пиррол. Описанные реакции проиллюстрированы на реакционной схеме XXXIII, где X является хлором, бромом или йодом, а R, R1 и R2 являются такими, как они были определены для реакционной схемы XI.
Аналогично, 2,3-Бис(трифторометил)-4-галогено-5-(3-тиенил)пирроловые соединения могут быть получены как показано на реакционной схеме XXXIV, где X является хлором, бромом или йодом, а R, R1 и R2 являются такими, как они были определены для реакционной схемы XII.
2, 5-Бис(трифторометил)-3-(2- и 3-тиенил)пирроловые соединения могут быть получены в соответствии с реакционной схемой XXXV.
3-(Галогеноалкилсульфонил)-2-(2- и 3-тиенил)пирроловые соединения могут быть получены с помощью реакции (2- или 3-тиенил)этинилгалогеноалкилсульфонила формулы XXXVII с ди(C1-C4-алкил)ацеталем аминоацетальдегида с образованием ди(C1-C4-алкил)ацеталя {{d-[(галогеноалкилсульфонил)метилен(2- или 3-тиенил)]амино}ацетальдегида формулы XXXVIII. Затем, указанный ацеталь формулы XXXVIII подвергают реакции с избыточным количеством трифтороуксусной кислоты, в результате чего получают целевой 3-(галогеноалкилсульфонил)-2-(2- или 3-тиенил)пиррол. Описанные реакции проиллюстрированы в реакционной схеме XXXVI.
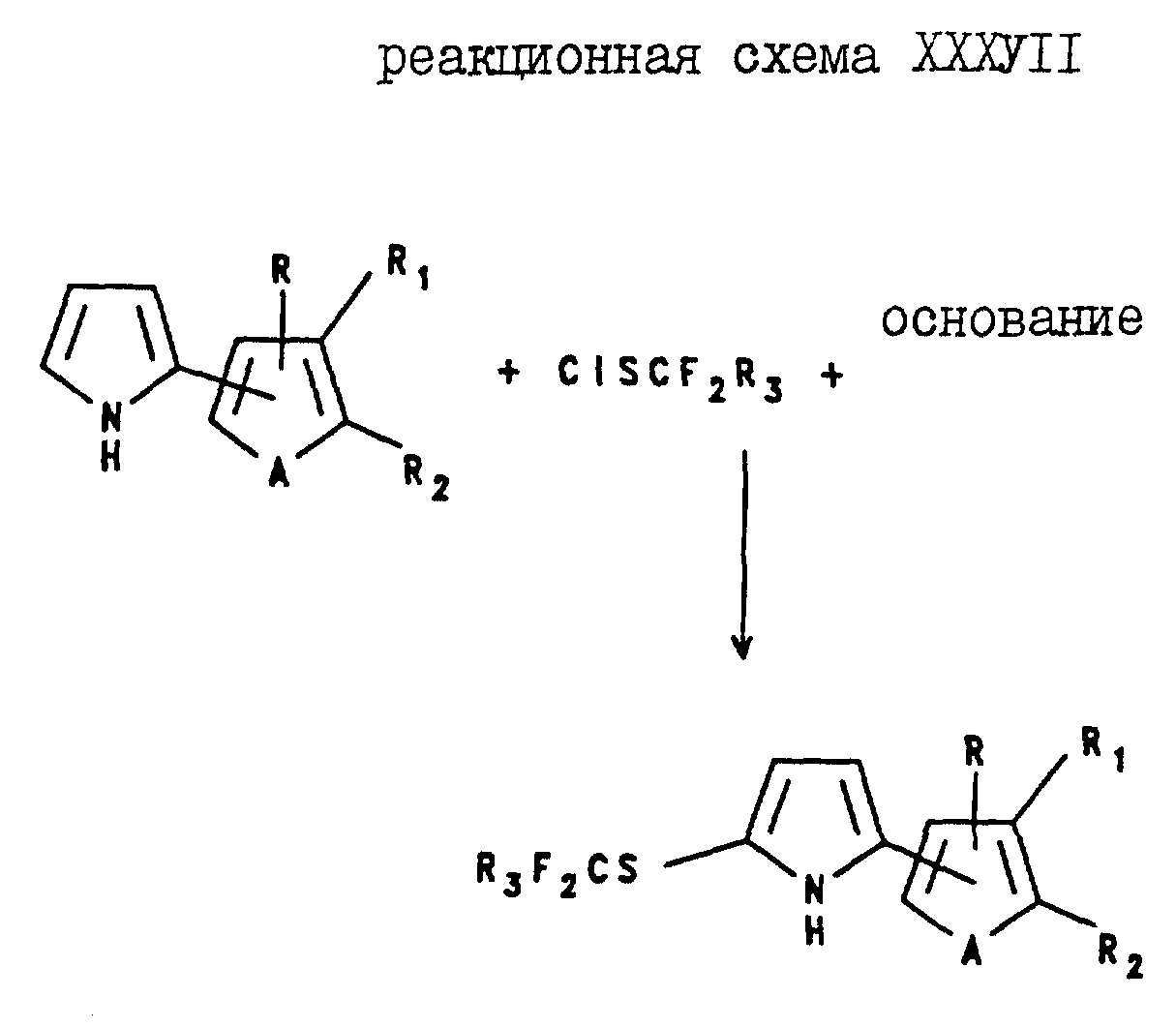
5-(Галогеноалкилтио)-2-(2- и 3-тиенил и -фурил)пирроловые соединения могут быть получены посредством реакции 2-(2- или 3-тиенил или -фурил)пиррола с
галогеноалкилсульфенилхлоридом в присутствии основания как показано в реакционной схеме XXXVII
4-(Галогеноалкилсульфонил)-5-(2-тиенил)пиррол-2-карбонитриловые соединения могут быть получены
посредством реакции 3-(галогеноалкилсульфонил)-2-(2-тиенил)пиррола формулы XXXIX с хлоросульфонилизоцианатом в присутствии растворителя с образованием соответствующей реакционной смеси. Затем
полученную реакционную смесь обрабатывают диметилформамидом, в результате чего получают целевой 4-(галогеноалкилсульфонил)-5-(2-тиенил)-пиррол-2-карбонитрил. Описанные реакции проиллюстрированы в
реакционной схеме XXXVIII, где R3 является таким, как он был определен для формулы I, а R, R1 и R2 являются такими, как они были определены для реакционной схемы
XI.
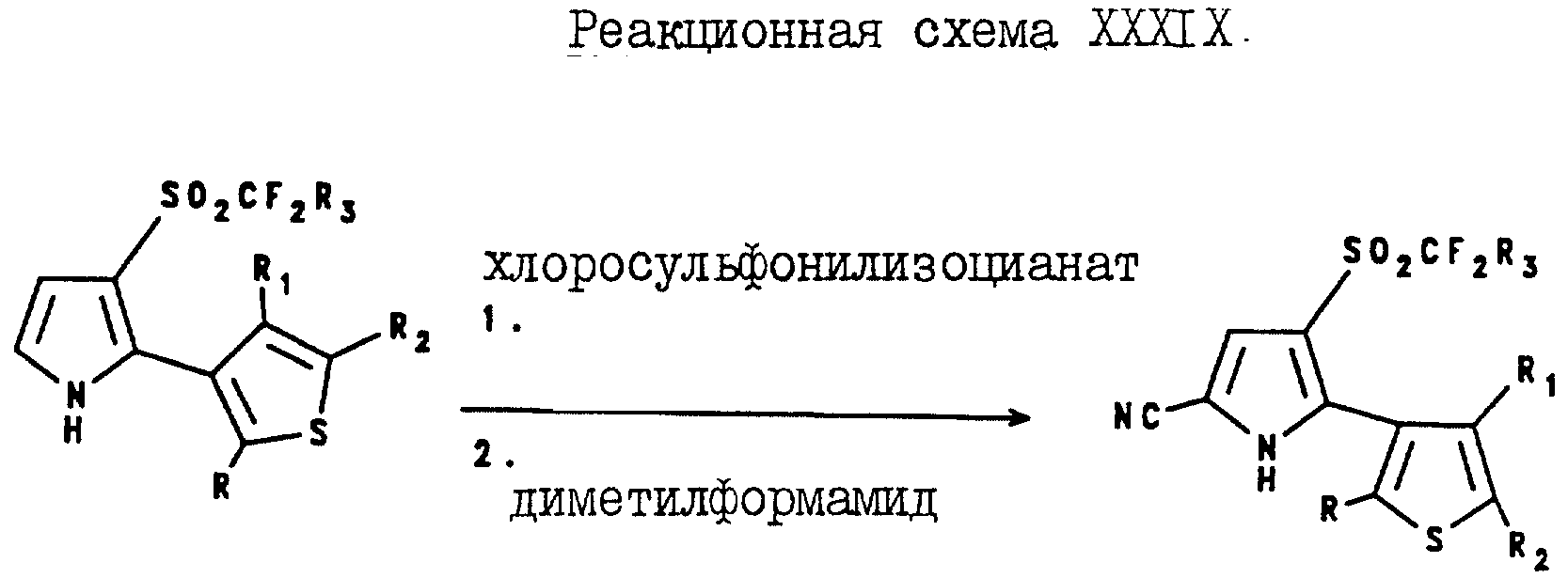
Аналогично, 4-(галогеноалкилсульфонил)-5-(3-тиенил)пиррол- 2-карбонитриловые соединения могут быть получены в соответствии с реакционной схемой XXXIX, где R3 определен в формуле I, а R, R1 и R2 являются такими, как они были определены для реакционной схемы XII.
5-(Галогеноалкилсульфинил)-2-(2- и 3-тиенил и фурил)пирроловые
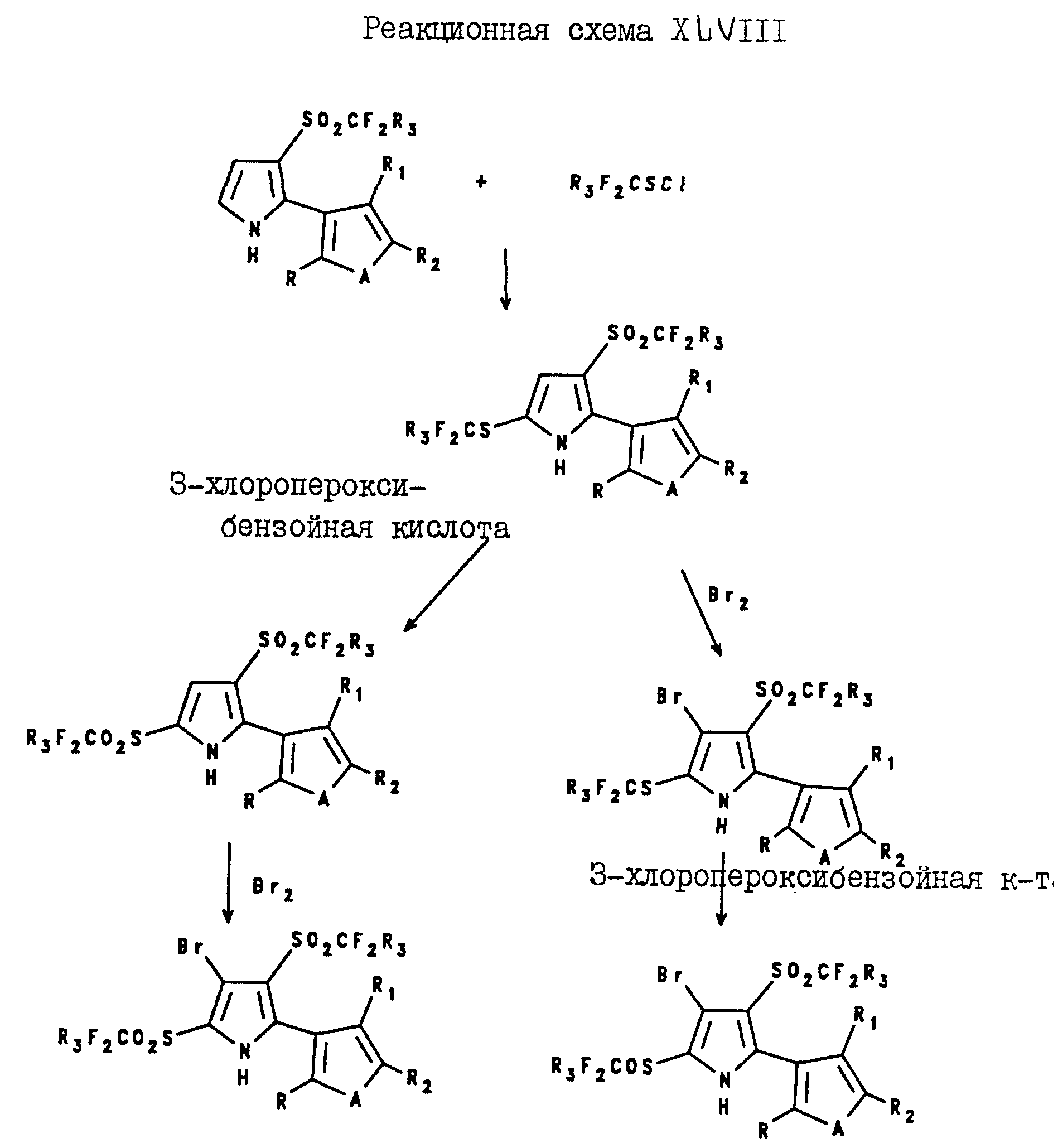
соединение могут быть получены посредством реакции 5-(галогеноалкилтио)-2-(2- или 3-тиенил или фурил)пиррола с оксидантом, таким, как 3-хлоропероксибензойная кислота, как показано на реакционной схеме
XL,
где A и R3 являются такими, как они были определены для формулы I;
R, R1 и R2 являются такими, как они были определены для реакционной схемы V;
Y и Z независимо являются водородом или галогеном.
3-(2- и 3-тиенил и -фурил)-4-(галогеноалкилсульфонил)пирроловые соединения могут быть получены посредством реакции галогеноалкилсульфона формулы XL с N-метилен-1-(п-толуолсульфонил)метиламином в присутствии основания, такого, как гидрид натрия, как показано в реакционной схеме XLI.
2-(Тиенил и
фурил)-2-нитро-5-(галогеноалкилтио)пирроловые соединения и 5-(тиенил и фурил)-3-нитро-2-(галогеноалкилтио)пирроловые соединения могут быть получены посредством реакции 2-(тиенил или
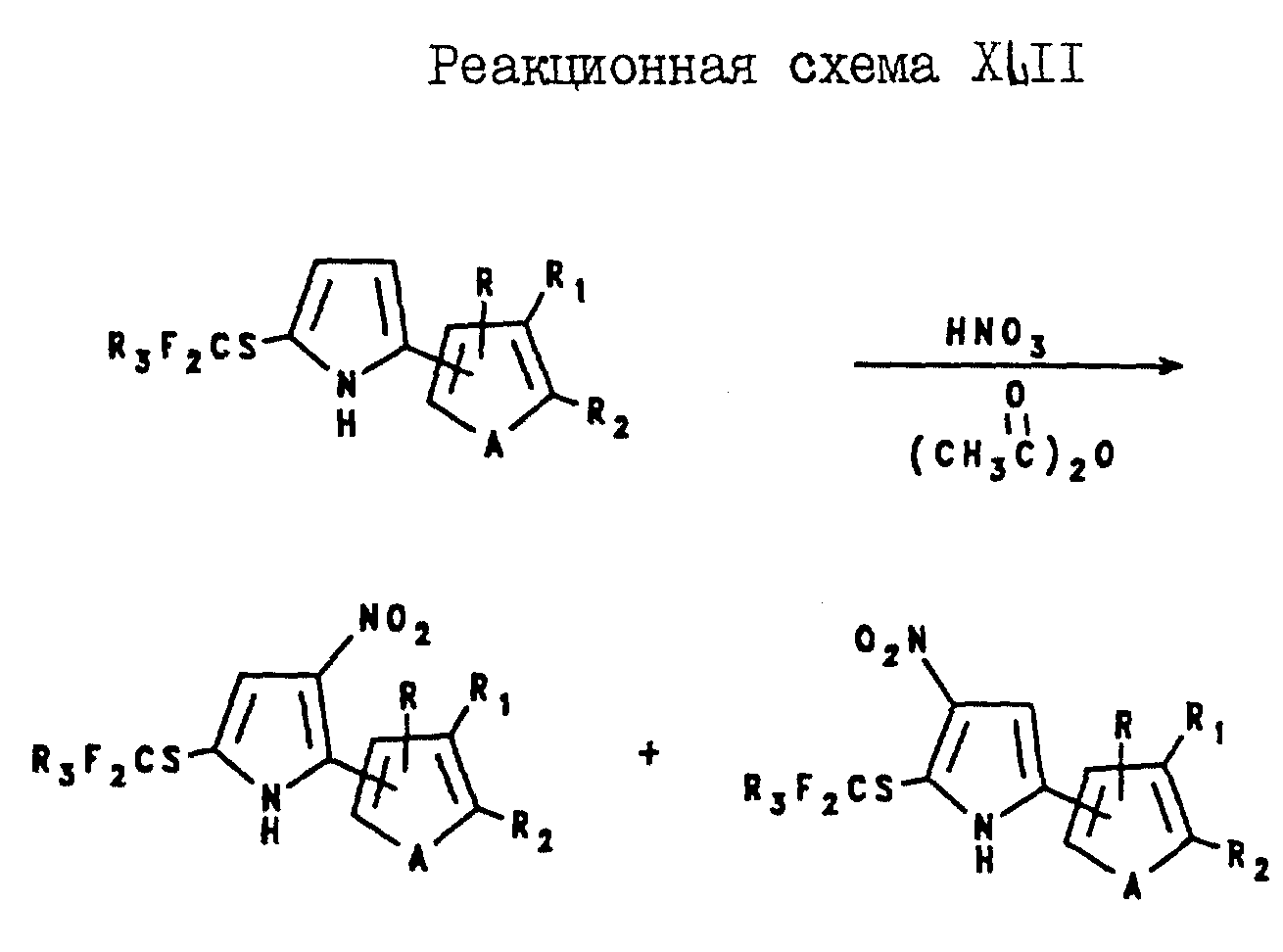
фурил)-5-(галогеноалкилтио)пиррола с дымящей азотной кислотой в присутствии уксусного ангидрида, как показано в реакционной схеме XLII,
где A и R3 являются такими, как они были
определены выше для формулы I;
R, R1 и R2 являются галогеном.
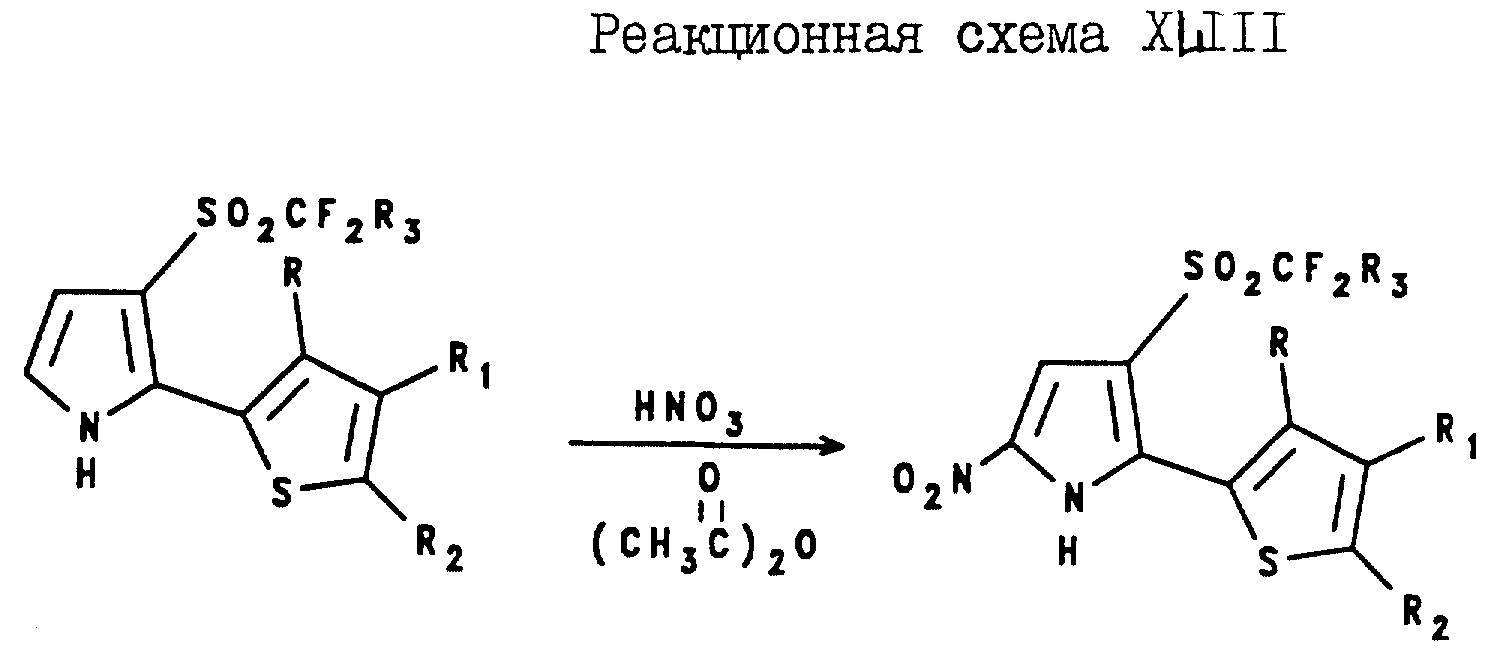
Аналогично, 2-(2-тиенил)-5-нитро-3-(галогеноалкилсульфонил)пирроловые соединения и
2-(3-тиенил)-5-нитро-3-(галогеноалкилсульфонил)пирроловые соединения могут быть получены в соответствии с реакционными схемами XLIII и XLIV соответственно,
где A и R3 являются
такими, как они были определены выше для формулы I;
R, R1 и R2 являются такими, как они были определены для реакционной схемы XI,
где A, и R3
являются такими, как они были определены выше для формулы I;
R, R1 и R2 являются такими, как они были определены для реакционной схемы XII.
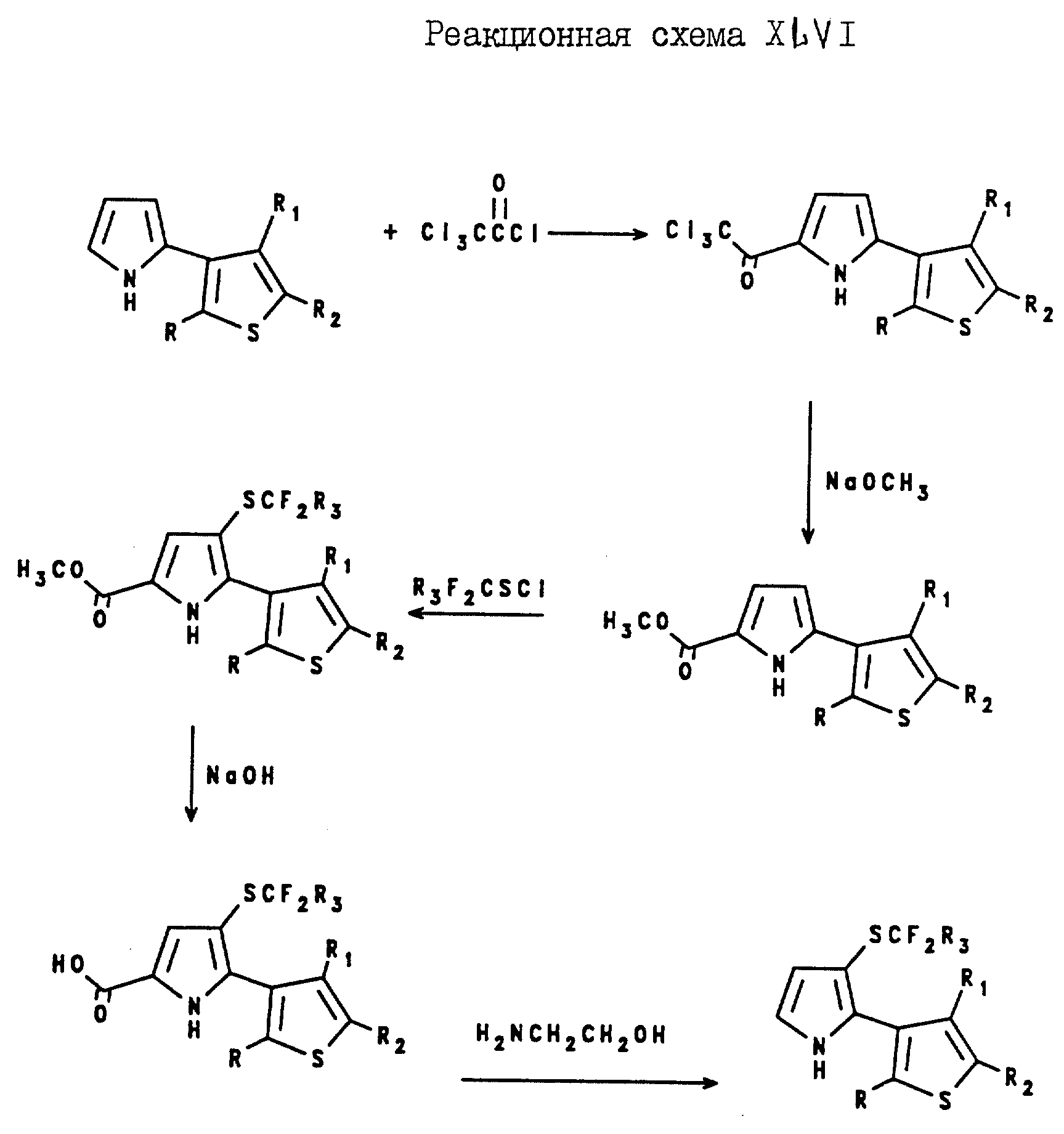
Способы
получения 2-(2-тиенил)-3-(галогеноалкилтио)пирроловых соединений и 2-(3-тиенил)-3-(галогеноалкилтио)пирроловых соединений проиллюстрированы в реакционных схемах XLV и XLVI, соответственно,
где R, R1 и R2 являются такими, как они были определены для реакционной схемы XI,
где R, R1 и R2 являются такими, как они были определены для
реакционной схемы XII.
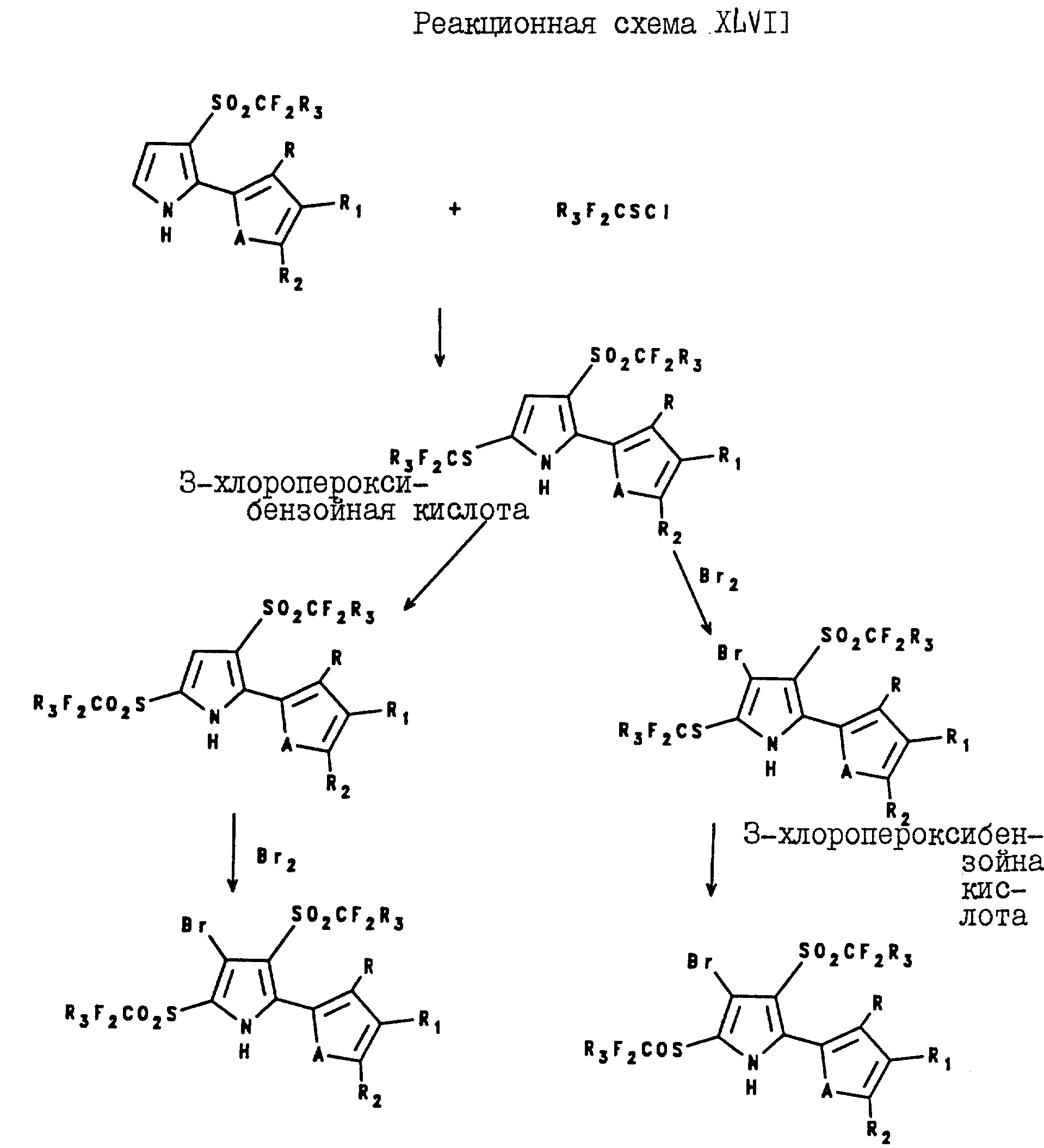
3-Бромо-5-(тиенил или фурил)-2-галогеноалкилсульфинил и -сульфонил-4-(галогеноалкилсульфонил)пирроловые соединения могут быть получены в соответствии с
реакционными схемами XLVII и XLVIII,
где A и R3 являются такими, как они были определены выше для формулы I;
R, R1 и R2 являются такими, как они были
определены для реакционной схемы XI.
где A и R3 являются такими, как они были определены выше для формулы I;
R, R1 и R2 являются такими, как
они были определены для реакционной схемы XII.
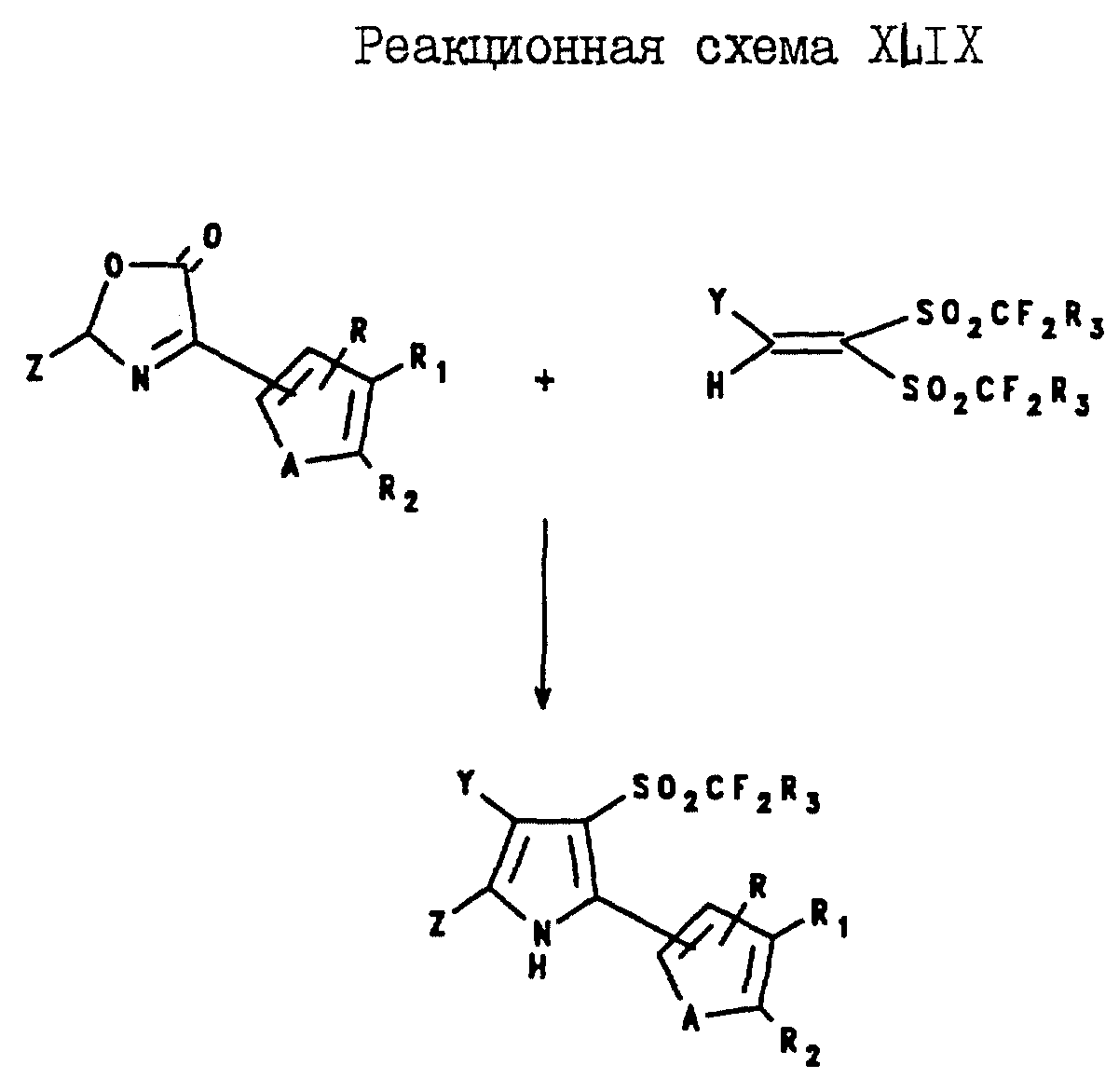
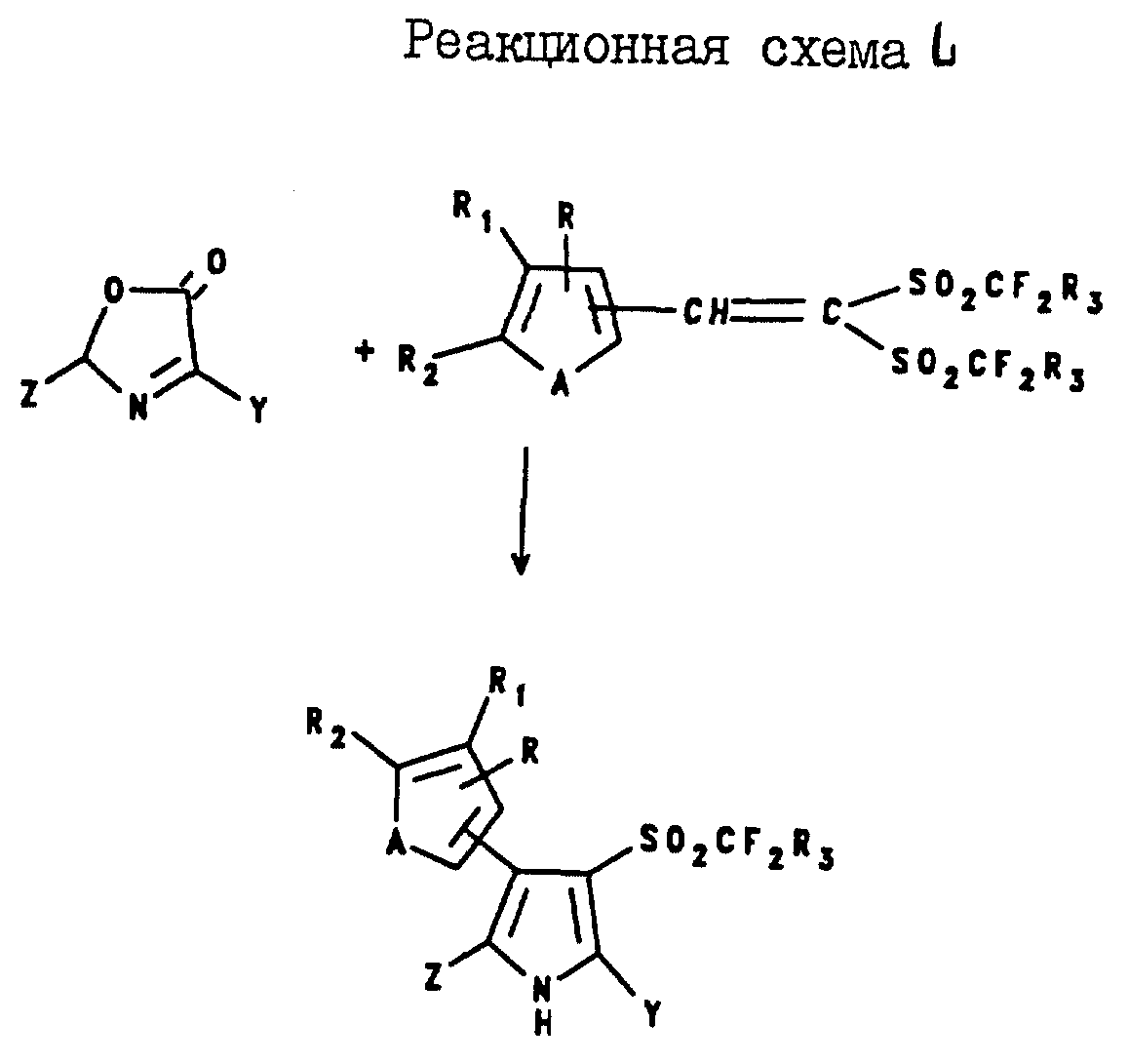
2-(Тиенил и фурил)-4-арил-5-галогеноалкил-3-(галогеноалкилсульфонил) пирроловые соединения могут быть получены в соответствии с
реакционной схемой XLIX,
где A, R, R1, R2, Y и Z являются такими, как они были определены в реакционной схеме XXI;
R3 является таким, как он был
определен выше для формулы I.
Аналогично 2-арил-4-(тиенил и фурил)-5-галогеноалкил- 3-(галогеноалкилсульфонил)пирроловые соединения могут быть получены в соответствии с реакционной
схемой L,
где A, R, R1, R2, Y и Z являются такими, как они были определены для реакционной схемы XXI;
R3 является таким, как он была определен выше
для формулы I.
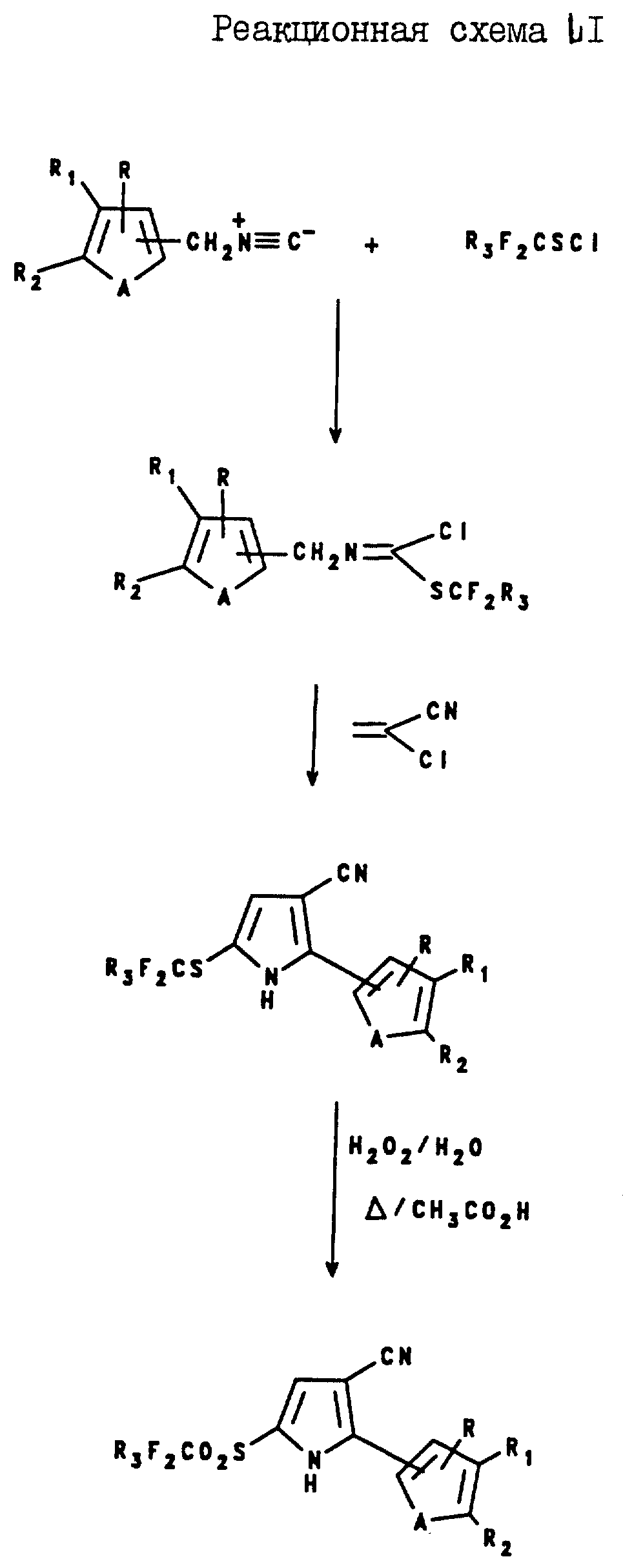
2-(Тиенил и фурил)-5-(галогеноалкилсульфонил)пиррол-3-карбонитриловые соединения могут быть получены в соответствии с реакционной схемой LI.
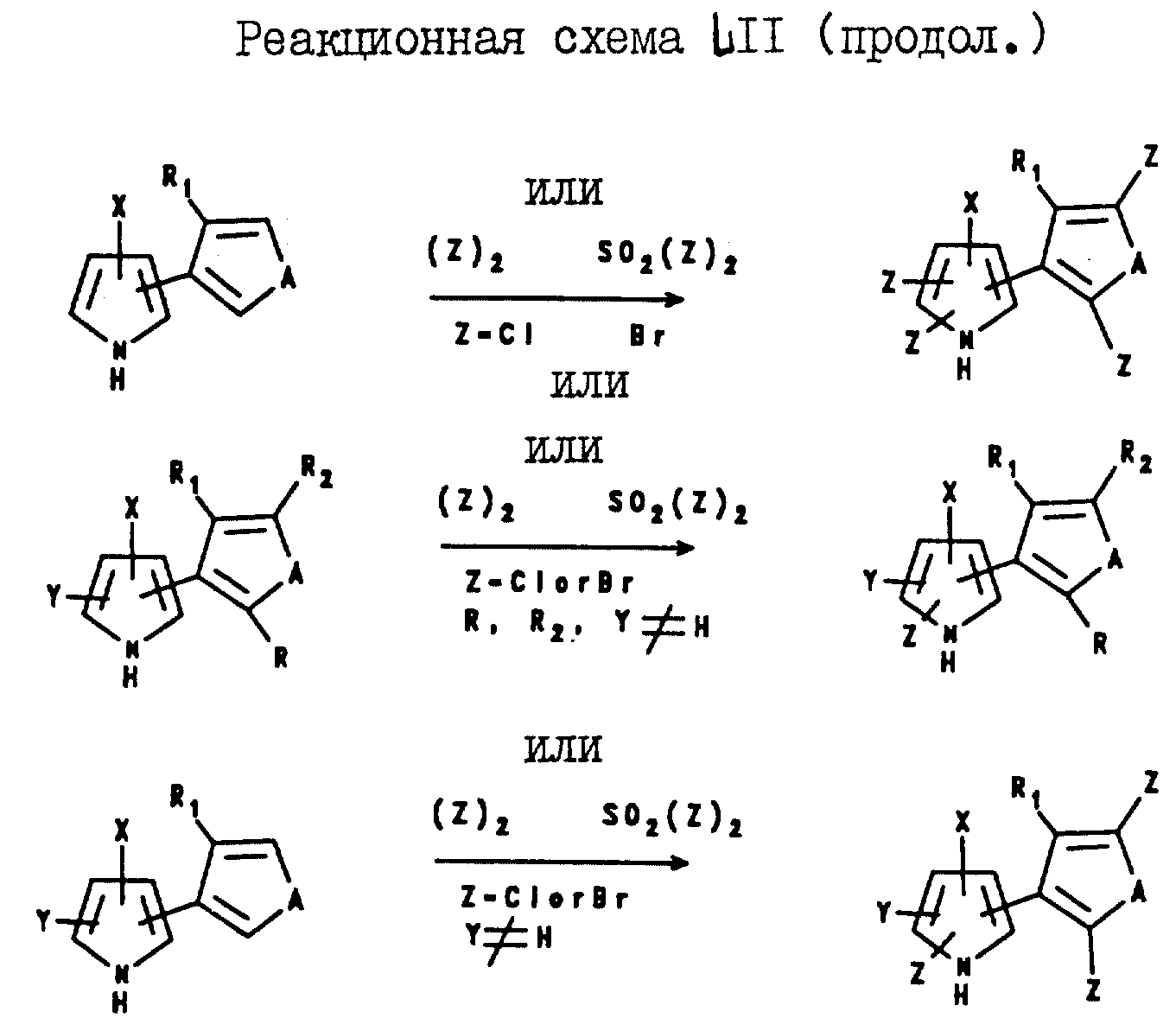
Превращение соединений формулы I, где Y и/или Z являются водородом, в соответствующие соединения формулы I, где Y и/или Z являются галогеном, может быть легко достигнуто посредством реакции водород-замещенного пиррола формулы I и, по крайней мере, 1 или 2 эквивалентов галогенирующего агента, такого, как сульфурилгалид, бром или хлор, в присутствии растворителя, такого, как диоксан, тетрагидрофуран, уксусная кислота или хлорированный углеводородный растворитель. Кроме того, соединения формулы I, где R, R1 и/или R2 являются водородом, могут быть превращены в соответствующие соединения формулы I, где R, R1 и/или R2 являются галогеном, посредством реакции соединений формулы I, где R, R1 и/или R2 являются водородом, с галогенирующим агентом в присутствии растворителя. В качестве галогенирующего агента могут быть использованы бром, сульфурилхлорид, сульфурилбромид, гипохлорит натрия, т-бутилгипохлорит, N-бромсукцинимид, N-йодосукцинимид натрия и т.п. Ниже, на реакционной схеме LII показано несколько реакций галогенирования.
1-Замещенные соединения формулы 1 могут быть получены посредством реакции соответствующим
образом замещенного соединения формулы I, где B является водородом, с алкилирующим или ацилирующим агентом в присутствии алкоксида или гидрида щелочного металла. Например, соединение формулы I, где B
является водородом, а R, R1, R2, A, X, Y и Z определены выше для формулы I, подвергают реакции с соответствующим алкилирующим агентом, таким, как C1-C6
-алкилгалид, где алкильная группа может быть прямой или разветвленной, и является необязательно замещенной: 1-3 атомами галогена; одной гидроксигруппой; одной цианогруппой; одной C1-C4-алкоксигруппой; одной C1-C4-алкилтио-группой; одной фенильной группой, необязательно замещенной 1 - 3 атомами галогена; или одной бензилоксигруппой, необязательно
замещенной 1 - 3 атомами галогена; а также с алкоксидом щелочного металла, таким, как т-бутоксид натрия или калия. В результате этой реакции получают тиенил- или фурилпиррол, который имеет тех же
самых заместителей, что и исходный материал, но, который является, к тому же, замещенным у азота C1-C6-алкильной группой, необязательно замещенной заместителями, описанными выше.
Эта реакция может быть проиллюстрирована нижеприведенной схемой:

где R, R1, R2, A, X, Y и Z являются такими, как они были определены выше для формулы I; R6 представляет собой C1-C6-алкил, необязательно замещенный как описано выше. В аналогичной реакции алкилгалид заменяют цианобромидом и получают тиенил- или фурилпиррол формулы I, имеющий в 1-положении вместо алкильной группы карбонитрильную группу.
Кроме того, процедура алкилирования, описанная выше, может быть также использована для получения тиенил- и фурилпирролов формулы I, имеющих N-C3-C6-алкенильный или N-C3-C6-алкинильный заместитель. Указанное замещение достигается путем простой замены C1-C6-алкилгалида на C3-C6-алкенилгалид или C1-C6 -алкинилгалид в вышеописанной реакции.
Аналогичным образом, 1-ацилированные тиенил- и фурилпирролы могут быть получены посредством реакции соответствующим образом замещенного тиенил- или фурилпиррола формулы I, где B является водородом, с ацилирующим агентом в присутствии алкоксида щелочного металла. При этом, в качестве ацилирующих агентов могут быть использованы хлориды C1-C6-алкил- или C2-C6-алкенилкислоты; замещенные хлориды C1-C6-алкил- или C2-C6-алкенилкислоты; бензоилхлориды; замещенные бензоилхлориды; фенилхлороформат; замещенные фенилхлороформаты; C1-C6-алкил- или C2-C6-алкенилхлороформаты; замещенные C1-C6 -алкил- или C2-C6-алкенилхлороформаты; N-замещенные карбамоилхлориды и т.п. Описанная реакция может быть проиллюстрирована схемой, приведенной ниже.
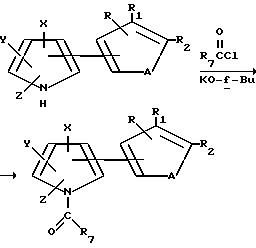
Тиенил- и фурилпирролы формулы I, где R6 является CH2SQ, могут быть получены с помощью реакции соответствующим образом замещенного тиенил- или фурилпиррола формулы I, где R6 является хлорометилом, со щелочно-металлической солью SQ-соединения в присутствии основания. А тиенил- и фурилпирроловые соединения формулы I, где R6 является CHR8NHC(O)R9, могут быть получены в соответствии с нижеприведенной схемой.
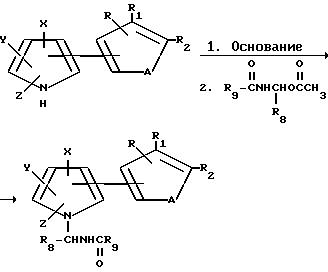
Кроме того, 1-галогенометилтиенил- и фурилпирролы, могут быть получены в соответствии с нижеприведенной схемой.
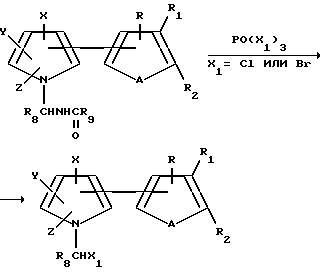
Соединения формулы I, где R6 представляет собой R10 CHOC(O)(CR11R12)SQ1, могут быть получены в соответствии с нижеприведенной схемой.

Соединения формулы I, где B является OR6, могут быть получены посредством реакции соответствующим образом замещенного тиенил- или фурилпиррола формулы I, где B является OH, а R, R1, R2, A, X, Y и Z являются такими, как они были определены выше, с соответствующим алкилирующим агентом, и подходящим основанием, например, с хлорометил(C1-C4)алкиловым эфиром и т-бутоксидом калия. В результате этой реакции получают тиенил- или фурилпирррол, который имеет те же заместители, что и исходный материал, но который, кроме того, является замещенным C1-C4-алкоксиметилом атома кислорода. В аналогичной реакции хлорометил(C1-C4)алкиловый эфир заменяют бромоацетонитрилом и получают тиенил- или фурилпиррол формулы I с ацетонитриловым заместителем у атома кислорода. Эти реакции могут быть проиллюстрированы следующей схемой:
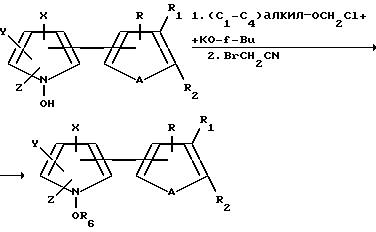
где R, R1, R2, A, X, Y и Z являются такими, как они были определены выше для формулы 1, а R2 представляет собой (1) C1-C4алкоксиметил или (2) CH2CN.
аналогично, соединения формулы 1, где B является C(O)R7, могут быть получены посредством реакции соответствующим образом замещенного тиенио- или фурилпиррол формулы 1, где B является OH, а R, R1, R2, A, X, Y и Z являются такими, как они были описаны выше для формулы 1, с соответствующим ацилирующим агентом и соответствующим основанием, например, с хлоридом C1-C6 и с т-бутоксидом калия. В результате этой реакции получают тиенил- или фурилпиррол, который имеет такие же заместители, что и исходный материал, но который, кроме того, является замещенным C1-C6алканоилом у атома кислорода. Эта реакция может быть проиллюстрировала нижеприведенной схемой.

Тиенил- и фурилпирроловые соединения настоящего изобретения являются эффективными и для борьбы против насекомых и клещей. Эти соединения являются также эффективными для защиты растений на корню, либо для защиты собранного урожая от поражения насекомыми и клещами.
Насекомыми, против которых могут быть использованы соединения настоящего изобретения формулы 1, являются чешуекрылые, такие, как совка Heliothis virescens, совка ни, гусеница совки хлопковой, совка малая, совка Spodoptera eridania и моль капустная; равнокрылые, такие, как тля растительная, цикадка листовая, дельфициды и белокрылки; пузыреногие, такие, как трипсы; жесткокрылые, такие, как долгоносики хлопковые, колорадский жук, блошка длинноусая и листоед хреновый; и прямокрылые, такие как саранча, сверчки, кузнечики и тараканы. Клещами, против которых могут быть использованы соединения настоящего изобретения формулы 1, являются клещ двупятнистый паутинный, клещик красный паутинный, луговой клещ, клещ земляничный, клещ войлочковый цитрусовый, и чесоточный клещ. Кроме того, было установлено, что соединения настоящего изобретения являются особенно эффективными против совок Spodoptera eridanai и Heliothis virescens.
На практике, для защиты культивируемых растений от поражения насекомыми и клещами, эти растения или почву, в которой эти растения произрастают, обрабатывают приблизительно 10-10000 млн. д, а предпочтительно от около 100 до 5000 млн. д. тиенил- или фурилпирролового соединения формулы 1, диспергированного в воде или другом жидком наполнителе.
Тиенил- и фурилпирроловые соединения настоящего изобретения являются также эффективными против насекомых и клещей при нанесении этих соединений на листья растений и/или в почву или воду, в которых произрастают указанные растения, в количестве, достаточном для обеспечения дозы активного ингредиента от около 1,0 кг/га до 4,0 кг/га.
Хотя соединения настоящего изобретения сами по себе являются достаточно эффективными для борьбы против насекомых и клещей, однако, они могут быть также использованы в сочетании с другими биохимическими агентами, такими, как другие инсектициды и акарициды. Например, соединения настоящего изобретения формулы 1 могут быть с успехом использованы в сочетании или в смеси с пиретроидами, фосфатами, карбаматами, циклодиенами, эндотоксинами bacillus thurigiensis (Bt), формамидинами, соединениями фенололоза, хлорированными углеводородами, бензоилфенилмочевинами и т.п.
Соединения настоящего изобретения могут быть использованы в виде эмульгируемых концентратов, текучих концентратов или смачиваемых порошков, которые затем разводят, обычно in situ, водой или другим подходящим растворителем, и наносят путем опрыскивания. Указанные соединения могут быть также получены в виде компактных гранул, гранулированных композиций, концентраторов в виде дустов, концентратов суспензий, микроэмульсий и т. п., которые являются подходящими для обработки семян, почвы, воды и/или листьев растений в целях их защиты от поражения насекомыми и клещами. Указанные композиции представляют собой соединения настоящего изобретения, смешанные с инертными твердыми или жидкими разбавителями.
Смачиваемые порошки, дусты, концентраторы дустов могут быть получены, например, путем совместного измельчения от около 25 до около 85 мас.% соединения формулы 1; от около 73 до 13 мас.% твердого разбавителя, такого, как бентонит, диатомовая земля, каолин, аттапульгин или т.п.; от около 1 до 5 мас. % диспергирующего агента, такого, как лигносульфонат; и от около 1 до 5 мас. % неионногенного поверхностно-активного вещества, такого, как октилфеноксиполиэтоксиэтанол, нонилфеноксиполиэтоксиэтанол или т.п.
Обычно эмульгируемые концентраты могут быть получены путем растворения от около 15 до 70 мас.%, объединения формулы 1 в приблизительно 84 - 29 мас. % растворителя, такого, как изофорон, толуол, бутилцеллюлозы, метилацетат, монометиловый эфир пропиленгликоля или т.п., с последующим диспергированием в полученном растворе от около 1 до 5 мас.% неионного поверхностно-активного вещества, такого, как алкилфеноксиполиэтоксиспирт.
Для лучшего понимания настоящего изобретения, а также для более подробной его иллюстрации, ниже представлены конкретные примеры. В этих примерах используются реакционные схемы, представленные выше, а также описаны способы получения других соединений настоящего изобретения, которые конкретно не упоминаются в вышеприведенном описании изобретения. Однако указанные примеры не должны рассматриваться, как некое ограничение полного объема настоящего изобретения, определенного в нижеследующей формуле изобретения.
Пример
1
Получение 3,4,5-трихлоро-2-тиофенкарбоксальдегида
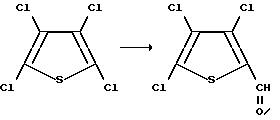
К раствору тетрахлоротиофена (2, 00 г, 9,01 мМ) в тетрагидрофуране (при 0oC) добавляли бутиллитий (2,5 М в тетрагидрофуране, 396 мл, 9,9 мМ). Реакционную смесь перемешивали при 0oC в течение 30 минут, нагревали до комнатной температуры в течение 45 минут, обрабатывали N,N-диметилформамидом (0,79 г, 10,8 мМ), перемешивали в течение 3 часов, а затем выливали в 1М раствор соляной кислоты (при 4oC) и экстрагировали эфиром. После этого объединенные органические экстракты промывали водой и солевым раствором, осушали сульфатом магния и концентрировали в вакууме с получением коричневого твердого вещества. Полученное вещество подвергали флеш-хроматографии (силикагель 5% раствор этилацетата в гексане) и получали твердое вещество бежевого цвета, которое затем перекристаллизовывали из этилацетата и гексана. Таким образом получали целевой продукт в виде игольчатых кристаллов бежевого цвета (1,63 г, 84%, т.пл. 81-82oC).
Пример 2
Получение оксима 3,4,
5-трихлоро-2-тиофенкарбоксальдегида

К суспензии 3,4,5-трихлоро-2-тиофенкарбоксальдегида (10, 69 г, 49,6 мМ) и гидроксиламинсульфата )8014 г, 49,6 мМ) в воде, добавляли раствор карбоната натрия (10,91 г, 99,2 мМ) в воде, после перемешивания при комнатной температуре в течение 18 часов, твердые вещества фильтровали из реакционной смеси и осушали в высоком вакууме в течение ночи, в результате чего получали целевой продукт в виде белого твердого вещества (10,24 г, 92%).
Следующие соединения были получены с использованием аналогичной процедуры и соответствующим образом замещенного тиофенкарбоксальдегида.
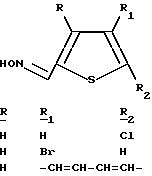

Пример 3
Получение 3,4, 5-трихлоро-2-тиофенкарбоксанитрила

Раствор оксима 3,4,5-трихлоро-2-тиофенкарбоксальдегида (10,075 г, 43,7 мМ) в уксусном ангидриде, нагревали с обратным холодильником в течение 2 часов и концентрировали в вакууме с получением коричневого маслообразного вещества. Это маслообразное вещество разводили эфиром, и органический раствор промывали водой и солевым раствором, а затем осушали сульфатом магния и концентрировали в вакууме с получением коричневого маслообразного вещества. После флеш-хроматографии на силикагеле (элюент: 5% этилацетат в гексане) получали твердое вещество бежевого цвета, которое перекристаллизовывали из этилацетат и гексана, в результате чего получали целевой продукт в виде игольчатых кристаллов бежевого цвета (8,23 г, выход 89%, т.пл. 63-64oC).
Следующие соединения получали с использованием той же самой процедуры и соответствующим образом замещенного оксима.

Пример 4
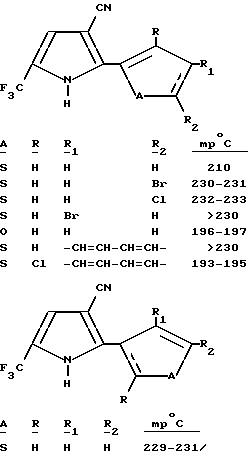
Получение 2-(3,4, 5-трихлоро-2-тиенил)-5-(трифторометил)пиррол-3-каронитрила
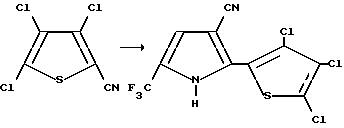
При - 78oC, к раствору диизопропиламида лития (2М в углеводороде, 10,9 мл, 21,8 мМ) в тетрагидрофуране, по капле добавляли ацетонитрил (0,97 г, 23,7 мМ). Полученную реакционную смесь перемешивали при -78oC в течение 30 минут, обрабатывали раствором 3,4,5-трихлоро-2-тиофенкарбонитрил (3,87 г, 18,2 мМ) в тетрагидрофуране, перемешивали 30 минут при -78oC, нагревали до комнатной температуры в течение 45 минут, гасили насыщенным раствором хлорида аммония и экстрагировали эфиром. После этого, объединенные органические экстракты промывали водой и солевым раствором, а затем осушали сульфатом магния и концентрировали в вакууме с получением красного твердого вещества. Смесь красного твердого вещества и 1-бромо-3,3,3-трифтороацетона (1,95 мл, 18,7 мМ) в уксусной кислоте, нагревали с обратным холодильником в течение 3 часов и 30 минут, разводили водой и экстрагировали эфиром. Объединенные органические экстракты промывали водой и солевым раствором, осушали сульфатом магния и концентрировали в вакууме с получением красного твердого вещества. После флеш-хроматографии на силикагеле (элюент: 15% раствор этилацетата в гексане) получали целевой продукт в виде белого твердого вещества (0,49 г, 7,8% т, пл. 220-221oC.)
С использованием аналогичной процедуры и соответствующим образом замещенного цианофурана или цианотиофена, получали следующие соединения:
Пример 5
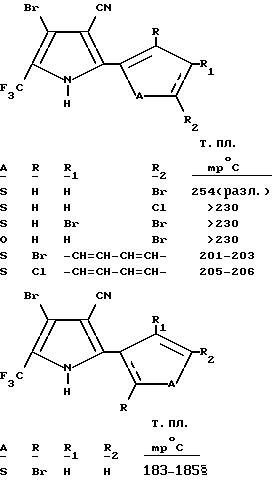
Получение 4-бромо-2-(3,4,5-трихлоро-2-тиенил)-5-(трифторметил) пиррол-3-карбонитрила

При 50oC, к раствору 2-(3,4, 5-трихлоро-2-тиенил)-5-(трифторометил)пиррол-3-карбонитрила (0,38 г, 1,09 мМ) и ацетата натрия (0,11 г, 1,31 мМ) в уксусной кислоте, добавляли бром (0,228 г, 1,31 мМ). После 30-минутного перемешивания при 50oC, к реакционной смеси добавляли еще 0,11 г (1,31 мМ) ацетата натрия и 0,208 г (1,31 мМ) брома. Затем реакционную смесь перемешивали в течение 15 минут, охлаждали до комнатной температуры и выливали в 1% раствор бисульфита натрия. Твердый остаток фильтровали из водной смеси и осушали в течение ночи в высоком вакууме, в результате чего получали белое твердое вещество. Полученное твердое вещество перекристаллизовывали из этилацетата и гексана. Таким образом был получен целевой продукт в виде белых кристаллов (0,45 г, выход 96%, т.пл. 221-224

С использованием аналогичной процедуры и соответствующим образом замещенного 2-(тиенил- или фурил)-5-(трифторометил)пиррол-3-карбонитрила, получали следующие соединения.
Пример 6
Получение 4-бромо-1-(этоксиметил)-2-(3,4,5-трихлоро-2-тиенил)- 5-(трифторометил)пиррол-3-карбонитрила
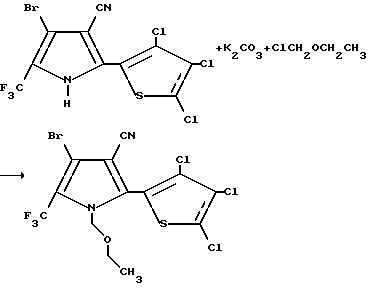
К смеси 4-бромо-2-(3,4,5-трихлоро-2-тиенил)-5-(трифторометил)пиррол-3- карбонитрила (0,30 г, 0,71 мМ) и карбоната калия (0,29 г, 2,13 мМ) в N, N- диметилформамиде, добавляли хлорометилэтиловый эфир (0,20 г, 2,13 мМ). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, разводили водой и экстрагировали эфиром. Объединенные органические экстракты промывали водой и солевым раствором, а затем осушали сульфатом магния и концентрировали в вакууме с получением прозрачного маслообразного вещества. Это маслообразное вещество подвергали флеш-хроматографии на силикагеле, элюируя 15% раствором этилацетата в гексане, в результате чего получали целевой продукт в виде белых кристаллов (0,24 г, выход 71%, т.пл. 85-87oC).
Следующие соединения получали с использованием аналогичной процедуры и соответствующим образом замещенного 4-галоген-2-(тиенил- или фурил)-5-(трифторметил)пиррол-3-карбонитрила.
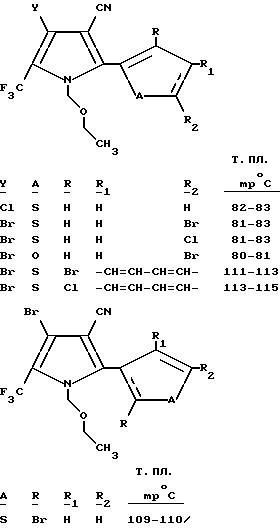
Пример 7
Получение 4-хлоро-2-(2-тиенил)-5-(трифторометил)пиррол-3-карбонитрила
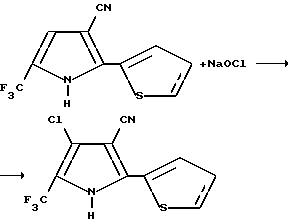
К раствору 2-(2-тиенил)-5-(трифторометил)пиррол-3-карбонитрила (2,00 г, 8,26 мМ) в тетрагидрофуране, по капле добавляли гипохлорит натрия (12 мл, 5,25%-ного раствора, 17 мМ). Реакционную смесь перемешивали 2 часа и 15 минут, гасили путем добавления 1% раствора бисульфита натрия, а затем разводили эфиром. Слои отделяли, органический слой промывали водой и солевым раствором, осушали сульфатом магния, а затем концентрировали в вакууме с получением желтого твердого вещества. После флеш-хроматографии на силикагеле (элюент: 15% раствор этилацетата в гексане) получали твердое вещество, которое перекристаллизовывали из этилацетата и гексана с получением целевого продукта в виде желтого твердого вещества (0,35 г, 15% т.пл. 221-223oC).
Пример 8
Получение
5-бромо-2-тиофенкарбонитрила

К раствору 5-бромо-2-тиофенкарбоксальдегида (15,0 г, 78,5 мМ) в воде и ацетонитриле, добавляли гидроксиламин-0-сульфоновую кислоту (17,58 г, 157 мМ). Реакционную смесь перемешивали в течение 17 часов, выливали в воду и экстрагировали эфиром и этилацетатом. После этого объединенные органические экстракты промывали водой и солевым раствором, осушали сульфатом магния и концентрировали в вакууме с получением коричневого маслообразного твердого продукта. Раствор маслообразного твердого продукта в уксусном ангидриде нагревали с обратным холодильником в течение 5 часов, концентрировали в вакууме, выливали в воду и экстрагировали эфиром. Объединенные органические экстракты промывали водой, полунасыщенным раствором гидрокарбоната натрия и солевым раствором, а затем осушали сульфатом магния и концентрировали в вакууме с получением коричневого маслообразного вещества. После флеш-хроматографии на силикагеле (элюент: 15% этилацетат в гексане) получали целевой продукт в виде желтого маслообразного вещества (3,6 г, выход 24%).
Пример 9
Получение 2-(5-бромо-2-фурил)-5-(трифторометил)пиррол-3-карбонитрила
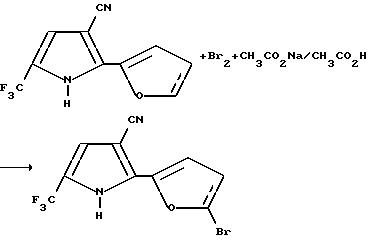
К раствору 2-(2-фурил)-5-(трифторометил)пиррол-3-карбонитрила (1,00 г, 4,42 мМ) и ацетата натрия (0,36 г, 4,42 мМ) в уксусной кислоте добавляли бром (0,71 г, 4,42 мМ). Реакционную смесь перемешивали в течение 15 минут и выливали в 1% раствор бисульфита натрия. Образовавшееся твердые вещества фильтровали из водной смеси, осушали в течение ночи в высоком вакууме и перекристаллизовывали из этилацетата и гексана, в результате чего получали целевой продукт в виде красных кристаллов (1,21 г, выход 90%, т.пл. 224-226oC).
Используя, в основном, аналогичную процедуру, за исключением того, что 2-(2-ферил)-5-(трифторометил)-пиррол-з-карбонитрил заменяли на 2-(2-тиенил)-5-(трифторометил)пиррол-3- карбонитрил, получали 2-(2-бромо-3-тиенил)-5-(трифторометил)пиррол-3-карбонитрил в виде твердого вещества, т.пл. 170oC.
Пример 10.
Получение
2-(5-формил-2-фурил)-5-(трифторометил)пиррол-3-карбонитрила

При -78oC, к раствору 2-(5-бромо-2-фурил)-5-(трифторометил)пиррол-3-карбонитрила (1,13 г, 3,70 мМ) в тетрагидрофуране, по капле добавляли бутиллитий (3,45 мл, 7,78 мМ). Реакционную смесь перемешивали в течение 30 минут при -78oC, нагревали до комнатной температуры, обрабатывали N,N-диметилформамидом (1,35 г, 18,5 мМ), выливали в 1М соляной кислоты, а затем экстрагировали эфиром и этилацетатом. Объединенные органические экстракты промывали водой и солевым раствором, осушали сульфатом натрия и концентрировали с получением оранжевого твердого вещества. Это вещество подвергали флеш-хроматографии на силикагель (элюент: 20% - 50% этилацетата в гексане) и образовавшееся оранжевое твердое вещество перекристаллизовывали из этилацетата, в результате чего получали целевой продукт в виде оранжевых кристаллов (0,66 г, 70%, т.пл. 224-225oC).
Пример 11
Получение бензо[b] nиофен-2-карбоксальдегида
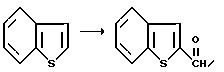
В атмосфере азота и при 0oC, к раствору N,N,N',N'-тетраметилэтилендиамина (15,57 г, 134 мМ) в тетрагидрофуране, по капле добавляли бутиллитий (54 мл, 134 мМ). После этого реакционную смесь по капле обрабатывали раствором бензотиофена (15 г, 112 мМ) в тетрагидрофуране, нагревали до комнатной температуры, еще раз обрабатывали N,N, N',N'-тетраметилэтилендиамином (15,57 г, 134 мМ) и бутиллитием (54 мл, 134 мМ), перемешивали при комнатной температуре в течение 13 часов, охлаждали до 0oC, обрабатывали N, N-диметилформамидом (24,40 г, 336 мМ), а затем нагревали до комнатной температуры, перемешивали 5 часов, выливали в IM-соляную кислоту и экстрагировали эфиром. Объединенные органические экстракты промывали водой и солевым раствором, осушали сульфатом натрия, а затем концентрировали в вакууме, в результате чего образовывалось оранжевое маслообразное вещество. Это вещество подвергали флеш-хроматографии на силикагеле, элюируя 15% раствором этилацетата в гексане, в результате чего получали целевой продукт в виде оранжевого маслообразного продукта (12,51 г, 69%).
Пример 12
Получение 3-хлоробензо [b]тиофен-2-карбонитрила
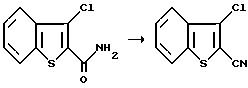
При 0oC, к смеси пиридина (5,23 г, 66,1 мМ) и 3-хлоробензо[b]тиофен-2-карбоксамида (10,0 г, 47,2 мМ) в метиленхлориде, по капле добавляли трифтороуксусный ангидрид (11,90 г, 56.6 мМ). Реакционную смесь нагревали до комнатной температуры в течение часа, разводили водой и экстрагировали эфиром. После этого объединенные органические экстракты промывали водой, IM раствором соляной кислоты и солевым раствором, а затем осушали сульфатом магния и концентрировали в вакууме, с получением желтого твердого вещества. Это твердое вещество перекристаллизовывали из этилацетата и гексана, в результате чего получали целевой продукт в виде беловатых игольчатых кристаллов (8,80 г, 96%).
Пример 13
Получение β- [(формилметил)амино-2-бензофуранакрилонитрила, диэтилацеталя

Смесь 2 -ω- цианоацетобензофурана (18,52 г, 100,0 мМ) и диэтилацеталя аминоацетальдегида (14,50 мл, 13,28 г, 99,7 мМ) в толуоле нагревали с обратным холодильником в течение ночи с удалением воды (ловушка Дина-Старка) и концентрировали в вакууме с получением черного маслообразного вещества. После безводной колоночной хроматографии на силикагеле (метиленхлорид) получали рыжевато-черное маслообразное вещество. Затем это вещество смешивали с раствором метиленхлорида/гексана. Образовавшуюся смесь фильтровали и фильтрат концентрировали в вакууме, в результате чего получали целевой продукт в виде рыжевато-черного маслообразного вещества (10,20 г).
Пример 14
Получение
2-(2-бензофуранил)пиррол-3-карбонитрила
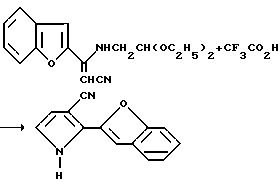
β -[(Формилметил)амино] -2-бензофуранакрилонитрил (1,00 г, 3,33 мМ) добавляли по капле к трифторуксусной кислоте (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение часа, разводили водой и экстрагировали этилацетатом. После этого органический экстракт промывали насыщенным раствором бикарбоната натрия и солевым раствором, а затем осушали сульфатом магния, обеспечивали путем добавления угля и концентрировали в вакууме с получением оранжевого твердого вещества. После безводной колоночной хроматографии на силикагеле (элюент: метиленхлорид) получали целевой продукт в виде коричневато-белого твердого вещества (0,32 г, выход 46%, и пл. 157-160,5oC).
Пример 15
Получение 4.5-дихлоро-2-(3-хлоро-2-бензофуранил)пиррол-3-карбонитрила
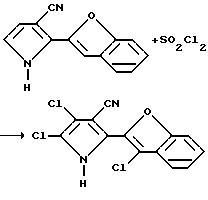
К раствору 2-(2-бензофуранил)пиррол-3-карбонитрила (1,00 г, 4,8 мМ) в уксусной кислоте, по капле добавляли сульфурилхлорид (1,20 мл, 2,02 г, 14,9 мМ). Реакционную смесь перемешивали при комнатной температуре в течение 45 минут и фильтровали, в результате чего образовывались твердые вещества. Эти твердые вещества промывали холодной уксусной кислотой и осушали в течение ночи, в результате чего образовывался серый порошок. Раствор серого порошкообразного вещества и тетрагидрофурана осушали сульфатом магния, обесцвечивали путем добавления угля и концентрировали в вакууме с получением желтовато-белого твердого вещества. Суспензию желто-белого твердого вещества и метиленхлорида перемешивали 90 минут и фильтровали с получением целевого продукта в виде беловатого твердого вещества (0,74 г, т.пл. 258-260,5oC).
Используя, в основном, ту же самую процедуру, за исключением двух эквивалентов сульфурилхлорида, получали 5-хлоро-2-(3-хлоро-2-бензофуранил)пиррол-3-карбонитрил в виде белого твердого вещества, т.пл. 223,5 - 225,5oC.
Пример 16
Получение 2-бромо-1-(5-хлоро-2-тиенил)этанона
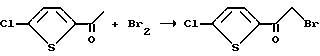
К раствору 2-ацетил-5-хлоротиофена (19,00 г, 118 мМ) в хлороформе, при 40 - 45oC, добавляли раствор брома (18,90 г, 118 мМ) в хлороформе. Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 часов и разводили водой. Органический слой отделяли, осушали сульфатом магния и концентрировали в вакууме, в результате чего образовывалось твердое вещество. Это твердое вещество суспендировали в растворе эфира/гексана, фильтровали и осушали, в результате чего получали целевой продукт в виде твердого вещества (12,20 г, т.пл. 68 - 70oC).
Пример 17
Получение (5-хлоро-2-теноил)метил малононитрила
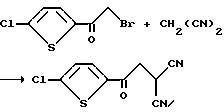
Раствор 2-бромо-1-(5-хлоро-2-тиенил)этанона (11,50 г, 48 мМ) в тетрагидрофуране, при 0oC, добавляли к раствору малононитрила (3,17 м, 48 мМ) и трет-бутоксида калия (5,70 г, 51 мМ) в тетрагидрофуране. Реакционную смесь перемешивали несколько минут, концентрировали в вакууме, разводили водой и фильтровали до образования твердых продуктов. Эти твердые продукты подвергали флеш-хроматографии на силикагеле (раствор гексана/этилацетата 4:1) и получали целевое соединение в виде желтого твердого вещества, т.пл. 155 - 158oC.
Пример 18
Получение 2-хлоро-5-(5-хлоро-2-тиенил)пиррол-3-карбонитрила
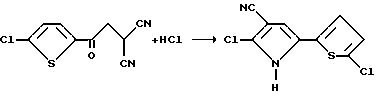
Газообразный хлороводород барботировали через смесь [(5-хлоро-2-теноил)метил] малононитрила (4,60 г, 20,5 мМ), эфира и хлороформа, в умеренной дозе в течение 20 минут. Полученную реакционную смесь выливали в смесь льда/воды и экстрагировали эфиром. Объединенные органические экстракты осушали сульфатом магния и концентрировали в вакууме, в результате чего образовывалось коричневое твердое вещество. Это твердое вещество смешивали с раствором гексана/эфира и фильтровали, в результате чего получали целевой продукт в виде коричневого твердого вещества, т.пл. > 2000oC.
Пример 19
Получение 4-бромо-2-хлоро-5-(5-хлоро-2-тиенил)пиррол-3-карбонитирла
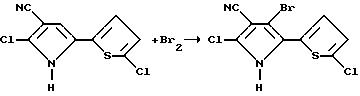
Раствор брома (0,70 г, 4, 3 мМ) в п-диоксане добавляли по капле к раствору 2-хлоро-5-(5-хлоро-2-тиенил)пиррол-3-карбонитрила (1,0 г, 4,1 мМ) в п-диоксане. Реакционную смесь перемешивали в течение ночи при комнатной температуре и концентрировали в вакууме с получением остатка. Этот остаток подвергали флеш-хроматографии на силикагеле (раствор гексана/этилацетата, 6: 1) и получали целевой продукт в виде желтого твердого вещества, т.пл. > 200oC.
Пример 20
Получение 4-(п-хлорофенил)-2-(трифторометил)-3-оксазолин-5-она

Раствор (п-хлорофенил)глицина (5,05 г, 27,3 мМ) и трифтороуксусного ангидрида (22,90г, 109,2 мМ) в толуоле нагревали с обратным холодильником в течение 5 минут и концентрировали в вакууме, в результате чего получали целевой продукт в виде прозрачного оранжевого маслообразного вещества. Этот продукт идентифицировали посредством анализа, проведенного с помощью высокоэффективной жидкостной хроматографии.
Использовали, в основном, ту же самую процедуру, за исключением того, что (р-хлорофенил)глицин заменяли на d-амино-2-тиофенуксусную кислоту, и получали 4-(2-тиенил)-2-(трифторометил)-3-оксазолин-5-он в виде коричневого маслообразного вещества.
Пример 21
Получение
5-(п-хлорофенил)-3-(5-нитро-2-тиенил)-2-(трифторометил)пиррола

К раствору 4-(п-хлорофенил)-2-(трифторометил)-3-оксазолин-5-она (2,97 г, 11,3 мМ) и 2-нитро-5-(2-нитровинил)тиофена (2,26 г, 11,3 мМ) в ацетонитриле, при температуре, примерно близкой к температуре перегонки, добавляли триэтиламин (1,16 г, 11,3 мМ). Полученную реакционную смесь нагревали с обратным холодильником в течение часа, перемешивали в течение ночи при комнатной температуре и концентрировали в вакууме с получением красного маслообразного вещества. Это вещество хроматографировали и получали целевой продукт в виде коричневатого твердого вещества, т.пл. 166 - 169oC.
Использовали, в основном, ту же самую процедуру, за исключением того, что 2-нитро-5-(2-нитровинил)тиофен заменяли на 2-(2-нитровинил)фуран, и получали 5-(р-хлорофенил)-3-(2-фурил)-2-трифторометил)пиррол в виде коричневатого твердого вещества, т.пл. 65 - 66oC.
Далее использовали, в основном, ту же самую процедуру, за исключением того, что 4-(п-хлорофенил)-2-(трифторометил)-3-оксазолин-5-он заменяли на 4-(2-тиенил)-2-(трифторметил)-3-оксазолин-5-он, а 2-нитро-5-(2-нитровинил)тиофен заменяли на 2-хлороакрилонитрил, в результате чего получали 2-(2-тиенил)- 5-трифторометил)пиррол-3-карбонитрил в виде коричневатого твердого вещества, т.пл. 210oC.
Пример 22
Получение
2-(п-хлорофенил)-3-нитро-4-(5-нитро-2-тиенил)-5-(трифторометил)пиррола
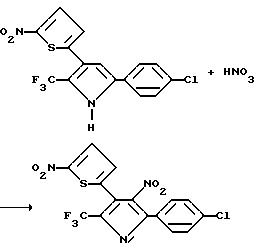
90%-ный раствор азотной кислоты (0,02 г, 0,28 мМ) добавляли к раствору 5-(п-хлорофенил)-3-(5-нитро-2-тиенил)-2-(трифторометил)пиррола (0,13 г, 0,34 мМ) в уксусном ангидриде. Полученную реакционную смесь перемешивали при комнатной температуре в течение 10 минут, обрабатывали еще 0,02 граммами (0,28 мМ) 90%-ного раствора азотной кислоты, перемешивали 15 минут при комнатной температуре, выливали в воду, а затем снова перемешивали в течение ночи при комнатной температуре и экстрагировали эфиром. Объединенные органические экстракты осушали сульфатом магния и концентрировали в вакууме, в результате чего получали целевой продукт в виде коричневого твердого вещества, который идентифицировали с помощью спектрального1H-ЯМР-анализа
Пример 23
Получение 4-бромо-2-(5-бромо-2-тиенил)-5-(трифторометил)пиррол-3-карбонитрила и 4-бромо-2-[(3(или 4-), 5-дибромо-2-тиенил]-5-(трифторометил)пиррол-3-карбонитрила

Раствор N-бромосукцимида (0,84 г, 4,63 мМ) и 2-(2-тиенил)-5-(трифторометил)-пиррол-3-карбонитрила (1,02 г, 4,21 мМ), в тетрагидрофуране перемешивали в течение 20 минут при комнатной температуре, обрабатывали 0,84 граммами (4,63 мМ) N-бромосукцинимида, перемешивали 20 минут при комнатной температуре, а затем перемешивали при нагревании с обратным холодильником в течение 2 часов и выливали в воду. Полученную водную смесь фильтровали и получали твердые вещества и фильтрат. Смесь полученных твердых веществ в толуоле нагревали, фильтровали и осушали, в результате чего получали 4-бромо-2-(5-бромо-2-тиенил)-5-(трифторометил)пиррол-3-карбонитрил в виде твердого вещества, т.пл. 254oC (с разл.). Фильтрат, полученный из водной смеси, концентрировали в вакууме и хроматографировали (силикагель; раствор гексана/этилацетата, 4: 1), в результате чего получали 4-бромо-2-[3(или 4-), 5-дибромо-2-тиенил]-5-(трифторометил)пиррол-3-карбонитрил в виде твердого вещества, т.пл. 203oC.
Пример 24
Получение 2-[1-(5-бромо-3-тиенил)-2-нитроэтил]
-4-(п-хлорофенил)-2- (трифторометил)-3-оксазолин-5-она
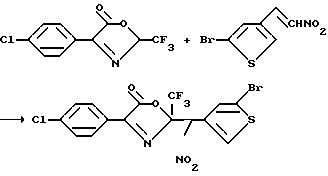
К раствору 4-(п-хлорофенил)-2-(трифторометил)-3-оксазолин-5-она (10,00 г, 38 мМ) и 2-бромо-4-(2-нитровинил)тиофена (8,98 г, 32 мМ) в толуоле, при 0oC, добавляли раствор триэтиламина (0,30 г, 3 мМ) в толуоле. Полученную реакционную смесь нагревали до комнатной температуры и разводили разбавленной соляной кислотой и эфиром. Органический слой отделяли, осушали сульфатом магния, концентрировали в вакууме, разбавляли гексаном, перемешивали, нагревали с обратным холодильником, охлаждали до комнатной температуры и декантировали, в результате чего получали прозрачный раствор. Этот раствор концентрировали в вакууме и хроматографировали с получением целевого продукта.
Пример 25
Получение 3-(5-бромо-3-тиенил)-5-(п-хлорофенил)-2-(трифторометил) пиррола и
3-(5-бромо-3-тиенил)-5-(п-хлорофенил)-4-нитро-2-(трифторометил)пиррола.

Раствор триэтиламина (3,24 г, 32,1 мМ) в ацетонитриле медленно добавляли к раствору 2-[1-(5-бромо-3-тиенил)-2-нитроэтил] -4-(п-хлорофенил)-2-(трифторометил)- 3-оксазолин-5-она (13,30 г, 26,8 мМ) в ацетонитриле. Полученную реакционную смесь перемешивали при комнатной температуре в течение нескольких минут, а затем разводили разбавленной соляной кислотой. Органический слой отделяли, осушали сульфатом магния и концентрировали в вакууме с получением остатка черного цвета. Этот остаток подвергали колоночной хроматографии (силикагель; раствор гексана/этилацетат, 9:1) и получали несколько твердых веществ. Одно из этих веществ перемешивали в холодном 1,2-дихлорэтане, фильтровали и осушали, в результате чего получали 3-(5-бромо-3-тиенил)-5-(п-хлорофенил)-2-(трифторометил)пиррол в виде слегка коричневого твердого вещества, т. пл. 112 - 115oC. Другое твердое вещество разводили гексаном, а полученную смесь нагревали с обратным холодильником, охлаждали до комнатной температуры и фильтровали. Таким образом получали 3-(5-бромо-3-тиенил)-5-(п-хлорофенил)-4-нитро-2-(трифторометил)пиррол в виде желтого твердого вещества, т.пл. 174-176oC.
Пример 26
Получение 3-(5-бром-4-нитро-3-тиенил)-5-(п-хлорофенил)-4-нитро-2-(трифторометил)пиррола

Раствор 3-(5-бромо-3-тиенил)-5-(п-хлорофенил)-2-(трифторометил)пиррола (0,70 г, 1,7 мМ) и 90%-ной азотной кислоты (0,145 г, 0,1 мл, 2,1 мМ)т в уксусном ангидриде перемешивали 20 минут при комнатной температуре, обрабатывали еще несколькими каплями 90%-ной азотной кислоты, а затем разводили водой. Образовавшиеся твердые продукты собирали путем фильтрования и осушали в течение ночи (при 60oC) в вакуумной печи, в результате чего получали целевой продукт в виде твердого вещества, т.пл. 186-190oC.
Пример 27
Получение
2-(р-Хлорофенил)-4-(4,5-дибромо-3-тиенил)-3-нитро-5-(трифторометил)пиррола
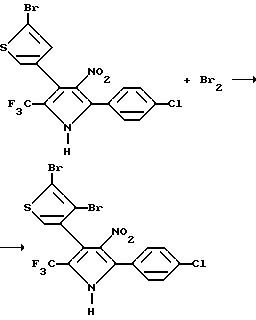
Раствор 3-(5-бромо-3-тиенил)-5-(p-хлорофенил)-4-нитро-2-(трифторметил)пиррола (0,50 г; 1,1 мМ) брома 90,20 г; 1,3 мМ) и ацетата натрия (0,11 г 1,3 мМ) в уксусной кислоты (10 мл) нагревали в течение ночи при 50oC, и выливали в воду. Твердые вещества собирали и перекристаллизовывали из 1,2-дихлорэтана, в результате чего получали целевой продукт в виде желтого твердого вещества, т.пл. 241 - 242oC.
Пример 28
Оценки инсектицидной и акарицидной активности
Описанные ниже тесты показали, что испытуемые соединения обладают инсектицидной и
акарицидной активностью. Испытания проводили с использованием растворов испытуемых соединений, растворенных или диспергируемых в смеси ацетона и воды (50/50). Испытуемое соединение растворяли или
диспергировали в указанных смесях ацетона и воды в количествах, достаточных для получения соответствующих концентраций, указанных в таблице 1 (см. в конце описание).
Все концентрации,
приведенные ниже, даны исходя из активного ингредиента. Все испытания были проведены в лаборатории при температуре около 27oC. При этом использовали следующую шкалу оценок:
Шкала
оценок
0 = эффект отсутствует
1 = 10-25% уничтожения
2 = 26-35% уничтожения
3 = 36-45% уничтожения
4 = 46-55% уничтожения
5 = 56-65%
уничтожения
6 = 66-75% уничтожения
7 = 76-85% уничтожения
8 = 86-99% уничтожения
9 = 100 % уничтожения
- = оценка не проводилась
Ниже описаны виды
насекомых и клещей, используемых в испытаниях, а также методики указанных испытаний.
Spodoptera eridana: личинки на третьей возрастной стадии (совка южная).
Фасоль Лима, выращенную до размера 7 - 8 см в длину, погружали в испытуемую суспензию, размешивая в течение трех секунд, а затем помещали в вытяжной шкаф для сушки. После этого листья помещали в чашки Петри (100 х 10 мм), содержащие на дне влажную фильтровальную бумагу и десять гусениц на третьей возрастной стадии. Чашки выдерживали в течение пяти дней, а затем исследовали на гибель личинок, на степень снижения поедания растений личинками либо на воздействие, препятствующее нормальной линьке личинок.
Spodoptera eridana: после 7-дневного выдерживания.
Растения, обработанные как описано в предыдущем испытании, помещали на семь дней в теплицу в условиях освещения лампами с высокой интенсивности. Эти лампы имитировали условия яркого солнечного дня, продолжительность которого в данном эксперименте составляла 14 часов. Через семь дней брали образцы листьев проводили испытания, как описано выше.
Tetranychus uоticae (OP-резистентный штамм): двупятнистый паутинный клещ.
Отбирали растения фасоли Лима с первичными листьями, выращенные до размера 7 - 8 см в длину, и выпаливали, оставляя одно растение на горшок. Затем на каждый лист испытуемых растений помещали небольшой кусочек, вырезанный из листа, взятого от главной колонии. Эту процедуру осуществляли за два часа до обработки для того, чтобы клещи успели перейти на испытуемое растение яйца. Размер вырезанного кусочка варьировали так, чтобы получить примерно 100 клещей на один лист. Ко времени обработки, кусочек листа, использованного для переноса клещей на испытуемое растение, удаляли и выбрасывали. Растения, пораженные клещами, погружали на 3 секунды, помещали при этом в испытуемую композицию, после чего помещали в вытяжной шкаф для осушки. Растения выдерживали в течение двух дней, а затем проводили анализ на уничтожение взрослых особей. Heiiothis viresceus, совка на третьей возрастной стадии.
Семядоли хлопка погружали в испытуемую композицию и помещали в вытяжной шкаф для осушки. После осушки каждую семядолю разрезали на четыре части и десять частей отдельно помещали в 30 миллитровые пластиковые медицинские чашки, содержащие отрезок (длиной 5 - 7 мм) влажного зазубренного фитиля. Затем в каждую чашку добавляли одну гусеницу на третьей стадии развития, после чего чашку покрывали картонкой. Обработка продолжалась три дня, после чего проводили подсчет погибших гусениц и оценку снижения степени ущерба, наносимого гусеницами, поедающими растения.
Diabrofica undecinpunctata howardi, южная длинноусая блошка на третьей возрастной стадии.
Один куб. см (1 см3) тонкоизмельченного талька помещали в 30-миллитровую широкогорлую склянку с завинчивающейся пробкой. Затем на этот тальк пипетировали 1 мл раствора испытуемого соединения в ацетоне так, чтобы на каждую склянку приходилось 1,25 мг активного ингредиента. После этого склянки помещали под слабый поток воздуха до тех пор, пока ацетон не испарится. Осушенный тальк разрыхляли и в каждую склянку добавляли 1 см3 семян проса, которые служили кормом для насекомых, и 25 мл влажной почвы. После этого склянки закрывали крышкой и содержимое склянок интенсивно размешивали в смесителе Uortex. Затем в каждую склянку добавляли 10 блошек на третьей возрастной стадии, причем склянки оставляли открытыми для того, чтобы к личинкам поступал воздух. Обработку проводили в течение 6 дней, после чего подсчитывали число погибших особей. Отсутствие личинок означало их гибель, поскольку эти личинки быстро разлагаются и не могут быть обнаружены. В этом эксперименте концентрация используемых соединений составляла приблизительно 50 млн. д.
Соединения, используемые в вышеописанных экспериментах на инсектицидную и акарицидную активность, обозначены номерами, по которым идентифицируется их название (см. ниже). В таблице, в которой приводятся данные экспериментов, соединения даны под их номерами.
Соединения, оцениваемые на инсектицидную и акарицидную активность
Соединения N
1 2-(p-Хлорофенил)-4-(4,
5-дибромо-3-тиенил)-3-нитро-5- (трифторометил)пиррол,
2 3-(5-Бромо-3-тиенил)-5-(p-хлорофенил)-4-нитро-2-(трифторометил)пиррол,
3
5-(п-Хлорофенил)-3-(2-фурил)-2-(трифторометил)пиррол
4 3-(5-Бромо-3-тиенил)-5-(п-хлорофенил)-2-(трифторометил)пиррол,
5 2-(2-Бензофуранил)пиррол-3-карбонитрил
6
3-Хлоро-1-(этоксиметил)-2-(2-тиенил)-5-(трифторометил)пиррол-3-карбонитрил,
7 2-(2-Тиенил)-5-(трифторометил)пиррол-3-карбонитрил
8
4-Хлоро-2-(2-тиенил)-5-(трифторометил)пиррол-3-карбонитрил,
9 2(5-Бромо-2-тиенил)-5-(трифторометил)пиррол-3-карбонитрил,
10
4-Бромо-2-(5-бромо-2-тиенил)-1-этоксиметил)-5-(трифторометил)пиррол -3-карбонитрил,
11 2-(5-Хлоро-2-тиенил)-5-(трифторометил)пиррол-3-карбонитрил,
12
4-Бромо-2-(5-хлоро-2-тиенил)-5-(трифторометил)-пиррол-3-карбонитрил,
13 4-Бромо-2-(5-хлоро-2-тиенил)-1-(этоксиметил)-5-(трифторометил)пиррол-3 -карбонитрил,
14
2-(4-Бромо-2-тиенил)-5-(трифторометил)пиррол-3-карбонитрил,
15 2-(3,4,5-Трихлоро-2-тиенил)-5-(трифторометил)пиррол-3-карбонитрил,
16 4-Бромо-2-(3,4,
5-трихлоро-2-тиенил)-5-(трифторометил)пиррол-3-карбонитрил,
17 4-Бромо-1-(этоксиметил)-2-(3,4,5-трихлоро-2-тиенил)-4-(трифторметил)пиррол -3-карбонитрил,
18
2-(2-Бромо-3-тиенил)-5-(трифторометил)пиррол-3-карбонитрил,
19 4-Бромо-2-(2-бромо-3-тиенил)-5-(трифторометил)-пиррол-3-карбонитрил,
20
2-(2-фурил)-5-(трифторометил)пиррол-3-карбонитрил,
21 1-(Этоксиметил)-2-(3,4,5-трихлоро-2-тиенил)-5-(трифторометил)пиррол-3- карбонитрил,
22
2-(5-формил-2-фурил)-5-(трифторометил)пиррол-3-карбонитрил,
23 4-Бромо-2-(5-бромо-2-тиенил)-5-(трифторометил)-пиррол-3-карбонитрил,
24
2-Хлоро-5-(5-хлоро-2-тиенил)пиррол-3-карбонитрил,
25 4-Бромо-2-(5-бромо-2-фурил)-1-(этоксиметил)-5-(трифторометил)пиррол- 3-карбонитрил,
26
4-Бромо-2-(5-бромо-2-ферил)-5-(трифторометил)-пиррол-3-карбонитрил,
27 2-(5-Бромо-2-ферил)-5-(трифторометил)пиррол-3-карбонитрил,
28 4-Бромо-2-(4,
5-дибромо-2-тиенил)-5-(трифторометил)пирроли-3-карбонитрил,
29 4,5-Дихлоро-2-(3-хлоро-2-бензофуранил)пиррол-3-карбонитрил,
30 5-Хлоро-2-(3-хлоро-2-бензофуранил)пиррол-3-карбонитрил,
31 4-Бромо-2-(3-хлоро-2-бензо[b] тиенил)-1-(этоксиметил)-5-(трифторометил)пиррол-3-карбонитрил,
32 4-Бромо-2-(3-хлоро-2-бензо [b] тиенил)-5-(трифторометил)пиррол-3-карбонитрил,
33 2-Бензо[b]тиенил-2-ил-5-(трифторометил)пиррол-3-карбонитрил,
34 4-Бромо-2-(3-бромобензо[b]тиен-2-ил)-5-(трифторометил)пиррол-3-карбонитрил,
35
4-Бромо-2-(3-бромобензо[b]тиен-2-ил)-5-(этоксиметил)-5-(трифторометил) пиррол-3-карбонитрил,
36 2-(п-Хлорофенил)-3-нитро-4-(5-нитро-2-тиенил)-5-(трифторометил)пиррол,
37
4-Бромо-2-хлоро-5-(5-хлоро-2-тиенил)пиррол-3-карбонитрил,
38 2-(3-Тиенил)-5-(трифторометил)пиррил-3-карбонитрил,
39
4-Бромо-2-(2-бромо-3-тиенил)-1-(этоксиметил)-5-(трифторометил)пиррол-3 -карбонитрил,
40 2-(3-Хлоро-2-бензо[b]тиенил)-5-(трифторометил)-пиррол-3-карбонитрил.
Примеры составов
по изобретению
Эмульгируемые концентраты
Состав 1
Компонент - мас.%
Соединение 1 - 25,0
ПАВ1 - 5,0
Растворитель2 - 70,0
- 100,0
1 ПАВ - алкилфеноксиполиэтоксиспирт
2Метилацетат
Состав 2
Компонент - мас.%.
Соединение 6 - 16,0
ПАВ - 4,0
Бутилцеллюлозоль в - 80,0 - 100,0
Состав 3
Суспензионный концентрат
Компонент - мас.%
Соединение 8 - 25,0
Разбавитель1 - 15,0
Диспергирующий агент2 - 5,0
ПАВ3 - 3,0
Вода - 52,0 - 100,0
1Диатомовая земля.
2Нонилфеноксиполиэтоксиэтанол.
3Лигносульфонат натрия.
Реферат
Изобретение относится к новым тиенил- или фурилпирроловым соединениям общей формулы I, где каждый R, R1 и R2 независимо представляет собой водород, галоген, NO2 или СНО или R1 и R2 , взятые вместе с атомами углерода, с которыми они связаны, могут образовать кольцо, в котором R1, R2 представлены структурой II, в которой каждый L, Т, V и W - водород, галоген, А представляет собой O или S, Х представляет собой CN, NO2 при условии, что заместитель во 2- или 5-положении пиррольного кольца отличен от водорода, Y представляет собой галоген, C1-C6-галогеноалкил, CN, фенил, необязательно замещенный одним или несколькими атомами галогена, Z представляет собой галоген или C1-C6 -галогеноалкил, В представляет собой R6, где R6 - водород или C1-C6-алкил, замещенный одной C1-C4-алкоксигруппой. Описывается способ борьбы с насекомыми, заключающийся в обработке пищи, которую они потребляют, или место, где они обитают, подвергают обработке соединением формулы I. Описывается также композиция для борьбы с насекомыми на базе соединения I. 5 с. и 2 з.п.ф-лы, 1 табл.
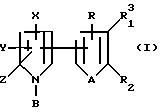

Формула
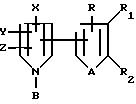
где каждый R, R1 и R2 независимо представляет собой водород, галоген, NO2 или CHO или R1 и R2, взятые вместе с атомами углерода, с которыми они связаны, могут образовать кольцо, в котором R1, R2, представлены структурой
в которой каждый L, T, V и W - водород, галоген;
A представляет собой O или S;
X представляет собой CN, NO2 при условии, что заместитель во 2- или 5-положении пиррольного кольца отличен от водорода;
Y представляет собой галоген, C1 - C6 -галогеналкил, CN, фенил, необязательно замещенный одним или несколькими атомами галогена;
Z представляет собой галоген или C1 - C6-галогеналкил;
B представляет собой R6, где R6 - водород или C1 - C6-алкил, замещенный одной C1 - C4-алкоксигруппой.
4-Бром-1-(этоксиметил)-2-(3,4, 5-трихлор-2-тиенил)-5-(трифторметил)пиррол-3-карбонитрил;
4-Бром-2-(3,4,5-трихлор-2-тиенил)-5-(трифторметил)пиррол-3-карбонитрил;
4-Бром-2-(5-бром-2-фурил)-1-(этоксиметил)-5-(трифторметил)пиррол-3-карбонитрил;
4-Бром-2-(5-бром-2-фурил)-5-(трифторметил)пиррол-3-карбонитрил;
1-(Этоксиметил)-2-(3,4, 5-трихлор-2-тиенил)-5-(трифторметил)пиррол-3-карбонитрил;
2-(5-хлор-2-тиенил)-5-(трифторметил)пиррол-3-карбонитрил;
2-(п-хлорфенил)-4-(4, 5-дибром-3-тиенил)-3-нитро-5-(трифторметил)пиррол;
2-(3,4,5-трихлор-2-тиенил)-5-(трифторметил)пиррол-3-карбонитрил;
4-Бром-2-(4, 5-дибром-2-тиенил)-5-(трифторметил)пиррол-3-карбонитрил;
2-(п-хлорфенил)-3-нитро-4-(5-нитро-2-тиенил)-5-(трифторметил)пиррол; и
4-Бром-2-хлор-5-(5-хлор-2-тиенил)пиррол-3-карбонитрил.
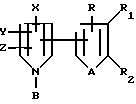
где R, R1, R2, A, X, Y, Z и B описаны в п.1.

Комментарии