Производные 2-[4-(4-азолилбутил)-1-пиперазинил]-пиримидина или их физиологически приемлемые соли, способ их получения и фармацевтическая композиция на их основе - RU2118318C1
Код документа: RU2118318C1
Описание
Изобретение относится к новым производным 2-[4-(4-азолилбутил)-1-пиперазинила] -пиримидина общей формулы I, к способу их получения, а также к содержащим их фармацевтическим
составам,

где
R1 представляет гидроксильный радикал, X2 представляет атом азота или группу C-R2, X4 представляет атом азота или группу C-R4, X5 представляет атом азота или группу C-R5, и R2, R3, R4 и R5, идентичные или различные, представляют атом водорода, галоген, радикал низшего алкила, радикал нитро, радикал гидрокси, радикал алкокси, радикал циано, карбоксильный радикал, радикал карбоксамида, радикал алкилкарбоксилата, радикал арила, радикал сульфонамидо, радикал амино или замещенного амино.
Алкильные группы вышеназванных радикалов представляют преимущественно группы низших алкилов с прямой или разветвленной цепью с C1-C6. Под арилом подразумевают преимущественно радикал фенила, замещенный в случае необходимости, или ароматический гетероцикл, содержащий 5-6 звеньев и по меньшей мере атом азота.
Соединения согласно изобретению, могут быть использованы в фармацевтической промышленности в качестве промежуточных продуктов синтеза для приготовления фармацевтических композиций.
Известны различные циклические амиды с анксиолитической активностью,
производные
арилпиперазинов общей формулы II
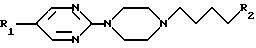
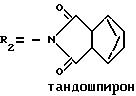
такие как бушпирон (Drugs of the Future, 1976, 1, 409), гепирон (Drugs of tht Future, 1985, 10, 456), ипсапирон (Drugs of tht Future, 1986, 11, 565), тандошпирон (Drugs of tht Future, 1989, 14, 1148), в которых R1 представляет атом водорода и R2 указан ниже для каждого из них:



Известен также класс арил-(о-гетероарил)-пиперазинил-алкилазолов, применяемых в качестве небензодиазепиновых агентов для лечения состояний страха (европейские патенты NN EP 382637, 497659 и 502786). Кроме того, эти соединения используют также для лечения других расстройств поведения (европейские патенты NN 429360 и 497658). Некоторые из наиболее интересных соединений представляют собой азолы, замещенные в 1-положении группой пиримидинил-пиперазинил-бутила, формулы I, в которой R1 представляет атом водорода и X2, X4, X5, R2, R3, R4 и R5 имеют указанные выше значения.
Особенно интересным соединением является лезопитрон (E-4424), соединение общей формулы I, в которой R1 представляет атом водорода, X2 представляет группу CR2, X4 представляет группу CR4, X5 представляет атом азота, R2 и R4 представляют водород и R3 представляет хлор. Было обнаружено, что лезопитрон имеет очень широкий и более сильнодействующий профиль активности, чем бушпирон или ипсапирон (ср. B. Costall и др. J. Pharmacol. Experimental Therapeutics, 1992, 262, 90).
Указывается, что соединения общей
формулы II подвергаются
биопревращению "в живом организме", с образованием двух типов метаболитов. Один из метаболитов представляет собой пиримидил-пиперазин формулы III

соединение, которое проявляет активность как биохимическую, так и фармакологическую, как было описано в многочисленных научных публикациях, среди которых в качестве примеров называют следующие: E. Tatarczynska и др. Pol. J. Pharmacol Pharm. 1989, 41, 51; A. Diaz-Marot и др. J. Chromatogr. 1989, 490, 470; S. Caccia и др. Acta Pharm. Jugosl., 1990, 40, 441; H. Nocon и др. J. Pharm. Pharmacol. 1990, 42, 642.
Другой метаболит названных выше соединений общей формулы II представляет собой соответствующее 5-гидрокси производное общей формулы II, в которой R1 означает гидроксильный радикал и R2 имеет упомянутые выше значения. В противоположность тому, что происходит с соединением III, было показано, что соединения общей формулы II, в которых R1 представляет радикал гидроокиси, являются биологически неактивными. Это поведение обычно наблюдают, когда гидроксилируют ароматические соединения в метаболическом процессе (например, Drug Metabolism. Chemical and Biochemical Aspects. B.Testa et P. Jenner, Marcel Dekker Inc. Нью-Йорк, 1976). В качестве библиографии, относящейся к биологической неактивности соединений II, в которых R1 представляет гидроксильный радикал и R2 имеет указанные выше значения, можно назвать: R.E. Gammans и др. The American Journal of Medicine, 1986, 80(3B), 41; C.P. Vander Maelen и др. Eur. J. Pharmacol., 1986, 129, 123; K. Ishizumi и др. Chem. Pharm. Bull. , 1991, 39, 228; H.K. Jajoo, Drug Metabolism & Disposition, 1989, 17, 625; H.K. Jajoo, Drug Metabolism & Disposition, 1989, 17, 634.
Теперь обнаружено, что новые производные 2-[4-(4-азолилбутил)-1-пиперазинил] -5-гидроксипиримидина общей формулы I, в которой R1 представляет гидроксильный радикал, и X2, X4, X5, R2, R3, R4 и R5 имеют указанные выше значения, и которые являются предметом изобретения, представляют собой метаболиты соединений, описанных в патентах заявителя (EP 382637 и EP 497659) и имеющих неожиданно биологическую активность относительно центральной нервной системы, в частности, анксиолитическое и успокаивающее действие, позволяющее использовать их в терапии для лечения заболеваний, которые затрагивают центральную нервную систему млекопитающих.
Новые производные общей формулы I, в которой R1 представляет гидроксильную
группу и X2, X4, X5, R2, R3, R4 и R5 имеют указанные выше значения, можно получать по изобретению следующей схемной
реакции:
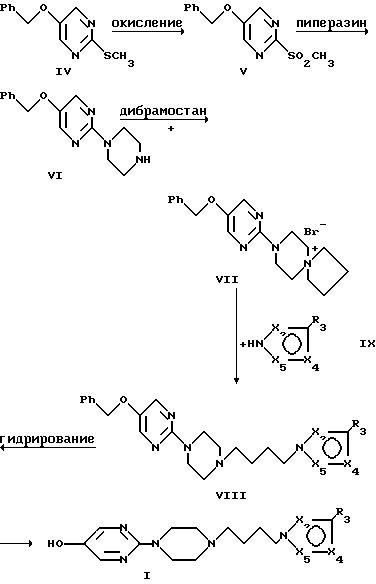
Исходный продукт представляет собой 5-бензилокси-2-метилтиопиримидин IV, который можно получать, исходя из хлористого бензилоксиацетила, последовательностью реакций, описанных J.H. Chesterfield и др. J. Chem. Soc., 1960, 4590 и D.T, Hurst и др. J. Chem. Soc., 1965, 7116.
Соединение V. Получение 5-бензилокси-2-метилсульфонилпиримидина.
В раствор 46,88 г (135,8 ммол) 50%-ной м-хлорнадбензойной кислоты в воде добавляют 15,76 г (67,9 ммол) 5-бензилокси-2-тиометилпиримидина в 240 мл хлороформа. Осуществляют рефлюкс смеси в течение 5 часов, охлаждают и добавляют насыщенный раствор кислого карбоната натрия. Сушат органическую фазу с сульфатом натрия и выпаривают досуха, получая 17,9 г (100% 5-бензилокси-2-метилсульфонилпиримидина.
Данные спектроскопии: инфракрасный спектр IR(Kbr): 1125: 1300 см-1.
Ядерный магнитный резонанс ЯМР-1H ( δ, , CDCl3): 8,58 (с, 2H); 7,41 (а. с., 5H); 5,27 (с, 2H); 3,30 (с, 3H).
Соединение VI. Получение 5-бензилокси-2-пиперазинилпиримидина.
Осуществляют рефлюкс в течение 3 часов раствора 26,36 г (99,8 ммол) и 85 г (99,8 ммол) пиперазина в 185 мл толуола. Оставляют для охлаждения, фильтруют и концентрируют. Из раствора кристаллизуют 19,84 г (73%) 5-бензилокси-2-пиперазинилпиримидина. Перекристаллизованный из гексана продукт имеет точку плавления 86-91oC.
Данные спектроскопии: ИК (KBr): 1267, 144 см-1.
ЯМР -1H ( δ, , CDCl3): 8,11 (с, 2H); 7,36 (а.с., 5H); 5,00 (с, 2H); 3,67 (т, 4H); 2, 90 (т, 4H).
Соединение VII. Получение бромистого 8-(5-бензилокси-2-пиримидинил)-8-аза-5-азониаспиро[4,5]декана.
Осуществляют рефлюкс в течение 8 часов раствора 7,25 г (26,85 ммол) 5-бензилокси-2-пиперазинилпиримидина и 3,2 мл (26,85 ммол) 1,4-дибромбутана в 240 мл хлороформа и 7,42 г (53,7 ммол) карбоната калия. Охлаждают, фильтруют, выпаривают досуха и перемешивают с простым этиловым эфиром, получают 16,0 г (91%) бромистого 8-(5-бензилокси-2-пиримидинил)-8-аза-5-азониаспиро[4,5]декана с точкой плавления 128-133oC.
Данные спектроскопии: ИК (KBr): 1268, 1451 см-1.
ЯМР -1H ( δ, CDCl3)): 8,13 (с, 2H); 7,38 (а.с., 5H); 5,03 (с, 2H); 4,01 (а.с., 8H); 3,77 (т, 4H); 2, 35 (т, 4H).
Соединение VIII. Получение 2-{4-[4-(азол-1-ил)-бутил]-1-пиперазинил]-5-бензилоксипиримидина.
Реакцией бромистого
8-(5-бензилокси-2-пиримидинил)-8-аза-5-азониаспиро[4,5]декана формулы VII с азолом общей формулы
IX

в которой
X2 представляет атом азота или группу C-R2, X4 представляет атом азота или группу C-R4, X5 представляет атом азота или группу C-R5, и R2, R3, R4 и R5, идентичные или различные, представляют атом водорода, галоген, радикал низшего алкила, радикал нитро, радикал гидрокси, радикал алкокси, радикал циано, карбоксильный радикал, радикал карбоксамида, радикал алкилкарбоксилата, радикал арила, радикал сульфонамида, радикал амино или замещенного амино, получают соединение общей формулы VIII, в которой X2, X4, X5, R2 , R3, R4 и R5 имеют упомянутые выше значения. Реакцию осуществляют в растворителе с высокой точкой кипения и в присутствии органического или неорганического основания.
Соединение I. Получение 2-{4-[4-азол-1-ил)бутил]-1-пиперазинил}-5-гидроксипиримидина.
Каталитическим гидрированием соединения общей формулы VIII получают соединение общей формулы I. В двух соединениях X2, X4, X5, R2, R3, R4 и R5 имеют упомянутые выше значения. Реакцию осуществляют в таком растворителе, как спирт, при температурах между 15 и 60oC, при давлениях между 1 и 15 атмосфер.
В следующих примерах показано получение новых производных по изобретению. Примеры, которые представлены ниже, данные просто в качестве иллюстрации, не должны однако никоим образом ограничивать объем изобретения.
Пример 1. Получение 2-{4-[4-(4-хлор-пиразол-1-ил)бутил]-1-пиперазинил} -5-гидроксипиримидина.
Выдерживают в течение 12 часов при флегме и фильтруют в горячем состоянии смесь из 12,55 г (30,94 ммол) бромистого 8-(5-бензилокси-2-пиримидинил)-8-аза-5-азониаспиро[4,5] декан, 3,48 г (34,03 ммол) 4-хлорпиразола и 8,54 г (61,89 ммол) карбоната калия в 250 мл диметилформамида. Выпаривают диметилформамид и хроматографируют с силикагелем, получают 6,82 г (51,6%) 2-{4-[4-(4-хлорпиразол-1-ил)бутил]-1-пиперазинил}-5-бензилоксипиримидина.
Данные спектроскопии: ИК (KBr): 1256, 1270, 1363, 1447, 1482 см-1.
ЯМР -1H ( δ, CDCl3): 8,11 (с, H2); 7,40 (с, 1H); 7,38 (а.с., 5H); 7,27 (с, 1H); 5,02 (с, 2H); 4,11 (т, 2H); 3,73 (м, 4H); 2,48 (м, 4H); 2,38 (т, 2H); 1,89 (квинт., 2H); 1,52 (квинт., 2H).
Перемешивают в течение 12 часов в атмосфере водорода, при комнатной температуре (24oC) и при давлении 2 атмосферы смесь из 6,87 г (16,07 ммол) 2-{4-[4-(4-хлорпиразол-1-ил)-бутил]-1-пиперазинил}- 5-бензилоксипиримидина и 0,63 г 10%-ного палладия на угле в 160 мл этанола. После фильтрования, промывки этанолом и выпаривания досуха хроматографируют с силикагелем и получают 2,65 г (49%) 2-{4-[4-(4-хлорпиразол-1-ил)бутил]-1-пиперазинил}-5-гидроксипиримидина с точкой плавления 131-132oC.
Данные спектроскопии: ИК (KBr): 1258, 1271, 1364, 1428 см-1.
ЯМР -1H ( δ, CDCl3): 7,99 (с, 2H); 7,40 (с, 1H); 7,36 (с, 1H); 4,06 (т, 2H); 3,66 (т, 4H); 2,49 (т, 4H); 2,37 (т, 2H); 1,84 (квинт., 2H); 1,49 (квинт., 2H).
Пример 2.
Получение 2-{ 4-[4-(4, 5-дихлор-2-метилимидазол-1-ил)бутил]- 1-пиперазинил}-5-гидроксипиримидина.
Выдерживают в течение 12 часов при флегме и фильтруют в горячем состоянии смесь из 3,59 г (8,85 ммол) бромистого 8-(5-бензилокси-2-пиримидинил)-8-аза-5-азониаспиро[4,5] декана, 1,47 г (9,73 ммол) 4,5-дихлор-2-метилмидазола и 4,89 г (35,41 ммол) карбоната калия в 72 мл диметилформамида. Выпаривают диметилформамид и хроматографируют с силикагелем, получают 2,90 г (69%) 2-{4-[4-(4,5-дихлор-2-метилимидазол-1-ил)бутил]-1-пиперазинил}- 5-бензилоксипиримидина.
Данные спектроскопии: ИК (KBr): 1033, 1050, 1231, 1412, 1580 см-1.
ЯМР -1H ( δ, CDCl3): 8,11 (с, 2H); 7,37 (а.с., 5H); 5,01 (с, 2H); 3,80 (т, 2H); 3,72 (м, 4H); 2, 48 (м, 4H); 2,36 (т, 2H); 2,36 (с, 3H); 1,65 (м, 4H).
Перемешивают в течение 12 часов в атмосфере водорода при комнатной температуре (24oC) и при давлении 0,28 MPa смесь из 2,90 г (6,10 ммол) 2-{ 4-[4-(4,5-дихлор-2-метилимидазол-1-ил)бутил- 1-пиперазинил} -5-бензилоксипиримидина и 0,30 г 10%-ного палладия на угле в 50 мл метанола. После фильтрования, промывки метанолом и выпаривания досуха хроматографируют с силикагелем и получают 1,39 г (59%) 2-{4-[4-(4,5-дихлор-2-метилимидазол-1-ил)бутил]-1-пиперазинил}- 5-гидроксипиримидина с точкой плавления 154-6o C.
Данные спектроскопии: ИК (KBr): 1250, 1277, 1355, 1408, 1429, 1445, 1469 см-1.
ЯМР -1H ( δ, CDCl3): 8,00 (с, 2H); 3,84 (т, 2H); 3, 65 (м, 4H); 2,49 (м, 4H); 2,39 (т, 2H); 2,32 (с, 3H); 1,69 (квинт., 2H); 1,55 (квинт., 2H).
В результате обработки 0,52 г (1,36 ммол) полученного выше продукта, растворенного в 15 мл этанола, 37%-ной соляной кислотой получают 0,43 (75%) монохлоргидрата 2-{4-[4-(4,5-дихлор-2-метилимидазол- 1-ил)бутил]-1-пиперазинил}-5-гидроксипиримидина с точкой плавления 212-6o C.
Данные спектроскопии: ИК (KBr): 1244, 1269, 1363, 1441, 1474 см-1.
ЯМР -1H ( δ, CDCl3): 11,21 (а, 1H); 9,63 (с, 1H); 8,12 (с, 2H); 4, 45 (м, 2H); 3,94 (м, 2H); 3,41 (м, 4H); 3,08 (м, 4H); 2,34 (с, 3H), 1,71 (м, 4H).
Биологическая активность.
Выявляют биологическую активность с мыши в опыте в светлой/темной камере, описанном B. Costall и др., J. Pharmacology and Experimental Therapeutics, 1992, 262, 90. Опыт осуществляют, как описано в упомянутой публикации. С более подобным методом работы можно ознакомиться также B. Costall и др. , Pharmacol. Biochem. Behav., 1989, 32, 777. Соединения назначают внутрибрюшинно и отмечают результаты в виде минимальной дозы, при которой наблюдают активность.
Соединение - Минимальная доза
Диазепам - 0,125
Ипсапирон - 0,5
Бушпирон - 0,125
Лезопитрон (E-4424) - 0,0001 - 0,000001
Пример
1. Учитывая их сильное фармакологическое действие, новые соединения согласно изобретению могут быть использованы в терапии человека и животных, в частности, при лечении нарушений центральной нервной
системы и особенно для лечения тревоги или как успокоительные средства.
В лечении человека назначаемая доза зависит, разумеется, от серьезности заболевания. Она может составлять приблизительно между 2 и 20 мг в день. Соединения, предметы изобретения, могут выпускаться в форме таблеток, капсул, растворов или суспензий. Ниже показаны в качестве примера две галеновые формы для соединений по изобретению.
3. Пример состава для таблеток.
Соединение примера 1 - 5 мг
Лактоза - 60 мг
Микрокристаллическая целлюлоза - 25 мг
Повидон - 5 мг
Предварительно желатинированный крахмал - 3 мг
Коллоидальная двуокись кремния - 1 мг
Стеарат магния - 1 мг
Вес таблетки - 100 мг
4. Пример
состава для капсулы.
Соединение примера 1 - 10 мг
Полиоксиэтиленглицерид - 135 мг
Бегенат глицерина - 5 мг
Эксципиент: желатина - 150 мг
Токсичность
определена на примере 2-{4-(4-азол-1-ил)бутил-1-пиперазинил} -5-гидроксипиримидина.
Летальная доза, поражающая 50% животных, составляет для мыши 712 мг/кг орально, 215 мг/кг интраперитонально; для крысы 385 мг/кг орально, 126 мг/кг интраперитонально.
Таким образом, описываемые соединения можно отнести к категории слаботоксичных.
Реферат
Использование: в медицине, как обладающие анксиолитической или успокаивающей активностью. Сущность изобретения: производные 2-[4-(4-азолилбутил)-1-пиперазинил] пиримидина
формулы I
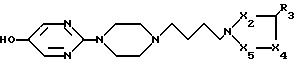
в которой X2 - CR2, где R2 - водород, галоген;
X4 - N, CR4, где R4 - водород,
X5 - N или CR5, где R5 - низш. алкил;
R3 - галоген или их физиологически приемлемые соли;
Способ получения соединения I: осуществляют окисление 5-бензилокси-2-тиометилпиримидина в соответствующий сульфон, замещают радикалметилсульфона пиперазином, полученный продукт вводят во взаимодействие с дибромбутаном и образующийся при этом бромистый 8-(5-бензилокси-2-пиримидинил)-8-аза-5-азониаспиро (4,5) декан конденсируют с азолом формулы


Комментарии