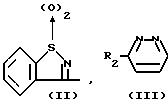
Простые эфиры (тио)морфолинил- или пиперазинил алкилфенолов, или их стереоизомеры, или их кислотно-аддитивные соли и антивирусная композиция - RU2057130C1
Код документа: RU2057130C1
Чертежи
Описание
Известны противовирусноактивные пиридазинамины (заявка на Европейский патент N 0156433) и другие противовирусные средства (патент США N 4451476, заявка на Европейский патент N 0137242 и заявка на Европейский патент N 0207453).
Предлагаемые соединения отличаются от известных тем, что они содержат (тио)-морфолинильный или пиперазинильный остаток, который замещается по ранее нераскрытым возможностям, и в особенности их благоприятными антириновирусными свойствами.
Изобретение относится к простым эфирам (тио)-морфолинил- и
пиперазинил-алкилфенолов формулы
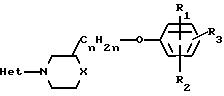
R
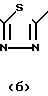
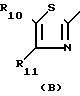
R6 является водородом, С1-С4 -алкилом, галоидом, оксигруппой, трифторметилом, цианогруппой, С1-4 -алкилокси-, С1-4-алкилтиогруппой, С1-4-алкилтионилом (алкилсульфонилом), С1-4 -алкилсульфонилом, С1-4-алкилоксикарбонилом, С1-4-алкилкарбонилом или арилом;
R7 и R8 каждый независимо является водородом или С1-4 -алкилом;
R9 является водородом, галоидом, аминогруппой, С1-4 -алкилом, трифторметилом или арилом;
R10 является водородом, галоидом, амино- или нитрогруппой;
R11 является водородом, С1-4-алкилом, С1-4 -алкилоксикарбонилом или арилом;
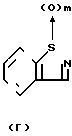
m является 0, 1 или 2;
Х является 0, S или NR5, причем R5 является водородом, С1-4-алкилом или арил-С1-4 -алкилом;
n является целым числом от 1 до 4 включительно;
R1 и R2 каждый независимо является водородом, С1-4-алкилом или галоидом;
R3 является водородом, галоидом, циано-С1-4-алкилоксигруппой, арилом или -СОOR4, причем R4 является водородом, С1-4-алкилом, арил-С1-4 -алкилом, С3-6-циклоалкил-С1-4-алкилом, С3-5-алкенилом, С3-5 -алкинилом, или С1-4-алкилокси-C1-4-алкилом, или R3 является радикалом формулы
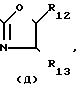
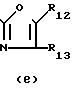
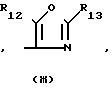
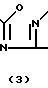
R12 и R13 каждый независимо является водородом, С1-4-алкилом, арилом или арил-С1-4-алкилом;
каждый арил является фенилом, необязательно замещенным одним или двумя заместителями, каждый независимо выбираемый из галоида, С1-4-алкила, трифторметила, С1-4-алкилокси или оксигруппы.
Используемый в приведенных определениях термин "галоид" является общим для фтора, хлора, брома и йода; термин "С1-4 -алкил" определяет линейные и разветвленно-цепные насыщенные углеводородные радикалы, имеющие от 1 до 4 атомов углерода, такие как метил, этил, пропил, 1-метилэтил, бутил, 1,1-диметилэтил и другие; термин "С3-6-циклоалкил" определяет циклопропил, циклобутил, циклопентил и циклогексил; термин "С3-5-алкенил" определяет линейно- и разветвленно-цепные углеводородные радикалы, содержащие одну двойную связь и имеющие от 3 до 5 атомов углерода, такие как 2-пропенил, 3-бутенил, 2-пентенил, 3-пентенил; 3-метил-2-бутенил и другие; термин "С3-5-алкинил" определяет линейно- и разветвленно-цепные углеводородные радикалы, содержащие одну тройную связь и имеющие от 3 до 5 атомов углерода, такие как пропаргил, 2-бутинил, 3-бутинил, 2-пентинил, 4-пентинил или 3-пентинил, и когда С3-5-алкенил или С3-5 -алкинил замещается на гетероатом, то атом углерода указанного С3-5-алкенила или С3-5-алкинила, связанный с указанным гетероатомом, предпочтительно является насыщенным.
Соединения формулы (I) могут содержать по их структуре кето-энольную таутомерную систему и, следовательно, указанные соединения могут находиться в их кето-форме, а также в их энольной форме.
В указанные соли присоединения кислот намереваются включать терапевтически активные и в особенности фармацевтически приемлемые нетоксичные солевые формы при присоединении кислот, которые соединения формулы (I) способны образовывать. Соли присоединения кислот могут быть получены путем обработки основной формы соответствующими кислотами, такими как неорганические кислоты, такие как галоидоводородная кислота, хлористоводородная, бромистоводородная и тому подобные, и серная кислота, азотная кислота, фосфорная кислота и тому подобные; или органические кислоты, такие как уксусная, оксиуксусная (гликолевая), пропионовая, 2-оксипропионовая, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, n-толуолсульфоновая, циклогексансульфаминовая, салициловая, 4-амино-2-оксибензойная и тому подобные кислоты. И, наоборот, солевая форма может быть превращена путем обработки щелочами в свободную основную форму. Соединения формулы (I), содержащие кислотные протоны, такие могут быть превращены в их терапевтически активные и в особенности фармацевтически приемлемые нетоксичные металлические или аминовые солевые формы путем обработки соответствующими органическими и неорганическими основаниями. Солевые формы соответствующих оснований включают, например, аммонийные соли, соли щелочных и щелочноземельных металлов, например соли лития, натрия, калия, магния, кальция и тому подобные; соли с органическими основаниями, например соли бензатинa, N-метил-Д-глюкомина, гидрабамина и, соли с аминокислотами, такими как аргинин, лизин и тому подобные. Термин "соль присоединения кислоты" включает также гидратные формы и сольватные формы, которые соединения формулы (I) способны образовывать. Примерами таких форм являются гидраты, алкоголяты и тому подобные.
Из формулы (I) становится очевидным, что предлагаемые соединения имеют по меньшей мере один асимметрический атом углерода, а именно замещенный атом углерода, расположенный в положении 2 (тио)-морфолинильного или пиперазинильного ядра. Абсолютная конфигурация этого центра может быть показана стереохимическими символами R и S, причем эта система обозначений R и S соответствует известным правилам (Pure and Appl. Chem. 1976, v. 45, p. 11-30). Если не указано или не показано особо, химическое обозначение соединений определяет смесь всевозможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры.
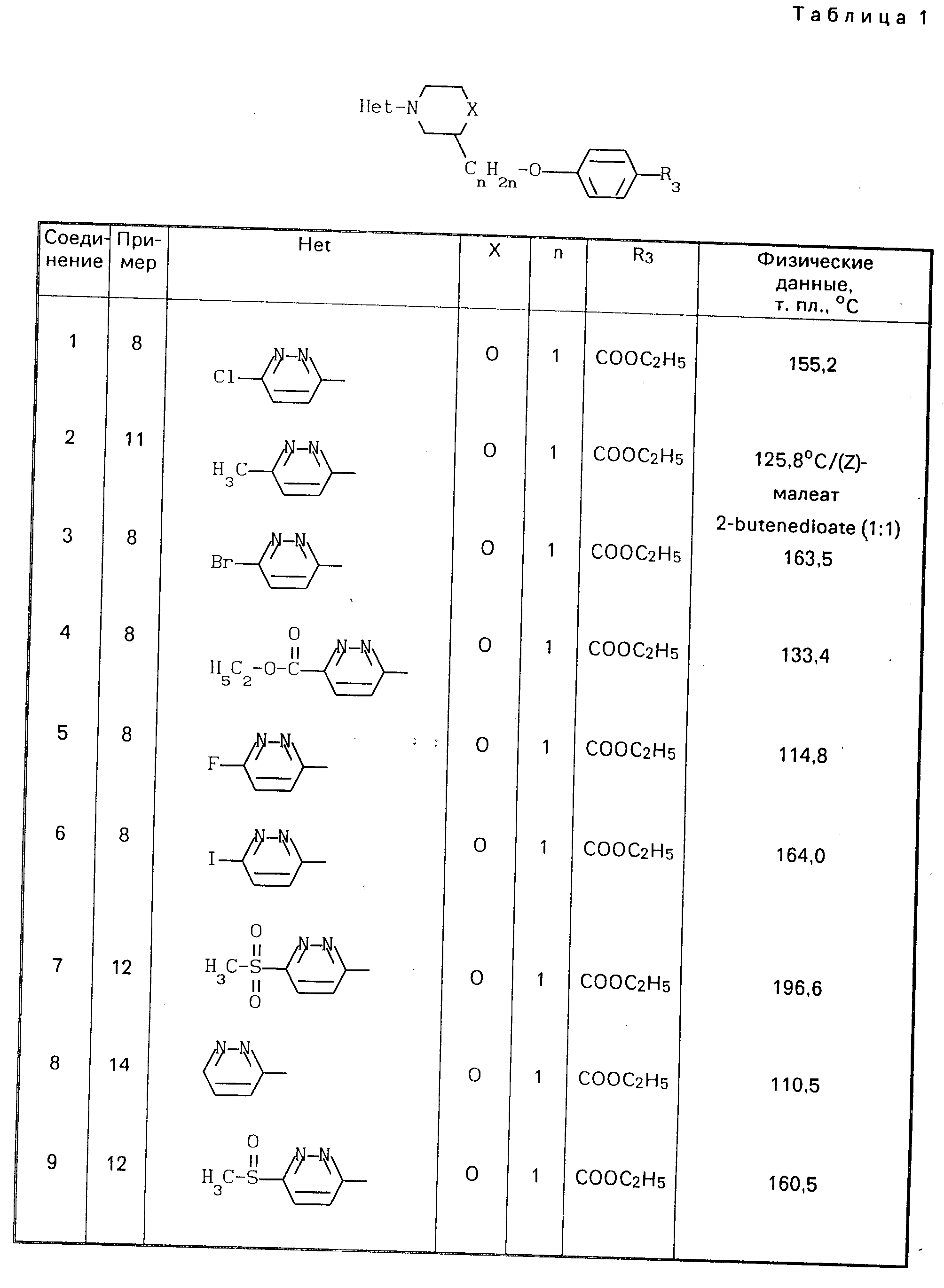
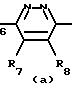
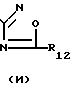
Особыми соединениями формулы (I) являются те соединения, в которых Het является радикалом формулы (а), в которой R6 представляет водород, С1-4-алкил, С1-4-алкилтио-группу, галоид, С1-С4-алкилтионил или С1-4-алкилсульфонил, а R7 и R8 оба являются водородом; или радикалом формулы (б), в которой R9 представляет водород, галоид, С1-4-алкил, С3-5-алкенил, С3-5-алкинил или С1-4 -алкилокси-С1-4 -алкил, или R3является гетероциклом формулы (д), (е), (ж), (з), или (и) в которой R12и R13 каждый независимо представляет водород или С1-4-алкил, причем указанный R3 предпочтительно располагается в положении 4.
Среди вышеприведенных подгрупп предпочтительными являются те соединения формулы (I), в которой Неt является радикалом формулы (а), в которой R6 представляет С1-4-алкил, галоид или С1-4-алкилтио-группу, или радикалом формулы (б), в которой R9 представляет С1-4-алкил или галоид; и/или R1 и R2 оба являются водородом; и/или R3 является С1-4-алкилоксикарбонилом или 1,2, 4-оксадиазол-5-илом-формулы (з) с R12, являющимся С1-4-алкилом; и/или n является 1, 2 или 3.
Более предпочтительными соединениями формулы (I) являются соединения, в которых Het является радикалом формулы (а), в которой R6представляет метил, хлор, бром, йод или метилтиогруппу, или радикалом формулы (б), в которой R9 представляет метил, хлор, бром или йод; и/или n является 1 или 2.
Особенно предпочтительными соединениями являются соединения, в которых Неt является радикалом формулы (а); в которой R6 представляет йод, бром или метилтиогруппу; или радикалом формулы (б), в которой R9представляет метил или бром; n является 2; а R3 является метоксикарбонилом, этоксикарбонилом или 3-этил-1,2, 4-оксадиазол-5-илом.
Наиболее предпочтительные соединения выбираются из этилового эфира 4-[2-[4-(6-йод-3-пиридазинил)-2-морфолинил] -эток- си]-бензойной кислоты, этилового эфира 4-[2-[4-[6-(метолтио)-3-пиридазинил]-2-морфо- линил]-этокси]-бензойной кислоты, их стереохимически изомерных форм и фармацевтически приемлемых солей при присоединении кислот.
Соединения формулы (I) в большинстве случаев могут быть получены путем взаимодействия амина формулы (II) с гетероциклом формулы (III) согласно общеизвестным методикам N-алкилирования
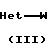
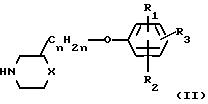

В этой и следующих схемах реакций W представляет соответствующую реакционноспособную отщепляемую группу, такую как галоид, например фтор, хлор, бром, йод, или в некоторых случаях W может быть также сульфонилоксигруппой, например 4-метилбензолсульфонилокси-, бензолсульфонилокси-, 2-нафталинсульфонилокси-, метансульфонилокси-, трифторметаносульфонилокси- и подобные реакционноспособные уходящие группы.
Реакция N-алкилирования может быть проведена путем смешивания реагирующих веществ возможно в растворителе, инертном к реакции, таком как вода; ароматический растворитель, например бензол, толуол, диметилбензол, хлорбензол, метоксибензол и тому подобные; С1-6-алканол, например метанол, этанол, 1-бутанол и тому подобные; кетон, например 2-пропанон, 2-бутанон, 4-метил-2-пентанон и тому подобные; сложный эфир, например этилацетат, γ -бутиролактон и тому подобные; эфир, например диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и тому подобные; диполярный апротонный растворитель, например N,N-диметилформамид, N, N-диметилацетамид, диметилсульфоксид, пиридин, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н), пиримидинон, 1,3-диметил-2-имидазолидинон, 1,1,3, 3-тетраметилмочевина, 1-метил-2-пирролидинон, нитробензол, ацетонитрил и тому подобные; или смесь таких растворителей. Добавление соответствующего основания, такого как карбонат, гидрокарбонат, гидроокись, окись, карбоксилат, алкоксид, гидрид или амид щелочного металла или щелочноземельного металла, например карбонат натрия, гидрокарбонат натрия, карбонат калия, гидроокись натрия, окись кальция, ацетат натрия, метилат натрия гидрид натрия, амид натрия и тому подобные, или органического основания, такого как третичный амин, например N, N-диэтилэтанамин (триэтиламин), N-(1-метилэтил)-2-пропанамин, 4-этилморфолин, 1,4-диазабицикло-2,2,2-октан, пиридин и тому подобные, необязательно может быть использовано, чтобы связывать кислоту, которая образуется во время протекания реакции. В некоторых случаях добавление йодидной соли, предпочтительно йодида щелочного металла, или краун-эфира, например 1,4,7,10,13,16-гексаоксациклооктадекана и тому подобных, может быть желательным. Перемешивание и относительно повышенные температуры могут повышать скорость реакции, более конкретно реакция может быть проведена при температуре кипения реакционной смеси с обратным холодильником. Дополнительно может быть целесообразным проведение указанной реакции N-алкилирования в инертной атмосфере, такой как аргон или азот, не содержащий кислорода.
Дополнительно реакция N-алкилирования может быть проведена применением общеизвестных условий реакций межфазного катализа. Указанные условия включают перемешивание реагирующих веществ вместе с соответствующим основанием и необязательно в инертной атмосфере, как это определено выше, в присутствии подходящего межфазного катализатора, такого как галогенид, гидроокись, кислый сульфат триалкилфенилметиламмония, тетраалкиламмония, тетраалкилфосфония, тетраалкилфосфония и тому подобных катализаторов. Относительно повышенные температуры могут быть уместными, чтобы повысить скорость реакции.
В этой и следующих методиках получения продукты реакции могут быть выведены из реакционной смеси и, если это необходимо, дополнительно очищены по методикам, в большинстве случаев известным в данной области техники, таким как экстракция, перегонка, кристаллизация, растирание в порошок и хроматография.
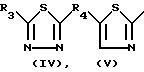
Соединения формулы (I) могут быть по- лучены также алкилированием фенола формулы (V) интермедиатом формулы (IV).
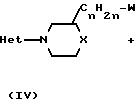
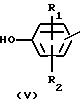
Указанная реакция 0-алкилирования может быть проведена смешиванием реагирующих веществ, возможно в инертном к реакции растворителе, таком как вода; ароматический растворитель, например бензол, толуол, диметилбензол и тому подобные; С1-6-алканол, например метанол, этанол и тому подобные; кетон, например 2-пропанон, 4-метил-2-пентанон и тому подобные; сложный эфир, например этилацетат, γ -бутиролактон и тому подобные; эфир, например диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и тому подобные; диполярный апротонный растворитель, например N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и тому подобные; или в смеси таких растворителей. Добавление соответствующего основания, такого как карбонат, гидрокарбонат, гидроокись, окись, карбоксилат, алкоксид, гидрид или амид щелочного металла или щелочноземельного металла, например карбонат натрия, гидрокарбонат натрия, карбонат калия, гидроокись натрия, окись кальция, ацетат натрия, метилат натрия, гидрид натрия, амид натрия и тому подобные, или органического основания, такого как третичный амин, например триэтиламина, N-(1-метил-этил)-2-пропанамина и тому подобных, необязательно может быть использовано, чтобы связывать кислоту, которая образуется во время протекания реакции. Кроме того, может быть целесообразным превращение промежуточного соединения формулы (V) сначала в соответствующую солевую форму его, такую как соль щелочного металла или щелочноземельного металла, путем взаимодействия (V) с соответствующим основанием, как это определено выше, и впоследствии использование указанной солевой формы в реакции с алкилирующим реагентом формулы (IV). Перемешивание и относительно повышенные температуры могут повышать скорость реакции, более конкретно реакция может быть проведена при температуре кипения с обратным холодильником реакционной смеси. Дополнительно, может быть целесообразным проведение указанной реакции алкилирования в инертной атмосфере, такой как аргон или азот, не содержащий кислорода.
Дополнительно указанная реакция 0-алкилирования может быть проведена применением общеизвестных условий реакций межфазного катализа, как это описано выше.
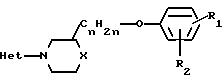
Соединения формулы
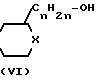
(I) альтернативно могут быть получены путем взаимодействия фенола формулы (V) со спиртом формулы (VI) в присутствии смеси диэтилового эфира азодикарбоновой кислоты и
трифенилфосфина
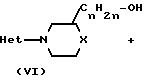
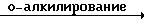
Реакция (VI) c (V) может быть проведена в безводном инертном к реакции растворителе предпочтительно при мягких нейтральных условиях и комнатной температуре или ниже. Подходящим инертным в реакции растворителем является алифатический углеводород, например гексан и тому подобные; простой эфир, например диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, 1,4-диоксан и тому подобные; диполярный растворитель, например гексаметилфосфортриамид, N,N-диметилформамид и тому подобные; или смесь таких растворителей.
Соединения формулы (I) могут быть получены также путем взаимодействия спирта формулы (VI) с соответствующим реагентом формулы (VII) согласно описанным выше методикам О-алкилирования для получения (I) из (IV) и (V).
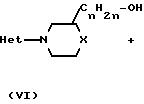
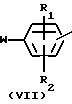
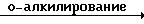
Соединения формулы (I), в которой Х представляет NR5 или S, причем указанные соединения представляются соответственно формулой (I-I) и (I-2), могут быть получены путем превращения двух спиртовых функциональных групп промежуточного (VIII) в соответствующие уходящие группы с помощью соответствующих галоидирующих агентов, таких как хлористый тионил, хлористый сульфурил, пятихлористый фосфор, пятибромистый фосфор, или с помощью соответствующего сульфонил-галогенида, такого как хлористый метансульфонил или хлористый 4-метилбензолсульфонил, чтобы получить интермедиаты формулы (IX). Реакция может быть проведена в ароматических углеводородах, таких как толуол, этилбензол и тому подобные; диполярных апротонных растворителях, таких как N,N-диметилформамид, N,N-диметилацетамид и тому подобных, или смесях таких растворителей. В дальнейшем пиперазинильный остаток соединения (I-I) или тиоморфолинильный остаток соединения (I-2) может быть получен циклизацией (IX) соответственно в присутствии амина (NH2R5) или в присутствии сульфида натрия и порошкообразной серы
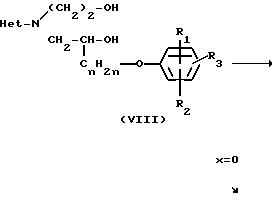
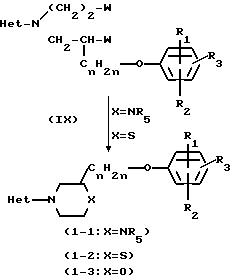
Соединения формулы (I), в которой Х представляет 0, причем указанные соединения представляются формулой (1-3), могут быть получены циклизацией (VIII) в присутствии дегидратирующего агента, такого как смесь диэтилового эфира азодикарбоновой кислоты и трифенилфосфина. Реакция может быть проведена в инертном к реакции растворителе, таком как углеводород, например гексан, хлористый метилен, хлороформ и тому подобные; простой эфир, например диэтиловый эфир, тетрагидрофуран и тому подобные.
Соединения формулы (I) могут быть также превращены друг в друга, следуя общеизвестным методикам превращения функциональных групп.
Соединения формулы (I) в которой R3 является замещенным или незамещенным 4,5-дигидро-2-оксазолилом формулы (е), причем указанные соединения представляются формулой (I-e), могут быть получены, следуя известным методикам (заявка на патент Европы N 207454 и заявка на патент Европы N 137242). Например, соответствующие кислоты, ацилгалогенид или сложный алкиловый эфир могут быть превращены в соответствующие оксилалкиламиды конденсацией с замещенным или незамещенным оксилакиламино. Полученный оксиалкиоламид может быть ин ситу или, если это необходимо, после выделения и очистки его, циклизован путем перемешивания с хлористым тионилом или с треххлористым фосфором необязательно в присутствии подходящего инертного растворителя, такого как простой эфир, например, тетрагидрофуран, 1,4-диоксан и тому подобные; галоидированный углеводород, например хлороформ, хлористый метилен; сложный эфир, например этилацетат, изопропилацетат, и тому подобных растворителей.
Соединения формулы (I), в которой R3 является 1,2,
4,-оксадиазол-5-ильным циклом формулы (h), причем указанные соединения представляются
формулой (I-h), могут быть получены путем взаимодействия соединения формулы (Х), в которой R14
является водородом или С1-4-алкилом, с амидоксимом формулы (XI)
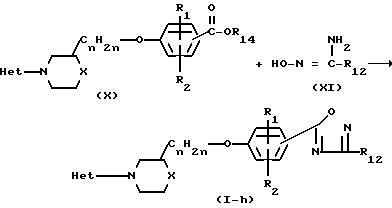
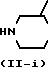
Соединения формулы (I), в которой R3 является 1,2,4-оксадиазол-3-ильным циклом формулы (i), причем указанные соединения представляются формулой (I-i), могут быть получены путем взаимодействия соединения формулы (I), в которой R3 является цианогруппой, представленной формулой (I-k), с гидроксиламином или с его солью при присоединении кислоты и реакцией полученного таким образом амидоксима с карбоновой кислотой формулы (XII) или с ее реакционноспособной функциональной производной, такой как ее галогенидной, ангидридной или сложной орто-эфирной формой.
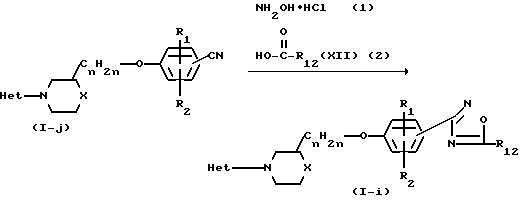
Реакции конденсации для получения соединений (I-h) и (I-i) могут быть проведены путем перемешивания и, если это необходимо, нагревания исходных веществ без или в подходящем инертном к реакции растворителе и необязательно в присутствии соответствующего основания, такого как алкоксида, гидрида или амида, например метилата натрия, этилата натрия, гидрида натрия, амида натрия и тому подобных. Подходящими растворителями для указанных реакций конденсации являются простые эфиры, например диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан и тому подобные; алканолы, например метанол, этанол, пропанол, бутанол и тому подобные; или смеси таких растворителей. Вода, кислота или галоидоводородная кислота, которые выделяются во время реакции конденсации, могут быть удалены из реакционной смеси путем азеотропной перегонки, комплексования, солеобразования и тому подобными методами.
Соединения, в которых R3 является цианогруппой, могут быть гидролизованы, при этом получаются соединения формулы (I), в которой радикал R3 является карбоксильной группой. Указанная реакция гидролиза предпочтительно проводится в водно-кислотной среде, например в водном растворе серной, соляной или фосфорной кислоты, при комнатной температуре или при слегка повышенной температуре. Может быть целесообразным добавление второй кислоты в реакционную смесь, например уксусной кислоты.
Соединения формулы (I), в которой радикал R3 является карбоксильной группой, могут быть превращены в соответствующие ацилгалогениды обработкой подходящим галоидирующим реагентом, таким как хлористый тионил, пятихлористый фосфор и хлористый сульфурил. Указанные ацилгалогениды и указанные кислоты могут быть далее превращены в их производные (соответствующие сложные эфиры) путем взаимодействия указанных кислот или ацилгалогенидов с соответствующим алканолом по общеизвестным методикам реакций этерификации. Указанные реакции наиболее удобно проводятся в соответствующем растворителе, таком как тетрагидрофуран, хлористый метилен, хлороформ, ацетонитрил и тому подобных растворителях.
Соединения формулы (I), в которой радикал R3 является сложноэфирной группой, могут быть превращены в соответствующие карбоновые кислоты, по общеизвестным методикам омыления, например путем обработки исходного соединения водно-щелочным или водно-кислотным раствором.
Соединения формулы (I), в которой Неt является радикалом формулы (а) с R6, являющимся галоидом, могут быть превращены в соединения формулы (I), в которой R6 является водородом, по общеизвестным методикам гидрогенолиза, т. е. путем перемешивания и, если это необходимо, нагревания исходных соединений в подходящем инертном к реакции растворителе, таком как алканол, например метанол или этанол, в присутствии водорода и соответствующего катализатора, такого как палладий на древесном угле или тому подобных катализаторах. Указанные атомы галоида могут быть замещены С1-4-алкилокси- или С1-4-алкилтио-заместителем путем взаимодействия исходного соединения с соответствующим спиртом или тиолом (меркаптаном) или предпочтительно с солью щелочного металла или щелочноземельного металла указанного спирта или меркаптана, необязательно в присутствии соответствующего катализатора, такого как, например, соль меди.
Ряд промежуточных и исходных веществ в приведенных выше методах получения являются известными соединениями, которые могут быть получены по общеизвестным методикам, а некоторые промежуточные являются новыми.
В следующей схеме реакции упоминаются некоторые пути получения промежуточных формул (XV), которые могут быть превращены в промежуточные формулы (II) путем удаления защитной группы Р. Знак Р представляет подходящую защитную группу, которая легко удаляется путем гидрирования или гидролиза. Предпочтительными защитными группами являются, например, способные к гидрогенолизу группы, например фенилметильная, фенилметоксикарбонильная и тому подобные группы, или гидролизуемые группы, например С1-4 -алкилкарбонильная, С1-4-алкилфенилсульфонильная и тому подобные группы.
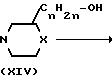
P
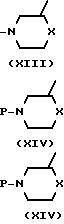
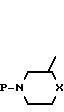


Промежуточные формулы (XV) могут быть получены 0-алкилированием спирта формулы (V) с помощью реагента формулы (XIII), или путем взаимодействия фенола формулы (V) со спиртом формулы (XIV), или альтернативно, путем взаимодействия спирта (XIV) с соответствующим реагентом формулы (VII). Все эти методики описываются выше при получении соединения (I).
Промежуточные формулы (II), в которой R3 является гетероциклом формулы (e), (f), (h) или (i), могут быть получены также путем циклизации соответствующего
алкилфенолового эфира (тио)-морфолинила или пиперазинила (XVI). Например,
интермедиаты формулы (II), в которой R3является 1,2,4-оксадиазол-5-ильным циклом формулы (h), причем указанные
интермедиаты представляются формулой (II-h), могут быть получены также путем
взаимодействия интермедиата формулы (XVI-h) c амидоксимом формулы (XI), как это описано выше для по- лучения (I-h) из (Х) и
(XI)
H
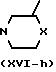
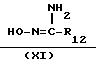
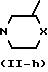
Промежуточные формулы (II), в которой R3 является 1,2,4-оксадиазол-3-ильным циклом формулы (i), причем указанные интермедиаты представляются формулой (II-i), могут быть получены путем взаимодействия интермедиата формулы (XVI-i) с гидроксиамином или с его солью при присоединении кислоты и реакцией полученного таким образом интермедиата с карбоновой кислотой формулы (XII) или с ее функциональным производным, таким как, например, галогенидная, ангидридная или орто-эфирная форма ее. Реакция может быть проведена по той же методике, что и описанная для синтеза (I-i) из (I-j) и (XII)
H
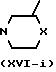
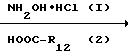
Промежуточные формулы (II), в которой Х является NR5 , причем указанные промежуточные представляются формулой (II-I-a) (R5 является водородом) и (II-I-б) (R5 является другим, чем водород), могут быть получены по следующей схеме реакции.
Промежуточное соединение (XVII) может быть получено путем взаимодействия 2-пиразинового спирта с производным фенола согласно описанным выше методикам реакций. Производное 2-пиразинила формулы (XVII) может быть восстановлено затем с помощью водорода в присутствии соответствующего катализатора, такого как, например, платина на древесном угле, палладий на древесном угле, никель Ренея и тому подобных, в подходящем инертном к реакции растворителе, подобном метанолу или этанолу, чтобы получить производное 2-пиперазинила формулы (II-I-a).
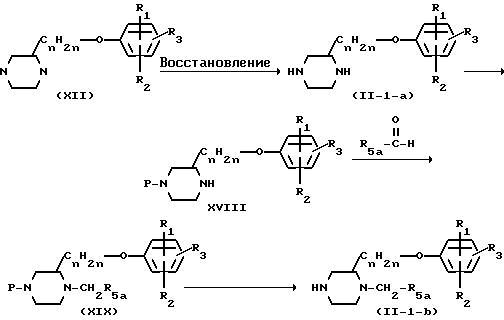
Чтобы алкилировать только N-I-положение производного 2-пиперазинила формулы (II-I-a), необходимо защитить N-4-положение с помощью, например, фенилметильной группы, (арил- или С1-4-алкил)-оксикарбонильной группы и тому подобных. Полученный таким образом интермедиат формулы (XVIII) может быть подвергнут восстановительному N-алкилированию с помощью реагента формулы R5a-CHO, в которой R5a представляет водород, С1-3-алкил, арил- или арил-С1-3-алкил, в инертном к реакции растворителе в присутствии водорода и подходящего катализатора. Указанное промежуточное соединение формулы (XIX) может быть превращено в промежуточные формулы (II-I-б) удалением защитной группы согласно общеизвестным методикам.
Промежуточные формулы (II) могут быть получены также так, как это описано в
следующей схеме реакции:
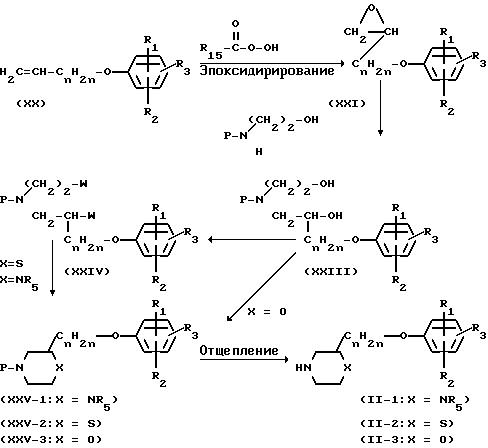
Алкеновый осадок промежуточного (ХХ), полученного путем взаимодействия производного фенола с алкенилгалогенидом, может быть эпоксидирован с пероксикарбоновой кислотой формулы R15-СОООН, чтобы получить оксациклопропан. Радикал R15 является необязательно замещенным арильным кольцом. Указанная реакция окисления может быть проведена в подходящем инертном к реакции растворителе, таком как галоидированный углеводород, например хлористый метилен, хлороформ, 1, 2-дихлорэтан и тому подобные. Реакция оксациклопропанового остатка формулы (XXI) с амином формулы (XXII) дает спиртовое промежуточное формулы (XXIII). Реакция может быть проведена в спиртах, например метаноле, этаноле, 2-пропаноле и тому подобных растворителях, необязательно при температуре кипения растворителя с обратным холодильником. Промежуточные формулы (XXV), в которой Х представляет NR5 или S, причем указанные интермедиаты представляются соответственно формулой (XXV-I) или (ХХV-2), могут быть получены путем превращения двух спиртовых функций (XXIII) в соответствующие уходящие группы. В дальнейшем промежуточные (XXIV) могут быть подвергнуты циклизации в присутствии амина или в присутствии сульфида натрия или порошкообразной серы, чтобы получить соответственно интермедиаты (XXV-I) и (XXV-2), как это описано выше для получения (I-I) и (I-2) из (VIII).
Промежуточные формулы (ХХV), в которой Х представляет 0, причем указанные промежуточные представляются формулой (XXV-3), могут быть получены путем циклизации (ХХIII) в присутствии дегидратирующего агента, как это описано для получения (I-3) из (VIII).
Промежуточные формулы (II-1), (II-2) и (II-3) могут быть получены путем удаления защитной группы Р с помощью реакции гидрирования или гидролиза в зависимости от природы Р.
Промежуточные формулы
(VIII) могут быть получены путем удаления защитной группы Р в формуле (XXIII) с помощью реакции гидрирования или гидролиза и впоследствии N-алкилирования полученного таким
образом амина формулы
(XXVII) с помощью гетероцикла формулы (III), как это описано для получения (I) из (II) и (III)
(XXIII) ___→ HN
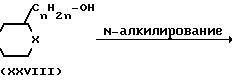
Промежуточные формулы (IV) могут быть получены путем N-алкилирования гетероцикла формулы (III) с помощью амина формулы (ХХVIII), согласно общеизвестным методикам N-алкилирования, описанным выше для по- лучения (I) из (II) и (III), и впоследствии путем превращения спиртовой функции полученного таким образом промежуточного (VI) в соответствующую уходящую группу, как это описано для получения (XXIV) из (ХХIII)
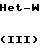
Промежуточные формулы (XIV) могут быть получены путем восстановления карбонильной группы промежуточного (ХХIX), в котором R17является водородом, С1-4-алкилокси- или оксигруппой, с помощью восстановителя, такого как литийалюминийгидрид или натрийборогидрид, в соответствующем инертном к реакции растворителе, например тетрагидрофуране и тому подобных. Спиртовая функция может быть превращена в соответствующую уходящую группу, как это описано выше, таким образом получается интермедиат формулы (XIII)
P-
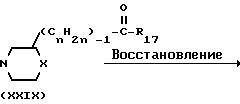
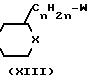
Исходные вещества и промежуточные, используемые во всех предшествующих методиках, могут быть получены по подобным методикам, которые описаны выше для соединения формулы (I), и/или могут быть по- лучены согласно общеизвестным методикам, описанным в литературе для получения подобных известных соединений.
Соединения формулы (I) и некоторые из промежуточных настоящего изобретения имеют по меньшей мере один асимметрический атом углерода, а именно замещенный атом углерода, расположенный в положении 2 (тио)-морфолинильного или пиперазинильного ядра. Стереохимически чистые изомерные формы указанных соединений и указанных промежуточных могут быть получены применением общеизвестных методик. Например, диастереомеры могут быть разделены физическими методами, такими как селективная кристаллизация, или хроматографическими методами, например противоточного распределения, жидкостной хроматографии и тому подобными методами. Энантиомеры могут быть получены из рацемических смесей путем превращения сначала указанных рацемических смесей с помощью соответствующих разделяющих реагентов, таких как хиральные кислоты, в смеси диастереомерных солей или соединений; затем путем физического разделения указанных смесей диастереомерных солей или соединений с помощью, например, селективной кристаллизации или методов хроматографии, например жидкостной хроматографией и тому подобными методами; и, наконец, путем превращения указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Альтернативно энантиомерно чистые соединения и промежуточные могут быть получены также хроматографией рацемата над хиральной стационарной фазой и тому подобными методами. Стереохимически чистые изомерные формы соединений формулы (I) могут быть получены также из стереохимически чистых форм соответствующих промежуточных и исходных веществ при условии, что применяемые реакции протекают стереоспецифично.
Соединения формулы (I) и фармацевтически приемлемые соли присоединения кислот и стереоизомерные формы этих соединений показывают противовирусную активность и являются привлекательными из-за их благоприятного терапевтического показателя, получающегося из приемлемой низкой степени клеточной токсичности, скомбинированной с удовлетворительной противовирусной активностью.
Противовирусные свойства соединений формулы (I) могут быть продемонстрированы, например, при испытании "Минимальной Ингибирующей Концентрации Пикорнавируса" (МИК-испытание), показывающем полезную противовирусную активность предлагаемых соединений.
Предлагаемые соединения являются поэтому полезными средствами для ингибирования роста и/или размножения вирусов. Соединения формулы (I), фармацевтически приемлемые соли присоединения кислот и стереохимически изомерные формы их являются активными против широкого спектра пикорнавирусов, включая энтеровирусы, например Коксакийвирусы, Эховирусы, Энтеровирусы, например Энтеровирус 70, и особенно многочисленные штампы риновирусов, например Человеческий Риновирус серотипов (НРV-ЧРВ) -2, -3, -4, -5, -6, -9, -14, -15, -29, -39, -42, -45, -51, -59, -63, -70, -72, -85, -86 и тому подобные. Совершенно неожиданно соединения формулы (I) проявляют также антриновирусную активность на Человеческий Риновирус серотипов НРV 41 и 89.
Ввиду их мощной, локальной, а также системной противовирусной активности предлагаемые соединения представляют полезные свойства для ингибирования, уничтожения или предотвращения роста вирусов. Более конкретно, предлагается способ лечения вирусных заболеваний у теплокровных животных, страдающих указанными вирусными заболеваниями, особенно респираторными заболеваниями, например насморк, пневмония, бронхолитиаз, герпангина и тому подобные; болезнями центральной нервной системы (ЦНС), например паралич, асептический менингит, энцефалит и тому подобные; болезнью сердца, например перикардит, миокардит и тому подобные; печеночными заболеваниями, например гепатитом и тому подобными; желудочно-кишечными заболеваниями, например диарреей и тому подобными; глазными заболеваниями, например острым геморрагическим конъюнктивитом и тому подобными, заболеваниями кожи, например экземой (кожной сыпью), сыпью, вирусной пузырчаткой полости рта и конечностей и тому подобными заболеваниями. Указанный способ включает системное и местное назначение (введение) теплокровным животным противовирусно эффективного количества соединения формулы (I), фармацевтически приемлемой соли или стереоизомерной формы его. Некоторые соединения настоящего изобретения являются особенно полезными для лечения респираторных заболеваний, подобных насморку, из-за их пролонгированной активности ин виво в преддверии рта и в полости носа.
Подвергаемые испытанию соединения могут быть рецептированы в различных фармацевтических формах для целей системного или местного назначения (ввода). Чтобы приготовить фармацевтические композиции настоящего изобретения, эффективное количество конкретного соединения, необязательно в форме соли при присоединении кислоты, в качестве действующего ингредиента смешивается в однородную смесь вместе с фармацевтически приемлемым носителем, который может браться в широком ряде формы в зависимости от формы препарата, необходимой для приема. Эти фармацевтические композиции являются желательными в форме стандартной дозы, пригодной в особенности для приема перорально, прямокишечно (ректально), через кожу, интраназально (внутрь носа), путем парентеральной инъекции или для офтальмологического ввода. Например, при приготовлении композиций в пероральной лекарственной форме может быть применена любая из обычных фармацевтических сред, такая как вода, гликоли, масла, спирты и тому подобные, в случае пероральных жидких препаратов, такие как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающиеся вещества, связывающие вещества, дезинтегрирующие вещества (вещества, вызывающие распад лекарственной формы) и тому подобные, в случае порошков, пилюлей, капсул и таблеток. Вследствие легкости их приема таблетки и капсулы представляют преимущественную пероральную лекарственную унифицированную форму, в случае которой твердые фармацевтические носители явно применяются. Для парентеральных композиций носитель обычно включает стерильную воду в значительной степени, хотя могут быть включены и другие ингредиенты, например, чтобы способствовать растворимости. Могут быть приготовлены инъецируемые растворы, в этом случае носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть приготовлены инъецируемые суспензии, в этом случае могут быть применены соответствующие жидкие носители, суспендирующие вещества и тому подобные. Кроме того, включенными являются твердые формы препаратов, которые незадолго до использования должны быть превращены в препараты жидкой формы. В композициях, пригодных для перкутанного ввода (для приема, вводимого через кожу), носитель необязательно включает вещество, повышающее проникновение внутрь, и/или подходящее смачивающее вещество, необязательно смешиваемое с соответствующими добавками любой природы в незначительных пропорциях, причем эти добавки не создают значительного вредного действия на кожу. Указанные добавки могут способствовать введению через кожу и/или могут быть полезными для приготовления необходимых композиций. Эти композиции могут принимать форму кремов, лосьонов, аэрозолей и/или эмульсий и могут быть включены в трансдермальный (подкожный) участок (пластырь) матрицы для этой цели. В композициях, пригодных для местного нанесения, действующий ингpедиент предпочтительно должен быть полутвердым, таким как густая композиция, такая как целебные мази, кремы, студни, мази и тому подобные, которые могут быть нанесены тампоном. Фармацевтическая композиция, пригодная для местного нанесения, может быть также в форме капель, лосьонов или аэрозоля. Пригодные аэрозольные препараты могут включать растворы и твердые вещества в порошкообразной форме, которые могут находиться в сочетании с фармацевтически приемлемым носителем, таким как сжиженный инертный газ. Соли соединения (I) при присоединении кислот из-за их повышенной водорастворимости по сравнению с соответствующей основной формой являются очевидно более пригодными при получении водных композиций.
Предлагаются особые фармацевтические композиции, которые включают соединение формулы (I), фармацевтически приемлемую соль присоединения кислот или стереохимически изомерную форму его и циклодекстрин или его производное. При нанесении на участок заражения такие композиции на основе циклодекстрина приводят к непрерывной и контролируемой доставке достаточно высоких концентраций противовирусного соединения формулы (I) на участок заражения в течение испытуемых периодов времени.
Такие композиции являются особенно удобными для лечения локальных вирусных инфекций, в частности инфекций слизистой оболочки, например, инфекций носа или глаз.
Циклодекстрин, который используется в этих композициях, включает фармацевтически приемлемые незамещенные и замещенные циклодекстрины, известные в данной области, более конкретно α β или γ-циклодекстрины или фармацевтически приемлемые производные их.
Замещенные циклодекстрины, которые могут быть использованы в настоящем изобретении, включают полиэфиры (патент США N 3459731). Незамещенные циклодекстрины подвергаются реакции с алкиленоксидом предпочтительно при сверхатмосферном давлении и при повышенной температуре в присутствии щелочного катализатора.
Так как оксиостаток циклодекстрина может быть замещен алкиленоксидом, который сам может реагировать с еще другой молекулой алкиленоксида, то среднее молярное замещение (МЗ) используется как мера среднего числа молей замещающего вещества на гликозидную единицу. МЗ может быть выше, чем 3, и теоретически не имеет ограничений.
Дополнительные замещенные циклодекстрины являются простыми эфирами, в которых водород одной или более оксигрупп циклодекстрина заменяется С1-6-алкилом, окси-С1-6-алкилом, карбокси-С1-6-алкилом или С1-6 -алкилоксикарбонил-С1-6-алкилом, или смешанными простыми эфирами их. В частности, такие замещенные циклодекстрины являются простыми эфирами, в которых водород одной или более оксигрупп циклодекстрина заменяется С1-3-алкилом, окси-С2-4-алкилом или карбокси-С1-2-алкилом или более конкретно метилом, этилом, оксиэтилом, оксопропилом, оксибутилом, карбоксиметилом или карбоксиэтилом.
В приведенных определениях термин "С1-6-алкил" подразумевает, что включает линейные и разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 6 атомов углерода, такие как метил, этил, 1-метилэтил, пропил, 1,1-диметилэтил, 2-метилпропил, бутил, амил, гексил и тому подобные.
Такие простые эфиры могут быть получены путем взаимодействия исходного циклодекстрина с соответствующим 0-алкилирующим реагентом или смесью таких реагентов при концентрации, которая выбирается так, чтобы получался целевой циклодекстриновый простой эфир. Указанная реакция предпочтительно проводится в подходящем растворителе в присутствии соответствующего основания. С такими простыми эфирами степень замещения (СЗ) является средним числом замещенных оксифункций на гликозидную единицу, причем СЗ составляет таким образом 3 или меньше.
В производных циклодекстрина для использования в композициях настоящего изобретения СЗ предпочтительно находится в пределах от 0,125 до 3, в частности от 0,3 до 2, более конкретно от 0,3 до 1, а МЗ находится в пределах от 0,125 до 10, в частности от 0,3 до 3, более конкретно от 0,3 до 1,5.
Известны циклодекстрины для использования в композициях настоящего изобретения и руководства для получения и характеристик циклодекстринов, для способа отложения (внедрения) выбираемого вещества внутри полости циклодекстриновой молекулы и для использования циклодекстринов в фармацевтических композициях (Технология циклодекстрина./Под ред. Джозефа Хейтли, 1988, Kluwer Academic Publishers, гл. Циклодекстрины в фармацевтических препаратах; Химия циклодекстрина. /Под ред. М. Л. Бендера и др.) 1978, Springer Verlag, Berlin; Advances in Carbohydrate Chemistry, vd. 12, Ed.by M. L. Wolfcom, 1957, Academic Press, New York, гл. Декстрины Шредингера, 189-269; Циклодекстрины и их соединения включения. /Под ред. Дж. Жейтли, 1982, Akademiai Kiado, Budapest, Hangary; Tabushi I. Aec. Chem. Reseach, 1982, v. 15, p. 66-72; Sanger W, Angewandte Chemie, 1981, v. 92, p. 343-361; Craft A. P. and Bartsch R. A. Tetrahedron, 1983, v. 39, p. 1417-1474; патент ФРГ N 3118218; патент ФРГ N 3317064; заявки на Европейские патенты N 94157 и 149197; патенты США N 4659696 и 4383992).
Особую полезность в настоящем изобретении имеют β -циклодекстриновые простые эфиры, например диметил-β -циклодекстрин (Лекарственные средства будущего, 1984, v. 9, N 8, р. 577-578) и полиэфиры, например оксипропил-β -циклодекстрин и оксиэтил-β -циклодекстрин, являющиеся примерами. Таким алкиловым эфиром может быть метиловый эфир со степенью замещения примерно от 0,125 до 3, например от 0,3 до 2. Такой оксипропил-циклодекстрин может быть получен при взаимодействии β-циклодекстрина и пропиленоксида и может иметь МЗ-величину примерно от 0,125 до 10, например от 0,3 до 3.
В указанном особом составе на основе циклодекстрина молекулы противовирусных соединений формулы (I) окружаются, по меньшей мере частично, циклодекстрином, т.е. вещество подходит полости циклодекстрина.
Чтобы получить указанные особые фармацевтические композиции на основе циклодекстрина, выбранное противовирусное соединение (или соединения) формулы (I), фармацевтически приемлемая соль или стереохимически изомерная форма его отлагается (внедряется) внутри самой молекулы циклодекстрин: противовирусное соединение составляет примерно от 1:1 до 5:1, в частности примерно от 1: 1 до 2:1. Таким образом, композиция должна получаться растворением циклодекстрина в воде и добавлением противовирусного соединения к этому раствору предпочтительно при энергичном перемешивании и при температуре в пределах от 10 до 50оС, в частности в пределах от 15 до 30оС, и предпочтительно при комнатной температуре. В конечных композициях циклодекстрин включает примерно от 2,5 до 40 мас. в частности примерно от 2,5 до 25 мас. более конкретно от 5 до 25 мас. или от 5 до 20 мас. например 10 мас. вместе с остальной частью, являющейся водой, консервирующим средством (противостарителем), действующим ингредиентом и любыми инертными наполнителями.
В частности, фармацевтические композиции могут состоять только из воды, циклодекстрина и противовирусных веществ (средств) без необходимости использования сорастворителей, таких как этанол или поверхностно-активных веществ.
Применение композиций на основе циклодекстрина согласно изобретению может быть в виде аэрозоля, например с газом-носителем, таким как азот, двуокись углерода, фреон, или без него, например насос для опрыскивания, капли или в виде полутвердой массы, такой как сгущенные композиции, которые могут быть нанесены тампоном. При конкретных применениях удобно использовать полутвердые композиции, такие как целебные мази, кремы, студни, мази и тому подобные.
Для жидких препаратов композиций на основе циклодекстрина может быть добавлена любая из обычных фармацевтических сред, такая как гликоли, масла, спирты и тому подобные, однако при концентрациях ниже уровня болезненной чувствительности (раздражения). Для того чтобы стабилизировать составы, рН может быть повышен или понижен или стабилизирован добавлением соответствующих кислот, оснований или буферных систем, например цитратных (лимоннокислых), фосфатных буферов. Дополнительные добавки могут включать вещества для создания изотонических составов, например хлористый натрий, маннит, глюкоза и тому подобные. Дополнительно рекомендуется добавлять консервирующее средство (противостаритель) к составам, такое как соль ртути или комплексная соль, например ацетат, нитрат, хлорид или борат фенилртути, фенилэтиловый спирт, этанол, пропиленгликоль и тому подобные. Подходящие загустители для получения упомянутых выше сгущенных композиций включают поливиниловые спирты, оксипропил-метилцеллюлозы, оксиэтил-целлюлозы, метилцеллюлозы, поливинилпирролидон, полимеры акриловой кислоты и тому подобные.
В зависимости от вида вируса, с которым должна проводиться борьба, указанные композиции на основе циклодекстрина могут быть введены во влагалище, нос, полость рта, глаза, легкие или внутрь щек с тем, чтобы уничтожить вирусы, которые не вводятся в кровяной поток пациента, например вирусы, которые располагаются в слизистых мембранах тела. Композиции на основе циклодекстрина являются особенно полезными на тех участках заражения, где естественные защитные механизмы предотвращают доставку противовирусных веществ во время испытуемых периодов времени вследствие эффективного удаления активного соединения из участках заражения. Такое удаление может быть обусловлено выведением с помощью цилиарного движения секреции или абсорбцией.
Как часть фармацевтической композиции она может включать также одинаковое или различное активное противовирусное вещество в различном носителе для доставки с тем, чтобы обеспечить различный профиль (показатель) активности, например широкий предел времени, в течение которого композиция показывает активность, или дополнение, чтобы поддерживать низкий уровень при определенной точке в графике выделения циклодекстрина.
Особенно целесообразно составлять вышеупомянутые фармацевтические композиции в стандартной лекарственной форме для облегчения приема и однородности дозировки. Стандартная лекарственная форма относится к физически раздельной единице, пригодной в качестве унифицированных (стандартных) доз, причем каждая единица содержит заранее определенное количество действующего ингредиента, вычисленного для получения необходимого терапевтического действия в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с зарубками или с покрытием), капсулы, пилюли, пакетики с порошком, облеточные капсулы, инъецируемые растворы или суспензии, капли, полные чайные ложки, полные столовые ложки и тому подобные и сегрегированная множественность их.
Специалисты при лечении противовирусных заболеваний у теплокровных животных могут легко определить эффективное количество из результатов испытаний, представленных ниже. Эффективное количество должно составлять от 0,001 до 50 мг/кг живого веса, предпочтительно от 0,01 до 10 мг/кг живого веса.
А. Полученные промежуточных.
П р и м е р 1. а) Смесь 11, 3 мас.ч. 2-хлорметил-4-(фенилметил)-морфолина Synth. Comm.m, 1980, v. 10 (1), p. 59-73)- 8.3 мас.ч. этилового эфира 4-оксибензойной кислоты, 6,9 мас.ч. карбоната калия и 141 мас.ч. N, N-диметилформамида перемешивают в течение ночи при 110оС. Реакционную смесь выпаривают и к остатку добавляют воду. Продукт реакции экстрагируют хлористым метиленом и экстракт высушивают, фильтруют и выпаривают. Остаток превращают в фумаратную соль в 2-пропаноле, получая 9,5 мас.ч. (40,3%) фумарата (1:1) этилового эфира 4-[[4-(фенилметил)-2-морфолинил] -метокси] -бензойной кислоты; т. пл. 174,4оС (промежуточное N 1).
б) Cмесь 8,5 мас.ч. промежуточного и 1 и 198 мас.ч. этанола гидрируют при обычном давлении и при 50оС вместе с 2 мас.ч. катализатора палладия на древесном угле с концентрацией 10% После поглощения вычисленного количества водорода катализатор отфильтровывают и фильтрат выпаривают. Остаток превращают в основание с помощью NH4OH (концентр.) и продукт реакции экстрагируют хлороформом. Экстракт высушивают, фильтруют и выпаривают, получая 5 мас.ч. (100% ) этилового эфира 4-[(2-морофолинил)-метокси] -бензойной кислоты (промежуточное 2).
в) К перемешиваемой смеси 3,6 мас.ч. 11-оксипропнимидамидаи 89 мас.ч. тетрагидрофурана добавляют по частям 40 мас.ч. 50%-ной дисперсии гидрида натрия. После перемешивания в течение 1 ч при комнатной температуре добавляют раствор из 5,3 мас.ч. промежуточного 2 в незначительном количестве тетрагидрофурана. Реакционную смесь перемешивают и нагревают с обратным холодильником в течение ночи. После выпаривания остаток переносят в воду. Выпадающий в осадок продукт реакции отфильтровывают и переносят в смесь хлороформа и метанола. Органический слой высушивают, фильтруют и выпаривают, получая 4,4 мас. ч. (76%) 2-[[4-(3-этил-1,2,4-оксадиазол-5-ил)-фенокси]-метил]-морфолина в виде остатка (промежуточное 3).
П р и м е р 2. а) К нагреваемой с обратным холодильником смеси из 15 мас.ч. литийалюминийгидрида и 534 мас.ч. тетрагидрофурана добавляют по каплям раствор 80 мас.ч. этилового эфира 4-(фенилметил)-2-морфолинуксусной кислоты в 89 мас.ч. тетрагидрофурана в атмосфере азота. Нагревание с обратным холодильником продолжают в течение ночи. После охлаждения до 0-5оС добавляют последовательно 15,5 мас.ч. воды, 14,6 мас.ч. 20%-ной NaOH и 51 мас.ч. воды. Содержимое перемешивают в течение 0,5 ч, а затем фильтруют над диатомовой землей. Фильтрат выпаривают, получая 68 мас.ч. (99,1%) 4-(фенилметил)-2-морфолинэтанола (промежуточное 4).
б) К смеси 54 мас.ч. хлористого тионила и 266 мас.ч. хлористого метилена добавляют по каплям раствор 44 мас.ч. промежуточного 4 в 266 мас.ч. хлористого метилена при 10-15оС. После перемешивания в течение ночи реакционную смесь выпаривают и остаток выпаривают вместе с 87 мас.ч. толуола (2 раза), получая 56 мас.ч. (100%) 2-(2-хлорэтил)-4-(фенилметил)-морфолина (промежуточное 5).
в) К нагреваемой (60оС) смеси 56 мас.ч. монохлоргидрата интермедиата 5,64 мас. ч. карбоната натрия и 522 мас.ч. толуола добавляют по каплям 42,6 мас. ч. фенилметилового эфира хлормуравьиной кислоты. Содержимое нагревают с обратным холодильником в течение 2 ч и перемешивают в течение ночи при 20оС. Добавляют воду и органический слой разделяют, высушивают, фильтруют и выпаривают. Остаток очищают колоночной хроматографией (силикагель; СН2Сl2/CH3OH 99: 1). Элюент целевой фракции выпаривают, получая 42 мас.ч. (74%) фенилметилового эфира 2-(2-хлорэтил)-4-морфолинкарбоновой кислоты (промежуточное 6).
г) Смесь 42 мас.ч. промежуточного 6, 24, 9 мас.ч. этилового эфира 4-оксибензойной кислоты, 34,5 мас.ч. карбоната калия и 327 мас.ч N,N-диметилформамида перемешивают в течение ночи при 110оС. Реакционную смесь выпаривают и к остатку добавляют воду. Продукт реакции экстрагируют толуолом и экстракт высушивают, фильтруют и выпаривают. Остаток очищают с помощью колоночной хроматографии (силикагель; CH2Cl2 /CH3OH 99:1) Элюент целевой фракции выпаривают, получая 10,8 маc. ч. (17,4% ) фенилметилового эфира 2-[2[4-(этоксикарбонил)-фенокси]-этил]-4-морфолинкар- боновой кислоты (промежуточное 7).
д) Смесь 10,8 мас.ч. промежуточного 7 и 198 мас.ч. этанола гидрируют при обычном давлении и при 50оС с помощью 10%-ного катализатора палладия на древесном угле. После поглощения вычисленного количества водорода катализатор отфильтровывают и фильтрат выпаривают, получая 6,5 мас.ч. (86,2%) этилового эфира 4-[2-(2-морфолинил)-этокси] -бензойной кислоты (промежуточное 8).
4,2 мас. ч. промежуточного 8 разделяют на чистые энантиомерные формы с помощью колоночной хроматографии (хиралцель ОД; Гексан/2-пропанол 97:3), получая 1,5 мас.ч. (35,7%) (-) этилового эфира 4-[2-(2-морфолинил)-этокси] -бензойной кислоты (промежуточное 8а) и 0,5 мас.ч. (11,9%) (+) этилового эфира 4-[2-(2-морфолинил)-этокси]-бензойной кислоты (промежуточное 8б).
П р и м е р 3. а) К перемешиваемому и охлаждаемому (≥ 5оС) раствору из 8,3 мас. ч. 2-пиразинметанола, 13,3 мас.ч. этилового эфира 4-оксибензойной кислоты и 20,2 мас.ч. трифенилфосфина в 178 мас.ч. тетрагидрофурана добавляют по каплям раствор 13,93 мас.ч. диэтилового эфира азодикарбоновой кислоты в 45 мас.ч. тетрагидрофурана. После завершения реакционную смесь перемешивают в течение уикенда (с субботы до понедельника). После выпаривания остаток переносят в воду и продукт реакции экстрагируют хлористым метиленом. Экстракт высушивают, фильтруют и выпаривают. Остаток перемешивают в диизопропиловом эфире. Выпадающий осадок отфильтровывают и фильтрат выпаривают. Остаток кристаллизуют из 2-пропанола, по- лучая 7,5 мас.ч. (38,7%) этилового эфира 4-(2-пиразинилметокси)-бензойной кислоты; т.пл. 76,1оС (промежуточное 9).
б) Смесь 12,8 мас.ч. промежуточного 9 и 120 мас.ч. этанола гидрируют при обычном давлении и при комнатной температуре в присутствии 2 мас.ч. 5%-ного катализатора платины на древесном угле. После поглощения вычисленного количества водорода катализатор отфильтровывают над диатомовой землей и фильтрат выпаривают, получая 13,2 мас.ч. (100%) этилового эфира 4-(2-пиперазинилметокси)-бензойной кислоты в виде остатка (промежуточного 10).
в) Смесь 12,5 мас.ч. промежуточного 10,5 мас.ч. бензальдегида, 3 мас.ч. тиофенового раствора и 200 мас.ч. этанола гидрируют при обычном давлении и при комнатной температуре в присутствии 2 мас.ч. 10%-ного катализатора палладия на древесном угле. После поглощения вычисленного количества водорода катализатор отфильтровывают над диатомовой землей и фильтрат выпаривают. Остаток очищают с помощью колоночной хроматографии (силикагель; СНСl3/C2H5ОН 99,5: 0,5). Элюент целевой фракции выпаривают, получая 11,2 мас.ч. (67,1%) этилового эфира 4-[[4-(фенилметил)-2-пиперазинил]-метокси]-бензойной кислоты в виде остатка (промежуточное 11).
г) Смесь из 6,6 мас.ч. промежуточного 11,2 мас.ч. поли(оксиметилена), 2 мас.ч. тиофенового раствора и 200 мас.ч. этанола гидрируют при обычном давлении и при комнатной температуре в присутствии 2 мас.ч. 10%-ного катализатора палладия на древесном угле. После поглощения вычисленного количества водорода катализатор отфильтровывают над диатомовой землей и фильтрат выпаривают. Остаток растворяют в хлористом метилене, промывают раствором гидроокиси аммония и водой, высушивают, фильтруют и выпаривают, получая 5,8 мас.ч. (84,6% ) этилового эфира 4-[[1-метил-4-(фенилметил)-2-пиперазинил]-метокси] -бензойной кислоты в виде остатка (промежуточное 12).
д) Смесь 5,8 мас.ч. промежуточного 12 и 120 мас.ч. этанола гидрируют при обычном давлении и при комнатной температуре в присутствии 2 мас.ч. 10%-ного катализатора палладия на древесном угле. После поглощения вычисленного количества водорода катализатор отфильтровывают над диатомовой землей и фильтрат выпаривают, получая 4 мас.ч. (91,5%) этилового эфира 4-[(1-метил-2-пиперазинил)-метокси]-бензойной кислоты в виде остатка (промежуточное 13).
П р и м е р 4. а) Смесь из 50 мас.ч. 4-бром-1-бутена, 58 мас.ч. этилового эфира 4-оксибензойной кислоты, 55,2 мас.ч. карбоната калия и 320 мас.ч. 2-пропанона нагревают с обратным холодильником в течение 68 ч. Реакционную смесь выпаривают и остаток растворяют в толуоле. Органический раствор промывают разбавленным раствором гидроокиси натрия. Разделенный органический слой высушивают, фильтруют и выпаривают, получая 25 мас.ч. (33%) этилового эфира 4-(3-бутенилокси)-бензойной кислоты в виде маслянистого остатка (промежуточное 14).
б) К перемешиваемому раствору 25,9 мас.ч 3-хлорбензолпероксикарбоновой кислоты в 260 мас.ч. хлористого метилена добавляют по каплям раствор 25 мас. ч. промежуточного 14 в 65 мас.ч. хлористого метилена при 20оС. После перемешивания в течение ночи при 20оС выпадающий осадок отфильтровывают и фильтрат промывают холодным разбавленным раствором гидроокиси натрия. Отделенный органический слой высушивают, фильтруют и выпаривают, получая 23,6 мас.ч. (90,8% ) этилового эфира 4-[2-(оксиранил)-этокси]-бензойной кислоты в виде маслянистого остатка (промежуточное 15).
в) Смесь 23,6 мас.ч. промежуточного 15, 15,1 мас.ч. 2-[(фенилметил)-амино]-этанола и 200 мас.ч. 2-пропанола перемешивают в течение ночи при нагревании с обратным холодильником. Реакционную смесь выпаривают и остаток очищают с помощью колоночной хроматографии (силикагель; СНСl2/C2H5OH 98:2). Элюент целевой фракции выпаривают, получая 32 мас.ч. (82,6%) этилового эфира 4-[3-окси-4-[(2-оксиэтил)(фенилметил)-амино] -бутокси]-бензой- ной кислоты в виде остатка (промежуточное 16).
г) Смесь 32 мас.ч. промежуточного 16 и 200 мас.ч. этанола гидрируют при обычном давлении и при комнатной температуре в присутствии 5 мас.ч. 10%-ного катализатора палладия на древесном угле. После поглощения вычисленного количества водорода катализатор отфильтровывают над диатомовой землей и фильтрат выпаривают, получая 23,8 мас.ч. (96,7%) этилового эфира 4-[3-окси-4-[(2-оксиэтил)-амино] -бутокси] -бензойной кислоты в виде остатка (промежуточное 17).
д) Смесь 17,2 мас. ч. хлористого 4-метилбензолсульфонила, 23,8 мас.ч. промежуточного 17, 21,2 мас.ч. карбоната натрия и 282 мас.ч. N,N-диметилформамида перемешивают в течение ночи при ±90оС. Реакционную смесь выливают в ледяную воду. Выпадающий в осадок продукт реакции отфильтровывают, растворяют в хлористом метилене, высушивают, фильтруют и выпаривают, получая 33 мас. ч. (91,4% ) этилового эфира 4-[3-окси-4[(2-оксиэтил)-[(4-метилфенил)-сульфонил]-амино]-бутокси]-бензойно й кислоты в виде остатка (промежуточного 18).
е) Раствор 33 мас.ч. промежуточного 18 в 261 мас.ч. толуола добавляют по каплям к раствору 47,6 мас.ч. хлористого тионила в 0,5 мас.ч. N,N-диметилформамида. Реакционную смесь перемешивают в течение ночи при комнатной температуре, а затем в течение 1 ч при температуре кипения с обратным холодильником. Содержимое выпаривают, получая 35 мас.ч. (98,2%) этилового эфира 4-[3-хлор-4-[(2-хлорэтил)-[(4-метилфенил)-сульфонил] -амино] -бутокси]-бензойн ой кислоты в виде остатка (промежуточного 19).
ж) Смесь из 35 мас.ч. промежуточного 19, 36 мас.ч. нонангидрата сульфида натрия, 0,1 мас. ч. порошкообразной серы и 320 мас.ч. этанола нагревают с обратным холодильником в течение 4 ч. Реакционную смесь выпаривают и остаток переносят в воду. Содержимое кипятят с обратным холодильником в течение 30 мин. После охлаждения реакционную смесь обрабатывают хлористоводородной кислотой. Выпадающий в осадок продукт реакции отфильтровывают, растворяют в этаноле и 1,6 мас.ч. серной кислоты и кипятят с обратным холодильником в течение ночи. После выпаривания остаток переносят в ледяную воду и экстрагируют хлористым метиленом. Экстракт промывают раствором гидроокиси аммония, высушивают, фильтруют и выпаривают. Остаток очищают с помощью колоночной хроматографии (силикагель; СНСl3/C2H5OH 99:1). Элюент целевой фракции выпаривают, получая 21,5 мас. ч. (66,8%) этилового эфира 4-[2-[4-[(4-метилфенил)-сульфонил] -2-тиоморфолинил] этокси]-бензойной кислоты в виде остатка (промежуточное 20).
з) Смесь из 21,5 мас.ч. промежуточного 20, 54 мас.ч. 1,22 этилендиамина и 94 мас.ч. N,N-диметилформамида детозилируют (электрохимически) с помощью 5 мас. ч. бромистого N,N,N-триэтилэтанаммония (тетраэтиламмония). Реакционную смесь выливают в воду и продукт реакции экстрагируют хлористым метиленом. Экстракт промывают водой, высушивают, фильтруют и выпаривают. Остаток превращают в фумаратную соль в 2-пропаноле. Соль фильтруют и высушивают, получая 9,3 мас.ч. (47,3%) фумарата (1:1) этилового эфира 4-[2-(2-тиоморфолинил)-этокси]-бензойной кислоты; т.пл. 141оС (промежуточное 21).
Подобным путем получают также этиловый эфир 4-(2-тиоморфолинилметокси)-бензойной кислоты (промежуточное 22).
и) К смеси 3,6 мас.ч. N-оксипропанимидамида и 135 мас.ч. тетрагидрофурана добавляют по частям 2 мас.ч. 50%-ной дисперсии гидрида натрия. После перемешивания в течение 30 мин при комнатной температуре добавляют по частям раствор 5,9 мас.ч. интермедиата 21 в 45 мас.ч. тетрагидрофурана и перемешивание продолжают сначала в течение 30 мин при комнатной температуре, а затем в течение ночи при температутре кипения с обратным холодильником. После выпаривания остаток переносят в ледяную воду. Содержимое перемешивают в течение 15 мин и водный слой декантируют. Остаток промывают петролейным эфиром, растворяют в хлористом метилене, высушивают, фильтруют и выпаривают, получая 5,7 мас.ч. (89,2%) 2[2-[4-(3-этил-1,2,4-оксадиазол-5-ил)-фенокси]-этил]-тио- морфолин в виде остатка (промежуточное 23).
П р и м е р 5. а) Смесь 18 мас.ч. промежуточного 4 и 160 мас.ч. метанола гидрируют при обычном давлении и при комнатной температуре в присутствии 2 мас.ч. катализатора палладия на древесном угле. После поглощения вычисленного количества водорода катализатор отфильтровывают над диатомовой землей и фильтрат выпаривают, получая 9,1 мас.ч. (86,7%) 2-морфолинэтанола в виде остатка (промежуточное 24).
б) Смесь из 4 мас.ч. 3,6-дихлорпиридазина, 2,64 мас.ч. промежуточного 24, 6,3 мас.ч. карбоната натрия и 141 мас.ч. N,N-диметилформамида перемешивают в течение ночи при ±90оС. Реакционную смесь выливают в воду. Водный слой выпаривают и остаток переносят в хлористый метилен. После перемешивания в течение 1 ч отделенный органический слой выпаривают и остаток очищают с помощью колоночной хроматографии (силикагель; СНСl3 /CH3OH 99:1). Элюент целевой фракции выпаривают. Остаток обрабатывают дважды толуолом и выпаривают, получая 2,9 мас.ч. (59,5%) 4-(6-хлор-3-пиридазинил)-2-морфолинэтанола в виде остатка (промежуточное 25).
Подобным образом получают также 4-(5-бром-1,3,4-тиадиазол-2-ил)-2-(хлорметил)- морфолин (промежуточное 26).
П р и м е р 6. К смеси 29, 9 мас.ч. этилового эфира 4-оксибензойной кислоты и 316 мас.ч. этанола добавляют по частям 35,6 мас.ч. этилата натрия. После перемешивания в течение 0,5 ч при комнатной температуре добавляют по каплям раствор 31,7 мас.ч. N-оксипропанимидамида в 79 мас.ч. этанола. Перемешивание продолжают в течение 0,5 ч при комнатной температуре и в течение ночи при температуре кипения с обратным холодильником. Реакционную смесь выпаривают и остаток переносят в воду. После нейтрализации с помощью уксусной кислоты выпадающий осадок отфильтровывают и высушивают. Его очищают с помощью колоночной хроматографии (ЖХВД; силикагель; CН2Cl2/CH3OH 99:1). Элюент целевой фракции выпаривают и остаток перемешивают в петролейном эфире. Выпадающий осадок отфильтровывают и высушивают, получая 7, 56 мас.ч. (22,1%) 4-(3-этил-1,2,4-оксадиазол-5-ил)-фенола; т.пл. 137,7оС (промежуточное 27).
П р и м е р 7. а) К охлаждаемой (5оС) смеси из 12,9 мас.ч. этилового эфира 4-[4-окси-5-[(2-оксиэтил)-(фенилметил)-амино] -пен- тил] -бензойной кислоты (полученного согласно методике, описанной в примере 4 (а, б, в)), 7,86 мас. ч. трифенилфосфина и 90 мас.ч. хлороформа добавляют по каплям 7 маc. ч. диэтилового эфира азодикарбоновой кислоты. После перемешивания в течение ночи при 20оС реакционную смесь разбавляют с 50 мас.ч. воды. Органический слой высушивают, фильтруют и выпаривают. Остаток растворяют в 261 мас.ч. толуола и этот раствор тщательно перемешивают вместе с 200 мл 2 N раствора HCl. Содержимое превращают в основание с помощью гидроокиси аммония и экстрагируют хлористым метиленом. Экстракт высушивают, фильтруют и выпаривают и остаток превращают в монохлоргидратную соль в 2-пропаноле. Продукт реакции отфильтровывают и высушивают, получая 4 мас.ч. (31,7%) хлоргидрата этилового эфира 4-[3-[4-(фенилметил)-2-морфолинил]-пропокси]-бензойной кислоты (промежуточное 28).
б) Смесь 4 мас.ч. промежуточного 28 и 119 мас.ч. этанола гидрируют при обычном давлении и комнатной температуре с помощью 2 мас.ч. 10%-ного катализатора палладия на древесном угле. После поглощения вычисленного количества водорода катализатора отфильтровывают и фильтрат выпаривают, получая 2,9 мас. ч. (87,9%) хлоргидрата этилового эфира 4-[3-(2-морфолинил)-пропокси]-бензойной кислоты (промежуточное 29).
Б. Получение конечных соединений.
П р и м е р 8. Смесь 3,96 мас.ч. 2,5-дибром-1,3,4-тиадиазола, 4 мас.ч. промежуточного 8, 5,3 мас.ч. карбоната натрия и 94 мас.ч. N,N-диметилформамида перемешивают в течение ночи при 65оС. Реакционную смесь выпаривают и остаток переносят в воду. Выпадающий осадок отфильтровывают, промывают водой и растворяют в хлористом метилене. Органический слой высушивают, фильтруют и выпаривают. Остаток очищают с помощью колоночной хроматографии (силикагель; СН2Сl2/CH3OH 99: 1). Элюент целевых фракций выпаривают и остаток кристаллизуют из 2-пропанола. Продукт реакции отфильтровывают и высушивают, получая 2,1 мас.ч. (31,7) этилового эфира 4-[2-[4-(5-бром-1,3, 4-тиадиазол-2-ил)-2-морфолинил]-этокси]-бензойной кислоты; т.пл. 130,8оС (соединение 12).
П р и м е р 9. Смесь 2,4 мас.ч. 3-хлор-6-(метилтио)-пиридазина, 3,5 мас. ч. промежуточного 8. 1.6 мас.ч. карбоната натрия и 3 каплей N,N-диметилацетамида перемешивают в течение 6 ч при ±160оС. Реакционную смесь оставляют стоять в течение уикенда (с субботы до понедельника). Добавляют воду и хлористый метилен и отделенный органический слой высушивают, фильтруют и выпаривают. Осадок кристаллизуют из смеси диизопропилового эфира и 2-пропанола. Продукт реакции отфильтровывают и высушивают, получая 2,1 мас.ч. (40%) этилового эфира 4-[2-[4-[6-(метилтио)-3-пиридазинил]-2-морфолинил]-этокси]-бен- зойной кислоты; т.пл. 111,4оС (соединение 23).
П р и м е р 10. Смесь 2,6 мас.ч. 1,1-диоксида 3-хлор-1,2-бензизотиазола, 3 мас.ч. промежуточного 8, 5,3 мас.ч. карбоната натрия и 120 мас.ч. 4-метил-2-пентанона кипятят с обратным холодильником в течение ночи и оставляют стоять в течение уикенда. После добавления воды отделенный органический слой высушивают, фильтруют и выпаривают. Остаток кристаллизуют из этанола. Продукт реакции отфильтровывают и высушивают, получая 3,3 мас.ч. (67,5%) 5,5-диоксида этилового эфира 4-[2-[4-(1,2-бензиотиазол-3-ил)-2-морфолинил]-этокси]-бензойной кислоты; т.пл. 150,5оС (соединение 22).
П р и м е р 11. Смесь 2,6 мас.ч. 2-бром-5-метил-1,3,4-тиадиазола, 4,0 мас.ч. промежуточного 2 и 1,6 мас.ч. карбоната натрия перемешивают в течение 6 ч при 140оС. После охлаждения реакционную смесь переносят в воду и хлористый метилен. Отделенный органический слой высушивают, фильтруют и выпаривают. Остаток очищают с помощью колоночной хроматографии (силикагель; СНСl3/CH3OH 99:1). Элюент целевых фракций выпаривают и остаток кристаллизуют из 2-пропанола. Продукт реакции отфильтровывают, промывают с помощью 2-пропанола и диизопропилового эфира и высушивают при 60оС, получая 1,3 мас.ч. (23,8% ) этилового эфира 4-[[4-(5-метил-1,3,4-тиадиазол-2-ил)-2-морфолинил] -метокси]-бензойной кислоты; т.пл. 112,4оС (соединение 15).
П р и м е р 12. Смесь 2,9 мас.ч. 3-хлор-6-(метилсульфонил)-пиридазина, 4 мас. ч. промежуточного 2,2 мас.ч. триэтиламина и 131 мас.ч. толуола перемешивают в течение 20 ч при температуре кипения с обратным холодильником. После охлаждения добавляют 100 мас.ч. воды и перемешивают в течение 12 ч. Выпадающий осадок отфильтровывают, промывают водой и растворяют в хлористом метилене. Этот раствор высушивают, фильтруют и выпаривают, затем остаток кристаллизуют из этанола, получая 4 мас.ч. (763,3%) этилового эфира 4-[[4-[6-(метилсульфонил)-3-пиридазинил)-2-морфолинил]-метокси]-бензойной кислоты; т.пл. 196,6оС (соединение 7).
П р и м е р 13. К перемешиваемому и охлаждаемому (± 10оС) раствору из 2,9 мас. ч. интермедиата 25, 2,3 мас.ч. промежуточного 27, 4,7 мас.ч. трифенилфосфина в 45 мас.ч. тетрагидрофурана добавляют по каплям раствор 3 мас.ч. диэтилового эфира азодикарбоновой кислоты в незначительном количестве тетрагидрофурана. После завершения перемешивание продолжают в течение ночи при комнатной температуре. Выпадающий в осадок продукт реакции отфильтровывают и фильтрат выпаривают. Остаток кристаллизуют из 2-пропанола. Кристаллизованный продукт реакции отфильтровывают, объединяют с выпадающим в осадок продуктом реакции и кристаллизуют из этанола. Продукт реакции отфильтровывают, промывают 2-пропанолом и высушивают под вакуумом при 50оС, получая 3,0 мас.ч. (60,1% ) 3-хлор-6-[2-[2-[4-(3-этил-1,2, 4-оксадиазол-5-ил)-фенокси]-этил]-4- морфолинил]-пиридазина; т.пл. 164,1оС (соединение 31).
П р и м е р 14. Смесь 2,5 мас.ч. соединения 1, 0,5 мас.ч. раствора тиофена в метаноле 4% -ной концентрации, 1 мас.ч. окиси кальция и 119 мас.ч. этанола гидрируют при обычном давлении и при 20оС с помощью 1 мас.ч. 10%-ного катализатора палладия на древесном угле. После поглощения вычисленного количества водорода катализатор отфильтровывают и фильтрат выпаривают. К остатку добавляют воду и содержимое превращают в основание с помощью концентрированной NH4OH. Продукт реакции экстрагируют хлористым метиленом и экстракт высушивают, фильтруют и выпаривают. Остаток очищают с помощью колоночной хроматографии (силикагель; СНСl3/CH3OH 98:2). Элюент целевой фракции выпаривают и остаток кристаллизуют из смеси 2-пропанола и диизопропилового эфира, получая 0,9 мас.ч. (39,7%) этилового эфира 4-[[4-(3-пиридазинил)-2-морфолинил]-метокси]-бензойной кислоты; т.пл. 110,5оС (соединение 8).
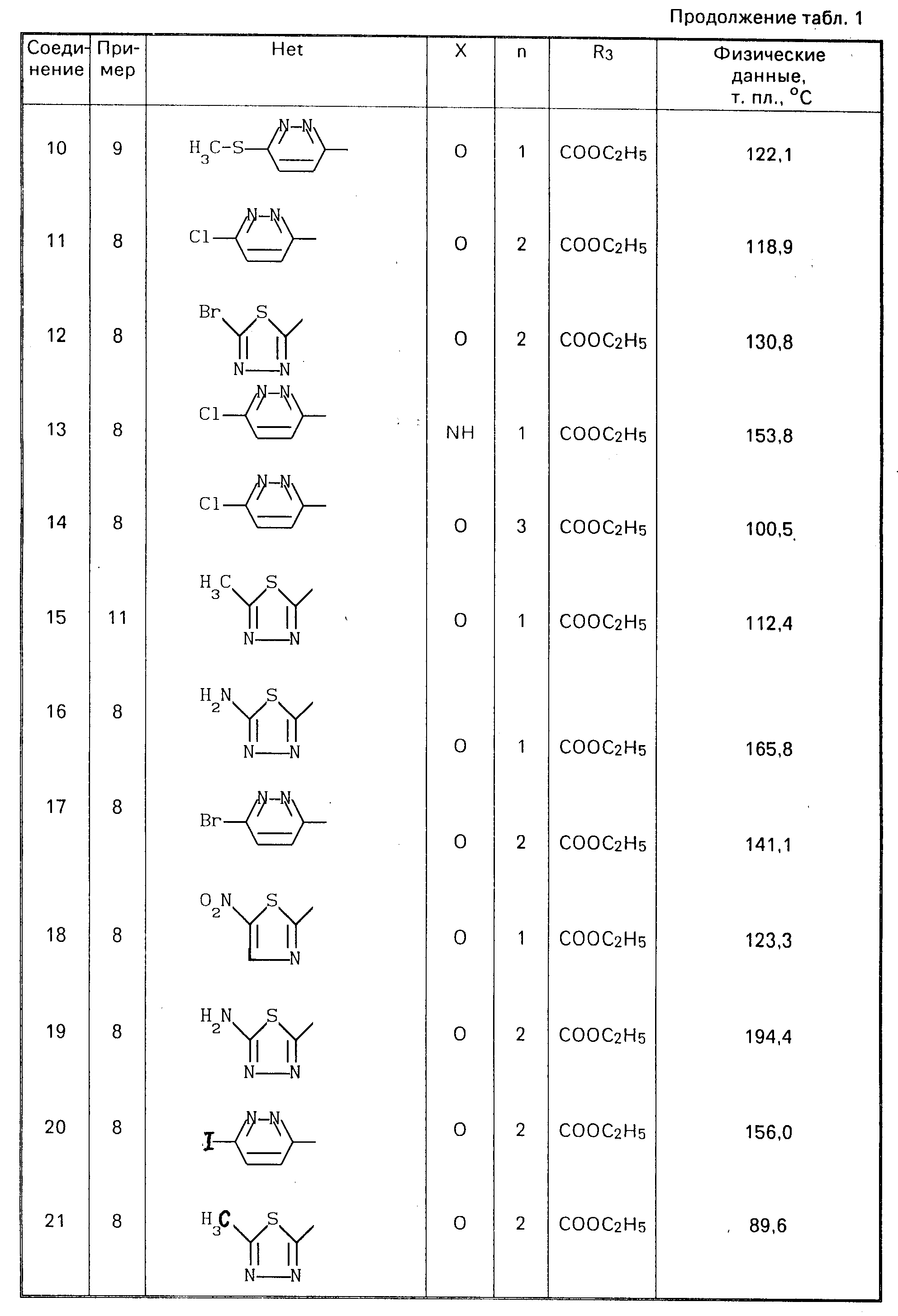
Соединения, перечисленные в табл. 1, получают по методикам, описанным в любом из предшествующих примеров 8-14.
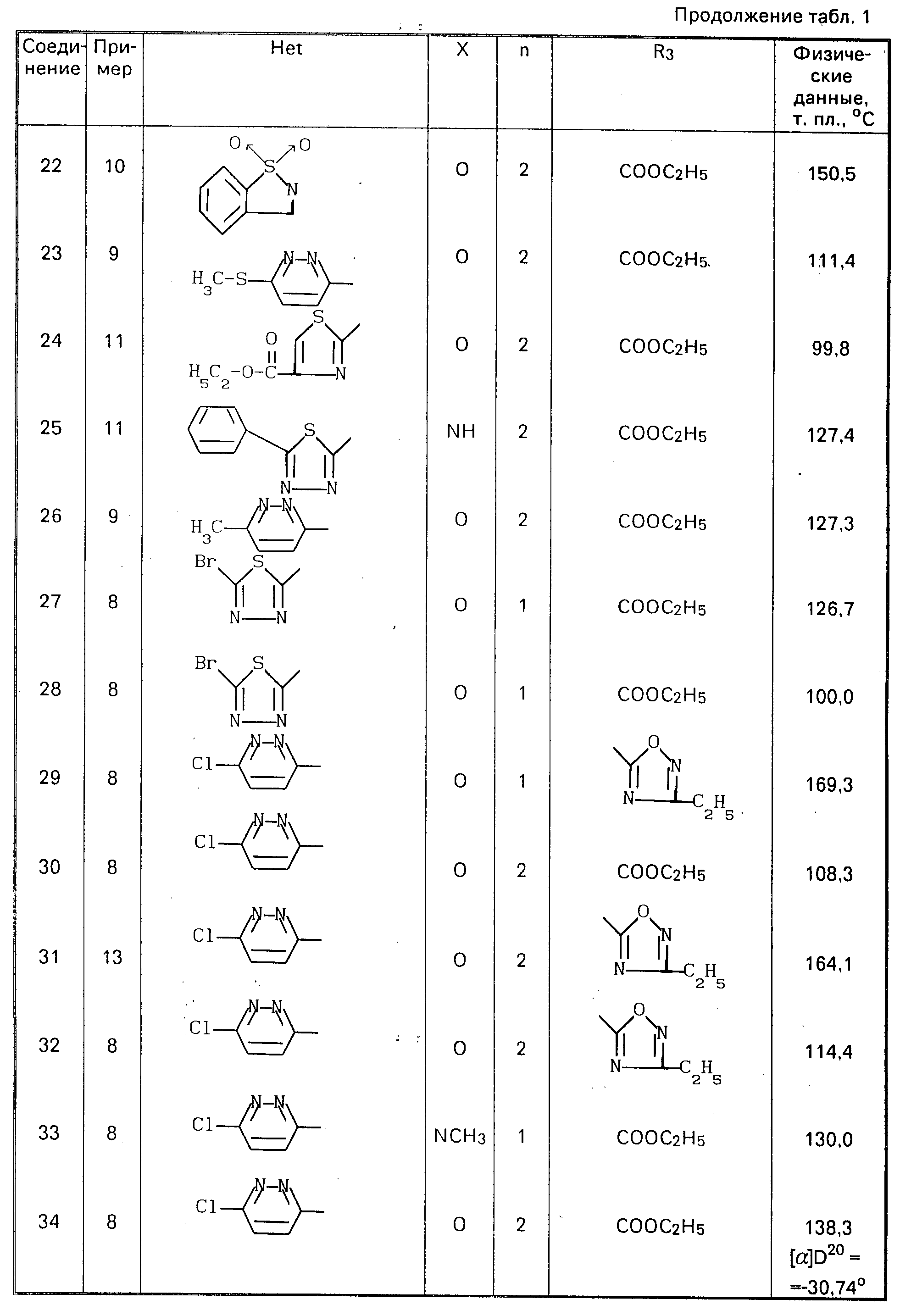
П р и м е р 15. Соединения, перечисленные в табл. 2, получают по методикам, описанным в любом из предшествующих примеров 8-14.
Б. Биологические примеры.
Сильная противовирусная активность соединений формулы (I) доказывается данными, полученными в следующем эксперименте.
П р и м е р 16. Испытание минимальной ингибирующей концентрации пикорнавируса.
Минимальная ингибирующая концентрация соединений настоящего изобретения против штаммов Человеческого Риновируса (ЧРВ)
-2, -9, -14,
-29. -39. -41, -42, -45, -51, -59, -63, -70, -72, -85, -86, -89 определена по стандартному испытанию ослабления цитопатического эффекта. К каждой из 96 ячеек микротитрованной чашки Петри
с культурой
тканей было добавлено 60 мкл поддерживающей среды для клеток Ohio Hela [Основная питательная среда Иглса, дополненная 5%-ной сывороткой Foetal Calf Serum (FCS)]
К двум ячейкам
добавлено 60
мкл соответствующего исходного разбавления соединения формулы (I) и двукратные разбавления были сделаны, чтобы покрыть широкий предел концентраций соединения. Впоследствии были добавлены
120 мкл
инфекционного раствора вируса в основной питательной среде Иглса с 2%-ным буфером Гепеса, 2%-ной сывороткой FCS и 30 ммоль MgCl2 во все ячейки, за исключением контрольных для
клеток и
соединений. Указанный инфекционный вирусный раствор имеет ТСIД50-величину (Инфекционная доза тканевой культуры) примерно 100.
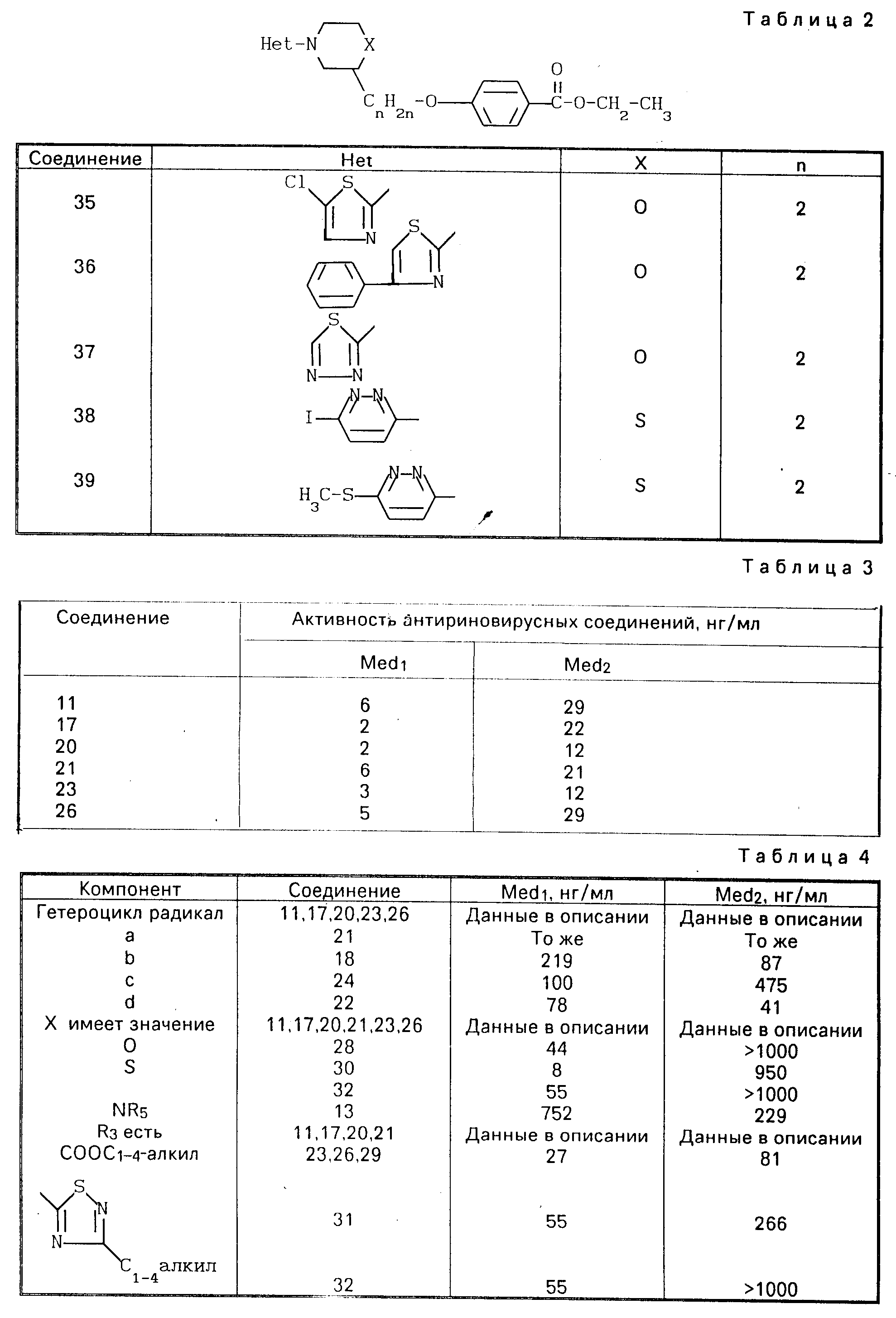
Величина ТСIД50 является дозой вирусов, которые инициируют цитопатический эффект в 50% зараженных клеток. 150 мкл полученных таким образом смесей вируса и соединения были затем перенесены в микротитрованные чашки Петри с субконфлюентными клетками Ohio Helа, выращенными в 100 мкл поддерживающей среды. Соответствующие контроли вируса, контроли клеток и контроли соединений были включены в каждое испытание. Чашки Петри инкубировали в течение от 3 до 5 дн. при 33оС в атмосфере с 5% СО2. Их контролировали ежедневно с помощью световой микроскопии без окрашивания и показания снимали, когда контроли вируса показывали 100% цитопатического эффекта (СРЕ ЦПЭ), обратное титрование вируса подтверждает, что ТСIД50 величина между 32 и 256 была использована при испытании. Величина IC50 для каждых серий вирус-соединение была принята как концентрация в нг/мл, которая защищает 50% клеток от цитопатических эффектов в отношении к необработанным контролям. В стандартной методике испытания соединения были испытаны против двух групп риновирусов, причем первая группа состоит из серотипов ЧРВ -2, -29, -39, -85, -9, -15, -51, -59, -63, -89, -41, а вторая группа состоит из ЧРВ -42, -45, -14, -70, -72 и -86.
Была определена величина IC50 для каждого риновирусного серотипа, а эффективность каждого соединения была определена в виде величины Med1 и величины Med2, которые являются средней величиной значения IC50 всех серотипов из первой и второй группы соответственно.
Результаты испытаний с некоторыми соединениями изобретения приведены в табл. 3 и 4.
Д. Примеры композиций.
Следующие формулирования служат примером типичных фармацевтических композиций в дозовой единичной форме, пригодной для систематического или местного введения теплокровным животным согласно настоящему изобретению. Активный ингредиент (А. И. ), используемый в этих примерах, относится к соединению формулы (I), его фармацевтически приемлемой соли присоединения кислоты или его стереоизомерной формы.
П р и м е р 17. Оральные капли.
500 г. А. И. растворяют в 0,5 л 2-гидроксипропионовой кислоты и 1,5 л полиэтиленгликоля при 60-80оС. После охлаждения до 30-40оС в смесь добавляют 35 л полиэтиленгликоля и хорошо перемешивают. Затем добавляют раствор 1750 г Na соли сахарина в 2,5 л очищенной воды и во время перемешивания добавляют 2,5 л кокосовой отдушки и полиэтиленгликоля g.S. до 50 л, при этом раствор для оральных капель содержит 10 мг/мл А.И.
Полученным раствором заполняют подходящие контейнеры.
П р и м е р 18. Капсулы.
20 г А.И. 6 г натрий лаурилсульфата, 56 г крахмала, 56 г лактозы, 0,8 г колоидального диоксида кремния и 1,2 г стеарата магния интенсивно перемешиваются вместе.
Полученной смесью тотчас же заполняют 1000 пригодных отвержденных желатиновых капсул, каждая из которых содержит 20 мг А.И.
П р и м е р 19. Аэрозоли.
а) К раствору 0,1 г гидроксипропил-β -циклодекстрина (MS 0,43) в 0,7 мл дистиллированной воды добавляют 730 мкг 0,1 N раствоpа HCl и 2,5 мг А.И. После перемешивания в течение 10 мин при комнатной температуре рН полученного таким образом раствора доводят до 5,5 добавлением 0,1 N раствора NaOH. Затем добавляют последовательно 4 мг NaOH и 0,15 мг ацетата фенилртути и данную смесь перемешивают до получения полного раствора.
Затем добавляют дистиллированную воду до объема 1,0 мл. Раствором заполняют стеклянную бутыль, закрытую механическим насосом, позволяющим вводить 0,1 мл на каждое нажатие.
б) К раствору 0,1 г диметил- β -циклодекстрина в 0,7 мл дистиллированной воды добавляют 600 мкг 0,1 N HCl и 2 мг А.И. После перемешивания в течение 10 мин при комнатной температуре смесь растворяют в 10 мл поливинилового спирта и доводят рН полученного таким образом раствора до 5,5 добавлением 0,1 N раствора NaOH. Далее к смеси последовательно добавляют 4 мг NaCl и 2 мг фенилэтилового спирта и все перемешивают до получения полного раствора. Затем добавляют дистиллированной воды до объема 10 мл, которым заполняют стеклянную бутыль, закрытую механическим насосом, позволяющим вводить при каждом впрыскивании 0,1 мл.
Реферат
Использование: в химии производных гетероциклических веществ, в частности в способе получения простых эфиров /тио/ морфолинил- или пиперазинилалкилфенолов или их
кислотно-аддитивных солей, или их стереоизомеров. Сущность изобретения: способ получения простых эфиров /тио/ морфолинил- или пиперазинилалкилфенолов или их кислотно-аддитивных солей, или их
стереоизомеров ф-лы (I), где Het - остаток одного из соединений ф-л (I) - (VI); R1 - C(O)-O-(C -C)-алкил, водород, C1 - C4-алкил, галоген, C1 - C4
-алкилтиогруппа; R2 - C1 -C4-алкилсульфонил, C1 -C4-алкилсулсульфинил или C1 -C4-алкоксикарбонил; R3
-галоген,
аминогруппа, C1 -C4-алкил, фенил; R4 - водород или нитрогруппа; R5 - водород или C1 -C4-алкоксикарбонил; X - кислород, сера
или NR6; R6 - водород или C -C-алкил; n - целое число 1 - 4, предусматривает взаимодействие соответствующего амина с гетероциклом, включающим остаток ф-л (II) - (VI). Структура
соединения
ф-л (I) - (VI):
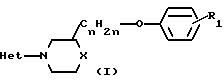
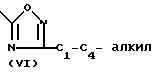
2 с. и 5 з. п. ф-лы, 4 табл.
Формула
где Het - гетероцикл формулы
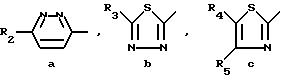
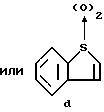
R1 - COOC1-C4-алкил или радикал формулы
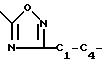
R2 - водород, C1 - C4-алкил, галоген, C1 - C4-алкилтио, C1 - C4-алкилсульфонил, C1 - C4-алкилсульфинил или C1 - C4 -алкилоксикарбонил;
R3 - галоген, аминогруппа C1 - C4-алкил или фенил;
R4 - водород или нитрогруппа;
R5 - водород или C1 - C4 -алкилоксикарбонил;
X - 0, S или NR6, где R6 - водород или C1 - C4-алкил;
n=1,2,3 или 4,
или их стереоизомеры, или их кислотно-аддитивные соли.

Комментарии