Производные фенокси- или феноксиалкилпиперидина и антивирусная композиция на их основе - RU2125565C1
Код документа: RU2125565C1
Чертежи

Описание
Настоящее изобретение относится к новым замещенным феноксипиперидинильным и феноксиалкилпиперидинильным соединениям, содержащим их фармацевтическим композициям и способу лечения или профилактики вирусной инфекции.
В европейской заявке на патент N 320032 раскрываются соединения формулы (а)
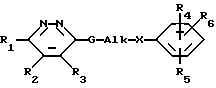
где R1 - водород, C1-C6-алкил, галоген, гидроксил, меркапто, трифторметил, амино, моно- или ди-(C1-C6 -алкил)-амино, циано, C1-C6-алкилокси, арилокси, арил-(C1-C6-алкил)-окси, C1-C6-алкилтио, арилтио, C1-C6 - алкил-сульфинил, C1 -C6-алкилсульфонил, арилсульфинил, арилсульфонил, C1-C6-алкоксикарбонил, C1-C6-алкилкарбонил или арил;
R2 и R3 каждый независимо друг от друга - водород или C1-C6-алкил или R2 и R3 вместе могут образовывать двухвалентный радикал формулы -CH=CH-CH=CH-;
Alk обозначает алифатическую углеводородную цепь (алкановую цепь) с 0-6 C-атомами
C - двухвалентный радикал формулы (б)
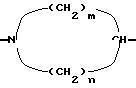
n = 2 или 3;
m = 2 или 3;
X - O, S, NR8 или прямая связь, причем R8 - водород или C1 -C6-алкил;
R4, R5 и R6 независимо друг от друга - водород, галоген C1-C6-алкил, амино, циано или нитро.
Установлено, что соединения обладают антивирусной активностью.
В европейской заявке на патент N 435381 раскрываются пиридазин-амины формулы (в)
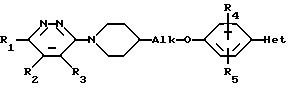
где R1 - водород, C1-C4-алкил, галоген, гидроксил, трифторметил, циано, C1-C4 -алкоксил, C1 -C4-алкилтио, C1-C4-алкилсульфинил, C1-C4-алкилсульфонил, C1-C4-алкилоксикарбонил, C1 -C4 -алкилкарбонил или арил;
R2 и R3 - водород или C1-C4-алкил;
Alk - C1-C4-алкандиил;
R4 и R5 - водород, C1-C4-алкил или галоген;
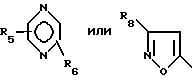
Het -
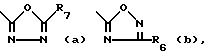
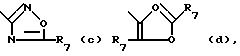
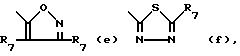
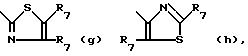
где R6 обозначает водород, C1-C6-алкил, гидрокси-(C1 -C6)-алкил, C3-C6-циклоалкил, арил, арил-(C1-C4) -алкил, C1-C4-алкилокси-C1-C4-алкил, C3 -C6-циклоалкил-C1-C4-алкил, трифторметил или амино;
каждый R7 независимо друг от друга обозначает водород, C1-C6 -алкил, C3-C6- циклоалкил, арил, арил-(C1-C4)-алкил, (C1-C4)-алкилокси-(C1-C4)-алкил, C3-C6 -циклоалкил- (C1-C4)-алкил или трифторметил;
каждый арил независимо друг от друга обозначает фенил, или фенил, замещенный одним или двумя замесителями, причем каждый независимо друг от друга выбирается из группы, включающей галоген, C1-C4-алкил, трифторметил, C1-C4- алкилокси или гидроксил.
Установлено, что соединения обладают антивирусной активностью.
В настоящее время найдено, что замещенные фенокси- и феноксиалкилпиперидинильные производные являются эффективными в качестве антивирусных агентов.
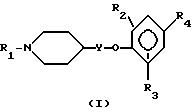
Поэтому настоящее изобретение относится к соединениям формулы I.
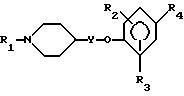
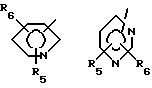
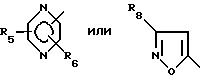
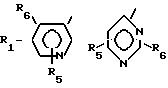
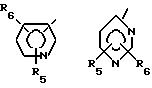
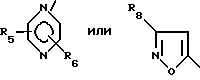
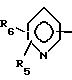
где R1 обозначает
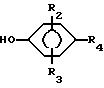
R2 и R3 независимо друг от друга - водород, низший алкил или галоген;
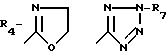
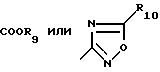
R4 обозначает
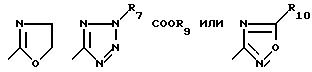
R5 - водород, низший алкил или галоген;
R6 - водород, низший алкил или галоген;
R7 - водород или низший алкил;
R8 - водород, низший алкил или трифторметил;
R9 - низший алкил;
R10 - низший алкил, дифторметил или трифторметил;
Y обозначает связь или низший алкилен;
или их фармацевтически приемлемым солям присоединения кислот.
Далее в рамки изобретения входят фармацевтические композиции, содержащие соединения формулы I.
В аспекте использования изобретение относится к способу борьбы или предохранения от вирусной инфекции в случае млекопитающих-хозяев, включающему введение эффективного количества соединения формулы I нуждающемуся в таком лечении пациенту.
В формуле I низший алкил относится к линейному или разветвленному углеводородному радикалу с 1-4 C-атомами, такому как метил, этил, изопропил, бутил, фтор-бутил и т. п. Низший алкилен относится к линейному или разветвленному углеводородному двухвалентному радикалу с 1-4 C-атомами, такому как метилен, этилен, 1,3-пропилен, 1,3-бутилен и т. п. Галоген относится к обычным галогенам, как фтор, хлор, бром и иод.
Термин "инертный" или "не взаимодействующий" растворитель относится к растворителю, который не принимает участия в реакции.
Некоторые аббревиатуры, используемые здесь ниже, имеют следующие
значения:
ТРР = трифенилфосфин;
ТГФ = тетрагидрофуран;
ДЕАД = диэтил-азодикарбоксилат;
LDA = диизопропиламид лития;
DIPEA = диизопропилэтиламин;
ДМФ = диметилформамид;
NMP = N-метилпирролидин;
и эфир относится к диэтиловому эфиру.
В соединениях формулы I предпочтительно Y - связь, метилен или этилен, а R7, R8 и R9 - низший алкил. Особенно предпочтительными соединениями являются такие, где R1-
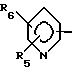
в особенности, где Y - связь, метилен или этилен и особенно где а) R4 - 2-R7-5-тетразолил и R2, R3, R5 и R6 обозначают водород или низший алкил, предпочтительно водород или метил, или b) R4 - COOR9.
Особенно предпочтительными соединениями являются такие, где R1 - 5-метил-2-пиридинил; R2 и R3 - водород и где или а) R4 обозначает 2-метил-5-тетразолил и Y - связь или б) R4- 2-метил-5-тетразолил и Y - этилен или в) R4 - COOC2H5 и Y - этилен или где R1 - 2-метил-4-пиридинил, R2- 5-метил, R3 - 3-метил, R4 - 2-метил-5-тетразолил и Y - этилен.
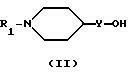
Соединение формулы I получают путем взаимодействия 1-R1-4-гидрокси- или 1-R1-4-гидроксиалкил-пипиридина формулы II
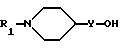
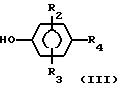
где Y - связь или низший алкилен соответственно с фенолом формулы III
в присутствии трифенилфосфина и диэтилазодикарбоксилата в инертном растворителе, таком как метиленхлорид, при температуре от 0oC до температуры кипения с обратным холодильником реакционной смеси.
Альтернативно в предпочтительном варианте способа соединения формулы I, где R1 представляет собой замещенный или незамещенный пиридинил, пиримидинил или пиразинил, получают путем взаимодействия фенокси- или феноксиалкил-пиперидина формулы IV
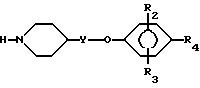
с соответствующим галогенпиридином, галогенпиримидином или галогенпиразином (R1-X, где X - галоген), необязательно в присутствии основания, предпочтительно органического основания, например DIPEA. Реакцию осуществляют в инертном растворителе, таком как NMP, при температуре от 25oC до температуры кипения растворителя. Если желательно, реакцию можно осуществлять в среде, сочетающей функции как основания, так и растворителя, например DIPEA.
Промежуточные
соединения формулы IV получают путем взаимодействия фенола формулы III с 1-бензил-4-гидрокси- или 1-бензил-4-гидроксиалкил-пиперидином формулы V
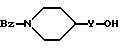
в присутствии TPP и ДEAД, как описано выше. Бензильную группу затем удаляют обычными способами, такими как реакция с водородом при использовании каталитического количества палладия на угле.
Промежуточные соединения формулы II, где R1 - замещенный или незамещенный пиридинил, пиримидинил или пиразинил, получают путем взаимодействия соответствующего 4-гидрокси- или 4-гидроксиалкил-пиперидина с соответствующим галогенпиридином, галогенпиримидином или галогенпиразином (R1-X; X - галоген), как описано выше для получения соединений формулы I из промежуточных соединений формулы IV. Галогенпиридины, галогенпиримидины и галогенпиразины (R1-X) известны в уровне техники и обычно имеются в продаже.
Промежуточные соединения формулы II, где R1 - изоксазол или замещенный изоксазол, получают путем взаимодействия 5-амино-3-R7-изоксазола
формулы
VI
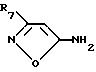
с аллилакрилатом в инертном растворителе, например NMP, и с основанием, например K2CO3, при температуре от комнатной до температуры кипения растворителя, с образованием соединения формулы VII
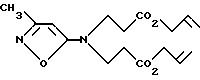
Восстановление соединения формулы VII, например с помощью гидрида металла, такого как литийалюминийгидрид, в инертном растворителе, таком как бензол, при температуре от -50oC до температуры кипения растворителя, дает соединение формулы VIII
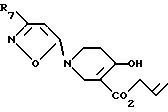
которое вводят во взаимодействие с тетракис-трифенилфосфинпалладием, приводя к образованию соединения формулы IX
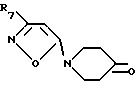
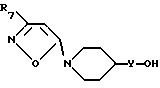
Кетон формулы IX восстанавливают при использовании обычных способов, например, с помощью комплексного гидрида металла, с получением соединения формулы II, где R1 - 3-R7- изоксазол-5-ил и Y - связь, или кетон формулы IX обрабатывают соответствующим реактивом Виттига, например как (низший алкилиден)-фосфоран или фосфон (низший алканоат), и полученный в результате продукт восстанавливают каталитически и/или с помощью гидрида металла, например как NaAlH2 (OCH2CH2OCH3)2, имеющийся в продаже под названием Vitride и т.п. с получением соединения формулы II, где R1-3-R7-изоксазол-5-ил, а Y-низший алкилен:
5-Амино-3-R6-изоксазолы, где R7 - водород или низший алкил, известны или могут быть получены известными способами [Stevens и др., Tet. Let. 25(41), c.4587-90 (1984); Himbert и др. Liebigs Ann. Chem. 403 (1990)].
Промежуточные фенолы формулы III, где R4 - COOR9, являются, как правило, известными соединениями. Промежуточные фенолы формулы III, где R4 - оксазолин-2-ил, подробно описаны в патенте США 4939267 [Diana].
Промежуточные фенолы формулы
III,
где R4 - тетразолил, получают путем взаимодействия 4-Z-O-R2-R3 - бензонитрила, в котором Z обозначает защитную группу; легко отщепляющуюся от простого
ароматического
эфира, такого как метиловый, бензиловый и т.п., с азидом натрия или т.п., в инертном растворителе при температуре от комнатной до температуры кипения растворителя с образованием
соединения формулы
X
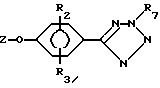
где R7 - водород.
Если желательно, 5-/4-Z-O-R2-R3-фенил/тетразол формулы X алкилируют путем введения во взаимодействие с основанием и низшим алкилгалогенидом R7 - X в инертном растворителе при температуре от 0oC до температуры кипения растворителя с получением соединений формулы X, где R7 - низший алкил.
Защитную группу Z удаляют путем отщепления с помощью кислоты, например путем введения во взаимодействие с HCl, HBr или BBr3 с получением 2-R7-5-/4-гидрокси-R2-R3-фенил/-2H-тетразола (формула X, Z-H; R7 - низший алкил).
Промежуточные фенолы формулы III, где R4 - оксадиазолил
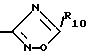
получают из соответствующего 4-Z-O-R2-R3-бензонитрила путем введения его во взаимодействие гидроксиламин-гидрохлоридом в инертном растворителе, предпочтительно в алканоле, например как метанол, этанол, н-бутанол и т.п. в присутствии основания, такого как карбонат калия или по предпочтительному варианту соли щелочного металла карбоновой кислоты, такой как трифторацетат натрия или ацетат натрия при температуре от комнатной до температуры кипения растворителя. Таким образом, полученный продукт затем вводят во взаимодействие с ангидридом кислоты формулы (R10CO)2O, например как ангидрид трифторуксусной кислоты или ацетангидрид при температуре от комнатной до температуры кипения реакционной смеси, в основном растворителе, таком как пиридин.
Защитную группу затем удаляют путем отщепления с помощью кислоты, как описано выше.
Промежуточные продукты формулы V, где Y - связь, имеются в продаже и могут быть бензилированы обычными методами, такими, которые известны в уровне техники.
Промежуточные продукты формулы V, где Y - алкилен, известны или
могут быть получены путем восстановления
соответствующих сложных эфиров формулы XI
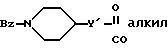
где Y' - низший алкилен, содержащий на один атом углерода меньше, чем Y.
Восстановление сложного эфира хорошо известными в уровне техники способами, такими, как с помощью комплексного гидрида металла, приводит к первичным спиртам в качестве получаемых продуктов. Если желательно, алкилирующий агент, такой как алкиллитий или реактив Гриньяра, может быть введен во взаимодействие со сложным эфиром, образуя разветвленный гидроксиалкилен.
Конечно, нужно принимать во внимание, что последовательность, в которой осуществляются вышеописанные реакции, может быть
различной. Например, нитрил формулы XII
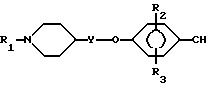
получают путем реакции пиперидина формулы II с 4-гидрокси-R2-R3 -бензонитрилом (формулы III, R4-CH) при условиях, описанных выше для получения соединений формулы I путем взаимодействия пиперидина формулы II с фенолом формулы III.
Нитрил формулы XII по очереди превращают в соединения формулы II, где R4 - тетразолил или оксадиазолил, путем введения во взаимодействие с азидом натрия или гидроксиламином, как описано выше при получении фенолов формулы III, где R4 - тетразолил или оксадиазолил соответственно.
Альтернативно, промежуточное соединение
формулы XII может быть получено путем реакции
сочетания 4-гидрокси-R2-R3-бензонитрила с пиперидином формулы N, как описано выше для получения промежуточного соединения формулы
IV с образованием соединения формулы XIII
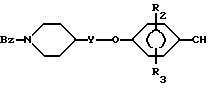
которое после удаления бензильной группы, вводят во взаимодействие с соответствующим галогенпиридином, галогенпиримидином или галогенпиразином (R1-X), как описано выше для получения соединений формулы I, с получением соединения формулы XII.
Также нужно принимать во внимание, что ни согласование выбора гетероциклического заместителя R4, ни последовательность получения промежуточных соединений не являются критическими для успешного синтеза соединений формулы I.
Соединения согласно изобретению являются достаточно основными, чтобы образовывать соли присоединения кислот, и пригодны как в форме свободного основания, так и в форме солей присоединения кислот, и обе формы далее составляют часть изобретения. Соли присоединения кислот в некоторых случаях представляют собой более пригодную форму для использования, и на практике использование солевой формы равнозначно использованию основной формы. Кислоты, которые могут быть использованы для получения солей присоединения кислот, предпочтительно включают такие, которые образуют, когда их комбинируют со свободным основанием, приемлемые в медицине соли, то есть соли, анионы которых относительно безвредны для животного организма в используемых в медицине дозах солей, так что присущие свободному основанию целебные свойства не ухудшаются за счет побочных эффектов, приписываемых анионам.
Примеры соответствующих солей присоединения кислот, не ограничивающие объема охраны изобретения, включают гидрохлорид, гидробромид, сульфат, кислый сульфат, малеат, цитрат, тартрат, метансульфонат, п-толуолсульфонат, додецилсульфат, циклогексансульфамат и т.п. Однако другие приемлемые в медицине, соответствующие соли, входящие в рамки изобретения, представляют собой соли, происходящие от других неорганических и органических кислот. Соли присоединения кислот основных соединений получают или путем растворения свободного основания в водном спиртовом растворе, содержащем соответствующую кислоту, и выделения соли путем выпаривания раствора; либо путем введения во взаимодействие свободного основания с кислотой в органическом растворителе, в случае которого соль прямо выделяется, осаждается вторым органическим растворителем или может быть получена путем концентрирования раствора. Хотя приемлемые в медицине соли основных соединений предпочтительны, все соли присоединения кислот далее входят в рамки настоящего изобретения. Все соли присоединения кислот пригодны в качестве источников свободной основной формы, даже если отдельная соль сама по себе желательна только в качестве промежуточного продукта, как, например, когда соль получают только для целей очистки или идентификации, или когда ее используют в качестве промежуточного продукта при получении приемлемой в медицине соли путем способов ионного обмена.
Структуры соединений изобретения устанавливаются способом синтеза, элементным анализом и ИК-спектроскопией и в некоторых случаях УФ-спектроскопией, ЯМР или масс-спектрометрией. За ходом реакций следят с помощью тонкослойной хроматографии (ТСХ) или газожидкостной хроматографии (ГЖХ).
Теперь изобретение может быть проиллюстрировано, ссылаясь на нижеследующие примеры, которые, однако, не ограничивают объема охраны изобретения.
Получение промежуточных соединений.
Получение 1: 2-Метил-5-(4-гидроксифенил)-2H-татразол (формула III; R2-R3-H; R4-2-CH3-2H-тетразол-5-ил).
а) Смесь, содержащую 325 г 4-цианофенола, 346 мл бензилхлорида и 758 г карбоната калия в 1,2 л NMP, нагревают в течение 1,5 ч при 95oC при перемешивании. Реакционную смесь охлаждают до комнатной температуры и выливают в 5 л холодной волы. Полученное твердое вещество белого цвета собирают, промывают водой, гексаном и сушат при 70oC в вакууме, получая 570,0 г 4-бензилоксибензонитрила.
b) Смесь 285 г нитрила, 262,5 г триэтиламин-гидрохлорида и 124 г азида натрия в 1,5 л ДМФ и в атмосфере азота перемешивают в течение 18 ч при температуре кипения с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры, выливают в 1 л холодной волы и подкисляют с помощью 3 н. HCl. Полученное твердое вещество белого цвета собирают, промывают водой и сушат при 60oC в вакууме, в течение 48 ч, получая 337 г 5-(4-бензилоксифенил)-тетразола.
c) К перемешиваемому раствору, содержащему 337 г тетразола и 362 г DIPEA в 1 л NMP, охлажденному до 18oC, а атмосфере азота в течение 1,5 ч прикапывают 200 г метилиодида в 170 мл NMP. После перемешивания дополнительно в течение часа при комнатной температуре, реакционную смесь разбавляют с помощью 340 мл воды и охлаждают до 18oC. Полученное твердое вещество собирают, промывают водой, перекристаллизуют из этанола и сушат в вакууме при 50oC, получая 232,3 г 2-метил-5-(4-бензилоксифенил)-2H-тетразола [формула X; R2-R3-H; R7-CH3, Z-Bz (бензил)].
d) Смесь, содержащую 214,2 г метилтетразола, 140 мл концентрированной соляной кислоты и 1,08 л ледяной уксусной кислоты, кипятят с обратным холодильником в течение 19 ч. Большую часть уксусной кислоты удаляют путем выпаривания при пониженном давлении при 60oC, и полученный шлам разбавляют с помощью 1,5 л холодной волы. Полученное твердое вещество собирают, промывают водой и сушат. Перекристаллизация из этанола дает после высушивания при 60oC в течение 20 ч 104,3 г 2-метил-5-(4-гидроксифенил)-2H-тетразрола.
Получение 2: 2-Метил-5-(4-гилрокси-3,5-диметилфенил)-2H-тетразол (формула III; R2-3-CH3; R3-5-CH3; R4-2-CH3-2H-тетразол-5-ил).
Целевой продукт получают способом, описанным выше в получении 1 исходя из 2,6-диметил-4-цианофенола.
Получение 3: 3-(3,5-Дифтор-4-гидроксифенил)-5-трифторметил-1,2,4-оксадиазол (формула III; R2-3-F, R3-5-F; R4 -5-CF3-1,2,4-оксадиазол-3-ил).
0,1 моль 3, 5-Дифтор-4-метоксибензонитрила, 0,3 мл гидроксиламингидрохлорида и 0,3 моль карбоната калия добавляют к 400 мл этанола и кипятят с обратным холодильником в течение ночи. Продукт отфильтровывают и перекристаллизуют из метанола, получая 3,04 г 3,5-дифтор-4-метокси-бензамид-оксима. Этот продукт растворяют в 5 мл пиридина и прикапывают 5,6 мл ангидрида трифторуксусной кислоты при комнатной температуре. Путем охлаждения продукт отверждается и его промывают водой, получая 4,1 г продукта.
Получение 4: 3-(4-Гидроксифенил)-5-трифторметил-1,2,4-оксадиазол (формула III: R2-R3-H; R4-5-CF3 -1,2,4-оксадиазол-3-ил).
13,32 г (0,1 моль) 4-Метоксибензонитрила, 20,85 г (0,3 моль) гидроксиламингидрохлорида и 41,40 г (0,3 моль) карбоната калия добавляют к 400 мл абсолютного этанола и кипятят с обратным холодильником в течение 21 ч. Продукт отфильтровывают перекристаллизуют из метанола, получая 3,12 г (0,02 моль) 4-метоксибензамидоксима.
Этот продукт растворяют в 5 мл пиридина и при комнатной температуре прикапывают 5,7 (0,04 моль) ангидрида трифторуксусной кислоты. Путем охлаждения смесь отверждается и ее промывают водой, получая 4,3 г продукта.
Получение 5: 4-(2-Гилроксиэтил)пиперидин.
а) Этил-4-пиперидинилацетат растворяют в 50 мл дихлорметана; в то время как смесь охлаждают на ледяной бане, добавляют 3,1 мл (22 ммоль) триэтиламина, затем бензилхлорид; смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения органический слой экстрагируют водой, рассолом и затем сушат над сульфатом магния. После кристаллизации получают 2,05 г N-бензол-4-пиперидинил-ацетата (формула XI; Y'-CH2, алкил- C2H5 ).
b) 2 г (7,5 ммоль) Этого промежуточного соединения обрабатывают ТГФ и добавляют 0,4 г (10 ммоль) литийалюминийгидрида в 5 мл метиленхлорида. Смесь перемешивают в течение 2 ч, затем реакцию прекращают путем прикапывания воды. Органический слой сушат над карбонатом калия, отфильтровывают и концентрируют в вакууме, получая масло желтого цвета, которое кристаллизуется при стоянии, давая N-бензил-4-(2-гидроксиэтил)-пиперидин (формула V; Y-C2H4 ).
с) 4 ммоль Этого промежуточного соединения, 15 ммоль (3 мл) 5М раствора формиата аммония и каталитическое количество палладия на угле суспендируют в 25 мл метанола и кипятят с обратным холодильником в течение 2 ч. Продукты затем подщелачивают и экстрагируют метиленхлоридом, органический слой промывают дважды рассолом и затем водой, концентрируют в вакууме и кристаллизуют путем оставления стоять, получая целевой продукт.
Получение 6: 4-(2-Гилроксиметил)пиперидин.
а) Продаваемый этил-4-изонипекотат растворяют в 50 мл дихлорметана, смесь охлаждают на ледяной бане и добавляют 3,1 мл (22 ммоль) триэтиламина. После этого добавляют бензилхлорид; смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения органический слой экстрагируют водой, рассолом и затем сушат над сульфатом магния. После кристаллизации получают 2,05 г этил-N-бензил-4-изонипекотата (формула XI; Y' -связь, алкил - C2H5). 3 г (12 ммоль) этого промежуточного соединения вводят во взаимодействие с 0,47 г (12 ммоль) литийалюминийгидрида и поступают аналогичным образом, как при получении 4-пиперидинэтанола. Органический слой сушат над сульфатом магния, отфильтровывают и концентрируют в вакууме, получая масло желтого цвета, которое при стоянии кристаллизуется, давая N-бензил-4-(2-гидроксиметил)-пиперидин (формулы V:Y-CH2).
b) 4 ммоль Этого промежуточного соединения, 15 ммоль (3 мл) 5 М раствора формиата аммония и каталитическое количество палладия на угле растворяют в 25 мл метанола и кипятят с обратным холодильником в течение 2 ч. Продукты затем подщелачивают и экстрагируют метиленхлоридом, органический слой промывают дважды рассолом и затем водой, концентрируют в вакууме и при стоянии выкристаллизовывается целевой продукт.
Получение 7: 3-Метил-5-[4-(2-гидроксиэтил)-1-пиперидинил] -изоксазол (формула II; R1-3-CH3-5-оксазолил, Y-C2H4).
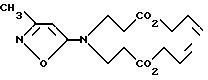
а) Смесь 9,81 г (100 ммоль)
5-амино-3-метилизоксазола, 200 мл NMP, 69 г карбоната калия, 4,2 г иодида калия и 64 мл (500 ммоль) аллилакрилата кипятят с обратным
холодильником в течение 16 ч. После охлаждения продукты
распределяют между эфиром
и водой. Водный слой промывают дважды с помощью 250 мл эфира, и органический слой объединяют. Органические слои
промывают трижды с помощью 1 н. HCl, затем рассолом и сушат
над сульфатом магния, затем концентрируют в вакууме, получая 16,9 г сложного бис-эфира формулы VII
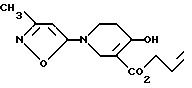
b) 16,1 г Этого промежуточного соединения растворяют в безводном бензоле и прикапывают к гидриду натрия, затем кипятят с обратным холодильником в течение 30 мин и охлаждают. Прикапывают 100 мл насыщенного раствора хлорида аммония и затем 14,2 мл воды. Смесь экстрагируют трижды с помощью эфира, и органические экстракты объединяют, сушат над сульфатом магния и после этого концентрируют в вакууме, получая 8,59 г циклизованного продукта VIII
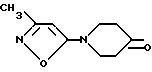
с) 7,93 г (3,0 ммоль) Вышеполученного промежуточного продукта обрабатывают ТГФ, добавляют 2,62 мл (30 ммоль) морфолина и 8,5 мг (76 ммоль) татракис (трифенилфосфинил)-палладия и перемешивают в течение 5 мин. Добавляют 80 мл эфира, после высушивания с выходом 68% (3,71 г) получают пиперидинон IX
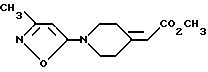
d) 3,75 г (20,8 ммоль) Вышеполученного промежуточного соединения растворяют в 20 мл ТГФ и в течение 20 мин прикапывают 4,86 мл (30 ммоль) триметилфосфоноaцетата в 90 мл ТГФ. Туда же добавляют 20 мл 1,8 М LDA/ТГФ в циклогексане, в то время как реакционную смесь выдерживают при -78oC. Продукты доводят до комнатной температуры и распределяют между 50 мл эфира и 200 мл воды. Органический слой промывают рассолом и затем сушат над сульфатом магния и концентрируют в вакууме, получая 4,62 г сложного эфира
e) 7,2 г (40 ммоль) Бромида меди-(1)в 75 мл ТГФ охлаждают до 0oC и прикапывают 11,2 мл 70%-ного раствора NaAlH2(OCH2CH2OCH3)2 в толуоле. 8,0 мл н-Бутанола и раствор 0,18 г вышеполученного промежуточного соединения в ТГФ перемешивают в течение 30 мин. Реакцию прекращают с помощью 25 мл волы и продукты выливают в 100 мл насыщенного раствора хлорида аммония. Водный слой промывают трижды водой, рассолом и затем сушат над сульфатом магния, и концентрируют в вакууме, получая соединение формулы
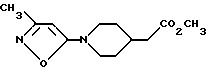
f) Раствор 0,33 г вышеполученного промежуточного соединения получают путем его растворения в 4 мл ТГФ и охлаждают его до 0oC. В течение 15 мин прикапывают 3,2 мл 1М раствора диизобутилалюминийгидрида в гексане. Реакцию прекращают с помощью соли Rochelle и 5 мл воды. Органический слой промывают трижды водой и затем рассолом, сушат над сульфатом магния и концентрируют в вакууме, получая количественный выход целевого продукта.
Получение 8: 1-(5-Метил-2-пиридинил)-4-(2-гидроксиэтил)пиперидин (формула II; R1-5-CH3-2-пиридинил, Y-C2H4).
20 ммоль 5-Метил-2-бромпиридина и 15 ммоль 4-(2-гидроксиэтил)-пиперидина растворяют в 100 мл смеси 1:1 NMP и DIPEA и кипятят с обратным холодильником в течение 1,5 ч; затем охлаждают и оставляют стоять в течение ночи. Продукты экстрагируют 2 н. раствором гидроксида натрия, затем трижды водой, сушат над сульфатом магния и концентрируют в вакууме, получая целевой продукт.
Получение 9.
Следуя процедуре, аналогичной описанной выше в получении 8, но заменяя соответствующим галогенпиридином, галогенпиримидином или галогенпиразином 5-метил-2-бром-пиридин и заменяя соответствующим пиперидинолом или пиперидиналканолом 4-(2-гидроксиэтил)-пиперидин, получают промежуточные соединения формулы II, указанные в табл. 1. В табл. 1 "pyr" обозначает пиридинил; "pym" обозначает пиримидинил и "pyz" обозначает пиразинил. NMP/DIPEA относится к смеси 1: 1 диизопропилэтиламина с N-метилпирролидином. Так, где в качестве растворителя указан н-бутанол, к реакционной смеси добавляют карбонат калия. Промежуточные соединения формулы II используют без дальнейшей очистки для получения соединений формулы I.
Получение целевых продуктов.
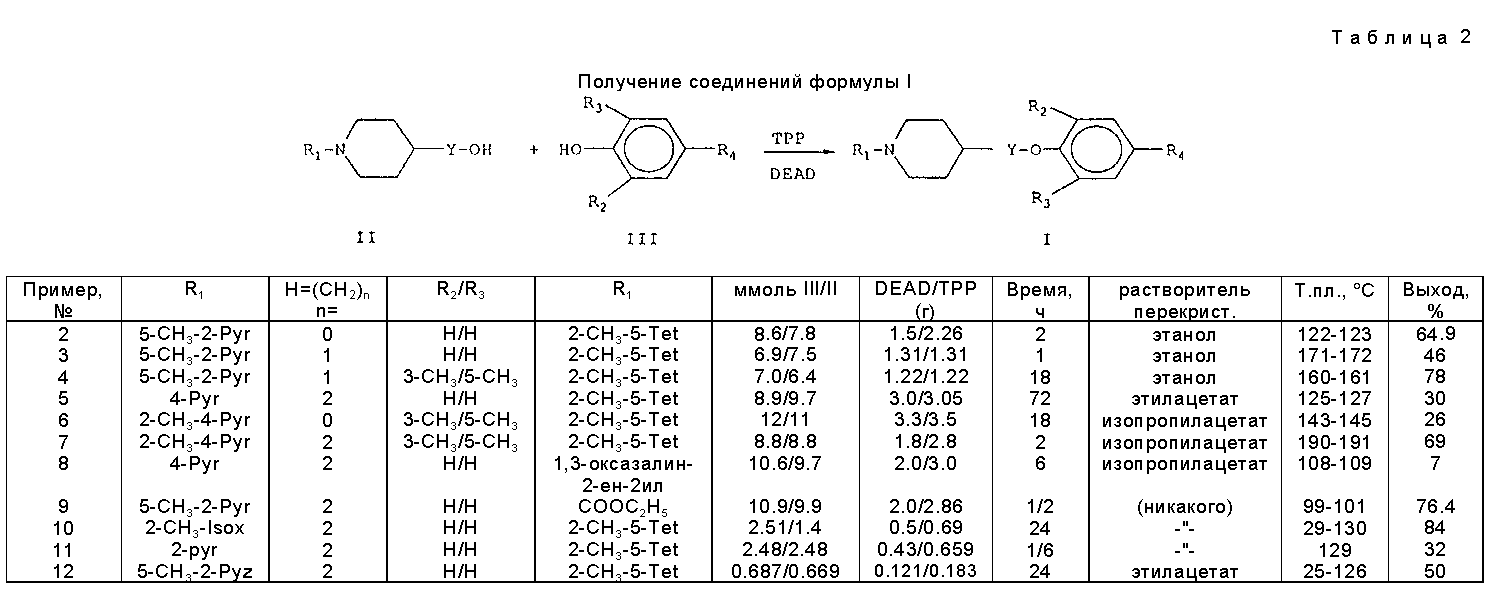
Пример 1. (Формула I; R1-5-CH3-2-пиридинил, R2-3-CH3, R3-5-CH3, R4-2-CH3 -2H-тетразол-5-ил, Y=C2H4).
9, 8 ммоль 2-Метил-5-(4-гидрокси-3,5-диметилфенил)-2H-тетразола (III), 8,9 ммоль 1-(5-метил-2-пиридинил)-4-(2-гидроксиэтил) пиперидина (II) и 2,57 г ТРР растворяют в 150 мл метиленхлорида и охлаждают на ледяной бане. К этой смеси в течение 30 мин прикапывают раствор 1,79 г ДЕАД в 2,5 мл метиленхлорида. После добавления смесь кипятят с обратным холодильником в течение часа, затем охлаждают. Для остановки реакции добавляют 50 мл воды и водный слой промывают дважды метиленхлоридом, органические экстракты объединяют и промывают с помощью 10%-ного раствора гидроксида натрия, рассолом и водой, затем сушат над сульфатом магния и концентрируют в вакууме. Неочищенный продукт перекристаллизуют из этанола, получая целевое соединение формулы I с выходом 66%. Т.пл. 174-176oC.
Примеры 2-12.
Следуя методике, подобной описанной в примере 1, но заменяя 2-метил-5-(4-гидрокси-3, 5-диметилфенил)-2H-тетразол и 1-(5-метил-2-пиридинил)-4-(2-гидроксиэтил)-пиперидин соответствующим фенолом формулы III и соответствующим пиперидином формулы II, получают соединения формулы I, указанные в табл. 2.
Аббревиатуры, используемые в табл. 2, следующие: Tet - (2H-тетразолил); Pyr - пиридинил; Pyz - пиразинил и Isox - изоксазолил.
Пример 13. (Формула I: R1-5-CH3 -2-пиримидинил, R2-R3-H, R4-2-CH3-2H-тетразол-5-ил, Y - C2H4).
а) 16,5 г (0,1 моль) Этил-4-пиридинил-ацетана, 8,4 мл (0,1 моль) 12 н. соляной кислоты и 2,5 г оксида платины растворяют в абсолютном этаноле и гидрируют при 280 кПа (40 фунт/дюйм2) водородом на вибраторе Парра. Спустя 1 ч содержимое резервуара отфильтровывают и концентрируют в вакууме, получая 27,79 г этил-4-пиперидинил-ацетата.
b) Вышеполученное соединение растворяют в 100 мл метиленхлорида с 13,8 мл (0,12 моль) бензилхлорида в атмосфере азота. Прикапывают 16,7 мл (0,12 моль) триэтиламина, в то время как смесь охлаждают льдом. По окончании добавления, смесь доводят до комнатной температуры и перемешивают в течение ночи, органический слой экстрагируют водой, затем основанием, затем насыщенным раствором соли. Органический слой концентрируют в вакууме до получения масла. Из масла получают кристаллы, в количестве 14,61 г (выход 56%), представляющие собой этил-N-бензил-4-пиперидинил-ацетат (формулa XI; алкил-этил; Y'-CH2).
с) 14,40 г (0,055 моль) Вышеполученного соединения растворяют в 100 мл безводного ТГФ в атмосфере азота. Медленно добавляют 2,3 г (0,06 моль) литийалюминийгидрида, и смесь перемешивают в течение 18 ч при комнатной температуре. Реакцию прекращают с помощью смеси воды с эфиром. Смесь подщелачивают с помощью гидроксида натрия, и органический слой сушат над сульфатом магния, затем концентрируют в вакууме дo получения масла, причем получают количественный выход N-бензил-4-(2-гидроксиэтил)-пиперидина (формула V; Y-C2H4).
d) 5,98 г (0,025 моль) Вышеполученного
спирта растворяют в 125 мл метиленхлорида
при 0oC. Добавляют по 0,025 моль каждого вещества в следующей последовательности: ТРР, 2-метил-5-(4-гидроксифенил)-2H-тетразол, и по каплям ДЕАД
(в дополнительном количестве 25 мл
метиленхлорида) в атмосфере азота. После этого добавления смесь концентрируют в вакууме и остаток перекристаллизуют из этанола, получая промежуточное соединение
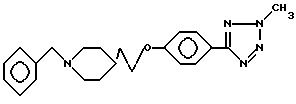
е) 3,91 г (9,64 ммоль) Вышеполученного промежуточного соединения, 7 мл (35 ммоль) 5М раствора формиата аммония и каталитическое количество палладия на угле растворяют в 50 мл метанола и кипятят с обратным холодильником в течение 1,5 ч. Смесь концентрируют и остаток перекристаллизуют из метанола, получая 1,63 г дебензилированного продукта (формулa IV; R2-R3-H, Y-C2H4, R4-2-CH3-2H-тетразол-5-ил).
f) 5,5 ммоль Вышеполученного продукта и 6,7 ммоль 2-хлор-5-метилпиримидина растворяют в 5 мл смеси 1:1 NМP/DIPEA и кипятят с обратным холодильником в течение 6 ч, затем охлаждают и оставляют стоять в течение ночи. Реакционную смесь экстрагируют 5 раз с помощью 25 мл этиленацетата. Органические фракции объединяют и экстрагируют 2 н. раствором гидроксида натрия, затем трижды водой, сушат над сульфатом магния и и концентрируют в вакууме, получая целевой продукт формулы I с выходом 46%.
Пример 14. (Формула I; R1-4-Cl-5-CH3-2-пиримидинил, R2 = R3-H, R4-2-CH3-2H-тетразол-5-ил, Y-C2H4).
Это соединение получают как в примере 13, используя 700 ммоль 2, 4-дихлор-5-метилпиримидина и 700 ммоль промежуточного соединения примера 13d (формула IV; Y= C2H4, R2-R3-H, R4-2-CH3 -2H-тетразол-5-ил) в смеси 1:1 NМР/DIPEA и путем кипячения с обратным холодильником в течение 16 ч. Обрабатывают, получая продукт с выходом 76%.
Пример 15. (Формула I; R1 -5-CH3-2-пиридинил, R2-R3-H, R4-2-CH3-2H-тетразол-5-ил, Y-C2H4).
1,57 г (5,1 ммоль) Промежуточного соединения, описанного в примере 13d (формула IV; Y-С2H4, R2-R3-H, R4-2-СH3-2H-тетразол-5-ил) и 4,3 г (25 ммоль) 5-метил-2-бромпиридина растворяют в 6 мл смеси 1:1 NМР/DIPEA и кипятят с обратным холодильником в течение 2 ч. После охлаждения добавляют 50 мл воды. Полученную смесь экстрагируют трижды с помощью этилацетата. Органические фракции комбинируют и промывают трижды водой, затем рассолом, затем сушат над сульфатом магния и концентрируют в вакууме. Получают 4,9 г (57%) целевого соединения формулы I.
Пример 16. (Формула I; R1-5-CH3 -2-пиридинил, R2-R3-H, R4-5-CH3-1,2,4-оксадиазол-3-ил, Y-C2H4 ).
Смесь, содержащую эквимолярные количества 4-(2-гидроксиэтил)-пиперидина и 2-бром-5-метил-пиридина в смеси 1:1 DIPEA: NMP нагревают обратным холодильником при 140oC в течение 4 ч. После охлаждения к смеси добавляют 100 мл воды и всю совокупность экстрагируют метиленхлоридом, затем промывают дважды водой и один раз раствором хлорида натрия и выпаривают в вакууме. Полученное масло пропускают через небольшой слой силикагеля, элюируя смесью 80% этилацетата с 20% гексана, и растворители выпаривают в вакууме, получая соединение формулы II (R1-5-CH3-2-пиридинил, Y-C2H4).
Это соединение растворяют в минимальном количестве ТГФ вместе с эквимолярными количествами ТРР и 4-цианофенола. При охлаждении перемешиваемого раствора прикапывают эквимолярное количество ДЕАД, растворенное в ТГФ. По окончании добавления раствор оставляют, чтобы он принял комнатную температуру, и перемешивают в течение ночи. Реакционную смесь разбавляют метиленхлоридом и промывают последовательно водой, 10%-ным раствором гидроксида натрия и насыщенным раствором NaCl. Органический слой сушат над сульфатом магния и концентрируют в вакууме. Полученный остаток подвергают перекристаллизации из метанола, получая соединение формулы XII (R1-5-CH3-2-пиридинил, R2-R3-H, Y-C2H4).
Вышеуказанное промежуточное соединение комбинируют с эквимолярными количествами гидроксиламингидрохлорида, тригидрата ацетата натрия, 25 мл этанола и 5 мл воды и кипятят с обратным холодильником в течение 2-8 ч. После концентрирования продуктов в вакууме к остатку добавляют 25 мл уксусного ангидрида и кипятят с обратным холодильником в течение 3 ч. Реакцию прекращают путем выливания реакционной смеси в 400 мл 10%-ного раствора гидроксида натрия при охлаждении льдом. Полученную смесь экстрагируют метиленхлоридом, растворитель выпаривают и полученный продукт перекристаллизуют из метанола, получая целевое соединение формулы I.
Следует отметить, что продукты получений 3 и 4 можно вводить во взаимодействие с любым из промежуточных соединений формулы II согласно методике примеров 1-12 для получения соединений формулы I.
Биологические свойства.
Биологическая оценка соединений формулы I показывает, что они обладают антивирусной активностью. Они пригодны для ингибирования репликации генома вируса in vitro и в первую очередь обладают активностью против picorna-вирусов, включая энтеровирусы, эковирусы и вирусы Коксаки и особенно многочисленныe виды риновирусов. Испытание in vitro соединений изобретения против picorna-вирусoв показало, что репликация генома вируса ингибируется с помощью минимальной ингибирующей концентрации (MIC), колеблющейся в пределах от примерно 0,01 до примерно 5 мкг/мл.
Значения MIC определяются стандартным анализом по уменьшению бляшек следующим образом: клетки HeLa/Ohio/ в монослоях заражают концентрациями вируса, получая примерно 80 бляшек на монослой в случае вирусного контроля (без лекарства). Испытуемое соединение последовательно разбавляют и вводят в агаровую среду сверху или в некоторых случаях также в течение периода адсорбции. MIC определяют как концентрацию соединения, которая уменьшает число бляшек на 50% по сравнению с необработанным вирусным контролем.
По стандартной тест-методике соединения испытывают против набора из 15 человеческих риновирусных (HPV) серотипов, а именно HRV-2, -1A, -1B, -6, -14, -21, -22, -15, -25, -30, -50, -67, -89, -86 и -41. Определяют MIC, оцениваемую для каждого риновирусного серотипа и определяют эффективность каждого соединения в значениях MIC50 и MIC80, которые представляют собой концентрацию, необходимую для ингибирования на 50 и 80% соответственно испытуемых серотипов.
В табл. 3 представлены результаты испытаний характерных соединений примеров изобретения. После указания MIC80 дается число серотипов (N=).
Антивирусные композиции могут быть использованы в виде разбавленного раствора или суспензии в фармацевтически приемлемой водной, органической или водно-органической среде для топического или парентерального введения внутривенной или внутримышечной инъекций, или для введения через нос или глаза; или готовят в виде таблеток, капсул или водных суспензий, которые получаются с обычными эксципиентами для орального введения.
Примеры композиций
(А) Таблетки
Ингредиент - мг/таблетку
Соединение примера 9 - 50.0
Маннит (пат. США) - 223.75
Натриевая кроскармелоза - 6.0
Кукурузный крахмал - 15.0
Гидоксипропил-метилцеллюлоза (пат. США) - 2.25
Стеарат магния - 3.0
(В) Капсулы
Ингредиент - мг/капсулу
Соединение примера
7 - 10.0
Маннит (пат. США) - 488.5
Натриевая кроскармелоза - 15.0
Стеарат магния - 1.5
(С) Парентеральный препарат
Ингредиент - мг/мл
Соединение
примера 2 - 2.0
Декстроза - 39.5
Стерильная вода для инъекций - До 1 млн
Реферат
Изобретение относится к новым производным фенокси- или феноксиалкилпиперидина ф-лы I, где R1 и R4 указаны ниже, R2 и R3 - водород, низший алкил или галоген, R5 и R6 - водород, низший алкил, галоген, R7 - водород или низший алкил, R8 - водород, низший алкил, трифторметил, R9 - низший алкил, R10 - низший алкил, дифторметил, трифторметил, Y - ковалентная связь, низший алкилен, или их соли. Изобретение относится к антивирусной композиции на основе соединений формулы I, использованных в эффективном количестве, которая может найти применение в медицине при профилактике или лечении вирусной инфекции. Соединения ф-лы I получают при взаимодействии 1-R1-4-гидрокси-, 1-R1 -4-гидроксиалкилпиперидина (II) с фенолом ф-лы (III) в присутствии трифенилфосфина и диэтилазодикарбоксилата в инертном растворителе. 2 с. и 7 з.п. ф-лы, 3 табл.
Формула
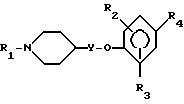
где R1 выбран из
R2 и R3 независимо представляют водород, низший алкил или галоген;
R4 представляет
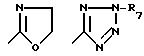
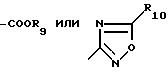
R5 и R6 - водород, низший алкил или галоген;
R7 - водород или низший алкил;
R8 - водород, низший алкил или трифторметил;
R9 - низший алкил;
R10 - низший алкил, дифторметил или трифторметил;
Y представляет ковалентную связь или низший алкилен,
или их фармацевтически приемлемые кислотно-аддитивные соли.
4. Соединение по п.3, в котором R4 представляет 2-R7-5-тетразолил, R2, R3, R5 и R6 - водород или низший алкил.

Комментарии