Бензотиофены в качестве модуляторов аденозиновогорецептора - RU2299882C2
Код документа: RU2299882C2
Описание
Настоящее изобретение относится к соединениям общей формулы

в которой
R представляет собой фенил, необязательно замещенный галогеном, или -пиридин-3- или 4-ил, необязательно замещенный низшим алкилом, или -NR1R2, где R1 и R2 вместе с атомом N, к которому они присоединены, образуют гетероциклические кольца, выбранные из группы, состоящей из морфолинила, тиоморфолинила, пиперидинила или пиперазинила, необязательно замещенные -(СН2)n-гидрокси, низшим алкилом или низшей алкоксигруппой;
n обозначает 0, 1 или 2;
и к их фармацевтически приемлемым кислотным аддитивным солям.
Неожиданно было обнаружено, что соединения общей формулы I являются лигандами аденозинового рецептора. Конкретно, соединения настоящего изобретения имеют высокое сродство с рецептором A2A и высокую селективность к рецепторам A1 и A3.
Аденозин модулирует множество физиологических функций взаимодействием со специфическими рецепторами клеточной поверхности. Активность аденозиновых рецепторов в качестве лекарственного средства была впервые открыта в 1982 году. Аденозин связан структурно и метаболически с биоактивными b нуклеотидами аденозинтрифосфатов (АТФ), аденозиндифосфатов (АДФ), аденозинмонофосфатов (АМФ) и циклических аденозинмонофосфатов (цАМФ); с биохимическим метилированным агентом S-аденосил-L-метионом (SAM) и структурно с коэнзимами NAD, FAD и коэнзимом А; и с РНК. Аденозин и эти связанные с ним соединения вместе важны для регулирования многих аспектов клеточного метаболизма и для модуляции различных действий центральной нервной системы.
Рецепторы для аденозина классифицируются как рецепторы A1, A2A, А2B и A3, относясь к семейству рецепторов, связанных с G-белком. Активация аденозиновых рецепторов аденозином запускает механизм передачи сигнала. Эти механизмы зависят от G-белка, связанного с рецептором. Каждый из подтипов аденозиновых рецепторов обычно характеризуют по эффекторной системе аденилатциклазы, которая использует цАМФ в качестве вторичного мессенжера. Рецепторы A1 и A3 , связанные с Gi белками, ингибируют аденилатциклазу, что приводит к уменьшению клеточных уровней цАМФ, в то время как рецепторы A2A и А2B связываются с Gs белками и активизируют аденилатциклазу, приводя к увеличению клеточных уровней цАМФ. Известно, что система рецептора A1 включает активацию фосфолипазы С и модуляцию ионных каналов калия и кальция. Подтип A3, в дополнение к его связыванию с аденилатциклазой, также стимулирует фосфолипазу С и, следовательно, активирует ионные каналы кальция.
Рецептор A1 (326-328 аминокислот) был клонирован из различных видов (псовый, человеческий, крысиный, собачий, куриный, бычий, морской свинки) с 90-95% идентичностью последовательностей среди млекопитающих. Рецептор A2A (409-412 аминокислот) был клонирован из собаки, крысы, человека, морской свинки и мыши. Рецептор A2B (332 аминокислоты) был клонирован из человека и мыши с 45% гомологичностью рецепторов А2B человека с A1 и A2A человека. Рецептор A3 (317-320 аминокислот) был клонирован из человека, крысы, собаки, кролика и овцы.
Предполагается, что подтипы рецепторов A1 и A2A играют дополнительные роли в регулировании аденозином поставки энергии. Аденозин, который является метаболическим продуктом АТФ, диффундирует от клетки и действует местно, активируя аденозиновые рецепторы для уменьшения потребности кислорода (A1) или увеличения доставки кислорода (А2A) и таким образом восстанавливая баланс поставки энергии: потребность в пределах ткани. Действия обоих подтипов должны увеличить количество доступного кислорода в тканях и защищать клетки от повреждения, вызванного краткосрочной нестабильностью кислорода. Одной из важных функций эндогенного аденозина является предотвращение повреждения во время травм, таких как гипоксия, ишемия, гипотензия и эпилептический припадок.
Кроме того, известно, что связывание агониста аденозинового рецептора с тучными клетками, экспрессирующими рецептор A3 крысы, приводит к увеличению концентраций инозитолтрифосфата и внутриклеточного кальция, что вызывает индуцированную антигеном секрецию воспалительных медиаторов. Поэтому рецептор А3 играет роль в медиировании приступов астмы и других аллергических реакциях.
Аденозин является нейромодулятором, способным модулировать множество аспектов физиологической функции мозга. Эндогенный аденозин, центральное связующее звено между метаболизмом энергии и деятельностью нейронов, изменяется в соответствии с поведением и (пато)физиологическими состояниями. В условиях повышенной потребности и пониженной доступности энергии (таких как гипоксия, гипоглицемия и/или избыточная деятельность нейронов) аденозин обеспечивает мощный защитный механизм отдачи. Взаимодействие с аденозиновыми рецепторами представляет собой многообещающую цель для терапевтического применения в многочисленных неврологических и психических болезнях, таких как эпилепсия, нарушения сна и движения (болезнь Паркинсона или Хантингтона), болезнь Альцгеймера, депрессия, шизофрения или наркомания. Повышение высвобождения нейротрансмиттеров приводит к травмам, таким как гипоксия, ишемия и эпилептические припадки. Эти нейротрансмиттеры в конечном счете отвечают за разрушение и гибель нервных клеток, что вызывает повреждение мозга или гибель индивидуума. Агонисты аденозина A1, которые имитируют центральные ингибирующие действия аденозина, могут поэтому быть полезны в качестве нейрозащитных агентов. Аденозин был предложен в качестве эндогенного антиконвульсионного агента, ингибирующего высвобождение глутамата из стимулирующих нейронов и ингибирующего нейронное сгорание. Агонисты аденозина поэтому могут использоваться в качестве противоэпилептических агентов. Антагонисты аденозина стимулируют деятельность ЦНС и, как оказывается, являются эффективными в качестве энхансеров распознавания. Селективные антагонисты А2A обладают терапевтической активностью при лечении различных форм слабоумия, например болезни Альцгеймера, и нейродегенеративных нарушений, например припадка. Антагонисты аденозинового рецептора А2A модулируют деятельность стриарных GABA нейронов и регулируют плавные и хорошо скоординированные движения, таким образом обеспечивая возможное лечение симптомов болезни Паркинсона. Аденозин также вовлечен в многочисленное физиологические процессы, включая успокаивающее действие, гипноз, шизофрению, беспокойство, боль, дыхание, депрессию и наркоманию (амфетамин, кокаин, опиоиды, этанол, никотин, каннабиноиды). Поэтому лекарственные средства, выступающие в качестве аденозиновых рецепторов, обладают терапевтической активностью в качестве успокоительных средств, мышечных релаксантов, антипсихотических средств, транквилизаторов, анальгетиков, дыхательных стимуляторов, антидепрессантов и средств для лечения злоупотребления наркотиками. Они могут также использоваться для лечения ADHD (заболевание гиперактивности дефицита внимания).
Важная роль аденозина в сердечно-сосудистой системе заключается в использовании его в качестве кардиозащитного агента. Уровни эндогенного аденозина увеличиваются в ответ на ишемию и гипоксию и защищают сердечную ткань во время травмы и после нее (предварительное состояние). Действуя на рецепторы A1, агонисты аденозина A1 могут защищать от повреждений, вызываемых миокардиальной ишемией и реперфузией. Модулирующее влияние рецепторов А2A на адренергическую функцию может иметь значение для различных заболеваний, таких как коронарная артериальная болезнь и сердечная недостаточность. Антагонисты А2A могут терапевтически применяться в ситуациях, в которых необходим повышенный антиадренергический отклик, таких как острая миокардиальная ишемия. Селективные антагонисты рецепторов А2A могут также увеличивать эффективность аденозина в устранении суправентрикулярных аритмий.
Аденозин модулирует множество аспектов функции почек, включая высвобождение ренина, скорость гломерулярной фильтрации и поток крови через почки. Соединения, которые являются антагонистами почечных функций аденозина, активны в качестве почечных защитных агентов. Кроме того, антагонисты аденозина A3 и/или А2B могут быть полезны для лечения астмы и других аллергических ответов или для лечения сахарного диабета и ожирения.
Многочисленные документы описывают общий уровень техники относительно аденозиновых рецепторов, например следующие публикации:
Bioorganic & Medicinal Chemistry, 6, (1998), 619-641,
Bioorganic & Medicinal Chemistry, 6, (1998), 707-719,
J. Med. Chem., (1998), 41, 2835-2845,
J. Med. Chem., (1998), 41, 3186-3201,
J. Med. Chem., (1998), 41, 2126-2133,
J. Med. Chem., (1999), 42, 706-721,
J. Med. Chem., (1996), 39, 1164-1171,
Arch. Pharm. Med. Chem., 332, 39-41, (1999),
Am. J. Physiol., 276, H1113-1116, (1999) или
Naunyn Schmied, Arch. Pharmacol. 362, 375-381, (2000).
Объектами настоящего изобретения являются соединения формулы I, применение соединений формулы I и их фармацевтически приемлемых солей для изготовления лекарственных средств для лечения заболеваний, связанных с аденозиновым рецептором А2, их получение, лекарственные средства на основе соединения в соответствии с изобретением и их получение, а также применение соединений формулы I для контроля или предотвращения заболеваний, основанных на модуляции системы аденозина, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, защита нервных клеток, шизофрения, беспокойство, боль, дефицит дыхания, депрессия, наркомания, такая как зависимость от амфетамина, кокаина, опиоидов, этанола, никотина, каннабиноидов, или для лечения астмы, аллергических реакций, гипоксии, ишемии, эпилептического припадка и токсикомании. Кроме того, соединения настоящего изобретения могут быть полезны в качестве успокоительных средств, мышечных релаксантов, антипсихотических веществ, противоэпилептических средств, антиконвульсантов и кардиозащитных агентов для заболеваний, таких как коронарная артериальная болезнь и сердечная недостаточность. Наиболее предпочтительные показания в соответствии с настоящим изобретением включают показания, которые основываются на антагонистической активности рецептора A2A и которые включают нарушения центральной нервной системы, например лечение или предотвращение болезни Альцгеймера, некоторых депрессивных нарушений, наркомании, защиты нервных клеток и болезни Паркинсона, а также ADHD.
Используемый здесь термин "низший алкил" обозначает алкильную группу с насыщенной линейной или разветвленной цепью, содержащей от 1 до 6 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изо-бутил, 2-бутил, трет-бутил и т.п. Предпочтительными низшими алкильными группами являются группы с 1-4 атомами углерода.
Термин "галоген" обозначает хлор, иод, фтор и бром.
Термин "низший алкокси" обозначает группу, в которой алкильные остатки являются такими, как определено выше, и которая присоединена через атом кислорода.
Термин "фармацевтически приемлемые кислотные аддитивные соли" охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, сукциновая кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п.
Предпочтительными соединениями настоящего изобретения являются соединения формулы I, в которой R представляет собой тиоморфолинил, например следующее соединение:
(4-метокси-7-фенилбензо[b]тиофен-2-ил)амид тиоморфолин-4-карбоновой кислоты.
Также предпочтительными являются соединения формулы I, в которой R представляет собой морфолинил, например следующее соединение:
(4-метокси-7-фенилбензо[b]тиофен-2-ил)амид морфолин-4-карбоновой кислоты.
Также предпочтительными являются соединения, в которых R представляет собой пиперидинил, необязательно замещенный гидроксигруппой, метоксигруппой или -СН2ОН, например следующие соединения:
(4-метокси-7-фенилбензо[b]тиофен-2-ил)амид пиперидин-1-карбоновой кислоты,
(4-метокси-7-фенилбензо[b]тиофен-2-ил)амид 4-гидроксипиперидин-1-карбоновой кислоты,
(4-метокси-7-фенилбензо[b]тиофен-2-ил)амид 4-метоксипиперидин-1-карбоновой кислоты или
(4-метокси-7-фенилбензо[b]тиофен-2-ил)амид 4-гидроксиметилпиперидин-1-карбоновой кислоты.
Также предпочтительными являются соединения, в которых R представляет собой пиперазинил, замещенный метилом, например следующее соединение:
(4-метокси-7-фенилбензо[b]тиофен-2-ил)амид 4-метилпиперазин-1-карбоновой кислоты.
Предпочтительной группой соединений являются также соединения, в которых R представляет собой фенил, необязательно замещенный галогеном, или -пиридин-3- или 4-ил, необязательно замещенный низшим алкилом, например следующие соединения:
N-(4-метокси-7-фенилбензо[b]тиофен-2-ил)-6-метилникотинамид,
N-(4-метокси-7-фенилбензо[b]тиофен-2-ил)-2-метилизоникотинамид или
4-фтор-N-(4-метокси-7-фенилбензо[b]тиофен-2-ил)бензамид.
Соединения формулы I согласно настоящему изобретению и их фармацевтически приемлемые соли могут быть получены способами, известными из уровня техники, например описанными ниже способами, которые включают:
а) реакцию соединения формулы
с соединением формулы

с получением соединения формулы

где R представляет собой фенил, необязательно замещенный галогеном, или -пиридин-3- или 4-ил, необязательно замещенный низшим алкилом, или
б) реакцию соединения формулы

с соединением формулы HNR1R2
с получением соединения формулы

где R1 и R2 вместе с атомом N, к которому они присоединены, образуют гетероциклические кольца, выбранные из группы, состоящей из морфолинила, тиоморфолинила, пиперидинила или пиперазинила, необязательно замещенных -(СН2)n-гидроксигруппой, низшим алкилом или низшей алкоксигруппой, и при необходимости, преобразование полученных соединений в фармацевтически приемлемые кислотные аддитивные соли.
Соединения формулы I могут быть получены в соответствии с вариантами способа а) и б) и в соответствии со следующей схемой 1. Десять примеров далее описывают способы более подробно.
Схема 1

R, R1 и R2 имеют определенные выше значения и
DPPA - дифенилфосфорилазид,
ДМФА - диметилформамид и
ДМАП 4-диметиламинопиридин.
В соответствии со схемой 1 соединения формулы IA и IB получены следующим образом:
Метиловый эфир 4-метоксибензо[b]тиофен-2-карбоновой кислоты (7) получен в две стадии из 3-фторанизидина согласно следующему документу:
Tetrahedron Lett. (1992), 33 (49), 7499-7502.
Метиловый эфир 7-бром-4-метоксибензо[b]тиофен-2-карбоновой кислоты (6) получен согласно документу (Eur. Pat. Appl. (1993), 72 pp. EP 568289, CAN 120:298461) обработкой метилового эфира 4-метоксибензо[b]тиофен-2-карбоновой кислоты бромом в хлороформе при 0-20°С.
Соединение формулы (4), 4-метокси-7-фенилбензо[b]тиофен-2-карбоновая кислота, получено следующим образом: суспензию метилового эфира 7-бром-4-метоксибензо[b]тиофен-2-карбоновой кислоты (6), хлорида бис(трифенилфосфин)палладия (II) и К2СО3 в атмосфере аргона в диоксане при 20°С перемешивали в течение около 60 минут. Затем добавляли фенилбороновую кислоту и Na2СО3 и смесь нагревали при около 100°С в течение ночи. После охлаждения, фильтрации и подкисления до рН 1 соляной кислотой продукт формулы (4) осаждали и отфильтровывали и высушивали в вакууме.
Далее, под атмосферой аргона при 20°С к перемешиваемому раствору тионилхлорида по частям добавляли 4-метокси-7-фенилбензо[b]тиофен-2-карбоновой кислоты (4). Реакцию нагревали в течение 1 часа при кипячении с обратным холодильником, затем охлаждали и досуха упаривали. Сырой остаток затем суспендировали в небольшом объеме ацетона и добавляли азид натрия при 0°С и перемешивали в течение 1 часа. После этого реакцию выливали в лед, экстрагировали дважды эфиром и высушивали над MgSO4, отфильтровывали и растворитель упаривали. Ацилазид затем переносили в 1,2-дихлорэтан и добавляли бензиловый спирт и смесь нагревали при 85°С в течение ночи. После охлаждения смеси реакцию упаривали досуха и очищали ускоренной хроматографией на силикагеле. Получали чистый бензиловый эфир (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты (5).
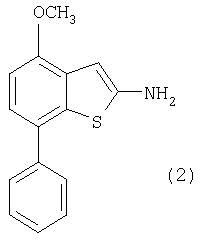
Соединение формулы (2), (4-метокси-7-фенилбензо[b]тиофен-2-ил)амин получали описанным ниже способом:
Перемешиваемый раствор бензилового эфира (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты (5) в этиленгликоле и диоксане нагревали при кипячении с обратным холодильником с NaOH в течение около 4 часов. После охлаждения и добавления воды смесь экстрагировали EtOAc, объединенные экстракты промывали соляным раствором, высушивали над Na2SO4, отфильтровывали и упаривали. Сырой остаток затем хроматографировали на силикагеле.
Получение соединения формулы IA:
Раствор (4-метокси-7-фенилбензо[b]тиофен-2-ил)амина (2) в ТГФ и диэтилизопропиламине перемешивали вместе при около -10°С в атмосфере аргона. К раствору медленно добавляли соединение формулы RC(O)Cl, в котором R представляет собой фенил, необязательно замещенный галогеном, или -пиридин-3- или 4-ил, необязательно замещенный низшим алкилом, в дихлорметане и смесь перемешивали при 20°С в течение ночи. Реакцию снова охлаждали до 0°С и затем добавляли метанол и смесь перемешивали в течение 30 минут при 20°С. Смесь затем досуха упаривали и хроматографировали на силикагеле.
Получение соединения формулы IB:
В соответствии со схемой 1 соединение формулы IB получали следующим путем:
Перемешиваемый раствор бензилового эфира (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты (5) в диоксане нагревали с соединением формулы HNR1R2, в котором R1 и R2 вместе с атомом N, к которому они присоединены, образуют гетероциклические кольца, выбранные из группы, состоящей из морфолинила, тиоморфолинила, пиперидинила или пиперазинила, необязательно замещенных -(СН2)n-гидроксигруппой, низшим алкилом или низшей алкоксигруппой, в течение около 68 часов при кипячении с обратным холодильником под атмосферой аргона. После охлаждения реакции растворители упаривали и остаток хроматографировали на силикагеле. Фракции продукта затем объединяли, упаривали и высушивали в вакууме. Получали соединение формулы IB.
Выделение и очистка соединений
Выделение и очистка описанных здесь соединений и промежуточных соединений могут производиться, при необходимости, любой подходящей процедурой разделения или очистки, такими как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, толстослойная хроматография, препаративная жидкостная хроматография низкого или высокого давления или комбинацией этих процедур. Конкретные примеры подходящих процедур разделения и выделения можно обнаружить ниже в разделе Получение и Примеры. Однако, конечно, могут также использоваться другие эквивалентные процедуры разделения или выделения.
Соли соединений формулы I
Соединения формулы I могут являться основаниями, например, когда остаток R содержит основную группу, такую как алифатическая или ароматическая аминогруппа. В таких случаях соединения формулы I могут быть преобразованы в соответствующую кислотную аддитивную соль.
Преобразование проводят обработкой по крайней мере стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, манделиновая кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в подобном растворителе. Температуру поддерживают между 0°С и 50°С. Полученную соль осаждают самостоятельно или могут перенести в раствор менее полярного растворителя.
Кислотные аддитивные соли основных соединений формулы I могут быть преобразованы в соответствующие свободные основания обработкой по крайней мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и т.п.
Соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. Конкретно, было обнаружено, что соединения согласно настоящему изобретению являются лигандами аденозинового рецептора и обладают высоким сродством к аденозиновому рецептору A2A.
Соединения были исследованы в соответствии с испытанием, приведенным далее.
Аденозиновый рецептор А2A человека
Аденозиновый рецептор A2A человека рекомбинантно экспрессировали в клетках яичников китайского хомячка (СНО), используя систему экспрессии вируса semliki forest. Клетки собирали, промывали дважды центрифугированием, гомогенизировали и снова промывали центрифугированием. Полученный промытый мембранный остаток суспендировали в буфере Tris (50 мМ), содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 10 мМ MgCl2 (pH 7,4) (буфер А). Испытание связывания с [3H]-SCH-58261 (Dionisotti и др., 1997, Br J Pharmacol 121, 353; 1 нМ) проводили в 96-ячеечных плашках в присутствии 2,5 мкг мембранного белка, 0,5 мг шариков Ysi-поли-1-лизина SPA и 0,1 U аденозиндеаминазы в конечном объеме буфера А 200 мкл. Неспецифическое связывание определяли с помощью представителей ксантинамина (ХАС; 2 мкМ). Соединения проверяли при 10 концентрациях от 10 мкМ до 0,3 нМ. Все испытания проводили дважды и повторяли по крайней мере два раза. Испытательные плашки инкубировали в течение 1 часа при комнатной температуре перед центрифугированием и затем определяли связавшийся лиганд, используя сцинтилляционный счетчик Packard Topcount. Значения IC50 рассчитывали с помощью программы подгонки нелинейной кривой и значения Ki рассчитывали с помощью уравнения Cheng-Prussoff.
Предпочтительные соединения показывают pKi>6,4.
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут использоваться в качестве лекарственных средств, например, в форме фармацевтических составов. Фармацевтические составы могут вводиться перорально, например, в форме таблеток, покрытых таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение, однако, может также осуществляться ректально, например, в форме свечей, парентерально, например, в форме инъекционных растворов.
Соединения формулы I могут быть обработаны фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических составов. Например, в качестве носителей для таблеток, покрытых таблеток, драже и твердых желатиновых капсул могут использоваться лактоза, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и т.п. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. В зависимости от природы активного вещества, однако, обычно не требуется никаких носителей для мягких желатиновых капсул. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и т.п. Подходящими носителями для свечей являются, например, природные или закрепляющие масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Фармацевтические составы, кроме того, могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульсификаторы, подслащивающие вещества, красители, отдушки, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие терапевтически полезные вещества.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, являются также объектом настоящего изобретения, а также способ их получения, который включает введение одного или нескольких соединений формулы I и/или фармацевтически приемлемых кислотных аддитивных солей и, при необходимости, одного или нескольких других терапевтически полезных веществ в галеновую форму введения вместе с одним или несколькими терапевтически инертными носителями.
В соответствии с изобретением соединения формулы I, а также их фармацевтически приемлемые соли, полезны для контролирования или предотвращения заболеваний, основанных на антагонистической активности аденозинового рецептора, таких как болезнь Альцгеймера, болезнь Паркинсона, нейрозащита, шизофрения, беспокойство, боль, дефицит дыхания, депрессия, астма, аллергические реакции, гипоксия, ишемия, эпилептический припадок и токсикомания. Кроме того, соединения настоящего изобретения могут быть полезны в качестве седативных средств, мышечных релаксантов, антипсихотических средств, противоэпилептических средств, антиконвульсантов и кардиозащитных агентов и для получения соответствующих лекарственных средств.
Наиболее предпочтительными показаниями в соответствии с настоящим изобретением являются показания, которые включают нарушения центральной нервной системы, например лечение или предотвращение некоторых депрессивных заболеваний, нейрозащита и болезнь Паркинсона.
Дозировка может изменяться в широких пределах и, конечно, должна соответствовать индивидуальным требованиям в каждом конкретном случае. В случае перорального введения дозировка для взрослых может меняться от около 0,01 мг до около 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Ежедневная дозировка может вводиться как отдельной дозой, так и разделенными дозами, и, кроме того, верхний предел при необходимости может также быть повышен.
Состав таблетки (влажное гранулирование)
Способ получения
1. Смешивали компоненты 1, 2, 3 и 4 и гранулировали с очищенной водой.
2. Сушили гранулы при 50°С.
3. Продавливали гранулы через подходящее измельчающее оборудование.
4. Добавляли компонент 5 и перемешивали в течение трех минут; спрессовывали на подходящем прессе.
Состав капсулы
Способ получения
1. Смешивали компоненты 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляли компоненты 4 и 5 и перемешивали в течение 3 минут.
3. Заполняли в подходящую капсулу.
Следующее получение и примеры иллюстрируют изобретение, но не предназначены для ограничения его объема.
Пример 1
(4-Метокси-7-фенилбензо[b]тиофен-2-ил)амид тиоморфолин-4-карбоновой кислоты
Перемешиваемый раствор бензилового эфира (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты (200 мг, 0,513 ммоль) в диоксане (5 мл) нагревали с тиоморфолином (10 эквив., 5,13 ммоль) в течение 68 часов при кипячении с обратным холодильником под атмосферой аргона. После охлаждения реакции растворители упаривали и остаток хроматографировали на силикагеле, элюируя гептан/EtOAc (1:2). Фракции продукта затем объединяли, упаривали и высушивали в вакууме при 60°С, получая чистый продукт, указанный в заглавии (94 мг, выход 47%) в виде светло-коричневого твердого вещества, MS m/e=383,2 (М-Н).
Пример 2
(4-Метокси-7-фенилбензо[b]тиофен-2-ил)амид морфолин-4-карбоновой кислоты
Указанное в заглавии соединение: MS m/e=369,3 (М+Н+) было получено в виде твердого вещества светло-коричневого цвета (выход 58%) реакцией морфолина с бензиловым эфиром (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты согласно способу, описанному выше в Примере 1.
Пример 3
(4-Метокси-7-фенилбензо[b]тиофен-2-ил)амид пиперидин-1-карбоновой кислоты
Указанное в заглавии соединение: MS m/e=365,1 (М-Н) было получено в виде твердого вещества светло-коричневого цвета (выход 62%) реакцией пиперидина с бензиловым эфиром (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты согласно способу, описанному выше в Примере 1.
Пример 4
(4-Метокси-7-фенилбензо[b]тиофен-2-ил)амид 4-гидроксипиперидин-1-карбоновой кислоты
Указанное в заглавии соединение: MS m/e=381,2 (М-Н) было получено в виде твердого вещества светло-коричневого цвета (выход 54%) реакцией 4-гидроксипиперидина с бензиловым эфиром (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты согласно способу, описанному выше в Примере 1.
Пример 5
(4-Метокси-7-фенилбензо[b]тиофен-2-ил)амид 4-метоксипиперидин-1-карбоновой кислоты
Указанное в заглавии соединение: MS m/e=395,3 (М-Н) было получено в виде твердого вещества светло-коричневого цвета (выход 54%) реакцией 4-метоксипиперидина с бензиловым эфиром (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты согласно способу, описанному выше в Примере 1.
Пример 6
(4-Метокси-7-фенилбензо[b]тиофен-2-ил)амид 4-гидроксиметилпиперидин-1-карбоновой кислоты
Указанное в заглавии соединение: MS m/e=395,2 (М-Н) было получено в виде светло-желтого твердого вещества (выход 53%) реакцией 4-пиперидинметилового спирта с бензиловым эфиром (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты согласно способу, описанному выше в Примере 1.
Пример 7
(4-Метокси-7-фенилбензо[b]тиофен-2-ил)амид 4-метилпиперазин-1-карбоновой кислоты
Указанное в заглавии соединение: MS m/e=380,2 (М-Н) было получено в виде светло-желтого пенистого вещества (выход 46%) реакцией N-метилпиперизина с бензиловым эфиром (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты согласно методу, описанному выше в Примере 1.
Пример 8
N-(4-Метокси-7-фенилбензо[b]тиофен-2-ил)-6-метилникотинамид
Раствор (4-метокси-7-фенилбензо[b]тиофен-2-ил)амина (100 мг, 0,392 ммоль) в ТГФ (8 мл) и диэтилизопропиламине (0,147 мл, 2,2 эквив.) перемешивали вместе при -10°С под атмосферой аргона. К раствору медленно добавляли хлоргидрат 6-метилникотинилхлорида (83 мг, 0,431 ммоль, 1,1 эквив.) в дихлорметане (5 мл) и смесь перемешивали при 20°С в течение ночи. Реакцию снова охлаждали до 0°С, и затем добавляли метанол (1,2 мл), и смесь перемешивали в течение 30 минут при 20°С. Затем смесь досуха упаривали и хроматографировали на силикагеле, элюируя градиентом гептан/EtOAc (1:1-1:8). Фракции продукта объединяли и упаривали, получая указанное в заглавии соединение (83 мг, выход 57%) в виде желтого твердого вещества, MS: m/e=375,4 (M+H+).
Пример 9
N-(4-Метокси-7-фенилбензо[b]тиофен-2-ил)-2-метилизоникотинамид
Указанное в заглавии соединение: MS m/e=375,4 (М+Н+) было получено в виде светло-желтого твердого вещества (выход 27%) реакцией хлоргидрата 2-метилизоникотинилхлорида с (4-метокси-7-фенилбензо[b]тиофен-2-ил)амином согласно методу, описанному выше в Примере 8.
Пример 10
4-Фтор-N-(4-метокси-7-фенилбензо[b]тиофен-2-ил)бензамид
Раствор (4-метокси-7-фенилбензо[b]тиофен-2-ил)амина (100 мг, 392 ммоль) в ТГФ (5 мл) с триэтиламином (0,049 мл, 0,9 эквив.) и ДМАП (5 мг, 0,1 эквив.) перемешивали вместе при 0°С под атмосферой аргона. К раствору медленно добавляли 4-фторбензоилхлорид (0,038 мл, 314 ммоль, 0,8 эквив.), и смесь перемешивали при 20°С в течение 2 часов. Смесь затем досуха упаривали и хроматографировали на силикагеле, элюируя градиентом гептан/EtOAc (6:1-2:1). Фракции продукта объединяли и упаривали, получая указанное в заглавии соединение (74 мг, выход 50%) в виде желтого твердого вещества, MS: m/e=378,3 (M+H+).
Промежуточные соединения
Пример 11
(4-Метокси-7-фенилбензо[b]тиофен-2-ил)амин
Перемешиваемый раствор бензилового эфира (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты (1,7 г, 4,36 ммоль) в этиленгликоле и диоксане нагревали при кипячении с обратным холодильником с 2N NaOH (20 мл, 9,1 эквив.) в течение 4 часов. После охлаждения и добавления воды (20 мл) смесь экстрагировали EtOAc (3×25, мл), объединенные экстракты промывали соляным раствором, высушивали над Na2 SO4, отфильтровывали и упаривали. Сырой продукт затем хроматографировали на силикагеле, элюируя дихлорметан/2Н NH3 в МеОН (99:1). Получали указанное в заглавии соединение (668 мг, выход 60%) в виде красного смолистого вещества. MS m/e = 256,2 (М+).
Пример 12
Бензиловый эфир (4-метокси-7-фенилбензо[b]тиофен-2-ил)карбоновой кислоты
К перемешиваемому раствору тионилхлорида (1,3 мл) под атмосферой аргона при 20°С по частям добавляли 4-метокси-7-фенилбензо[b]тиофен-2-карбоновой кислоты (300 мг, 1,06 ммоль). Реакцию нагревали в течение 1 часа при кипячении с обратным холодильником, затем охлаждали и упаривали. Сырой продукт затем суспендировали в небольшом объеме ацетона и добавляли азид натрия (75 мг, 1, 15 ммоль, 1,1 эквив.) при 0°С и перемешивали в течение 1 часа. После этого реакцию выливали в лед, экстрагировали дважды эфиром и высушивали над MgSO4, отфильтровали и растворитель удаляли. Ацилазид затем переносили в 1,2-дихлорэтан и добавляли бензиловый спирт, и смесь нагревали при 85°С в течение ночи. После охлаждения реакционную смесь упаривали и очищали ускоренной хроматографией на силикагеле, элюируя дихлорметан/гептаном (3:1). Получали чистое указанное в заглавии соединение (332 мг, выход 81%) в виде желтого масла. MS m/e=390,3 (М+Н+).
Пример 13
4-Метокси-7-фенилбензо[b]тиофен-2-карбоновой кислоты
Суспензию метилового эфира 7-бром-4-метоксибензо[b]тиофен-2-карбоновой кислоты (5 г, 16,6 ммоль) с хлоридом бис(трифенилфосфин)палладия (II) (350 мг, 0,496 ммоль, 0,03 эквив.) и К2СО3 (4,88 г, 49,8 ммоль, 3 эквив.) под атмосферой аргона в диоксане (40 мл) при 20°С перемешивали в течение 60 минут. Затем добавляли фенилбороновую кислоту (2,16 г, 17,4 ммоль, 1,05 эквив.) и 2N Na2СО3 (80 мл), и смесь нагревали при 100°С в течение ночи. После охлаждения, фильтрации и подкисления до рН 1 водной HCl продукт осаждали и отфильтровывали и высушивали в вакууме при 50°С, получая указанное в заглавии соединение (3,16 г, выход 67%) в виде светло-коричневого твердого вещества. MS m/z = 282,9 (М-Н).
Пример 14
Метиловый эфир 7-бром-4-метоксибензо[b]тиофен-2-карбоновой кислоты
Указанное в заглавии соединение получали в виде почти белого твердого вещества (Тпл. 112°С) согласно уровню техники обработкой метилового эфира 4-метоксибензо[b]тиофен-2-карбоновой кислоты бромом в хлороформе при 0°С -20°С.
Ссылка: Bridges, Alexander; Schwartz, С. Eric; Littlefield, Bruce A. Eur. Pat. Appl. (1993), 72 pp. EP 568289, CAN 120:298461.
Пример 15
Метиловый эфир 4-метоксибензо[b]тиофен-2-карбоновой кислоты
Указанное в заглавии соединение получали в две стадии из 3-фторанизидина в виде почти белого твердого вещества (Тпл. 74°С) согласно уровню техники.
Ссылка: Bridges, Alexander J.; Lee, Arthur; Maduakor, Emmanuel C.; Schwartz, C. Eric.; Tetrahedron Lett. (1992), 33 (49), 7499-7502.
Реферат
Настоящее изобретение относится к бензотиофенам общей формулы I

в которой
R представляет собой фенил, необязательно замещенный галогеном, или пиридин-3- или 4-ил, необязательно замещенный низшим алкилом, или -NR1R2, где R1 и R2 вместе с атомом N, к которому они присоединены, образуют гетероциклические кольца, выбранные из группы, состоящей из морфолинила, тиоморфолинила, пиперидинила или пиперазинила, необязательно замещенные -(СН2)n-гидрокси, низшим алкилом или низшей алкоксигруппой; n обозначает 0, 1 или 2; и их фармацевтически приемлемым кислотно-аддитивным солям. Соединения формулы I имеют высокое сродство с рецептором A2A и могут быть использованы для регулирования многих аспектов клеточного метаболизма. Описано также лекарственное средство на основе соединений формулы I. 2 н. и 11 з.п. ф-лы.
Формула


Комментарии