Способ получения 2,3-дигидробензо/ /тиофенонов-2 или их солей - SU795475A3
Код документа: SU795475A3
Описание
(54) СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИГИДРОБЕНЗО в ТИОФЕНОНОВ-2 ИЛИ ИХ СОЛЕЙ где Ry имеет вышеуказанные значения низшая алкоксигруппа, незаме мещенная или замещенная одним или не сколькими атомами галогена, фенокси группа, незамещенная или замещенная низшим алкилом, низшей алкоксигруппо одним или двумя атомами галогена, одной или двумя нитрогруппами, галоген или группа формулы (R). или , где R имеет вышеуказанное зна чение; Y 2 - водород или Y и Yj вместе образуют связь, и при необходимости подвергают гидролизу с последующим выделением целевого продукта в свободном виде или в виде соли. Реакцию .проводят в присутствии неорганического или органического ос нованиг. в качестве неорганических оснований предпочтительно используют гидриды или амиды щелочных металлов Из органических оснований предпочти тельно используют алкоголяты щелочны металлов, металлоорганические соеди нения щелочных металлов, например бутиллитий, фениллитий, амины, например триэтиламин, пиридин, гидрок тетралкиламмония или триалкилфениламмония . Реакцию проводят без растворител или в растворителе, при температуре от -10 до 120 в атмосфере инертно го газа. П р и ,м е р 1. Суспензию 16 г 50%-ной дисперсии гидрида натрия в минеральном масле, в 500 мл триамид гексаметилфосгЬорной кислоты, при охлаждении, по каплям смешивают с раствором 50 г 2,З-дигидро-2-оксо-бензотиофенона в 200 мл триамида гексаметилфосфорной кислоты при тем пературе ниже 15°С. После перемешивания в течение 1 ч при комнатной температуре добавляют при охлаждени отдельными порциями 77 г фенилового эфира М-(2-фторфенил)карбаминовой кислоты. Перемешивание продолжают п комнатной температуре в течение 16 и затем выливают реакционную смесь на смесь 300 мл 2 н. раствора солян кислоты и ЗООО мл ледяной воды. Оса дается маслянистый продукт, который кристаллизуется примерно через 2 ч. Кристаллический продукт, который включает в себя растворитель, растворяют в 1000 мл диэтилового эфира раствор промывают водой. ОрганичесKyio фазу отделяют, сушат сульфатом натрия и упаривают досуха. Сырой продук,т перекристаллизовывают из диэтилового эфира и раствор промывают водой и получают М- (2-фторфенил )-2-ОКСО-2,3-дигидро-З-бензо в тиофенкарбоксамид с т.пл.155-15б°С, Пример 2. Аналогично примеру 1 получают N-(2,4-дифторфенил )-2-рксо-3 , 2-дигидро-3-бензо в т фенкарбоксамид с т.пл. 158-161 С (после пере сристаллизации из смеси изопропанола с петролейным эфиром), причем в качестве исходных соединений применяют 10 г 2,З-дигидро-2-оксобензо тиофена и 16,6 г фенилового эфира N-(2,4-дифторфенил)-карбаминовоЯ кислоты. Пример J. Аналогично примеру 2 получают следующие соединения: N-(2-хлорфенил)-2-ОКСО-2,3-дигидро-З-бензо в тиофенкарбоксамид, т.пл. 167-169 С (после перекристаллизации из изопропанола) с использованием в качестве исходных соединений 12 г и , 3-дигидро-2--оксобензо в J тиофена и 19,2 г фенилового эфира М-(2-хлорфенил )-карбаминовой кислоты ; N- ( 4-фторфе }Ил) -2-ОКСО-2 , 3-дигидро-3-бензо в тиофенкарбоксамид, т.пл. 169-170 С (после перекристаллизации из эфира) с использованием в качестве исходных соединений 10 г 2,З-дигидро-2-оксобензо в тиофена и 15,4 г фенилового эфира N-(4-фтopФенил )-карбаминовой кислоты; N-(4-хлорфенил)-2-оксо-2,3-дигидро--3-бензоГв тиофенкарбоксамид с т.пл. 159-161 0 (после перекристаллизации из смеси метанола и воды) с использованием в качестве исходных соединений 10 г 2,З-дигидро-2-оксобензо в тиофена и 16,5 г фенилового эфира N-(4-хлорфенил) и карбаминовой. КИСЛОТЫ; N-фенил-2-оксо-2,3-дигидро-З-бензо в тиофенкасбоксамид с т.пл. 246147 0 (после перекристаллизации из смеси метанола и воды) с использованием в качестве исходных соединений 10 г 2,З-дигидро-2-оксобензо в тиофена и 14,2 г фенилового эфира N-фенилкарбаминовой кислоты; N-(2-тиазолил)-2-оксо-2,3-дигидро-3-бензо в тиофенкарбоксамид с т.пл. 288°С (после перекристаллизации из смеси диметилформамида и воды) с использованием в качестве исходных соединений 7,5 г 2,З-дигидро-2-оксобензо IB}тиофена и 11 г фенилового эфира N-(2-тиазолил)-карбаминозой кислоты. Пример 4. В условиях примера 1 подвергают взаимодействию 10 г 2,З-дигидро-2-оксобензо в тиофена и 14,3 г фенилового эфира М-(2-пиридил )-карбаминовой кислоты. После перемешивания в течение 16 ч при комнатной температуре выливают реакционную смесь на смзсь соляной кислоты и воды и получают коричнево-фиолетовый осадок, который отфильтровывают и кипятят с 3000 мл ацетона. Нерастворенное вещество отфильтровывают и, фильтрат концентрируют до объема примерно 300 мл. Выкристаллизовавшееся на холоду вещество идентично первому кристаллизату, получают N-(2-пиридил)-2-ОКСО-2,3-дигидро-З-бенэо в тиофенкарбоксамид, т.пл. в ше 280вС. Вместо феннлового эфира М-(2-пир дил)-карбаминовой кислоты можно при менять 4-нитрофениловый эфир М-(.2-п ридил)-карбаминовой кислоты, 4-нитро или 2,4-ДИЙитрофениловый эфир М-(2ридил )-карбаминовой кислоты. Пример 5. Суспензию 5,9 г 50%-ной суспензии гидрида натрия в минеральном масле в 180 мл триамида гексаметилфосфорной кислоты при охлаждении , по каплям смешивают с раст рором 18,2 г 2,3-дигидро-2-оксобен;ро в тиофена в 60 мл триамида. гекса метилфосфорной кислоты при темпер атуре ниже . После перемешивания в течение 1 ч при комнатарй темпера туре отдельными порциями, при ох лаждении льдом добавляют 30,4 г фенилового.эфира Н-(З-хлорфенил)карбаминовой кислоты-, перемешивают при комнатной температуре в течение 16 ч и выливают в смесь 100 мл 2 н. соляной кислоты и 1000 г льда. Осаждается маслянистый продукт, который через несколько часов кристаллизуется . Кристаллы собирают и растворяют в 300 мл эфира..Раствор промывают водой, органическую фазу отделяют, сушат сульфатом натрия и упаривают. досуха. Остаток перекристаллизовывают из эфира и получают Н-(3-хлорфенил ) -2-ОКСО-2 ,.3-дигидро-З-бензо в тиофенкарбоксамид с т.пл. 175177°С .Вместо фенилового эфира N-(З-хлорфенил)-карбаминовой кисло ты можно использовать соответствующее количество (3-хлор)-фенилового эфира N-(З-хлорфенил)-карбаминовой кислоты 3,5-дихлорфенилового эфира N-(З-хлорфенил)-карбаминовой кислоты . Пример 6. К кипящей суспензии 7 г N-(З-хлорфенил)-2-оксо-2 ,3-дигидро-3-бенэо в тиофенкарбокс мида в 200 мл ацетона добавляют 2 мл морфолина. Прозрачный раствор охлаждают и разбавляют 250 мл петро лейного эфира, кристаллизуется морфолиновая соль N-(З-хлорфенил)-2-оксо-2 ,3-дигидро-З-бензо | в тиофенкарбоксамида , которую отфильтровывают и сушат, т.пл. 172-173.,. Пример 7. 2,2г М-(3-клорфенил )-2-ОКСО-2,3-дигидро-З-бензо в тиофенкарбоксамида.нагревают в смеси из 7,5 мл 1 и. раствора едкого натра и 30 мл воды, причем при тe шepaтуре примерно все растворяется. Затем смешивают р.раствором 1,1г гепта идрата сульфата цинка в 5. мл воды, отфильтровывают спустя примерно 30 мин кристаллический осадок цин ковой соли N-(З-хлорфенил)-2-оксо- . -2,3-дигидро-З-бензо |в}тиофенкарбокс мида и сушат ее, т.пл. 172С (с выделением газа). Пример 8. К суспензии 1,93 г 50%-ной суспензии гидрида натрия в минеральном масле в 50 мл тетрагидрофурана при температуре 10-20с прикапывают pac-jiBOp 6 г 2,3-дигидpo-2-oкcoбeнзot в тиофена в 40 мл тет- рагидрофурана, перемешивают в течение 30 мин при комнатной температуре и после этого медленно по каплям добавляют 5,5 г 3-фторфенилизоцианата, причем происходит экзотермическая реакция . Перемешивают в течение 1 ч (При комнатной температуре и в тече :Ние еще 1 ч при температуре выливают в смесь из 500 мл .ледяной воды и 50 мл 2 н. соляной кислоты. Отсасывают маслАнистый, быстро крис. таллизующийся осадок ,и„перекристаллизовывают его из смеси ацетона и петролейного эфира, -получают N-(3-фторфенил ) -2-оксо-,2,3-дигидро-З-бензо в тиофенкарбоксамид, т.пл. 169-171 С.о Пример 9. 20 г N-(3 хлорфенил ) -2-ОКСО-2,3-дигидро-З-бензо(в J тиофенкарбоксамида суспендируют в 250 мл ацетона и смешивают с 66 мл 1 н. раствора едкого натра, этот раствор упаривают дОсуха, остаток после упаривания перемешивают сначала с толуолом и затем с эфиром, отсасывают и высушивают, получают натриевую соль N-(З-хлорфенил)-2-оксо-2 ,3-дигидро-З-бензо в Зтиофенкарбоксамида , т.пл. . Пример 10. В условиях примера 1 получают М-(2,4-дихлорфенил)- -2-ОКСО-2,3-дигидро-З-бензо в тиофенкарбоксамид с т.пл. 201-203 С (с использованием в качестве исходных соединения 12 г 2,З-дигидро-2-оксо-бензо в тиофена и 22,5 г фенилового эфира N-(2,4-дихлорфёнил)-карбаминовой кислоты, N-(2-тиенил)-2-ОК-. со-2,3-дигидро-З-бензо тиофенкарбоксамид , с т.пл. 142-144 С (с расположением ) 6-хлор-М-(2-пиридил)-2-оксо-2 ,3-дигидро-З-бёнзо в}тиофенкарбоксамид ,Ма-соль, т.пл. , 6-xлop-N-{з-(5-мeтилизoкcaзoлил)-2-оксо-2 ,3-дигидро-З-бензо |р тиофенкарбоксамид , т.пл. 220-222 с,vN-(4-метоксифенил )-2-оксо-2,3-дигидро-3-бензо в тиофенкарёоксамид с т.пл, 181-183 С (с использованием в качестве исходных соединений 12 г 2,3-дигидро-2-оксо-бензо в тиофена и 19,4 г фенилового эфира N-(4-метоксифенилкарбаминовой: кислоты). N-(2-метилфенил)-2-ОКСО-2,3-дигидро-З-бензо в тиофенкарбоксамид с т.пл. 153-155С (с использованием в качестве исходных соединений 12 г 2,3-дигидро-2-оксобензо в тиофена и 18,1 г фенилового эфира N-(2-метилфенил ) -карбаминовой кислоты); М-(3,5-бис-трифторметилфенил)-2-оксо-2 ,3-дигидро-З-бензо в тиофенкарбоксамид с т.пл. 169rl7lc (с использованием в качестве исходных соединений 7,5 г 2,3-дигидро-2-оксобенэо в -тиофена и 17,5 г фениловоjo эфира Н-(3,5-бис-трифторфенил)кХрбаминовой кислоты);
Н-(4-метилфенил)-2-оксо-2,3-дигид- . ротЗ-бенэо в тиофенкарбоксамид с.Л.пл, 176-179с (с испольэовайием -вкачестве исходных соединений 12 г 2,З-дигидро-2-оксобензо в тиофена |и 18,1 г фениловрго эфира Н-(4-метил; . юенил)-карбаминовой кислоты) ; М-(4-этоксифенил)-2-оксо-2,3-дигидро-З-бензо вЗтиофенкарбоксамид с т.пл. 149-151°С (с использованием в качестве исходных соединений 20,5 г фенилового. эфира N-(4-этоксифенил)- tS карбаминовой кислоты и 12 г 2,3-дигидро-2-оксобензо |в}тиофена);
М-(4-бромфенил)-2-оксо-2,3-дигидрр-3-бёнзо в тиофенкарбоксамид с т.пл. 178-180°С (с использованием ;20 в качестве исходных соединений 7,5 г 2,3-дигидро-2- оксобензоСв тиофена и 14,6 г фенилового эфира N-(4-6poMфенил )-карбаминовой кислоты);
N-{3-(S-мeтилизoкcaзoлил)7-2-oк- 25 со-2,3-дигидро-З-бензо{в тиофенкарбоксамид с т.пл. 194-196 С.
N-(2-метоксикарбонилфенил)-2-оксо-2 ,3-дигидро-З-бензо вЗтиофенкарбрксамид с т.пл. 147-149°С.
Гидролизом последнего получают N-(2-кар6оксифенил)-2-ОКСО-2,3-дигидро-З-бензо 1в тиофенкарбоксамид, т.пл. 280°С) ; .
М-(3,4-диметоксифенйл)-2-оксо-2,3-дигидро-3-бензо в тиофенкарбокс- - амид с т.пл. 194-19б с (с использованием в качестве исходных еоединений 12 г 2,З-дигидро-2-оксобензо |в тиофена и 21,8 г фенилового эфира N-(3,4 -диметрксифенил)-карбаминовой кис- 40 лоты);
N-(2-мвтоксифенял)-2-ОКСО-2,3-дигидро-З-бензо вЗтиофенкарбоксамид С т.пл. 140-142 0 (с использованием в качестве исходных соединений 12 г j 2,З-дигидро-2-оксобензо в тиофена и 19,5 г фенилового эфира м-(2-метоксифенил )-карбаминовой кислоты и N,-(3 ,4-диxлopфeнил)-2-oкco-2,3-дигидpo-3-бeнзo в тиофенкарбоксамид «л с т.пл. 192-194 С (с использованием в качестве исхо;п;ных соединений 17,9 г 2,3 -дигйдро-2-оксобензо в тиофена и 1б19 г фенилового эфира Н-(3,4-дихлврфеиил )-карбаминовой кислоты);
М-бутил-2,З-дигидро-2-оксо-З-бен- 55 зоГв1тиофенкарбоксамид,. т.пл. 111112 0}
Н-бензил-2,3-дигидро-2- оксо-3-бенаоГвТтиофэнкарбоксамид с т.пл. 141142 ,500. .
.Приме р 11. К охлажденному до раствору 6 г (32,5 ммоль) 5 хпор-2,3-дигидро-2-оксЬбензо вТтиофена в 75 мл триамида гексаметилфосфорной кислоты добавляют 1,63 с
гидрида натрия (5%-ная суспензия) и перемешивают приблизительно в течение 10 мин до прекращения выделения водорода, перемешивают 1 ч при комнатной температуре. После повторного охлаждения-добавляют порциями 8,43 г фенилового эфира М-(З-хлорфенил)карбаминовой кислоты. Затем исходkiyjo смесь выдерживают 1 ч при ком- / ратной температуре,. добавляют к смеси 1 л ледяной воды и 20 мл 2 н. соляной кислоты и дважды экстрагируют по 300 мл этилацетата. Объединенные экстракты трижды промывают водой и сушат сульфатом магния. После упаривания в вакууме остается N (З-хлорфенил -Б-хлор-2 ,3-дигидро-2-оксо-З-бензо в тиофенкарбоксамид в виде кристаллического продукта. Его промывают 100 мл смеси эфира и гексана 1:1 , затем гексаном и сушат в вакууме. Получают почти бесцветные кристаллы с т.пл. 160-163 0.
Аналогично получают М-(2-тиазолил ) -5-ХЛОР-2,3-дигидро-2-оксо-бензо в тиофенкарбоксамид с т.пл. 296299« С ) ;
М -фенил-5-хлор-2,З-дигидро-2-оксобензо в тиофенкарбоксамид с т.пл. 170-172« 0, и б-хлор-Н- З- 5-метилизоксалилЗ -2-оксо-2,3-дигидро-бензо в тиофенкарбоксамид, т.пл. 220-222°0.
Используе№лй в качестве исходного вещества 5-хлор-2,3-дигидро-бензо в J тиофен получают следующим образом.
8 г (35,5 ммоль) метилового эфира 5-хлор-2-бензо в тиофенкарбоновой кислоты кипятят с 10 мл гидразингидрата в 100 мл абсолютного этанола в течение 45 мин. Охлажденную суспензию разбавляют 100 мл ледяной воды и продукт отфильтровывают. Его промывают двумя порциями по 40 мл метанола и высушивают в вакууме, получают гидразид 5-хлор-2-бензо в тиофенкарбоновой кислоты с т.пл. 254-255 0.
Охлё1жденную до суспензию 7,5 г (33,1 мМоль) гидразида 5-хлор-2-бензо в тйофенкарбоновой кислоты .в 100 мл ледяной уксусной кислоты смешивают с раствором 2,51 г нитрита натрия в 5 мл воды, добавляют еще 100 мл ледяной уксусной кислоты. После этого перемешивают при комнатной температуре в течение 15 мин и затем добавляют 500 мл ледяной воды. Осажденный азид 5-хлор-2-бензо РВ тиофенкарбоновой кислоты отсасывают,про .мывают ледяной водой, растворяют в 200 мл метиленхлорида, сушат сульфатом магния. После удешения растворителя в вакууме при температуре получают желтоватые кристаллы с т.пл. 90-91°0.
7г (28,3 ммоль) азида 5-хлор-2-бензо 2тиофенкарбоновой кислоты в 15 мл абсолютного спирта кипятят 6ч. Прсле концентрирования раствора в вакууме и перекристаллизации из 30 мл метанола получают 2-этокаикарб ниламино-5-хлорбензо в тирфен в виде коричневых кристаллов с т.пл. 133135 С . Из остатка маточного раствора посредством хроматографии на силикагеле и элюирования бензолом получают еще некоторое количество продукта. Смесь из 37,1 2-этоксикарбониламино-5-хлорбензо а тиофена ,(145,2 ммоль) , 300 мл ледяной- уксус ой кислоты, 50 мл воды и 50 мл концентрированной серной кислоты КИПЯТЯ 75 мин. Охлажденный выливают в 5 л ледяной воды, причем осаждается крис таллический 5-хлор-2,З-дигидро-2-оксобензо | в тиофен. Его отсасывают к тщательно промывают водой. Влажный сырой продукт растворяют .р-г 300 мл метиленхлорида, раствор высушивают сульфатом магния и упаривают. С целью дальнейшей очистки растворяют в 200 мл смеси бензола и гексана (1;1) и-раствор пропускают через колонку с 300 г силикагеля. Из элюата упаривания в вакууме вьщеляют бесцветйые кристаллы, т.пл. 113-114с. Пример 12. В условиях примера 11 готовят раствор из б г 5-хлор-2;3-дигидро-2-оксобензо в1тио фена и 1,63 г гидрида натрия в 75 мл триамида гексаметилфосфорной кислоты . К нему добавляют по порциям 8,76 г (34,1 г влолъ) фенилового эфира Н-(4-этоксифе:нил)карбаминовой кислоты , и реакционную смесь перемешивают в течение 3 ч. Обработку проводят как указано в примере 11, причем получают сырой N-(4-этоксифенил)-5-хлор-2 ,З-дйгидро-2-оксо-З-бензо JBJ тиофенкарбоксамид, который после перекристаллизации из ацетона плавится при 202-205°С. Пример 13. Как описано в примере 11, готовят раствор 6 г 5 хлор-2,3-дигидро-2-оксобензо |в гио фена и 1,63 г гидрида натрия в 75 мл триамида гексаметилфосфорной кислоты . К нему отдельньнии порциями добав ляют 7,88 г фенилового эфира М-{2-фторфенил )-карбаминоБОй кислоты,и реакционную смесь перемешивают в течение 3 ч. Реакционную смесь обрабатывают , как указано в примере 12, пр чем при экстракции этилацетатом для лучшего разделения фаз к водному слою добавляют раствор поваренной со ли. При концентрировании органическо го слоя в вакууме до небольшого объема осаждается М-(2-фторфенил)-5-хлор-2 ,3-дигидро-2-оксобензоТв5тио фенкарбоксамид, т.пл. 205-207 С. Его отфильтровывают на нутче, промывают холодным этилацетатом и гексано и сушат. Из маточных растворов можно извлечь еще некоторое количество про дукта. Пример 14- Аналогично при меру 1, исходя из 5-карбокси- или 5-метокси-карбонил-2,3-дигидро-2-окс бензо вЗтиофена, получают N-фенил -5-карбокси-2 ,3-дигидро-2-оксо-З -бензо в тйофенкарбоксамид, N- (2-метилфенИл )-5-карбокси-2,3-дигидро-2-оксо-З-бензо в тиофент арбоксамиДу М-(2-хлорфенил)-5-карбокси-2,3-дигидро-2-оксо-З-бензо fB тиофенкарб|Ьксамид и N-(3-хлорфенил)-5-карб- |окси-2 , 3-дигидро-2-оксо-3-бензо ;в} : тиофенкарбоксамид, а также их сложные низшие алкиловые эфиры. Исходный Материал получают, исходя из этилового эфира З-метил-4-нитробензойной кислоты бромированием метильной группы, вза.имодействием полученного этилового эфира 3-бромметил -4-нитробензойной кислоты.с цианистым калием и затем с бензилмеркаптаном, полученный этиловый эфир 3-цианометил-4-бензилмеркаптрбензойной кислоты гидролизуют с замыканием цикла до 5-карбокси-2,З-дигидро-2-оксобензо в тиофена и при недбходимости его этерифицируют. Пример 15. .Аналогично примеру 11, исходя из гидразида 6-хлор-2-бензо {в:|тиофенкарбоновой кислоты, полученного из метилового или этилового эфиров взаимодействием с гидразином , получают N- 2-фторфенил -6-хлор-2 ,3-дигидро-2-оксо-3-бензо в тиофенкарбоксамид с т.пл., 187-190 с Ы-фенил;-б-хлор-2,3-дигидро-2-оксо-З- ,бензо в тиофенкарбоксамид с т.пл. 201-204 С ((натриевая соль с т.пл. : 350°С , м-(3-хл6рфенил)-6-хлор-2;3-дигидро-2-оксо-З-бензо в тиофенкарбоксамид т.пл. 169-170С. Пример 16. Аналогично примеру 11, исходя из гидразида 6-мет-, окси-2-бензо в тиофенкарбоновой кисЛоты , полученного путем восстановительного Дегалогенирования метилового эфира 3-хлор-6-метокси-2-бензо тиофенкарбоновой кислоты и последующего взаимодействия с гидразином, получают к-фенил-2,З-дигидро-6-метокси-2-окс6-3-бензо Гв}тиофенкарбокс-амид , тГпл. 17,-1730С, N-{2-хлорфенил ) 2,3-дигидро-6-метокси-2-оксо-3-бензо в тиофенкарбокса 1ид, N-(3-хлорфенил )-2,3-дигидpo-6-мeтoкcи-2-oкco-3-бeнзotв тиофенкарбоксамид, т.пл 165-167 С, и М-(2-фторфенил)-2 ,3-дигиДро-б-метокси-2-оксо-З.-беи30 в тиофенкарбоксамид с т.пл. 152143С ,1 а также, исходя из гидразина 5-нитрр-2-бензо в тиофенк рбоновой кислоты, полученного из метилового эфира и гидразина, получают N-фенил-2 ,3-дигидро-5-нитро-2-оксо-3-бензо в тиофенкарбоксамид с т.пл. 175178 С , N-( 2-хлорфенил) -2 , 3-дигидрог-5-нитро-2-оксо-3-бензо в тиофенкарбоксамид , И-(3-хлорфенил)-2,3-дигидро-5-нитро-2-оксо-3-бензо в тиофенкарбоксамид с т.пл. 182.-185°С, и М-{2-фТорфенил)-2,Зтдигидро-5-нитро-2-оксо--3-бензоГвЗ тиофенкарбоксамид с т.пл. 177-180 С.
Пример 17. К охлажденной суспензии 8,7 г 50%-ной суспензии гидрида натрия в парафиновом масле te 250 мл триамида гексаметилфосфорно кислоты добавляют по каплям раствор 127,5 г 2, 3-дигидро 2-оксобензо в тиофена в 100 мл триамида гексаметилфосфорной кислоты. Перемешивают в течение 1 ч при комнатной температуре, опять охлаждают до и добавляют по каплям 33 г этилового эфира N-(2-фторфенил )-карбаминовой кислоты, растворенного в 50 мл триамида гексаметилфосфорной кислоты,перемешивают в течение 20 ч при комнатной температуре и выливают на смесь из 1500 I льда и 200.мл 2 я. соляной кислоты. Смесь дважды экстрагируют по 300 мл эфира. Экстракт прогуивают водой и упаривают досуха, получают N-(3-фторфенил)-2-рксо 2,3-дигидробензо в тиофен-3-карбоксамид с т.пл. 154-15б С.
Пример 18. 16,9 г 2,3-дигид ро-3-оксобензо в тиофена растворяют в 200 мл триамида гексаметилфосфорно кислоты. Раствор охлаждают до ОС и в атмосфере азота добавляют по каплям раствор 3,2 г бутиллития в 20 мл гексана. При комнатной температуре порциями добавляют 32 г (2,2,2-трихлор )-этилового эфира м-{2-фторфенил )-карбаминовой кислоты, перемешивают 2 ч при 0°С и 20 ч при комнатной температуре, выливают на 1000 г льда, экстрагируют трижды по 1000 мл эфира, сушат сульфатом натрия, упаривают досуха и перекристаллизовывают из смеси гексана с эфиром (1:5), полученный М-(3-фторфенил)-2,3-ди х-Идро-З-оксобензо в тиофен-З-карбоксамид плавится при 155°С.
Пример 19. В 50%-ную суспензию 2,32 г гидрида натрия в минеральном масле в 60 мл тетрагидрофурана добавляют по каплям 7,3 г 2,3-дигидро-2-Ьксобензо вЗ тиофена в 50 мл тетрагидрофурана, перемешивают 30 ми и добавляют 50 мл пиридина и затем по каплям 8,5 г N-(3-фторфенил)-карбамоилхлорида в 20 мл тетрагидрофурана , перемешивают в течение 1 ч ари комнатной температуре и 2 ч. при выливают на 750 мл ледяной воды, подкисляют с помощью 2 н. соляной кйсловы ., отсасывают и перекристаллизовывают из смеси ацетона с гексаном.Получают . N-(3-фторфенил)-2,3-дигидро-2-оксобензо в тиофен-3-карбоксамид с т.пл. 170-171°С.
Пример 20. В суспензию 6,5 г гидрида натрия в минеральном масле в 100 мл триамида гексаметилфосфорной кислоты добавляют по каплям при охлаждении до iO°C раствор 20,2 г 2,3-дигидро-2-оксобвнэо (вЗтиофена. Перемешивгиют в течение 1 ч при комнатной температуре, затем добавляют по каплям раствор 38 г N-(3-хлорфенил)-мочевины в 100 мл триамида гексаметилфосфорной кислоты. Перемешивают в течение 10 ч Ьри комнатной температуре и 22 ч при if О С, выливают на смесь из 100 мл 2 и. соляной кислоты и 1000 г льда, экстрагируют трижды по 250 мл эфира, сушат сульфатом натрия -и упаривают досуха. Остаток перекристаллизовываI9T из эфира, получают N-(3-хлорфенил -2,З-дигидро-2-оксобензо в}тиофен-3-карбоксамий с т.пл. 178°С.
Пример 21. К 50%-ной суспензии 3,3 г гидрида натрия в минеральном масле в 125 мл триамида гексаметилфосфорной кислоты добавляют ло каплям раствор 10,5 г 2,З-дигидро-2-оксобензо в тиофена в 25 мл триамид гексаметилфосфорной кислоты, перемешивают в течение 30 мин при комнатной температуре, добавляют 22 г N-(3-хлорфенил)- N, м-дифенилмочевины и перемешивают в течение 48 ч при 80с, выливают на смесь из 100 мл 2 н. соляной кислоты и 100 г льда, экстрагируют дважды по 300 мл эфира, промывают экстракт с помощью 1 н. соляной кислоты и затем воды, сушат сульфатом натрия и упаривают досуха. Остаток, полученный упариванием, перекристаллизовывают дважды из смесиэфира с гексаном, получают N-(3-хлорфенил ) -2 , З-дигидро-2-оксобензо в}тиофен-2-карбоксамид с т.пл. 177-178 С.
Формула изобретения
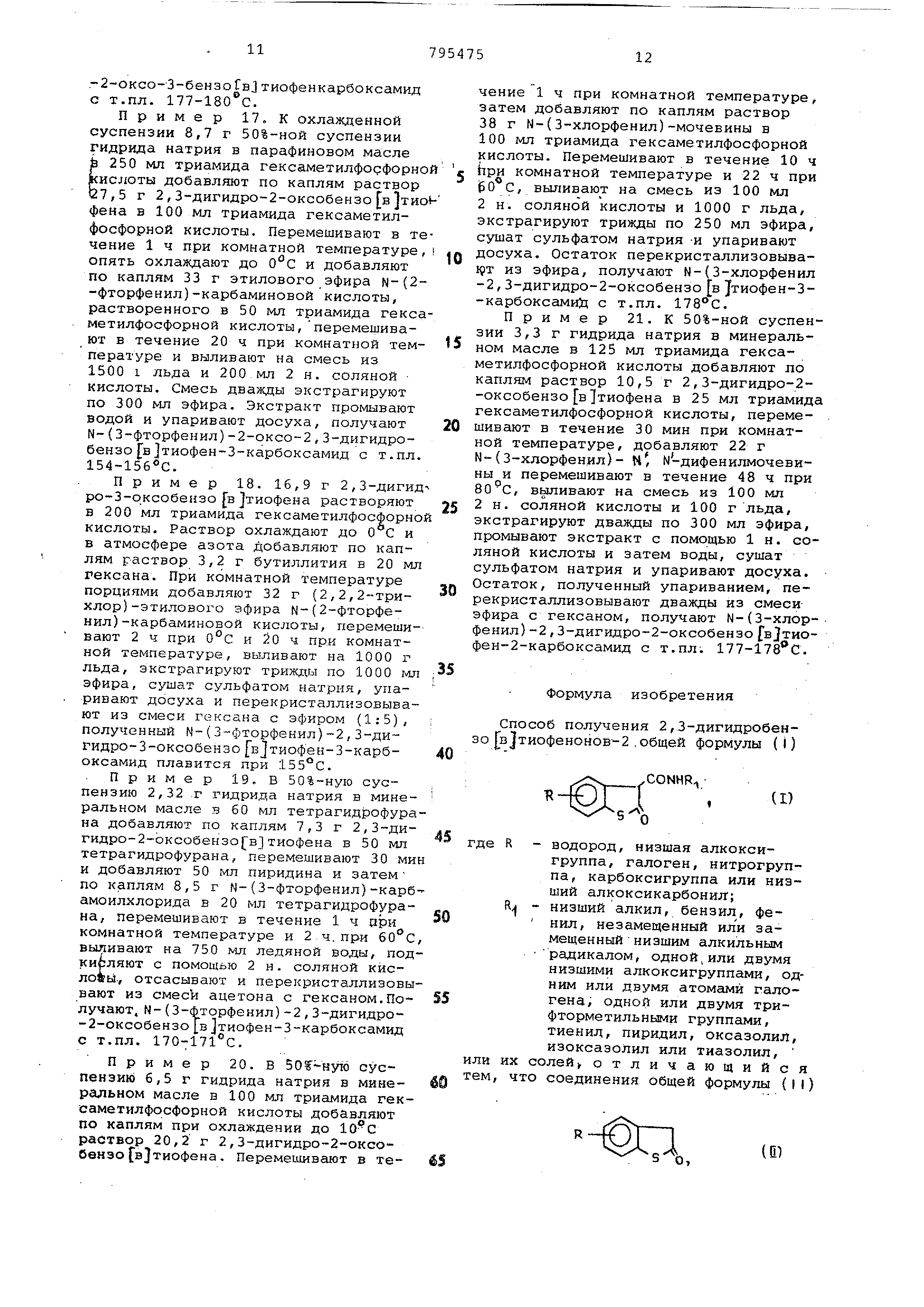
Способ получения 2,3-дигидробензо|в2тиофенонов-2 .общей формулы (I)
(1)
R - водород, низшая алкоксигруппа , галоген, нитрогруппа , карбоксигруппа или низший алкоксикарбонил; R - низший алкил, бензил, фе НИЛ, незамещенный или замещенный низшим алкильным радикалом, одной,или двумя низшими алкоксигруппами, одним или двумя атомами галогена , одной или двумя трифторметильными группс1ми, тиенид, пиридил, оксазолил, изоксазолил или тиазолил, их солей отличающийся что соединения общей формулы (II)
(Е) где R имеет вьшеукаэанные значения, подвергают взаимодействию с соедине нием общей формулы (III) К М-С-О , где R имеет вышеуказанные значения низшая алкоксигруппа, незамещенная или замещенная одним или несколькими атомами галогена , феноксигруппа, незамещенная или замещенная низшим алкилом, низшей алкоксигруппой , одним или двумя атомами галогена, одной или двумя , нитрогруппами, галоген или группа формулы (RyljjN- или - , где R - имеет бышеуказанные значения, Vj -водород или У и У2 вместе о разуют связь, , и при необходимости подвергают гидр лизу с последующим вьаделением целевого продукта в свободном виде или в виде соли. Приоритет по признакам, 09.04.76 при R - водород, низшая алкоксигруппа, галоген или нитрогруппа , и RJ - имеет значения, указанные в п. 1 формулы изобретения, за исключением тиенила, в свободном виде, 20.12.76при R - водород, низшая алкоксигрупда, галоген, или нитрогруппа , и R т имеет значения, указанные в п. 1 формулы изобретения, за исключением тиенила, в виде соли, 06.04.77при R и R - имеют все значения, указанные в п. 1 формулы изобретения, в свободном виде или в виде соли. Источники информации, принятые во внимание при экспертизе 1. Бюллер К. , Пирсш д. Органичес кие синтезы, М. , МирЧ 1973, ч. U, с. 410-411.






Реферат

Формула


Комментарии